Сперматозоиды не обнаружены: гид по лечению Азооспермии
| Консультация андролога по стимуляции сперматогенеза | 4000 руб |
| Спермограмма (ВОЗ 2010) | 2750 руб |

Меньщиков Константин Анатольевич.
Уролог, андролог, стаж более 20 лет.
Специализация: лечение бесплодия, в том числе азооспермии.
Стимуляция сперматогенеза
Это воздействие на репродуктивную систему мужчины с помощью медикаментов, активирующее процесс образования сперматозоидов. Пациенту назначают комплекс высококачественных аминокислот и через 3-6 месяцев лечения начинается продукция жизнеспособных сперматозоидов. Стимуляция эффективна даже в случаях, когда причина необструктивной (секреторной) азооспермии неизвестна.
Обструктивная азооспермия | Необструктивная (секреторная) азооспермия | Диагностика азооспермии | Лечение обструктивной азооспермии
Лечение неоструктивной азооспермии | Варикоцеле
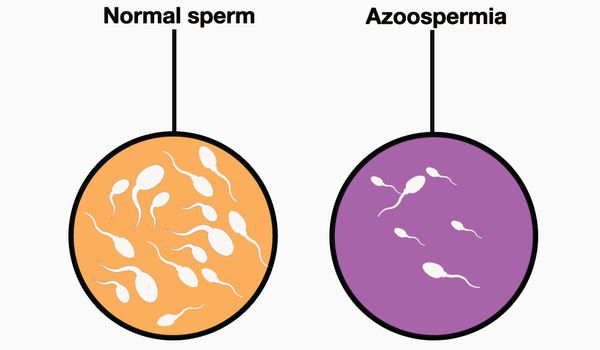
Азооспермия – тяжелая форма бесплодия у мужчин, при которой в эякуляте нет сперматозоидов.
Диагноз Азооспермия ставится после выполнения спермограммы, по результатам которой в эякуляте не обнаруживаются сперматозоиды.
В норме, прежде чем выйти наружу (во время эякуляции), сперматозоиды должны смешаться с семенной плазмой в протоках репродуктивной системы. Если сперматозоидов в сперме нет, а эякулят полностью состоит из плазмы, значит:
- сперматозоиды есть, но в семенных протоках закупорка и они не выходят наружу
- сперматозоиды не образуются вообще
Сперма в этом случае представляет собой только семенную плазму. Азооспермия — это прямая причина мужского бесплодия. Наступление естественной беременности невозможно.

Методы лечения азооспермии
Лечение обструктивной азооспермии
Не существует лекарственных или других консервативных методов лечения обструктивной азооспермии. Но существует 2 хирургические тактики помощи при обструктивной азооспермии:
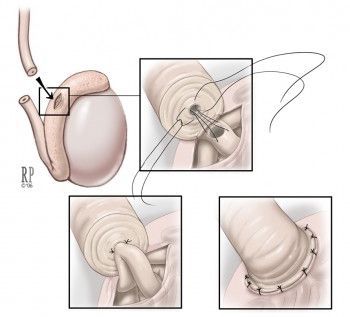
1. Операция по наложению ваз-эпидидимо анастомоза
2. Проведение биопсии для получения сперматозоидов
Обструкция, т.е. закупорка это физическая преграда на пути сперматозоидов, поэтому и устранять ее придется только хирургически, если для этого есть возможность.
Операция по наложению ваз-эпидидимо анастомоза
Если обструкция, т.е. препятствие есть в семявыносящем протоке или придатке, то операция будет эффективной. Вероятность успеха — 70-95%. Препятствия будут устранены и сперматозоиды вновь станут поступать в эякулят. Пара может обоснованно надеться на оплодотворение и наступление беременности естественным путем.
Это микрохирургическая операция. Выполняется под общим наркозом через разрез на мошонке. Разрез небольшой — от 1 до 2 см. Останется незаметный аккуратный шов. Риск послеоперационных осложнений: минимальный (инфекции и гематомы).
После операции необходимо:
- исключить тяжелые физические нагрузки на 3-4 недель
- 2 недели полового воздержания
Затем каждые 2-3 месяца мужчина сдает образец на анализ для наблюдения за восстановлением концентрации сперматозоидов в эякуляте. Как правило, уже в первой спермограмме обнаруживаются клетки сперматозоидов. Если через 6-18 месяцев сперматозоиды не будут обнаруживаться, значит операция не удалась. В 70-95% случаев доставка сперматозоидов в эякулят восстанавливается и в течении 24 месяцев после операции у пары наступает естественная беременность.
Стоимость Операции по наложению ваз-эпидидимо анастомоза — 70 000 рублей.
Если устранить обструкцию не удается, можно получить сперматозоиды и заморозить.Проводят биопсию для получения сперматозоидов и их дальнейшего использования для ЭКО, ИКСИ.
Операция по наложению ваз-эпидидимо анастомоза
при обструктивной азооспермии
для отмены эффекта вазектомии
Цена 70 000 руб
в стоимость операции включена общая анестезия и пребывание в палате
Консультация андролога
Цена 4 000 руб
Адрес: г.Москва ул.Беговая д.7
м.Беговая
Лечение необструктивной азооспермии
Гормональные нарушения
Необструктивная азооспермия связана с производством сперматозоидов. И если обструктивная азооспермия совсем не лечится консервативными методами, то в этом случае действуют другие правила.
Сперматогенез можно восстановить с помощью медикаментозной терапии. Схема стимуляции сперматогенеза для получения сперматозоидов основана на последних исследованиях мировой медицины. Эффективность стимуляции составляет 89%. Т.е. у 9 из 10 пациентов временно удается наладить выработку сперматозоидов для успешного зачатия. Обратите внимание стимуляция носит именно временный характер, т.е. по окончании лечения и достижения цели — беременность — репродуктивная система скорее всего вернется к своему исходному состоянию. Но до наступления беременности сперматогенез можно стимулировать.
Для назначания стимуляции сперматогенеза андролог назначает каждому пациенту:
- УЗИ органов мошонки
- анализ крови на уровень аминокислот
- спермограмма, выполненная по нормам ВОЗ с морфологией по Крюгеру
- анализ крови на гормоны
- ПСА общий и ПСА свободный (для мужчин старше 40 лет)
Лечение гормонами длится от 3 до 12 месяцев. Каждые 2-3 надо сдавать образец на анализ для контроля лечения.
Консультация андролога. Схема лечения азооспермии
Стимуляция сперматогенеза для получения сперматозоидов
Эффективность 89%
Цена 4 000 руб
Меньщиков Константин
Андролог, урогенитальный хирург. Стаж 20 лет.
Адрес: г.Москва ул.Беговая д.7
м.Беговая
Биопсия яичка: Micro-TESE
Получение сперматозоидов из яичка при необструктивной азооспермии
Как показывают исследования и клинический опыт, даже при необструктивной азооспермии, у 60% мужчин все равно можно обнаружить небольшие участки выработки сперматозоидов внутри яичка. Эти сперматозоиды можно успешно использовать для проведения ЭКО и ИКСИ. Это действительно здорово! Врачи начали искать методики, позволяющие одновременно искать и извлекать такие сперматозоиды для криоконсервации (заморозки). Поэтому существует несколько разных методик биопсии яичка.
Биопсия Micro-TESE — самая сложная, но при этом самая эффективная методика обнаружения и извлечения сперматозоидов.
Сложная, потому что требует точности и навыка микрохирургии от андролога. Во время операции так же присутствует эмбриолог-сперматолог, который сразу анализирует качество найденных сперматозоидов.
При этом для пациента это легкопереносимая, малоинвазивная операция. В послеоперационном периоде потребуется провести в клинике несколько часов. Риски послеоперационных осложнений минимальны. Фактически операция проводится под микроскопом, потому что состояние и содержания семенных канальцев невозможно разглядеть невооруженных взглядом. Такая точная визуализация исключает травмирование или повреждение тканей яичек.
С одной стороны, биопсию яичка можно считать диагностикой, с другой — полноценной тактикой помощи и лечения.
В течении 10 дней после операции рекомендуется воздержаться от половой жизни, мастурбации, фитнеса и спорта.
Micro-TESE имеет превосходные показатели извлечения сперматозоидов и требует удаления значительно меньшего количества ткани, чем другие методики биопсии яичка.
Микрохирургическая биопсия яичка: Micro-TESE
одностороннее
Цена 45 000 руб
в стоимость операции включена общая анестезия и пребывание в палате
Консультация андролога
Цена 4 000 руб
Адрес: г.Москва ул.Беговая д.7
м.Беговая
Варикоцеле
Если осмотр покажет, что есть расширение вен яичка (варикоцеле), то восстновить сперматогенез может операция варикоцелэктомия. При расширении вен, кровь застаивается и местно повышает температуру в мошонке. А повышение температуры даже на 1-2 градуса вызывает нарушение и даже остановку образования и созревания сперматозоидов.
Операция проводится под местной анестезией через минимальный разрез в паху (всего 1-2 см).
Первую ночь придется провести в клинике. Но уже на 3-и сутки можно вернуться на работу.
Через 2 недели можно возобновить занятия спортом.
Спустя 3 недели нормальный кровоток в мошонке восстанавливается. Однако контрольный анализ лучше сдавать только через 2-3 месяца. Это связано с циклом созревания сперматозоидов. Он занимает около 3 месяцев. Подробнее об обновлении спермы читайте здесь.
Микрохирургическая субингвинальная варикоцелэктомия по Мармар
одностороннее
Цена 45 000 руб
двустороннее
Цена 75 000 руб
одностороннее (рецидив)
Цена 55 000 руб
в стоимость операции включена местная анестезия и пребывание в палате
Консультация андролога
Цена 4 000 руб
Адрес: г.Москва ул.Беговая д.7
м.Беговая
Статистика
От азооспермии страдают 2% мужчин от общего числа и около 10-15% мужчин, проходящих лечение в связи с бесплодием.
Важно
Если у вас уже стоит диагноз Обструктивная азооспермия — получить эякулят возможно. Но потребуется операция — биопсия яичка.
Виды и основные причины азооспермии
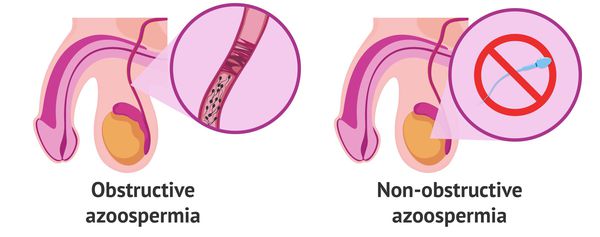
Азооспермии можно разделить на 2 вида: обструктивные и необструктивные.
Обструктивная азооспермия это как раз тот случай, когда сперматозоиды есть, но не могут преодолеть закупорку в семявыводящих путей.
Необструктивная азооспермия связана с нарушением сперматогенеза. Сперматозоиды не образуются и не созревают.
Спермограмма не дает информации о том какая именно азооспермия у мужчины. Она лишь фиксирует наличие или отсутствие сперматозоидов, но не говорит о причинах.
Как понять какая азооспермия у меня: обструктивная или необструктивная?
Требуется осмотр андролога и дополнительные анализы. Врача будут интересовать размеры и структура яичек (тестикул). Результаты анализов можно взять сразу на консультацию. Нужен анализ крови на фолликулостимулирующий гормон (ФСГ) и тестостерон. Врач так может провести УЗИ органов мошонки.
Если уровень ФСГ и тестостерона нормальный и осмотр врача подтверждает, что всё в норме, то сперма есть в яичках, но не может преодолеть закупорку протоков. Это обструктивная азооспермия.
Если уровень ФСГ повышен, а яички имеют недостаточную функцию, они маленькие и мягкие, то диагностируется необструктивная азооспермия (т.е. сперматозоиды даже не вырабатываются. Дальше придется выяснить можно ли это исправить и наладить производство сперматозоидов. К сожалению, это не всегда возможно.
Обструктивная азооспермия и причины её возникновения
При закупорке (обструкции) протоков сперматозоиды не выходят наружу. Обструктивный вид азооспермии встречается в 40% случаев всех диагностированных азооспермий. Хорошая новость заключается в том, что при такой форме азооспермии можно получить сперму и воспользоваться вспомогательными репродуктивными технологиями: ИКСИ, ЭКО. В некоторых случаях можно ликвидировать закупорку и тогда возможно оплодотворение естественным путем.
Получение спермы
При обструктивной азооспермии, успешность получения спермы хирургическим путем достигает почти 100%.
Причины обструктивной азооспермии
Причины закупорки могут быть разными: врожденные дефекты, т.е. наследственность (недоразвитие органов репродуктивной системы), воспалительные заболевания, травмы и органическая патология.
Если этиологическим фактором азооспермии является наследственность, то в организме мужчины встречаются анатомические дефекты репродуктивной системы. Двусторонняя гипоплазия (недоразвитие) семявыносящих протоков является следствием генетических мутаций, передающихся по наследству. При ней отсутствуют каналы для вывода спермы из предстательной железы в уретру.
Инфекционные заболевания репродуктивной системы, предстательной железы, яичек также оказывают влияние на формирование мужской фертильности.
Травматические повреждения позвоночного столба, грыжи межпозвонковых дисков, операции на половых органах и брюшной полости нередко сопровождаются снижением функциональных способностей мужской репродуктивной системы.
При варикоцеле вены и кровеносные сосуды мошонки расширены и увеличены. Азооспермия возникает за счет нарушения кровоснабжения половых органов и сдавления семявыводящих протоков.
Вазэктомия (перевязка семявыводящих протоков) – оперативное вмешательство, которое применяется для контрацепции у мужчин. Перевязанные или прижженные семявыводящие протоки при вазэктомии предотвращают попадание сперматозоидов в семенную жидкость.
Необструктивная азооспермия и причины её возникновения
В 80% случаев (азооспермий) причиной является необструктивная (секреторная) патология репродуктивной системы. Т.е. связана с нарушением выработки спермы в организме. Часто причиной патологии являются гормональные нарушения, реже:
- наследственные болезни с нарушением продукции спермы или дефектами половых органов (синдром Кальмана и Клайнфельтера),
- применение некоторых антибиотиков, стероидных препаратов, противовоспалительных средств, химиотерапия,
- алкоголь и курение,
- ретроградная эякуляция – состояние, при котором семенная жидкость транспортируется вместо уретры в мочевой пузырь (ситуация возникает при повреждении спинного мозга, патологии шейки пузыря, сахарном диабете и применении некоторых лекарственных препаратов),
- радиационное облучение
- иные факторы (неправильное положение яичек, отравление пестицидами и тяжелыми металлами, длительный перегрев организма)
Важно
Не путайте азооспермию (нет сперматозоидов) с олигозооспермией (мало сперматозоидов). У этих состояний разные причины и разные принципы лечения.
Основные симптомы и признаки азооспермии
Нет никаких специфических симптомов азооспермии. Часто первым и единственным симптомом является ненаступление беременности у партнерши. Если у мужчины выявлена азооспермия, врач может обратить свое внимание на:
- Чрезмерное оволосение
- Маленькие яички
- Варикоцеле и припухлость мошонки.
Но ни один врач не станет уточнять диагноз по косвенным признакам. Диагностическую значимость имеют только лабораторные анализы и инструментальные исследования.
Самостоятельно определить азооспермию и ее тип по данным признакам невозможно. Как и говорить о прогнозах без уточненного диагноза. Поэтому самое важное — пройти весь протокол исследования и получить полное представление о состоянии репродуктивной системы.
Диагностика азооспермии
- 2 анализа спермы
- осмотр андролога (уролога)
- анализы крови на гормоны
- генетические тесты
- УЗИ органов мошонки
- МРТ (может потребоваться)
Подробнее о диагностике
Выполнить 2 спермограммы с интервалом 2-3 недели в одной и той же лаборатории. Во второй раз можно увеличить срок воздержания, но не более 7 дней. Если есть проблемы с количеством (концентрацией) серматозоидов, то они появятся, если нет, азооспермия подтвердится.
Спермограмма с морфологией сперматозоидов по Крюгеру
Цена 2750 руб
Адрес: г.Москва ул.Беговая д.7
м.Беговая
Для уточнения типа азооспермии врачу потребуется информация о времени, в течение которого пациент пытался зачать ребенка, образе жизни, существующих проблемах в сексуальной жизни (преждевременная эякуляция, эректильная дисфункция). На образование сперматозоидов оказывает влияние курение и употребление спиртных напитков, перенесенные болезни и прием лекарственных средств. Врач проведет осмотр и назначит анализ крови на гормоны, генетические тесты и УЗИ мошонки.
Медицинский осмотр позволит выявить проблемы с избыточным весом, гормональной сферой, оволосением. При исследовании патологии репродуктивной системы врач обследует яички, измерит их размеры и оценит форму.
Анализ крови на гормоны и генетические тесты берется из вены. Генетические отклонения тоже могут стать причиной нарушения транспорта спермы или ее выработки в мужских репродуктивных органах.
Диагностика подтвердит или опровергнет наличие азооспермии. Если азооспермия подтвердится, диагностика укажет тип: обструктивная или необструктивная.
Для получения достоверных результатов, рекомендованный срок воздержания составляет 2-7 суток. После первой сдачи анализ дублируется через 2 недели. В этот период запрещается прием алкоголя, сильных лекарств. Лучше не сдавать анализ в период инфекционных заболеваний, так как высокая температура провоцирует отсутствие спермиев в ней. Подробнее о правилах сдачи образца.
О лаборатории
Специализированная лаборатория сперматологии
Высокий профессиональный уровень, наличие собственной сертифицированной лаборатории, применение инновационных лечебно-диагностических технологий.
Услуги и цены
Адрес: г.Москва ул.Беговая д.7
м.Беговая — 8-10 минут пешком
Часы работы лаборатории
Пн — Пт 08:00-18:45
Сб — Вс 09:00-13:30
Технический перерыв: 13:30 — 15:45
Запись по телефону: Пн — Вс 09:00-20:00
НАШИ СПЕЦИАЛИСТЫ
Все доктора и сотрудники лаборатории сперматологии имеют высокую квалификацию и многолетний опыт работы.

Уролог, андролог, генитальный хирург

Уролог, андролог

Эмбриолог-сперматолог
Запишитесь на анализ
+
ЗАПИСАТЬСЯ НА АНАЛИЗ
Секреторная азооспермия
Секреторная азооспермия, или отсутствие сперматозоидов: причины, симптомы, можно ли вылечить азооспермию, как она лечится, как забеременеть при азооспермии— отвечает главный врач Клиники МАМА — Виктория Викторовна Залетова.
Азооспермия — патология, при которой сперматозоиды в эякуляте мужчины отсутствуют вовсе. Многие супруги изначально ставят на себе крест, понимая, что азооспермия — синоним бесплодия, то есть мужчина с подобным диагнозом не может быть отцом. Является ли отсутствие сперматозоидов в сперме необратимым заболеванием, или его можно вылечить, возможна ли беременность при азооспермии, как забеременеть при азооспермии — узнаем прямо сейчас.
История болезни
Итак, для начала определяемся с формой азооспермии, их может быть две.
Первая — нарушение в непосредственном образовании сперматозоидов, это — секреторная (необструктивная) азооспермия, и вторая — экскреторная (обструктивная) азооспермия, когда сперматозоиды образуются, но не могут выйти наружу из-за препятствия.
Причины могут быть следующие:
- воспаление тканей яичка (орхит)воспаление семенных пузырьков (эпидимит)
- гормональные нарушения
- инфекционные заболевания органов половой системы
- травмы половых органовоперации на внутренних и внешних половых органах, а также органах малого таза
- наследственные патологии
Диагностика заболевания включает следующие этапы:
- спермограмма расширенная
- ультразвуковое исследование (УЗИ) органов малого таза, мошонки, с доплеровским исследованием
- анализ на гормоны мазки, посевы, ПЦР-исследование на исключение заболеваний, передающихся половым путем
- исследование ткани яичка
- генетическое исследование
На основании результатов проведенной диагностики, врач может с точностью сказать, о какой форме заболевания идет речь в нашем конкретном случае, можно ли вылечить, и как лечить азооспермию.
Стоит сразу отметить, какая бы форма заболевания ни была у мужчины, экстракорпоральное оплодотворение (ЭКО) при тяжелом мужском факторе — азооспермии — требует внимания специалистов, а именно — врачей-репродуктологов.
Главное — запомнить, если у мужа азооспермия — это не значит, что он не сможет стать отцом наших детей. Это повод обеспечить мужу необходимую медицинскую помощь, ведь даже в тяжелых случаях беременность при азооспермии возможна при помощи ЭКО с биопсией яичек.
Беременность при азооспермии
Секреторная (необструктивная) азооспермия — нарушение процесса образования сперматозоидов в яичках мужчины. Секреторная азооспермия может быть врожденной — обусловленной патологиями развития яичек, и приобретенной в результате инфекционных и воспалительных заболеваний.
Как правило, выявляют следующие показатели:
- отсутствие сперматозоидов в сперме или присутствие незрелых половых клеток в эякуляте
- нарушения показателей тестостерона в крови
- повышенный уровень фолликулостимулирующего гормона (ФСГ) в крови
- патологию развития яичек и предстательной железы
Беременность при секреторной азооспермии может быть возможна с помощью ЭКО. ЭКО при азооспермии может включать несколько этапов: если у мужчины найдены единичные жизнеспособные сперматозоиды, их извлекают из яичка с помощью микрохирургической операции (Micro-TESE), культивируют при помощи метода биологической активации (SMART), выбирают самый лучший, а затем проводят интрацитоплазматическую инъекцию сперматозоида в яйцеклетку (ICSI-MAQS). В случае получения множества жизнеспособных сперматозоидов, оставшиеся после успешного оплодотворения витрифицируют — замораживают.
Экскреторная (обструктивная) азооспермия — нарушение проходимости семявыносящих путей, которое не затрагивает процесс выработки сперматозоидов. Данный вид азооспермии также может быть врожденным — по причине патологий развития органов репродуктивной системы мужчины, и приобретенным — вследствие перенесенного воспалительного процесса или травмы внешних или внутренних половых органов.
Как узнать:
- патологические изменения в размере и плотности яичек
- маленький объем спермы при семяизвержении
- нарушения работы половой системы в результате травмы, операции, воспалительного процесса в организме
Беременность при азооспермии данного типа также может состояться при помощи ЭКО при проведении Micro-TESE — микрохирургического выделения сперматозоидов из ткани яичка — и дальнейшей интрацитоплазматической инъекции сперматозоида в яйцеклетку.
Восстановить проходимость и забеременеть самостоятельно женщине можно, если мужчина успешно пройдет хирургическую операцию по восстановлению семявыводящих протоков. Результативность данной операции не очень высока.
В заключение
Если беременность в паре не наступает в течение 12 месяцев при ведении регулярной половой жизни без применения средств контрацепции — речь идет о бесплодии у супругов. Факторов бесплодия много: и женских, и мужских. Какой фактор бесплодия в нашей паре — покажет только комплекс обследований, но каждому из нас стоит знать, что обязательно на 1 этапе нужно провести диагностику мужчины — ведь сдать спермограмму так просто.
Сделайте первый шаг — запишитесь на прием!
или позвоните +7 495 921-34-26 8 800 550-05-33 бесплатный телефон по России info@ma-ma.ru
Азооспермия — отсутствие сперматозоидов в эякуляте (семенной жидкости). Является одной из причин бесплодного брака. Распространенность азооспермии среди всех мужчин составляет менее 1%, среди мужчин, состоящих в браке и не имеющих детей — 11-14 % [1][2]. Азооспермию следует рассматривать, скорее, как патологический симптомокомплекс, а не в качестве самостоятельного заболевания.
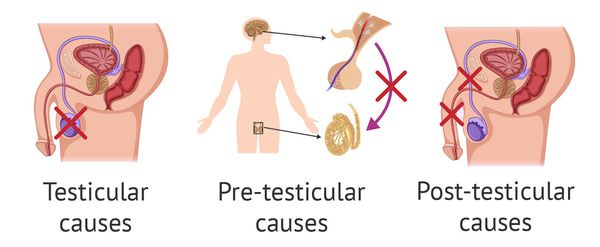
Причины возникновения азооспермии подразделяют на тестикулярные, претестикулярные и посттестикулярные.
Тестикулярные причины обусловлены:
- генетическими факторами (отсутствием лоскута Y-хромосомы, отвечающего за сперматогенез; синдромом Клайнфельтера — наличие дополнительной женской половой X-хромосомы; муковисцидозом, приводящим к врождённому отсутствию семявыводящих протоков [8]; синдромом Юнга, характеризующимся систематической закупоркой протоков яичка; синдромом Прадера-Вилли — отсутствием отцовской копии участка хромосомы [9]);
- врождёнными аномалиями (недоразвитием (аплазией) яичек; крипторхизмом — несвоевременным выходом яичек из брюшной полости наружу; варикоцеле);
- осложнениями инфекций (орхитом после перенесённого паротита и другими);
- половыми излишествами (недозреванием половых клеток в придатках яичка);
- сахарным диабетом (нарушением обмена веществ в яичке).
К претестикулярным причинам следует отнести:
- опухоль гипофиза, кровоизлияния в головной мозг;
- дисфункцию гипоталамуса (неправильную выработку гормонов);
- гипогонадотропный гипогонадизм (недостаточность сперматогенеза вследствие отсутствия стимуляции его гонадотропинами);
- токсические воздействия (наркотики, алкоголь, препараты тестостерона, антибиотики, стероиды, противовоспалительные препараты и пестициды);
- воздействие ионизирующей радиации (а также рентгеновского излучения) и лучевой терапии;
- постоянную гипертермию (частое посещение бани или сауны, заболевания, сопровождающиеся высокой температурой);
- тяжёлые физические и психологические нагрузки, стрессы;
- недостаток витаминов и микроэлементов в пище.
Протестикулярные причины заключаются в обструкции (препятствии) и нарушении семенных протоков. Этому способствует:
- проведение вазэктомии, перевязывания семявыводящих протоков и вазографии семенных путей с применением контрастных средств;
- осуществление оперативного вмешательства в область эякуляторных каналов;
- наличие воспалительных заболеваний, опухолей придатков яичка, семенных пузырьков и предстательной железы;
- использование метода грыжесечения (в особенности у детей) с целью пластики грыж полипропиленовых сеток, который вызывает в окружающих тканях фиброз и вовлекает семявыводящие протоки с дальнейшей их полной облитерацией (заращением);
- возникновение ретроградной эякуляции (полный или частичный выброс семенной жидкости в мочевой пузырь) и нарушение эмиссии (сперма не поступает в заднюю часть мочеиспускательного канала);
- онкологические заболевания крови (лейкоз, болезнь Ходжкина) [11].
Основной симптом — невозможность зачать ребёнка (крайне малое количество сперматозоидов в эякуляте или же их полное отсутствие) при сохранённой сексуальной функции.
Косвенные симптомы:
- обнаружение гена наследственной патологии или её признаков;
- повышение числа антиспермальных тел в эякуляте;
- малое количество семенной жидкости, возникающее во время эякуляции;
- белые непроизвольные выделения из мочеиспускательного канала;
- повышенное оволосение;
- малый размер яичек при их повышенной плотности;
- гипоплазия (уменьшение) предстательной железы;
- сексуальные дисфункции после инфекционного заболевания.
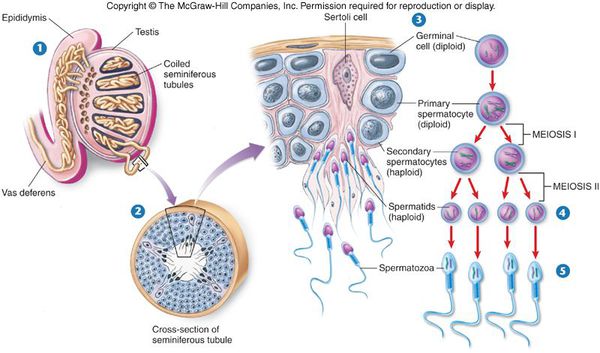
Чтобы лучше понять патологические процессы, происходящие со сперматозоидами, рассмотрим нормальную физиологию сперматогенеза.
Сперматозоиды и мужские половые гормоны (андрогены) вырабатываются в основных половых железах мужчины — яичках. Этот процесс называется сперматогенезом. Одни из самых важных клеток яичка — клетки Лейдега (описаны в 1850 году Францем Лейдегом). Они вырабатывают тестостерон — основной мужской половой гормон, а также клетки иммунной системы — макрофаги и лимфоциты. В канальцах яичка осуществляется сперматогенез с активным участием клеток Сертоли. Эти клетки синтезируют множество факторов, участвующих в образовании сперматозоидов: белки, гормоны, биологически активные вещества, именно они определяют объём яичек, качество и количество спермы.
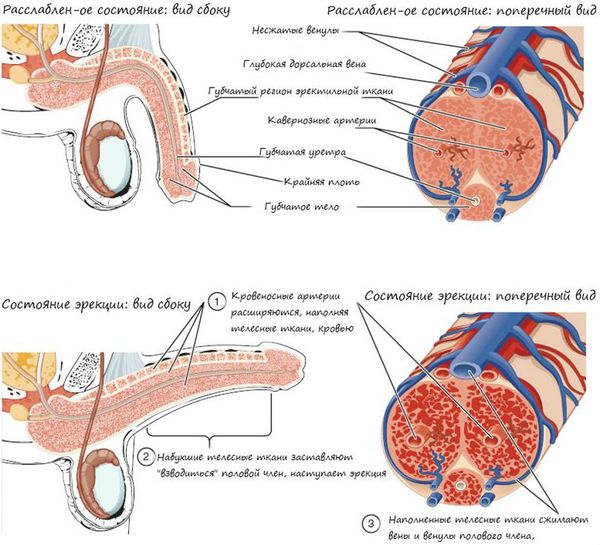
Образование сперматозоидов начинается в канальцах яичка с делением стволовых клеток и заканчивается путём сложных преобразований в зрелые сперматозоиды. Дозревание и концентрация сперматозоидов происходит в небольшом придатке яичка (а именно в его хвосте), где спермии могут сохранять жизнеспособность в течение двух недель. Попадают недозрелые сперматозоиды из более извитых канальцев яичка за счёт смывания их жидким секретом клеток Сертоли в более прямые канальцы, сливающиеся в общий канал придатка яичка. Далее сперма эвакуируется из мужского организма путём эякуляции, при помощи эрекции. В ответ на сексуальные стимулы эректильные парасимпатические нервы выделяют ацетилхолин, который расширяет артерии промежности, увеличивает кровоток в кавернозных и губчатых телах полового члена. Это способствует набуханию пениса — эрекции.
Далее происходит эмиссия — прохождение спермы в мочеиспускательный канал. Подчревные симпатические нервы выделяют адреналин, который вызывает сокращение гладких мышц, окружающих выносящие канальцы и хвост придатка яичка. В момент эякуляции нервы нижнего поясничного и верхнего крестцового центров вызывает сокращение бульбокавернозных мышц, что приводит к резкому выбросу спермы из уретры. Одновременно с этим, импульсы восходящих нервов создают ощущение оргазма.
Наконец, детумесценция (прекращение или спад эрекции после эякуляции и оргазма) связана с выделением норадреналина симпатическими нервами, также вырабатывается пролактин. Это приводит к сужению сосудов органа и его последующей вялости.[3]
Патогенез азооспермии разнообразен и зависит от конкретных причин.
При обструктивной азооспермии сперматозоиды вырабатываются в нормальном количестве, но при этом нарушается проходимость протоков. В связи с этим сперматозоиды не могут выйти наружу и оплодотворить яйцеклетку. При непроходимости протока придатка яичка наблюдается нормальный размер яичек и уровень фолликулостимулирующего гормона (ФСГ), а также уплотнение и отёк придатка.[4]
При наследственных аномалиях обращает на себя внимание целостность Y-хромосомы. Этот фактор является необходимым условием нормального строения и функционирования мужской половой системы. Особую роль в сперматогенезе играют три участка длинного плеча этой Y-хромосомы: AZFa, AZFb, AZFc.[5] Иначе они называются “факторами азооспермии”. Потеря одного из них приводит к тяжёлым нарушениям плодовитости (фертильности). Подобное нарушение может возникнуть по причине мутаций зародышевых клеток отцовской линии. При азооспермии эта патология встречается в 5-10% случаев, при олигоспермии — с частотой до 5%.[6] Клинически проявляется в резком нарушении сперматогенеза. При этом эндокринная функция яичек остаётся в норме, а их клеточное строение варьируется от наличия в канальцах зародышевых клеток с нарушением сперматогенеза (очаговый Сертоли), до блокады или ослабления процесса формирования и созревания сперматозоидов. Уровень ФСГ остаётся в норме или немного повышен.
Интересен механизм нарушений при муковисцидозе (кистозном фиброзе). Эта генетическая патология является наиболее распространённым и неизлечимым на данный момент заболеванием белой расы, поражающее одного из 2500 младенцев. Люди с данной болезнью чаще всего умирали, не достигая зрелого возраста, поэтому их фертильность не принималась во внимание. Однако совершенствование диагностики и методов лечения повлияло на увеличение количества больных, способных дожить до 30 лет и более, в связи с чем муковисцидоз приобрёл важное клиническое значение.
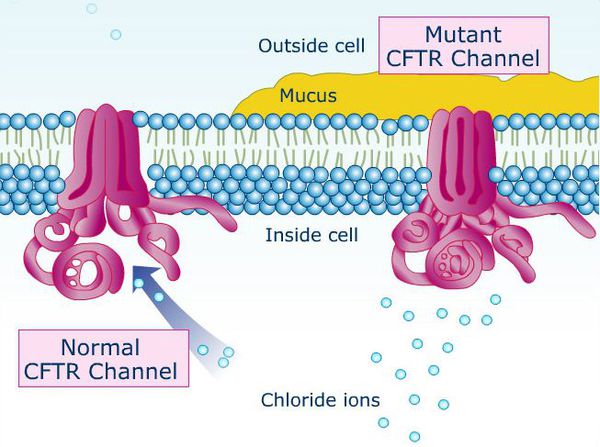
Причина муковисцидоза — мутирующий ген CFTR (трансмембранный регулятор муковисцидоза). Нарушение структуры данного белка способствует образованию вязкости секрета бронхов и закупорке (обструкции) дыхательных путей, развитию правожелудочковой недостаточности, нарушению работы поджелудочной железы, непроходиомости кишечника у новорождённых с застоем первородного кала (мекония). Основной признак данного заболевания — повышенная содержание хлорида в поте. Для взятия анализа потоотделение стимулируют местным электрофорезом препарата «пилокарпин».[7]
В типичных случаях при муковисцидозе внутримошоночная часть семявыводящего канала либо полностью отсутствует, либо изменена до лентовидной структуры, которая лишена просвета. Тело и хвост придатков яичка недоразвиты, его ткань, в основном, не изменена, но могут быть участки отложения солей кальция в мягких тканях (кальциноз), кистозные и гипоэхогенные (недостаточно плотные) участки (можно обнаружить при УЗИ). Врождённому отсутствию (аплазии) семявыводящего канала и придатка яичка сопутствуют патологические изменения семенных пузырьков: их отсутствие, гипоплазия (недоразвитие), обтурация (закупоривание) и кистозное изменение. В связи с этим уменьшается объём эякулята. Интересно, что фертильность сохраняется у большинства мужчин, а при нарушениях сперматогенеза можно достаточно быстро восстановить фертильность.[8]
Заслуживает внимания в патогенезе азооспермии синдром Прадера-Лабхарта-Вилли. В основе этого синдрома лежит потеря целого кластера на участке 15q11-q13 проксимальной области длинного плеча хромосомы 15. Дети с этим синдромом развиваются медленно. Если в младенчестве они выглядят худыми, то к моменту начала ходьбы они становятся очень толстыми. В зрелом возрасте развивается значительное ожирение при маленьком росте (менее 155 см). Руки и ноги у таких детей маленькие, даже по отношению к небольшому росту, имеется гипопигментация, нарушение умственного развития. У пациентов с синдромом Прадера-Вилли гениталии не развиты, характерен микропенис, двухстороннее неопущение яичек и недоразвитие мошонки. Уровень основных половых гормонов (тестостерона, ФСГ, ЛГ) резко снижен.[9]
Азооспермия бывает обструктивной, необструктивной (секреторной) и транзиторной (временной).
Обструктивная форма азооспермии связан с закупоркой (обструкцией) семявыводящих путей вследствие разных причин.
Необструктивная форма возникает по причине нарушения выработки (секреции) сперматозоидов.
При транзиторной форме заболевания сперматозоиды в эякуляте отсутствуют определённый промежуток времени, однако между подобными эпизодами возможно оплодотворение женщины естественным путём. Транзиторная азооспермия может возникнуть как в связи с обструктивными, так и секреторными причинами. Также временная азооспермия подразумевает, что при исключении токсических или вредных факторов воздействия фертильность мужчины восстанавливается естественным образом.[10]
- Развёрнутая спермограмма. В соответствии с рекомендациями Всемирной организации здравоохранения, данный метод диагностики считается достоверным при отсутствии сперматозоидов как минимум в двух пробах, между которыми должно пройти 2-3 недели. Для установления временной азооспермии требуется ещё одна повторная спермограмма с интервалом в 2-3 месяца (столько необходимо времени для образования, созревания и перемещения половых клеток).
- Генетическое исследование крови. Предполагается установление кариотипа, гена белка СFTR, а также анализ на микроделеции (отсутствие) участка AZF Y-хромосомы.
- УЗИ мошонки с описанием размеров, структуры яичек и их придатков.
- ТРУЗИ предстательной железы и семенных пузырьков.
- МСКТ, МРТ тестикул и простаты.
- Исследование в эякуляте маркtрных веществ (цинка, фруктозы, альфа-глюкозидазы).
- Исследование гормонального статуса: тестостерон свободный и связанный, ФСГ, ЛГ, пролактин, ингибин В, ГСПГ — глобулин, связывающий половые гормоны.
- МРТ гипофиза.
- Двухсторонняя биопсия яичка (для оценки сперматогенеза). Более точной результат устанавливается путём проведения открытой диагностической биопсии яичка (TESE). Данный метод диагностике необходимо проводить совместно с забором сперматозоидов через прокол с последующей их криоконсервацией. Это позволит использовать сперматозоиды в дальнейшем при ЭКО и ИКСИ (искусственном оплодотворении).
Если у пациентов с азооспермией или тяжелой олигозооспермией нормальный размер яичек и уровень гормонов, то это может свидетельствовать о наличии обструкции семенного канала.[12]
Лечение направлено на устранение фактора, приведшего к нарушению репродуктивности (плодовитости) мужчины.
Лечение обструктивной азооспермии
Один из ведущих методов лечения — реконструктивная операция. С её помощью можно восстановить проходимость семявыносящих путей. Для этого применяется пластика уретры, наложение вазо-вазоанастомоза (соустья) или вазо-эпидидимоанастомоза.
Если обструкция семенных путей возникла на уровне придатка яичка, то в таком случае рекомендуется проведение микрохирургической эпидидимовазостомии по типу «конец в конец» или «конец в бок»: соединение семявыносящего протока с протоком придатка яичка происходит ближе (проксимальнее) к уровню обструкции. При этом предпочтительна такая техника операции, как микрохирургическая инвагинация (впячивание) эпидидимовазостомы.[13]
Реконструкция бывает односторонней и двусторонней, причём восстановление проходимости и частота беременностей обычно выше при двусторонней операции. Переход к микрохирургическому этапу вмешательства следует осуществлять в случае подтверждения проходимости семенных канальцев ниже придатка яичка. Анатомическое восстановление проходимости (реканализация) после реконструкции может продлиться от 3 до 18 месяцев.
До микрохирургического вмешательства (а также в случаях невозможности реканализации) необходимо провести извлечение сперматозоидов из придатка яичка (аспирацию) с последующей их криоконсервацией, которая может потребоваться для ИКСИ при неэффективности хирургической реканализации.[14]
Таким образом, реконструкция происходит поэтапно: ревизия мошонки и извлечение сперматозоидов из придатка яичка с последующей криоконсервацией семени, и затем проводится микрохирургическое восстановление семенных путей.[15] Восстановление фертильности после такого метода лечения происходит более чем в 50% случаев.
Лечение секреторной азооспермии
При данной форме азооспермии используется заместительная или стимулирующая гормональная терапия, корректирующая эндокринные расстройства. Этот метод лечения способен привести к восстановлению сперматозоидов в эякуляте. Также гормональная лекарственная терапия может быть очень эффективным способом восстановления фертильности при нарушениях гипоталамо-гипофизарной системы (гипогонадотропном гипогонадизм). В случаях хронических инфекционных процессов проводится антибактериальное и противовоспалительное лечение с учётом возбудителя.
Лечение транзиторной азооспермии
При лечении этой формы заболевания уделяют внимание устранению вредного фактора, а также проводят оперативное или гормональное лечение в зависимости от предпочтительной причины, которая может быть как секреторной, так и обструктивной. Данный случай отличается тем, что тяжёлые нарушения сперматогенеза ещё не наступили, поэтому процесс нарушения фертильности вполне поддаётся быстрому регрессу.
Если же при проведённом хирургическом и консервативном лечении фертильность восстановить не удалось, то следует обратиться к вспомогательным репродуктивным технологиям. ИКСИ является самым эффективным методом искусственного оплодотворения. Для данной процедуры необходимо получить сперматозоиды путём открытой/аспирационной биопсии яичка (TESA/TESE) или придатка яичка (MESA, PESA).[16]
При неустранимых причинах азооспермии (в основном, при генетических нарушениях) успешное лечение мужского бесплодия является трудно выполнимой задачей. В таком случае для оплодотворения супругам стоит воспользоваться донорской спермой. При обструктивной азооспермии шанс зачать ребёнка естественным путём или с использованием метода репродуктивной технологии выше, чем при секреторной форме заболевания. В подавляющем большинстве случаев причинами возникновения азооспермии являются необратимые нарушения работы яичек, приводящие к глубокому нарушению сперматогенеза.[17]
Профилактика:
- своевременное лечение инфекционных заболеваний, в том числе урогенитальных;
- раннее генетическое обследование при подозрении на наследственные нарушения, приводящие к бесплодию;
- исключение травм и ушибов яичек;
- сбалансированный рацион питания, обеспечение правильного физического развития в период полового созревания.
Азооспермия (Аспермия)
Азооспермия – нарушение сперматогенеза, характеризующееся отсутствием сперматозоидов в составе семенной жидкости. В зависимости от причин различают обструктивную и необструктивную азооспермию. Азооспермия сопровождается невозможностью зачатия естественным путем, а в некоторых случаях — и с помощью вспомогательных репродуктивных технологий. Азооспермия диагностируется в процессе обследования репродуктивного статуса мужчины (УЗИ, биопсии яичка, определения уровня гормонов, спермограммы, АСАТ). При обструктивной азооспермии требуется микрохирургическое восстановление проходимости семявыносящих путей; при секреторной форме патологии – проведение стимулирующей гормональной терапии. В случае невозможности естественного зачатия прибегают к использованию ЭКО (ИКСИ).
Общие сведения
Азооспермия – форма мужского бесплодия, обусловленная отсутствием сперматозоидов в эякуляте. В андрологии и урологии выделяют несколько вариантов нарушения сперматогенеза: олигозооспермию, астенозооспермию, тератозооспермию, азооспермию. Кроме этого встречаются сочетанные формы патологии: олигоастенозооспермия, олиготератозооспермия, астенотератозооспермия и пр. Из всех факторов бесплодия у мужчин на долю азооспермии приходится около 10-20%. Патология спермы, в т. ч. азооспермия, всегда является отражением неблагополучия мужского репродуктивного здоровья, поэтому основные усилия специалистов должны быть направлены на выявление и устранение причин данного состояния.
Азооспермия
Причины азооспермии
С учетом причин возникновения азооспермия может быть обструктивной, необструктивной (секреторной) и временной. В основе обструктивной формы азооспермии лежит непроходимость семявыносящих путей, в результате чего сперматозоиды не могут попасть в эякулят. При этом мужские половые клетки образуются в достаточном количестве, имеют нормальную морфологию и подвижность. Причинами, приводящими к обструктивной азооспермии, могут являться:
- врожденные аномалии (аплазия семявыносящих протоков);
- воспалительные процессы (орхит, эпидидимит, везикулит, простатит);
- травмы органов мошонки;
- варикоцеле;
- пахово-мошоночные грыжи;
- стриктура уретры;
- операции на органах мошонки (вазорезекция, грыжесечение, операции при гидроцеле).
При секреторной (необструктивной) азооспермии изначально нарушается образование сперматозоидов в яичках. Факторами, вызывающими подобное состояние, могут служить:
- двусторонний крипторхизм;
- эпидемический паротит, осложненный орхоэпидидимитом;
- опухоли яичек;
- радиационное облучение;
- токсическое воздействие солей тяжелых металлов и пестицидов.
Нарушение сперматогенеза по типу секреторной и обструктивной азооспермии может иметь место при гипогонадизме, муковисцидозе, сахарном диабете, целиакии, опухолях гипофиза, травмах позвоночника, сифилисе и другой патологии.
Временная азооспермия характеризуется преходящими функциональными нарушениями со стороны половых желез и может развиваться на фоне острых заболеваний, стрессов, приема лекарственных препаратов (стероидных гормонов, антибактериальных и противоопухолевых средств), частого посещения саун и бань. Временное снижение производства сперматозоидов отмечается у сексуально активных мужчин при частых половых актах.
Патанатомия
Сперматогенез – процесс образования и созревания мужских половых клеток начинается в пубертатном периоде и продолжается до глубокой старости. Образование сперматозоидов происходит в извитых семенных канальцах яичек и включает три последовательные фазы: пролиферацию сперматогоний, мейоз и спермиогенез. Наиболее активно этот процесс протекает при температуре 34°С, что обеспечивается анатомическим расположением яичек в мошонке, вне брюшной полости. Окончательное созревание сперматозоидов происходит в придатке яичка. Продолжительность полного цикла сперматогенеза у мужчины составляет примерно 73-75 дней.
Классификация
Разного рода неблагоприятные факторы могут нарушать процесс образования и созревания сперматозоидов, приводя к различным формам патоспермии, наиболее частыми среди которых являются:
- олигозооспермия — снижение количества живых сперматозоидов (менее 20 млн. в 1 мл эякулята)
- астенозооспермия – наличие менее 50% сперматозоидов с движением 1 типа (прогрессивного линейного) и 2 типа (медленного линейного либо прогрессивного нелинейного) или менее 25% сперматозоидов с движением 1 типа. Количество и форма сперматозоидов при этом в норме.
- тератозооспермия – более половины сперматозоидов имеют отклонения в строении головки и хвоста. Подвижность и количество клеток не изменены.
- азооспермия – сперматозоиды в семенной жидкости отсутствуют.
Симптомы азооспермии
Основным специфическим симптомом азооспермии является мужское бесплодие. При этом сексуальная функция у мужчины может оставаться не нарушенной. Остальные клинические симптомы, сопровождающие азооспермию, связаны с основным заболеванием. Так, при гипогонадизме у мужчины определяется неразвитость вторичных половых признаков: скудное оволосение, телосложение по женскому типу, гинекомастия. Секреторной азооспермии нередко сопутствует гипоплазия яичек, микропенис, снижение либидо, эректильная дисфункция.
При различных формах обструктивной азооспермии мужчину может беспокоить дискомфорт, боль, отек или припухлость мошонки. При пальпации определяются яички нормальных размеров и формы, а придатки яичек увеличены за счет скопления в нем сперматозоидов. Обструктивная азооспермия может сопровождаться ретроградной эякуляцией.
Диагностика
Причины и форма азооспермии могут быть установлены только специалистами (андрологами, урологами, эндокринологами) на основании комплексного обследования мужской репродуктивной системы. Применяются следующие диагностические методики:
- Сбор анамнеза. Уточняется частота половой активности и длительность периода бесплодия, перенесенные заболевания, профессиональные вредности, образ жизни пациента и другие факторы.
- Физикальный осмотр. Оценивается тип телосложения, выраженность вторичных половых признаков, состояние наружных гениталий.
- Ультразвуковые исследования. Для исключения патологии мужских половых органов проводится УЗИ органов мошонки, ТРУЗИ предстательной железы, УЗДГ сосудов мошонки и др.
- Спермограмма с MAR-тестом. Важными анализами, позволяющими судить о мужской фертильности в целом и азооспермии в частности, являются спермограмма и определение уровня антиспермальных антител в крови.
- Анализы на гормоны. Исследование гормонального статуса при азооспермии (тестостерон, пролактин, эстрадиол, ЛГ, ФСГ) позволяет судить о гипоталамо-гипофизарной регуляции деятельности половых желез.
С целью исключения ЗППП, как фактора азооспермии, осуществляется обследование пациента на инфекции методами ИФА, РИФ, ПЦР. Для исключения ретроградного семяизвержения производится постэякуляторный анализ мочи. Дифференциальной диагностике форм азооспермии способствует проведение диагностической биопсии яичка.
Лечение азооспермии
Консервативное и хирургическое лечение
Во всех случаях азооспермии лечение направлено на устранение причины, вызвавшей нарушение мужской фертильности. Так, главным путем решения проблемы обструктивной азооспермии является проведение реконструктивной операции, обеспечивающей восстановление проходимости семявыносящих путей: пластики уретры, наложения вазо-вазоанастомоза или вазо-эпидидимоанастомоза, оперативного устранения варикоцеле и др.
Успешность восстановления фертильности после хирургического устранения обструкции семявыносящих путей составляет 27-56%. Для коррекции эндокринных расстройств, приведших к секреторной азооспермии, назначается заместительная или стимулирующая гормональная терапия. С помощью курса лечения мужского бесплодия гормонального генеза в некоторых случаях удается добиться появления сперматозоидов в эякуляте.
Вспомогательные репродуктивные технологии
Если, несмотря на предпринятое хирургическое и консервативное лечение азооспермии, беременность у партнерши так и наступает, на помощь приходят вспомогательные репродуктивные технологии, самой эффективной из которых является ИКСИ. Для процедуры экстракорпорального оплодотворения сперматозоиды получают в процессе открытой или аспирационной биопсии из яичка (TESA/TESE) или биопсии придатка яичка (MESA, PESA).
При неустранимых причинах азооспермии успешное лечение мужского бесплодия не представляется возможным. В этом случае для оплодотворения паре рекомендуется воспользоваться донорской спермой. В целом же шансы на зачатие естественным путем или с помощью методов ВРТ выше у мужчин с обструктивной формой азооспермии, по сравнению с секреторной.
Азооспермия — лечение в Москве
Диагноз ставят, если в эякуляте полностью отсутствуют сперматозоиды. Патологию оценивают как тяжелую — в большинстве случаев мужчины не могут зачать естественным путем. Но благодаря современным технологиям азооспермия перестала быть приговором.
Содержание статьи
Азооспермия: что это такое
У мужчин с бесплодием этот диагноз ставят в 10 ‒ 15% случаев. Патология обычно не дает о себе знать. Объем спермы, сексуальная активность — все в норме. Пара узнает о проблеме, когда планирует беременность. После долгих безуспешных попыток супруги начинают обследование — сначала женщина, а когда ее результаты оказываются в норме, — то и мужчина. Уролог-андролог или репродуктолог направляет пациента на спермограмму.
Если сперматозоиды в ней не обнаружены, с диагнозом не спешат. Назначают повторные анализы, исследуют гормональный фон. Выбирают лучший — и опираясь на него ставят диагноз.
Причины азооспермии
Зависят от типа патологии. Врачи называют общие причины:
- Некорректная работа протоков, которые выводят сперму. Возникает вследствие перенесенной травмы спинного мозга, оперативного лечения предстательной железы, инфекций — хламидиоза, гонореи, туберкулеза;
- Дисфункция яичек. Бывает при их неопущении, орхите, сниженном уровне мужских половых гормонов, травмах яичек, инфекциях, патологии семенного канальца, хромосомных и генетических аномалиях, отсутствии яичек (или одного из них);
- Первичные заболевания. Сахарный диабет, муковисцидоз, врожденные аномалии;
- Нарушение отделов головного мозга. Состояние репродуктивной системы мужчины зависит от двух отделов — гипоталамуса и гипофиза. Они отвечают за выработку половых гормонов, сексуальное влечение и мужское здоровье.
Все эти факторы негативно влияют на способность мужчины к зачатию.
Разновидности азооспермии
Выделяют несколько типов патологии: обструктивная, необструктивная или секреторная, сочетанная, транзиторная. Каждая разновидность имеет характерные признаки и причины. Рассмотрим их.
Обструктивная азооспермия
При этой форме недуга яички вырабатывают сперматозоиды, их качество и количество в норме, но они не попадают в эякулят. Причина — семявыносящие пути непроходимы или их проходимость частично нарушена.
С чем связана проблема? Врачи указывают на несколько факторов:
- врожденная патология — младенец рождается без семенных канальцев;
- травмы половых органов;
- хирургическое вмешательство: по поводу паховой грыжи, стерилизации (вазэктомии);
- воспалительные процессы, кисты, рубцы;
- склеротические явления в уретре, предстательной железе, придатках;
- муковисцидоз — при этом недуге семявыносящие протоки развиты недостаточно.
Эту форму диагностируют у 25 ‒ 30% пациентов с азооспермией.
Секреторная азооспермия
В этом случае сперматозоиды не созревают или их созревание прерывается на каком-то этапе. Это тяжелая форма. Семявыносящие протоки функционируют нормально.
Вот причины патологии:
- Дисфункция щитовидной железы или гипофиза — это приводит к гормональному дисбалансу;
- Врожденная патология — яички развиты не полностью, крипторхизм;
- Травма яичек — при перенесенной грыже мошонки, варикоцеле, физическом воздействии;
- В результате перенесенной онкологии, химио- или лучевой терапии;
- Хронические болезни: сахарный диабет, туберкулез;
- Сепсис;
- Следствие перенесенного в детстве паротита;
- Дефицит витаминов, злоупотребление строгими диетами;
- Работа на вредном производстве — химическом, связанном с радиационным облучением;
- Медикаментозная терапия — некоторые лекарства угнетают сперматогенез, употребление алкоголя, наркотиков.
Эту форму патологии диагностируют у 60% пациентов.
Другие формы патологии
Выделяют 2 типа азооспермии — смешанного генеза (сочетанную) и транзиторную (временную). При смешанной у пациента выявляют признаки обоих типов недуга. Это самая сложная форма патологии. При транзиторной нарушение имеет временный характер. Оно возникает на фоне секреторных или обструктивных факторов, но полностью обратима.
Признаки азооспермии
Заболевание обычно никак не проявляет себя. Мужчина здоров, ведет активную сексуальную жизнь, имеет хорошую эрекцию с эякуляцией, внешний вид спермы тоже не выдает проблемы.
Врачи обращают внимание на такие косвенные признаки.
Недоразвитие половых органов. Оно связано с низким уровнем продуцирования гормонов.
Внешний вид половых органов. Мошонка отекшая, яички дряблые, аномального размера.
Субъективные жалобы. Возможны болевые ощущения в области мошонки. У мужчин с бесплодием часто диагностируют варикоцеле, у них мягкие и слишком маленькие яички, избыточное оволосение тела.
Эти признаки свидетельствуют о наличии проблемы, но необязательно о бесплодии. Диагноз ставят на основании многочисленных исследований.
Этапы диагностики заболевания
Для постановки диагноза мужчина проходит комплексное обследование:
- Осмотр уролога-андролога. Врач оценивает внешнее состояние органов мочеполовой системы — яичек, придатков, уретры, предстательной железы. Он оценивает их строение, размер;
- Спермограмма. Анализ, который имеет важнейшее значение при постановке диагноза. Заключается в исследовании эякулята под микроскопом. Он позволяет определить наличие или отсутствие в нем сперматозоидов, антиспермальных тел, лейкоцитов. При наличии спермиев оценивают их качество (подвижность, строение) и количество;
- Биопсия придатков, яичек. Выявляет сперматогенез и причины нарушения процесса;
- Анализ крови на гормоны. Позволяет установить или опровергнуть секреторный тип патологии;
- Рентген семенных протоков. Проводят при обструктивном нарушении — для определения его точных характеристик. Процедуру проводят с контрастным веществом.
Диагноз азооспермия: лечение
Для планирования терапии врачу необходимы данные о форме и причине недуга. Он получает их в результате обследования. Цель терапии — помочь мужчине стать отцом.
Лечение обструктивного нарушения направлено на восстановление репродуктивной функции. В этом случае поможет оперативное вмешательство. Цель — восстановить проходимость семявыносящих путей. Врач использует микрохирургические методы. Проводятся операции по-разному: это зависит от протяженности и расположения непроходимого участка.
Лечение при секреторном нарушении малоперспективно. Цель — скорректировать эндокринные нарушения и восстановить процесс созревания сперматозоидов. Результат зависит от причины.
В некоторых случаях можно восстановить гормональный фон с помощью медикаментозной терапии. Мужчинам с бесплодием вследствие варикоцеле поможет операция по устранению первичного заболевания.
Шансы на беременность
При этом недуге шансы зачать естественным путем стремятся к нулю. Конечно, немало женщин забеременело при азооспермии у мужей. Но важно сразу оценить ситуацию: насколько перспективна медикаментозная терапия или операция. Если в вашем случае шансов мало, есть альтернативный метод — экстракорпоральное оплодотворение.
ЭКО при азооспермии
Не спешите отчаиваться при диагнозе бесплодие. Метод ЭКО помог многим парам с этой проблемой зачать и родить здоровых малышей. Современная репродуктивная технология позволяет использовать собственную сперму мужчины. Ее получают из придатков и яичек путем биопсии.
Биопсию яичка при азооспермии проводят мужчинам, у которых в эякуляте абсолютно нет сперматозоидов. В этом случае остается шанс извлечь гаметы из яичек. Врач извлекает из придатков или яичка тестикулярную ткань и отправляет в лабораторию. Эмбриолог исследует ее с целью выявления спермиев. При их наличии — оценивает концентрацию и качество. Процедуру проводят двумя способами: оперативно через разрез или пункцию.
Затем приступают к оплодотворению. При синхронном получении половых клеток обоих супругов оплодотворение проводят сразу после извлечения и оценки спермиев.
При пункции яйцеклеток сперматозоиды замораживают и хранят, пока женщина готовится к процедуре.
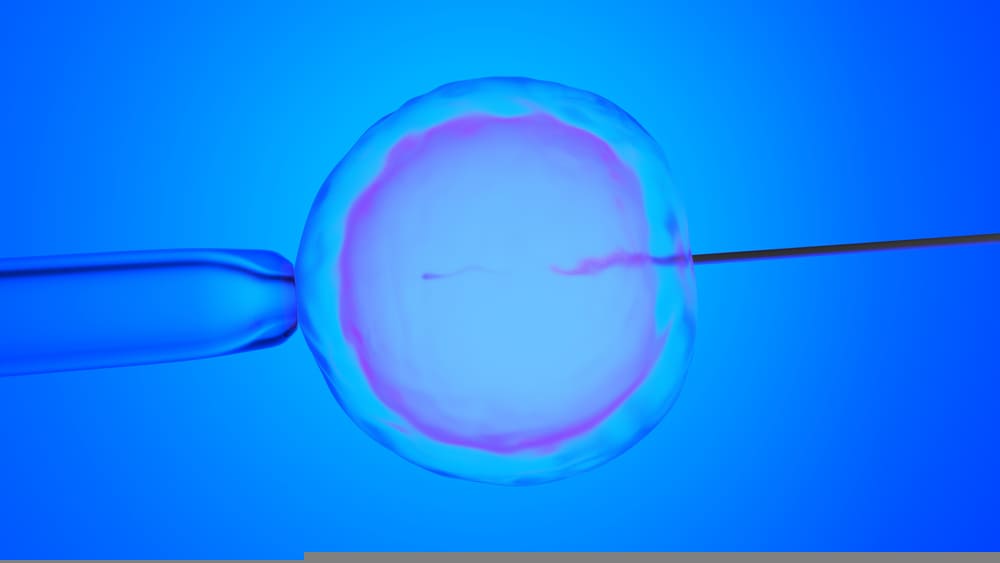
Метод ИКСИ (ICSI) при бесплодии
При азооспермии из яичек могут извлечь всего несколько сперматозоидов — и благодаря современной технологии ИКСИ этого будет достаточно для оплодотворения. Даже если будет всего одна клетка, у супругов есть шанс зачать собственного малыша.
Эмбриолог оценивает полученные в ходе биопсии клетки, выбирает самую лучшую — и вводит ее в яйцеклетку.
Если полученные сперматозоиды низкого качества (например, имеют плохую морфологию) или их вовсе не удалось извлечь, паре рекомендуют использовать биоматериал донора.
Благодаря этой репродуктивной технологии азооспермия — больше не приговор для пар, мечтающих о ребенке.
Азооспермия – полное или почти полное отсутствие в сперме мужчины сперматозоидов, что ведёт к развитию тяжелых форм бесплодия. Ведь азооспермия и беременность естественным путём практически несовместимы.
Чаще всего мужчины свято уверены в том, что качественное и частое исполнение супружеского долга является показателем их отличной фертильности (способности к воспроизведению потомства). На самом деле это не совсем соответствует истине, ведь существует такой диагноз азооспермия, при котором мужчина может не испытывать трудностей в половой сфере, но при этом он будет оставаться бесплодным.
Конечно, любого мужчину интересуют приводящие к данному заболеванию причины – чтобы избегать их и защититься от этого заболевания:
- Нарушения гормональной регуляции
- Воспаления ткани яичек (особенно в подростковом периоде)
- Опухоль гипофиза
- Травмы половых органов
- Генетическая патология
- Оперативные вмешательства на яичках в анамнезе
- Рак простаты
Для того, чтобы понять, можно ли вылечить азооспермию в каждом конкретном случае, нужно разобраться, почему возникает такой диагноз и какие её виды встречаются.
Существует две разновидности азооспермии:
- Обструктивная азооспермия – возникает при нормальной выработке сперматозоидов, но нарушенном сообщении между придатками яичка и выводящими протоками, из-за чего сперматозоиды не попадают в эякулят. Для детородной функции более благоприятной является обструктивная азооспермия, лечение этого состояние может привести к излечению от бесплодия. Если же лечение окажется неэффективным, обструктивная азооспермия и ЭКО вполне совместимы.
- Секреторная азооспермия (необструктивная) – возникает при отсутствии выработки сперматозоидов. В результате половая функция будет сохранена, эякулят образуется, однако мужчина к оплодотворению неспособен. Если мужчине устанавливается диагноз секреторная азооспермия, лечение может оказаться безуспешным. Однако секреторная азооспермия и ЭКО также могут дать шанс на приобретение потомства.
- Временная азооспермия – некоторые врачи устанавливают такой диагноз, если отсутствие сперматозоидов в эякуляте носило временный характер из-за стрессов, усталости или приёма медикаментов. После исчезновения раздражающего фактора состав спермы полностью восстанавливается. В этой ситуации может помочь лечение азооспермии народными средствами, отзывы о таком лечении при временной азооспермии довольно благоприятны.
Несмотря на то, что всего 2% бесплодных пар сталкиваются с диагнозом азооспермия у мужа, диагностика этого состояния является важным этапом в лечении мужского бесплодия. Как же устанавливается данный диагноз?
Диагностика азооспермии:
- Осмотр на предмет изменений со стороны яичек и их придатков, а также наличия гипогонадизма (низкий уровень половых гормонов, из-за чего сперма не вырабатывается)
- Различные анализы крови, в том числе гормональный профиль
- Биопсия ткани яичек проводится для выяснения, вырабатывают ли яички хоть какое-то количество сперматозоидов. Биопсия при азооспермии может служить не только для диагностики бесплодия, но и для проведения ЭКО. Известно, что биопсия при азооспермии секреторной может выявить участки яичек, которые вырабатывают сперматозоиды – в дальнейшем их можно использовать при ЭКО (даже при секреторной азооспермии ЭКО имеет до 65% успешности)
- Генетический скрининг – выявляет различные наследственные причины азооспермии
- МРТ головного мозга проводится при подозрении на опухоли
- Для исключения варикоцеле проводят дуплекс-сканирование органов мошонки
- УЗИ яичек и придатков, сосудов
- Спермограмма
- Исследование мочи после эякуляции проводится при подозрении на заброс спермы в мочевой пузырь
Как лечить?
В зависимости от того, какие у азооспермии причины, назначается целевое лечение:
- Обструктивная азооспермия – лечение направлено на восстановление движения спермы по выводящим путям. Чаще всего это микрохирургические операции, требующие определённых навыков и опыта, поэтому обычно обструктивная азооспермия лечится в больших клиниках, имеющих хорошую репутацию. Если же пассаж спермы не восстановился даже после операции, то проводится биопсия при азооспермии с последующим циклом ЭКО: как уже неоднократно говорилось, азооспермия и ЭКО вполне сочетаемы.
- Необструктивная азооспермия (секреторная) – лечение будет зависеть от причины.
- Если секреторная азооспермия вызвана воспалительными процессами – назначаются антибиотики.
- Если причиной к установке данного диагноза послужил гипогонадизм – проводится гормональная терапия.
- Если же излечить основное заболевание не удаётся – проводится множественная биопсия при азооспермии, во время которой происходит поиск работающих участков гонад и забор из них сперматозоидов.
- Если же сперматозоиды получены в очень маленьком количестве, они малоподвижны – азооспермия лечится методом ЭКО-ИКСИ (когда сперматозоид вводится прямо в ооцит).
- При безуспешности всех этих методов единственным успешным методом лечения оказывается ЭКО спермой донора.
Сегодня на форумах можно найти множество историй мужчин с таким диагнозом, кто вылечил это заболевание, имеет детей. Столкнувшись с этим состоянием, главное – не отчаиваться и вовремя понять, что такое азооспермия, как лечить это состояние – ведь от своевременности начала лечения зависит вероятность успеха!
Мужское бесплодие. Азооспермия: анализ спермограммы, обследование
21.05.201512:5421.05.2015 12:54:28
В прошлом сообщении мы подробно остановились на том, что такое азооспермия, какие факторы приводят к этому состоянию, как отличить друг от друга разные виды азооспермии. Сегодня мы расскажем о том, какое обследование надо пройти при азооспермии, на что обратить внимание при интерпретации спермограммы и зачем выполняется биопсия яичек.
На какие показатели спермограммы стоит обратить внимание при азооспермии?
Анализу спермы — спермограмме- надо уделить особое внимание, так как ее показатели могут помочь врачу в правильной постановке диагноза.
После подтверждения азооспермии в двух спермограммах, обязательно подвергнутых центрифугированию, с данными анализами следует обратиться к врачу урологу-андрологу. Центрифугирование и затем микроскопическое исследование материала позволяет исключить криптозооспермию, когда единичные сперматозоиды все-таки в эякуляте присутствуют.
В спермограмме при необструктивной азооспермии объем эякулята остается нормальным, соответственно при обструкции объем эякулята как правило снижен. При азооспермии в связи с отсутствием сперматозоидов в сперме цвет эякулята прозрачный, а не светло-молочный.
Биохимический состав спермы может также меняться, например: у пациентов с двухсторонней обструктивной азооспермией выше придатков яичек наблюдается снижение концентрации фермента альфа-гликозидазы.
С чего начинается обследование при азооспермии?
Обследование пациентов с азооспермией начинается со сбора анамнеза и осмотра. У пациента выясняют: не было ли в анамнезе крипторхизма, перекрута яичек, химио или лучевой терапии, половых инфекций, травм и серьезных полостных операций на гениталиях и внизу живота, исключают двустороннее варикоцеле. Врач также обращает внимание на объем и консистенцию яичек, вторичные половые признаки, исключает гинекомастию. Учитывает, были ли беременности и рождались дети от пациента в прошлом.
Минимальный алгоритм обследования при азооспермии
Конечно, каждый пациент рассматривается индивидуально и алгоритм может расширяться, но «минимум» не меняется.
- Гормональный скрининг. Исследуют уровень половых гормонов (основные: ФСГ, ЛГ, тестостерон общий и свободный, ГСПГ, пролактин, эстрадиол, гормоны щитовидной железы). Уровень ФСГ (фолликулостимулирующего гормона) играет существенную роль в прогнозе заболевания, он зависит от количества сперматогоний. При отсутствии сперматогоний или снижении их уровня, уровень ФСГ существенно возрастает. Однако, бывает, что нормальное число сперматогоний при полном блоке сперматоцитов и сперматид сочетается с нормальными показателями ФСГ. Конечно, чем выше уровень ФСГ, тем меньше шансов при биопсии яичек обнаружить сохранный сперматогенез, но несмотря на это окончательную точку можно поставить только после биопсии яичек.
- Исключение урогенитальных инфекций методом ПЦР.
- Генетическое обследование: кариотипирование, AZF-фактор, CFTR-фактор.
- УЗДГ органов мошонки и ТрУЗИ предстательной железы.
- Окончательный диагноз можно поставить только после проведения биопсии яичек с последующим гистологическим исследованием.
Зачем при азооспермии выполняют биопсию яичек?
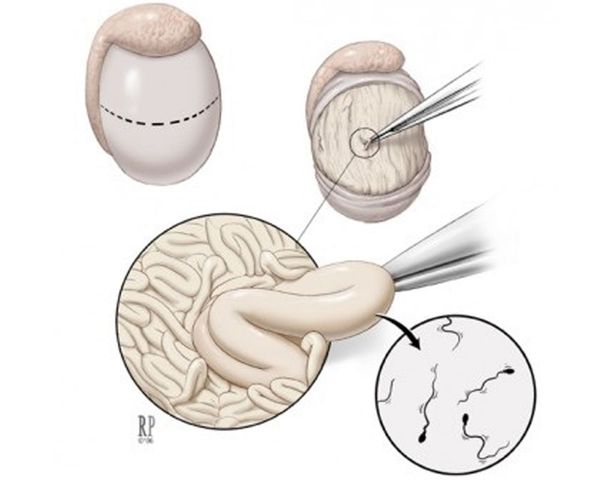
Биопсия яичек при азооспермии может быть диагностической и непосредственно в программе ИКСИ, т.е. уже в цикле искусственного оплодотворения. По технике выполнения — открытой, перкутанной и аспирационной. Задача любой биопсии — попытка обнаружения сперматозоидов пригодных к оплодотворению и получение достаточного количества материала для гистологического исследования.
Диагностическая биопсия показана тем пациентам, когда нет полной уверенности по результатам обследования, что сперматозоиды будут найдены (например: очень высокий уровень ФСГ) или для дифференциальной диагностики между обструктивной и необструктивной азооспермией (например: когда нормальный уровень ФСГ). Диагностическая биопсия может быть также частью терапевтического процесса у пациентов с необструктивной азооспермией при подготовке к ИКСИ. Если во время диагностической биопсии сперматозоиды обнаружены их можно подвергнуть криоконсервации, а супружеской паре рекомендуют программу ИКСИ с использованием криосперматозоидов или с получением сперматозоидов путем повторной биопсии. Биопсия яичек является амбулаторной манипуляцией и проводится под местной анестезией или под непродолжительным внутривенным наркозом, желательно в клинике ЭКО, т.к. это позволит сразу криоконсервировать полученные сперматозоиды.
Открытая биопсия выполняют путем разреза кожи по обе стороны мошонки от срединного шва на обоих яичках. Это позволяет оценить ткань яичка и придатка и получить достаточно гистологического материала для исследования.
Перкутанная биопсия (черезкожная), также как и аспирационная биопсия могут быть использованы, однако не всегда удается получить достаточное количество материала необходимого для исследования и приходится переходить к открытой биопсии.
Выводы
Азооспермия — неприятная находка, но не окончательный приговор к бесплодию. Современные методы диагностики и лечения позволяют дать шанс на получение своего генетического ребенка. Окончательный диагноз бесплодия при азооспермии можно поставить только по результатам биопсии яичек.
1 часть: Причины и лечение азооспермии
//ru.pinterest.com/pin/create/extension/
21.05.201512:5421.05.2015 12:54:28
Информация, о которой пойдет речь ниже, будет весьма полезна тем, кто столкнулся с таким диагнозом, как азооспермия.
По-научному азооспермия – это нарушение сперматогенеза (развития мужских половых клеток), характеризующееся отсутствием сперматозоидов в семенной жидкости.
При азооспермии практически невозможно зачатие естественным путем (!), а в некоторых случаях – и с помощью вспомогательных репродуктивных технологий.
Диагностика:
Заболевание диагностируется в процессе обследования репродуктивного статуса мужчины. Так, могут быть назначены: спермограмма, МАР-тест, УЗИ и допплерометрия органов мошонки, ТРУЗИ предстательной железы. Необходимые в каждом конкретном случае виды обследований определяет врач уролог-андролог.
Лечение:
Лечение азооспермии может проводиться как консервативно, так и оперативно, однако шансы стать отцом естественным путем остаются достаточно низкими. Раньше эту проблему решали с помощью донорской спермы. Сейчас целесообразнее проведение забора сперматозоидов с помощью биопсии яичка – операции TESA, TESE или Micro-TESE, с последующим использованием полученного материала в процедуре ЭКО – ИКСИ.
Вышеуказанные методы хирургического лечения в Клинике Доктора Фомина выполняют:
- врач уролог-андролог, хирург, член Российской Ассоциации Репродукции Человека и Профессиональной Ассоциации Андрологов России – Анастасия Валерьевна Астахова.
- кандидат медицинских наук, врач уролог-андролог, хирург, член Европейской ассоциации урологов, Татьяна Алексеевна Бедарева (Лукомник)
Ваше здоровье – это наша работа!
Справочно:
Различают следующие виды азооспермии:
- Обструктивная азооспермия
Обструктивная азооспермия характеризуется отсутствием или непроходимостью семявыносящих протоков и обусловлена их врожденной аплазией (отсутствием), либо гипоплазией (недоразвитием), наличием диффузных воспалительных процессов в придатке яичка, перенесенных травм, вазэктомии (удаление семявыносящих протоков – мужская стерилизация), операций по поводу паховой грыжи.
- Необструктивная (секреторная) азооспермия
При необструктивной (секреторной) форме азооспермии наблюдается недостаточность сперматогенеза, вызванная полной или неполной остановкой созревания, угнетением сперматогенеза, аплазией сперматогенного эпителия, блоком сперматогенеза на различных уровнях. В 30% случаев необструктивной (секреторной) азооспермии причины неизвестны.
Частота обструктивной азооспермии составляет около 25-30%, необструктивной азооспермии – 20%. Смешанные формы азооспермии встречаются чаще других.
- Транзиторная азооспермия
Еще один вид азооспермии – транзиторная азооспермия, возникающая лишь в определенные временные промежутки, встречается довольно редко и составляет 5-10% в общей структуре заболевания. Это состояние полностью обратимо и может быть вызвано как обструктивными так, и необструктивными причинами. Диагноз транзиторной азооспермии устанавливается если у пациента фиксируется в одних спермограммах – азооспермия, а в других сперматозоиды обнаруживаются.
Тактикой лечения данного вида азооспермии является, получение сперматозоидов из эякулята с их последующей криоконсервацией, для дальнейшего использования в протоколах ВРТ (ЭКО, ИКСИ).
Для записи на прием к специалистам КДФ звоните по телефону: 8 (4822) 65-01-29 или используйте онлайн-форму.
Возможны противопоказания. Проконсультируйтесь с врачом.
Если в результате спермограммы сперматозоидов в сперме не выявлено, уролог-андролог ставит диагноз – азооспермия. Именно эта патология является одной из самых распространённых причин мужской бездетности. При этом у мужчины наблюдается нормальная эрекция с полноценной эякуляцией. По внешним признака эякулят никак не отличается от эякулята здорового человека. Выявить нарушения и диагностировать проблему возможно только с помощью специального исследования — спермограммы. Именно поэтому, зачастую, семьи даже не подозревают, что зачатие не происходит именно как следствие «мужского фактора».
Причины и симптомы азооспермии.
Основными причинами этого заболевания являются: нарушения в работе семявыносящих протоков; дисфункция яичек, следствие перенесенных заболеваний.
Нарушения в работе семявыводящих протоков могут возникнуть вследствие: травм, в том числе позвоночника и/или спинного мозга; оперативного вмешательства на предстательной железе; ЗППП; сахарного диабета; нарушений обменных процессов; врожденных пороков.
Среди главных причин нарушений в функции яичек врачи урологи выделяют следующие:
- неопущение яичек (криптохризм);
- недостаточная выработка тестостерона и других половых гормонов;
- травмы;
- воспаления в органах малого таза;
- вредные привычки;
- радиационное облучение;
- инфекционные заболевания;
- врожденные патологии.
Важно также отметить, что нормальное функционирование репродуктивной системы мужчины во многом зависит от стабильной работы и состояния таких отделов мозга, как гипоталамус (играющий существенную роль в секреции гормонов) и гипофиз. Нарушения в работе этих отделов мозга могут быть вызваны интоксикацией организма, вредными привычками, опухолевыми процессами или как следствие травм и кровоизлияния.
Если у мужчины азооспермия — он не будет наблюдать изменений в общем самочувствии и какие-либо ярко выраженные симптомы. Главным симптомом заболевания врачи считают бесплодие при нормальной эрекции и эякуляции. Только лишь диагностика может выявить количество и качество сперматозоидов в эякуляте.
Несмотря на это, существует несколько явных признаков, при появлении которых необходимо непременно обратиться к профильному специалисту, а именно:
- избыточный рост волос на теле;
- скудный рост волос на теле и лице, женоподобность;
- признаки варикоцеле (дискомфорт в паховой области, расширенные вены и др.);
- плохо развитые или слишком мягкие яички;
- прозрачная сперма.
Помните, что выявить эту болезнь в домашних условиях невозможно. Поставить верный диагноз и назначить лечение способен только уролог-андролог, после проведения ряда диагностических мероприятий и лабораторных исследований.
ИНТЕРЕСНЫЙ ФАКТ:
| Самая распространённая причина по статистике | крипторхизм |
| Диагноз поставлен | 2 % мужчин во всем мире |
| Усредненный период вызревания сперматозоида | 3 месяца |
Виды азооспермии.
В современной медицинской практике врачи выделяют две формы азооспермии.
Обструктивная – с нарушением проходимости семявыводящих протоков. Как следствие – сперматозоиды не способны попасть в пенис. Встречается у 20-30% мужчин.
Возможные причины:
- нарушенное развитие протоков, выводящих сперму;
- наличие воспаления;
- травма семявыводящих протоков, в том числе после перенесённых операций;
- оперативная стерилизация.
Секреторная (необструктивная) – более сложное состояние, вызванное нарушениям функциональности яичек. Для этой формы болезни характерно серьезное нарушение или полное прекращение выработки сперматозоидов. Диагностируется в 70-80% случаев, может быть и первичной, и приобретенной. Дисфункция яичек является одной из самых распространенных причин мужского бесплодия и часто связана с низкой выработкой мужских половых гормонов. У пациентов с пониженной выработкой тестостерона плохо выражены вторичные половые признаки: женоподобная внешность, отсутствие или не выраженность оволосения на лице и теле, маленькие мягкие яички.
Возможные причины:
- гормональный дисбаланс;
- вредные привычки, влияние экологии;
- побочные действия ряда лекарственных препаратов;
- крипторхизм (неопущение яичек);
- отравление сильнодействующими токсичными веществами или радиационное облучение;
- диабет;
- наследственность;
- высокая температура тела на протяжении длительного периода времени.
Нередко во врачебной практике у одного пациента встречается не один вид азооспермии, а сочетание обоих типов. Часто бывает так, что первопричиной служит обструкция, но со временем на фоне обструктивных изменений нарушается секреция. Именно поэтому для полноценного лечения бесплодия и восстановления сперматогенеза восстановления проходимости семявыводящих протоков может быть недостаточно.
Особенным типом болезни является временная азооспермия (транзиторная). При временной форме азооспермии отсутствие сперматозоидов наблюдают только в некоторых результатах спермограммы. Причинами могут быть стрессы, осложнение тяжелых заболеваний, употребление стероидов, побочные явления сильнодействующих лекарств, большое количество семяизвержений за непродолжительный период времени. Мужчины с временной формой нуждаются в особом плане лечения на различных его этапах.
Диагностика заболевания.
Как правило, выявление азооспермии наблюдается у мужчин, страдающих бесплодием.
Чтобы выявить истинные причины заболевания и подобрать эффективное лечение, необходимо полное обследование организма мужчины.
Как мы уже писали ранее, в подавляющем большинстве случаев азооспермия протекает бессимптомно и не сопровождается болевыми ощущениями, недомоганием, проблемами с эрекцией или эякуляцией.
Учитывая, что причин не наступления зачатия существует множество, необходимо провести исследования для подтверждения или опровержения конкретного диагноза.
В рамках диагностики проводится:
- Осмотр врача, позволяющий выявить внешние нарушения, такие как аномалии размеров, строения яичек, придатков, простаты, возможные патологии уретры и др. и составить дальнейших план диагностики.
- Спермограмма — исследование спермы под микроскопом, позволяющее выявить наличие или отсутствие сперматозоидов, определить их количество и качество, изучить строение. Данное исследование позволяет также установить содержание в эякуляте антиспермальных тел и лейкоцитов.
- Анализ крови для определения уровня секреции гормонов.
- УЗИ и ТРУЗИ позволяет врачам дать оценку состоянию яичек, эпидидимуса, простаты и семенных пузырьков.
- Рентгенографию семенных протоков (генитография). Назначается при необходимости определения точных параметров обструктивной азооспермии.
- Биопсия — помогает определить, как проходит развитие мужских половых клеток, и выявить причины нарушений сперматогенеза.
Как правило, на первом этапе диагностики, врач назначает спермограмму и анализ крови. Если по результатам этих исследований выявить точную причину отсутствия сперматозоидов в сперме мужчины невозможно, специалист прибегает к биопсии яичка. При подозрениях о наличии секреторного типа, биопсию проводят на различных зонах мужского яичка.
Подготовка к спермограмме. Для получения достоверных данных спермограммы, пациенту нужно исключить половую близость на протяжении недели. Запрещено париться в бане, сауне или перегреваться каким-либо другим образом. Также важно знать, что определенные препараты могут также влиять на точность данного исследования. Поэтому, если вы системно принимаете любые лекарства – обязательно скажите об этому вашему лечащему врачу-урологу. Возможно, он порекомендует Вам временно воздержаться от их приема. Сперму необходимо собирать не раньше 1,5-2 часов с момента последнего испражнения мочевого пузыря.
Профилактика
Одними из самых действенных методов профилактики нарушений сперматогенеза являются: лечение ЗППП и воспалительных процессов на ранней стадии; своевременное генетическое обследование при наличии наследственных или врожденных факторов; исключение травм мошонки; отсутствие вредных привычек; минимизация приема сильнодействующих лекарств с возможными побочными явлениями; нормальная физическая активность и развитие юноши во время полового созревания.
Чтобы как можно дольше поддерживать мужское здоровье и репродуктивную функцию, мужчинам в любом возрасте обязательно нужно уделять внимание своему здоровью до возникновения проблемы. В качестве общих профилактических мер можно отнести такие рекомендации:
- не перегревать и не переохлаждать половые органы;
- носить нижнее белье из натуральных тканей, избегать сдавливания половых органов бельем;
- регулярные половые акты с постоянным партнером;
- ведение активного образа жизни;
- избегание излишних физических нагрузок;
- контроль индекса массы тела;
- сбалансированное питание;
- отсутствие вредных привычек;
- сведение к минимуму стрессов;
- полноценный сон (не менее 7 часов в сутки);
- адекватное лечение инфекционных, хронических, воспалительных процессов в органах малого таза;
- избежание, а в случае невозможности – минимизация с соблюдением мер безопасности, в контакте с активными химическими веществами, ядами, радиацией и др.
- укрепление иммунной системы.
Мужчинам в возрасте от 30 лет необходимо не реже одного раза в год проходить профилактический осмотр у врача уролога-андролога.
ВАЖНО:
Ученые из Стэнфордского университета (Калифорния, США) обнаружили взаимосвязь между наличием бесплодия в анамнезе мужчины и риском заболевания раком яичка. Как доказывает исследование, опубликованное в журнале «Medicine», риск развития онкологии у пациентов, страдающих бесплодием, в несколько раз выше, в сравнении с мужчинами, способными к зачатию.
Лечение азооспермии.
Еще около 30 лет назад этот диагноз был «приговором» наступлению беременности и приравнивался к стопроцентному мужскому бесплодию. Сейчас же это заболевание – решаемая проблема, при условии применения современных методик лечения и грамотного врачебного подхода.
Чтобы понять, как лечить болезнь, необходимо прежде всего определить ее вид и форму.
При лечении секреторной формы учитываются причины, вызвавшие это состояние. Лечение может быть как медикаментозным, так и оперативным, а также может требовать применения дополнительных методик для лечения бесплодия.
К примеру, необструктивная форма, обусловленная нарушением в геноме, скорее всего будет корректироваться назначением препаратов, нормализующих гормональный фон. При наличии инфекционных заболеваний, сопутствующих азооспермии, назначается лечение, направленное на устранение инфекции и дальнейшее улучшение сперматогенеза.
При обструктивной форме вероятна необходимость проведения операции на протоках и придатках яичка.
Прием лекарств при азооспермии. Препараты для лечения азооспермии можно применять только по рекомендации и под наблюдением врача. Уролог предварительно должен убедиться в отсутствии обструкции и в том, что целостность каналов органов малого таза пациента не нарушена. Важно понимать, что только после полной диагностики и постановки диагноза врач может подобрать лекарственные препараты, направленных на активизацию сперматогенеза и стабилизацию работы гормональной системы.
Также врач может порекомендовать мужчине принимать ряд микроэлементов и витаминов, в качестве поддерживающей терапии. Мало кто из мужчин знает, к примеру, что всем известный витамин E не только нормализует работу иммунной системы и укрепляет стенки сосудов, но и способствует нормальной работе репродуктивной системы.
Преимущества нашей клиники.
Специалисты Клинике мужского здоровья профессора Чалого имеют успешный 25 летний опыт лечения азооспермии. Мы оказываем помощь мужчинам как при обструктивной азооспермии, так и при секреторной. Помимо высочайшей квалификации врачей и огромного опыта, основным преимуществом лечения именно в нашей является применение авторских методик и уникальных технологий. Все эти факторы позволяют лечить это заболевание максимально быстро, комфортно и эффективно.
Наши врачи применяют как классические методы лечения, так и новейшие уникальные запатентованные методики, а именно:
- трансдермальное введение лекарственных препаратов в зону патологии методом фармафореза;
- стимуляция сперматогенеза факторами роста;
- терапия пептидами;
- системная и локальная антибактериальная терапия;
- коррекция микроэлементарного состава (выведение токсичных и восполнение дефицита жизненно необходимых микроэлементов) выявляемых при озолировании волос и спермы методом масспектрометрии;
- применение стромально-васкулярный фракции;
- в случае необходимости оперативное лечение проводится в МНОЦ МГУ им. М. В. Ломоносова
Наша клиника предоставляет полный спектр услуг по диагностике и лечению азооспермии.
Обратившись к нашим специалистам, Вы можете быть уверены в профессиональном походе и, как следствие, в максимальной вероятности устранения проблемы! Наши врачи являются одними из ведущих в России.
О клинике.
«Клиника мужского здоровья профессора Чалого М.Е.» работает на медицинском рынке более 23 лет. Мы оказываем высококачественные медицинские услуги и решаем любые проблемы, связанные с мужским здоровьем.
Мы гарантируем абсолютную конфиденциальность и индивидуальны подход в лечении каждого мужчины. Мы создали все условия, чтобы пациент чувствовал себя комфортно. Врачи медицинского центра применяют инновационные методики и работают на современном оборудовании, что гарантирует быстрое и эффективное лечение.
Мы не проводим «лишних» исследований!
Мы не назначаем операции без острой необходимости!
Мы применяем исключительно передовые методы лечения с наивысшей результативностью!
ЦЕНЫ
Комплексное обследование
- первичный прием врача,
- УЗИ органов малого таза,
- посев секрета предстательной железы или эякулята,
- микроскопия секрета предстательной железы или эякулята,
- определение общего уровня тестостерона,
- повторная консультация врача
10 000 руб.
Звоните прямо сейчас по телефонам нашей клиники:
+7 (495) 708-38-00
+7 (963) 782-84-98
+7 (965) 264-72-48 (круглосуточно)
Или записывайтесь через форму записи на нашем сайте (кнопка записи на прием)
Записаться на прием
- Review article
- Open Access
- Published: 23 April 2019
Basic and Clinical Andrology
volume 29, Article number: 4 (2019)
Cite this article
-
6471 Accesses
-
30 Citations
-
1 Altmetric
-
Metrics details
Abstract
As with many other diseases, genetic testing in human azoospermia was initially restricted to karyotype analyses (leading to diagnostic chromosome rearrangement tests for Klinefelter and other syndromes). With the advent of molecular biology in the 1980s, genetic screening was broadened to analyses of Y chromosome microdeletions and the gene coding for the cystic fibrosis transmembrane conductance regulator (CFTR). Decades later, the emergence of whole-genome techniques has led to the identification of other genetic defects associated with human azoospermia. Although TEX11 and ADGRG2 defects are frequently described in men with azoospermia, most of the causal gene defects found to date are private (i.e. identified in a small number of consanguineous families).
Here, we provide an up-to-date overview of all the types of genetic defects known to be linked to human azoospermia and try to give clinical practice guidelines according to azoospermia phenotype. Along with homozygous mutations, polymorphisms and epigenetic defects are also briefly discussed. However, as these variations predispose to azoospermia, a specific review will be needed to compile data on all the particular genetic variations reported in the literature.
Résumé
Comme pour beaucoup de maladies humaines, les analyses génétiques en cas d’azoospermie étaient initialement limitées à la réalisation d’un caryotype, conduisant au diagnostic de réarrangements chromosomiques comme pour le syndrome de Klinefelter ou autres syndromes. L’avènement de la biologie moléculaire, dans les années 1980, a permis l’élargissement du dépistage génétique à la recherche des microdélétions du chromosome Y et aux anomalies du gène CFTR (cystic fibrosis transmembrane conductance regulator). Il a fallu attendre plusieurs décennies et l’apparition des techniques d’analyses du génome entier pour que soit réalisée l’identification d’autres anomalies génétiques associés à l’azoospermie humaine. Si les anomalies des gènes TEX11 et ADGRG2 sont fréquemment décrites dans la littérature pour les hommes présentant une azoospermie, la plupart des altérations génétiques découvertes à ce jour sont privées, identifiées dans un petit nombre de familles souvent consanguines.
L’objectif dans cette revue est de fournir un aperçu actualisé de toutes les anomalies génétiques décrites dans la littérature et associées à l’azoospermie humaine tout en essayant de fournir des guides de conduite diagnostique en fonction du phénotype de l’azoospermie. En plus des mutations homozygotes et délétères, les polymorphismes et les défauts épigénétiques sont également brièvement abordés. Néanmoins, comme ces variations ne sont que de potentiels facteurs de prédisposition à l’azoospermie, une étude spécifique sera nécessaire pour compiler l’ensemble des données de la littérature pour chaque variant génétique.
The World Health Organization (WHO) considers infertility (defined as the inability to conceive after 12 months of sexual intercourse without the use of contraceptives) to be a major health concern. Indeed, infertility affects more than 50 million couples worldwide. In about half of these couples, infertility is of male origin [1].
Semen analysis can often reveal congenital or acquired causes of male infertility. These include quantitative and/or qualitative abnormalities in spermatogenesis, which therefore affect the sperm count, sperm mobility and/or sperm morphology. Azoospermia (defined as the total absence of spermatozoa in the ejaculate in two successive semen examinations) accounts for around 10% of cases of male infertility, and affects about 1% of the men in the general population [2,3,4]. This condition can be classified as non-obstructive azoospermia (NOA, associated with spermatogenesis failure), and obstructive azoospermia (OA, characterized by an obstruction in the seminal tract and normal spermatogenesis). Whereas NOA accounts for 60% of azoospermic patients, OA accounts for around 40% [5, 6].
In almost all cases of azoospermia, the combination of sperm extraction with in vitro fertilization (IVF) and intra-cytoplasmic sperm injection (ICSI) gives these patients an opportunity to father children [7]. A variety of sperm extraction modalities and techniques have been developed, depending on the type of azoospermia. In general, sperm retrieval from the testis or epididymis should be prescribed for azoospermic patients [8]. In patients with OA, percutaneous epididymal aspiration, open fine-needle aspiration, or open surgical procedures (such as microsurgical epididymal sperm aspiration (MESA)) [9, 10] are often used for sperm retrieval. Sperm is successfully retrieved in more than 95% of cases.
However, the clinical management of NOA is more challenging; not all patients have sperm in their testes, and seminiferous tubules with complete spermatogenesis are intermixed with tubules without any germinal cells. In men with NOA, the sperm retrieval rate is around 40 to 50%. As is the case for OA, various sperm extraction techniques have been developed for men with NOA. According to the literature, microdissection testicular sperm extraction (microTESE) in several areas of the testis may be associated with higher sperm retrieval rates and lower postoperative complication rates [11,12,13,14,15].
Three histological phenotypes for NOA can be defined on the basis of the TESE (testicular sperm extraction) results: hypospermatogenesis, Sertoli-cell-only syndrome (SCOS), and maturation arrest (MA) [16, 17]. Thus, TESE also provides information on the infertility phenotype and guides the choice of treatments.
Maturation arrest is defined as incomplete spermatogenesis in which germ cells fail to mature. The condition is subcategorized into early MA, with the presence of spermatogonia or spermatocytes only (i.e. pre-meiotic or meiosis-arrested germ cells) and late MA, in which spermatids can be detected (i.e. post-meiotic arrest). In SCOS, germ cells are completely absent in all seminiferous tubules; only Sertoli cells and Leydig cells can be seen in the seminiferous tubules and the interstitial tissue, respectively [18, 19]. Lastly, hypospermatogenesis is characterized by the presence of all types of germ cell (from spermatogonia to spermatozoa), albeit in small numbers [20]. The degree of this histological phenotype can vary from mild to severe. Although a purely testicular histological phenotype can be found, the mixed pattern, is most frequent observed in azoospermic patients [16].
The many etiologies underlying azoospermia fall into pretesticular, testicular and post-testicular categories (see for review [21, 22]). Pretesticular (central) causes of azoospermia are endocrine abnormalities, and include hypogonadotropic hypogonadism, hyperprolactinemia, and androgen resistance. In contrast, testicular etiologies are characterized by disorders of spermatogenesis inside the testes, such as varicocele-induced testicular damage, undescended testes, testicular torsion, mumps orchitis, gonadotoxic effects of medications, genetic abnormalities, and idiopathic causes. Most cases of NOA have a pretesticular or testicular cause. Lastly, post-testicular etiologies (due to ejaculatory dysfunction or genital tract outflow obstruction) are the major contributors to OA [23, 24]. In the present review, we will not discuss pretesticular etiologies because they correspond to central nervous system defects and not to genital tract disease. Indeed, de novo or familial chromosomal or gene abnormalities constitute well-established genetic causes of azoospermia.
Genetic testing in human azoospermia was initially restricted to karyotype analyses [25,26,27]. With technical progress, genetic screening has been broadened to the analysis of the gene coding for cystic fibrosis transmembrane conductance regulator (CFTR) in patients with OA [28, 29] and Y chromosome microdeletions in patients with NOA [30,31,32,33]. Over the last 5 years, emergence of whole-genome techniques has led to the identification of many other supposedly causal genetic defects – raising the question of which genetic testing techniques should be used to evaluate human azoospermia. Here, we provide an up-to-date overview of all the types of genetic defects known to be linked to human azoospermia, including (i) chromosome abnormalities, (ii) causative gene mutations in OA, (iii) causative gene mutations in NOA, (iv) polymorphisms and (v) epigenetic alterations (Table 1). The last two types of defect are described in less detail.
Full size table
Chromosome abnormalities
Klinefelter syndrome (KS)
This syndrome was the first chromosomal abnormality to be linked to male infertility. It was first described in 1942 [34], and is the most common genetic etiology of human male infertility. The syndrome is caused by a 47,XXY karyotype [35]. The prevalence of KS is close to 2 per 1000 male births [36, 37]. Eighty percent of cases of KS have a nonmosaic 47,XXY karyotype, whereas the remaining 20% variously show higher-grade chromosome aneuploidies, a 46,XY/47,XXY mosaic, or a structurally abnormal chromosome X [38]. Mosaic KS patients are usually less severely affected than nonmosaic patients are, and few cases of spontaneous paternity have been reported [39, 40]. This situation is not specific to humans; a XXY karyotype is always associated with infertility in various domestic animals (mice, cats, dogs, pigs, cows, horses, etc.) [41,42,43].
The presence of two X chromosomes in a male leads to impaired spermatogenesis and the failure of meiosis because gametogenesis is only possible for 46, XY cells — explaining the presence of gametes in mosaic patients (see for review [44]). Although very few functional tubules may be present in men, focal spermatogenesis enabled the recovery of spermatozoa (using TESE) in almost 50% of cases in a study of 1248 patients; however, none of the tested parameters (including age, testis volume, and levels of FSH, LH and testosterone (T)) had predictive value [45].
In KS, degeneration of the seminiferous tubules starts well before puberty [46] and progresses throughout infancy [47]. A dramatic increase in degeneration frequently occurs at puberty, and often leads to the complete hyalinization of the seminiferous tubules in adulthood [48]. It was initially recommended to cryopreserve testicular tissue as soon as possible in those cases. However, it is now generally acknowledged that TESE in young boys with KS is questionable; germ cells loss probably occurs very early [49], and so may explain the poor results seen for adolescent testicular tissue banking [50].
47,XYY syndrome
This syndrome was first described in 1961 [51], and is associated with a predisposition to infertility ranging from a normal sperm count to azoospermia [52, 53] . In fact, the supernumerary Y chromosome is probably lost in the early stages of spermatogenesis in the great majority of XYY males [54,55,56], thus enabling normal spermatogenesis. However, the supernumerary Y chromosome persists in some XYY males, which results in asynapsed sex chromosomes at the pachytene stage [57, 58]. In this situation, only a trivalent configuration could achieve meiosis [59].
46,XX males
In more than 80% of cases, a 46,X,der(X)t(X;Y)(p22.3;p11.2) karyotype results from an unbalanced de novo X-Y translocation and then the translocation of SRY (sex-determining region of Y chromosome) to the X chromosome. In the remaining 20% of cases, the genetic defect concerns the human sex determination pathway. 46, XX patients often exhibit SCOS [60, 61]. A defect in the SOX9 pathway is most frequently described, with duplication, triplication or balanced chromosomal translocation that overlaps with the so-called RevSex dosage sensitive critical region on chromosome 17q24 [62]. Other defects (like SOX3 duplication [63] and RSPO1 point mutation [64]) are rare but are frequently associated with a syndromic clinical presentation.
Chromosome rearrangements
By comparing infertile men with newborn children, it was found that patients with impaired spermatogenesis have a greater number of chromosome abnormalities and/or rearrangements [65, 66]. Depending on the population studied, the proportion of affected individuals ranged from 2 to 20% [67,68,69], and the frequency of infertility increased with the severity of the impairment in spermatogenesis. Furthermore, it appears that gonosome abnormalities (aneuploidy or balanced translocation) most often result in azoospermia, whereas balanced abnormalities in autosomes tend to result in oligozoospermia.
Chromosome rearrangement appears to impact spermatogenesis through meiotic arrest. Several putative explanations for this association have been suggested. The first hypothesis is based on evidence of an interaction between the human quadrivalent chromosome (the association between the chromosomes involved in the translocation, at the pachytene stage), the acrocentric chromosomes, and the XY body — all of which are located near to the nucleolus [70,71,72]. This leads to an impairment in meiotic sex chromosome inactivation. The second hypothesis relates to the silencing of crucial genes in segments close to the chromosome breakpoints (due to the frequent non-pairing of these autosomal segments) and thus asynapsis. This hypothesis has been confirmed in studies of male mice [73] and boars [74] bearing a translocation.
Y chromosome microdeletions
Frequent observations of Y chromosome rearrangements and large deletions in azoospermic males have suggested that a particular region is required for meiosis (e.g. 46,X,i(Y)(p11); 46,X,r(Y)). Experiments with specific probes have identified various interstitial deletions [75, 76], and have enabled the definition of three regions: AZFa, AZFb, and AZFc (azoospermia factor a, b and c) [77]. The prevalence ranges from 3 to 28%, depending on the type of impairment in spermatogenesis [78]. Although the AZFc phenotype is highly variable, full deletion of AZFa and AZFb always leads to azoospermia (SCOS, and pachytene MA, respectively) [79]. The complete deletion of AZFa and/or AZFb are currently the sole genetic abnormalities that contraindicate TESE.
Clinical practice: karyotyping and Y chromosome microdeletion screening are recommended by the latest international guidelines. This approach leads to a diagnosis in more than 15% of cases. Furthermore, a full AZFa and/or AZFb microdeletion diagnosis contraindicates a testicular biopsy.
Causative gene mutations in OA
Some genetic diseases and abnormalities result in OA; they include cystic fibrosis, congenital bilateral absence of the vas deferens (CBAVD), congenital unilateral absence of the vas deferens, congenital bilateral epididymal obstruction and normal vasa, and Young syndrome. According to the literature, some gene mutations are associated with OA. We shall first describe CFTR mutations, and then mutations that have been described in the literature (starting with ADGRG2 mutations).
CFTR
This gene encodes a protein with an essential role in the sodium/chloride balance in cAMP-regulated epithelial secretions. Defects in the CFTR gene lead to the production of sweat with an abnormally high salt content and mucus secretions with an abnormally high viscosity. Complete loss of CFTR protein function leads to the autosomal recessive disease cystic fibrosis (CF) [80, 81]. The most common features of CF are respiratory symptoms, digestive problems, poor growth, short stature, and male sterility (due to CBAVD). The poor prognosis is due to bronchopulmonary involvement. To date, more than 2000 causal mutations are listed in public databases (https://www.re3data.org/repository/r3d100012093; [82]. These mutations are divided into different classes, depending on their effects on the protein and the disease mechanism [83,84,85]. Cystic fibrosis is the most common life-limiting genetic disorder in Caucasian populations. Several different explanations for the high frequency of heterozygotes in Caucasian populations have been suggested. Although greater fertility was initially hypothesized, it appears that heterozygosity for CFTR mutations confers greater resistance to typhoid fever [86], the effects of cholera toxin, and other diarrheal disorders [87]. Other hypotheses include (i) the development of cattle pastoralism, based on similarities in the distributions of lactase persistence and the most common CF mutation (Delta F508) [88], and (ii) possible respiratory advantages during the dusty climate of the last ice age [89].
Cystic fibrosis is caused by the presence of severe mutations (such as ∆F508, the most frequent CFTR mutation in Caucasian population) in both copies of the CFTR gene. This 3 bp deletion leads to the failure of CFTR protein to migrate to the plasma membrane [90]. Nevertheless, combinations of severe/mild mutations and mild/mild mutations lead to CFTR dysfunction that does not meet the diagnostic criteria for CF. These CFTR-related mutations are linked to a “minimal” phenotype that features CBAVD, chronic or recurrent acute pancreatitis, and disseminated bronchiectasis [91].
The incidence of CBAVD is as high as 6% in men with OA [92, 93]. The production of thick mucus in the genital tract associated with the CFTR mutations leads to vas deferens deterioration. Almost 80% of patients with CBAVD carry a CFTR mutation [94], and other etiologies might account for the phenotype in the remaining 20% of cases. Recently, a few genes have been linked to CBAVD as listed below.
Many studies have found a connection between CFTR mutations and impaired spermatogenesis [95]. A body of clinical evidence has highlighted an elevated mutation frequency and/or abnormally low expression of the CFTR gene in men with sperm abnormalities. The CFTR protein seems to be involved in spermatogenesis in rodent Sertoli cells and germ cells, and low CFTR protein expression has been observed in men with NOA [96]. Furthermore, CFTR has a critical role in sperm capacitation by directly or indirectly mediating HCO3− entry, which is essential for this process [97].
ADGRG2
In patients lacking CFTR mutations, hemizygous protein-truncating mutations in the X-linked gene coding for adhesion G-protein-coupled receptor G2 (ADGRG2) were first described in a study of 26 azoospermic men [98], and then in a replication study of an unrelated population of 18 men [98, 99]. ADGRG2 (located in Xp22.3) is expressed in the efferent ducts and epididymis [100]. Moreover, ADGRG2 regulates fluid reabsorption in the efferent ducts through the ADGRG2-Gq/β-arrestin-1/CFTR signaling complex [101,102,103]. All patients with ADGRG2 mutations (Fig. 1) displayed CBAVD only, and no other symptoms of CF (as with certain mild CFTR variants) — indicating a possible similar involvement of both genes in the development of CBAVD [98, 99] In a recent study, an additive nonsense ADGRG2 mutation was described in two brothers with OA from a Pakistani family [104], confirming the involvement of ADGRG2 mutations in OA.
Schematic depiction of the structure of the ADGRG2 protein. Truncating mutations reported in OA patients are indicated. Yellow rectangles represent the seven transmembrane helices. ADGRG2 is also composed of a G-protein-coupled receptor (GPCR) autoproteolysis-inducing (GAIN) domain containing a cysteine-rich GPCR proteolysis site (GPS), and an extracellular STP region (in grey)
Full size image
SLC9A3
The gene coding for solute carrier family 9 member A3 has also been described as pathogenic in patients with CBAVD. This protein is a Na+/H+ exchanger expressed on the apical membranes of cells in many structures (including the epididymis, vas deferens, and the non-ciliated cells of the efferent duct) [105, 106]. In the male reproductive tract, SLC9A3 is involved in fluid absorption and acidification [107]. It has been reported that loss of SLC9A3 decreases the expression of CFTR protein and causes OA in mice [108]. These findings suggest that SLC9A3 deletion has an impact in patients with CBAVD [109]. Further studies of the SLC9A3 gene’s involvement in CBAVD are required.
PANK2
In a study of gene copy number variations in Asian patients with CBAVD [110], Lee et al. observed the homozygous loss of the PANK2 gene encoding pantothenate kinase 2. This enzyme is the first in the co-enzyme A (CoA) biosynthetic pathway, and catalyzes the ATP (adenosine triphosphate)-dependent phosphorylation of pantothenate. Homozygous male mutants were infertile due to azoospermia [111] but also displayed retinal degeneration with progressive photoreceptor decline. The putative association between CBAVD and PANK2 has not been confirmed to date.
Clinical practice: given that almost 80% of patients with CBAVD carry a CFTR mutation [94], the latter gene should be fully sequenced. If a CFTR mutation is diagnosed, the patient’s spouse should also be tested (given the likelihood of CF in the offspring). If a CFTR mutation is not revealed by full sequencing, the patient could be screened for a possible defect in ADGRG2 – even though this diagnosis would not modify clinical practice.
Causative gene mutations in NOA
The above-listed chromosome defects are observed in 15% of cases of azoospermia. Hence, one can reasonably hypothesize that most of the genetic causes of male infertility have yet to be characterized — probably because of the large number of genes involved [112]. Given that no more than 20% of men with NOA have chromosomal abnormalities, other spermatogenesis-related gene mutations are probably located elsewhere on the genome. To date, gene mutations have been discovered through studies of inbred families, which have confirmed the great genetic heterogeneity of this pathology. Furthermore, many azoospermic murine models have been described in the literature. A large number of possibly causal single-gene mutations have been reported for patients with the testicular phenotype of NOA (Table 1). Below, we briefly profile a number of candidate genes as a function of the testicular phenotype. We first describe mutations in TEX11 (the gene most frequently cited in the literature) and then list other genes in alphabetical order.
TEX11
This gene (coding for testis expressed 11) on Xq13.1 appears to be the prime gene of interest in NOA. Initially, a 90 kb deletion (encompassing exons 9, 10, and 11) in one isoform of TEX11 was identified (using a chromosome micro-array) in two azoospermic patients with homogeneous or mixed meiotic arrest [113]. This deletion resulted in the loss of 79 amino acids from the TEX11 protein’s meiosis-specific sporulation (Spo22) domain. Additional TEX11 mutations (missense and splice mutations) were found in 2.4% of the azoospermic patients. In line with the phenotype of male Tex11−/− mice, a histological analysis evidenced meiotic arrest and low levels of TEX11 protein expression in patients bearing these mutations. The TEX11 mutations reported to date (Fig. 2) are strongly associated with the occurrence of NOA due to testicular meiotic arrest [114]. In fact, TEX11 gene abnormalities are the sole defects recurrently described in the literature and in sporadic patients. The genes described below have been linked to azoospermia in consanguineous families.
Schematic diagram of the location of TEX11 variants in isoform 2, as detected in patients with azoospermia. Brackets indicate the TEX11 protein’s interaction domains (the SPO22 sporulation domain and the TPR tetratricopeptide repeat-containing domain), according to the TEX11–203 transcript in the Ensembl database (https://www.ensembl.org/index.html). Orange boxes represent exons, and black lines represent introns. Missense mutations are shown in red, with splice site mutations in blue, silent mutations in green, frameshift mutations in grey, intronic mutations in pink, and deletions in purple
Full size image
DMC1
DMC1 is essential for meiotic recombination in various organisms. Whole-exome sequencing of DNA (deoxyribonucleic acid) samples from two members of a consanguineous Chinese family (a man with NOA and a woman with premature ovarian insufficiency) enabled the identification of a homozygous missense mutation in the DMC1 gene [115]. A detailed analysis evidenced MA at the zygotene stage in the seminiferous tubules of the patient with NOA.
DNAH6
A rare, nonsynonymous mutation in the dynein axonemal heavy chain 6 (DNAH6) gene has been reported in azoospermic brothers from a consanguineous family [116]. DNAH6 protein is strongly expressed in testis, and DNAH6 is important for meiosis [117] and ciliary beating. Mutations in DNAH6 have also been linked to primary ciliary dyskinesia and sperm head anomaly [118], as well as to NOA.
MAGEB4
The analysis of a consanguineous Turkish family led to the identification of a novel nonstop mutation in the X-linked gene MAGEB4 (coding for melanoma antigen family B4) that segregated with an azoospermic and oligozoospermic phenotype [119]. In the testis, MAGEB4 is specifically expressed during germ cell differentiation [120].
MCM8
[121] reported a homozygous mutation in the MCM8 gene (coding for minichromosome maintenance complex component 8 and located on chromosome 20p12.3) in a consanguineous family in which a male with a 22q11.2 microdeletion presented azoospermia and a female had primary amenorrhea. Both individuals presented mild mental retardation. The complex formed by the MCM8 and MCM9 proteins has a key role in homologous-recombination (HR)-mediated DNA repair [122,123,124]. MCM8−/− mice display infertility, a blockage in meiotic HR-mediated double-strand break (DSB) repair, and the absence of post-meiotic cells — confirming the importance of this gene in the meiotic stage of spermatogenesis [124].
MEIOB
A homozygote non-synonymous mutation in the MEIOB gene has been identified in members of one family [116]. One of the brothers showed a meiotic arrest, as observed in Meiob knock-out mice [125, 126]. The mutation occurred in the MEIOB protein’s replication protein A1 DNA binding domain, and might have altered the meiotic recombination process. These studies highlight MEIOB’s role in meiosis (DSB repair and complete synapsis) and fertility in both humans and mice.
MEI1
A homozygous missense mutation in the MEI1 gene (coding for meiotic double-stranded break formation protein 1) has been described in two azoospermic brothers from a consanguineous family [127]. Meiotic arrest at the pachytene stage was confirmed in one brother. The mutation affecting the MEI1 gene was found to co-segregate with the family’s NOA phenotype, and was heterozygous or absent in the other (fertile) family members. Meiotic double-stranded break formation protein 1 is overexpressed in testis, and is necessary for pairing of meiotic chromosomes. It may also be involved in the formation of meiotic DSBs in gonocytes. Mutant mice were infertile, due to meiotic arrest [128]. Consequently, defects in this gene are thought to disrupt the meiotic process. It has been reported that polymorphic alleles of the human MEI1 are associated with human azoospermia caused by meiotic arrest [129].
NPAS2
Using whole-exome sequencing, [130] identified a damaging non-synonymous mutation in NPAS2 in three brothers with NOA from a consanguineous family. NPAS2 (expressed in testis and cerebral cortex) encodes a member of the basic helix-loop-helix/PAS family of transcription factors, with functions in circadian rhythms and fertility.
PSMC3IP
PSMC3 interacting protein has several functions, including the co-activation of ligand-dependent transcription mediated by nuclear hormone receptors, and the activation of DMC1 and RAD51 during meiotic recombination [131]. Recently, Al-Agha et al. identified a homozygous stop gain mutation in exon 6 of the PSMC3IP gene in an azoospermic man from a consanguineous family. This mutation was also present in his four sisters – all of whom suffered from primary ovarian insufficiency [132]. PSMC3IP is strongly expressed in testis of humans and mice. Null-mutant mice exhibit meiotic arrest at the spermatocyte I stage, and the failure of synaptonemal complex formation.
SPINK2
SPINK2 is an acrosomal protein that targets acrosin in sperm and has an essential role in spermiogenesis. It is located in the acrosomal vesicle in round spermatids, and persists in mature spermatozoa. Researchers identified a homozygous splice mutation in the SPINK2 gene in two brothers from a consanguineous family [133]. One of the two brothers had a low round spermatid count in a testicular biopsy. Studies of knock-out mice also confirmed the involvement of SPINK2 in NOA, with spermiogenesis arrest at the round spermatid stage. This arrest was due to Golgi fragmentation and the failure of acrosome biogenesis in the absence of SPINK2 protein.
STX2
Nakamura et al. identified a homozygous frameshift mutation in the syntaxin-2 (STX2) gene [134] in just one member of a population of 131 Japanese men with NOA. Histological analysis of the patient’s testis revealed MA and multinucleated spermatocytes. Furthermore, this gene is located within the 58.4 Mb genomic region with loss of heterozygosity, suggesting that the parents were consanguineous. In view of the phenotype seen in mice [135], it has been suggested that NOA may be caused by STX2 mutations in a small proportion of patients.
SYCE1
A pathogenic splice site mutation in the SYCE1 gene (coding for synaptonemal complex central element 1) was identified in two azoospermic brothers with complete meiotic arrest from a consanguineous family [136]. This mutation disrupted the acceptor site of intron 3, and as a result, no SYCE1 protein could be detected in the patient’s seminiferous tubules. SYCE1 is one of the four components of the synaptonemal complex required for chromosome pairing. Its absence leads to the disruption of synapsis in mice [137].
TAF4B
A homozygous mutation in the TAF4B gene (coding for TATA box-binding protein-associated factor 4B) resulted in NOA in two unrelated consanguineous families [138]. In the first family, the three affected brothers were homozygous for the same nonsense mutation in TAF4B; the resulting truncated protein lacked the histone fold domain (which is important for the DNA-binding activity of TAFs) and the TAF12 interaction domain). This gene is a transcriptional regulator enriched in human and mouse testis. However, TAF4B variants were not associated with NOA in a recent study of a Han population in north-east China [139]. Null mutant mice become infertile by the age of 3 months, with an absence of germ cells in the seminiferous tubules and an impairment in spermatogonial stem cell proliferation [140].
TDRD7
A recent study of a consanguineous Chinese family reported two novel homozygous loss-of-function mutations in the TDRD7 gene in individuals with congenital cataract and NOA [141]. One of the patients displayed a post-meiotic arrest in spermatogenesis, with the absence of mature spermatozoa in the seminiferous tubules. However, a TDRD7 mutation is not a common cause for NOA because variants were not found in cohorts of patients with NOA alone or with congenital cataract alone. The researchers then confirmed the mutations’ impact in a mouse model, where the phenotype was similar to that seen in the two patients. TDRD7 encodes a Tudor family protein required for the remodeling of dynamic ribonucleoprotein particles in chromatid bodies during spermatogenesis [142]. Furthermore, the encode protein repressed LINE1 retrotransposons in the male germline — highlighting its importance in spermatogenesis and male fertility.
TDRD9
The Tudor-domain containing 9 protein (TDRD9) is a member of the DEAD-box helicase family. It represses transposable elements and prevents their mobility via the piwi-interacting RNA (piRNA) metabolic process [143]. A 4 bp deletion frameshift mutation in TDRD9 has been identified in five infertile azoospermic men from a large consanguineous family; the mutation led to the loss of all the known functional domains [144]. Tdrd9−/− male mice were sterile, with activation of retrotransposon line-1 and chromosomal synapsis failure [143].
TEX14
TEX14 is considered to be a novel causative gene for NOA because its expression is abnormally low in men with NOA [145]. TEX14 protein is exclusively expressed in testis, especially during meiosis [146]. TEX14 has a major role in spermatogenesis, where it is thought to be required for the formation of intercellular bridges in germ cells during meiosis [147]. A recent study of two azoospermic brothers from a consanguineous family revealed a 10 bp frameshift deletion, which resulted in an early stop codon [116]. Azoospermia or infertility has also been observed in pigs [148] and mice with Tex14 mutations [147].
TEX15
In studies of two different families, mutations in the TEX15 gene (required for meiotic recombination in spermatocytes) segregated with the NOA phenotype [149, 150]. In the first study, two brothers with NOA had a compound-heterozygote nonsense mutation. In the second, a homozygous nonsense mutation was identified in three Turkish brothers with azoospermia. Observations in a mouse model confirmed the patients’ infertility phenotype, since loss of the Tex15 gene disrupted the DSB repair process and induced sterility (in males only) with meiotic arrest in the testis [151]. Two association studies of TEX15 single-nucleotide polymorphisms (SNPs) gave contradictory results; a link to spermatogenetic failure was observed in one study [152] but not the other [153].
XRCC2
Recently, Yang et al. identified a point mutation in the XRCC2 gene (coding for X-ray repair cross-complementing protein 2 homolog, a RAD51 paralog) in two brothers with meiotic arrest and azoospermia from a consanguineous family [154]. The XRCC2 gene’s product is involved in HR (homologous-recombination)-mediated DSB repair. Recreation of this mutation in mice using Crispr-Cas9 (clustered regularly interspaced short palindromic repeats associated proteins 9) technology also induced meiotic arrest and infertility, and thus confirmed its involvement in the patients’ phenotype. Another study identified a mutation in XRCC2 that causes NOA and premature ovarian insufficiency [155]. One can therefore conclude that XRCC2 is an essential for the progression of meiosis, and that a mutation in this gene could cause infertility in humans. Polymorphisms in XRCC2 homologs 1, 5, 6 and 7 have been linked to male infertility [156,157,158].
ZMYND15
In three azoospermic brothers with MA at the spermatid stage, a homozygous mutation in the gene coding for ZMYND15 (zinc finger MYND-containing protein 15) led to amputation of the proline-rich domain (essential for cytoskeleton binding and signal transduction) [138]. ZMYND15 is involved in spermiogenesis and acts as a histone deacetylase-dependent transcriptional repressor. When ZMYND15 was inactivated, male mice displayed infertility and a low late spermatid count [159].
Clinical practice: with the exception of TEX11 defects (recurrent but rare in NOA), the other mutations seems to be private. So, whole-exome sequencing might be of diagnostic value, given that most gene defects are associated with meiotic arrest and thus rule out the retrieval of any spermatozoa. A number of points must to be considered: (i) the need for pedigree studies to identify consanguineous patients, (ii) the practical difficulty of analyzing genomic DNA samples, (iii) the time and cost of whole-exome sequencing, (iv) the absence of specific therapies, (v) the patient’s gratitude upon receipt of an etiologic diagnosis for his infertility. At present, whole-exome sequencing appears to have been restricted to clinical research. Hence, only TEX11 screening should be considered because defects are associated with meiotic arrest. However, the development of genetic analysis software and emergence of new genetic therapies (e.g. induced pluripotent stem cells [160]) might modify the diagnosis of NOA.
Polymorphisms and related variations associated with azoospermia
Gene-targeted sequencing and candidate gene approaches have enabled the identification of a large number of SNPs and heterozygous mutations linked to azoospermia or which might predispose to impairments of spermatogenesis. Most of these studies were carried out on a small numbers of azoospermic patients and controls. We searched the PubMed database with the following keywords: (((((azoospermia[MeSH Major Topic]) or azoospermia[Title/Abstract]) AND (polymorphism[Title/Abstract] OR polymorphisms[Title/Abstract]))) NOT review[Publication Type]) NOT meta-analysis[Title]) AND English[Language], and then (((((azoospermia[MeSH Major Topic]) or azoospermia[Title/Abstract]) AND (mutation[Title/Abstract] OR mutation[Title/Abstract]))) NOT review[Publication Type]) NOT meta-analysis[Title]) AND English[Language]. The search yielded a list of more than 600 publications. After selecting only publications dealing with polymorphisms, SNP or heterozygote mutations, we found that 182 genes have been highlighted in azoospermic or oligo/azoospermic populations. The most frequently studied gene was MTHFR, in 19 different publications. Few genome-wide association studies have been performed in this field; a few loci have been identified but their association with male infertility has yet to be confirmed. We did not find any clear methodological proposals in the literature on how to use SNPs associated with spermatogenesis failure.
Clinical practice: screening polymorphism does not currently appear to be of great value because a diagnosis wouldn’t influence the patient’s treatment. Only MTHFR screening could be considered [161], despite the present lack of a randomized, placebo-controlled study.
Epigenetic alterations in azoospermia
Along with genetic defects, epigenetic alterations (i.e. heritable alterations in gene function that do not affect the basic DNA sequence [162]) are now being increasing studied in the field of human infertility [163,164,165,166]. Epigenetics has an essential role during sperm production, sperm function, and fertilization. Sperm cells are epigenetically programmed through histone-protamine replacement, DNA methylation (> 80%), chromatin remodeling, genomic imprinting, and the involvement of small non-coding RNAs (piRNAs [167] and microRNAs (miRNA) [168, 169]). Hence, many studies have evidenced epigenetic changes in cases of azoospermia.
It was recently shown that mRNA and protein expression levels of the KDM3A gene (coding for lysine demethylase 3A) were abnormally low in testicular biopsies from patients with meiotic arrest at the round spermatid level or with SCOS, relative to samples from patients with OA [170]. Lysine demethylase 3A is a histone demethylase that is dynamically expressed in male germ cells. It regulates the expression of genes required for the packaging and condensation of sperm chromatin, such as PRM1 and TNP1 [166, 167, 171,172,173]. Furthermore, elevated histone H4 acetylation (essential for spermiogenesis) was observed in the nuclei of Sertoli cells in testicular biopsies from patients with SCOS, relative to controls [174]. Earlier, Sonnack et al. had observed low levels of H4 acetylation in the spermatids of patients with azoospermia; this contrasted with the hyperacetylation of this histone seen in spermatids from fertile patients [175].
In 2009, the methylation status of the promoter region of the MTHFR gene (coding for a regulatory enzyme involved in re-methylation reactions, DNA synthesis and the process of folate metabolism) was performed in patients with NOA and OA [176]. Relative to fertile controls, MTHFR was hypermethylated in DNA obtained from testicular biopsies (but not from peripheral blood) in men with NOA. It has been suggested that aberrant methylation of the MTHFR promoter reduces the expression and enzymatic activity of the encoded protein, leading to the development of azoospermia in these patients.
Genome-wide DNA methylation was subsequently assessed in testicular tissues from 94 azoospermic patients with OA or NOA and either positive or negative TESEs. The OA and NOA differed significantly with regard to the DNA methylation profile at over 9000 CpG sites. Accordingly, patients could be classified as having OA or NOA by considering the 212 CpG sites with the greatest methylation differences [177]. Fourteen of these 212 CpG sites were located in genes with a specific testicular function — suggesting the presence of epigenetic differences between types of azoospermia.
The association between DNA methylation and azoospermia has been extensively explored [178, 179]. For example, more than 30% of gene promoters differed in their DNA methylation status in men with NOA vs. fertile controls [180]. In particular, a hypermethylated DDR1 gene (coding for discoidin domain receptor 1, a subfamily of receptor tyrosine kinases expressed in human postmeiotic germ cells) displayed an abnormal expression profile; it was overexpressed in 25% of the patients and underexpressed in 16%. The protein was not found in the testis of patients with SCOS.
Most recently, Li et al. have sought to identify methylation-regulated genes involved in NOA [181]. In a microarray analysis, a hypermethylated, down-regulated gene coding for zinc-finger CCHC-type containing 13 (ZCCHC13) was found to have low protein expression in NOA testis. The ZCCHC13 protein upregulates the AKT/MAPK/c-MYC signaling pathway. Hypermethylation of ZCCHC13 might induce c-MYC lower expression and therefore act on cell differentiation and proliferation by altering the expression of c-MYC’s target genes.
Similarly, a study of the methylation status of the paternally imprinted H19 gene and the maternally imprinted MEST gene in spermatogenic cells from azoospermic patients with either complete or incomplete MA revealed the presence of imprinting errors [182]. Low levels of H19 gene methylation were observed in primary spermatocytes and elongated spermatids, and MEST methylation errors were found in spermatocytes [182]. These results are in line with previous reports of gene imprinting errors in azoospermia [183].
These epigenetic alterations might be valuable biomarkers for male infertility in general and idiopathic azoospermia in particular. For example, it has been suggested that miRNAs (essential for spermatogenesis and possibly involved in the regulation of gene expression) are diagnosis biomarkers for azoospermia. Indeed, miRNA expression was altered in patients, relative to controls [179,180,181,182, 184,185,188]. A recent comparison of men with OA and men with NOA evidenced differences in miRNA expression in spermatogonia, spermatocytes and round spermatids, and thus suggested the presence of epigenetic dysregulation in NOA [189]. A comparison of subgroups of NOA patients with a positive vs. negative TESE gave similar results [190].
Clinical practice: in summary, it is clear that dynamic epigenetic processes are essential for normal spermatogenesis, and are being increasingly investigated in men with NOA. This research may open up perspectives for diagnosis and treatment.
Conclusion
After the description of the Klinefelter syndrome karyotype (in 1959) and various chromosome rearrangements, it was several decades before the emergence of new genomic techniques initiated a new age for molecular studies of the etiology, mechanism, and diagnosis of azoospermia. Therapeutic approaches may even emerge in the near future. Genetic causes of azoospermia are not limited to gene alterations alone; epigenetic variations, SNPs and other polymorphisms have an impact on spermatogenesis.
Experiments in animal models will probably be needed to characterize all the pathways involved in spermatogenesis and (from a therapeutic perspective) circumvent defects in this process. New technologies (such as Crispr-Cas9) may make it possible to perform genome editing in animal models and thus confirm the causes of spermatogenesis failure.
Ideally, genetic studies of azoospermia should include a large number of patients with a defined phenotype, and a control group matched for ethnicity. Nevertheless, studies of consanguineous families may also generate new strategies that could be extended to all types of azoospermia.
Lastly, the following question arises; does it really make sense to restrict the genetic evaluation of azoospermia to karyotyping, CFTR testing and screening for chromosome Y microdeletions?
General guidelines:
Genetic screening in NOA: patients should be karyotyped and screened for Y chromosome microdeletions; these analyses lead to a diagnosis in more than 15% of cases, and contraindicate a testicular biopsy when a full AZFa and/or AZFb microdeletion is present. Depending on the geneticist’s experience, whole-exome sequencing could also be performed (together with a family segregation study). It should be borne in mind that guidelines on new gene defects are lacking, and that (with the exception of TEX11 defects) most gene defects are private.
Genetic screening in OA: with a view to avoiding CF in the offspring, patients with CBAVD should undergo whole gene sequencing. If mutations are detected, the patient’s spouse should also undergone this sequencing. Although screening might detect defects in ADGRG2, this observation would not change clinical practice.
Abbreviations
- ATP:
-
Adenosine triphosphate
- AZF:
-
Azoospermia factor
- CBAVD:
-
Congenital bilateral absence of the vas deferens
- CF:
-
Cystic fibrosis
- Crispr-Cas9:
-
Clustered regularly interspaced short palindromic repeats associated proteins 9
- DNA:
-
Deoxyribonucleic acid
- DSB:
-
Double-strand break
- HR:
-
Homologous-recombination
- ICSI:
-
Intra-cytoplasmic sperm injection
- IVF:
-
In vitro fertilization
- KS:
-
Klinefelter syndrome
- MA:
-
Maturation arrest
- MESA:
-
Microsurgical epididymal sperm aspiration
- micro-TESE:
-
Microdissection testicular sperm extraction
- miRNA:
-
Micro RNA
- NOA:
-
Non-obstructive azoospermia
- OA:
-
Obstructive azoospermia
- piRNA:
-
Piwi-interacting RNA
- SCOS:
-
Sertoli-cell-only syndrome
- SNP:
-
Single-nucleotide polymorphism
- TESE:
-
Testicular sperm extraction
- WHO:
-
World Health Organization
References
-
Agarwal A, Mulgund A, Hamada A, Chyatte MR. A unique view on male infertility around the globe. Reprod Biol Endocrinol RBE. 2015;13:37. https://doi.org/10.1186/s12958-015-0032-1.
Article
Google Scholar
-
Jarow JP, Espeland MA, Lipshultz LI. Evaluation of the azoospermic patient. J Urol. 1989;142:62–5. https://doi.org/10.1016/S0022-5347(17)38662-7.
Article
CAS
PubMedGoogle Scholar
-
Foresta C, Ferlin A, Bettella A, Rossato M, Varotto A. Diagnostic and clinical features in azoospermia. Clin Endocrinol. 1995;43:537–43.
Article
CASGoogle Scholar
-
Willott GM. Frequency of azoospermia. Forensic Sci Int. 1982;20:9–10.
Article
CASGoogle Scholar
-
Thonneau P, Marchand S, Tallec A, Ferial ML, Ducot B, Lansac J, et al. Incidence and main causes of infertility in a resident population (1,850,000) of three French regions (1988-1989). Hum Reprod Oxf Engl. 1991;6:811–6.
Article
CASGoogle Scholar
-
Matsumiya K, Namiki M, Takahara S, Kondoh N, Takada S, Kiyohara H, et al. Clinical study of azoospermia. Int J Androl. 1994;17:140–2. https://doi.org/10.1111/j.1365-2605.1994.tb01233.x.
Article
CAS
PubMedGoogle Scholar
-
Donoso P, Tournaye H, Devroey P. Which is the best sperm retrieval technique for non-obstructive azoospermia? A systematic review. Hum Reprod Update. 2007;13:539–49. https://doi.org/10.1093/humupd/dmm029.
Article
CAS
PubMedGoogle Scholar
-
Esteves SC, Miyaoka R, Agarwal A. Surgical treatment of male infertility in the era of intracytoplasmic sperm injection – new insights. Clinics. 2011;66:1463–77. https://doi.org/10.1590/S1807-59322011000800026.
Article
PubMed
PubMed CentralGoogle Scholar
-
Kovac JR, Lehmann KJ, Fischer MA. A single-center study examining the outcomes of percutaneous epididymal sperm aspiration in the treatment of obstructive azoospermia. Urol Ann. 2014;6:41–5. https://doi.org/10.4103/0974-7796.127026.
Article
PubMed
PubMed CentralGoogle Scholar
-
Esteves SC, Miyaoka R, Orosz JE, Agarwal A. An update on sperm retrieval techniques for azoospermic males. Clinics. 2013;68:99–110. https://doi.org/10.6061/clinics/2013(Sup01)11.
Article
PubMed
PubMed CentralGoogle Scholar
-
Schlegel PN. Testicular sperm extraction: microdissection improves sperm yield with minimal tissue excision. Hum Reprod Oxf Engl. 1999;14:131–5.
Article
CASGoogle Scholar
-
Amer M, Ateyah A, Hany R, Zohdy W. Prospective comparative study between microsurgical and conventional testicular sperm extraction in non-obstructive azoospermia: follow-up by serial ultrasound examinations. Hum Reprod Oxf Engl. 2000;15:653–6.
Article
CASGoogle Scholar
-
Okada H, Dobashi M, Yamazaki T, Hara I, Fujisawa M, Arakawa S, et al. Conventional versus microdissection testicular sperm extraction for nonobstructive azoospermia. J Urol. 2002;168:1063–7. https://doi.org/10.1097/01.ju.0000025397.03586.c4.
Article
PubMedGoogle Scholar
-
Tsujimura A. Microdissection testicular sperm extraction: prediction, outcome, and complications. Int J Urol Off J Jpn Urol Assoc. 2007;14:883–9. https://doi.org/10.1111/j.1442-2042.2007.01828.x.
Article
Google Scholar
-
Franco G, Scarselli F, Casciani V, De Nunzio C, Dente D, Leonardo C, et al. A novel stepwise micro-TESE approach in non obstructive azoospermia. BMC Urol. 2016;16. https://doi.org/10.1186/s12894-016-0138-6.
-
McLachlan RI, Rajpert-De Meyts E, Hoei-Hansen CE, de Kretser DM, Skakkebaek NE. Histological evaluation of the human testis—approaches to optimizing the clinical value of the assessment: mini review. Hum Reprod Oxf Engl. 2007;22:2–16. https://doi.org/10.1093/humrep/del279.
Article
CASGoogle Scholar
-
Robin G, Boitrelle F, Leroy X, Peers M-C, Marcelli F, Rigot J-M, et al. Assessment of azoospermia and histological evaluation of spermatogenesis. Ann Pathol. 2010;30:182–95. https://doi.org/10.1016/j.annpat.2010.03.015.
Article
PubMedGoogle Scholar
-
Tournaye H, Camus M, Vandervorst M, Nagy Z, Joris H, Van AS, et al. Surgical sperm retrieval for intracytoplasmic sperm injection. Int J Androl. 1997;20(Suppl 3):69–73.
PubMed
Google Scholar
-
Tsujimura A, Matsumiya K, Miyagawa Y, Tohda A, Miura H, Nishimura K, et al. Conventional multiple or microdissection testicular sperm extraction: a comparative study. Hum Reprod. 2002;17:2924–9. https://doi.org/10.1093/humrep/17.11.2924.
Article
CAS
PubMedGoogle Scholar
-
Dohle GR, Elzanaty S, van Casteren NJ. Testicular biopsy: clinical practice and interpretation. Asian J Androl. 2012;14:88–93. https://doi.org/10.1038/aja.2011.57.
Article
PubMedGoogle Scholar
-
Hamada AJ, Esteves SC, Agarwal A. A comprehensive review of genetics and genetic testing in azoospermia. Clin Sao Paulo Braz. 2013;68(Suppl 1):39–60.
Article
Google Scholar
-
Cocuzza M, Alvarenga C, Pagani R. The epidemiology and etiology of azoospermia. Clinics. 2013;68:15–26. https://doi.org/10.6061/clinics/2013(Sup01)03.
Article
PubMed
PubMed CentralGoogle Scholar
-
Fisch H, Lambert SM, Goluboff ET. Management of ejaculatory duct obstruction: etiology, diagnosis, and treatment. World J Urol. 2006;24:604–10. https://doi.org/10.1007/s00345-006-0129-4.
Article
PubMedGoogle Scholar
-
Clements KM, Shipley CF, Coleman DA, Ehrhart EJ, Haschek WM, Clark SG. Azoospermia in an 8-month-old boar due to bilateral obstruction at the testis/epididymis interface. Can Vet J Rev Veterinaire Can. 2010;51:1130–4.
Google Scholar
-
Jalbert P, Servoz-Gavin M, Amblard F, Pison H, Augusseau S, Jalbert H, et al. Role of karyotype in studying male infertility. J Gynecol Obstet Biol Reprod (Paris). 1989;18:724–8.
CAS
Google Scholar
-
Hazama M, Nakano M, Shinozaki M, Fujisawa M, Okamoto Y, Oka N, et al. Male infertility with chromosomal abnormalities. III. 46, XYq. Hinyokika Kiyo. 1988;34:1063–8.
CAS
PubMedGoogle Scholar
-
Diaz-Castaños LR, Rivera H, Gonzalez-Montes RM, Diaz M. Translocation (Y;19)(q12;q13) and azoospermia. Ann Genet. 1991;34:27–9.
PubMed
Google Scholar
-
Meschede D, Keck C, De Geyter C, Eigel A, Horst J, Nieschlag E. Mutation in the cystic fibrosis transmembrane-regulator gene in bilateral congenital ductus deferens aplasia. Dtsch Med Wochenschr 1946. 1993;118:661–4. https://doi.org/10.1055/s-2008-1059376.
Article
CASGoogle Scholar
-
Stuppia L, Antonucci I, Binni F, Brandi A, Grifone N, Colosimo A, et al. Screening of mutations in the CFTR gene in 1195 couples entering assisted reproduction technique programs. Eur J Hum Genet EJHG. 2005;13:959–64. https://doi.org/10.1038/sj.ejhg.5201437.
Article
CAS
PubMedGoogle Scholar
-
Quilter CR, Svennevik EC, Serhal P, Ralph D, Bahadur G, Stanhope R, et al. Cytogenetic and Y chromosome microdeletion screening of a random group of infertile males. Fertil Steril. 2003;79:301–7.
Article
Google Scholar
-
Bor P, Hindkjær J, Ingerslev HJ, Kølvraa S. Genetics: multiplex PCR for screening of microdeletions on the Y chromosome. J Assist Reprod Genet. 2001;18:291–8. https://doi.org/10.1023/A:1016618418319.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Bardoni B, Zuffardi O, Guioli S, Ballabio A, Simi P, Cavalli P, et al. A deletion map of the human Yq11 region: implications for the evolution of the Y chromosome and tentative mapping of a locus involved in spermatogenesis. Genomics. 1991;11:443–51.
Article
CASGoogle Scholar
-
Henegariu O, Hirschmann P, Kilian K, Kirsch S, Lengauer C, Maiwald R, et al. Rapid screening of the Y chromosome in idiopathic sterile men, diagnostic for deletions in AZF, a genetic Y factor expressed during spermatogenesis. Andrologia. 1994;26:97–106.
Article
CASGoogle Scholar
-
Klinefelter HF, Reifenstein EC, Albright F. Syndrome characterized by gynecomastia, aspermatogenesis without A-Leydigism, and increased excretion of follicle-stimulating hormone. J Clin Endocrinol. 1942;2:615–27. https://doi.org/10.1210/jcem-2-11-615.
Article
CASGoogle Scholar
-
Jacobs PA, Strong JA. A case of human intersexuality having a possible XXY sex-determining mechanism. Nature. 1959;183:302–3.
Article
CASGoogle Scholar
-
Nielsen J, Wohlert M. Chromosome abnormalities found among 34,910 newborn children: results from a 13-year incidence study in Arhus, Denmark. Hum Genet. 1991;87:81–3.
Article
CASGoogle Scholar
-
Morris JK, Alberman E, Scott C, Jacobs P. Is the prevalence of Klinefelter syndrome increasing? Eur J Hum Genet EJHG. 2008;16:163–70. https://doi.org/10.1038/sj.ejhg.5201956.
Article
CAS
PubMedGoogle Scholar
-
Lanfranco F, Kamischke A, Zitzmann M, Nieschlag E. Klinefelter’s syndrome. Lancet Lond Engl. 2004;364:273–83. https://doi.org/10.1016/S0140-6736(04)16678-6.
Article
CASGoogle Scholar
-
Laron Z, Dickerman Z, Zamir R, Galatzer A. Paternity in Klinefelter’s syndrome—a case report. Arch Androl. 1982;8:149–51.
Article
CASGoogle Scholar
-
Terzoli G, Lalatta F, Lobbiani A, Simoni G, Colucci G. Fertility in a 47,XXY patient: assessment of biological paternity by deoxyribonucleic acid fingerprinting. Fertil Steril. 1992;58:821–2. https://doi.org/10.1016/S0015-0282(16)55334-5.
Article
CAS
PubMedGoogle Scholar
-
Hancock JL, Daker MG. Testicular hypoplasia in a boar with abnormal sex chromosome constitution (39 XXY). J Reprod Fertil. 1981;61:395–7.
Article
CASGoogle Scholar
-
Dunn HO, Lein DH, McEntee K. Testicular hypoplasia in a Hereford bull with 61,XXY karyotype: the bovine counterpart of human Klinefelter’s syndrome. Cornell Vet. 1980;70:137–46.
CAS
PubMedGoogle Scholar
-
Meyers-Wallen VN. Genetics of sexual differentiation and anomalies in dogs and cats. J Reprod Fertil Suppl. 1993;47:441–52.
CAS
PubMedGoogle Scholar
-
Aksglaede L, Juul A. Therapy of endocrine disease: testicular function and fertility in men with Klinefelter syndrome: a review. Eur J Endocrinol. 2013;168:R67–76. https://doi.org/10.1530/EJE-12-0934.
Article
CAS
PubMedGoogle Scholar
-
Corona G, Pizzocaro A, Lanfranco F, Garolla A, Pelliccione F, Vignozzi L, et al. Sperm recovery and ICSI outcomes in Klinefelter syndrome: a systematic review and meta-analysis. Hum Reprod Update. 2017;23:265–75. https://doi.org/10.1093/humupd/dmx008.
Article
CAS
PubMedGoogle Scholar
-
Coerdt W, Rehder H, Gausmann I, Johannisson R, Gropp A. Quantitative histology of human fetal testes in chromosomal disease. Pediatr Pathol. 1985;3:245–59.
Article
CASGoogle Scholar
-
Aksglaede L, Wikström AM, Rajpert-De Meyts E, Dunkel L, Skakkebaek NE, Juul A. Natural history of seminiferous tubule degeneration in Klinefelter syndrome. Hum Reprod Update. 2006;12:39–48. https://doi.org/10.1093/humupd/dmi039.
Article
PubMedGoogle Scholar
-
Wikström AM, Raivio T, Hadziselimovic F, Wikström S, Tuuri T, Dunkel L. Klinefelter syndrome in adolescence: onset of puberty is associated with accelerated germ cell depletion. J Clin Endocrinol Metab. 2004;89:2263–70. https://doi.org/10.1210/jc.2003-031725.
Article
CAS
PubMedGoogle Scholar
-
Van Saen D, Vloeberghs V, Gies I, Mateizel I, Sermon K, De Schepper J, et al. When does germ cell loss and fibrosis occur in patients with Klinefelter syndrome? Hum Reprod Oxf Engl. 2018;33:1009–22. https://doi.org/10.1093/humrep/dey094.
Article
Google Scholar
-
Rives N, Milazzo JP, Perdrix A, Castanet M, Joly-Hélas G, Sibert L, et al. The feasibility of fertility preservation in adolescents with Klinefelter syndrome. Hum Reprod Oxf Engl. 2013;28:1468–79. https://doi.org/10.1093/humrep/det084.
Article
CASGoogle Scholar
-
Sandberg AA, Koepf GF, Ishihara T, Hauschka TS. AN XYY HUMAN MALE. Lancet. 1961;278:488–9. https://doi.org/10.1016/S0140-6736(61)92459-X.
Article
Google Scholar
-
Skakkebaek NE, Hultén M, Jacobsen P, Mikkelsen M. Quantification of human seminiferous epithelium. II. Histological studies in eight 47,XYY men. J Reprod Fertil. 1973;32:391–401.
Article
CASGoogle Scholar
-
Abdel-Razic MM, Abdel-Hamid IA, ElSobky ES. Nonmosaic 47,XYY syndrome presenting with male infertility: case series. Andrologia. 2012;44:200–4. https://doi.org/10.1111/j.1439-0272.2010.01129.x.
Article
CAS
PubMedGoogle Scholar
-
Chandley AC, Fletcher J, Robinson JA. Normal meiosis in two 47,XYY men. Hum Genet. 1976;33:231–40.
Article
CASGoogle Scholar
-
Speed RM, Faed MJ, Batstone PJ, Baxby K, Barnetson W. Persistence of two Y chromosomes through meiotic prophase and metaphase I in an XYY man. Hum Genet. 1991;87:416–20.
Article
CASGoogle Scholar
-
Gabriel-Robez O, Delobel B, Croquette MF, Rigot JM, Djlelati R, Rumpler Y. Synaptic behaviour of sex chromosome in two XYY men. Ann Genet. 1996;39:129–32.
CAS
PubMedGoogle Scholar
-
Mahadevaiah SK, Evans EP, Burgoyne PS. An analysis of meiotic impairment and of sex chromosome associations throughout meiosis in XYY mice. Cytogenet Cell Genet. 2000;89:29–37. https://doi.org/10.1159/000015585.
Article
CAS
PubMedGoogle Scholar
-
Rodriguez TA, Burgoyne PS. Evidence that sex chromosome asynapsis, rather than excess Y gene dosage, is responsible for the meiotic impairment of XYY mice. Cytogenet Cell Genet. 2000;89:38–43. https://doi.org/10.1159/000015559.
Article
CAS
PubMedGoogle Scholar
-
Rives N, Siméon N, Milazzo JP, Barthélémy C, Macé B. Meiotic segregation of sex chromosomes in mosaic and non-mosaic XYY males: case reports and review of the literature. Int J Androl. 2003;26:242–9.
Article
CASGoogle Scholar
-
Gurbuz F, Ceylaner S, Erdogan S, Topaloglu AK, Yuksel B. Sertoli cell only syndrome with ambiguous genitalia. J Pediatr Endocrinol Metab JPEM. 2016;29:849–52. https://doi.org/10.1515/jpem-2015-0458.
Article
PubMedGoogle Scholar
-
Jain M, VeeraMohan V, Chaudhary I, Halder A. The Sertoli cell only syndrome and Glaucoma in a sex — determining region Y (SRY) positive XX infertile male. J Clin Diagn Res JCDR. 2013;7:1457–9. https://doi.org/10.7860/JCDR/2013/5186.3169.
Article
PubMedGoogle Scholar
-
Délot EC, Vilain EJ. Nonsyndromic 46,XX Testicular Disorders of Sex Development. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, et al., editors. GeneReviews®. Seattle: University of Washington, Seattle; 1993. Available: http://www.ncbi.nlm.nih.gov/books/NBK1416/.
Google Scholar
-
Vetro A, Dehghani MR, Kraoua L, Giorda R, Beri S, Cardarelli L, et al. Testis development in the absence of SRY: chromosomal rearrangements at SOX9 and SOX3. Eur J Hum Genet EJHG. 2015;23:1025–32. https://doi.org/10.1038/ejhg.2014.237.
Article
CAS
PubMedGoogle Scholar
-
Tallapaka K, Venugopal V, Dalal A, Aggarwal S. Novel RSPO1 mutation causing 46,XX testicular disorder of sex development with palmoplantar keratoderma: A review of literature and expansion of clinical phenotype. Am J Med Genet A. 2018;176:1006–10. https://doi.org/10.1002/ajmg.a.38646.
Article
PubMedGoogle Scholar
-
Koulischer L, Schoysman R. Studies of the mitotic and meiotic chromosomes in infertile males. J Genet Hum. 1975;23(SUPPL):58–70.
PubMed
Google Scholar
-
Chandley AC. The chromosomal basis of human infertility. Br Med Bull. 1979;35:181–6.
Article
CASGoogle Scholar
-
Retief AE, Van Zyl JA, Menkveld R, Fox MF, Kotzè GM, Brusnickỳ J. Chromosome studies in 496 infertile males with a sperm count below 10 million/ml. Hum Genet. 1984;66:162–4.
Article
CASGoogle Scholar
-
Bourrouillou G, Dastugue N, Colombies P. Chromosome studies in 952 infertile males with a sperm count below 10 million/ml. Hum Genet. 1985;71:366–7.
Article
CASGoogle Scholar
-
Hens L, Bonduelle M, Liebaers I, Devroey P, Van Steirteghem AC. Chromosome aberrations in 500 couples referred for in-vitro fertilization or related fertility treatment. Hum Reprod Oxf Engl. 1988;3:451–7.
Article
CASGoogle Scholar
-
Chandley AC, Seuánez H, Fletcher JM. Meiotic behavior of five human reciprocal translocations. Cytogenet Cell Genet. 1976;17:98–111. https://doi.org/10.1159/000130694.
Article
CAS
PubMedGoogle Scholar
-
Johannisson R, Schwinger E, Wolff HH, vom Ende V, Löhrs U. The effect of 13;14 Robertsonian translocations on germ-cell differentiation in infertile males. Cytogenet Cell Genet. 1993;63:151–5. https://doi.org/10.1159/000133524.
Article
CAS
PubMedGoogle Scholar
-
Gabriel-Robez O, Ratomponirina C, Rumpler Y, Le Marec B, Luciani JM, Guichaoua MR. Synapsis and synaptic adjustment in an infertile human male heterozygous for a pericentric inversion in chromosome 1. Hum Genet. 1986;72:148–52.
Article
CASGoogle Scholar
-
Turner JMA, Mahadevaiah SK, Fernandez-Capetillo O, Nussenzweig A, Xu X, Deng C-X, et al. Silencing of unsynapsed meiotic chromosomes in the mouse. Nat Genet. 2005;37:41–7. https://doi.org/10.1038/ng1484.
Article
CAS
PubMedGoogle Scholar
-
Barasc H, Congras A, Mary N, Trouilh L, Marquet V, Ferchaud S, et al. Meiotic pairing and gene expression disturbance in germ cells from an infertile boar with a balanced reciprocal autosome-autosome translocation. Chromosome Res Int J Mol Supramol Evol Asp Chromosome Biol. 2016;24:511–27. https://doi.org/10.1007/s10577-016-9533-9.
Article
CASGoogle Scholar
-
Vogt P, Chandley AC, Hargreave TB, Keil R, Ma K, Sharkey A. Microdeletions in interval 6 of the Y chromosome of males with idiopathic sterility point to disruption of AZF, a human spermatogenesis gene. Hum Genet. 1992;89:491–6.
Article
CASGoogle Scholar
-
Vogt PH, Edelmann A, Kirsch S, Henegariu O, Hirschmann P, Kiesewetter F, et al. Human Y chromosome azoospermia factors (AZF) mapped to different subregions in Yq11. Hum Mol Genet. 1996;5:933–43.
Article
CASGoogle Scholar
-
Vogt PH. Azoospermia factor (AZF) in Yq11: towards a molecular understanding of its function for human male fertility and spermatogenesis. Reprod BioMed Online. 2005;10:81–93.
Article
CASGoogle Scholar
-
Reijo R, Alagappan RK, Patrizio P, Page DC. Severe oligozoospermia resulting from deletions of azoospermia factor gene on Y chromosome. Lancet Lond Engl. 1996;347:1290–3.
Article
CASGoogle Scholar
-
Patrat C, Bienvenu T, Janny L, Faure A-K, Fauque P, Aknin-Seifer I, et al. Clinical data and parenthood of 63 infertile and Y-microdeleted men. Fertil Steril. 2010;93:822–32. https://doi.org/10.1016/j.fertnstert.2008.10.033.
Article
PubMedGoogle Scholar
-
Kaplan E, Shwachman H, Perlmutter AD, Rule A, Khaw K-T, Holsclaw DS. Reproductive failure in males with cystic fibrosis. N Engl J Med. 1968;279:65–9. https://doi.org/10.1056/NEJM196807112790203.
Article
CAS
PubMedGoogle Scholar
-
O’Sullivan BP, Freedman SD. Cystic fibrosis. Lancet. 2009;373:1891–904. https://doi.org/10.1016/S0140-6736(09)60327-5.
Article
PubMedGoogle Scholar
-
Sosnay PR, Siklosi KR, Van Goor F, Kaniecki K, Yu H, Sharma N, et al. Defining the disease liability of variants in the cystic fibrosis transmembrane conductance regulator gene. Nat Genet. 2013;45:1160–7. https://doi.org/10.1038/ng.2745.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Welsh MJ, Smith AE. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis. Cell. 1993;73:1251–4.
Article
CASGoogle Scholar
-
Tsui LC. The spectrum of cystic fibrosis mutations. Trends Genet TIG. 1992;8:392–8.
Article
CASGoogle Scholar
-
Zielenski J, Tsui LC. Cystic fibrosis: genotypic and phenotypic variations. Annu Rev Genet. 1995;29:777–807. https://doi.org/10.1146/annurev.ge.29.120195.004021.
Article
CAS
PubMedGoogle Scholar
-
Pier GB, Grout M, Zaidi T, Meluleni G, Mueschenborn SS, Banting G, et al. Salmonella typhi uses CFTR to enter intestinal epithelial cells. Nature. 1998;393:79–82. https://doi.org/10.1038/30006.
Article
CAS
PubMedGoogle Scholar
-
Modiano G, Ciminelli BM, Pignatti PF. Cystic fibrosis and lactase persistence: a possible correlation. Eur J Hum Genet EJHG. 2007;15:255–9. https://doi.org/10.1038/sj.ejhg.5201749.
Article
CAS
PubMedGoogle Scholar
-
Alfonso-Sánchez MA, Pérez-Miranda AM, García-Obregón S, Peña JA. An evolutionary approach to the high frequency of the Delta F508 CFTR mutation in European populations. Med Hypotheses. 2010;74:989–92. https://doi.org/10.1016/j.mehy.2009.12.018.
Article
CAS
PubMedGoogle Scholar
-
Borzan V, Tomašević B, Kurbel S. Hypothesis: possible respiratory advantages for heterozygote carriers of cystic fibrosis linked mutations during dusty climate of last glaciation. J Theor Biol. 2014;363:164–8. https://doi.org/10.1016/j.jtbi.2014.08.015.
Article
PubMedGoogle Scholar
-
Kerem B, Rommens JM, Buchanan JA, Markiewicz D, Cox TK, Chakravarti A, et al. Identification of the cystic fibrosis gene: genetic analysis. Science. 1989;245:1073–80. https://doi.org/10.1126/science.2570460.
Article
CAS
PubMedGoogle Scholar
-
Bombieri C, Claustres M, De Boeck K, Derichs N, Dodge J, Girodon E, et al. Recommendations for the classification of diseases as CFTR-related disorders. J Cyst Fibros Off J Eur Cyst Fibros Soc. 2011;10(Suppl 2):S86–102. https://doi.org/10.1016/S1569-1993(11)60014-3.
Article
CASGoogle Scholar
-
Ferlin A, Raicu F, Gatta V, Zuccarello D, Palka G, Foresta C. Male infertility: role of genetic background. Reprod BioMed Online. 2007;14:734–45.
Article
CASGoogle Scholar
-
Chillón M, Casals T, Mercier B, Bassas L, Lissens W, Silber S, et al. Mutations in the cystic fibrosis gene in patients with congenital absence of the vas deferens. N Engl J Med. 1995;332:1475–80. https://doi.org/10.1056/NEJM199506013322204.
Article
PubMedGoogle Scholar
-
Yu J, Chen Z, Ni Y, Li Z. CFTR mutations in men with congenital bilateral absence of the vas deferens (CBAVD): a systemic review and meta-analysis. Hum Reprod Oxf Engl. 2012;27:25–35. https://doi.org/10.1093/humrep/der377.
Article
CASGoogle Scholar
-
Llabador MA, Pagin A, Lefebvre-Maunoury C, Marcelli F, Leroy-Martin B, Rigot JM, et al. Congenital bilateral absence of the vas deferens: the impact of spermatogenesis quality on intracytoplasmic sperm injection outcomes in 108 men. Andrology. 2015;3:473–80. https://doi.org/10.1111/andr.12019.
Article
CAS
PubMedGoogle Scholar
-
Xu WM, Chen J, Chen H, Diao RY, Fok KL, Dong JD, et al. Defective CFTR-dependent CREB activation results in impaired spermatogenesis and azoospermia. PLoS One. 2011;6:e19120. https://doi.org/10.1371/journal.pone.0019120.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Molina LCP, Pinto NA, Rodríguez PT, Romarowski A, Sanchez AV, Visconti PE, et al. Essential role of CFTR in PKA-dependent phosphorylation, alkalinization, and hyperpolarization during human sperm capacitation. J Cell Physiol. 2017;232:1404–14. https://doi.org/10.1002/jcp.25634.
Article
CASGoogle Scholar
-
Patat O, Pagin A, Siegfried A, Mitchell V, Chassaing N, Faguer S, et al. Truncating mutations in the adhesion G protein-coupled receptor G2 gene ADGRG2 cause an X-linked congenital bilateral absence of vas deferens. Am J Hum Genet. 2016;99:437–42. https://doi.org/10.1016/j.ajhg.2016.06.012.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Yang B, Wang J, Zhang W, Pan H, Li T, Liu B, et al. Pathogenic role of ADGRG2 in CBAVD patients replicated in Chinese population. Andrology. 2017;5:954–7. https://doi.org/10.1111/andr.12407.
Article
CAS
PubMedGoogle Scholar
-
Obermann H, Samalecos A, Osterhoff C, Schröder B, Heller R, Kirchhoff C. HE6, a two-subunit heptahelical receptor associated with apical membranes of efferent and epididymal duct epithelia. Mol Reprod Dev. 2003;64:13–26. https://doi.org/10.1002/mrd.10220.
Article
CAS
PubMedGoogle Scholar
-
Zhang D-L, Sun Y-J, Ma M-L, Wang Y, Lin H, Li R-R, et al. Gq activity- and β-arrestin-1 scaffolding-mediated ADGRG2/CFTR coupling are required for male fertility. Bagnat M, editor. eLife. 2018;7:e33432. https://doi.org/10.7554/eLife.33432.
Article
PubMed
PubMed CentralGoogle Scholar
-
Davies B, Baumann C, Kirchhoff C, Ivell R, Nubbemeyer R, Habenicht U-F, et al. Targeted deletion of the epididymal receptor HE6 results in fluid dysregulation and male infertility. Mol Cell Biol. 2004;24:8642–8. https://doi.org/10.1128/MCB.24.19.8642-8648.2004.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Clulow J, Jones RC, Hansen LA, Man SY. Fluid and electrolyte reabsorption in the ductuli efferentes testis. J Reprod Fertil Suppl. 1998;53:1–14.
CAS
PubMedGoogle Scholar
-
Khan MJ, Pollock N, Jiang H, Castro C, Nazli R, Ahmed J, et al. X-linked ADGRG2 mutation and obstructive azoospermia in a large Pakistani family. Sci Rep. 2018;8:16280. https://doi.org/10.1038/s41598-018-34262-5.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Hihnala S, Kujala M, Toppari J, Kere J, Holmberg C, Höglund P. Expression of SLC26A3, CFTR and NHE3 in the human male reproductive tract: role in male subfertility caused by congenital chloride diarrhoea. Mol Hum Reprod. 2006;12:107–11. https://doi.org/10.1093/molehr/gal009.
Article
CAS
PubMedGoogle Scholar
-
Zhou Q, Clarke L, Nie R, Carnes K, Lai LW, Lien YH, et al. Estrogen action and male fertility: roles of the sodium/hydrogen exchanger-3 and fluid reabsorption in reproductive tract function. Proc Natl Acad Sci U S A. 2001;98:14132–7. https://doi.org/10.1073/pnas.241245898.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Pholpramool C, Borwornpinyo S, Dinudom A. Role of Na+ /H+ exchanger 3 in the acidification of the male reproductive tract and male fertility. Clin Exp Pharmacol Physiol. 2011;38:403–9. https://doi.org/10.1111/j.1440-1681.2011.05525.x.
Article
CAS
PubMedGoogle Scholar
-
Wang Y-Y, Lin Y-H, Wu Y-N, Chen Y-L, Lin Y-C, Cheng C-Y, et al. Loss of SLC9A3 decreases CFTR protein and causes obstructed azoospermia in mice. PLoS Genet. 2017;13. https://doi.org/10.1371/journal.pgen.1006715.
-
Wu Y-N, Lin Y-H, Chiang H-S. SLC9A3 is a novel pathogenic gene in Taiwanese males with congenital bilateral absence of the vas deferens. Eur Urol Suppl. 2018;17:e1092. https://doi.org/10.1016/S1569-9056(18)31593-8.
Article
Google Scholar
-
Lee C-H, Wu C-C, Wu Y-N, Chiang H-S. Gene copy number variations in Asian patients with congenital bilateral absence of the vas deferens. Hum Reprod Oxf Engl. 2009;24:748–55. https://doi.org/10.1093/humrep/den413.
Article
CASGoogle Scholar
-
Kuo Y-M, Duncan JL, Westaway SK, Yang H, Nune G, Xu EY, et al. Deficiency of pantothenate kinase 2 (Pank2) in mice leads to retinal degeneration and azoospermia. Hum Mol Genet. 2005;14:49–57. https://doi.org/10.1093/hmg/ddi005.
Article
CAS
PubMedGoogle Scholar
-
Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges. Nat Med. 2008;14:1197–213. https://doi.org/10.1038/nm.f.1895.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Yatsenko AN, Georgiadis AP, Röpke A, Berman AJ, Jaffe T, Olszewska M, et al. X-linked TEX11 mutations, meiotic arrest, and azoospermia in infertile men. N Engl J Med. 2015;372:2097–107. https://doi.org/10.1056/NEJMoa1406192.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Sha Y, Zheng L, Ji Z, Mei L, Ding L, Lin S, et al. A novel TEX11 mutation induces azoospermia: a case report of infertile brothers and literature review. BMC Med Genet. 2018;19. https://doi.org/10.1186/s12881-018-0570-4.
-
He W-B, Tu C-F, Liu Q, Meng L-L, Yuan S-M, Luo A-X, et al. DMC1 mutation that causes human non-obstructive azoospermia and premature ovarian insufficiency identified by whole-exome sequencing. J Med Genet. 2018;55:198–204. https://doi.org/10.1136/jmedgenet-2017-104992.
Article
CAS
PubMedGoogle Scholar
-
Gershoni M, Hauser R, Yogev L, Lehavi O, Azem F, Yavetz H, et al. A familial study of azoospermic men identifies three novel causative mutations in three new human azoospermia genes. Genet Med Off J Am Coll Med Genet. 2017;19:998–1006. https://doi.org/10.1038/gim.2016.225.
Article
CASGoogle Scholar
-
McNally FJ. Mechanisms of spindle positioning. J Cell Biol. 2013;200:131–40. https://doi.org/10.1083/jcb.201210007.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Li Y, Yagi H, Onuoha EO, Damerla RR, Francis R, Furutani Y, et al. DNAH6 and its interactions with PCD genes in Heterotaxy and primary ciliary dyskinesia. PLoS Genet. 2016;12:e1005821. https://doi.org/10.1371/journal.pgen.1005821.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Okutman O, Muller J, Skory V, Garnier JM, Gaucherot A, Baert Y, et al. A no-stop mutation in MAGEB4 is a possible cause of rare X-linked azoospermia and oligozoospermia in a consanguineous Turkish family. J Assist Reprod Genet. 2017;34:683–94. https://doi.org/10.1007/s10815-017-0900-z.
Article
PubMed
PubMed CentralGoogle Scholar
-
Osterlund C, Töhönen V, Forslund KO, Nordqvist K. Mage-b4, a novel melanoma antigen (MAGE) gene specifically expressed during germ cell differentiation. Cancer Res. 2000;60:1054–61.
CAS
PubMedGoogle Scholar
-
Tenenbaum-Rakover Y, Weinberg-Shukron A, Renbaum P, Lobel O, Eideh H, Gulsuner S, et al. Minichromosome maintenance complex component 8 (MCM8) gene mutations result in primary gonadal failure. J Med Genet. 2015;52:391–9. https://doi.org/10.1136/jmedgenet-2014-102921.
Article
CAS
PubMedGoogle Scholar
-
Lee KY, Im J-S, Shibata E, Park J, Handa N, Kowalczykowski SC, et al. MCM8-9 complex promotes resection of double-strand break ends by MRE11-RAD50-NBS1 complex. Nat Commun. 2015;6:7744. https://doi.org/10.1038/ncomms8744.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Park J, Long DT, Lee KY, Abbas T, Shibata E, Negishi M, et al. The MCM8-MCM9 complex promotes RAD51 recruitment at DNA damage sites to facilitate homologous recombination. Mol Cell Biol. 2013;33:1632–44. https://doi.org/10.1128/MCB.01503-12.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Lutzmann M, Grey C, Traver S, Ganier O, Maya-Mendoza A, Ranisavljevic N, et al. MCM8- and MCM9-deficient mice reveal gametogenesis defects and genome instability due to impaired homologous recombination. Mol Cell. 2012;47:523–34. https://doi.org/10.1016/j.molcel.2012.05.048.
Article
CAS
PubMedGoogle Scholar
-
Luo M, Yang F, Leu NA, Landaiche J, Handel MA, Benavente R, et al. MEIOB exhibits single-stranded DNA-binding and exonuclease activities and is essential for meiotic recombination. Nat Commun. 2013;4:2788. https://doi.org/10.1038/ncomms3788.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Souquet B, Abby E, Hervé R, Finsterbusch F, Tourpin S, Le Bouffant R, et al. MEIOB targets single-strand DNA and is necessary for meiotic recombination. PLoS Genet. 2013;9:e1003784. https://doi.org/10.1371/journal.pgen.1003784.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Ben Khelifa M, Ghieh F, Boudjenah R, Hue C, Fauvert D, Dard R, et al. A MEI1 homozygous missense mutation associated with meiotic arrest in a consanguineous family. Hum Reprod Oxf Engl. 2018;33:1034–7. https://doi.org/10.1093/humrep/dey073.
Article
CASGoogle Scholar
-
Libby BJ, De La Fuente R, O’Brien MJ, Wigglesworth K, Cobb J, Inselman A, et al. The mouse meiotic mutation mei1 disrupts chromosome synapsis with sexually dimorphic consequences for meiotic progression. Dev Biol. 2002;242:174–87. https://doi.org/10.1006/dbio.2001.0535.
Article
CAS
PubMedGoogle Scholar
-
Sato H, Miyamoto T, Yogev L, Namiki M, Koh E, Hayashi H, et al. Polymorphic alleles of the human MEI1 gene are associated with human azoospermia by meiotic arrest. J Hum Genet. 2006;51:533–40. https://doi.org/10.1007/s10038-006-0394-5.
Article
CAS
PubMedGoogle Scholar
-
Ramasamy R, Bakırcıoğlu ME, Cengiz C, Karaca E, Scovell J, Jhangiani SN, et al. Whole-exome sequencing identifies novel homozygous mutation in NPAS2 in family with nonobstructive azoospermia. Fertil Steril. 2015;104:286–91. https://doi.org/10.1016/j.fertnstert.2015.04.001.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Zangen D, Kaufman Y, Zeligson S, Perlberg S, Fridman H, Kanaan M, et al. XX ovarian dysgenesis is caused by a PSMC3IP/HOP2 mutation that abolishes coactivation of estrogen-driven transcription. Am J Hum Genet. 2011;89:572–9. https://doi.org/10.1016/j.ajhg.2011.09.006.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Al-Agha AE, Ahmed IA, Nuebel E, Moriwaki M, Moore B, Peacock KA, et al. Primary ovarian insufficiency and azoospermia in carriers of a homozygous PSMC3IP stop gain mutation. J Clin Endocrinol Metab. 2018;103:555–63. https://doi.org/10.1210/jc.2017-01966.
Article
PubMedGoogle Scholar
-
Kherraf Z-E, Christou-Kent M, Karaouzene T, Amiri-Yekta A, Martinez G, Vargas AS, et al. SPINK2 deficiency causes infertility by inducing sperm defects in heterozygotes and azoospermia in homozygotes. EMBO Mol Med. 2017;9:1132–49. https://doi.org/10.15252/emmm.201607461.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Nakamura S, Kobori Y, Ueda Y, Tanaka Y, Ishikawa H, Yoshida A, et al. STX2 is a causative gene for nonobstructive azoospermia. Hum Mutat. 2018;39:830–3. https://doi.org/10.1002/humu.23423.
Article
CAS
PubMedGoogle Scholar
-
Fujiwara Y, Ogonuki N, Inoue K, Ogura A, Handel MA, Noguchi J, et al. t-SNARE Syntaxin2 (STX2) is implicated in intracellular transport of sulfoglycolipids during meiotic prophase in mouse spermatogenesis. Biol Reprod. 2013;88:141. https://doi.org/10.1095/biolreprod.112.107110.
Article
PubMed
PubMed CentralGoogle Scholar
-
Maor-Sagie E, Cinnamon Y, Yaacov B, Shaag A, Goldsmidt H, Zenvirt S, et al. Deleterious mutation in SYCE1 is associated with non-obstructive azoospermia. J Assist Reprod Genet. 2015;32:887–91. https://doi.org/10.1007/s10815-015-0445-y.
Article
PubMed
PubMed CentralGoogle Scholar
-
Bolcun-Filas E, Hall E, Speed R, Taggart M, Grey C, de Massy B, et al. Mutation of the mouse Syce1 gene disrupts synapsis and suggests a link between synaptonemal complex structural components and DNA repair. PLoS Genet. 2009;5:e1000393. https://doi.org/10.1371/journal.pgen.1000393.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Ayhan Ö, Balkan M, Guven A, Hazan R, Atar M, Tok A, et al. Truncating mutations in TAF4B and ZMYND15 causing recessive azoospermia. J Med Genet. 2014;51:239–44. https://doi.org/10.1136/jmedgenet-2013-102102.
Article
CAS
PubMedGoogle Scholar
-
Yang X, Zhang H, Jiang Y, Zhang H, Hu X, Zhu D, et al. Association study between MTRR, TAF4B, PIWIL1 variants and non-obstructive azoospermia in northeast Chinese Han population. Clin Lab. 2018;64:1731–8. https://doi.org/10.7754/Clin.Lab.2018.180525.
Article
PubMedGoogle Scholar
-
Falender AE, Freiman RN, Geles KG, Lo KC, Hwang K, Lamb DJ, et al. Maintenance of spermatogenesis requires TAF4b, a gonad-specific subunit of TFIID. Genes Dev. 2005;19:794–803. https://doi.org/10.1101/gad.1290105.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Tan Y-Q, Tu C, Meng L, Yuan S, Sjaarda C, Luo A, et al. Loss-of-function mutations in TDRD7 lead to a rare novel syndrome combining congenital cataract and nonobstructive azoospermia in humans. Genet Med Off J Am Coll Med Genet. 2017. https://doi.org/10.1038/gim.2017.130.
-
Tanaka T, Hosokawa M, Vagin VV, Reuter M, Hayashi E, Mochizuki AL, et al. Tudor domain containing 7 (Tdrd7) is essential for dynamic ribonucleoprotein (RNP) remodeling of chromatoid bodies during spermatogenesis. Proc Natl Acad Sci U S A. 2011;108:10579–84. https://doi.org/10.1073/pnas.1015447108.
Article
PubMed
PubMed CentralGoogle Scholar
-
Shoji M, Tanaka T, Hosokawa M, Reuter M, Stark A, Kato Y, et al. The TDRD9-MIWI2 complex is essential for piRNA-mediated retrotransposon silencing in the mouse male germline. Dev Cell. 2009;17:775–87. https://doi.org/10.1016/j.devcel.2009.10.012.
Article
CAS
PubMedGoogle Scholar
-
Arafat M, Har-Vardi I, Harlev A, Levitas E, Zeadna A, Abofoul-Azab M, et al. Mutation in TDRD9 causes non-obstructive azoospermia in infertile men. J Med Genet. 2017;54:633–9. https://doi.org/10.1136/jmedgenet-2017-104514.
Article
CAS
PubMedGoogle Scholar
-
Boroujeni PB, Sabbaghian M, Totonchi M, Sodeifi N, Sarkardeh H, Samadian A, et al. Expression analysis of genes encoding TEX11, TEX12, TEX14 and TEX15 in testis tissues of men with non-obstructive azoospermia. JBRA Assist Reprod. 2018;22:185–92. https://doi.org/10.5935/1518-0557.20180030.
Article
PubMed
PubMed CentralGoogle Scholar
-
Wu M-H, Rajkovic A, Burns KH, Yan W, Lin Y-N, Matzuk MM. Sequence and expression of testis-expressed gene 14 (Tex14): a gene encoding a protein kinase preferentially expressed during spermatogenesis. Gene Expr Patterns GEP. 2003;3:231–6.
Article
CASGoogle Scholar
-
Greenbaum MP, Yan W, Wu M-H, Lin Y-N, Agno JE, Sharma M, et al. TEX14 is essential for intercellular bridges and fertility in male mice. Proc Natl Acad Sci U S A. 2006;103:4982–7. https://doi.org/10.1073/pnas.0505123103.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Sironen A, Uimari P, Venhoranta H, Andersson M, Vilkki J. An exonic insertion within Tex14 gene causes spermatogenic arrest in pigs. BMC Genomics. 2011;12:591. https://doi.org/10.1186/1471-2164-12-591.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Colombo R, Pontoglio A, Bini M. Two novel TEX15 mutations in a family with nonobstructive azoospermia. Gynecol Obstet Investig. 2017;82:283–6. https://doi.org/10.1159/000468934.
Article
CASGoogle Scholar
-
Okutman O, Muller J, Baert Y, Serdarogullari M, Gultomruk M, Piton A, et al. Exome sequencing reveals a nonsense mutation in TEX15 causing spermatogenic failure in a Turkish family. Hum Mol Genet. 2015;24:5581–8. https://doi.org/10.1093/hmg/ddv290.
Article
CAS
PubMedGoogle Scholar
-
Yang F, Eckardt S, Leu NA, McLaughlin KJ, Wang PJ. Mouse TEX15 is essential for DNA double-strand break repair and chromosomal synapsis during male meiosis. J Cell Biol. 2008;180:673–9. https://doi.org/10.1083/jcb.200709057.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Ruan J, He X-J, Du W-D, Chen G, Zhou Y, Xu S, et al. Genetic variants in TEX15 gene conferred susceptibility to spermatogenic failure in the Chinese Han population. Reprod Sci Thousand Oaks Calif. 2012;19:1190–6. https://doi.org/10.1177/1933719112446076.
Article
CASGoogle Scholar
-
Plaseski T, Noveski P, Popeska Z, Efremov GD, Plaseska-Karanfilska D. Association study of single-nucleotide polymorphisms in FASLG, JMJDIA, LOC203413, TEX15, BRDT, OR2W3, INSR, and TAS2R38 genes with male infertility. J Androl. 2012;33:675–83. https://doi.org/10.2164/jandrol.111.013995.
Article
CAS
PubMedGoogle Scholar
-
Yang Y, Guo J, Dai L, Zhu Y, Hu H, Tan L, et al. XRCC2 mutation causes meiotic arrest, azoospermia and infertility. J Med Genet. 2018;55:628–36. https://doi.org/10.1136/jmedgenet-2017-105145.
Article
PubMed
PubMed CentralGoogle Scholar
-
Zhang Y-X, Li H-Y, He W-B, Tu C, Du J, Li W, et al. XRCC2 mutation causes premature ovarian insufficiency as well as non-obstructive azoospermia in humans. Clin Genet. 2018. https://doi.org/10.1111/cge.13475.
-
Gu A-H, Liang J, Lu N-X, Wu B, Xia Y-K, Lu C-C, et al. Association of XRCC1 gene polymorphisms with idiopathic azoospermia in a Chinese population. Asian J Androl. 2007;9:781–6. https://doi.org/10.1111/j.1745-7262.2007.00325.x.
Article
CAS
PubMedGoogle Scholar
-
Zheng L, Wang X, Zhou D, Zhang J, Huo Y, Tian H. Association between XRCC1 single-nucleotide polymorphisms and infertility with idiopathic azoospermia in northern Chinese Han males. Reprod BioMed Online. 2012;25:402–7. https://doi.org/10.1016/j.rbmo.2012.06.014.
Article
CAS
PubMedGoogle Scholar
-
Jahantigh D, Hosseinzadeh Colagar A. XRCC5 VNTR, XRCC6 -61C>G, and XRCC7 6721G>T gene polymorphisms associated with male infertility risk: evidences from case-control and in silico studies. Int J Endocrinol. 2017;2017:4795076. https://doi.org/10.1155/2017/4795076.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Yan W, Si Y, Slaymaker S, Li J, Zheng H, Young DL, et al. Zmynd15 encodes a histone deacetylase-dependent transcriptional repressor essential for spermiogenesis and male fertility. J Biol Chem. 2010;285:31418–26. https://doi.org/10.1074/jbc.M110.116418.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Mouka A, Izard V, Tachdjian G, Brisset S, Yates F, Mayeur A, et al. Induced pluripotent stem cell generation from a man carrying a complex chromosomal rearrangement as a genetic model for infertility studies. Sci Rep. 2017;7:39760. https://doi.org/10.1038/srep39760.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Yang Y, Luo YY, Wu S, Tang YD, Rao XD, Xiong L, et al. Association between C677T and A1298C polymorphisms of the MTHFR gene and risk of male infertility: a meta-analysis. Genet Mol Res GMR. 2016;15. https://doi.org/10.4238/gmr.15027631.
-
Holliday R. The inheritance of epigenetic defects. Science. 1987;238:163–70.
Article
CASGoogle Scholar
-
Dada R, Kumar M, Jesudasan R, Fernández JL, Gosálvez J, Agarwal A. Epigenetics and its role in male infertility. J Assist Reprod Genet. 2012;29:213–23. https://doi.org/10.1007/s10815-012-9715-0.
Article
PubMed
PubMed CentralGoogle Scholar
-
Filipponi D, Feil R. Perturbation of genomic imprinting in oligozoospermia. Epigenetics. 2009;4:27–30.
Article
CASGoogle Scholar
-
Kobayashi H, Sato A, Otsu E, Hiura H, Tomatsu C, Utsunomiya T, et al. Aberrant DNA methylation of imprinted loci in sperm from oligospermic patients. Hum Mol Genet. 2007;16:2542–51. https://doi.org/10.1093/hmg/ddm187.
Article
CAS
PubMedGoogle Scholar
-
Hammoud SS, Purwar J, Pflueger C, Cairns BR, Carrell DT. Alterations in sperm DNA methylation patterns at imprinted loci in two classes of infertility. Fertil Steril. 2010;94:1728–33. https://doi.org/10.1016/j.fertnstert.2009.09.010.
Article
CAS
PubMedGoogle Scholar
-
De Mateo S, Sassone-Corsi P. Regulation of spermatogenesis by small non-coding RNAs: role of the germ granule. Semin Cell Dev Biol. 2014;29:84–92. https://doi.org/10.1016/j.semcdb.2014.04.021.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Hayashi K, Chuva de Sousa Lopes SM, Kaneda M, Tang F, Hajkova P, Lao K, et al. MicroRNA biogenesis is required for mouse primordial germ cell development and spermatogenesis. PLoS One. 2008;3:e1738. https://doi.org/10.1371/journal.pone.0001738.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Maatouk DM, Loveland KL, McManus MT, Moore K, Harfe BD. Dicer1 is required for differentiation of the mouse male germline. Biol Reprod. 2008;79:696–703. https://doi.org/10.1095/biolreprod.108.067827.
Article
CAS
PubMedGoogle Scholar
-
Eelaminejad Z, Favaedi R, Sodeifi N, Sadighi Gilani MA, Shahhoseini M. Deficient expression of JMJD1A histone demethylase in patients with round spermatid maturation arrest. Reprod BioMed Online. 2017;34:82–9. https://doi.org/10.1016/j.rbmo.2016.09.005.
Article
CAS
PubMedGoogle Scholar
-
Okada Y, Scott G, Ray MK, Mishina Y, Zhang Y. Histone demethylase JHDM2A is critical for Tnp1 and Prm1 transcription and spermatogenesis. Nature. 2007;450:119–23. https://doi.org/10.1038/nature06236.
Article
CAS
PubMedGoogle Scholar
-
Pedersen MT, Helin K. Histone demethylases in development and disease. Trends Cell Biol. 2010;20:662–71. https://doi.org/10.1016/j.tcb.2010.08.011.
Article
CAS
PubMedGoogle Scholar
-
Liu Z, Zhou S, Liao L, Chen X, Meistrich M, Xu J. Jmjd1a demethylase-regulated histone modification is essential for cAMP-response element modulator-regulated gene expression and spermatogenesis. J Biol Chem. 2010;285:2758–70. https://doi.org/10.1074/jbc.M109.066845.
Article
CAS
PubMedGoogle Scholar
-
Faure AK, Pivot-Pajot C, Kerjean A, Hazzouri M, Pelletier R, Péoc’h M, et al. Misregulation of histone acetylation in Sertoli cell-only syndrome and testicular cancer. Mol Hum Reprod. 2003;9:757–63.
Article
CASGoogle Scholar
-
Sonnack V, Failing K, Bergmann M, Steger K. Expression of hyperacetylated histone H4 during normal and impaired human spermatogenesis. Andrologia. 2002;34:384–90.
Article
CASGoogle Scholar
-
Khazamipour N, Noruzinia M, Fatehmanesh P, Keyhanee M, Pujol P. MTHFR promoter hypermethylation in testicular biopsies of patients with non-obstructive azoospermia: the role of epigenetics in male infertility. Hum Reprod Oxf Engl. 2009;24:2361–4. https://doi.org/10.1093/humrep/dep194.
Article
CASGoogle Scholar
-
Ferfouri F, Boitrelle F, Ghout I, Albert M, Molina Gomes D, Wainer R, et al. A genome-wide DNA methylation study in azoospermia. Andrology. 2013;1:815–21. https://doi.org/10.1111/j.2047-2927.2013.00117.x.
Article
CAS
PubMedGoogle Scholar
-
Cheng Y-S, Wee S-K, Lin T-Y, Lin Y-M. MAEL promoter hypermethylation is associated with de-repression of LINE-1 in human hypospermatogenesis. Hum Reprod Oxf Engl. 2017;32:2373–81. https://doi.org/10.1093/humrep/dex329.
Article
CASGoogle Scholar
-
Minor A, Chow V, Ma S. Aberrant DNA methylation at imprinted genes in testicular sperm retrieved from men with obstructive azoospermia and undergoing vasectomy reversal. Reproduction. 2011;141:749–57. https://doi.org/10.1530/REP-11-0008.
Article
CAS
PubMedGoogle Scholar
-
Ramasamy R, Ridgeway A, Lipshultz LI, Lamb DJ. Integrative DNA methylation and gene expression analysis identifies discoidin domain receptor 1 association with idiopathic nonobstructive azoospermia. Fertil Steril. 2014;102:968–973.e3. https://doi.org/10.1016/j.fertnstert.2014.06.028.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Li Z, Chen S, Yang Y, Zhuang X, Tzeng C-M. Novel biomarker ZCCHC13 revealed by integrating DNA methylation and mRNA expression data in non-obstructive azoospermia. Cell Death Dis. 2018;4. https://doi.org/10.1038/s41420-018-0033-x.
-
Marques PI, Fernandes S, Carvalho F, Barros A, Sousa M, Marques CJ. DNA methylation imprinting errors in spermatogenic cells from maturation arrest azoospermic patients. Andrology. 2017;5:451–9. https://doi.org/10.1111/andr.12329.
Article
CAS
PubMedGoogle Scholar
-
Marques CJ, Francisco T, Sousa S, Carvalho F, Barros A, Sousa M. Methylation defects of imprinted genes in human testicular spermatozoa. Fertil Steril. 2010;94:585–94. https://doi.org/10.1016/j.fertnstert.2009.02.051.
Article
CAS
PubMedGoogle Scholar
-
Lian J, Zhang X, Tian H, Liang N, Wang Y, Liang C, et al. Altered microRNA expression in patients with non-obstructive azoospermia. Reprod Biol Endocrinol RBE. 2009;7:13. https://doi.org/10.1186/1477-7827-7-13.
Article
CASGoogle Scholar
-
Wang C, Yang C, Chen X, Yao B, Yang C, Zhu C, et al. Altered profile of seminal plasma microRNAs in the molecular diagnosis of male infertility. Clin Chem. 2011;57:1722–31. https://doi.org/10.1373/clinchem.2011.169714.
Article
CAS
PubMedGoogle Scholar
-
Wu W, Qin Y, Li Z, Dong J, Dai J, Lu C, et al. Genome-wide microRNA expression profiling in idiopathic non-obstructive azoospermia: significant up-regulation of miR-141, miR-429 and miR-7-1-3p. Hum Reprod Oxf Engl. 2013;28:1827–36. https://doi.org/10.1093/humrep/det099.
Article
CASGoogle Scholar
-
Abu-Halima M, Hammadeh M, Backes C, Fischer U, Leidinger P, Lubbad AM, et al. Panel of five microRNAs as potential biomarkers for the diagnosis and assessment of male infertility. Fertil Steril. 2014;102:989–997.e1. https://doi.org/10.1016/j.fertnstert.2014.07.001.
Article
CAS
PubMedGoogle Scholar
-
Dabaja AA, Mielnik A, Robinson BD, Wosnitzer MS, Schlegel PN, Paduch DA. Possible germ cell-Sertoli cell interactions are critical for establishing appropriate expression levels for the Sertoli cell-specific MicroRNA, miR-202-5p, in human testis. Basic Clin Androl. 2015;25:2. https://doi.org/10.1186/s12610-015-0018-z.
Article
PubMed
PubMed CentralGoogle Scholar
-
Yao C, Yuan Q, Niu M, Fu H, Zhou F, Zhang W, et al. Distinct expression profiles and novel targets of microRNAs in human spermatogonia, pachytene spermatocytes, and round spermatids between OA patients and NOA patients. Mol Ther — Nucleic Acids. 2017;9:182–94. https://doi.org/10.1016/j.omtn.2017.09.007.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Fang N, Cao C, Wen Y, Wang X, Yuan S, Huang X. MicroRNA profile comparison of testicular tissues derived from successful and unsuccessful microdissection testicular sperm extraction retrieval in non-obstructive azoospermia patients. Reprod Fertil Dev. 2018. https://doi.org/10.1071/RD17423.
Download references
Acknowledgments
Not applicable
Funding
There are no funding sources to report.
Availability of data and materials
Not applicable
Author information
Authors and Affiliations
-
EA7404-GIG, UFR des Sciences de la Santé Simone Veil, UVSQ, Montigny le Bretonneux, France
Farah Ghieh & François Vialard
-
CHU Lille, Reproductive Biology Institute-Spermiologie-CECOS, Jeanne de Flandre Hospital, Lille, France
Valérie Mitchell
-
EA4308 “Gametogenesis and Gamete Quality”, University of Lille, Lille, France
Valérie Mitchell
-
UMR BDR, INRA, ENVA, Université Paris Saclay, Jouy en Josas, France
Béatrice Mandon-Pepin
-
Genetics Division, CHI de Poissy St Germain en Laye, Poissy, France
François Vialard
Authors
- Farah Ghieh
You can also search for this author in
PubMed Google Scholar - Valérie Mitchell
You can also search for this author in
PubMed Google Scholar - Béatrice Mandon-Pepin
You can also search for this author in
PubMed Google Scholar - François Vialard
You can also search for this author in
PubMed Google Scholar
Contributions
FG and FV: wrote the paper. BM-P and VM revised the paper. FG, BM-P, VM and FV designed the paper. All authors read and approved the final manuscript.
Corresponding author
Correspondence to
François Vialard.
Ethics declarations
Competing interests
The authors declare that they have no competing interests.
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is distributed under the terms of the Creative Commons Attribution 4.0 International License (http://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons license, and indicate if changes were made. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated.
Reprints and Permissions
About this article
Cite this article
Ghieh, F., Mitchell, V., Mandon-Pepin, B. et al. Genetic defects in human azoospermia.
Basic Clin. Androl. 29, 4 (2019). https://doi.org/10.1186/s12610-019-0086-6
Download citation
-
Received: 28 December 2018
-
Accepted: 07 March 2019
-
Published: 23 April 2019
-
DOI: https://doi.org/10.1186/s12610-019-0086-6
Keywords
- Azoospermia
- Genetic defects
- Chromosome
- Mutations
- Polymorphisms
- Epigenetics
Mots clés
- Azoospermie
- Anomalies génétiques
- Chromosome
- Mutations
- Polymorphismes
- Épigénétique