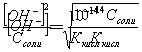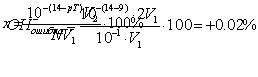В протолитометрии
различают 4 вида индикаторных
ошибок: водородная, гидроксильная,
кислотная и основная.
-
Водородная
(Н+) ошибка
возникает при титровании сильных
электролитов (сильное – сильное)
и обусловлена избытком протонов в
растворе. Эта ошибка имеет место, если
сильная кислота
недотитрована, а сильное основание
– перетитровано. -
Гидроксильная
(ОН–) ошибка
также характерна для титрования
системы сильное – сильное и возникает
при избытке гидроксо—групп
в растворе. Сильная кислота при этом
будет перетитрована, а сильное
основание – недотитровано. -
Кислотная
ошибка проявляется при титровании
слабой кислоты сильным основанием,
в том случае, когда слабая кислота
недотитрована и в растворе избыток
протонов. -
Основная ошибка
характеризует систему слабое
основание
сильная кислота в момент, когда
слабое основание недотитровано, т.е.
при избытке в растворе гидроксо-групп.
Так как при
титровании слабых электролитов в
качестве титранта обычно используют
сильный электролит (щелочь или кислоту),
то в перетитрованном растворе
избыток титранта создает погрешность
1-го или 2-го типа: водородную или
гидроксильную ошибку.
Главным критерием
применимости того или иного индикатора
является значение индикаторной ошибки,
которая не должна превышать 0,5%. Если
погрешность выше, то такой индикатор
применять нельзя.
4.3. Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая
характеристика каждого титриметрического
метода включает наиболее существенные
его особенности: приготовление и свойства
рабочих растворов, виды кривых титрования,
погрешности определения, способы
индикации точки эквивалентности и
практическое применение. На основании
этого все методы титрования
классифицируют
по 2-м признакам: типу
реакции,
лежащей в основе
метода
и способу проведения анализа.
Каждый вид титрования имеет свои
особенности и закономерности и может
осуществляться различными способами.
Как видно из схемы (рис. 4.9), в зависимости
от типа
реакции,
лежащей в основе метода, различают 4-ре
вида
титрования:
-
кислотно-основное
или метод нейтрализации (протолитометрия); -
окислительно-восстановительное
(редоксиметрия); -
комплексометрическое;
-
осадительное
(метод седиментации).

Рисунок
4.9 – Классификация методов титрования
в соответствии с типом химической
реакции (где L
– комплексный ион; МеL
– образовавшийся комплекс; А – осаждаемое
вещество, В – титрант, АВ – осадок).
4.3.1 Способы титрования.
Так как напрямую,
реакцией с титрантом, можно анализировать
далеко не любое вещество, особенно, если
оно неустойчиво на воздухе, то для
решения подобных задач было разработано
несколько приемов
(способов)
проведения анализа. Они
позволяют заменять неустойчивые,
в данных условиях соединения,
на эквивалентное количество более
устойчивого, которое не подвергается
гидролизу или окислению. Известны
следующие основные способы
проведения титриметрического анализа:
-
прямое
титрование; -
реверсивное;
-
обратное титрование
или титрование по остатку; -
косвенное
титрование или по замещению (по
заместителю).
В таблице 4.1 показаны
области применения различных способов
в зависимости от вида титрования.
Таблица 4.1 –
Применение различных видов и способов
титрования.
|
название метода |
частное название метода; (рабочий раствор) |
вещества, |
||
|
прямым |
обратным |
косвенным |
||
|
Протолито-метрия |
Ацидиметрия
(кислоты: |
основания;
соли, образован-ные сильным |
соли слабых оснований и сильных кислот; органические соединения |
|
|
Алкалиметрия
(щелочи: |
кислоты;
соли, образован-ные слабым |
|
|
|
|
Редокси-метрия |
Перманганато-метрия |
восстановители |
окислители |
вещества, реагирующие с восстанови-телями |
|
Иодометрия
( и |
восстановители |
восстановители |
окислители; кислоты |
|
|
Комплексо-метрия |
Комплексоно- метрия (ЭДТА) |
катионы, образующие с ЭДТА комплексы |
катионы в водо-нерастворимых катионы,
для которых отсутствует |
катионы, образующие с ЭДТА |
|
Метод |
Аргентометрия
( |
Анионы, образую-щие с |
катионы, образующие |
|
Рассмотрим подробнее
суть различных способов титрования.
1. Прямое
титрование заключается в
непосредственном взаимодействии
титранта и титруемого вещества. В
процессе титрования к аликвоте или
навеске вещества постепенно добавляют
раствор титранта, объем которого точно
фиксируют в Т. Э. В качестве титранта
используют рабочий раствор известной
концентрации. Расчет содержания вещества
в образце выполняют по закону эквивалентов:
=
(4.1)
где
– количество моль-эквивалентов
анализируемого вещества в титруемом
образце; а
количество
моль-эквивалентов титранта, вступившего
в реакцию с определяемым компонентом
А.
Концентрацию
компонента А в растворе вычисляют
по формуле:
(4.2)
где
– молярная концентрация эквивалента
(нормальность) титруемого раствора
(определяемого компонента), моль-экв/л;
– объем аликвоты титруемого раствора,
мл;
–
концентрация и
объем титранта в
точке эквивалентности. При титровании
методом отдельных навесок формула
(4.2) преобразуется в выражение (4.3):
(4.3)
Метод применяется
во всех случаях, когда нет каких-либо
ограничений. Например, при анализе
кислот, определении жесткости воды.
2. Реверсивное
титрование – это разновидность
прямого титрования, когда рабочий и
титруемый растворы меняют местами. В
этом случае для анализа отбирают
аликвоты рабочего раствора, а в Т.Э.
измеряют израсходованный на
титрование объем анализируемого
раствора. Вычисления проводят также,
как и в прямом титровании, по формулам
(4.2) или (4.3). Метод позволяет ограничить
площадь поверхности раствора,
контактирующей с воздухом, при
стандартизации относительно неустойчивых
соединений, как например NaOH.
Титрование по
заместителю (косвенное) и титрование
по остатку (обратное) основаны
на использовании вспомогательного
раствора, взаимодействующего с
определяемым компонентом. Такой прием
позволяет выполнять анализ химически
нестойких объектов или же при отсутствии
подходящего индикатора.
В косвенном
титровании сначала осуществляют
реакцию определяемого вещества
А со вспомогательным раствором
В, а затем титруют
эквивалентное количество
образовавшегося продукта реакции
С (заместитель). Этот способ
можно представить в виде схемы: А + В
С + (т-т) , исходя из которой запишем
выражение для закона эквивалентов:
=
=
.
(4.4)
Из равенства (4.4)
следует, что
=
и расчет можно также выполнять по
формулам (4.2) и (4.3), используемых для
прямого титрования. Для полноты реакции
вспомогательный раствор всегда берут
с небольшим избытком. Такой метод
титрования реализуется в йодометрии.
В обратном
титровании также сначала протекает
реакция между определяемым
веществом А и
взятым в избытке вспомогательным
раствором В, но затем титруют
остаток не прореагировавшего
вспомогательного раствора. Поэтому
необходимо точно знать концентрацию
вспомогательного раствора В и его
объем, взятый для анализа. Определение
компонента А выполняется согласно
схеме: А + В
Вост + (т-т). Исходя из
условий титрования, закон эквивалентов
можно записать в виде:
–
=
.
(4.5)
Откуда имеем:
=
.
(4.6)
Если все вещества
взяты в виде растворов, то формула (4.6)
примет вид
(4.7)
Если хотя бы одно
из веществ взято в сухом виде (известна
его масса), то следует воспользоваться
выражением (4.6) и записать значение
для каждого из веществ индивидуально.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
|
|
Макеты страниц
Индикаторная ошибка. Изменение цвета индикатора происходит не абсолютно точно в точке эквивалентности, а раньше или позже, поэтому химик-аналитик допускает некоторую ошибку, прекращая титрование раньше или позже требуемого момента. Такую ошибку называют индикаторной ошибкой. Величина ее может колебаться в самых широких пределах в зависимости от того, насколько удачно выбран примененный индикатор.
Предположим, что для титрования 0,1 н. раствора слабой кислоты с 




В случае прибавления к титруемой кислоте метилового оранжевого раствор окрасится в красный цвет. Вскоре после прибавления первых порций сильного основания 

Если же к титруемой кислоте прибавить фенолфталеин, то раствор будет оставаться бесцветным до тех пор, пока по мере прибавления к нему щелочи 


Так как в точке эквивалентности 


Таким образом, если индикатор выбран правильно, то индикаторную ошибку не принимают во внимание; если же индикатор выбран неправильно, то индикаторная ошибка превышает допустимые погрешности и может достигать очень большой величины. В случаях, требующих более точных результатов, следует учитывать индикаторные ошибки.
Типы индикаторных ошибок. К индикаторным ошибкам относят такие, которые вызываются недотитрованием или перетитрованием исследуемого раствора. В методе нейтрализации различают несколько типов индикаторных ошибок.
а) Водородная ошибка титрования, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов водорода, остающихся в растворе в результате недотитрования сильной кислоты сильной щелочью (обозначается 

б) Гидроксильная ошибка титрования, вызываемая наличием в титруемом растворе по окончании титрования избытка ионов гидроксила, остающихся в растворе в результате недотитрования сильного основания сильной кислотой (

в) Кислотная ошибка титрования, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованной слабой кислоты (
г) Щелочная ошибка титрования, вызываемая присутствием в титруемом растворе по окончании титрования нейтральных молекул недотитрованного слабого основания (
Примеры вычисления ошибок титрования. 




Пусть концентрация титруемой кислоты 


Каждый миллилитр 0,1 н. раствора кислоты или щелочи содержит 


Неоттитрованных ионов водорода 




Величину 



В нашем примере






Концентрация щелочи к концу титрования составит:

или

В 

Эта величина и составляет гидроксильную ошибку титрования, обусловливаемую перетитрованием кислоты щелочью.
В процентах:

В нашем примере (при 

Это означает, что при титровании сильной кислоты сильным основанием в присутствии метилового оранжевого изменение окраски индикатора наступает раньше, а при титровании в присутствии фенолфталеина (при условии отсутствия в растворе 
Так как величина концентрации титруемого раствора входит в знаменатель дроби, то ошибка титрования будет тем больше, чем менее концентрированный раствор титруют.
Поэтому, чтобы избежать больших ошибок титрования, не следует титровать слишком разбавленные растворы очень разбавленными титрантами.
Влияние области интервала перехода индикатора на величину ошибки титрования. При титровании оснований в присутствии индикатора метилового оранжевого 
Если 


При 


При титровании кислоты в присутствии фенолфталеина 


При 

Поэтому, чтобы избежать слишком больших ошибок титрования, не следует применять при титровании кислот индикаторы, интервалы перехода которых лежат выше 
Гидроксильная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор с 



Каждый миллилитр 0,1 н. раствора основания содержит г-экв.
Для титрования взято 




Концентрация ионов гидроксила в конце титрования составит 

В 

Эта величина и составляет гидроксильную ошибку титрования, обусловленную недотитрованием ОН «
Величину 

В нашем примере

Если выполнять титрование в присутствии индикатора с 
Водородная ошибка титрования. Предположим, что для титрования сильного основания сильной кислотой выбран индикатор 

В процентах



Если 

Кислотная ошибка титрования. Предположим, что для титрования дана слабая кислота 


или

Так как 






Отношение можно рассматривать как отношение концентраций неоттитрованной части кислоты к оттитрованной ее части и считать это отношение критерием кислотной ошибки титрования. В нашем примере 





Пример. Вычислите ошибку титрования 0,1 н. раствора 



Следовательно, на каждую оттитрованную молекулу 

Это значит, что 85% кислоты будет не оттитровано, если титровать 



Щелочная ошибка титрования. Предположив, что для титрования дано слабое основание КЮН, щелочную ошибку титрования вычисляют аналогично кислотной ошибке:

Пример. Вычислите ошибку титрования 0,1 н. раствора аммиака 



Следовательно, на каждую оттитрованную молекулу 

Это значит, что около 35% аммиака будет не оттитровано, если его титровать раствором 


Оглавление
- ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- § 1. Понятие о количественном анализе
- § 2. Классификация методов количественного анализа
- § 3. Характеристика методов количественного анализа
- § 4. Анализ больших и малых количеств вещества
- § 5. Отбор средней пробы
- § 6. Подготовка вещества для взвешивания
- § 7. Взвешивание
- § 8. Техника взвешивания на аналитических весах
- § 9. Правила обращения с аналитическими весами
- § 10. Приготовление раствора для анализа
- § 11. Запись результатов анализа
- Часть первая. Объемный анализ
- § 1. Сущность объемного анализа
- § 2. Общее уравнение реакции титрования и выводы из него
- Б. ТЕХНИКА ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА В ОБЪЕМНОМ АНАЛИЗЕ
- § 3. Измерение объемов растворов
- § 4. Посуда, применяемая для измерения объемов растворов
- § 5. Работа с мерными колбами
- § 6. Работа с пипетками
- § 7. Работа с бюретками
- § 8. Приготовление стандартных растворов
- В. ВЫЧИСЛЕНИЯ В ОБЪЕМНОМ АНАЛИЗЕ
- § 9. Концентрация растворов и способы ее выражения
- § 10. Способы вычисления в объемном анализе
- § 11. Связь между точностью измерений и точностью вычислений
- § 12. Краткие сведения о статистической обработке экспериментальных данных
- Г. ПОЛУМИКРООБЪЕМНЫЙ МЕТОД АНАЛИЗА
- § 13. Понятие о полумикрообъемном анализе
- § 14. Особенности техники измерения объемов растворов в полумикрометоде
- Д. БЕЗБЮРЕТОЧНЫЕ МЕТОДЫ ТИТРОВАНИЯ
- § 15. Понятие о безбюреточных методах титрования
- § 16. Классификация методов безбюреточного титрования
- Е. АВТОМАТИЧЕСКИЕ МЕТОДЫ
- § 17. Химико-аналитический контроль производства
- § 18. Автоматические методы титрования
- ГЛАВА II. МЕТОДЫ НЕЙТРАЛИЗАЦИИ, ИЛИ МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
- § 1. Характеристика метода
- § 2. Установление точки эквивалентности
- § 3. Графический метод изображения процесса нейтрализации
- § 4. Вычисление концентрации ионов водорода в водных растворах сильных кислот и оснований
- § 5. Вычисление активности ионов водорода в водных растворах сильных кислот и оснований
- § 6. Титрование сильной кислоты сильным основанием
- § 7. Вычисление концентрации ионов водорода в растворах слабых кислот и оснований
- § 8. Вычисление активности ионов водорода в водных растворах слабых кислот и оснований
- § 9. Равновесия в водных буферных растворах слабых кислот в присутствии солей этих кислот
- § 10. Равновесия в водных буферных растворах слабых оснований в присутствии солей этих оснований
- § 11. Вычисление концентрации ионов водорода в водных буферных растворах
- § 12. Вычисление активности ионов водорода в водных буферных растворах
- § 13. Вычисление концентрации ионов водорода и степени гидролиза в водных растворах гидролизующихся бинарных солей
- § 14. Вычисление активности ионов водорода в водных растворах гидролизующихся бинарных солей
- § 15. Титрование слабой кислоты сильным основанием
- § 16. Титрование слабого основания сильной кислотой
- § 17. Титрование многоосновных кислот
- § 18. Титрование солей, образованных катионами сильных оснований и анионами слабых многоосновных кислот
- § 19. Изменение активности и показателя активности ионов водорода в процессе титрования водных растворов кислот и оснований
- § 20. Выводы, вытекающие из рассмотрения кривых нейтрализации
- § 21. Индикаторы
- § 22. Интервал перехода индикатора
- § 23. Выбор индикатора
- § 24. Ошибки титрования
- Б. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 25. Организация рабочего места
- § 26. Приготовление стандартных (титрованных) растворов
- § 27. Приготовление 0,1 н. раствора хлористоводородной кислоты
- § 28. Установка титра 0,1 н. раствора хлористоводородной кислоты
- § 29. Приготовление 0,1 н. раствора едкого натра
- § 30. Установка титра 0,1 н. раствора едкого натра
- § 31. Определение карбонатов
- § 32. Определение содержания H2SO4 в технической серной кислоте
- § 33. Определение содержания уксусной кислоты
- § 34. Определение содержания Na2CO3 и NaOH при их совместном присутствии
- § 35. Определение содержания Na2CO3 и NaHCO3 при их совместном присутствии
- § 36. Определение жесткости воды
- § 37. Определение аммонийного азота в солях аммония
- § 38. Определение содержания фосфорной кислоты
- В. КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ В НЕВОДНЫХ СРЕДАХ
- § 39. Неводные растворы
- § 40. Современные представления о кислотах и основаниях
- § 41. Диссоциация электролитов в неводных растворах
- § 42. Влияние неводных растворителей на силу кислот и оснований
- § 43. Применение закона действия масс к растворам сильных электролитов
- § 44. Титрование кислот и оснований в неводных растворах
- § 45. Методы кислотно-основного титрования в неводных средах
- § 46. Примеры практических определений в неводных растворах
- ГЛАВА III. МЕТОДЫ ОКИСЛЕНИЯ—ВОССТАНОВЛЕНИЯ (ОКСИДИМЕТРИЯ, ОКСРЕДМЕТРИЯ, РЕД-ОКС-МЕТОДЫ)
- § 1. Значение окислительно-восстановительных потенциалов
- § 2. Реакции окисления—восстановления и комплексообразования
- § 3. Примеры окислительно-восстановительного титрования
- § 4. Константы равновесия окислительно-восстановительных реакций
- § 5. Связь между константами равновесия окислительно-восстановительных реакций и нормальными потенциалами
- § 6. Вычисление констант равновесия окислительно-восстановительных реакций
- § 8. Зависимость скорости реакций окисления—восстановления от различных факторов
- § 9. Графический метод изображения процесса окисления—восстановления
- § 10. Фиксирование точки эквивалентности в методах окисления—восстановления
- § 11. Окислительно-восстановительные индикаторы (ред-окс-индикаторы)
- Б. ПЕРМАНГАНАТОМЕТРИЯ
- § 12. Основы перманганатометрии
- § 13. Титрование перманганатом в кислой среде
- § 14. Титрование перманганатом в щелочной среде
- § 15. Приготовление стандартного (титрованного) раствора перманганата калия
- § 16. Установка титра стандартного раствора перманганата калия
- § 17. Установка титра и нормальности раствора перманганата калия по оксалату аммония
- § 18. Вещества, определяемые методом перманганатометрии
- ОПРЕДЕЛЕНИЕ ВОССТАНОВИТЕЛЕЙ
- § 19. Определение щавелевой кислоты и оксалатов
- § 20. Определение соединений железа (II)
- § 21. Определение содержания металлического железа в присутствии окислов железа
- § 22. Определение азотистой кислоты и нитритов
- § 23. Определение содержания марганца (II) в рудах
- ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЕЙ
- § 24. Определение соединений железа (III)
- § 25. Определение нитратов
- § 26. Определение бихроматов
- § 27. Определение содержания MnO2 в пиролюзите
- ОПРЕДЕЛЕНИЕ ДРУГИХ ВЕЩЕСТВ
- § 28. Определение ионов кальция
- В. ИОДОМЕТРИЯ
- § 29. Основы иодометрии
- § 30. Методы иодометрического титрования
- § 31. Преимущества и недостатки иодометрического метода
- § 32. Приготовление стандартного (титрованного) раствора тиосульфата и установка его титра
- § 33. Приготовление стандартного (титрованного) раствора иода и установка его титра
- МЕТОДЫ ПРЯМОГО ТИТРОВАНИЯ
- § 34. Определение мышьяка (III)
- МЕТОДЫ ОБРАТНОГО ТИТРОВАНИЯ
- § 35. Определение сульфита натрия
- § 36. Определение содержания формальдегида в формалине
- МЕТОДЫ КОСВЕННОГО ОПРЕДЕЛЕНИЯ
- § 37. Определение ионов меди (II)
- § 38. Определение двуокиси свинца в сурике
- МЕТОД ТИТРОВАНИЯ ЗАМЕСТИТЕЛЕЙ
- § 39. Определение содержания двуокиси марганца в пиролюзите
- МЕТОД ОПРЕДЕЛЕНИЯ КИСЛОТ
- § 40. Определение хлористоводородной кислоты
- § 41. Определение воды по Фишеру
- Г. ПОНЯТИЕ О ДРУГИХ МЕТОДАХ ОКИСЛЕНИЯ — ВОССТАНОВЛЕНИЯ
- § 42. Хроматометрия
- § 43. Определение содержания железа (II)
- § 44. Цериметрия
- § 45. Броматометрия
- § 46. Ванадатометрия
- § 47. Аскорбинометрия
- § 48. Титанометрия
- ГЛАВА IV. МЕТОДЫ ОСАЖДЕНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ
- § 1. Общая характеристика методов
- § 2. Классификация методов осаждения и комплексообразования
- § 3. Применение теории осаждения к объемному анализу
- § 4. Вычисление растворимости электролитов в воде с учетом коэффициентов активности
- § 5. Влияние одноименных ионов на растворимость малорастворимого электролита
- § 6. Солевой эффект
- § 7. Влияние концентрации ионов водорода на растворимость малорастворимых соединений
- § 8. Кривые титрования в методе осаждения
- § 9. Общие выводы, вытекающие из рассмотрения кривых осаждения
- § 10. Адсорбционные явления, наблюдаемые при титровании по методу осаждения
- Б. АРГЕНТОМЕТРИЯ
- § 11. Характеристика метода
- § 12. Приготовление 0,1 н. раствора нитрата серебра
- § 13. Приготовление стандартного раствора хлорида натрия
- § 14. Установка титра 0,1 н. раствора нитрата серебра по точной навеске хлорида натрия
- §15. Определение ионов хлора в техническом хлориде натрия по методу Мора
- § 16. Определение хлоридов по методу Фаянса
- В. РОДАНОМЕТРИЯ
- § 17. Характеристика метода
- § 18. Приготовление 0,1 н. раствора роданида аммония
- § 19. Определение ионов хлора в растворимых хлоридах по методу Фольгарда
- § 20. Определение серебра в сплавах
- Г. МЕРКУРИМЕТРИЯ
- § 21. Характеристика метода
- § 22. Приготовление 0,1 н. раствора нитрата ртути (II)
- § 23. Установка титра раствора нитрата ртути (II)
- § 24. Определение ионов хлора в воде меркуриметрическим методом
- Д. МЕРКУРОМЕТРИЯ
- § 25. Краткая характеристика метода
- Е. КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ)
- § 26. Характеристика метода
- § 27. Теоретические основы комплексонометрического титрования
- § 28. Классификация методов комплексонометрического титрования
- § 29. Установка титра раствора комплексона III
- § 30. Определение содержания кальция
- § 31. Определение жесткости воды комплексонометрическим методом
- § 32. Анализ смеси ионов кальция и магния
- § 33. Определение содержания алюминия
- § 34. Раздельное определение ионов кальция и алюминия
- § 35. Раздельное определение ионов алюминия и железа
- Часть вторая. Весовой анализ
- § 1. Сущность весового анализа
- § 2. Классификация методов весового анализа
- § 3. Расчеты в весовом анализе
- Б. ТЕХНИКА ВЕСОВОГО АНАЛИЗА
- § 4. Взятие и растворение навески
- § 5. Техника осаждения
- § 6. Фильтрование и промывание осадков
- § 7. Получение весовой формы
- § 8. Взвешивание весовой формы
- В. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
- § 9. Теоретические основы выделения осадков из растворов с помощью специфических неорганических и органических реактивов
- § 10. Требования, предъявляемые к осадкам
- § 11. Методы повышения точности весовых определений
- § 12. Теоретические обоснования выбора оптимальных условий для весового определения
- Г. ПРАКТИЧЕСКАЯ ЧАСТЬ
- § 13. Определение кристаллизационной воды в BaCl2 2H2O
- § 14. Определение сульфат-ионов или серы
- § 15. Определение ионов железа (III)
- § 16. Определение содержания кальция в карбонате кальция
- § 17. Определение содержания магния
- § 18. Определение ионов хлора в растворимых хлоридах или в хлористоводородной кислоте
- § 19. Анализ силикатов
- § 20. Анализ доломита
- § 21. Анализ бронзы и латуни
- Д. МЕТОДЫ ВЕСОВЫХ ОПРЕДЕЛЕНИЙ, ОСНОВАННЫЕ НА ПРИМЕНЕНИИ ОРГАНИЧЕСКИХ РЕАКТИВОВ
- § 22. Определение никеля
- § 23. Определение алюминия
- Часть третья. Понятие о физических и физико-химических (инструментальных) методах анализа
- § 1. Электрохимические методы
- § 2. Спектральные (оптические) методы
- § 3. Хроматографические методы
- § 4. Радиометрические методы
- § 5. Масс-спектрометрические методы
- ГЛАВА VII ЭЛЕКТРОВЕСОВЫЕ МЕТОДЫ АНАЛИЗА
- § 1. Характеристика методов электроанализа
- § 2. Химические процессы, протекающие при электролизе
- § 3. Методы электроанализа
- § 4. Электровесовой анализ
- § 5. Метод внутреннего электролиза
- § 6. Определение меди в растворе сульфата меди с применением платиновых сетчатых электродов
- § 7. Определение меди и свинца в латуни с применением платиновых сетчатых электродов
- § 8. Определение малых количеств меди методом внутреннего электролиза
- ГЛАВА VIII. ОБЪЕМНЫЕ ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Особенности объемных электрохимических методов анализа
- § 2. Кондуктометрическое титрование
- § 3. Высокочастотное титрование
- § 4. Потенциометрическое титрование
- § 5. Полярографический метод анализа
- § 6. Амперометрическоб титрование
- § 7. Кулонометрическое титрование
- ГЛАВА IX. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Понятие об эмиссионном спектральном анализе
- Б. КОЛОРИМЕТРИЯ
- § 2. Особенности колориметрических методов анализа
- § 3. Характеристика колориметрических методов анализа
- В. ОПТИЧЕСКИЕ МЕТОДЫ УСТАНОВЛЕНИЯ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
- § 4. Спектрофотометрическое титрование
- § 5. Фототурбидиметрическое и фотонефелометрическое титрование
- Г. ЛАБОРАТОРНЫЕ РАБОТЫ
- § 6. Определение содержания ионов железа методом колориметрического титрования
- § 7. Определение содержания титана
- ГЛАВА X. МЕТОДЫ РАЗДЕЛЕНИЯ, ВЫДЕЛЕНИЯ И КОНЦЕНТРИРОВАНИЯ ОТДЕЛЬНЫХ КОМПОНЕНТОВ АНАЛИЗИРУЕМЫХ СМЕСЕЙ
- § 1. Определение следов элементов (микропримесей)
- § 2. Метод осаждения малорастворимых соединений
- § 3. Электрохимические методы разделения
- § 4. Метод экстрагирования
- § 5. Методы отгонки летучих соединений
- § 6. Хроматографические методы разделения
- § 7. Метод флотации
Тетриметрия
Тетриметрия
Содержание:
1. Основные понятия тетриметрии:
1.1 Сущность титрования;
1.2 Стандартные растворы;
1.3 Кривые титрования;
1.4 Индикаторы.
2. Кислотно-основное титрование:
2.1 Расчеты рН;
2.2 Таблица;
2.3 Кривая титрования;
2.4 Погрешности титрования;
2.5 Выводы;
3. Используемая литература.
Основные понятия тетриметрии.
Сущность титрования.
Процесс приливания одного раствора, находящегося в бюретке, к другому раствору для определения концентрации одного
из них при известной концентрации другого называется титрованием.
Взаимодействие между определенным веществом и реактивом должно идти в определенных стехиометрических отношениях. Отклонение
от этого требования наблюдается в ряде случаев; чаще всего причиной этих ограничений являются следующие обстоятельства:
1. Особенности самого определяемого вещества, которое взаимодействует с реактивом не только по одному уравнению основной реакции, то
есть наряду с основной реакцией идут побочные процессы.
2. Присутствие посторонних веществ, которые также реагируют с другим реактивом.
Реакция между определяемым веществом и реактивом должна идти с большей скоростью, что особенно важно в прямом
титровании.
Одно из важных условий применения реакции – найти подходящий индикатор для определения конца титрования.
Стандартные растворы.
Стандартными растворами называются растворы с точно известной концентрацией. Существует два способа их приготовления:
1. Берут на аналитических весах точную навеску соответствующего вещества, растворяют ее в мерной колбе и доводят объем
раствора водой до метки. Этим способом можно готовить титрованные растворы только тех веществ, которые удовлетворяют ряду требований:
1.1 Вещество должно быть химически чистым, т.е. не должно содержать посторонних примесей в
таких количествах, которые могут повлиять на точность анализов (не более 0,05-0,1%).
1.2 Состав вещества должен строго соответствовать формуле. Например, кристаллогидраты должны содержать ровно
столько воды, сколько соответствует их формулам.
1.3 Вещество должно быть устойчивым при хранении и в твердом виде и в растворе, т.к. иначе
легко нарушилось бы соответствие состава формуле.
2. Если вещество не удовлетворяет перечисленным выше требованиям , то сначала готовят раствор его приблизительно нужной молярности.
Параллельно с этим готовят также стандартный раствор какого-нибудь подходящего исходного вещества, как описано выше. Далее, оттитровав один из указанных
растворов другим и зная концентрацию раствора исходного вещества, вычисляют точную концентрацию раствора данного
вещества.
Кривые титрования.
Кривые титрования являются графическим изображением изменений рН раствора при постепенном прибавлении
рабочего раствора к определенному количеству испытуемого раствора. На оси абсцисс записывают количество прибавленного рабочего раствора, а на оси ординат
– значение рН раствора. Отдельные точки кривой титрования рассчитывают по обычным формулам для вычисления рН растворов соответствующих электролитов.
Индикаторы.
При титровании необходимо установить количество рабочего раствора, эквивалентное количеству
определяемого вещества. Для этой цели к исследуемому раствору приливают постепенно титрант до тех пор, пока не будет достигнуто эквивалентное
отношение. Этот момент называется точкой эквивалентности. Признаком достижения точки эквивалентности служит приобретение раствором определенного
значения рН. Поэтому в качестве индикаторов метода нейтрализации служат вещества, окраска которых меняется в зависимости от изменения величины рН. К
ним относятся лакмус, метиловый оранжевый, фенолфталеин и многие другие вещества. Окраска каждого из них изменяется внутри определенного узкого
интервала значений рН, причем этот интервал зависит только от свойств данного индикатора и совершенно не зависит от природы реагирующих между собой кислоты и
основания. Благодаря этому перемена окраски индикатора происходит, как правило, не строго в точке эквивалентности, а с известным отклонением от нее. Такое
отклонение влечет за собой некоторую ошибку, называемую индикаторной ошибкой титрования. Величина этой ошибки может колебаться в весьма широких пределах
в зависимости от того, какой взят индикатор и какие основание и кислота реагируют между собой. При правильном выборе индикатора ошибка не выходит за
обычные пределы аналитических погрешностей и может во внимание не приниматься. Наоборот, если индикатор взят
неподходящий, ошибка окажется весьма значительной.
Момент титрования, когда индикатор изменяет свою окраску, называется точкой конца
титрования. Необходимо выбирать индикатор и условия титрования так, чтобы точка конца титрования совпадала с точкой эквивалентности или была, возможно,
ближе к ней.
Кислотно-основное титрование
Расчеты рН
При вычислении рН исходят из уравнения константы диссоциации слабой кислоты:
В начальный момент бензойная кислота в растворе
частично диссоциирована по уравнению:
откуда видно, что на каждый образующийся ион Н+
в растворе приходится один ион С6Н5СОО—. Следовательно, концентрации их равны:
Т.к. степень диссоциации бензойной кислоты очень
мала, можно принять, что:
где Скисл есть общая концентрация
бензойной кислоты в растворе, равная 0,1 М.
Учитывая это, из уравнения (1) получим:
и
Чтобы от [H+] перейти
к рН, прологарифмируем уравнение (2) и переменим знаки логарифмов на обратные. При этом получим:
или
Здесь рКкисл=-lgKкисл
представляет собой показатель индикатора, который равен:
Отсюда по формуле (3) находим:
Такова величина рН 0,1 м раствора бензойной кислоты, соответствующая начальной точке
рассматриваемой кривой титрования.
Вывод формул для вычисления промежуточных точек кривой титрования. Эти точки соответствуют моментам, когда оттитрована, т.е.
превращена в соль, только та или иная часть общего количества титруемой кислоты. Следовательно, раствор здесь содержит свободную слабую кислоту (С6Н5СООН)
и ее соль (С6Н5СООNa). Чтобы вычислить рН для таких растворов, решим
уравнение константы диссоциации бензойной кислоты относительно [H+]. При этом получим:
Но С6Н5СООН – слабая кислота и присутствует почти исключительно в виде недиссоциированных молекул С6Н5СООН.
Поэтому концентрацию последних можно без заметной погрешности принять равной общей концентрации кислоты в растворе:
С другой стороны, поскольку соль С6Н5СООNa диссоциирована нацело, а бензойная кислота
диссоциирована очень слабо, почти все имеющиеся в растворе анионы С6Н5СОО—
получены в результате диссоциации соли, причем каждая продиссоциировавшая молекула соли дает один анион С6Н5СОО—. Отсюда
следует, что концентрацию анионов можно принять равной общей концентрации соли:
Из этого уравнения получим:
Логарифмируя это уравнение и переменив знаки на обратные, получим:
откуда
Расчет для точки, когда прибавлена титранта 90
мл. 0,1 м NaОН:
Состав раствора: 10 мл. 0,1 м С6Н5СООН
90 мл. 0,1 м С6Н5СООNa
По формуле С1V1=C2V2 получим:
Особый практический интерес представляет область
скачка на кривой титрования. Она лежит в пределах значений рН от момента, когда оставалось 0,1 мл неоттитрованной свободной бензойной кислоты, до момента,
когда прибавлена 0,1 мл избытка щелочи.
Расчет для точки, когда прибавлена титранта 99,9 мл. 0,1 м NaОН:
Состав раствора: 0,1 мл. 0,1 м С6Н5СООН
99,9 мл. 0,1 м С6Н5СООNa
По формуле С1V1=C2V2 получим:
Вывод формул для вычисления рН в точке эквивалентности. В растворе присутствует соль С6Н5СООNa, которая частично гидролизирована по уравнению:
Применяя к этой обратимой реакции закон действия масс,
напишем:
Концентрацию воды можно считать практически постоянной:
Произведение К[H2O] представляет собой также постоянную величину, называемую константой гидролиза. Из выражения:
получим:
Подставив полученную величину [OH—] в уравнение Кгидр, получим:
Но дробь [C6H5COOH]/[C6H5COO—][H+] представляет собой величину, обратную Ккисл
; она равна 1/Ккисл. Следовательно, можно написать:
и
Согласно ионному уравнению реакции, при гидролизе на каждый образующийся ион OH— в растворе появляется одна молекула С6Н5СООН,
откуда:
В то же время, поскольку диссоциация С6Н5СООН
дает мало ионов С6Н5СОО— , можно принять, что:
Учитывая это, получим:
и
Логарифмируя и меняя у логарифмов знаки на обратные, находим:
и
Но рН=14-рОН. Отсюда окончательно находим
формулу для вычисления величины рН в точке эквивалентности:
Расчет для точки, когда прибавлена титранта
100,0 мл. 0,1 м NaОН:
Состав раствора: 0 мл. 0,1 м С6Н5СООН
100,0 мл. 0,1 м С6Н5СООNa
Вычисления рН для тех моментов титрования, когда
к раствору прибавлен избыток NaOH.
Расчет для точки, когда прибавлена титранта 100,1 мл. 0,1 м NaОН:
Состав раствора: 0,1 мл. 0,1 м NaOH
100,0 мл. 0,1 м С6Н5СООNa
т.к. NaOH – сильная щелочь, то [OH—]=C(NaOH).
C1V1=C2V2
Расчет для точки, когда прибавлена титранта 110,0 мл. 0,1 м NaОН:
Состав раствора: 10 мл. 0,1 м NaOH
100,0 мл. 0,1 м С6Н5СООNa
C1V1=C2V2
Таблица
Расчет кривой титрования.
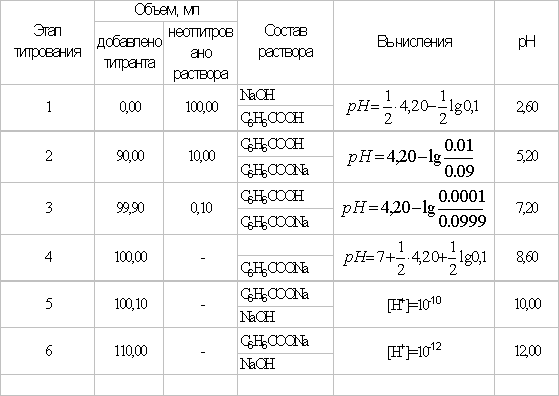
Кривая титрования
При титровании бензойной кислоты, из индикаторов может быть применен только фенолфталеин, т.к.
константа диссоциации его равна 10-9, область перехода должна лежать между рН=8 и рН=10, что и наблюдается в действительности. При этом вплоть до
рН=8 будет наблюдаться окраска кислотной формы индикатора, т.е. раствор будет бесцветным, а начиная рН=10 – окраска щелочной формы, т.е. красная.
Индикаторная ошибка титрования
Индикаторная ошибка титрования представляет собой ту погрешность, которая обусловлена несовпадением показателя титрования
примененного индикатора с величиной рН в точке эквивалентности. Избыточное основание является сильным, оно обуславливает возникновение «гидроксильной
ошибки».
Всего взято на титрование NV1/100 ионов ОН—. Заканчивается титрование
при рН=рТ индикатора. Следовательно, по окончании титрования:
и в V2 мл раствора содержится:
ионов ОН—.
Отсюда NV1/1000 – 100% и:
Следовательно ОН— ошибка равна:
Применяя фенолфталеин, заканчивают титрование при рН=9, т.е. раствор бензойной
кислоты будет несколько перетитрован.
Выводы
1. Точка эквивалентности находится в области рН>7, (рН=8,60).
2. Скачок рН на кривой титрования находится в области от рН=7,20 (при 0,1 мл избытка кислоты) до рН=10
(при 0,1 мл избытка щелочи).
3. При титровании бензойной кислоты гидроксидом натрия с фенолфталеином происходит легко уловимый переход
окраски от бесцветной к розовой. Поэтому порядок титрования здесь не имеет такого значения, как при употреблении метилоранжа.
4. Чем слабее титруемая кислота, тем меньше скачок рН на кривой титрования. Слабая кислота создает
малую концентрацию [H+].
5. На величину скачка влияет ряд факторов:
А. Константа равновесия реакции
Б. Температура
В. Концентрация веществ
Г. Ионная сила раствора
Использованная литература
1. Ю.Ю. Лурье, Справочник по аналитической химии.-М: химия, 1989.
2. В.Н. Алексеев, Количественный анализ. –М: химия, 1972
3. Н.Н. Ушакова, Е.Р. Николаева, С.А. Моросанова, Пособие по аналитической химии: Количественный
анализ. –М: Изд.МГУ, 1981
4. А.К.Бабко, И.В. Пятницкий, Количественный анализ. –М: 1962
5. А.Т Пилипенко, И.В. Пятницкий, Аналитическая химия, т. 1,2 – М: химия, 1990
6. Ю.А. Золотов Основы аналитической химии. – М: Высшая школа, 2000