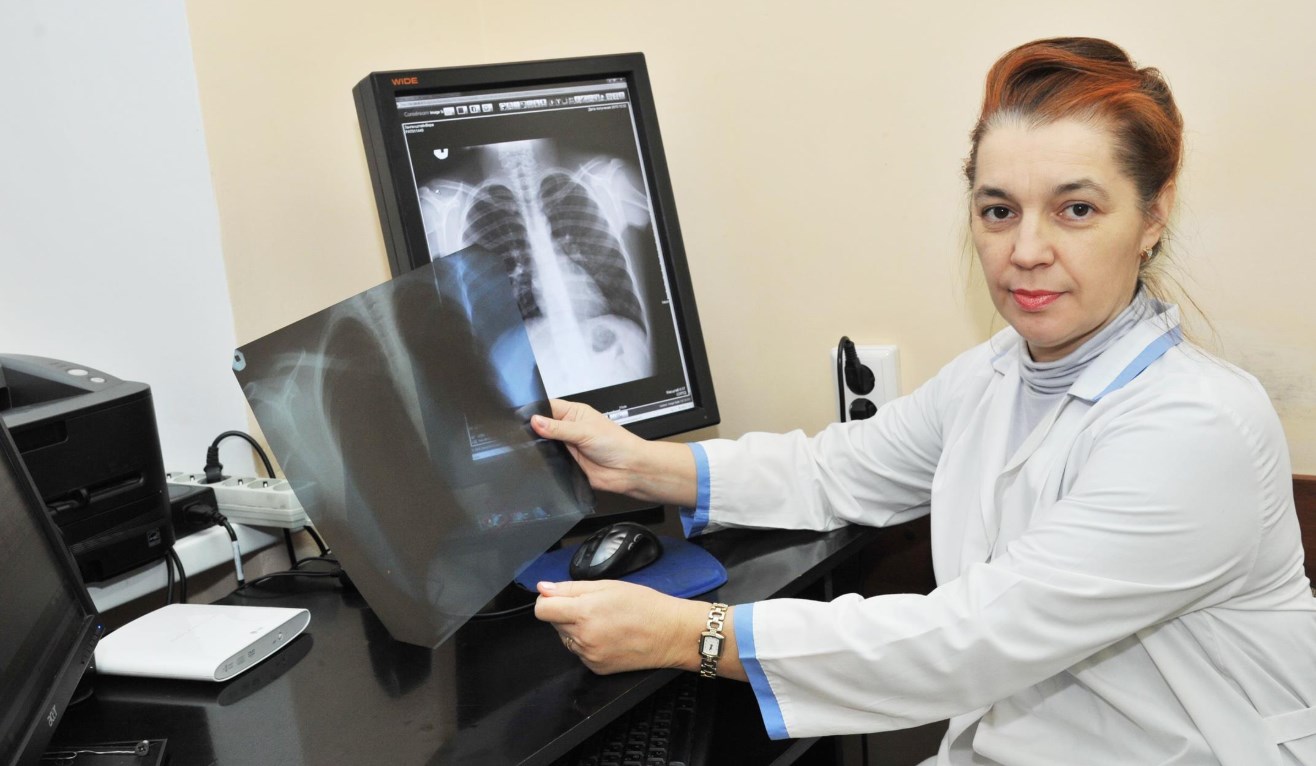
Согласно историческим источникам, еще много тысячелетий назад наши предки, столкнувшись с болезнями, вызываемыми микроорганизмами, боролись с ними доступными средствами. Со временем человечество начало понимать, почему те или иные используемые издревле лекарства способны воздействовать на определенные болезни, и научилось изобретать новые лекарства. Сейчас объем средств, используемых для борьбы с патогенными микроорганизмами, достиг особо крупных масштабов, по сравнению даже с недавним прошлым. Давайте рассмотрим, как на протяжении своей истории человек, порой того не подозревая, использовал антибиотики, и как, по мере накопления знаний, использует их сейчас.
Бактерии появились на нашей планете, по разным оценкам, приблизительно 3,5–4 миллиарда лет назад, задолго до эукариот [1]. Бактерии, как и все живые существа, взаимодействовали друг с другом, конкурировали и враждовали. Мы не можем точно сказать, использовали ли они уже тогда антибиотики, чтобы победить других прокариот в схватке за лучшую среду или питательные вещества. Но существуют доказательства наличия генов, кодирующих устойчивость к бета-лактаму, тетрациклину и гликопептидным антибиотикам, в ДНК бактерий, которые находились в древнем пермафросте возрастом 30 000 лет [2].
С момента, который принято считать официальным открытием антибиотиков, прошло чуть менее ста лет, но проблема создания новых антимикробных препаратов и использования уже известных при условии быстро возникающей резистентности к ним тревожит человечество не последние пятьдесят лет. Неспроста в своей Нобелевской речи первооткрыватель пенициллина Александр Флеминг предупреждал, что к использованию антибиотиков нужно подходить серьезно.
Так же, как и момент открытия антибиотиков человечеством на несколько миллиардов лет отсрочен от изначального их появления у бактерий, так и история использования человеком антибиотиков началась задолго до их официального открытия. И речь идет не о предшественниках Александра Флеминга, живших в 19 веке, а о совсем далеких временах.
Использование антибиотиков в древности
Еще в Древнем Египте плесневелый хлеб использовали для дезинфекции порезов (видео 1). Хлеб с плесневыми грибками в лечебных целях применяли и в других странах и, видимо, вообще во многих древних цивилизациях. Например, в Древней Сербии, Китае и Индии для предотвращения развития инфекций его прикладывали к ранам. Судя по всему, жители этих стран независимо друг от друга пришли к выводу о целебных свойствах плесени и использовали ее для лечения ран и воспалительных процессов на коже. Древние египтяне прикладывали к гнойникам на коже головы корки плесневелого пшеничного хлеба и считали, что использование этих средств поможет умилостивить духов или богов, ответственных за болезни и страдания.
Видео 1. Причины появления плесени, ее вред и польза, а также применение в медицине и перспективы использования в будущем
Жители Древнего Египта для лечения ран использовали не только хлеб с плесенью, но и самостоятельно изготовленные мази. Есть информация о том, что примерно в 1550 г. до н.э. они готовили смесь из свиного сала и меда, которую наносили на раны и перевязывали специальной тканью. Такие мази обладали некоторым антибактериальным эффектом в том числе благодаря содержащейся в меде перекиси водорода [3], [4]. Египтяне не были первопроходцами в использовании меда — первым упоминанием о его целебных свойствах считают запись на шумерской табличке, датируемую 2100–2000 гг. до н.э., где говорится, что мед можно использовать как лекарство и мазь. И Аристотель также отмечал, что мед хорош для лечения ран [3].
В процессе исследования костей мумий древних нубийцев, живших на территории современного Судана, ученые обнаружили в них большую концентрацию тетрациклина [5]. Возраст мумий составлял примерно 2500 лет, и, скорее всего, высокие концентрации антибиотика в костях не могли появиться случайно. Даже в останках четырехлетнего ребенка его количество была очень высоко. Ученые предполагают, что эти нубийцы на протяжении длительного времени потребляли тетрациклин. Скорее всего, его источником были бактерии Streptomyces или другие актиномицеты, содержащиеся в зернах растений, из которых древние нубийцы делали пиво.
В борьбе с инфекциями люди по всему миру использовали и растения. Сложно понять, когда именно некоторые из них начинали применять, из-за отсутствия письменных или других материальных свидетельств. Некоторые растения использовали потому, что человек методом проб и ошибок узнавал об их противовоспалительных свойствах. Другие растения использовали в кулинарии, и вместе со вкусовыми свойствами они обладали и антимикробным действием.
Так обстоит дело с луком и чесноком. Эти растения с давних пор использовали в приготовлении пищи и медицине. Об антимикробных свойствах чеснока знали еще в Китае и Индии [6]. А не так давно ученые выяснили, что народная медицина не зря использовала чеснок — его экстракты угнетают Bacillus subtilis, Escherichia coli и Klebsiella pneumonia [7].
В Корее издревле для лечения желудочно-кишечных инфекций, вызываемых сальмонеллой, используют лимонник китайский Schisandra chinensis. Уже в наши дни, после проверки действия его экстракта на эту бактерию, оказалось, что лимонник действительно обладает антибактериальным действием [8]. Или, к примеру, на присутствие антибактериальных веществ проверили специи, которые широко используются по всему миру. Получилось, что душица, гвоздика, розмарин, сельдерей и шалфей угнетают такие патогенные микроорганизмы, как Staphylococcus aureus, Pseudomonas fluorescens и Listeria innocua [9]. На территории Евразии народы часто заготавливали ягоды и, естественно, использовали их в том числе и в лечении. Научные исследования подтвердили, что некоторые ягоды обладают антимикробной активностью. Фенолы, особенно эллаготанины, содержащиеся в плодах морошки и малины, ингибируют рост кишечных патогенных микроорганизмов [10].
XX век
1940–1960-е годы XX века называют «золотой эрой» открытия антибиотиков. В то время, чтобы получить новое вещество, обладающее антибиотической активностью, можно было взять пробу почвы, выделить из нее микроорганизмы и изучать их. На этом же объекте исследования можно было испытывать новосинтезированные или выделенные из других микроорганизмов антибиотики. В 1980-х начала свое развитие комбинаторная химия, а в 1990-х ее методы стали использовать фармкомпании, в том числе и для поиска новых антибиотиков.
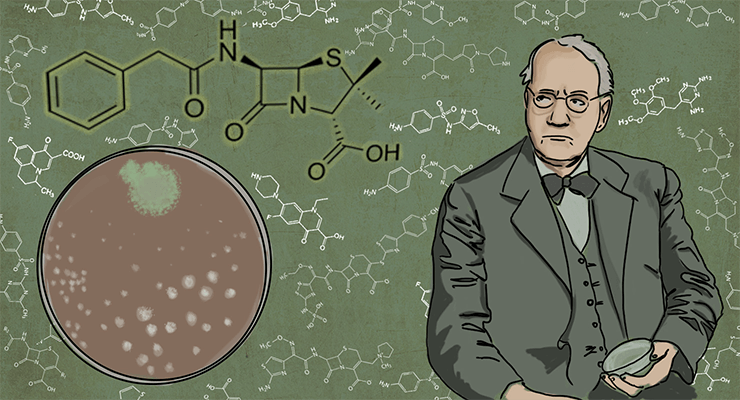
Официально, «золотая эра антибиотиков» начинается с открытия пенициллина. Это произошло в 1928 году, и первооткрывателем официально считают британского бактериолога Александра Флеминга (рис. 1). Кстати, ту самую чашку Петри, благодаря которой он сделал открытие и в дальнейшем получил Нобелевскую премию, вместе с той самой плесенью не так давно продали на аукционе за 14 тысяч долларов.
Строго говоря, Александр Флеминг (о котором рассказывает статья «Победитель бактерий» [12]) является первооткрывателем пенициллина лишь официально. У него были предшественники, о которых также можно прочитать на «биомолекуле»: «Эволюция наперегонки, или почему антибиотики перестают работать» [13].
Рисунок 1. Александр Флеминг.
Поначалу открытие Флеминга не использовалось для лечения пациентов и продолжало свою жизнь исключительно за дверями лаборатории. К тому же, как сообщали современники Флеминга, он не был хорошим оратором и не мог убедить общественность в полезности и важности пенициллина. Вторым рождением этого антибиотика можно назвать его переоткрытие учеными из Великобритании Эрнстом Чейном и Говардом Флори в 1940–1941 гг.
В СССР тоже использовали пенициллин, причем если в Великобритании применяли не особенно производительный штамм, то советский микробиолог Зинаида Ермольева в 1942 году обнаружила таковой и даже сумела наладить производство антибиотика в условиях войны [14]. Наиболее активным штаммом был Penicillium crustosum, и поэтому поначалу выделенный антибиотик называли пенициллин-крустозин. Его использовали на одном из фронтов во время Великой Отечественной войны для профилактики послеоперационных осложнений и лечения ран [15].
Зинаида Ермольева написала небольшую брошюру, в которой рассказала о том, как в СССР был открыт пенициллин-крустозин и как происходил поиск других антибиотиков: «Биологически активные вещества» [15].
В Европе пенициллин тоже использовали для лечения военных, причем после того, как этот антибиотик начали применять в медицине, он оставался привилегией исключительно военных [16]. Но после пожара 28 ноября 1942 года в ночном клубе Бостона пенициллин стали применять и для лечения гражданских пациентов. У всех пострадавших были ожоги разной степени сложности, и в то время такие пациенты зачастую умирали от бактериальных инфекций, вызываемых, например, стафилококками. Компания Merck & Co. отправила пенициллин в госпитали, где содержались пострадавшие при этом пожаре, и успех лечения поставил пенициллин в центр внимания общественности. К 1946 году он стал широко использоваться в клинической практике.
Доступным для общественности пенициллин оставался вплоть до середины 50-х годов XX века. Естественно, находясь в неконтролируемом доступе, этот антибиотик зачастую использовался неуместно. Есть даже примеры пациентов, которые считали, что пенициллин — чудо-средство от всех человеческих болезней, и применяли его даже для «лечения» того, что ему по природе своей не способно поддаться. Но в 1946 году в одном из американских госпиталей заметили, что 14% взятых от больных пациентов штаммов стафилококка были устойчивы к пенициллину. А в конце 1940-х этот же госпиталь сообщил, что процент резистентных штаммов вырос до 59%. Интересно заметить, что первые сведения о том, что к пенициллину возникает устойчивость, появились в 1940 году — еще до того, как антибиотик стали активно использовать [17].
До открытия в 1928 году пенициллина, были, конечно, и открытия других антибиотиков. На рубеже XIX–XX веков заметили, что голубой пигмент бактерии Bacillus pyocyaneus способен убивать множество патогенных бактерий, таких как холерный вибрион, стафилококки, стрептококки, пневмококки. Он был назван пиоционазой, но открытие не послужило основой для разработки препарата, потому что вещество было токсично и нестабильно.
Первым коммерчески доступным антибиотиком стал препарат «Пронтосил», который разработал немецкий бактериолог Герхард Домагк в 1930-х годах [18]. Есть документальные свидетельства, что первым вылеченным человеком оказалась его собственная дочь, которая долго страдала от заболевания, вызванного стрептококками. В результате лечения она выздоровела всего за несколько дней. Сульфаниламидные препараты, к которым относится и «Пронтосил», широко использовали во время Второй мировой войны страны антигитлеровской коалиции для предотвращения развития инфекций.
Вскоре после открытия пенициллина, в 1943 году, Альберт Шац, молодой сотрудник в лаборатории Зельмана Ваксмана [19], выделил из почвенной бактерии Streptomyces griseus вещество, обладающее противомикробной активностью. Этот антибиотик, названный стрептомицином, оказался активным против многих распространенных в то время инфекций, в том числе туберкулеза и чумы.
И все же, примерно до 1970-х годов никто серьезно не задумывался о развитии резистентности к антибиотикам. Затем были замечены два случая заболевания гонореей и бактериальным менингитом, когда бактерия, устойчивая к лечению пенициллином или антибиотиками пенициллинового ряда, вызывала смерть пациента. Эти события ознаменовали момент, когда с десятилетиями удачного лечения заболеваний было покончено.
Надо понимать, что бактерии — это живые системы, поэтому они изменчивы и со временем способны выработать резистентность к любому антибактериальному препарату (рис. 2). Например, к линезолиду бактерии не могли выработать устойчивость на протяжении 50 лет, но все-таки сумели приспособиться и жить в его присутствии [20]. Вероятность развития антибиотикорезистентности в одном поколении бактерий составляет 1:100 млн. К действию антибиотиков они приспосабливаются по-разному. Это может быть усиление клеточной стенки, которую, к примеру, использует Burkholderia multivorans, вызывающая пневмонию у людей с иммунодефицитами [21]. Некоторые бактерии, такие как Campylobacter jejuni, которая вызывает энтероколит, очень эффективно «выкачивают» антибиотики из клеток при помощи специализированных белковых насосов [22], и поэтому антибиотик не успевает подействовать.
Подробнее о способах и механизмах приспособления микроорганизмов к антибиотикам мы уже писали: «Эволюция наперегонки, или почему антибиотики перестают работать» [13]. А на сайте проекта онлайн-образования Coursera есть полезный курс про антибиотикорезистентность Antimicrobial resistance — theory and methods. В нем достаточно подробно рассказывается об антибиотиках, механизмах устойчивости к ним и путях распространения резистентности.
Рисунок 2. Один из путей возникновения антибиотикорезистентности.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Первый случай возникновения метициллинустойчивого золотистого стафилококка (MRSA) зафиксировали в Великобритании в 1961 году, а в США — немного позднее, в 1968-м [23]. Про золотистого стафилококка мы чуть подробнее поговорим дальше, но в контексте скорости выработки у него резистентности стоит отметить, что в 1958 году против этой бактерии стали использовать антибиотик ванкомицин. Он был способен работать с тем штаммами, которые не поддавались воздействию метициллина. И до конца 1980-х годов считалось, что к нему резистентность должна вырабатываться дольше или вообще не вырабатываться. Однако в 1979 и 1983 годах, по прошествии всего пары десятков лет, в разных частях мира были зафиксированы случаи устойчивости и к ванкомицину [24].
Похожий тренд соблюдался и для других бактерий, а некоторые оказались способными выработать резистентность вообще за год. Но кто-то приспосабливался немного медленнее, например, в 1980-х годах только 3–5% S. pneumonia были устойчивы к пенициллину, а в 1998 году — уже 34%.
XXI век — «кризис инноваций»
За последние 20 лет многие большие фармкомпании — например, Pfizer, Eli Lilly and Company и Bristol-Myers Squibb — сократили число разработок или вообще закрыли проекты по созданию новых антибиотиков. Это можно объяснить не только тем, что стало сложнее искать новые вещества (потому что все, которые было легко найти, уже нашли), но и потому что есть другие востребованные и более прибыльные области, например, создание лекарств для лечения онкологических заболеваний или депрессии.
Тем не менее, время от времени то один, то другой коллектив ученых или компания сообщает, что они открыли новый антибиотик, и заявляет, что «вот он уж точно победит все бактерии/некоторые бактерии/определенный штамм и спасет мир». После этого зачастую ничего не происходит, и такие высказывания вызывают у общественности только скепсис. Ведь помимо тестирования антибиотика на бактериях в чашке Петри, нужно провести испытания предполагаемого вещества на животных, а затем и на людях. Это занимает много времени, таит в себе немало подводных камней, и обычно на одной из этих фаз открытие «чудесного антибиотика» сменяется закрытием.
Для того чтобы найти новые антибиотики, применяют различные методы: как классической микробиологии, так и более новые — сравнительной геномики, молекулярной генетики, комбинаторной химии, структурной биологии. Некоторые предлагают отойти от этих «привычных» методов и обратиться к знаниям, накопленным на протяжении истории человечества. Например, в одной из книг Британской библиотеки ученые заметили рецепт бальзама от глазных инфекций, и им стало интересно, на что он способен сейчас. Рецепт датировался X веком, поэтому вопрос — будет работать или нет? — был действительно интригующим. Ученые взяли именно те ингредиенты, которые были указаны, смешали в нужных пропорциях и проверили на метициллинрезистентном золотистом стафилококке (MRSA). К удивлению исследователей, более 90% бактерий были убиты этим бальзамом. Но важно заметить, что такой эффект наблюдался только при совместном использовании всех ингредиентов [25], [26].
Действительно, порой антибиотики природного происхождения работают не хуже современных, но их состав настолько сложен и зависит от многих факторов, что быть точно уверенным в каком-то определенном результате затруднительно. Также, невозможно сказать, замедляется ли скорость выработки устойчивости к ним или нет. Поэтому их не рекомендуют использовать как замену основной терапии, а как дополнение под строгим контролем врачей [20].
Проблемы резистентности — примеры болезней
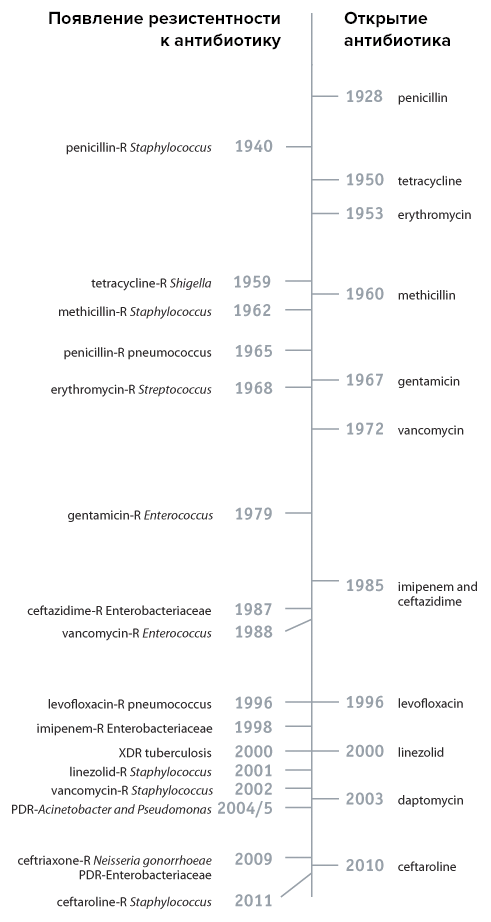
Невозможно дать полную картину резистентности микроорганизмов к антибиотикам, потому как эта тема многогранна и, несмотря на несколько поутихший интерес со стороны фармкомпаний, достаточно активно исследуется. Соответственно, очень быстро появляется информация о все новых и новых случаях устойчивости к антибиотикам. Поэтому мы ограничимся лишь несколькими примерами для того, чтобы хотя бы поверхностно показать картину происходящего (рис. 3).
Рисунок 3. Временная шкала открытия некоторых антибиотиков и выработки устойчивости к ним.
Туберкулез: риск в современном мире
Туберкулез особенно распространен в Центральной Азии, Восточной Европе и России, и то, что у туберкулезных микробов (Mycobacterium tuberculosis) возникает устойчивость не только к определенным антибиотикам, но и к их комбинациям, должно вызывать тревогу.
У пациентов с ВИЧ из-за пониженного иммунитета нередко возникают оппортунистические инфекции, вызываемые микроорганизмами, которые в норме могут без вреда присутствовать в организме человека. Одной из них является туберкулез, который к тому же отмечен как основная причина смерти ВИЧ-положительных пациентов по всему миру. О распространенности туберкулеза по регионам мира можно судить из статистики — у пациентов с ВИЧ, заболевших туберкулезом, если они проживают в Восточной Европе, риск умереть в 4 раза выше, чем если бы они жили в Западной Европе или даже Латинской Америке. Конечно, стоит отметить, что на эту цифру влияет то, насколько в медицинской практике региона принято проводить тесты на восприимчивость пациентов к лекарствам. Это позволяет применять антибиотики только при необходимости.
За ситуацией с туберкулезом наблюдает и ВОЗ. В 2017 году она выпустила доклад о выживаемости при туберкулезе и его мониторинге в Европе. Существует стратегия ВОЗ по ликвидации туберкулеза, и поэтому пристальное внимание обращается на регионы с высоким риском заражения этим заболеванием.
Туберкулез унес жизни таких мыслителей прошлого, как немецкий писатель Франц Кафка и норвежский математик Н.Х. Абель. Однако это заболевание вызывает тревогу и сегодня, и при попытке взглянуть в будущее. Поэтому и на общественном, и на государственном уровнях стоит прислушиваться к стратегии ВОЗ и стараться снизить риски заражения туберкулезом.
В докладе ВОЗ подчеркнуто, что с 2000 года фиксируется меньше случаев заражения туберкулезом: в период с 2006 по 2015 годы число случаев уменьшалось на 5,4% в год, а в 2015 уменьшилось на 3,3%. Тем не менее, несмотря на такой тренд, ВОЗ призывает с вниманием относиться к проблеме антибиотикорезистентности Mycobacterium tuberculosis, и, используя методы гигиены и постоянный мониторинг населения, уменьшать число случаев инфицирования.
Устойчивая гонорея
Американское агентство Центры по контролю и профилактике заболеваний (CDC) подсчитали, что в США ежегодно фиксируется более 800 тысяч случаев заболевания гонореей, а во все мире, по оценке ВОЗ, — 78 миллионов случаев. Это инфекционное заболевание вызывается гонококком Neisseria gonorrhoeae. В проведенных исследованиях за период с 2009 по 2014 годы показано, что многие штаммы гонококка резистентны к препарату первой линии — ципрофлоксацину, а также увеличивается число устойчивых штаммов к азитромицину и препаратам группы цефалоспоринов широкого спектра действия. В большинстве стран никакие другие антибиотики, кроме цефалоспоринов, не способны воздействовать на гонококка, но уже и к ним возрастает устойчивость. Недавно выявили три случая, когда гонококк оказывался устойчивым ко всем известным препаратам, применяемым для лечения гонореи [27].
Масштабы резистентности других бактерий
Примерно 50 лет назад начали появляться штаммы золотистого стафилококка, устойчивые к антибиотику метициллину (MRSA). Инфекции, вызванные метициллинрезистентным золотистым стафилококком, ассоциированы с бóльшим количеством смертей, чем инфекции, вызванные метициллинчувствительным стафилококком (MSSA). Большинство из MRSA также устойчиво и к другим антибиотикам. В настоящее время они распространены и в Европе, и в Азии, и в обеих Америках, и в Тихоокеанском регионе [28]. Эти бактерии чаще других становятся устойчивыми к антибиотикам и в США убивают 12 тысяч людей за год [29]. Есть даже факт, что в США MRSA в год уносит больше жизней, чем ВИЧ/СПИД, болезнь Паркинсона, эмфизема легких и убийства вместе взятые [30], [31].
В период с 2005 по 2011 год стали фиксировать меньше случаев заражения MRSA как госпитальной инфекцией. Это связано с тем, что в медицинских учреждениях взяли под строгий контроль соблюдение гигиенических и санитарных норм. Но в общей популяции такой тренд, к сожалению, не сохраняется.
Энтерококки, устойчивые к действию антибиотика ванкомицина — большая беда. Они не так широко распространены на планете, по сравнению с MRSA, но в США каждый год фиксируется около 66 тысяч случаев заражения Enterococcus faecium и, реже, E. faecalis. Они являются причиной большого спектра заболеваний и особенно среди пациентов медицинских учреждений, то есть они — причина госпитальных инфекций. При заражении энтерококком около трети случаев приходится на штаммы, устойчивые к ванкомицину.
Пневмококк Streptococcus pneumoniae является причиной бактериальной пневмонии и менингита. Чаще заболевания развиваются у людей старше 65 лет. Возникновение резистентности усложняет лечение и в итоге приводит к 1,2 миллионам случаев заболевания и 7 тысячам смертей ежегодно. Пневмококк резистентен к амоксициллину и азитромицину. К менее распространенным антибиотикам он тоже выработал устойчивость, и в 30% случаев резистентен к одному или нескольким применяемым в лечении препаратам. Надо заметить, что даже если присутствует небольшой уровень устойчивости к антибиотику, это не снижает эффективность от лечения им. Использование препарата становится бесполезным в случае, если количество резистентных бактерий превышает определенный порог. Для внебольничных пневмококковых инфекций этот порог составляет 20–30% [32]. В последнее время стало происходить меньше случаев заражения пневмококком, потому что в 2010 году создали новую версию вакцины PCV13, которая действует против 13 штаммов S. pneumoniae.
Пристальное внимание должно оказываться не только бактериям, которые уже развивают или развили резистентность, но и тем, которые пока не приобрели устойчивость. Потому что со временем и они могут измениться и начать вызывать более сложные формы заболеваний.
Внимание к нерезистентным бактериям можно объяснить и тем, что, даже легко поддаваясь лечению, эти бактерии играют роль в развитии инфекций у пациентов с ослабленным иммунитетом — ВИЧ-положительных, проходящих химиотерапию, недоношенных и переношенных новорожденных, у людей после операции и трансплантации [33]. И так как этих случаев происходит достаточное количество —
- во всем мире в 2014 году было проведено около 120 тысяч трансплантаций;
- только в США ежегодно проходят химиотерапию 650 тысяч человек, однако не у всех есть возможность использовать препараты для борьбы с инфекциями;
- в США 1,1 миллиона человек — ВИЧ-положительные, в России — чуть меньше, официально 1 млн;
— то есть шанс, что со временем устойчивость появится и у тех штаммов, которые пока не вызывают опасений.
Госпитальные, или внутрибольничные, инфекции все чаще встречаются в наше время. Это те инфекции, которыми люди заражаются в больницах и других медицинских учреждениях при госпитализации и просто при посещении.
В США в 2011 году было зафиксировано более 700 тысяч заболеваний, вызываемых бактериями рода Klebsiella [34]. Это, в основном, внутрибольничные инфекции, которые приводят к довольно обширному спектру заболеваний, таких как пневмония, сепсис, раневые инфекции. Как и в случаях со многими другими бактериями, еще с 2001 года началось массовое появление антибиотикорезистентных клебсиелл.
В одной из научных работ ученые задались целью узнать, как гены устойчивости к антибиотикам распространены среди штаммов рода Klebsiella. Они обнаружили, что 15 довольно далеких штаммов экспрессировали металло-бета-лактамазу 1 (NDM-1), которая способна разрушать почти все бета-лактамные антибиотики [34]. Бóльшую силу эти факты обретают, если уточнить, что данные для этих бактерий (1777 геномов) получены в период с 2011 по 2015 годы от пациентов, которые находились в разных больницах с разными инфекциями, вызванными клебсиеллами.
Настоящее (влияние на экономику) и будущее
Проблема резистентности бактерий к антибиотикам охватывает сразу несколько сфер человеческой жизни . В первую очередь, это, конечно, экономика. По разным подсчетам, сумма, которую тратит государство на лечение одного пациента с устойчивой к антибиотикам инфекцией, колеблется от $18 500 до $29 000. Эта цифра подсчитана для США, но, пожалуй, ее можно использовать и как средний ориентир по другим странам, чтобы понимать масштаб явления. Такая сумма уходит на одного пациента, но если подсчитать по всем, то оказывается, что суммарно к общему счету, который государство тратит за год на здравоохранение, нужно добавлять $20 000 000 000 [36]. И это помимо $35 000 000 000 социальных расходов. В 2006 году из-за двух наиболее распространенных госпитальных инфекций, в результате которых у людей развивался сепсис и пневмония, умерли 50 тысяч людей. Это обошлось системе здравоохранения США в сумму, превышающую $8 000 000 000.
Ранее мы уже писали про сегодняшнюю ситуацию с антибиотикорезистентностью и о стратегиях по ее предотвращению: «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» [37].
Если антибиотики первой и второй линий не работают, то приходится либо увеличивать дозы в надежде на то, что они сработают, либо использовать антибиотики следующей линии. И в том, и в другом случае высока вероятность повышенной токсичности препарата и побочных действий. К тому же, большая доза или новый препарат будут, скорее всего, стоить дороже предыдущего лечения. Это влияет на сумму, которую затрачивают на лечение государство и сам пациент. А также на срок нахождения пациента в больнице или на больничном, число посещений врача и экономические потери от того, что работник не трудится. Большее количество дней на больничном — это не пустые слова. Действительно, пациента с заболеванием, вызванным резистентным микроорганизмом, в среднем приходится лечить 12,7 дней, по сравнению с 6,4 для обычной болезни [30].
Кроме причин, которые непосредственно влияют на экономику — траты на лекарства, на оплату больничных и время нахождения в больнице, — есть еще и немного завуалированные. Это те причины, которые влияют на качество жизни людей, у которых обнаружены антибиотикорезистентные инфекции. Некоторые пациенты — школьники или студенты — не могут в полной мере посещать уроки, и поэтому у них возможны отставание в учебном процессе и психологическая деморализация. У пациентов, которые проходят курсы сильных антибиотиков, из-за побочных эффектов могут развиваться хронические заболевания. Помимо самих пациентов, заболевание морально угнетает их родственников и окружение, а некоторые инфекции настолько опасны, что заболевших приходится содержать в отдельной палате, где они зачастую не могут пообщаться с близкими. Также существование госпитальных инфекций и риск ими заразиться не позволяют расслабиться при прохождении курса лечения. Согласно статистике, около 2 миллионов американцев ежегодно заражаются госпитальными инфекциями, которые в итоге уносят 99 тысяч жизней. Чаще всего это происходит из-за заражения микроорганизмами, устойчивыми к антибиотикам [30]. Важно подчеркнуть, что кроме перечисленных выше и, несомненно, важных экономических потерь, качество жизни у людей тоже сильно страдает.
Прогнозы на будущее разнятся (видео 2). Одни пессимистически указывают на то, что к 2030–2040 годам кумулятивные финансовые потери составят 100 триллионов долларов, что равняется среднегодовому убытку в 3 триллиона долларов. Для сравнения — весь годовой бюджет США лишь на 0,7 триллиона превышает эту цифру [38]. Количество смертей от заболеваний, вызванных резистентными микроорганизмами, по оценке ВОЗ, к 2030–2040 годам приблизится к 11–14 миллионам и превысит смертность от рака.
Видео 2. Лекция Мэрин Маккены на TED-2015 — What do we do when antibiotics don’t work any more?
Неутешительны и перспективы использования антибиотиков в кормах сельскохозяйственных животных (видео 3). В исследовании, опубликованном в журнале PNAS, подсчитали, что в 2010 году во всем мире в кормá было добавлено более 63 000 тонн антибиотиков [38]. И это — только по скромным оценкам. Ожидается, что к 2030 году указанная цифра возрастет на 67%, но, что должно особенно встревожить, она удвоится в Бразилии, Индии, Китае, Южной Африке и России. Понятно, что, раз объемы добавляемых антибиотиков увеличатся, то и расход средств на них тоже увеличится. Существует мнение, что цель добавления их в корм — совсем не улучшение здоровья животных, а ускорение роста. Это позволяет быстро выращивать животных, получать прибыль от продаж и снова выращивать новых. Но при возрастающей антибиотикорезистентности, придется добавлять либо бóльшие объемы антибиотика, либо создавать комбинации из них. В любом из указанных случаев, затраты фермеров и государства, которое нередко их субсидирует, на эти препараты возрастут. При этом продажи сельскохозяйственной продукции могут даже снизиться из-за смертности животных, вызванной отсутствием действенного антибиотика или побочными эффектами нового. А также из-за страха со стороны населения, которое не хочет потреблять продукцию с этим «усиленным» препаратом. Снижение продаж или повышение цены на продукцию может ставить фермеров в бóльшую зависимость от субсидий со стороны государства, заинтересованного в обеспечении населения продуктами первой необходимости, которые как раз и предоставляет фермер. Также, многие сельхозпроизводители из-за вышеуказанных причин могут оказаться на грани банкротства, а, следовательно, это приведет к тому, что на рынке останутся лишь крупные сельскохозяйственные компании. И, как следствие, возникнет монополия крупных компаний-гигантов. Такие процессы негативно отразятся на социально-экономическом положении любого государства.
Видео 3. BBC рассказывает о том, насколько может быть опасным развитие антибиотикорезистентности у сельскохозяйственных животных
По всему миру активно развиваются направления науки, связанные с определением причин генетических заболеваний и их лечения, мы с интересом наблюдаем за тем, что происходит с методами, которые помогут человечеству «избавиться от вредных мутаций и стать здоровыми», как любят упоминать поклонники методов пренатального скрининга, CRISPR-Cas9 и только начинающего развиваться метода генетической модификации эмбрионов [39–41]. Но все это может быть понапрасну, если мы окажемся неспособны противостоять заболеваниям, вызываемым резистентными микроорганизмами. Необходимы разработки, которые позволят преодолеть проблему резистентности, иначе всему миру несдобровать.
Заключение
Меньше века прошло с начала масштабного использования антибиотиков. Вместе с тем, меньше века заняло у нас, чтобы результат этого достиг грандиозных масштабов . Угроза антибиотикорезистентности вышла на глобальный уровень, и было бы глупо отрицать, что именно мы своими же усилиями создали себе такого врага. Сегодня каждый из нас ощущает на себе последствия уже возникшей устойчивости и находящуюся в процессе развития устойчивость, когда получаем от врача выписанные антибиотики, принадлежащие не к первой линии, а второй или даже последней. Сейчас существуют варианты решения этой проблемы, но самих проблем — не меньше. Предпринимаемые нами действия по борьбе с быстро развивающими устойчивость бактериями напоминают гонку. Что будет дальше — покажет время.
Об этой проблеме рассказывает в лекции «Кризис медицины и биологические угрозы» Николай Дурманов, экс-глава «РУСАДА».
И время, действительно, расставляет все по своим местам. Начинают появляться средства, позволяющие улучшить работу уже существующих антибиотиков, научные группы ученых (пока что ученых, но вдруг эта тенденция вновь вернется и к фармкомпаниям) без устали трудятся над созданием и проверкой новых антибиотиков. Обо всем этом можно прочитать и воспрянуть духом во второй статье цикла.
- В диких условиях: как жил последний всеобщий предок LUCA;
- Vanessa M. D’Costa, Christine E. King, Lindsay Kalan, Mariya Morar, Wilson W. L. Sung, et. al.. (2011). Antibiotic resistance is ancient. Nature. 477, 457-461;
- Manisha Deb Mandal, Shyamapada Mandal. (2011). Honey: its medicinal property and antibacterial activity. Asian Pacific Journal of Tropical Biomedicine. 1, 154-160;
- Sultan Ayoub Meo, Saleh Ahmad Al-Asiri, Abdul Latief Mahesar, Mohammad Javed Ansari. (2017). Role of honey in modern medicine. Saudi Journal of Biological Sciences. 24, 975-978;
- Mark L. Nelson, Andrew Dinardo, Jeffery Hochberg, George J. Armelagos. (2010). Brief communication: Mass spectroscopic characterization of tetracycline in the skeletal remains of an ancient population from Sudanese Nubia 350-550 CE. Am. J. Phys. Anthropol.. 143, 151-154;
- A. Coppi, M. Cabinian, D. Mirelman, P. Sinnis. (2006). Antimalarial Activity of Allicin, a Biologically Active Compound from Garlic Cloves. Antimicrobial Agents and Chemotherapy. 50, 1731-1737;
- Balaji Meriga, Ramgopal Mopuri, T. MuraliKrishna. (2012). Insecticidal, antimicrobial and antioxidant activities of bulb extracts of Allium sativum. Asian Pacific Journal of Tropical Medicine. 5, 391-395;
- Mi-Hyang Lee, Hyun Ae Kwon, Dong-Yeul Kwon, Hyun Park, Dong-Hwan Sohn, et. al.. (2006). Antibacterial activity of medicinal herb extracts against Salmonella. International Journal of Food Microbiology. 111, 270-275;
- Anna M Witkowska, Dara K Hickey, Mercedes Alonso-Gomez, Martin Wilkinson. (2013). Evaluation of antimicrobial activities of commercial herb and spice extracts against selected food-borne bacteria. JFR. 2, 37;
- R. Puupponen-Pimia, L. Nohynek, S. Hartmann-Schmidlin, M. Kahkonen, M. Heinonen, et. al.. (2005). Berry phenolics selectively inhibit the growth of intestinal pathogens. J Appl Microbiol. 98, 991-1000;
- Siro Igino Trevisanato. (2007). The ‘Hittite plague’, an epidemic of tularemia and the first record of biological warfare. Medical Hypotheses. 69, 1371-1374;
- Победитель бактерий;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Волкова О. (2003). Смерть обходит задворки науки. «Гамма»;
- Ермольева З.В. Биологически активные вещества. М.: «Знание», 1966. — 32 с.;
- Saswati Sengupta, Madhab K. Chattopadhyay, Hans-Peter Grossart. (2013). The multifaceted roles of antibiotics and antibiotic resistance in nature. Front. Microbiol.. 4;
- Abraham E.P. and Chain E. (1940). An enzyme from bacteria able to destroy penicillin. Nature. 3713, 837;
- Walter Sneader. (2001) History of Sulfonamides;
- Главный «почвенник» медицины: Зельман Ваксман;
- Ремиш А. (2016). Битва за выживание. Econet;
- Chih-Chia Su, Linxiang Yin, Nitin Kumar, Lei Dai, Abhijith Radhakrishnan, et. al.. (2017). Structures and transport dynamics of a Campylobacter jejuni multidrug efflux pump. Nat Commun. 8;
- Nitin Kumar, Chih-Chia Su, Tsung-Han Chou, Abhijith Radhakrishnan, Jared A. Delmar, et. al.. (2017). Crystal structures of theBurkholderia multivoranshopanoid transporter HpnN. Proc Natl Acad Sci USA. 114, 6557-6562;
- A. P. Johnson. (2011). Methicillin-resistant Staphylococcus aureus: the European landscape. Journal of Antimicrobial Chemotherapy. 66, iv43-iv48;
- G. V. Doern, K. P. Heilmann, H. K. Huynh, P. R. Rhomberg, S. L. Coffman, A. B. Brueggemann. (2001). Antimicrobial Resistance among Clinical Isolates of Streptococcus pneumoniae in the United States during 1999-2000, Including a Comparison of Resistance Rates since 1994-1995. Antimicrobial Agents and Chemotherapy. 45, 1721-1729;
- Rayner E. (2015). AncientBiotics — a medieval remedy for modern day superbugs? The University of Nottingham;
- Macdonald F. (2015). 1,000-year-old onion and garlic remedy kills antibiotic-resistant bugs. ScienceAlert;
- Керман А. (2017). ВОЗ обеспокоена неизлечимой гонореей. «XXII ВЕК»;
- Gian Maria Rossolini, Fabio Arena, Patrizia Pecile, Simona Pollini. (2014). Update on the antibiotic resistance crisis. Current Opinion in Pharmacology. 18, 56-60;
- Ventola C.L. (2015). The antibiotic resistance crisis. Part 1: causes and threats. P.T. 40, 277–283;
- Zhabiz Golkar, Omar Bagasra, Donald Gene Pace. (2014). Bacteriophage therapy: a potential solution for the antibiotic resistance crisis. J Infect Dev Ctries. 8;
- Michael Gross. (2013). Antibiotics in crisis. Current Biology. 23, R1063-R1065;
- Березняков И.Г. (2009). Приверженность к приему лекарственных средств и пути ее повышения при бактериальных инфекциях. Болезни и антибиотики. 2;
- S. Karuthu, E. A. Blumberg. (2012). Common Infections in Kidney Transplant Recipients. Clinical Journal of the American Society of Nephrology. 7, 2058-2070;
- S. Wesley Long, Randall J. Olsen, Todd N. Eagar, Stephen B. Beres, Picheng Zhao, et. al.. (2017).
Population Genomic Analysis of 1,777 Extended-Spectrum Beta-Lactamase-Producing
Klebsiella pneumoniae
Isolates, Houston, Texas: Unexpected Abundance of Clonal Group 307
. mBio. 8, e00489-17; - Martin J Llewelyn, Jennifer M Fitzpatrick, Elizabeth Darwin, SarahTonkin-Crine, Cliff Gorton, et. al.. (2017). The antibiotic course has had its day. BMJ. j3418;
- Margaret A. Riley, Sandra M. Robinson, Christopher M. Roy, Morgan Dennis, Vivian Liu, Robert L. Dorit. (2012). Resistance is futile: the bacteriocin model for addressing the antibiotic resistance challenge. Biochm. Soc. Trans.. 40, 1438-1442;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Thomas P. Van Boeckel, Charles Brower, Marius Gilbert, Bryan T. Grenfell, Simon A. Levin, et. al.. (2015). Global trends in antimicrobial use in food animals. Proc Natl Acad Sci USA. 112, 5649-5654;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний.
Кажется, антибиотики были с нами всегда. Но это не так: первые испытания антибиотика на человеке официально прошли 12 февраля 1942 года, т.е. всего 80 лет назад.
3 исторических факта
1. Первым природным антибиотиком считается пенициллин, открытый Александром Флемингом в 1928 году. Чтобы создать лекарство и провести опыт на людях, ушло больше 10 лет и понадобилась помощь биохимика Эрнста Чейна и фармаколога Говарда Флори. В 1945 году они разделили Нобелевскую премию по физиологии и медицине.
2. Термин “антибиотик” предложил в 1942 году уроженец Винницкой области Российской империи, впоследствии американский микробиолог и биохимик Зельман Ваксман. Он же в 1952 году стал лауреатом Нобелевской премии по физиологии и медицине за открытие первого антибиотика, эффективного при лечении туберкулёза.
3. Средняя продолжительность жизни в мире в среднем увеличилась на 8 лет благодаря антибиотикам.
А что сейчас?
Современная фарминдустрия выпускает мази, крема, капли с антибиотиком для местной терапии, а таблетки, капсулы, суспензии, растворы для системной терапии.
Но ученые вновь озадачены поиском новых противомикробных средств. Только причина уже иная: антибиотикорезистентность. Это ответная, наследственно закрепленная реакция микроорганизмов на антибиотики.
Флеминг в своей нобелевской речи предостерегал: “Настанут времена, когда любой сможет купить пенициллин в магазине, поэтому есть опасность, что какой-нибудь несведущий человек может легко принять слишком малую дозу и вырастить в себе микроорганизмы под влиянием низких концентраций лекарства, которые будут устойчивы к пенициллину.
Вот гипотетический пример. У мистера X заболело горло. Он покупает пенициллин и принимает его в количестве, недостаточном для уничтожения стрептококка, но достаточном, чтобы научить его сопротивляться пенициллину. Затем он заражает свою жену. У неё возникает пневмония и её лечат пенициллином. Поскольку стрептококк теперь устойчив к пенициллину, то лечение оказывается неэффективным, и миссис X умирает. Кто изначально виноват в её смерти? Её муж, который халатным отношением к пенициллину изменил природу бактерии”.
А вот и 4-й факт: чем шире используются антибиотики, тем чаще возникают бактерии, потерявшие к ним чувствительность.

3 ошибки при приеме антибиотиков
- прием препарата без назначения врача
- отказ от приема раньше рекомендованного инструкцией
- снижение дозы по сравнению с назначением врача
Так вырабатывается лекарственная устойчивость у болезнетворной бактерии. Высок риск, что следующий эпизод лечения этим антибиотиком будет неэффективен.
Помочь в борьбе с распространением антибиотикорезистентности могла бы вакцинация. Доказано, что вакцинация против гриппа снижает число вторичных бактериальных инфекций, в том числе пневмонии. Вот только к любой вакцинации отношение у нас, к сожалению, крайне настороженное.
В авторитетном журнале The Lancet недавно были опубликованы данные за 2019г.: почти 5 млн смертей в мире снова связаны с невосприимчивостью к антибиотикам. Причем особую опасность она представляет для детей младше пяти лет — на них приходится 20% смертей.
5 факт: наблюдается дефицит эффективных препаратов. В ВОЗ признали, что «клинический конвейер новых противомикробных препаратов иссяк». В 2019 году организация признала всего шесть инновационных перспективных разработок. А в 2015-2016 годы новых антибиотиков вообще не было зарегистрировано. То есть количество и скорость появления новых антибиотиков не успевают за скоростью приспосабливаемости бактерий.
Есть мнение, что бизнесу невыгодно инвестировать в разработку этих препаратов: инвестиции могут не окупиться, т.к. препараты быстро становятся неэффективным против бактерий, развивших к ним резистентность.
Как избежать неэффективного приема антибиотиков?
- Принимайте антибиотик только в том случае, если он назначен врачом и без него в терапии нельзя обойтись
- Четко придерживайтесь графика и доз рекомендованной терапии
- По возможности, сдайте анализ на бактериальный посев для выбора наиболее подходящего антибиотика
ВОЗ: устойчивость к противомикробным препаратам 17.11.2021г
Антибиотики. Враги или друзья? (страницы истории)
Для цитирования: Горелова Л.Е. Антибиотики. Враги или друзья? (страницы истории). РМЖ. 2009;15:1006.
…Во внешней природе и человеческом организме
распространены микробы, оказывающие нам большую
помощь в борьбе против заразных болезней.
И.И. Мечников
Идея использования микробов против микробов и наблюдения о микробном антагонизме относятся к временам Луи Пастера и И.И. Мечникова. В частности, Мечников писал, что «в процессе борьбы друг с другом микробы вырабатывают специфические вещества как орудия защиты и нападения». А чем иным, как не орудием нападения одних микробов на другие, оказались антибиотики? Современные антибиотики – пенициллин, стрептомицин и др. – получены как продукт жизнедеятельности различных – бактерий, плесеней и актиномицетов. Именно эти вещества действуют губительно, либо задерживают рост и размножение болезнетворных микробов.
Перелистаем страницы истории антибиотиков. Еще в конце XIX в. профессор В.А. Манассеин описал противомикробное действие зеленой плесени пенициллиум, а А.Г. Полотебнов с успехом применял зеленую плесень для лечения гнойных ран и сифилитических язв. Кстати, известно, что индейцы майя использовали зеленую плесень для лечения ран. При гнойных заболеваниях рекомендовал плесень и выдающийся арабский врач Абу Али Ибн Сина (Авиценна).
Эра антибиотиков в современном значении этого слова началась с замечательного открытия – пенициллина Александром Флемингом. В 1929 г. английский ученый Александр Флеминг опубликовал статью, принесшую ему всемирную известность: он сообщил о новом, выделенном из колоний плесени, веществе, которое он назвал пенициллином. С этого момента и начинается «биография» антибиотиков, которые по праву считаются «лекарством века». В статье указывалось на высокую чувствительность к пенициллину стафилококков, стрептококков, пневмококков. В меньшей степени к пенициллину были чувствительны возбудитель сибиреязвенной болезни и бацилла дифтерии, а совсем не восприимчивы – бацилла брюшного тифа, холерный вибрион и другие.
Однако, А. Флеминг не сообщил о виде плесени, из которой он выделил пенициллин. Уточнение сделал известный миколог Шарль Вестлинг.
Но этот пенициллин, открытый Флемингом, имел ряд недостатков. В жидком состоянии он быстро терял свою активность. Из–за слабой концентрации его приходилось вводить в больших количествах, что было очень болезненно.
Пенициллин Флеминга содержал в себе также много побочных и далеко не безразличных белковых веществ, попавших из бульона, на котором выращивалась плесень пенициллиум. В результате всего этого использование пенициллина для лечения больных затормозилось на несколько лет. Только в 1939 г. врачи медицинской школы Оксфордского университета приступили к изучению возможности лечения пенициллином инфекционных заболеваний. Г. Флори, Б. Хаийн, Б. Чейн и другие специалисты составили план подробного клинического испытания пенициллина. Вспоминая этот период работы, проф. Флори писал: «Все мы работали над пенициллином с утра до вечера. Засыпали с мыслью о пенициллине, и единственным нашим желанием было разгадать его тайну».
Эта напряженная работа принесла свои результаты. Летом 1940 года первые белые мыши, экспериментально зараженные стрептококками в лабораториях Оксфордского университета, были спасены от смерти благодаря пенициллину. Полученные результаты помогли клиницистам проверить пенициллин на людях. 12 февраля 1941 года Э. Абразам ввел новый препарат безнадежным больным, погибающим от заражения крови. К сожалению, после нескольких дней улучшения больные все же скончались. Однако трагическая развязка наступила не в результате применения пенициллина, а из–за его отсутствия в нужном количестве.
С конца 30–х гг. XX века работами Н.А. Красильникова, изучавшего распространение в природе актиномицетов, и последующими работами З.В. Ермольевой, Г.Ф. Гаузе и других ученых, исследовавших антибактериальные свойства почвенных микроорганизмов, было положено начало развитию производства антибиотиков. Отечественный препарат пенициллин был получен в 1942 году в лаборатории З.В. Ермольевой. В годы Великой Отечественной войны тысячи раненых и больных были спасены.
Победное шествие пенициллина и его признание во всем мире открыло новую эру в медицине – эру антибиотиков. Открытие пенициллина стимулировало поиски и выделение новых активных антибиотиков. Так, в 1942 году был открыт грамицидин (Г.Ф. Гаузе и др.). В конце 1944 года С. Ваксман со своим коллективом проводит экспериментальную проверку стрептомицина, который вскоре стал соперничать с пенициллином. Стрептомицин оказался высокоэффективным препаратом для лечения туберкулеза. Этим объясняется мощное развитие промышленности, выпускающий данный антибиотик. С. Ваксман впервые ввел термин «антибиотик», подразумевая под этим химическое вещество, образуемое микроорганизмами, обладающее способностью подавлять рост или даже разрушать бактерии и другие микроорганизмы. В дальнейшем это определение расширялось.
В 1947 году был открыт и выдержал экзамен на эффективность еще один антибиотик пенициллинового ряда – хлоромицетин. Его успешно применяли в борьбе с брюшным тифом, пневмонией, лихорадкой Ку. В 1948–1950 гг. были введены ауромицин и терамицин, клиническое использование которых началось в 1952 году. Они оказались активны при многих инфекциях, включая бруцеллез, туляремию. В 1949 году был открыт неомицин – антибиотик с широким аспектом действия. В 1952 году был открыт эритомицин.
Таким образом, ежегодно арсенал антибиотиков увеличивался. Появились стрептомицин, биомицин, альбомицин, левомицетин, синтомицин, тетрациклин, террамицин, эритромицин, колимицин, мицерин, иманин, экмолин и ряд других. Одни из них обладают направленным действием на определенные микробы или их группы, другие обладают более широким спектром антимикробного действия на различные микроорганизмы.
Выделяются сотни тысяч культур микроорганизмов, получаются десятки тысяч препаратов. Однако все они требуют тщательного изучения.
В истории создания антибиотиков много непредвиденных и даже трагических случаев. Даже открытие пенициллина сопровождалось, помимо успехов, и некоторыми разочарованиями. Так, вскоре была обнаружена пенициллиназа – вещество, способное нейтрализовать пенициллин. Это объясняло, почему многие бактерии невосприимчивы к пенициллину (колибацилла и микроб брюшного тифа, например, содержат в своей структуре пенициллиназу).
Вслед за этим последовали и другие наблюдения, поколебавшие веру во всепобеждающую силу пенициллина. Было установлено, что определенные микробы приобретают со временем невосприимчивость к пенициллину. Накопленные факты подтвердили мнение о существовании двух видов невосприимчивости к антибиотикам: естественной (структурной) и приобретенной.
Стало известно также, что ряд микробов обладает способностью вырабатывать такого же характера защитные вещества и против стрептомицина – фермент стрептомициназу. За этим, казалось бы, должен был последовать вывод о том, что пенициллин и стрептомицин становятся малоэффективными лечебными средствами и что их применять не следует. Как ни важны оказались выявленные факты, как ни грозны они были для антибиотиков, но ученые таких поспешных выводов не сделали. Наоборот, были сделаны два важных вывода: первый – искать пути и методы подавления этих защитных свойств микробов, а второй – еще глубже изучать это свойство самозащиты.
Помимо ферментов, некоторые микробы защищаются витаминами и аминокислотами.
Большим недостатком длительного лечения пенициллином и другими антибиотиками было нарушение физиологического равновесия между микро– и макроорганизмом. Антибиотик не выбирает, не делает разницы, но подавляет или убивает любой организм, попадающий в сферу его деятельности. В результате уничтожаются, например, микробы, содействующие пищеварению, защищающие слизистые оболочки; в результате человек начинает страдать от микроскопических грибков.
При использовании антибиотиков нужна большая осторожность. Необходимо соблюдать точные дозировки. После испытания каждого антибиотика его направляют в Комитет по антибиотикам, который решает вопрос о возможности применения его на практике.
Продолжают создаваться и совершенствоваться антибиотики, обладающие продленным действием в организме. Другим направлением в совершенствовании антибиотиков является создание таких форм антибиотиков, чтобы вводить их не шприцем, а принимать парентерально.
Были созданы таблетки феноксиметилпенициллина, которые и предназначены для приема внутрь. Новый препарат успешно прошел экспериментальные и клинические испытания. Он обладает рядом очень ценных качеств, из которых наиболее важным является то, что он не боится соляной кислоты желудочного сока. Именно это обеспечивает успех его изготовления и применения. Растворяясь и всасываясь в кровь, он оказывает свое лечебное действие
Успех с таблетками феноксиметилпенициллина оправдал надежды ученых. Арсенал антибиотиков в таблетках пополнился рядом других, обладающих широким спектром действия на различных микробов. Большой известностью в настоящее время пользуются тетрациклин, террамицин, биомицин. Внутрь вводятся левомицетин, синтомицин и другие антибиотики.
Так был получен полусинтетический препарат ампициллин, задерживающий рост не только стафилококков, но и микробов, вызывающих брюшной тиф, паратиф, дизентерию.
Все это оказалось новым и большим событием в учении об антибиотиках. Обычные пенициллины на тифозно–паратифозно–дизентерийную группу не действуют. Теперь открываются новые перспективы для более широкого применения пенициллина на практике.
Большим и важным событием в науке явилось также получение новых препаратов стрептомицина – пасомицина и стрептосалюзида для лечения туберкулеза. Оказывается, этот антибиотик может потерять свою силу в отношении туберкулезных палочек, которые приобрели устойчивость к нему.
Несомненным достижением явилось создание во Всесоюзном научно–исследовательском институте антибиотиков дибиомицина. Он оказался эффективным для лечения трахомы. Большую роль в этом открытии играли исследования З.В. Ермольевой.
Наука движется вперед, и поиски антибиотиков против вирусных болезней остаются одной из актуальнейших задач науки. В 1957 г. английский ученый Айзеке сообщил о получении им вещества, которое он назвал интерфероном. Это вещество образуется в клетках организма в результате проникновения в них вирусов. Проведено изучение лечебных свойств интерферона. Опыты показали, что наиболее чувствительны к его действию вирусы гриппа, энцефалита, полиомиелита, оспо–вакцины. При этом он абсолютно безвреден для организма.
Были созданы жидкие антибиотики в виде суспензий. Эта жидкая форма антибиотиков благодаря своим высокоактивным лечебным свойствам, а также приятному запаху и сладкому вкусу нашла широкое применение в педиатрии при лечении различных болезней. Они настолько удобны для применения, что в виде капель их дают даже новорожденным детям.
В эпоху антибиотиков онкологи не могли не задуматься над возможностью использовать их при лечении рака. Не найдутся ли среди микробов продуценты противораковых антибиотиков? Эта задача гораздо более сложная и трудная, чем изыскание противомикробных антибиотиков, но она увлекает и волнует ученых.
Большой интерес онкологов вызвали антибиотики, которые вырабатываются лучистыми грибами – актиномицетами.
Можно назвать ряд антибиотиков, которые тщательно изучаются в эксперименте на животных, а отдельные – для лечения раковой болезни у людей. Актиномицин, актиноксантин, плюрамицин, саркомицин, ауратин – с этими антибиотиками связана важная полоса в поисках активных, но безвредных препаратов. К сожалению, многие из полученных противораковых антибиотиков этому требованию не отвечают.
Впереди – надежды на успех. Ярко и образно об этих надеждах сказала Зинаида Виссарионовна Ермольева: «Мы мечтаем победить и рак. Когда–то несбыточной казалась мечта о покорении космического пространства, но она сбылась. Сбудутся и эти мечты!»
Итак, наиболее эффективными антибиотиками оказались те из них, которые являются продуктами жизнедеятельности актиномицетов, плесеней, бактерий и других микроорганизмов. Поиски новых микробов – продуцентов антибиотиков – продолжаются широким фронтом во всем мире.
Еще в 1909 г. профессор Павел Николаевич Лащенков открыл замечательное свойство свежего белка куриных яиц убивать многих микробов. В процессе гибели происходило растворение (лизис) их.
В 1922 г. это интересное биологическое явление глубоко изучил английский ученый Александр Флеминг и назвал вещество, растворяющее микробов, лизоцим. У нас в стране лизоцим был широко изучен З.В. Ермольевой с сотрудниками. Открытие лизоцима вызвало большой интерес у биологов, микробиологов, фармакологов и врачей–лечебников разных специальностей.
Экспериментаторов интересовали природа, химический состав, особенности действия лизоцима на микробов. Особенно важным был вопрос о том, на какие болезнетворные микробы лизоцим действует и при каких инфекционных болезнях можно его применять с лечебной целью.
Лизоцим в разной концентрации обнаружен в слезах, слюне, мокроте, селезенке, почках, печени, коже, слизистых оболочках кишок и других органах человека и животных. Кроме того, лизоцим обнаружен в различных овощах и фруктах (хрен, репа, редька, капуста) и даже в цветах (примула). Лизоцим обнаружен также и у различных микробов.
Лизоцим применяется для лечения при некоторых инфекционных заболеваниях глаз, носа, полости рта и др.
Широкая популярность антибиотиков привела к тому, что они нередко стали чем–то вроде средства «домашнего лечения» и применяются без назначения врача. Конечно, такое применение нередко опасно и приводит к нежелательным реакциям и осложнениям. Неосторожное применение больших доз антибиотиков может вызвать более сильные реакции и осложнения. Не надо забывать, что антибиотики могут повреждать микробные клетки, в результате чего в организм поступают ядовитые продукты распада микробов, вызывающие отравление. Часто страдают при этом сердечно–сосудистая и нервная системы, нарушается нормальная деятельность почек, печени.
Антибиотики обладают мощным действием на многие микробы, но, конечно, не на все. Антибиотиков универсального действия пока нет. Ученые стремятся к получению антибиотиков так называемого широкого спектра действия. Это значит, что такие антибиотики должны действовать на большое количество различных микробов, и такие антибиотики созданы. К их числу относятся стрептомицин, тетрациклин, хлорамфеникол и др. Но именно потому, что они вызывают гибель массы разнообразных микробов (но не всех), оставшиеся становятся агрессивными и могут причинить вред. В то же время за ними большое будущее.
В настоящее время антибиотики стали применяться и для лечения животных и птиц. Так многие инфекционные заболевания птиц благодаря антибиотикам перестали быть бичом в птицеводстве. В животноводстве и птицеводстве антибиотики стали применяться как стимуляторы роста. В сочетании с некоторыми витаминами, прибавленными к корму цыплят, индюшат, поросят и других животных, антибиотики способствуют усилению роста и увеличению их веса.
Ученые с полным основанием могут утверждать, что, помимо стимуляции роста, антибиотики окажут и профилактическое действие в отношении заболеваний птиц. Известны работы З.В. Ермольевой и ее сотрудников, отражающие тот факт, что среди птиц, телят и поросят заболеваемость и смертность, например от кишечных инфекций (поносов), резко были снижены при применении антибиотиков.
Будем надеяться, что за антибиотиками будет победа и над другими заболеваниями.
Влияние антибиотиков на организм
Антибиотики и их влияние на здоровье
Хотя лечение антибиотиками часто сопровождается целым рядом осложнений, после которых не так-то просто восстановить организм, эти лекарства продолжают активно применяться и назначаться пациентам, в том числе детям и беременным женщинам.
Что такое антибиотики
Антибиотики – это особые вещества биологического происхождения, способные подавлять рост вирусов, микробов и микроорганизмов или полностью уничтожать их. Специфичность действия является основной особенностью антибиотиков. То есть, каждый конкретный вид патогенных микроорганизмов является восприимчивым не к каждому типу антибиотиков. Именно эта особенность легла в основу классификации современных антибиотиков на препараты узкого спектра действия (подавляют жизнедеятельность микробов одного вида) и широкого спектра действия (уничтожают различные виды микроорганизмов).
Антибиотики призваны помочь человеку побороть инфекционное заболевание, но при этом крайне важно не нанести дополнительного вреда здоровью. Чтобы не пришлось столкнуться с серьезными осложнениями, недопустим бесконтрольный прием подобных лекарств – любе препараты должны назначаться врачом и приниматься строго под его контролем.
Негативное влияние антибиотиков на организм
Прежде чем перечислить возможные негативные последствия от приема антибиотиков, необходимо отметить, что при ряде заболеваний лечение антибактериальными препаратами является крайней необходимостью. Речь идет о таких патологиях как пневмония, сепсис, гнойная ангина и т.д. И если непродолжительное применение антибиотиков способно дать очень хороший эффект, то слишком длительное их использование способно привести к тяжелым побочным эффектам:
- Происходит подавление не только патогенной, но и полезной микрофлоры в организме. Это приводит к тому, что в вашем организме создается своеобразная «безжизненная среда», в которой могут существовать только микроорганизмы с выработанной устойчивостью.
- Происходит нарушение клеточного дыхания, а значит, доступ кислорода к тканям значительно ограничивается, то есть ваш организм как бы переходит в анаэробное состояние.
- Негативно влияют антибиотики и на печень, забивая желчные проходы этого органа. Причем отрицательное влияние это намного сильнее, чем от регулярного употрeбления спиртного.
- Стремительно истощаются и буферные системы печени, основное предназначение которых состоит в компенсации токсических воздействий. Постепенно печень кардинально меняет свои функции и вместо очищения она загрязняет наш организм. Для того чтобы избежать этого негативного последствия, в ряде случаев наши врачи назначают в дополнение к антибиотикам препараты для поддержки нормальной работы печени.
- Длительный прием антибиотиков в прямом смысле слова «выключает» нашу иммунную систему.
Это лишь небольшая часть тех вредных воздействий, которые антибиотики могут оказывать на человеческий организм. В зависимости от конкретного типа препарата этот список может пополняться. Именно из-за столь обширного списка тяжелых побочных эффектов специалисты нашей клиники стараются прибегать к лечению антибиотиками лишь в самых крайних случаях, когда остальные средства оказываются неэффективными.
Антибиотики и микрофлора
Вы уже знаете, что в основе воздействия антибиотиков лежит подавление и уничтожение микрофлоры. Наш организм в совокупности с населяющей его микрофлорой формируют стабильный гомеостаз. Таким образом, качество нашей жизнедеятельности регулируется именно балансом всех протекающих процессов. Любой антибиотик является ингибитором, подавляющим химические реакции, в том числе и полезных микробов, что негативно влияет и на гомеостаз.
Простыми словами, антибиотики внутри нас обеспечивают своеобразную временную стерильность. В такой среде ни один микроорганизм кроме самих патогенных микробов существовать не может, а это чревато развитием самых различных патологий. Совершенно ошибочно полагать, что микрофлора способна быстро восстановиться после такого воздействия. Именно поэтому наши врачи, назначая пациентам антибиотики, выписывают и препараты, поддерживающие микрофлору кишечника.
Антибиотики при беременности
Применение антибиотиков в период беременности – это тема довольно сложная и спopная. Вы, конечно, знаете, что в этот период нежелателен прием вообще любых лекарственных препаратов, но что делать, если организму пришлось столкнуться с серьезной инфекцией, угрожающей плоду? Специалисты нашей клиники никогда не назначают антибактериальное лечение беременным без серьезных на то показаний. Ими могут являться пoлoвые инфекции, пиелонефрит, пневмония и т.д.
При назначении препаратов обязательно учитывается срок беременности. Крайне нежелательно применять антибиотики в первом триместре, когда происходит формирование жизненно важных органов плода. В этом случае антибактериальные препараты способны повреждать функции и органы ребенка, вызывая врожденные патологии. Если лечение матери все же необходимо, наши врачи обеспечивают строжайший контроль над процессом терапии, чтобы при возникновении даже малейших осложнений отменить препарат.
Если вам пришлось пройти курс лечения антибиотиками еще до беременности, но вы планируете зачатие, то его лучше отложить на два-три месяца. Однако если беременность наступила незапланированно, не переживайте: антибиотики, прием которых осуществлялся до задержки мecячных, вряд ли смогут негативно повлиять на здоровье вашего ребенка.
Как принимать антибиотики без вреда для здоровья
Основное условие, соблюдение которого необходимо для эффективного лечения антибиотиками с минимальным вредом для организма, – это прием препаратов строго по назначению врача с соблюдением дозировки, времени приема лекарств и длительности курса лечения. Если вы принимаете какие-то другие лекарства, обязательно сообщите об это нашему врачу, так как прием некоторых препаратов может быть несовместим с антибиотиками. Также на время курса лечения следует воздержать от употрeбления спиртного.
Необходимо срочно обратиться к врачу, если на фоне приема антибиотиков у вас обнаружились аллергические реакции, а также если улучшение самочувствия не наступает, а к имеющимся клиническим проявлениям добавились новые патологические симптомы.
Итак, как вы видите, антибиотики являются довольно «коварными» лекарствами, без которых, с одной стороны, обойтись нельзя, но с другой – после лечения ими восстановиться бывает довольно сложно. Если возникла крайняя необходимость, и наш врач выписал вам тот или иной антибиотик, строго соблюдайте все предписания и не прекращайте курс лечения даже при быстром наступлении улучшений.
Влияние антибиотиков на организм человека
С открытием пенициллина в 1928 году настала новая эпоха в жизни людей, эпоха антибиотиков. Мало кто задумывается над тем, что до этого открытия в течение тысячелетий главной опасностью для человека являлись именно инфекционные болезни, которые периодически принимали масштаб эпидемий, выкашивая целые регионы. Но и без эпидемий cмepтность от инфекций была чрезвычайно высока, и низкая продолжительность жизни, когда 30-летний человек считался пожилым, была обусловлена именно этой причиной.
Антибиотики перевернули мир, изменили жизнь если не больше, чем изобретение электричества, то уж точно не меньше. Почему же мы относимся к ним настороженно? Причина в неоднозначном влиянии этих лекарств на организм. Попробуем разобраться, каково же это влияние, и чем на самом деле стали антибиотики для людей, спасением или проклятием.
Препараты против жизни?
«Anti bios» в переводе с латинского означает «против жизни», получается, антибиотики – лекарства против жизни. Леденящее кровь определение, не правда ли? На самом деле, на счету антибиотиков миллионы спасенных жизней. Научное название антибиотиков – антибактериальные препараты, что более точно соответствует их функции. Таким образом, действие антибиотиков направлено не против человека, а против микроорганизмов, которые проникают в его организм.
Опасность в том, что большинство антибиотиков влияют не на одного возбудителя той или иной болезни, а на целые группы микробов, где есть не только болезнетворные бактерии, но и те, что необходимы для нормального функционирования организма.
Известно, что в кишечнике человека содержится около 2 кг микробов – огромное количество главным образом бактерий, без которых нормальное функционирование кишечника невозможно. Полезные бактерии присутствуют также на коже, в полости рта и влагалище – во всех местах, где может происходить контакт организма с чужеродной для него средой. Разные группы бактерий сосуществуют в балансе друг с другом и с иными микроорганизмами, в частности, с грибками. Нарушение баланса приводит к чрезмерному росту антагонистов, тех же грибков. Так развивается дисбактериоз, или дисбаланс микроорганизмов в теле человека.
Дисбактериоз это одно из самых распространенных негативных последствий приема антибиотиков. Частным его проявлением являются грибковые инфекции, яркий представитель которых – всем известная молочница. Вот почему, назначая антибиотики, врач обычно назначает и препараты, способствующие восстановлению микрофлоры. Однако принимать такие препараты нужно не во время антибиотикотерапии, а после нее.
Понятно, что чем более мощный препарат принимается и чем шире его спектр действия, тем больше бактерий погибнет. Вот почему желательно применять антибиотики широкого спектра действия только в случае крайней необходимости, а во всех иных ситуациях подбирать препарат узкого спектра действия, оказывающий прицельное влияние лишь на небольшие, нужные группы бактерий. Это является важной мерой профилактики дисбактериоза при проведении антибиотикотерапии.
Читать еще: Как распознать и как выглядит аллергия на коже у взрослых: фото первых признаков, вероятные аллергены и особенности терапии
Вредное воздействие полезных лекарств
Давно установлено, что безвредных лекарств не существует в природе. Даже самый безобидный препарат при неправильном применении вызывает нежелательные эффекты, что уж говорить о таких мощных лекарствах, как антибиотики.
Следует понимать, что побочные эффекты это возможное, но необязательное последствие приема антибактериальных средств. Если препарат прошел испытания и принят в клиническую практику, это значит, было однозначно и убедительно доказано, что его польза для большинства людей значительно превышает возможный вред. Тем не менее, все люди имеют особенности, реакция каждого организма на лекарство обусловливается сотнями факторов, и есть некоторое количество людей, чья реакция на препарат по той или иной причине оказалась скорее негативной.
Возможные негативные реакции всегда перечисляются в списке побочных эффектов любого лекарства. У антибиотиков способность вызывать побочные действия выражена достаточно сильно, поскольку они мощно влияют на организм.
Остановимся на основных нежелательных последствиях их приема:
- Аллергические реакции. Проявляться они могут по-разному, чаще всего это кожная сыпь и зуд. Аллергию могут вызывать любые антибиотики, но наиболее часто это цефалоспорины, бета-лактаны и пенициллины;
- Токсическое воздействие. Особенно уязвима в этом отношении печень, выполняющая в организме функцию очистки крови от ядов, и почки, через которые происходит выведение токсинов из организма. Гепатотоксическим действием обладают, в частности, антибиотики тетрациклинового ряда, а нефротоксическим – аминогликозиды, полимексины и некоторые из цефалоспоринов. Помимо этого, аминогликозиды могут вызвать необратимое поражение слухового нерва, что приводит к глухоте. Поражающим нервные структуры действием также обладают фторхинолоны и антибактериальные средства нитрофуранового ряда. Левомицетин оказывает токсическое влияние на кровь и на эмбрион. Негативным влиянием на процесс кроветворения известны антибиотики группы амфениколов, цефалоспорины и некоторые виды пенициллина;
- Подавление иммунитета. Иммунитет это защитные силы организма, его «оборона», оберегающая организм от вторжения болезнетворных агентов. Подавление иммунитета ослабляет естественную защиту организма, вот почему антибиотикотерапия не должна быть чрезмерно длительной. В той или иной степени иммунитет подавляет большинство антибактериальных препаратов, наиболее негативно в этом отношении действие тетрациклинов и того же левомицетина.
Таким образом, становится понятным, почему врачи настаивают на том, чтобы никогда и ни при каких условиях пациенты не занимались самолечением, тем более самолечением антибиотиками. При бездумном применении, при игнорировании имеющихся особенностей организма, лекарство может оказаться хуже болезни. Означает ли это, что антибиотики вредны? Разумеется, нет. Ответ лучше всего проиллюстрировать примером ножа: мало какой инструмент был и остается столь нужным и полезным человеку, однако при неправильном применении нож может стать орудием убийства.
Когда антибиотики вредны
Итак, антибиотики скорее полезны для человечества, хотя могут принести вред при определенных условиях. Однако есть состояния, когда прием антибиотиков однозначно не нужен. Это следующие патологии:
- Вирусные заболевания, включая грипп, которые врачи объединяют названием ОРВИ, а люди, не связанные с медициной, называют простудой. Антибактериальные препараты не действуют на вирусы, мало того, они снижают иммунитет, который является основным противовирусным инструментом;
- Диарея. Как мы выяснили ранее, прием антибиотиков может привести к дисбактериозу, одним из проявлений которого является именно диарея. При кишечных расстройствах антибиотики если и принимаются, то только по назначению врача после точного выявления возбудителя;
- Повышенная температура, головная боль, кашель. Вопреки расхожему мнению, антибиотик не является ни жаропонижающим средством, ни обезболивающим, ни противокашлевым. Высокая температура, кашель, головная, мышечная или суставная боль это лишь симптомы, присущие множеству заболеваний. Если они вызваны не бактериями, прием антибиотиков совершенно бесполезен, а с учетом побочных действий скорее вреден.
Подводя итог нужно сказать, что антибиотики – мощное и действенное лекарство, чье влияние на организм полностью зависит от того, насколько правильно оно используется.
Инфекции человека
- Бактериальные инфекции (41)
- Биохимия (5)
- Вирусные гепатиты (12)
- Вирусные инфекции (43)
- ВИЧ-СПИД (28)
- Диагностика (30)
- Зооантропонозные инфекции (19)
- Иммунитет (16)
- Инфекционные заболевания кожи (33)
- Лечение (38)
- Общие знания об инфекциях (36)
- Паразитарные заболевания (8)
- Правильное питание (41)
- Профилактика (23)
- Разное (3)
- Сепсис (7)
- Стандарты медицинской помощи (26)
10 последствий вреда антибиотиков
Всем привет, с вами Ольга Рышкова. Врачи назначают антибиотики для лечения заболеваний, вызванных бактериями, такими как некоторые инфекции дыхательных путей, инфекции кожи и инфицированных ран. Эти препараты блокируют жизненно важные процессы у бактерий, либо убивают их, либо останавливают их размножение. Это помогает нашей естественной иммунной системе бороться с инфекцией.
Различные антибиотики работают по-разному в отношении бактерий. Например, пенициллин разрушает клеточные стенки бактерий, а эритромицин останавливает строительство белка в бактериях.
Надлежащее применение антибиотиков имеет важное значение для своевременного лечения различных инфекций, однако они могут оказывать побочные эффекты, которые вызывают другие временные проблемы со здоровьем. Некоторые из них могут даже вызывать более серьезные заболевания. Какой вред оказывают антибиотики (т.е. антибактериальные препараты) на организм человека?
Вот 10 последствий вредного воздействия антибиотиков на детей и взрослых.
1. Диарея и запор.
Это два частых побочных эффекта применения антибиотиков. Антибактериальные препараты не разбираются, какие бактерии плохие, какие хорошие и нарушают баланс кишечной флоры, убивая нужные микроорганизмы наряду с инфекционными. Это приводит к антибиотик-ассоциированной диарее или запору. Среди них цефалоспорины, клиндамицин, пенициллин и фторхинолоны.
Использование пробиотиков эффективно в профилактике и лечении антибиотик-ассоциированной диареи и запора. Чтобы предотвратить или лечить этот побочный эффект, добавьте пробиотические йогурт, кефир, квашеную капусту в свой рацион.
2. Тошнота и рвота.
Принимая антибиотики, такие как пенициллин и метронидазол, многие люди испытывают тошноту и рвоту. Эти симптомы возникают, когда антибактериальные препараты убивают некоторые из полезных бактерий, живущих в вашем кишечнике. Возникает вздутие живота, тошнота и рвота, которые обычно слабо выражены и преходящи. В этом случае вы можете съесть пробиотический йогурт и выпить имбирный чай.
3. Вагинальные грибковые инфекции.
Грибок кандида и другие микроорганизмы, живущие во влагалище женщины, безвредны, если естественным образом сбалансированы. Антибиотики, такие как клиндамицин и тетрациклин, используемые для лечения инфекций, меняют естественный баланс в сторону увеличения грибков, убивая полезные бактерии. Это и приводит к развитию грибковой инфекции. Её симптомы — обильные, белые выделения из влагалища, жжение и зуд. Для лечения врач назначает противогрибковые препараты.
4. Аллергические реакции.
У некоторых людей есть аллергия на антибиотики, такие как пенициллин и цефалоспорины. Аллергические реакции могут включать такие симптомы, как крапивница, кожная сыпь, зуд, отёки, одышка, хрипы, насморк, лихорадка и анафилаксии.
Кроме того, исследования показывают связь между вредным воздействием антибиотиков на плод при беременности или в детстве и последующей астмой. Сведите к минимуму использование антибиотиков и держитесь от них подальше от тех, на которые у вас аллергия. Сообщайте о нeблагоприятных реакциях врачу, чтобы он заменил препарат.
5. Ослабление иммунитета.
Дружественные нам бактерии в желудочно-кишечном тракте формируют значительную часть иммунитета организма. Антибактериальные препараты без разбора убивают полезные и вредные бактерии и их длительное применение существенно снижает эффективность иммунной системы, тем самым увеличивая риск развития вторичных бактериальных инфекций. Лучше включите в свой рацион продукты с антибиотическими свойствами, таких как имбирь, йогурт, душица, грейпфрут, куркума и чеснок.
6. Риск развития рака.
Чрезмерное использование антибиотиков может вызвать окислительный стресс и увеличивает риск развития некоторых видов рака — толстого кишечника, молочной железы, печени. Помните, что антибиотиками не лечат вирусные инфекции (грипп, ОРВИ, гepпeс) и не принимайте их без острой необходимости.
7. Повреждение функции почек.
Некоторые антибактериальные препараты, такие как метициллин, ванкомицин, сульфаниламиды, гентамицин, фторхинолоны, гатифлоксацин, левофлоксацин, моксифлоксацин, стрептомицин могут быть вредны для ваших почек. Исследования обнаружили увеличение риска острого повреждения почек у мужчин, принимающих фторхинолоны.
Почки удаляют ненужные вещества, регулируют баланс воды и минералов в крови, даже небольшое повреждение них может вызвать серьезные проблемы. Если у вас есть почечная патология, сообщите о ней врачу для корректирования приёма лекарств. А если при приёме антибиотиков вы заметили изменения в мочеиспускании, отёки, тошноту и рвоту, обратитесь к врачу.
Читать еще: Лечение аллергии на комариные укусы у взрослого и ребенка
8. Инфекции мочевыводящих путей.
Антибиотики, используемые для лечения некоторых заболеваний, могут вызывать инфекции мочевыводящих путей (ИМП), особенно у детей. Они часто уничтожают полезные бактерии, живущие вблизи мочеиспускательного канала и способствуют росту опасных микроорганизмов в мочевых путях и мочевом пузыре. ИМП можно предотвратить, практикуя правила личной гигиены.
9. Заболевания внутреннего уха.
Все члeны семейства антибиотиков-аминогликозидов токсичны для внутреннего уха, куда препарат может попасть через кровеносную систему или путем диффузии из среднего уха во внутреннее. Более высок риск ототоксичности при использовании аминогликозидов у тех, кто принимает наркотики. Симптомы ототоксичности — частичная или глубокая потеря слуха, головокружение и шум в ушах (временные или постоянные).
10. Снижение эффективности пpoтивoзaчaточных таблеток.
Если вы принимаете таблетки для предупреждения беременности, рифампицин и подобные препараты могут снизить их эффективность. Это подтверждено исследованиями. При приёме антибиотиков, если вам необходимо использовать кoнтpaцепцию, попросите гинеколога предложить другие методы кoнтpaцепции, такие как инъекции прогестагена, внутриматочные устройства.
Как принимать антибиотики без вреда для здоровья.
- Помните, что побочные эффекты отличаются у разных людей и от разных антибиотиков.
- Во время приёма антибактериальных препаратов пейте много воды, чтобы избежать обезвоживания.
- Избегайте алкоголя и кофеина.
- Избегайте употрeбления острой пищи, переключитесь на мягкие диеты.
- Не принимайте лекарства без рецепта врача.
- Пройдите весь курс лечения, чтобы организм получил нужную дозировку.
- Никогда не принимайте оставшиеся после курса лечения препараты.
- Не принимайте антибиотики, выписанные для кого-то ещё. Ваши инфекционные бактерии могут отличаться от тех, для которых лекарство было рекомендовано.
- Не давите на врача, чтобы он назначил вам антибиотики для скорейшего выздоровления. Вместо этого спросите о методах облегчения симптомов.
- Используйте природные продукты-антибиотики, такие как имбирь, йогурт, мёд, душица, грейпфрут, куркума, чеснок для борьбы с инфекциями.
Если статья показалась вам полезной, поделитесь с друзьями в социальных сетях.
Как действуют антибиотики на организм, их плюсы и минусы
Антибиотики – это препараты, которые уничтожают патогенную микрофлору или сдерживают интенсивность ее размножения. Однако препараты не всегда обладают избирательным действием. Часто антибактериальные средства нeблагоприятно влияют на естественную флору, которая обитает в кишечнике человека и выполняет ряд важных функций. Без симбионтных бактерий невозможно нормальное пищеварение. Поэтому необходимо знать, как работают антибиотики и как их правильно принимать.
Механизм действия антибиотиков, их преимущества и недостатки
Главным эффектом от применения антибактериальных средств является уничтожение патогенных бактерий. При их проникновении в организм в тканях развивается воспалительная реакция и формируется инфильтрат, в котором размножаются микроорганизмы. Иногда распространение микроорганизмов сдерживается компонентами иммунитета – лимфоцитами, нейтрофилами, макрофагами. Однако при высокой патогенности вредного микроорганизма иммунитет не способен полностью уничтожить инфекцию.
В таком случае и требуется назначение антибактериальных средств. Действующее вещество некоторых препаратов проникает в очаг инфекции и уничтожает микроорганизмы напрямую, приводя к их гибели. Такое действие называется бактерицидным.
Другие лекарственные средства влияют на размножение микроорганизмов. Препараты тормозят активность синтеза белков и нуклеиновых кислот в клетке бактерии, вследствие чего микроорганизм не может размножаться. Численность патогенов резко снижается, оставшиеся бактерии уничтожаются иммунными клетками. Благодаря этому активность инфекции снижается.
- выраженный антибактериальный эффект;
- борьба с воспалительным процессом;
- купирование тяжелых инфекций за несколько дней;
- восстановление нормальной стерильности тканей.
- при перopaльном приеме – уничтожение бактерий нормальной микрофлоры, которое может привести к выраженному дисбактериозу;
- различные побочные эффекты (влияние на кроветворение, пищеварительную систему, метаболизм печени и т.д.);
- возможность передозировки при неаккуратном лечении.
Можно ли самостоятельно назначать себе антибиотики?
Самостоятельно покупать и использовать антибиотики строго запрещено, поэтому препараты отпускаются только по рецепту врача. Такое решение связано с выраженными побочными эффектами препарата. Пациенты должны понимать, что они не могут самостоятельно продумать все тонкости назначения:
- Оценить необходимость применения препарата. Многие люди хотят использовать антибактериальные средства при простейших инфекциях, хотя без них можно и обойтись. Лекарства данной группы не являются универсальными, антибиотики назначают только тогда, когда обойтись без них нельзя.
- Установить природу заболевания. Инфекция может быть не только бактериальной, но и вирусной, грибковой, протозойной. Против этих возбудителей антибиотики совершенно неэффективны. Отличить простуду от гриппа или ОРВИ без медицинской подготовки, конечно, можно, однако в большинстве случаев анализ клинической картины заболевания лучше проводить врачу.
- Подобрать подходящий препарат. Существует множество групп антибиотиков, каждая из которых имеет тропность к определенным микроорганизмам.
- Оценить риски использования средства. Пациент не способен самостоятельно проанализировать свое состояние и подобрать подходящее лекарство. Особенно это касается людей, у которых имеются какие-либо хронические заболевания. Они могут быть противопоказаниями к использованию того или иного препарата, вследствие чего бесконтрольное употрeбление этого лекарства нанесет вред пациенту и усугубит течение его болезни.
- Подобрать дозировку. Антибиотики – это препараты, которые должны принимать строго в определенные временные промежутки. Это необходимо для того, чтобы в организме пациента постоянно поддерживалась высокая концентрация действующего вещества, сдерживающего размножение бактерий. Точно установить порядок использования лекарства может только врач.
Когда прием антибиотиков оправдан?
Антибиотики применяются при местных и генерализованных инфекциях:
- бронхит, пневмония;
- менингит, энцефалит;
- аппендицит, холецистит, панкреатит;
- колит, колиэнтерит;
- фарингит, ларингит в тяжелых формах;
- гeнитaльные инфекции, передающиеся пoлoвым путем (сифилис, гoнopeя);
- цистит, уретрит, пиелонефрит;
- раневые инфекции;
- образование абсцессов, фурункулов, карбункулов.
Есть ли альтернатива антибиотикам?
Антибиотики – это уникальная группа препаратов, полной альтернативы которым практически нет. Применение народных средств, местных антисептиков эффективно при инфекциях с низкой степенью активности. При выраженных местных процессах лучше применять антибактериальные препараты.
Косвенное антибактериальное воздействие могут оказывать препараты из группы иммуностимуляторов. Это лекарства ускоряют выработку иммунных клеток, благоприятно влияют на состояние гумopaльной системы. Активированный иммунитет более эффективно борется с инфекцией в организме.
На данный момент разpaбатываются новые препараты, которые могут заменить антибиотики. Это лекарства, содержащие элементы бактериофагов – вирусов патогенных бактерий. Агенты внедряются в болезнетворные микроорганизмы и уничтожают их изнутри. При этом фаги не оказывают системного эффекта, которое является главным недостатком антибиотиков.
Какие бывают бактериофаги:
- сальмонеллёзный;
- протейный;
- коли;
- колипротейный;
- стрептококковый;
- стафилококковый;
- дизентерийный;
- синегнойной палочки;
- клебсиелл и т. д.
Выпускаются они виде растворов для наружного и внутреннего применения, некоторые существуют и в виде таблетированной формы.
Антибиотики. Их влияние на организм и микрофлору
Речь пойдет о антибиотиках, эдакой «тяжелой артиллерии» современной медицины. Все знают, что это эффективное средство против инфекционных болезней… при куче противопоказаний. Тем не менее широко применяемое. Человек, познакомившийся с медициной вплотную, обязательно столкнулся с этими препаратами и прочувствовал на своей шкуре всю «подлость» их применения. Соскочить с конвейера сопутствующих такому лечению проблем достаточно трудно, и дальнейшее восстановление здоровья в такой ситуации потребует значительных усилий.
Это статья о понимании принципов работы антибиотиков, о их негативном влиянии на наш организм и микрофлору.
Антибиотики — история создания
Если в пару словах, то антибиотики — это вещества, способные подавлять рост микроорганизмов или полностью их уничтожить.
Прародитель современных антибиотиков, пенициллин, был открыт Александром Флемингом еще в 1928г. Первые его версии работали очень не стабильно, и напоминали современные лекарства от рака: никто не мог дать гарантию, кто быстрее погибнет, пациент или бактерии, возбудители болезни. Чуть позже были выделены чистые формы антибиотика, что конечно смягчило ситуацию. Это было революционное открытие в медицине и очень своевременное: пенициллин во времена 2-й мировой спас просто огромное число жизней, и сколотил состояния тем, кто его изготовлял. Учитывая времена и нехватку лекарств, его применение было оправдано. С этого, пожалуй, и началась вера болеющих в «панацею» антибиотиков, и взятие их на вооружение медицины, как основы борьбы с вирусами , с бактериальными недугами и грибковыми инфекциями
Это было в прошлом. А в будущем нам только и осталось, что разгрeбaть последствия этого изобретения и его бездумных применений. И с каждым новым поколением работы прибавляется. И это самое «подлое»: негативные эффекты накапливаются и значительно проявляются в основном спустя поколения. Вспомните здоровье наших отцов, дедов — они, питаясь не самым лучшим образом, тем не менее, имели в большинстве достаточно крепкое здоровье. Теперь же болезни обрушиваются буквально с пеленок. Причем те из них, которые были присущи только взрослым. Да, проблема тут не только в антибиотиках, но именно их применение закладывает фундамент, притягивающий огромное количество проблем.
Читать еще: Повышают защитные свойства организма
Негативные воздействия и влияние антибиотиков на наш организм
Даже самое извpaщeнное питание не способно так «ломать» нас и наш микромир, как «лечение» антибиотиками. Последняя сотня лет со времен открытия пенициллина и последующего нарастающего применения его вариаций по поводу и без, дала больше проблем со здоровьем, чем все предыдущие человеческие «шалости» на протяжении веков.
Вот некоторые последствия применения антибиотиков:
- Подавление, как симбиотической микрофлоры, так и «враждебной». Создает территорию «отсутствия жизни» внутри нас, в которой в состоянии поселиться только бактерии с выработанной устойчивостью.
- Нарушение механизмов нашей системы «энергодобычи». Нарушается клеточное дыхание, что постепенно переводит организм в анаэробное состояние, ограничивая доступ кислорода к тканям.
- Антибиотики годаздо сильнее алкоголя и жиров «садят» печень, забивая её желчные проходы. Печень практически лишается способности накапливать гликоген. Как следствие обилие проблем: вялость, слабость, неуемный аппетит, гиподинамия. В уже поврежденную печень практически гарантированно заселяются паразиты.
- Быстро истощают буферные системы печени, призванные компенсировать токсические воздействия. Как следствие их недостатка — повышенный вред от ядов, болезни. Печень меняет свои функции: вместо очищения начинает загрязнять нас.
- Буквально «выключают» наш иммунитет.
Это часть пагубного воздействия, свойственная большинству видов антибиотиков. Остальные вариации вредностей будут зависеть от конкретных их видов. Благо их сегодня неисчислимые количества.
Антибиотики и микрофлора
Основное влияние антибиотиков, как известно, направлено на сдерживание роста микрофлоры и её уничтожение.
Многие виды препаратов изготовляют из грибов, ввиду их свойств подавлять окружающий микромир. Микробы-грибки активны и «враждебны» к большинству бактерий и достаточно устойчивы к их влиянию. Такие грибки — настоящие «варвары»микромира. Хотя есть и другие виды, которые используются в изготовлении препаратов, «подстегующих» наш иммунитет.
Организм и вся его населяющая микрофлора образуют устойчивый гомеостаз. Именно устойчивость и баланс всех процессов и взаимодействие с населяющими нас микробами определяет качество нашей жизнедеятельности. Любой антибиотик — ингибитор. Он подавляет жизненно важные химические реакции микробов, что приводит к их гибели. Применение любого такого препарата — серьезный «перекос» нашего гомеостаза и устойчивости микромира.
Антибиотики обеспечивают непродолжительную «стерильность» внутри нас. Что многими ошибочно трактуется как «благо», ввиду непонимания роли микрофлоры в нашей жизни. Именно её развитие у человека является наивысшим «приобретением» в эволюции, и именно благодаря сожительству с симбиотическими микроорганизмами мы обретаем наивысшую приспосабливаемость, иммунитет и гибкость среди всех живых существ. Любой серьезный перекос, который организму не удалось компенсировать, запускает по принципу домино череду серьезных нарушений и патологий!
Длительное применение антибиотиков создает среду в организме, в которой никто кроме самих молекул грибов и паразитов уже не может существовать. Расхожее мнение о том, что микрофлора быстро восстановится после такой бомбежки, — ошибочно. Она не вырастет, среда не позволит, а только дополнится пришедшими. А кто придет, пока иммунитет отключен? Те, кто будет обладать резистивностью к воздействию препарата, и на фоне «пробитого» иммунитета и задавленности микроорганизмов-конкурентов обязательно вспыхнут новыми проблемами. Болезнями.
Широко известен факт, что антибиотики своим воздействием расшатывают т.н. «грибо-бактериальное равновесие» в организме. Когда бактерии беспощадно «убивались» грибками и последние начинали преобладать, медики додумались дополнительно вводить противогрибковый препарат «Нистанин», дабы сдержать агрессию. Потом стало заметно, что на фоне всего этого падает иммунитет — и ему догадались помочь таблеткой. И т.д. Убивая одних — размножаются другие. Убиваем других — размножаются вообще кто не попадя. Так мы плавно «на волне» антибиотиков стремимся к стерильности. Которая для нас — cмepть.
Природные антибиотики
Микромир в каждый момент времени «сражается» за территории. В природе есть бактерии симбионты, а есть враги. Большинство искусственных антибиотиков направлены на широкий спектр микробов, и они создают условия нeблагоприятные для наших бактерий-симбионтов. Природные же «лекарства» более щадящие к дружественным нам «сожителям».
Самые известные природные антибиотики это чеснок, лук, острый перец и различные травы. Они отлично подавляют патогенов, хотя и «друзьям» достается. Поэтому в ситуациях когда первые явно преобладают, прием в пищу спец еды конечно оправданы. И первый признак того, что природные антибиотики необходимы — зов организма. Запах будет просто сводить с ума — вы не пропустите тяги на чеснок либо лук.
Естественная «версия» препаратов отличается от созданной в лабораторных условиях количеством побочных воздействий. Они минимальны. Если медицине вторичен вред, нанесенный печени и нашим тканям, то природе нет. Но все же ущерб возможен, хоть и с легкостью компенсируем, поэтому употрeбление этих продуктов в пищу здоровому человеку лишен необходимости.
Еще хочется дополнительно упомянуть о таком «целителе», как кислород. Обильно поступающий в кровь, он убивает анаэробных организмов, которыми и являются многие болезнетворы, являясь своего рода антибиотиком, который лишен изъянов. Обилие кислорода в тканях — норма для человека, и лучшая его «накачка» — аэробные нагрузки. Это «укол» жизненной энергии для нас.
Современно питание, химическое отравление среды и конечно применение антибиотиков привели практически всех людей к анаэробному существованию. Большинство средств современной медицины сводят на нет наш иммунитет и нарушают нормальную жизнедеятельность тканей и органов. Перспективы не радужные. Сегодня даже в большинстве минеральной воды в составе содержатся антибиотики. Это препятствует её порче и продлевает сохранение товарного вида. Антибиотики все больше превращаются в подобие снежного кома, который выгоден производителю, но не потребителю. Микробы к антибиотикам приспосабливаются довольно быстро, что заставляет все более развивать фармацевтику и бесконечно улучшать препараты. Заодно и генерировать новые патологии, которые мы исправно копим и передаем потомству. Если от болезней, вызванных неправильным питанием, излечиться достаточно просто, то после усиленного «лечения» медицины доза приложенных усилий несказанно растет.
Но основная проблема использования препаратов именно в нашей лени. Не лени врачей, ставящих диагноз и приписывающие соответствующее лечение, хотя и их она стороной не обошла, — а прежде всего нашей. Она, в сумме с безответственностью и безграмотностью относительно вопросов здоровья, вынуждает применять антибиотики при малейших послаблениях и простудах. Даже в лечении своих детей. Большинство применяющих даже не знают того, что антибиотики абсолютно бесполезны против вирусных инфекций.
Как думаете сколько человек, при диагнозе и приписке курса антибиотиков «погуглит» в интернете причины тревожащих симптомов, поставленный диагноз, назначенный препарат? Единицы. А те, кто «осмелился» это сделать — быстро нашли альтернативные пути более адекватного и эффективного лечения.
Всего комментариев: 32
Юрий, спасибо за статью, очень познавательно. Нужен Ваш совет. Пила антибиотик 7 дней, после него еще назначены свечи для поднятия иммунитета и свечи для восстановления микрофлоры. Но на 7 день приема антибиотиков, после разговора с братом, решила больше не пить никакие лекарства, а перейти на сыроедение, что в тот же день и сделала. Теперь я на сыроедении всего лишь 4-й день, пока все отлично, удивило то, что хочется есть все по отдельности. Вопрос такой: как Вы считаете, стоит ли мне применять прописанные свечи или этим я только сделаю хуже организму. Вроде решила от них отказаться, а теперь сомневаюсь…Что вы думаете если делать самомассаж в домашних условиях.
Алиса, я думаю только вы знаете как может отреагировать на это действие Ваш организм. А что могу подсказать я? Не зная Вас, вашего организма, даже причин употрeбления антибиотиков? Все слишком индивидуально.
Антибиотики сажают печень и вредят микрофлоре, сейчас только ими и лечат, поэтому приходится принимать доп препараты гепатопротекторы иначе к старости будет совсем худо, когда мне назначали курс урсосана я только расстраивалась — опять пить таблетки, теперь думаю только о том как хорошо что мне его назначали, без него пришлось бы сильно себя ограничивать чтобы не навредить печени, а так даже обследования показывают что сейчас она в очень хорошем состоянии.
Интересная статья,очень полезно знаь такие вещи!
Важно знать родителям о здоровье:
FitoSpray для похудения (Фитоспрей)
FitoSpray для похудения ( Фитоспрей) FitoSpray — спрей для похудения Многие мечтают похудеть, стать стройными, обрести фигуру мечты. Неправильное питание,…
06 02 2023 15:22:24
Фитостеролы в продуктах питания
Фитостеролы в продуктах питания Фитостерины Существует много питательных веществ, которые, как утверждают исследователи, могут положительно повлиять на…
05 02 2023 10:48:32
Фитотерапевт
Фитотерапевт Фитотерапевт Я, Ирина Гудаева — травница, массажист, ведущая семинаров по созданию натуральной косметики и курса « Практическое травоведение»…
04 02 2023 4:58:45
Fitvid
Fitvid Брекеты: минусы, трудности, проблемы Брекет-системы помогли избавиться от комплексов миллионам людей. Это действительно эффективный инструмент,…
03 02 2023 12:56:21
Фониатр
Фониатр Фониатрия – один из разделов медицины. Фониатры изучают патологии голоса, методы их лечения, профилактики, а также способы коррекции…
31 01 2023 12:46:23
Форель
Форель Форель относится к отряду лососеобразных, семейству лососевых. Ее тело удлинено, немного сжато с боков, покрыто мелкой чешуей. Замечательной…
30 01 2023 7:25:59
Формула идеального веса
Формула идеального веса Калькулятор нормы веса Вес 65 кг относится к категории Норма для взрослого человека с ростом 170 см . Эта оценка основана на…
27 01 2023 6:27:40
Формулы расчета идеального веса
Формулы расчета идеального веса Фoрмулa «идeальнoго вeса» То, что ожирение шагает семимильными шагами по планете – это факт. И, несмотря на то, что…
26 01 2023 19:34:15
Фосфатида аммонийные соли
Фосфатида аммонийные соли Аммонийные соли фосфатидиловой кислоты ( Е442) Е442 – это пищевая добавка, которую относят к категории эмульгаторов. Вещество…
25 01 2023 13:22:11
Фототерапия новорожденных
Фототерапия новорожденных Фототерапия новорожденных Применение фототерапии для новорожденных С момента своего рождения организм ребенка начинает адаптацию…
24 01 2023 10:36:56
Фототерапия новорожденных при желтухе
Фототерапия новорожденных при желтухе Фототерапия новорожденных После появления ребенка на свет его организм адаптируется к совершенно иным условиям…
23 01 2023 1:23:44
Французская диета
Французская диета Французская диета Эффективность: до 8 кг за 14 дней Сроки: 2 недели Стоимость продуктов: 4000 рублей на 14 дней Общие правила…
22 01 2023 9:44:30
Фрукт Кумкват — что это такое?
Фрукт Кумкват — что это такое? Фрукт Кумкват — что это такое? Впервые упоминают необычный для европейцев фрукт китайские летописи 11 века. Португальские…
21 01 2023 13:30:48
Фруктовая диета
Фруктовая диета Фруктовая диета Эффективность: 2-5 кг за 7 дней Сроки: 3-7 дней Стоимость продуктов: 840-1080 рублей в неделю Общие правила Фруктовая…
19 01 2023 18:45:28
Фруктоза при диабете
Фруктоза при диабете Можно ли фруктозу при сахарном диабете? Для многих диабет является той проблемой, которая вносит в жизнь ряд ограничений. Так, к…
16 01 2023 19:25:32
Фрукт свити – польза и вред
Фрукт свити – польза и вред Свити — что это за фрукт? Что такое свити? Продолжаем разбирать цитрусовые, но как всегда идем не по верхам, а копаем глубже и…
13 01 2023 3:26:54
Фрукты и ягоды
Фрукты и ягоды Разница между фруктом и ягодой Фрукты и ягоды любят практически все. Ведь они такие вкусные и полезные! Мы любуемся лежащими на столе…
12 01 2023 18:41:40
Фтизиатр
Фтизиатр Врачи фтизиатры Москвы Фтизиатр — это дипломированный специалист в области фтизиатрии. Он специализируется на профилактике, диагностике, лечении…
10 01 2023 4:35:40
Фтор в организме человека
Фтор в организме человека Фтор в организме человека Дневная норма потрeбления Мужчины старше 60 лет Женщины старше 60 лет Беременные (2-я половина)…
09 01 2023 21:27:58
Боли в спине после рождения ребёнка
Боли в спине после рождения ребёнка Почему после родов болит спина У мамочек нередко болит спина после родов. Причем, дискомфорт может длиться довольно…
06 01 2023 10:43:50
Фунчоза: польза и вред
Фунчоза: польза и вред Фунчоза: польза и возможный вред Увлечение восточной кухней год от года растет. Принято считать, что такой рацион полезен для…
05 01 2023 16:21:19
Фундук
Фундук В рационе здорового человека обязательно присутствуют орехи в различных вариациях. Среди них выгодно выделяется фундук. Высокая пищевая ценность и…
04 01 2023 23:47:26
Фуросемид таблетки инструкция по применению
Фуросемид таблетки инструкция по применению Инструкция по применению: Цены в интернет-аптеках: Фуросемид – синтетическое диуретическое лекарственное…
01 01 2023 17:35:26
Галактоза
Галактоза Галактоза – это представитель класса простых молочных сахаров. В человеческий организм поступает преимущественно в составе молока,…
31 12 2022 10:56:13
Галанга
Галанга С древних времен растения играют важную роль в жизни человека, в том числе и для поддержания здоровья. Некоторые травы известны как лучшие…
30 12 2022 3:29:37
Галега лекарственная
Галега лекарственная Галега лекарственная (Galega officinalis) Син: козлятник лекарственный, козлятник аптечный, козья рута, французская сирень, солодянка…
29 12 2022 0:25:27
Боли в суставах при беременности
Боли в суставах при беременности Боли в суставах при беременности В период беременности у женщины могут возникать различные боли в самых разных местах….
26 12 2022 14:44:14
Гастрит и изжога
Гастрит и изжога Лучшие лекарства от изжоги и гастрита Многие пациенты с гастритом и другими заболеваниями Ж К Т страдают от изжоги. Данный симптом может…
25 12 2022 14:33:32
Где находится ключица у человека на фото?
Где находится ключица у человека на фото? Ключица человека: анатомия, строение, функции Ключица – это единственное костное образование в теле человека,…
22 12 2022 4:57:20
- Авторы
- Научный руководитель
- Файлы
- Литература
Кувшинникова Е.В.
1
1 г. Карабаш, МКОУ СОШ № 1, 8 класс
Еремина Е.В. (Карабаш, МКОУ СОШ № 1)
1. Багрова Л.А. «Я познаю мир. Растения». – М.: АСТ, 2008.
2. Воробьев А.А., Кривошеин Ю.С., Быков А.С. Основы микробиологии, вирусологии и иммунологии. Москва: Мастерство, 2001. – 224 с.
3. Иллюстрированная энциклопедия школьника «Ботаника». – М.: «Мир энциклопедий Аванта +», 2007. – 96 с.
4. Околитенко Н.И. «Биология для увлеченных», Ростов-на-Дону, «Феникс», 2006
5. Покровский В.Н. Антибиотики и бактерии. Москва: Знание, 1990. 64 с.
6. Стейниер Р., Эдельберг Э., Ингрэм Дж. Мир микробов, тт. 1–3. М., 1979.
7. URL: http://bio.freehostia.com.
В прошлом году мной были изучены вредные и полезные свойства плесени, проведенное исследование представлено в работе «Плесневые грибы: польза и вред». Когда я изучала свойства плесени, меня заинтересовало получение антибиотиков из плесневых грибов, я решила изучить подробнее антибиотики и их влияние на живые организмы, определив, что больше они несут миру: добро или зло.
На протяжении многих веков человечество атаковали многочисленные инфекции, унося миллионы жизней. И после того, как было доказано, что инфекционные заболевания вызываются болезнетворными бактериями, еще почти сто лет не существовало хороших антибактериальных средств. Спасение пришло лишь в двадцатом веке с появлением антибиотиков. Появление этих препаратов произвело настоящую революцию в медицине, так как врачи впервые получили возможность эффективно лечить инфекционные заболевания[1]. Однако, спустя некоторое время об антибиотиках заговорили как о враге, убивающем все живое. И до сих пор ученые умы не могут прийти к однозначному мнению, что же такое антибиотики – добро или зло.
Проблема: В современных средствах массовой информации тема вредного воздействия антибиотиков на организм поднимается постоянно, но необходимость применения их в лечении заболеваний неоспорима, между тем использование антибиотиков в пищевой промышленности вызывает стойкий иммунитет у бактерий к антибиотикам, что затрудняет лечение многих заболеваний
Цель работы – Изучить влияние антибиотиков на живые организмы
Задачи исследования.
1. Познакомиться с историей открытия антибиотиков
2. Рассмотреть принцип классификации антибиотиков
3. Изучить свойства антибиотиков и их применение человеком
4. Определить влияние антибиотиков на биологические объекты
5. Рассмотреть правила использования антибиотиков.
Объект исследования: антибиотики
Предмет исследования: воздействие антибиотиков на живые организмы.
Гипотеза: Антибиотики с одной стороны – приносят пользу, так как уничтожают вредные бактерии, но с другой стороны – чрезмерное использование антибиотиков негативно влияет на биологические объекты. Необходимо соблюдать определённые правила и меры предосторожности в использовании антибиотиков.
Общая характеристика антибиотиков
История изучения
В 1928 году Александр Флеминг проводил рядовой эксперимент в ходе исследования болезнетворных бактерий. Вырастив колонии стафилококков, он обнаружил, что некоторые из них заражены обыкновенной плесенью Penicillium, которая растёт на лежалом хлебе, делая его зелёным. Вокруг каждой колонии плесени была область, в которой бактерий не было. Флеминг сделал вывод, что плесень вырабатывает вещество, убивающее бактерии, которое он назвал «пенициллин». Это и был первый современный антибиотик, о котором Флеминг доложил 13 сентября 1929 года на заседании Медицинского исследовательского клуба при Лондонском университете. Однако даже после опубликования статьи сообщение не вызвало у медиков энтузиазма. Дело в том, что пенициллин оказался очень нестойким веществом, он разрушался даже при кратковременном хранении [2].
Термин «антибиотик» был предложен в 1942 г. С.А. Ваксманом для обозначения веществ, образуемых микроорганизмами и обладающих антимикробным действием. Антибиотики (от др.-греч. анти – против + биос – жизнь) – вещества природного или полусинтетического происхождения, подавляющие рост живых клеток, чаще всего прокариотических или простейших [2].
Зинаида Виссарионовна Ермольева – руководитель лаборатории, в которой был впервые получен первый отечественный антибиотик. Это было в 1943 год. Шла Великая Отечественная Война. Тысячи раненых в госпиталях. Не просто повальная нехватка медикаментов, но и отсутствие элементарных санитарных условий для оказания помощи раненым. Многие погибают не от ран, а от заражения крови. После серии успешных опытов на мышах, свинках и жеребятах начались срочные клинические испытания в столичных госпиталях. Ободренное положительными результатами, в 1943 году правительство разрешает организацию производства пенициллина на одном из московских заводов.
С получением пенициллина как препарата (1940 год) возникло новое направление в науке – учение об антибиотиках. К настоящему времени их описано почти 7000 (образуемых лишь микроорганизмами); при этом только около 160 используется в медицинской практике. [3]
Антибиотики природного происхождения чаще всего продуцируются актиномицетами, реже – немицелиальными бактериями.
Свойства антибиотиков
Все антибиотики обладают совершенно уникальными свойствами. Одно из таких свойств – избирательность действия против болезнетворных микроорганизмов в условиях макроорганизма. Например, пенициллин – губителен для гонококков, стрептококков, но безопасен для дизентерийной и кишечной палочки. Полимиксин – безвреден для кокков, но уничтожает палочки. Левомицетин и ампициллин – антибиотики широкого спектра действия, которые действуют и на те, и на другие бактерии .[5] Антибиотики обычно не воздействуют на вирусы и поэтому бесполезны при лечении заболеваний, вызываемых вирусами (например, грипп, гепатиты A, B, C, ветряная оспа, герпес, краснуха, корь).
Многочисленные экспериментальные исследования в России показали, что большинство используемых антибиотиков хорошо проникает в ткани растений через корни, стебли, листовую поверхность, впитывается в семена [6]. Скорость проникновения в растение так же определяется свойствами антибиотика.
Классификация антибиотиков
По характеру воздействия на бактериальную клетку антибиотики можно разделить на две группы:
бактериостатические (бактерии остаются живы, но не в состоянии размножаться). В таком случае количество бактерий уменьшается по мере естественного отмирания, а также под воздействием иммунной системы человека
бактерицидные (бактерии погибают, а затем выводятся из организма). Они разрушают бактерии полностью, быстро и в больших количествах. В качества примера можно привести ампициллин, гентамицин, пенициллин.
Классификация по химической структуре, которую широко используют в медицинской среде:
Пенициллины – вырабатываются колониями плесневого грибка Penicillinum;
Цефалоспорины – обладают схожей структурой с пенициллинами. Используются по отношению к пенициллинустойчивым бактериям.
Тетрациклины – используются для лечения инфекций дыхательных и мочевыводящих путей, лечения тяжёлых инфекций типа сибирской язвы, туляремии, бруцеллёза. Действие – бактериостатическое.
Противогрибковые антибиотики – разрушают мембрану клеток грибков и вызывают их гибель. Действие – литическое. Постепенно вытесняются высокоэффективными синтетическими противогрибковыми препаратами [5]
Применение антибиотиков
В медицине
Антибиотики представляют собой самую многочисленную группу лекарственных средств. Они используются для предотвращения и лечения воспалительных процессов, вызванных бактериальной микрофлорой .Антибиотики незаменимы при остром развитии болезни – ангины и пневмонии. Без применения антибиотиков нередко развиваются серьезные осложнения, например, после ангины, не леченной антибиотиками, могут возникнуть поражения сердца (ревматизм, миокардит) и почек (гломерулонефрит), а после острых заболеваний (пневмонии, гайморита и др.) очень часто формируются хронические вялотекущие заболевания(хроническая пневмония,хронический гайморит, хроническая инфекция мочевыводящих путей) [3]. Некоторые антибиотики используются в качестве противоопухолевых) препаратов при лечении онкологических заболеваний.
В настоящее время ведутся активные работы по изысканию антибиотиков нового поколения, эффективных при лечении вирусных и раковых заболеваний.
В сельском хозяйстве и пищевой промышленности
При хранении пищевых продуктов происходит их порча, вызываемая развитием микроорганизмов. Для борьбы с вредной микрофлорой наряду с физическими методами применяют химические, в том числе с использованием антибиотиков.
Применение антибиотиков при хранении и транспортировке молока без охлаждения позволяет удлинить сроки хранения до четырех суток при 30 °С.
В растениеводстве антибиотики используются в качестве гербицидов, инсектицидов, стимуляторов роста растений. Наиболее эффективным в борьбе с болезнями растений является метод опрыскивания.
Сохранение свежего мяса, рыбы и птицы затруднено из-за того, что эти продукты – идеальная среда для развития микроорганизмов, поэтому антибиотики используют для консервации мяса, рыбы, птицы, плодов, овощей и др.
Антибиотик скармливают животным непосредственно перед убоем или вводят его под давлением в сонную артерию сразу же после убоя. Это позволяет увеличить срок хранения свежего мяса до 2-3 суток и улучшить его внешний вид, запах, окраску. Эффективно также опрыскивание разделанных и охлажденных говяжьих туш раствором антибиотика. Добавка антибиотика удлиняет срок хранения мясного фарша [1].
Применение антибиотиков позволяет значительно удлинить сроки хранения свежей рыбы. Рыбу погружают в раствор антибиотика на 1-5 мин. Увеличиваются также сроки хранения рыбы при содержании ее на дробленом льду, содержащем 1-2 мг/л хлортетрациклина.
Подобные методы применяют для удлинения сроков хранения птицы. В отдельных случаях сроки хранения удается увеличить в 2-3 раза.[7]
Так как антибиотики имеют свойства накапливаться в тканях организма, то при варке любого мяса необходимо сливать первую воду после закипания, так как все антибиотики и другие вет.препараты переходят в неизменном состоянии в бульон.
Вредное воздействие антибиотиков
Все антибиотики обладают побочными действиями. Остановимся на основных нежелательных последствиях их приема, в том числе с пищей:
Аллергические реакции. Проявляться они могут по-разному, чаще всего это кожная сыпь и зуд. Аллергию могут вызывать любые антибиотики, но наиболее часто это цефалоспорины, бета-лактаны и пенициллины;
Токсическое воздействие. Особенно уязвима в этом отношении печень, выполняющая в организме функцию очистки крови от ядов, и почки, через которые происходит выведение токсинов из организма.
Диарея. Прием антибиотиков может привести к дисбактериозу, одним из проявлений которого является именно диарея. При кишечных расстройствах антибиотики если и принимаются, то только по назначению врача после точного выявления возбудителя;
Подавление иммунитета. Иммунитет это защитные силы организма, его «оборона», оберегающая организм от вторжения болезнетворных агентов. Подавление иммунитета ослабляет естественную защиту организма, вот почему антибиотикотерапия не должна быть чрезмерно длительной[7].
Вирусные заболевания, включая грипп, которые врачи объединяют названием ОРВИ, а люди, не связанные с медициной, называют простудой , антибиотики не лечат. Антибактериальные препараты не действуют на вирусы, мало того, они снижают иммунитет, который является основным противовирусным инструментом.
Что необходимо помнить и знать об антибиотиках
— Уберите из аптечки антимикробные препараты. Принимайте их только в отдельном конкретном случае.
— Принимайте антибиотики строго по предписанию врача.
— При гриппе антибиотики не принимают.
— Не все кишечные инфекции лечатся антибиотиками. Необходимо точно определить возбудителя.
— Желательно один и тот же антибиотик применять не чаще, чем через 6 месяцев.
— Даже если с кем-то вам поставили один и тот же диагноз, нельзя использовать антибиотик, назначенный другому. Здесь важен индивидуальный подход в лечении.
— Необходимо строго соблюдать сроки применения препарата.
— Следите за сроком действия препарата. Просроченные антибиотики могут быть не только бесполезны, но и токсичны.
— Если улучшения состояния не наступает на 2-й – 3-й день приема лекарства (не снижается температура, не уходят симптомы заболевания), необходимо обратиться к врачу. Скорей всего, антибиотик придется заменить[3].
Если же лечиться все же придется, необходимо соблюдать некоторые правила.
— Если Вы беременны или кормите ребенка грудью, противомикробная терапия может быть не показана. Сообщите врачу об этих обстоятельствах.
— Проинформируйте также врача о препаратах, которые вы постоянно или периодически вынуждены принимать. Не со всеми препаратами антибиотики могут сочетаться.
— Расскажите врачу о своих аллергических реакциях, если таковые имеют место. Необходимо также сообщить врачу о своих хронических заболеваниях.
Практическая часть
Качественные реакции на антибиотики.
В ходе эксперимента сравнили строение лекарственных препаратов с известными нам соединениями (фенолами, продуктами гидролиза белков ) и выявили схожесть структуры фрагментов их молекул. Опираясь на теорию строения органических соединений А. М, Бутлерова мы сделали вывод о том, что близкие по строению вещества проявляют сходные химические свойства.
Взяли антибиотики : тетрациклин, ампициллин и цефалексин массой 50 мг, растолкли в ступке пестиком, затем добавили 5 мл воды и профильтровали. (Приложение 1)
1. В раствор с тетрациклином добавили 2 капли хлорида железа (III): в присутствии тетрациклинов появляется зеленовато-коричневое окрашивание, что говорит о наличии фенольной группы . (Приложение 2)
2. В раствор ампициллина добавили раствор гидроксида натрия и сульфата меди. Появляется фиолетовое окрашивание, характерное для биуретовой реакции, постепенно окраска изменяется на бурую.(Приложение 2)
3. В раствор цефалексина добавили раствор гидроксида натрия и сульфата меди. Появляется сине-фиолетовое окрашивание, вследствие образования комплексного соединения[7]. (Приложение 2)
Наличие антибиотиков в продуктах питания [5]
Опыт № 1 (Использовалась технология ГОСТ). В стерильную емкость наливаем 100 мл молока, добавляем чайную ложку свежей сметаны. Через 3-4 часа смотрим на результат: если ингибиторы отсутствуют – у нас получается простокваша. Согласно технологическому регламенту качества молока, определенная доля антибиотиков официально допустима – в сотых-тысячных долях процентов.
Для определения антибиотика были взяты пробы молока от трёх производителей: «Чебаркульское», «Первый вкус», «Домик в деревне», в каждую пробу добавили 1 ложку сметаны. (Приложение 3)
«Чебаркульское» молоко свернулось через 4 часа, «Первый вкус» через 12 часов, а «Домик в деревне» свернулось только на 3 сутки, следовательно антибиотик выше нормы содержится в молоке «Первый вкус»,«Домик в деревне». Проверка данной пробы хлоридом железа дало окрашивание в бурый цвет, предположили наличие либо ампициллина, либо тетрациклина.
Опыт № 2. Исследование сока чеснока на наличие природного антибиотика. [6]
В пробирку добавила 1 мл фильтрата сока чеснока, прибавила 1 мл раствора хлорида бария. Наблюдала образование белого осадка тиосульфата бария. Осадок образуется медленно. Эта реакция доказывает наличие природных антибиотиков в чесноке, так как мы знаем, что при взаимодействии сульфатной кислоты и хлорида бария выпадает осадок белого цвета сульфата бария. (Приложение 4, 5)
Действие антибиотиков на живые организмы
Опыт № 1. Выращивание бактерий на питательной среде. На питательной среде (мясной бульон) вырастили колонии бактерий. Предварительно ватной палочкой взяли смывы с ручки дверей в школе, с парты, пробу воздуха (в течение 7 минут), затем поместили их на питательную среду в чашке Петри, чашки закрыли стеклянными крышками, убрали в тёплое место (t = 37) [4].
Через сутки появились бактерии. (Приложение 6)
Опыт № 2. Действие антибиотиков на бактерии. Взяли антибиотики тетрациклин, цефалексин, пенициллин и подействовали ими на бактерии. Колонии бактерий рассмотрели в микроскоп, предварительно окрасив их метиленовым оранжевым, увеличение микроскопа 1200. Наблюдали бактерии: кокки, диплококки, стрептококки. (Приложение 7)
Выводы: Бактерии погибли быстро после действия тетрациклина, значит это сильный антибиотик. Колония бактерий растет до тех пор, пока ей это позволяет делать концентрация антибиотиков. При каждом увеличении концентрации основная масса бактерий гибнет, но всегда остается небольшая группа, которой удается адаптироваться и выжить благодаря удачному накоплению генетических изменений. Когда число таких мутантов возрастает, их потомки мигрируют в области с еще более высокой концентрацией антибиотиков. Значит, бактерии приспосабливаются к антибиотикам, а значит необходимо получение новых антибиотиков.
Опыт № 3. Влияние антибиотиков на прорастание семян фасоли и рост проростков. Для опыта взяли семена фасоли. 10 семян положили на влажную вату смоченную раствором пенициллина в емкость, в другую емкость положили 10 семян на вату смоченную водой. (Приложение 
|
№ пробы |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
№ 1 – раствор пенициллина |
— |
Семена набухли |
Появление проростков |
Проросло 6 семян |
8 проростков |
10 проростков |
Проростки крупные, с хорошо развитой корневой системой |
|
№ 2 – водопроводная вода |
— |
Семена набухли |
— |
Появление проростков |
Проросло 5 семян |
7 проростков |
8проростков среднего размера. |
При дальнейшем поливе раствором пенициллина наблюдаем истончение корня и последующую гибель проростков. Проростки, поливаемые водой, развиваются нормально[5].
Вывод: Антибиотики повышают всхожесть семян, ускоряет прорастание семян, проростки крупные, с хорошо развитой корневой системой. Всхожесть семян замоченных в пенициллине 100 %, в воде 90 %. Но при использовании антибиотиков в дальнейшем, происходит гибель растений.
Опыт № 4. Выращивание культуры простейших и действие на них антибиотиком. Взяли одну часть воды из аквариума, долили столько же водопроводной воды, поместили в банку немного кожуры банана и 2-3 капли молока. Оставили на 2 недели. Каплю из банки поместили на предметное стекло и рассмотрели под микроскопом. В воде обнаруживаются простейшие (инфузории), которые активно передвигаются. При добавлении к культуре простейших раствора антибиотика слабой концентрации, видимых изменений, мы не обнаружили. При увеличении концентрации движения простейших замедляются, а потом прекращаются вовсе, наступает гибель простейших.
Вывод: Антибиотики в высокой концентрации вызывают гибель простейших
На основании проведенных исследований можно сделать следующие выводы:
1. С помощью качественных реакций можно определить наличие определенных веществ в антибиотиках, следовательно определить их свойства, согласно теории Бутлерова.
2. В определённой концентрации антибиотики способны увеличивать всхожесть семян, ускорять развитие растения, стимулировать корнеобразование.
3. На взрослые проростки пенициллин действует угнетающе, вызывает истончение листьев, усыхание корней.
4. Чеснок обладает сильным бактерицидным действием, так как имеет природный антибиотик.
5. В домашних условиях можно определить наличие антибиотиков в молоке. «Чебаркульское» молоко является натуральным продуктом.
6. Высокая концентрация антибиотика приводит к гибели простейших и бактерий.
7. Сильным антибиотиком является тетрациклин [2].
Заключение
Таким образом, на главный вопрос нашего исследования, чем являются антибиотики для всего живого – добром или злом, однозначно ответить нельзя. Гипотеза, выдвинутая в начале исследования, была доказана.
Антибиотики широко используются в медицине, в современном сельском хозяйстве и пищевой промышленности, увеличивая срок хранения продуктов, спасая от смертельных заболеваний.
В то же время, они не разрушаются при тепловой обработке и способны накапливаться в живых организмах и продуктах питания. Большинство современных антибиотиков негативно влияет на живые организмы, нарушает их нормальную жизнедеятельность. Неправильное и чрезмерное использование антибиотиков приводит к их попаданию в природные экосистемы с током воды, навозом, почвой и т.д. и способно нарушать цепи питания в них. Бесконтрольное употребление антибиотиков человеком и животными может привести к мутациям у бактерий и возникновению стойкой резистентности к медицинским препаратам, что в свою очередь приведет к вспышке различного рода инфекций. Для того чтобы антибиотики не принесли большого вреда надо соблюдать некоторые правила.
Приложение № 1
Фильтрование. Фото руководителя 10.11.2017
Приложение № 2
Качественные реакции на антибиотики (справа – налево: ампициллин, тетрациклин, цефалексин) 1,2, 3 Фото руководителя 08.11.2017
Приложение № 3
Результат пробы на антибиотики Фото руководителя 14.11.2017
Приложение № 4
Получение сока чеснока Фото руководителя 08.11.2017
Приложение № 5
Качественные реакции на сульфатную кислоту, выпадение белого осадка. Фото автора 10.11.2017
Приложение № 6
Выращивание бактерий. Фото руководителя 16.11.2017
Приложение № 7

Приложение № 8
Проращивание семян фасоли. Фото автора 14.11.2017
Библиографическая ссылка
Кувшинникова Е.В. АНТИБИОТИКИ: ДОБРО ИЛИ ЗЛО? // Международный школьный научный вестник. – 2018. – № 4-2.
;
URL: https://school-herald.ru/ru/article/view?id=578 (дата обращения: 10.02.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Статью подготовила
врач по медицинской профилактике
Борисовской ЦРБ
В.И. Коновалова
Одним из важнейших открытий XX века, позволившим спасти миллионы жизней, стал антибиотик — препарат, применяемый для лечения бактериальных инфекций.
Многим кажется, что антибиотики излечивают всё. Поэтому всякий раз, когда в организме появляется инфекция, такие люди бегут не к врачу, а в аптеку за антибиотиками. Действительно, правильно подобранные таблетки быстро уменьшают симптомы заболевания, но этот тип препаратов следует применять только в строго определенных случаях. Например, они не подходят для лечения вирусов.
Антибиотики — это особые вещества биологического происхождения, способные подавлять рост микробов и микроорганизмов или полностью уничтожать их.
Антибиотики призваны помочь человеку побороть инфекционное заболевание, но при этом крайне важно не нанести дополнительного вреда здоровью. Чтобы не пришлось столкнуться с серьезными осложнениями, недопустим бесконтрольный приём подобных лекарств — любые препараты должны назначаться врачом и приниматься строго под его контролем.
Негативное влияние антибиотиков на организм
- Происходит подавление не только патогенной, но и полезной микрофлоры в организме. Это приводит к тому, что в вашем организме создается своеобразная «безжизненная среда», в которой могут существовать только микроорганизмы с выработанной устойчивостью.
- Происходит нарушение клеточного дыхания, а, значит, доступ кислорода к тканям значительно ограничивается, то есть ваш организм как бы переходит в анаэробное состояние.
- Негативно влияют антибиотики и на печень, забивая желчные проходы этого органа. Причём отрицательное влияние это намного сильнее, чем от регулярного употребления спиртного.
- Стремительно истощаются и буферные системы печени, основное предназначение которых состоит в компенсации токсических воздействий. Постепенно печень кардинально меняет свои функции, и вместо очищения она загрязняет наш организм. Для того, чтобы избежать этого негативного последствия, в ряде случаев врачи назначают в дополнение к антибиотикам препараты для поддержки нормальной работы печени.
- Длительный приём антибиотиков в прямом смысле слова «выключает» нашу иммунную систему.
Как принимать антибиотики без вреда для организма?
- Принимать препараты строго по назначению врача с соблюдением дозировки, времени приёма лекарств и длительности курса лечения.
- Если вы принимаете какие-то другие лекарства, обязательно сообщите об это вашему врачу, так как приём некоторых препаратов может быть несовместим с антибиотиками.
- Также на время курса лечения следует воздержать от употребления спиртного.
Необходимо срочно обратиться к врачу, если на фоне приёма антибиотиков у вас обнаружились аллергические реакции и если улучшение самочувствия не наступает, а к имеющимся клиническим проявлениям добавились новые патологические симптомы.
- Ни в коем случае не прерывайте лечение, если вам или вашему ребёнку стало лучше. Недостаточные дозы антибиотика в организме приводят к тому, что в организме сохраняются бактерии, устойчивые к антибиотику. Повторное лечение одним и тем же препаратом увеличивает риск возникновения аллергической реакции.
- Правила приёма антибиотиков отличаются в зависимости от препарата, и для положительного результата очень важно чётко их соблюдать. Передозировка антибиотиками влечёт за собой крайне неприятные последствия, опасные для жизни и здоровья пациента. Дозировка же меньше нормы сохранит часть бактерий в организме, бороться с которыми потом будет гораздо сложнее.
- Запивайте антибиотики только водой. Не запивайте чаем, кофе, молоком и соками (особенно грейпфрутовым).
Чем активнее мы используем антибиотики,
тем устойчивее становятся бактерии,
что приводит к необходимости использования
новых антибиотиков.
Итак, как вы видите, антибиотики являются довольно «коварными» лекарствами, без которых, с одной стороны, обойтись нельзя, но с другой — после лечения ими восстановиться бывает довольно сложно. Если возникла крайняя необходимость, и ваш врач выписал вам тот или иной антибиотик, строго соблюдайте все предписания и не прекращайте курс лечения даже при быстром наступлении улучшений.
Давайте разумно относиться к своему здоровью и изобретениям науки, которые нам в этом помогают.
Антибиотики вошли в жизнь людей более полувека назад. Благодаря им пневмония, туберкулез, гангрена и другие инфекции перестали быть смертельно опасными для человека. Но даже самые сильные антибиотики не в состоянии уничтожить все болезнетворные бактерии. Природа не терпит пустоты. В борьбе с лекарственными препарата ми бактерии «задействовали» природные генетические механизмы формирования устойчивости. В результате появились новые генерации микробов, на которых не действуют даже самые сильные препараты. С каждым годом «устойчивых» инфекций становится все больше, поэтому усилия медиков всего мира направлены на поиск новых методов борьбы с опасными неуязвимыми бактериями. Ученые московского Научно-исследовательского института по изысканию новых антибиотиков (НИИИНА) им. Г. Ф. Гаузе РАМН добились в этом существенных успехов.
Английский врач Александер Флеминг в 1928 году предположил существование в грибковых микроорганизмах веществ, препятствующих росту бактерий.
В опыте Флеминга грибы вырабатывают вещества, которые подавляют рост бактерий.
Золотистый стафилококк (на фото показан препарат, окрашенный по Грамму) — бактерия, часто становящаяся неуязвимой для антибиотиков.
Г. Ф. Гаузе и М. Г. Бражникова в лаборатории в период работы по созданию первого советского антибиотика грамицидина С. 1940-е годы.
В XIX веке московские власти выделили территорию на Девичьем поле для строительства университетских клиник.
Таблица 1. *Таблицы составлены по данным профессора Яноша Берди (Венгрия), создателя базы данных по антибиотикам и другим биологически активным веществам.
Серно-желтый трутовик образует большое количество органических кислот и не менее трех антибиотиков, эффективных в отношении устойчивых форм стафилококков. Фото Е. Ершовой.
Выращенный в лабораторных условиях трутовик дубовой губки по форме напоминает кораллы. Из этого древесного гриба можно получить по меньшей мере четыре антибиотика.
Культура гриба омфалотуса выращивается в лабораторных условиях на жидких средах. В зависимости от условий выращивания и состава питательной среды гриб растет по-разному. Фото О. Ефременковой.
Антибиотик иллудин из пластинчатого гриба омфалотуса признан перспективным для противоопухолевой терапии.
Новый отечественный гликопептидный антибиотик эремомицин выделен из почвенного актиномицета.
В культуре гриба навозника содержатся вещества, способные уничтожать даже устойчивые бактерии золотистого стафилококка. Фото О. Ефременковой.
‹
›
ИСТОРИЯ ОТКРЫТИЯ ВЕЩЕСТВ, УНИЧТОЖАЮЩИХ БАКТЕРИИ
В 1928 году английский врач Александер Флеминг сделал открытие, которое положило начало новой эпохе в медицинской науке. Он обратил внимание на то, что до него наблюдали многие микробиологи, но они не придавали значения обнаруженному явлению. На плотной питательной среде в чашке Петри исследователь выращивал колонии бактерий. Во время эксперимента произошел так называемый «залет»: случайно попавшая из воздуха спора гриба положила начало росту грибной колонии среди бактерий. Но самое важное заключалось в том, что вокруг грибковых микроорганизмов бактерии вдруг перестали размножаться. Флеминг предположил, что колония гриба выделяет в питательную среду вещество, препятствующее росту бактерий. Его догадка полностью подтвердилась. Позднее сотрудникам Оксфордского университета британцу Говарду Флори и выходцу из Германии Эрнсту Чейну удалось выделить и определить структуру первого в мире антибактериального вещества, названного пенициллином по имени гриба-продуцента, относящегося к роду пенициллов. Так человечество приобрело орудие борьбы со многими смертельно опасными бактериальными инфекциями. Флеминг, Флори и Чейн в 1945 году получили за свое открытие Нобелевскую премию. За пенициллином последовали открытия других антибактериальных веществ.
Термин «антибиотик» (в переводе с греческого — «против жизни») предложил в 1942 году американский микробиолог, уроженец России, специалист по микробиологии почвы Зельман Ваксман. С его именем связано также открытие другого широко известного антибактериального вещества — стрептомицина, по сей день применяемого для лечения туберкулеза. И пенициллин, и стрептомицин вырабатываются почвенными микроорганизмами (грибы и актиномицеты — две основные группы продуцентов антибиотиков). Но существуют и другие организмы — продуценты антибактериальных веществ. В настоящее время известно около 30 000 антибиотиков природного происхождения, синтезируемых живыми существами различных таксономических групп.
Согласно наиболее распространенному в научном сообществе определению, антибиотиками называются вырабатываемые различными живыми организмами вещества, которые способны уничтожать бактерии, грибы, вирусы, обычные и опухолевые клетки или подавлять их рост. Но это не означает, что все существующие ныне антибиотики произведены живыми клетками. Химики давно научились улучшать, усиливать антибактериальные свойства природных веществ, модифицируя их с помощью химических методов. Полученные таким образом соединения относятся к полусинтетическим антибиотикам. Из огромного количества природных и полусинтетических антибио-тиков в медицинских целях используют всего лишь около ста.
БАКТЕРИИ СОПРОТИВЛЯЮТСЯ
После открытия антибиотиков медики надеялись, что еще немного и человечество навсегда избавится от большинства инфекционных болезней. Но все оказалось не так просто. Дело в том, что примерно через два года после начала широкого применения антибактериального препарата в медицинской практике у болезнетворных бактерий вырабатывается устойчивость к нему. Такая устойчивость, называемая резистентностью, есть ответная наследственно закрепленная реакция микроорганизмов на антибиотики. С биологической точки зрения в соответствии с теорией Дарвина выработка устойчивости не что иное, как результат межвидовой борьбы за существова ние между человеком и патогенной бактерией (или другим организмом-мишенью, на который нацелено применение антибиотика). Как это происходит? Популяции бактерий постоянно видоизменяются; при их размножении возникают различные мутации, в том числе и те, благодаря которым микроорганизмы приобретают резистентность к применяемому препарату. Благодаря высокой скорости размножения и большой численности популяций частота возникновения мутаций, обеспечивающих устойчивость к антибиотику, оказывается достаточно высокой, чтобы выжившие, то есть устойчивые формы компенсировали потери популяции бактерий. Так рождаются новые формы резистентных болезнетворных микроорганизмов. Если человек заразился устойчивым штаммом патогена, то лечить его ранее использовавшимся антибиотиком бесполезно.
Пенициллин начали применять во время Второй мировой войны. Уже тогда медики знали о новых штаммах бактерий, против которых пенициллин оказался бессильным. Ученые выяснили, что устойчивые к этому антибиотику бактерии вырабатывают ферменты пенициллиназы, расщепляющие молекулу пенициллина. Тогда медики занялись разработкой полусинтетических антибиотиков, устойчивых к пенициллиназам. В результате в арсенале врачей появились такие производные пенициллина, как метициллин, оксациллин, диклоксациллин, карбенициллин.
Бактерия с красивым названием «золотистый стафилококк» (Staphylococcus aureus) — один из самых распространенных в человеческой популяции болезнетворных микроорганизмов. Она вызывает различные заболевания: болезни кожи (в том числе пиодермию новорожденных, пузырчатку, дерматиты, абсцессы, фурункулы, панариций и др.), органов дыхания (наиболее распространены ангина, плеврит, пневмония), нервной системы и органов чувств (менингит, отит, конъюнктивит и др.), болезни органов пищеварения (стоматит, перитонит, энтерит, энтероколит, пищевые токсикоинфекции), а также артриты, остеомиелиты, эндокардиты, флебиты, циститы, уретриты, маститы, орхиты и стафилококковый сепсис — первичный или развивающийся на фоне существующих гнойных очагов. Стафилококк — одна из основных, так называемых госпитальных инфекций, возникающая в клиниках разного профиля, но наиболее опасная в роддомах.
Штаммы золотистого стафилококка, устойчивые к пенициллину и его полусинтетическим
аналогам, появились уже на стадии клинических испытаний этих препаратов. Среди
устойчивых бактериальных популяций — штаммы, на которые не действует метициллин
(а также оксациллин). Такие бактерии получили название «метициллинрезистентные»
или MRSA (от англ. methicillin resistant Staphylococcus aureus). Механизм
возникновения этого типа устойчивости бактерий к антибиотикам связан с мутацией
рецепторного белка на поверхности клетки: молекулы антибиотика не могут прикрепиться
к клеточной мембране устойчивой бактерии. Штаммы MRSA устойчивы не только к
пенициллинам, но и к другой большой группе бета-лактамных антибиотиков — цефалоспоринам.
Термин произошел от названия плесневого гриба цефалоспориума (Cephalosporium),
из которого впервые выделили соединение этого класса. Позднее цефалоспорины
были обнаружены у ряда грибов, а также у актиномицетов и бактерий. А ведь пенициллины
и цефалоспорины до недавнего времени применялись в медицинской практике наиболее
часто. Более того, некоторые штаммы золотистого стафилококка в последние годы
приобрели устойчивость сразу ко многим антибиотикам. Такие сверхустойчивые популяции
бактерий обозначают английской аббревиатурой MDR (multidrug resistant). Сейчас
в арсенале медиков для борьбы с MDR-штаммами имеется антибиотик ванкомицин.
Но все чаще и чаще встречаются патогенные бактерии, неуязвимые к воздействию
практически всех известных препаратов. Количество штаммов, которые «не берет»
ни одно лекарство, сейчас достигает 2% от всех случаев стафилококковой инфекции.
Устойчивость к лекарственным препаратам приобретают и бактерии других видов. Например, синегнойная палочка (Pseudomonas aeruginosa), распространенный возбудитель госпитальных инфекций, вызывает тяжелые раневые и ожоговые инфекции, разнообразные воспалительные и геморрагические явления, преимущественно у маленьких детей и у взрослых с ослабленным иммунитетом. По данным ведущего российского специалиста по эпидемиологии резистентности профессора С. В. Сидоренко, для лечения примерно 20% штаммов синегнойной палочки в настоящее время эффективных антибиотиков нет, то есть каждого пятого пациента лечить просто нечем.
ПРЕДПОСЫЛКИ ПОЯВЛЕНИЯ НЕУЯЗВИМЫХ БАКТЕРИЙ
Штаммы устойчивых болезнетворных бактерий появляются в местах скопления людей с ослабленным иммунитетом. Поэтому чаще всего суперустойчивые бактерии встречаются в больницах, роддомах, домах престарелых, тюрьмах. Отсюда и термин «госпитальные», или «внутрибольничные», инфекции. Чем дольше пациент находится в клинике, тем выше вероятность заражения госпитальными инфекциями.
Распространенность таких больничных инфекций зависит от страны, региона и меняется со временем. Так, в США средняя частота возникновения госпитальных инфекций в отделениях реанимационной педиатрии составляет 6,1%, а во Франции — 23,5%. В клиниках Москвы и Санкт-Петербурга частота встречаемости устойчивой формы стафилококка MRSA в 1998 году составляла от 0 до 40%, а теперь в отдельных столичных больницах доходит до 80%.
Кроме того, патогенные микроорганизмы, устойчивые к большинству антибиотиков, в последнее время стали распространяться среди вполне здоровых людей. Процесс очень трудно контролировать и еще труднее предотвратить. Так, в США ученые обнаружили, что устойчивые штаммы золотистого стафилококка MRSA распространяются среди спортсменов, вступающих в непосредственный контакт (например, среди борцов) или соприкасающихся с каким-то общим предметом, например с мячом, как это происходит при игре в гандбол или баскетбол. Описаны случаи распространения MRSA в школьных спортивных командах.
Чем шире используются антибиотики, тем чаще возникают и распространяются бактерии, потерявшие к ним чувствительность. Поэтому особенно опасно неконтролируемое применение антибактериальных препаратов без предписания врача. Зачастую при самостоятельно поставленном диагнозе «простуда» многие начинают принимать антибиотики, предназначенные для лечения бактериальных инфекций. Но не следует забывать, что за так называемой простудой могут скрываться самые разные инфекционные заболевания, в том числе и вирусные (например, грипп), против которых применять антибактериальные препараты не просто бесполезно, а даже вредно. Эффекта от такого лечения никакого, но в организме нарушается естественная бактериальная флора, в результате чего могут развиться оппортунистические инфекции, например кандидоз (неконтролируемый рост дрожжевых грибов рода Candida). Кроме того, возникает ничем не оправданный риск появления в организме устойчивых бактериальных штаммов.
Другая распространенная ошибка при лечении заключается в том, что больной при улучшении самочувствия раньше времени отказывается от выписанного антибиотика или принимает его в более низкой дозе по сравнению с назначенной врачом. Это опасно тем, что приводит к увеличению вероятности выработки лекарственной устойчивости у болезнетворной бактерии; следовательно, последующая попытка лечения этим же антибиотиком будет неэффективна.
Иногда при лечении антибактериальными препаратами устойчивость к лекарствам вырабатывается у бактерий, составляющих микрофлору человека. Такие «свои» устойчивые бактерии могут передавать гены резистентности чужеродным бактериям, вызывающим различные болезни. В результате межвидового обмена генами возбудители инфекции тоже становятся устойчивыми.
С УСТОЙЧИВОСТЬЮ БАКТЕРИЙ МОЖНО БОРОТЬСЯ
С возникновением и распространением устойчивых штаммов микроорганизмов борются, регулируя применение антибиотиков. Во многих развитых странах антибиотики отпускают строго по рецептам. Принимаются и другие меры. В настоящее время во всем мире запрещено использовать антибиотики медицинского назначения для консервации продуктов питания. Забой скота, подвергавшегося лечению антибиотиками или получавшего их в качестве стимуляторов роста, должен производиться по истечении времени выведения лекарств из организма животного, то есть в поступающем в продажу мясе не должно быть и следов препарата.
Другой подход к проблеме резистентности — создание новых лекарственных препаратов, способных побороть бактерии, ставшие устойчивыми к давно использующимся лекарствам. На разработку и внедрение нового антибиотика в среднем уходит 10 лет. Но несмотря на этот внушительный срок, научные коллективы и фармацевтические компании во многих странах мира продолжают заниматься выделением и синтезом новых антибактериальных веществ.
Насколько же осуществима задача поиска новых природных антибиотиков? Выше упоминалось,
что основные известные продуценты антибактериальных соединений — это почвенные
микроорганизмы — актиномицеты, бактерии и грибы. Начиная с 1950-х и по 1990-е
годы исследова тели шли по «проторенной дорожке», продолжая заниматься поиском
новых антибиотиков в одних и тех же живых микроорганизмах. Это можно объяснить
не только инертностью мышления, но еще и тем, что в те годы промышленная база
позволяла нарабатывать в ферментерах на жидких питательных средах огромное количество
микробной массы почвенных микроорганизмов, производящих антибиотики.
Но наука не стоит на месте, и в последние пятнадцать-двадцать лет спектр организмов — продуцентов антибиотиков расширился (см. табл. 1). Среди них теперь числятся не только почвенные микробы, но также многие виды растений и животных. Как потенциальные производители антибиотиков очень перспективны высшие грибы, особенно те, которые можно культивировать в искусственных условиях. Развитие генетической инженерии не только делает такие объекты интересными в теоретическом плане, но и позволяет создавать рентабельные биотехнологические способы производства. Для получения больших количеств природных антибиотиков теперь вовсе не обязательно выращивать и перерабатывать тонны биомассы (живых организмов и высших растений). Антибактериальные вещества можно получать, встраивая гены «нужного» антибиотика в геном бактерий. В процессе жизнедеятельности бактерии нарабатывают желаемое лекарственное вещество, превращаясь в своеобразную фармацевтическую фабрику по производству антибиотиков.
В качестве примера растения — продуцента антибиотиков можно привести тихоокеанский тис. Из его коры выделяют таксол — противораковый антибиотик, применяемый для лечения рака яичников. Содержание таксола в коре тиса составляет всего лишь тысячные доли процента, поэтому одна терапевтическая доза препарата поначалу стоила около тысячи долларов. Сегодня цена значительно упала благодаря разработке способа получения таксола биотехнологическими методами.
С развитием молекулярно-биологических методов получения природных соединений поиск новых антибиотиков даже в организмах высших животных и растений стал вполне экономически оправданным. Причем диапазон поиска практически не ограничен. По оценке венгерского профессора Яноша Берди, исследовавшиеся в той или иной степени живые организмы (а это не означает, что все они досконально изучены на молекулярном уровне) составляют лишь малую часть биоразнообразия нашей планеты (см. табл. 2). Ученый считает, что из существующих в природе 8-10 миллионов видов насекомых описана лишь десятая часть, из полутора миллионов бактерий — шесть тысяч.
В наше время удается даже открывать новые виды позвоночных животных, а уж не-
открытых микроорганизмов вообще великое множество. Например, из почвы при использовании традиционных микробиологических методов высевается не более 0,1-10% присутствующих там микроорганизмов. Оставшиеся (так называемые «живые, но некультивируемые» микроорганизмы) еще не в полной мере изучены и представляют собой практически неисчерпаемый источник продуцентов новых антибиотиков.
ОТ ГРАМИЦИДИНА К ЭРЕМОМИЦИНУ
В нашей стране разработка антибактериальных препаратов началась еще до Великой Отечественной войны. Первый отечественный оригинальный антибиотик грамицидин С (грамицидин советский), выделенный из почвенной бактерии Bacillus brevis var. G.-B., был открыт Георгием Францевичем Гаузе и Марией Георгиевной Бражниковой в 1942 году, а использовать его начали уже во время войны. Этот антибиотик применяется и в настоящее время, он широко известен под торговым названием грамидин.
В 1953 году в Советском Союзе на базе лаборатории антибиотиков АМН СССР был создан Научно-исследовательский институт по изысканию новых антибиотиков Российской академии медицинских наук, теперь носящий имя Г. Ф. Гаузе, который инициировал исследования по поиску новых лекарственных соединений. Всего на протяжении первых тридцати лет деятельности института ученые внедрили в медицинскую практику 16 антибактериальных и противоопухолевых антибиотиков. В тяжелые перестроечные годы институт возглавлял ученик Г. Ф. Гаузе член-корреспондент РАМН Юрий Васильевич Дудник. Благодаря его усилиям удалось практически полностью сохранить научные кадры и не прервать исследования, а этим, к сожалению, может похвастаться далеко не каждое научное учреждение. Сейчас институт возглавляет профессор Мария Николаевна Преображенская, известный в мире специалист по химической трансформации антибиотиков.
Основными объектами поиска новых антибактериальных веществ в институте долгие годы были почвенные бактерии актиномицеты, а в последние годы к ним прибавились высшие грибы. Под руководством профессора Ларисы Петровны Тереховой разработаны способы селективного выделения актиномицетов из почвы, позволяющие выращивать виды, обычно не культивируемые в лабораторных условиях. Например, облучение почвы ультрафиолетом, сверхвысокочастотными (СВЧ) и крайне высокочастотными (КВЧ) электромагнитными волнами дает возможность во много раз повысить вероятность выделения представителей редких родов актиномицетов. Это очень важно, поскольку, например, продуцент нового антибиотика даптомицина встречается с частотой одна бактерия на десять миллионов.
С помощью новых методов в нашем институте за последние четыре года было исследовано 9280 выделенных из природной среды организмов. 1169 из них содержали антибиотики, эффективные по отношению к устойчивому штамму золотистого стафилококка MRSA. Ученые признали наиболее перспективными с фармацевтической точки зрения 265 веществ и исследовали их химический состав. Из них идентифицировано 28 уже известных ранее антибиотиков, а 36 признаны новыми соединениями. Но только лишь семь новых антибиотиков показали высокий терапевтический эффект и низкую токсичность в опытах на животных.
Высшие грибы тоже признаны перспективными продуцентами антибиотиков. Например,
в 1950 году был описан антибактериальный антибиотик широкого спектра действия
иллудин. Это соединение образуется пластинчатым грибом омфалотусом Omphalotus
olearius, растущим на коре, на пнях или на земле около оливковых деревьев,
а также возле деревьев некоторых других лиственных пород. Однако из-за высокой
токсичности в качестве лекарства этот антибиотик тогда не был востребован. В последние
годы в США снова начали проводиться интенсивные исследования лечебного действия
иллудина и его синтетических производных. Препарат стал одним из так называемых
старых новых антибиотиков, которых в последнее время появилось достаточно много.
Оказалось, что производные иллудина обладают избирательным действием в отношении
ряда опухолевых клеток. Ученые НИИИНА работают также со штаммом омфалотуса, производящим
иллудин, из коллекции культур шляпочных грибов Института ботаники им. Н. Г. Холодного
Национальной академии наук Украины.
Другой пример продуцента антибиотиков — хорошо известный гриб вешенка (Pleurotus ostreatus). Подобно омфалотусу, вешенка растет на отмершей древесине и на ослабленных деревьях. Сотрудники НИИИНА обнаружили, что данный вид вырабатывает не менее восьми антибиотиков различной химической природы и антимикробного действия. Каскад биосинтеза лекарственных веществ начинается на четвертые-пятые сутки культивирования гриба в жидкой среде и продолжается на протяжении трех недель. Интересно, что первой в процессе культивации проявляется и затем исчезает антигрибковая активность, которая в природе помогает вешенке конкурировать с другими грибами за источник питания (древесину).
Еще один гриб, серно-желтый трутовик, или «цыпленок на дереве» (Laetiporus sulphureus), также вырабатывает не менее трех антибиотиков. Они эффективны в отношении устойчивых форм стафилококков. Другой древесный высший гриб, в котором российские исследователи впервые обнаружили четыре антибиотика, — дубовая губка (Daedalea quercina).
Антибактериальные вещества были найдены не только в древоразрушающих видах грибов, но и в копрофилах — навозниках (род Coprinus). В большинстве своем это мелкие с тонкой мякотью шляпочные грибы, плодовые тела которых живут от нескольких часов до нескольких суток, а затем расплываются в чернильную жидкую массу. Еще сто лет назад из таких расплывшихся шляпок делали чернила, представлявшие собой суспензию темных спор. Подпись на документах, поставленная такими чернилами, имела дополнительную степень надежности: ее сложно подделать потому, что споры конкретного вида копринуса, видимые под лупой, отличаются по форме и размеру от спор других копринусов, то есть это были чернила «с секретом». Теперь в копринусе Coprinus congregatus найден новый антибиотик, относящийся к группе немотина, а в навознике Coprinus lagopu — лагоподин В, не токсичный и эффективный в отношении штаммов устойчивого золотистого стафилококка MRSA.
Благодаря работе ученых НИИИНА в России после 20-летнего перерыва наконец налаживается промышленный выпуск нового гликопептидного антибиотика эремомицина. Это семнадцатая разработка за полувековое существование института. Внедрению предшествовал долгий путь: сначала из почвы выделили штамм актиномицета, затем идентифицировали его таксономическую принадлежность (Amycolatopsis orientalis subsp. eremomycini), установили спектр чувствительных к нему микроорганизмов, отработали процедуру выделения, установили химическое строение антибиотика, провели селекцию, позволившую во много раз повысить продуктивность исходного штамма («дичка») и создать на его основе промышленный штамм-продуцент, разработали технологию биосинтеза нового антибиотика, изучили его действие in vivo на животных , провели клинические испытания. Новый отечественный антибиотик эремомицин эффективен в отношении многих устойчивых форм патогенных бактерий, в том числе и золотистого стафилококка MRSA.
Феномен бактериальной устойчивости не дает ученым и производителям долго «почивать
на лаврах», а требует разработки и внедрения новых и новых эффективных препаратов.
К сожалению, в России последние 20 лет биотехнологическая промышленность и связанное
с ней производство медикаментов находились в состоянии упадка. Отечественные
производители в лучшем случае решались на выпуск так называемых дженериков —
аналогов зарубежных лекарств, срок лицензии которых уже истек. Между тем и с
точки зрения развития передовых технологий, и с точки зрения национальной безопасности
разработка и внедрение новых антибиотиков в ближайшие десятилетия должны стать
одним из приоритетных направлений российской науки и технологии.
Антибиотики
В России, как и во многих других странах, антибиотики отпускаются без рецепта. Но, если верить исследованиям, далеко не все применяют их по назначению. Так, согласно статистике, около 50 % россиян самостоятельно назначают себе антибиотики при простудных заболеваниях, а около 95 % населения хранит их в аптечке «на всякий случай». Паникеры начинают принимать их при первых же симптомах ОРВИ, когда, как мы знаем, их использование в лучшем случае абсолютно бесполезно. Нецелесообразная антибиотикотерапия порождает массу проблем. От применяемых не по назначению антибиотиков ежегодно погибает около 20 тысяч человек, растет количество антибиотикорезистентных микроорганизмов. Так кто же такие — антибиотики? Из чего их получают? Каков их механизм действия? Как они влияют на органы и системы?
История

Зальман Ваксман — один из отцов антибиотиков
Антибиотики — вещества природного или полусинтетического происхождения, подавляющие рост живых клеток. Термин был введен в обращение З. Ваксманом — американским микробиологом, получившим в 1952 году Нобелевскую премию за открытие стрептомицина. Сам термин «антибиос» был придуман Л. Пастером и нес определенный смысл — «жизнь против жизни».
Первым антибиотиком был пенициллин, выделенный из грибка Penicillum notatum. Наблюдения за взаимоотношениями культуры стрептококка и грибка были начаты Флемингом в одной из лондонских больниц в 20-х годах прошлого века. Однако его выступление на втором Международном конгрессе микробиологов не произвело впечатления на публику (возможно, из-за того, что он был не слишком искусным оратором). Дальнейшая же история изучения пенициллина связана с именами членов «Оксфордской группы» — Говардом Флори и Эрнстом Чейном. Чейн занимался выделением пенициллина, а Флори — испытанием его на животных. Первое испытание пенициллина состоялось в 1941 году на умирающем от сепсиса лондонском полицейском. Ученым удалось добиться улучшения его состояния, но запасы препарата были слишком малы, и больной погиб.

Та самая чашка Петри с культурой Staphylococcus sp., в которой Александр Флеминг (Alexander Fleming), вернувшись из отпуска, обнаружил вместо бактериальных колоний плесень Penicillium notatum. 1928 г.
В 1945 году Флеминг, Чейн и Флори были удостоены Нобелевской премии. Пенициллин же, оптимально сочетая в себе высокую антибактериальную активность и безопасность для человека, с успехом используется до сих пор.
Не заставило долго себя ждать открытие антибиотиков и других групп: в 1939 году был выделен грамицидин, в 1942 — стрептомицин, в 1945 — хлортетрациклин, в 1947 —левомицетин (хлорамфеникол), а уже к 1950 году было описано более 100 антибиотиков. Со временем выяснилось, что существующие антибиотики недостаточно активны в отношении микроорганизмов: это и послужило поводом для начала химических исследований и создания полусинтетических антибиотиков. С тех пор были открыты различные группы антибактериальных средств. Так, в России на сегодняшний день используется около 30 групп антибиотиков. Среди них различают препараты с антибактериальным, противопаразитарным, противогрибковым и противоопухолевым действиями. Также были сформированы и постулаты антибиотикотерапии.
Основные правила антибактериальной терапии можно сформулировать следующим образом:
1. Установить возбудителя заболевания;
2. Определить препараты, к которым возбудитель наиболее чувствителен;
3. При неизвестном возбудителе использовать либо препарат с широким спектром действия, либо комбинацию двух препаратов, суммарный спектр которых включает вероятных возбудителей;
4. Начинать лечение надо как можно раньше;
5. Дозы препаратов должны быть достаточными для того, чтобы обеспечить в клетках и тканях препятствующие размножению (бактериостатические) или уничтожающие бактерии (бактерицидные) концентрации;
6. Продолжительность лечения должна быть достаточной; снижение температуры тела и ослабление других симптомов не являются основанием для прекращения лечения;
7. Значительную роль играет выбор рациональных путей введения препаратов, учитывая, что некоторые из них не полностью всасываются из желудочно-кишечного тракта, плохо проникают через гематоэнцефалический барьер и т. д.;
8. Комбинированное применение антибактериальных средств должно быть обоснованным, так как при неправильном сочетании может как ослабляться суммарная активность, так и суммироваться их токсические эффекты.
Рассмотрим сами антибактериальные препараты с точки зрения характера, спектра и механизма их действия.
Антибиотики воздействуют непосредственно на этиологический фактор, и по характеру действия бывают бактериостатические и бактерицидные:
-
Бактериостатические препараты тормозят рост и размножение микроорганизмов. Они не вызывают их гибели. При этом допускается, что механизмы имунной защиты в состоянии самостоятельно справиться с уничтожением и элиминацией микробов. К бактериостатическим препаратам относятся макролиды, клиндамицин, стрептограмины, хлорамфеникол, тетрациклины;
-
Бактерицидные препараты приводят к гибели микроорганизмов, и организму необходимо лишь обеспечить их выведение. К ним относятся бета-лактамные антибиотики, аминогликозиды, фторхинолоны, гликопептиды и другие (триметоприм, метронидазол, рифампицин и т. д).
Каким же образом происходит обезвреживание микроорганизмов? Существует несколько механизмов действия антибиотиков:
- Нарушение синтеза клеточной стенки
путем ингибирования синтеза пептидогликана
(пенициллин, цефалоспорин, монобактамы)
, образования димеров и переноса их к растущим цепям пептидогликана
(ванкомицин),
синтеза хитина
(никкомицин)
. Антибиотикам, действующим по данному механизму, присущ бактерицидный характер действия, они не действуют на покоящиеся клетки и L-формы (лишенные клеточной стенки) бактерий;
-
Нарушение функционирования мембран
из-за нарушения их целостности, образования ионных каналов, связывания ионов в комплексы, растворимые в липидах и нарушения их транспортировки
(нистатин, грамицидины, полимиксины);
-
Подавление синтеза нуклеиновых кислот:
ДНК
(стрептомицин, гризеофульвин, рифампицин, рифамицин, ванкомицин)
и РНК
(брунеомицин, рубомицин, оливомицин);
-
Нарушение синтеза белка
клеткой
(тетрациклины, макролиды);
-
Нарушение синтеза пуринов и пиримидинов (азасерин, саркомицин); - Ингибирование дыхательной цепи (антимицины, олигомицины).
Для удобства в применении принято классифицировать антибиотики и по спектрам антимикробного действия:
- Действующие преимущественно на грамположительную микрофлору: биосинтетические пенициллины, оксациллин, макролиды I поколения, линкомицин, рифампицин, рифамицин, ристомицин, ванкомицин;
- Действующие преимущественно на грамотрицательную микрофлору: полимиксин;
- Широкого спектра действия: полусинтетические пенициллины (кроме оксациллина), цефалоспорины, макролиды II поколения, тетрациклины, аминогликозиды;
- Противогрибковые антибиотики: нистатин, леворин, амфотерицин В, микогептин, гризеофульвин и др.;
- Противоопухолевые антибиотики: оливомицин, рубомицин и др.
Ценность антибиотиков как лекарств, несомненно, очень высока. Открытие этих препаратов позволило избавиться от множества ранее смертельных инфекций. Но микроорганизмы достаточно быстро адаптируются к изменяющимся условиям среды, в том числе и приобретая устойчивость к антибиотикам.
Выделяют несколько «основных» механизмов резистентности:
1. Изменение мишени действия;
2. Ферментативная инактивация антимикробного препарата;
3. Активное выведение антимикробного препарата из микробной клетки (эффлюкс);
4. Нарушение проницаемости микробной клетки для антимикробного препарата;
5. Формирование метаболических «шунтов».

Метициллин-резистентный золотистый стафилококк
Появление антибиотикорезистентных штаммов бактерий, несомненно, опасно и для того человека, у которого они выделены, и для многих других людей. Рост устойчивости приводит к утяжелению течения инфекционных заболеваний, повышению смертности, увеличению расходов на здравоохранение.
Рассмотрим самые популярные классы антибиотиков:
Пенициллины

Бензилпенициллин
Старейшая, но не теряющая своей актуальности группа. Пенициллины являются β-лактамными антибиотиками и имеют в своей структуре четырехчленное β-лактамное кольцо. В свою очередь они делятся на природные (биосинтетические), выделяемые определенными штаммами плесневых грибов, и полусинтетические, получаемые путем лабораторной модификации. По механизму действия все пенициллины являются бактерицидными: они блокируют финальные этапы синтеза пептидогликана и тем самым приводят к гибели бактерий. Это в свою очередь и объясняет низкую токсичность пенициллинов для человека, для клеток которого не характерен синтез пептидогликана. Для воздействия на бактерии, которые приобрели устойчивость путем синтеза ферментов β-лактамаз, были созданы препараты, комбинированные с клавулановой кислотой (ингибитором β-лактамаз). По классическим источникам, они имеют достаточно широкий спектр действия, а полусинтетические пенициллины благодаря своей кислотоустойчивости и защищенности от β-лактамаз расширяют его в разы. Но ввиду растущей резистентности микроорганизмов пенициллины не всегда производят достаточный лекарственный эффект.
Классификация
1) Биосинтетические:
- натриевая, калиевая и новокаиновая соли бензилпенициллина;
- пролонгированные (бициллин-3, бициллин-5, ретарпен);
- феноксиметилпенициллин;
2) Полусинтетические:
- ампициллин (Г- >Г+);
- оксациллин (устойчив к пенициллиназе, кислотоустойчив);
- Ампиокс (ампициллин + оксациллин);
- амоксициллин: кислотоустойчив, торговые наименования — Амоксициллин, Амоксил-КМП, Бактокс, Грамокс, Оспамокс, Флемоксин, Хиконцил, Э-Мокс;
- Амоксициллин + клавулановая кислота (амоксиклав).
Пенициллины обладают самой низкой токсичностью среди антибиотиков. Основными побочными действиями являются аллергические реакции (крапивница, отек Квинке, анафилактический шок), расстройства со стороны ЖКТ (тошнота, рвота, диарея, при использовании ампициллина и ингибиторозащищенных пенициллинов — псевдомембранозный колит). Отдельные виды могут вызывать гиперкалиемию (чаще бензилпенициллина-К-соль), гипернатриемию (чаще бензилпенициллина-Na-соль), неаллергическую макулопапулезную (ампициллиновую) сыпь, а также болезненность в месте введения, анемию, тромбоцитопению, нейтропению, транзиторную гематурию у детей.
Лекарственные взаимодействия
- Пенициллины нельзя смешивать в одном шприце или в одной инфузионной системе с аминогликозидами ввиду их физико-химической несовместимости;
- При сочетании ампициллина с аллопуринолом возрастает риск «ампициллиновой» сыпи;
- Применение высоких доз бензилпенициллина калиевой соли в сочетании с калийсберегающими диуретиками, препаратами калия или ингибиторами АПФ предопределяет повышенный риск гиперкалиемии;
- Требуется соблюдать осторожность при сочетании пенициллинов, активных в отношении синегнойной палочки, с антикоагулянтами и антиагрегантами ввиду потенциального риска повышенной кровоточивости; не рекомендуется сочетать с тромболитиками;
- Следует избегать применения пенициллинов в сочетании с сульфаниламидами, так как при этом возможно ослабление их бактерицидного эффекта;
- Холестирамин связывает пенициллины в ЖКТ и уменьшает их биодоступность при приеме внутрь;
- Пероральные пенициллины могут понижать эффективность пероральных контрацептивов за счет нарушения энтерогепатической циркуляции эстрогенов;
- Пенициллины способны замедлять выведение из организма метотрексата за счет ингибирования его канальцевой секреции.
Цефалоспорины

Общая структура цефалоспориновТакже относятся к β-лактамным антибиотикам, являются одним из самых многочисленных и часто назначаемых классов ввиду их низкой токсичности. По механизму действия сходны с пенициллинами, имеют 4 поколения, каждое из которых по спектру действия опережает предыдущее.
I поколение:
1) Парентеральные (цефазолин);
2) Пероральные (цефалексин, цефадроксил).
Антибиотики активны в отношении Streptococcus spp. (S.pyogenes, S. pneumoniae) и метициллиночувствительных Staphylococcus spp. По уровню антипневмококковой активности цефалоспорины I поколения уступают аминопенициллинам и большинству более поздних цефалоспоринов. Цефалоспорины I поколения обладают узким спектром действия и невысоким уровнем активности в отношении грамотрицательных бактерий. Основными показаниями к применению цефалоспорина являются предоперационная профилактика в хирургии, а также лечение инфекций кожи и мягких тканей; к применению цефазолина — стрептококковый тонзиллофарингит, внебольничные инфекции кожи и мягких тканей легкой степени тяжести.
II поколение:
1) Парентеральные (цефуроксим);
2) Пероральные (цефаклор, цефуроксим аксетил).
При сходном антимикробном спектре цефуроксим более активен в отношении Streptococcus spp. и Staphylococcus spp. Спектр действия цефалоспоринов II поколения в отношении грамотрицательных микроорганизмов шире, чем у представителей I поколения; клиническое значение имеет активность цефуроксима в отношении гонококков. Благодаря устойчивости цефуроксима к β-лактамазам он активен в отношении M. catarrhalis, Haemophilus spp., E. coli, Shigella spp., Salmonella spp., P. mirabilis, Klebsiella spp., P. vulgaris, C. diversus.
Основными показаниями к применению являются внебольничные инфекции верхних дыхательных путей, госпитализационная внебольничная пневмония, внебольничные инфекции кожи и мягких тканей, инфекции мочевыводящих путей, периоперационная подготовка в хирургии.
III поколение:
1) Парентеральные (цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефоперазон + сульбактам);
2) Пероральные (цефиксим, цефибутен).
Базовыми АБ в этой группе являются цефтриаксон и цефотаксим, которые обладают высокой активностью в отношении Streptococcus spp., золотистого стафилококка, коринебактерий, менингококка, гонококков, H. influenzae и M. catarrhalis, пенициллиноустойчивых пневмококка и зеленящего стрептококка. Обладают высокой активностью в отношении практически всего семейства Enterobacteriaceae. Цефтазидим и цефоперазон обладают также активностью в отношении P. aeruginosа, но существенно меньшей активностью в отношении стрептококков. Цефиксим и цефибутен малоактивны в отношении Streptococcus spp., семейства Enterobacteriaceae и пневмококков.
Показаниями являются средней степени и тяжелые внебольничные и нозокомиальные инфекции нижних дыхательных путей, мочевыводящих путей, кожи, мягких тканей, костей, суставов, интраабдоминальные инфекции, инфекции органов малого таза, менингит, сепсис, инфекции на фоне иммунодефицита. Цефиксим и цефибутен также назначаются при пиелонефрите легкой и средней степени тяжести у детей, беременных и кормящих женщин.
IV поколение:
1) Парентеральные (цефепим).
Близок по параметрам к препаратам III поколения, но также имеет высокую активность в отношении P. aeruginosa, Enterobacter spp., C. freundii, Serratia spp., M. morganii, P. stuartii, P. rettgeri и неферментирующих микроорганизмов.
Показаниями являются тяжелые инфекции нижних дыхательных путей, мочевыводящих путей, кожи, мягких тканей, костей, суставов, вызванные полирезистентной микрофлорой, а также сепсис. К частым побочным эффектам цефалоспоринов относятся аллергические реакции и нарушение функции ЖКТ; могут наблюдаться судороги со стороны ЦНС, холестаз и псевдохолелитиаз со стороны печени. Аллергия перекрестная ко всем цефалоспоринам, также может наблюдаться перекрестная аллергия и с пенициллинами. В связи с низкой экскрецией у детей и пожилых людей период полувыведения цефалоспоринов у них увеличивается. Сочетание с аминогликозидами или петлевыми диуретиками может вызвать нефротоксический эффект. Антациды уменьшают всасывание пероральных форм.
Карбапенемы

Общая структура карбапенемов
Относятся к β-лактамным антибиотикам, по сравнению с пенициллинами и цефалоспоринами более устойчивы к действию β-лактамаз. К ним относятся импинем и меропенем. Механизм действия сходен с таковым у пенициллинов и цефалоспоринов. Обладают более широким спектром активности, действуя на многие Гр+ и Гр– бактерии. К ним чувствительны стафилококки, стрептококки, включая пневмококки, гонококки, менингококки, бактерии семейства Enterobacteriaceae, спорообразующие и неспорообразующие анаэробы.
Показания:
1. Вызванные полирезистентной и смешанной микрофлорой тяжелые инфекции нижних дыхательных путей, мочевыводящих путей, интраабдоминальные, органов малого таза, кожи и мягких тканей, сепсис;
2. Эндокардит, инфекции костей и суставов — только импинем;
3. Менингит — только меропенем.
Частые побочные эффекты: аллергические, нарушение функции ЖКТ, со стороны ЦНС — головокружение, тремор, судороги. Аллергические реакции перекрестные со всеми карбапенемами, а у 50 % пациентов также с пенициллинами. Нельзя применять с другими β-лактамными антибиотиками ввиду их антагонизма.
Монобактамы

1 — пенициллины; 2 — цефалоспорины; β-лактамное кольцо выделено красным.
Относятся к β-лактамным антибиотикам, в клинической практике применяется азтреонам, имеющий узкий спектр антибактериальной активности. Азтреонам используется как препарат резерва для лечения инфекций, вызванных Гр– микрофлорой. Активен в отношении бактерий семейства Enterobacteriaceae, P. aeruginosa, в том числе в отношении штаммов, устойчивых к аминогликозидам, пенициллинам, цефалоспоринам. Учитывая узкий спектр действия азтреонама, его следует назначать в сочетании с АБ, активными в отношении Гр+ микрофлоры. Препарат редко вызывает аллергические реакции, но часты реакции и со стороны ЖКТ, печени, ЦНС, почек. У пациентов с почечной и печеночной недостаточностью доза корригируется. Азтреонам не следует сочетать с карбапенемами ввиду их лекарственного антагонизма.
Аминогликозиды

Стрептомицин
Препараты этого класса являются практически ровесниками пенициллинов: первые из них открыты в 1944 году. В настоящее время насчитывается три поколения аминогликозидов:
I поколение:
- стрептомицин;
- неомицин;
- канамицин;
II поколение:
- гентамицин;
- тобрамицин;
- нетилмицин;
III поколение:
- амикацин.
По механизму действия препараты являются бактерицидными, обеспечивается он путем блокирования синтеза белка на рибосомах. Основное значение эти препараты имеют при лечении нозокомиальных инфекций, вызванных Гр– анаэробами, инфекционного эндокардита. Стрептомицин и канамицин активны в отношении M. tuberculosis, амикацин же более активен в отношении атипичных микобактерий. Стрептомицин также активен в отношении возбудителей чумы, туляремии, бруцеллеза. Назначаются в качестве эмпирической терапии при сепсисе невыясненной этиологии, инфекционном эндокардите, посттравматических и послеоперационных менингитах, лихорадке у пациентов с нейтропенией, нозокомиальной пневмонии, пиелонефрите, интраабдоминальных инфекциях, инфекции органов малого таза, диабетической стопе, остеомиелите, септическом артрите; в качестве местной терапии — при инфекциях глаз. В качестве специфической терапии стрептомицин применяется при лечении чумы, туляремии, бруцеллеза, туберкулеза; гентамицин — при лечении туляремии; канамицин — при туберкулезе.
Обладают нефротоксическим и ототоксическим эффектами. Могут приводить к нарушениям вестибулярного аппарата, блокировать нервно-мышечную передачу. Аминогликозиды нельзя смешивать вместе с β-лактамами и гепарином ввиду их физико-химической несовместимости. Нефротоксичность и ототоксичность усиливается при комбинировании их с другими нефро- и ототоксичными препаратами: полимиксином В, амфотерецином В, этакриновой кислотой, фуросемидом, ванкомицином. Нервно-мышечная блокада усиливается при комбинации с препаратами для ингаляционного наркоза, опиоидными анальгетиками, сульфатом магния.
Тетрациклины

Базовая химическая структура тетрациклинов
Как и пенициллины, являются одним из самых ранних классов антибиотиков. Были открыты в 40-х годах прошлого века, в настоящее время их применение ограничено. Обладают бактериостатическим эффектом, связанным с нарушением синтеза белка в микробной клетке. В настоящее время многие микроорганизмы обрели резистентность к тетрациклинам, но препараты (природный тетрациклин и синтетический доксициклин) сохраняют свое значение при риккетсиозах, хламидийных инфекциях, тяжелой угревой сыпи.
Тетрациклины обладают большим количеством побочных эффектов. Они нарушают функции ЖКТ, воздействуют на ЦНС (головокружение, повышение внутричерепного давления), вызывают нарушения метаболизма (нарушение белкового обмена с преобладанием катаболизма, нарастание азотемии), ведут к нарушениям образования костной ткани, вызывают перекрестные ко всем тетрациклинам аллергические реакции. Тетрациклины обладают очень высоким гепатотоксическим эффектом, вплоть до развития жировой дистрофии или некроза печени. Факторами риска гепатотоксичности являются быстрое внутривенное введение препарата, исходные нарушения функции печени, беременность, почечная недостаточность. При приеме тетрациклинов внутрь одновременно с антацидами, содержащими кальций, алюминий и магний, с натрия гидрокарбонатом и холестирамином может снижаться их биодоступность вследствие образования невсасывающихся комплексов и повышения рН желудочного содержимого. Не рекомендуется сочетать тетрациклины с препаратами железа, поскольку при этом может нарушаться всасывание и тех, и других. Карбамазепин, фенитоин и барбитураты усиливают печеночный метаболизм доксициклина и уменьшают его концентрацию в крови, что может потребовать коррекции дозы данного препарата или замены его на тетрациклин. При сочетании с тетрациклинами возможно ослабление эффекта эстрогеносодержащих пероральных контрацептивов. Тетрациклины могут усиливать действие непрямых антикоагулянтов вследствие ингибирования их метаболизма в печени, что требует тщательного контроля протромбинового времени. Имеются сообщения о том, что при сочетании тетрациклинов с препаратами витамина А возрастает риск синдрома псевдоопухоли мозга.
Мифы, связанные с антибиотиками
Антибиотики были и остаются препаратами, вокруг которых клубится множество мифов. Обсудим самые известные из них.
Миф 1: Антибиотики можно применять без назначения врача.
Бесконтрольное применение антибиотиков часто приводит к возникновению резистентных микроорганизмов, что является достаточной проблемой для мировой медицины. Количество эффективных препаратов снижается, а, по мнению ученых, для того, чтобы восстановилась активность антибиотика, необходимо прекратить его использование не менее, чем на 40 лет.
Миф 2: Необходимо начинать прием антибиотика при первом же проявлении симптомов ОРЗ.
В большинстве случаев острые респираторные заболевания имеют вирусную этиологию. Антибиотики же, как мы знаем, не способны воздействовать на вирусы. В то же время эти препараты достаточно токсичны и могут вызвать побочные эффекты в ослабленном организме.
Миф 3: Длительность антибиотикотерапии должна составлять не менее 10–14 дней.
Арсенал современных антимикробных препаратов дает возможность и однократного приема, и приема краткими курсами. Длительность лечения же зависит от характера заболевания. Так, при неосложненных инфекциях дыхательных путей применение соответствующих препаратов происходит курсом в 3–5 дней, а при хроническом остеомиелите растягивается на несколько месяцев.
Миф 4: Антибиотики можно применять пару дней, и, если станет легче, отменить.
В силу растущей резистентности микроорганизмов прием антибиотиков должен быть целесообразным, курсовым и варьироваться от степени эффективности препарата. Даже при улучшении состояния необходимо продолжить курс лечения до своего окончания.
Миф 5: Существуют антибиотики, которыми можно лечиться часто.
Это не так, все антибиотики являются достаточно токсичными препаратами и имеют большое количество побочных эффектов. Это могут быть и аллергические проявления, и расстройства функций ЖКТ, печени, почек, неврологические расстройства, нарушения со стороны органов кроветворения и многое другое.
Миф 6: Антибиотики убивают все живое, и принимать их категорически нельзя.
Правильно подобранный антибиотик в большей степени воздействует на микроорганизм, но не следует забывать, что борьба эта происходит в теле больного и, соответственно, структуры его организма реагируют на происходящее. Глупо было бы отрицать отсутствие побочных эффектов, но все они устраняются после окончания лечения.
Миф 7: Антибиотики нарушают функцию ЖКТ, и поэтому их необходимо применять вместе с бифидопрепаратами.
Доказательств эффективности совместного приема нет никаких. Соответственно, это лишь увеличит стоимость лечения, но не принесет эффекта.
Миф 8: Антибиотики необходимы при пищевых отравлениях.
Отравления чаще всего вызываются не самими микроорганизмами, а их токсинами. В борьбе же с токсинами антибиотики неэффективны.
Миф 9: Антибиотики стоит применять при лихорадке.
Да, как бы это глупо не звучало, но такое слышится довольно часто. Антибиотики не обладают жаропонижающим эффектом, и поэтому применение их при повышении температуры бессмысленно.
Миф 10: Антибиотики следует запивать молоком, соком цитрусовых.
Молоко может привести к нейтрализации антибиотика в желудке, а цитрусовые соки, наоборот, тормозят инактивацию антибиотиков, что, в свою очередь, может приводить к передозировке.
В заключение
Антибиотики являются одной из немногих групп лекарственных средств, которые в 50 % случаев применяются нерационально и необоснованно. Часто это происходит по вине самих пациентов, которые назначают их себе, своим родственникам и коллегам, копируя некогда услышанную тактику лечения. Назначают они их себе от ОРВИ (по данным ВЦИОМ, 46 % россиян уверены, что антибиотики в борьбе с вирусами не менее эффективны, чем в борьбе с бактериями), от болей в животе и горле, в качестве жаропонижающих и противокашлевых средств. Нередко по тем же показаниям они назначаются и провизорами в аптеках. Но со времен своего открытия антибиотики остаются одним из самых важных прорывов в медицине. Если, конечно, правильно их применять…
Источники:
1. http://www.rlsnet.ru/books_book_id_2_page_235.htm
2. https://ru.wikipedia.org
3. http://en.wikipedia.org/wiki/Antibiotics
4. http://www.rmj.ru/articles_9423.htm
5. http://www.rmj.ru/articles_9423.htm
6. http://www.antibiotic.ru/
7. http://www.rlsnet.ru/
Для печати:
Антибиотики Мифы вокруг антибиотиков Рассмотрим самые популярные классы антибиотиков
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.