Давно мы что-то с Катей не химичили 🙂 Захотелось каких-то простых, но зрелищных опытов. А что может быть проще, чем получение разноцветных жидкостей? Главное выбрать такие реакции, чтобы все необходимые ингредиенты для них можно было бы найти дома. И их не так уж мало! А что еще хорошо при работе с жидкостями, так это то, что если не брать уж совсем какие-то едкие кислоты, проведение таких опытов можно доверить самому ребенку. Под присмотром, конечно. Но, по крайней мере, смешивать, капать и переливать он сможет сам. Например, в прошлый раз мы делали цветной огонь – там все манипуляции проводила я сама, Катя лишь наблюдала. А в это раз Катя сама “колдовала” – и восторга было в сто раз больше! 🙂
Итак, нам понадобятся: крахмал, соль, молоко, уксус (все это есть на кухне), марганцовка, йод, перекись водорода, раствор аммиака, более известный как нашатырный спирт (все это покупается в аптеке) и медный купорос (последний можно купить в садоводческих магазинах – он продается как удобрение).
Начинаем опыты с того, что подготавливаем нужные вещества. Так потом будет удобнее экспериментировать – не придется по сто раз замешивать нужные жидкости. В отдельных емкостях (например, в стеклянных стаканах) делаем растворы, тщательно перемешивая их:
- медного купороса (1 ч.л. на 150 г воды)
- насыщенный солевой (6 ч.л. соли на 150 г воды)
- марганцовки (буквально несколько крупинок перманганата калия на 150 г воды: так, чтобы получился ярко-малиновый цвет)
- йода (капаем 3-5 капель йода в 100 г воды)
- крахмала (1ч.л. на 100 г воды)
ОПЫТ ЗЕЛЕНЫЙ. Соль и медный купорос.
Понадобится: насыщенный солевой раствор, раствор медного купороса, пустая стеклянная емкость (например, стакан).
 |
| соль и медный купорос |
Ход работы:
В пустой стакан наливаем около 50 г солевого раствора (прозрачная жидкость), добавляем тоже около 50 г раствора медного купороса (голубая жидкость) и смотрим, как в результате реакции жидкость становится зеленой!
 |
| голубой + прозрачный = зеленый |
ОПЫТ СИНИЙ. Медный купорос и аммиак
Понадобится: нашатырный спирт, раствор медного купороса, пустая стеклянная емкость (например, стакан).
 |
| медный купорос и нашатырный спирт |
Ход работы:
Перед тем, как проводить опыт, я еще раз рассказала и показала Кате, как надо нюхать вещества при проведении химических опытов. И только после этого открыла пузырек с нашатырем. Теперь Катя на себе поняла, почему не стоит сразу совать свой нос в банку и нюхать))))
А дальше сам опыт.
В пустой стакан наливаем 50 г раствора медного купороса (голубой цвет) и капаем буквально пару капель прозрачного нашатырного спирта. Голубая жидкость тут же превращается в синюю!
 |
| Прозрачный + голубой = синий |
ОПЫТ ФИОЛЕТОВЫЙ. Йод и крахмал
Общеизвестную йодную реакцию на крахмал мы уже делали с Катей, когда изучали клубни картофеля при наших опытах с растениями. Но в таком виде реакция происходит гораздо зрелищнее.
Понадобится: раствор йода, раствор крахмала, пустая стеклянная емкость (например, стакан).
 |
| йод и крахмал |
Ход работы:
Взбалтываем раствор крахмала (непрозрачный, белого цвета) и наливаем грамм 50 в пустой стакан. Добавляем туда 50 грамм раствора йода (золотисто-желтого цвета). В результате у нас в стакане получается жидкость темно-фиолетового цвета!
 |
| Желтый + белый = фиолетовый |
ОПЫТ БЕЖЕВЫЙ. Марганцовка и молоко
Понадобится: раствор марганцовки, молоко, пустая стеклянная емкость (например, стакан).
 |
| марганцовка и молоко |
Ход работы:
Наливаем грамм 50 молока в пустой стакан. Получаем жидкость белого цвета. Добавляем туда столовую ложку раствора марганцовки (малинового цвета). В результате молоко темнеет и становиться бледно-коричневым!
 |
| Малиновый + белый = коричневый |
И напоследок самый эффектный опыт!
ОПЫТ ПО ОБЕСЦВЕЧИВАНИЮ. Марганцовка, уксус и перекись
Понадобится: раствор марганцовки, столовый уксус, перекись водорода, пустая стеклянная емкость (например, стакан).
 |
| Марганцовка, уксус, перекись водорода |
Ход работы:
Наливаем в пустой стакан 50 г раствора марганцовки (ярко-малиновый цвет).
 |
| Просто марганцовка |
Добавляем в него 1 ч.л. уксуса (прозрачный цвет). Жидкость окраски не поменяла – все такая же ярко-малиновая.
А теперь добавьте в нее пол чайной ложки перекиси. Прямо у вас на глазах жидкость начнет светлеть! И уже буквально через минуту в стакане будет кристально-прозрачная вода!
 |
| В марганцовку с уксусом добавляем перекись |
 |
| Жидкость обесцвечивается! |
Это так неожиданно и так интересно, что потом мы еще несколько раз проделывали этот опыт в разных вариантах.
Например, если к марганцовке сначала добавить перекись, то жидкость станет коричневой и начнет активно выделять пузырьки газа. Но тоже обесцвечивается, если к ней добавить чайную ложку уксуса.
 |
| Слева – марганцовка, справа – результат ее смешения с перекисью водорода |
ОПЫТ ПЕНИСТЫЙ. Мыло и жидкость из прошлого опыта.
Понадобится: жидкое мыло, разведенное водой.
 |
| Марганцовка, перекись и жидкое мыло |
Ход работы:
Если вместо уксуса в ту жидкость, которая получилась после соединения марганцовки и перекиси в прошлом опыте, добавить жидкое мыло, то жидкость станет сильно пениться. Чтобы реакция шла быстрее, жидкость можно помешать. Через некоторое время она начнет по виду напоминать пенистое пиво 🙂
 |
| Пенистая жидкость |
Вот такие разноцветные химические опыты у нас были в этот раз.
 |
| Разноцветные жидкости из наших опытов |
Качественные реакции органической химии
09-Дек-2012 | комментариев 10 | Лолита Окольнова
Качественные реакции органической химии
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества.
Итак, классы органических соединений и соответствующие им качественные реакции:
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций. Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: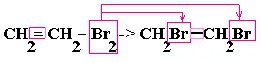 2. Изменение окраски раствора 2. Изменение окраски раствора
перманганата калия: 3СH2=CH2 + 2KMnO4 + 4H2O → 3C2H4(OH)2 + 2MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: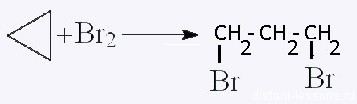 |
| Алкины | 1. Обесцвечивание бромной воды, 2. Образование ацетиленидов серебра и меди: 
3. Изменение окраски перманганата калия: (KMnO4 → MnO2) C2H2 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Взаимодействие с бромом (в присутствии катализатора)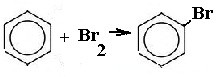
|
| Спирты | Реакция с оксидом меди — в осадок выпадает медь: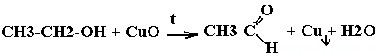 |
| Многоатомные спирты | С гидрокисдом меди (II) — Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды |
Реакция «серебряного зеркала» и реакция «медного зеркала»: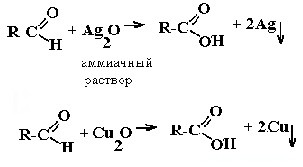 |
| Кислоты органические | Дают окрашенные соли тяжелых металлов — см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин — имеет характерный запах) |
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
- в ЕГЭ это вопрос B6— Качественные реакции органических соединений
Обсуждение: «Качественные реакции органической химии»
(Правила комментирования)
The chemical chameleon is a wonderful color-change chemistry demonstration that may be used to illustrate redox reactions. The color change runs from purple to blue to green to orange-yellow and finally to clear.
Color Change Chameleon Materials
For this demonstration, you start by preparing two separate solutions:
Solution A
- 2 mg potassium permanganate
- 500 ml distilled water
Dissolve a small amount of potassium permanganate into water. The amount isn’t critical, but don’t use too much or else the solution will be too deeply colored to see the color changes. Use distilled water rather than tap water to avoid problems caused by salts in tap water that can affect water pH and interfere with the reaction. The solution should be a deep purple color.
Solution B
- 6 g sugar (sucrose)
- 10 g sodium hydroxide (NaOH)
- 750 ml distilled water
Dissolve the sugar and sodium hydroxide in the water. The reaction between sodium hydroxide and water is exothermic, so expect some heat to be produced. This will be a clear solution.
Make the Chameleon Change Colors
When you’re ready to start the demonstration, all you need to do is mix the two solutions together. You’ll get the most dramatic effect if you swirl the mixture together to thoroughly combine the reactants.
Upon mixing, the purple of the potassium permanganate solution immediately changes to blue. It changes to green fairly quickly, but it takes a few minutes for the next color change to pale orange-yellow, as manganese dioxide (MnO2) precipitates. If you let the solution sit long enough, the manganese dioxide will sink to the bottom of the flask, leaving you with a clear liquid.
Chemical Chameleon Redox Reaction
The color changes are the result oxidation and reduction or a redox reaction.
The potassium permanganate is reduced (gains electrons), while the sugar is oxidized (loses electrons). This occurs in two steps. First, the permanangate ion (purple in solution) is reduced to form the manganate ion (green in solution):
- MnO4— + e— → MnO42-
As the reaction is proceeding, both the purple permanganate and green manganate are present, blending together to produce a solution that appears blue. Eventually, there is more green manganate, yielding a green solution.
Next, the green manganate ion is further reduced and forms manganese dioxide:
- MnO42- + 2 H2O + 2 e— → MnO2 + 4 OH—
Manganese dioxide is golden brown solid, but the particles are so small they make the solution appear to change color. Eventually, the particles will settle out of solution, leaving it clear.
The chameleon demonstration is just one of many possible color change chemistry experiments you can perform. If you don’t have the materials on hand for this particular demonstration, consider trying a different one.
Safety Information
Sucrose and distilled water are safe and non-toxic. However, appropriate safety gear (lab coat, safety goggles, gloves) should be worn when preparing the solutions and performing the demonstration. Sodium hydroxide and potassium permanganate can cause irritation and chemical burns in contact with skin or mucous membranes. The chemical solutions must be labelled and kept away from children and pets to avoid accidental ingestion. Potassium permanganate is highly toxic to aquatic organisms. In some places, pouring a small quantity of a solution down the drain is allowed. The reader is advised to consult federal, state, and local regulations for proper disposal.
Fast Facts: Chemical Chameleon Science Experiment
Materials
- Potassium permanganate
- Sucrose (table sugar)
- Sodium hydroxide
- Distilled Water
Concepts Illustrated
- This demonstration is a good example of an exothermic reaction. The color change is produced via a redox (oxidation-reduction) reaction.
Time Required
- The two chemical solutions may be prepared in advance, so this demonstration is instantaneous.
Level
- The demonstration is suitable for all age groups. High school and college chemistry students studying redox reactions will get the most out of the experiment, but it can be used to stimulate interest in chemistry and science at any age. The demonstration may be performed by any high school or college chemistry teacher. Because there are safety protocols for using potassium permanganate and sodium hydroxide, this demonstration is not suitable for unsupervised children.
The chemical chameleon is a wonderful color-change chemistry demonstration that may be used to illustrate redox reactions. The color change runs from purple to blue to green to orange-yellow and finally to clear.
Color Change Chameleon Materials
For this demonstration, you start by preparing two separate solutions:
Solution A
- 2 mg potassium permanganate
- 500 ml distilled water
Dissolve a small amount of potassium permanganate into water. The amount isn’t critical, but don’t use too much or else the solution will be too deeply colored to see the color changes. Use distilled water rather than tap water to avoid problems caused by salts in tap water that can affect water pH and interfere with the reaction. The solution should be a deep purple color.
Solution B
- 6 g sugar (sucrose)
- 10 g sodium hydroxide (NaOH)
- 750 ml distilled water
Dissolve the sugar and sodium hydroxide in the water. The reaction between sodium hydroxide and water is exothermic, so expect some heat to be produced. This will be a clear solution.
Make the Chameleon Change Colors
When you’re ready to start the demonstration, all you need to do is mix the two solutions together. You’ll get the most dramatic effect if you swirl the mixture together to thoroughly combine the reactants.
Upon mixing, the purple of the potassium permanganate solution immediately changes to blue. It changes to green fairly quickly, but it takes a few minutes for the next color change to pale orange-yellow, as manganese dioxide (MnO2) precipitates. If you let the solution sit long enough, the manganese dioxide will sink to the bottom of the flask, leaving you with a clear liquid.
Chemical Chameleon Redox Reaction
The color changes are the result oxidation and reduction or a redox reaction.
The potassium permanganate is reduced (gains electrons), while the sugar is oxidized (loses electrons). This occurs in two steps. First, the permanangate ion (purple in solution) is reduced to form the manganate ion (green in solution):
- MnO4— + e— → MnO42-
As the reaction is proceeding, both the purple permanganate and green manganate are present, blending together to produce a solution that appears blue. Eventually, there is more green manganate, yielding a green solution.
Next, the green manganate ion is further reduced and forms manganese dioxide:
- MnO42- + 2 H2O + 2 e— → MnO2 + 4 OH—
Manganese dioxide is golden brown solid, but the particles are so small they make the solution appear to change color. Eventually, the particles will settle out of solution, leaving it clear.
The chameleon demonstration is just one of many possible color change chemistry experiments you can perform. If you don’t have the materials on hand for this particular demonstration, consider trying a different one.
Safety Information
Sucrose and distilled water are safe and non-toxic. However, appropriate safety gear (lab coat, safety goggles, gloves) should be worn when preparing the solutions and performing the demonstration. Sodium hydroxide and potassium permanganate can cause irritation and chemical burns in contact with skin or mucous membranes. The chemical solutions must be labelled and kept away from children and pets to avoid accidental ingestion. Potassium permanganate is highly toxic to aquatic organisms. In some places, pouring a small quantity of a solution down the drain is allowed. The reader is advised to consult federal, state, and local regulations for proper disposal.
Fast Facts: Chemical Chameleon Science Experiment
Materials
- Potassium permanganate
- Sucrose (table sugar)
- Sodium hydroxide
- Distilled Water
Concepts Illustrated
- This demonstration is a good example of an exothermic reaction. The color change is produced via a redox (oxidation-reduction) reaction.
Time Required
- The two chemical solutions may be prepared in advance, so this demonstration is instantaneous.
Level
- The demonstration is suitable for all age groups. High school and college chemistry students studying redox reactions will get the most out of the experiment, but it can be used to stimulate interest in chemistry and science at any age. The demonstration may be performed by any high school or college chemistry teacher. Because there are safety protocols for using potassium permanganate and sodium hydroxide, this demonstration is not suitable for unsupervised children.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Пособие-репетитор по химии
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19/2008
ЗАНЯТИЕ 26
10-й класс (первый год обучения)
Марганец. Перманганат калия и
продукты его восстановления
в различных средах
П л а н

Положение в таблице Д.И.Менделеева, возможные
валентности и степени окисления.
2. Краткая история открытия и происхождение
названия.
3. Физические и химические свойства.
4. Нахождение в природе и основные методы
получения.
5. Важнейшее соединение
марганца – перманганат калия. Продукты его
восстановления в зависимости от среды раствора.
Марганец расположен в побочной подгруппе VII
группы периодической системы Д.И. Менделеева. Это
элемент, обладающий переменной валентностью.
В соединениях марганец проявляет степени
окисления +2, +3, +4, +6, +7, основными из которых
являются степени окисления +2 и +4.
Марганец был открыт в 1774 г. шведскими химиками
К.Шееле и Ю.Ганном при прокаливании минерала
пиролюзита (MnO2) с углем. Название
элемента, вероятно, представляет собой
искаженное слово «манганес», что означает
«обесцвечиваю, навожу блеск». Это название имеет
ремесленное происхождение и связано
с обесцвечивающим действием пиролюзита на
стекло при плавлении.
Ф и з и ч е с к и е и х и м и ч е
с к и е с в о й с т в а
Марганец – серебристый, довольно
тугоплавкий металл. На воздухе и в воде он
пассивируется, но в мелкораздробленном
состоянии может быть окислен и взаимодействует
с водой с образованием гидроксида.
В целом марганец можно охарактеризовать как
достаточно активный металл (особенно в
мелкодисперсном состоянии).
Н2 (–).
О2 (+):
Mn + O2 MnO2
(t = 400 °C).
Металлы (–).
Неметаллы (+):
Mn + Cl2 MnCl2,
Mn + S MnS,
3Mn + N2 Mn3N2.
Н2О (+/–):*
Основные оксиды (–).
Кислотные оксиды (–).
Основания (–).
Кислоты-неокислители (+):
Mn + 2HCl = MnCl2 + H2.
Кислоты-окислители (+):
Mn + 2H2SO4(конц.) = MnSO4 + SO2 + 2H2O,
3Mn + 8HNO3(р-р) = 3Mn (NO3)2 + 2NO + 4H2O,
Mn + 4HNO3(конц.) = Mn (NO3)2 +
2NO2 + 2H2O.
Соли (+/–):
Mn + CuCl2 = MnCl2 + Cu,
Mn + CаCl2
реакция не идет.
В п р и р о д е марганец в основном
встречается в виде оксидов, поэтому основным
промышленным м е т о д о м п о л у ч е н и я
марганца является его восстановление (обычно
с помощью кремния, углерода или алюминия):
MnO2 + C Mn + CO2,
Кроме того, марганец получают, проводя
электролиз растворов его солей, например:
Важнейшее соединение
марганца – перманганат калия.
Продукты его восстановления в зависимости от
среды раствора
Перманганат калия (KMnO4) – соль
марганцовой кислоты HMnO4. Марганцовая
кислота является очень сильной, существует
только в водном растворе. Перманганат
калия – самая известная и широко
применяемая соль этой кислоты. Это
кристаллическое вещество темно-фиолетового,
почти черного цвета, умеренно растворимое в воде.
Растворы перманганата калия слабой концентрации
имеют малиновый цвет, при повышении концентрации
цвет становится фиолетовым (такая окраска
свойственна перманганат-иону). В водных
растворах эта соль не подвергается гидролизу,
т.к. образована сильным основанием и сильной
кислотой. При нагревании перманганат калия легко
разлагается с образованием манганата калия,
оксида марганца(IV) и кислорода:
2KMnO4 K2MnO4
+ MnO2 + O2.
Перманганат калия является сильным
окислителем за счет перманганат-иона,
содержащего марганец в высшей степени окисления
+7. Характер продуктов восстановления KMnO4
зависит от того, в какой среде происходит
реакция.
В кислой среде перманганат-ионы
восстанавливаются до ионов Mn2+. За счет
образования неокрашенных солей марганца цвет
раствора меняется от фиолетового до бесцветного.
2KMnO4 + 5Na2SO3 + 6HCl = 2MnCl2 +
5Na2SO4 + 2KCl + 3H2O.
В нейтральной среде перманганат-ионы
восстанавливаются до оксида марганца(IV),
выпадает бурый осадок MnO2, степень
окисления марганца понижается от +7 до +4.
2KMnO4 + 3Na2SO3 + H2O =
2MnO2 + 3Na2SO4
+ 2KOH.
В щелочной среде перманганат-ионы
восстанавливаются до манганат-ионов.
В результате раствор приобретает зеленый
цвет; степень окисления марганца понижается от +7
до +6.
2KMnO4 + Na2SO3 + 2KOH = 2K2MnO4
+ Na2SO4 + H2O.
Как окислитель перманганат калия широко
применяется в лабораторной практике. Кроме того,
марганцовку широко применяют в медицине в
качестве антисептического средства. Находит
применение перманганат калия и как твердый
источник для получения кислорода.
Тест по теме «Марганец и его
соединения»

из оксидов является кислотным?
а) MnO; б) Mn2O3;
в) MnO2; г) Mn2O7.
2. Соединение, содержащее , в среде с рН < 7
восстанавливается до:
3. В реакции окисления сульфата железа(II)
перманганатом калия в сернокислой среде сумма
коэффициентов перед реагентами равна:
а) 11; б) 15; в) 16; г) 20.
4. В каком из перечисленных соединений
атом марганца имеет максимально возможную
степень окисления?
а) Перманганат калия; б) манганат калия;
в) сульфид марганца; г) марганцовая кислота.
5. В каком из оксидов марганца
максимальна массовая доля кислорода?
а) MnO; б) Mn2O3; в) MnO2; г) Mn2O7.
6. Плотность 36,2 %-го раствора серной
кислоты составляет 1,27 г/мл. Рассчитайте молярную
концентрацию (в моль/л) кислоты в этом растворе.
а) Недостаточно данных для решения задачи;
б) 4,7; в) 36,2; г) 0,0047.
7. Сколько электронов содержит
перманганат-ион?
а) 25; б) 57;
в) 58; г) 120.
8. Какую массу йодида калия (в г) окислили
перманганатом калия в солянокислом растворе,
если при этом образовалось 6,3 г соли марганца?
а) 8,3; б) 4,15; в) 16,6; г) 41,5.
9. Сумма всех коэффициентов в реакции
окисления свежеосажденного гидроксида железа(II)
перманганатом калия в водном растворе
составляет:
а) 5; б) 6; в) 8; г) 11.
10. Число -связей
в молекуле марганцовой кислоты равно:
а) 5; б) 3; в) 6; г) 0.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| г | в | г | а, г | г | б | в | г | г | б |
Качественные задачи на обсуждение
попарного взаимодействия веществ

данного типа удобно решать с помощью решетки
Плетнера. При этом необходимо учитывать
возможность протекания альтернативных реакций
(в случае образования кислых и средних солей, в
случае неизвестной концентрации
кислот-окислителей и т.д.).
1. Обсудите возможность попарного
взаимодействия между следующими веществами:
соляная кислота, хлорид кальция, нитрат серебра,
карбонат калия, гидроксид натрия, хлор. Напишите
уравнения реакций.
Решение
Решаем с помощью решетки Плетнера.
| Вещества | HCl | CaCl2 | AgNO3 | K2CO3 | NaOH | Cl2 |
| HCl | – | – | + (1-е уравнение) |
+ (2-е уравнение) |
+ (3-е уравнение) |
– |
| CaCl2 | – | – | + (4-е уравнение) |
+ (6-е уравнение) |
+ (7-е уравнение) |
– |
| AgNO3 | + (1-е уравнение) |
+ (4-е уравнение) |
– | + (5-е уравнение) |
+ (8-е уравнение) |
– |
| K2CO3 | + (2-е уравнение) |
+ (6-е уравнение) |
+ (5-е уравнение) |
– | – | – |
| NaOH | + (3-е уравнение) |
+ (7-е уравнение) |
+ (8-е уравнение) |
– | – | + (9-е и 10-е уравнения) |
| Cl2 | – | – | – | – | + (9-е и 10-е уравнения) |
– |
1) HCl + AgNO3 = AgCl + HNO3.
2) 2HCl + K2CO3 = 2KCl + H2O + CO2.
3) HCl + NaOH = NaCl + H2O.
4) CaCl2 + 2AgNO3 = 2AgCl + Ca(NO3)2.
5) 2AgNO3 + K2CO3 = Ag2CO3 + 2KNO3.
6) CaCl2 + K2CO3 = CaCO3 + 2KCl.
7) CaCl2 + 2NaOH = Ca(OH)2 + 2NaCl.

+ 2NaNO3 + H2O.
9) 2NaOH + Cl2 NaCl + NaClO + H2O.
10) 6NaOH + 3Cl2 5NaCl + NaClO3
+ 3H2O.
Ответ. 9 вариантов возможных
попарных
взаимодействий (10 уравнений реакций).
2. Какие из перечисленных веществ будут
реагировать между собой: медь, концентрированная
азотная кислота, углерод, сера, алюминий, хлорид
железа(III), карбонат натрия? Напишите уравнения
реакций.
Ответ. 14 вариантов возможных
попарных
взаимодействий (14 уравнений реакций).
3. Определите, какие вещества могут
взаимодействовать между собой: цинк, хлор,
угарный газ, оксид натрия, гидроксид натрия,
азотная кислота, хлорид меди(II). Напишите
уравнения реакций.
Ответ. 12 вариантов возможных
попарных
взаимодействий (15 уравнений реакций).
4. Какие из перечисленных веществ могут
взаимодействовать между собой: бром, гидроксид
калия, аммиак, соляная кислота, йодид калия, цинк.
Напишите уравнения реакций.
Ответ. 8 вариантов возможных
попарных
взаимодействий (10 уравнений реакций).
5. Определите, какие вещества могут
взаимодействовать между собой: кальций, вода,
оксид меди(II), водород, гидроксид кальция,
концентрированная серная кислота, йодид натрия.
Напишите уравнения реакций.
Ответ. 7 вариантов возможных попарны
взаимодействий (7 уравнений реакций).
6. Обсудите возможность попарного
взаимодействия между следующими веществами:
сульфат натрия, ацетат свинца(II), сульфид калия,
хлорид алюминия, нитрат бария. Напишите
уравнения реакций.
Ответ. 5 вариантов возможных
попарных
взаимодействий (5 уравнений реакций).
*Знак (+/–) означает,
что данная реакция протекает не со всеми
реагентами или в специфических условиях.
Продолжение следует
Содержание
- Опыт «Хамелеон». Проводим интересный эксперимент для детей
- Посмотрите видео
- Почему введен запрет на свободную продажу Марганцовки
- Почему нельзя купить марганцовку – основные причины
- Что делать, если ребенок выпил раствор или съел кристаллы?
- Почему марганцовка желтеет в воде?
- ЦЕЛЕБНЫЕ СВОЙСТВА МАРГАНЦОВКИ — ПОЛЕЗНЫЕ СОВЕТЫ
Опыт «Хамелеон». Проводим интересный эксперимент для детей
ОПЫТ № 1
Для опыта вам понадобится:
- Вода
- Стакан
- Марганцовка
- Средство для очистки труб
- Сахар
Разбавляем немного порошка марганцовки с водой. В другой стакан наливаем воду, и добавляем немного разбавленной марганцовки,чтобы вода стала ярко розового цвета. Далее пол чайной ложки сахара растворяем в небольшом количестве воды и доливаем средство для очистки труб. Этот раствор выливаем в стакан с марганцовкой и наблюдаем за реакцией. Окраска начинает меняться. Сначала раствор становится синим, потом – зеленым, потом постепенно идет переход в желтый цвет. Марганцовка окислила сахар в щелочной среде (средство для очистки труб), с образованием желтого диоксида марганца.
ОПЫТ № 2
Для опыта вам понадобится:
- Стакан
- Вода
- Зеленка
- Перекись водорода
- Средство для очистки труб
Добавляем в стакан с водой немного зеленки чтобы вода окрасилась. Затем добавляем немного перекиси, и в конце небольшое количество средства для очистки труб. Наблюдаем за реакцией. Раствор зеленки обесцветился. В состав зеленки входит краситель — бриллиантовый зеленый, который в щелочной среде (средство для очистки труб) в присутствии перекиси обесцвечивается.
Увлекательных вам наблюдений!
Посмотрите видео
Источник
Почему введен запрет на свободную продажу Марганцовки

Является антисептическим средством, которым еще буквально 5-10 лет тому назад пользовались практически в каждом доме. С помощью марганцовки можно делать слабый обеззараживающий раствор воды в ванной и купать в нем ребенка.
Очень слабый раствор вызывает рвоту, что поможет при отравлениях.
Перманганат калия отлично справляется с разного рода инфицированными ранами, которые долго не заживают, достаточно пару раз на день обрабатывать гнойные поражения кожи раствором, и они начнут быстрее заживать.
Полезна марганцовка и при ангине, с помощью нее можно бороться с вредоносными бактериями в горле – всего лишь нужно делать полоскания 3 раза в день. Также ею можно лечить молочницу влагалища, промывать ожоги на коже. С помощью рецептов народной медицины калия перманганатом можно лечить понос, гастрит и геморрой.
Не смотря на все полезные качества и явную пользу в быту, на данный момент марганцовка запрещена в России для свободной продажи. Тот, кто будет несанкционированно продавать калия перманганат, подлежит уголовному наказанию.
Почему нельзя купить марганцовку – основные причины
Существует 4 веские причины отсутствия данного препарата на аптечных прилавках:
- Из него могут делать бомбы и взрывоопасные вещества
- Наркозависимые используют кристаллы препарата в качестве одного из составных опаснейшего наркотического вещества – первитина
- Продавать калиевую соль марганцевой кислоты неудобно и невыгодно
- Марганцовка опасна для потребления – неверные дозировки могут вызвать отек и ожог гортани, ротовой полости
Пояснение касательно первого пункта – так как вещество действительно взрывоопасно, оно должно храниться в определенных условиях, этим могут похвастаться далеко не все аптеки в России. Если в аптечном помещении есть место для хранения кристаллов, которое пропитано огнеупорными веществами, то только тогда по закону оно может продаваться. Также нельзя выставлять этот медикамент на витрину прилавка.
Пояснение касательно второго пункта – наркотическое вещество под названием первитин наркозависимые научились делать из перманганата калия и бронхолитина (средство от кашля, в состав которого входит эфедрина гидрохлорид). В связи с этим властям пришлось внести изменения в список сильнодействующих наркотических веществ и внести туда калиевую соль марганцевой кислоты.
Пояснение насчет третьего пункта — если работник аптечного учреждения продает данный препарат, то он обязан вести строгий учет по продажам. Также по рецепту нельзя отпускать более двух бутылочек медикамента. Плюс ко всему марганцовка должна храниться в особых условиях, указанных в первом пункте (с противопожарной системой), а специально устанавливать огнеупорную защиту ради копеечного лекарства, которое продается в ограниченном количестве – вообще не выгодно. Вот почему препарат так сложно найти.
И наконец, последний пункт – калиевая соль марганцевой кислоты действительно представляет опасность для здоровья детей и невнимательных людей, которые не могут правильно рассчитать верную концентрацию средства для перорального употребления. Если человек выпил больше необходимого, медикамент легко спровоцирует ожог или отек. Случаи отравления перманганатом калия, когда он был в свободной продаже, встречались в медицинской практике часто, особенно среди несовершеннолетних.
Что делать, если ребенок выпил раствор или съел кристаллы?
Все зависит от количества выпитого или съеденного средства. Если ребенок выпил слабый раствор медикамента бледно-розового цвета, то с ним, скорее всего ничего не случится. В таком случае нужно, чтобы он выпил пол-литра или литр кипяченой теплой воды. 
Скорее всего, придется лечить ребенка от последствий съеденного порошка. В самых тяжелых случаях придется делать операцию. Возможные последствия: в лучшем случае будет рвота и понос, а в худшем – ожог пищевода, отек гортани, судорожные припадки, геморрагический колит, нефропатия, гепатопатия.
Смертельная доза для ребенка считается 3 грамма вещества, а для взрослого колеблется от 0.3 до 0.5 грамм на килограмм веса. Также в домашних условиях, чтобы предотвратить ожог, можно дать выпить раствор соды. Так как перманганат калия – это не что иное, как калиевая соль марганцевой кислоты, а все кислоты нейтрализуются щелочью, то сода может сгладить возможные негативные последствия, если был выпит слабый раствор в небольшом количестве.
Почему марганцовка желтеет в воде?
На самом деле, многие люди задаются этим вопросом и не понимают что делать, когда видят такую странную реакцию. Если в проточной воде перманганат калия меняет розовый или фиолетовый цвет на желтый, это означает, что в воде содержатся продукты распада органических соединений, с которыми калиевая соль марганцевой кислоты вступает в реакцию, из-за чего образуется такой оттенок. Это свойство перманганата калия очень полезно в быту, так можно проверить качество питьевой воды: достаточно накапать пару капель раствора, и если он пожелтеет, значит, такую воду не стоит пить.
Источник
ЦЕЛЕБНЫЕ СВОЙСТВА МАРГАНЦОВКИ — ПОЛЕЗНЫЕ СОВЕТЫ
ЛЕЧЕНИЕ МАРГАНЦОВКОЙ — полезные советы
В годы Великой Отечественной войны, как патроны у солдата, она находилась в сумках санитаров, фельдшеров и широко использовалась при лечении ран в госпиталях.
Первое, к чему прибегают при заболеваниях горла, расстройствах кишечника, отравлениях — это марганцовка (перманганат калия, марганцовокислый калий).
В годы Великой Отечественной войны, как патроны у солдата, она находилась в сумках санитаров, фельдшеров и широко использовалась при лечении ран в госпиталях.
В основе действия перманганата калия — его способность окислять органические вещества, выделяя при этом кислород. Этим обусловлено антимикробное и антисептическое действие марганцовки.
Водный раствор перманганата калия обладает противовоспалительными свойствами. В различных концентрациях этот раствор применяют для промывания ран, полоскания рта и горла, для смазывания язвенных и ожоговых поверхностей, спринцеваний. Диапазон применения перманганата калия достаточно широк. Даже при наличии многих новых синтетических средств он и сейчас незаменим «в» гинекологической, урологической, дерматологической практике.
В таблице противоядий при отравлениях перманганат калия является одним из важнейших средств оказания первой помощи.
Однако при всех достоинствах марганцовокислого калия обращаться с ним надо осторожно. В больших концентрациях он прижигает и вызывает отек слизистых оболочек рта, глотки, пищевода, желудка, кишок, рвоту и понос. Поэтому применять раствор следует с осторожностью.
Еще наши бабушки знали полезные в быту свойства марганцовки: ей промывали раны, лечили отравление, обеззараживали, купали младенцев и даже использовали в борьбе с вредителями в огороде. Такое широкое применение марганцовки объясняет главное ее свойство – это противогрибковый, противомикробный препарат. За счет активных процессов окисления марганцовка убивает вредные микробы – возбудителей различных инфекций как на поверхности кожи, так и внутри организма.
Целебные свойства марганцовки (перманганата калия)
Марганцовка — эффективное дезинфицирующее средство. Раствор перманганата калия (марганцовки) обладает антисептическими свойствами, способен нейтрализовать токсическое действие на организм таких отравляющих соединений, как аконитин, морфин, другие алкалоиды, фосфор (при приеме их внутрь).
Перманганат калия — один из видов перманганатов (от лат. manganum — «марганец») — марганцовокислых солей. Это химическое вещество широко используют как для домашних нужд, так и для медицины. Перманганат калия — кристаллы темно-фиолетового цвета, хорошо растворимые в воде (в зависимости от концентрации цвет может быть от светло-розового до красно-фиолетового), метиловом спирте, уксусной кислоте и ацетоне. В быту марганцовокислый калий, растворенный в воде, называют марганцовкой.
Лечение марганцовкой в медицине
Нейтрализация синильной кислоты (ядовитого вещества) марганцовкой происходит лишь в щелочной среде. Калия перманганат — сильный окислитель. Водный раствор марганцовки оказывает сильное дезинфицирующее и подсушивающее действие, его широко используют в дерматологической и хирургической практике.
При появлении первых признаков гастрита и гастроэнтероколита в первую очередь надо промыть желудок, используя для этого слабый (слегка розовый) раствор марганцовки. Для промывания желудка у взрослых и даже детей зондом пользоваться необязательно, достаточно просто дать выпить больному приготовленный раствор в количестве 0,5 — 2 л, после чего рефлекторно вызвать рвоту.
При отравлениях, когда нужно как можно быстрее вызвать рвоту, пострадавшему дают выпить розовый раствор марганцовки, который является также лекарственным, дезинфицирующим желудочно-кишечный тракт средством.
Раствор зачастую готовят «на глаз», но основные рекомендации — это 10 кристаллов на 1 литр воды, дальнейшую крепость раствора можно корректировать по его цвету. Очень важно, чтобы перед применением все кристаллы растворились в воде, иначе в процессе соприкосновения с кожей или внутренними органами нерастворенные кристаллы могут вызвать ожог.
Наиболее популярен раствор марганцовки при отравлении. При первых признаках, в том числе при диарее больному предлагают раствор марганцовки, который стимулирует очищение кишечника.
Марганцовка для применения внутрь при отравлении готовится в соотношении 2 кристалла на чашку воды, такой раствор выпивается. Благодаря своим антисептическим свойствам подобное лекарство останавливает очаг инфекции в желудке.
Марганцовка – применение в урологии, гинекологии
За счет своих антисептических, противомикробных способностей раствор марганцовки применяют при лечении грибковых, бактериальных заболевания в урологии и гинекологии. Марганцовка имеет применение при молочнице, когда слабый раствор назначают для ежедневных спринцеваний. При урологических проблемах у мужчин, связанных с наружными воспалительными процессами, назначают промывания раствором марганцовки.
При применении в урологии и гинекологии важно соблюдать правила приготовления раствора, следить за тем, чтобы кристаллы марганцовки полностью растворились. В противном случае при попадании на слизистую кристаллы могут вызвать еще большее раздражение.
Марганцовка — противопоказания
Не рекомендуется применять раствор марганцовки при индивидуальной непереносимости. Это сразу можно понять по наличию побочных эффектов – отек, изменение цвета слизистых, резкая боль при применении внутрь, судороги и др. При наличии подобных или других неприятных симптомов прием марганцовки следует прекратить.
Марганцовка за счет своих окислительных свойств абсолютно несовместима с применением угля, сахара и другими веществами, которые легко окисляются. Важно хранить кристаллы перманганата калия вдали от легкоокисляющихся веществ, иначе их соприкосновение может привести к взрыву и даже пожару.
Лечение марганцовкой (перманганатом калия) в народной медицине
Лечение марганцовкой в народной медицине для устранения болей, вызванных мозолями. Для этого в раствор марганцовки розового цвета добавляют поваренную соль и, налив раствор в тазик, опускают в него ноги на 20 мин, после процедуры ноги не нужно вытирать. Через некоторое время боль в области мозолей пройдет. Ни в коем случае для лечения марганцовкой нельзя пользоваться сильно концентрированным раствором (фиолетового цвета), так как это может повлечь за собой вред здоровью, получение ожогов кожи и слизистых, отравление.
Хороший лечебный эффект при опрелостях, в том числе и у грудных детей, оказывают гигиенические ванны с марганцовкой: вода должна быть розового цвета и теплой.
При повышенной потливости нижних конечностей, неприятных запахах, гнойных мозолях поможет теплая ножная ванна с солью и марганцовкой, после процедур ноги следует хорошо вытереть и посыпать тальком.
Лечение перманганатом калия активно используется для промывания открытых ран, в том числе и гноящихся. При дерматитах, характеризующихся появлением пузырей, кожу следует обмыть розовым раствором перманганата калия.
Если при постановке банок их слишком долго держать, на коже могут образоваться багровые пятна и даже пузырьки, наполненные сукровичной жидкостью. В подобных случаях пораженные места полезно смазать 5 — 10%-ным раствором марганцовокислого калия.
Лечение перманганатом калия на практике: лучшие рецепты
В запущенных случаях геморроя можно приготовить целебный раствор.
1 ч. л. пищевой соды,
1 ст. л. любого растительного масла,
марганцовка,
3 л воды.
В горячую воду всыпать столько марганцовки, чтобы получить розовый цвет, добавить соду, масло, раствор влить в ванну.
Применение. Принимать ванну в течение 20 мин на ночь. Процедуру проводить ежедневно в течение недели.
В народной медицине есть рецепт для лечения марганцовкой от дизентерии.
В состав этого средства входят несколько кристаллов марганцовки на 0,5 л воды. Советуют увеличивать концентрацию раствора в зависимости от возраста (грудничкам — бледно-розовый, а взрослым людям — малиновый раствор).
Рекомендуется принимать такой раствор внутрь, совмещая это с процедурой постановки клизмы.
Надо иметь в виду, что перманганат калия при взаимодействии с различными органическими веществами становится взрывоопасным. Поэтому его кристаллы надо хранить в чистой стеклянной посуде с притертыми пробками, а раствор — в склянках из темного стекла, так как под действием солнечных лучей и дневного света он легко разлагается.
При пользовании раствором часто остаются трудно смываемые пятна на коже и белье. Чтобы устранить их, кожу можно обмыть раствором сернистого аммония в концентрации 1:5, а затем горячей водой. С белья пятна выводят раствором щавелевой кислоты (1:9), 2-процентным раствором соляной кислоты, уксусом или лимонным соком..
Источник
Понравилась статья? Подпишитесь на канал, чтобы быть в курсе самых интересных материалов
Источник
Качественные реакции в органической химии
Содержание
- 1 Качественные реакции на алканы
- 2 Качественные реакции на алкены
- 3 Качественные реакции на алкины
- 4 Качественные реакции на альдегиды
- 5 Качественные реакции на спирты
- 6 Качественные реакции на карбоновые кислоты
- 7 Качественные реакции на амины
- 8 Качественные реакции на анилин
- 9 Качественные реакции на фенол
- 10 Качественные реакции на алкилхлориды
- 11 Качественные реакции на углеводы
- 12 Качественные реакции на белки
Качественные реакции в органической химии используются для быстрого распознавания класса соединения. Для таких реакций характерно проявление внешних эффектов — изменение цвета раствора, выпадение осадка или выделение газа.
Качественные реакции на алканы
- При горении алканов пламя становится голубым.
- Реакция окисления алканов перманганатом калия на холоде не идет – раствор не меняет цвет.
Читайте также:
Окисление алкенов перманганатом калия
Применение алканов
Качественные реакции на алкены
- Реакция Вагнера – обесцвечивание раствора перманганата калия, сопровождается выпадением темно-коричневого осадка диоксида марганца:
- Обесцвечивание бромной воды:
Качественные реакции на алкины
- Реакция Вагнера – раствор перманганата калия обесцвечивается и выпадает осадок черного цвета (диоксид магния):
- Обесцвечивание бромной воды:
- С реактивом Толленса (гидроксид диамин серебра) только алкины с крайними тройными связями образуют осадок ацетиленида серебра. Алкины с другим расположением тройной связи в реакцию не вступают:
Качественные реакции на альдегиды
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:
- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты делят на одно- и многоатомные (по количеству ОН-групп) и определяют с помощью разных качественных реакций.
1. Для одноатомных спиртов
1.1 С оксидом меди (II) — над раскаленным оксидом пропускают пары спирта, образуется альдегид, который выявляют пробой с фуксинсернистой кислотой – раствор окрашивается в характерный бледно-фиолетовый цвет:
1.2 Йодоформная проба – с йодом и гидроксидом натрия образуется йодоформ, осадок желтого цвета:
1.3. Проба Лукаса для выявления вторичных и третичных спиртов – первичные в реакцию не вступают. При взаимодействии одноатомных спиртов с концентрированным раствором соляной кислоты и хлорида цинка раствор расслаивается и образуется мутный маслянистый слой алкилхлорида:
2. Для многоатомных спиртов на примере глицерина
Голубой осадок гидроксида меди (II) при нормальных условиях растворяется в глицерине с образованием комплексного соединения меди ярко-синего цвета:
Качественные реакции на карбоновые кислоты
1. Фиолетовый раствор лакмуса карбоновые кислоты окрашивают в красный цвет.
2. Разложение под действием серной кислоты на угарный газ и воду. Выделяющийся угарный газ можно поджечь – он горит синим пламенем.
Для муравьиной кислоты:
Аналогично разлагается и многоосновная щавелевая кислота:
3. Реакция щавелевой кислоты с солями меди (II) – выпадает зелено-голубой кристаллический осадок оксалата меди:
Качественные реакции на амины
- Фиолетовый раствор лакмуса амины окрашивают в синий цвет.
- Образование дыма в результате взаимодействия летучих аминов с газообразным хлороводородом.
- Первичные амины с хлороформом в щелочной среде образуют соединения – изонитрилы с характерным неприятным запахом:
Качественные реакции на анилин
- При действии хлорной извести водный раствор анилина приобретает интенсивный фиолетовый цвет.
- При бромировании образуется белый осадок 2,4,6-триброманилина:
Качественные реакции на фенол
- При взаимодействии с хлоридом железа (III) раствор приобретает фиолетовый цвет:
- С бромной водой образует твердый белый осадок 2,4,6-трибромфенола:
- При поликонденсации фенолов с альдегидами в кислой или щелочной среде образуются смолообразные полимеры и вода.
Качественные реакции на алкилхлориды
Проба Бейльштейна – качественная реакция определения хлора в органических соединениях.
Образец алкилхлорида на прокаленной медной проволоке помещают в пламя горелки, которое становится сине-зеленым.
Качественные реакции на углеводы
Углевод содержат альдегидные и гидрокси- группы — характерными будут реакции на спирты и альдегиды.
1. Крахмалсодержащие растворы под действием йода становятся синими.
Реакция обратима:
- при нагревании раствор обесцвечивается;
- охлажденный – восстанавливает синий цвет.
2. Проба Селиванова определяет наличие фруктозы. В присутствии резорцина и соляной кислоты углевод приобретает красно-вишневый цвет.
Это интересно:
Основания в химии
Изомеры пентена
Качественные реакции на белки
Цветные реакции позволяют выявить наличие белков в растворах.
- Ксанторотеиновая или Мульдера реакция выявляет в белке наличие аминокислот ароматического ряда (триптофана, тирозина и фенилаланина). Раствор обрабатывается концентрированной азотной кислотой – он окрашивается в желтый цвет; после добавления щелочи цвет изменяется на оранжевый.
- Реакция Фоля указывает на наличие аминокислот, содержащих слабосвязанную серу (цистина и цистеина). При кипячении белка со щелочью сера в виде сульфида свинца дает осадок бурого или черного цвета.
- Горение белка сопровождается запахом паленой шерсти. Качественные реакции в органической химии помогают с минимальными затратами определить, к какому классу соединений относится вещество.
Оценка статьи:
Загрузка…