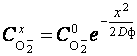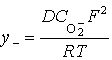В этой заметке я немного расскажу о том, как «красится» титановое изделие.
В мире существует множество технологий, придающий цвет тому или иному материалу.
Цвет можно изменить у чего угодно и как угодно, и в зависимости от химических, физических свойств вещества выбирается та или иная технология.
Самые простые и дешёвые из них — это окрашивание и эмалирование. Эмаль накладывается на дерево, на металлы, да на всё что угодно. Однако если эти технологии и применимы к другим металлам, то с титаном этот номер не прокатит. Ведь, как я рассказывал ранее в статьях, титан в холодном состоянии практически полностью инертен по отношению к любым агрессивным средам, в том числе и к краске, эпоксидке и эмали. Чуть нагреешь — и все труды отваливаются. Распространённым изменением цвета на металлах является также гальваника. Вы когда-нибудь задумывались, как иногда делается белое золото или почему золотые изделия очень хорошо блестят белым цветом, или черным? Это и есть гальваническое родиевое покрытие, и иногда его применяют для удешевления производства белого золота (когда у заказчика нет денег на полноценную технологию) или для того, чтобы закрыть дефекты, или для того, чтобы придать оттенки изделию. Однако с титаном этот номер не прокатит — на любой титан, независимо от марки, гальваническое покрытие как ложится, так и слезает.
Поэтому, чтобы покрасить титан так, чтобы поверхность приобрела относительно устойчивый цвет, приходится изгаляться с другими технологиями. Самая распространённая из них — простое нагревание в муфельной печи или нагревание просто газовой горелкой. Пожалуй, самая доступная технология — что может быть проще: купил газовый туристический баллон для плиток (200 рублей), горелку (500 рублей), и нагревай себе. При этом поверхность будет плыть совершенно разными цветами. Минус такой технологии — процесс неуправляем, и неизвестно какие вы получите цвета. Ведь разные титановые марки по разному реагируют на одну и ту же температуру. Одна может покраситься в цвет, а другая вообще почернеть в графит. В муфельной печи, которая может нагреть титан до определённой температуры, этот процесс более управляем, но полагаю, не у каждого дома есть она, поэтому с ней сложнее. Минусы термообработки в том, что они применимы только к матовым поверхностям. Если отполировать титан до зеркала и затем нагревать, на поверхности появятся разные неприятные артефакты, значительно снижающее качество внешнего вида, и окрашивание не будет равномерным.
То же самое кольцо, вид с другого боку 
Конечно да, при нагреве горелкой температура на поверхности создаётся совершенно разная, и титан красиво может поплыть всеми цветами радуги, но при этом такое изделие не должно претендовать на звание ювелирного — так как вся тончайшая работа по полировке будет просто спущена коту под хвост — артефактов в данном случае не избежать. Поэтому изделия, обработанные при помощи температуры, никогда не полируют до зеркала — в этом просто нет никакого смысла, так как вся работа будет испорчена, а качественно полировать любой титан — это большой труд. Выше — картинка простого глянцевого колечка. Дёшево, забавно и совсем не сердито.
Итак,
Плюсы плюсы термической обработки титана: дёшево, дешевле только бесплатно.
Минусы: покрытие не держится долго в местах трения (что бы не писали о нём), не позволяет сохранить идеальное зеркало и набор заданных цветов плохо управляем.
Следующий тип придания цвета титановой поверхности — это электрохимическое анодирование.
Поскольку титан в простых домашних условиях почти ни с чем не реагирует, приходится прибегать к помощи электричества. Такая технология предполагает погружение титанового изделия в слабой концентрации электролит, и на изделие при помощи электрического тока перетекают ионы нержавеющей стали. Благодаря этому поверхность приобретает очень красивый равномерный цвет, при этом процесс управляем — определённое напряжение соответствует определённому цвету. Такая технология требует уже больших вложений, так как такие блоки питания стоят дороже, чем газовая горелка из туристического или авто-магазина. Однако у технологии есть и значительные минусы — покрытие неустойчиво к трению, а некоторые цвета нельзя нанести, не испортив полировку.
Итак, плюсы технологии электрохимического анодирования
1. Процесс почти полностью управляем.
2. Позволяет получить практически любой цвет.
3. Некоторые цвета позволяют сохранить идеальную зеркальную поверхность.
Минусы — покрытие ещё более неустойчиво, чем термооксидирование и несколько более дорогостоящее, так как требует покупки качественного блока питания с точной тонкой регулировки ампеража и вольтажа.
Ещё один способ, который набирает обороты и обладает также рядом плюсов — это химическое травление титана.
Да, титан инертен по отношению к агрессивным средам в быту, но использования моногидратов различных кислот в комбинации, при помещении титана в колбу с таким очень агрессивным раствором с последующим подогревом — и титан не выстоит и поверхность не только приобретает другой цвет, но ещё и меняет фактуру. Такая технология требует умелого обращения с сильными реактивами — при неосторожном обращении можно получить ожог или сильное отравление, и тогда больница — друг мастера.
Специфика такой обработки в том, что цвета, полученные таким образом, все находятся в диапазоне серого цвета, однако выраженными фактурными и оттеночными отличиями. По устойчивости такое покрытие лучше, чем термообработка и анодирование. Вот, например на видео ниже представлены заготовки колец из титана марки ВТ1-00 с таким химическим травлением.
Плюсы: поверхность получается фактурной, рельефной.
Минусы: технология опасна для здоровья, требует повышенной внимательности и средств защиты при работе.
Следующий тип покрытий и изменения цвета поверхности, который набирает неспешно обороты — это плазменная обработка.
Плазма — это четвертое состояние вещества, где вещество представлено в виде отрицательно заряженных ионов. Была изобретена в Советском Союзе и с тех пор распространилась по всему миру. Эта технология может обойти химическую инертность титана и нанести практически любое вещество на титановое изделие, при этом не испортив качество. Поверхности, обработанные таким образом, просто восхитительно выглядят — равномерный, устойчивый цвет, можно даже с переливами радуги. А цвет будет уже зависеть от того, плазма какого вещества наносится на титановую подложку. Плазменная обработка даёт самый устойчивый из всех технологий цвет, практически не влияет на саму поверхность и выглядит просто великолепно. Ниже фото кремниевой плазмы, по твёрдости приближающейся к алмазу.
Однако, высокие технологии требуют крайне серьёзного подхода к титановому изделию. Как, к примеру дорогое авто требует дорогого обслуживания и ухода, так и титановое изделие , на которое наносится плазма, должно изготавливаться по особенным требованиям. Первое из них — это чистота поверхности, или степень зеркальности. Чем выше — тем лучше. На родном титановом цвете мельчайшие шероховатости просто незаметны вообще, даже если просто хорошо отполировать, а нанеси ты на такую поверхность плазму (любую) — эти шероховатости начинают мерзко зиять и резать глаз, и в результате изделие такое может претендовать только на роль слесарной запчасти, но никак не ювелирного. Вот как выглядит брак.
Обработка поверхности перед таким занятием особенно трудозатратна, из-за чего стоимость изделий может вырасти порой в разы. Помимо этого, плазменная обработка выполняется на специальных промышленных установках, стоящих как целая квартира, это объясняет сильную ограниченность для мастеров — на такие заводы редко пускают, эти заводы как правило занимаются не ювелиркой и чтобы заинтересовать исполнителя, приходится порой сильно стараться.
Плюсы плазменной обработки — это наилучший внешний вид и исключительная износостойкость поверхности.
Минусы — требуется значительно больше сил на подготовку изделия и — цена.
Специально 92 для mozgochiny.ru
Анодирование титана является чрезвычайно интересным и полезный занятием, которое очень легко выполнить своими руками в домашних условиях. Анодирование используется в промышленности для повышения (коррозионной) стойкости металлов. Кроме того оно также используется в качестве декоративного украшения ювелирных изделий (благодаря широкому спектру получаемых цветов).
Шаг 1: Электролиз
Первый метод анодирования титана построен на принципах электролиза. Кусок титана будет выступать в качестве положительного анода, который следует погрузить в ванну с электролитом. (обычно используется бура или серная кислота).
Шаг 2: Материалы и инструменты
- Алюминиевая фольга;
- Достаточно большой пластиковый контейнер (чтобы вместить в себя кусок анодируемого металла);
- От 1 до 8 9В батарей;
- 1,5 м изолированного провода;
- Тетраборат натрия (Бура);
- Горячая вода;
- Ложка;
- Резиновые перчатки;
- Ацетон или спирт;
- Пластиковый стаканчик.
Инструменты (по желанию):
- Клещи;
- Устройство для зачистки проводов.
Шаг 3: Подготавливаем электролит
Возьмём буру и горячую воду,, смешаем всё в чашке. Размешиваем раствор пока вся бура не растворится.
Возьмём алюминиевую фольгу и полностью покроем ею пластиковый контейнер. Лишнюю фольгу завернём на верхнем краю контейнера.
Шаг 4: Электропитание
Снимем около сантиметра изоляции с двух концов провода (длиной 60 см). После этого сделаем небольшое отверстие в одном из углов алюминиевой фольги. Протянем в отверстие один из концов провода и скрутим всё вместе.
Зальём заготовленный электролит в контейнер.
Возьмём нужное количество 9 В батарей и подключим их, как показано на рисунке. Затем подключим провод, который крепится к фольге к отрицательной клемме аккумуляторной батареи. Возьмём другой провод и подключим к плюсу батареи (этот провод будет крепиться к куску титана).
Шаг 5:
Разное напряжение будет создавать различные цвета на поверхности титана. Обратите внимание, что вы всегда сможете изменить цвет, увеличив напряжение, но не сможете вернуться к цветам, которые получаются на более низком напряжении. На изображении показан процесс анодирования в серной кислоте, но результаты очень похожи с анодированием бурой. Если вы не уверены в величине напряжении, необходимо произвести серию экспериментов с постепенным увеличением величины напряжения.
Шаг 6: Очистка титана
Наденем резиновые перчатки, чтобы предотвратить появление отпечатков пальцев на поверхности титана после очистки. Затем протрём поверхность спиртом.
Шаг 7:
Возьмём кусок титана и закрепим на нём положительный электрод. Погрузим его в раствор. При этом стоит убедиться, что провод не касается жидкости и титан не дотрагивается до фольги. Это может привести к короткому замыканию (в случае контакта). После того, как будет достигнут желаемый цвет, извлечём титан и высушим его. Вы увидите, что изменение цвета происходит под действием ваших отпечатков пальцев. Это совершенно нормально (оригинальный цвет может быть восстановлен с помощью ацетона или спирта).
Шаг 8: Тепловой метод
В этом методе используется сильный нагрев, который будет «загущать» оксидный слой на поверхности титана. Настоятельно рекомендую использовать паяльную лампу (хотя можно воспользоваться газовой плитой).
Шаг 9: Материалы/инструменты
- Источник тепла;
- Щипцы или плоскогубцы (перед использованием убедитесь, что ручки имеют надежную теплоизоляцию);
- Спирт или ацетон;
- Чашка с очень холодной водой.
Шаг 10:
Очистим поверхность титана.
Шаг 11:
Возьмём щипцами/плоскогубцами очищенный титан. После чего включим плиту/паяльную лампу и поднесём кусок титана близко к пламени. Вы заметите, что цвет поменялся на желтый примерно после 30 секунд. Нагревая титан более длительный период времени, вы сможете добиться красного, синего и немного зеленого цвета.
Шаг 12:
После достижения желаемого цвет выключим источник тепла и погрузим металл в холодную воду.
Шаг 13: Поиск и устранение неисправностей
Анодирование титана может не происходить по следующим причинам:
- Провод, который закреплен на куске титана погружен в электролит.
- Провод, который закреплен на металле не подключен к положительному полюсу батареи.
- Батареи разряжены.

( Специально для МозгоЧинов #How-to-EASILY-Anodize-Titanium-at-Home-2-Methods» target=»_blank»>)
Stasbiker 06.05.2014 — 22:11
Друзья извините, или я такой тугой или что то еще, но вроде обшарил все и не нашел разумного пояснения как получить цвет на титановых плашках нагреванием . Т.е. Везде есть информация о том что есть анодирование с помощью тока и температуры. Про ток написано много всего — но для меня это сложно, я не электрик… Пробовал вникнуть и понял что нужно собрать источник правильный с возможностью изменений параметров + высокая опасность есть при работе!
И точно понял что кто то закидывал плашки в духовку и получал цвет — но этот процесс вообще нераскрыт.
1. Как подготовить титановые плашки — зачистка, обезжиривание, полировка или можно грубо после 300 — 400 грит?
2. Можно ли класть их в духовку вместе с другими металлами — если например на плашке прикручены детали из простой стали, винты которые не хотелось бы снимать?
3. Можно ли в простую кухонную духовку или нет?
4. На какую температуру и какое время?
5. Можно ли в процессе доставать что бы смотреть результат или нежелатель?
—
Заранее спасибо, если тема уже обсуждалась в таком контексте — прошу ткнуть носом и не злиться, спасибо 😊
Scunc 06.05.2014 — 22:19
Я горелкой газовой грел и появлялись цвета,поэтому лучше на ненужном куске попробовать сначала.
Scunc 06.05.2014 — 22:20
можно и грубо,но видно хуже,на полировке видно лучше.
циклодол 06.05.2014 — 22:30
оксидировал мелочевку…
Как подготовить титановые плашки — зачистка, обезжиривание, полировка или можно грубо после 300 — 400 грит?
какой финиш сделаете, такой и будет под оксидной плёнкой… желательно обезжирить
Можно ли в простую кухонную духовку или нет?
думаю простой духовкой не отделаетесь
На какую температуру и какое время
скорее по цвету… в моём случае разогревал до цвета очень спелой вишни. вообще рекомендую изначально «потренироваться на кошках». так сказать поймать желаемый цвет.
нежелатель
крайне нежелательно
Халит 06.05.2014 — 22:35
ТС, а зачем так много вопросов? что мешает просто взять и попробовать самому, разве это не интересно?
циклодол 06.05.2014 — 22:38
что мешает просто взять и попробовать самому, разве это не интересно?
кстати Владимир прав… очень забавная штука
Юстус 06.05.2014 — 22:58
Суй смело в духовку — волков бояться шампанское не пить но не больше 400 в процессе можно вынимать — цвет понравился сунь в воду
Не полированные поверхности- первые цвета будут грязными
Первый цвет золотистый второй бронза третий фиолетовый четвертый голубой пятый светло голубой почти белый далее будут совсем интересные но печка не нагреет
Stasbiker 06.05.2014 — 22:59
scunc
спасибо большое
циклодол
огромное спасибо за советы
Халит
уважаемый спасибо что помогаете во всех темах, попробовать интересно конечно — просто хотел с помощью советом решить как правильно пробовать 😛 пойду возьму у друга простую газовую горелку до 1300 градусов, думаю хватит 😛
Stasbiker 06.05.2014 — 23:00
Юстус
Огромное спасибо — попробую с горелкой!!!
Pass Alik 06.05.2014 — 23:19
Может видео поможет легче понять процесс …
И вот
есть ещё видео ,но они в том же духе . В духовке не пробовал , на матовой -цвет матовый , на полированной поверхности -цвет переливается .Термический способ более стойкий цвет даёт ,но цвета «ловить»сложнее . Не обезжириваю ,нет смысла ,просто мою перед нагревом . в процессе латунной щеткой снимаю сходящие цвета ,без фанатизма , промываю и дальше ,но это если надо несколько цветов … Можно китайскими мелкими газовыми балончиками делать ,1300 там не нужно (вот сколько надо не скажу ) ,но балончикового газа хватает ,правда у меня бензиновая горелка и в конце бывает на пару секунд ставлю под электричество ,чтобы «цвета оживить» .
Юстус 06.05.2014 — 23:28
Горелка классно но можно получить пятнистость — по мне так горелка лучше
Главное не забудь обезжирить хорошенько и пальцами тогда не хапай и лучше высушить после обезжиривония
Юстус 06.05.2014 — 23:48
jericho 07.05.2014 — 20:20
Я на кошках пробовал как-то давно — интересно было, заготовочка даже не была подготовлена. нагрел горелкой. результат есть. что и требовалось доказать))
ladikanton 07.05.2014 — 21:01
Stasbiker
но для меня это сложно, я не электрик…
Я тоже не электрик, но приспособу собрал по схеме предложенной камрадами. По мне проще током анодировать, процесс легче контролировать, равномерный цвет выходит. Опасности не намного больше чем с обычным электроприбором, осторожность конечно нужна.
мучачо 08.05.2014 — 18:58
А насколько прочное получается покрытие ? Наверно при ношении в кармане ( чехле, кобуре, ножнах ) будет постепенно стираться разноцветье по поверхности ?
Stasbiker 10.05.2014 — 09:51
Уже 40 минут держу плашку в духовке при температуре 250 градусов — пока тишина и покой 😊
2SAV 10.05.2014 — 10:14
Кетчупом, майонезом хорошо намазали? 😊
Держите далее, ничего не произойдет при такой температуре.
Научитесь внимательно читать/изучать то, что Вам пишут другие.
Удачи.
циклодол 10.05.2014 — 10:39
Держите далее, ничего не произойдет при такой температуре.
+
TEA737 10.05.2014 — 11:56
мучачо
А насколько прочное получается покрытие ? Наверно при ношении в кармане ( чехле, кобуре, ножнах ) будет постепенно стираться разноцветье по поверхности ?
При определенных условиях оно настолько прочное, что даже шкуркой «содрать» проблематично. Как раз сейчас заканчиваю такой нож. В некоторых местах так и не смог удалить следы оксидирования — только заполировал. 😊
ladikanton 10.05.2014 — 18:07
Чем ровнее(полировка) поверхность тем ярче цвет, но тем менее устойчиво покрытие. При шероховатой поверхности( пескоструй, галтовка) не так ярко, но достаточно устойчиво. Это я про анодирование, оксидирование думаю что аналогично.
Юстус 10.05.2014 — 23:41
Оксидирование в отличии от анодирования довольно стойкое покрытие- я не добившись нужного цвета, долго вычищаю всю поверхность, особенно там где пытаюсь титан подкалить , а анодирование стирается очень легко — но его и легко восстанавливать, поэтому мой совет оксидировать только торцы или внутренние поверхности ножа, если это складник или рельеф
Stasbiker 11.05.2014 — 11:04
Stasbiker 11.05.2014 — 20:28
Огромное спасибо!
Юстус
ladikanton
Scunc
циклодол
Халит
Pass Alik
2SAV
jericho
TEA737
Pass Alik 11.05.2014 — 20:45
По мне так -на здоровье и будущие успехи , но почему вторая плашка «голая » или это на будущее оставили ? Фото под углом плохо передают всю картину вашей работы .
TEA737 11.05.2014 — 20:57
Удачи! Хорошо получилось в итоге.
Stasbiker 11.05.2014 — 22:44
Pass Alik
вторую плашку специально оставил голой — так я вижу 😊))))
TEA737
спасибо огромное
Фазлутдинов К.К
25.08.2022 (обновленно 25.08.2022)
3551 просмотров
Механизм и технологический процесс анодирования титана
1. Общие сведения о титане и его сплавах.
1.1 Свойства титана и его сплавов.
Титан – современный легкий, прочный и коррозионно-стойкий конструкционный материал. Относится к переходным металлам. Он устойчив во многих средах, при комнатной температуре, на воздухе — до 550 °C. Стойкость титана обусловлена присутствием на поверхности тонкой, но плотной оксидной пленки. Толщина ее достигает 5-20 нм, что чуть больше, чем на алюминии, но на титане она гораздо прочнее. Естественная пленка на титане преимущественно состоит из рутила и анатаза. При температуре выше 600 °C титан активно реагирует с кислородом с образованием чистого рутила.
Титан имеет две аллотропные модификации:
- низкотемпературную α-модификацию (α-Ti) с гексагональной элементарной ячейкой (а = 0.295 нм, с = 0.468 нм, с/а = 1.587).
- высокотемпературную β-модификацию (β-Ti) с объемоцентрированной кубической ячейкой (а = 0.332 нм), стабильную от 882 °C до температуры плавления 1672 °C.
На механические свойства титана влияет наличие таких примесей как O, N и C, которые повышают прочность при значительном снижении пластичности и коррозионной стойкости. Несмотря на высокую температуру плавления титан не является жаростойким, так как при повышении температуры до 250 °C сопротивление на разрыв уменьшается почти вдвое, при температуре выше 500 °C увеличивается в 1.5-2 раза скорость окисления, а при 500-700 °C начинается поглощение азота, угарного и углекислого газа. При низких температурах 50-70 °C титан адсорбирует водород, что свидетельствует о склонности к водородному охрупчиванию.
Недостатками чистого Ti также являются низкий модуль упругости, склонность к ползучести уже при комнатной температуре, плохая обрабатываемость резанием. Функциональность Ti можно повысить легированием или с помощью термической обработки.
Достоинством титановых сплавов по сравнению с чистым титаном являются более высокие прочность и жаропрочность при достаточно хорошей пластичности, высокой коррозионной стойкости и малой плотности. В зависимости от влияния на температуру перехода α-Ti в β-Ti, легирующие титан элементы делятся на нейтральные (Sn и Zr), α- и β-стабилизаторы. α-стабилизаторы увеличивают температуру перехода, в то время как при β-стабилизации происходит ее уменьшение. Среди α-стабилизаторов самым распространенным является алюминий, поскольку он повышает удельную прочность сплавов при сохранении пластичности, приводит к увеличению модуля упругости, а также уменьшает плотность и склонность к водородной хрупкости, что является основным недостатоком титановых сплавов. Кислород, азот и углерод также принадлежат к данной категории.
Самой распространенной классификацией титановых сплавов является классификация по фазовому составу. Согласно ей выделяют: α-сплавы, псевдо α-сплавы (α-фаза + β-фаза до 5% или интерметаллиды), (α+β)-сплавы, псевдо β-сплавы (структура представляет собой в основном β-фазу, а после термической обработки — α-фаза + β-фаза в небольшом количестве), β-сплавы. Необходимо добавить также сплавы на основе интерметаллидов, например, Ti3Al, TiAl, Ti3Al, обладающих повышенной химической стойкостью, твердостью, жаропрочностью.
| Марка сплава | Содержание металлов в сплаве, % | |||||||||
| Титан, Ti | Алюминий, A | Марганец, Mn | Вольфрам, W | Молибден, Mo | Ниобий, Nb | Ванадий, Va | Цирконий, Zn | Хром, Cr | Олово, Sn | |
| ВТ 1-00 | 99,05 | |||||||||
| ВТ 1-0 | 98,28 | |||||||||
| ОТ 4-0 | 96,018 | 1,4 | 1,3 | |||||||
| ОТ 4-1 | 94,168 | 2,6 | 2 | |||||||
| ОТ 4 | 91,668 | 6 | 2 | |||||||
| ВТ 6 | 86,585 | 6,8 | 5,3 | |||||||
| ВТ 5-1 | 88,665 | 6 | ||||||||
| ВТ 5 | 90,416 | 6,2 | ||||||||
| ВТ 6С | 87,716 | 6,5 | 4,5 | |||||||
| ВТ 3-1 | 85,785 | 7 | 3 | 2 | ||||||
| ВТ 8 | 87,385 | 7 | 3,8 | |||||||
| ВТ 9 | 85,986 | 7 | 3,8 | 2 | ||||||
| ВТ 14 | 86,685 | 6,3 | 3,8 | 1,9 | ||||||
| ВТ 15 | 74,368 | 3,6 | 8 | 11,5 | ||||||
| ВТ 16 | 84,385 | 3,8 | 5,5 | 5 | ||||||
| ВТ 18 | 84,465 | 8,2 | 1 | 1,5 | 1,8 | |||||
| ВТ 20 | 84,985 | 7 | 2 | 2,5 | 2,5 | |||||
| ВТ 22 | 79,206 | 5,7 | 5,5 | 5,5 | 1,5 | |||||
| ВТ 25 | 82,595 | 7,2 | 0,5-1,5 | 2,5 | 2,5 | 2 | ||||
| ВТ 18у | 81,665 | 7,3 | 1 | 1,5 | 4,5 | |||||
| ПТ 3В | 91,232 | 6 | 2,5 | |||||||
| ПТ 7М | 93,534 | 2,5 | 3 | |||||||
| 19 | 86,414 | 6,5 | 4 | 2,5 | ||||||
| 14 | 87,734 | 5,6 | 3,5 | 2,5 | ||||||
| 28 | 94,944 | 2,5 | 2 | |||||||
| 40 | 94,374 | 3,6 | 1,6 | |||||||
| 3М | 94,334 | 6 | ||||||||
| 17 | 84,164 | 6,5 | 2,2 | 6,5 |
1.2 Области применения титана и его сплавов.
- Сплавы титана используются в ракетно-космической и авиационной технике, в судостроении и транспортном машиностроении. Прежде всего — по причине их жаропрочности (не путать с жаростойкостью), т.е. высокой механической прочности при повышенных температурах, и превосходной устойчивости к коррозии.
- Благодаря пластичности и вязкости при низких температурах титановые сплавы начинают применяться в холодильной и криогенной технике.
- Титан используется в медицине благодаря высокой устойчивости в тканях человеческого организма. В частности, легированные сплавы на основе титана с небольшим содержанием алюминия, ниобия или ванадия (Ti6Al7Nb – IMI 367, Великобритания, TC20 – Китай, Ti6Al4V – IMI 318, Великобритания, Ti-64 — США, ВТ6 — Россия) применяются для изготовления имплантов, особенно для замены тазобедренных суставов. Ti6Al7Nb — α+β титановый сплав с хорошей устойчивостью к коррозии, клинически используемый с 1986 г., полученный в качестве замены Ti6Al4V. Как и у всех сплавов титана, его биологическая совместимость главным образом связана с тонким оксидным слоем, который естественным образом покрывает его поверхность. Помимо диоксида титана TiO2 пассивная пленка содержит оксиды легирующих элементов (Al и Nb), в данном случае Al2O3 и Nb2O5. Установлено, что сплав Ti6Al7Nb обладает лучшей биологической совместимостью, чем Ti6Al4V, благодаря формированию на поверхности оксида ниобия Nb2O5, который химически более устойчив и менее подвержен разрушению, а также нетоксичен в отличие от V2O5.
2. Структура анодированного титана.
При взаимодействии титана и кислорода может быть образовано до 15 оксидных соединений с различными свойствами. Наибольший интерес вызывает диоксид титана, а также ряд так называемых фаз Магнели. Для TiO2 имеется три кристаллических модификации: анатаз (а-TiO2), рутил (р-TiO2) и брукит (рисунок 1 а-в), структура которых представляет собой комбинации, составленные из искаженных октаэдров TiO6.
Рисунок 1 — Кристаллические структуры анатаза (а), рутила (б) и брукита (в).
Нагревание TiO2 приводит к уходу кислорода с образованием Ti3O5, а затем Ti2O3 и TiO, которые, как правило, имеют черный (темно-фиолетовый, темно-синий) цвет, а значит, способны поглощать свет и проявлять фотокаталитическую активность в видимой области. Монооксид титана TiO имеет структуру типа NaCl (рисунок 2 а), Ti2O3— кристаллическую решетку типа корунда α-Al2O3 (рисунок 2, б). Брукит редко исследуется, так как трудно синтезируется в лабораторных условиях. При нагревании анатаз необратимо превращается в рутил, температура такого перехода колеблется в интервале Т=673-1473 K в зависимости от условий термического воздействия. Отличия в кристаллической структуре обуславливают разные физические свойства рутила и анатаза, например, величину ширины запрещенной зоны, составляющую Eg = 3.2 эВ для а-TiO2, Eg = 3.0 эВ для р-TiO2, а у аморфного TiO2 – Eg = 3.2-3.5 эВ. В соответствии со значениями Eg, как анатаз, так и рутил относят к широкозонным полупроводникам.
Рисунок 2 — Кристаллические структуры Ti2O3 (а), и TiO (б).
Повысить толщину и плотность естественной оксидной пленки на титане можно путем анодирования (анодного оксидирования). После анодирования можно также добиться повышения микротвердости поверхности титана, износостойкости, жаростойкости, жаропрочности, усталостной прочности и стойкости к схватыванию. После анодирования повышаются антифрикционные свойства поверхности деталей, предотвращается контактная коррозия при соприкосновении титана с алюминием, магнием, кадмиевыми и цинковыми покрытиями. Также анодная плёнка, благодаря пористой структуре, хорошо зарекомендовала себя как подслой для нанесения лакокрасочных материалов, клеев, герметиков, смазок. Высокая коррозионная стойкость в физиологической среде анодированного титана позволяет использовать данный материал для производства имплантов и протезов.
Анодирование титана исследуется достаточно давно. На первом этапе особенное внимание уделялось изучению процесса формирования оксидных пленок барьерного типа в слабых водных растворах H2SO4, Na2SO4, HNO3. Малая толщина (не более 40-50 нм) и неоднородное аморфно-кристаллическое строение барьерных анодных оксидов титана заметно ограничивали их применение, в частности, как диэлектрических слоев.
Начиная с 1999 г. изучается электрохимическое анодирование титана в различных фторсодержащих электролитах с целью создания нанотрубчатых оксидных пленок (НТАОТ). Было предложено несколько групп фторсодержащих электролитов:
- водные растворы плавиковой кислоты;
- водные растворы серной и фосфорной кислот с добавкой фторсодержащих компонентов;
- органические электролиты на основе этиленгликоля, глицерина, их сложных композиций с добавкой плавиковой кислоты или других соединений фтора, чаще всего NH4F.
- водные растворы, в которых присутствуют ионы хлора, а также как водные, так и безводные электролиты с нитратсодержащей добавкой.
На рисунке 3 показана схематичная структура идеального аноднооксидного покрытия на титане. Как и для анодированного алюминия, реальная структура оксида получается искаженной, если процесс проводился не в контролируемых условиях получения идеальных нанотрубок.
Рисунок 3 – Идеальная схема анодно-оксидного покрытия на титане.
Исследования, выполненные методом электронной микроскопии, выявили, что поверхность анодно-оксидного покрытия имеет развитую ячеистую структуру. Покрытие пористое, но поры не достигают поверхности металла. Диаметр пор составляет от 100 до 500 нм. На размер пор влияет способ получения, состав электролита и технологические режимы процесса. Толщина покрытия ограничена ввиду высоких электроизоляционных свойств TiO2 который имеет большее электрическое сопротивление, чем электролит, и препятствуют прохождению тока. В этот момент происходит разогрев в приграничной зоне и начинает преобладать химическая реакция, оксиды растворяются в электролите.
Ниже представлено разнообразие структур анодных оксидов титана, полученных в различных условиях: разные электролиты, разное время проведения процесса, наличие термообработки.
Рисунок 4 — СЭМ-изображения поверхности анодных неструктурированных анодных оксидов на титане, сформированных анодированием в 10% H2SO4+0.15 % HF, Ua=20В, ta=20 мин.
Рисунок 5 — СЭМ-изображения поверхности трубчатого слоя и поперечного сечения НТАОТ, сформированных в водном растворе 0.5% HF при 20В в течение 20 мин.
Рисунок 6 — СЭМ-изображения поверхности пористого (а) и барьерного (в) слоев и поперечного сечения (б) НТАОТ, сформированной в водном растворе 1M (NH4)2SO4+ 0.5% NH4F.
Рисунок 7 — СЭМ-изображения, характеризующие морфологию поверхности барьерного (а), трубчатого (б) слоев, а также поперечное сечение (в) НТАОТ, сформированного в этиленгликоле с добавкой 0.3% NH4F + 2% H2O при 60В в течение 6 ч.
Рисунок 8 — СЭМ-изображения поверхности трубчатого слоя (а) и поперечного слома (б) НТАОТ толщиной 40 мкм, сформированного долговременным анодированием в течение 23 ч в C2H4(OH)2+0.25%NH4F.

Рисунок 9 — СЭМ-изображение поверхности пористого слоя оксидов, полученных двухступенчатым анодированием в C2H4(OH)2+0.25%NH4F и (б) Al в 3% C2H2O4.
Рисунок 10 — СЭМ-изображения поверхности НТАОТ, сформированного одноступенчатым анодированием в C2H4(OH)2+0.25%NH4F, после отжига в атмосфере при 600 °С(а, б), а также после отжига при 1093 K в атмосфере (в) и в вакууме (г).
Рисунок 11 — СЭМ-изображения поверхности и поперечного сечения НТАОТ, сформированных в хлорсодержащих электролитах: (а) 0.5М муравьиная кислота + 0.4M NH4Cl; (б) 0.5М глюконовая кислота + 0.4M NH4Cl.
3. Технология и электролиты для анодирования титана
Процесс анодирования деталей из титановых сплавов заключается в погружении детали в электролит и соединение её с положительным полюсом источника постоянного тока. Минус идет на катоды. Во время прохождения электрического тока через электролит, на аноде в активной форме выделяется кислород, который взаимодействует с титаном образуя анодно-оксидную пленку. Нарастание анодного слоя происходит не на внешней поверхности детали, а под слоем ранее образовавшейся окисной плёнки, то есть на границе титана с анодной плёнкой.
Технологический процесс оксидирования в промышленных условиях обычно состоит из следующих этапов:
- Монтаж обрабатываемых деталей на приспособления для анодирования.
- Химическое обезжиривание деталей (в соответствии с производственной инструкцией).
- Промывка в горячей (40-50 градусов) проточной воде многократным окунанием.
- Промывка в холодной проточной воде многократным окунанием.
- Травление в смеси кислот HNO3 44% и HF 10%.
- Промывка в холодной проточной воде многократным окунанием.
- Непосредственно анодирование.
- Промывка в холодной проточной воде многократным окунанием.
- Сушка.
- Демонтаж изделий с приспособлений для анодирования.
- Контроль результата с помощью осмотра и проверки толщины анодного покрытия (до 5 мкм — оценкой напряжения пробоя, выше — с помощью толщиномера).
4.1 Анодирование титана в сернокислом электролите
Состав электролита:
Кислота серная от 50 до 60 г/л для сплавов ВТ-1, ВТ-3, ВТ-4,ОТ-4, ВТ-5, ОТЧ
Температура электролита от 15 до 25 °С
Может выполняться в двух режимах:
- Анодирование в стационарном режиме в сернокислотной ванне. Обработку проводят при поддерживании постоянной плотности тока 1-1,5 А/дм2 увеличением напряжения от 5 до 25 В. Толщина получаемого покрытия составляет от 6 до 12 мкм.
- Анодирование в импульсном режиме в сернокислотной ванне. Источник постоянного тока выдаёт кратковременные импульсы длиной в 0,1–0,3 сек. с частотой 120 импульсов в минуту, превышающие рабочий ток в 5–8 раз. Для получения плёнки 15-20 мкм необходим источник тока, позволяющий выдавать плотность тока до 50 А/дм2. В конце процесса напряжение возрастает до 250 В. Необходимо охлаждение ванны. В данном процессе происходит послойное уплотнение плёнки, поэтому плёнки обладают малой пористостью. Покрытия, полученные при анодировании титана из сернокислого электролита имеют удельное электрическое сопротивление σ = 3,7·10-8 Ом/см.
4.2 Анодирование в фосфорной кислоте
Состав электролита:
Кислота ортофосфорная 50-100 г/л
Температура электролита 15-25 °С.
Выполняется в фосфорнокислом электролите, при низких плотностях тока от 0,2 до 0,8 А/дм2 и напряжении от 50 до 150 В.
Цветное декоративное анодирование титановых сплавов позволяет получать непосредственно в процессе электролиза, без применения красителей, цветные окисные пленки толщиной до 10 мкм, относящиеся по своей природе к интерференционно – окрашенным.
Цвет пленки зависит от приложенного напряжения на ванне и марки исходного сплава, что продемонстрировано в таблицах 1 и 2.
Декоративное анодирование титановых сплавов позволяет получить коричнево-желтые, синие, голубые, желтые, розовые, малиновые, зеленые цвета и оттенки поверхности.
Таблица 1 — Характеристика анодных пленок, полученных на полированной поверхности титановых сплавов (8% H2C2O4 2H2O, температура комнатная, продолжительность 2 мин)
| Напряжение, В | Группы декоративности титановых сплавов | |||
| 1 | 2 | 3 | 4 | |
|
ВТ20, ВТ6 |
ВТ14, ВТ15, ВТ16, ВТ3-1, 4201 |
ВТ1-0, ВТ5-1 |
ОТ4, ОТ4-1 |
|
| 8 | Светло-коричневый | Светло-коричневый | Светло-коричневый | Светло-коричневый |
| 10 | Коричневый | Коричневый | Коричневый | Коричневый |
| 12 | Темно-коричневый | Темно-коричневый | Темно-коричневый | Темно-коричневый |
| 15 | Лиловый | Лиловый | Лиловый | |
| 20 | Темно-синий | Темно-синий | Темно-синий | |
| 25 | Синий | Синий | Синий | |
| 30 | Голубой | Голубой | Голубой | |
| 35 | Светло-голубой | Светло-голубой | Светло-голубой | |
| 40 | Светло-салатовый | Светло-салатовый | Светло-салатовый | |
| 45 | Светло-желтый | |||
| 50 | Желтый | |||
| 55 | Розовый | |||
| 60 | Светло-малиновый |
Таблица 2 — Характеристика анодных пленок, полученных на шлифованных и отпескоструенной поверхности титановых сплавов
| Напряжение, В | Группы декоративности титановых сплавов | |||
| 1 | 2 | 3 | 4 | |
|
ВТ20, ВТ6 |
ВТ14, ВТ15, ВТ16, ВТ3-1, 4201 |
ВТ1-0, ВТ5-1 |
ОТ4, ОТ4-1 |
|
| 8 | Светло-коричневый | Светло-коричневый | Светло-коричневый | Светло-коричневый |
| 10 | Коричневый | Коричневый | Коричневый | Коричневый |
| 12 | Темно-коричневый | Лиловый | Лиловый | Лиловый |
| 15 | Лиловый | Темно-синий | Синий | Темно-синий |
| 20 | Темно-синий | Синий | Светло-синий | Синий |
| 25 | Синий | Темно-голубой | Голубой | Голубой |
| 30 | Голубой | Голубой | Бледно-желтый | Светло-голубой |
| 35 | Светло-голубой | Светло-голубой | Светло-желтый | |
| 40 | Слабо выраженный светлозеленый | Слабо выраженный светлозеленый | Желтый | |
| 45 | Светло-желтый | Светло-желтый | ||
| 50 | Желтый | Желтый | ||
| 55 | Желто-розовый | Желто-розовый | ||
| 60 | Светло-розовый | Светло-розовый | ||
| 65 | Розовый | Розовый | ||
| 70 | Розово-малиновый | Розово-малиновый | ||
| 75 | Малиново-фиолетовый | Темно-бирюзовый | ||
| 80 | Бирюзовый | Зеленовато-желтый | ||
| 85 | Зеленый | |||
| 87 | Желто-зеленый |
Визуально пример градиента цвета анодированного титана в зависимости от напряжения на ванне показан на рисунке 12.
Рисунок 12 – Градиент цвета покрытия на титане при анодировании в зависимости от напряжения.
Изменение цвета связано с различиями в кристаллической структуре анодного слоя. Толщина анодного слоя влияет на попадающий в слой свет, который преломляется под разными углами, при этом немного изменяется цвет пленки. Это отличает его от анодированного алюминия, в котором используются красители и цвет не зависит от угла обзора.
Цветное анодирование титановых сплавов используется для декоративной отделки и маркировки. Декоративное анодирование увеличивает коррозионную стойкость изделий и обеспечивает высокую светостойкость окрашенной поверхности с сохранением блеска исходной поверхности. Наибольшая цветовая гамма и насыщение тона могут быть получены на сплавах титана ВТ-20 (псевдо-α-сплав) и ВТ-6 (α+βсплав). На α+β-сплавах, содержащих молибден и хром, качество анодных пленок более низкое. На технически чистом титане цветовая гамма ограниченна. Сплавы титана, содержащие марганец (ОТ4, ОТ4-1) не рекомендуются для декоративного анодирования.
4.3 Анодирование в электролите комбинированного состава (импульсное).
Состав электролита:
Серная кислота (плотность 1,84) — 205 мл/л
Ортофосфорная кислота (плотность 1,7) — 15 мл/л,
Температура электролита 5 °С.
Длительность импульса тока — 0,1-0,3 сек., частота импульсов — 60-120 имп/мин, плотность тока в импульсе — 5-10 А/дм2. При этом в зависимости от соотношения длительности импульса и паузы формируются пленки различной толщины и качества. При плотности тока 1-2 А/дм2 толщина покрытия составляет 2-3 мкм, при наличии мощного источника питания можно получить толщину покрытия до 20 мкм. (при плотности тока до 50 А/дм2).
4.4 Анодирование титана в щавелевой кислоте.
Состав электролита:
Кислота щавелевая 50-60 г/л
Температура электролита 15-20 °С.
Плотность тока1-3 А/дм2.
Напряжение 110 В.
Время 30-60 мин.
5. Микродуговое оксидирование титана
МДО титана выполняется в электролите содержащим соли магния, кальция, алюминия.
Сущность процесса МДО на титане заключается в следующем. При наложении положительного потенциала на деталь, на поверхности образуется пленка диоксида титана TiO2. Когда подаваемое напряжение возрастает до некоторого критического значения, возникает пробой диэлектрического слоя TiO2 и образуется микродуга. Микродуговые разряды приводят к сильному разогреву электролита в каналах пор. Электролит разлагается и образуется атомарный кислород, который диффундирует в поверхность металла, вызывая ее окисление и обеспечивая рост пленки, которая на титане может достигать 50 мкм. Напряжение на ванне может доходить до 200 В. Полученное покрытие оказывается пористо. МДО титана, таким образом, происходит последовательным ростом диэлектрической пленки и ее пробоем, новым ростом, пробоем и т.д. На качество покрытия (твердость, пористость, пробивное напряжение) влияет жесткость разряда: время чисто электрохимического и время микродугового воздействия, а также величина тока, влияющая на температуру в разряде.
6. Механизм образования анодноокисного покрытия на титане.
Механизм образования и роста оксидных покрытий определяется химическим составом и кристаллическим строением исходного металла, видом применяемого электролита и технологическим режимом обработки. Важным фактором также является шероховатость исходной поверхности. На шероховатой поверхности можно получать прочные покрытия повышенной толщины с высокими значениями открытой пористости и адгезии, тогда как на гладкой поверхности толстослойное покрытие легко разрушается и отслаивается от основного металла.
6.1 Упрощенный механизм анодирования титана.
Упрощенно при анодировании титана происходит два противоположных процесса:
• электрохимическое образование анодной плёнки:
Ti + O2 = TiO2
• химическое растворение её в электролите:
TiO2 + H2SO4 = TiSO4 + H2O
Толщина плёнки зависит от соотношения скоростей указанных процессов. Скорость образования плёнки при неизменном электрическом режиме остаётся практически постоянной, затем падает из-за увеличения доли тока, приходящейся на выделение кислорода из раствора. Скорость же растворения, наоборот, непрерывно возрастает вследствие постепенного разрыхления плёнки.
Необходимым условием является возникновение пор на наименее устойчивых её участках при совместном действии тока и электролита. Через электролит, находящийся в порах, проходит ток. Объём пор при сернокислом анодировании составляет до 30%
Следует отметить, что сразу после подачи напряжения происходит рост барьерного слоя, (граница металл / анодный слой) создающего значительное сопротивление, что приводит к падению плотности тока впервые секунды анодирования. С увеличением толщины барьерного слоя увеличивается температура электролита в приэлектродном слое, что способствует повышению растворимости анодной пленки. Это приводит к тому, что сформировавшийся барьерный слой начинает несколько растворяться, что сопровождается уменьшением сопротивления и некоторым увеличением плотности тока. Падение тока приводит к частичному растворению оксида с образованием пор, а последующие скачки тока — к увеличению их диаметра. Это может быть связано с интенсификацией процессов разрастания пор в анодном оксиде в условиях достаточно интенсивного локального разогрева. При увеличении температуры при подаче напряжения анодирования происходит электрохимическая деструкция анодной плёнки. Для предотвращения этого необходимо охлаждение ванны.
6.2 Точный механизм анодирования титана в сернокислом электролите.
Анодирование титановых пластинчатых образцов с шероховатой пескоструйно обработанной поверхностью в электролите 200 г/л H2SO4 при сравнительно небольших значениях анодной плотности тока i=5 мА/см2 и продолжительности τ=2-5 мин приводит к тому, что по мере роста покрытия в толщину, при температуре электролитов 25-55°С, происходит сдвиг потенциала анодирования ∆Е в положительную область до величин 18-26 В (рисунок 13). При дальнейшем увеличении продолжительности обработки потенциалы анодирования стабилизируются при всех выбранных значениях температуры электролитов.
Рисунок 13 — Температурно-кинетические зависимости потенциалов анодирования титана: 1 — 25°С; 2 — 35 °С; 3 — 45 °С; 4 — 55 °С
В первом приближении установившиеся потенциалы анодирования Е∞ линейно уменьшаются при увеличении температуры электролитов с температурным коэффициентом ∂Е∞/∂Т = -0,27 В/К (рисунок 14). Время установления τ∞ этих стационарных потенциалов, напротив, увеличивается с повышением температуры электролитов и возрастает с температурным коэффициентом ∂τ∞/∂Т = 0,07 мин/К (рисунок 15).
Рисунок 14 — Температурная зависимость установившегося потенциала анодирования титана (удалить 1 с графика).
Рисунок 15 — Температурная зависимость времени установления стационарного потенциала анодирования(тоже удалить 1).
Отсюда следует, что анодирование пескоструйно обработанного титана в сернокислом электролите сопровождается существенным сдвигом значений потенциала анодирования ∆Е в положительную область.
Для расчета температурной зависимости скорости формирования j∞ оксидного покрытия в момент стабилизации потенциала анодирования Е∞ можно применить закон Фарадея в виде (перепечатать все формулы):
j∞=3MTiO2i ⁄ 4CTiO2F
Где:
η — выход по току,
MTiO2 и CTiO2— молекулярная масса и плотность диоксида TiO2,
F = 96500 Кл/моль.
Коэффициент z = 4 в знаменателе отвечает реакции анодного окисления титана:
Ti + 2H2O ⇔ TiO2 + 4H++ 4ē
с равновесным потенциалом E0p= -1,16 В по н.х.с.э., намного более отрицательным, чем установившиеся потенциалы анодирования Е∞ = 17-26 В по н.х.с.э., что указывает на высокую вероятность протекания реакции образования диоксида TiО2.
При значениях выхода по току η=1, молекулярной массе диоксида MTiO2 = 80 г/моль и его плотности CTiO2= 4,1 г/см2 расчет дает результаты, из которых следует, что переходные скорости формирования покрытия не зависят от температуры электролита и составляют j∞ = 2,5 нм/с (рисунок 16, кривая 1).
Рисунок 16 — Температурные зависимости переходной скорости роста j∞ покрытия (1), переходного количества электричества iτ∞ (2) и переходной напряженности электрического поля U∞ (3), полученные анодированием титана.
Полученный результат объясняется температурной компенсацией переходного количества электричества iτ∞ (рисунок 16, кривая 2) и падением напряженности поля U∞ в оксидном покрытии (рисунок 16, кривая 3).
Представленные данные позволяют определить окончание продолжительности анодирования титана, необходимой для получения оксидного покрытия с заданной толщиной, например, hTiO2 = 10-15 мкм. Расчеты показывают, что эта продолжительность составляет порядка hTiO2 / j∞= 67-70 мин при i = 5 мА/см2, η = 1 и практически не зависит от температуры электролита. Но учитывая, что в реальных условиях электролиза имеет место анодное растворение титана, протекающее при равновесном потенциале, равном E0p = — 1,14 В (н.х.с.э) по реакции:
Ti ⇔ Ti 4+ + 4ē
то часть количества электричества, пропускаемого через анод, расходуется на его растворение и значение выхода по току η при этом заметно уменьшается, за счет чего существенно возрастает продолжительность анодирования. Таким образом, основное влияние на рост толщины покрытия оказывает величина анодной плотности тока.
Для определения времени окончания анодирования можно использовать профилометрические данные по относительной шероховатости пескоструйно обработанных и анодированных поверхностей титана Өпо и Өа. Учитывая, что конкуренция между реакциями анодного оксидирования и растворения приводит к известному из практики анодной электрополировки титана эффекту сглаживания микронеровностей поверхности, то выход по току η можно оценить по соотношению:
η = Өа / Өпо
где относительная шероховатость поверхности Ө рассчитывается по формуле:
Ө = (2ξRa + (1-ξ)Rmax)/Sm
где:
ξ — – статистическая доля частиц абразива меньшего радиуса (при пескоструйной обработке) и Sm – средний шаг местных выступов профиля, мкм.
Соответствующее определение значений относительной шероховатости Ө и выхода по току η показало, что реакция анодного растворения титана действительно конкурирует с реакцией анодного оксидирования и потребляет примерно половину количества электричества, пропущенного через анод при среднем значении выхода по току, равном η = 0,47:
| Вид обработки поверхности | Пескоструйная | Анодирование в электролите №1 | Анодирование в электролите №1 |
| Ө | 0,47 | 0,23 | 0,21 |
| η | — | 0,49 | 0,45 |
При небольших значениях анодной плотности тока это приводит к более чем двукратному возрастанию времени окончания электролиза до величины порядка 2 ч.
Действительно, оптико-микроскопическое измерение толщины покрытий на поперечных микрошлифах анодированных образцов, показало достижение ее значений до существенных величин, составляющих 20-30 мкм за продолжительность обработки τ = 4-6 ч при плотности тока 5-10 мА/см2. С возрастанием плотности тока до 50 мА/см2 толщина покрытий достигала 10 мкм при анодировании титана за продолжительность обработки 0,3 ч.
Для дальнейшего исследования механизма и кинетики сернокислотного анодирования титана следует рассмотреть вольтамперные характеристики (ВАХ) его анодного поведения при продолжительности обработки τ = 5 мин, гарантирующей стационарность потенциалов анодирования Е∞ (рисунок 17).
Рисунок 17 — Вольтамперные характеристики анодного поведения пескоструйно обработанного титана при t=55 °С
Полученные данные согласуются с моделью омического контроля анодных реакций и твердофазной миграцией катионов Ti4+ через оксидный слой в условиях относительно малой напряженности электрического поля в нем, составляющей U∞ = (2,3-8)·105 В/см (рисунок16, кривая 3).
Совокупность полученных экспериментальных результатов интерпретируется с помощью изложенных ниже представлений о механизме и кинетике анодного оксидирования титана.
Известно, что переходные многовалентные металлы, в частности титан, при анодном растворении не отдают все свои валентные электроны в одном элементарном акте. Поэтому, для титана можно предложить следующую четырехстадийную схему анодного растворения:
Ti ⇔ Ti + + ē , (1)
Ti+ ⇔ Ti 2+ + ē , (2)
Ti2+ ⇔ Ti 3+ + ē , (3)
Ti3+ ⇔ Ti 4+ + ē . (4)
Такая схема реакций характеризуется отрицательными (по н.в.э) значениями равновесных электродных потенциалов, равными E0p= -1,75 В – для реакции (2), E0p = -0,37 В – для реакции (3) и E0p= -0,04 В – для реакции (4). Реакции анодного растворения титана (1)-(4) вероятнее всего протекают с участием компонентов электролита анодирования. Для сернокислых растворов такими электроактивными компонентами являются анионы HSO—4 , катионы Н+ (Н3О+) и молекулы воды. В связи с этим схема реакций растворения титана (1)-(4) может быть модифицирована с учетом участия в них компонентов сернокислого электролита анодирования следующим образом:
Ti + H2O⇔ TiOH + H++ ē, (5)
TiOH + HSO4—⇔ TiSO4 + H2O + ē, (6)
TiSO4 + H2O⇔ TiOHSO4 + H++ ē, (7)
TiOHSO4 + 2H+⇔ Ti 4+ HSO4— +H2O + ē . (8)
Анализ электрохимических реакций (5)-(8) показывает, что компоненты сернокислого электролита выступают в качестве катализаторов реакций (1)-(4) и ускоряют их, не сдвигая электродные равновесия в системе. Поэтому, на основании приведенных выше значений стандартных электродных потенциалов можно заключить, что наиболее быстрой реакцией будет являться реакция образования TiОН (5). Поскольку сернокислые электролиты анодирования имеют большую концентрацию катионов водорода Н+, то на границе титана с электролитом наиболее высока активность адсорбированных катионов одновалентного титана Ti+, образующихся по химической реакции:
TiOH + H+⇔ Ti+ + H2O,
В параллельном анодном процессе протекает реакция окисления OH— до пероксидного аниона:
3OH—⇔ HO2— + H2O + 2ē,
характеризуемая стандартным равновесным электродным потенциалом, равным E0p = 0,88 В по н.в.э. Далее образуется анион кислорода O2— по реакции:
HO2— + OH—⇔ O2—+ H2O + ē,
Основная реакция анодного оксидирования титана реализуется в виде химического окисления одновалентного катиона титана Ti+ анионом кислорода O2—:
Ti+ + O2—⇔ TiO2, (9)
По мере роста титанооксидного покрытия в толщину описанные выше процессы анодного растворения и оксидирования переходят с поверхности титана в объем покрытия и начинают контролироваться твердофазной ионной миграцией катионов титана и анионов кислорода, для выражения которой можно записать соответствующие уравнения Нернста-Планка:

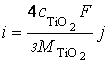
Где:
х – нормальная координата, отсчитываемая от поверхности оксидного покрытия,
Y+ и Y–, σ+ и σ–, μ+ и μ– – потоки катионов титана и анионов кислорода, катионные и анионные удельные электропроводности оксидного покрытия, химические потенциалы катионов титана и анионов кислорода в соединении TiO2, соответственно,
φ – потенциал внутрипленочного электрического поля
F = 96487 Кл/моль – постоянная Фарадея.
С учетом условия электронейтральности оксидного покрытия в виде равенства:
Y+ — Y–=0 (12)
из формул (10), (11) можно исключить градиент внутрипленочного электрического потенциала φ:
получив в результате уравнение для потока миграции анионов кислорода O2—:
Если принять, что удельная электропроводность катионов титана в оксидном покрытии намного больше удельной электропроводности анионов кислорода σ+>>σ–, то предыдущее выражение легко упрощается:
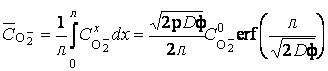
Интегрируя уравнение (13) по х, получаем:
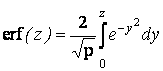
где M—0– химический потенциал анионов O2—на поверхности оксидного покрытия и M—x– химический потенциал анионов O2—на глубине покрытия х.
При небольшой концентрации анионов O2— удельная электропроводность покрытия σ– связана с коэффициентом его твердофазной диффузии D и описывается законом Нернста-Эйнштейна:
где CO—2 — концентрация анионов O2—, R = 8,314 Дж/(моль·К) и Т – абсолютная температура анодирования.
Поэтому уравнение (14) можно выразить в виде:
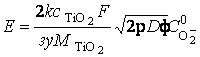
С другой стороны поток миграции анионов кислорода можно определить и через скорость движения фронта миграции анионов O2—:
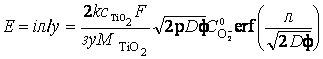
где τ – продолжительность анодирования.
Примем параболический закон движения фронта миграции анионов O2— в виде:
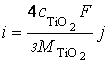
где k– константа скорости роста толщины покрытия.
Тогда, после приравнивания уравнений (15) и (16) с учетом (17), получаем выражение для константы скорости роста покрытия:
При небольшой концентрации анионов кислорода CO—2 величина коэффициента твердофазной диффузии D покрытия не зависит от его концентрации и химического потенциала. Поэтому, с учетом того, что активность анионов O2— в титанооксидном слое совпадает с их малой концентрацией CO—2 из предыдущего уравнения можно записать:

где: C0O—2 и CxO—2 – твердофазные концентрации анионов O2— на поверхности оксидного покрытия и в его глубине х.
Поскольку на основании выражения (17) константа скорости роста покрытия прямопропорциональна квадрату его глубины и обратнопропорциональна продолжительности анодирования k = x2/2τ, то после потенциирования уравнения (18) получаем формулу для определения твердофазной концентрации анионов O2— на глубине покрытия х:
Таким образом, концентрация анионов кислорода уменьшается с квадратом глубины их проникновения х2 и увеличивается с повышением продолжительности анодирования τ по экспоненциальному закону. Кроме этого, она сильно возрастает с увеличением температуры анодирования t и коэффициента твердофазной диффузии D, нарастающим со степенью структурной дефектности формирующегося оксидного покрытия.
Для дальнейшего исследования кинетики анодирования титана целесообразно задаться некоторой эффективной глубиной λ миграции анионов O2— и определить их среднюю концентрацию CO—2 по этой глубине:
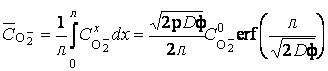
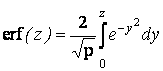
Можно принять, что в пределах 0 ≤ х ≤ λ скорость линейного роста оксидного покрытия в толщину j пропорциональна средней концентрации анионов кислорода CO—2
j=kCO2
что соответствует протеканию реакции (14) по закономерностям кинетики реакций первого порядка при избытке твердофазной концентрации катионов титана.
Тогда на основании линейности вольтамперной характеристики сернокислотного анодирования титана, обусловленной омическим контролем, можно записать выражение для потенциала анодирования Е:
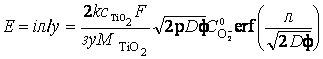
где:
i – анодная плотность тока, σ – суммарная ионная и электронная проводимость покрытия из диоксида TiO2,
CTiO2 и MTiO2 – плотность и молекулярная масса покрытия, η ≤ 1 – выход по току.
Принято, что основное падение величины потенциала происходит в пределах эффективной глубины проникновения λ анионов кислорода.
Величина анодной плотности тока i рассчитывается по закону Фарадея:
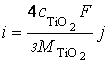
Анализ полученного кинетического уравнения представляет интерес для анодирования титана при малых и больших значениях продолжительности, поскольку функция ошибок
при z→0 и erf (z) = 1 при z ≥2
При небольшой продолжительности анодирования τ = τ0 ≤ λ2/8D из выражения (19) получается параболический закон роста потенциала Ес√Φ :
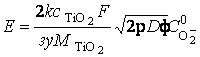
соответствующий нарастающим участкам экспериментальных кривых Е – τ (рисунок 13) и эффективной глубине проникновения λ анионов кислорода по всей малой толщине оксидного покрытия.
При больших значениях продолжительности электролиза τ = τ∞>>λ2/2D и повышенной толщине покрытия происходит установление потенциала анодирования Е∞ до стационарных величин и он перестает зависеть от τ ≥ τ∞. Поэтому из уравнения (19) выражаем стационарный потенциал Е∞, который также соответствует экспериментальным данным и эффективной глубине проникновения λ анионов кислорода лишь в небольшую приповерхностную область растущего анодно-оксидного покрытия (рисунок 13).
Линейное уменьшение стационарного потенциала Е∞ с температурой анодирования титана объясняется ростом ионной компоненты удельной электропроводности оксидного покрытия σ, входящей в знаменатель уравнения (22) (рисунок 14). Увеличение продолжительности обработки и температуры электролита отвечает снижению потенциала анодирования Е на начальных стадиях процесса (рисунок 13) и повышению времени его установления τ∞ до стационарных значений (рисунок 15), что также связано с температурным увеличением электропроводности покрытия σ по соотношению (21).
Температурная независимость линейной скорости роста j титанооксидного покрытия в толщину определяется постоянством значения выхода по току η согласно закону Фарадея (20) (рисунок 16).
Конец статьи
Понравилась статья?
Оцените статью. Всего 1 клик!
Средняя оценка:
4,43
Всего оценок:
7
Данная статья является интеллектуальной собственностью ООО «НПП Электрохимия». Любое копирование информации возможно только с разрешения владельца сайта. Размещение активной индексируемой ссылки на https://zctc.ru обязательно.
Доброго всем времени суток! Давеча, в топике уважаемого AleksSi пообещал я найти титан и отфотографировать процесс его анодирования в разные цвета, так как народу интересно, а я -электрохимик дома и химик на работе 
Почему «блиц»? Потому, что цель мастер-класса показать основы этого процесса. Я сам делаю это впервые, возможны неточности с моей стороны, дополняйте! Само-собой есть множество тонкостей: марка сплава, электролит, площадь покрытия, сила тока. Сегодня я рассмотрю процесс кустарно, на примере обработке малых площадей «рисованием».
Анодирование — электрохимическое нанесение тонких оксидных пленок. У титана эти пленки окрашены за счет интерференции света. Подробнее все описано в Википедии и т.д., не буду тратить место. Цвета зависят от вольтажа, в интернете есть примерные схемы расцветок. У меня идет смещенение на 10 Вольт от большинства. Во многом цвет зависит от электролита и площади поверхности. В будущем, надеюсь, я покажу Вам анодирование погружением. Сразу прошу прощения за несколько блеклые фотки процесса, темновато. В конце есть фотки на ярком дневном свету.
Писал текст за раз, простите за возможные ошибки!
Итак. Для работы понадобится титан. Я заказал у ребят с Ганзы пару листов сплава OT4-0 и ВТ1-0. Сожержание титана в ОТ4 — 95,938 — 99,6%, в ВТ1-0 — 98,61 — 99,7%.
При подготовке мастер-класса я находил информацию, что цвета анодирования варьируются от марки — на чистом титане они более блеклые. Честно говоря-большой разницы не заметил. Буду рисовать на OT4-0, он почище внешне, другой лист погрязнее и царапанее.
Также вычитал, что на матовой поверхности цвета выглядят более сочно, что подтвердилось. Для матирования использовал щетку-матовку для дремеля.
Перед анодированием тщательно протер поверхность ацетоном, иначе будет видно ваши пальчики.
Блок питания.
Цвет покрытия меняется в основном с шагом в 10 Вольт, я использовал БП постоянного тока на работе, чтобы охватить наиболее доступную мне гамму цветов. Блок старенький, старше меня, но зато честно дает 99,9 Вольт (да и стоят сейчас такие немало).
Цвета кладутся «поверх», нельзя изменить «70 Вольтовый цвет» на «20 Вольтовый», наоборот- пожалуйста.
Внимание, помните, что переменный ток (а покрытие возможно и с его помощью)опасен для здоровья!
Сила тока.
Опыт показал, что от нее зависит скорость достижения цвета. Я поставил 500 мА, результат за секунду. Этот параметр больше интересен для работы на больших поверхностях, для создания цветовых растяжек, например.
Электролит и электрод.
При подготовке я пробовал три электролита: соляную кислоту 10%, NaCl насыщенный р-р, H2SO4 10%. Мог бы и больше, но это потом 
Следует помнить, что «слабый» раствор серной кислоты, попавший на ваши штаны, будет слабым очень короткое время, до испарения воды :). Потом будут кружевные штанишки!
Электрод я использовал медный (заклепка из СССР), на него намотал ватку, будем рисовать! Край пластины разметил. Для погружного окрашивания можно выстелить дно тары алюминиевой фольгой, но об этом в другой раз.
Начнемс, цепляем плюс к титану, минус к электроду!
10 Вольт
Цвет желто-коричневый. Грязный, блеклый. Скучно.
20 Вольт
Грязно-фиолетовый цвет, не блестит. Тоже скучно.
30 Вольт.
Это потолок многих блоков питания, но цвет очень красивый. Насыщенно-синий, блестит. С ним можно работать! Случайно задел соседние капли, и окрасил их.
40 Вольт
Светло-голубой цвет. Красивый, но не очень сочный что-ли. Идем дальше.
50 вольт.
Светло-желтый цвет. Довольно невнятный, переходный.
60 Вольт. Уже начинается дискотека при анодировании. Искорки, дымок, ползут цвета.
Цвет получается переходный от золотого к красно-рыжеватому.
Тут можно шагнуть на 55 Вольт. Получается вполне сносный сочный золотисто-желтый цвет. В других случаях +- 5 Вольт не помогает.
70 Вольт. Тут очень красивый розово-фиолетовый цвет. Но уже стоит сделать поменьше силу тока, иначе жидкость на ватке подкипает и цвета ползут. Я вот не сделал, оттого и такие растяжки.
Дальше 80,90,99 Вольт. Дискотека. Цвета ползут, оттенки от розового через голубой к голубовато-зеленому. Еще стоит подобрать режимы.
Теперь давайте я покажу получившуюся палитру при дневном свете у окна.
При большем контактном пятне (налили электролита) можно получать растяжки:
Это, кстати, ВТ1-0.
Наверное, на сегодняшний день хватит. Это была вводная, кустарная часть. Дальше надеюсь опробовать другие способы!
Спасибо!
Только зарегистрированные и авторизованные пользователи могут оставлять комментарии.
Introduction: How to EASILY Anodize Titanium at Home (2 Methods)
Titanium anodizing is an extremely cool and rewarding project that is very easy to do at home. Anodizing is used industrially for enhanced corrosion resistance on metals like aluminum. Anodizing is also used as a decorative process for titanium jewelry as a wide range of colors can be achieved.
If you liked this instructable please vote for me. I would really appreciate it 
Step 1: Learning the Science Behind Anodizing
Please note that the science behind anodizing can be complicated and hard to understand. Please skip to the next step if you want to jump right into anodizing. I would be more then happy to answer any questions through a PM or the comments below.
There is great website I found that explains how anodizing works better than me. The link is http://mrtitanium.com/interference.html
Step 2: Method 1 — Using a Chemical Cell — Intro
The first method of titanium anodization is done using a chemical cell. The titanium piece is is made the positive anode (hence the name anodization) and submerged into an electrolyte bath (borax and sulfuric acid are commonly used).
Step 3: Method 1 — Using a Chemical Cell — Step 1
Gather Parts and Tools
You Will Need:
1. Aluminum foil
2. A plastic container big enough to fully contain the piece you want to anodize
3. 1-8 nine volt batteries
4. At least 4 feet of insulated wire
5. Borax
6. Hot water
7. A spoon
8. Rubber gloves
9. Acetone or alcohol (the alcohol swabs at CVS work well)
10. A plastic cup (should hold about the same volume as your plastic container)
Tools (optional):
1. Pliers
2. Wire strippers
Step 4: Method 1 — Using a Chemical Cell — Step 2
Time to mix your electrolyte and build the anodizing bath.
Take the cup, spoon, borax and hot water and combine in the cup. Mix until all borax is dissolved. The closer the mixture is to saturation the better.
For the anodizing bath, take the aluminum foil and completely line the container with the foil. If there is any excess foil around the top of the container, I recommend folding it around the edge of the container.
Step 5: Method 1 — Using a Chemical Cell — Step 3
Time for the wiring and battery setup.
Strip about half inch of insulation off both ends of 2 foot wire lengths. After the wires have been stripped, Take one corner of of the aluminum foil and make a hole through it. Insert the end of the wire and twist them together. Tuck in the wire and aluminum corner. Now fill with the borax and water solution.
Take the desired number of nine volt batteries and connect them as shown in the picture. Then connect the wire that is attached to the foil to the negative (-) terminal of the battery. Take the other wire and connect to the positive (+) terminal of the battery (this is the wire that gets attached to the titanium piece).
Step 6: Method 1 — Using a Chemical Cell — Step 4
Time to figure out what color to anodize. Different voltages will produce different colors. Note that you can always change the color buy increasing the voltage but can not revert back to lower voltage colors. The above image is for anodizing in sulfuric acid but the results are pretty similar with borax. Remember, if you are unsure of the voltage needed, just go up in small increments of voltage.
Step 7: Method 1 — Using a Chemical Cell — Step 5
Cleaning the titanium.
Put on your rubber gloves to prevent any fingerprints on the titanium after it is cleaned. Then wipe down the titanium piece with the alcohol until is it very clean.
Step 8: Method 1 — Using a Chemical Cell — Step 6
Now for the actual anodizing.
Take the titanium and positive wire and touch them together. Submerge the titanium piece. Make sure that the the wire isn’t submerged and only titanium touches the solution. Also, take caution and make sure the titanium never touches the foil at any time. It can short everything out and generate huge and dangerous sparks. Once the desired color is reached, take the titanium out and dry it. You will find that some colors are affected by fingerprints and can become dull when exposed to fingerprints. This is perfectly normal and the original color can be restored using acetone or alcohol to remove the oils
Step 9: Method 2 — Using Heat — Intro
For this anodization method, intense heat is used to thicken the oxide layer. I use a gas stove to anodize but a blowtorch is recommended.
Step 10: Method 2 — Using Heat — Step 1
Gather your parts and tools.
You will need:
1. A heat source (blowtorches are best but a gas stove works too)
2. A pair of tongs or needle nose pliers (the handles will get hot so make sure they are rubber coated to provide adequate insulation)
3. Alcohol or acetone (alcohol pads from CVS work well)
4. A cup of very cold water
Step 11: Method 2 — Using Heat — Step 2
Clean the titanium as in step 5 of the chemical cell method.
Step 12: Method 2 — Using Heat — Step 3
Time to anodize!
Take the cleaned titanium and grip the edge of it with tongs/pliers. Turn on your stove/blowtorch and bring the titanium piece close to the heat. Keep the titanium moving and you should notice a color change to yellow after about 30 seconds or so. Heat the titanium piece for longer to achieve reds, blues and some greens.
Step 13: Method 2 — Using Heat — Step 4
After the desired color is achieved, turn off the stove/blowtorch and submerge the titanium in the cold water to cool it down. Be careful not to touch the titanium until it is cool as it will burn you. Same goes for the tip of the pliers/tongs too.
Step 14: Conclusion
Congrats you have anodized titanium!! I hope you found this interesting as well as fun and enjoyable. Please share your thoughts in the comments below. I look forward to any comments or suggestions.
Step 15: Troubleshooting
If anodizing the titanium isn’t working for any reason, please ask me in the comments as I would be more than happy to take questions!
Here are some possible solutions to problems you may encounter:
1. Make sure the titanium is the only thing submerged in the solution. The wire touching the titanium must not be submerged.
2. Make sure the wire touching the titanium is connected to the positive terminal of the battery.
3. Make sure you are using borax. Sulfuric acid works well too but is very dangerous to work with.
4. Make sure your batteries aren’t dead.
1 Person Made This Project!
Recommendations
Introduction: How to EASILY Anodize Titanium at Home (2 Methods)
Titanium anodizing is an extremely cool and rewarding project that is very easy to do at home. Anodizing is used industrially for enhanced corrosion resistance on metals like aluminum. Anodizing is also used as a decorative process for titanium jewelry as a wide range of colors can be achieved.
If you liked this instructable please vote for me. I would really appreciate it 
Step 1: Learning the Science Behind Anodizing
Please note that the science behind anodizing can be complicated and hard to understand. Please skip to the next step if you want to jump right into anodizing. I would be more then happy to answer any questions through a PM or the comments below.
There is great website I found that explains how anodizing works better than me. The link is http://mrtitanium.com/interference.html
Step 2: Method 1 — Using a Chemical Cell — Intro
The first method of titanium anodization is done using a chemical cell. The titanium piece is is made the positive anode (hence the name anodization) and submerged into an electrolyte bath (borax and sulfuric acid are commonly used).
Step 3: Method 1 — Using a Chemical Cell — Step 1
Gather Parts and Tools
You Will Need:
1. Aluminum foil
2. A plastic container big enough to fully contain the piece you want to anodize
3. 1-8 nine volt batteries
4. At least 4 feet of insulated wire
5. Borax
6. Hot water
7. A spoon
8. Rubber gloves
9. Acetone or alcohol (the alcohol swabs at CVS work well)
10. A plastic cup (should hold about the same volume as your plastic container)
Tools (optional):
1. Pliers
2. Wire strippers
Step 4: Method 1 — Using a Chemical Cell — Step 2
Time to mix your electrolyte and build the anodizing bath.
Take the cup, spoon, borax and hot water and combine in the cup. Mix until all borax is dissolved. The closer the mixture is to saturation the better.
For the anodizing bath, take the aluminum foil and completely line the container with the foil. If there is any excess foil around the top of the container, I recommend folding it around the edge of the container.
Step 5: Method 1 — Using a Chemical Cell — Step 3
Time for the wiring and battery setup.
Strip about half inch of insulation off both ends of 2 foot wire lengths. After the wires have been stripped, Take one corner of of the aluminum foil and make a hole through it. Insert the end of the wire and twist them together. Tuck in the wire and aluminum corner. Now fill with the borax and water solution.
Take the desired number of nine volt batteries and connect them as shown in the picture. Then connect the wire that is attached to the foil to the negative (-) terminal of the battery. Take the other wire and connect to the positive (+) terminal of the battery (this is the wire that gets attached to the titanium piece).
Step 6: Method 1 — Using a Chemical Cell — Step 4
Time to figure out what color to anodize. Different voltages will produce different colors. Note that you can always change the color buy increasing the voltage but can not revert back to lower voltage colors. The above image is for anodizing in sulfuric acid but the results are pretty similar with borax. Remember, if you are unsure of the voltage needed, just go up in small increments of voltage.
Step 7: Method 1 — Using a Chemical Cell — Step 5
Cleaning the titanium.
Put on your rubber gloves to prevent any fingerprints on the titanium after it is cleaned. Then wipe down the titanium piece with the alcohol until is it very clean.
Step 8: Method 1 — Using a Chemical Cell — Step 6
Now for the actual anodizing.
Take the titanium and positive wire and touch them together. Submerge the titanium piece. Make sure that the the wire isn’t submerged and only titanium touches the solution. Also, take caution and make sure the titanium never touches the foil at any time. It can short everything out and generate huge and dangerous sparks. Once the desired color is reached, take the titanium out and dry it. You will find that some colors are affected by fingerprints and can become dull when exposed to fingerprints. This is perfectly normal and the original color can be restored using acetone or alcohol to remove the oils
Step 9: Method 2 — Using Heat — Intro
For this anodization method, intense heat is used to thicken the oxide layer. I use a gas stove to anodize but a blowtorch is recommended.
Step 10: Method 2 — Using Heat — Step 1
Gather your parts and tools.
You will need:
1. A heat source (blowtorches are best but a gas stove works too)
2. A pair of tongs or needle nose pliers (the handles will get hot so make sure they are rubber coated to provide adequate insulation)
3. Alcohol or acetone (alcohol pads from CVS work well)
4. A cup of very cold water
Step 11: Method 2 — Using Heat — Step 2
Clean the titanium as in step 5 of the chemical cell method.
Step 12: Method 2 — Using Heat — Step 3
Time to anodize!
Take the cleaned titanium and grip the edge of it with tongs/pliers. Turn on your stove/blowtorch and bring the titanium piece close to the heat. Keep the titanium moving and you should notice a color change to yellow after about 30 seconds or so. Heat the titanium piece for longer to achieve reds, blues and some greens.
Step 13: Method 2 — Using Heat — Step 4
After the desired color is achieved, turn off the stove/blowtorch and submerge the titanium in the cold water to cool it down. Be careful not to touch the titanium until it is cool as it will burn you. Same goes for the tip of the pliers/tongs too.
Step 14: Conclusion
Congrats you have anodized titanium!! I hope you found this interesting as well as fun and enjoyable. Please share your thoughts in the comments below. I look forward to any comments or suggestions.
Step 15: Troubleshooting
If anodizing the titanium isn’t working for any reason, please ask me in the comments as I would be more than happy to take questions!
Here are some possible solutions to problems you may encounter:
1. Make sure the titanium is the only thing submerged in the solution. The wire touching the titanium must not be submerged.
2. Make sure the wire touching the titanium is connected to the positive terminal of the battery.
3. Make sure you are using borax. Sulfuric acid works well too but is very dangerous to work with.
4. Make sure your batteries aren’t dead.
1 Person Made This Project!
Recommendations
Наткнулся не так давно в интернете на материал по анодированию титана и решил попробовать.
Поделиться:
Для начала расскажу немного зачем мне все это надо. Сводится обоснование к 3-м пунктам:
1) мне было интересно получится ли
2) считаю так красивее
3) ложки становятся заметнее, их проще отличить от других и меньше шансов перепутатьпотерять
Весь смысл в том, что при анодировании в зависимости от напряжения титан приобретает разнообразный цвет. Цвет зависит от кучи факторов: марки титанового сплава, электролита, катода и пр. Но в общем случае мои результаты похожи на эту шкалу, привязанную к напряжению.
В статье в качестве источника тока была выбрана батарея из 9 вольтовых батареек «крона». Количеством батарей подбирается нужное напряжение.
Для начала нужно сделать электролит. Я использовал раствор лимонной кислоты.
Предмет (в данном случае вилка) тщательно шкурится 1000 шкуркой, а затем обезжиривается.
Из батареек создается сборка. «Минус» подключается к катоду (а данном случае стальная кастрюлька).
А «плюс» к нашей вилке.
Важно:
вилка не должна касаться котелка. «Крокодил» не должен погружаться в воду.
Реакция и изменение цвета начинается сразу.
Вероятно силы тока батареек недостаточно т.к. анодирование получилось «не очень», даже после значительного времени выдержки.
Вот, что получилось.
Я решил не останавливаться на достигнутом. Из автотрансформатора и диодного моста собрал блок питания. Он гораздо мощнее сборки из батарей + возможность плавной регулировки напряжения.
С таким блоком питания дело пошло на лад. Непосредственно регулируя напряжение можно выбрать цвет, который нравится. Единственное «но» — цвет меняется только в порядке увеличения напряжения. При уменьшении цвет изменяться не будет и если мы хотим, чтобы предмет принял цвет, которому соответствует меньшее напряжение, то надо сошкуривать анодирование и начинать все с начала.
Вот результат, который мне понравился и меня устроил.
В целом технология весьма проста, а результат весьма интересен. Проведенными опытами я доволен. Впредь тоже буду анодировать мелкие титановые предметы. Собираюсь замахнуться на котелки, хотя те и так приобретают цвет, но уже термическим способом. На это статью завершаю.
Спасибо за внимание!
UPD 24.11.13
фото ложек на природе
Поделиться:
Титан окрашивается в разные цвета (от желтого до синего) при нагревании. Просто горелкой греете до получения нужного цвета, ловите момент и охлаждаете.
Титан окрашивается в разные цвета (от желтого до синего) при нагревании. Просто горелкой греете до получения нужного цвета, ловите момент и охлаждаете.
Что такое анодированный титан?
Анодированный титан широко используется в медицине – например, в качестве материала для зубных имплантов. Оксидный слой, образующийся при анодировании, имеет толщину от 50 до 100 нанометров, что намного больше, чем толщина оксидного слоя естественного происхождения – от 5 до 25 нанометров.
Что такое анодирование украшения?
Анодирование – это создание оксидной пленки на поверхности украшения, оно абсолютно безопасно для проколов, не облезает как краска на украшениях плохого качества, добавляет украшению больше блеска и гладкости, что очень важно для безопасности вашего прокола!
Анодирование-это процесс электролитической пассивации, используемый для увеличения толщины естественного оксидного слоя на поверхности металлических деталей. Этот процесс называется анодированием, потому что обрабатываемая деталь образует анодный электрод электролизера.
Можно ли Анодировать сталь?
К наиболее популярным методам относится анодирование стали. Этот процесс так же называют электрохимическим или анодным оксидированием. Его наиболее часто применяют при обработке деталей из алюминия или титана. Плохо нанесению оксидной пленки поддается медь.
Возможно формирование оксидной пленки на поверхности металла другим способом – за счет повышения температуры. Но данный процесс возможен только до некоторой толщины, выше которой оксидная пленка трескается, ломается и отслаивается. При анодировании можно получать более толстые оксидные пленки, сохраняющие защитные свойства и прекрасную адгезию к субстрату. Анодирование возможно практически для любого металла.
Как происходит анодирование?
Анодирование (синонимы: анодное оксидирование, анодное окисление) — процесс создания оксидной плёнки на поверхности некоторых металлов и сплавов путём их анодной поляризации в проводящей среде.
Как происходит анодирование. Процесс создания этого защитного оксидного покрытия происходит электролитически. Металлическое изделие, на котором нужно получить анодное покрытие (обычно алюминий) погружают в ванну с электролитическим раствором. В этой же ванне установлены катоды, обычно вдоль бортов ванны. Когда электрический ток проходит через раствор кислоты на катоде выделяется водород, а на аноде – кислород.
Какой цвет у Титана?
Менделеева, с атомным номером 22. Плотность (при н. у.) Простое вещество титан — это лёгкий переходный металл серебристо-белого цвета.
Сначала титан приобретает первый цвет – золотистый. С ростом температуры появляются разнообразные оттенки: от светло-желтого до зеленоватого, фиолетового и голубого, вплоть до темно-синего. Для получения на поверхности специальных эффектов можно использовать различные тонизирующие присадки, придающие изделиям очень красивый угольно-серый цвет.
Что такое анодирование пирсинга?
Анодирование – это методика, подразумевающая окрашивание титанового изделия в определенный цвет. Происходит воздействие на материал с помощью электротока или температуры. В результате образуется пленка заданного цвета.
Анодирование – процесс, при котором на определённом металлическом изделии создаётся оксидная плёнка. Серьги из титана для пирсинга с помощью анодирования, меняя вольтаж, можно “окрасить” практически в любой цвет.
Что такое анодированное покрытие?
Анодированный алюминий (anodized aluminum) – металл с покрытием, которое способно предупреждать окисление алюминия на открытом воздухе и защищать его от возможных механических повреждений. Анодированное покрытие делает алюминиевое изделие, например, лист из алюминия или алюминиевый швеллер, пригодным к окрашиванию.
Анодирование-это процесс электролитической пассивации, используемый для увеличения толщины естественного оксидного слоя на поверхности металлических деталей.
Для чего нужно анодирование?
Анодирование позволяет выбрать толщину защитной пленки, желаемый оттенок поверхности, а также матовый или глянцевый эффект; Изделия из анодированного алюминия могут устанавливаться в местах с повышенной влажностью, в том числе на улице.
Анодирование-это процесс электролитической пассивации, используемый для увеличения толщины естественного оксидного слоя на поверхности металлических деталей.
Что такое анодированный профиль?
Анодированный профиль – это алюминиевое изделие, покрытое прочным и эстетичным оксидным слоем. Анодирование – трудоемкий и энергоемкий процесс, происходящий в несколько этапов: Очищение и обезжиривание поверхности с помощью щелочного раствора.
Анодирование – трудоемкий и энергоемкий процесс, происходящий в несколько этапов:
Очищение и обезжиривание поверхности с помощью щелочного раствора
Травление с помощью раствора серной кислоты для более тщательного очищения
Процесс анодирования при помощи электролитов
Электролитическое окрашивание
Уплотнение профиля благодаря закрытию пор
Анодирование металла – это электрохимический процесс создания защитной оксидной пленки, которая защищает поверхность металла от воздействия окружающей среды.
Анодирование-это процесс электролитической пассивации, используемый для увеличения толщины естественного оксидного слоя на поверхности металлических деталей. Этот процесс называется анодированием, потому что обрабатываемая деталь образует анодный электрод электролизера.
Что лучше анодированный алюминий или нержавеющая сталь?
Чуть более тяжелая, чем алюминий, нержавеющая сталь отлично справляется с ударными воздействиями, высоким давлением и истиранием (особенно марки, в которых есть марганец). Теплопередача у неё хуже, чем у алюминия: но благодаря этому металл не «потеет», на нем меньше конденсата.
Чем покрасить анодированный алюминий?
Окрашивать анодированный алюминий следует раствором анилинового красителя. Для приготовления такого раствора необходимо в 1 литр воды добавить 15 граммов красителя, 1 мл уксусной кислоты и нагреть его до 70-80 градусов.
Окрашивать анодированный алюминий следует раствором анилинового красителя. Для приготовления такого раствора необходимо в 1 литр воды добавить 15 граммов красителя, 1 мл уксусной кислоты и нагреть его до 70-80 градусов. Погружаем наше алюминиевое изделие в раствор красителя на 10-15 минут, чем дольше мы держим изделие в растворе красителя, тем более насыщенным и темным будет его цвет после окрашивания.
Где используют анодированный алюминий?
Анодированный алюминий – защита от коррозии
В последние десятилетия анодные покрытия, бесцветные и цветные, массово применяют для наружных и внутренних строительных материалов и деталей, в том числе, окон, дверей, фасадов зданий, внутренних перегородок и перил.
Анодированный алюминий (anodized aluminum) – металл с покрытием, которое способно предупреждать окисление алюминия на открытом воздухе и защищать его от возможных механических повреждений. Анодированное покрытие делает алюминиевое изделие, например, лист из алюминия или алюминиевый швеллер, пригодным к окрашиванию. Способы анодирования.
Как понять что это титан?
Существует ряд альтернативных способов, как определить титан в руках или алюминий, например. Один из вариантов – тонкая стружка. В случае титана она легко воспламеняется и ярко горит. Напротив, алюминиевая стружка плавится.
…
Прочие методики
- титан – 14;
- сталь низкоуглеродистая – 55;
- нержавейка – 16;
- алюминий – 250.
Как выглядит титан?
В чистом виде титан (Ti) – серебристо-серый лёгкий металл № 22 в Таблице Менделеева с атомной массой 47,86. Он отличается самым большим отношением прочности к массе из всех элементов таблицы. Это значит, что пластина из титана будет весить на 50% меньше, чем из стали, при одинаковой прочности.
Что крепче железо или титан?
Если затрагивать физические свойства титана, то можно отметить его высокую удельную прочность, прочности при высоких температурах, маленькую плотность и коррозийную стойкость. Механическая прочность титана в два раза выше прочности железа и в шесть – алюминия.
Конечно же, титан намного прочнее железа. Чистое железо – вообще, один из наименее твёрдых металлов. То, что на практике называется “железом”, на самом деле почти всегда – сталь или чугун.
Как обрабатывать титан?
Существует несколько видов механической обработки титана:
- резка;
- фрезеровка;
- шлифовка;
- сверление.
Титановые листы разрезают с помощью гильотинных ножниц. Прокатный сортовой металл крупного диаметра обычно подвергают резке специальными пилами механического типа. Этот инструмент отличается тем, что зуб полотна у него достаточно крупный. Если пруток имеет меньший диаметр, в ход можно пустить токарный станок. Кстати, токарная обработка данного металла осуществляется резцами, изготовленными из особо прочных сплавов.
Как сделать анодирование титана?
Анодирование титана в домашних условиях
Изделие из титана, которое нужно обработать, подключается зажимом к положительному заряду, после чего помещается в резервуар с электролитическим раствором. К отрицательному заряду крепятся пластины из нержавеющей стали из свинца, после чего также погружаются в электролит.
Почему Титан плохо обрабатывается?
Основные проблемы при обработки титана — это большая склонность его к налипанию и задиранию, низкая теплопроводность, а также то обстоятельство, что практически все металлы и огнеупорны растворяются в титане, в результате чего представляет собой сплав титана и твёрдого материала режущего инструмента.
Чем шлифовать титан?
Для шлифования титанового сплава следует использовать абразивные круги из карбида кремния марки 64С. Круги из электрокорунда марки 25А и др. применять не следует, так как титан взаимодействует с содержащимся в электрокорунде алюминием и круги быстро изнашиваются.
Для шлифования титанового сплава следует использовать абразивные круги из карбида кремния марки 64С. Круги из электрокорунда марки 25А и др. применять не следует, так как титан взаимодействует с содержащимся в электрокорунде алюминием и круги быстро изнашиваются.
Каким резцом обрабатывают титан?
Используйте резцы, предназначенные для титана, которые обычно намного острее, чем те, которые вы бы использовали для стали. Такие резцы лучше режут и не выделяют столько тепла. Фрезы с отрицательным углом наклона или с закругленными режущими кромками не подходят для обработки титана; Используйте прореживание стружки.
Для обработки титановых сплавов ВТ14 и ВТ15 рекомендуется черновое точение производить твердосплавными резцами ВК8, ВК6-М; после закалки рекомендуемые режимы резания: / = 2—8 мм, s = 0,25—0,35 мм/об, о= 15—20 м/мин. |70] Чистовое точение производится твердосплавными резцами ВК8, ВК6-М с режимами резания t – 0,3-1,5 мм, s – 0,1-0,2 мм/об.
Каким инструментом обрабатывают титан?
Соблюдение технологии обработки титановых сплавов
Для резания заготовок из титана применяются токарные станки с ЧПУ и специальный режущий инструмент, а процесс делится на ряд операций, каждая из которых выполняется по особой технологии.
При обработке титановых сплавов применяют шлифование абразивными кругами и ленточное шлифование. Для титановых сплавов наибольшее распространение в промышленности получили абразивные круги из зеленого карбида кремния, обладающего большими твердостью и хрупкостью, стабильностью физико-механических свойств и более высокой абразивной способностью, чем черный карбид кремния.
Какую особенность имеет спутник Титан?
Как Луна и многие другие спутники планет в Солнечной системе, Титан имеет синхронное вращение относительно планеты, ставшее результатом приливного захвата. То есть периоды вращения вокруг своей оси и обращения вокруг Сатурна совпадают, и спутник повёрнут к планете всегда одной и той же стороной.
Чем чистить часы из титана?
Титановые браслеты часов прочные и легкие. Ухаживать за ними не трудно: нужно потереть изделие каучуковым ластиком, затем нанести немного зубной пасты, вычистить грязь между звеньями и отполировать браслет безворсовой тканью.
Титановые браслеты часов прочные и легкие. Ухаживать за ними не трудно: нужно потереть изделие каучуковым ластиком, затем нанести немного зубной пасты, вычистить грязь между звеньями и отполировать браслет безворсовой тканью. Совет. Обратите внимание, что браслеты часов с IP, PVD или DLC-покрытиями нужно чистить очень аккуратно, чтобы не повредить защитный слой, поэтому рекомендуем доверить чистку таких изделий профессионалам.
Как шлифовать твердый сплав?
При обработке изделий из твердых сплавов применяют природный и искусственный алмаз. Природный алмаз — минерал, состоит из одного химического элемента — углерода, встречается в виде кристаллов от 0,005 до нескольких десятков карат (1 карат = 0,2 г).
Сколько стоит 1 кг титана?
Прием титана | Цена на лом за кг на сегодня
| Стоимость лома титана за 1 кг на сегодня от да | ||
|---|---|---|
| Наименование | Цена за кг | |
| Титан | ||
| Титан Легкий серебристо-белый металл | 270 руб. | |
| Стружка Стружка из титана любой марки. | 50 руб. |
Что можно сделать из титана?
Титан можно применять для изготовления броневых плит, лопастей пропеллера и снарядных ящиков. В настоящее время титан применяется в конструкции самолетов военной авиации Дуглас Х-3 для обшивки, Рипаблик F-84F, Кертисс-Райт J-65 и Боинг В-52. Применяется титан и при постройке гражданских самолетов DC-7.
Памятник Гагарину в Москве, изготовленный из титана. Начиная с 40-х годов прошлого века титан активно используют в кораблестроении, изготовлении самолётов и ракет. Из него также делают велосипедные рамы, насосы, реакторы, протезы, арматуру, бронежилеты и ещё множество полезных для человека вещей. Не последнее место титан занял в часовом и ювелирном производстве.
Чем можно просверлить титан?
Виды сверл для титана
Отлично подойдут твердосплавные сверла из стали марок ВК4, ВК8, ВК6М, ВК10М или из быстрорежущей стали Р18, Р9К5, Р9М4К8, Р6М5К5 твердостью HRC≥ 63 с острой заточкой, которые используются для труднообрабатываемых сталей.
Для сверления титана лучше всего подходят твердоспланые сверла с обозначением PMX, K20, К30F. Так же твердоспланые сверла могут покрывать износостойким покрытием, что увеличивает ресурс сверла до 70%. Покрытие сверла обычно обозначают так -TIALSIN, NITREX, ALTIN.У каждого производителя могут быть разные обозначения.













































,%20rutila%20(b)%20i%20brukita%20(v).jpg)
,%20i%20TiO%20(b)..jpg)



%20i%20bar'ernogo%20(v)%20sloev%20i%20poperechnogo%20secheniya%20(b)%20NTAOT,%20sformirovannoj%20v%20vodnom%20rastvore.jpg)
,%20trubchatogo%20(b)%20sloev,%20a%20takzhe%20poperechnoe%20sechenie%20(v)%20NTAOT,%20sformirovannogo%20v%20etilenglikole%20s%20dobavkoj.jpg)
%20i%20poperechnogo%20sloma%20(b)%20NTAOT%20tolshchinoj%2040%20mkm,%20sformirovannogo%20dolgovremennym%20anodirovaniem%20v%20techenie.jpg)