Ацидоз: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Ацидоз – это смещение кислотно-щелочного баланса организма в сторону повышения кислотности.
Кислотами называют вещества, способные отдавать ион водорода (Н+), а основаниями – вещества, способные его принимать. Кислоты постоянно образуются в результате жизнедеятельности клеток организма и расщепляются с освобождением очень активных ионов водорода.
Для поддержания нормальной жизнедеятельности организма концентрация этих ионов должна поддерживаться в физиологических значениях, этой цели служат буферные и выделительные системы организма (легкие, почки, кишечник).
Так поддерживается кислотно-щелочное равновесие (баланс) – относительное постоянство концентрации водородных ионов во внутренних средах организма.
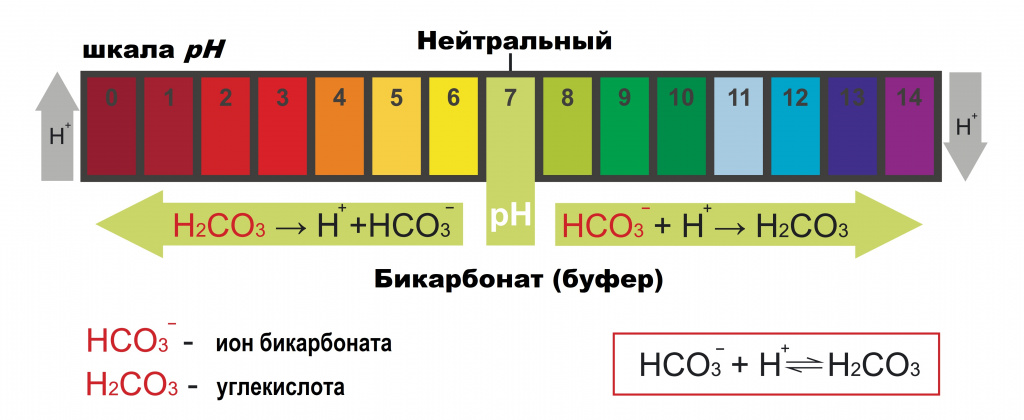
Соотношение положительно заряженных ионов водорода (Н+) и отрицательно заряженных гидроксильных ионов (ОН-) во внутренней среде организма определяет интенсивность окислительно-восстановительных процессов, синтез и расщепление белков, жиров и углеводов, активность ферментов, проницаемость мембран, чувствительность к гормональным стимулам и др. Это соотношение определяется показателем рН (водородным показателем). Кислотность или щёлочность раствора зависят от содержания в нем свободных ионов водорода и концентрации гидроксильных групп. Если концентрация Н+ больше концентрации ОН-, то мы говорим о том, что среда кислая. Если концентрация Н+ равна концентрации ОН-, то среда нейтральная, когда концентрация Н+ меньше концентрации ОН-, то это щелочная среда. Таким образом, при рН < 7,0 среда кислая, при рН = 7,0 – нейтральная, рН ˃ 7,0 свидетельствует о щелочной среде.
В физиологических условиях показатель рН крови колеблется в пределах 7,35-7,45. Даже незначительные нарушения этих границ могут иметь неприятные последствия, а рН менее 6,8 и выше 7,8 несовместимы с жизнью.
Ведущую роль в поддержании кислотно-щелочного баланса крови играют буферные системы организма – растворы химических композиций, которые способны сглаживать изменения рН. Буфер состоит из основания и какой-нибудь слабой кислоты (слабыми считаются те кислоты, которые отдают не все ионы Н+ в раствор). Буферные системы крови – это первая «линия охраны», которая поддерживает рН при поступлении в кровь кислых или щелочных продуктов, пока те не будут выведены или использованы в метаболических процессах. Основные буферные системы организма – бикарбонатная, фосфатная, белковая и гемоглобиновая.
Наряду с химическими буферными системами действуют органные механизмы компенсации – легкие, почки, желудочно-кишечный тракт. Для достижения эффекта им необходимо больше времени – от нескольких минут до нескольких часов. Так, например, легкие обеспечивают устранение или уменьшение сдвигов кислотно-щелочного равновесия путем изменения объема альвеолярной вентиляции в течение нескольких минут (увеличение вентиляции легких в 2 раза повышает рН крови примерно на 0,2, снижение вентиляции на 25% может уменьшить рН на 0,3-0,4). Почки могут увеличивать выведение (экскрецию) ионов Н+ и восстанавливать резерв гидрокарбонатной буферной системы крови. В печени осуществляется синтез белков крови, входящих в белковую буферную систему, образуется аммиак, способный нейтрализовать кислоты, а молочная кислота, которую многие органы и ткани не способны метаболизировать, превращается в нейтральные продукты и т.д.
Если буферные системы не справляются, происходит нарушение баланса. В зависимости от направленности сдвига рН крови выделяют ацидоз и алкалоз.
Смещение рН менее 7,35 – ацидоз, смещение рН более 7,45 – алкалоз.
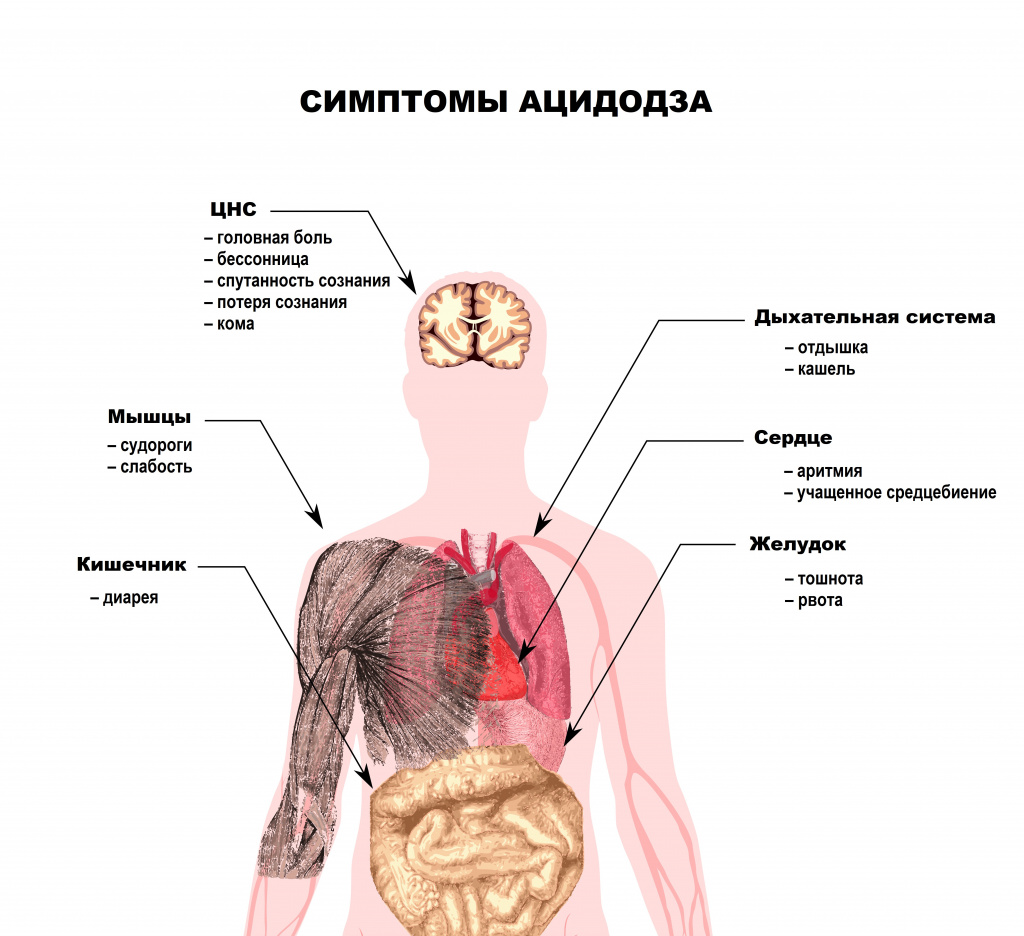
К симптомам ацидоза относят тошноту и рвоту, диарею, частое дыхание, головную боль, головокружение, нарушение сознания вплоть до комы, падение артериального давления, нарушения ритма сердца (от экстрасистолии до фибрилляции желудочков). Характерным признаком тяжелого метаболического ацидоза является медленное глубокое шумное дыхание или дыхание Куссмауля. Это симптом обычно наблюдается у пациентов в предтерминальном состоянии.
По механизму развития нарушения кислотно-щелочного равновесия выделяют респираторный, метаболический и смешанный ацидоз, а по степени компенсации – компенсированный, субкомпенсированный и декомпенсированный.
Компенсированными считаются такие сдвиги, при которых рН капиллярной крови не отклоняется за пределы диапазона нормы – 7,35-7,45, но присутствуют изменения других показателей. При рН 7,3-7,26 ставится диагноз «субкомпенсированный ацидоз», а при рН от 7,18 до 6,8 – «декомпенсированный ацидоз».
Возможные причины ацидоза
Причиной развития ацидоза могут быть как эндогенные факторы (заболевания, нарушения работы физиологических систем поддержания равновесия), так и экзогенные (связанные с избыточным поступлением в организм веществ кислого характера – лекарств, токсичных средств, некоторых продуктов питания).
В основе респираторного ацидоза лежит гиповентиляция, в результате которой в организме накапливается избыток CO2, а в последующем – углекислоты. Респираторный ацидоз может стать следствием обструкции (закупорки) дыхательных путей, нарушения растяжимости легких, нарушения регуляции дыхания, повышенного образования углекислого газа или его избыточного поступления в организм с вдыхаемым воздухом (при работе в скафандре, на подводных лодках) или при нахождении большого количества людей в замкнутом пространстве (например, в шахте).
Метаболический ацидоз развивается в результате повышенной продукции кислот, сниженной экскреции (выведения) кислот и/или повышенной экскреции оснований. Причинами метаболического ацидоза являются гипоксия, нарушение кровообращения, голодание, сахарный диабет, тяжелые поражения печени и почек, длительная интенсивная физическая нагрузка, ожоги, воспаление, травма, кровопотеря, гипопротеинемия. Бикарбонат (буфер) выделяется в полость тонкого кишечника для осуществления пищеварения и обратно всасывается в нижних отделах желудочно-кишечного тракта или выводится с фекалиями. Любые патологии пищеварительного тракта (например, тяжелая диарея) могут привести выведению бикарбоната из организма в количествах, достаточных для развития метаболического ацидоза. Также потеря бикарбонатов может быть связана с почечной недостаточностью. Тяжелый метаболический ацидоз способен стать следствием всасывания случайно попавших в пищеварительный тракт кислых соединений (например, метанола).
Заболевания, при которых может развиться ацидоз
Наиболее частые причины респираторного ацидоза — бронхиальная астма, бронхит, эмфизема легких, аспирация инородного тела, пневмония, гемоторакс, ателектаз легкого, инфаркт легкого, парез диафрагмы. Энцефалиты, полиомиелит, расстройства мозгового кровообращения могут стать причиной нарушения регуляции дыхания. Повышенное образование эндогенного CO2 является следствием лихорадки, сепсиса, длительных судорог, может сопровождать тепловой удар.
Распространенной причиной метаболического ацидоза является тяжелая диарея, при которой большое количество ионов бикарбонатов выводится с фекалиями. Эта форма метаболического ацидоза особенно опасна, поскольку способна приводить к летальному исходу, особенно у детей в раннем возрасте.
Канальцевый ацидоз возникает при хронической почечной недостаточности, недостаточной секреции альдостерона (болезни Аддисона), других наследственных и приобретенных заболеваниях, которые нарушают функцию почечных канальцев.
При значительном нарушении функции почек снижается выделение кислот с мочой и снижается образование ионов бикарбонатов, что тоже может привести к метаболическому ацидозу.
Усиленная продукция кетокислот является одной из особенностей неконтролируемого или плохо контролируемого инсулинозависимого сахарного диабета (диабетический кетоацидоз).
К каким врачам обращаться при ацидозе
Острые нарушения кислотно-щелочного равновесия являются жизнеугрожающими состояниями, поэтому пациенты госпитализируются в стационар под наблюдение врача-реаниматолога. В случае хронического ацидоза необходима коррекция основного заболевания (например, заболевания легких или почек), поэтому наблюдение осуществляет
врач-терапевт
или
врач-пульмонолог
,
кардиолог
, нефролог,
невролог
,
гастроэнтеролог
.
Диагностика и обследования при ацидозе
Диагноз устанавливается на основании оценки содержания электролитов и газов крови. Для исследования кислотно-щелочного состояния используются специальные автоматические анализаторы.
Измеряются такие показатели как:
- pH – концентрация ионов (активность) H+,
- рCO2 – парциальное давление CO2 (в мм рт.ст.),
- рO2 – парциальное давление O2 (в мм рт.ст.).
Рассчитываются показатели:
- HCO3 – концентрация бикарбоната (в ммоль/л),
- BE – избыток (или дефицит) оснований (в ммоль/л),
- BB – сумма оснований всех буферных систем крови (в ммоль/л),
- SBE – стандартный избыток оснований (в ммоль/л),
- SBC – стандартный бикарбонат (в ммоль/л).
При подозрении на диабетический, алкогольный кетоацидоз или связанный с голоданием кетоацидоз определяют содержание кетоновых тел при помощи нитропруссидного теста.
Необходимо также выполнить определенные исследования крови и мочи:
- общий анализ крови;
Что делать при ацидозе
При подозрении на ацидоз необходимо обратиться как можно быстрее за медицинской помощью.
Лечение ацидоза
Лечение ацидоза зависит от вызвавшей его причины, механизма развития, степени компенсации. Поэтому главная задача – устранение причины его развития, то есть терапия основного заболевания.
Для коррекции метаболического ацидоза могут применяться внутривенные инфузии натрия бикарбоната, препараты калия, в случае кетоацидоза на фоне сахарного диабета проводят инсулинотерапию. Острый респираторный ацидоз представляет угрозу для жизни пациента, поэтому требуется незамедлительное восстановление адекватной вентиляции легких и уровня оксигенации крови.
Источники:
- Тепаев Р.Ф., Ластовка В.А., Пыталь А.В., Савлук Ю.В. Метаболический ацидоз: диагностика и лечение // Педиатрическая фармакология. – 2016. – Т. 13. – № 4. – С. 384-389. DOI: 10.15690/pf.v13i4.1612
- Азбука кислотно-щелочного состояния: метод. указ. для врачей-интернов детских анестезиологов / сост. Межирова Н.М, Кравцова Г.Д, Данилова В.В., Коваль А.В., Овчаренко С.С. – Харьков, ХНМУ. – 2015.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Кто не любит встретиться с друзьями, поговорить о жизни, попеть в караоке или «зажечь» на танцполе, особенно, если для этого есть весомый повод? Однако зачастую вечеринки сопровождаются не только музыкой, хорошей компанией и веселым настроением, но и алкоголем в больших количествах. Предполагаем, что некоторым известно состояние на утро после увеселительного мероприятия, когда голову невозможно оторвать от подушки, а желудок выворачивает наружу.
Это метаболическое расстройство, которое называется «ацидоз». Оно связано с нарушением кислотно-щелочного (pH) баланса организма — алкоголь сдвигает его в сторону окисления.
Кислотно-щелочное равновесие имеют все жидкости организма человека, из которых он по большей части состоит. Это устойчивый параметр, который отвечает за баланс в крови кислых и щелочных компонентов. Норма кислотности в крови и организме составляет от 7,35 до 7,45 pH. Это является одним из показателей нашего здоровья, от которого зависит стабильная работа всех систем организма и протекание множества биохимических реакций.
Признаки нарушения кислотно-щелочного баланса после приема алкоголя:
— тошнота и рвота,
— тахикардия,
— тремор,
— головокружение и головная боль,
— сбои артериального давления,
— обезвоживание.
Такое состояние может длиться от нескольких часов до нескольких суток, в зависимости от степени алкогольной интоксикации. Чтобы избежать ацидоза, нужно сохранять pH-баланс на необходимом для организма уровне либо в быстрые сроки ликвидировать закисление организма.
Как поддерживать кислотно-щелочной баланс
Кислотно-щелочное равновесие напрямую влияет на наше самочувствие. Поддержать или восстановить его поможет NFO pH-баланс — комплекс, содержащий в себе все необходимые элементы: магний, кальций, цинк и аскорбиновую кислоту. Его можно принимать и как антипохмельное «оружие» во время вечеринки, и как «противоядие» — для очищения организма от токсинов уже после застолья.
NFO pH-баланс хорошо усваивается организмом, быстро восстанавливает pH-равновесие и устраняет все симптомы, характерные для алкогольной интоксикации, включая головную боль, жажду, озноб, неприятный запах изо рта.
Комплекс также способствует восстановлению минералов в организме, восполняет нехватку кислорода, защищает от воздействия свободных радикалов, стимулирует работу органов, оказывает положительное влияние на умственную и физическую работоспособность, регулирует метаболизм.
Основные свойства NFO pH-баланс:
— поддержка кислотно-щелочного баланса,
— детоксикация организма,
— профилактика и ликвидация похмельного синдрома,
— улучшение энергетического обмена,
— нормализация нервной системы,
— быстрое восстановление при отравлениях.
Если планируется застолье, то NFO pH-баланс следует приобрести заранее и принять одну дозу за один час до застолья, далее одну дозу во время и еще одну — после употребления алкоголя. Это убережет ваш организм от утренних «неприятностей», даже если выпитого алкоголя окажется много.
Важно! При растворении порошка не использовать металлическую посуду и не размешивать средство столовыми приборами из металла. Их можно заменить на одноразовую пластиковую ложку, трубочку для коктейля или деревянную китайскую палочку.
БАД. Не является лекарственным средством.
В последнее время появилось множество публикаций на тему питания, которое помогает живому организму поддерживать кислотно-щелочное равновесие, не позволяя ему сдвигаться в кислую сторону [1, 2]. Такое питание включает в себя как рацион, насыщенный овощами и фруктами, так и употребление щелочной воды.
Кислотно-щелочной баланс внутренней среды организма поддерживается в достаточно жестких границах на уровне pH артериальной крови от 7,26 до 7,45 буферными системами организма [3], и принято считать, что он изменяется только при тяжелых заболеваниях. Однако анализ кислотно-щелочного равновесия крови, как правило, проводился у пациентов с выраженной патологией и мало изучался у практически здоровых людей, подверженных негативному влиянию экологии, стрессам, изменению в питании и проч. В настоящее время отрабатываются более чувствительные методы и модели, которые, возможно, помогут понять более тонкие, но весьма существенные для здоровья колебания pH [4, 5].
Есть исследование, убедительно доказывающее, что не только тяжелые состояния здоровья, но и условия работы в современной промышленности достоверно сдвигают традиционные показатели буферной системы крови (pH, РаCO2, РаO2 крови и HCO в плазме) у рабочих завода по производству пластмасс [6]. О более тонких изменениях кислотно-щелочного равновесия в связи с эволюцией питания людей в историческом разрезе изложено также в European Journal of Nutrition в 2001 г. [7]. Там же указано, что «во время высокоинтенсивной активности ацидоз ответственен за усталость и истощение рабочих мышц. Введение бикарбонатной добавки перед тренировкой улучшало показатели, задерживая начало усталости». Кислотно-щелочное равновесие зависит от питания перед высокоинтенсивной тренировкой. Низкое употребление углеводов перед тренировкой приводит после интенсивной нагрузки к его сдвигу в кислую сторону [8, 9]. Определение кислотно-щелочного равновесия по показателям мочи (pH, бикарбонаты, мочевина) также может показать баланс кислот и оснований в организме. Таким методом было выявлено негативное влияние западного стиля питания с большим количеством белка на изменение показателей мочи в кислую сторону [10]. Есть и другие работы, доказывающие влияние питания на кислотно-щелочной баланс как у людей, так и у животных, где подчеркивается, что несбалансированный рацион меняет кислотно-щелочное равновесие в кислую сторону [11–13].
Таким образом, роль питания в поддержании кислотно-щелочного баланса подтверждена и продолжает изучаться, и немалую долю в рационе составляет вода, оказывающая значимое влияние на здоровье наряду с пищей. В литературе накопилось немало данных о благоприятном воздействии на здоровье употребления питьевой щелочной воды, являющейся основой для коррекции кислотно-щелочного равновесия на фоне привычного для человека питания. Изучалось ее влияние на общее оздоровление, уровень глюкозы в крови, массу тела, восстановление спортсменов после напряженных тренировок и проч., что будет отдельно рассмотрено ниже.
Материалы и методы исследования
Были проанализированы рандомизированные клинические исследования, а также группы нерандомизированных исследований.
Результаты и обсуждения
Питьевая вода во всех странах регулируется по показателю pH, однако допустимый диапазон колебаний достаточно широкий. В Российской Федерации допустимыми параметрами для питьевой воды является pH в диапазоне 6–9 [14], охватывая диапазон от слабокислой до щелочной реакции. Питьевая вода с водородным показателем 8–9 является щелочной, находясь в нормируемых параметрах для ежедневного потребления.
Одним из самых спорных вопросов, возникающих при рассмотрении пользы питьевой щелочной воды, является сомнение в том, что она может полностью нейтрализоваться кислой средой желудка. Действительно, на первый взгляд этот вопрос очевиден, и есть предположение, что щелочная среда будет полностью инактивирована желудочным соком, потеряв свои полезные свойства. Однако ответ на этот вопрос не так прост, и было бы неправильно его рассматривать, опираясь только на физико-химические свойства двух сред, упуская из виду некоторые особенности эвакуации желудочного содержимого. Этот вопрос очень внимательно был рассмотрен некоторыми исследователями, так как в медицине всегда достаточно остро стоит вопрос, как избежать инактивации отдельных медицинских препаратов и снизить время их контакта с кислым содержимым желудка. Этот вопрос по отношению к щелочной воде в данном обзоре будет рассмотрен впервые.
Для понимания степени и времени контакта щелочной воды с кислотностью желудка необходимо рассмотреть особенности эвакуации жидкости и пищи из желудка. Методы изучения особенности эвакуации содержимого желудка включают методы взятия проб желудочно-кишечного тракта [15–18], сцинтиграфию [19, 20], фармакокинетический анализ маркерных веществ [21] и магнитно-резонансную томографию (МРТ) [22, 23].
Впервые механизм намного более быстрой эвакуации воды по сравнению с пищей был описан и изучен в 1908 г. Г. В. Вальдейером, который описал анатомическую структуру складок слизистой на малой кривизне желудка (рис.), выступающей в качестве пути для быстрой эвакуации жидкости [24], назвав ее «Magenstrasse» — желудочной дорожкой. Кстати, именно этот известнейший гистолог и анатом ввел термины «нейрон» и «хромосома».
Впоследствии феномен Вальдейера был неоднократно описан другими авторами [25, 26] и в 70-х годах прошлого столетия был окончательно подтвержден [27, 28]. В 2007 и 2015 гг. феномен быстрой эвакуации воды (в течение 10 мин) из желудка был подтвержден с помощью математических моделей [29, 30].
В 2017 г. группа немецких ученых опубликовала работу, где с помощью МРТ изучался механизм эвакуации воды, выпитой как натощак, так и после приема пищи, причем в данной работе исследовались различные виды пищи (твердость, калорийность, жирность) [31]. Несмотря на высокую вариабельность времени эвакуации воды у испытуемых, подтверждено, что большая часть воды не смешивается с химусом и эвакуируется значительно быстрее пищи. Более всего задерживает эвакуацию гомогенная нежирная пища, с которой происходит смешивание жидкости в желудке.
На скорость эвакуации воды влияет также ее температура — прохладные напитки (5–20 °C) проходят из желудка в двенадцатиперстную кишку быстрее, чем теплые (25–40 °C) [32, 33]. Следует отметить, что все исследования проводились на объемах 250–350 мл, то есть эвакуаторная функция желудка при употреблении больших объемов пищи не изучалась, вода также выпивалась в количестве 250 мл.
Несмотря на то, что вопрос особенностей эвакуации воды из желудка был достаточно хорошо изучен и подтвержден, он известен только определенному кругу исследователей и широко не обсуждается в кругах практических врачей. Хотя именно этот феномен помог бы понять механизм всасывания и расщепления некоторых лекарств и жидкостей, долгое соприкосновение которых с кислой средой желудка было бы нежелательно.
Ознакомление с феноменом Вальдейера дает понимание того, что значительная часть щелочной воды в желудке после ее употребления будет эвакуироваться в двенадцатиперстную кишку достаточно быстро по складкам малой кривизны и не будет соприкасаться с кислой средой желудочного сока, сосредоточенного в антральном отделе. Особенно быстро этот процесс происходит при пустом желудке. Другими словами, кислотность желудочного сока не влияет на сохранение щелочности жидкости. В качестве рекомендаций для максимального сохранения щелочной среды самым оптимальным будет режим, когда щелочная вода будет выпита натощак или между приемами пищи.
Воздействие на организм человека щелочной воды, полученной электролизом, изучалось отдельными авторами как в моделях на животных, так и у людей. Общеоздоровительный эффект от постоянного употребления такой воды рассматривался, в частности, с точки зрения воздействия на окислительные процессы, вызывающие обширное повреждение биологических макромолекул и ведущие к различным заболеваниям, старению и мутациям. В частности, были рассмотрены механизмы защиты от окисления и повреждения РНК, ДНК и белков как in vitro [34–37], так и in vivo у лабораторных крыс [38]. Предполагалось, что щелочная вода является идеальным поглотителем активного кислорода, являющегося одним из мощных повреждающих факторов в живых системах. Результаты исследований подтвердили данный тезис. Все эти исследования установили, что щелочная вода имела тенденцию подавлять одноцепочечный разрыв ДНК, РНК и защищать белок от воздействия окислительного стресса. Доказано также, что щелочная вода повышает активность ключевого детоксифицирующего фермента в организме, супероксиддисмутазы, который является основной защитой от повреждения свободными радикалами [34, 35].
Вода с щелочным диапазоном (pH 8,5–9,5) хорошо продемонстрировала свое антиоксидантное действие у пациентов, находящихся на диализе. K. C. Huang и соавт. изучили активные формы кислорода в плазме этих пациентов и обнаружили, что такая вода снижает уровень пероксида, повышенный гемодиализом, и минимизирует маркеры воспаления (С-реактивный белок и интерлейкин-6) после 1 месяца употребления. Эти данные показывают, что сердечно-сосудистые осложнения (инсульт и сердечный приступ) у пациентов, находящихся на гемодиализе, могут быть предотвращены или отсрочены с помощью такого безобидного питья [39]. Причем по активности и результатам анализов употребление щелочной воды у этой группы пациентов сравнимо с действием инъекционного витамина С, но, в отличие от последнего, без риска образования оксалатов [40]. В этой же статье отмечено, что шестимесячный прием щелочной воды увеличил гематокрит и уменьшил количество цитокинов, обеспечивающих мобилизацию воспалительного ответа.
Известно, что именно свободнорадикальное окисление приводит к развитию многих возрастных болезней, поэтому антиоксиданты могут быть полезными для смягчения разрушительного действия старения и, возможно, для его замедления. G. Fernandes из Университета Техаса сообщил, что различные виды лабораторных мышей, получавших щелочную воду с рождения, живут на 20–50% дольше контрольной группы, употреблявшей водопроводную воду. Он также обнаружил снижение уровня пероксида в сыворотке опытных мышей по сравнению с контрольными [41]. Исследование, проведенное на нематодах, у которых в качестве водной среды использовалась щелочная вода, показало, что она значительно продлила продолжительность жизни червей, что было интерпретировано как проявление поглощающего действия активных форм кислорода [42].
Оздоровительный эффект при приеме щелочной воды зарегистрирован и описан у людей в исследовании Н. В. Воробьевой (МГУ им. М. В. Ломоносова) при изучении микрофлоры кишечника. Отмечалась стимуляция роста нормальной анаэробной флоры. Положительное воздействие трактовалось автором как улучшение среды обитания и благоприятного микроэкологического фона для роста аутомикрофлоры [43].
Исследование, проведенное в Китае в 2001 г. с людьми, продемонстрировало, что прием щелочной воды на протяжении от 3 до 6 месяцев снижал вплоть до нормальных значений гиперлипидемию, уровень глюкозы крови при сахарном диабете 2 типа легкой степени и регулировал уровень артериального давления [44]. Аналогичные результаты с регуляцией сахара крови были получены и в других исследованиях. Другое исследование 2006 г., проведенное на лабораторных крысах с экспериментальным диабетом, подтвердило данные результаты [45]. Через 12 недель употребления щелочной воды снижались уровни холестерина, триглицеридов и сахара в крови.
Поскольку сахарный диабет 2 типа является достаточно актуальной проблемой в современном обществе, ему уделяется много внимания различными исследователеми. Интересные результаты были получены на людях, больных диабетом 2 типа, которые были разбиты на группы и получали воду с различным pH (7,0; 8,0; 9,5 и 11,5) в течение 14 дней. Было обнаружено, что сахароснижающее свойство проявляет вода с pH 9,5 и 11,5, тогда как более низкие значения не оказывают статистически достоверного влияния на глюкозу в крови [46]. Авторы также отмечают, что наряду с сахароснижающим эффектом щелочная вода проявляет выраженное антиоксидантное действие, которое необходимо больным сахарным диабетом, а также выраженный детоксикационный эффект, проявляющийся в учащенном мочеиспускании. Корейское исследование, проведенное на мышах с диабетом, подтвердило, что питье щелочной воды значительно снижало концентрацию глюкозы в крови и улучшало толерантность к глюкозе [47]. Однако не было выявлено воздействия на уровень инсулина. Еще два исследования подтвердили не только способствование снижению глюкозы в крови и нормализации толерантности к глюкозе, но и лучшее сохранение β-клеток поджелудочной железы, активно разрушающихся при прогрессировании данного заболевания [48, 49].
Исследования, посвященные действию щелочной воды на организм, были также проведены среди спортсменов и среди людей, получавших интенсивные физические нагрузки. Предполагается, что интенсивные физические нагрузки провоцируют окислительный стресс в организме [50]. Дегидратация после тренировок также провоцирует повышение уровня малонового альдегида, являющегося одним из маркеров окислительного стресса [51]. К окислению весьма чувствительны эритроциты. Насыщенный железом гемоглобин разлагается, выделяя супероксид [49, 52]. Когда активные формы кислорода инициируют перекисное окисление липидных мембран, белки клеточных мембран часто становятся сшитыми, а эритроциты становятся более жесткими с меньшей подвижностью [53]. Эти механизмы изменяют свойства эритроцитов, в том числе снижают текучесть крови и повышают агрегацию ее клеток, что приводит к увеличению вязкости крови и нарушению кровотока [54]. Аналогичные изменения под действием окислителей происходят и с тромбоцитами [55]. Агрегацию тромбоцитов усиливает и финибриноген, испытывающий действие окислительного стресса [56]. Поэтому одним из показателей выраженного окислительного стресса у спортсменов можно рассматривать повышение вязкости крови, которую усугубляет дегидратация после интенсивных тренировок.
Быстрое восстановление после интенсивных физических нагрузок является актуальной проблемой в спортивной медицине. J. Weidman и соавт. провели двойное слепое рандомизированное исследование для сравнения эффективности регидратации после тренировок с применением стандартной питьевой и щелочной воды (pH 9,5), полученной электролизом, в котором изучали показатели вязкости крови [57]. В этом исследовании была обнаружена значительная разница в вязкости цельной крови при оценке употребления воды с высоким pH по сравнению со стандартной очищенной водой во время фазы восстановления (120 мин) после интенсивной дегидратации, вызванной физической нагрузкой. Авторы объясняют полученные результаты нейтрализацией окислительных процессов, выявленных после интенсивных физических нагрузок в организме спортсменов. Исследование, проведенное с тремя видами воды: минеральной (pH 6,1), щелочной с низким содержанием минералов (pH 
В другом исследовании D. P. Heil продемонстрировал более быструю и лучшую регидратацию с бутылочной щелочной водой (pH 10), чем со стандартной питьевой водой у десяти велосипедистов мужского пола. Маркерами регидратации были удельный вес мочи, диурез, концентрация сывороточного белка и восстановление водного баланса [59]. Бикарбонатная бутылочная щелочная вода с микроэлементами (pH 9,1) показала также лучшие восстановительные свойства по сравнению с питьевой водой и у спортсменов боевых искусств после ограничения воды для быстрой потери веса перед соревнованиями [60]. Перечисленные исследования демонстрируют, что лучшие восстановительные свойства показывает вода со щелочным pH по сравнению с нейтральной питьевой водой, независимо от того, получена она электролизом или это бутылочный вариант.
Выводы
Таким образом, вода с pH 9–10 может рассматриваться как дополнительный фактор оздоровления. Растущий объем научных исследований не выявил негативных отрицательных воздействий на организм. Из рассмотренных публикаций очевидно, что употребление щелочной воды может быть дополнительной антиоксидантной поддержкой, благоприятно сказывается на состоянии здоровья при диабете и гиперлипидемии и может улучшать реологию крови в случае, когда она нарушена из-за интенсивных физических нагрузок. Применение щелочной воды в спорте для более активного восстановления после тренировок может дать дополнительный безопасный инструмент сохранения здоровья спортсменов.
Литературные данные, приведенные в обзоре, также могут помочь выработать рекомендации по приему щелочной воды для максимального сохранения ее полезных свойств. Особенности эвакуаторной функции желудка при употреблении пищи объемом до 250 мл позволяют большей ее части не смешиваться с его содержимым. Однако это касается не всего объема выпитой воды. Часть ее все-таки смешивается, особенно если пища является гомогенной и полужидкой. Наиболее полно сохранение свойств с наибольшей вероятностью произойдет при употреблении щелочной воды натощак или между приемами пищи. Следует также принимать во внимание, что исследования касались объема жидкости до 250 мл. Каким образом эвакуируются из желудка большие объемы воды, на сегодняшний день остается не изученным.
В заключение следует отметить, что сохраняется высокая актуальность исследований воздействия щелочной воды на здоровье, поскольку есть перспективы дополнительного безопасного алиментарного фактора питания, благотворно влияющего на организм и доступного для широких кругов населения.
Литература
- Riond J. L. Animal nutrition and acid-base balance // Eur J Nutr. 2001. № 40 (5). P. 245–254.
- Gannon R. H., Millward D. J., Brown J. E. et al. Estimates of daily net endogenous acid production in the elderly UK population: analysis of the National Diet and Nutrition Survey (NDNS) of British adults aged 65 years and over // Br J Nutr. 2008, Sep; 100 (3): 615–623.
- Adrogué H. E., Adrogué H. J. Acid-base physiology // Respir Care. 2001. Apr; 46 (4). Р. 328–341.
- Adrogué H. J., Madias N. E. Assessing Acid-Base Status: Physiologic Versus Physicochemical Approach // Kidney Dis. 2016. Nov; 68 (5). Р. 793–802.
- Todorovic J., Nešovic-Ostojic J., Milovanovic A. et al. The assessment of acid-base analysis: comparison of the «traditional» and the «modern» approaches // Med Glas (Zenica). 2015. Feb; 12 (1). Р. 7–18.
- Prakova G. Monitoring of acid-base status of workers at a methyl methacrylate and polymethyl methacrylate production plant in Bulgaria // RAIHA J (Fairfax, Va). 2003. Jan-Feb; 64 (1). Р. 11–16.
- Manz F. History of nutrition and acid-base physiology // Eur J Nutr. 2001. Oct; 40 (5). P. 189–199.
- Greenhaff P. L., Gleeson M., Maughan R. J. The effects of dietary manipulation on blood acid-base status and the performance of high intensity exercise // Eur J Appl Physiol Occup Physiol. 1987. 56 (3). Р. 331–337.
- Greenhaff P. L., Gleeson M., Whiting P. H. et al. Dietary composition and acid-base status: limiting factors in the performance of maximal exercise in man? // Eur J Appl Physiol Occup Physiol. 1987. 56 (4). Р. 444–450.
- Remer T. Influence of nutrition on acid-base balance — metabolic aspects // Eur J Nutr. 2001. Oct; 40 (5). Р. 214–220.
- Remer T. Influence of diet on acid-base balance // Semin Dial. 2000, Jul-Aug; 13 (4): 221–226.
- Riond J. L. Animal nutrition and acid-base balance // Eur J Nutr. 2001 Oct; 40 (5): 245–254.
- Akter S., Eguchi M., Kurotani K. High dietary acid load is associated with increased prevalence of hypertension: the Furukawa Nutrition and Health Study // Nutrition. 2015 Feb; 31 (2): 298–303.
- СанПиН 2.1.4.10749–01 «Питьевая вода. Гигиенические требования к качеству воды».
- Malagelada J. R., Longstreth G. F., Summerskill W. H. et al. Measurement of Gastric Functions during Digestion of Ordinary Solid Meals in Man // Gastroenterology. 1976, 70 (2), 203–210.
- Hens B., Corsetti M., Brouwers J. et al. Gastrointestinal and Systemic Monitoring of Posaconazole in Humans After Fasted and Fed State Administration of a Solid Dispersion // J. Pharm. Sci. 2016, 105 (9), 2904–2912.
- Hunt J. N., Macdonald I. The Influence of Volume on Gastric Emptying // J. Physiol. 1954, 126 (3), 459–474.
- Rubbens J., Brouwers J., Wolfs K. et al. Ethanol Concentrations in the Human Gastrointestinal Tract after Intake of Alcoholic Beverages // Eur. J. Pharm. Sci. 2016, 86, 91–95.
- Feinle C., Kunz P., Boesiger P. et al. Scintigraphic Validation of a Magnetic Resonance Imaging Method to Study Gastric Emptying of a Solid Meal in Humans // Gut. 1999, 44 (1), 106–111.
- Coupe A. J., Davis S. S., Evans D. F. et al. Do Pellet Formulations Empty from the Stomach with Food? // Int. J. Pharm. 1993, 92 (1), 167–175.
- Heading R. C., Nimmo J., Prescott L. F. et al. The Dependence of Paracetamol Absorption on the Rate of Gastric Emptying // Br. J. Pharmacol. 1973, 47 (2), 415–421.
- Koziolek M., Grimm M., Garbacz G. et al. Intragastric Volume Changes after Intake of a High-Caloric, HighFat Standard Breakfast in Healthy Human Subjects Investigated by MRI // Mol. Pharmaceutics. 2014, 11 (5), 1632–1639.
- Mudie D. M., Murray K., Hoad, C. L. et al. Quantification of Gastrointestinal Liquid Volumes and Distribution Following a 240 mL Dose of Water in the Fasted State // Mol. Pharmaceutics. 2014, 11 (9), 3039–3047.
- Waldeyer H. W. Die Magenstraße. Sitzungsberichte der Koniglich — Preussischen Akademie der Wissenschaften; Verlag der Ko?niglich Preussischen Akademie der Wissenschaften: Berlin, 1908.
- Jefferson G. The Human Stomach and the Canalis Gastricus (Lewis) // J. Anat. Physiol. 1915, 49 (Part 2), 165–181.
- Baastrup C. I. Roentgenological Studies of the Inner Surface of the Stomach and of the Movements of the Gastic Contents // Acta Radiol. 1924, 3 (2–3), 180–204.
- Malagelada J. R., Go V. L., Summerskill W. H. Different gastric, pancreatic, and biliary responses to solid-liquid or homogenized meals // Dig. Dis. Sci. 1979, 24 (2), 101–110.
- Malagelada J. R. Quantification of gastric solid-liquid discrimination during digestion of ordinary meals // Gastroenterology. 1977, 72 (6), 1264–1267.
- Pal A., Brasseur J. G., Abrahamsson B. A stomach road or «Magenstrasse» for gastric emptying // J. Biomech. 2007, 40 (6), 1202–1210.
- Ferrua M. J., Singh R. P. Computational modelling of gastric digestion: current challenges and future directions // Curr. Opin. Food Sci. 2015, 4, 116–123.
- Grimm M., Scholz E., Koziolek M. et al. Gastric Water Emptying under Fed State Clinical Trial Conditions Is as Fast as under Fasted Conditions // Mol Pharm. 2017, Dec 4; 14 (12): 4262–4271.
- Bateman D. N. Effects of meal temperature and volume on the emptying of liquid from the human stomach // J Physiol. 1982, Oct; 331: 461–467.
- Ritschel W. A., Erni W. The influence of temperature of ingested fluid on stomach emptying time // Int J Clin Pharmacol Biopharm. 1977 Apr; 15 (4): 172–175.
- Park E. J., Ryoo K. K., Lee Y. B. et al. Protective effect of electrolyzed reduced water on the paraquat-induced oxidative damage of human lymphocyte DNA // J. Korean Soc. Appl. Biol. Chem. 2005, 48, 155–160.
- Hanaoka K., Sun D., Lawrence R. et al. The mechanism of the enhanced antioxidant effects against superoxide anion radicals of reduced water produced by electrolysis // Biophys Chem. 2004, Jan 1; 107 (1): 71–82.
- Shirahata S., Kabayama S., Nakano M. et al. Electrolyzed-reduced water scavenges active oxygen species and protects DNA from oxidative damage // Biochem Biophys Res Commun. 1997, May 8; 234 (1): 269–274.
- Lee M. Y., Kim Y. K., Ryoo K. K. et al. Electrolyzed-reduced water protects against oxidative damage to DNA, RNA, and protein // Appl Biochem Biotechnol. 2006, Nov; 135 (2): 133–144.
- Yanagihara T., Arai K., Miyamae K. et al. Electrolyzed hydrogen-saturated water for drinking use elicits an antioxidative effect: a feeding test with rats // Biosci Biotechnol Biochem. 2005, Oct; 69 (10): 1985–1987.
- Huang K. C., Lee K. T., Chien C. T. Reduced hemodialysis-induced oxidative stress in end-stage renal disease patients by electrolyzed reduced water // Kidney International. 2003, 64 (2), p. 704–714.
- Huang K. C., Yang C. C., Hsu S. P. et al. Electrolyzed-reduced water reduced hemodialysis-induced erythrocyte impairment in end-stage renal disease patients // Kidney Int. 2006, Jul; 70 (2): 391–398.
- Rubik B. Studies and observations on the health effects of drinking electrolyzed-reduced alkaline water // WIT Transactions on Ecology and The Environment. 2011. Vol. 153, 317–327.
- Landis G. N., Tower J. Superoxide dismutase evolution and life span regulation // Mech. Ageing Dev. 2005. Vol. 126, № 3. P. 365–379.
- Vorobjeva N. V. Selective stimulation of the growth of anaerobic microflora in the human intestinal tract by electrolyzed reducing water // Medical Hypotheses. 2005. 64 (3), p. 543–546,
- Wang Yu-Lian. Preliminary observation on changes of blood pressure, blood sugar and blood lipids after using alkaline ionized drinking water // Shanghai Journal of Preventive Medicin. 2001, 12.
- Jin D., Ryu S. H., Kim H. W. et al. Anti-diabetic effect of alkaline-reduced water on OLETF rats // Biosci Biotechnol Biochem. 2006, Jan; 70 (1): 31–37.
- Edy Siswantoro, Nasrul Hadi Purwanto, Sutomo Effectiveness of Alkali Water Consumption to Reduce Blood Sugar Levels in Diabetes Mellitus Type 2 // JDM. 2017, Nov, vol. 7, № 4, р. 249–264.
- Kim M. J., Kim H. K. Anti-diabetic effects of electrolyzed reduced water in streptozotocin-induced and genetic diabetic mice // Life Sci. 2006, Nov 10; 79 (24): 2288–2292.
- Kim M. J., Jung K. H., Uhm Y. K. et al. Preservative effect of electrolyzed reduced water on pancreatic beta-cell mass in diabetic db/db mice // Biol. Pharm. Bull. 2007, Feb; 30 (2): 234–236
- Li Y., Nishimura T., Teruya K. et al. Protective mechanism of reduced water against alloxan-induced pancreatic beta-cell damage: Scavenging effect against reactive oxygen species // Cytotechnology. 2002, vol. 40, № 1–3, p. 139–149.
- Oostenbrug G. S., Mensink R. P., Hardeman M. R. et al. Exercise performance, red blood cell deformability, and lipid peroxidation: effects of fish oil and vitamin E // J Appl Physiol. 1997, Sep; 83 (3): 746–752.
- Paik I. Y., Jeong M. H., Jin H. E. et al. Fluid replacement following dehydration reduces oxidative stress during recovery // Biochem Biophys Res Commun. 2009; 383 (1): 103–107.
- Baskurt O. K., Meiselman H. J. Blood rheology and hemodynamics. Semin Thromb Hemost. 2003; 29 (5): 435–450.
- Halliwell B., Gutteridge J. Free radicals in medicine and biology. Oxford: Clarendon, 1999.
- Nwose E. U., Jelinek H. F., Richards R. S., Kerr P. G. Erythrocyte oxidative stress in clinical management of diabetes and its cardiovascular complications // Br J Biomed Sci. 2007; 64 (1): 35–43.
- https://www.lvrach.ru/2003/04/4530251/.
- Azizova O. A., Aseichev A. V., Piryazev A. P. et al. Effects of oxidized fibrinogen on the functions of blood cells, blood clotting, and rheology // Bull Exp Biol Med. 2007, Sep; 144 (3): 397–407.
- Weidman J., Holsworth R. E. Jr., Brossman B. et al. Effect of electrolyzed high-pH alkaline water on blood viscosity in healthy adults // J Int Soc Sports Nutr. 2016, Nov 28; 13: 45.
- Chycki J., Zajac T., Maszczyk A. et al. The effect of mineral-based alkaline water on hydration status and the metabolic response to short-term anaerobic exercise // Biol Sport. 2017, Sep; 34 (3): 255–261.
- Heil D., Seifert J. Influence of bottled water on rehydration following a dehydrating bout of cycling exercise // J Int Soc Sports Nutr. 2009; 6 (Suppl 1): 1–2.
- Chycki J., Kurylas A., Maszczyk A. et al. Alkaline water improves exercise-induced metabolic acidosis and enhances anaerobic exercise performance in combat sport athletes // PLoS One. 2018, Nov 19; 13 (11).
Е. А. Хохлова, доктор медицинских наук
ООО «Медицинский центр «Август», Чебоксары
Контактная информация: helenkhokhlova@rambler.ru
DOI: 10.26295/OS.2019.16.75.011
Питьевая щелочная вода – насколько благотворно ее влияние на организм? Обзор литературы/ Е. А. Хохлова
Для цитирования: Лечащий врач № 6/2019; Номера страниц в выпуске: 44-49
Теги: физические нагрузки, кислотно-щелочной баланс, диабет
Ацидоз и алкалоз – это термины, используемые для описания ненормальной ситуации, вызванной избытком кислот или щелочей (оснований) в крови. Этот дисбаланс вызван рядом состояний или заболеваний.
Что такое ацидоз и алкалоз
Чтобы обеспечить нормальное функционирование метаболических процессов и снабжение тканей достаточным количеством кислорода, нормальный pH крови должен поддерживаться в узком диапазоне 7,36-7,44.
- Ацидоз — это состояние с избытком кислот в крови, что приводит к падению pH крови ниже 7,36.
- Алкалозом называют избыток оснований в крови с последующим повышением pH крови выше 7,44.
Повлиять на регулирование pH крови и привести к тому, что pH крови окажется за пределами диапазона здоровых людей могут многие состояния и заболевания. Равновесие можно восстановить, увеличив выведение и / или уменьшив потребление этих веществ.
Причины развития ацидоза и алкалоза
Во время метаболизма образуется большое количество кислот, которые необходимо нейтрализовать и / или удалить, чтобы поддерживать нормальный pH. Например, угольная кислота, образующаяся из двуокиси углерода (CO 2) и воды. Углекислый газ образуется в организме в процессе метаболизма глюкозы и жиров. Также образуются меньшие количества молочной кислоты (лактата), кетокислот и других органических кислот.
Основными органами, участвующими в поддержании pH крови, являются легкие и почки.
- Легкие избавляют организм от кислот, за счет выдыхания CO2. По мере того как частота дыхания увеличивается или уменьшается, количество выдыхаемого CO 2 изменяется, что может изменить pH крови в считанные секунды или минуты.
- Почки выводят кислоты с мочой и влияют на концентрацию бикарбонатов (бикарбонатов, HCO 3 -) в крови; они щелочные по природе. Изменения pH из-за увеличения или уменьшения концентрации HCO 3 – происходят намного медленнее, чем в случае CO 2, на это уходят часы или дни.
Оба процесса работают постоянно, и очень тщательно контролируют pH крови здоровых людей. Также помогают регулировать концентрацию кислот и оснований буферные системы, предотвращающие большие колебания pH. Основные буферы крови включают гемоглобин (в красных кровяных тельцах), белки плазмы, бикарбонаты и фосфаты.
Абсолютное количество кислот или оснований менее важно для изменения pH крови, чем баланс между ними.
Ацидоз может быть вызван повышенным образованием кислоты в организме, приемом веществ, которые могут метаболизироваться до кислот, снижением экскреции кислоты или, наоборот, увеличением потерь оснований.
Алкалоз может возникать в результате изменений концентрации электролитов, таких как продолжительная рвота или сильное обезвоживание во время приема или потребления щелочей и гипервентиляции (с повышенным выделением кислот в форме CO 2). Любое заболевание или состояние, которое влияет на легкие, почки, метаболизм или дыхание, может вызывать ацидоз или алкалоз.
Нарушения кислотно-щелочного баланса делятся на две основные группы:
- Нарушения, влияющие на дыхание и приводящие к изменению уровня CO2, называются респираторным ацидозом (низкий pH) и респираторным алкалозом (высоким pH). Респираторные нарушения кислотно-щелочного баланса обычно вызваны заболеваниями легких или состояниями, влияющими на нормальное дыхание.
- Расстройства, которые изменяют концентрацию HCO3 – называются метаболическим ацидозом (низкий рН) и метаболический алкалоз (высокий рН). Метаболические нарушения кислотно-щелочного баланса могут быть вызваны заболеванием почек, изменением уровня электролитов, сильной рвотой или диареей, приемом некоторых лекарств или ядов, а также заболеваниями, влияющими на нормальный обмен веществ (например, сахарный диабет).
Симптомы
Ацидоз может не сопровождаться какими-либо симптомами или может сопровождаться неспецифическими симптомами, такими как усталость, тошнота и рвота. Острый ацидоз также может вызывать учащение и глубину дыхания, спутанность сознания и головную боль, а также может привести к потере сознания, коме и, в некоторых случаях, к смерти.
Симптомы алкалоза часто связаны с потерей калия (K +) и могут включать раздражительность, слабость и судороги.
Распространенные причины кислотно-щелочного дисбаланса
Респираторный ацидоз. Снижение экскреции CO2:
- снижение дыхания (гиповентиляция) из-за лекарств или нарушений центральной нервной системы;
- респираторный дистресс из-за травмы или из-за наличия воздуха между легкими и грудной стенкой (пневмоторакс);
- заболевания дыхательных мышц или нервов (миастения, ботулизм, боковой амиотрофический склероз (БАС), синдром Гийена-Барре);
- обструкция дыхательных путей (пища или инородное тело);
- заболевание легких.
Респираторный алкалоз. Повышенная экскреция CO2:
- учащенное дыхание (гипервентиляция) при страхе, боли, шоке;
- лекарства (например, при передозировке аспирином);
- пневмония, застой в легких или тромбоэмболия легочной артерии;
- перегрузка, лихорадка;
- опухоли, травмы или инфекции (менингит, энцефалит) центральной нервной системы;
- печеночная недостаточность.
Метаболический ацидоз. Снижение HCO 3 из-за потери HCO 3 или увеличения производства кислоты:
- алкогольный кетоацидоз;
- диабетический кетоацидоз;
- почечная недостаточность;
- лактоацидоз (обычно при недостатке кислорода в тканях);
- отравление – передозировка салицилатами (аспирин), метанолом, этиленгликолем;
- потеря бикарбонатов пищеварительным трактом, например, при длительной диарее;
- неспособность почек производить кислую мочу.
Метаболический алкалоз. Повышенный уровень HCO 3 – из-за потери кислоты или приема бикарбоната:
- диуретики;
- длительная рвота;
- сильное обезвоживание;
- прием бикарбонатов, прием щелочных веществ внутрь.
Диагностика
Цель обследования – выяснить, есть ли у обследуемого кислотно-щелочной дисбаланс, определить, насколько сложно это расстройство, чтобы помочь диагностировать основное заболевание или состояние (например, диабетический кетоацидоз, отравление и т. д.).
Вызвавшее расстройство. Обследование также проводится при наблюдении за тяжелобольными пациентами, а также в условиях, которые, как мы знаем, влияют на кислотно-щелочной баланс, например, при хронических заболеваниях легких или почек.
Основные тесты, используемые для выявления, оценки и мониторинга кислотно-щелочного дисбаланса:
- газы крови;
- анализ на электролиты.
Газы крови – это группа тестов, выполняемых вместе, обычно на основе образца артериальной крови (кровь, полученная из артерии, а не вены). Они отображают pH, pO2 (количество кислорода) и pCO2 (количество углекислого газа) в крови. По этим результатам можно рассчитать концентрацию бикарбонатов (HCO 3 -).
Для большинства случаев кислотно-щелочного дисбаланса значения HCO3 – и I pCO2 выходят за пределы допустимого диапазона. Это связано с тем, что организм пытается поддерживать уровень pH крови близким к норме. Следовательно, если одно из этих веществ является аномально высоким или низким, концентрация другого изменится в том же направлении, чтобы вернуть pH крови к норме. Этот процесс называется компенсацией. В таблице ниже показаны ожидаемые значения для каждого из четырех основных кислотно-щелочных дисбалансов.
Значения наблюдаются при четырех основных нарушениях кислотно-щелочного баланса:
| Ошибка ABR | pH | HCO 3 – | pCO 2 | Компенсация деятельности организма |
| Метаболический ацидоз | <7,36 | Низкий | Низкий | Увеличение частоты дыхания (гипервентиляция) для снижения CO 2 |
| Метаболический алкалоз | > 7,44 | Высокая | Высокая | Медленное дыхание (гиповентиляция) для увеличения выведения CO 2. |
| Респираторный ацидоз | <7,36 | Высокая | Высокая | Почки задерживают HCO 3 – и увеличивают выведение кислоты. |
| Респираторный алкалоз | > 7,44 | Низкий | Низкий | Почки уменьшают всасывание HCO 3 – и выведение кислот |
Электролиты представляют собой четыре теста: Na + (натрий, натрий), K + (калий, калий), Cl – (хлориды) и бикарбонаты (HCO 3 -), которые обычно рассчитываются по pH и CO2. Содержание жидкости в организме, концентрация электролитов и кислотно-щелочной баланс взаимосвязаны; при кислотно-щелочном дисбалансе концентрация одного или нескольких электролитов обычно повышается или понижается.
У пациентов с метаболическим ацидозом так называемая анионная щель рассчитывается с использованием концентраций электролитов; помогает узнать, какие нарушения могут быть причиной нарушения кислотно-щелочного баланса. Например, увеличение анионной щели указывает на ацидоз, например, диабетический.
Пациенты с метаболическим алкалозом обычно имеют низкие уровни хлорида (Cl -) и калия (K +), что снова является ориентиром для выявления причины кислотно-щелочного дисбаланса. На основании этих результатов могут потребоваться дополнительные тесты для выявления заболевания или состояния, вызывающего ацидоз или алкалоз (например, глюкоза, лактат, кетоновые тела, осмоляльность, метанол, этиленгликоль, токсикологические тесты на передозировку некоторыми лекарствами, индикаторы сепсиса и т. д.).
Бывает, что у пациента одновременно наблюдается более одного кислотно-щелочного дисбаланса. Примерами являются прием аспирина (который может вызвать как респираторный алкалоз, так и метаболический ацидоз) или люди с заболеваниями легких, принимающие диуретики (респираторный ацидоз плюс метаболический алкалоз). Используя номограммы для расчета ожидаемой степени компенсации, можно определить, присутствует ли смешанный кислотно-щелочной дисбаланс.
Лечение
Лечение ацидоза и алкалоза включает выявление и устранение причины, вызвавшей расстройство. Пациенту необходимо оказать необходимую поддержку. В большинстве случаев повышенный или пониженный pH не лечится напрямую. Однако в некоторых случаях врачи могут ввести в вену HCO3 – людям с опасно низким pH крови.
Источники: Статья «Ацидоз и алкалоз» на американском сайте Lab Tests Online; БЕРТИС, Калифорния, ЭШВУД, Эр., Брунс, Делавэр, (ред.), Учебник Тиц по клинической химии и молекулярной диагностике. 4-е издание Луи: Эльзевье-Сондерс, 2006; JABOR, A. et al .: Внутренняя среда. Praha: Grada Pulbishing, 2008; Kasper, DL., Braunwald, E., Fauci, AS., Hauser, SL, Longo, DL., Jameson, JL. (ред.) «Принципы внутренней медицины» Харрисона, 16-е издание, 2005.

Основные сведения о кислотно-щелочном балансе
Большинство из нас не до конца понимает, что такое кислотно-щелочной баланс, и тем более не осознает всю серьезность последствий его нарушения.
Кислотно-щелочной баланс – это состояние, в котором поддерживается определенное соотношение катионов и анионов (положительно и отрицательно заряженных ионов), содержащихся в жидкостях организма. Кислоты – это химические соединения, которые содержат положительно заряженные ионы водорода. Основания – это соединения с отрицательно заряженными ионами гидроксильных групп. Основания могут быть растворимыми и нерастворимыми. Те, которые способны растворяться в воде, принято называть щелочью. Кислоты и основания являются неотъемлемой частью нормального функционирования человеческого организма.
Что такое дисбаланс щелочей и кислот
Кислотно-щелочной баланс играет фундаментальную роль в функционировании всех клеток и органов организма человека, измеряется показателем кислотно-щелочного равновесия (рН), и его нарушение приводит к серьезным сбоям в работе всего организма.
Содержание:
- Основные сведения о кислотно-щелочном балансе
- Что такое дисбаланс щелочей и кислот
- Регуляторные системы организма
- Причины кислотно-щелочного дисбаланса
- Разновидности кислотно-щелочного дисбаланса
- Чем опасен кислотно-щелочной дисбаланс
- Последствия закисления организма
- Как поддержать кислотно-щелочной баланс
- Как определить pH организма
- Таблица нормального значения pH разных жидкостей и тканей организма
Обычно внутри клеток поддерживается стабильный ионный состав. Определенная концентрация компонентов содержится и во внеклеточной жидкости, а также в других жидкостях организма. Когда их химические характеристики нарушаются, говорят о кислотно-щелочном дисбалансе. Часто такой дисбаланс приводит к тому, что среда становится либо слишком кислой, либо чрезмерно щелочной. Такое случается, если в результате ферментативных реакций в организме производится чрезмерное количество кислот или оснований.
Баланс кислот и щелочей достигается, когда pH крови находится в пределах 7,35-7,45. Более высокий показатель pH крови указывает на преобладание в ней щелочных компонентов, более низкий – доминирование кислот. Опасный для организма дисбаланс возникает, когда pH крови опускается ниже показателя 6,8 или превышает 7,8. В таких случаях происходит денатурация белков (меняется их молекула), клеточные ферменты перестают функционировать, нарушается дыхательный газообмен. Кислотно-щелочной дисбаланс может проявляться как ацидоз или алкалоз. Оба эти состояния опасны для жизни, но о них более детально поговорим немного ниже.
Регуляторные системы организма

За поддержание уровня pH в диапазоне нормы главным образом отвечают почки и печень. Эти органы, вместе с буферной системой крови, пищеварительным трактом и скелетом являются неотъемлемым механизмом нейтрализации возможных кислотно-щелочных нарушений. Если функция почек нарушается, это может привести к снижению pH организма, а затем – к стойкому ацидозу. Что касается печени, то ее функция состоит в расщеплении жирных кислот, метаболиты которых затем выводятся почками.
Легкие являются второй важной системой, необходимой для поддержания кислотности в диапазоне нормы. Во время дыхания человек выдыхает углекислый газ, повышенная концентрация которого в крови вызывает снижение кислотности. Работа дыхательной системы, регулирующей уровень углекислого газа, основана на гипер- или гиповентиляции. В первом случае речь идет о чрезмерной вентиляции легких, во втором – о недостаточной. При гиповентиляции может возникать нарушение pH в виде респираторного ацидоза. Если вентиляция легких, наоборот, чрезмерная, то возможен респираторный алкалоз, при нарушении функции легких по какой-либо причине, функцию по нейтрализации pH выполняют почки – вместе с мочой выводят из организма кислоты.
Что касается буферной системы крови, то в процессе поддержания кислотно-щелочного баланса, она имеет одну очень важную особенность. Добавление к ней кислот или оснований кардинальным образом не меняет ее собственный pH, но в зависимости от ситуации буферная кровь может стать «донором» «кислых» ионов водорода.
Кишечный тракт принимает участие в очищении организма. Но в некоторых случаях пищеварительная система может стать причиной нарушения кислотно-щелочного баланса. Такое может происходить в случае сильной длительной диареи, в процессе которой из организма интенсивно выводятся ионы бикарбоната, отвечающие за щелочность среды.
Кости – самая большая буферная система для хранения основных минералов. Доступ к этому резерву организм может получить в любое время, когда возникает на это потребность. Щелочи из костных «запасников» используются, когда необходимо нейтрализовать лишнюю кислоту в организме. Но если повышенная кислотность сохраняется в течение продолжительного времени, это может привести к чрезмерному вымыванию из костной ткани бикарбонатных минералов. В итоге это негативно влияет на плотность и массу костей, становится причиной частых переломов и болезней опорно-двигательного аппарата.
Еще одна важная буферная система – это соединительные и мышечные ткани, в которых временно хранятся избытки кислот. Регуляторные функции выполняет также кожа, когда вместе с потом выводится лишняя кислота, в крови содержатся бикарбонаты, которые могут связываться с кислотами для их нейтрализации.
Причины кислотно-щелочного дисбаланса

- дегидратация;
- употребление кислой пищи;
- высокобелковая диета при отсутствии достаточного количества углеводов;
- злоупотребление алкоголем и напитками с кофеином;
- курение;
- наркотики;
- прием некоторых лекарств, в том числе диуретиков;
- загрязнение воздуха и воды;
- химикаты в продуктах личной гигиены;
- плохая экология;
- частое использование бытовой химии;
- эмоциональное потрясение;
- недостаток сна;
- чрезмерная физическая нагрузка;
- тяжелое инфекционное заболевание;
- нарушение работы буферных систем;
- хронические заболевания почек, диабет.
Разновидности кислотно-щелочного дисбаланса
Кислотно-щелочной дисбаланс может проявляться в виде алкалоза – когда повышается количество щелочных веществ в жидкостях, или ацидоза – когда повышается уровень кислот. В свою очередь эти процессы могут проявляться как:
- метаболический ацидоз;
- респираторный ацидоз;
- метаболический алкалоз;
- респираторный алкалоз.
Метаболический ацидоз

К повышенной выработке в организме кислот приводят следующие факторы:
- злоупотребление пищей, богатой животными белками;
- чрезмерные физические нагрузки;
- стресс;
- воспалительные процессы;
- соблюдение низкоуглеводной диеты.
Сами по себе эти факторы не являются опасными для человека, но если они сохраняются длительно, риск ацидоза повышается.
Признаки метаболического ацидоза довольно расплывчаты и неспецифичны. Они могут включать такие симптомы как хроническая усталость, слабость, снижение массы и плотности костной ткани, а также проблемы с кожей, ногтями и пищеварением. Нарушение кислотно-щелочного баланса в сторону повышения кислотности также может повлиять на функционирование периферической и центральной нервной системы, вызывая «затуманенность» мозга, беспокойство, мышечные спазмы.
Респираторный ацидоз
Респираторный ацидоз развивается из-за неспособности легких выводить избыток углекислого газа из организма. Во многом признаки нарушения схожи с метаболическим ацидозом.
Эта разновидность кислотно-щелочного дисбаланса может появляться на фоне приема некоторых препаратов, после травмы грудной клетки или обструкции дыхательных путей. Специфический симптом – замедленное и поверхностное дыхание больного.
Причины ацидоза
Кислотно-щелочной дисбаланс, проявляющийся ацидозом, может появляться в силу разных факторов и нести с собой опасные клинические последствия. Как правило, кислотность организма повышается в результате нарушения работы органов, призванных регулировать pH. Чаще всего такое случается на фоне некоторых заболеваний, таких как:
- почечная недостаточность;
- нарушение дыхательной функции, например, при хронической обструктивной болезни легких или сердечной недостаточности;
- сахарный диабет, при котором развивается кетоацидоз;
- хроническая диарея;
- гипоксия, в ходе которой развивается лактоацидоз;
- отравление алкоголем, салицилатами, этиленгликолем.
Метаболический алкалоз

Такое состояние обычно связывают с передозировкой бикарбоната натрия, употреблением наркотиков, сильным обезвоживанием, вызванным в том числе продолжительной рвотой, диареей.
Респираторный алкалоз
Это патологическое повышение в организме щелочей, вызванное усиленным выведением углекислого газа. Респираторный алкалоз может случаться из-за гипервентиляции легких, а также бывает у пациентов после болевого шока. Иногда причиной этого нарушения служат чрезмерная физическая нагрузка, лихорадка, некоторые легочные заболевания (пневмония, бронхит, астма, ХОБЛ). В некоторых случаях может развиться после длительного приема лекарственных препаратов.
Причины алкалоза
Причиной алкалоза чаще всего является дефицит калия и/или водорода. Такое возможно в случае:
- применения глюкокортикостероидов, которые вызывают снижение концентрации калия и повышение натрия в сыворотке крови;
- чрезмерной потери «кислых» ионов водорода (например, в результате продолжительной и сильной рвоты);
- вымывания калия после приема диуретиков;
- гипервентиляции легких, в ходе которой уменьшается концентрация двуокиси углерода, ответственного за «кислотность».
Чем опасен кислотно-щелочной дисбаланс
Когда в организме возникают системные нарушения электролитов, это создает неблагоприятное воздействие на сердечно-сосудистую и нервную системы.
Повышение щелочной составляющей вызывает:
- снижение уровня электролитов в сыворотке крови;
- сердечную аритмию;
- судороги (иногда напоминают приступ эпилепсии);
- онемение и спазм кистей рук (так называемый синдром «руки акушера» – из-за характерного положения кистей);
- судороги век и светобоязнь;
- стенокардию (сокращение коронарных артерий);
- спазм брыжеечных артерий (вызывает боль в животе);
- спазм дыхательных путей (гортани, бронхов), вызывающий одышку;
- спазм сосудов головного мозга (проявляется как мигрень);
- сокращение периферических сосудов рук и ног (вызывает симптом Рейно).
Чрезмерно повышенная кислотность вызывает:
- интенсификацию глюконеогенеза (усиленное производство глюкозы в печени);
- липолиз (распад жировой ткани);
- катаболизм (распад) белков;
- нарушение сердечного ритма;
- слабость скелетных мышц;
- кислое дыхание.
Последствия закисления организма

Избыток кислоты в организме может стать причиной разных проблем со здоровьем:
- со стороны желудочно-кишечного тракта это острое или хроническое воспаление слизистой оболочки желудка, кишечный микоз, запор, проблемы с пищеварением, вздутие живота, заболевания желчного пузыря;
- со стороны мышц и суставов – подагра, мышечные боли, повреждение межпозвонковых дисков, острые и хронические боли в спине, остеопороз, артрит, ревматоидные заболевания;
- выпадение волос, ломкость ногтей, разрушение зубов, пародонтоз, сухость кожи, грибковые инфекции, прыщи, проблемы с кожей, целлюлит;
- со стороны метаболической системы это избыточный вес, внезапная потребность сладкого, сахарный диабет, камни в почках, повышенный уровень холестерина;
- со стороны сердечно-сосудистой системы это гипертония, заболевания кровеносных сосудов, нарушение кровоснабжения рук и ног, вызывающие ощущение холода в конечностях, головокружение, мигрень, инфаркт миокарда;
- хронические боли, депрессия, снижение работоспособности, общее недомогание, неспособность справиться со стрессом, снижение либидо, быстрая утомляемость.
Как поддержать кислотно-щелочной баланс
Чтобы вывести организм из состояния хронического ацидоза и восстановить кислотно-щелочной баланс, потребуется немного времени и некоторые изменения в образе жизни.
Диета
В то время как животные белки в ходе метаболизма превращаются в кислоты, фрукты и овощи метаболизируются в основания. Поэтому растительная пища является лучшим натуральным средством против повышенной кислотности организма. Кроме того, фрукты и овощи обладают противовоспалительными свойствами, что также немаловажно в программе восстановления кислотно-щелочного баланса. Еще один важный компонент здоровой диеты – вода. Обильное питье помогает поддержать работоспособность буферных систем.
Проанализировав современные популярные блюда, исследователи пришли к выводу, что в наши дни человек делает упор на продукты, повышающие кислотность организма. То есть современная диета ведет к закислению тканей и жидкостей, что, в свою очередь, весьма негативно сказывается на здоровье. Даже сравнительно небольшое повышение уровня кислоты, которое еще нельзя называть ацидозом, уже является вредным. Избыток кислот в организме вызывает старение тканей, ранние морщины, отеки и воспаления. На культурах опухолевых клеток показано, что они лучше растут в кислой среде.

«Кислотные» продукты:
- перловая крупа;
- овсянка;
- рис;
- макароны;
- свинина;
- говядина;
- яйца;
- сыр.
Подщелачивающие продукты:
- молоко;
- свекла;
- картофель;
- морковь;
- помидоры;
- салат;
- огурцы;
- капуста;
- черная смородина;
- вишня;
- груши;
- клубника.
Полезные минералы
Употребление минералов помогает поддерживать кислотно-щелочной баланс, а также работоспособность буферных систем. В случае нарушения pH-баланса минеральные вещества помогают организму быстрее вернуть равновесие.
Одним из наиболее полезных для правильной буферизации считается цинк. Кроме того, он улучшает состояние кожи, ногтей, костей, укрепляет иммунную систему. Состояние иммунной системы крайне важно для лиц с кислотно-щелочным дисбалансом. Не менее полезные минералы при разбалансированном pH – кальций и магний. Кальций способствует укреплению костей, поддерживая их плотность и структуру, а магний благотворно влияет на нервную и мышечную системы.
Физический упражнения и отдых
Умеренная физическая активность положительно влияет на весь организм. Упражнения способствуют движению жидкостей и лимфы, что помогает выводить токсины и метаболиты. Кроме того, правильное сочетание физической активности и отдыха способствует уменьшению стресса. Но достаточно переусердствовать с занятиями спортом или тяжелой физической работой, как в тканях в избытке вырабатывается молочная кислота. В таком случае упражнения становятся фактором риска развития лактоацидоза и повышенной кислотности организма. Поэтому после интенсивных тренировок важно давать телу отдых. Это помогает расслабиться и предотвращает накопление лишних кислот.
Как определить pH организма
- Коронавирусы: SARS-CoV-2 (COVID-19)
- Антибиотики для профилактики и лечения COVID-19: на сколько эффективны
- Самые распространенные «офисные» болезни
- Убивает ли водка коронавирус
- Как остаться живым на наших дорогах?
Самый простой способ определить pH – с помощью тест-полосок для оценки кислотности мочи. Тест проводят с использованием первой утренней мочи. В идеале полоска должна выдать результат в диапазоне 7-8,5. Но надо понимать, что такое тестирование покажет только приблизительный результат и не объяснит, что является причиной ацидоза или алкалоза.
Также определить pH можно путем лабораторного исследования крови. Нормальный pH крови колеблется в диапазоне от 7,35 до 7,45. Если показатель ниже 7,35 – говорят об ацидозе, выше 7,45 – это признак алкалоза. Для получения более полной картины состояния здоровья пациента, помимо самого значения pH, важно определить концентрацию в его организме бикарбонат-ионов и количество углекислого газа.
Оценка pH слюны с применением тест-полосок может дать представление об общем состоянии здоровья. Результаты этого теста показывают щелочные запасы организма, а также внутриклеточный pH. Чтобы получить наиболее точные результаты, тест следует делать сразу после сна (при этом сон должен длится не менее 5 часов), до еды и чистки зубов. Если человек здоровый, тест выдаст результат 6,8 (сразу после пробуждения). Если тест делать немного позже, но до употребления пищи, результат должен быть 7, а после завтрака – 8,5.
Таблица нормального значения pH разных жидкостей и тканей организма
| Жидкости и ткани | pH |
|---|---|
| Кровь | 7,35-7,45 |
| Внутриклеточная жидкость | 7,4 |
| Внеклеточная жидкость | 7,2 |
| Желудочный сок | 1,5-1,8 |
| Предел кислотной экскреции почек | 4-4,4 |
| Моча | 4-8 |
| Сердечная мышца | 6,9 |
| Слюна | 6,5-7 |
| Соединительная ткань | 7,1-7,25 |
| Панкреатические соки | 8,3 |
| Амниотическая жидкость (околоплодные воды) | 8,5 |
| Желчь | 8,8 |
Кислотно-щелочной дисбаланс – это всегда нарушение функционирования клеток и органов. Насколько серьезными могут быть последствия, зависит от времени и степени разбалансированности системы поддержки баланса кислот и щелочей в организме.
При ухудшении общего состояния и самочувствия необходимо определять pH крови в комплексе обследования организма.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Извозчикова Нина Владиславовна
Специальность: инфекционист, гастроэнтеролог, пульмонолог.
Общий стаж: 35 лет.
Образование: 1975-1982, 1ММИ, сан-гиг, высшая квалификация, врач-инфекционист.
Редактор статьи:
Момот Валентина Яковлевна
Физиология и нарушения кислотно-основного состояния (методические материалы к практическим и семинарским занятиям)
Категория:
КазМУНО (АГИУВ). Кафедра анестезиологии и реаниматологии
Информация
Физиология и нарушения кислотно-основного состояния
Методические материалы к практическим и семинарским занятиям
Физиология и нарушения кислотно-основного состояния. Методические материалы к практическим и семинарским занятиям, – 2011. -21 с.
Составители: к.м.н. Батырханова Н.М., ассистент Прмагамбетов Г.К., резидент Иманбекова К.Б., резидент Тлеубаев С.С., под редакцией доцента Чурсина В.В.
Справочное пособие содержит информацию о физиологии кислотно- основного состояния (КОС). Представлена информация о методах лабораторной диагностики нарушений КОС. Перечислены варианты нарушений и методы коррекции. Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
© Чурсин В.В., Батырханова Н.М., Прмагамбетов Г.К., Иманбекова К.Б., Тлеубаев С.С., 2011 г.
Физиология кислотно-основного состояния
В результате жизнедеятельности клетки в ней постоянно образуются кислоты, которые диссоциируют с освобождением очень активных ионов Н+. Часть этих ионов нейтрализуется буферной системной клетки, другая — буферными системами межклеточной жидкости и крови, а также при функционировании легких, почек, кишечника, печени и др.
Соотношение водородных и гидроксильных ионов во внутренней среде в значительной мере определяет интенсивность окислительно-восстановительных процессов, синтез и расщепление белков, жиров и углеводов, активность ферментов, проницаемость мембран, чувствительность к гормональным стимулам и др. Это соотношение выражается в интегральном показателе рН. Учитывая, что показатель рН часто встречается в медицинской литературе, мы дадим ему более подробную характеристику. Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода и концентрации гидроксильных групп.
Если концентрация Н+ > концентрации ОН— — рН кислая
Если концентрация Н+ = концентрации ОН— — рН нейтральная
Если концентрация Н+ < концентрации ОН— — рН щелочная
Эталон нормы – концентрация Н+ = 0,00000001 моль/л в 1 литре химически чистой воды при t0 250С. При этом рН будет нейтральной. Для удобства используют коэффициент рН. Термин «рН» представляет собой аббревиатуру от слов «puissance hydrogen» (puissance по-французски означает сила). Это мера активности или концентрации ионов водорода. рН определяют как отрицательный десятичный логарифм концентрации ионов водорода в моль/л:
pH=-Ig [H+] (конц. Н+) = 7,0
Из этого уравнения следует, что:
рН <7,0 — кислая среда
рН =7,0- нейтральная среда
рН >7,0 – щелочная среда
Для адекватного клеточного метаболизма требуется, чтобы уровень рН крови сохранялся в границах 7,35-7,45, несмотря на постоянную продукцию ионов водорода, которые понижают рН. Даже незначительные нарушения этих границ рН могут иметь неприятные последствия, а снижение рН менее 6,8 и повышение до 7,8 несовместимы с жизнью.
В некоторых случаях лаборатории предпочитают использовать показатель концентрации ионов водорода в нмоль/л, а не рН.
рН 7,4 = концентрация ионов водорода 40 нмоль/л;
рН 7,0 = концентрация ионов водорода 100 нмоль/л;
рН 6,0 = концентрация ионов водорода 1000 нмоль/л.
■ два этих параметра (рН и концентрация Н+) изменяются в противоположных направлениях — если концентрация ионов водорода возрастает, то рН снижается;
■ благодаря логарифмической природе шкалы незначительные изменения рН означают фактически очень существенные изменения концентрации ионов водорода. Например, удвоение концентрации ионов водорода соответствует снижению рН всего на 0,3 единицы.
Факторы, определяющие постоянство рН:
— продукция Н+ за счет катаболизма кислот
— дальнейшее преобразование и распределение кислот в организме
— выведение Н+ из организма
Продукция Н+ происходит в результате расщепления белков, жиров и углеводов. У взрослого человека за сутки вырабатывается 20000 — 22000 ммоль Н+. При перерасчете на НС1 это составит 2 -2,5 л.
В организме продуцируется два вида кислот:
— Н2С03 угольная кислота — летучая кислота, которая выводится через легкие — (слабая кислота, т.к. плохо диссоциирует),
— нелетучие кислоты – H3P04 и Н2SО4 — не выводятся через легкие, но выводятся почками (сильные кислоты, т.к. хорошо диссоциируют).
В норме сильных кислот образуется 50 – 100 ммоль/сутки. При избыточном образовании они вызывают тяжелые нарушения. Это происходит при анаэробном окислении глюкозы.
В норме окисление глюкозы происходит аэробно: С6Н12О2 + 6О2 = 6Н2О + 6СО2 + 38 АТФ
При патологии глюкоза окисляется анаэробно: С6Н12О2 = 2СН2 + 2СН(ОН)СООН + 2 АТФ
В результате образуется избыток кислот и дефицит энергии.
Преобразование и распределение кислот в организме происходит за счет:
-разведения (пассивного механизма);
-действия буферных систем.
Чтобы понять принцип работы химических буферных систем необходимо
разобрать:
Что такое кислоты и основания?
Кислота — это вещество, которое диссоциирует в растворе с высвобождением ионов водорода. Основания (щелочи) присоединяют ионы водорода.
Например, соляная кислота (НС1) диссоциирует на ионы водорода и ионы хлора:
НС1 ↔ Н++Сl—
тогда как бикарбонат (НС03), являющийся основанием, захватывает ион водорода, образуя угольную кислоту:
НСОз + Н+ ↔ Н2С03
Сильные кислоты, такие как соляная, диссоциируют легко, освобождая большое количество водородных ионов, т. е. они имеют очень низкое значение рН. Слабые кислоты диссоциируют хуже, поэтому высвобождается меньше ионов водорода, т. е. они имеют более высокие значения рН, чем сильные кислоты. Иными словами сила кислоты определяется способностью к диссоциации, т.е. степенью, с которой реакция смещается вправо. Водород проявляет кислотные свойства только в ионной форме.
Буферы — это растворы химических композиций, которые способны сглаживать изменения рН, вызываемые добавлением кислоты, при помощи нейтрализации образующихся ионов водорода. Буфер состоит из основания и какой-либо слабой кислоты. Попадание в плазму сильной кислоты вызывает реакцию буферных систем, в результате которой сильная кислота превращается в слабую. То же происходит и при действии на биологические жидкости сильного основания, которое после взаимодействия с буферными системами превращается в слабое основание. В результате указанных процессов изменения рН либо не наступают, либо бывают минимальными.
Бикарбонаты обеспечивают 53% буферной способности крови, небикарбонатные системы — 47%: гемоглобиновый буфер (35%), протеиновый (7%) и фосфатный (5%). Кровь составляет только 1/5 общей буферной ёмкости организма.
1. Бикарбонатная
2. Фосфатная
3. Гемоглобиновая
4. Белковая
Бикарбонатный буфер состоит из угольной кислоты и бикарбоната, в соотношении 1:20
Основная роль данного буфера это перевод сильной кислоты в слабую, сильного основания в слабое:
NаОН + H 2C03 ↔ NаHC03 + Н2О
НСl + NаHC03 ↔ Nа Сl+ H 2C03
↓
С02 + Н2О
Система утрачивает буферные свойства при рН= 6,1, когда соотношение H 2C03 / NаHC03 = 1 /1
Происхождение бикарбонатной буферной системы тесно связано с метаболизмом органического углерода, поскольку конечным продуктом его является СО2 или НСО3— .
Бикарбонатный буфер – главная и единственная система внеклеточной жидкости.
Участие бикарбонатного буфера в выведении H+:
Кислород из вдыхаемого воздуха диффундирует через альвеолы в легкие и соединяется с гемоглобином, который, проявляя буферные свойства, высвобождает ионы водорода:
Освободившиеся ионы водорода буферируются бикарбонатом с образованием угольной кислоты, которая превращается в углекислый газ и воду:
H+ + HC03 ↔ Н2СО3 ↔ С02 + Н2О
Углекислый газ диффундирует из крови в альвеолы и выводится из организма с выдыхаемым воздухом.
Фосфатная буферная система (1% буферной емкости крови) состоит из фосфорнокислых солей: кислотная часть представлена в виде однозамещенного фосфата натрия NaH2P04, а основная часть представлена двузамещенным фосфатом натрия — Na2HP04. Одноосновные фосфатные соли являются слабыми кислотами, а двухосновные соли имеют ясно выраженную щелочную реакцию.
NaH2P04 / Na2HP04 = 1/4 при рН=7,4
Принцип действия фосфатного буфера аналогичен карбонатному. Непосредственная роль фосфатного буфера в крови небольшая, но ему принадлежит значительная роль в конечной регуляции кислотно-основного гомеостаза и регуляции активной реакции тканей. В крови действие этого буфера сводится к поддержанию и воспроизводству бикарбонатного буфера.
При увеличении в крови кислот и образовании Н2С03 происходит обменная реакция:
H++HC03— + Na2HP04 = NaHC03 + NaH2P04
Избыток Н2С03 ликвидируется, а концентрация НС03 — увеличивается.
Таким образом, удерживается соотношение Н2С03/ NaHCO3= l:20 на постоянном уровне.
02НЬ – слабое основание
С02 – слабая кислота
Участие легких в кислотно-основном равновесии состоит в поддержании содержания углекислого газа (С02) в крови. Нормальное количество С02 в крови отражает равновесие между его продукцией в процессе клеточного обмена и выведением легкими с выдыхаемым воздухом. Последовательность событий от продукции С02 в тканях до его элиминации при выдохе выглядит следующим образом (рис. 1):
■ 1. С02 диффундирует из тканей (с высоким содержанием С02) в кровь.
■ 2.В эритроцитах крови С02 превращается в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует с образованием бикарбоната и ионов водорода:
С02+ Н20 ↔ Н2С03 ↔ НСО3 — + Н+
■ 3. Так как концентрация бикарбоната растет, часть его диффундирует из эритроцитов в плазму. Ионы водорода (которые, если позволить им накопиться, могут вызвать сильное снижение рН) связываются, с гемоглобином, который освобождается от принесенного кислорода в тканях (гемоглобин в данном случае действует как буфер).
Н+ + 02НЬ ↔ Н+НЬ + 02
■ 4. Когда кровь насыщена кислородом. Кислород из вдыхаемого воздуха диффундирует через альвеолы легких и соединяется с гемоглобином, который, проявляя буферные свойства, высвобождает ионы водорода.
02 + Н+НЬ ↔ Н+ + 02НЬ
■ 5. Освободившиеся ионы водорода буферируются бикарбонатом с образованием угольной кислоты, которая превращается в С02 и воду:
Н+ + НС03— ↔ H2C03 ↔ Н20 + С02
■ 6.С02 диффундирует из крови, где он находится в высокой концентрации, в альвеолы, где концентрация мала, и выводится из организма с выдыхаемым воздухом.
Рис. 1. Доставка 02 к тканям и первые стадии элиминации CO2
Рис. 2. В легких бикарбонат снова превращается в С02 и выводится
Транспорт кислорода из легких к тканям и из тканей к легким обусловлен изменениями, которые воздействуют на сродство кислорода к гемоглобину. На уровне тканей из-за снижения рН это сродство уменьшается (эффект Бора) и вследствие этого улучшается отдача кислорода. В крови легочных капилляров сродство гемоглобина к кислороду увеличивается из-за снижения рС02 и возрастания рН по сравнению с аналогичными показателями венозной крови, что приводит к повышению насыщения артериальной крови кислородом.
Белки плазмы крови – амфолиты – обладают свойствами кислот. Они составляют большую часть пула анионов плазмы. Изменение содержания альбуминов, протеинов и аномальных белков плазмы оказывает существенное влияние на величину анионной разницы.
Если в крови много Н+, то белки их связывают:
R-CООН + Н+→ R-CООН2
Если в крови много ОН—, то белки отдают Н+ и образуется вода:
R-CООН + ОН—→ R-CОО + Н2О
Выведение Н+ из организма
Почки
Нейтрализация и секреция ионов водорода происходит в результате их обмена с натрием в буферах первичной мочи. Бикарбонатные ионы, которые остаются после выхода Н+ в канальцевую мочу, реабсорбируются в кровь, повышая ее буферную способность. Процесс выведения эпителием почечных канальцев ионов Н+ происходит одновременно с реабсорбцией эквивалентного количества ионов Nа+.
При усиленном выделении почками кислот на уровне дистальных канальцев и собирательных трубок включается механизм аммониогенеза.
Аммиак (NН3) с одной стороны обеспечивает связывание Н+, с другой стороны – выведение анионов сильных кислот в виде аммонийных солей, в составе которых ионы Н+ не оказывают повреждающего действия на эпителий канальцев. Реабсорбция натрия происходит в обмен на выделение как ионов водорода, так и ионов калия. Этот обмен регулируется минералокорикоидами.
При недостатке ионов водорода может усилиться выделение калия, а при избытке – уменьшается.
Желудочно-кишечный тракт.
Клетки слизистой оболочки желудка секретируют Н+ и С1—, а в крови остаются Na+ и НС03—. Защелачивание крови не происходит, так как ионы хлора желудочного сока вновь всасываются в кишечнике. Эпителий слизистой оболочки кишечника секретирует щелочной сок Na+ и НСОз—. При этом в крови остаются Н+ и С1—. Кратковременный сдвиг реакции уравновешивается обратным всасыванием бикарбоната из кишечнике.
В то время, как почки концентрируют и выделяют из организма главным образом Н+ и одновалентные катионы, кишечный тракт концентрирует и выделяет двухвалентные щелочные ионы.
Участие печени
в нейтрализации кислот и оснований возможно за счет нескольких механизмов:
1) Органические кислоты, образующие в процессе метаболизма, в печени превращаются в межуточные и конечные продукты, которые не являются кислотами, или образуют углекислоту, быстро выделяющуюся из легких;
2) Некоторые органические кислоты нейтрализуются, образуя соединение с продуктами белкового обмена (соединение бензойной кислоты с гликогеном);
3) Молочная кислота нейтрализируется в печени, превращаясь в гликоген. Этот процесс имеет значение после усиления мышечной работы, когда в кровь поступает значительное количество молочной кислоты;
4) Неорганические кислоты задерживаются в печени, нейтрализуются и удаляются вместе с желчью. Также удаляются вместе с желчью и основания;
5) В печени происходит нейтрализация кислот аммиаком, образующимся при дезаминировании аминокислот и некоторых других продуктов белкового обмена.
Первичные изменения КЩС и компенсаторные реакции
Компенсаторные реакции немедленного типа
Дыхательная компенсация срабатывает при метаболических нарушениях (ацидоз, алкалоз).
Через легкие выводится в большей или меньшей степени С02. Это зависит от возбуждения или угнетения дыхательного центра.
Возбуждает дыхательный центр увеличение рС02 и снижение рО2 , уменьшение концентрации гидрокарбоната.
Угнетает дыхательный центр снижение рС02 и увеличение рО2 , увеличение концентрации гидрокарбоната.
Снижение уровня НСО3– в плазме крови (метаболический ацидоз), возникающее первично, компенсируется увеличением легочной вентиляции и снижением рС02, при этом соотношение рС02 /НСО3– остается неизменным.
При тяжелом метаболическом ацидозе стимуляция вентиляции легких доходит до крайнего предела (рС02 ниже 20 мм рт.ст. и даже ниже 10 мм рт.ст.), и дальнейшая компенсация становится невозможной.
Увеличение содержания НСО3– в плазме крови (метаболический алкалоз), возникающее первично, компенсируется снижением легочной вентиляции и увеличением рС02. Как правило, выраженный дыхательный ацидоз не развивается. Тем не менее, при выраженном метаболическом алкалозе существует опасность гиповентиляции и гиперкапнии.
Компенсаторные реакции начинаются сразу же при изменении содержания НСО3–. Максимум компенсации достигается через 12- 24 часа.
Компенсаторные реакции замедленного типа
Основной компенсаторный механизм при дыхательных нарушениях. Суть данного механизма сводится к выведению в большей или меньшей степени Н+ нелетучих кислот и также реабсорбции NаHC03 — обеспечивается функцией почек (аммониогенез, титрование Н+, реабсорбция).
Первичное снижение рС02 (дыхательный алкалоз) способствует подавлению реабсорбции бикарбоната в канальцах почек и задержке ионов Н+, в результате чего снижается содержание НСО3– в плазме крови и компенсаторно развивается метаболический ацидоз.
Первичная гиперкапния (дыхательный ацидоз) сопровождается увеличением реабсорбции бикарбоната и усилением выведения ионов Н+, компенсаторно развивается метаболический алкалоз.
Эти компенсаторные реакции в отличие от реакций немедленного типа происходят длительное время – 6 -12 часов и достигают максимума через несколько суток. Быстрое возрастание рС02 – острый дыхательный ацидоз не компенсируется почками и может привести к летальному исходу без заметного содержания бикарбоната в крови. В отличие от острого, медленно прогрессирующий дыхательный ацидоз (хронический) компенсируется увеличением уровня бикарбоната в крови и прямой угрозы для жизни не представляет.
Определение первичного нарушения КЩС
Снижение или повышение одного показателя — рН крови – свидетельствует об ацидозе или алкалозе, но не дает исчерпывающего ответа на вопрос, какой компонент КЩС нарушен: респираторный или метаболический.
Если же интерпретируются два показателя (рН и рС02), то определение первичности нарушения КЩС становится возможным (таб. 1).
Таблица 1. Определение первичности нарушения КЩС
|
рН артериальной крови (норма 7,35 – 7,45) |
рС02 (норма 35 -45 мм рт.ст.) | Первичное нарушение |
| Снижен | Повышено | Дыхательный ацидоз |
| Снижен | Норма или снижено | Метаболический ацидоз |
| Повышен | Повышено или норма | Метаболический алкалоз |
| Повышено | Снижено | Дыхательный алкалоз |
| Норма | Понижено |
Смешанная форма дыхательного алкалоза и метаболического ацидоза |
| Норма | Повышено |
Смешанная форма дыхательного ацидоза и метаболического алкалоза |
Кислотно-основной гомеостаз крови характеризуют следующие показатели:
рН — показатель активной реакции крови; суммарно отражает функциональное состояние дыхательных и метаболических компонентов и изменяется в случае превышения возможностей всех буферных систем (в норме 7,35 — 7,45).
рСО2 (мм рт. ст.) — напряжение углекислоты в крови; единственный дыхательный показатель КОГ, отражающий функциональное состояние системы дыхания, изменяющееся при ее патологии и в результате компенсаторных реакций при метаболических сдвигах (в норме 35-45 мм рт.ст. в артериальной крови).
АВ (ммоль/л) — истинные бикарбонаты крови (aktual bikarbonate); концентрация ионов угольной кислоты, НС03— при физическом состоянии крови в кровеносном русле, т. е. определенное без соприкосновения с воздухом при температуре 38°С (в норме 21,8-27,2 ммоль/л).
SВ (ммоль/л) — стандартный бикарбонат (standart bikar-bonate); концентрация бикарбонатных ионов (НС03—, измеренная при стандартных условиях: рС02 — 5,3 кПа (40 мм рт. ст.), при температуре 38°С и полном насыщении гемоглобина кислородом. Характеризует смещение ионов бикарбонатной системы.
Этот показатель считается более ценным в диагностическом отношении, чем истинный бикарбонат, поскольку отражает только метаболические сдвиги (в норме 21,6—26,9 ммоль/л).
ВВ (ммоль/л) — буферные основания крови (buffer base); общая концентрация буферных ионов бикарбонаты, белки, гемоглобин в полностью оксигенированной крови. Диагностическое значение этого показателя небольшое, т.к. он меняется в зависимости от рС02, концентрация гемоглобина (в норме 43,7-53,5 ммоль/л).
BE (ммоль/л) — избыток или недостаток буферных оснований (base excess). Характеризует сдвиг ионов всех буферных систем и указывает на природу нарушений кислотно-основного гомеостаза. Отрицательное значение BE отражает дефицит оснований или избыток кислот. При метаболических сдвигах КОГ крови смещение BE будет выражено более значительно, чем при дыхательных нарушениях (в норме BE = -3 — + 3 ммоль/л).
АР- анионная разница. В основе клинического применения показателя АР лежит предположение, что любой раствор, включая плазму, должен быть электронейтральным, т.е. сумма катионов равна сумме анионов. Плазма содержит один главный измеряемый катион Na+ и два главных измеряемых аниона СI— и НСОз—. Вклад других неизмеряемых анионов (НА) и катионов (НК) невелик (таб. 2). Из этого следует, что сумма измеряемых и неизмеряемых анионов равна сумме измеряемых и неизмеряемых катионов:
НА + (СI— + НСОз—) = НК + Na+
Таблица 2. Анионная разница
Пользуясь данными таблицы можно рассчитать АР:
АР = НА – НК = 23 – 11 = 12 мэкв/л
АР = НА – НК = Na+- (СI— + НСОз—)
В случаях увеличения Н+ неравенство между измеряемыми в плазме концентрациями катионов и анионов выйдет за пределы нормального диапазона 9 – 13 мэкв/л.
Показатель АР может быть полезен для выявления этиологии метаболического ацидоза.
Как правило, чем больше АР, тем легче определить причину ацидоза.
Высокая АР характерна для лактат-ацидоза, вызванного анаэробным гликолизом. Диабетический кетоацидоз и уремия также сопровождается увеличением АР. Если при высокой АР уровень лактата, кетона и креатинина нормальный, наиболее вероятно, что причиной ацидоза является прием токсичных веществ (метанол, паральдегид, этанол, этиленгликоль, лекарственные средства). Высокий уровень салицилатов в плазме сопровождается значительным увеличением АР.
Классификация нарушений КЩС
1. Простые нарушения:
Ацидоз:
— метаболический
— респираторный
Алкалоз:
— метаболический
— респираторный
2.1 Однонаправленные: метаболический и дыхательный ацидоз и алкалоз
2.2 Разнонаправленные:
— метаболический ацидоз и дыхательный алкалоз
— метаболический алкалоз и дыхательный ацидоз
Значения рН остаются в пределах нормы (рН=7,35 — 7,45), содержание бикарбонатов и СО2 изменяется в зависимости от направленности метаболических и респираторных сдвигов.
Кроме изменений в содержании бикарбонатов и СО2 изменяется и рН, но в незначительных пределах + 0,04 (рН=7,31 – 7,49)
рН < 7,30 – некомпенсированный ацидоз;
рН > 7,50 – некомпенсированный алкалоз.
Метаболический ацидоз
Метаболический ацидоз возникает вследствие существенного снижения уровня бикарбоната в организме.
1. Увеличение продукции нелетучих кислот.
Усиленная продукция кислых метаболитов (так называемых кетокислот — (3-гидроксибутирата и ацетоацетата) является одной из характерных особенностей неконтролируемого или плохо контролируемого инсулинзависимого диабета. При этом состоянии, называемом диабетическим кетоацидозом, количество бикарбоната в крови значительно снижается из-за его использования для нейтрализации избытка кислот.
В клетках, которые в значительной мере лишены кислорода и, поэтому, не могут метаболизировать (окислять) глюкозу происходит накопление лактата. Такое существенное накопление лактата в крови в количествах, достаточных для развития метаболического ацидоза, происходит, если ткани неадекватно перфузируются кровью, а следовательно и недостаточно оксигенируются.
Наиболее яркой причиной лактоацидоза при нарушении перфузии тканей является гиповолемический шок. Кроме того, лактоацидоз может возникать при почечной или печеночной недостаточности, диабете, сепсисе и лейкемии.
2. Увеличение потерь оснований.
Бикарбонат секретируется в полость тонкого кишечника для осуществления пищеварения и абсорбируется в нижних отделах желудочно-кишечного тракта. Если реабсорбции не происходит, он теряется с фекалиями.
Любые заболевания пищеварительного тракта (например, тяжелая диарея) могут привести к потерям бикарбоната из организма в количествах, достаточных для развития метаболического ацидоза.
Также потеря бикарбонатов может быть связана с почечной недостаточностью (проксимальный канальцевый ацидоз – почечный ацидоз II типа). Ухудшение реабсорбции Nа+ приводит появлению щелочной реакции мочи. Кроме этого, проксимальный канальцевый ацидоз характеризуется снижением уратов, фосфатов и калия в сыворотке крови, глюкозурией и аминоацидурией.
С помощью величины АР можно отличить потери НСОз— при диарее от потерь НСОз—, вызванных почечным канальцевым ацидозом таб. 3.
Таблица 3. Анионная разница по (П.Марино, 1998)
|
АР мочи АР = (Nа+ + К+) – СI- |
рН мочи | диагноз |
|
Отрицательная Положительная Отрицательная |
<5,5
>5,5 >5,5 |
Патологии нет Почечный канальц. ацидоз Диарея |
3. Увеличение поступлений в организм кислот извне.
Злоупотребление кислой пищей, прием внутрь соляной кислоты, введение в больших количествах старой консервированной крови
4. Уменьшение выведения ионов Н+ через почки.
В нормальных условиях почки выводят Н+ в виде титруемой кислоты (фосфаты, сульфаты) и аммиака. Этот механизм может быть нарушен при заболеваниях почек, недостаточности надпочечников, дистальном почечном канальцевом ацидозе и гиперальдостеронизме. При почечной недостаточности, уменьшении числа функционирующих нефронов адекватная фильтрация и выведение Н+ отсутствуют.
При почечном ацидозе I типа (дистальный канальцевый ацидоз) секреция Н+ в дистальных канальцах нарушается. Поскольку экскреция Н+ в дистальных канальцах зависит от обмена Nа+ , уменьшение объема жидкости способствует нарастанию ацидоза. Посредством такого же механизма, связанного с уменьшением поставки Nа+ в канальцы почек, адреналиновая недостаточность и селективный гипоальдостеронизм также приводят к ухудшению экскреции Н+. При этом метаболический ацидоз сочетается с другими формами нарушений электролитного обмена: гиперкалиемией, гипонатриемией, гиперкальциемией.
Снижение уровня НСО3– в плазме крови (метаболический ацидоз), возникающее первично, компенсируется увеличением легочной вентиляции и снижением рС02, при этом соотношение рС02 /НСО3– остается неизменным.
Увеличение содержания кислот буферируется бикарбонатным буфером:
НС1 + H 2C03/NаHC03 ↔ Nа Сl+ H 2C03
↓
С02 + Н2О
Диагностические критерии:
1. При сниженном рН нормальный или пониженный уровень рСО2 указывает на первичный метаболический ацидоз;
2. При нормальной величине рН пониженный уровень рСО2 указывает на смешанную форму дыхательного алкалоза и метаболического ацидоза;
3. При нормальной величине рН нормальный уровень рСО2 может свидетельствовать о том, что показатели КЩС находятся в пределах нормы, но не исключается возможность смешанных метаболических алкалозов/ацидозов.
В этих случаях определяют АР и по этому показателю судят об изменениях КЩС.
4. Дефицит оснований – АВ, ВЕ, ВВ, SВ.
Клинические формы ацидоза
Лактат – ацидоз
Этиопатогенез.
1. Снижение оксигенации тканей – тканевая гипоксия. Наибольшее значение придают циркуляторным нарушениям (кардиогенный, септический, гиповолемический шок). Наличие всех форм гипоксии теоретически способствует развитию лактат-ацидоза. Остановка сердца сопровождается анаэробным обменом веществ и лактат-ацидозом;
2. Нарушения функции печени снижают ее способность к превращению молочной кислоты в глюкозу и гликоген.
3. Недостаток тиамина (витамин В1) у больных, злоупотребляющих алкоголем ведет к угнетению окисления пирувата в митохондриях и способствует накоплению молочной кислоты.
4. Повышение правовращающего изомера молочной кислоты (D-лактат-ацидоз), неопределяемого стандартными лабораторными методиками. Это изомер образуется в результате действия микроорганизмов, расщепляющих глюкозу в кишечнике. Чаще всего встречается у больных после обширных операций на кишечнике, при дисбактериозе, нарушениях функции ЖКТ. По-видимому, это наиболее распространенное нарушение КЩС, но оно часто не диагностируется (П.Марино, 1998);
5. Не исключается возможность лактат-ацидоза при длительных инфузиях адреналина и других сосудосуживающих средств.
6. Лактат-ацидоз может развиться в случаях использования натрия нитропруссида, при метаболизме которого образуются цианиды, способные нарушать процессы окислительного фосфорилирования.
Диагностика лактат-ацидоза:
— наличие метаболического ацидоза, связанного с повышенной АР;
— выраженный дефицит оснований;
— АР>30 мэкв/л, в то время как другие причины, вызывающие ацидоз (кетоацидоз, почечная недостаточность, введение токсических веществ), отсутствуют;
— уровень молочной кислоты в венозной крови превышает 2 мэкв/л. Этот показатель отражает интенсивность образования лактата в тканях.
Устранение причины лактат-ацидоза.
Введение натрия бикарбоната показано при рН<7,2, содержании НСОз— <15 ммоль/л. Расчет примерной дозы натрия бикарбоната можно провести по следующей формуле:
Дефицит НСОз—(ммоль) = 0,3 * масса тела (кг) * ВЕ = мл 8,5%р-р соды
Для 3% соды: ВЕ*0,8*масса тела
Для 4% соды: ВЕ*0,6*масса тела
Для 5% соды: ВЕ*0,5*масса тела
Вначале устраняют половину выявленного дефицита НСОз путем внутривенного введения раствора в течение 30 минут. Затем под контролем содержания НСОз в сыворотке крови продолжают коррекцию в течение 4 – 6 часов.
Пример:
В данном случае рН ниже нормы — обозначается как некомпенсированный ацидоз. Далее оцениваем газовый состав крови: уровень рО2 для артериальной крови несколько повышен, но рСО2 снижен. Учитывая дефицит оснований и повышенный лактат можно сделать вывод, что это метаболический лактат-ацидоз, при котором включена немедленная компенсация в виде гипервентиляции.
Кетоацидоз.
В условиях выраженного дефицита инсулина блокируется поступление глюкозы в мышцы и жировую ткань, снижается уровень глюкозы в клетках, ткани испытывают «энергетический голод». Это ведет к гиперсекреции контринсулярных гормонов – соматотропина, глюкагона, кортизола, адреналина. Под влиянием этих гормонов стимулируется гликогенолиз, глюконеогенез и липолиз. В результате липолиза жиры расщепляются до свободных жирных кислот, которые становятся источником энергии и кетоновых тел. В условиях дефицита инсулина происходит чрезмерное образование кетоновых тел, развивается кетоацидоз.
— слабость, жажда, тошнота;
— диабетическая прекома;
— диабетическая кома.
— гипергликемия
— глюкозурия
— метаболический ацидоз (снижение рН, НСОз, рСО2, выраженный дефицит оснований)
— ацетон в плазме
— ацетонурия
— гиперосмолярность плазмы > 300 мосм/л
Первоначальная доза инсулина 10 ЕД в/в. Последующую инфузию инсулина в изотоническом растворе натрия хлорида или 5% раствре глюкозы проводят со скоростью 0,1 ЕД/кг/час.
Дефицит внеклеточной и внутриклеточной жидкости при кетоацидозе может достигать 10% массы тела. Лечение следует начинать с введения изотонических растворов, содержащих Na+ и CI—. Опасность чрезмерного введения кристаллоидов заключается не только в перегрузке объёмом, но и в дисбалансе концентраций натрия и глюкозы. Поэтому необходим динамический контроль этих веществ и при необходимости своевременная коррекция.
Потери К+ при кетоацидозе достигают 200 – 700 ммоль и продолжаются по мере устранения ацидоза. Проводя коррекцию гипокалиемии необходимо учитывать не только дефицит, но и потребность. Представлена формула расчета дефицита К+:
Дефицит калия (ммоль) = масса больного (кг) х 0,2 х (4,5 – К+ плазмы)
Рекомендуется введение натрия бикарбоната при снижении рН < 7,2 и снижении АДсист ниже 90 мм рт.ст., для предупреждения дальнейших электролитных нарушений и гемолиза. Но введение раствора соды должно быть более осторожным, чем при лактат-ацидозе, рекомендуется вводить 1/2 расчетной дозы.
— превращение этанола в процессе метаболизма в печени в ацетальдегид с образованием НАД-Н, способствующего выработке кетоновых тел;
— сопутствующее голодание, сопровождающееся усилением кетогенеза и кетонемией;
— обезвоживание, ведущее к олигурии и снижению экскреции кетоновых тел с мочой.
Алкогольный кетоацидоз обычно развивается через 1 – 3 дня после чрезмерного потребления спиртных напитков. Как правило, уровень глюкозы и кетоновых тел повышается не очень высоко.
Показано в/в введение изотонического раствора натрия хлорида и 5% глюкозы.
Глюкоза угнетает образование кетоновых тел в печени, а солевые растворы повышают выведение их с мочой. Коррекцию калия проводят по содержанию его в сыворотке крови. натрия бикарбонат применим только если рН < 7,2 и снижении АДсист ниже 90 мм рт.ст..
Пример:
Интерпретация анализа начинается с рН. В данном случае рН ниже нормы и обозначается как некомпенсированный ацидоз. Далее оцениваем газовый состав крови: уровень рО2 для венозной крови нормальный, однако сделать заключение о наличие гипоксемии нельзя, для этого необходимо определить рО2 в артериальной крови. Но с учетом нормального уровня лактата, можно сделать вывод, что дефицита О2 нет, идет аэробный гликолиз. Генез ацидоза метаболический и данное заключение можно сделать по уровню дефицита оснований.
Снижение уровня бикарбоната может быть связано с метаболическим ацидозом или развившейся почечной недостаточностью, это можно сказать с учетом анамнестических и клинических данных.
— Потеря нелетучих кислот
Тяжелая и длительная рвота желудочным соком (он кислый) приводит к потере НСI из организма. Это причины метаболического алкалоза, ассоциированного со стенозом привратника — состояния, при котором затрудняется продвижение желудочного содержимого в тонкий кишечник.
— Потеря ионов Н+
Гипокалиемия увеличивает проксимальную канальцевую реабсорбцию НСОз и повышает дистальную канальцевую секрецию Н+. Повышение уровня албдостерона увеличивает секрецию Н+.
— Избыточное введение бикарбоната натрия.
В данном случае алкалоз развивается при неконтролируемом введении бикарбоната, цитрата, лактата или ацетата.
Компенсаторные механизмы:
Увеличение содержания НСО3– в плазме крови (метаболический алкалоз), возникающее первично, компенсируется снижением легочной вентиляции и увеличением рС02. Как правило, выраженный дыхательный ацидоз не развивается. Тем не менее, при выраженном метаболическом алкалозе существует опасность гиповентиляции и гиперкапнии.
NаОН + H 2C03/NаHC03 ↔ 2NаHC03 + Н2О
— НСОз в артериальной крови более 25 ммоль/л, в венозной крови – более 30 ммоль/л;
— рН выше нормального уровня;
— рСО2 нормальное или повышенное, в наиболее тяжелых случаях может быть сниженным;
— при гипохлоремическом алкалозе – СI менее 100 ммоль/л;
— часто бывает гипокалиемия.
1.Устранение основной причины алкалоза;
2.Восполнение дефицита: Дефицит СI (моль/л) = 0,27* масса тела (кг) * (100 – фактическое содержание СI)
Необходимый объём изотонического раствора натрия хлорида может быть определен по формуле: NаСI (л) = дефицит СI / 154, где 154 – содержание СI (моль/л) в 1 л 0,9% раствора натрия хлорида;
3.При потерях НСI необходимо в/в раствора НСI. Обязательное условие для его назначения – нормальное содержание жидкости в организме и нормальная концентрация К+ в сыворотке крови. Дефицит водорода определяют по следующей формуле:
Дефицит Н+ = 0,5 * масса тела (кг) *
(фактическое содержание HC03 – желаемое содержание HC03)
В 1 л 0,1 нормального раствора HC03 содержится 100 ммоль Н+. скорость введения раствора НСI – 0,2 ммоль/кг/час.
Максимальная суточная доза раствора НСI = 100 ммоль.
При неосложненном метаболическом алкалозе содержание HC03 в сыворотке крови менее 35 ммоль/л считают относительно безопасным.
4.Устранение гипокалиемии (см. выше).
Пример:
В данном случае рН выше нормы и обозначается как некомпенсированный алкалоз. Далее оцениваем газовый состав крови: уровень рСО2 несколько повышен, а рО2 в пределах нормы, следовательно алкалоз не респираторного происхождения. Генез алкалоза однозначно метаболический, что подтверждает избыток оснований.
Дыхательный ацидоз.
— Острая дыхательная недостаточность;
— Хроническая дыхательная недостаточность.
Острый дыхательный ацидоз.
Острый дыхательный ацидоз представляет угрозу для жизни больного, характеризуется первичным острым накоплением СО2 в жидких средах организма из-за снижения альвеолярной вентиляции, ограничивающей элиминацию СО2. Однако наряду с увеличением содержания в крови СО2, как правило наблюдается снижение рО2 в артериальной крови.
Первичная гиперкапния (дыхательный ацидоз) сопровождается увеличением реабсорбции бикарбоната и усилением выведения ионов Н+ почками, компенсаторно развивается метаболический алкалоз. Но эта компенсаторная реакция относится к реакции замедленного типа, которая происходит длительное время (6-12 часов) Клетки почечных канальцев богаты ферментом карбоангидразой, которая катализирует синтез угольной кислоты из углекислого газа и воды. Угольная кислота диссоциирует с освобождением бикарбоната, который выходит в кровь (для восполнения бикарбонатного буфера), и ионов водорода, которые эксретируются с мочой.
В крови действие фосфатного буфера сводится к поддержанию и воспроизводству бикарбонатного буфера. При увеличении в крови кислот и образовании Н2С03 происходит обменная реакция:
H++HC03— + Na2HP04 = NaHC03 + NaH2P04
Избыток Н2С03 ликвидируется, а концентрация НС03— увеличивается.
Остро возникшее увеличение содержания СО2 в крови в первую очередь проявляется изменениями функции ЦНС и в меньшей степени сердечно-сосудистой системы. Потеря сознания является результатом интраневрельного ацидоза, усиления мозгового кровотока и увеличения ВЧД, за счет гиперкапнии и дилатации сосудов мозга. Системное сосудорасширяющее действие гиперкапнии проявляется гиперемией кожных покровов, повышенной потливостью, тахикардией.
Восстановление адекватной вентиляции легких и оксигенации крови, под контролем рСО2 и рО2 в артериальной крови. Одновременно проводят лечение основного заболевания, вызвавшего острый дыхательный ацидоз.
Хронический дыхательный ацидоз.
Хронические обструктивные заболевания легких.
Хронический дыхательный ацидоз развивается длительное время, компенсация может быть полной, и тогда рН не выходит за пределы нормы при повышенном рСО2 в артериальной крови и соответствующем возрастании НСО3. При отсутствии достаточных механизмов компенсации хронический дыхательный ацидоз может быть субкомпенсированным. Обычно повышение рСО2 сопровождается умеренным снижением рН и увеличением уровня НСО3. Из организма при этом выводятся Н+,CI— и NН4CI, обладающий свойствами сильной кислоты. Компенсаторный характер метаболического алкалоза очевиден. Несмотря на почечную компенсацию, дыхательные нарушения могут прогрессировать.
Хронический дыхательный ацидоз может перейти в острый, и тогда он представляет угрозу для жизни больного.
Профилактика и лечение основного заболевания.
Пример:
В данном случае рН ниже нормы — обозначается как некомпенсированный ацидоз. Оцениваем газовый состав крови: уровень рО2 для венозной крови нормальный, однако сделать заключение о наличие гипоксемии нельзя, для этого необходимо определить рО2 в артериальной крови. Но с учетом нормального уровня лактата, можно сделать вывод, что дефицита О2 нет, идет аэробный гликолиз. Но повышенный уровень рСО2 говорит о дыхательном ацидозе. Тактика коррекции будет зависеть от клиники.
Дыхательный алкалоз.
— нарушения функции ЦНС;
— болевой синдром;
— возбуждение;
— ИВЛ в режиме гиповентиляции.
Первичное снижение рС02 (дыхательный алкалоз) способствует подавлению реабсорбции бикарбоната в канальцах почек и задержке ионов Н+, в результате чего снижается содержание НСО3– в плазме крови и компенсаторно развивается метаболический ацидоз.
Патофизиологические изменения.
Доказано, что острая гипокапния сопровождается снижением содержания бикарбонатов и концентрации Н+ не только в артериальной крови, но и в цереброспинальной жидкости. Острая гипокапния снижает мозговой кровоток, что приводит к гипоксии мозга и увеличению образования в мозге лактата.
При острой гипокапнии возможны значительное снижение сердечного выброса, повышение ОПСС, что ведет к значительному уменьшению перфузии тканей и увеличению содержания лактата в плазме.
Обычными признаками острого алкалоза являются тахипноэ и одышка. При хроническом алкалозе частота дыхания может оставаться нормальной при повышенном дыхательном объёме. Признаки дыхательного алкалоза не специфичны и проявляются нарушением нейромышечной функции (парестезии, судороги, тремор).
Специального лечения не требуется, важно выявить и устранить основную причину, вызвавшую это нарушение.
Пример:
В данном случае рН выше нормы и обозначается как некомпенсированный алкалоз.
Учитывая, что рСО2 ниже нормы, уровень лактата в норме и нет избытка оснований, можно говорить о чистом дыхательном алкалозе. Тактика коррекции будет зависеть от клиники.
При гипокапнии и одновременном повышении уровня лактата с метаболическим ацидозом, необходимо думать о циркуляторной или тканевой гипоксии – низкой продукции углекислоты тканями при анаэробном гликолизе.
Это чрезвычайно опасная ситуация, сопровождающаяся нормальной сатурацией и нормальным напряжением кислорода, что успокаивает врача. Подтверждением этому опасному состоянию служит низкая артерио-венозная разница по кислороду.
Литература
1. Бунятян А.А., Рябов Г.А., Маневич А.3. Анестезиология и реаниматология. 2-е изд. перераб. и доп. М., Медицина 1984
2. Дэвид М.Габа, Кевин Дж.Фиш, Стивен К.Хауард. Критические ситуации в анестезиологии. Перевод с англ. –М.М. -2000 г.
3. Малышев В.Д. Интенсивная терапия острых водно-электролитных нарушений. М.:Медицина,1985. 192 с.
4. Малышев В.Д. Интенсивная терапия. Реанимация. Первая помощь: Учебное пособие. — М.: Медицина.— 2000.— 464 с
5. Уилкинсон А.У. Водно-электоролитный обмен в хирургии / Пер. с англ. М.: Медицина 1974
6. Шмидт Р., Тевс Г. /ред./ Физиология человека. /пер. с англ./ М., 1986, т.3.
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Кислотно-щелочной баланс поддерживается сложным взаимодействием многих систем органов, включая мозг, легкие, почки и печень. Несмотря на свою важность, физиология кислотно-щелочного метаболизма кажется непопулярной темой в медицине из-за ее сложности и сбивающего с толку одновременного использования различных понятий и терминов. Точная и своевременная интерпретация кислотно-щелочного расстройства может спасти жизнь, но постановка правильного диагноза может оказаться сложной задачей. Изложение симптомов в учебниках может ускорить диагностику и лечение, но в клинической практике многие области неопределенности остаются на ранних и даже поздних стадиях заболевания. Анамнез и физикальное обследование могут дать важные ключи к диагностике кислотно-основных расстройств, но очевидные клинические признаки часто отсутствуют, а интеграция лабораторных параметров в клиническую картину имеет основополагающее значение для постановки диагноза кислотно-основных расстройств. К счастью, важные кислотно-щелочные результаты часто доступны в течение нескольких минут в условиях стационара.
История оценки pH и текущие вопросы, касающиеся ее оценки.
Даже сложные кислотно-основные случаи могут быть правильно оценены с помощью обычных результатов определения электролитов и газов артериальной крови, при этом концентрация Hþ, выраженная в виде pH, находится в центре оценки. Несмотря на важность, существует много проблем с оценкой pH. Концентрация Hþ требует точного регулирования, потому что влияет на деятельность почти всех ферментных систем и другие метаболические процессы в организме. По сравнению с другими ионами концентрация H2O в сыворотке чрезвычайно низка. При нормальной концентрации H2O около 0,00004 ммоль / л концентрация натрия, наиболее заметного катиона в плазме, примерно в 3,5 миллиона раз выше. Термин pH был введен Соренсеном (1868–1939), чтобы избежать необходимости писать много нулей в статье об активности ферментов. Отрицательный логарифм (основание 10) концентрации гемоглобина позволил получить меньшие и более управляемые числа. Электрометрическое измерение концентрации ионов водорода было открыто Вильгельмом Оствальдом в Лейпциге около 1890 года и термодинамически описано его учеником Вальтером Нернстом, используя концепцию осмотического давления Ван’т-Гоффа вместе с концепцией ионизации Аррениуса оба из которых были формализованы в 1887 году. Первое точное измерение pH крови было приписано в 1912 году Хассельбалху и Лундсгаарду, которые использовали водородный электрод с плазмой. Тем не менее, pH не представлял особого клинического интереса до эпидемии полиомиелита в Копенгагене в 1952 г. Только по мере того, как измерения pH стали более точными, стало очевидно, что физиологическое регулирование pH было чрезвычайно точным в нормальных условиях, требуя точности измерения, которая в некоторых случаях все еще недосягаема. Например, теперь мы знаем, что изменение pH спинномозговой жидкости вокруг медуллярных респираторных хеморецепторов на 0,001 единицы изменяет дыхательную минутную вентиляцию примерно на 2,5% и изменяет уровень артериального PCO2 на 1 мм рт. pH не является точной концентрацией pHþ, но отражает фактор активности. Это представляет собой тенденцию ионов водорода взаимодействовать с другие компоненты раствора, которые влияют на считывание электрического потенциала с помощью pH-метра. Однако pH остается непонятной переменной, потому что это нелинейное преобразование концентрации Hþ — логарифма обратной величины. Таким образом, большинство врачей не осведомлены о зависимости концентрации H2O от изменений pH. Например, снижение pH с нормального значения 7,4 до 7,2 приводит к увеличению концентрации H2O на 60% с 40 до 63 нмоль / л. Организм обладает большой способностью переносить тяжелые уровни ацидоза. От pH 7,40 (40 нмоль / л) до тяжелого ацидоза pH 6,70 (175 нмоль / л) концентрация H2 увеличивается в 4 раза, приращение, которое невозможно переносить с другими ионами, такими как натрий или калий. Таким образом, диапазон pH, совместимый с жизнью, примерно от 6,9 (0,126 ммоль / л Hþ) до 7,6 (0,025 ммоль / л Hþ), относится к очень небольшим различиям в концентрации H2O ниже 0,13 ммоль / л.
Биологические жидкости можно рассматривать как разбавленные водные растворы. В чистой воде небольшая диссоциация выражается в реакции: H2O HþþOH; по сути, это гидроксоний вместо Hþ: 2H2O $ H3OþþOH. Концентрация H2O в чистой воде составляет 55 ммоль / л, а [Hþ] и [OH] 10 7 или менее. Влияние температуры на pH крови было установлено в 1948 году: снижение на 0,015 единицы на градус Цельсия. В клинических условиях потенциальное влияние преаналитической температуры на обработку и хранение образцов, вероятно, невелико. Хранение образца при 0 до 60 минут не показало никакого влияния на pH, тогда как хранение образца при 22 градусах показало значительное снижение через 30 минут в одном исследовании.
Референсные значения газов артериальной крови должны основываться на пациентах, которые характерны для в целом здорового населения. В то время как pH является краеугольным камнем кислотно-щелочной оценки, эталонное значение для нормальной популяции, к удивлению, не установлено.
Газы артериальной крови
Лабораторная оценка кислотно-основных нарушений включает измерение газов артериальной крови, электролитов сыворотки (или плазмы), лактата, осмоляльности и результатов мочи. Высокий уровень качества на протяжении всего процесса тестирования имеет решающее значение для предоставления врачам надежных лабораторных данных, но, к сожалению, многие ошибки остаются нераспознанными. При рассмотрении всех ошибок, о которых сообщается в клинических лабораторных условиях, преаналитическая фаза ответственна за более чем две трети из них. Например, даже минимальные пузырьки воздуха влияют на pO2 и pCO2.Раннее исследование показало, что загрязнение воздуха пузырьками газа, относительный объем которых составлял 0,5–1% или более от жидкости в устройстве для сбора, может быть источником значительной ошибки. Другое исследование, проведенное в отделении интенсивной терапии, показало, что 40% проб газов артериальной крови содержат пузырьки воздуха или пену.
Своевременная обработка образцов крови является критическим преаналитическим этапом для получения надежных результатов по газам артериальной крови из-за диффузии газов через стенки пробирок для забора крови и продолжающегося метаболизма в крови, который может изменять значения газов в крови во время между взятием пробы и анализом. В одном исследовании с участием 100 пациентов с легочными заболеваниями парциальное давление кислорода и углекислого газа и уровень насыщения кислородом гемоглобина были проанализированы в образцах артериальной и капиллярной крови. Парные измерения образцов артериальной крови были выполнены в течение 15 минут и через 60 минут после отбора и сравнивались. pO2 и значения sO2 в образцах капиллярной крови в пластиковых пробирках были значительно выше, чем в стеклянных пробирках (в килопаскалях: pO2 8,50 ± 1,98 против 7,89 ± 2,00 и sO2 89,66 ± 11,04 против 88,23 ± 11,22, p <0,01, соответственно).
Значения pCO2 в крови существенно не повлияли. Если в прошлом стеклянные пробирки были обычными устройствами для сбора газов артериальной крови, то сегодня пластиковые устройства используются преимущественно из соображений безопасности, но утечка газа через пластиковый материал устройств вероятна. Идеальным устройством для забора проб артериальной крови является самонаполняющийся пластиковый одноразовый шприц объемом 1, 3 или 5 мл, предварительно заполненный небольшим количеством лиофилизированной соли гепарина. Лейкоциты крови продолжают потреблять кислород со скоростью, которая зависит от температуры хранения, времени хранения и начального уровня парциального давления кислорода в образце крови. В шприцах было принято замораживать образцы газов крови, собранные в стеклянные шприцы, немедленно, чтобы замедлить скорость метаболизма лейкоцитов и минимизировать снижение уровня кислорода. В отличие от полипропилена и других полимерных материалов, из которых изготовлены пластиковые шприцы, стекло непроницаемо для газов. Институт клинических и лабораторных стандартов (CLSI) рекомендует не замораживать пластиковые шприцы, а хранить их при комнатной температуре до тех пор, пока кровь не будет проанализирована в течение 30 минут после забора. На уровни кислорода и углекислого газа в крови, сохраняемой при комнатной температуре в течение 30 минут или меньше, это минимально влияет, за исключением случаев повышенного количества лейкоцитов или тромбоцитов. Кровь, взятая для специальных исследований, включая альвеолярно-артериальные градиенты давления кислорода или исследования «шунта», должна быть проанализирована в течение пяти минут после сбора. Если время задержки (более За 30 мин) до предполагаемого анализа рекомендуется использовать стеклянные шприцы с хранением в ледяной воде. Шприцы от разных производителей представляют собой еще один источник вариабельности в анализе газов крови, поскольку шприцы разных марок, предназначенные для анализа газов крови или нет, могут влиять на качество лабораторных тестов. Поэтому стандартизация методов сбора является обязательной.
Для практических целей для оценки в отдельных случаях используются эталонные значения pH (7,40), PaCO2 (40 мм рт. Ст.), HCO3 (24 ммоль / л) и SBE (0 ммоль / л). Четыре основных кислотно-щелочных нарушения рассматриваются как простые кислотно-основные нарушения: респираторный ацидоз, респираторный алкалоз, метаболический ацидоз и метаболический алкалоз. Несмотря на некоторые ограничения, вторичный
ответы при кислотно-основных расстройствах математически предсказуемы. В ответ на метаболические кислотно-щелочные нарушения изменения частоты дыхания развиваются быстро, и стабильное состояние PaCO2 достигается в течение нескольких часов. При стойких респираторных нарушениях адаптация почек развивается медленно, и требуется от двух до пяти дней, чтобы концентрация бикарбоната в плазме достигла нового стабильного уровня. Изменение дыхания называется «острым» или «хроническим» в зависимости от того, соответствует ли вторичное изменение [HCO3] прогнозам. Смешанные кислотно-основные расстройства диагностируются, когда вторичный ответ отличается от ожидаемого.
Есть многочисленные ограничения относительно точности вторичного кислотно-основного ответа. Уравнения вторичного отклика, поскольку они записаны, создают ложное впечатление, что они очень точны. Это неверно, потому что ранее существовавшие значения пациента обычно недоступны, и клиницисты фактически «угадывают» эти значения с помощью своих лабораторных эталонных значений. Кроме того, широко используемые расчеты вторичного ответа на изменение кислотно-основного статуса были адаптированы из исследований 1960-х годов на людях и собаках и основывались на более старом оборудовании. По сравнению с людьми у здоровых собак часто наблюдается хроническое респираторное заболевание. алкалоз (артериальный pCO2, 22,6–34,5 мм рт. ст .; бикарбонат, 14–22 ммоль / л; SBE, –12–1,6 ммоль / л), поэтому его применимость к людям является предположительной. Кроме того, исследования хронических респираторных заболеваний у людей редки. В исследовании 76 парализованных пациентов, находящихся на ИВЛ, различие между острым и хроническим респираторным алкалозом было трудным, когда артериальный
pCO2 было выше 25 мм рт. Более того, существуют противоречивые данные о хроническом респираторном ацидозе , а величина респираторного ответа при метаболическом ацидозе значительно различается в разных исследованиях. Кроме того, само существование вторичной гиперкапнии в ответ на метаболический алкалоз является спорным.
Выводы
Лабораторные параметры имеют решающее значение для диагностики кислотно-основных нарушений. Лабораторные данные должны быть оценены в соответствии с клинической картиной пациента. Вместе с клинической информацией и знанием ограниченности данных в большинстве случаев должно быть несложно установить этиологию кислотно-щелочного нарушения, но, к сожалению, существует много предостережений. При рассмотрении всех ошибок, зарегистрированных в клинических лабораторных условиях, более двух третей приходится на преаналитическую
16 ноября 2020 г.









