Микробиом человека – важная составляющая здоровья
Микробиом кишечника человека представляет собой сложную экосистему, состоящую из 39 триллионов микроорганизмов, и включает в себя не только бактерии, но и археи, грибы и вирусы. (1) Указанные микроорганизмы эволюционировали на протяжении тысяч лет в симбиозе с организмом хозяина. Кишечная микрофлора играет важную роль в пищеварении, иммунных реакциях, выполняет разнообразные метаболические функции. Так, бактерии продуцируют короткоцепочечные жирные кислоты, которые используются в качестве питательного вещества не только колоноцитами, но и клетками микроглии мозга. Обмен холестерина и гормонов в организме также осуществляется при участии кишечного микробиома. (2)
С развитием в конце ХХ века методов, позволяющих оценить состав и функции микроорганизмов, а именно секвенирования генома, появилась возможность изучить разнообразие микробных сообществ. Для качественной и количественной оценки бактериального разнообразия в образцах широко применяется секвенирование 16S рибосомальной РНК микроорганизмов, все более доступными становятся методы метагеномного анализа, позволяющие провести оценку метаболизма и функций того или иного вида бактерий. (3)
Наибольшее количество бактерий находится в толстой кишке, среди которых в норме преобладают два типа, Bacteroidetes и Firmicutes (∼90%). Тип Firmicutes состоит из более чем 250 родов бактерий, среди которых Lactobacillus и Clostridium, в то время как тип Bacteroidetes включает 20 родов, с преобладанием Bacteroides. Такие типы как Actinobacteria, Proteobacteria и Verrucomicrobia обнаруживаются в составе нормальной микрофлоры, но в гораздо меньших количествах. (1,4) Кроме того, среди здоровой микробиоты толстой кишки могут встречаться метанопродуцирующие археи, которые, в отличии от других живых организмов, не содержат пептидогликан в клеточной стенке и имеют особые рибосомы и рибосомные РНК, а также эукариоты (дрожжи) и вирусы.
Понятие «нормы» в отношении кишечного микробиома относительно, его состав может изменять множество различных факторов, воздействующих на кишечник и организм человека в целом. В настоящее время важным для поддержания равновесия между непатогенными и условно-патогенными бактериями считается отношение численности Bacteroidetes к Firmicutes (так называемый градиент Firmicutes/Bacteroidetes). (5)
Заселение кишечника микроорганизмами начинается с рождения, и состав микробиома определяется в значительной степени способом родоразрешения. В последующем микрофлора кишечника изменяется в зависимости от пищевых привычек, адаптируясь к новым продуктам в рационе человека. (6, 7) Вакцинация, различные заболевания, прием лекарственных препаратов, курение и другие факторы также влияют на композицию кишечного микробиома и его метаболизм. (8, 9) В то же время имеет место двустороннее взаимодействие между микро- и макроорганизмом. Очевидной демонстрацией этому служит важная роль кишечной микробиоты в формировании гипоталамо-гипофизарно-надпочечниковой оси, которая участвует в регуляции иммуномодуляции, обмена липидов, энергетического баланса и электрофизиологической активности энтеральной нервной системы. (11)
Влияние физических упражнений на изменение кишечного микробиома
Регулярные физические упражнения рекомендованы Всемирной организацией здравоохранения для укрепления здоровья и снижения риска развития многих заболеваний, в том числе психических, а также для увеличения продолжительности жизни. (12) Эти рекомендации основаны на данных множества исследований, демонстрирующих разнообразие патогенетических путей, посредством которых улучшается здоровье на фоне физической нагрузки. (13) С появлением возможности изучения микробиома кишечника, влияние на его таксономический состав и метаболизм с помощью упражнений служит предметом научного интереса.
Изучение микробного состава животных при физических упражнениях демонстрирует противоречивые результаты. Например, в некоторых исследованиях обнаружено увеличение градиента Firmicutes/Bacteroidetes, в то время как другие свидетельствуют о его снижении или отсутствии изменений. (Таблица 1)
Вероятно, это связано с отсутствием стандартизации вида физических упражнений, породы и возраста животных, их диеты.
Таблица 1. Влияние физических упражнений на кишечный микробиом животных
|
Авторы |
Модель |
Упражнения |
Результаты |
|
Hsu et al. (14) |
GF-, SPF-, BF-мыши |
Плавание |
↓ глутатиона ↓КЖК ↓ каталазы у GF— и BF-мышей |
|
Matsumoto et al. (15) |
Крысы Вистар |
Свободный бег в колесе 5 недель |
↑ бутирата ↑бутират-подуцирующих бактерий |
|
Campbell et al. (16) |
Дикие мыши с ожирением |
Свободный бег в колесе 12 недель |
↓Cox-2 ↑Faecalibacterium prausnitzii |
|
Evans et al. (17) |
Дикие мыши |
Свободный бег в колесе 12 недель |
↓градиента Firmicutes/Bacteroidetes; ↑Bacteroidetes, ↓Firmicutes; ↓Actinobacteria |
|
Cook et al. (18) |
Дикие мыши |
Тредмил (8-12 м/мин, 40 мин 5 раз в неделю, 6 недель) или бег в колесе (30 дней) |
↑диарея, ↑экспрессия IL-6, IL-1, IL-17, ↑смертность в группе с тредмил-тестом; снижение провоспалительных цитокинов в группе с бегом в колесе |
|
Kang et al. (19) |
Дикие мыши, мыши с индуцированным ожирением |
Бег в колесе с мотором (7 м /мин) 1 ч в день в течение 16 недель |
↓Bacteroidetes; ↑Firmicutes; ↑когнитивных способностей |
|
Denou al. (20) |
Дикие мыши |
Высокоинтенсивные интервальные тренировки 6 недель |
↓градиента Firmicutes/Bacteroidetes |
|
Liu et al. (21) |
Крысы с удаленными яичниками |
Свободный бег в колесе 6 недель |
↓Firmicutes у крыс с низкой толерантностью к физической нагрузке ↑Firmicutes у крыс с высокой толерантностью к физической нагрузке |
|
Allen et al. (22) |
Дикие мыши |
Свободный бег в колесе 6 недель |
↓таксономического разнообразия в группе бегающих мышей |
|
Lambert et al.(23) |
db/db мыши (модель для сахарного диабета 2 типа) |
Тредмил-тест низкой интенсивности 5 дней в неделю 6 недель |
↑Firmicutes, ↓Bacteroidetes:Prevotella spp. у тренированных и не тренированных мышей; ↑Bifidobacterium spp. у тренированных мышей без сахарного диабета |
|
Lamoureux et al. (24) |
Дикие мыши |
Тредмил-тест |
Увеличение таксономического разнообразия микробного сообщества, изменение воспалительных маркеров в тренируемой и контрольной группах |
|
Petriz et al. (25) |
Мыши с ожирением, артериальной гипертензией (SHR) и крысы Вистара |
Тредмил-тест 30 минут в день 4 недели |
↑Firmicutes; ↓Proteobacteria; ↑Lactobacillus во всех группах |
|
Mika et al. (26) |
F344 крысы, молодые и взрослые |
Свободный бег в колесе 6 недель |
↑Bacteroidetes, ↓Firmicutes, ↑таксономического разнообразия в группе молодых животных в сравнении со взрослыми |
Mailing et al продемонстрировали, что разный вид физической нагрузки — произвольный бег мышей в колесе и по беговой дорожке, изменяет микрофлору кишечника в разной степени. (27) В эксперименте Mika et al больших изменений в составе кишечного микробиома при одинаковых физических упражнениях удалось достигнуть молодым животным, эффект был менее значимым с увеличением возраста. (26) Другой группой ученых была подтверждена важная роль диеты в формировании микробиома. Так, при одинаковой физической нагрузке повышение разнообразия состава микрофлоры отмечалось лишь у мышей, получающих корм с большим содержанием жира. (17)
Ученые отмечают, что физическая активность может влиять не только на состав, но и метаболическую активность кишечного микробиома. В экспериментах на животных Matsumoto et al. обнаружено увеличение продукции бактериями бутирата на фоне физических упражнений в течение 5 недель. Бутират представляет собой короткоцепочечную жирную кислоту (КЖК), которая производится микрофлорой кишечника посредством ферментации пищевых волокон. Являясь важным питательным субстратом для колоноцитов, данная КЖК способствует ускорению пролиферации эпителия толстой кишки, поддержанию целостности кишечного барьера, участвует в регуляции иммунитета и экспрессии генов. (15)
Результаты экспериментов с участием животных не позволяют провести полную аналогию с изменением микробима людей при физической нагрузке ввиду отличий в таксономическом составе и метаболизме.
Доказательство влияния физических упражнений на состав кишечного микробиома человека были изначально получены из так называемых поперечных исследований, в которых данные собираются лишь один раз и другие факторы, за исключением искомого, принимаются за константу. (Таблица 2)
Таблица 2. Поперечные исследования с участием людей
|
Исследование |
Участники |
Влияние на кишечный микробиом |
|
Clarke et al., (28) |
Игроки в регби (n = 40), Контрольная группа с низким ИМТ (n = 23) и большим ИМТ (n = 23) |
Больше разнообразия в микробиоме спортсменов; ↑Akkermansia у спортсменов и лиц с низким ИМТ; ↑Erysipelotrichaceae, Prevotella, и Succinivibrio ↓Lactobacillaceae, Bacteroides, и Lactobacillus у спортсменов |
|
Estaki et al., (29) |
Здоровые взрослые добровольцы, занимающиеся фитнесом (n = 39) |
Сила физической нагрузки связана с повышением продукции бутирата и увеличением численности образующих его бактерий |
|
Stewart et al., (30) |
Мужчины, страдающие СД 1 типа с удовлетворительным гилкемическим контролем и занимающиеся физическими упражнениями (n = 10) и здоровые люди (n = 10) |
Не выявлено различий в микрофлоре кишечника при сравнении образцов пациентов с СД 1 типа и здоровых людей |
|
Bressa et al., (31) |
Активные женщины в предменопаузе, занимающиеся физическими упражнениями >3 ч в неделю (n = 19) и не активные (<30 минут 3 дня в неделю, n = 21) |
Повышение численности F. prausnitzii, R. hominis, и A. muciniphila, снижение численности Barnesiellaceae и Odoribacteraceae у активных женщин |
|
Yang et al., (32) |
Женщины в предменопаузе, разной степени физической активности, изначально с избыточным весом или ожирением (n = 71) |
Меньшая физическая нагрузка была связана с меньшим числом Bacteroides и збытком Eubacterium rectale и Clostridium coccoides |
|
Barton et al., (33) |
Игроки в регби (n = 40) и контрольная группа с низким (n = 22) и высоким ИМТ (n = 24) |
У спортсменов выявлено повышение синтеза аминокислот, ускорение метаболизма углеводов, повышение уровня КЖК в сравнении с контрольной группой |
|
Durk et al., (34) |
Здоровые мужчины (n = 20) и женщины (n = 17), занимающиеся регулярными физическими упражнениями |
Физическая нагрузка имела корреляцию с изменением отношения Firmicutes/ Bacteroidetes, увеличением таксономического разнообразия фекальной микробиоты |
Физическая нагрузка имела корреляцию с изменением отношения Firmicutes/ Bacteroidetes, увеличением таксономического разнообразия фекальной микробиоты
Clarke et al. обнаружили, что микробиом игроков в регби имеет большее разнообразие, в сравнении с людьми, не занимающимися спортом. При этом численность видов Bacteroides и Lactobacillus у спортсменов была ниже. (28) В исследовании Bressa et al. у женщин, выполняющих физические упражнения по меньшей мере 3 раза в неделю, отмечено повышение уровня Faecalibacterium prausnitzii, Roseburia hominis, Akkermansia muciniphila. F. prausnitzii и R. hominis известны как продуценты бутирата, в то время как A. muciniphila имеет отношение к снижению массы тела и улучшению метаболических показателей.(31)
Все больше работ посвящено влиянию фитнеса на состав и метаболизм кишечного микробиома. Многие из них подтверждают выявленную на модели животных тенденцию к расширению микробного разнообразия и увеличения продукции КЖК. (27,33) Ограничением указанных исследований служит их дизайн (перекрестные поперечные исследования), отсутствие учета диеты и многих других факторов, также вносящих вклад в изменение микрофлоры кишечника.
Указанные недостатки призваны исправить так называемые лонгитудинальные (протяженные) исследования, позволяющие оценить изменения изучаемого показателя во времени, с учетом влияния на него сопутствующих факторов. Более высокая стоимость, недостаточная приверженность участников и многие другие нюансы определяют меньшее количество научных работ по данной проблеме. (Таблица 3)
Таблица 3. Лонгитудинальные исследования с участием людей
|
Исследование |
Участники |
Физические упражнения |
Влияние на кишечный микробиом |
|
Paulsen et al., (35) |
Пациенты после первичного лечения рака молочной железы (n = 12) |
Пациенты письменно фиксировали физическую нагрузку в течение 3 месяцев |
Достоверное увеличение разнообразие таксономического состава кишечной микрофлоры в течение 3 месяцев |
|
Allen et al., (36) |
Люди с ожирением (ИМТ >30 кг/кв.м) и низкой массой тела (ИМТ<25 кг/кв.м)без предшествовавшей физической активности (n = 32) |
6 недель аэробных упражнений с увеличением нагрузки, 6 недель период без физических упражнений |
Зависимость состава микробиома от начального ИМТ: повышение численности Faecalibacterium у людей с низкой массой тела и снижение ее при ожирении; уменьшение численности Bacteroides у людей с низкой массой тела и повышение ее при ожирении; повышение продукции КЖК у всех. Эффект оказался временным с возвращением к исходным показателям через 6 недель без упражнений |
|
Cronin et al., (37) |
Люди с избыточным весом и ожирением , выполняющие упражнения, дополнительно принимающие протеин, и выполняющие упражнения и принимающие протеин (n = 30 в каждой группе) |
8 недель аэробных нагрузок с возрастанием их тяжести (18–32 мин) и тренировки на выносливость |
Не обнаружено изменений в составе микрофлоры, незначительное изменение метаболизма микрофлоры в группе, выполняющей упражнения и принимающей протеин |
|
Munukka et al., (38) |
Женщины с избыточным весом (n = 17) |
6 недель упражнений (велотренажер) |
Увеличение численности Akkermansia и снижение количества Proteobacteria. Изменения микробиома только у половины участников. Снижение активности генов, влияющих на метаболизм фруктозы и аминокислот |
В исследование Allen et al были включены 32 взрослых волонтера, не занимающиеся спортом, с индексом массы тела (ИМТ) <25 или >30, которым в течение 6 недель была назначена определенная программа упражнений (30-60 мин, 3 раза в неделю) со строгим контролем рациона. В результате ученые обнаружили значительные изменения микробного сообщества в кишечнике вне зависимости от ИМТ. В частности, отмечалось повышение доли Faecalibacterium у лиц с ИМТ< 25, но снижение их доли среди участников с ИМТ >30. Численность Bacteroides, наоборот, оказалась ниже у лиц с ИМТ< 25 после упражнений, в то время как среди участников с ИМТ >30 выявлено увеличение числа данных микроорганизмов. В завершении исследования также отмечалось повышение численности бутират-продуцирующих таксонов, однако лишь у субъектов с ИМТ< 25.(36)
Следующим этапом эксперимента стало изучение состава и метаболической активности кишечного микробиома участников исследования через 6 недель после окончания физических упражнений. В этот период все участники должны были воздержаться от избыточной физической активности, их рацион также учитывался. В результате отмечалось «возвращение» состава микробиоты кишечника к исходному, отмечавшемуся до начала упражнений. Исследователи пришли к выводу, что физические нагрузки имеют транзиторный и обратимый эффект в отношении изменений кишечной микробиоты.(36)
Схожие данные были получены другой группой ученых. Cronin et al. изучили влияние краткосрочных упражнений и биологически активных добавок (БАД), содержащих сывороточный белок, на состав и функции кишечного микробиома у людей с избыточной массой тела и ожирением (n=90). Физические упражнения представляли собой аэробную нагрузку длительностью до 30 мин 3 раза в неделю в течение 8 недель. В завершении исследования не было обнаружено значимых изменений в таксономическом составе или метаболизме среди участников, которые имели физическую нагрузку без приема БАД, в сравнении с началом эксперимента. У лиц, принимавших БАД и выполнявших упражнения имелась тенденция к увеличению разнообразия микробного сообщества, сохранявшаяся в сравнении с группой, получавшей БАД и не занимавшейся физическими упражнениями. Метагеномный анализ выявил незначительные изменения в метаболизме микробиома во всех группах. (37)
Munukka et al. также обратились к проблеме изменения метаболизма кишечного микробиома при физической нагрузке. Участниками исследования стали женщины с избыточным весом, имеющие сидячий образ жизни (n = 17). В завершении 6 недель занятий на велотренажере в составе их микрофлоры отмечалось относительное увеличение численности A. muciniphila и снижение Proteobacteria. Метагеномный анализ выявил снижение экспрессии генов, связанных с метаболизмом фруктозы и аминокислот. (38)
Таким образом, полученные данные свидетельствуют, что физические нагрузки имеют независимое влияние на микробиом кишечника. Тем не менее, для более значимых таксономических и метагеномных изменений, вероятно, требуется увеличение длительности и интенсивности аэробных нагрузок. Микробиота худых людей, вероятно, лучше поддается изменениям посредством упражнений, чем у лиц с избыточной массой тела и ожирением.
Потенциальные механизмы изменений кишечного микробиома при физических упражнениях
В настоящее время ученые не пришли к единой концепции относительно того, какие механизмы лежат в основе влияния физических упражнений на микробиом кишечника. Высказываются различные предположения о потенциальном влиянии многих факторов (Рисунок 1).
Рисунок 1. Модель воздействия физических упражнений на микробиом кишечника с потенциальным влиянием на здоровье человека.
Одной из гипотез служит воздействие на микробиом посредством изменений в лимфоидной ткани кишечника. Иммунные клетки находятся в непосредственной близости от микробного сообщества и производит защитные факторы. Hoffman-Goetz et al в экспериментах на животных продемонстрировали изменение экспрессии генов интраэпителиальных лимфоцитов, снижение регуляторной активности провоспалительных цитокинов, повышение продукции противовоспалительных цитокинов и антиоксидантов. (39)
Наряду с этим, упражнения могут способствовать поддержанию целостности слизистого барьера кишечника. Слизь играет важную роль в защите эпителиоцитов от микробной адгезии и служит необходимым субстратом для определенных бактерий, например, A.muciniphila.(40)
Физические упражнения увеличивают температуру тела и дают определенную нагрузку на сердечно-сосудистую систему, что приводит к снижению интестинального кровотока более чем на 50%, с развитием значительной ишемии через 10 минут в среднем, при упражнениях высокой интенсивности. Во время отдыха кровоток в органах быстро восстанавливается. Эпителиальные клетки кишечника в качестве источника энергии используют кислород, таким образом интенсивная физическая нагрузка приводит к транзиторному нарушению их метаболизма и кратковременному снижению функции белков плотных контактов, а следовательно целостности эпителиального барьера. (41) Предположительно, ввиду этого иммунные клетки, находящиеся в непосредственной близости от кишечного барьера, в короткий период ишемии непосредственно могут взаимодействовать с микробиотой, с последующим изменением ее таксономического состава. (42) Несмотря на то, что повышение кишечной проницаемости отмечается транзиторно при внезапной сильной физической нагрузке, этот эффект может быть нивелирован при регулярной физической активности. Ученые оценивают физические упражнения как положительный стрессовый фактор для кишечника, стимулирующий адаптацию и улучшающий прочность кишечного барьера в длительной перспективе. (43)
Не менее важным механизмом, посредством которого упражнения влияют на кишечный микробиом, служит изменение моторики и энтеральной нервной системы кишечника. Активность поперечнополосатой мускулатуры способствует активации гладких мышечных волокон в стенке ЖКТ, благодаря чему снижается время транзита содержимого в толстой кишке. (44) В то же время активация автономной нервной системы увеличивает одновременно симпатический тонус и влияние вагуса. Физические упражнения значительно ускоряют метаболический поток, что стимулирует высвобождение миокинов, нейроэндокринных гормонов, которые взаимодействуют с кишечником и его микрофлорой напрямую или через иммунные пути (45). (Рисунок 2)
Рисунок 2. Блок-схема функций микробиома кишечника и его взаимодействия с другими органами и системами в норме и при патологии.
Выделение большого количества лактата при физической нагрузке может менять рН внутри кишечника ввиду секреции данного вещества в его просвет.
Ускорение двигательной активности кишечной трубки опосредованно влияет на изменение рН, секрецию слизи, формирование биопленок микрофлорой и доступность питательных веществ для бактерий. Отмечается также повышение продукции мозгового нейротрофического фактора, который положительно влияет на настроение и снижает вероятность развития депрессивных и тревожных расстройств. (46)
Кроме того, физические упражнения могут способствовать изменению энтерогепатической циркуляции желчных кислот. Meissner et al. было установлено, что у мышей с гиперхолестеринемией после бега внутри колеса на протяжении 12 недель отмечается повышение секреции желчных кислот и их выделения с фекалиями. Желчные кислоты выделены в качестве одного из факторов, определяющих структуру кишечного микробиома, и изменение их экскреции может существенно отразиться на таксономическом составе микробиома кишечника. (47)
Еще одним механизмом, изученным недостаточно на сегодня, служит так называемый метаболический поток, под которым понимают скорость оборота молекул через метаболические пути. (48)
Таким образом, существует множество различных механизмов, потенциально ответственных за изменение кишечного микробиома на фоне физических упражнений. Необходимы дальнейшие исследования для уточнения приведенных гипотез.
Будущие перспективы
В целом, все больше данных свидетельствуют о том, что регулярные занятия физическими упражнениями благоприятно влияют на таксономический состав и метаболизм кишечной микробиоты. (49) Это может частично объяснять наблюдающийся положительный эффект регулярной физической активности на здоровье человека. Несмотря на увеличивающееся количество экспериментов в области изменений микробиома кишечника при физической нагрузке, остается много вопросов, ответить на которые призваны будущие исследования. В частности, необходимо выяснить, какая частота, режим и интенсивность упражнения лучше для профилактики заболеваний и их осложнений, как физические нагрузки влияют на кишечный микробиом детей и пожилых людей. Взаимодействие упражнений с рационом питания, возможность добавления пробиотиков и пребиотиков при этом также остается неизученным вопросом.
Важным недостатком исследований, который необходимо устранить в будущем, служит отсутствие оценки влияния упражнений на представителей, не относящихся к бактериям (археи, грибы, вирусы).
Тем не менее, с учетом возрастающей доступности метагеномных методов исследования микробиома, решение указанных вопросов представляется возможным. В перспективе полученные данные способны сформировать новый, основанный на индивидуальном подходе к изменению микробиома кишечника, с учетом физических упражнений и диеты.
Список литературы:
1. Codella R, Terruzzi I, Luzi L. Sugars, exercise and health. J. Affective Disord2017;224:76–86.
2. Brestoff JR, Artis D. Commensal bacteria at the interface of host metabolism and the immune system. Nat. Immunol. 2013; 14(7):676–84.
3. Morgan XC, Huttenhower C. Meta’omic analytic techniques for studying the intestinal microbiome. Gastroenterology. 2014; 146(6):1437–1448.e1.
4. Scott KP, Jean-Michel A, Midtvedt T, van Hemert S. Manipulating the gut microbiota to maintain health and treat disease. Microb. Ecol. Health
Dis. 2015; 26(1):25877.
5. HumanMicrobiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012; 486(7402):207–14.
6. Perez-Muñoz ME, Arrieta M-C, Ramer-Tait AE, Walter J. A critical assessment of the «sterile womb» and «in utero colonization» hypotheses: implications for research on the pioneer infant microbiome. Microbiome. 2017; 5(1):48.
7. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics. 2006; 118(2):511–21.
8. Marchesi JR, Adams DH, Fava F, et al. The gut microbiota and host health: a new clinical frontier. Gut. 2015; 65(2):330–9.
9. Maier L, Pruteanu M, Kuhn M, et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature. 2018; 555(7698):623–8.
10. David LA,Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014; 505(7484):559–63.
11. Evans JM, Morris LS, Marchesi JR. The gut microbiome: the role of a vir-tual organ in the endocrinology of the host. J Endocrinol 2013;218:R37–47
12. WHO Information sheet: global recommendations on physical activity forhealth 5–17 years old. WHO; 2015.
13. Clarke SF, Murphy EF, O’SullivanO, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014; 63(12):1913–20.
14. Hsu YJ, Chiu CC, Li YP, Huang WC, Huang Y Te, Huang CC, et al. Effect ofintestinal microbiota on exercise performance in mice. J Strength Cond Res2015;29:552–8
15. Matsumoto M, Inoue R, Tsukahara T, Ushida K, Chiji H, Matsubara N, et al.Voluntary running exercise alters microbiota composition and increasesn-butyrate concentration in the rat cecum. Biosci Biotechnol Biochem2008;72:572–6
16. Campbell SC, Wisniewski PJ, Noji M, McGuinness LR, Häggblom MM,Lightfoot SA, et al. The effect of diet and exercise on intestinalintegrity and microbial diversity in mice. PLoS One 2016;11:e0150502
17. Evans CC, LePard KJ, Kwak JW, Stancukas MC, Laskowski S, Dougherty J,et al. Exercise prevents weight gain and alters the gut microbiota in amouse model of high fat diet-induced obesity. PLoS One 2014;9:e92193
18. Cook MD, Allen JM, Pence BD, Wallig MA, Gaskins HR, White BA, et al. Exer-cise and gut immune function: evidence of alterations in colon immune cellhomeostasis and microbiome characteristics with exercise training. ImmunolCell Biol 2016;94:158–63
19. Dietand exercise orthogonally alter the gut microbiome and reveal indepen-dent associations with anxiety and cognition. Mol Neurodegener 2014;9:36,http://dx.doi.org/10.1186/1750-1326-9-36.
20. Denou E, Marcinko K, Surette MG, Steinberg GR, Schertzer JD. High-intensityexercise training increases the diversity and metabolic capacity of the mousedistal gut microbiota during diet-induced obesity. Am J Physiol EndocrinolMetab 2016;310:E982–93
21. Liu T-W, Park Y-M, Holscher HD, Padilla J, Scroggins RJ, Welly R, et al.Physical activity differentially affects the cecal microbiota of ovariectomizedfemale rats selectively bred for high and low aerobic capacity. PLoS One2015;10:e0136150
22. Allen JM, Berg Miller ME, Pence BD, Whitlock K, Nehra V, Gask-ins HR, et al. Voluntary and forced exercise differentially alters thegut microbiome in C57BL/6J mice. J Appl Physiol 2015;118:1059–66
23. Lambert JE, Myslicki JP, Bomhof MR, Belke DD, Shearer J, Reimer RA. Exercisetraining modifies gut microbiota in normal and diabetic mice. Appl PhysiolNutr Metab 2015;40:749–52
24. Lamoureux EV, Grandy SA, Langille MGI. Moderate exercise has lim-ited but distinguishable effects on the mouse microbiome. mSystems2017;2:e00006–17
25. Petriz BA, Castro AP, Almeida JA, Gomes CP, Fernandes GR, KrugerRH, et al. Exercise induction of gut microbiota modifications inobese, non-obese and hypertensive rats. BMC Genomics 2014;15:511
26. Mika A, Van Treuren W, González A, Herrera JJ, Knight R, Fleshner M. Exer-cise is more effective at altering gut microbial composition and producingstable changes in lean mass in juvenile versus adult male F344 rats. PLoS One2015; 10:e0125889
27. Mailing LJ, Allen JM, Buford TW, Fields CJ, Woods JA.Exercise and the Gut Microbiome: A Review of the Evidence, Potential Mechanisms, and Implications for Human Health.xerc Sport Sci Rev. 2019 Apr;47(2):75-85.
28. Clarke SF, Murphy EF, O’SullivanO, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014; 63(12):1913–20.
29. EstakiM, Pither J, Baumeister P, et al. Cardiorespiratory fitness as a predictor of intestinal microbial diversity and distinct metagenomic functions. Microbiome. 2016; 4:42.
30. Stewart CJ, Nelson A, Campbell MD, et al. Gut microbiota of Type 1 diabetes patients with good glycaemic control and high physical fitness is similar to people without diabetes: an observational study. Diabet. Med. 2017; 34:127–34.
31. Bressa C, Bailén-AndrinoM, Pérez-Santiago J, et al. Differences in gutmicrobiota profile between women with active lifestyle and sedentary women. PLoS One. 2017; 12(2):e0171352.
32. Yang Y, Shi Y,Wiklund P, et al. The association between cardiorespiratory fitness and gut microbiota composition in premenopausal women. Nutrients. 2017; 9(8):792.
33. Barton W, Penney NC, Cronin O, et al. The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level. Gut. 2018; 67(4):625–33.
34. Durk RP, Castillo E, Márquez-Magaña L, et al. Gut microbiota composition is related to cardiorespiratory fitness in healthy young adults. Int. J. Sport Nutr. Exerc. Metab. 2018; 1–15.
35. Paulsen JA, Ptacek TS, Carter SJ, et al. Gut microbiota composition associated with alterations in cardiorespiratory fitness and psychosocial outcomes among breast cancer survivors. Support Care Cancer. 2017; 25(5):1563–70.
36. Allen JM, Mailing LJ, Niemiro GM, et al. Exercise alters gut microbiota composition and function in lean and obese humans. Med. Sci. Sports Exerc. 2018; 50(4):747–57.
37. Cronin O, Barton W, Skuse P, et al. A prospective metagenomic and metabolomic analysis of the impact of exercise and/or whey protein supplementation on the gut microbiome of sedentary adults. mSystems. 2018; 3(3):e00044–18.
38. Munukka E, Ahtiainen JP, Puigbó P, et al. Six-week endurance exercise alters gut metagenome that is not reflected in systemic metabolism in
39. PackerN,Hoffman-Goetz L. Exercise training reduces inflammatory mediators in the intestinal tract of healthy older adult mice. Can. J. Aging. 2012; 31(2):161–71.
40. Hoffman-Goetz L, Pervaiz N, Guan J. Voluntary exercise training in mice increases the expression of antioxidant enzymes and decreases the expression of TNF-alpha in intestinal lymphocytes. Brain Behav. Immun. 2009; 23(4):498–506.
41. vanWijck K, Lenaerts K, van Loon LJ, PetersWH, BuurmanWA,Dejong CH. Exercise-induced splanchnic hypoperfusion results in gut dysfunction in healthy men. PLoS One. 2011; 6(7):e22366.
42. Otte JA, Oostveen E,Geelkerken RH, GroeneveldAB, Kolkman JJ. Exercise induces gastric ischemia in healthy volunteers: a tonometry study. J. Appl. Physiol. 2001; 91(2):866–71.
43. Lira FS, Rosa JC, Pimentel GD, et al. Endotoxin levels correlate positively with a sedentary lifestyle and negatively with highly trained subjects. Lipids Health Dis. 2010; 9:82.
44. Dainese R, Serra J, Azpiroz F, Malagelada J-R. Effects of physical activity on intestinal gas transit and evacuation in healthy subjects. Am. J. Med. 2004; 116(8):536–9.
45. Freeman JV, Dewey FE, Hadley DM, Myers J, Froelicher VF. Autonomic nervous system interaction with the cardiovascular system during exercise. Prog. Cardiovasc. Dis. 2006; 48(5):342–62.
46. Song BK, Cho KO, Jo Y, Oh JW, Kim YS. Colon transit time according to physical activity level in adults. J. Neurogastroenterol. Motil. 2012; 18(1):64–9.
47. Meissner M, Lombardo E, Havinga R, Tietge UJ, Kuipers F, Groen AK. Voluntary wheel running increases bile acid as well as cholesterol excretion and decreases atherosclerosis in hypercholesterolemic mice. Atherosclerosis. 2011; 218(2):323–9.
48. Egan B, Zierath JR. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 2013; 17(2):162–84.
49. Warburton DE,Nicol CW, Bredin SS.Health benefits of physical activity:the evidence. CMAJ. 2006; 174(6):801–9.
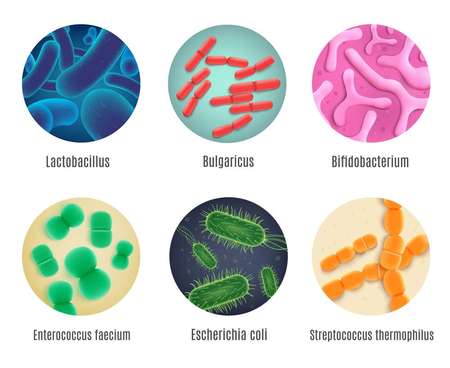
В кишечнике обитают миллионы бактерий, которые в совокупности известны как микробиом. Это сообщество микроорганизмов играет центральную роль в сохранении здоровья человека, «обучая» иммунные клетки поддерживать иммунный гомеостаз. Микробиота кишечника разнообразна и состоит из множества различных видов бактерий. Согласно данным проекта «Микробиом человека» (The Human Microbiome Project), в кишечнике содержится до 10 тысяч различных видов, насчитывающих триллионы клеток: полезные комменсальные бактерии, такие как Bifidobacterium и Lactobacillus, нейтральные штаммы, а также некоторые потенциально вредные бактерии, такие как Clostridia.
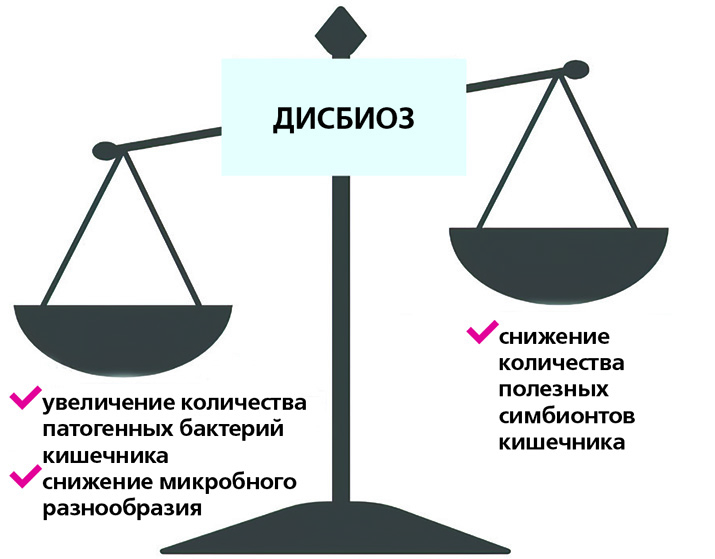
В зависимости от разнообразия и баланса бактерий кишечника микробиом может ингибировать либо способствовать развитию иммунного ответа. Несбалансированный микробиом, известный как дисбиоз, связан с хроническим воспалением и может увеличить риск развития воспалительных заболеваний кишечника, аутоиммунных патологий и других болезней. Однако воздействуя на микробиом кишечника, можно предотвратить развитие воспалительных реакций.
Регуляция баланса микроорганизмов

Ключ к созданию и управлению здоровой микробиотой кишечника и таким образом к реализации ее полезного воздействия на здоровье человека — в регуляции баланса между полезными и патогенными микроорганизмами.
Диета играет решающую роль, не только обеспечивая сбалансированность поступления энергии, но и поставляя определенные питательные вещества, которые непосредственно влияют на состав микробиоты.
Добавление пребиотиков необходимо для оптимальной функции кишечной микробиоты. Положительное влияние пребиотиков на рост и активность микробиоты хорошо изучено, в частности, способность питать полезные комменсальные бактерии, одновременно помогая подавлять вредные.
Роль микробиоты
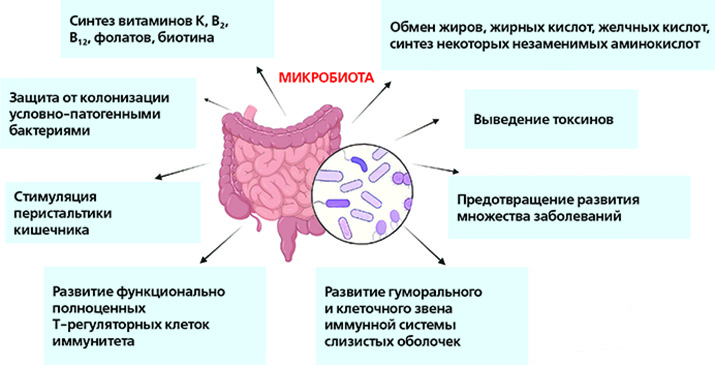
Ключевые функции бактерий кишечника связаны с метаболизмом, синтезом многих веществ, защитой от инвазии патогенов и регуляцией иммунной системы.
Если бы не кишечный микробиом, организму не хватало бы ряда полезных для него веществ, включая витамины и аминокислоты. Одной из важнейших ролей кишечного микробиома является способность к ферментации неперевариваемых волокон. Эти волокна выступают питательными веществами для группы, производящей короткоцепочечные жирные кислоты (КЦЖК). Наиболее необходимые производимые КЦЖК — ацетат, пропионат и бутират.
Бутират является важным источником энергии для клеток внутренней оболочки толстой кишки (колоноцитов). Считается, что недостаток КЦЖК играет ключевую роль во многих проблемах, связанных с микробиомом, а также приводит к запуску местного воспаления. Бутират выполняет ряд функций в организме человека, включая способность вызывать апоптоз клеток рака толстой кишки, участвует в активации кишечного глюконеогенеза, что имеет значение для энергетического баланса и связано с патогенезом сахарного диабета. Кроме того, он также может стимулировать «иммуноуспокаивающие» Treg клетки.
Пропионат необходим для контроля уровня глюкозы, поскольку он регулирует глюконеогенез в печени и участвует в передаче сигналов о насыщении.
Ацетат участвует в регуляции метаболизма внекишечных тканей, включая метаболизм холестерина и липогенез.
Связь между кишечником и иммунной системой
Пищеварительную систему называют первичной системой иммунной защиты, поскольку она является основным звеном между внешней средой и внутренними системами нашего организма. Иммунная система и микробиота кишечника находятся в симбиотических отношениях, чтобы поддерживать и регулировать друг друга. Значимость этого взаимодействия подчеркивается тем фактом, что 70–80 % иммунных клеток организма находятся в кишечнике.
Микробиота кишечника формируется у новорожденных и сохраняется на протяжении всей жизни. По мере развития организма микробиота участвует в формировании иммунной системы, а та в свою очередь влияет на состав микробиоты. Здоровый пищеварительный тракт защищает организм от внешних факторов.
Полезные бактерии в кишечнике, такие как Bifidobacterium и Lactobacillus, принимаю участие в регуляции иммунной системы: подавляют рост патогенов, конкурируют за биологические вещества, поддерживают развитие иммунных клеток, борясь с воспалением, защищают кишечный барьер, вырабатывая продукты метаболизма и способствуя регуляции иммунных ответов.
Помимо «обучения» иммунных клеток, кишечные бактерии и их метаболиты могут «успокаивать» иммунную систему или вызывать развитие воспалительных реакций. Новые исследования также показывают, что состав микробиома может влиять на выработку интерлейкина-10, мощного противовоспалительного цитокина.
С другой стороны, некоторые бактерии производят провоспалительные вещества, активируя цитокины и Т-хелперы, запуская иммунный ответ.
Грамотрицательные бактерии содержат липополисахариды в своей внешней оболочке, эндотоксин, который способствует воспалительной реакции. Когда грамотрицательные бактерии погибают, эндотоксины выделяются в окружающую среду. Если эти соединения пересекают слизистую оболочку кишечника и попадают в кровоток, они могут привести к хроническому и системному воспалению.
В частности, дисбаланс в микробиоме связан с повышенной проницаемостью эпителиального барьера кишечника, более известной как «дырявый кишечник». Липополисахариды бактерий могут попасть в системный кровоток, вызывая развитие воспалительных реакций со стороны рецепторов клеток иммунитета.
В отличие от генов микробиом динамичен и реагирует на диету и образ жизни. Поэтому мы можем поддержать иммунное здоровье, соблюдая диету, богатую пребиотическими растительными волокнами и с низким содержанием жиров. Таким образом стимулирется выработка противовоспалительных метаболитов, таких как бутират.
Дисбаланс в кишечнике может стать активатором болезни
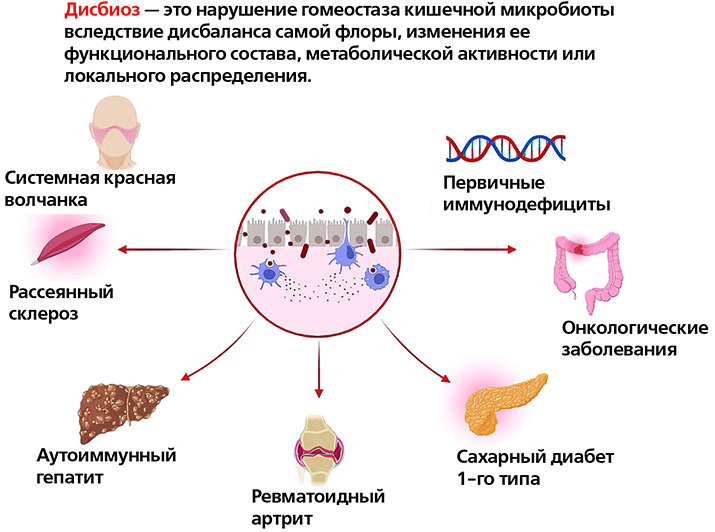
Изменения в микробиоте кишечника коррелируют почти со всеми известными иммунологическими заболеваниями, но в большинстве случаев остается неясным, являются ли эти изменения причиной или следствием заболевания либо просто отражением эпидемиологических различий между группами. Представители микробиоты кишечника участвуют в модуляции иммунитета организма, а также в развитии и прогрессировании множества заболеваний: атеросклероза, ожирения, СД 1-го типа, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, хронической обструктивной болезни легких, атопических заболеваний, депрессии, аутизма и др.
Есть мнение, что микробиота кишечника может быть связана с развитием таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона. Действительно, существует двунаправленная связь между кишечником и мозгом, так называемая ось «мозг — кишечник», и микробиота кишечника может влиять на взаимодействие этих органов. Вот почему наш кишечник иногда называют вторым мозгом.
Изменения микробиоты при первичных иммунодефицитах
Первичные иммунодефициты (ПИД) — группа гетерогенных генетических заболеваний, приводящих к развитию как качественной и (или) функциональной недостаточности, так и к неконтролируемой активации пролиферации иммунокомпетентных клеток и формированию аутоиммунных, аутовоспалительных и аллергических заболеваний. Генетические дефекты, вызывающие ПИД, приводят к нарушениям традиционных механизмов, лежащих в основе гомеостаза в кишечнике, при этом происходит нарушение иммунного надзора за кишечным барьером, изменение кишечной проницаемости, бактериальная транслокация.
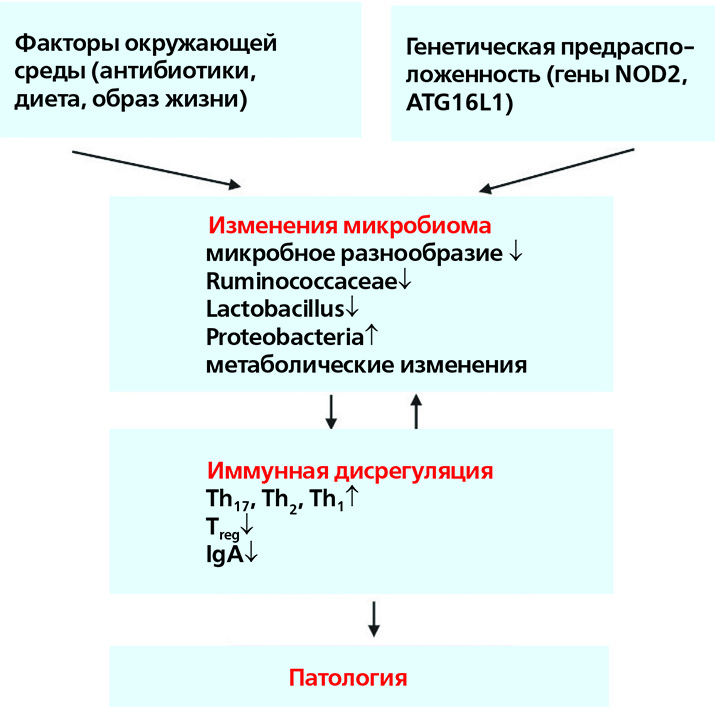
Под влиянием определенных факторов окружающей среды и генетической предрасположенности человека аберрантные взаимодействия между микробиомом и иммунной системой хозяина способствуют развитию различных иммуноопосредованных нарушений.
Например, при ВЗК-подобных патологиях, часто возникающих у пациентов с ПИД, использование антибиотиков или диетические изменения при наличии генетической предрасположенности (например, мутация NOD2) могут привести к изменениям конфигурации микробиома кишечника, включая уменьшение богатства и нарушение таксономического и метаболитного состава. Эти изменения микробиома тесно связаны с аберрантными иммунными реакциями слизистых оболочек, включая усиленные реакции клеток типа Th17, Th1 и Th2, подавление Т-регуляторных клеток и нарушение регуляции гуморального иммунитета. В конечном итоге это может привести к хроническому, клинически выраженному воспалению кишечника и повреждению тканей.
По многочисленным литературным данным, ассоциированные со здоровьем микробные сообщества истощены у пациентов с ПИД. Микробные сообщества кишечника у таких пациентов значительно отличаются от здоровых по разнообразию и составу. Одной из объединяющих характеристик микробиома при ПИД является снижение разнообразия бактерий кишечника.
Другой общей чертой исследований у пациентов с ПИД является транслокация липосахаридов (ЛПС) в воспалительных очагах и в системном кровотоке. Бактериальный ЛПС связан с хронической иммунной активацией и иммунной дисрегуляцией.
Микробиота при аутоиммунных патологиях
Данные убедительно свидетельствуют о том, что существует определенная степень взаимодействия между аутоиммунным заболеванием и здоровьем микробиома кишечника. Однако необходимы дополнительные исследования, чтобы определить, являются ли нарушения микробиома причиной аутоиммунного заболевания, следствием или и тем, и другим сразу.
Микробиом пациентов с системной красной волчанкой, по литературным данным, характеризуется значительным снижением микробного разнообразия, а также увеличением численности вида Ruminococcus gnavus. Эти изменения также коррелируют с тяжестью течения заболевания.
Существует очевидная связь между обострениями болезни Крона и численностью бактерий Ruminococcus gnavus в кишечнике. R. gnavus является типичным представителем микробиома кишечника человека, но производит вредные полисахариды, оказывающие в большом количестве воспалительное действие на организм.
При СД 1-го типа у пациентов часто наблюдается «дырявый кишечник», Исследования показывают, что дисбиоз может влиять на патогенез СД 1-го типа, воздействуя на иммунный гомеостаз и тем самым приводя к данному патологическому состоянию.
Проводятся также исследования по анализу микробиома у пациентов с рассеянным склерозом: отмечается дисбиоз, особенно при отсутствии или чрезмерном преобладании нескольких родов и видов микробов.
Среди них некоторые виды вовлечены в повышенную экспрессию генов, которые участвуют как во врожденном, так и в адаптивном иммунитете.
Еще одним аутоиммунным заболеванием, при котором отмечаются изменения микробиома, является ревматоидный артрит: по сравнению с составом бактерий кишечника здоровых людей, у пациентов с ревматоидным артритом отмечается повышенная численность одних бактерий и сниженное количество других, что приводит к воспалительным реакциям в кишечнике.
Микробиом и онкология
Считается, что взаимодействие между микробиотой кишечника и иммунной системой влияет на иммунный надзор за онкологическими заболеваниями. При раке толстого кишечника уничтожение опухолей естественными киллерами (NK-клетками) напрямую ингибируется присутствием вида Fusobacterium nucleatum в микроокружении опухоли.
Более высокое количество бактерий F. nucleatum при колоректальном раке связано с более низкой плотностью CD3+T-клеток — популяции клеток иммунной системы, связанной с более благоприятным клиническим исходом. В печени комменсальные бактерии рода Clostridium желудочно-кишечного тракта используют желчные кислоты в качестве мессенджеров для усиления противоопухолевого эффекта печеночных клеток CXCR6+ NKT, поражая как первичные, так и метастатические опухоли печени.
Различные мировые исследователи пришли к выводу о том, что микробиом также модулирует ответы противоопухолевой иммунотерапии. Например, более высокое содержание комменсалов Bifidobacterium longum, Collinsella aerofaciens и Enterococcus faecium стимулирует более благоприятный Т-клеточно-опосредованный ответ на анти-PD-1-терапию у пациентов c меланомой.
Описана положительная корреляция между количеством таксона Akkermansia muciniphila и эффективностью блокады PD-1 у пациентов с эпителиальными опухолями. Иммунный ответ на другие противораковые методы лечения онкологических заболеваний, включая блокаду CTLA-4 и циклофосфамид, также был связан с различными конфигурациями микробиома кишечника. Выяснение роли кишечного микробиома в противоопухолевом иммунном надзоре и иммунотерапии может иметь большие перспективы в оптимизации ответа на лечение у онкологических больных.
Автор: врач-инфекционист, аллерголог-иммунолог
Гордиенко Наталия Николаевна
Что такое микробиота человека, какие функции она выполняет, что негативно влияет на нее, и к каким последствиям приводит нарушение микробиома, расскажем в нашей статье.
Микробиота человека – новый взгляд на «микрофлору»
Термин микробиом был впервые предложен в 2001 году для обозначения коллективного сообщества микроорганизмов. Микробиом представляет собой всё разнообразие бактерий, которые находятся как внутри, так и снаружи нашего организма.
Раньше в этом понимании использовался термин «микрофлора», но от него отказались. Все-таки «флора» — это растительный мир, а не огромное разнообразия микромира человеческого организма.
Новая эпоха в изучении кишечного микробиома наступила всего лишь 5-10 лет назад и связана с появлением молекулярно-генетических методов исследования. Они перевернули представления о микромире.
Пришло абсолютно новое понимание необходимости присутствия в человеческом организме дружественных нам микроорганизмов не только для нашего пищеварения, но и для тела и здоровья в целом.
Сегодня организм человека рассматривается как сложнейший суперорганизм. Это симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, включая архибактерии и вирусы. Он обильно заселен микроорганизмами, численность которых составляет миллиарды. Количество видов бактерий колеблется от 2,5 до 4 тысяч, а штаммов – до 70 тысяч!
При этом микромир каждого человека индивидуален. Видовой состав относительно стабилен у каждого из нас. Общее содержание бактерий и количество их видов у разных людей может различаться в 12 – 2200 раз. Неповторим не только наш набор хромосом, но и свой набор микробиома.
Более 60% представителей всей микрофлоры колонизирует кишечник человека. Практически весь потенциал кишечной микробиоты локализован в толстой кишке.
Почему микробиота так важна для человека?
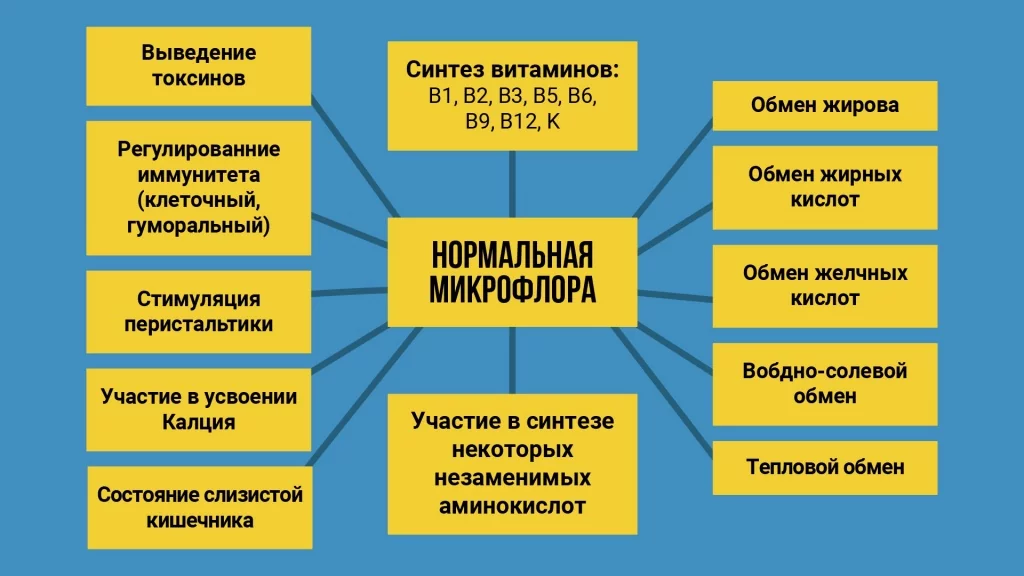
Микробиота играет важную роль в поддержании нашего здоровья. В настоящее время микробиом человека рассматривается как единый метаболически активный орган. Микробиота и слизистые нашего организма постоянно взаимодействуют и оказывают взаимное влияние друг на друга.
- Одна из основных функций микробиоты – это создание колонизационной резистентности. Это механизм на нашей слизистой оболочке, который предотвращает заселение «плохих», экзогенных или внешних микроорганизмов, и их избыточный рост. Природа не терпит пустоты. Если слизистые плотно закрыты нормальными здоровыми биопленками, то «заселять» болезнетворные бактерии эти слизистые не могут. Их не пустит нормальная микробиота. Это — важный защитный механизм.
- Синтез веществ. Это и синтез органических кислот, и синтез перекиси, и подавление роста экзогенных микробов за счет выработки тех же органических кислот или той же перекиси. Благодаря этой функции происходит санация нашей внутренней среды от болезнетворных бактерий.
- Конкуренция за места прикрепления на слизистых и источники питания. Конкуренция за прикрепление к слизистой бактерий жесткая в мире микроорганизмов. Есть такой научный термин как адгезия. Прежде чем наступит бактериальное воспаление, должна произойти адгезия или «прилипание» болезнетворной бактерии на том или ином участке слизистой, либо кожи. Наша здоровая микрофлора не дает возможности произойти адгезии.
- Газовый обмен. Микробиома участвует в регуляции газового обмена в кишечнике и других полостях организма.
- Производство энзимов, участвующих в метаболизме белков, жиров, углеводов.
- Детосикация. Нормальная здоровая микробиота активно проводит в организме детоксикацию. Интоксикация же организма происходит из-за экзогенных, попавших извне в организм токсинов, из-за эндогенных, продуцированных внутри организма токсичных субстратов и метаболитов, и, большей частью будет нейтрализована нашими «дружественными» бактериями. Микробиом — это огромный естественный био-сорбент.
- Образование свободных метаболитов, образование желчи.
- Повышение резистентности эпителиальных клеток к мутагенам или канцерогенам. Поступая из внешней или внутренней среды, мутгены способны вызвать мутацию на слизистых и, соответственно, привести к развитию онкозаболевания. Предотвращение воздействия мутагенов на клетку слизистой — это одна из функций микробиоты. Если микробиота будет качественной, слизистая будет защищена, в том числе и от воздействия мутагенов.
- Канцеролитическая функция. Если произошла поломка в геноме клетки, и она начинает безудержный рост, это означает образование онкозаболевания. Нормальная микробиота вырабатывая свои энзимы, интерфероны, будет оказывать «останавливающее» действие на опухоль.
- Функция хранилища генов. Микробиом является гигантским хранилищем микробных, плазмидных и хромосомных генов. Возможно удаление, встраивание генов, «ремонт поломки» генов происходит благодаря наличию хранилища микробных плазмидов. Получается, что у клеток иммунной системы, у клеток которые занимаются контролем генетической чистоты, всегда «под рукой» есть материал, чтобы «залатать», «подремонтировать» любые сбои в геноме человека.
Миробиота кишечника – источник иммунитета
Кишечник выполняет важную роль в иммунной системе в работе иммунных механизмов на уровне интестинального (желудочно-кишечного)тракта. В этом процессе принимают участие три ключевых компонента.
- Нормальная, здоровая микробиота
- Сама слизистая, правильнее сказать, лимфоидная ткань слизистой.
- Цитокины. Цитокины — это фактор межклеточного воздействия. Люди могут дотронуться друг до друга, сказать что-то вербально, а бактерии между собой общаются с помощью цитокинов . Цитокин воспринимается другой бактерией как информация.
Влияние микробиоты на формирование иммунитета
Врожденный адаптивный иммунитет вырабатывается при взаимодействии микробиоты и макроорганизма. Контакт с микробами в кишечнике приводит к активации различных клонов лимфоцитов. Они как бы учатся бороться с «врагом». Это влияние потом будет сохраняться, когда лимфоциты переместятся из подслизистого слоя в кишечнике в общий кровоток. Так будет формироваться стимуляция или «дрессировка» наших клеток иммунной системы постоянным присутствием бактерий. В роли «дрессировщика» будет выступать наша нормальная микробиота.
Влияние нормальной микробиоты человека на иммунную систему складывается из нескольких моментов.
Во-первых, это слизистая кишечника, особенно толстой кишки. Из-за массивного заселения бактериями она обильно инфильтрирована макрофагами, лимфоцитами, плазматическими клетками. «Клетки белой крови», которые присутствуют на слизистых, поддерживают там перманентно текущий или хронический воспалительный процесс. Они всегда пребывают в состоянии активности, «войны», к этому их и принуждает микробиота.
Почему это важно? Если в человеческий организм попал болезнетворный агент, а там уже присутствуют и лимфоциты, и макрофаги, они будут нейтрализовывать «врага».
Во-вторых, под воздействием нормальной микробиоты синтезируются естественные или нормальные антитела, которые будут реагировать на всевозможные антигены, возбудители. Если нормально работает иммунная система человека, она готова расправиться с «врагом». Именно микробиота будет стимулировать и дрессировать наши клетки иммунитета.
В-третьих, в кишечнике постоянно находятся до семидесяти процентов всех лимфоцитов, которые затем циркулируют в организме. Они контактируют с агентами и нормальной, и условно патогенной флоры, и болезнетворными бактериями. Затем лимфоциты, циркулируя в организме, разносятся и, так называемые, «клетки памяти», будут формировать уже отдалённую иммунную защиту.
В-четвертых, микробиота стимулирует и индуцирует синтез интерферонов, стимулирует лимфоидный аппарат кишечника.
Какие условия необходимы для нормальной работы микробиоты
Что же это за факторы, которые будут угнетать или стимулировать микробиом человека. Чтобы нормально, как единый оркестр в унисон, работала наши дружественные бактерии им нужны определенные условия.
Факторы, влияющие на микробиом человека
- Химиотерапевтические. От воздействия химического агента, особенно химиотерапии (при лечении онобольных), микробиом будет сильно страдать.
- Постлучевое воздействие. Ионизирующее излучение воздействует на все живое пагубно и будет пагубно влиять на микробиом. Может развиваться аплазия костного мозга, гибель микробиоты в целом, гибель эпителия, слизистой кишечника. На фоне ионизирующей радиации механизм воздействия на иммунную систему нашей микробиоты будет практически обнуляться.
- Постинфекционной фактор. После перенесенных инфекций, в том числе и после коронавируса, состояние микробиоты ухудшается. Поскольку микробиом модулирует иммунный ответ, любой серьезный инфекционный агент, как-то — бактериальный, вирусный либо агрессивный грибковый — разрушительно влияет на нормальную микробиоту. Искажает, ухудшает, приводит к гибели определенных клонов и заселению клонами патогенных клеток.
- Стрессовые факторы. Любой стрессовый фактор будет негативно влиять на микробиому, будь это: психогенный стресс, тепловой стресс, химический стресс, длительное пребывание в депрессивном состоянии.
- Наследственность. Говоря о наследственности, стоит обратить внимание на присутствие или отсутствие ферментопатий. Если в желудочно-кишечном тракте существует генетически обусловленная ферментопатия, и есть ряд продуктов, которые человек не в состоянии переваривать из-за того, что не вырабатываются энзимы для расщепления этого продукта питания, микробиота будет тоже страдать.
- Экологические факторы. Загрязнение окружающей среды — не будет улучшать «внутренний мир» человека, и это отразится в конечном итоге на его здоровье.
- Использование антибиотиков. Как в питании, так и при лечении. Современные методы животноводства, птицеводства широко используют антибиотики. При изготовлении продуктов питания применяют консерванты, бытовые дезинфектанты. В супермаркетах продукты могут храниться неделями, иногда месяцами, не теряя своего товарного вида. В процессе хранения продуктов используются всевозможные средства воздействия для остановки бактериального роста. Они тоже проникают в наш организм.
Антибиотикотерапия, которую мы используем для лечения тех или иных инфекционных заболеваний, а, достаточно часто необоснованно и бесконтрольно, убивает собственную микробиоту. Конечно, прием антибиотиков предотвращает развитие грозных осложнений, тяжелых заболеваний, благодаря антибиотикам человечество смогло увеличить продолжительность жизни и снизить смертность. Но эра антибиотиков серьезно бумерангом ударила по микробиому.
Каковы последствия изменения микробиома
Изменения микробиомы человека, приводят к серьезным последствиям. Самые распространенные из них:
- синдром раздраженного кишечника
- развитие бронхиальной астмы
- развитие пищевых аллергий
- всевозможные воспалительные заболевания в кишечнике вплоть до формирования язвенного колита
- болезнь Крона
- аутоиммунные заболевания
- аторосклероз
- сахарный диабет второго типа
- заболевания печени
- заболевания нервной системы
- болезнь Паркинсона
- ранний детский аутизм
- некоторые виды рака
- депрессии
- шизофрении
- заболевания кожи: всевозможные гнойно-септические поражения, дерматит, экзема
Еще 20 лет назад ученые даже не предполагали, что аутизм, шизофрения, болезнь Паркинсона, онкология связаны с нарушением в микробиоме человека. Эпоха открытий в «микромире» только начинается. Интенсивные исследования в этом направлении активно ведутся и принесут множество неожиданных открытий. Но уже сегодня очевидно, что стоит уделить особое внимание «миру внутри нас». Профессиональные консультации врача помогут не ошибиться в этом и поддержать микробиоту и организм в отличном состоянии.
Статья на конкурс «био/мол/текст»: Микробиом человеческого кишечника представляет собой уникальную совокупность микроорганизмов. Его незримое присутствие опосредует целый ряд важных процессов: от метаболических и иммунных до когнитивных, а отклонение его состава от нормы приводит к развитию разнообразных патологических состояний: аллергических и аутоиммунных заболеваний, сахарного диабета, ожирения и др. Качественный и количественный состав микробиома, от которого во многом зависит будущее здоровье человека, определяется во младенчестве. Процессам его формирования и будет посвящена эта статья.
В настоящее время понятие «микрофлора человека» утратило свою актуальность: мы несем в своем организме не просто набор бактерий, а настоящий биом — микробиом . Но если биом с точки зрения экологов представляет собой крупную экосистему, то наше тело — это место обитания многочисленной популяции микроорганизмов, своего рода микробная экосистема, характеризующаяся своей генетической регуляцией и сложными взаимодействиями и реагирующая на влияние факторов внешней и внутренней среды. Она настолько уникальна, что в мире не найдется двух людей с идентичным микробиомом. Различия в микробном составе зависят от таких факторов среды, как набор питательных веществ, рН, влажность и температура. Те или иные их значения способствуют размножению бактерий и опосредуют пользу, которую они могут принести хозяину — человеку [1], [2].
Утрачивает актуальность оно еще и потому, что современный уровень знаний позволяет выражаться более корректно, и всё чаще «микрофлору» заменяют термином «микробиота» (наряду с «микробиомом»), подчеркивая, что бактерии и грибы (ну и вирусы с простейшими тоже) никак к «флоре», то есть миру растений, не относятся. Однако многие микробиологи «микрофлору» спокойно помещают в научные статьи и не кидаются друг в друга тухлыми помидорами: ничего особо ужасного в этом традиционном термине нет. — Ред.
Микробиом распределен в нашем организме неравномерно, по его топографии и видовому составу принято различать микробиом кожи, полости рта, дыхательных путей, урогенитального тракта и кишечника. Наиболее крупным микробиомом нашего тела является, несомненно, кишечный. Он может состоять из сотен видов различных микроорганизмов, но у взрослого человека преобладают бактерии двух типов: Firmicutes и Bacteroidetes [3]. Кишечный микробиом изучен лучше других бактериальных сообществ человека, и многолетние исследования, о которых будет рассказано ниже, показали, что именно он в большей степени влияет на здоровье своего носителя. Давайте же совершим путешествие в прошлое и разберем, как формируется микробиом нашего кишечника.
Микробиом: начало
Еще до недавнего времени считалось, что плод в утробе матери полностью огражден от контакта с миром микроорганизмов, то есть человек рождается полностью стерильным, а его заселение бактериями происходит позже. Но появились данные о том, что первые колонизаторы осваивают организм человека еще до его рождения. В ряде исследований было выявлено, что в плаценте, околоплодных водах, пуповинной крови и первичном кале — меконии — присутствуют бактерии родов Enterococcus, Escherichia, Leuconostoc, Lactococcus и Streptococcus, а у недоношенных младенцев — следы Enterobacter, Enterococcus (в меньшей степени, чем у доношенных), Lactobacillus, Photorhabdus и Tannerella [4–14]. Также в одной из работ были получены доказательства внутриутробной бактериальной транслокации — проникновения бактерий из кишечника матери к плоду [13]. Исследователи предполагают, что это происходит посредством кровотока: механизмом, сходным с «энтеромаммарной осью», о которой поговорим чуть позже. Эту гипотезу поддерживают данные другого эксперимента, в котором беременные мыши перорально получали меченых Enterococcus faecium, после чего эти бактерии «заявляли о себе» в плаценте и даже меконии еще не рожденных мышат [13].
Но всё же по-настоящему серьезный контакт с миром микроорганизмов происходит после рождения, и во многом от того, как пройдет эта встреча, зависит будущее здоровье человека. Колонизация кишечника у здоровых детей укладывается в четыре последовательные временны́е фазы. Первая длится от момента рождения до двух недель. Микробная популяция в этот период представлена в основном стрептококками и кишечной палочкой. В зависимости от вида вскармливания — грудного или искусственного — через некоторое время присоединяются бифидо- или лактобактерии соответственно. В небольших количествах обнаруживаются и представители родов Clostridium и Bacteroides. Через две недели начинается вторая фаза, которая продолжается до введения в рацион прикорма. В это время увеличивается численность представителей рода Bacteroides. С момента введения прикорма начинается третья фаза, длящаяся до завершения грудного вскармливания. В эту фазу окончательно формируется микробиом ребенка: постепенно, по мере увеличения в рационе доли твердой пищи и снижения доли грудного молока, растет количество бактероидов и анаэробных грамположительных кокков (пептококков и пептострептококков). Окончание грудного вскармливания знаменует переход к четвертой фазе. Она характеризуется относительной стабильностью микробного состава, который сохраняется в течение всей жизни индивида [15].
А теперь рассмотрим подробнее, как протекают процессы колонизации и становления иммунного ответа во время и после рождения.
Родоразрешение
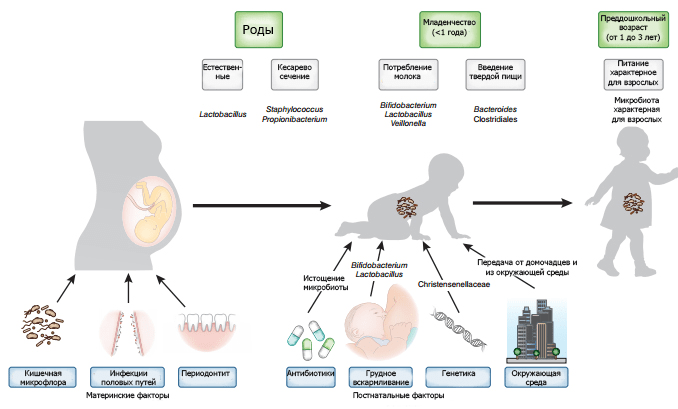
Как оказалось, даже характер родоразрешения (ребенок может появиться на свет естественным путем, а может и оперативным, с помощью кесарева сечения) влияет на состав микробиома младенца.
Первое, с чем сталкивается ребенок, — микробный мир родовых путей его матери. У небеременных женщин идентифицировано шесть видов лактобактерий, исходя из соотношения которых выделяют по крайней мере пять качественно различных типов микробиома влагалища [16]. В четырех из них — характерных, как правило, для представительниц европейских и азиатских народов — преобладают следующие представители рода Lactobacillus:
- L. crispatus (I тип микробиома);
- L. gasseri (II тип микробиома);
- L. iners (III тип микробиома);
- L. jensenii (V тип микробиома).
IV тип микробиома часто встречается у чернокожих и латиноамериканских женщин и характеризуется низким уровнем Lactobacillus spp. и большим числом анаэробных бактерий.
При беременности из-за изменения pH влагалища бактериальное разнообразие уменьшается, но повышается стабильность состава микробиоты. Как правило, в этот период в микробиоме преобладают Lactobacillus crispatus и Lactobacillus iners. Количественное превосходство этих видов подчеркивает их важность для поддержания здоровой среды родовых путей. У европейских и азиатских женщин во время беременности могут происходить сдвиги между типами микробиомов, но, как правило, они редко переходят к IV типу [18]. Таким образом, в зависимости от особенностей микробиоты влагалища матери ребенок начинает свою жизнь со «знакомства» с определенным видовым набором микроорганизмов, что подчеркивает важность исследований микробиомов различных групп населения.
Но во что же выливается это знакомство? Почему вообще заселение микробами так важно для ребенка? Дело в том, что бактерии за счет симбиотических взаимоотношений с эпителиальными и иммунными структурами кишечника фактически активируют иммунную систему хозяина (рис. 1) [21].
Покидая родовые пути естественным образом, доношенный новорожденный в небольших количествах заглатывает представителей вагинальной и кишечной микробиоты матери. В основном это бактерии родов Prevotella, Sneathia и Lactobacillus [15]. Если же родоразрешение происходит путем кесарева сечения, одними из первых колонизируют организм новорожденного представители кожных микробиомов матери и медицинского персонала, в основном — бактерии родов Propionibacterium, Corynebacterium и Streptococcus [19], [20]. У таких младенцев отмечают замедление заселения кишечника филой Bacteroidetes и низкое бактериальное разнообразие в течение первых двух лет жизни [22]. Однако с четырех месяцев различия в бактериальном разнообразии с естественно рожденными детьми начинают стираться, и к 12 месяцам практически исчезают [19].
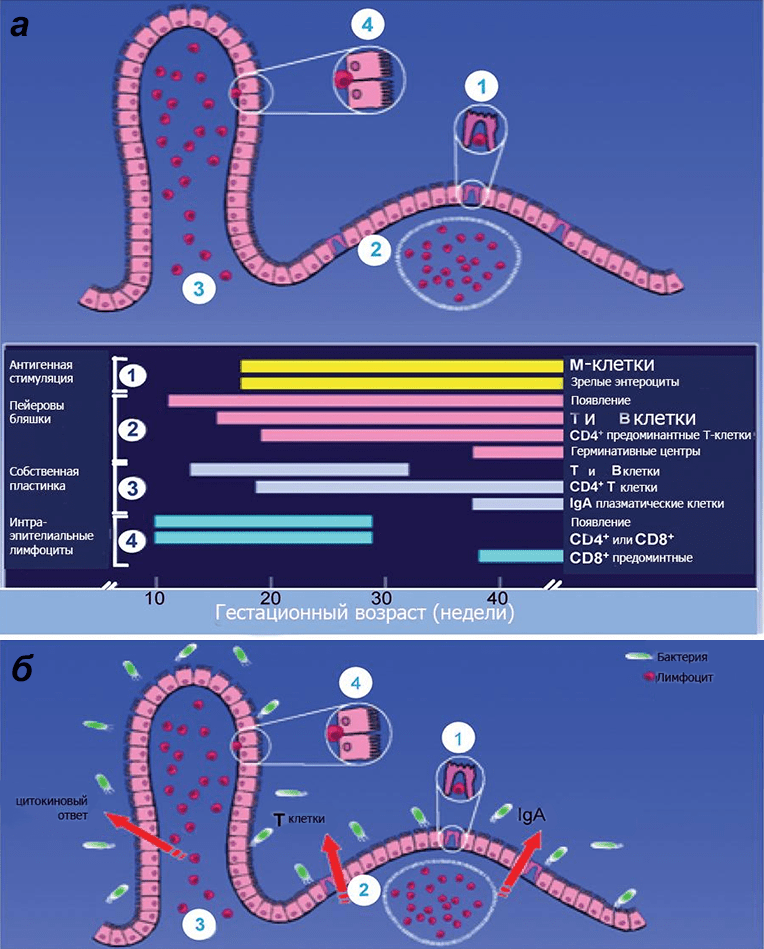
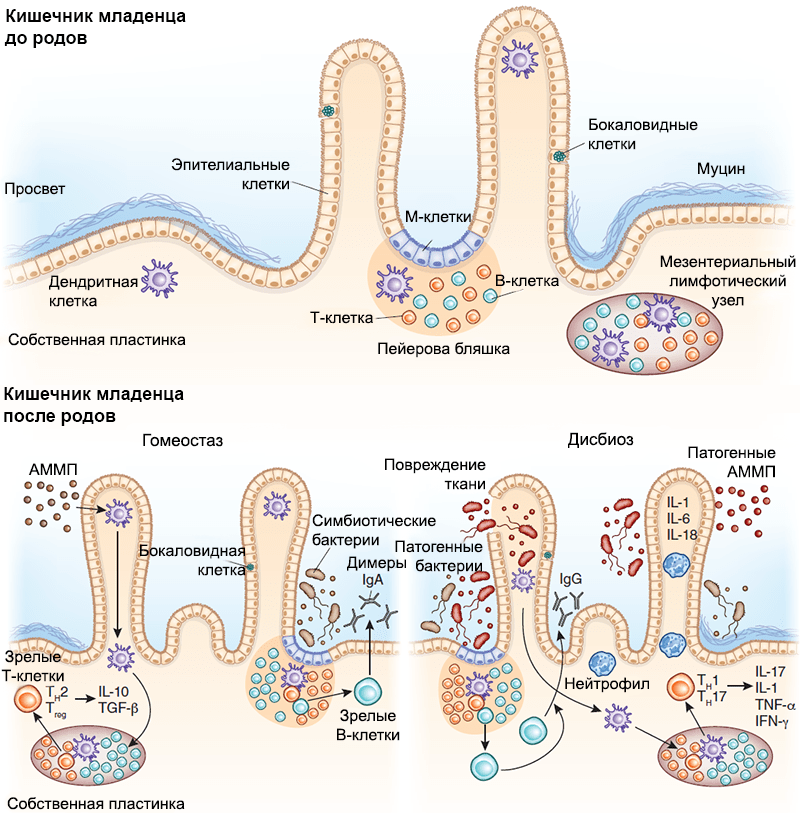
Рисунок 1. Схема иммунной защиты слизистой оболочки кишечника плода в зависимости от гестационного возраста. а — У младенца, рожденного в срок, все компоненты иммунной защиты слизистой оболочки являются зрелыми. б — Однако чтобы иммунная система приобрела работоспособность, должна произойти ее стимуляция первичными колонизаторами. Иммунная защита кишечника включает в себя: специализированный эпителий, или М-клетки (1), пейеровы бляшки (2), интерстициальные (3) и интраэпителиальные (4) лимфоциты, опосредующие развитие иммунных реакций. Среди лимфоидных образований кишечника выделяют одиночные лимфатические узлы (расположены преимущественно в дистальных отделах кишечника) и пейеровы бляшки (расположены в основном в подвздошной кишке). Последние образованы сгруппированными лимфатическими фолликулами, выпячивающими эпителий в просвет кишки в виде купола, и межузелковыми скоплениями лимфоидной ткани. Эпителий слизистой оболочки в области бляшки содержит до 10% специфических микроскладчатых (М-) клеток, обеспечивающих трансэпителиальный транспорт, механизм которого — трансцитоз: благодаря тонкому гликокаликсу они активно поглощают апикальной поверхностью макромолекулы (в том числе антигены) из просвета кишки, в составе эндосом перемещают их через свою цитоплазму и посредством экзоцитоза передают иммунокомпетентным клеткам пейеровых бляшек. Для ускорения процесса М-клетки снизу образуют «карманы», заполняющиеся «иммунным винегретом» из В-клеток, плазмоцитов, Т-клеток, макрофагов и антигенпрезентирующих дендритных клеток.
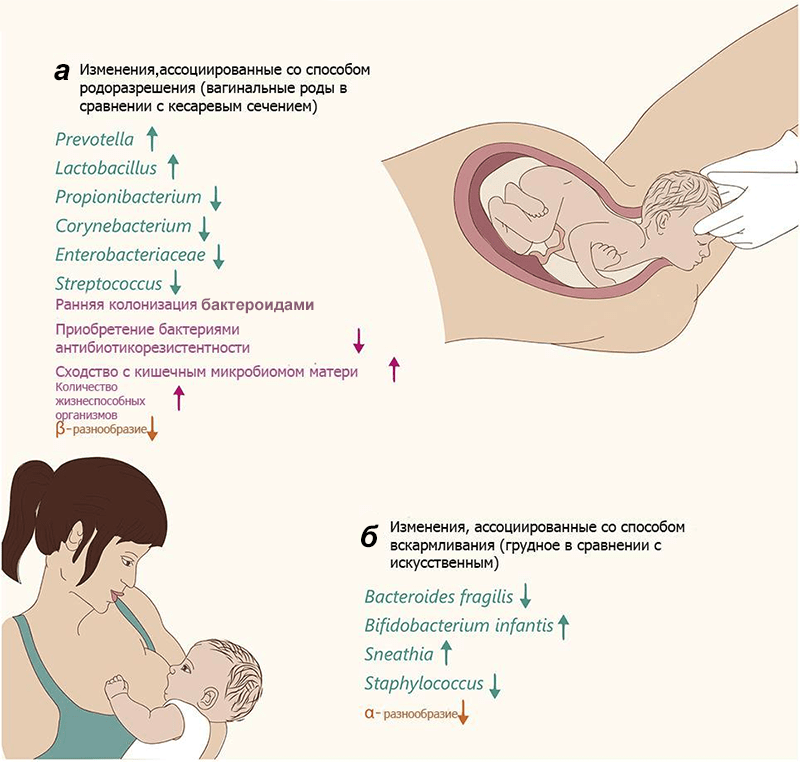
Тем не менее очевидно, что характер родоразрешения влияет на микробиом новорожденного (рис. 2). Правда, пока неясно, сказываются ли эти различия на здоровье взрослого индивида: хотя некоторые эпидемиологические исследования демонстрируют связь между кесаревым сечением и различными заболеваниями (табл. 1), причина их развития окончательно не выяснена.
Рисунок 2. Изменения микробиома у новорожденных. Цвет текста и стрелки обозначают изменения специфических разновидностей (зеленый), общие изменения (розовый) и разнообразие сообщества (оранжевый). а — Изменения у младенцев, родившихся естественным путем, относительно извлеченных хирургически. б — Изменения у младенцев, находящихся на грудном вскармливании, относительно «искусственников». α-разнообразие — видовое разнообразие внутри исследуемого сообщества, β-разнообразие — видовое разнообразие между сообществами данной области (по Р. Уиттекеру).
Грудное вскармливание
Не менее важным фактором в формировании микробиома новорожденного является характер питания. Грудное молоко — оптимально сбалансированная пища для младенца, обеспечивающая его нормальное развитие [23]. Как известно, в первые дни жизни именно оно защищает ребенка от инфекционных болезней и способствует снижению смертности от них [24] за счет содержания множества иммунных факторов: Т- и В-лимфоцитов, плазматических клеток, иммуноглобулинов (в первую очередь IgА) и антимикробных ферментов (лизоцима и лактоферрина). Установлено, что грудное вскармливание в какой-то мере предотвращает развитие таких хронических заболеваний, как сахарный диабет [25] и ожирение [26]. И, несомненно, грудное молоко способствует формированию «здорового» микробиома. Первые данные об обнаружении бактерий в женском молоке были получены в 1950 году, но исследователей тех лет интересовали лишь патогенные микроорганизмы [27]. И хотя уже в 70-х годах в грудном молоке были найдены первые бактерии-симбионты, ученым не удалось их идентифицировать [27]. Лишь в 2003 году, когда в молоке, на коже груди и ареолах сосков восьми кормящих матерей и в ротовой полости и фекалиях их детей были обнаружены родственные лактобациллы, ученые предположили, что эти бактерии не занесены случайно извне, а имеют эндогенное происхождение [28].
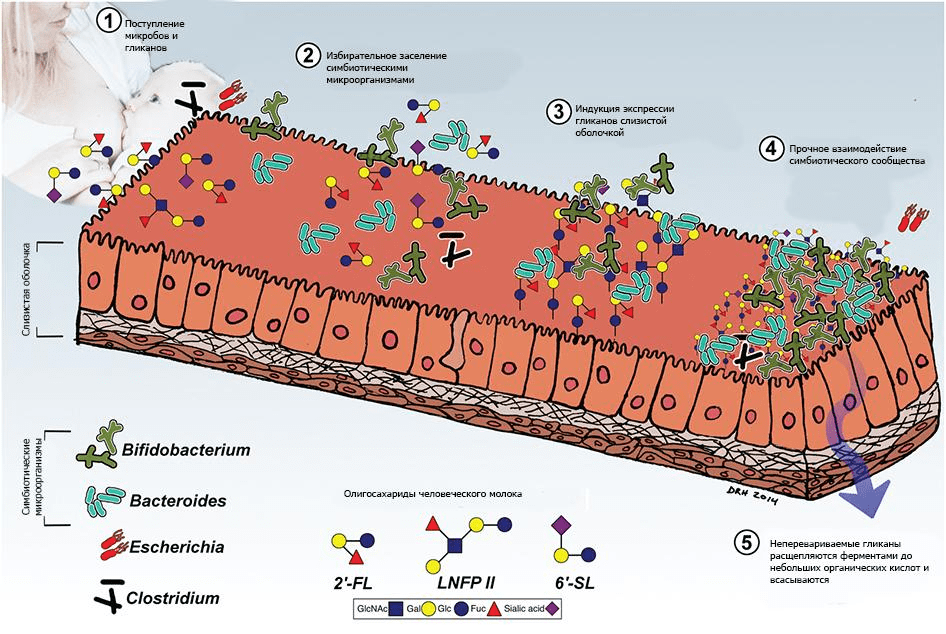
Независимо от того, материнское или донорское грудное молоко используется для вскармливания, у каждого младенца формируется свой особый микробиом. Заслуга в этом принадлежит олигосахаридам молока человека (ОМЧ) [29], [30]. В составе женского молока около 8% отведено перевариваемым ОМЧ — пребиотикам, поддерживающим рост Bifidobacterium longum subsp. infantis [31]. При этом профиль ОМЧ у каждой женщины уникален, что обеспечивает, в свою очередь, индивидуальность младенческого микробиома (рис. 3) [32].
Рисунок 3. Взаимодействие гликанов человеческого молока и микробиоты. Взаимодействие новорожденного с материнскими и содержащимися в окружающей среде микроорганизмами опосредовано потреблением молозива и содержащихся в нём гликанов (олигосахаридов молока человека, ОМЧ). ОМЧ обладают пребиотической, антиадгезионной и противовоспалительной активностью, облегчают экспансию симбионтов — в особенности Bacteroides и Bifidobacterium — и ингибируют рост и адгезию оппортунистических и облигатных патогенов.
Другим опосредующим формирование микробиома фактором является так называемая энтеромаммарная ось — система, которая обеспечивает транспорт бактерий из кишечника (будущей) матери в молочные железы. Ее первичным звеном служат дендритные клетки кишечника, которые захватывают бактерий и транспортируют их в местные лимфоидные фолликулы [1]. Там осуществляется выработка специфического иммуноглобулина А. Эти дендритные клетки и секретирующие иммуноглобулин лимфоциты циркулируют в крови, но могут избирательно возвращаться в кишечник за счет взаимодействия между β7-интегринами и выделяемыми эндотелиоцитами молекулами адгезии (адрессинами, MAdCAM-1). Клетки эндотелия молочных желез синтезируют молекулы MAdCAM-1 во время беременности, обеспечивая избирательное поступление в железу «запрограммированных» дендритных клеток, содержащих кишечные бактерии [33]. Помимо бактерий, в молозиве и молоке матери содержатся Т-клетки, производящие β7-интегрины, и плазматические клетки, вырабатывающие специфический IgА [34]. Также в молоке находятся цитокины, состав которых зависит от иммунологического опыта матери, приобретенного в течение жизни.
Существует теория, предполагающая передачу микроорганизмов из полости рта младенца в молочную железу матери с последующей выработкой в ее организме специфических антител и их поступлением в ЖКТ ребенка [34]. Предположение подтверждается тем фактом, что в ротовой полости новорожденного и в грудном молоке обнаруживаются идентичные бактерии родов Gemella, Veillonella, Staphylococcus и Streptococcus [35], [36]. Хотя есть данные, что они присутствуют в молозиве еще до начала грудного вскармливания (даже после тщательной гигиенической обработки железы образцы сцеженного молока содержат бактерии кожного и кишечного микробиома матери [37]), это всё же не отменяет возможность реализации механизма обратного заноса.
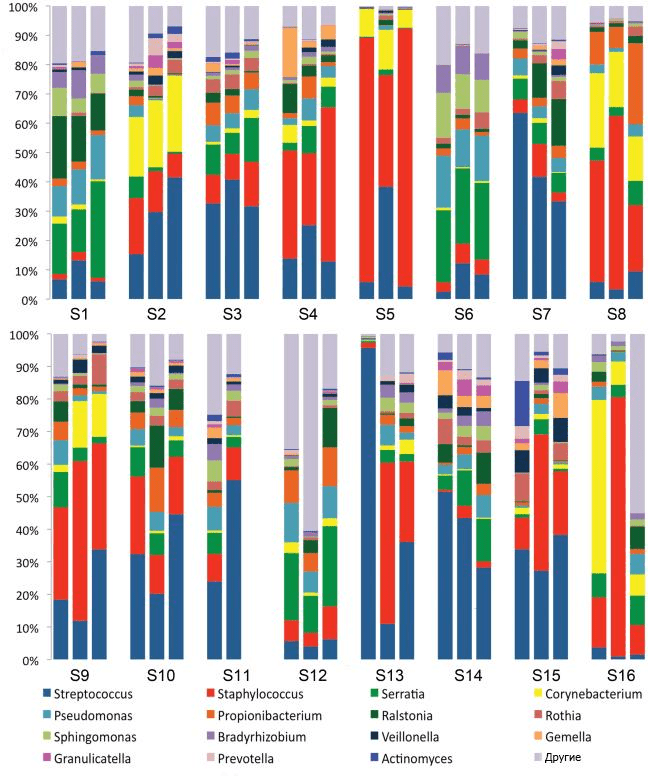
В 2011 году ученые из США обнаружили девять таксономических единиц бактерий в образцах молока от 16 женщин. Установив тем самым, что микробный состав молока чрезвычайно разнообразен, они предложили концепцию «ядра микробиома женского молока» (рис. 4) [35]. В дальнейшем стало ясно, что микробиом изменяется в течение всего периода лактации. Так, в молозиве преобладают бактерии родов Weissella, Leuconostoc, Staphylococcus, Streptococcus и Lactococcus, а в молоке, вырабатываемом в первые шесть месяцев после родов, видимо, из-за частого контакта с обитателями полости рта младенца происходит «перекос» в сторону Veillonella, Leptotrichia и Prevotella — что опять же подтверждает теорию обратного заноса [37].
Рисунок 4. Девять бактериальных таксономических единиц, обнаруженных в образцах молока от 16 женщин в 2011 году. Наблюдаемые сообщества оказались достаточно сложными, и при относительном постоянстве состава у одной группы испытуемых у другой с течением времени отмечались изменения.
Здоровье матери также играет важную роль в формировании микробного состава молока. В первый месяц лактации в молоке страдающих ожирением женщин преобладают Lactobacillus, однако через полгода их сменяют представители рода Staphylococcus [37], которые, как показывают исследования, начинают преобладать и в кишечнике тучных младенцев, в связи с чем ученые предположили существование связи между особенностями микробиома женского молока и паратрофией у детей.
Постепенное отнятие младенца от груди и переход на твердую пищу также играют важную роль в формировании бактериального разнообразия. После завершения грудного вскармливания в микробиоме детского кишечника появляются характерные для взрослого бактерии — представители типов Bacteroidetes, Firmicutes и класса Clostridia: Clostridium, Ruminococcus, Faecalibacterium, Roseburia, и Anaerostipes [19], [38].
Иммунитет
Недавние исследования подтвердили важную роль кишечной микрофлоры в развитии иммунной защиты. В Nature Reviews Immunology был опубликован обзор, подчеркнувший важный вклад бактерий-комменсалов в функционирование эпителиального барьера кишечника (рис. 5).
Рисунок 5. Эпителиальный барьер кишечника. Простой цилиндрический эпителий обладает механизмами физической и биохимической адаптации к микробной колонизации, поддерживающими целостность барьера. К ним относятся: богатые актином микроворсинки; плотные контакты эпителиальных клеток (а); муцины, которые формируют «сито» для просеивания молекул — гликокаликс; продукция различных антимикробных пептидов. М-клетки, покрывающие пейеровы бляшки и одиночные лимфоидные фолликулы, обеспечивают транслокацию молекул из просвета кишки под эпителий, к антигенпредставляющим клеткам. Дендриты специализированных дендритных клеток (ДК) могут проникать в просвет кишечника через плотные контакты (б).
Ученые предположили, что бактерии кишечника не только стимулируют его лимфоидные элементы, но и оказывают влияние на кишечный слизистый барьер, стимулируя образование микроворсинок [39], [40] и плотных контактов [41].
Рисунок 6. Взаимодействие между иммунной системой кишечника и микробиомом младенца. Развитие вторичных лимфоидных структур, в том числе пейеровых бляшек и одиночных лимфоузлов, происходит внутриутробно, задолго до начала бактериальной колонизации. С ее началом настраиваются механизмы взаимодействия иммунной системы хозяина и бактерий-симбионтов. М-клетки путем трансцитоза передают бактериальные антигены дендритным клеткам, те их презентируют, опосредуя Т-зависимое созревание В-лимфоцитов и способствуя секреции плазматическими клетками IgA, который играет важную роль в защите от патогенов. Бактерии могут транслоцироваться также через дендритные клетки и презентироваться Т-клеткам лимфоузла, индуцируя их дифференцировку. Нижняя левая панель — АММП — ассоциированный с микроорганизмами молекулярный паттерн. В условиях гомеостаза АММП, ассоциированные с бактериями-симбионтами, стимулируют продукцию регуляторных цитокинов (IL-25, IL-33, тимусного стромального лимфопоэтина и трансформирующего фактора роста, TGF-β). Трансдукция сигнала на дендритные клетки стимулирует развитие регуляторных Т-клеток и способствует секреции IL-10. Нижняя правая панель — В состоянии дисбиоза снижение количества бактерий-симбионтов приводит к размножению патогенов. Патогенные АММП индуцируют секрецию провоспалительных цитокинов (IL-1, IL-6 и IL-18), способствуя размножению эффекторных Т-клеток. Эти Т-клетки дифференцируются в CD4+ Th1 и Th17 и секретируют IL-17, фактор некроза опухоли (TNF-α) и интерферон-γ (IFN-γ), которые привлекают в очаг воспаления нейтрофилы, защищая организм хозяина от патогенов.
Исследуя влияние бактерий на защитные механизмы кишечника (рис. 6), ученые искусственно колонизировали бактерией Bacteroides thetaiotaomicron кишечники безмикробных мышей. Затем РНК кишечного эпителия анализировали на предмет изменения экспрессии генов [42]. Была отмечена обширная активация генов эпителиоцитов, которые регулировали функцию эпителиального барьера и способствовали повышению продукции рецептора к IgА. Это исследование прекрасно отражает влияние бактериальной колонизации на кишечник новорожденного, ведь он в данном контексте такой же, практически безбактериальный, организм.
Всё новые работы подчеркивают важную роль бактериальной колонизации в формировании и поддержании здоровья млекопитающих. В недавнем эксперименте, посвященном изучению функций Toll-подобных рецепторов, нокаутировали ген важного компонента врожденного иммунитета — рецептора TLR5, расположенного на базолатеральной поверхности энтероцитов мышей. Это повлекло за собой следующее: мыши начали регулярно объедаться и в конце концов развили метаболический синдром, сопровождавшийся изменением состава кишечной микробиоты. Возникло предположение, что микробиом может служить индикатором развития многих заболеваний. Но ученые пошли дальше и пересадили «патологическую» микробиоту из TLR5-дефицитных особей безмикробным мышам с нормальным рецептором, и у тех тоже проявились признаки метаболического синдрома. То есть микробиом, возможно, может служить не только индикатором системных проблем, но и непосредственно участвовать в их возникновении. Интересно, что ограничение питания TLR5-дефицитных мышей предотвращало развитие ожирения, но не резистентности к инсулину [43].
Вообще, связь колонизации бактериями-симбионтами с развитием как приобретенного, так и врожденного иммунитета, демонстрировали неоднократно. Было установлено, что взаимодействие рецепторов энтероцитов и иммунных клеток кишечника с антигенами микроорганизмов вызывает естественную, самоограничивающуюся воспалительную реакцию. Таким способом механизмы врожденного иммунного ответа позволяют предотвратить проникновение патогенов через эпителиальный барьер кишечника, при этом отличая их от безвредных симбионтов (рис. 6) [44], [45]. Когда ребенок покидает утробу матери, происходит контакт с огромным количеством бактерий. И для того чтобы избежать непрерывной воспалительной реакции в ответ на колонизацию кишечника, снижается экспрессия упомянутых рецепторов, в частности TLR2 и TLR4 [46]. К сожалению, у детей, появившихся на свет раньше срока, описанные механизмы еще незрелые, что часто приводит к развитию некротического энтероколита [47].
Исследования последних лет показали, что кишечные бактерии могут вносить свой вклад и в развитие иммунной толерантности, то есть защиты от избыточных иммунных реакций. Эти наблюдения чрезвычайно актуальны для разработки возможных терапевтических вмешательств, ведь многие бактериальные виды имеют количественное преимущество лишь на ранних этапах колонизации, во время грудного вскармливания (см. главу «Микробиом и грудное вскармливание»). Как же симбионтов связали с иммунотолерантностью? Например, полисахарид А капсулы Bacteroides fragilis может взаимодействовать с TLR2-рецепторами дендритных клеток кишечника, активируя продукцию противовоспалительных цитокинов, которые создают для бактерий специфическую микросреду [48]. Некоторые виды клостридий подобным образом увеличивают количество регуляторных Т-клеток — контролеров, подавляющих иммунный ответ, если Т-эффекторы неоправданно разбушевались, — предотвращая тем самым IgE-опосредованные заболевания [49]. Таким образом, конкретные микроорганизмы, представленные в материнском молоке, еще во младенчестве могут предопределить степень «аллергичности» индивида: упомянутые механизмы позволяют выработать толерантность к «полезным» антигенам и бактериям, предотвращая в дальнейшем развитие аллергий и аутоиммунных заболеваний .
Дополнительно о связях микробиома с иммунитетом, питанием, болезнями и препаратами для их лечения можно прочитать на «биомолекуле»: «Зоопарк в моем животе» [50].
И другие…
Помимо генетических факторов, характера родоразрешения и вскармливания, на формирование микробиома и иммунитета у новорожденного в той или иной мере оказывают влияние особенности питания, опыт приема антибиотиков и факторы окружающей среды (рис. 7).
Рисунок 7. Факторы, обеспечивающие формирование микробиома младенца. Инфекции половых путей женщины могут привести к бактериальному загрязнению матки. Микрофлора кишечника и ротовой полости может транспортироваться с кровью к плоду. Характер родоразрешения формирует первичную микрофлору. Генетика и постнатальные факторы, такие как режим питания, использование антибиотиков и воздействие окружающей среды оказывают дополнительное влияние на микробиом.
Антибиотики — одни из наиболее часто выписываемых детям препаратов. Назначение их матери в послеродовом периоде или же новорожденному может нарушить хрупкие процессы, которые лежат в основе формирования микробиома, и стать причиной ряда заболеваний (табл. 1). Исследования последних лет регулярно подчеркивают важность понимания процессов, ведущих к неонатальному дисбиозу и развитию в дальнейшем таких патологий, как диабет II типа, воспалительные заболевания кишечника или аллергическая реакция на компоненты молока [51–56]. Изменения в микробиоме, провоцируемые антибиотиками, зависят от способа введения, мишени, типа и дозировки препарата. Всё это пока плохо изучено у младенцев, что затрудняет понимание влияния антибиотикотерапии на формирование нормальной микрофлоры.
| Фактор, вызывающий дисбаланс | Характеристика когорты | Исходы |
|---|---|---|
| Кесарево сечение | 1,9 млн датских детей в возрасте 0–15 лет | Астма, системные заболевания соединительной ткани, ювенильный ревматоидный артрит, воспалительные заболевания кишечника, иммунодефициты и лейкозы |
| 1255 трехлетних детей из США | Ожирение, высокий ИМТ | |
| 2803 норвежских ребенка 0–3 лет | Аллергическая реакция на куриные яйца, рыбу или орехи | |
| Антибиотикотерапия | 1401 ребенок 0–6 месяцев из США | Астма и аллергия |
| 5780 британских детей 0–2 лет | Астма и экзема | |
| 12 062 финских ребенка 0–2 лет | Избыточный вес и ожирение | |
| 162820 детей 2–18 лет из США | Избыточный вес | |
| 9 млн британских детей | Воспалительные заболевания кишечника | |
| Пробиотики | 215 испанских детей 0–6 месяцев | Снижение частоты инфекций ЖКТ и верхних дыхательных путей |
| Европейское общество специалистов в области детской гастроэнтерологии, гепатологии и питания, комиссия по вопросам питания | Снижение частоты неспецифических желудочно-кишечных инфекций | |
| Пищевые добавки | 139 африканских детей 6–14 лет | С большей частотой — воспалительные заболевания кишечника, с меньшей — колики |
| Гигиена | 184 ребенка 0–3 лет (исследование чистоты пустышек) | Чистота пустышек снижала риск развития астмы, аллергии и сенсибилизации |
| Домашние животные | 3143 финских ребенка 0–1 года | Снижение риска развития диабета I типа |
Отдельно стоит сказать о пробиотиках и пребиотиках, которыми повсеместно обогащены смеси для искусственного вскармливания, несмотря на недоказанность их эффективности [57]. Пробиотики представляют собой живые микроорганизмы, которые, предположительно, должны участвовать в формировании микробиома, а пребиотики — это вещества, которые способствуют росту полезных микроорганизмов. Использование пробиотиков в педиатрической практике — до сих пор спорный момент, хотя их влияние на различные детские заболевания изучалось достаточно широко. Так, некоторые мета-анализы обнаружили их эффективность в терапии атопического дерматита, в то время как другие не выявили существенного влияния на детей младше 12 месяцев [58–61]. Была проведена оценка воздействия самых популярных пробиотических добавок в детском питании (Lactobacillus и Bifidobacterium spp., L. reuteri) на колики у младенцев. После трех недель их применения в кишечнике новорожденных увеличивалось количество лактобацилл и уменьшалось содержание кишечной палочки [62]. Однако на сегодняшний день большинство исследований показывает, что пре- или пробиотики значительно не влияют на качественный и количественный состав микробиома кишечника.
Окружающая среда не стерильна, и предметы быта, с которыми сталкивается новорожденный, тоже служат источниками микроорганизмов, участвующих в формировании микробиома. К примеру, вероятность обмена бактериями посредством предметов быта и воздуха в помещении увеличивается соразмерно количеству людей, проживающих в доме. Исследование 60 семей из США выявило, что члены одной семьи (домовладения) имеют более схожие микробиомы, чем члены разных семей [63]. Особенно показательно максимальное сходство микробиоты кожи у супругов, а также обмен поверхностными бактериальными сообществами между хозяевами и их собаками. Частый контакт с компонентами домашней пыли и большая семья в первые два месяца жизни могут привести к изменениям в микробиоме, ассоциированным с возникновением аллергии. Они заключаются в увеличении у младенцев количества бифидобактерий (за исключением B. adolescentis) и снижении численности Lactobacillus spp., Bifidobacterium adolescentis и Clostridium difficile [64].
Вероятно, частый контакт с животными, а соответственно, и с их микробиотой, на первом году жизни оказывает защитное действие, повышая иммунную толерантность. Например, взаимодействие с домашними животными с раннего возраста снижает риск развития аллергических состояний и астмы, но механизмы этого явления пока в полной мере не выявлены [65]. Ну и после всего сказанного, конечно, не станет сюрпризом вывод ученых о том, что бактериальное разнообразие гораздо выше у сельских детей, чем у городских [66]. В заключение стόит отметить, что ряд бактериальных штаммов обнаруживается одновременно у матерей и их взрослых дочерей, из чего следует, что одни бактерии временно «арендуют» жилплощадь, а другие получают в макроорганизме пожизненную «прописку».
Коррекция
В недавно проведенных исследованиях изучались терапевтические вмешательства, которые могли бы изменять микробом и профилактировать микробный дисбаланс еще в раннем детстве.
Подходы к модификации микробиома, как правило, подразделяются на три основные группы: очищение от микроорганизмов, их модуляция и замена, восстановление микробиоты. К примеру, антибиотики из-за их способности эффективно очищать кишечник от бактерий часто используют для лечения состояний, вызванных неспецифической патогенной микробиотой (рис. 8).
Рисунок 8. «Микробная терапия» в зависимости от стадии заболевания. На доклинических стадиях болезнь еще не проявляется в полной мере: ее симптомы (если вообще они есть) минимальны и неспецифичны, но тонкие биологические изменения уже происходят. Использование культур определенных бактериальных сообществ на ранних стадиях болезни может с максимальной эффективностью предотвратить дисбиоз и развитие патологии. По мере прогрессирования заболевания происходит обогащение микробиома патогенами (изображены красным), продуцирующими провоспалительные метаболиты и тем самым активирующими воспалительные пути (рис. 6). Слизистый слой, защищенный эпителием, истончается по мере накопления патогенов, утяжеляя течение заболевания. Диетотерапия и антибиотики на этом этапе могут использоваться в качестве радикальной меры, изменяющей количественный и качественный состав бактерий. На поздних стадиях продолжающееся истончение слизистого слоя позволяет бактериям прорваться через эпителиальный барьер. Тогда агрессивная антибиотикотерапия в сочетании с трансплантацией микробиоты может помочь восстановить микробный баланс. АММП — ассоциированный с микроорганизмами молекулярный паттерн.
Однако у детей раннего возраста длительное применение антибиотиков чревато значительным риском осложнений. Состав микробиоты можно изменить и посредством диетотерапии, употребляя продукты, которые способствуют росту «полезных» микроорганизмов. Одним из примеров подобной диеты является особое энтеральное питание, применяемое для симптоматической терапии болезни Крона у детей. Оно представляет собой специфическую смесь всех необходимых микро- и макронутриентов и потому в течение длительного времени может служить единственным источником питательных веществ. Оно подается исключительно в жидком виде — перорально либо через зонд — и способствует достижению клинической ремиссии за счет создания своеобразного «режима покоя»: снижения функциональной нагрузки на воспаленный кишечник и уменьшения его травматизации [67].
Исследования в области дефицита питания продемонстрировали, что на сегодняшний день невозможно, используя только диетотерапию, существенно повлиять на состав кишечного микробиома, хотя изучение влияния характера питания на него продолжается.
Учитывая то, какое значительное воздействие на здоровье оказывает микробиота в раннем детстве, весьма актуальными выглядят методы, направленные на своевременное, профилактическое, восстановление микробного баланса. Недавно удалось показать, что микробиом новорожденных, появившихся на свет посредством кесарева сечения, можно восстановить до состояния, схожего с младенцами, родившимися естественным путем. Обтирание таких детей тампонами, которые были введены за час до кесарева сечения во влагалище матери, приводило к значительному обогащению их микробиома представителями Lactobacillus и Bacteroides. Правда, пока не выяснены возможные последствия такой процедуры для здоровья [68].
Микробиом кишечника можно рассматривать как целый отдельный орган нашего тела. Мы приобретаем его при рождении, и то, каким он будет, зависит от множества факторов. Но одно можно сказать наверняка: он будет непохожим ни на какой другой микробиом. Это практически такой же уникальный признак, как папиллярные линии и сосудистый рисунок сетчатки глаза. И подобно тому, как отпечатки пальцев могут рассказать следователям криминальную биографию преступника, микробиом кишечника может предъявить ученым вехи онтогенеза своего хозяина. И как нельзя лучше процесс бактериальной колонизации и его значимость для организма отражает знаменитая пословица: «Что посеешь, то и пожнешь». Берегите свой микробиом и будьте здоровы!
Литература
- Hooper L.V., Littman D.R., Macpherson A.J. (2012). Interactions between the microbiota and the immune system. Science. 336, 1268–1273;
- Mayer E.A., Knight R., Mazmanian S.K., Cryan J.F., Tillisch K. (2014). Gut microbes and the brain: paradigm shift in neuroscience. J. Neurosci. 34, 15490–15496;
- Rajilic-Stojanovic M., Heilig H.G., Molenaar D., Kajander K., Surakka A., Smidt H., de Vos W.M. (2009). Development and application of the human intestinal tract chip, a phylogenetic microarray: analysis of universally conserved phylotypes in the abundant microbiota of young and elderly adults. Environ. Microbiol. 11, 1736–1751;
- Ardissone A.N., de la Cruz D.M., Davis-Richardson A.G., Rechcigl K.T., Li N., Drew J.C. et al. (2014). Meconium microbiome analysis identifies bacteria correlated with premature birth. PLoS One. 9, e90784;
- Moles L., Gomez M., Heilig H., Bustos G., Fuentes S., de Vos W. et al. (2013). Bacterial diversity in meconium of preterm neonates and evolution of their fecal microbiota during the first month of life. PLoS One. 8, e66986;
- Rautava S., Kainonen E., Salminen S., Isolauri E. (2012). Maternal probiotic supplementation during pregnancy and breast-feeding reduces the risk of eczema in the infant. J. Allergy Clin. Immunol. 130, 1355–1360;
- Dominguez-Bello M.G., Costello E.K., Contreras M., Magris M., Hidalgo G., Fierer N., Knight R. (2010). Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc. Natl. Acad. Sci. USA. 107, 11971–11975;
- Satokari R., Grönroos T., Laitinen K., Salminen S., Isolauri E. (2009). Bifidobacterium and Lactobacillus DNA in the human placenta. Lett. Appl. Microbiol. 48, 8–12;
- Aagaard K., Ma J., Antony K.M., Ganu R., Petrosino J., Versalovic J. (2014). The placenta harbors a unique microbiome. Sci. Transl. Med. 6, 237ra265;
- Oh K.J., Lee S.E., Jung H., Kim G., Romero R., Yoon B.H. (2010). Detection of ureaplasmas by the polymerase chain reaction in the amniotic fluid of patients with cervical insufficiency. J. Perinat. Med. 38, 261–268;
- DiGiulio D.B., Romero R., Amogan H.P., Kusanovic J.P., Bik E.M., Gotsch F. et al. (2008). Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One. 3, e3056;
- Jiménez E., Fernández L., Marín M.L., Martín R., Odriozola J.M., Nueno-Palop C. et al. (2005). Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section. Curr. Microbiol. 51, 270–274;
- Jimenez E., Marin M.L., Martin R., Odriozola J.M., Olivares M., Xaus J. et al. (2008). Is meconium from healthy newborns actually sterile? Res. Microbiol. 159, 187–193;
- Hu J., Nomura Y., Bashir A., Fernandez-Hernandez H., Itzkowitz S., Pei Z. et al. (2013). Diversified microbiota of meconium is affected by maternal diabetes status. PLoS One. 8, e78257;
- Mackie R.I., Sghir A., Gaskins H.R. (1999). Developmental microbial ecology of the neonatal gastrointestinal tract. Am. J. Clin. Nutr. 69, 1035S—1045S;
- Ravel J., Gajer P., Abdo Z., Schneider G.M., Koenig S.S., McCulle S.L. et al. (2011). Vaginal microbiome of reproductive-age women. Proc. Natl. Acad. Sci. USA. 108 Suppl 1, 4680–4687;
- Cohen J. (2016). Vaginal bacteria species can raise HIV infection risk and undermine prevention. Science;
- Witkin S.S. and Ledger W.J. (2012). Complexities of the uniquely human vagina. Sci. Transl. Med. 4, 132fs11;
- Backhed F., Roswall J., Peng Y., Feng Q., Jia H., Kovatcheva-Datchary P. et al. (2015). Dynamics and stabilization of the human gut microbiome during the first year of life. Cell Host Microbe. 17, 690–703;
- MacIntyre D.A., Chandiramani M., Lee Y.S., Kindinger L., Smith A., Angelopoulos N. et al. (2015). The vaginal microbiome during pregnancy and the postpartum period in a European population. Sci. Rep. 5, 8988;
- Insoft R.M., Sanderson I.S., Walker W.A. (1996). Development of immune function within the human intestine and its role in neonatal diseases. Pediatr. Clin. North Am. 43, 551–571;
- Jakobsson H.E., Abrahamsson T.R., Jenmalm M.C., Harris K., Quince C., Jernberg C. et al. (2014). Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section. Gut. 63, 559–566;
- Butte N., Lopez-Alarcon M., Garza C. Nutrient adequacy of exclusive breastfeeding for the term infant during the first six months of life. Geneva: World Health Organization, 2002. — 47 p.;
- WHO collaborative study team on the role of breastfeeding on the prevention of infant mortality. (2000). Effect of breastfeeding on infant and child mortality due to infectious diseases in less developed countries: a pooled analysis. Lancet. 355, 451–455;
- Horta B.L. and Victora C.G. Long-term effects of breastfeeding: a systematic review. Geneva: World Health Organization, 2013. — 69 p.;
- Horta B.L., de Mola C.L., Victora C.G. (2015). Long-term consequences of breastfeeding on cholesterol, obesity, systolic blood pressure, and type-2 diabetes: systematic review and meta-analysis. Acta Paediatr. 104, 30–37;
- Dorr H. and Sittel I. (1953). Bacteriological examination of human milk and its relation to mastitis. Zentralbl. Gynakol. 75, 1833–1835;
- Martín R., Langa S., Reviriego C., Jimínez E., Marín M.L., Xaus J. et al. (2003). Human milk is a source of lactic acid bacteria for the infant gut. J. Pediatr. 143, 754–758;
- Azad M.B., Konya T., Maughan H., Guttman D.S., Field C.J., Chari R.S. et al. (2013). Gut microbiota of healthy Canadian infants: profi les by mode of delivery and infant diet at 4 months. CMAJ. 185, 385–394;
- Yatsunenko T., Rey F.E., Manary M.J., Trehan I., Dominguez-Bello M.G., Contreras M. et al. (2012). Human gut microbiome viewed across age and geography. Nature. 486, 222–227;
- Gura T. (2014). Nature’s fi rst functional food. Science. 345, 747–749;
- De Leoz M.L., Kalanetra K.M., Bokulich N.A., Strum J.S., Underwood M.A., German J.B. et al. (2015). Human milk glycomics and gut microbial genomics in infant feces show a correlation between human milk oligosaccharides and gut microbiota: a proof-of-concept study. J. Proteome Res. 14, 491–502;
- Bourges D., Meurens F., Berri M., Chevaleyre C., Zanello G., Levast B. et al. (2008). New insights into the dual recruitment of IgA+ B cells in the developing mammary gland. Mol. Immunol. 45, 3354–3362;
- Latuga M.S., Stuebe A., Seed P.C. (2014). A review of the source and function of microbiota in breast milk. Semin. Reprod. Med. 32, 68–73;
- Hunt K.M., Foster J.A., Forney L.J., Schutte U.M., Beck D.L., Abdo Z. et al. (2011). Characterization of the diversity and temporal stability of bacterial communities in human milk. PLoS One. 6, e21313;
- Lif Holgerson P., Harnevik L., Hernell O., Tanner A.C., Johansson I. (2011). Mode of birth delivery affects oral microbiota in infants. J. Dent. Res. 90, 1183–1188;
- Cabrera-Rubio R., Collado M.C., Laitinen K., Salminen S., Isolauri E., Mira A. (2012). The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. Am. J. Clin. Nutr. 96, 544–551;
- Valles Y., Artacho A., Pascual-Garcia A., Ferrus M.L., Gosalbes M.J., Abellan J.J., Francino M.P. (2014). Microbial succession in the gut: directional trends of taxonomic and functional change in a birth cohort of Spanish infants. PLoS Genet. 10, e1004406;
- Artis D. (2008). Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nat. Rev. Immunol. 8, 411–420;
- McAuley J.L., Linden S.K., Png C.W., King R.M., Pennington H.L., Gendler S.J. et al. (2007). MUC1 cell surface mucin is a critical element of the mucosal barrier to infection. J. Clin. Invest. 117, 2313–2324;
- Shen L. and Turner J.R. (2006). Role of epithelial cells in initiation and propagation of intestinal inflammation. Eliminating the static: tight junction dynamics exposed. Am. J. Physiol. Gastrointest. Liver. Physiol. 290, G577–G582;
- Hooper L.V., Wong M.H., Thelin A., Hansson L., Falk P.G., Gordon J.I. (2001). Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291, 881–884;
- Vijay-Kumar M., Aitken J.D., Carvalho F.A. Cullender T.C., Mwangi S., Srinivasan S. et al. (2010). Metabolic syndrome and altered gut microbiota in mice lacking toll-like receptor 5. Science. 328, 228–231;
- Round J.L. and Mazmanian S.K. (2009). The gut microbiota shapes intestinal responses during health and disease. Nat. Rev. Immunol. 9, 313–323;
- O’Hara A.M. and Shanahan F. (2007). Gut microbiota: mining for therapeutic potential. Clin. Gastroenterol. Hepatol. 5, 274–284;
- Abreu M.T., Fukata M., Arditi M. (2005). TLR signaling in the gut in health and disease. J. Immunol. 174, 4453–4460;
- Claud E.C., Lu L., Anton P.M., Savidge T., Walker W.A., Cherayil B.J. (2004). Developmentally-regulated IκB expression in intestinal epithelium and susceptibility to flagellin-induced inflammation. Proc. Natl. Acad. Sci. USA. 101, 7404–7408;
- Mazmanian S.K. and Kasper D.L. (2006). The love—hate relationship between bacterial polysaccharides and the host immune system. Nat. Rev. Immunol. 6, 849–858;
- Atarashi K., Tanoue T., Shima T., Imaoka A., Kuwahara T., Momose Y. et al. (2011). Induction of colonic regulatory T cells by indigenous Clostridium species. Science. 331, 337–341;
- Зоопарк в моем животе;
- Kozyrskyj A.L., Ernst P., Becker A.B. (2007). Increased risk of childhood asthma from antibiotic use in early life. Chest. 131, 1753–1759;
- Risnes K.R., Belanger K., Murk W., Bracken M.B. (2011). Antibiotic exposure by 6 months, and asthma and allergy at 6 years: findings in a cohort of 1,401 US children. Am. J. Epidemiol. 173, 310–318;
- Hoskin-Parr L., Teyhan A., Blocker A., Henderson A.J. (2013). Antibiotic exposure in the first 2 years of life and development of asthma and other allergic diseases by 7.5 years: a dose-dependent relationship. Pediatr. Allergy Immunol. 24, 762–771;
- Bailey L.C., Forrest C.B., Zhang P., Richards T.M., Livshits A., DeRusso P.A. (2014). Association of antibiotics in infancy with early childhood obesity. JAMA Pediatr. 168, 1063–1069;
- Metsälä J., Lundqvist A., Virta L.J., Kaila M., Gissler M., Virtanen S.M. (2013). Mother’s and offspring’s use of antibiotics, and infant allergy to cow’s milk. Epidemiology. 24, 303–309;
- Kronman M.P., Zaoutis T.E., Haynes K., Feng R., Coffin S.E. (2012). Antibiotic exposure and IBD development among children: a population-based cohort study. Pediatrics. 130, e794–e803;
- Braegger C., Chmielewska A., Decsi T., Kolacek S., Mihatsch W., Moreno L. et al. (2011). Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J. Pediatr. Gastroenterol. Nutr. 52, 238–250;
- Panduru M., Panduru N.M., Sălăvăstru C.M., Tiplica G.S. (2015). Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J. Eur. Acad. Dermatol. Venereol. 29, 232–242;
- Foolad N., Brezinski E.A., Chase E.P., Armstrong A.W. (2013). Effect of nutrient supplementation on atopic dermatitis in children: a systematic review of probiotics, prebiotics, formula and fatty acids. JAMA Dermatol. 149, 350–355;
- Doege K., Grajecki D., Zyriax B.C., Detinkina E., Zu Eulenburg C., Buhling K.J. (2012). Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood — a meta-analysis. Br. J. Nutr. 107, 1–6;
- Kim S.O., Ah Y.M., Yu Y.M., Choi K.H., Shin W.G., Lee J.Y. (2014). Effects of probiotics for the treatment of atopic dermatitis: a meta-analysis of randomized controlled trials. Ann. Allergy Asthma Immunol. 113, 217–226;
- Savino F., Cordisco L., Tarasco V., Palumeri E., Calabrese R., Oggero R. et al. (2010). Lactobacillus reuteri DSM 17938 in infantile colic: a randomized, double-blind, placebo-controlled trial. Pediatrics. 126, e526–e533;
- Song S.J., Lauber C., Costello E.K., Lozupone C.A., Humphrey G., Berg-Lyons D. et al. (2013). Cohabiting family members share microbiota with one another and with their dogs. Elife. 2, e00458;
- Sjögren Y.M., Jenmalm M.C., Böttcher M.F., Björkstén B., Sverremark-Ekström E. (2009). Altered early infant gut microbiota in children developing allergy up to 5 years of age. Clin. Exp. Allergy. 39, 518–526;
- Ownby D.R., Johnson C.C., Peterson E.L. (2002). Exposure to dogs and cats in the first year of life and risk of allergic sensitization at 6 to 7 years of age. J. Am. Med. Assoc. 288, 963–972;
- Normand A.C., Sudre B., Vacheyrou M., Depner M., Wouters I.M., Noss I. et al. (2011). Airborne cultivable microflora and microbial transfer in farm buildings and rural dwellings. Occup. Environ. Med. 68, 849–855;
- Ткаченко Е.И., Иванов С.В., Жигалова Т.Н., Ситкин С.И. (2008). Энтеральное питание при язвенном колите. Лечащий Врач. 6;
- Dominguez-Bello M.G., De Jesus-Laboy K.M., Shen N., Cox L.M., Amir A., Gonzalez A. et al. (2016). Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nat. Med. 22, 250–253;
- Nuriel-Ohayon M., Neuman H., Koren O. (2016). Microbial changes during pregnancy, birth, and infancy. Front. Microbiol. 7, 1031;
- Newburg D.S. and Morelli L. (2015). Human milk and infant intestinal mucosal glycans guide succession of the neonatal intestinal microbiota. Pediatr. Res. 77, 115–120;
- Tamburini S., Shen N., Wu H.C., Clemente J.C. (2016). The microbiome in early life: implications for health outcomes. Nat. Med. 22, 713–722.
Как грамотно восстановить микрофлору кишечника
Кишечник человека содержит миллионы бактерий. Но не все из них являются полезными. В кишечнике иногда обитают вредоносные микроорганизмы, вызывающие различные заболевания. Что вызывает рост вредных бактерий, и как же восстановить нормальную микрофлору, поговорим далее.
Содержание:
-
Важность восстановления микрофлоры
-
Как восстановить микрофлору
Важность восстановления микрофлоры
Нормальная кишечная микрофлора – это баланс полезных и вредных бактерий, населяющих кишечник человека. Если преобладают вредные, а полезные находятся в меньшинстве, такое состояние называется дисбалансом микрофлоры и требует коррекции. Этим занимаются врачи-гастроэнтерологи.
Они рекомендуют сдать анализ кала на дисбактериоз и бактериальный посев при заметных нарушениях в работе кишечника (вздутие, понос, тошнота, запор, боли и т.д.).
По результатам анализов назначается соответствующее лечение, после которого микрофлора нормализуются, самочувствие человека улучшается. Нормальная микрофлора кишечника важна для выработки необходимых витаминов, укрепления иммунитета и защиты от различных болезней.
Различные факторы могут ухудшать состояние микрофлоры кишечника, это:
-
прием антибиотиков и НПВС;
-
увлечение западной диетой (с наличием фастфудов);
-
недостаточность клетчатки в рационе;
-
прием обезболивающих средств;
-
лечение ингибиторами протонного насоса;
-
применение блокаторов Н2- гистаминовых рецепторов.
Некоторые врачи считают, что среда кишечника не должна быть стерильной. Но вредные бактерии должны составлять не более 15 процентов всей микрофлоры. Только тогда дисбаланс сохранится.
Микрофлора может меняться в зависимости от возраста, настроения, самочувствия человека, климата, сезона.
Нарушение микрофлоры может вызывать следующие заболевания:
-
онкология;
-
астма;
-
колит;
-
аутизм;
-
экзема;
-
диабет;
-
ожирение;
-
рассеянный склероз;
-
заболевания сердца.
Именно поэтому мы должны заботиться о состоянии микрофлоры кишечника. Рассмотрим некоторые полезные советы по этому поводу.
Как восстановить микрофлору
Полноценный рацион
Человек должен за день съедать разнообразную пищу, а не скудную, состоящую в преимуществе из углеводов и жиров. Так питается большинство людей, перекусывая, за неимением времени, фастфудами, булками и т.д.. Надо включать в рацион каждый день клетчатку.
Это:
-
свежие овощи;
-
фрукты;
-
зерновой хлеб;
-
бобовые;
-
зелень;
-
орехи.
Полезен для нормализации микрофлоры православный пост. Замечено, кто соблюдает посты, меньше страдает заболеваниями кишечника, даже раком. Пост исключает животные жиры (мясо, сливочное масло, яйца) и делает акцент на свежих овощах и фруктах, ягодах, крупах.
Известно, что инулин, обладающий пребиотическим действием, находится в следующих продуктах:
-
чеснок;
-
лук;
-
лук-порей;
-
спаржа;
-
цикорий;
-
артишок.
Эти продукты помогают наладить микрофлору кишечника и победить вредные бактерии. Их обязательно необходимо включать в свой рацион, если есть проблемы с кишечником.
Источниками бифидобактерий, полезных для человека, являются:
-
яблоки;
-
черника;
-
артишок;
-
миндаль;
-
фисташки.
Они обязательно должны присутствовать на столе как можно чаще.
Ферментирование продуктов
Полезно есть ферментированные, т.е. квашеные продукты. В результате процесса квашения простые продукты становятся фантастически полезными, потому что изменяют свой состав благодаря бактериям. Они помогают восстановить микрофлору кишечника.
Самые распространенные квашеные продукты:
-
квашеная капуста;
-
кефир;
-
йогурт;
-
чайный гриб.
У некоторых народов принято квасить овощи, даже острые. Такое блюдо из квашеных острых овощей называется «кимчхи». Квашеные соевые бобы называются «темпе».
Молочные квашеные продукты имеют в составе лактобактерии, так необходимые для нормальной микрофлоры. Людям, страдающим заболеванием почек, они просто необходимы, т.к. при таких болезнях нарушается микрофлора.
Искусственные подсластители — вред
Заместители сахара (аспартам, сахарин) являются вредными продуктами. Они действуют разрушительно на микрофлору кишечника. Кроме того, они повышают уровень глюкозы в крови. Поэтому их надо исключить из рациона.
Больше пребиотиков
Пребиотики содержат полезные бактерии, которые помогают выселять вредные, попадая в кишечник человека. Они находятся в овощах, фруктах, бобовых, зерновых. Их надо есть как можно чаще. Они также понижают уровень триглицеридов, холестерина, инсулина в организме. Значит пребиотики снижают риск сердечно-сосудистых заболеваний, смерти от инфаркта, инсульта.
Цельные зерна
Польза цельных зерен в том, что они содержат клетчатку и неперевариваемые углеводы, которые не усваиваются в тонком кишечнике, а поступают в толстый. Там они расщепляются и вызывают рост полезных бактерий.
Цельные зерна содержат:
-
витамины группы В;
-
железо;
-
цинк;
-
белки;
-
углеводы.
Они продаются в целом виде, а также из них изготовляется цельнозерновой хлеб. Также из них изготовляется цельная пшеничная мука.
Искусственные пробиотики
Насчет препаратов-пробиотиков ведутся споры. Есть сведения о некоторой пользе, которую оказывают такие препараты. Но она полностью не доказана. Тем более, что среди препаратов немало подделок. Надо осторожнее выбирать пробиотики, руководствуясь рекомендациями врача. Рекомендуем обратить внимание на Максилак.
Остальные советы
Есть еще несколько советов для нормализации микрофлоры:
-
Надо меньше перекусывать, чтобы дать возможность кишечнику восстановиться.
-
При возможности голодать, именно в таком состоянии кишечник сам нормализует микрофлору.
-
Работайте в огороде. Замечено, что у людей, живущих на свежем воздухе и ведущим активный образ жизни, микрофлора богаче.
-
Заведите собаку. Доказано, что те, у кого есть собаки дома, легче справляются с вредными бактериями.
-
Меньше употреблять антибиотики.
-
Больше двигаться и пить чистой воды.
У каждого человека организм индивидуален, поэтому каждый может знать свои способы нормализации микрофлоры.
ДОРОГИЕ ДРУЗЬЯ И КОЛЛЕГИ, А ТАКЖЕ ВСЕ, КТО ИНТЕРЕСУЕТСЯ ВЕСЬМА АКТУАЛЬНОЙ ПРОБЛЕМОЙ ПОДДЕРЖАНИЯ И ВОССТАНОВЛЕНИЯ КИШЕЧНОЙ МИКРОБИОТЫ!
По данным Всемирной организации здравоохранения, до 95% жителей земного шара страдают дисбактериозом (дисбиозом) кишечника. Практически ни одно заболевание не протекает без негативных последствий для кишечной микробиоты. Но самым распространенным губительным действием на кишечные микробы является использование антибиотиков. У относительно здорового человека с массой тела около 70-75 кг в толстой кишке находится около 2-2,5 кг живой биомассы микроорганизмов (нормобиоты), а количество видов достигает 1-1,5 тыс. (!).
Каждый врач, и пациент в том числе, должны понимать, что используемый антибиотик не выбирает точку приложения в организме и в конечном итоге будет подавлять все микробы, которые к нему чувствительны. Применение антибиотика при пневмонии, цистите, бронхите и т.д., как говорится, и лечит, и калечит. С одной стороны, помогает излечить основное заболевание, ради которого его назначили, а с другой, наносит огромный сопутствующий вред чувствительной микробиоте, и в первую очередь, кишечной, одновременно значительно понижая колонизационную резистентность слизистой оболочки желудка и кишечника. При банальном использовании антибиотиков содержание полезных микроорганизмов может снижаться в кишечнике на 3-6 порядков, т.е. в тысячу-миллион раз!
Уже более 50 лет как в нашей стране, так и во всем мире для коррекции микроэкологических нарушений в кишечнике (дисбактериоз, дисбиоз) основными средствами (95-97%) служили препараты на основе живых микробов — пробиотики. В обычной лечебной практике, если врач при анализе кала на дисбактериоз выявлял снижение того или иного вида нормальной микробиоты, то он в первую очередь назначал пациенту пробиотик на основе того вида нормобиоты, дефицит которого зафиксирован. Мало бифидобактерий, давайте «добавим» бифидобактерии в составе того препарата, который врачу больше нравится, и т.д.
В последние годы была пересмотрена стратегия по поддержанию и восстановлению кишечной микробиоты!
Группе российских ученых (около 60 научных работ, 2010-2019 гг., 2 Международных научных открытий, более 10 патентов на изобретения) удалось получить убедительные доказательства того, что использование традиционных препаратов на основе живых микробов — пробиотиков — является не самым эффективным и безопасным путем коррекции микроэкологических нарушений в кишечнике.
Было установлено:
До толстой кишки (основной ареал обитания нормобиоты) в среднем доходит живой всего 1 из 1 000 000 (миллиона) принятых внутрь микробных клеток в составе пробиотика. Выживаемость живых клеток при транзите по желудочно-кишечному тракту составляет менее одной десятимиллионной доли процента. И никакие кислотоустойчивые капсулы, применяемые в некоторых пробиотиках, не спасают ситуацию: выживает не 1, а 4-5 клеток.
У каждого человека в кишечнике находятся свои индивидуальные штаммы (аутоштаммы) лактобацилл, бифидобактерий, кишечной палочки и т.д. А пробиотики изготавливают на основе «универсальных» производственных штаммов микробов. Дошедшие живыми до толстой кишки пробиотические клетки более чем в 70% случаев вступают в антагонистические взаимоотношения с аутоштаммами микроорганизмов пациента, проще говоря, обладают бионесовместимостью.
Пробиотические микробы обладают лимфоцитотоксическим действием, т.к. иммунная система пациента способна определить, какие микроорганизмы (свои или чужие) поступают в желудочно-кишечный тракт. Пробиотические микроорганизмы всегда являются чужеродными для индивидуальной микробиоты пациента.
Существовавший несколько десятилетий тезис о заместительном действии пробиотиков оказался мифом. Пробиотические клетки, дошедшие до толстой кишки в жизнеспособном состоянии, не приживаются в слизистой оболочке кишечника.
В пробиотиках основным действующим началом оказались не микробные клетки, как априорно считалось ранее, а продукты их жизнедеятельности — экзометаболиты, а сами микробные клетки только тормозят процесс восстановления микробиоты при дисбактериозе.
Одновременный прием тех или иных пробиотиков с антибиотиками, о чем постоянно твердят телевизионные рекламные ролики, на самом деле является абсурдным с научной точки зрения и необоснованным. Пробиотические клетки чувствительны к большинству антибиотиков даже в тех небольших концентрациях, которые создаются антибиотиками в крови, а в кишечнике концентрации антибиотиков создаются в десятки-сотни раз выше. Очевидно, что такая реклама вводит потребителя в заблуждение и, видимо, преследует только коммерческие цели.
Получены убедительные доказательства того, что чужеродные пробиотические микроорганизмы обладают биологически опасным потенциалом – при повышенных дозировках способны инициировать транслокацию кишечной микробиоты в брюшную полость и кровоток экспериментальных животных, приводящей к их гибели от инфекционно-токсического шока. При этом культуры аутоштаммов кишечной микробиоты, вводимые в тех же дозах, патологических реакций не вызывают.
Извечный российский вопрос — что делать?
Ответ простой, и в настоящее время он находит полное понимание и согласие у специалистов в данной области — поддерживать и восстанавливать свою собственную индивидуальную микробиоту, ту, которая сформировалась у вас после рождения. Это значительно эффективнее и безопаснее, чем пытаться заселить кишечник «хорошими», но чужими штаммами микроорганизмов!
Самое важное, что этот вывод многократно доказан и научно обоснован.
Достигнуть этого можно только:
- Путем использования узконаправленных пребиотиков, т.е. препаратов, в составе которых отсутствуют живые микробы, но есть вещества, селективно стимулирующие размножение индивидуальной микробиоты пациента. Данный класс препаратов представлен на российском рынке. Наиболее эффективным и изученным из них являются Стимбифид.
- Путем использования метабиотиков (метаболитных пробиотиков), т.е. препаратов, содержащих продукты жизнедеятельности микроорганизмов нормальной микробиоты, — экзометаболитов. Данный класс современных препаратов находится на стадии разработки.
- Путем использования композиции пребиотиков и метабиотиков (метапребиотиков), т.к. механизмы действия у них разные, а цель одна – эффективное и безопасное поддержание и восстановление индивидуальной (индигенной) микробиоты ЖКТ. Первым в мире и наиболее изученным метапребиотиком является Стимбифид плюс.
Пребиотики и метабиотики имеют неоспоримые преимущества перед препаратами, содержащими живые микробы (пробиотиками), а именно:
- Высокая биодоступность, т.к. пребиотические вещества доходят до толстой кишки на 95-97% в неизменном виде (у пробиотиков — менее 0,00000001%). На них в отличие от пробиотиков не влияют агрессивные факторы желудочно-кишечного тракта — кислотность, ферменты, желчь, перекисные соединения, иммуноглобулины и т.д.
- В отличие от пробиотических микробов пребиотики не вступают в конфликт (антагонистические взаимоотношения) с собственной микробиотой пациента, они, наоборот, служат эксклюзивной пищей для нее.
- После ферментации (утилизации) собственными штаммами нормобиоты пациента пребиотики создают благоприятные метаболические условия для её дальнейшего существования в активном состоянии путем закисления внутриполостной среды (снижения pH).
- Пребиотики и метабиотики в отличие от пробиотиков не только можно, но и нужно при необходимости принимать одновременно с антибиотиками. Во-первых, антибактериальные препараты не инактивируют пребиотики и метабиотики, т.к. в них нет живых клеток, а во-вторых, одновременный прием позволяет защитить кишечную микробиоту пациента от негативного сопутствующего воздействия антибиотиков, назначенных при инфекционной патологии других органов.
Этот очень важный вывод научно обоснован в экспериментальных работах группы российских ученых и получил подтверждение в клинической практике Учебно-научного медицинского центра УД Президента РФ.
И самое главное, пребиотики и метабиотики поддерживают и восстанавливают собственную кишечную микробиоту пациента, а не пытаются безрезультатно заселить слизистую кишечника «хорошими», но чужими для него штаммами микроорганизмов. Процесс восстановления индигенной (собственной) микробиоты всегда протекает наиболее эффективно и безопасно, т.к. она является составной частью сформировавшегося микробиоценоза еще с рождения индивидуума и ей не нужно «проходить паспортный контроль» перед иммунной системой и организмом в целом.
Метапребитики, а именно Стимбифид плюс, существенно повышают колонизационную резистентность слизистой оболочки ЖКТ, приводя к выраженному противоинфекционному эффекту: в желудке – к эрадикации хеликобактер пилори (в виде монотерапии!), а в кишечнике – к блокированию бактериальных кишечных инфекций (сальмонеллёза, кишечного иерсиниоза, псевдотуберкулёза и токсигенного эшерихиоза).
C глубоким уважением, президент научного общества «Микробиота» Чичерин И.Ю.
В дополнение к написанному:
В последнее время не только у врачей и учёных сформировалось понимание того, как правильно поддерживать и восстанавливать кишечную микробиоту, но и у широкой общественности появилось аргументированное мнение, что настойчиво рекламируемые пробиотики не решают лечебных проблем и служат только коммерческим целям их производителей. Смотрите сюжет одного из центральных каналов российского ТВ.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва, Россия;
ГБУЗ «Городская клиническая больница №31», Москва, Россия
Жарова М.Е.
ФГБУО ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
ГБУ «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента Департамента здравоохранения Москвы», Москва, Россия
Филимендикова К.Ю.
ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль, Россия
Никонов Е.Л.
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Микробиом человека: возрастные изменения и функции
Авторы:
Кайбышева В.О., Жарова М.Е., Филимендикова К.Ю., Никонов Е.Л.
Журнал:
Доказательная гастроэнтерология. 2020;9(2): 42‑55
Как цитировать:
Кайбышева В.О., Жарова М.Е., Филимендикова К.Ю., Никонов Е.Л.
Микробиом человека: возрастные изменения и функции. Доказательная гастроэнтерология.
2020;9(2):42‑55.
Kaibysheva VO, Zharova ME, Filimendikova KYu, Nikonov EL. Human Microbiome: age-related changes and functions. Russian Journal of Evidence-Based Gastroenterology. 2020;9(2):42‑55. (In Russ.).
https://doi.org/10.17116/dokgastro2020902142

?>
Читать метаданные
Цель исследования — рассмотреть основные возрастные изменения микробиома и его важнейшие функции. Основные положения. Интерес к микробиому человека вырос за последние десятилетия благодаря развитию новых методов диагностики, таких как секвенирование 16S рибосомальной РНК, полногеномное секвенирование, хроматоспектрометрия и др. Данные методы за короткий срок позволили значительно расширить понимание роли кишечной микробиоты и ее уникальных метаболитов в регуляции различных физиологических функций макроорганизма, включая обеспечение колонизационной резистентности слизистых оболочек, метаболизм, развитие и гомеостаз иммунной и нервной систем. Заключение. Несмотря на большое количество имеющихся данных о микробиоме, понимание его функции в организме человека еще далеко от совершенства, что обусловливает необходимость дальнейших исследований.
Авторы:
Кайбышева В.О.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова», Москва, Россия;
ГБУЗ «Городская клиническая больница №31», Москва, Россия
Жарова М.Е.
ФГБУО ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
ГБУ «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента Департамента здравоохранения Москвы», Москва, Россия
Филимендикова К.Ю.
ФГБОУ ВО «Ярославский государственный медицинский университет» Минздрава России, Ярославль, Россия
Никонов Е.Л.
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Список литературы:
- Ардатская М.Д., Бельмер С.В., Добрица В.П., Захаренко С.М., Лазебник Л.Б., Минушкин О.Н., Орешко Л.С., Ситкин С.И., Ткаченко Е.И., Суворов А.Н., Хавкин А.И., Шендеров Б.А. Дисбиоз (Дисбактериоз) кишечника: современное состояние проблемы, комплексная диагностика и лечебная коррекция. Экспериментальная и клиническая гастроэнтерология. 2015;117(5):13-50.
- Sender R, Fuchs S, Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoS Biology. 2016;14(8):e1002533. https://doi.org/10.1371/journal.pbio.1002533
- Sartor RB. Microbial influences in inflammatory bowel diseases. Gastroenterology. 2008;134(2):577-594. https://doi.org/10.1053/j.gastro.2007.11.059
- Микробиота. Под ред. Никонова Е.Л., Поповой Е.Н. М.: Издательство Медиа Сфера; 2019.
- Hooper LV, Gordon JI. Commensal Host-Bacterial Relationships in the Gut. Science. 2001;292(5519):1115-1118. https://doi.org/10.1126/science.1058709
- Ивашкин В.Т., Ивашкин К.В. Микробиом человека в приложении к клинической практике. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017;27(6):4-13.
- Okada H, Kuhn C, Feillet H, Bach JF. The «hygiene hypothesis» for autoimmune and allergic diseases: an update. Clinical and Experimental Immunology. 2010;160(1):1-9. https://doi.org/10.1111/j.1365-2249.2010.04139.x
- Canche-Pool EB, Cortez-Gómez R, Flores-Mejía R, González-González E, González-Serrano ME, Lara-Rodríguez MC, Ledesma-Soto Y, Mendoza-Aguilar MD, Meza-Sánchez DE, Sánchez-García FJ, Silva-Sánchez A, Thompson-Bonilla MR, Trujillo-Vizuet MG, Wong-Baeza I. Probiotics and autoimmunity: an evolutionary perspective. Medical Hypotheses. 2008;70(3):657-660. https://doi.org/10.1016/j.mehy.2007.07.008
- Vaarala O, Atkinson MA, Neu J. The «perfect storm» for type 1 diabetes: the complex interplay between intestinal microbiota, gut permeability, and mucosal immunity. Diabetes. 2008;57(10):2555-2562. https://doi.org/10.2337/db08-0331
- Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489(7415):220-230. https://doi.org/10.1038/nature11550
- Yatsunenko T, Rey FE, Manary MJ, Trehan I, Dominguez-Bello MG, Contreras M, Magris M, Hidalgo G, Baldassano RN, Anokhin AP, Heath AC, Warner B, Reeder J, Kuczynski J, Caporaso JG, Lozupone CA, Lauber C, Clemente JC, Knights D, Knight R, Gordon JI. Human gut microbiome viewed across age and geography. Nature. 2012;486(7402):222-227. https://doi.org/10.1038/nature11053
- Baohong W, Mingfei Y, Longxian L, Zongxin L, Lanjuan L. The Human Microbiota in Health and Disease. Engineering. 2017;3(1):71-82. https://doi.org/10.1016/J.ENG.2017.01.008
- Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, Fernandes GR, Tap J, Bruls T, Batto J, Bertalan M, Borruel N, Casellas F, Fernandez L, Gautier L, Hansen T, Hattori M, Hayashi T, Kleerebezem M, Kurokawa K, Leclerc M, Levenez F, Manichanh C, Nielsen HB, Nielsen T, Pons N, Poulain J, Qin J, Sicheritz-Ponten T, Tims S, Torrents D, Ugarte E, Zoetendal EG, Wang J, Guarner F, Pedersen O, de Vos WM, Brunak S, Doré J, Weissenbach J, Ehrlich SD, Bork P. Enterotypes of the human gut microbiome. Nature. 2011;473(7346):174-180. https://doi.org/10.1038/nature09944
- Cheng M, Ning K. Stereotypes about Enterotype: the Old and New Ideas. Genomics, Proteomics and Bioinformatics. 2019;17(1):4-12. https://doi.org/10.1016/j.gpb.2018.02.004
- Koren O, Knights D, Gonzalez A, Waldron L, Segata N, Knight R, Huttenhower C, Ley RE. A guide to enterotypes across the human body: meta-analysis of microbial community structures in human microbiome datasets. PLoS Computational Biology. 2013;9(1):e1002863. https://doi.org/10.1371/journal.pcbi.1002863
- Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li H, Bushman FD, Lewis JD. Linking long-term dietary patterns with gut microbial enterotypes. Science. 2011;334(6052):105-108. https://doi.org/10.1126/science.1208344
- Knights D, Ward TL, McKinlay CE, Miller H, Gonzalez A, McDonald D, Rob Knight R. Rethinking «enterotypes». Cell Host and Microbe. 2014;16(4):433-437. https://doi.org/10.1016/j.chom.2014.09.013
- Costea PI, Hildebrand F, Arumugam M, Bäckhed F, Blaser MJ, Bushman FD, de Vos WM, Ehrlich SD, Fraser CM, Hattori M, Huttenhower C, Jeffery IB, Knights D, Lewis JD, Ley RE, Ochman H, O’Toole PW, Quince C, Relman DA, Shanahan F, Sunagawa S, Wang J, Weinstock GM, Wu GD, Zeller G, Zhao L, Raes J, Knight R, Bork P. Enterotypes in the landscape of gut microbial community composition. Nature Microbiology. 2018;3(1):8-16. https://doi.org/10.1038/s41564-017-0072-8
- Jeffery IB, Claesson MJ, O’Toole PW, Shanahan F. Categorization of the gut microbiota: enterotypes or gradients? Nature Reviews Microbiology. 2012;10(9):591-592. https://doi.org/10.1038/nrmicro2859
- Matsuki T, Yahagi K, Mori H, Matsumoto H, Hara T, Tajima S, Ogawa E, Kodama H, Yamamoto K, Yamada T, Matsumoto S, Kurokawa K. A key genetic factor for fucosyllactose utilization affects infant gut microbiota development. Nature Communications. 2016;7:11939. https://doi.org/10.1038/ncomms11939
- Dethlefsen L, McFall-Ngai M, Relman DA. An ecological and evolutionary perspective on human-microbe mutualism and disease. Nature. 2007;449(7164):811-818. https://doi.org/10.1038/nature06245
- Tanaka M, Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life. Allergology International. 2017;66(4):515-522. https://doi.org/10.1016/j.alit.2017.07.010
- Greenhalgh K, Meyer KM, Aagaard KM, Wilmes P. The human gut microbiome in health: establishment and resilience of microbiota over a lifetime. Environmental Microbiology. 2016;18(7):2103-2116. https://doi.org/10.1111/1462-2920.13318
- Sjögren YM, Tomicic S, Lundberg A, Böttcher MF, Björkstén B, Sverremark-Ekström E, Jenmalm MC. Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses. Clinical and Experimental Allergy. 2009;39(12):1842-1851. https://doi.org/10.1111/j.1365-2222.2009.03326.x
- Chichlowski M, De Lartigue G, German JB, Raybould HE, Mills DA. Bifidobacteria isolated from infants and cultured on human milk oligosaccharides affect intestinal epithelial function. Journal of Pediatric Gastroenterology and Nutrition. 2012;55(3):321-327. https://doi.org/10.1097/MPG.0b013e31824fb899
- Jeurink PV, van Bergenhenegouwen J, Jiménez E, Knippels LM, Fernández L, Garssen J, Knol J, Rodríguez JM, Martín R. Human milk: a source of more life than we imagine. Beneficial Microbes. 2013;4(1):17-30. https://doi.org/10.3920/BM2012.0040
- Soto A, Martín V, Jiménez E, Mader I, Rodríguez JM, Fernández L. Lactobacilli and bifidobacteria in human breast milk: influence of antibiotherapy and other host and clinical factors. Journal of Pediatric Gastroenterology and Nutrition. 2014;59(1):78-88. https://doi.org/10.1097/MPG.0000000000000347
- Heikkilä MP, Saris PE. Inhibition of Staphylococcus aureus by the commensal bacteria of human milk. Journal of Applied Microbiology. 2003;95(3):471-478. https://doi.org/10.1046/j.1365-2672.2003.02002.x
- Jost T, Lacroix C, Braegger C, Chassard C. Assessment of bacterial diversity in breast milk using culture-dependent and culture-independent approaches. British Journal of Nutrition. 2013;110(7):1253-1262. https://doi.org/10.1017/S0007114513000597
- Cabrera-Rubio R, Collado MC, Laitinen K, Salminen S, Isolauri E, Mira A. The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. The American Journal of Clinical Nutrition. 2012;96(3):544-551. https://doi.org/10.3945/ajcn.112.037382
- Marcobal A, Barboza M, Froehlich JW, Block DE, German JB, Lebrilla CB, Mills DA. Consumption of human milk oligosaccharides by gut-related microbes. Journal of Agricultural and Food Chemistry. 2010;58(9):5334-5340. https://doi.org/10.1021/jf9044205
- Le Huerou-Luron I, Blat S, Boudry G. Breast-v. formula-feeding: impacts on the digestive tract and immediate and long-term health effects. Nutrition Research Reviews. 2010;23(1):23-36. https://doi.org/10.1017/S0954422410000065
- Veereman-Wauters G, Staelens S, Van de Broek H, Plaskie K, Wesling F, Roger LC, McCartney AL, Assam P. Physiological and bifidogenic effects of prebiotic supplements in infant formulae. Journal of Pediatric Gastroenterology and Nutrition. 2011;52(6):763-771. https://doi.org/10.1097/MPG.0b013e3182139f39
- Stark PL, Lee A. Clostridia isolated from the feces of infants during the first year of life. The Journal of Pediatrics. 1982;100(3):362-365. https://doi.org/10.1016/S0022-3476(82)80430-7
- Marcobal A, Barboza M, Sonnenburg ED, Pudlo N, Martens EC, Desai P, Lebrilla CB, Weimer BC, Mills DA, German JB, Sonnenburg JL. Bacteroides in the infant gut consume milk oligosaccharides via mucus-utilization pathways. Cell Host and Microbe. 2011;10(5):507-514. https://doi.org/10.1016/j.chom.2011.10.007
- Gregory KE, Samuel BS, Houghteling P, Shan G, Ausubel FM, Sadreyev RI, Walker AW. Influence of maternal breast milk ingestion on acquisition of the intestinal microbiome in preterm infants. Microbiome. 2016;4(1):68. https://doi.org/10.1186/s40168-016-0214-x
- Iyengar SR, Walker WA. Immune factors in breast milk and the development of atopic disease. Journal of Pediatric Gastroenterology and Nutrition. 2012;55(6):641-647. https://doi.org/10.1097/MPG.0b013e3182617a9d
- Field CJ. The immunological components of human milk and their effect on immune development in infants. Journal of Nutrition. 2005;135(1):1-4. https://doi.org/10.1093/jn/135.1.1
- Levast B, Li Z, Madrenas J. The role of IL-10 in microbiome-associated immune modulation and disease tolerance. Cytokine. 2015;75(2):291-301. https://doi.org/10.1016/j.cyto.2014.11.027
- Vallès Y, Artacho A, Pascual-García A, Ferrús ML, Gosalbes MJ, Abellán JJ, Francino MP. Microbial succession in the gut: directional trends of taxonomic and functional change in a birth cohort of Spanish infants. PLoS Genetics. 2014;10(6):e1004406. https://doi.org/10.1371/journal.pgen.1004406
- Palmer C, Bik EM, DiGiulio DB, Relman DA, Brown PO. Development of the human infant intestinal microbiota. PLoS Biology. 2007;5(7):e177. https://doi.org/10.1371/journal.pbio.0050177
- Fallani M, Amarri S, Uusijarvi A, Adam R, Khanna S, Aguilera M, Gil A, Vieites JM, Norin E, Young D, Scott JA, Doré J, Edwardset CA, Thezé B, Khan MK, Benatti F, De Mola RM, Schroten H, Thompson O, Maldonado J, Ferrer M. Determinants of the human infant intestinal microbiota after the introduction of first complementary foods in infant samples from five European centres. Microbiology. 2011;157(Pt 5):1385-1392. https://doi.org/10.1099/mic.0.042143-0
- Fouhy F, Guinane CM, Hussey S, Wall R, Ryan CA, Dempsey EM, Murphy B, Ross RP, Fitzgerald GF, Stanton C, Cotter PD. High-throughput sequencing reveals the incomplete, short-term recovery of infant gut microbiota following parenteral antibiotic treatment with ampicillin and gentamicin. Antimicrobial Agents and Chemotherapy. 2012;56(11):5811-5820. https://doi.org/10.1128/AAC.00789-12
- Greenwood C, Morrow AL, Lagomarcino AJ, Altaye M, Taft DH, Yu Z, Newburg DS, Ward DV, Schibler KR. Early empiric antibiotic use in preterm infants is associated with lower bacterial diversity and higher relative abundance of Enterobacter. The Journal of Pediatrics. 2014;165(1):23-29. https://doi.org/10.1016/j.jpeds.2014.01.010
- Moore AM, Ahmadi S, Patel S, Gibson MK, Wang B, Ndao IM, Deych E, Shannon W, Tarr PI, Warner BB, Dantas G. Erratum: Gut resistome development in healthy twin pairs in the first year of life. Microbiome. 2015;3:29. https://doi.org/10.1186/s40168-015-0095-4
- Tanaka S, Kobayashi T, Songjinda P, Tateyama A, Tsubouchi M, Kiyohara C, Shirakawa T, Sonomoto K, Nakayama J. Influence of antibiotic exposure in the early postnatal period on the development of intestinal microbiota. FEMS Immunology and Medical Microbiology. 2009;56(1):80-87. https://doi.org/10.1111/j.1574-695X.2009.00553.x
- Langdon A, Crook N, Dantas G. The effects of antibiotics on the microbiome throughout development and alternative approaches for therapeutic modulation. Genome Medicine. 2016;8(1):39. https://doi.org/10.1186/s13073-016-0294-z
- David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling AV, Devlin AS, Varma Y, Fischbach MA, Biddinger SB, Dutton RJ, Turnbaugh PJ. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014;505(7484):559-563. https://doi.org/10.1038/nature12820
- Maukonen J, Saarela M. Human gut microbiota: does diet matter? Proceedings of the Nutrition Society. 2015;74(1):23-36. https://doi.org/10.1017/S0029665114000688
- Graf D, Di Cagno R, Fåk F, Flint HJ, Nyman M, Saarela M, Watzl B. Contribution of diet to the composition of the human gut microbiota. Microbial Ecology in Health and Disease. 2015;26:26164. https://doi.org/10.3402/mehd.v26.26164
- Chung WS, Walker AW, Louis P, Parkhill J, Vermeiren J, Bosscher D, Duncan SH, Flint HJ. Modulation of the human gut microbiota by dietary fibres occurs at the species level. BMC Biology. 2016;14:3. https://doi.org/10.1186/s12915-015-0224-3
- Dominianni C, Sinha R, Goedert JJ, Pei Z, Yang L, Hayes RB, Ahn J. Sex, body mass index, and dietary fiber intake influence the human gut microbiome. PLoS One. 2015;10(4):e0124599. https://doi.org/10.1371/journal.pone.0124599
- Flint HJ, Duncan SH, Scott KP, Louis P. Links between diet, gut microbiota composition and gut metabolism. Proceedings of the Nutrition Society. 2015;74(1):13-22. https://doi.org/10.1017/S0029665114001463
- Jandhyala SM, Talukdar R, Subramanyam C, Vuyyuru H, Sasikala M, Nageshwar Reddy D. Role of the normal gut microbiota. World Journal of Gastroenterology. 2015;21(29):8787-8803. https://doi.org/10.3748/wjg.v21.i29.8787
- Greenhill AR, Tsuji H, Ogata K, Natsuhara K, Morita A, Soli K, Larkins J, Tadokoro T, Odani S, Baba J, Naito Y, Tomitsuka E, Nomoto K, Siba PM, Horwood PF, Umezaki M. Characterization of the gut microbiota of Papua New Guineans using reverse transcription quantitative PCR. PLoS One. 2015;10(2):e0117427. https://doi.org/10.1371/journal.pone.0117427
- Flint HJ, Scott KP, Louis P, Duncan SH. The role of the gut microbiota in nutrition and health. Nature Reviews Gastroenterology and Hepatology. 2012;9(10):577-589. https://doi.org/10.1038/nrgastro.2012.156
- Azad MB, Konya T, Maughan H, Guttman DS, Field CJ, Chari RS, Sears MR, Becker AB, Scott JA, Kozyrskyj AL, CHILD Study Investigators. Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months. Canadian Medical Association Journal. 2013;185(5):385-394. https://doi.org/10.1503/cmaj.121189
- Maryam TA, Jean-Christophe L, Didier R. Diet influence on the gut microbiota and dysbiosisrelated to nutritional disorders. Human Microbiome Journal. 2016;1:3-11. https://doi.org/10.1016/j.humic.2016.09.001
- Mariat D, Firmesse O, Levenez F, Guimarăes V, Sokol H, Doré J, Corthier G, Furet JP. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age. BMC Microbiology. 2009;9:123. https://doi.org/10.1186/1471-2180-9-123
- Cho I, Blaser MJ. The human microbiome: at the interface of health and disease. Nature Reviews Genetics. 2012;13(4):260-270. https://doi.org/10.1038/nrg3182
- van Tongeren SP, Slaets JP, Harmsen HJ, Welling GW. Fecal microbiota composition and frailty. Applied and Environmental Microbiology. 2005;71(10):6438-6442. https://doi.org/10.1128/AEM.71.10.6438-6442.2005
- Voreades N, Kozil A, Weir TL. Diet and the development of the human intestinal microbiome. Frontiers in Microbiology. 2014;5:494. https://doi.org/10.3389/fmicb.2014.00494
- Claesson MJ, Jeffery IB, Conde S, Power SE, O’Connor EM, Cusack S, Harris HMB, Coakley M, Lakshminarayanan B, O’Sullivan O, Fitzgerald GF, Deane J, O’Connor M, Harnedy N, O’Connor K, O’Mahony D, van Sinderen D, Wallace M, Brennan L, Stanton C, Marchesi JR, Fitzgerald AP, Shanahan F, Hill C, Ross RP, O’Toole PW. Gut microbiota composition correlates with diet and health in the elderly. Nature. 2012;488(7410):178-184. https://doi.org/10.1038/nature11319
- Kho ZY, Lal SK. The Human Gut Microbiome — A Potential Controller of Wellness and Disease. Frontiers in Microbiology. 2018;9:1835. https://doi.org/10.3389/fmicb.2018.01835
- Madsen KL, Doyle JS, Jewell LD, Tavernini MM, Fedorak RN. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology. 1999;116(5):1107-1114. https://doi.org/10.1016/S0016-5085(99)70013-2
- Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease. Nature Reviews Immunology. 2009;9(5):313-323. https://doi.org/10.1038/nri2515
- Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, Wei D, Goldfarb KC, Santee CA, Lynch SV, Tanoue T, Imaoka A, Itoh K, Takeda K, Umesaki Y, Honda K, Littman DR. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 2009;139(3):485-498. https://doi.org/10.1016/j.cell.2009.09.033
- Erny D, Hrabě de Angelis AL, Jaitin D, Wieghofer P, Staszewski O, David E, Keren-Shaul H, Mahlakoiv T, Jakobshagen K, Buch T, Schwierzeck V, Utermöhlen O, Chun E, Garrett WS, McCoy KD, Diefenbach A, Staeheli P, Stecher B, Amit I, Prinz M. Host microbiota constantly control maturation and function of microglia in the CNS. Nature Neuroscience. 2015;18(7):965-977. https://doi.org/10.1038/nn.4030
- Nishioku T, Matsumoto J, Dohgu S, Sumi N, Miyao K, Takata F, Shuto H, Yamauchi A, Kataoka Y. Tumor necrosis factor-alpha mediates the blood-brain barrier dysfunction induced by activated microglia in mouse brain microvascular endothelial cells. Journal of Pharmacological Sciences. 2010;112(2):251-254. https://doi.org/10.1254/jphs.09292SC
Введение
Согласно современным представлениям, «микробиом» включает в себя единый микробно-тканевый комплекс, который образуют микроколонии бактерий, грибы, вирусы, простейшие и продуцируемые ими метаболиты, а также слизь (муцин), эпителиальные клетки слизистой оболочки и их гликокаликс, клетки стромы слизистой оболочки (фибробласты, лейкоциты, нейроэндокринные клетки, клетки микроциркуляторного русла и прочее) [1].
До последнего времени изучение состава и функциональной активности микробиоты человека было крайне ограничено в связи с невозможностью культивирования подавляющего большинства микроорганизмов на питательных средах. Однако развитие таких технологий, как секвенирование 16S рибосомальной РНК, а также полногеномное секвенирование позволило (в рамках двух проектов по изучению микробиома человека Human Microbiome Project и Metagenomics of Human Intestinal Tract) получить колоссальную по своим масштабам и значению информацию о составе и метаболической активности микробиоты.
На сегодняшний день считается, что соотношение микробных клеток к клеткам человека составляет 1:1, а суммарное количество клеток в составе микробиоты человека равно 1013—1014. Эти данные основаны на оценке общего количества бактериальных клеток в толстой кишке (примерно 1013), в которой, как известно, наблюдается наивысшая плотность бактериальной колонизации [2—4].
В различных отделах пищеварительного тракта состав и численность микробиоты значительно различаются (рис. 1). Наиболее скудным является микробное сообщество желудка, в котором обнаруживают представителей родов Lactobacillus, Stomatococcus, Sarcina в количестве до 102 в 1 г содержимого. В тонкой кишке, за исключением дистальных отделов подвздошной кишки, количество микроорганизмов не превышает 104—105 клеток на 1 г. Численность микроорганизмов в дистальных отделах подвздошной кишки значительно возрастает, достигая 107—108 на 1 г. При этом в проксимальных отделах тонкой кишки обнаруживаются преимущественно грамположительные аэробные бактерии, в дистальных — грамотрицательные энтеробактерии и анаэробы. Микробиота толстой кишки представлена в основном анаэробными бактериями — их общее количество достигает огромных значений — 1013 на 1 г содержимого [1—4].
Бактерии, входящие в состав микробиоты желудочно-кишечного тракта (ЖКТ) человека, условно можно разделить на представителей облигатной (около 90%), факультативной (около 10%) и транзиторной (менее 1%) микрофлоры.
К облигатной микрофлоре, постоянно присутствующей в организме человека, выполняющей важную роль в его метаболизме и защите его от возбудителей инфекционных заболеваний, относятся преимущественно анаэробные бактерии, обитающие в толстой кишке (Bifidobacterium, Propionibacterium, Bacteroides). Видовое разнообразие облигатной флоры невелико, крайне консервативно, однако численность (по сравнению с другими представителями) максимальна.
К факультативной (сопутствующей) микрофлоре относятся условно-патогенные бактерии, доля которых в норме не превышает 10% (Escherichia, Enterococcus, Fusobacterium, Peptostreptococcus, Clostridium, Eubacterium и др.). Количественный и качественный состав факультативной флоры подвержен значительным изменениям в зависимости от внешних факторов.
Транзиторная флора составляет менее 1%, представлена стафилококками, клостридиями, протеями, дрожжеподобными грибами и др., в основном состоит из микроорганизмов, занесенных извне и транзитом проходящих ЖКТ. Некоторые представители транзиторной флоры могут обладать высоким адгезивным или токсигенным потенциалом, приводя (при ослаблении защитных функций облигатной микрофлоры) к развитию кишечных инфекций [1, 4].
Представители облигатной микробиоты образуют микроколонии, так называемую пристеночную флору, функционирующую в тесной взаимосвязи с кишечной стенкой. Облигатные анаэробы (бифидобактерии, бактероиды, пропионовокислые бактерии и др.) занимают нишу в непосредственном контакте с эпителием, далее располагаются аэротолерантные анаэробы (лактобациллы и др.), еще выше — факультативные анаэробы, а затем — аэробы [1].
Следует отметить, что бактерии, обитающие в просвете кишки (около 5% от микробной популяции) и являющиеся основными представителями фекальной микрофлоры, не взаимодействуют со слизистой оболочкой. Субстратом для жизнедеятельности полостной микрофлоры являются неперевариваемые пищевые волокна, на которых она и фиксируется. Состав полостной флоры крайне непостоянен, зависит от поступления пищевых веществ и множества других факторов. Полостная флора доминирует в фекальной микрофлоре, что заставляет с особой осторожностью оценивать изменения в различных микробных популяциях, выявляемых при бактериологическом исследовании кала [1].
Крайне важным вопросом при изучении микробиома человека является геном микроорганизмов (в связи с их огромным разнообразием и принадлежностью к разным родам, видам и прочее), который содержит, по меньшей мере, в 50—100 (а по некоторым оценкам в 200) раз больше генов по сравнению с геномом организма-хозяина. Генетическое разнообразие, которое привносит в организм человека микробиота, обусловливает возникновение дополнительных (не закодированных в организме хозяина) ферментативных путей метаболизма, влияя на функционирование организма, процессы адаптации, реактивность [4—6].
Микробиом не только дополняет человеческий генный пул, но и демонстрирует значительно бóльшие пластичность и изменчивость по сравнению с человеческим геномом. Это означает, что состав микробиоты может быстро изменяться, реагируя на иммунную агрессию организма-хозяина, инфекции, новые компоненты пищевого рациона, прием антибиотиков, многие другие факторы. Способность микробиоты быстро приспосабливаться к изменяющимся условиям внешней среды путем изменения своего состава и ферментативной активности в свою очередь обеспечивает лучшую адаптацию человеческого организма к неблагоприятным факторам [6].
Сложно переоценить роль микробиоты в развитии и функционировании иммунной системы организма-хозяина. Существует точка зрения, известная как «гигиеническая теория». Данная теория гласит, что быстрый рост аллергических и аутоиммунных заболеваний, наблюдаемый в последние десятилетия в экономически развитых странах, можно объяснить нарушением формирования микробного разнообразия у современных детей как следствие улучшения гигиенических условий, чрезмерного использования дезинфектантов, моющих средств, антибиотиков. Ограничение контакта с микроорганизмами в ранние периоды развития кишечника ребенка приводит впоследствии к неспособности организма поддерживать необходимый уровень иммунологической толерантности и развитию аллергических и аутоиммунных заболеваний [4, 7—9].
Несмотря на многообразие микроорганизмов, обитающих в просвете ЖКТ человека, известно, что более 90% кишечных бактерий у здоровых лиц представлены двумя основными типами (phyla) — Firmicutes и Bacteroidetes. Типы Actinobacteria и Proteobacteria представлены в меньшей мере (рис. 2).
К типу Bacteroidetes относятся грамотрицательные бактерии, принадлежащие почти к 20 родам, к типу Firmicutes — грамположительные бактерии, принадлежащие более чем к 200 родам. Подавляющее большинство лиц в человеческой популяции имеют схожие пропорции каждого из этих типов [6]. Однако на видовом и особенно штаммовом уровне микробиота каждого человека индивидуальна [4, 10, 11].
Следует отметить, что по сей день не существует понятия «нормальной» микробиоты, поскольку состав ее индивидуален, вариабелен и зависит от возраста, пола, расы, места обитания, характера питания и многих других факторов [12].
Энтеротипы
В зависимости от доминирующего рода бактерий в составе микробиоты предложено условное выделение 3 основных ее типов — «энтеротипов». Впервые термин «энтеротип» появился в публикации журнала «Nature» в 2011 г., получив с тех пор широкое распространение [13].
Энтеротипы отличаются не только составом, но и главными метаболическими путями извлечения энергии из пищевых субстратов. Так, энтеротип 1 (тип с преобладанием бактерий рода Bacteroides) характеризуется высокой сахаролитической активностью, энтеротип 2 (тип с преобладанием бактерий рода Prevotella) — способностью расщеплять гликопротеины слизи, энтеротип 3 (тип с преобладанием бактерий рода Ruminococcus) — расщеплением гликопротеинов и трансмембранным транспортом углеводов.
Основным из ключевых положений концепции об энтеротипах является устойчивость и постоянство микробного состава энтеротипа. Если состав микробиоты и подвержен изменениям в ответ на внешние факторы (прием антибиотиков, изменения пищевого рациона), то происходит это на уровне видового и штаммового разнообразия, но не приводит к смене доминирующего рода бактерий в составе энтеротипа. Считалось, что энтеротипы не имеют континентальной или национальной специфичности, изначально определяясь путем родоразрешения, методом вскармливания в грудничковый период и рационом питания в семье. Преобладающий род бактерий в составе микробиома толстой кишки наделялся способностью определять характер метаболизма пищевых и лекарственных веществ и даже склонность к некоторым заболеваниям [13]. Большое количество экспериментальных и клинических исследований посвящено поиску ассоциаций между различными заболеваниями и энтеротипами. Так, например, обнаружено, что ожирение чаще наблюдается у лиц с преобладанием бактерий типа Firmicutes (энтеротип 3).
Тем не менее в настоящее время накапливается все больше данных, ставящих под сомнение концепцию энтеротипов. Считается, что столь категоричное разделение микробиоты человека на 3 энтеротипа слишком условно, тогда как в большинстве случаев имеет место некий промежуточный вариант, изменяющийся в зависимости от внешних факторов, прежде всего от характера питания, между типами с преобладанием бактерий рода Bacteroides и Prevotella [14—21].
Более того, вопреки предыдущим представлениям о значительной устойчивости энтеротипов, в некоторых экспериментальных работах наглядно показана возможность изменения энтеротипа в течение нескольких дней с дальнейшим сохранением «нового» доминирующего рода бактерий. Так, в работе D. Knights и соавт. под названием «Переосмысливая концепцию энтеротипов» (Rethinking «enterotypes») показана возможность быстрой смены энтеротипа Ruminococcus на энтеротип с преобладанием Bacteroides, а также энтеротипа Bacteroides на энтеротип Prevotella [17]. В целом у большинства наблюдаемых субъектов с течением времени (5—10 лет) зафиксирована смена энтеротипа, что поставило под сомнение идею об устойчивости и постоянстве энтеротипов, а значит и целесообразность подобной классификации [14, 17].
В связи с этим возник закономерный вопрос о правомочности рассмотрения тех или иных энтеротипов как маркеров, ассоциированных с развитием определенных заболеваний. Требуются дальнейшие исследования для ответа на указанные вопросы, однако уже сейчас очевидно, что взаимодействия между бактериальными родами в составе микробиоты кишечника значительно сложнее, чем представлялось ранее.
Микробиота здорового человека и ее развитие в течение жизни
Становление микробиоты человека начинается еще в период внутриутробного развития в полости матки. Бактерии обнаруживаются в околоплодной жидкости, пупочном канатике, оболочках плода, плаценте и меконии. Видовой состав этих бактерий в большей степени соответствует микробиоте кишечника и ротовой полости матери (например, Fusobacterium spp. и Bacteroides spp.). Предполагается, что бактерии из полости рта через микроповреждения слизистой оболочки могут попадать в системный кровоток, гематогенным путем достигать плаценты и колонизировать ее [22].
Существуют работы, показывающие ассоциацию между заболеваниями периодонта у матери и повышением риска преждевременных родов и внутриутробных инфекций плода [22, 23]. Таким образом, микробиом матери может быть как источником первых бактерий, колонизирующих ЖКТ плода, так и причиной патологических состояний. В ходе ряда исследований выявлены следующие перинатальные факторы, оказывающие негативное влияние на микробиоту новорожденного и/или плаценты: чрезмерный набор массы тела и избыточное содержание жира в рационе матери во время беременности, инфекционные заболевания, стрессы, сахарный диабет [22, 23].
Активное заселение пищеварительного тракта микробами начинается в процессе родов, и происходит это за счет бактерий, входящих в состав микробиоты влагалища, кожи, кишечника, ротовой полости матери (Lactobacillus, Prevotella, Sneathia). Способ родоразрешения в значительной мере определяет видовой состав микробиоты младенцев. У детей, рожденных посредством кесарева сечения, заселение кишечника бактериями рода Bacteroides и Bifidobacterium запаздывает, по меньшей мере, на 1 мес по сравнению с детьми, рожденными естественным путем (рис. 3). В составе микробиоты таких детей доминируют виды, колонизирующие кожные покровы, а не родовые пути матери, такие как Staphylococcus, Corynebacterium и Propionibacterium, наблюдается активное размножение бактерий вида Clostridium difficile. Для микробиоты детей, родившихся посредством кесарева сечения, характерно снижение микробного разнообразия, у них повышен риск развития аллергических и аутоиммунных заболеваний, таких как бронхиальная астма, аллергический ринит, целиакия и прочее [22, 23].
Большое значение для состава микробиоты кишечника имеет также срок родоразрешения. У недоношенных детей наблюдается снижение разнообразия кишечной микробиоты, низкое содержание лакто- и бифидобактерий (Lactobacillus spp., Bacteroides spp. и Bifidobacterium spp). Считается, что это может быть связано не столько с недоношенностью, сколько с применением антибиотиков, пребыванием в палатах интенсивной терапии и другими ятрогенными факторами. Нарушение состава кишечной микробиоты у недоношенных детей ассоциировано с развитием некротизирующего энтероколита, тяжелых воспалительных процессов в ЖКТ [22, 23].
Роль питания в раннем детском возрасте в формировании микробиоты толстой кишки
В 1-й год жизни микробиота младенцев характеризуется относительно невысоким микробным разнообразием. Постепенно, в зависимости от метода вскармливания и обширности контакта с окружающей средой (наличие животных в доме, число братьев и сестер, гигиенические условия, применение антибиотиков), таксономическое разнообразие микробиоты толстой кишки значительно обогащается (см. рис. 3) [22, 23]. Большое значение в становлении микробиоты кишечника ребенка имеет метод вскармливания (грудное вскармливание или искусственные смеси). Грудное молоко не стерильно, оно содержит до 600 видов различных бактерий, численность бактерий в 1 мл молока достигает 103—104. Большую часть бактерий грудного молока составляют бактерии родов Lactobacillus, Leuconostoc, Streptococcus, Enterococcus, Lactococcus, Weissella, Bifidobacterium. Кроме того, в грудном молоке могут присутствовать грамотрицательные бактерии Serratia, Pseudomonas, а также типичные представители микробиома полости рта Veillonella, Leptotrichia, Prevotella [24—30].
Одним из компонентов грудного молока являются олигосахариды (галактоолигосахариды). Незначительно расщепляясь в тонкой кишке, они достигают толстой кишки преимущественно в непереваренном виде, где ферментируются Bifidobacterium с образованием короткоцепочечных жирных кислот (КЦЖК) и молочной кислоты. Таким образом, присутствие в молоке олигосахаридов обусловливает размножение в кишечнике детей, находящихся на грудном вскармливании, грамположительных бактерий типа Actinobacteria (преимущественно бифидобактерий), сдерживающих размножение бактерий других типов [20, 22, 23, 31, 32].
Большинство современных молочных смесей обогащено олигосахаридами, что теоретически должно способствовать развитию бактерий рода Bifidobacterium. Однако у детей, находящихся на искусственном вскармливании, обнаруживаются такие изменения состава микробиоты толстой кишки, как чрезмерное развитие представителей Bacteroides и Clostridium, увеличение доли условно-патогенных видов бактерий, например Escherichia coli, Clostridium difficile [33—36]. Вероятно, влияние грудного молока на становление микробиоты толстой кишки младенца обусловлено не только олигосахаридами. Помимо них, грудное молоко содержит иммуноглобулины IgA и IgG, антимикробные вещества — лизоцим и лактоферрин, интерлейкин (ИЛ) ИЛ-10, лимфоциты, фактор роста опухоли TGF-β, модулирующие работу иммунной системы ребенка и влияющие на состав микроорганизмов, которые смогут прижиться в его ЖКТ [29, 37—39]. Известно, что добавление к рациону искусственно вскармливаемых детей пастеризованного человеческого молока способствует становлению микробиоты, близкой по составу к таковой у детей, находящихся на грудном вскармливании [36].
После введения прикорма в рацион ребенка происходит значительное изменение микробного сообщества толстой кишки, характеризующееся снижением доли Bifidobacterium наряду с активизацией размножения бактерий, ферментирующих полисахариды (типов Bacteroidetes или Firmicutes) [40—42].
Примерно к 3 годам у ребенка формируется взрослый тип микробиоты, который в отсутствие тяжелых заболеваний, кардинальных изменений в диетических пристрастиях или длительного приема антибиотиков характеризуется постоянством состава на уровне доминирующего типа бактерий.
Влияние антибиотикотерапии в раннем детском возрасте на формирование микробиоты толстой кишки
Применение антибиотиков в раннем детском возрасте приводит к значительному снижению микробного разнообразия, обеднению представителей преобладающего типа Actinobacteria с одновременным увеличением доли Proteobacteria, а также селекции антибиотикорезистентных штаммов [43—45].
В работе S. Tanaka и соавт. проанализирован результат антибиотикотерапии препаратами широкого спектра действия в течение первых 4 дней жизни детей [46]. Согласно полученным данным, в 1-ю неделю в составе микробиоты толстой кишки наблюдалось снижение доли Bifidobacterium наряду с патологической колонизацией Enterococcus. В течение последующего месяца зафиксирован избыточный рост Enterobacteriaceae и Enterococcus.
В целом данные эпидемиологических исследований свидетельствуют о том, что применение антибиотиков в раннем детском возрасте сопровождается значительными изменениями еще несформированной микробиоты, нередко приводя к непрогнозируемым и серьезным последствиям. Известно, что лечение антибиотиками повышает у детей риск развития таких заболеваний, как астма, экзема, сахарный диабет 1-го типа, воспалительные заболевания кишки, ожирение и др. [47].
Факторы, оказывающие влияние на состав микробиоты взрослых людей
Кроме возраста, на состав микробиоты человека влияют такие факторы, как пол, пищевые предпочтения, социально-экономический статус и уровень образования, прием антибиотиков и прочее. Имеют значение и географические различия, предположительно связанные с характером питания. У взрослого человека со сформировавшейся микробиотой характер питания не является главным фактором, определяющим ее состав, но некоторые бактериальные таксоны (например, энтеротип 1 с преобладанием бактерий рода Bacteroidetes) могут быстро реагировать на изменения пищевого рациона [48].
Так, употребление в пищу продуктов с высоким содержанием пищевых волокон приводит к увеличению в составе микробиоты доли определенных видов бактерий (Roseburia, Blautia, Eubacterium rectale, Faecalibacterium prausnitzii), ферментирующих растительные волокна с образованием бутирата, а также некоторых бактерий, относящихся к типам Actinobacteria (Bifidobacteria, Lactobacilli) и Bacteroidetes [49—52]. Известно, что доминирующими бактериями в микробиоте вегетарианцев являются Prevotella, Clostridium clostridioforme и Faecalibacterium prausnitzii [50, 53]. По сравнению с лицами, употребляющими животные продукты, у вегетарианцев наблюдается снижение доли бактерий, принадлежащих к Bacteroides, Bifidobacteria, Enterobacteriaceae species [54].
Высокобелковая диета характеризуется увеличением активности протеолитических бактерий, таких как, например, Bacteroides spp. [49, 50]. Богатая жирами диета приводит к синтезу большого количества желчных кислот, что в свою очередь способствует размножению тех бактерий, которые метаболизируют эти кислоты, и угнетает размножение других видов [49, 50]. Диеты с преобладанием животных продуктов способствуют развитию бактерий, устойчивых к желчным кислотам, таких как Bacteroides, Alistipes и Bilophila, а также бутират-продуцирующих клостридий [50, 53].
Таким образом, преобладание в пищевом рационе одного из макронутриентов (белков, жиров, углеводов) детерминирует развитие определенных видов бактерий в составе микробиоты толстой кишки (рис. 4) [22, 23].
Например, «западная диета», распространенная в экономически развитых странах Европы и Северной Америки, изобилует жирами, рафинированными углеводами, животными белками на фоне крайне низкого содержания растительных волокон. Такая диета ассоциирована со снижением микробного разнообразия, увеличением доли Bacteroides и снижением бактерий рода Prevotella [49].
В развивающихся странах с низким социально-экономическим статусом (особенно в сельской местности) пищевой рацион жителей, напротив, богат растительными волокнами, сложными углеводами (за счет наличия большого количества свежих овощей, фруктов и цельнозерновых продуктов). Микробиота толстой кишки людей, проживающих в данных регионах, характеризуется разнообразием видов бактерий (Prevotella, Succinivibrio, Treponema), ферментирующих полисахариды и образующих КЦЖК [22, 23, 53, 55, 56].
КЦЖК, образующиеся в процессе ферментации пищевых волокон, являются ключевыми субстратами в энергетическом метаболизме колоноцитов, играют важнейшую роль в нормальном функционировании барьерной функции кишки, модулируют работу иммунной системы организма-хозяина. Считается, что низкой продукцией КЦЖК у людей, предпочитающих «западную диету», можно объяснить возросшую распространенность аллергических и аутоиммунных заболеваний в экономически развитых странах [57].
Развитие определенных видов бактерий в составе микробиоты толстой кишки в зависимости от преобладания в пищевом рационе одного из макронутриентов (белков, жиров, углеводов) представлено на рис. 4 [58].
Возможность влияния на состав микробиоты и ее метаболическую активность путем изменения характера питания (увеличение доли свежих овощей и фруктов в рационе, применение пищевых волокон, способствующих развитию бутиратпродуцирующей флоры) представляется перспективным направлением современной медицины.
Микробиом у людей пожилого возраста
Микробиом ЖКТ у пожилых людей характеризуется тенденцией к снижению доли бактерий, относящихся к типу Bacteroidetes и роду Bifidobacteria, с одновременным увеличением доли бактерий Firmicutes [59]. Согласно данным нескольких исследований, редукция бактерий видов Bacteroides spp., Prevotella spp., Faecalibacterium prausnitzii наряду с увеличением бактерий семейства Enterobacteriaceae ассоциирована со снижением качества жизни у людей пожилого возраста [59—61]. Считается, что факторами, способствующими изменениям микробиоты кишки в пожилом возрасте, являются прием большого количества медикаментов, изменения гормонального статуса и рациона питания, тяжелые соматические заболевания, пребывание в пансионах для престарелых лиц [62]. Кроме того, неблагоприятные сдвиги состава микробиоты полости рта, происходящие в пожилом возрасте, также оказывают значительное влияние на состояние микробиоты ЖКТ [63].
Функции кишечной микробиоты
Симбиотические отношения между кишечной микробиотой и макроорганизмом включают метаболические, иммунные и нейроэндокринные взаимодействия. Доказано, что микробиота задействована в важнейших процессах жизнедеятельности организма, таких как обмен веществ, развитие, дифференцировка и колонизационная резистентность эпителия, формирование врожденной и адаптивной иммунной систем. Микробиота обеспечивает трофику кишечного эпителия, синтез витаминов, метаболизм пищевых компонентов, холестерина, желчных кислот, регулирует моторику кишечника [4].
Основные функции микробиоты кишечника и связанные с ней ключевые метаболиты представлены в таблице [64].
Многие хронические заболевания, например ожирение, воспалительные заболевания кишки, сахарный диабет, метаболический синдром, атеросклероз, неалкогольная болезнь печени и даже цирроз и гепатоцеллюлярная карцинома, ассоциированы с развитием дисбаланса в составе микробиоты ЖКТ (рис. 5) [64].
ВЗК — воспалительные заболевания кишечника.
Механизмы, в силу которых симбиотические микроорганизмы могут способствовать или, напротив, препятствовать развитию перечисленных заболеваний, включают следующее [1, 4, 12, 64]:
— увеличение энергетической ценности пищи за счет бактериальной ферментации нутриентов, не подвергающихся расщеплению ферментами пищеварительного тракта человека;
— влияние на аппетит;
— метаболизм ксенобиотиков;
— метаболизм желчных кислот;
— синтез витаминов;
— синтез КЦЖК;
— обеспечение колонизационной резистентности слизистой оболочки кишки и синтез антимикробных веществ;
— участие в развитии и созревании местного иммунитета слизистой оболочки пищеварительного тракта и иммунной системы организма-хозяина;
— участие в развитии и созревании нервной системы;
— регуляция метаболизма липидов и гомеостаза глюкозы.
Метаболизм веществ и энергии
Анализ образцов фекалий человека с использованием секвенирования 16S рибосомальной РНК и методов метагеномного секвенирования показал значительное расширение путей метаболизма белков, полисахаридов, аминокислот, ксенобиотиков и микроэлементов за счет ферментов, синтезируемых микробиотой кишечника [12].
Доказано, что кишечная микробиота значительно повышает эффективность расщепления и усвоения пищевых веществ. И если раньше так называемое симбионтное пищеварение, происходящее при содействии микрофлоры, считалось прерогативой жвачных животных, то теперь стало очевидно, что в процессе бактериальной ферментации неперевариваемых углеводов в анаэробных условиях образуются КЦЖК (уксусная, пропионовая и масляная кислоты), являющиеся важнейшими энергетическими субстратами для эпителиальных тканей человека [12].
Известно, что до 70% молекул АТФ колоноциты синтезируют из КЦЖК, преимущественно бутирата. В целом ферментация бактериями непереваренных пищевых волокон способствует более эффективному извлечению энергии (на 10%) из пищи. В норме микробиота кишечника синтезирует около 50—100 ммоль/л КЦЖК в день, которые практически полностью всасываются в кишечнике [12].
Всосавшиеся в кровоток из просвета кишки КЦЖК оказывают многообразное действие на функционирование различных органов и систем макроорганизма. Например, активизируют моторику кишки, являясь субстратами для глюконеогенеза и липогенеза, регулируют липидный и углеводный обмен в печени, активность воспалительных процессов [12].
Метаболизм желчных кислот
Как известно, в организме человека желчные кислоты синтезируются в печени из холестерина, конъюгируются с таурином или глицином (первичные желчные кислоты) и выделяются в двенадцатиперстную кишку, участвуя в эмульгировании и абсорбции жиров. В дальнейшем 95% первичных желчных кислот реабсорбируется в дистальной части подвздошной кишки, в то время как оставшиеся 5% неабсорбированных первичных желчных кислот подвергаются трансформации (деконъюгации) до вторичных желчных кислот (дезоксихолевая кислота и литохолевая кислота) с участием гидролаз кишечных бактерий (преимущественно за счет ферментов Clostridium perfringens и Clostridium scindens). Часть вторичных желчных кислот в последующем вновь реабсорбируется в печень, где происходит их конъюгация. Неабсорбированные желчные кислоты выводятся с калом.
Важно, что первичные и вторичные желчные кислоты способны активировать ядерный фарнезоидный рецептор Х (FXR) в ядре клеток организма-хозяина. Данный рецептор регулирует синтез желчных кислот, метаболизм глюкозы и даже процессы аутофагии печеночных клеток. Кроме того, вторичные желчные кислоты обладают мощным антимикробным действием, ингибируя рост и размножение бактерий.
Взаимодействие микробиоты с иммунной и нервной системами
Кишечный барьер, состоящий из нескольких функциональных компонентов, включающих физические (эпителиальные и слизистые слои), биохимические (ферменты и антимикробные белки) и иммунологические (IgA и эпителиальные иммунные клетки) факторы, служит границей между внешним миром и внутренней средой организма. Повышение проницаемости кишечного барьера для микробных метаболитов и других компонентов, содержащихся в полости кишки, ведет к развитию воспалительных или патологических иммуновоспалительных реакций [64].
Для поддержания кишечного гомеостаза и толерантности иммунной системы к бактериям-симбионтам разграничения патогенов и комменсальных микробов необходимы соблюдение очень тонкого баланса между регуляторными (Т-лимфоциты супрессоры) и эффекторными (Т-лимфоциты хелперы) клетками, гармоничное сочетание «иммунологической толерантности и продуктивного иммунного ответа». Значительную роль в созревании иммунной системы и развитии иммунологической толерантности отводят кишечной микробиоте.
Исследования, проведенные на мышах-гнотобионтах (безмикробные животные, с рождения выращиваемые в стерильных условиях), показали, что у таких животных имеются тяжелые нарушения развития лимфоидной ткани кишки и других иммунокомпетентных органов, а также нарушена продукция антител [65, 66].
Известно, что некоторые условно-патогенные микроорганизмы, такие как Bacteroides fragilis, Bifidobacterium infantis и Firmicutes, способствуют привлечению в стенку кишки регуляторных Т-лимофцитов (Т-супрессоров), продуцирующих противовоспалительные ИЛ, подавляя развитие патологических иммунных реакций. Такое «толерантное» состояние иммунной системы позволяет симбиотическим микроорганизмам мирно существовать, тесно контактируя с эпителиоцитами кишечной стенки, не вызывая иммунной агрессии со стороны организма-хозяина [64].
В то же время из экспериментов на мышах известно, что так называемые нитевидные бактерии, напротив, обладают мощным иммуностимулирующим действием, активируя Т-хелперы 17, индуцируя продукцию ими провоспалительных ИЛ-17 и ИЛ-22, тем самым усиливая антимикробную защиту и резистентность слизистой оболочки кишки к Citrobacter rodentium [67].
Таким образом, правильное взаимодействие Т-супрессоров/Т-хелперов 17, регулируемое в том числе микробными метаболитами, имеет важнейшее значение в поддержании целостности кишечного барьера, иммунологической толерантности, предотвращении развития патологических иммунных реакций, и в то же время препятствует инвазии патогенов.
Конечно, не все представители микробиоты кишки ведут к здоровому и правильному развитию и функционированию кишечного барьера, некоторые из них, напротив, могут вызывать воспалительные процессы, приводить к возникновению злокачественных новообразований. Однако на современном этапе развития учения о микробиоте наше понимание данных процессов еще далеко от совершенства [12].
Интересно, что кишечная микробиота играет немаловажную роль в созревании и нормальном функционировании нервной системы организма-хозяина.
Механизмы влияния микробиоты на функционирование центральной нервной системы (ЦНС) связаны с выработкой молочной кислоты, аммиака, КЦЖК, нейротрансмиттеров. Так, например, в процессе ферментации углеводов некоторыми молочнокислыми бактериями образуется D-лактат, который в случае повышения кишечной проницаемости способен оказывать нейротоксическое действие [4].
Аммиак — нейротоксин, продуцируемый из мочевины под действием бактериальной уреазы. Аммиак обладает прямыми нейротоксическими свойствами, изменяет функцию гематоэнцефалического барьера, тормозит синтез серотонина и допамина [4].
КЦЖК, продуцируемые микробиотой, напротив, оказывают позитивное влияние на функционирование нервной системы, принимая участие в созревании микроглии (резидентных макрофагов) ЦНС. Исследования, проведенные на мышах с дефектом развития рецепторов к КЦЖК, показали нарушение созревания микроглии в ЦНС у таких животных. В то же время колонизация кишечника мышей гнотобионтов нормальной микробиотой приводила к созреванию первоначально незрелой микроглии [68, 69].
Известно также, что некоторые бактерии способны синтезировать гормоны и нейротрансмиттеры, такие как ацетилхолин и гамма-аминомасляную кислоту (ГАМК), норадреналин, серотонин, мелатонин, допамин, глутамин [4]. Серотонин, продуцируемый микробиотой кишечника, участвует в регуляции перистальтики кишки, рвотного рефлекса и восприятии боли через спинальные афферентные нейроны [4]. Выделение серотонина и других биогенных аминов обусловливает влияние микробиоты кишки на настроение, аппетит, пищевые пристрастия человека [4].
ГАМК — антистрессорный медиатор, продуцируется в больших количествах микробиотой кишки, образуя единый пул с эндогенной фракцией ГАМК. Изменение уровня ГАМК у пациентов с синдромом раздраженного кишечника, возможно, объясняет склонность больных к повышенной возбудимости и тревожности, а также пониженный болевой порог у данной группы пациентов по сравнению со здоровыми субъектами.
Колонизационная резистентность
Еще одной важной ролью микробиоты кишечника является формирование колонизационной резистентности, предотвращающей инвазию патогенных микроорганизмов в слизистую оболочку кишки.
Колонизационная резистентность обеспечивается способностью нормальной микрофлоры адгезироваться на эпителии кишечника, которая образует на ней пристеночный слой и тем самым препятствует прикреплению патогенных и условно-патогенных микроорганизмов. Другой механизм создания колонизационной резистентности связан с синтезом микробиотой кишки антимикробных веществ (органических кислот, перекиси водорода и других биологически активных субстанций), а также с конкуренцией с патогенными микроорганизмами за источники питания [4].
Заключение
До последнего времени изучение состава и функциональной активности микробиоты человека было ограничено в связи с невозможностью культивирования подавляющего большинства микроорганизмов на питательных средах. Однако развитие таких технологий, как секвенирование 16S рибосомальной РНК, а также полногеномное секвенирование, позволило значительно расширить понимание роли кишечной микробиоты и ее уникальных метаболитов в регуляции различных физиологических функций макроорганизма, включая обеспечение колонизационной резистентности слизистых оболочек, метаболизм, развитие и гомеостаз иммунной и нервной систем.
Интерес к микробиому человека за последние десятилетия существенно вырос, и все же на современном этапе развития учения о микробиоте понимание данных процессов еще далеко от совершенства, что обусловливает необходимость дальнейших исследований.
Авторы заявляют об отсутствии конфликта интересов.
Относительно недавно в медицинских кругах сложилось утверждение, что человеческим организмом, эмоциями, настроением, здоровьем и поступками правят…бактерии! Место обитания которых — кишечник. Публика мгновенно разделилась на 2 лагеря. Одни утверждают, что бактерии действительно обладают способностью управлять нами, и обосновывают мнение фактами, другие признают это полным антинаучным бредом и, как ни парадоксально, тоже приводят аргументы. Попробуем разобраться и понять, что такое микрофлора, зачем она нужна, как бактерии управляют нами, за что их называют вторым мозгом, и как помочь бактериям сделать управление эффективным.
Что такое микрофлора кишечника
Флора кишечника — это то, что человек получает с момента рождения и развивает на протяжении первых 7-10 лет. Со временем набор микроорганизмов становится разнообразнее и состоит из лактобактерий, бифидобактерий, грибков и кишечных палочек. Все они живут в дружном соседстве не только между собой, но и с патогенной микрофлорой, не позволяя ей размножаться и причинять организму вред.
Считается, что патогенная микрофлора составляет не более 15% от общей массы бактерий. А всего ученые умы насчитывают около 100 триллионов простейших микроорганизмов в нашем кишечнике, вес которых составляет в среднем 1,5 килограмма.
В норме, питанием и образом жизни человек способен длительно поддерживать удачный симбиоз своих поселенцев. Понимание этого процесса поможет значительно повысить качество жизни и здоровья.
За что отвечает микрофлора кишечника
Пищеварение
Одна из важнейших функций кишечных бактерий — участие в процессе переваривания пищи. Это такой гигантский завод по очистке зёрен от плевел. Когда вся поступающая пища, белки, жиры и углеводы расщепляются под воздействием ферментов, работу которых активизирует кишечник. Кишечник — финальная, но самая трудоемкая и времезатратная часть процесса пищеварения. Именно там с помощью микробиома запускается процесс сортировки полезных веществ от ненужного мусора. От того насколько здоров кишечник и весь пищеварительный тракт, зависит и качество сортировки пищи, и количество полезных веществ, которые всасываются и усваиваются именно в кишечнике.
Защита
Один в поле не воин — фраза, которая удачно характеризует работу кишечника. Чем меньше в нём “хороших” бактерий, тем больше места достается “плохим”. Полезные бактерии в процессе жизнедеятельности подавляют рост возбудителей инфекционных заболеваний, поддерживая тем самым защитные функции всего организма.
Иммунитет
Когда защита организма сильна, болезнь не пройдет. И большую роль в этом играет иммунитет, родина которого — кишечник. Как это происходит? Кишечные бактерии стимулируют синтез иммуноглобулинов – особых белков, повышающих защитные силы организма в отношении опасных инфекций. Иммуноглобулины населяют стенки кишечника, при достаточном количестве которых патогенные микроорганизмы не проникают. Также полезные бактерии содействуют созреванию системы фагоцитирующих клеток (неспецифический иммунитет), способных к поглощению и уничтожению патогенных микробов.
Синтез витаминов
Дружественные бактерии, живущие в кишечнике жизненно необходимы человеку для синтеза, хранения и поставки витаминов в организм:
- Витамин В-12
- Фолиевая кислота / Витамин В-9
- Витамин К
- Рибофлавин / Витамин В-2
- Биотин / Витамин В-7
- Никотиновая кислота / Витамин В-3
- Пантотеновая кислота / Витамин В-5
- Пиридоксин / Витамин В-6
- Тиамин / Витамин В-1
Среди них такие, которые нигде больше в организме не вырабатываются. Эта миссия возложена на бактерии. Витамины группы В жизненно необходимы человеку. Они содержат в порядке нервную систему, участвуют в обменных процессах, помогают противостоять стрессам и депрессии. Если нарушена микрофлора, синтез витаминов не происходит должным образом и неприятных последствий не избежать. Кроме того, никакие курсы витаминов не помогут. Вы не ощутите положительный эффект просто потому, что они не будут всасываться в кишечнике.
Как кишечная микрофлора помогает похудеть
Ещё один центр внимания ученых и исследователей — это зависимость веса человека от разнообразия микрофлоры. Так, недавние исследования американских ученых подтвердило этот факт. В ходе эксперимента наборы кишечных бактерий от людей-близнецов поместили в кишечник стерильных мышей. В одном наборе люди-близнецы были худые, в другом страдали ожирением. Микробы, взятые у худых близнецов вызывали похудение у мышей, а бактерии от полных близнецов вызывали у мышей ожирение. Но через время, когда мышей сажали в одну клетку, мыши с ожирением начинали стремительно терять вес.
Ученые сделали предположение, что микрофлора способна управлять пищевыми привычками, требуя от человека тех или иных продуктов, которые будут способствовать росту либо патогенных, либо “худых” бактерий. Лучшим рационом для некоторых бактерий являются жиры и они требуют их постоянно снова и снова, другим жизненно необходим сахар. Именно на зависимости пищевых потребностей и разнообразием бактерий в кишечнике, ученые выдвинули теорию, что кишечные поселенцы, стремятся брать верх над человеком и манипулировать химическим составом среды обитания ради собственных целей и выгоды. Это, в свою очередь, может означать манипуляции нашим поведением (нервничаем, если не едим сладкое, )путем воздействия с помощью нервных импульсов на центры голода, желание съесть тот или иной продукт, к тем или иным продуктам питания, или чувству отвращения от некоторых продуктов.
Почему нарушается баланс микрофлоры
Этот баланс очень хрупок и легко подвержен внешнему влиянию. И происходит это по нескольким причинам:
- прием антибиотиков
- нарушение режима питания
- злоупотребление сахаром и алкоголем
- отравления
- приём некоторых гормональных препаратов
- заболевания пищеварительной системы
- стресс
- приём некоторых лекарств — нестероидных противовоспалительных средств.
Признаки нарушения микрофлоры
- Нарушение стула — запоры, диарея, нерегулярный стул, вздутие, колики, боль
- Нарушения работы ЖКТ — появление тяжести, изжога, отрыжка, увеличение массы тела.
- Обезвоживание — появление ломкости и сухости волос и ногтей, кожных покровов,
- Интоксикация организма — тошнота, болезненный цвет лица, прыщи и угревая сыпь.
- Наличие неприятного запаха при дыхании, неприятный запах фекалий
- Изменения нервной системы — быстрая утомляемость, сонливость, отсутствие настроения, снижение работоспособности.
- Головокружения и головные боли
Как восстановить микрофлору кишечника
Процесс восстановления микрофлоры не быстрый. Важно не только скорректировать режим питания, но и активно помогать организму “наращивать” микробиом — правильно подобрать нужный препарат, содержащий пре- и пробиотики.
Линекс
Пробиолог
Пробифид
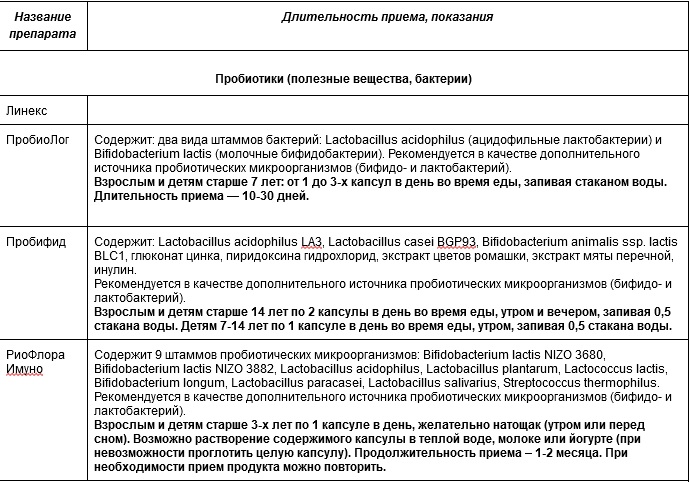


Бонус: могут ли микробы управлять человеческим поведением
Эта гипотеза сейчас становится очень популярной и, действительно, имеет на то ряд прямых и косвенных оснований. Кишечник называют вторым мозгом человека и бактерии, живущие в нем, действительно способны управлять человеком на уровне нервной системы.
В настоящий момент человечеству известно про наш организм многое, но не всё. Исследования в области микрофлоры кишечника и её влиянии на здоровье и качество организма находятся на зачаточной стадии, но привлекает всё больше внимания учёного мира. Так в ходе изучения микробиома человека подтвердилось существование сильной взаимосвязи между состоянием бактерий и работой иммунной, нервной и эндокринной систем. Некоторые ученые полагают, что бактерии могут выделять определенные сигнальные молекулы, влияющие на активность десятичного черепного нерва, проходящего от кишечника к головному мозгу, либо в данном процессе может быть задействован блуждающий нерв.
Сколько времени займет полное познание человека сказать невозможно, но можно быть уверенным, что мы подошли к чрезвычайно важным открытиям, которые, в будущем, решат множество проблем со здоровьем, помогут найти ключ к неизлечимым заболеваниям и тотально изменят привычную жизнь.
Будьте здоровы!
Питание для кишечной микрофлоры
ДИЕТА И КИШЕЧНЫЙ МИКРОБИОМ
ВЫ — ТО, ЧТО ВЫ ЕДИТЕ: ДИЕТА, ЗДОРОВЬЕ И МИКРОБИОТА КИШЕЧИКА
Niv Zmora, Jotham Suez & Eran Elinav.
You are what you eat: diet, health and the gut microbiota.
Nature Reviews Gastroenterology & Hepatology volume 16, pages 35–56 (2019)
СОДЕРЖАНИЕ:
|
|
Резюме. Со времени возрождения микробиомных исследований в последнее десятилетие накопилось много знаний о силах, формирующих архитектуру и функциональность резидентных микроорганизмов в кишечнике человека. Из множества вовлеченных эндогенных и экзогенных факторов, связанных с хозяином, основным детерминантом структуры и функционирования сообщества микробиоты кишечника является питание. Вводя пищевые сигналы в связь между хозяином и его микробиотой, питание поддерживает гомеостаз или способствует восприимчивости к болезням. Здесь мы суммируем основные понятия, связанные с влиянием пищевых компонентов на кишечную микробиоту, выделяя основные принципы в перекрестных помехах между диетой и микробиотой. Затем мы обсуждаем пользу для здоровья и вредные последствия, которые вызывают у хозяина взаимодействия между пищевыми и микробными факторами. Наконец, мы представляем обещания и проблемы, которые возникают при попытке включить данные о микробиомах в планирование диеты, и изображаем ожидаемую революцию, с которой сталкивается область питания после принятия этих новых концепций.
Ключевые моменты:
- Распространенные многофакторные заболевания как в промышленно развитых, так и в развивающихся странах часто связаны с питанием, однако современные подходы к питанию, направленные на их лечение и профилактику, имеют ограниченную эффективность.
- Содержание и количество пищи играют важную роль в формировании состава и функции микробиоты человека.
- Сложные взаимодействия между питательными веществами и микроорганизмами диктуют благоприятные или неблагоприятные результаты для здоровья хозяина.
- Противоречивые отчеты выделяют несколько питательных веществ, метаболитов и микроорганизмов как полезных, так и вредных для здоровья хозяина, что может быть обусловлено методологическими различиями между исследованиями и межиндивидуальными вариациями.
- Персонализированное питание — это новый подход, основанный на данных, который потенциально позволяет использовать диеты, адаптированные к индивидуальным особенностям в различных клинических контекстах.
Вступление
Последнее десятилетие ознаменовалось взрывом исследований, посвященных триллионам аборигенных микроорганизмов, обитающих внутри и по всему организму человека, в совокупности называемых микробиотой, и их взаимодействию с эукариотическим хозяином. Эти ранее игнорировавшиеся прокариотические члены «человеческого голобионта» были признаны обеспечивающими важнейшие функции для физиологии хозяина, включая его метаболизм, иммунитет и нейрональное развитие, в то время как аберрации в их конфигурации или функции, как предполагалось, вносят вклад в состояние болезни. Примечательно, что в отличие от генома хозяина, микробиом проявляет большую пластичность и может легко приспосабливаться к большому разнообразию внешних и внутренних стимулов. Из этих факторов окружающей среды диета является ключевым детерминантом сборки кишечных бактерий и генов, что делает ее потенциально привлекательной мишенью для манипуляций.
Питание человека оказывает глубокое влияние на здоровье как отдельных людей, так и всего населения. Таким образом, исследования в области питания занимают центральное место в медицинской, экономической, культурной и социальной областях. Концепция «пусть пища будет твоим лекарством» была придумана Гиппократом более 2000 лет назад, и организации здравоохранения во всем мире стремятся установить стандарты «здорового питания», которые определяют рекомендуемое потребление микроэлементов, макроэлементов и общее количество калорий. ВОЗ выпустила диетические рекомендации по здоровому управлению весом, однако ожирение и сопутствующие ему заболевания продолжают представлять собой пандемию, причем заболеваемость растет как среди взрослых, так и среди детей3. Хотя многие стратегии снижения веса эффективны в краткосрочной перспективе, большинство сидящих на диете восстанавливают большую часть или весь свой предыдущий вес в течение промежуточного или долгосрочного периода. Кроме того, диетические рекомендации, предназначенные для борьбы с IBD6,7, IBS8, аутоиммунными болезнями9 и раком10,11, часто основаны на неубедительных, противоречивых или несуществующих медицинских данных. Заметный разрыв между большим объемом исследований и отсутствием эффективных или окончательных руководящих принципов является главным источником путаницы и разочарования среди диет, которые привели к возникновению потенциально проблемных тенденций в питании и неподдерживаемых практик.
Очевидная взаимосвязь между диетой и микробиотой и их коллективным воздействием на хозяина, которая только сейчас начинает расшифровываться, может примирить некоторые несоответствия, которые беспокоили исследователей в области питания, и может объяснить некоторые ранее непонятные различия, возникающие в ответ на диету, иногда наблюдаемые в явно сходных условиях. В этом обзоре мы попытаемся распутать некоторые аспекты этой трехсторонней перекрестной связи диета–микробиота–хозяин, обсудив каждый аспект отдельно и, следовательно, попытаться собрать значимые и применимые выводы, которые могли бы иметь прямые трансляционные последствия. Благодаря обширному объему литературы основное внимание в этом обзоре уделяется бактериальному компоненту микробиоты; роль вирома, микома и простейших кратко иллюстрируется (вставка 1 и вставка 2).
Вставка 1. Диета и грибы, вирусы и археи
Увлекательный, но в значительной степени неисследованный аспект взаимодействия диета-микробиом-хозяин связан с его небактериальными членами — вирусами, грибами, археями, простейшими и многоклеточными паразитами — и сложной сетью взаимозависимостей между царствами в кишечной микробиоте. Хотя большинство данных накоплено по домашнему скоту и другим животным271,272, было выявлено несколько связей между долгосрочным и краткосрочным рационом питания и грибами или археями в кишечнике человека273. Коммуникация между этими царствами может происходить через хозяина посредством мальабсорбции, воспаления или кровотечения или через синтрофизм, в результате чего отходы одного микроорганизма питают другой; например, дрожжевой маннан может быть использован бактерией Bacteroides thetaiotaomicron274.
Вироме человека демонстрирует высокую степень внутриличностной стабильности с течением времени275. Мелкомасштабные исследования на людях показали, что отклонения от типичной программы развития вирома могут быть связаны с недоеданием в неонатальной жизни65 и что человеческий Виром может изменяться после изменения содержания в рационе пищевых жиров, сахара и клетчатки276. Другое исследование на мышах показало, что эти изменения более выражены в ассоциированном со слизистой оболочкой вироме, чем в люминальном (просветном) вироме277. Пищевая недостаточность может оказывать избирательное давление на членов вирома, чтобы непосредственно воздействовать на хозяина; например, дефицит селена вызвал эволюцию генома у авирулентного штамма вируса Коксаки (Coxsackievirus), что позволило ему вызвать миокардит у мышей278. Кроме того, диетическая модуляция вирусного репертуара может влиять на хозяина через интеграцию хромосом бактериофагов в бактериальные геномы, тем самым изменяя состав276 и функциональность279,280 бактериальной микробиоты. До сих пор было показано, что этот механизм влияет на бактериальные факторы вирулентности; однако его способность изменять бактериальный метаболизм и его последующее воздействие на хозяина заслуживают дальнейших исследований.
Вставка 2. Диета и паразитарные инфекции

Диета может помочь в сдерживании паразитарных инфекций281,282 или в модуляции их тяжести. Например, сочетание элементарной диеты и заражения нематодой Nippostrongylus brasiliensis или простейшими Giardia muris, но не каждой из них в отдельности, приводило к неблагоприятным клиническим исходам и увеличению гистологических изменений слизистой оболочки кишечника мышей283, а высокобелковая диета улучшала течение нематодной инфекции у жвачных животных284. Пищевые компоненты были предложены для того, чтобы вызвать иммунные и метаболические транскрипционные реакции хозяина, такие как циннамальдегид и заражение тощей кишки аскаридами (Ascaris suum) у свиней285. Однако более интригующая связь между простейшими или многоклеточными эукариотами и хозяином опосредуется бактериальной микробиотой. Эта ассоциация была зарегистрирована задолго до того, как поле микробиома вступило в геномную революцию и охватывает различных членов паразитома, включая простейших, таких как Entamoeba286 и Blastocystis287, и червей, таких как Schistosoma288,289 и гельминтов290,291,292. Это двунаправленное взаимодействие выходит за пределы желудочно-кишечного тракта, поскольку паразиты, обитающие в желчном дереве, как было показано, вызывают кишечный бактериальный дисбиоз293; и наоборот, кишечная бактериальная сборка была связана с защитой от приобретения малярийной инфекции294, возможно, вызывая защитный иммунный ответ посредством молекулярной мимикрии295. Точно так же кишечная микробиота может придавать мышам устойчивость или восприимчивость к малярийной инфекции, и этот фенотип может быть передан мышам GF путем трансплантации фекальной микробиоты или пробиотической обработки Лактобациллами и Бифидобактериями spp.296. Предварительные попытки использовать это перекрестное воздействие паразиты-бактерии на благо хозяина уже были предложены; например, добавление пребиотического инулина у недоедающих мышей с лямблиозом вызвало изменения микробиоты, увеличило выработку антител против простейших и ослабило фенотип болезни297.
Данные свидетельствуют о том, что гельминтозные инфекции могут приводить к изменению бактериального состава и функциональных сдвигов кишечника, особенно в желудочно-кишечном очаге инфекции298, и, следовательно, модулировать метаболизм питательных веществ, таких как углеводы, аминокислоты и витамин D299,300. Кроме того, через дисбактериоз паразиты могут ослаблять воспалительные реакции в организме хозяина. Действительно, заражение мышей гельминтом Heligmosomoides polygyrus bakeri опосредовало иммуномодулирующий эффект путем изменения микробиома и увеличения продукции короткоцепочечных жирных кислот (SCFAs). Перенос вышеупомянутой сборки бактериального микробиома в обработанных антибиотиками или GF-мышей защищал их от аллергической астмы303. Эти результаты требуют дополнительных исследований, чтобы выяснить, можно ли использовать межклеточные иммуномодулирующие взаимодействия для модуляции других системных воспалительных реакций, таких как метаболический синдром. Это новое направление исследований исключительно интересно в свете обратных ассоциаций, которые были обнаружены между инфекцией шистосомы (Schistosoma) и диабетом в китайской популяции304 и лимфатическим филяриозом (lymphatic filariasis) и диабетом в индийской популяции305.
Диетическая модуляция микробиоты
Вклад диеты в модуляцию микробиоты и ее решающая роль в организации перекрестных помех между микробиотой–хозяином очевидны с самого начала жизни, когда олигосахариды человеческого молока (НМО) участвуют в созревании микробиоты в раннем младенчестве12, за которым следует увеличение бактериального богатства, связанное с введением твердых пищевых продуктов13, и завершается снижением богатства, наблюдаемого у слабых стареющих групп населения при длительном уходе, вероятно, из-за уменьшения разнообразия продуктов питания14. Представители кишечной микробиоты не только чувствительны к пропорциям определенных компонентов рациона, но и по-разному реагируют на питание во множестве временных и географических контекстов. В этом разделе мы попытаемся описать ключевые понятия, с помощью которых диетические факторы влияют на структуру сообщества и функции кишечных бактерий в состояниях гомеостаза и пищевого дисбаланса.
Микробиомные ответы на продукты
Прямые механизмы
Питательные вещества могут напрямую взаимодействовать с микроорганизмами, чтобы стимулировать или ингибировать их рост, а способность извлекать энергию из определенных пищевых компонентов дает прямое конкурентное преимущество отдельным членам кишечного микробного сообщества, делая их более способными к размножению за счет менее опытных членов. Этот аспект отражен в наблюдении, что диета влияет не только на относительную и абсолютную численность кишечных бактерий, но и на их кинетику роста16. Центральными питательными веществами в этом механизме являются неперевариваемые углеводы, называемые гликанами, которые в основном получают из растительных, а также животных, грибковых и водорослевых источников17.
Геном человека кодирует ограниченное количество гликозидгидролаз и не содержит полисахаридных лиаз (вместе именуемых углеводно-активными ферментами или CAZymes)17. Таким образом, гликаны, такие как устойчивый крахмал, инулин, лигнин, пектин, целлюлоза и фруктоолигосахариды (FOS), достигают толстой кишки в их непереваренных формах. В отличие от человека, микробиом, по оценкам, кодирует десятки тысяч CAZymes17. Бактерии, которые могут разрушать гликаны, называются первичными деградаторами, включая представителей родов Bacteroides, Bifidobacterium и Ruminococcus. Их конкурентное преимущество отражается в способности прогнозировать численность бактерий в соответствии с характером деградации гликанов18. В Bacteroides генетический репертуар CAZyme является прогностическим фактором индуцированной гликаном видоспецифической конкурентоспособности, которая играет важную роль в установлении in vivo приспособленности представителей этого рода19,20. Во время нехватки пищи бактерии могут переключаться между источниками энергии, используя сенсорные и регуляторные механизмы, контролирующие экспрессию генов. Поэтому предпочтение отдается таксонам, которые могут легко приспосабливаться к изменяющимся источникам энергии, таким как представители типа Bacteroidetes, которые обладают довольно большим количеством генов, кодирующих CAZymes21,22,23. Первичная деградация гликанов высвобождает глюкозу и, в сочетании с ферментацией вторичными деградаторами, приводит к образованию ацетата, пропионата, формиата, бутирата, лактата и сукцината и инициирует сложную перекрестную метаболическую сеть. Например, ферментация часто приводит к образованию газообразного водорода, который потребляется в кишечнике человека сульфатвосстанавливающими бактериями, метаногенами и ацетогенами24. Существует большой интерес к моделированию этих взаимодействий между кормлениями, которые могут позволить прогнозировать структуру сообщества на основе диетических вариаций25,26. В дополнение к прямому взаимодействию, которое способствует росту адептовых бактерий, питательные вещества также могут ингибировать рост бактерий. Питательные вещества растений, такие как хиноны, флавоноиды, терпеноиды и алкалоиды, обладают антимикробной активностью in vitro27. Другие, такие как растительный антимикробный берберин28, связаны с элиминацией in vivo некоторых бактериальных таксонов и уменьшением кишечной микробиоты. Однако в последнем случае трудно приписать прямое торможение.
Косвенные эффекты
Полученные из рациона антигены и соединения могут косвенно формировать кишечную микробиоту, воздействуя на метаболизм хозяина и его иммунную систему. Например, активность арилуглеводородного рецептора (AhR) важна для поддержания интраэпителиальных лимфоцитов в кишечнике, а при его отсутствии наблюдается увеличение бактериальной нагрузки, приписываемой членам типа Bacteroidetes29. Полученные из индола и триптофана AhR-лиганды могут быть получены из рациона (например, из овощей семейства крестоцветных, например, капусты)29. Кроме того, острый дефицит витамина А приводит к расцвету Bacteroides vulgatus у мышей из-за ингибирующего воздействия ретинола на бактерию, которое может быть прямым или потенциально опосредованным снижением содержания желчных кислот (таких как дезоксихолевая кислота), которые подавляют ее рост в мышах с недостаточным питанием30. Витамин D необходим для иммунной защиты слизистой оболочки кишечника от патогенных микроорганизмов и поддержания полезных свойств комменсалов, поскольку мыши с дефицитом витамина D проявляют: сниженную экспрессию дефенсинов клеток Панета, генов плотного соединения и муцина 2 (MUC2)31; снижение эпителиального кадгерина (Е-кадгерина) на кишечном эпителии и иммунных клетках; и уменьшение доли толерогенных дендритных клеток и увеличение αβ-клеток рецептора T-клеток (TCR) в собственной пластинке слизистой оболочки32. Кроме того, потребление витамина D у людей было связано со снижением уровня циркулирующего липополисахарида (LPS; компонента грамотрицательной бактериальной клеточной стенки), уменьшением количества копрококков и бифидобактерий и повышением содержания Prevotella33. Кроме того, мыши, имеющие сбалансированное соотношение омега-6: омега-3 полиненасыщенных жирных кислот (ПНЖК) в тканях, показали повышенную продукцию и секрецию кишечной щелочной фосфатазы, которая подавляет продуцирующие LPS члены микробиома, такие как протеобактерии34. Регуляторные T (Treg) клетки играют важную роль в поддержании гомеостаза в кишечнике, с недостатками, ведущими к воспалению кишечника и болезням, а также к дисбиозу35. Бактериальная ферментация пищевых волокон приводит к образованию короткоцепочечных жирных кислот (SCFAs), которые играют важную роль в поддержании гомеостаза Treg-клеток36. Желчные кислоты могут также косвенно ингибировать рост бактерий через ядерный фарнезоид Х рецептор (FXR; также известный как NR1H4)37.
Пищевые компоненты могут также нарушать защитные функции кишечного барьера таким образом, что они могут влиять на взаимодействие хозяина и микробиома и вызывать дисбактериоз, способствуя воспалительным процессам и оказывая влияние на организм хозяина в дальнейшем. Например, использование выбранных эмульгаторов в обработанных пищевых продуктах может разрушать защитный эпителиальный слой слизистой оболочки хозяина и приводить к дисбиоз-опосредованному низкодифференцированному воспалению и развитию метаболического синдрома в экспериментальных моделях. Кроме того, диеты, богатые жирами39, западноевропейские диеты40 или диеты с низким содержанием фибринов41, также были предложены для нарушения барьерной функции у мышей, которая может быть улучшена добавлением клетчатки40,42; эти диеты будут дополнительно рассмотрены позже.
Пассивная передача
Некоторые представители микробиоты, в том числе бактерии, продуцирующие молочную кислоту, грибы Candida и Penicillium, а также вирусы растений43, могут передаваться через пищу и, следовательно, пассивно переноситься и внедряться в микробную экосистему кишечника с помощью диеты. Было высказано предположение, что колонизация пищевой микробиоты кишечника зависела от ранее существовавшего состава микробиоты, как у крыс, так и у человека, поскольку некоторые бактериальные сообщества были более «разрешительными» для колонизации аллохтонными бактериями, тогда как другие были более «устойчивыми»44, хотя требуется дополнительная работа для обобщения микробных факторов, которые опосредуют вседозволенность и устойчивость.
Диетическое содержание как модулятор
Основным аспектом влияния диеты на микробиоту является ее содержание, а именно: макроэлементы и микроэлементы, которые составляют потребляемую пищу. Этот аспект питания был широко исследован, так как считается, что поразительный всплеск метаболических заболеваний и других последствий в модернизированных обществах можно объяснить изменением тенденций в питании в прошлом столетии2.
Различия в микробиомах популяций, потребляющих несопоставимые диеты, могут быть четко определены на основании исследований, проведенных в современной городской и аграрной когортах, а также у травоядных и плотоядных индивидуумов. Различные линии млекопитающих развивались вместе с их микробиомными сообществами, которые различают их по своим диетическим предпочтениям, а не по филогении хозяина: бактериальные сообщества уменьшаются в разнообразии от травоядных до всеядных и плотоядных особей и содержат типичные микробные конфигурации 45,46. Микробиом кишечника охотников-собирателей, а также загородного и сельскохозяйственного населения во всем мире показал повышенное бактериальное богатство по сравнению с таковым в модернизированных обществах, предполагая, что первые требуют большего функционального репертуара, чтобы максимизировать потребление энергии из пищевых волокон, чем вторые, которые потребляют в основном переработанную пищу, хотя такая причинность должна быть формально подтверждена47,48,49,50,51,52,53. Однако микробиом, полученный из неиндустриальных сельскохозяйственных популяций, как правило, был однородным по составу, в то время как микробиом, полученный из городских популяций, был более разнообразным52, что можно объяснить увеличением рассеивания фекального материала в сельском населении или большим разнообразием продуктов питания в меню городского населения.
Микробиота очень пластична и реагирует на некоторые, но не на все диетические вмешательства. У людей потребление рациона, состоящего исключительно из продуктов животного происхождения, вызывает обогащение желчно-толерантных бактерий (Alistipes, Bilophila и Bacteroides) и истощение у Firmicutes, которые метаболизируют растительные полисахариды (Roseburia, Eubacterium rectale и Ruminococcus bromii)43. Метагеномный и метаболомный анализы подтвердили наблюдаемый компромисс между ферментацией и деградацией белка в богатых белком рационах на животной основе, в отличие от ферментации углеводов и биосинтеза аминокислот в рационах на растительной основе43,46. Кроме того, сообщается, что богатство генов микробиома положительно коррелирует с потреблением фруктов, овощей и рыбы людьми с избыточным весом или ожирением54. У мышей диета с высоким содержанием жиров (HFD) или потребление «западного» рациона с высоким содержанием жиров и высоким содержанием сахара (HFHSD) была связана со снижением уровней Bacteroidetes и увеличением Firmicutes и Proteobacteria в зависимости от дозы, независимо от изученного генотипа55,56,57. Изменение состава сопровождалось функциональными изменениями, так как диета HFHSD вызывала увеличение метаболизма сахарозы, метаболизма мочевины, мембранных транспортных систем, метаболизма кофакторов и витаминов, а также сворачивания, сортировки и деградации белков58,59. И наоборот, менее радикальные и кратковременные диетические вмешательства не смогли вызвать серьезных изменений в микробиоме, что противоречит распространенным представлениям. Например, только незначительные различия наблюдались в составе бактерий кишечника человека после кратковременного (два 1-недельных интервенционных периода; n = 20) употребления промышленного белого хлеба по сравнению с кустарным кисло-тестовым хлебом60. Более крупные когорты, подвергающиеся этому вмешательству в течение более длительных периодов времени, заслуживают исключения более тонких или хронических микробных эффектов. Точно так же 6-12 г клетчатки подорожника (волокна псиллиума) не изменяли микробиоту кишечника у детей с СРК (6-недельные интервенции; n = 33)61, фруктаны не вызывали изменений в составе микробиома у мышей дикого типа62, а диета с высоким содержанием холестерина не вызывала дисбактериоз у мышей с дефицитом рецепторов ЛПНП63. Эти результаты важны для лучшего понимания истинного и разнообразного влияния компонентов питания на микробиоту61.
Отсутствие питательных веществ оказывает глубокое влияние на микробиоту и хозяина. Исследование населения в развивающихся странах показало, что недоедание часто является «двойным процессом», который требует как нарушенного микробиома, так и неадекватной диеты64. Задержка роста в педиатрической популяции в Малави была связана со снижением уровня HMO в материнском грудном молоке. Когда фекалии от младенцев с задержкой роста трансплантировали мышам, лишенным микробов (GF), которых кормили малавийской диетой, нарушения роста были воспроизведены в различных органах. Пищевая добавка с сиалированными олигосахаридами коровьего молока спасла фенотип, ограниченный ростом, у мышей и поросят12. Точно так же малавийские пары близнецов, диссонирующие по отношению к квашиоркору, содержали различные консорциумы микробиом64 (включая virome65), и их трансплантация мышам GF, которых кормили малавийской диетой, приводила к большей потере веса в группе, получавшей микробиом «квашиоркор», чем в группе, получавшей микробиомы от здоровых братьев и сестер. Введение мышам терапевтической пищи, состоящей из арахисовой пасты, сахара, растительного масла и молока, обогащенного витаминами и минералами, ослабило этот фенотип и изменило сборку микробиоты фекалий, хотя она все еще отличалась от здоровой конфигурации64. С помощью алгоритма машинного обучения можно было бы предсказать тяжелое острое недоедание у бангладешских детей, рассчитав степень незрелости микробиоты или отклонение от здорового состава микробиоты,и этот же показатель можно было бы использовать для оценки эффективности диетического вмешательства. Кроме того, было высказано предположение, что идиопатическая сущность «экологической энтеропатии» (или тропической спру), которая распространена в развивающихся странах, также является результатом дисбиоза, происходящего в восприимчивом хозяине67. Кроме того, сообщалось также о влиянии на микробиом специфического дефицита питательных веществ (обсуждается позже).
С другой стороны, население развитых стран, как правило, потребляет продукты питания с низким содержанием клетчатки. Низкое потребление клетчатки мышами индуцировало увеличение Firmicutes и снижение Bacteroidetes15. Аналогичным образом, у людей микробиота, полученная от африканских детей, потреблявших большое количество растительных полисахаридов, демонстрировала низкое содержание Firmicutes и высокое содержание Bacteroidetes, преимущественно Prevotella, по сравнению с итальянскими детьми, чей рацион питания характеризовался нехваткой пищевых волокон и которые содержали повышенные уровни Enterobacteriaceae, преимущественно Shigella и Escherichia47. Кроме того, мыши с гнотобиотиками, которым трансплантировали синтетическую микробиоту, которая включала 14 комменсалов человека, показали, что переключение с рациона, богатого клетчаткой, на диету, не содержащую волокон, приводило к поразительным изменениям в составе микробного кишечника41. В отсутствие пищевых волокон бактерии, разлагающие слизь (Akkermansia muciniphila и Bacteroides caccae), увеличивались в избытке за счет видов, разлагающих волокна (Bacteroides ovatus и Eubacterium rectale). Эти таксономические изменения соответствовали транскрипционным изменениям, так как при дефиците пищевых волокон бактерии, разлагающие муцин, проявляли повышенную экспрессию разлагающих муцин CAZymes41. Кроме того, как упоминалось ранее, отсутствие клетчатки в рационе может избирательно адаптировать транскрипционные реакции некоторых представителей кишечной микробиоты, таких как Bacteroides thetaiotaomicron, для кормления слизи хозяина гликанами23, тем самым распространяя последствия этого дефицита питательных веществ от микробиоты к хозяину.
Количество пищи как микробный модулятор
Количество потребляемой пищи может повлиять на микробиоту кишечника. Ограничение калорий — режим питания, основанный на сниженном потреблении пищи при отсутствии недоедания, — может вызвать изменения в составе микробиоты, а также в метаболических профилях сыворотки и мочи у мышей, как на HFD, так и на рационе с низким содержанием жира68,69. У людей кратковременное ограничение углеводов (24–164 г в день в течение 4 недель) приводило к уменьшению количества бактерий, продуцирующих бутират, и, следовательно, к снижению потребления бутирата70, а режим ограничения потребления калорий (снижение потребления энергии на 10-40% в течение 10 недель) приводил к изменению состава микробиома, включая уменьшение количества Blautia coccoides и увеличения Bacteroides71. Более длительное 1-летнее вмешательство привело к увеличению количества фекальных Bacteroidetes и уменьшению относительной численности актинобактерий, которые первоначально не были заметны в ранние сроки72. Хотя это и не выяснено в полной мере, вполне вероятно, что эти конкретные изменения модулируют многочисленные эффекты, способствующие укреплению здоровья и продлению жизни, связанные с ограничением калорийности рациона питания73. В качестве одного примера, количество фекальных A. muciniphila коррелировало с улучшенными метаболическими результатами при ограничении калорий у людей с избыточным весом или ожирением74. Поскольку ограничение количества питательных веществ в рационе и, в частности, потребление энергии, является популярной стратегией снижения веса, принимая во внимание микробные особенности, такие как богатство генов54,75 или «подпись микробиома после ожирения»76, она может дополнять текущий набор инструментов питания, чтобы лучше бороться с эпидемией ожирения.
Временные эффекты диеты
Временные эффекты диеты на состав и функции микробиома могут проявляться в различных временных масштабах, начиная от диеты, вызывающей суточные колебания микробиома, и заканчивая связанными с питанием эффектами, наблюдаемыми в течение нескольких дней после воздействия, и хроническими изменениями, отмечаемыми после более длительных периодов воздействия (рис. 1). При самом высоком разрешении суточные циркадные ритмы циклов сон–бодрствование и кормление–голодание хозяина сопровождаются выраженными композиционными и функциональными изменениями микробиома кишечника, причем абсолютные колебания численности наблюдаются у представителей трех основных типов: Bacteroidetes, Firmicutes и Proteobacteria, а также в уровнях бактериальных метаболитов в стуле и циркуляции77,78,79,80,81. Суточная ритмичность микробиома диктуется транскрипционными колебаниями хозяина и временем кормления как у мышей, так и у людей77, 81. Серия экспериментов на мышах, ночных животных, которые обычно питаются в ночные часы, показала, что ограниченное по времени кормление в светлую фазу вызывает фазовый сдвиг ~12 ч. в ритмах микробиоты. И наоборот, мутации, вызываемые нокаутом циркадных часов, и ожирение, вызванное диетой, ослабляли эти циркадные ритмы микробов, которые были частично исправлены введением ограниченного по времени питания.

Рис. 1. Временная диетическая модуляция кишечной микробиоты.
Диета влияет на структуру и функцию бактерий кишечника на протяжении всей жизни человека. Изменения микробиоты отражают адаптацию к пищевым сдвигам в различных временных рамках: суточные колебания соответствуют циклам «сон–бодрствование» и «питание–голодание»; значительные изменения в составе и количествах пищи (в данном случае низкокалорийная, высокожирная или высокобелковая диета) вызывают переходные сдвиги в микробиоте, которые сохраняются дольше, чем продолжительность диетического возмущения; а длительные диетические практики ведут к безболезненным («ленивым») изменениям в кишечной микробиоте. Синяя линия указывает на степень сходства конфигурации микробиоты в определенный момент времени с произвольной гомеостатической конфигурацией в зрелом возрасте (β-разнообразие). Красная линия указывает на микробное богатство фекалий (α-разнообразие). Цвета фона указывают типичное содержание таксонов на каждом этапе. Обратите внимание, что из-за высокой вариабельности в сборке микробиоты среди людей и расхождений между исследованиями эти образцы микробиоты носят только концептуальный характер и не имеют целью обеспечить точное представление на персонализированном уровне.
Некоторые изменения в питании могут изменить состав и функции микробиоты кишечника в течение нескольких дней, хотя точные временные рамки могут быть индивидуальными, например, в случае добавления пищевых волокон: у некоторых людей изменения микробиома наблюдались уже через 1 день82, 2 дня83 или 3-4 дня84,85 после приема добавок, тогда как у других не было отмечено никаких эффектов через 3 дня84, 1 неделю60, 3 недели85 или даже через 12 недель86 после такого потребления. Точно так же David et al. сообщили об отсутствии статистически значимых изменений состава после того, как участники перешли на богатую клетчаткой диету на основе растений в течение 5 дней. Напротив, переход на диету на основе животных быстро изменил состав и функцию микробиома, что было обратимо при прекращении и могло быть связано с очень низким потреблением клетчатки или повышенным потреблением диетического жира и животного белка. Это наблюдение также было воспроизведено на мышах, колонизированных микробиотой человека, которая показала сдвиги в составе микробиоты, метаболических путях и экспрессии генов только через 1 день после перехода с растительной диеты на основе полисахаридов на HFHSD15. Интересно, что хотя некоторые изменения у мышей обратимы при смене рациона питания, другие функции таксонов и микробов были более устойчивыми58, тем самым, играя роль в усиленном восстановлении веса после повторяющихся циклов потери веса и увеличения веса, вызванного диетой76. Ограниченные по энергии диеты для похудения могут влиять на состав микробиома в течение времени от нескольких дней до нескольких недель после инициации, в зависимости от богатства генов микробиома человека. Важно отметить, что при отсутствии пищевых возмущений состав микробиоты человека считается стабильным88,89,90. Сельская община Хадза в Танзании характеризуется сезонными и циклическими сдвигами в составе микробиома, отражающими различия в доступности питательных веществ и структуре питания в сухой и влажный сезоны50. Микробиомы людей, живущих в промышленно развитых обществах, не демонстрируют таких вариаций и, что интересно, они имеют очень низкую представленность таксонов, которые колеблются в микробиоме Хадза50.
Долгосрочные изменения в конфигурации микробиома отмечены в отношении развития и старения и могут развиваться в течение многих лет14,91. Резкие сдвиги в питании в период младенчества приводят к соответствующей структурной и функциональной адаптации к кишечным бактериям младенцев, так как новорожденный микробиом содержит пути поглощения и утилизации лактозы, галактозы и сахарозы, тогда как пути ферментации углеводов и биосинтеза витаминов, характерные для взрослого микробиома, появляются только при введении твердой пищи к концу первого года жизни. Позднее микробиомные изменения в значительной степени обусловлены и играют причинную роль в связанных с возрастом системных воспалительных процессах у старых (18–22 месяцев) мышей94, включая повышенные уровни циркулирующих провоспалительных цитокинов и дисфункцию макрофагов. Эти изменения в значительной степени модифицируются диетой; следовательно, микробиота у пожилых людей демонстрирует большую степень индивидуальной изменчивости и может служить маркером слабости14,95. Интересно, что диетические режимы также могут иметь межпоколенческие последствия, поскольку недостаток пищевых волокон снижает бактериальное разнообразие кишечника у мышей, которое может быть восстановлено в течение одного поколения, тогда как недостаток пищевых волокон в течение нескольких поколений привел к постоянному снижению бактериального богатства, в результате чего некоторые микробные таксоны необратимо исчезли96. Подобный межпоколенческий дисбиоз наблюдался также у приматов97 и mice98,99,100, потреблявших HFD (далее обсуждается ниже).
Комплексные диетические взаимодействия
Диета неотделима от множества хозяев и условий окружающей среды, в которых она потребляется. Таким образом, часто бывает трудно отделить физиологические эффекты, вызванные измененной диетой микробиотой, от тех, которые непосредственно вызваны диетой, и от тех, в которых изменения микробиоты являются просто случайным или вторичным эффектом. В отличие от экспериментов на животных in vivo, которые проводятся в генетически сходных условиях и включают нормализацию рациона в хорошо контролируемой среде, люди значительно различаются по своему генетическому составу, подвергаются воздействию многочисленных экзогенных факторов, и их рационы часто состоят из большого разнообразия питательных веществ. Это множество переменных может иметь синергетические или противоположные результаты в отношении кишечной микробиоты, что затрудняет прогнозирование суммарного воздействия диетических вмешательств на кишечную микробиоту и ее последующее воздействие на человека-хозяина.
Было обнаружено, что некоторые питательные микроэлементы или их дефицит вызывают различные структурные изменения микробиоты у людей, мышей, крыс и поросят. Примечательными примерами являются железо101,102,103,104, магний105, цинк106,107, селен108, нитрит или нитрат109, витамин А30, витамин D31,32,110 и флавоноиды111,112. Другие соединения проявили свойства, противодействующие свойствам современных диет, и стали потенциальными кандидатами для профилактики, диагностики и лечения вызванного диетой ожирения и метаболического синдрома. Например, экстракт клюквы увеличивал количество A. muciniphila у мышей, потребляющих HFHSD, и улучшал фенотип метаболического синдрома113.
Предполагается, что географические различия маскируют или модулируют пищевые влияния. Одно исследование показало, что вышеупомянутая изменчивость между травоядными и плотоядными обусловлена не диетой, а глобальным влиянием окружающей среды, поскольку у здоровых веганов и всеядных индивидуумов, отобранных в городской среде в США, не было отмечено заметных различий в конфигурации их микробиоты и метаболома хозяина114. Напротив, рацион афроамериканцев характеризуется высоким содержанием животных жиров и белков и низким содержанием клетчатки по сравнению с южноафриканцами и связан с повышенным риском развития рака толстой кишки. Выполнение диетического переключения между этими географически различными группами индуцировало сдвиги в составе микробиома, секретируемых метаболитах и пролиферативных и воспалительных маркерах115. В соответствии с этим наблюдением, отсутствие различий между веганами и всеядными в США может быть связано с тем, что эти самооценочные категории являются слишком общими и недостаточно информативными по содержанию рациона; Анализ образцов в Американском проекте кишечника (American Gut Project), опубликованном в 2018 году, показал, что разнообразие растений, потребляемых в рационе, обеспечивает лучшее разделение микробиомов, чем редуцирующие диеты, такие как веганство116.
Тем не менее, в географическом контексте по-прежнему важно учитывать, что рекомендации по питанию, полезные для современного населения, иногда могут быть вредными для развивающихся стран. Ярким примером такого несоответствия являются добавки железа и фолиевой кислоты, которые привели к увеличению смертности от малярии и других инфекций среди детей, проживающих в Занзибаре117, предположительно вследствие обогащения кишечными патогенами, такими как Escherichia, Shigella и Clostridium, а также к усилению воспаления118.
Мета-сообщество, в котором обитает хозяин, может влиять на его микробиом, особенно у совместно обитающих грызунов, практикующих копрофагию, но также и в сожительстве приматов119 и людей120, что вызывает горизонтальную бактериальную дисперсию среди членов сообщества121. Кроме того, бактериальная среда потребляемой диеты также может играть роль в формировании микробиоты кишечника, поскольку бактерии, находящиеся в одной и той же среде, могут динамически развиваться посредством межвидовых генетических перестроек, дупликаций генов и латеральных переносов генов122. Эти генетические модификации расширяют метаболические возможности кишечника и обогащают репертуар перевариваемых субстратов123. Например, потребление морских водорослей японским населением способствует переносу генов из морских микроорганизмов в микробиом кишечника, позволяя последнему переваривать виды водорослей124, что может быть использовано для модуляции ниши на основе диеты для приживления полезных бактерий125. Кроме того, предварительные данные указывают на заслуживающие внимания взаимодействия между рационом и виромом хозяина, микомом, простейшими и другими эукариотами, добавляя дополнительный аспект к взаимодействию диета-микробиом-хозяин (вставки 1 и 2).
Наконец, генетический состав хозяина может влиять на пищеварение. Например, популяции людей, потребляющих богатые крахмалом продукты питания, обладают более высоким числом копий гена амилазы слюнных желез, чем популяции, потребляющие низкокрахмальные продукты питания. Кроме того, мыши, имеющие мутации в сигнальных путях трансдукции или стероидогенезе, проявляют дисбактериоз и последующие метаболические последствия, влияющие на ожирение, воспаление жировой ткани и инсулинорезистентность127,128. Однако, согласно данным исследований близнецов, истинная степень генетического вклада в структуру микробиома у человека кажется незначительной129, и диета, по-видимому, доминирует над генотипом у множества инбредных и аутбредных мышей58,130. У людей диета не только доминирует над генетикой во влиянии на состав микробиома, но и превосходит ее в предсказании множества признаков хозяина, таких как уровень глюкозы в крови и показатели ожирения131.
Диета-микробиотное взаимодействие и здоровье
Модуляция состава и функции кишечной микробиоты с помощью диеты может привести к полезным или вредным последствиям для здоровья хозяина. Это может быть связано с иммуномодулирующим действием модифицированной микробиоты, последующим воздействием на экспрессию генов хозяина или изменениями в ландшафте продуцируемых микробиотой метаболитов, которые могут действовать локально в кишечнике или системно в других органах. Важно отметить, что опосредованное микробиотой воздействие диеты на здоровье не обязательно требует изменения конфигурации глобального сообщества, но может привести к тому, что пищевые ресурсы будут дифференцированно взаимодействовать с различными микробными популяциями (например, отдельные сообщества микробиоты могут играть определенную роль в исходе терапевтического диетического вмешательства в отношении недостаточного питания64). Здесь мы обсуждаем, как основные пищевые компоненты взаимодействуют с микробиотой, чтобы повлиять на здоровье хозяина через множество механизмов.
Пищевое волокно
Ферментация пищевых волокон является одной из доминирующих функций микробиоты слепой кишки и толстой кишки и основным источником SCFAs, которые являются конечными продуктами ферментации (рис. 2). SCFAs служат в качестве сигнальных молекул, либо ингибируя деацетилазы гистонов (HDAC), либо действуя в качестве лигандов для нескольких рецепторов, связанных с G-белком (GPR; включая GPR41 (также известный как FFAR3), GPR43 (также известный как FFAR2) и GPR109A (также известный как как HCAR2)) и пероксисомный пролифератор-активированный рецептор гамма (PPARy)132,133. Дополнение HFD у мышей бутиратом предотвращало вызванное диетой ожирение и резистентность к инсулину и увеличивало расход энергии134,135. У людей, получавших пропионат, увеличение массы тела было предотвращено у лиц с избыточной массой тела (24-недельное добавление 10 г инулин-пропионатного эфира в день; n = 60)136, а толерантность к глюкозе была улучшена у здоровых женщин (7-недельное добавление 7,5 г в день пропионата натрия; n = 10)137. Инфузии в толстой кишке ацетатом, пропионатом или бутиратом в уровнях, соответствующих уровням, полученным при потреблении клетчатки, улучшают энергетический обмен у мужчин с избыточным весом или ожирением (два ректальных введения 40 ммоль ацетата, пропионата или бутирата повторяются четыре раза; n = 12)138. De Vadder и соавт.139 предложили механистическую связь, в которой бутират и пропионат, полученные из микробиомного брожения клетчатки, стимулировали экспрессию генов, связанных с кишечным глюконеогенезом, посредством цАМФ-зависимой активации или через FFAR3-зависимую нейронную цепь кишечник–мозг. Frost et al. также сообщили о полезной роли ацетата, полученного из волокон, опосредованного центральным механизмом, регулирующим аппетит, так как мыши, которых кормят HFD, и которые получают ферментируемое волокно, были более худыми, потребляли меньше пищи и выражали профиль экспрессии аноректического нейропептида в гипоталамусе140. Путем введения меченых углеводов они показали, что ацетат толстой кишки накапливается в гипоталамусе и подтверждают изменения в активации нейронов гипоталамуса путем функциональной визуализации мозга после внутривенной инфузии ацетата140.
Рис. 2. Микробиота-диетическое взаимодействие при метаболическом синдроме.
Общие пищевые компоненты метаболизируются кишечной микробиотой с образованием метаболитов (например, диетического холина и триметиламина (ТМА)), которые модулируют метаболизм хозяина (например, при атеросклерозе). Параллельно диета изменяет состав микробиоты и, следовательно, ландшафт ассоциированных с микробами продуктов, некоторые из которых связаны с благоприятным или вредным воздействием на хозяина (например, жиры, липополисахариды (LPS) и эндотоксемия). Некоторые из взаимодействий локализуются в кишечнике (например, клетчатка, короткоцепочечные жирные кислоты (SCFAs) и кишечный глюконеогенез), в то время как другие оказывают системный эффект (например, жир, ацетат и инсулинорезистентность (IR)). Оранжевые линии указывают на взаимодействие, способствующее развитию метаболического синдрома (MetS), а зеленые линии указывают на взаимодействие, защищающее от MetS. Пунктирные линии обозначают системные эффекты. CCL2 (CC-хемокиновый лиганд 2); FMO (флавинсодержащая монооксигеназа); GPR41 (G-белок-связанный рецептор 41); GSIS (стимулированная глюкозой секреция инсулина); TLR4 (Toll-подобный рецептор 4); TMAO (триметиламин N-оксид); UCP1 (митохондриальный белок расщепления жировой ткани 1); WAT (белая жировая ткань).
Короткоцепочечные жирные кислоты (SCFAs), и особенно бутират, играют важную роль в поддержании кишечного иммунного гомеостаза и защите от воспаления и канцерогенеза141,142. Этот процесс может быть достигнут путем регуляции воспалительного процесса143 или путем стимулирования и регуляции клеток Treg36,144,145. SCFAs могут также действовать вне кишечника; диета, богатая клетчаткой, может подавлять аллергическое заболевание дыхательных путей путем увеличения числа клеток Treg и их функции посредством ингибирования HDAC9143,146 или FFAR3-зависимым гемопоэзом дендритных клеток, которые снижают эффекторную функцию Th2-клеток (Т-хелперов типа 2)147. Ферментация пищевых волокон в SCFAs также может помочь хозяину защититься от таких патогенов, как Clostridium difficile148 и Salmonella enterica subsp. enterica serovar Typhimurium149 у мышей и поросят соответственно.
В дополнение к выработке SCFAs, кишечная микробиота может опосредовать воздействие клетчатки на здоровье с помощью дополнительных механизмов. Добавление в рацион хлеба на основе ячменных зерен ассоциировалось с улучшением толерантности к глюкозе, что было более очевидно у лиц с высоким уровнем Prevotella, которая защищала от Bacteroides-опосредованной непереносимости глюкозы и способствовала накоплению гликогена в печени у мышей84.
Несколько исследований, проведенных за последние несколько лет, указывают на важную роль клетчатки в укреплении барьерной функции кишечника. Защита от патогенов нарушается, когда животных кормят низкокалорийной пищей вследствие переключения источника питательных веществ кишечной микробиоты с клетчатки на слизь хозяина. Этот процесс приводит к эрозии слизистого слоя, что нарушает барьерную функцию и приводит к летальному колиту при заражении мышей слизистым патогеном Citrobacter rodentium41. Хотя добавление в рацион питания с низким содержанием клетчатки очищенных волокон (таких как инулин) не отменяет восприимчивость к Цитробактериям, очищенные волокна могут смягчить вредное воздействие богатой жирами диеты на кишечный барьер и, следовательно, на здоровье хозяина в механизме, который включает либо опосредованное волокнами продвижение бактерий, критически важных для функции слизи40, либо индукцию IL-2242.
Интересно, что взаимодействие между клетчаткой и кишечной микробиотой не всегда может быть полезным для хозяина. В отличие от нескольких вышеупомянутых полезных сообщений [142, 150], по крайней мере, в одном примере полученный из волокон бутират был связан с онкогенезом в генетически восприимчивой мышиной модели колоректального рака с дефицитом генов-супрессоров, таких как ген Apc и ген Msh2. В этом случае бутират стимулировал онкогенез, индуцируя характеристики, подобные стволовым клеткам, в кишечных криптах, что потенциально ведет к генерации стволовых клеток и самообновлению151. Это наблюдение еще предстоит подтвердить на людях.
Насыщенный и ненасыщенный жир
В течение десятилетий высокое потребление пищевого жира не поощрялось из-за предполагаемой связи с сердечно-сосудистыми заболеваниями (ССЗ) и ожирением. Мета-анализ проспективных когортных исследований, опубликованных в период с 1981 по 2007 год, не подтвердил такую связь152; следовательно, последняя версия рекомендаций по питанию, выпущенная в 2015 году Министерством сельского хозяйства и здравоохранения США, больше не призывает к снижению общего потребления жиров, а скорее к оптимизации типов жиров в рационе и, в частности, к уменьшению потребления насыщенных и транс-жиров153. Эта рекомендация подтверждается механистическими исследованиями, демонстрирующими, что количество и источник жира могут оказывать различное влияние на хозяина и что некоторые из этих опосредованных жиром эффектов передаются через изменения, вызванные микробиомом кишечника. Микробиота кишечника, модифицированная диетой, богатой жирами, характеризуется чрезмерным представлением бактерий, экспрессирующих LPS, что приводит к повышенным уровням LPS в кровообращении как у мышей57, так и у людей154, провоспалительное состояние, которое называется «метаболическая эндотоксемия». LPS затем передает сигналы через Toll-подобный рецептор 4 (TLR4)155 и CD14 (ref.57) в гемопоэтических клетках, чтобы способствовать увеличению веса и ожирению, повышению воспалительных маркеров в макрофагах белой жировой ткани (WAT) и резистентности к инсулину. Параллельно метаболическая эндотоксемия также связана с повышенной проницаемостью кишечника, и причиной может быть снижение экспрессии генов, кодирующих белки с плотным соединением156; все вышеупомянутые изменения были обратимы при лечении антибиотиками156. Интересно, что эти побочные эффекты, по-видимому, характерны для насыщенных жиров; мыши, которых кормят богатой салом пищей, характеризуются цветением Bacteroides, Turicibacter и Bilophila spp., которые способствуют воспалению WAT, а также ожирению и нечувствительности к инсулину способом, зависящим от первичной реакции белка MyD88 на миелоидную дифференцировку, содержащей домен TIR адаптерной молекулы 1 (TRIF; также известной как TICAM1) и CC-хемокиновый лиганд 2 (CCL2)157. Напротив, мыши, которых кормили ненасыщенным рыбьим жиром, характеризовались экспансией Bifidobacterium, Akkermansia и Lactobacillus spp. и не продемонстрировали метаболических нарушений. Репликация метаболического фенотипа у мышей GF, которым трансплантировали эти различные микробные композиции, предполагала роль кишечной микробиоты в опосредовании дифференциальных эффектов типа жира на здоровье хозяина157. У людей, подверженных риску метаболического синдрома (n = 22 в 24-недельном исследовании), переход с диеты, богатой насыщенными жирами, на изокалорийную диету, богатую ненасыщенными жирами, не повлиял на состав микробиоты, но уменьшил общее количество бактерий. Необходимы более прямые сравнения, чтобы понять дифференциальное влияние типа жира на микробиоту человека.
В дополнение к метаболическим последствиям, кишечная микробиота может также связать потребление жиров с повышенной склонностью к воспалению кишечника у хозяина. Этот аспект был отмечен у мышей дикого типа, получавших HFD, но не у мышей с дефицитом TLR4, получавших HFD, что указывает на роль грамотрицательных комменсальных микроорганизмов и ассоциированных с ними LPS в опосредовании этого диетического метаболического фенотипа39. В дополнение к избыточной репрезентации LPS-экспрессирующих бактерий, HFD-ассоциированный микробиом иногда ассоциируется со снижением уровней бутирата и ретиноевой кислоты (RA)159, которые способствуют гомеостазу кишечника и регулируют гомеостазирование и дифференцировку дендритных клеток (DCs) и Treg-клеток144,160. Таким образом, истощение бутирата и RA высокожирной диетой (HFD) приводит к обострению химически индуцированного колита у мышей159. В дополнение к стимулированию колита путем подавления Treg-клеток, измененная жиром микробиота может также активировать дендритные клетки для стимулирования Th1-опосредованного колита у генетически восприимчивых мышей161. Насыщенные жиры также могут способствовать развитию колита, стимулируя тауриновую конъюгацию желчных кислот хозяином и тем самым увеличивая обилие Bilophila wadsworthia, которая использует их в качестве конечных электронных рецепторов и производит сероводород или вторичные желчные кислоты, потенциально приводя к нарушению кишечного барьера и, следовательно, к инфильтрации иммунных клеток161.
Отчеты о взаимодействии между диетическим жиром, ожирением и SCFAs противоречат вышеупомянутым положительным эффектам SCFAs в контексте потребления клетчатки. В своем оригинальном исследовании Turnbaugh et al. сообщили об увеличении способности к получению энергии из пищи микробиомом мышей с ожирением. В этом предлагаемом механизме ферментация неперевариваемых углеводов приводит к выработке SCFAs — ацетата, пропионата и бутирата162, этот процесс также продемонстрирован на людях с ожирением163. Эти SCFAs могут служить источниками энергии в толстой кишке (бутират) или периферических тканях (ацетат и пропионат), среди множества других метаболических и иммуномодулирующих ролей2, и предполагается, что этот процесс также приводит к увеличению доступной энергии для хозяина и, следовательно, к увеличению веса (ожирению). Так совпало, что у людей, потребляющих диету, богатую насыщенными жирами, и у мышей, питающихся HFD, повышенные уровни SCFAs158 в фекалиях сопровождались пониженным содержанием энергии в фекалиях, что позволяет предположить, что пищевые жиры могут способствовать ожирению за счет увеличения сбора энергии164. Однако важно отметить, что более низкое содержание энергии в фекалиях также может быть результатом увеличения энергетических затрат или уменьшения потребления пищи, что не всегда сообщается, хотя в настоящее время нет прямых доказательств того, что вызванный SCFAs повышенный сбор энергии связан с увеличением веса. Кроме того, диета с высоким содержанием клетчатки, которая также повышает уровень SCFAs, связана с уменьшением набора веса у людей165, а добавление SCFAs защищает мышей от индуцированного HFD ожирения166.
В дополнение к их предполагаемой связи с повышенным сбором энергии ацетат может способствовать метаболическому синдрому посредством воздействия на ось кишечника и мозга. Perry и соавт.167 сообщили, что у крыс, получавших HFD, повышен уровень ацетата, получаемого из микробиоты, который активирует парасимпатическую нервную систему для перепроизводства инсулина в ответ на глюкозу и повышает уровень связанного с голодом гормона грелина, что приводит к порочному циклу, в котором жир способствует перекармливанию и параллельно нарушает гомеостаз глюкозы. Это открытие противоречит вышеупомянутому сообщению Frost et al., в котором активность ацетата в гипоталамусе мыши подавляла аппетит140. Множество механизмов, с помощью которых диетический жир взаимодействует с микробиотой, чтобы способствовать метаболическим результатам, суммированы на рис. 2. В частности, необходимы дополнительные работы для разрешения многочисленных конфликтов, касающихся роли SCFAs в метаболическом синдроме и их взаимодействия с клетчаткой по сравнению с диетическим жиром.
Интересно, что разрушительное воздействие жира на микробиом пересекает поколения, так как потомство приматов, вскармливаемых HFD97 или мышей98,99, также содержит дисбиотический микробиом кишечника. У мышей этот унаследованный микробиом был связан с пониженным иммунитетом кишечника, повышенной восприимчивостью к инфекциям и развитием аллергий и аутоиммунитета по LPS-зависимому механизму98, а также с неалкогольной жировой болезнью печени и стеатогепатитом99. Как у приматов, так и у мышей, кормление потомков диетой с низким содержанием жиров не полностью изменило эти эффекты. Кроме того, материнское кормление HFD, как полагают, связано с повышенной восприимчивостью к колиту, вызванному декстраном сульфата натрия (DSS), у мышей-потомков100. Тем не менее, кормление родителей HFD также связано с измененными эпигенетическими признаками99. Поскольку некоторые исследования не обсуждали этот аспект, а другие не продемонстрировали разобщение последствий, связанных с эпигенетикой, с последствиями, связанными с микробиотой, степень, в которой унаследованный микробиом играет причинно-следственную и независимую от эпигенетики роль во вредных эффектах, наблюдаемых в потомстве, еще предстоит определить. Будущие исследования, посвященные лечению детей антибиотиками, могут быть полезны для понимания роли микробиома в этих фенотипах разных поколений.
Пищевая насыщенная длинноцепочечная жирная кислота (LCFA) пальмитат также ассоциировалась с обострением аутоиммунитета центральной нервной системы в мышиной модели рассеянного склероза, частично вследствие снижения уровней SCFAs, продуцируемых микробиотой (в частности пропионата), которые являются защитными в этой модели168. Важно отметить, что в другой мышиной модели аутоиммунного остеомиелита насыщенные жиры играли защитную роль благодаря HFD-опосредованным модуляциям микробиома, подавляя микробные группы, которые, как было показано, способствуют опосредованному воспалением и каспазой-8 созреванию IL-1β и остеомиелита169, эффект, приписываемый авторами превотеллам (Prevotella).
Таким образом, имеющиеся данные свидетельствуют о том, что насыщенные жиры модифицируют микробиом, способствуя неблагоприятным последствиям, которые частично наследуются, что приводит к специфическому риску метаболического синдрома, колита или аутоиммунитета центральной нервной системы, изменяя иммунный ландшафт в кишечнике или системно, увеличивая сбор энергии из пищи и изменяя уровни SCFAs. Необходимы дополнительные исследования, особенно на людях, чтобы разрешить противоречивые сообщения о способности пищевых жиров увеличивать или уменьшать уровень SCFA и о том, как эти изменения могут повлиять на насыщение (сытость). Важно, что текущие данные указывают на то, что следует учитывать тип жира157 и множество дополнительных факторов, таких как восприимчивость к болезням161 и наличие специфических комменсалов, которые взаимодействуют с жиром169.
Животный белок и переработанное мясо
Красное и переработанное мясо обычно ассоциируется с повышенным риском развития сердечно-сосудистых заболеваний (ССЗ), причем подозреваемые виновные часто упоминаются как насыщенные жиры и холестерин из-за установленной связи между гиперлипидемией и гиперхолестеринемией и ССЗ152. Тем не менее, недостаточно доказательств, подтверждающих роль потребления жира с пищей в этой связи с ССЗ152, что позволяет предположить, что могут быть вовлечены другие факторы или питательные вещества (Рис. 2). Красное мясо особенно богато L-карнитином, который метаболизируется кишечной микробиотой до триметиламина (ТМА)170. ТМА, в свою очередь, транспортируется портальной циркуляцией в печень и превращается в триметиламин N-оксид (ТМАО) с помощью флавиновых монооксигеназ. ТМАО ассоциируется с развитием атеросклероза, и действительно, мыши, хронически получавшие L-карнитин, имели измененный состав микробиоты кишечника, повышенный синтез ТМА и ТМАО и повышенный атеросклероз, которые были подавлены антибиотикотерапией. У всеядных людей, получавших L-карнитин, уровень ТМАО был выше, чем у веганов или вегетарианцев, что также блокировалось лечением антибиотиками. Как у мышей, так и у человека специфические представители микробиоты кишечника были связаны со способностью превращать L-карнитин в ТМА или ТМАО, причем в обоих организмах наблюдалась общая ассоциация с Превотеллой. В дополнение к атеросклерозу, микробная продукция TMAO также была связана у людей с гиперреактивностью тромбоцитов и связанным с ней риском тромбоза171.
Обработанное мясо также ассоциируется с риском развития колоректального рака у людей из-за производства канцерогенных гетероциклических аминов в процессе обугливания172,173. Бактерии, продуцирующие молочную кислоту (такие как Lactobacillus), могут напрямую связывать гетероциклические амины и, следовательно, потенциально защищать хозяина от индукции повреждения ДНК и неоплазии в соответствии с экспериментальными данными174. Красное мясо также богато гемом, который связан с цитотоксичностью толстой кишки и гиперпролиферацией. Интересно, что богатая гемом диета у мышей приводит к расцвету муцин-деградирующих бактерий, таких как А. муцинифила (A. muciniphila), приводящих к нарушению барьерной функции кишечника вследствие деградации слизистого слоя175. Потребление красного мяса также было связано с раком толстой кишки и желудка из-за его повышенной эндогенной продукции канцерогенных N-нитрозосоединений176. Сравнение N-нитрозосоединений в GF крысах (безмикробных) с обычными крысами, потребляющими нитраты, позволило предположить, что кишечная микробиота ответственна за выработку N-нитрозосоединений177, возможно, благодаря ферментативной активности нитратредуктазы.
Таким образом, определенные члены микробиоты кишечника могут защищать от последствий (или опосредовать последствия) метаболитов для здоровья, которые связаны с употреблением красного и обработанного мяса, хотя многие из этих ассоциаций не имеют доказательств причинно-следственной связи и заслуживают дальнейших исследований.
Пищевые добавки
Одним из основных изменений в рационе человека в последние десятилетия является потребление обработанных пищевых продуктов, которые часто содержат синтетические или натуральные добавки, такие как консерванты, подсластители, эмульгаторы и укрепляющие агенты. Эти добавки обычно рассматриваются регуляторами пищевых продуктов как безопасные на основе опубликованных научных данных на момент утверждения178. С развитием нашей способности изучать микробиом и его взаимодействие с пищей и болезнями, будет также важно определить, взаимодействуют ли какие-либо из этих соединений с резидентными микроорганизмами и каковы будут последствия таких взаимодействий.
Диетические эмульгаторы добавляют во многие продукты питания (например, кетчуп промышленного производства) для поддержания эмульсии масла и воды. Chassaing et al. сообщили, что низкие количества двух распространенных эмульгаторов, карбоксиметилцеллюлозы и полисорбата-80, способствуют развитию дисбиотической микробиоты, которая вызывает слабое воспаление, метаболический синдром и колит у мышей38. Когда ответы на эти соединения анализировали в культуре с микробиотой кишечника человека, измеряли повышенные уровни биологически активного флагеллина, обусловленные либо дисбиозом, либо измененной экспрессией бактериальных генов179. Кроме того, трансплантация этих модифицированных человеческих микробиот мышам GF повторяла многие фенотипы, наблюдаемые у мышей, которых кормили эмульгаторами179. Другим эмульгатором, который может взаимодействовать с микробиотой и влиять на здоровье человека, является фосфатидилхолин (тип лецитина). Как и в случае с L-карнитином и другими холиновыми фрагментами, лецитин трансформируется кишечной микробиотой в ТМА и, следовательно, повышает уровень ТМАО и риск развития ССЗ180.
Другая часто употребляемая группа пищевых добавок — некалорийные искусственные подсластители (NAS), которые продвигаются в качестве общей стратегии снижения веса для ограничения количества потребляемых калорий в рационе путем замены продуктов и напитков, содержащих калорийные сахара, некалорийными заменителями сахара. Исследования эффективности этого подхода демонстрируют смешанные и противоречивые результаты, как в наблюдательных исследованиях на людях, так и в вмешательствах на грызунах: некоторые демонстрируют благоприятную роль NAS в потере веса, в то время как другие сообщают о противоречивом эффекте NAS в содействии увеличению веса и другим связанным с этим метаболическим расстройствам. Эти противоположные результаты еще рассматриваются181 и могут быть согласованы, по крайней мере частично, путем рассмотрения роли некоторых конфигураций микробиома в опосредовании влияния NAS на метаболизм.
В ряде исследований сообщалось о дисбиозе и нарушении метаболического гомеостаза у грызунов, потребляющих NAS, таких как сахарин182,183,184, сукралоза185,186, аспартам 187,188, цикламат189, неотам190 и ацесульфам-калий191 (рис. 2). Функциональные анализы, выполненные либо на генном содержании измененного микробиома, либо на его секретируемых метаболитах, показывают, что NAS-индуцированный дисбиоз привел к метаболическим фенотипам, и для сахарина была установлена прямая связь путем репликации непереносимости глюкозы у наивных мышей GF, с пересаженной фекальной микробиотой от мышей, пьющих сахарин, или наивной микробиоты, модифицированной in vitro сахарином182.
Интересно, что в двух исследованиях на грызунах 182,187 на различных NAS (сахарин и аспартам) потребление было связано с повышенным уровнем ацетата и пропионата, что свидетельствует о повышенной способности сбора энергии NAS-измененной микробиотой кишечника. В небольшом интервенционном испытании на людях нарушенный гомеостаз глюкозы после потребления сахарина был очевиден у некоторых, но не у всех участников, как в отношении их предварительной экспозиции, так и вызванных сахарином изменений в составе микробиома (6-дневное добавление 120 мг сахарина в день, n = 7)182. Хотя широкомасштабная репликация этих результатов в проспективных рандомизированных исследованиях является обязательной, это говорит о том, что противоположные результаты, касающиеся последствий потребления NAS для здоровья, обусловлены различиями в микробиомах участников и что путем идентификации сигнатуры чувствительности микробиомов мы можем различать людей кому может быть полезно заменить калорийные подсластители NAS и тех, кто должен их избегать.
Минералы
Дополнение рациона железом является распространенным подходом к профилактике и лечению анемии, особенно у младенцев. Однако бактерии и особенно некоторые патогены являются эффективными поглотителями железа192. Поэтому добавление железа может привести к дисбактериозу и цветению патогенов103,118. Аналогичным образом, добавление в диету марганца усиливает бактериальную колонизацию сердца и летальность инфекции Staphylococcus aureus (золотистого стафилококка) у мышей, возможно, вследствие использования бактерией марганца для защиты от активных форм кислорода и уничтожения нейтрофилов193.
Биологически активные вещества растительного происхождения
В дополнение к клетчатке растения вносят много биологически активных соединений в рацион человека. Полифенолы представляют собой большую и разнообразную группу соединений, некоторые из которых связаны с полезными для здоровья свойствами. Например, добавление мышам, получавшим HFD, полифенолов, полученных из винограда194 или клюквы113, уменьшало эффекты воспаления и ожирения, что было связано с процветанием A. muciniphila. Несмотря на эти и многие другие ассоциации, трудно проанализировать влияние полифенолов на здоровье человека, и особенно флавоноидов, из-за значительных межиндивидуальных различий в реакции на соединения, которые могут быть обусловлены различиями в микробиоте кишечника. Таким образом, выявление бактерий, взаимодействующих с полифенолами, и их механизмов является важным шагом в понимании их влияния на хозяина. Важная роль флавоноидов в тесной связи с изменениями микробиоты была описана у мышей, подвергающихся повторным циклам диеты76. У мышей, вскармливаемых HFD, наблюдалось выраженное истощение уровней флавоноидов апигенина и нарингенина в кишечнике из-за низкой пищевой доступности и экспансии флавоноид-деградирующих комменсалов. Переход мышей с HFD на нормальную полисахаридную диету нормализует их метаболические параметры, но не состав кишечной микробиоты, которая упорно ухудшала эти флавоноиды, приводя к их низкому уровню. Поскольку успешно сидевших на диете мышей повторно кормили HFD, низкие уровни флавоноидов служили «памятью микробиома» для дальнейшего усиления метаболических эффектов HFD, влияя на выработку тепла коричневой жировой тканью. Дополнение диеты мышей пищевым апигенином и нарингенином предотвратило усиленное восстановление веса, восполнив их способность регулировать расход энергии. Таким образом, взаимодействие между микробиотой и диетой с низким содержанием флавоноидов или добавок флавоноидов может усугубить или защитить от вредного воздействия HFD на здоровье. Поскольку циклы потери и увеличения веса являются общими для людей, важно определить, является ли этот механизм общим для всех млекопитающих.
Примеры других растительных соединений, модифицированных кишечной микробиотой до формы, которая ассоциируется с пользой для здоровья, включают гидроксициннаматы кофейной, кумаровой и феруловой кислот, присутствующие в растениях в виде сложноэфирных конъюгатов и считающиеся в их свободной химической форме противовоспалительными и антиоксидантными соединениями196. Представители родов Bifidobacterium, Lactobacillus и Escherichia способны высвобождать эти соединения из их конъюгированной растительной формы197, влияя на индивидуальные уровни этих биологически активных соединений197. В то же время микробиота кишечника разлагает токсичные соединения растительного происхождения, такие как оксалат, который содержится в большом количестве в зелени, орехах, ягодах и чае, и образует кристаллы оксалата кальция, которые могут привести к образованию камней в почках. Из бактерий, катаболизирующих оксалат, ключевым игроком является Oxalobacter formigenes, и низкое содержание этого таксона связано с повышенными концентрациями оксалата в моче и повышенным риском образования камней в мочевых путях у человеков198.
Диетические методы терапии микробиоты
Многочисленные исследования, связанные с режимами питания, изменениями микробиоты кишечника и здоровьем, привели к множеству вмешательств, направленных на пропаганду «здоровой микробиоты» и обеспечение «здорового питания». Несмотря на то, что некоторые диетические подходы могут быть универсально полезными или вредными, перекрестные помехи диета-микробиота-хозяин становятся очень сложными, причем множественные компоненты проявляют как полезные, так и вредные эффекты в различных клинических контекстах (таблица 1). Таким образом, поиск «волшебной пули» полезной стратегии диетического вмешательства может быть ограничен и затруднен многими факторами, влияющими на диетические реакции на индивидуальном уровне. Например, данные, полученные на мышиных моделях, свидетельствуют о том,что ограничение насыщенных жиров в рационе улучшает метаболический синдром56,57,157, 167, воспалительные заболевания кишечника (ВЗК)39,159,161 и рассеянный склероз168, но может отрицательно влиять на особенности остеомиелита, способствуя расцвету Превотеллы и связанным с ней воспалительным ответом169. Возможные благотворные эффекты, опосредованные пищевыми соединениями,такими как полифенолы или NAS, на профилактику метаболического синдрома могут зависеть от состава микробиоты кишечника индивидуума195, а в некоторых случаях даже могут быть связаны с повышенным риском метаболического синдрома182. Было показано, что потребление клетчатки полезно для борьбы с метаболическим синдромом у людей с помощью нескольких потенциальных механизмов, включая предотвращение увеличения веса и повышение чувствительности к инсулину199, но по крайней мере в одной модели ApcMin/+Msh2−/−мышей клетчатка усугубила колоректальный рак151. Обилие Prevotella было связано с ВЗК (у мышей200 и человека201), остеомиелитом (У мышей линии pstpip2(cmo)169) и ревматоидным артритом (у человека202), но может быть полезно для толерантности к глюкозе у людей и мышей84. Экспериментальные данные показали, что добавление бактерии A. muciniphila203 или ее ассоциированных молекул204 может быть полезным в предотвращении особенностей метаболического синдрома, но ее повышенное содержание может способствовать развитию колита205 или колоректального рака175. Показано, что соотношение Firmicutes / Bacteroidetes увеличивается206,207,208, уменьшается163 или не изменяется209,210,211 у лиц с ожирением по сравнению с худыми. SCFAs связаны с благоприятным воздействием на хозяина в ряде состояний136,140,147148 212, но были также отмечены некоторые вредные эффекты162,167,187.
Таблица 1. Сложность взаимодействия диета-микробиом-здоровье
|
Диетический компонент |
Бактерия |
Метаболиты или медиаторы |
Риск заболевания |
|
Красное мясо ( L-карнитин) |
Prevotella a |
↑ TMAO |
↑ ССЗ |
|
Красное мясо ( L-карнитин) |
Bacteroides b |
↓ TMAO |
↓ ССЗ |
|
Эмульгаторы (лецитин) |
? |
↑ TMAO |
↑ ССЗ |
|
Эмульгаторы (P80 и CMC) |
↑ Proteobacteriaa |
↑ ЛПС и флагеллин |
↑ Колит и метаболический синдром |
|
Эмульгаторы (P80 и CMC) |
↑ Akkermansiaa |
↑ ЛПС и флагеллин |
↑ Колит и метаболический синдром |
|
Красное мясо (гетероциклические амины) |
Bacteroides a |
↑ 7-OHIQ |
↑ Канцерогенез |
|
Красное мясо (гетероциклические амины) |
Clostridium a |
↑ 7-OHIQ |
↑ Канцерогенез |
|
Красное мясо (гетероциклические амины) |
Eubacterium a |
↑ 7-OHIQ |
↑ Канцерогенез |
|
Красное мясо (гетероциклические амины) |
Lactobacillus b |
↑ IQ и PhIP |
↓ Канцерогенез |
|
Красное мясо (Гем) |
↑ Bacteroidesa |
↑ ЛПС? |
↑ Рак толстой кишки |
|
Красное мясо (Гем) |
↑ Sulfate-reducing bacteriaa |
↑ Сероводород |
↑ Рак толстой кишки |
|
Красное мясо (Гем) |
↑ Prevotellaa |
↑ ЛПС? |
↑ Рак толстой кишки |
|
Красное мясо (Гем) |
↑ Akkermansiaa |
↓ Слизь |
Рак толстой кишки и ВЗК |
|
Полифенолы (кофейная кислота) |
↑ Akkermansiab |
? |
↓ ВЗК |
|
Полифенолы (ресвератрол) |
↓ Prevotellaa |
↓ TMAO |
↓ ССЗ |
|
Полифенолы (экстракт винограда и/или клюквы) |
↑ Akkermansiab |
? |
↓ Метаболический синдром |
|
NAS (сахарин) |
↑ Bacteroidesa |
↑Ацетат, пропионат и ЛПС а |
↑ Метаболический синдром |
|
NAS (сахарин) |
↓ Akkermansiab |
↑Ацетат и пропионат а |
↑ Метаболический синдром |
|
NAS (сахарин) |
↑ Turicibactera |
↑ ЛПС? |
↑ Метаболический синдром |
|
NAS (аспартам) |
↑ Clostridium leptuma |
↑Аацетат, пропионат и бутират а |
↑ Метаболический синдром |
|
NAS (ацесульфам-калий) |
↑ Bacteroidesa |
↑ ЛПС, пируват и холат |
↑ Метаболический синдром |
|
Высокожирная и высокосахаристая диета |
↑ Firmicutes, Mollicutes и Eubacteriuma |
↑Лактат, ацетат и бутират а |
↑ Метаболический синдром |
|
Высокожирная и высокосахаристая диета |
↓ Bacteroidetesb |
? |
↑ Метаболический синдром |
|
Насыщенный жир |
↑ Bacteroides и Turicibactera |
↑ ЛПС |
↑ Метаболический синдром |
|
Насыщенный жир |
Supplemented Bacteroides uniformisb |
? |
↓ Метаболический синдром |
|
Насыщенный жир |
↑ Bilophilaa |
↑ ЛПС |
↑ ВЗК |
|
Насыщенный жир |
↓ S24-7 (Bacteroidetes) и Lachnospiraceaeb |
↓Бутират и ретиноевая кислота b |
↑ ВЗК |
|
Насыщенный жир |
↑ Bacteroides, Mollicutes and Lactobacillusa |
↓ Флавоноиды и UCP1 |
↑ Метаболический синдром |
|
Насыщенный жир (пальмитат) |
↓ S24-7 (Bacteroidetes) и Prevotellaceaeb |
↓ Пропионат?b |
↑ Рассеянный склероз |
|
Ненасыщенный жир |
↑ Akkermansia, Mollicutes и Lactobacillusb |
↓ ЛПС? |
↓ Метаболический синдром |
|
Высокожирные (насыщенные и ненасыщенные) |
Prevotella, Bacteroides and Turicibactera |
↓ Pro-IL-1β |
↓ Остеомиелит |
|
Волокно |
Clostridialesa |
↑Бутират а |
↑ Рак толстой кишки |
|
Волокно |
? |
↑Бутират, IL-10 и IL-18 |
↓ Рак толстой кишки |
|
Волокно |
↑ Actinobacteria и Bacteroidetesb |
↑Propionate пропионат, бутират и IGN b |
↓ Метаболический синдром |
|
Волокно |
Prevotella b |
↑ Накопление гликогена |
↓ Метаболический синдром |
|
Ферментируемое волокно (инулин) |
↑ Bifidobacterium и Akkermansiab |
↑ IL-22 |
↓ Метаболический синдром |
|
Ферментируемое волокно (инулин) |
Bifidobacterium b |
↑Рост слизи |
↓ ВЗК |
|
Ферментируемое волокно (инулин) |
? |
↑Acetate ацетат b ↓ Аппетит |
↓ Метаболический синдром |
|
Высокожирная диета |
? |
↑Acetate ацетат а, GSIS и гиперфагия |
↑ Метаболический синдром |
|
Низкокалорийная диета |
↑ Akkermansia и Bacteroides caccaea |
↓ Слизь |
Чувствительность к цитробактериям |
Примечание к таблице: IQ и 7-OHIQ: 2-Амино-3-метилимидазо[4-5-f]-хинолин и его 7-кето производное, соответственно; aассоциации, вредные для здоровья хозяина, bассоциации полезны для здоровья хозяина.
Макроэлементы, микроэлементы и пищевые добавки взаимодействуют с микробиотой, изменяя обилие определенных родов или микробный метаболический ландшафт, что приводит к значительному воздействию на здоровье хозяина. В этой сложной сети Большинство пищевых компонентов и микроорганизмов многогранны, проявляя как благотворное, так и пагубное воздействие на хозяина. Стрелки на бактериях и медиаторах показывают, что после потребления питательного вещества наблюдается увеличение или уменьшение его количества. Отсутствие стрелки перед бактерией указывает на то, что когда питательное вещество подается в присутствии этой бактерии, наблюдаются следующие метаболиты, медиаторы или риски заболеваний. Вопросительные знаки не указывают на описание соответствующей бактерии или медиатора.
Учитывая эту сложность, необходимо учитывать несколько уровней точности при решении задачи укрепления здоровья путем изменения рациона питания или микробиоты кишечника (рис. 3). Одним из соображений является желаемая польза для здоровья: является ли цель предотвратить конкретное заболевание или лечить активное? Есть ли у человека генетическая или врожденная предрасположенность к этому заболеванию213? Не менее важны диетические соображения: как дополненное или вычитаемое питательное вещество будет взаимодействовать с остальной частью рациона? Может ли диетическое вмешательство ввести экзогенные бактерии, которые могут иметь вредное взаимодействие с текущей диетой? Эти вопросы в сочетании с соображениями микробиоты: будет ли взаимодействие микробиоты с выбранным питательным веществом полезным или вредным? Смогут ли экзогенные бактерии колонизировать нишу? Хотя сложность этих вопросов может показаться демотивирующей, мы обсудим, как они могут быть решены, чтобы извлечь выгоду из обещания модифицирующих микробиоту диетических подходов.
Рис. 3. Терапевтические принципы использования оси пища-микробиота.
Диета взаимодействует с «голобионтом» человека индивидуально. Получение множества параметров от хозяина и его резидентной микробиоты может помочь в разработке точных диетических вмешательств, которые включают количество пищи, ее содержание и сроки. Эти вмешательства могут быть использованы в профилактических или лечебных целях при различных медицинских состояниях, а также для оценки прогноза, прогнозирования вероятности успеха диетического вмешательства и мониторинга клинической реакции на вмешательство. Этот сдвиг парадигмы в питании от «обобщенного» к «персонализированному» заслуживает периодической переоценки параметров хозяина и микробиоты, поскольку они подвержены постоянным изменениям после самого диетического вмешательства или из-за других факторов окружающей среды.
Пребиотики
Пребиотические диетические вмешательства — обычно называемые неперевариваемыми пищевыми ингредиентами или веществами, которые стимулируют рост или активность способствующих здоровью бактерий, колонизирующих толстый кишечник214 — были предложены в качестве средства стимулирования изменения микробиоты кишечника на благо хозяина. Введение ферментируемых пищевых волокон в форме инулина, олигофруктозы, фруктоолигосахаридов (FOS) или галактоолигосахаридов (GOS) было тщательно изучено, и в целом было предложено увеличить количество Bifidobacterium и Lactobacillus spp. в человеческом стуле (с Bifidobacterium spp., связано увеличение SCFAs) в нескольких возрастных группах и медицинских состояниях215,216. Тем не менее, важно учитывать ограничения имеющихся данных, поскольку популяции и методологии исследования значительно различались, и вышеупомянутые эффекты не всегда были воспроизводимыми и лишь иногда транслировались в четкие клинические результаты у людей, такие как иммуномодулирующие эффекты217, метаболические эффекты218 или защита против энтеропатогенных инфекций219,220. Примечательно, что реакция на пребиотики у людей, как полагают, зависит от человека221 и от исходного состава микробиоты кишечника222,223. Более того, легкодоступный отбор проб кала может повторять, по крайней мере до некоторой степени, просвет толстой кишки, в то же время недопредставляя микробиоту слизистой оболочки, экосистему на пересечении между микробиотой и хозяином224.
Другие пребиотические агенты были идентифицированы и протестированы на мышах и людях на их способность модулировать микробиоту и приносить пользу хозяину. Например, цельнозерновой ячмень и неочищенный рис (60 г в день или их смесь) улучшали разнообразие фекальных бактерий, увеличивали соотношение Firmicutes: Bacteroidetes и обилие Blautia, ослабляли пиковые уровни глюкозы в крови после приема пищи и снижали уровень IL-6 в плазме у здоровых людей (n = 28)225. Диета, основанная на овощных и фруктовых соках (6 бутылок в день в течение 3 дней), уменьшила количество фекальных Firmicutes и Proteobacteria, увеличила количество Bacteroidetes и Cyanobacteria и индуцировала функциональные изменения, свидетельствующие о полезных метаболических свойствах у здоровых добровольцев (n = 20)226. Nopal, кактус, используемый в мексиканской традиционной медицине, и берберин, компонент китайской травы, были предложены для модуляции состава кишечной микробиоты, стимулирования продукции SCFA и улучшения метаболического фенотипа у крыс28, 227. Другие пребиотики, модифицирующие микробиоту, включают олигосахариды203,228,229,230, конъюгированную линолевую кислоту231 и молочный сфингомиелин232, которые, как предполагается, усиливают метаболизм у мышей, потребляющих HFD. Удивительно, но некоторые обычно назначаемые лекарства могут также служить пребиотиками (например, противодиабетический препарат метформин увеличивает долю A. muciniphila у мышей с ожирением, вызванных диетой233 и у лиц с диабетом 2 типа234), потенциально вследствие увеличения числа муцин-продуцирующих бокаловидных клеток233 и намекая на микробиотозависимый механизм его антидиабетических свойств. Следует отметить, что определение понятия «пребиотики» было пересмотрено с акцентом на их влияние на микробную экологию и функциональные особенности, имеющие отношение к физиологии хозяина, а не на специфическую активность селективных бактерий235.
Пробиотики

Пищевые добавки с пробиотическими бактериальными штаммами направлены на пополнение кишечника полезными комменсальными бактериями, которые предоставляют хозяину благоприятные метаболические свойства. Эта индустрия с многомиллиардным оборотом была принята во всем мире производителями продуктов питания и предложила обеспечить пользу для здоровья при различных состояниях, включая метаболический синдром236, желудочно-кишечные инфекции237,238 и ВЗК239. Тем не менее, многие аспекты пробиотической терапии остаются противоречивыми, многие из результатов, связанных с пробиотиками, носят ассоциативный характер, не дают представления о лежащем в их основе механизме и были выполнены на животных моделях или в условиях in vitro с ограниченными исследованиями на людях. Одним из ограничений в использовании пробиотиков является то, что штаммы, используемые в промышленности и одобренные регулирующими органами, часто характеризуются низкой вирулентностью, которую выбирают на основании их отсутствия влияния на вкус пищи и их способности выживать в молочных продуктах или таблетках, и универсально предоставляются в качестве универсального вмешательства244. Следовательно, хотя и менее популярные, основанные на комменсале вмешательства могут также рассматриваться как пробиотики и могут потенциально превосходить обычно используемые штаммы в отношении некоторых преимуществ для здоровья. Например, лечение A. muciniphila203 или B. thetaiotaomicron245 успешно обратило некоторые компоненты метаболического синдрома у мышей, потребляющих HFD. A. muciniphila также может служить прогностическим и диагностическим инструментом для оценки диетических вмешательств, поскольку лица с избыточной массой тела или ожирением с более высокой распространенностью этого таксона показали большее улучшение чувствительности к инсулину и других особенностей метаболического синдрома в ответ на вмешательство по ограничению калорий (n = 49, 1200–1500 ккал в день в течение 6 недель)74. Альтернативным или дополнительным подходом могут быть смеси штаммов, которые могут быть более эффективными, чем некоторые препараты с одним штаммом246. В свете больших различий в конфигурациях микробиома у людей, нынешний универсальный подход к пробиотикам представляется спорным, и более оправдан индивидуализированный подход в применении конкретных штаммов247.
Персонализированное питание
Учитывая множественные переменные, влияющие на сложные взаимоотношения между хозяином, его микробиотой и их реакцией на диету, очевидно, что одна диета не может подходить всем, и при разработке индивидуализированных меню также следует придерживаться общепринятого понятия персонализированной медицины2. Эти диеты должны быть не только персонализированы с точки зрения компонентов и их количества, но также в идеале должны учитывать другие соображения, такие как временной, географический и медицинский контекст. Эволюция точных диет началась с выявления одной или нескольких переменных, связанных с микробиотой, которые изменяют результаты диетических вмешательств. Например, было обнаружено, что снижение микробного генетического богатства обратно коррелирует с эффективностью индуцированных диетой мероприятий по снижению веса и стабилизации веса у лиц с избыточным весом или ожирением (n = 49)54; начальная сборка микробиоты кишечника предсказывала обогащение специфических таксонов в ответ на диетические вмешательства у мужчин с избыточным весом (n = 14)85. Здоровые люди (n = 20), улучшившие свой метаболизм глюкозы после употребления хлеба на основе ячменных зерен, имели высокое соотношение Prevotella / Bacteroides в своей фекальной микробиоте до введения добавок, а здоровые люди, у которых была нарушена толерантность к глюкозе после употребления искусственных подсластителей, имели четкий состав микробиоты до начала вмешательства и развили более выраженный дисбактериоз, чем не реагирующие (n = 7)182. С появлением передовых методов анализа больших данных появилась возможность расшифровывать многомерные взаимодействия и предлагать точные интервенции. Таким образом, статистическая модель, основанная на мышах, укрывающих десятичленное бактериальное сообщество и подвергающихся воздействию возмущений в четырех определенных ингредиентах (белке, жире, полисахариде и простом сахаре), могла бы предсказать более половины вариаций численности видов микробиоты, приписываемых диете248. Точно так же простая модель, основанная на специфических значениях фекальных таксонов и генотипе хозяина, могла бы надежно предсказать склонность к жирной печени, вызванной дефицитом холина, у здоровых женщин (n = 15)249.
В совокупности, точные диеты должны быть построены в соответствии с индивидуальными параметрами, такими как возраст, пол, местоположение, метаболический статус, начальная сборка бактерий кишечника и функции и предпочтения в еде, среди многих других. Действительно, было обнаружено, что гликемическая реакция на хлеб у здоровых людей зависит от индивидуальных параметров в большей степени, чем от типа потребляемого хлеба (n = 20)60, опровергая господствующую аксиому о том, что «здоровость» является неотъемлемым свойством потребляемой пищи, и поэтому некоторые продукты универсально «здоровее», чем другие60. Исследование, проведенное на 800 здоровых индивидуумах250, предложило включить аналогичные индивидуальные параметры в диетологическое планирование путем реализации алгоритма машинного обучения, который основывался на структурных и функциональных особенностях микробиома, и продемонстрировало, что он может точно предсказывать постпрандиальные реакции глюкозы на различные типы пищи, превосходя широко используемые современные модели подсчета углеводов или подсчета калорий. Кроме того, краткосрочное диетическое вмешательство, основанное на персонально предсказанных постпрандиальных реакциях на глюкозу, может успешно поддерживать нормогликемию у здоровых людей. Примечательно, что применение индивидуально подобранных диет ассоциировалось со сдвигами в составе микробиоты кишечника после 1 недели вмешательства, что требовало периодической переоценки индивидуальных параметров и соответствующей корректировки режима питания (n = 26)250.
Проблемы в исследованиях
Учитывая сложность и множество персонализированных факторов, влияющих на взаимодействие между диетой, микробиомом и хозяином, крайне важно учитывать факторы, которые усложняют интерпретацию знаний и создают проблемы при их интеграции в политику общественного здравоохранения и диетические рекомендации.
Ассоциация против причинности
Диетическое вмешательство, которое связано с изменениями микробиома и любым последующим фенотипом у хозяина, не обязательно подразумевает, что диета изменила микробиом и что микробиом является причиной фенотипа. Например, диета может оказывать прямое влияние на хозяина и оказывать дискретное влияние на микробиом, который не влияет на фенотип хозяина. С другой стороны, изменения микробиома могут быть результатом изменений в физиологии хозяина, а не быть причиной таких изменений. Хотя более ранние описательные работы служат важной отправной точкой для будущих исследований, их вклад в понимание сложных взаимодействий ограничен, особенно когда они проводятся в гетерогенных человеческих популяциях.
Несколько подходов могут пролить свет на прямую или положительную связь. Хотя все еще описательный, но дополненный функциональными подходами, такими как секвенирование дробовика и метаболомика, композиционный анализ может помочь расшифровать потенциальные механизмы, с помощью которых микробиом вносит вклад в фенотип. Отмена фенотипа антибиотиками предполагает определенную роль микробиоты кишечника; однако воздействие на микробиоту часто носит грубый характер и не позволяет выделить специфические бактерии, которые вносят вклад в фенотип, а антибиотики могут оказывать на хозяина неожиданные эффекты, не связанные с микробиотой (например, дисгликемия, иммуномодуляция и повышенная моторика желудочно-кишечного тракта)251. Демонстрация прямого воздействия питательного вещества на кишечную микробиоту может быть достигнута путем совместного культивирования in vitro в полной среде без хозяина, которая может контролироваться множеством факторов окружающей среды, чтобы имитировать условия в различных областях кишечника и их просвете и микробные сборки слизистой оболочки с использованием биопленочных реакторов и хемостатов252. Один из таких подходов, названный M-SHIME, был использован для демонстрации прямого воздействия пищевых эмульгаторов на микробиом человека179. Хотя эти свободные от хозяина системы могут демонстрировать прямое взаимодействие между питательным веществом и микробиотой, сами по себе они не могут демонстрировать причинно-следственную связь в данном фенотипе. Таким образом, пересадка модулированных in vitro культур мышам GF могла бы дополнить эти подходы и обосновать причинно-следственную связь путем повторения фенотипа, наблюдаемого у животных, подвергшихся воздействию самого питательного вещества. Желудочно-кишечные органоиды или более сложные культуры органов кишечника, сохраняющие тканевую архитектуру254, дают возможность изучать механистические взаимодействия между стимулами окружающей среды, микроорганизмами и хозяином в более жестко контролируемой и изменчиво-ограниченной системе. Мыши GF служат золотым стандартом для определения причинно-следственной связи либо неспособностью реплицировать связанный с диетой фенотип в отсутствие микроорганизмов, либо воспроизводством фенотипа у мыши GF с помощью микробиоты от донора, получавшего диету. Скармливая мышам-реципиентам контрольную диету или ту же диету, которую скармливают донорам, можно потенциально идентифицировать прямые воздействия микробиоты на хозяина по сравнению с теми, которые требуют взаимодействия между микробиомом и диетой, как в случае недостаточного питания64. Введение отдельных видов или даже связанных с микроорганизмами метаболитов может дополнительно уточнить эксперименты на мышах GF. Однако эксперименты с GF имеют свои ограничения, о чем будет сказано позже. Таким образом, комплексный микробиоцентрический подход, направленный на достижение механистического понимания диетического и микробиологически опосредованного воздействия на хозяина, оптимально сочетал бы несколько взаимодополняющих вычислительных, экспериментальных, in vitro и in vivo систем. В таблице (Supplementary table 1) дополнительной информации представлены результаты, в которых экспериментально была продемонстрирована причинная роль микробиоты, а также та, которая демонстрирует ассоциацию, требующую дальнейшего подтверждения.
Разработка диетического вмешательства
Одной из самых больших проблем при сравнении диетических вмешательств является несоответствие между применяемыми протоколами. В моделях на животных стандартизация становится все более распространенной, поскольку исследователи используют коммерческие, воспроизводимые диеты и диеты с открытым исходным кодом, позволяя сравнивать как макроэлементы, так и микроэлементы между исследованиями. Однако в более ранних работах использовались нестандартизированные протоколы, в которых полная информация о содержании диеты часто недоступна, и их следует интерпретировать с осторожностью до их подтверждения с использованием более единообразных диетических вмешательств. Тем не менее, даже стандартизированные диеты в исследованиях на животных не обязательно представляют собой идеальную модель, так как часто переизбыток одного питательного вещества происходит за счет другого; например, HFD обычно содержат меньше углеводов и волокон255. Таким образом, некоторые из эффектов, приписываемых жировому фрагменту при HFD, могут фактически быть вызваны недостатком клетчатки. Хотя эти диеты могут служить удобным инструментом для скрининга, было бы целесообразно продолжить эксперименты, сфокусированные на конкретном интересующем питательном веществе.
Кроме того, дифференцированное потребление питательных веществ между группами также может быть связано с дифференцированным потреблением пищи животными из-за вкусовых качеств или влияния рациона на регуляцию сытости255,256. Это предостережение важно во многих исследованиях, демонстрирующих фенотип, противодействующий HFD, без сообщения о том, влияло ли лечение на потребление HFD, поскольку HFD является сильной детерминантой состава кишечной микробиоты даже независимо от ожирения55. Мониторинг таких различий может быть достигнут с помощью метаболических клеток, которые могут контролировать дополнительные важные параметры, такие как потребление жидкости (особенно если питьевая вода пронизана антибиотиками или питательными веществами) и расход энергии. Кроме того, как в модельных экспериментах на животных, так и в экспериментах на людях диетические вмешательства часто носят экстремальный характер и не отражают общечеловеческий образ жизни и потребление пищи. Хотя такие протоколы обеспечивают удобный и часто быстрый путь для установления доказательства концепции, их выводы должны быть воспроизведены в реалистичных условиях, с тем чтобы можно было сделать применимые выводы в отношении здоровья человека.
Исследования питания у людей, естественно, еще больше усложняются. Исследования «случай-контроль», такие как некоторые из тех, которые предположили связь между пищевыми жирами и ССЗ, склонны как к воспоминанию, так и к предвзятому выбору, и должны служить только основой для дальнейших исследований и не использоваться в качестве окончательных ответов на вопросы питания, поскольку они указывают на ассоциацию, а не причинно-следственную связь. Рандомизированные контролируемые исследования (РКИ) являются предпочтительными, но также могут иметь важные ограничения. В РКИ диетическое вмешательство часто добавляется (или опускается) к стандартному рациону индивидуума, которое может значительно различаться, что влияет на результат вмешательства. Разработка полноценной диеты идеальна, но редко осуществима в течение длительного периода времени из-за несоблюдения и неспособности контролировать весь рацион людей вне институциональных условий. Таким образом, исследователи должны контролировать потребление калорий, макронутриентов и микронутриентов, предпочтительно используя пищевые дневники в реальном времени, которые менее склонны к искажению воспоминаний, чем вопросники по частоте приема пищи. Поскольку соблюдение режима питания может быть неоптимальным, по возможности рекомендуется контролировать уровни характерного (сигнатурного) метаболита в биологических образцах из лечебной и контрольной групп. Ослепление является проблемой в диетических вмешательствах человека и может привести к различиям в образе жизни между группами во время вмешательства. Этот аспект может быть частично решен путем использования журналов активности (например, физической активности). Эти ограничения и необходимость контроля многих параметров часто приводят к меньшим когортам и более коротким воздействиям, что следует учитывать при интерпретации результатов43,84,85,182,226,249.
Человека против животных моделей
Эксперименты на грызунах позволяют контролировать условия питания в преодолении вышеупомянутых проблем, с которыми сталкиваются люди. Однако мыши отличаются от людей в нескольких важных аспектах диета-микробиом257. Первый относится к структуре и функции кишечника и к анатомическим участкам, где метаболизируются некоторые питательные вещества. У мышей ферментация неперевариваемых пищевых компонентов происходит в слепой кишке, тогда как у человека слепая кишка значительно меньше, и ферментация происходит в толстой кишке, которая, в отличие от мыши, является субкомпартментализированной257. Это несоответствие также подчеркивает разницу в сообществах микробных клеток толстой кишки и регионе, в котором производятся SCFAs. Бокаловидные и клетки Панета, которые играют важную роль в поддержании равновесия между хозяином и микробиотой, распределены между этими двумя организмами по-разному. Клетки Панета обнаруживаются исключительно в тонкой кишке у мышей, но также обнаруживаются в слепой кишке и проксимальном отделе толстой кишки у людей. Бокаловидных клеток много в проксимальном отделе толстой кишки мыши, и их количество уменьшается у основания крипты дистально, тогда как у людей их много в толстой кишке257.
Хотя многие бактериальные роды разделяются между двумя организмами, они различаются по своей относительной численности. Одной из стратегий, используемых для устранения этого несоответствия, является модель гуманизированных гнотобиотических мышей15, в которой мышам GF трансплантируют микробиоту человека; однако даже в этой модели некоторые представители микробиоты человека не колонизируют пересаженную мышь15. Несмотря на эти ограничения, мышь представляет собой важную диетическую модель, имеющую отношение к физиологии человека во многих аспектах. Например, микробиота как у людей с ожирением258, так и у мышей с ожирением162 может способствовать увеличению веса у мышей-реципиентов GF, а ожирение связано с уменьшением бактериального разнообразия у обоих организмов56,207. Тем не менее, проверка любых штамм-специфических эффектов, когда отмечается на мышах, заслуживает внимания в исследованиях на людях. В таблице (Supplementary table 1) дополнительной информации мы перечисляем наблюдения, которые были продемонстрированы на людях, по сравнению с наблюдениями, которые были показаны только на животных моделях.
Даже при сравнении исследований, проведенных на мышах, следует проявлять осторожность, когда речь идет о разных генотипах, поскольку даже у разных генотипов мышей дикого типа наблюдаются разные конфигурации микробиома, и это становится еще более очевидным при экспериментах с генетически измененными моделями мышей259. Хотя было показано, что диета доминирует над генотипом с точки зрения его влияния на состав микробиоты58, в этом контексте было подробно изучено лишь ограниченное количество диет, и возможно, что некоторые диеты могут по-разному взаимодействовать с различными конфигурациями микробиоты.
Мыши GF служат наилучшей доступной моделью для изучения причинно-следственных эффектов микробиоты на здоровье хозяина, но это происходит ценой нескольких важных различий между GF и колонизированными специфическими мышами, свободными от патогенов. Мыши GF требуют диетического дополнения с витаминами B и K; имеют меньше жировых отложений но более высокие уровни холестерина в крови; и характеризуются повышенным потреблением пищи, снижением скорости основного обмена, увеличением времени прохождения через кишечник, изменением морфологии и функции кишечника и значительным увеличением слепой кишки260. Кроме того, они имеют дефекты в развитии кишечно-ассоциированных лимфоидных тканей и в продукции антител, а также меньшее количество и меньшие размеры патчей Пейера и брыжеечных лимфатических узлов. Дополнительные различия между GF и колонизированными мышами рассматриваются в другом месте: [260, 261]. Один из полезных подходов в этом контексте включает сравнение между мышами GF и условно-патогенными мышами GF, а не специфическими мышами, свободными от патогенов, как более контролируемое сравнение, которое могло бы ограничить смещение, происходящее от врожденных дефектов GF.
Протоколы характеристики микробиома
Интерес к взаимодействиям микробиома, диеты и здоровья предшествует секвенированию следующего поколения (NGS), и поэтому во многих докладах использовались целевые методы, ПЦР, флуоресцентная гибридизация in situ или культуры для характеристики микробной популяции. Ограничения этих методов следует учитывать при сравнении между исследованиями. В настоящее время исследователи, устанавливающие конвейер NGS для характеристики микробиома, сталкиваются с рядом решений, которые могут привести к искажениям и различным результатам для одной и той же пробы, включая: сбор, обработку и хранение образцов ДНК262; протокол очистки микробной ДНК263; секвенирование ампликона 16S рДНК в сравнении с метагеномикой дробовика264; вариабельная область 16S для амплификации265; полимеразные и ПЦР-условия266; и множественные решения во время обработки последовательностей in silico и интеллектуального анализа данных267,268. При сравнении публикаций следует учитывать потенциальные искажения, обусловленные этим выбором. Costea et al. сообщили, что в конвейерах секвенирования дробовика различия, обусловленные протоколами очистки ДНК, оказали наибольшее влияние на вариации результатов, полученных из одних и тех же образцов (по сравнению с подготовкой библиотеки и хранением образцов), и поэтому сравнили несколько протоколов, чтобы предложить те, которые являются наиболее воспроизводимый263. Аналогичная стандартизация рекомендуется для других этапов процесса анализа ДНК микроорганизмов.
Относительное и абсолютное изобилие
Часто сообщается, что связанные с диетой изменения микробиоты вызывают изменения в относительной численности, тогда как абсолютная численность бактериальных штаммов, по-видимому, встречается редко. При интерпретации таких результатов следует соблюдать осторожность, так как увеличение относительной численности бактериальной группы может означать не изменение абсолютной численности, а уменьшение других представителей микробиоты. Это ограничение можно преодолеть с помощью статистических алгоритмов, таких как log-ratio analysis (анализ логарифмических коэффициентов)269, или с помощью рабочих процессов, которые сочетают основанные на секвенировании относительные содержания с микробными количествами, полученными из таких методов, как проточная цитометрия270. Альтернативно, как только потенциальная бактерия, представляющая интерес, была идентифицирована с помощью анализа относительной численности, непосредственная количественная оценка абсолютной численности (например, с использованием селективных условий культивирования, где это применимо, или с использованием специфичных для штамма праймеров для количественной ПЦР) может решить эту проблему. Кроме того, если предполагается, что секретируемые бактериальные метаболиты опосредуют фенотип, их количественное определение может обойти необходимость определения абсолютных изменений численности.
Выводы
Взятые вместе, область питания в настоящее время изобилует многими не основанными на фактических данных практиками и рекомендациями — некоторые получены из неверно истолкованных или недостаточных научных исследований, а другие вытекают из коммерческих интересов или в результате произвольных заявлений. Общие схемы диеты часто приводят к неудачам и разочарованию на личном уровне и постоянному увеличению числа случаев ожирения и метаболической пандемии на уровне населения, побуждая общественность колебаться между краткосрочными тенденциями. Появление исследований микробиоты и растущее количество фактических данных, указывающих на ее тесную взаимосвязь с привычками питания и вмешательствами, а также ее важную роль в метаболизме пищи, представили потенциально привлекательную новую цель для диетических манипуляций. Тем не менее, количество противоречивых сообщений существенно затрудняет трансляцию исследований диета-микробиом-хозяин в клиническое использование. Сосредоточение внимания только на исследованиях, которые продемонстрировали причинно-следственную связь или те, которые были изучены на людях, а не только на животных моделях, устраняет некоторые из этих конфликтов, хотя некоторые питательные вещества или бактерии все еще считаются как полезными, так и вредными (см. Таблицу 1 и дополнительную таблицу 1). С изменением в области микробиоты в сторону более механистических работ можно ожидать, что стандартизация как микробиомного анализа, так и протоколов диетического вмешательства разрешит некоторые из конфликтов, чтобы облегчить идентификацию питательных веществ, которые могут быть рекомендованы для широкой общественности, или бактерий, которые могут быть использованы в качестве пробиотиков. Параллельно некоторые из этих конфликтов могут возникать из-за реальных биологических вариаций. Хотя необходимость в точности и персонализации при применении диетических терапевтических средств при различных болезненных состояниях может показаться интуитивно понятной, различия между индивидуумами в ответ на одно и то же питательное вещество только оцениваются. Эта развивающаяся область несет в себе потенциал революционизировать восприятие питания от единообразных внутренних пищевых рекомендаций до гибких индивидуальных и контекстно-ориентированных рекомендаций, которые предназначены для предотвращения или коррекции метаболических нарушений и даже улучшения воспалительных и опухолевых процессов. Такое концептуальное изменение может сдвинуть стандартный способ действия от традиционных универсальных подходов к подходам, предусматривающим интеграцию многочисленных индивидуальных параметров, с использованием набора передовых биоинформационных инструментов, способных обрабатывать большие данные, позволяющих планировать терапевтические стратегии с учетом предпочтений пациента (Рис. 3). Такой индивидуальный подход может создать новые проблемы в планировании питания, поскольку некоторые программы питания, разработанные для решения конкретных проблем, могут препятствовать или вступать в противоречие с другими соображениями здравоохранения. Кроме того, поскольку микробиом кишечника подвержен изменениям, диетические вмешательства могут вызвать структурные и функциональные изменения в кишечных бактериях, что может потребовать периодической переоценки индивидуальных параметров и соответствующей корректировки режима питания. Тем не менее, эта неизведанная территория может создать захватывающую возможность использовать наших эндогенных микробов кишечника для рационализации и оптимизации пользы для здоровья, обеспечиваемой питанием человека.
По теме см. также:
- Прецизионное питание и микробиом: Ч 1.
- Прецизионное питание и микробиом: Ч.II
- Пробиотики, резистентный крахмал и резистентные белки для здорового долголетия
- Взаимодействие диеты и микробиома (подраздел к статье)
- Диета-взаимодействие микробиоты и персонализированное питание
- Роль диетических питательных веществ в модуляции микробиоты
- Пищевое воздействие на микробиом как потенциальное лечение недостаточности питания и хронического воспаления
- Кетодиета и микробиом
- Питание и псориаз
- Диета с высоким содержанием жиров в западном стиле, системное воспаление и микробиота кишечника
- Болезнь Крона, кишечная микробиота и лечебные диеты
- Иммунитет и диета при воспалительных заболеваниях кишечника
- Ферментированные продукты, здоровье и микробиом кишечника
- Влияние неперевариваемых углеводов на метаболические заболевания
Дополнительно см.:
- Характеристика некоторых представителей кишечной микробиоты
- Механизмы действия пребиотиков
- Пищевые волокна
- Влияние пищевых волокон на кишечную микробиоту
- Роль углеводов в болезнях человека через регуляцию несбалансированной кишечной микробиоты
- Вкусовые ощущения и микробиота
Литература:
- Cho, I. & Blaser, M. J. The human microbiome: at the interface of health and disease. Nat. Rev. Genet. 13, 260–270 (2012).
- Sonnenburg, J. L. & Backhed, F. Diet-microbiota interactions as moderators of human metabolism. Nature 535, 56–64 (2016).
- Collaboration, N. R. F. Trends in adult body-mass index in 200 countries from 1975 to 2014: a pooled analysis of 1698 population-based measurement studies with 19·2 million participants. Lancet387, 1377–1396 (2016).
- Ayyad, C. & Andersen, T. Long-term efficacy of dietary treatment of obesity: a systematic review of studies published between 1931 and 1999. Obes. Rev. 1, 113–119 (2000).
- Tsai, A. G. & Wadden, T. A. Systematic review: an evaluation of major commercial weight loss programs in the United States. Ann. Internal Med. 142, 56–66 (2005).
- Gibson, P. & Shepherd, S. Personal view: food for thought–western lifestyle and susceptibility to Crohn’s disease. The FODMAP hypothesis. Aliment. Pharmacol. Ther. 21, 1399–1409 (2005).
- Lee, J. et al. British Dietetic Association evidence-based guidelines for the dietary management of Crohn’s disease in adults. J. Hum. Nutr. Dietet. 27, 207–218 (2014).
- Marsh, A., Eslick, E. M. & Eslick, G. D. Does a diet low in FODMAPs reduce symptoms associated with functional gastrointestinal disorders? A comprehensive systematic review and meta-analysis. Eur. J. Nutr. 55, 897–906 (2016).
- Manzel, A. et al. Role of “Western diet” in inflammatory autoimmune diseases. Curr. Allergy Asthma Rep. 14, 404 (2014).
- Fuchs, C. S. et al. Dietary fiber and the risk of colorectal cancer and adenoma in women. N. Engl. J. Med. 1999, 169–176 (1999).
- Bradbury, K. E., Appleby, P. N. & Key, T. J. Fruit, vegetable, and fiber intake in relation to cancer risk: findings from the European Prospective Investigation into Cancer and Nutrition (EPIC). Am. J. Clin. Nutr. 100, 394S–398S (2014).
- Charbonneau, M. R. et al. Sialylated milk oligosaccharides promote microbiota-dependent growth in models of infant undernutrition. Cell 164, 859–871 (2016).
- Laursen, M. F., Bahl, M. I., Michaelsen, K. F. & Licht, T. R. First foods and gut microbes. Front. Microbiol. 8, 356 (2017).
- Claesson, M. J. et al. Gut microbiota composition correlates with diet and health in the elderly. Nature 488, 178–184 (2012).
- Turnbaugh, P. J. et al. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci. Transl Med. 1, 6ra14 (2009).
- Korem, T. et al. Growth dynamics of gut microbiota in health and disease inferred from single metagenomic samples. Science 349, 1101–1106 (2015).
- Cantarel, B. L., Lombard, V. & Henrissat, B. Complex carbohydrate utilization by the healthy human microbiome. PLOS One 7, e28742 (2012).
- Eilam, O. et al. Glycan degradation (GlyDeR) analysis predicts mammalian gut microbiota abundance and host diet-specific adaptations. mBio 5, e01526–14 (2014).
- Sonnenburg, E. D. et al. Specificity of polysaccharide use in intestinal bacteroides species determines diet-induced microbiota alterations. Cell 141, 1241–1252 (2010). This work sheds light on a mechanism by which diet shapes the microbiota and proposes that genetic and structural analyses of Bacteroides species can infer their metabolic capacity and predict competitiveness in the presence of specific dietary polysaccharides.
- Martens, E. C., Chiang, H. C. & Gordon, J. I. Mucosal glycan foraging enhances fitness and transmission of a saccharolytic human gut bacterial symbiont. Cell Host Microbe 4, 447–457 (2008).
- Koropatkin, N. M., Cameron, E. A. & Martens, E. C. How glycan metabolism shapes the human gut microbiota. Nat. Rev. Microbiol.10, 323–335 (2012).
- Scott, K. P. et al. Substrate-driven gene expression in Roseburia inulinivorans: importance of inducible enzymes in the utilization of inulin and starch. Proc. Natl Acad. Sci. USA 108 (Suppl. 1), 4672–4679 (2011).
- Sonnenburg, J. L. et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 307, 1955–1959 (2005).
- Fischbach, M. A. & Sonnenburg, J. L. Eating for two: how metabolism establishes interspecies interactions in the gut. Cell Host Microbe 10, 336–347 (2011).
- Hoek, M. & Merks, R. M. H. Emergence of microbial diversity due to cross-feeding interactions in a spatial model of gut microbial metabolism. BMC Syst. Biol. 11, 56 (2017).
- Freilich, S. et al. Competitive and cooperative metabolic interactions in bacterial communities. Nat. Commun. 2, 589 (2011).
- Cowan, M. M. Plant products as antimicrobial agents. Clin. Microbiol. Rev. 12, 564–582 (1999).
- Zhang, X. et al. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats. PLOS One 7, e42529 (2012).
- Li, Y. et al. Exogenous stimuli maintain intraepithelial lymphocytes via aryl hydrocarbon receptor activation. Cell 147, 629–640 (2011). This work provides an example of an indirect mechanism for dietary modulation of the microbiota structure via the host immune system.
- Hibberd, M. C. et al. The effects of micronutrient deficiencies on bacterial species from the human gut microbiota. Sci. Transl Med.9, eaal4069 (2017).
- Su, D. et al. Vitamin D signaling through induction of paneth cell defensins maintains gut microbiota and improves metabolic disorders and hepatic steatosis in animal models. Front. Physiol. 7, 498 (2016).
- Ooi, J. H., Li, Y., Rogers, C. J. & Cantorna, M. T. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis. J. Nutr. 143, 1679–1686 (2013).
- Luthold, R. V., Fernandes, G. R., Franco-de-Moraes, A. C., Folchetti, L. G. & Ferreira, S. R. Gut microbiota interactions with the immunomodulatory role of vitamin D in normal individuals. Metabolism 69, 76–86 (2017).
- Kaliannan, K., Wang, B., Li, X. Y., Kim, K. J. & Kang, J. X. A host-microbiome interaction mediates the opposing effects of omega-6 and omega-3 fatty acids on metabolic endotoxemia. Sci. Rep. 5, 11276 (2015).
- He, B. et al. Resetting microbiota by Lactobacillus reuteri inhibits T reg deficiency-induced autoimmunity via adenosine A2A receptors. J. Exp. Med. 214, 107–123 (2017).
- Smith, P. M. et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 341, 569–573 (2013). This work suggests a mechanism by which diet-derived bacterial metabolites regulate the host immune system and confer health-promoting effects.
- Inagaki, T. et al. Regulation of antibacterial defense in the small intestine by the nuclear bile acid receptor. Proc. Natl Acad. Sci. USA103, 3920–3925 (2006).
- Chassaing, B. et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature 519, 92–96 (2015). This study presents an example of a food additive disrupting homeostasis in a microbiota-dependent manner, resulting in low-grade inflammation.
- Kim, K.-A., Gu, W., Lee, I.-A., Joh, E.-H. & Kim, D.-H. High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway. PLOS One 7, e47713 (2012).
- Schroeder, B. O. et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration. Cell Host Microbe 23, 27–40 (2018).
- Desai, M. S. et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell 167, 1339–1353 (2016).
- Zou, J. et al. Fiber-mediated nourishment of gut microbiota protects against diet-induced obesity by restoring IL-22-mediated colonic health. Cell Host Microbe 23, 41–53 (2018).
- David, L. A. et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 505, 559–563 (2014). This work illustrates passive transfer of foodborne microorganisms into the gut indigenous microbial ecosystem and presents short-term structural and functional microbiota alterations typical of animal-based versus plant-based diets in humans.
- Zhang, C. et al. Ecological robustness of the gut microbiota in response to ingestion of transient food-borne microbes. ISME J. 10, 2235–2245 (2016).
- Ley, R. E. et al. Evolution of mammals and their gut microbes. Science 320, 1647–1651 (2008).
- Muegge, B. D. et al. Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans. Science 332, 970–974 (2011).
- De Filippo, C. et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc. Natl Acad. Sci. USA 107, 14691–14696 (2010).
- Yatsunenko, T. et al. Human gut microbiome viewed across age and geography. Nature 486, 222–227 (2012).
- Schnorr, S. L. et al. Gut microbiome of the Hadza hunter-gatherers. Nat. Commun. 5, 3654 (2014).
- Smits, S. A. et al. Seasonal cycling in the gut microbiome of the Hadza hunter-gatherers of Tanzania. Science 357, 802–806 (2017). This study demonstrates seasonality in the composition of faecal microbiota obtained from hunter-gatherers, which corresponds to the availability of different types of foods, and delineates the difference between this population and the industrialized population.
- Obregon-Tito, A. J. et al. Subsistence strategies in traditional societies distinguish gut microbiomes. Nat. Commun. 6, 6505 (2015).
- Martinez, I. et al. The gut microbiota of rural papua new guineans: composition, diversity patterns, and ecological processes. Cell Rep.11, 527–538 (2015).
- Clemente, J. C. et al. The microbiome of uncontacted Amerindians. Sci. Adv. 1, e1500183 (2015).
- Cotillard, A. et al. Dietary intervention impact on gut microbial gene richness. Nature 500, 585–588 (2013).
- Hildebrandt, M. A. et al. High-fat diet determines the composition of the murine gut microbiome independently of obesity. Gastroenterology 137, 1716–1724 (2009).
- Turnbaugh, P. J., Bäckhed, F., Fulton, L. & Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host Microbe 3, 213–223 (2008).
- Cani, P. D. et al. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes 56, 1761–1772 (2007).
- Carmody, R. N. et al. Diet dominates host genotype in shaping the murine gut microbiota. Cell Host Microbe 17, 72–84 (2015).
- Wu, M. et al. Genetic determinants of in vivo fitness and diet responsiveness in multiple human gut Bacteroides. Science 350, aac5992 (2015).
- Korem, T. et al. Bread affects clinical parameters and induces gut microbiome-associated personal glycemic responses. Cell Metab.25, 1243–1253 (2017).
- Shulman, R. J. et al. Psyllium fiber reduces abdominal pain in children with irritable bowel syndrome in a randomized, double-blind trial. Clin. Gastroenterol. Hepatol. 15, 712–719 (2017).
- Fransen, F. et al. beta2-→1-Fructans modulate the immune system in vivo in a microbiota-dependent and -independent fashion. Front. Immunol. 8, 154 (2017).
- Dimova, L. G., Zlatkov, N., Verkade, H. J., Uhlin, B. E. & Tietge, U. J. F. High-cholesterol diet does not alter gut microbiota composition in mice. Nutr. Metab. 14, 15 (2017).
- Smith, M. I. et al. Gut microbiomes of Malawian twin pairs discordant for kwashiorkor. Science 339, 548–554 (2013). This work in children with undernutrition highlights the interrelationship between the microbiota and a nutrient-deficient diet.
- Reyes, A. et al. Gut DNA viromes of Malawian twins discordant for severe acute malnutrition. Proc. Natl Acad. Sci. USA 112, 11941–11946 (2015).
- Subramanian, S. et al. Persistent gut microbiota immaturity in malnourished Bangladeshi children. Nature 510, 417–421 (2014). This work devises a model to assess the ‘relative microbiota maturity index’ as a marker for malnutrition and the efficacy of therapeutic intervention.
- Kau, A. L., Ahern, P. P., Griffin, N. W., Goodman, A. L. & Gordon, J. I. Human nutrition, the gut microbiome and the immune system. Nature 474, 327–336 (2011).
- Zhang, C. et al. Structural modulation of gut microbiota in life-long calorie-restricted mice. Nat. Commun. 4, 2163 (2013).
- Wu, J. et al. metabolomics insights into the modulatory effects of long-term low calorie intake in mice. J. Proteome Res. 15, 2299–2308 (2016).
- Duncan, S. H. et al. Reduced dietary intake of carbohydrates by obese subjects results in decreased concentrations of butyrate and butyrate-producing bacteria in feces. Appl. Environ. Microbiol. 73, 1073–1078 (2007).
- Santacruz, A. et al. Interplay between weight loss and gut microbiota composition in overweight adolescents. Obes. (Silver Spring, Md.) 17, 1906–1915 (2009).
- Ruiz, A. et al. One-year calorie restriction impacts gut microbial composition but not its metabolic performance in obese adolescents. Environ. Microbiol. 19, 1536–1551 (2017).
- Fontana, L. & Partridge, L. Promoting health and longevity through diet: from model organisms to humans. Cell 161, 106–118 (2015). This review summarizes the interplay between dietary restriction, the gut microbiota and the host to explain lifespan extension and amelioration in ageing-associated diseases in various organisms.
- Dao, M. C. et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 65, 426–436 (2016).
- Le Chatelier, E. et al. Richness of human gut microbiome correlates with metabolic markers. Nature 500, 541–546 (2013).
- Thaiss, C. A. et al. Persistent microbiome alterations modulate the rate of post-dieting weight regain. Nature 540, 544–551 (2016). The study demonstrates ‘microbiome memory’ mediated by polyphenols that contributes to exacerbated weight gain in ‘yo-yo’ dieting.
- Thaiss, C. A. et al. Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis. Cell 159, 514–529 (2014).
- Thaiss, C. A. et al. Microbiota diurnal rhythmicity programs host transcriptome oscillations. Cell 167, 1495–1510. e1412 (2016).
- Leone, V. et al. Effects of diurnal variation of gut microbes and high-fat feeding on host circadian clock function and metabolism. Cell Host Microbe 17, 681–689 (2015).
- Liang, X., Bushman, F. D. & FitzGerald, G. A. Rhythmicity of the intestinal microbiota is regulated by gender and the host circadian clock. Proc. Natl Acad. Sci. USA 112, 10479–10484 (2015).
- Zarrinpar, A., Chaix, A., Yooseph, S. & Panda, S. Diet and feeding pattern affect the diurnal dynamics of the gut microbiome. Cell Metab. 20, 1006–1017 (2014).
- David, L. A. et al. Host lifestyle affects human microbiota on daily timescales. Genome Biol. 15, R89 (2014).
- Ten Bruggencate, S. J., Bovee-Oudenhoven, I. M., Lettink-Wissink, M. L., Katan, M. B. & van der Meer, R. Dietary fructooligosaccharides affect intestinal barrier function in healthy men. J. Nutr. 136, 70–74 (2006).
- Kovatcheva-Datchary, P. et al. Dietary fiber-induced improvement in glucose metabolism is associated with increased abundance of Prevotella. Cell Metab. 22, 971–982 (2015). This work exemplifies that the presence of a specific gut microbiota composition in humans can dictate the host response to food.
- Walker, A. W. et al. Dominant and diet-responsive groups of bacteria within the human colonic microbiota. ISME J. 5, 220–230 (2011).
- Lappi, J. et al. Intake of whole-grain and fiber-rich rye bread versus refined wheat bread does not differentiate intestinal microbiota composition in Finnish adults with metabolic syndrome. J. Nutr. 143, 648–655 (2013).
- Jumpertz, R. et al. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am. J. Clin. Nutr. 94, 58–65 (2011).
- Faith, J. J. et al. The long-term stability of the human gut microbiota. Science 341, 1237439 (2013).
- Costello, E. K. et al. Bacterial community variation in human body habitats across space and time. Science 326, 1694–1697 (2009).
- Lozupone, C. A., Stombaugh, J. I., Gordon, J. I., Jansson, J. K. & Knight, R. Diversity, stability and resilience of the human gut microbiota. Nature 489, 220–230 (2012).
- Mariat, D. et al. The Firmicutes/Bacteroidetes ratio of the human microbiota changes with age. BMC Microbiol. 9, 123 (2009).
- Koenig, J. E. et al. Succession of microbial consortia in the developing infant gut microbiome. Proc. Natl Acad. Sci. USA 108(Suppl. 1), 4578–4585 (2011).
- Palmer, C., Bik, E. M., DiGiulio, D. B., Relman, D. A. & Brown, P. O. Development of the human infant intestinal microbiota. PLOS Biol.5, e177 (2007).
- Thevaranjan, N. et al. Age-associated microbial dysbiosis promotes intestinal permeability, systemic inflammation, and macrophage dysfunction. Cell Host Microbe 21, 455–466 (2017).
- Jeffery, I. B., Lynch, D. B. & O’Toole, P. W. Composition and temporal stability of the gut microbiota in older persons. ISME J.10, 170–182 (2016).
- Sonnenburg, E. D. et al. Diet-induced extinctions in the gut microbiota compound over generations. Nature 529, 212–215 (2016).
- Ma, J. et al. High-fat maternal diet during pregnancy persistently alters the offspring microbiome in a primate model. Nat. Commun.5, 3889 (2014).
- Myles, I. A. et al. Parental dietary fat intake alters offspring microbiome and immunity. J. Immunol. 191, 3200–3209 (2013).
- Wankhade, U. D. et al. Enhanced offspring predisposition to steatohepatitis with maternal high-fat diet is associated with epigenetic and microbiome alterations. PLOS One 12, e0175675 (2017).
- Bibi, S., Kang, Y., Du, M. & Zhu, M. J. Maternal high-fat diet consumption enhances offspring susceptibility to DSS-induced colitis in mice. Obesity 25, 901–908 (2017).
- Tompkins, G. R., O’Dell, N. L., Bryson, I. T. & Pennington, C. B. The effects of dietary ferric iron and iron deprivation on the bacterial composition of the mouse intestine. Curr. Microbiol. 43, 38–42 (2001).
- Werner, T. et al. Depletion of luminal iron alters the gut microbiota and prevents Crohn’s disease-like ileitis. Gut 60, 325–333 (2011).
- Dostal, A. et al. Iron depletion and repletion with ferrous sulfate or electrolytic iron modifies the composition and metabolic activity of the gut microbiota in rats. J. Nutr. 142, 271–277 (2012).
- Balamurugan, R. et al. Low levels of faecal lactobacilli in women with iron-deficiency anaemia in south India. Br. J. Nutr. 104, 931–934 (2010).
- Pachikian, B. D. et al. Changes in intestinal bifidobacteria levels are associated with the inflammatory response in magnesium-deficient mice. J. Nutr. 140, 509–514 (2010).
- Starke, I. C., Pieper, R., Neumann, K., Zentek, J. & Vahjen, W. The impact of high dietary zinc oxide on the development of the intestinal microbiota in weaned piglets. FEMS Microbiol. Ecol. 87, 416–427 (2014).
- Mayneris-Perxachs, J. et al. Protein- and zinc-deficient diets modulate the murine microbiome and metabolic phenotype. Am. J. Clin. Nutr. 104, 1253–1262 (2016).
- Speckmann, B. & Steinbrenner, H. Selenium and selenoproteins in inflammatory bowel diseases and experimental colitis. Inflamm. Bowel Dis. 20, 1110–1119 (2014).
- Kina-Tanada, M. et al. Long-term dietary nitrite and nitrate deficiency causes the metabolic syndrome, endothelial dysfunction and cardiovascular death in mice. Diabetologia 60, 1138–1151 (2017).
- Assa, A. et al. Vitamin D deficiency promotes epithelial barrier dysfunction and intestinal inflammation. J. Infect. Dis. 210, 1296–1305 (2014).
- Etxeberria, U. et al. Reshaping faecal gut microbiota composition by the intake of trans-resveratrol and quercetin in high-fat sucrose diet-fed rats. J. Nutr. Biochem. 26, 651–660 (2015).
- Huang, J. et al. Different flavonoids can shape unique gut microbiota profile in vitro. J. Food Sci. 81, H2273–H2279 (2016).
- Anhê, F. F. et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp. population in the gut microbiota of mice. Gut 64, 872–883 (2015).
- Wu, G. D. et al. Comparative metabolomics in vegans and omnivores reveal constraints on diet-dependent gut microbiota metabolite production. Gut 65, 63–72 (2016).
- O’Keefe, S. J. et al. Fat, fibre and cancer risk in African Americans and rural Africans. Nat. Commun. 6, 6342 (2015).
- McDonald, D. et al. American Gut: an open platform for citizen science microbiome research. mSystems 3, e00031–18 (2018).
- Sazawal, S. et al. Effects of routine prophylactic supplementation with iron and folic acid on admission to hospital and mortality in preschool children in a high malaria transmission setting: community-based, randomised, placebo-controlled trial. Lancet367, 133–143 (2006).
- Jaeggi, T. et al. Iron fortification adversely affects the gut microbiome, increases pathogen abundance and induces intestinal inflammation in Kenyan infants. Gut 64, 731–742 (2014).
- Tung, J. et al. Social networks predict gut microbiome composition in wild baboons. eLife 4, e05224 (2015).
- Song, S. J. et al. Cohabiting family members share microbiota with one another and with their dogs. eLife 2, e00458 (2013).
- Griffin, N. W. et al. Prior dietary practices and connections to a human gut microbial metacommunity alter responses to diet interventions. Cell Host Microbe 21, 84–96 (2017).
- Brito, I. L. et al. Mobile genes in the human microbiome are structured from global to individual scales. Nature 535, 435–439 (2016).
- Thomas, F., Hehemann, J. H., Rebuffet, E., Czjzek, M. & Michel, G. Environmental and gut bacteroidetes: the food connection. Front. Microbiol. 2, 93 (2011).
- Hehemann, J.-H. et al. Transfer of carbohydrate-active enzymes from marine bacteria to Japanese gut microbiota. Nature 464, 908–912 (2010).
- Shepherd, E. S., DeLoache, W. C., Pruss, K. M., Whitaker, W. R. & Sonnenburg, J. L. An exclusive metabolic niche enables strain engraftment in the gut microbiota. Nature 557, 434–438 (2018).
- Perry, G. H. et al. Diet and the evolution of human amylase gene copy number variation. Nat. Genet. 39, 1256–1260 (2007).
- Johnson, J. S. et al. 11beta-hydroxysteroid dehydrogenase-1 deficiency alters the gut microbiome response to Western diet. J. Endocrinol. 232, 273–283 (2017).
- Ruan, J. W. et al. Dual-specificity phosphatase 6 deficiency regulates gut microbiome and transcriptome response against diet-induced obesity in mice. Nat. Microbiol. 2, 16220 (2016).
- Goodrich, J. K. et al. Genetic determinants of the gut microbiome in UK twins. Cell Host Microbe 19, 731–743 (2016).
- Ussar, S. et al. Interactions between gut microbiota, host genetics and diet modulate the predisposition to obesity and metabolic syndrome. Cell Metab. 22, 516–530 (2015).
- Rothschild, D. et al. Environment dominates over host genetics in shaping human gut microbiota. Nature 555, 210–215 (2018).
- Koh, A., De Vadder, F., Kovatcheva-Datchary, P. & Backhed, F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell 165, 1332–1345 (2016). This work provides two mechanisms for SCFAs to activate intestinal gluconeogenesis either directly or through a gut–brain neural circuit.
- Byndloss, M. X. et al. Microbiota-activated PPAR-gamma signaling inhibits dysbiotic Enterobacteriaceae expansion. Science 357, 570–575 (2017).
- Gao, Z. et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes 58, 1509–1517 (2009).
- Lin, H. V. et al. Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms. PLOS One 7, e35240 (2012).
- Chambers, E. S. et al. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Gut 64, 1744–1754 (2015).
- Venter, C. S., Vorster, H. H. & Cummings, J. H. Effects of dietary propionate on carbohydrate and lipid metabolism in healthy volunteers. Am. J. Gastroenterol. 85, 549–553 (1990).
- Canfora, E. E. et al. Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial. Sci. Rep. 7, 2360 (2017).
- De Vadder, F. et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits. Cell 156, 84–96 (2014).
- Frost, G. et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat. Commun. 5, 3611 (2014).
- Maslowski, K. M. et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature 461, 1282–1286 (2009).
- Singh, N. et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity 40, 128–139 (2014).
- Macia, L. et al. Metabolite-sensing receptors GPR43 and GPR109A facilitate dietary fibre-induced gut homeostasis through regulation of the inflammasome. Nat. Commun. 6 (2015).
- Arpaia, N. et al. Metabolites produced by commensal bacteria promote peripheral regulatory T cell generation. Nature 504, 451–455 (2013). This work demonstrates how SCFAs, which are generated by the microbiota from non-digestible carbohydrates, take part in host immunomodulation.
- Furusawa, Y. et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature 504, 446–450 (2013).
- Thorburn, A. N. et al. Evidence that asthma is a developmental origin disease influenced by maternal diet and bacterial metabolites. Nat. Commun. 6, 7320 (2015).
- Trompette, A. et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat. Med.20, 159–166 (2014).
- Hryckowian, A. J. et al. Microbiota-accessible carbohydrates suppress Clostridium difficile infection in a murine model. Nat. Microbiol. 3, 662–669 (2018).
- Correa-Matos, N. J. et al. Fermentable fiber reduces recovery time and improves intestinal function in piglets following Salmonellatyphimurium infection. J. Nutr. 133, 1845–1852 (2003).
- McIntyre, A., Gibson, P. & Young, G. Butyrate production from dietary fibre and protection against large bowel cancer in a rat model. Gut 34, 386–391 (1993).
- Belcheva, A. et al. Gut microbial metabolism drives transformation of MSH2-deficient colon epithelial cells. Cell 158, 288–299 (2014).
- Siri-Tarino, P. W., Sun, Q., Hu, F. B. & Krauss, R. M. Meta-analysis of prospective cohort studies evaluating the association of saturated fat with cardiovascular disease. Am. J. Clin. Nutr. 91, 535–546 (2010).
- Mozaffarian, D. & Ludwig, D. S. The 2015 US Dietary Guidelines: lifting the ban on total dietary fat. JAMA 313, 2421–2422 (2015).
- Amar, J. et al. Energy intake is associated with endotoxemia in apparently healthy men. Am. J. Clin. Nutr. 87, 1219–1223 (2008).
- Saberi, M. et al. Hematopoietic cell-specific deletion of toll-like receptor 4 ameliorates hepatic and adipose tissue insulin resistance in high-fat-fed mice. Cell Metab. 10, 419–429 (2009).
- Cani, P. D. et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet–induced obesity and diabetes in mice. Diabetes 57, 1470–1481 (2008). This work shows for the first time that gut microbiota alterations can modulate HFD-induced metabolic endotoxaemia and its deleterious effects on the host.
- Caesar, R., Tremaroli, V., Kovatcheva-Datchary, P., Cani, P. D. & Backhed, F. Crosstalk between gut microbiota and dietary lipids aggravates WAT inflammation through TLR signaling. Cell Metab.22, 658–668 (2015).
- Fava, F. et al. The type and quantity of dietary fat and carbohydrate alter faecal microbiome and short-chain fatty acid excretion in a metabolic syndrome ‘at-risk’ population. Int. J. Obes.37, 216–223 (2013).
- Cheng, L. et al. High fat diet exacerbates dextran sulfate sodium induced colitis through disturbing mucosal dendritic cell homeostasis. Int. Immunopharmacol. 40, 1–10 (2016).
- Klebanoff, C. A. et al. Retinoic acid controls the homeostasis of pre-cDC-derived splenic and intestinal dendritic cells. J. Exp. Med. 210, 1961–1976 (2013).
- Devkota, S. et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10−/− mice. Nature 487, 104–108 (2012).
- Turnbaugh, P. J. et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 444, 1027–1131 (2006). This landmark study suggested for the first time that the microbiota of obese mice fed an HFD can harvest more energy from food; thus, this trait can be transmissible to other mice by microbiota transplantation.
- Schwiertz, A. et al. Microbiota and SCFA in lean and overweight healthy subjects. Obesity 18, 190–195 (2010).
- Murphy, E. et al. Composition and energy harvesting capacity of the gut microbiota: relationship to diet, obesity and time in mouse models. Gut 59, 1635–1642 (2010).
- Du, H. et al. Dietary fiber and subsequent changes in body weight and waist circumference in European men and women. Am. J. Clin. Nutr. 91, 329–336 (2009).
- den Besten, G. et al. Short-chain fatty acids protect against high-fat diet–induced obesity via a PPARγ-dependent switch from lipogenesis to fat oxidation. Diabetes 64, 2398–2408 (2015).
- Perry, R. J. et al. Acetate mediates a microbiome–brain–β-cell axis to promote metabolic syndrome. Nature 534, 213–217 (2016).
- Haghikia, A. et al. Dietary fatty acids directly impact central nervous system autoimmunity via the small intestine. Immunity43, 817–829 (2015).
- Lukens, J. R. et al. Dietary modulation of the microbiome affects autoinflammatory disease. Nature 516, 246–249 (2014).
- Koeth, R. A. et al. Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat. Med. 19, 576–585 (2013). This work presents a causative link between red meat consumption, its microbiota-derived metabolites and host-derived formation of atherogenic end products.
- Zhu, W. et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk. Cell 165, 111–124 (2016).
- Butler, L. M. et al. Heterocyclic amines, meat intake, and association with colon cancer in a population-based study. Am. J. Epidemiol. 157, 434–445 (2003).
- Bouvard, V. et al. Carcinogenicity of consumption of red and processed meat. Lancet Oncol. 16, 1599–1600 (2015).
- Zsivkovits, M. et al. Prevention of heterocyclic amine-induced DNA damage in colon and liver of rats by different lactobacillus strains. Carcinogenesis 24, 1913–1918 (2003).
- Ijssennagger, N. et al. Gut microbiota facilitates dietary heme-induced epithelial hyperproliferation by opening the mucus barrier in colon. Proc. Natl Acad. Sci. USA 112, 10038–10043 (2015).
- Hullar, M. A., Burnett-Hartman, A. N. & Lampe, J. W. Gut microbes, diet, and cancer. Cancer Treatment Res. 159, 377–399 (2014).
- Massey, R., Key, P., Mallett, A. & Rowland, I. An investigation of the endogenous formation of apparent total N-nitroso compounds in conventional microflora and germ-free rats. Food Chem. Toxicol.26, 595–600 (1988).
- FDA. Food additives and ingredients. Food and Drug Agencyhttps://www.fda.gov/Food/IngredientsPackagingLabeling/FoodAdditivesIngredients/default.htm (2018).
- Chassaing, B., Van de Wiele, T., De Bodt, J., Marzorati, M. & Gewirtz, A. T. Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. Gut 66, 1414–1427 (2017).
- Tang, W. W. et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk. N. Engl. J. Med. 368, 1575–1584 (2013).
- Suez, J., Korem, T., Zilberman-Schapira, G., Segal, E. & Elinav, E. Non-caloric artificial sweeteners and the microbiome: findings and challenges. Gut Microbes 6, 149–155 (2015).
- Suez, J. et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature 514, 181–186 (2014).
- Bian, X. et al. Saccharin induced liver inflammation in mice by altering the gut microbiota and its metabolic functions. Food Chem. Toxicol. 107, 530–539 (2017).
- Labrecque, M. T., Malone, D., Caldwell, K. E. & Allan, A. M. Impact of ethanol and saccharin on fecal microbiome in pregnant and non-pregnant mice. J. Pregnancy Child Health 2, 193 (2015).
- Abou-Donia, M. B., El-Masry, E. M., Abdel-Rahman, A. A., McLendon, R. E. & Schiffman, S. S. Splenda alters gut microflora and increases intestinal p-glycoprotein and cytochrome p-450 in male rats. J. Toxicol. Environ. Health, Part A 71, 1415–1429 (2008).
- Uebanso, T. et al. Effects of low-dose non-caloric sweetener consumption on gut microbiota in mice. Nutrients 9, 560 (2017).
- Palmnäs, M. S. A. et al. Low-dose aspartame consumption differentially affects gut microbiota-host metabolic interactions in the diet-induced obese rat. PLOS One 9, e109841 (2014).
- Gul, S. S. et al. Inhibition of the gut enzyme intestinal alkaline phosphatase may explain how aspartame promotes glucose intolerance and obesity in mice. Appl. Physiol., Nutr., Metab. 42, 77–83 (2016).
- Drasar, B., Renwick, A. & Williams, R. The role of the gut flora in the metabolism of cyclamate. Biochem. J. 129, 881–890 (1972).
- Chi, L. et al. Effects of the artificial sweetener neotame on the gut microbiome and fecal metabolites in mice. Molecules (Basel, Switzerland) 23, 367 (2018).
- Bian, X. et al. The artificial sweetener acesulfame potassium affects the gut microbiome and body weight gain in CD-1 mice. PLOS One 12, e0178426 (2017).
- Fischbach, M. A., Lin, H., Liu, D. R. & Walsh, C. T. How pathogenic bacteria evade mammalian sabotage in the battle for iron. Nat. Chem. Biol. 2, 132–138 (2006).
- Juttukonda, L. J. et al. Dietary manganese promotes staphylococcal infection of the heart. Cell Host Microbe 22, 531–542 (2017).
- Roopchand, D. E. et al. Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet–induced metabolic syndrome. Diabetes 64, 2847–2858 (2015).
- Cassidy, A. & Minihane, A.-M. The role of metabolism (and the microbiome) in defining the clinical efficacy of dietary flavonoids. Am. J. Clin. Nutr. 105, 10–22 (2017).
- Laparra, J. M. & Sanz, Y. Interactions of gut microbiota with functional food components and nutraceuticals. Pharmacol. Res.61, 219–225 (2010).
- Couteau, D., McCartney, A., Gibson, G., Williamson, G. & Faulds, C. Isolation and characterization of human colonic bacteria able to hydrolyse chlorogenic acid. J. Appl. Microbiol. 90, 873–881 (2001).
- Stewart, C. S., Duncan, S. H. & Cave, D. R. Oxalobacter formigenesand its role in oxalate metabolism in the human gut. FEMS Microbiol. Lett. 230, 1–7 (2004).
- Chen, J. P., Chen, G. C., Wang, X. P., Qin, L. & Bai, Y. Dietary fiber and metabolic syndrome: a meta-analysis and review of related mechanisms. Nutrients 10, 24 (2018).
- Elinav, E. et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell 145, 745–757 (2011).
- Lucke, K., Miehlke, S., Jacobs, E. & Schuppler, M. Prevalence of Bacteroides & Prevotella spp. in ulcerative colitis. J. Med. Microbiol.55, 617–624 (2006).
- Scher, J. U. et al. Expansion of intestinal Prevotella copricorrelates with enhanced susceptibility to arthritis. eLife 2, e01202 (2013).
- Everard, A. et al. Cross-talk between Akkermansia muciniphilaand intestinal epithelium controls diet-induced obesity. Proc. Natl Acad. Sci. USA 110, 9066–9071 (2013).
- Plovier, H. et al. A purified membrane protein from Akkermansia muciniphila or the pasteurized bacterium improves metabolism in obese and diabetic mice. Nat. Med. 23, 107–113 (2017).
- Seregin, S. S. et al. NLRP6 protects Il10−/− mice from colitis by limiting colonization of Akkermansia muciniphila. Cell Rep. 19, 733–745 (2017).
- Ley, R. E., Turnbaugh, P. J., Klein, S. & Gordon, J. I. Microbial ecology: human gut microbes associated with obesity. Nature444, 1022–1023 (2006).
- Turnbaugh, P. J. et al. A core gut microbiome in obese and lean twins. Nature 457, 480–484 (2008).
- Verdam, F. J. et al. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity. Obesity 21, E607–E615 (2013).
- Duncan, S. H. et al. Human colonic microbiota associated with diet, obesity and weight loss. Int. J. Obes. 32, 1720–1724 (2008).
- Patil, D. P. et al. Molecular analysis of gut microbiota in obesity among Indian individuals. J. Biosci. 37, 647–657 (2012).
- Tims, S. et al. Microbiota conservation and BMI signatures in adult monozygotic twins. ISME J. 7, 707 (2013).
- Butzner, J., Parmar, R., Bell, C. & Dalal, V. Butyrate enema therapy stimulates mucosal repair in experimental colitis in the rat. Gut38, 568–573 (1996).
- Kreznar, J. H. et al. Host genotype and gut microbiome modulate insulin secretion and diet-induced metabolic phenotypes. Cell Rep. 18, 1739–1750 (2017).
- Gibson, G. R. & Roberfroid, M. B. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J. Nutr.125, 1401–1412 (1995).
- Meyer, D. & Stasse-Wolthuis, M. The bifidogenic effect of inulin and oligofructose and its consequences for gut health. Eur. J. Clin. Nutr. 63, 1277 (2009).
- Heilpern, D. & Szilagyi, A. Manipulation of intestinal microbial flora for therapeutic benefit in inflammatory bowel diseases: review of clinical trials of probiotics, prebiotics and synbiotics. Rev. Recent Clin. Trials 3, 167–184 (2008).
- Arslanoglu, S. et al. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life. J. Nutr. 138, 1091–1095 (2008).
- Vulevic, J., Juric, A., Tzortzis, G. & Gibson, G. R. A mixture of trans-galactooligosaccharides reduces markers of metabolic syndrome and modulates the fecal microbiota and immune function of overweight adults. J. Nutr. 143, 324–331 (2013).
- Arslanoglu, S., Moro, G. E. & Boehm, G. Early supplementation of prebiotic oligosaccharides protects formula-fed infants against infections during the first 6 months of life. J. Nutr. 137, 2420–2424 (2007).
- Cummings, J., Christie, S. & Cole, T. A study of fructo oligosaccharides in the prevention of travellers’ diarrhoea. Aliment. Pharmacol. Ther. 15, 1139–1145 (2001).
- Davis, L. M., Martínez, I., Walter, J., Goin, C. & Hutkins, R. W. Barcoded pyrosequencing reveals that consumption of galactooligosaccharides results in a highly specific bifidogenic response in humans. PLOS One 6, e25200 (2011).
- Kolida, S., Meyer, D. & Gibson, G. A double-blind placebo-controlled study to establish the bifidogenic dose of inulin in healthy humans. Eur. J. Clin. Nutr. 61, 1189 (2007).
- De Preter, V. et al. Baseline microbiota activity and initial bifidobacteria counts influence responses to prebiotic dosing in healthy subjects. Aliment. Pharmacol. Ther. 27, 504–513 (2008).
- Langlands, S., Hopkins, M., Coleman, N. & Cummings, J. Prebiotic carbohydrates modify the mucosa associated microflora of the human large bowel. Gut 53, 1610–1616 (2004).
- Martínez, I. et al. Gut microbiome composition is linked to whole grain-induced immunological improvements. ISME J. 7, 269 (2013).
- Henning, S. M. et al. Health benefit of vegetable/fruit juice-based diet: role of microbiome. Sci. Rep. 7, 2167 (2017).
- Moran-Ramos, S. et al. Nopal feeding reduces adiposity, intestinal inflammation and shifts the cecal microbiota and metabolism in high-fat fed rats. PLOS One 12, e0171672 (2017).
- Everard, A. et al. Responses of gut microbiota and glucose and lipid metabolism to prebiotics in genetic obese and diet-induced leptin-resistant mice. Diabetes 60, 2775–2786 (2011).
- Cani, P. D. et al. Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia. Diabetologia 50, 2374–2383 (2007).
- Serino, M. et al. Metabolic adaptation to a high-fat diet is associated with a change in the gut microbiota. Gut 61, 543–553 (2012).
- Chaplin, A., Parra, P., Serra, F. & Palou, A. Conjugated linoleic acid supplementation under a high-fat diet modulates stomach protein expression and intestinal microbiota in adult mice. PLOS One 10, e0125091 (2015).
- Norris, G. H., Jiang, C., Ryan, J., Porter, C. M. & Blesso, C. N. Milk sphingomyelin improves lipid metabolism and alters gut microbiota in high fat diet-fed mice. J. Nutr. Biochem. 30, 93–101 (2016).
- Shin, N.-R. et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut 63, 727–735 (2014).
- de la Cuesta-Zuluaga, J. et al. Metformin is associated with higher relative abundance of mucin-degrading Akkermansia muciniphilaand several short-chain fatty acid-producing microbiota in the gut. Diabetes Care 40, 54–62 (2017).
- Gibson, G. R. et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 14, 491–502 (2017).
- Chen, M. et al. Dairy consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. BMC Med. 12, 215 (2014).
- Fukuda, S. et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 469, 543 (2011).
- D’souza, A. L., Rajkumar, C., Cooke, J. & Bulpitt, C. J. Probiotics in prevention of antibiotic associated diarrhoea: meta-analysis. BMJ324, 1361 (2002).
- Bibiloni, R. et al. VSL# 3 probiotic-mixture induces remission in patients with active ulcerative colitis. Am. J. Gastroenterol. 100, 1539 (2005).
- Allen, S. J. et al. Lactobacilli and bifidobacteria in the prevention of antibiotic-associated diarrhoea and Clostridium difficilediarrhoea in older inpatients (PLACIDE): a randomised, double-blind, placebo-controlled, multicentre trial. Lancet 382, 1249–1257 (2013).
- Azad, M. B. et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze: systematic review and meta-analysis. BMJ 347, f6471 (2013).
- Marteau, P. et al. Ineffectiveness of Lactobacillus johnsonii LA1 for prophylaxis of postoperative recurrence in Crohn’s disease: a randomised, double blind, placebo controlled GETAID trial. Gut55, 842–847 (2006).
- NCCIH. Probiotics: in depth. National Center for Complementary and Integrative Health https://nccih.nih.gov/health/probiotics/introduction.htm (2016).
- Hammerman, C., Bin-Nun, A. & Kaplan, M. Safety of probiotics: comparison of two popular strains. BMJ 333, 1006 (2006).
- Liu, R. et al. Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention. Nat. Med. 23, 859 (2017).
- Canani, R. B. et al. Probiotics for treatment of acute diarrhoea in children: randomised clinical trial of five different preparations. BMJ 335, 340 (2007).
- Mobini, R. et al. Metabolic effects of Lactobacillus reuteri DSM 17938 in people with type 2 diabetes: a randomized controlled trial. Diabetes, Obes. Metab. 19, 579–589 (2017).
- Faith, J. J., McNulty, N. P., Rey, F. E. & Gordon, J. I. Predicting a human gut microbiota’s response to diet in gnotobiotic mice. Science 333, 101–104 (2011).
- Spencer, M. D. et al. Association between composition of the human gastrointestinal microbiome and development of fatty liver with choline deficiency. Gastroenterology 140, 976–986 (2011).
- Zeevi, D. et al. Personalized nutrition by prediction of glycemic responses. Cell 163, 1079–1094 (2015). This paper highlights interindividual differences among humans, including microbiota composition and function, as drivers of variability in postprandial glycaemic responses to food items and suggests that diets should be tailor-made in order to better control blood glucose levels.
- Pasquale, T. R. & Tan, J. S. Nonantimicrobial effects of antibacterial agents. Clin. Infect. Dis. 40, 127–135 (2005).
- McDonald, J. A. et al. Simulating distal gut mucosal and luminal communities using packed-column biofilm reactors and an in vitro chemostat model. J. Microbiol. Methods 108, 36–44 (2015).
- Lukovac, S. et al. Differential modulation by Akkermansia muciniphila and Faecalibacterium prausnitzii of host peripheral lipid metabolism and histone acetylation in mouse gut organoids. mBio 5, e01438–14 (2014).
- Yissachar, N. et al. An intestinal organ culture system uncovers a role for the nervous system in microbe-immune crosstalk. Cell168, 1135–1148 (2017).
- Warden, C. H. & Fisler, J. S. Comparisons of diets used in animal models of high-fat feeding. Cell Metab. 7, 277 (2008).
- Adam, C. L. et al. Effects of dietary fibre (pectin) and/or increased protein (casein or pea) on satiety, body weight, adiposity and caecal fermentation in high fat diet-induced obese rats. PLOS One 11, e0155871 (2016).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A. & Raes, J. How informative is the mouse for human gut microbiota research? Dis. Models Mechanisms 8, 1–16 (2015).
- Ridaura, V. K. et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 341, 1241214 (2013). This pioneering work shows that gut microbiota transfer from human twin pairs discordant for obesity is able to transmit the metabolic phenotype into GF mice and that this phenotype can be attributed to certain members of the microbiota.
- Hildebrand, F. et al. Inflammation-associated enterotypes, host genotype, cage and inter-individual effects drive gut microbiota variation in common laboratory mice. Genome Biol. 14, R4 (2013).
- Al-Asmakh, M. & Zadjali, F. Use of germ-free animal models in microbiota-related research. J. Microbiol. Biotechnol. 25, 1583–1588 (2015).
- Round, J. L. & Mazmanian, S. K. The gut microbiota shapes intestinal immune responses during health and disease. Nat. Rev. Immunol. 9, 313 (2009).
- Choo, J. M., Leong, L. E. & Rogers, G. B. Sample storage conditions significantly influence faecal microbiome profiles. Sci. Rep. 5, 16350 (2015).
- Costea, P. I. et al. Towards standards for human fecal sample processing in metagenomic studies. Nat. Biotechnol. 35, 1069 (2017).
- Shah, N., Tang, H., Doak, T. G. & Ye, Y. in Biocomputing 2011, 165–176 (World Scientific, 2011).
- Claesson, M. J. et al. Comparison of two next-generation sequencing technologies for resolving highly complex microbiota composition using tandem variable 16S rRNA gene regions. Nucleic Acids Res. 38, e200 (2010).
- Gohl, D. M. et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nat. Biotechnol. 34, 942 (2016).
- de la Cuesta-Zuluaga, J. & Escobar, J. S. Considerations for optimizing microbiome analysis using a marker gene. Front. Nutr.3, 26 (2016).
- Segata, N. et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nat. Methods 9, 811 (2012).
- Mandal, S. et al. Analysis of composition of microbiomes: a novel method for studying microbial composition. Microb. Ecol. Health Dis. 26, 27663 (2015).
- Vandeputte, D. et al. Quantitative microbiome profiling links gut community variation to microbial load. Nature 551, 507–511 (2017).
- Kumar, S., Indugu, N., Vecchiarelli, B. & Pitta, D. W. Associative patterns among anaerobic fungi, methanogenic archaea, and bacterial communities in response to changes in diet and age in the rumen of dairy cows. Front. Microbiol. 6, 781 (2015).
- Salgado-Flores, A. et al. Rumen and cecum microbiomes in reindeer (Rangifer tarandus tarandus) are changed in response to a lichen diet and may affect enteric methane emissions. PLOS One 11, e0155213 (2016).
- Hoffmann, C. et al. Archaea and fungi of the human gut microbiome: correlations with diet and bacterial residents. PLOS One 8, e66019 (2013).
- Cuskin, F. et al. Human gut Bacteroidetes can utilize yeast mannan through a selfish mechanism. Nature 517, 165 (2015).
- Reyes, A. et al. Viruses in the faecal microbiota of monozygotic twins and their mothers. Nature 466, 334 (2010).
- Minot, S. et al. The human gut virome: inter-individual variation and dynamic response to diet. Genome Res. 21, 1616–1625 (2011).
- Kim, M. S. & Bae, J. W. Spatial disturbances in altered mucosal and luminal gut viromes of diet-induced obese mice. Environ. Microbiol. 18, 1498–1510 (2016).
- Beck, M. A., Shi, Q., Morris, V. C. & Levander, O. A. Rapid genomic evolution of a non-virulent coxsackievirus B3 in selenium-deficient mice results in selection of identical virulent isolates. Nat. Med. 1, 433–436 (1995).
- Willner, D. et al. Metagenomic detection of phage-encoded platelet-binding factors in the human oral cavity. Proc. Natl Acad. Sci. USA 108, 4547–4553 (2011).
- Wang, X. et al. Cryptic prophages help bacteria cope with adverse environments. Nat. Commun. 1, 147 (2010).
- Freitas, C. E. S. et al. Sheep fed with banana leaf hay reduce ruminal protozoa population. Trop. Animal Health Prod. 49, 807–812 (2017).
- Yang, W. et al. Effect of Bidens pilosa on infection and drug resistance of Eimeria in chickens. Res. Veterinary Sci. 98, 74–81 (2015).
- Ferguson, A., Logan, R. & MacDonald, T. Increased mucosal damage during parasite infection in mice fed an elemental diet. Gut 21, 37–43 (1980).
- Coop, R. & Holmes, P. Nutrition and parasite interaction. Int. J. Parasitol. 26, 951–962 (1996).
- Williams, A. R. et al. Dietary cinnamaldehyde enhances acquisition of specific antibodies following helminth infection in pigs. Veterinary Immunol. Immunopathol. 189, 43–52 (2017).
- Morton, E. R. et al. Variation in rural African gut microbiota is strongly correlated with colonization by Entamoeba and subsistence. PLoS Genet. 11, e1005658 (2015).
- Nourrisson, C. et al. Blastocystis is associated with decrease of fecal microbiota protective bacteria: comparative analysis between patients with irritable bowel syndrome and control subjects. PLOS One 9, e111868 (2014).
- Wang, Y. et al. Metabonomic investigations in mice infected with Schistosoma mansoni: an approach for biomarker identification. Proc. Natl Acad. Sci. USA 101, 12676–12681 (2004).
- Kay, G. L. et al. Differences in the faecal microbiome in Schistosoma haematobium infected children versus uninfected children. PLoS Negl. Trop. Diseases 9, e0003861 (2015).
- Mansfield, L. & Urban, Jr, J. The pathogenesis of necrotic proliferative colitis in swine is linked to whipworm induced suppression of mucosal immunity to resident bacteria. Veterinary Immunol. Immunopathol. 50, 1–17 (1996).
- Cantacessi, C. et al. Impact of experimental hookworm infection on the human gut microbiota. J. Infecti. Diseases 210, 1431–1434 (2014).
- Cooper, P. et al. Patent human infections with the whipworm, Trichuris trichiura, are not associated with alterations in the faecal microbiota. PLOS One 8, e76573 (2013).
- Plieskatt, J. L. et al. Infection with the carcinogenic liver fluke Opisthorchis viverrini modifies intestinal and biliary microbiome. FASEB J. 27, 4572–4584 (2013).
- Yooseph, S. et al. Stool microbiota composition is associated with the prospective risk of Plasmodium falciparum infection. BMC Genom. 16, 631 (2015).
- Yilmaz, B. et al. Gut microbiota elicits a protective immune response against malaria transmission. Cell 159, 1277–1289 (2014).
- Villarino, N. F. et al. Composition of the gut microbiota modulates the severity of malaria. Proc. Natl Acad. Sci. USA 113, 2235–2240 (2016).
- Shukla, G., Bhatia, R. & Sharma, A. Prebiotic inulin supplementation modulates the immune response and restores gut morphology in Giardia duodenalis-infected malnourished mice. Parasitol. Res. 115, 4189–4198 (2016).
- Newbold, L. K. et al. Helminth burden and ecological factors associated with alterations in wild host gastrointestinal microbiota. ISME J. 11, 663 (2017).
- Houlden, A. et al. Chronic Trichuris muris infection in C57BL/6 mice causes significant changes in host microbiota and metabolome: effects reversed by pathogen clearance. PLOS One10, e0125945 (2015).
- Li, R. W. et al. The effect of helminth infection on the microbial composition and structure of the caprine abomasal microbiome. Sci. Rep. 6, 20606 (2016).
- Wu, S. et al. Worm burden-dependent disruption of the porcine colon microbiota by Trichuris suis infection. PLOS One 7, e35470 (2012).
- Rutter, J. & Beer, R. Synergism between Trichuris suis and the microbial flora of the large intestine causing dysentery in pigs. Infection Immun. 11, 395–404 (1975).
- Zaiss, M. M. et al. The intestinal microbiota contributes to the ability of helminths to modulate allergic inflammation. Immunity43, 998–1010 (2015).
- Chen, Y. et al. Association of previous schistosome infection with diabetes and metabolic syndrome: a cross-sectional study in rural China. J. Clin. Endocrinol. Metab. 98, E283–E287 (2013).
- Aravindhan, V. et al. Decreased prevalence of lymphatic filariasis among diabetic subjects associated with a diminished pro-inflammatory cytokine response (CURES 83). PLoS Negl. Trop. Diseases 4, e707 (2010).
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- БИФИКАРДИО
- ПРОБИОТИКИ С ПНЖК
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА ЖКТ
- ДИСБИОЗ КИШЕЧНИКА
- МИКРОБИОМ и ВЗК
- МИКРОБИОМ И РАК
- МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
- МИКРОБИОМ И ПЕЧЕНЬ
- МИКРОБИОМ И ПОЧКИ
- МИКРОБИОМ И ЛЕГКИЕ
- МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
- МИКРОБИОМ И КОСТИ
- МИКРОБИОМ И ОЖИРЕНИЕ
- МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
- МИКРОБИОМ И ФУНКЦИИ МОЗГА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОБИОМ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- КОРОТКОЦЕПОЧЕЧНЫЕ ЖИРНЫЕ КИСЛОТЫ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- МИКРОБИОМ И ПРЕЦИЗИОННОЕ ПИТАНИЕ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ