Как грамотно восстановить микрофлору кишечника
Кишечник человека содержит миллионы бактерий. Но не все из них являются полезными. В кишечнике иногда обитают вредоносные микроорганизмы, вызывающие различные заболевания. Что вызывает рост вредных бактерий, и как же восстановить нормальную микрофлору, поговорим далее.
Содержание:
-
Важность восстановления микрофлоры
-
Как восстановить микрофлору
Важность восстановления микрофлоры
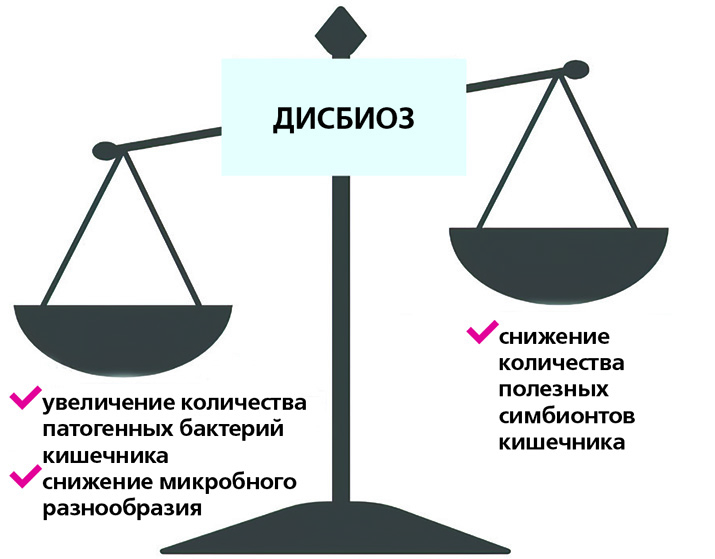
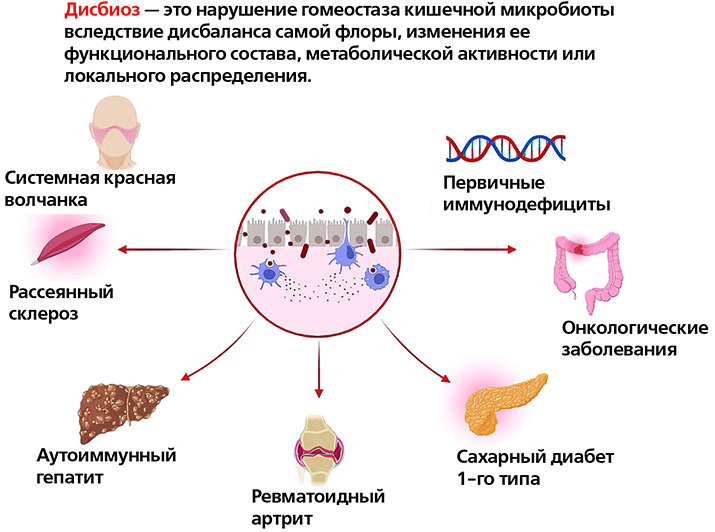
Нормальная кишечная микрофлора – это баланс полезных и вредных бактерий, населяющих кишечник человека. Если преобладают вредные, а полезные находятся в меньшинстве, такое состояние называется дисбалансом микрофлоры и требует коррекции. Этим занимаются врачи-гастроэнтерологи.
Они рекомендуют сдать анализ кала на дисбактериоз и бактериальный посев при заметных нарушениях в работе кишечника (вздутие, понос, тошнота, запор, боли и т.д.).
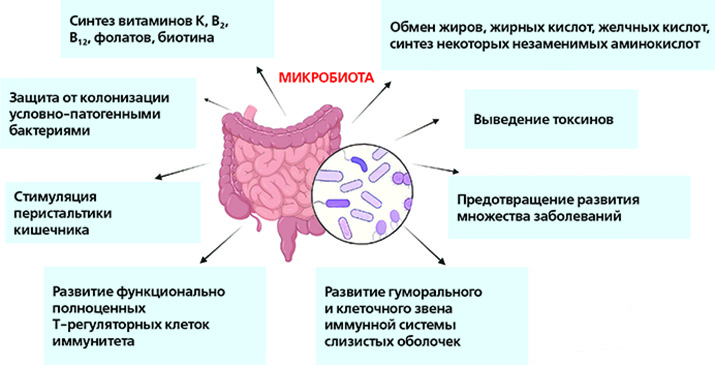
По результатам анализов назначается соответствующее лечение, после которого микрофлора нормализуются, самочувствие человека улучшается. Нормальная микрофлора кишечника важна для выработки необходимых витаминов, укрепления иммунитета и защиты от различных болезней.
Различные факторы могут ухудшать состояние микрофлоры кишечника, это:
-
прием антибиотиков и НПВС;
-
увлечение западной диетой (с наличием фастфудов);
-
недостаточность клетчатки в рационе;
-
прием обезболивающих средств;
-
лечение ингибиторами протонного насоса;
-
применение блокаторов Н2- гистаминовых рецепторов.
Некоторые врачи считают, что среда кишечника не должна быть стерильной. Но вредные бактерии должны составлять не более 15 процентов всей микрофлоры. Только тогда дисбаланс сохранится.
Микрофлора может меняться в зависимости от возраста, настроения, самочувствия человека, климата, сезона.
Нарушение микрофлоры может вызывать следующие заболевания:
-
онкология;
-
астма;
-
колит;
-
аутизм;
-
экзема;
-
диабет;
-
ожирение;
-
рассеянный склероз;
-
заболевания сердца.
Именно поэтому мы должны заботиться о состоянии микрофлоры кишечника. Рассмотрим некоторые полезные советы по этому поводу.
Как восстановить микрофлору
Полноценный рацион
Человек должен за день съедать разнообразную пищу, а не скудную, состоящую в преимуществе из углеводов и жиров. Так питается большинство людей, перекусывая, за неимением времени, фастфудами, булками и т.д.. Надо включать в рацион каждый день клетчатку.
Это:
-
свежие овощи;
-
фрукты;
-
зерновой хлеб;
-
бобовые;
-
зелень;
-
орехи.
Полезен для нормализации микрофлоры православный пост. Замечено, кто соблюдает посты, меньше страдает заболеваниями кишечника, даже раком. Пост исключает животные жиры (мясо, сливочное масло, яйца) и делает акцент на свежих овощах и фруктах, ягодах, крупах.
Известно, что инулин, обладающий пребиотическим действием, находится в следующих продуктах:
-
чеснок;
-
лук;
-
лук-порей;
-
спаржа;
-
цикорий;
-
артишок.
Эти продукты помогают наладить микрофлору кишечника и победить вредные бактерии. Их обязательно необходимо включать в свой рацион, если есть проблемы с кишечником.
Источниками бифидобактерий, полезных для человека, являются:
-
яблоки;
-
черника;
-
артишок;
-
миндаль;
-
фисташки.
Они обязательно должны присутствовать на столе как можно чаще.
Ферментирование продуктов
Полезно есть ферментированные, т.е. квашеные продукты. В результате процесса квашения простые продукты становятся фантастически полезными, потому что изменяют свой состав благодаря бактериям. Они помогают восстановить микрофлору кишечника.
Самые распространенные квашеные продукты:
-
квашеная капуста;
-
кефир;
-
йогурт;
-
чайный гриб.
У некоторых народов принято квасить овощи, даже острые. Такое блюдо из квашеных острых овощей называется «кимчхи». Квашеные соевые бобы называются «темпе».
Молочные квашеные продукты имеют в составе лактобактерии, так необходимые для нормальной микрофлоры. Людям, страдающим заболеванием почек, они просто необходимы, т.к. при таких болезнях нарушается микрофлора.
Искусственные подсластители — вред
Заместители сахара (аспартам, сахарин) являются вредными продуктами. Они действуют разрушительно на микрофлору кишечника. Кроме того, они повышают уровень глюкозы в крови. Поэтому их надо исключить из рациона.
Больше пребиотиков
Пребиотики содержат полезные бактерии, которые помогают выселять вредные, попадая в кишечник человека. Они находятся в овощах, фруктах, бобовых, зерновых. Их надо есть как можно чаще. Они также понижают уровень триглицеридов, холестерина, инсулина в организме. Значит пребиотики снижают риск сердечно-сосудистых заболеваний, смерти от инфаркта, инсульта.
Цельные зерна
Польза цельных зерен в том, что они содержат клетчатку и неперевариваемые углеводы, которые не усваиваются в тонком кишечнике, а поступают в толстый. Там они расщепляются и вызывают рост полезных бактерий.
Цельные зерна содержат:
-
витамины группы В;
-
железо;
-
цинк;
-
белки;
-
углеводы.
Они продаются в целом виде, а также из них изготовляется цельнозерновой хлеб. Также из них изготовляется цельная пшеничная мука.
Искусственные пробиотики
Насчет препаратов-пробиотиков ведутся споры. Есть сведения о некоторой пользе, которую оказывают такие препараты. Но она полностью не доказана. Тем более, что среди препаратов немало подделок. Надо осторожнее выбирать пробиотики, руководствуясь рекомендациями врача. Рекомендуем обратить внимание на Максилак.
Остальные советы
Есть еще несколько советов для нормализации микрофлоры:
-
Надо меньше перекусывать, чтобы дать возможность кишечнику восстановиться.
-
При возможности голодать, именно в таком состоянии кишечник сам нормализует микрофлору.
-
Работайте в огороде. Замечено, что у людей, живущих на свежем воздухе и ведущим активный образ жизни, микрофлора богаче.
-
Заведите собаку. Доказано, что те, у кого есть собаки дома, легче справляются с вредными бактериями.
-
Меньше употреблять антибиотики.
-
Больше двигаться и пить чистой воды.
У каждого человека организм индивидуален, поэтому каждый может знать свои способы нормализации микрофлоры.
Статья на конкурс «био/мол/текст»: Микробиом человеческого кишечника представляет собой уникальную совокупность микроорганизмов. Его незримое присутствие опосредует целый ряд важных процессов: от метаболических и иммунных до когнитивных, а отклонение его состава от нормы приводит к развитию разнообразных патологических состояний: аллергических и аутоиммунных заболеваний, сахарного диабета, ожирения и др. Качественный и количественный состав микробиома, от которого во многом зависит будущее здоровье человека, определяется во младенчестве. Процессам его формирования и будет посвящена эта статья.
В настоящее время понятие «микрофлора человека» утратило свою актуальность: мы несем в своем организме не просто набор бактерий, а настоящий биом — микробиом . Но если биом с точки зрения экологов представляет собой крупную экосистему, то наше тело — это место обитания многочисленной популяции микроорганизмов, своего рода микробная экосистема, характеризующаяся своей генетической регуляцией и сложными взаимодействиями и реагирующая на влияние факторов внешней и внутренней среды. Она настолько уникальна, что в мире не найдется двух людей с идентичным микробиомом. Различия в микробном составе зависят от таких факторов среды, как набор питательных веществ, рН, влажность и температура. Те или иные их значения способствуют размножению бактерий и опосредуют пользу, которую они могут принести хозяину — человеку [1], [2].
Утрачивает актуальность оно еще и потому, что современный уровень знаний позволяет выражаться более корректно, и всё чаще «микрофлору» заменяют термином «микробиота» (наряду с «микробиомом»), подчеркивая, что бактерии и грибы (ну и вирусы с простейшими тоже) никак к «флоре», то есть миру растений, не относятся. Однако многие микробиологи «микрофлору» спокойно помещают в научные статьи и не кидаются друг в друга тухлыми помидорами: ничего особо ужасного в этом традиционном термине нет. — Ред.
Микробиом распределен в нашем организме неравномерно, по его топографии и видовому составу принято различать микробиом кожи, полости рта, дыхательных путей, урогенитального тракта и кишечника. Наиболее крупным микробиомом нашего тела является, несомненно, кишечный. Он может состоять из сотен видов различных микроорганизмов, но у взрослого человека преобладают бактерии двух типов: Firmicutes и Bacteroidetes [3]. Кишечный микробиом изучен лучше других бактериальных сообществ человека, и многолетние исследования, о которых будет рассказано ниже, показали, что именно он в большей степени влияет на здоровье своего носителя. Давайте же совершим путешествие в прошлое и разберем, как формируется микробиом нашего кишечника.
Микробиом: начало
Еще до недавнего времени считалось, что плод в утробе матери полностью огражден от контакта с миром микроорганизмов, то есть человек рождается полностью стерильным, а его заселение бактериями происходит позже. Но появились данные о том, что первые колонизаторы осваивают организм человека еще до его рождения. В ряде исследований было выявлено, что в плаценте, околоплодных водах, пуповинной крови и первичном кале — меконии — присутствуют бактерии родов Enterococcus, Escherichia, Leuconostoc, Lactococcus и Streptococcus, а у недоношенных младенцев — следы Enterobacter, Enterococcus (в меньшей степени, чем у доношенных), Lactobacillus, Photorhabdus и Tannerella [4–14]. Также в одной из работ были получены доказательства внутриутробной бактериальной транслокации — проникновения бактерий из кишечника матери к плоду [13]. Исследователи предполагают, что это происходит посредством кровотока: механизмом, сходным с «энтеромаммарной осью», о которой поговорим чуть позже. Эту гипотезу поддерживают данные другого эксперимента, в котором беременные мыши перорально получали меченых Enterococcus faecium, после чего эти бактерии «заявляли о себе» в плаценте и даже меконии еще не рожденных мышат [13].
Но всё же по-настоящему серьезный контакт с миром микроорганизмов происходит после рождения, и во многом от того, как пройдет эта встреча, зависит будущее здоровье человека. Колонизация кишечника у здоровых детей укладывается в четыре последовательные временны́е фазы. Первая длится от момента рождения до двух недель. Микробная популяция в этот период представлена в основном стрептококками и кишечной палочкой. В зависимости от вида вскармливания — грудного или искусственного — через некоторое время присоединяются бифидо- или лактобактерии соответственно. В небольших количествах обнаруживаются и представители родов Clostridium и Bacteroides. Через две недели начинается вторая фаза, которая продолжается до введения в рацион прикорма. В это время увеличивается численность представителей рода Bacteroides. С момента введения прикорма начинается третья фаза, длящаяся до завершения грудного вскармливания. В эту фазу окончательно формируется микробиом ребенка: постепенно, по мере увеличения в рационе доли твердой пищи и снижения доли грудного молока, растет количество бактероидов и анаэробных грамположительных кокков (пептококков и пептострептококков). Окончание грудного вскармливания знаменует переход к четвертой фазе. Она характеризуется относительной стабильностью микробного состава, который сохраняется в течение всей жизни индивида [15].
А теперь рассмотрим подробнее, как протекают процессы колонизации и становления иммунного ответа во время и после рождения.
Родоразрешение
Как оказалось, даже характер родоразрешения (ребенок может появиться на свет естественным путем, а может и оперативным, с помощью кесарева сечения) влияет на состав микробиома младенца.
Первое, с чем сталкивается ребенок, — микробный мир родовых путей его матери. У небеременных женщин идентифицировано шесть видов лактобактерий, исходя из соотношения которых выделяют по крайней мере пять качественно различных типов микробиома влагалища [16]. В четырех из них — характерных, как правило, для представительниц европейских и азиатских народов — преобладают следующие представители рода Lactobacillus:
- L. crispatus (I тип микробиома);
- L. gasseri (II тип микробиома);
- L. iners (III тип микробиома);
- L. jensenii (V тип микробиома).
IV тип микробиома часто встречается у чернокожих и латиноамериканских женщин и характеризуется низким уровнем Lactobacillus spp. и большим числом анаэробных бактерий.
При беременности из-за изменения pH влагалища бактериальное разнообразие уменьшается, но повышается стабильность состава микробиоты. Как правило, в этот период в микробиоме преобладают Lactobacillus crispatus и Lactobacillus iners. Количественное превосходство этих видов подчеркивает их важность для поддержания здоровой среды родовых путей. У европейских и азиатских женщин во время беременности могут происходить сдвиги между типами микробиомов, но, как правило, они редко переходят к IV типу [18]. Таким образом, в зависимости от особенностей микробиоты влагалища матери ребенок начинает свою жизнь со «знакомства» с определенным видовым набором микроорганизмов, что подчеркивает важность исследований микробиомов различных групп населения.
Но во что же выливается это знакомство? Почему вообще заселение микробами так важно для ребенка? Дело в том, что бактерии за счет симбиотических взаимоотношений с эпителиальными и иммунными структурами кишечника фактически активируют иммунную систему хозяина (рис. 1) [21].
Покидая родовые пути естественным образом, доношенный новорожденный в небольших количествах заглатывает представителей вагинальной и кишечной микробиоты матери. В основном это бактерии родов Prevotella, Sneathia и Lactobacillus [15]. Если же родоразрешение происходит путем кесарева сечения, одними из первых колонизируют организм новорожденного представители кожных микробиомов матери и медицинского персонала, в основном — бактерии родов Propionibacterium, Corynebacterium и Streptococcus [19], [20]. У таких младенцев отмечают замедление заселения кишечника филой Bacteroidetes и низкое бактериальное разнообразие в течение первых двух лет жизни [22]. Однако с четырех месяцев различия в бактериальном разнообразии с естественно рожденными детьми начинают стираться, и к 12 месяцам практически исчезают [19].
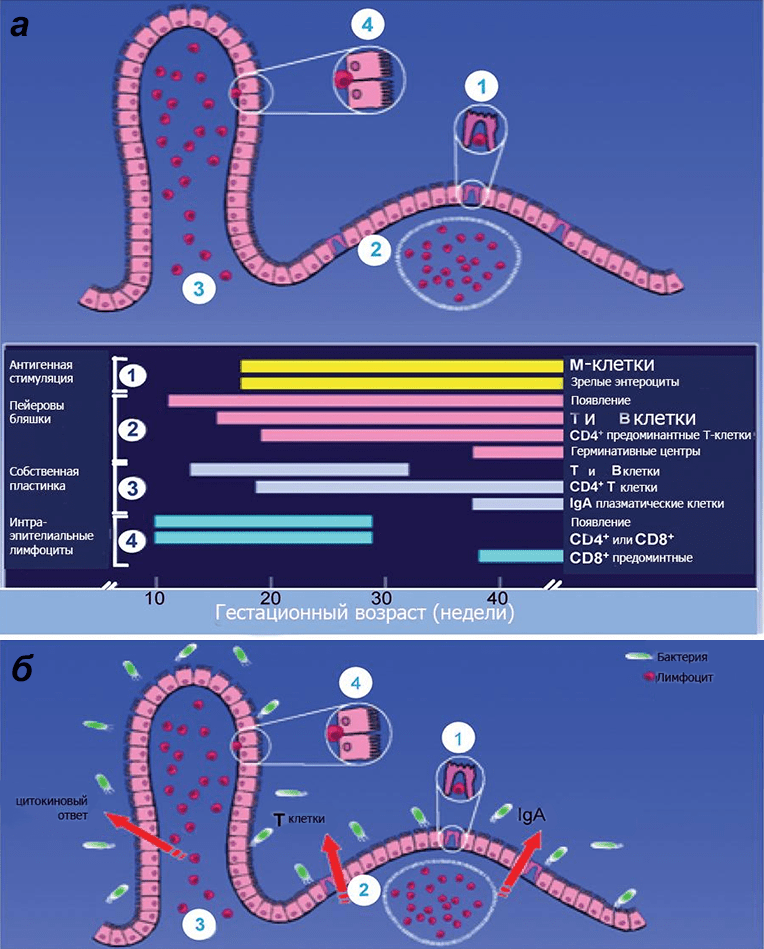
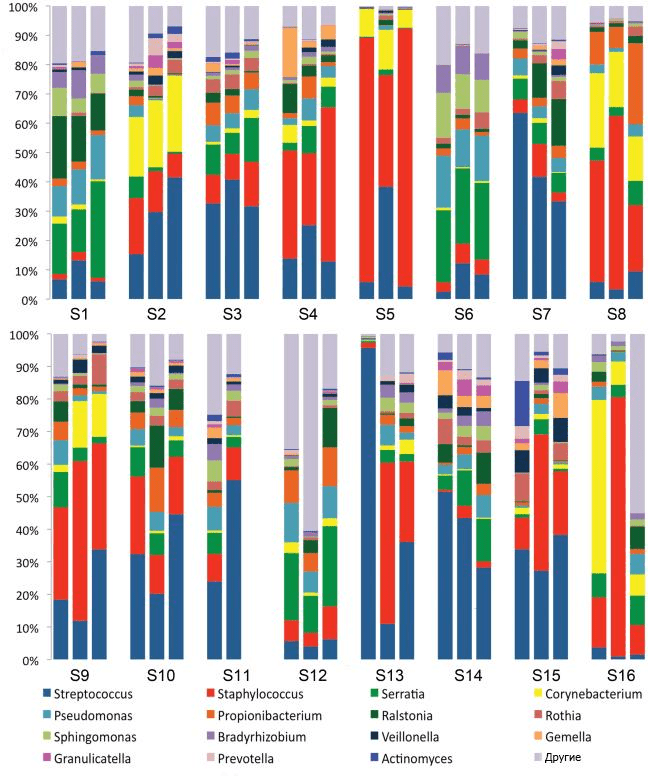
Рисунок 1. Схема иммунной защиты слизистой оболочки кишечника плода в зависимости от гестационного возраста. а — У младенца, рожденного в срок, все компоненты иммунной защиты слизистой оболочки являются зрелыми. б — Однако чтобы иммунная система приобрела работоспособность, должна произойти ее стимуляция первичными колонизаторами. Иммунная защита кишечника включает в себя: специализированный эпителий, или М-клетки (1), пейеровы бляшки (2), интерстициальные (3) и интраэпителиальные (4) лимфоциты, опосредующие развитие иммунных реакций. Среди лимфоидных образований кишечника выделяют одиночные лимфатические узлы (расположены преимущественно в дистальных отделах кишечника) и пейеровы бляшки (расположены в основном в подвздошной кишке). Последние образованы сгруппированными лимфатическими фолликулами, выпячивающими эпителий в просвет кишки в виде купола, и межузелковыми скоплениями лимфоидной ткани. Эпителий слизистой оболочки в области бляшки содержит до 10% специфических микроскладчатых (М-) клеток, обеспечивающих трансэпителиальный транспорт, механизм которого — трансцитоз: благодаря тонкому гликокаликсу они активно поглощают апикальной поверхностью макромолекулы (в том числе антигены) из просвета кишки, в составе эндосом перемещают их через свою цитоплазму и посредством экзоцитоза передают иммунокомпетентным клеткам пейеровых бляшек. Для ускорения процесса М-клетки снизу образуют «карманы», заполняющиеся «иммунным винегретом» из В-клеток, плазмоцитов, Т-клеток, макрофагов и антигенпрезентирующих дендритных клеток.
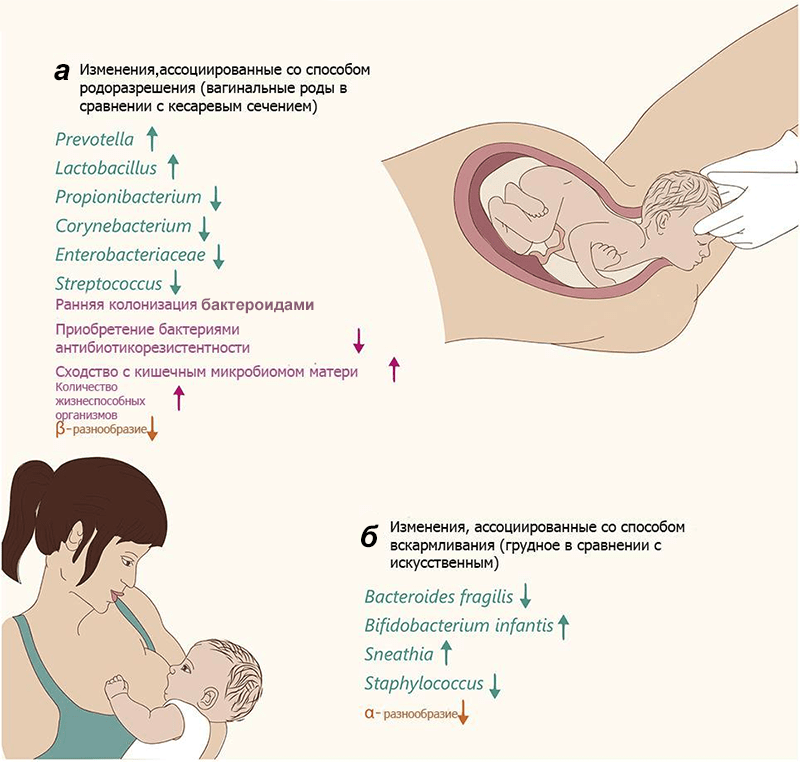
Тем не менее очевидно, что характер родоразрешения влияет на микробиом новорожденного (рис. 2). Правда, пока неясно, сказываются ли эти различия на здоровье взрослого индивида: хотя некоторые эпидемиологические исследования демонстрируют связь между кесаревым сечением и различными заболеваниями (табл. 1), причина их развития окончательно не выяснена.
Рисунок 2. Изменения микробиома у новорожденных. Цвет текста и стрелки обозначают изменения специфических разновидностей (зеленый), общие изменения (розовый) и разнообразие сообщества (оранжевый). а — Изменения у младенцев, родившихся естественным путем, относительно извлеченных хирургически. б — Изменения у младенцев, находящихся на грудном вскармливании, относительно «искусственников». α-разнообразие — видовое разнообразие внутри исследуемого сообщества, β-разнообразие — видовое разнообразие между сообществами данной области (по Р. Уиттекеру).
Грудное вскармливание
Не менее важным фактором в формировании микробиома новорожденного является характер питания. Грудное молоко — оптимально сбалансированная пища для младенца, обеспечивающая его нормальное развитие [23]. Как известно, в первые дни жизни именно оно защищает ребенка от инфекционных болезней и способствует снижению смертности от них [24] за счет содержания множества иммунных факторов: Т- и В-лимфоцитов, плазматических клеток, иммуноглобулинов (в первую очередь IgА) и антимикробных ферментов (лизоцима и лактоферрина). Установлено, что грудное вскармливание в какой-то мере предотвращает развитие таких хронических заболеваний, как сахарный диабет [25] и ожирение [26]. И, несомненно, грудное молоко способствует формированию «здорового» микробиома. Первые данные об обнаружении бактерий в женском молоке были получены в 1950 году, но исследователей тех лет интересовали лишь патогенные микроорганизмы [27]. И хотя уже в 70-х годах в грудном молоке были найдены первые бактерии-симбионты, ученым не удалось их идентифицировать [27]. Лишь в 2003 году, когда в молоке, на коже груди и ареолах сосков восьми кормящих матерей и в ротовой полости и фекалиях их детей были обнаружены родственные лактобациллы, ученые предположили, что эти бактерии не занесены случайно извне, а имеют эндогенное происхождение [28].
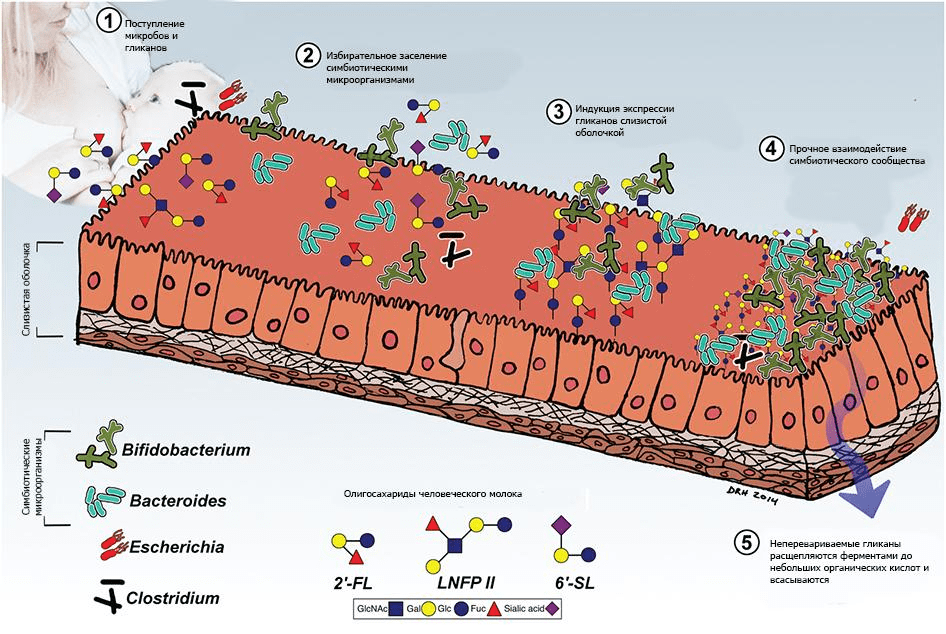
Независимо от того, материнское или донорское грудное молоко используется для вскармливания, у каждого младенца формируется свой особый микробиом. Заслуга в этом принадлежит олигосахаридам молока человека (ОМЧ) [29], [30]. В составе женского молока около 8% отведено перевариваемым ОМЧ — пребиотикам, поддерживающим рост Bifidobacterium longum subsp. infantis [31]. При этом профиль ОМЧ у каждой женщины уникален, что обеспечивает, в свою очередь, индивидуальность младенческого микробиома (рис. 3) [32].
Рисунок 3. Взаимодействие гликанов человеческого молока и микробиоты. Взаимодействие новорожденного с материнскими и содержащимися в окружающей среде микроорганизмами опосредовано потреблением молозива и содержащихся в нём гликанов (олигосахаридов молока человека, ОМЧ). ОМЧ обладают пребиотической, антиадгезионной и противовоспалительной активностью, облегчают экспансию симбионтов — в особенности Bacteroides и Bifidobacterium — и ингибируют рост и адгезию оппортунистических и облигатных патогенов.
Другим опосредующим формирование микробиома фактором является так называемая энтеромаммарная ось — система, которая обеспечивает транспорт бактерий из кишечника (будущей) матери в молочные железы. Ее первичным звеном служат дендритные клетки кишечника, которые захватывают бактерий и транспортируют их в местные лимфоидные фолликулы [1]. Там осуществляется выработка специфического иммуноглобулина А. Эти дендритные клетки и секретирующие иммуноглобулин лимфоциты циркулируют в крови, но могут избирательно возвращаться в кишечник за счет взаимодействия между β7-интегринами и выделяемыми эндотелиоцитами молекулами адгезии (адрессинами, MAdCAM-1). Клетки эндотелия молочных желез синтезируют молекулы MAdCAM-1 во время беременности, обеспечивая избирательное поступление в железу «запрограммированных» дендритных клеток, содержащих кишечные бактерии [33]. Помимо бактерий, в молозиве и молоке матери содержатся Т-клетки, производящие β7-интегрины, и плазматические клетки, вырабатывающие специфический IgА [34]. Также в молоке находятся цитокины, состав которых зависит от иммунологического опыта матери, приобретенного в течение жизни.
Существует теория, предполагающая передачу микроорганизмов из полости рта младенца в молочную железу матери с последующей выработкой в ее организме специфических антител и их поступлением в ЖКТ ребенка [34]. Предположение подтверждается тем фактом, что в ротовой полости новорожденного и в грудном молоке обнаруживаются идентичные бактерии родов Gemella, Veillonella, Staphylococcus и Streptococcus [35], [36]. Хотя есть данные, что они присутствуют в молозиве еще до начала грудного вскармливания (даже после тщательной гигиенической обработки железы образцы сцеженного молока содержат бактерии кожного и кишечного микробиома матери [37]), это всё же не отменяет возможность реализации механизма обратного заноса.
В 2011 году ученые из США обнаружили девять таксономических единиц бактерий в образцах молока от 16 женщин. Установив тем самым, что микробный состав молока чрезвычайно разнообразен, они предложили концепцию «ядра микробиома женского молока» (рис. 4) [35]. В дальнейшем стало ясно, что микробиом изменяется в течение всего периода лактации. Так, в молозиве преобладают бактерии родов Weissella, Leuconostoc, Staphylococcus, Streptococcus и Lactococcus, а в молоке, вырабатываемом в первые шесть месяцев после родов, видимо, из-за частого контакта с обитателями полости рта младенца происходит «перекос» в сторону Veillonella, Leptotrichia и Prevotella — что опять же подтверждает теорию обратного заноса [37].
Рисунок 4. Девять бактериальных таксономических единиц, обнаруженных в образцах молока от 16 женщин в 2011 году. Наблюдаемые сообщества оказались достаточно сложными, и при относительном постоянстве состава у одной группы испытуемых у другой с течением времени отмечались изменения.
Здоровье матери также играет важную роль в формировании микробного состава молока. В первый месяц лактации в молоке страдающих ожирением женщин преобладают Lactobacillus, однако через полгода их сменяют представители рода Staphylococcus [37], которые, как показывают исследования, начинают преобладать и в кишечнике тучных младенцев, в связи с чем ученые предположили существование связи между особенностями микробиома женского молока и паратрофией у детей.
Постепенное отнятие младенца от груди и переход на твердую пищу также играют важную роль в формировании бактериального разнообразия. После завершения грудного вскармливания в микробиоме детского кишечника появляются характерные для взрослого бактерии — представители типов Bacteroidetes, Firmicutes и класса Clostridia: Clostridium, Ruminococcus, Faecalibacterium, Roseburia, и Anaerostipes [19], [38].
Иммунитет
Недавние исследования подтвердили важную роль кишечной микрофлоры в развитии иммунной защиты. В Nature Reviews Immunology был опубликован обзор, подчеркнувший важный вклад бактерий-комменсалов в функционирование эпителиального барьера кишечника (рис. 5).
Рисунок 5. Эпителиальный барьер кишечника. Простой цилиндрический эпителий обладает механизмами физической и биохимической адаптации к микробной колонизации, поддерживающими целостность барьера. К ним относятся: богатые актином микроворсинки; плотные контакты эпителиальных клеток (а); муцины, которые формируют «сито» для просеивания молекул — гликокаликс; продукция различных антимикробных пептидов. М-клетки, покрывающие пейеровы бляшки и одиночные лимфоидные фолликулы, обеспечивают транслокацию молекул из просвета кишки под эпителий, к антигенпредставляющим клеткам. Дендриты специализированных дендритных клеток (ДК) могут проникать в просвет кишечника через плотные контакты (б).
Ученые предположили, что бактерии кишечника не только стимулируют его лимфоидные элементы, но и оказывают влияние на кишечный слизистый барьер, стимулируя образование микроворсинок [39], [40] и плотных контактов [41].
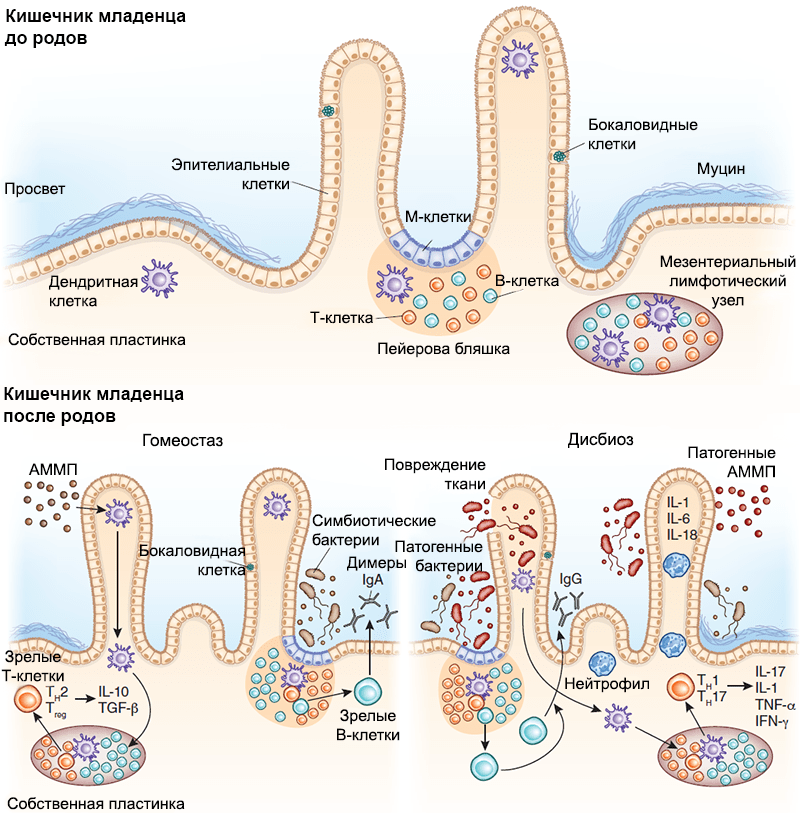
Рисунок 6. Взаимодействие между иммунной системой кишечника и микробиомом младенца. Развитие вторичных лимфоидных структур, в том числе пейеровых бляшек и одиночных лимфоузлов, происходит внутриутробно, задолго до начала бактериальной колонизации. С ее началом настраиваются механизмы взаимодействия иммунной системы хозяина и бактерий-симбионтов. М-клетки путем трансцитоза передают бактериальные антигены дендритным клеткам, те их презентируют, опосредуя Т-зависимое созревание В-лимфоцитов и способствуя секреции плазматическими клетками IgA, который играет важную роль в защите от патогенов. Бактерии могут транслоцироваться также через дендритные клетки и презентироваться Т-клеткам лимфоузла, индуцируя их дифференцировку. Нижняя левая панель — АММП — ассоциированный с микроорганизмами молекулярный паттерн. В условиях гомеостаза АММП, ассоциированные с бактериями-симбионтами, стимулируют продукцию регуляторных цитокинов (IL-25, IL-33, тимусного стромального лимфопоэтина и трансформирующего фактора роста, TGF-β). Трансдукция сигнала на дендритные клетки стимулирует развитие регуляторных Т-клеток и способствует секреции IL-10. Нижняя правая панель — В состоянии дисбиоза снижение количества бактерий-симбионтов приводит к размножению патогенов. Патогенные АММП индуцируют секрецию провоспалительных цитокинов (IL-1, IL-6 и IL-18), способствуя размножению эффекторных Т-клеток. Эти Т-клетки дифференцируются в CD4+ Th1 и Th17 и секретируют IL-17, фактор некроза опухоли (TNF-α) и интерферон-γ (IFN-γ), которые привлекают в очаг воспаления нейтрофилы, защищая организм хозяина от патогенов.
Исследуя влияние бактерий на защитные механизмы кишечника (рис. 6), ученые искусственно колонизировали бактерией Bacteroides thetaiotaomicron кишечники безмикробных мышей. Затем РНК кишечного эпителия анализировали на предмет изменения экспрессии генов [42]. Была отмечена обширная активация генов эпителиоцитов, которые регулировали функцию эпителиального барьера и способствовали повышению продукции рецептора к IgА. Это исследование прекрасно отражает влияние бактериальной колонизации на кишечник новорожденного, ведь он в данном контексте такой же, практически безбактериальный, организм.
Всё новые работы подчеркивают важную роль бактериальной колонизации в формировании и поддержании здоровья млекопитающих. В недавнем эксперименте, посвященном изучению функций Toll-подобных рецепторов, нокаутировали ген важного компонента врожденного иммунитета — рецептора TLR5, расположенного на базолатеральной поверхности энтероцитов мышей. Это повлекло за собой следующее: мыши начали регулярно объедаться и в конце концов развили метаболический синдром, сопровождавшийся изменением состава кишечной микробиоты. Возникло предположение, что микробиом может служить индикатором развития многих заболеваний. Но ученые пошли дальше и пересадили «патологическую» микробиоту из TLR5-дефицитных особей безмикробным мышам с нормальным рецептором, и у тех тоже проявились признаки метаболического синдрома. То есть микробиом, возможно, может служить не только индикатором системных проблем, но и непосредственно участвовать в их возникновении. Интересно, что ограничение питания TLR5-дефицитных мышей предотвращало развитие ожирения, но не резистентности к инсулину [43].
Вообще, связь колонизации бактериями-симбионтами с развитием как приобретенного, так и врожденного иммунитета, демонстрировали неоднократно. Было установлено, что взаимодействие рецепторов энтероцитов и иммунных клеток кишечника с антигенами микроорганизмов вызывает естественную, самоограничивающуюся воспалительную реакцию. Таким способом механизмы врожденного иммунного ответа позволяют предотвратить проникновение патогенов через эпителиальный барьер кишечника, при этом отличая их от безвредных симбионтов (рис. 6) [44], [45]. Когда ребенок покидает утробу матери, происходит контакт с огромным количеством бактерий. И для того чтобы избежать непрерывной воспалительной реакции в ответ на колонизацию кишечника, снижается экспрессия упомянутых рецепторов, в частности TLR2 и TLR4 [46]. К сожалению, у детей, появившихся на свет раньше срока, описанные механизмы еще незрелые, что часто приводит к развитию некротического энтероколита [47].
Исследования последних лет показали, что кишечные бактерии могут вносить свой вклад и в развитие иммунной толерантности, то есть защиты от избыточных иммунных реакций. Эти наблюдения чрезвычайно актуальны для разработки возможных терапевтических вмешательств, ведь многие бактериальные виды имеют количественное преимущество лишь на ранних этапах колонизации, во время грудного вскармливания (см. главу «Микробиом и грудное вскармливание»). Как же симбионтов связали с иммунотолерантностью? Например, полисахарид А капсулы Bacteroides fragilis может взаимодействовать с TLR2-рецепторами дендритных клеток кишечника, активируя продукцию противовоспалительных цитокинов, которые создают для бактерий специфическую микросреду [48]. Некоторые виды клостридий подобным образом увеличивают количество регуляторных Т-клеток — контролеров, подавляющих иммунный ответ, если Т-эффекторы неоправданно разбушевались, — предотвращая тем самым IgE-опосредованные заболевания [49]. Таким образом, конкретные микроорганизмы, представленные в материнском молоке, еще во младенчестве могут предопределить степень «аллергичности» индивида: упомянутые механизмы позволяют выработать толерантность к «полезным» антигенам и бактериям, предотвращая в дальнейшем развитие аллергий и аутоиммунных заболеваний .
Дополнительно о связях микробиома с иммунитетом, питанием, болезнями и препаратами для их лечения можно прочитать на «биомолекуле»: «Зоопарк в моем животе» [50].
И другие…
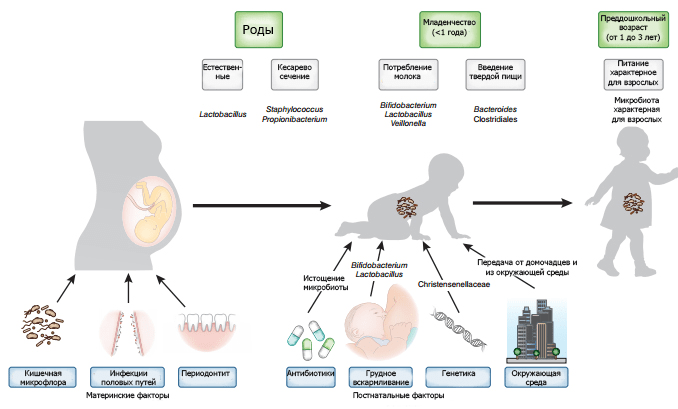
Помимо генетических факторов, характера родоразрешения и вскармливания, на формирование микробиома и иммунитета у новорожденного в той или иной мере оказывают влияние особенности питания, опыт приема антибиотиков и факторы окружающей среды (рис. 7).
Рисунок 7. Факторы, обеспечивающие формирование микробиома младенца. Инфекции половых путей женщины могут привести к бактериальному загрязнению матки. Микрофлора кишечника и ротовой полости может транспортироваться с кровью к плоду. Характер родоразрешения формирует первичную микрофлору. Генетика и постнатальные факторы, такие как режим питания, использование антибиотиков и воздействие окружающей среды оказывают дополнительное влияние на микробиом.
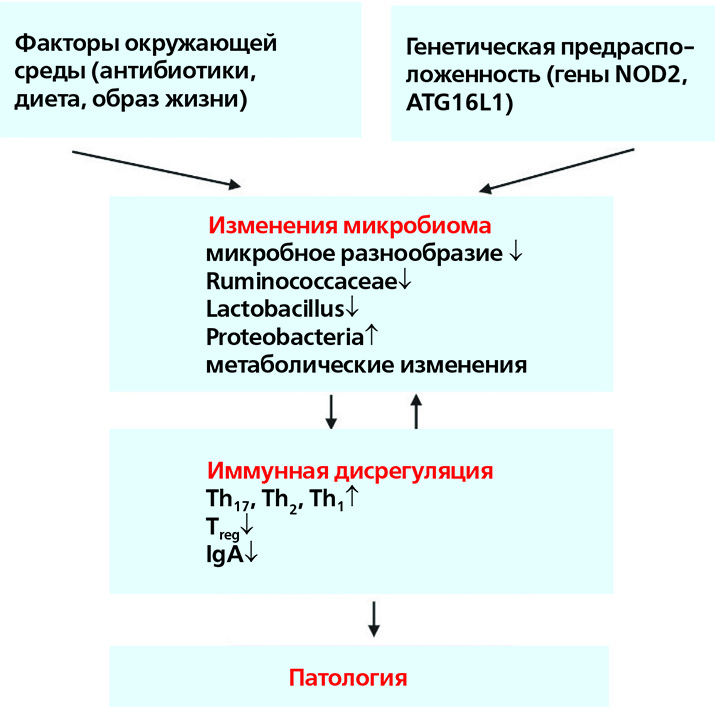
Антибиотики — одни из наиболее часто выписываемых детям препаратов. Назначение их матери в послеродовом периоде или же новорожденному может нарушить хрупкие процессы, которые лежат в основе формирования микробиома, и стать причиной ряда заболеваний (табл. 1). Исследования последних лет регулярно подчеркивают важность понимания процессов, ведущих к неонатальному дисбиозу и развитию в дальнейшем таких патологий, как диабет II типа, воспалительные заболевания кишечника или аллергическая реакция на компоненты молока [51–56]. Изменения в микробиоме, провоцируемые антибиотиками, зависят от способа введения, мишени, типа и дозировки препарата. Всё это пока плохо изучено у младенцев, что затрудняет понимание влияния антибиотикотерапии на формирование нормальной микрофлоры.
| Фактор, вызывающий дисбаланс | Характеристика когорты | Исходы |
|---|---|---|
| Кесарево сечение | 1,9 млн датских детей в возрасте 0–15 лет | Астма, системные заболевания соединительной ткани, ювенильный ревматоидный артрит, воспалительные заболевания кишечника, иммунодефициты и лейкозы |
| 1255 трехлетних детей из США | Ожирение, высокий ИМТ | |
| 2803 норвежских ребенка 0–3 лет | Аллергическая реакция на куриные яйца, рыбу или орехи | |
| Антибиотикотерапия | 1401 ребенок 0–6 месяцев из США | Астма и аллергия |
| 5780 британских детей 0–2 лет | Астма и экзема | |
| 12 062 финских ребенка 0–2 лет | Избыточный вес и ожирение | |
| 162820 детей 2–18 лет из США | Избыточный вес | |
| 9 млн британских детей | Воспалительные заболевания кишечника | |
| Пробиотики | 215 испанских детей 0–6 месяцев | Снижение частоты инфекций ЖКТ и верхних дыхательных путей |
| Европейское общество специалистов в области детской гастроэнтерологии, гепатологии и питания, комиссия по вопросам питания | Снижение частоты неспецифических желудочно-кишечных инфекций | |
| Пищевые добавки | 139 африканских детей 6–14 лет | С большей частотой — воспалительные заболевания кишечника, с меньшей — колики |
| Гигиена | 184 ребенка 0–3 лет (исследование чистоты пустышек) | Чистота пустышек снижала риск развития астмы, аллергии и сенсибилизации |
| Домашние животные | 3143 финских ребенка 0–1 года | Снижение риска развития диабета I типа |
Отдельно стоит сказать о пробиотиках и пребиотиках, которыми повсеместно обогащены смеси для искусственного вскармливания, несмотря на недоказанность их эффективности [57]. Пробиотики представляют собой живые микроорганизмы, которые, предположительно, должны участвовать в формировании микробиома, а пребиотики — это вещества, которые способствуют росту полезных микроорганизмов. Использование пробиотиков в педиатрической практике — до сих пор спорный момент, хотя их влияние на различные детские заболевания изучалось достаточно широко. Так, некоторые мета-анализы обнаружили их эффективность в терапии атопического дерматита, в то время как другие не выявили существенного влияния на детей младше 12 месяцев [58–61]. Была проведена оценка воздействия самых популярных пробиотических добавок в детском питании (Lactobacillus и Bifidobacterium spp., L. reuteri) на колики у младенцев. После трех недель их применения в кишечнике новорожденных увеличивалось количество лактобацилл и уменьшалось содержание кишечной палочки [62]. Однако на сегодняшний день большинство исследований показывает, что пре- или пробиотики значительно не влияют на качественный и количественный состав микробиома кишечника.
Окружающая среда не стерильна, и предметы быта, с которыми сталкивается новорожденный, тоже служат источниками микроорганизмов, участвующих в формировании микробиома. К примеру, вероятность обмена бактериями посредством предметов быта и воздуха в помещении увеличивается соразмерно количеству людей, проживающих в доме. Исследование 60 семей из США выявило, что члены одной семьи (домовладения) имеют более схожие микробиомы, чем члены разных семей [63]. Особенно показательно максимальное сходство микробиоты кожи у супругов, а также обмен поверхностными бактериальными сообществами между хозяевами и их собаками. Частый контакт с компонентами домашней пыли и большая семья в первые два месяца жизни могут привести к изменениям в микробиоме, ассоциированным с возникновением аллергии. Они заключаются в увеличении у младенцев количества бифидобактерий (за исключением B. adolescentis) и снижении численности Lactobacillus spp., Bifidobacterium adolescentis и Clostridium difficile [64].
Вероятно, частый контакт с животными, а соответственно, и с их микробиотой, на первом году жизни оказывает защитное действие, повышая иммунную толерантность. Например, взаимодействие с домашними животными с раннего возраста снижает риск развития аллергических состояний и астмы, но механизмы этого явления пока в полной мере не выявлены [65]. Ну и после всего сказанного, конечно, не станет сюрпризом вывод ученых о том, что бактериальное разнообразие гораздо выше у сельских детей, чем у городских [66]. В заключение стόит отметить, что ряд бактериальных штаммов обнаруживается одновременно у матерей и их взрослых дочерей, из чего следует, что одни бактерии временно «арендуют» жилплощадь, а другие получают в макроорганизме пожизненную «прописку».
Коррекция
В недавно проведенных исследованиях изучались терапевтические вмешательства, которые могли бы изменять микробом и профилактировать микробный дисбаланс еще в раннем детстве.
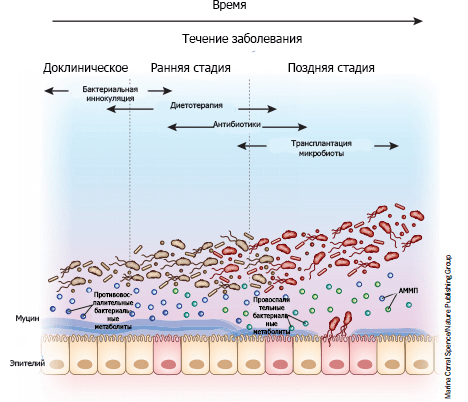
Подходы к модификации микробиома, как правило, подразделяются на три основные группы: очищение от микроорганизмов, их модуляция и замена, восстановление микробиоты. К примеру, антибиотики из-за их способности эффективно очищать кишечник от бактерий часто используют для лечения состояний, вызванных неспецифической патогенной микробиотой (рис. 8).
Рисунок 8. «Микробная терапия» в зависимости от стадии заболевания. На доклинических стадиях болезнь еще не проявляется в полной мере: ее симптомы (если вообще они есть) минимальны и неспецифичны, но тонкие биологические изменения уже происходят. Использование культур определенных бактериальных сообществ на ранних стадиях болезни может с максимальной эффективностью предотвратить дисбиоз и развитие патологии. По мере прогрессирования заболевания происходит обогащение микробиома патогенами (изображены красным), продуцирующими провоспалительные метаболиты и тем самым активирующими воспалительные пути (рис. 6). Слизистый слой, защищенный эпителием, истончается по мере накопления патогенов, утяжеляя течение заболевания. Диетотерапия и антибиотики на этом этапе могут использоваться в качестве радикальной меры, изменяющей количественный и качественный состав бактерий. На поздних стадиях продолжающееся истончение слизистого слоя позволяет бактериям прорваться через эпителиальный барьер. Тогда агрессивная антибиотикотерапия в сочетании с трансплантацией микробиоты может помочь восстановить микробный баланс. АММП — ассоциированный с микроорганизмами молекулярный паттерн.
Однако у детей раннего возраста длительное применение антибиотиков чревато значительным риском осложнений. Состав микробиоты можно изменить и посредством диетотерапии, употребляя продукты, которые способствуют росту «полезных» микроорганизмов. Одним из примеров подобной диеты является особое энтеральное питание, применяемое для симптоматической терапии болезни Крона у детей. Оно представляет собой специфическую смесь всех необходимых микро- и макронутриентов и потому в течение длительного времени может служить единственным источником питательных веществ. Оно подается исключительно в жидком виде — перорально либо через зонд — и способствует достижению клинической ремиссии за счет создания своеобразного «режима покоя»: снижения функциональной нагрузки на воспаленный кишечник и уменьшения его травматизации [67].
Исследования в области дефицита питания продемонстрировали, что на сегодняшний день невозможно, используя только диетотерапию, существенно повлиять на состав кишечного микробиома, хотя изучение влияния характера питания на него продолжается.
Учитывая то, какое значительное воздействие на здоровье оказывает микробиота в раннем детстве, весьма актуальными выглядят методы, направленные на своевременное, профилактическое, восстановление микробного баланса. Недавно удалось показать, что микробиом новорожденных, появившихся на свет посредством кесарева сечения, можно восстановить до состояния, схожего с младенцами, родившимися естественным путем. Обтирание таких детей тампонами, которые были введены за час до кесарева сечения во влагалище матери, приводило к значительному обогащению их микробиома представителями Lactobacillus и Bacteroides. Правда, пока не выяснены возможные последствия такой процедуры для здоровья [68].
Микробиом кишечника можно рассматривать как целый отдельный орган нашего тела. Мы приобретаем его при рождении, и то, каким он будет, зависит от множества факторов. Но одно можно сказать наверняка: он будет непохожим ни на какой другой микробиом. Это практически такой же уникальный признак, как папиллярные линии и сосудистый рисунок сетчатки глаза. И подобно тому, как отпечатки пальцев могут рассказать следователям криминальную биографию преступника, микробиом кишечника может предъявить ученым вехи онтогенеза своего хозяина. И как нельзя лучше процесс бактериальной колонизации и его значимость для организма отражает знаменитая пословица: «Что посеешь, то и пожнешь». Берегите свой микробиом и будьте здоровы!
Литература
- Hooper L.V., Littman D.R., Macpherson A.J. (2012). Interactions between the microbiota and the immune system. Science. 336, 1268–1273;
- Mayer E.A., Knight R., Mazmanian S.K., Cryan J.F., Tillisch K. (2014). Gut microbes and the brain: paradigm shift in neuroscience. J. Neurosci. 34, 15490–15496;
- Rajilic-Stojanovic M., Heilig H.G., Molenaar D., Kajander K., Surakka A., Smidt H., de Vos W.M. (2009). Development and application of the human intestinal tract chip, a phylogenetic microarray: analysis of universally conserved phylotypes in the abundant microbiota of young and elderly adults. Environ. Microbiol. 11, 1736–1751;
- Ardissone A.N., de la Cruz D.M., Davis-Richardson A.G., Rechcigl K.T., Li N., Drew J.C. et al. (2014). Meconium microbiome analysis identifies bacteria correlated with premature birth. PLoS One. 9, e90784;
- Moles L., Gomez M., Heilig H., Bustos G., Fuentes S., de Vos W. et al. (2013). Bacterial diversity in meconium of preterm neonates and evolution of their fecal microbiota during the first month of life. PLoS One. 8, e66986;
- Rautava S., Kainonen E., Salminen S., Isolauri E. (2012). Maternal probiotic supplementation during pregnancy and breast-feeding reduces the risk of eczema in the infant. J. Allergy Clin. Immunol. 130, 1355–1360;
- Dominguez-Bello M.G., Costello E.K., Contreras M., Magris M., Hidalgo G., Fierer N., Knight R. (2010). Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns. Proc. Natl. Acad. Sci. USA. 107, 11971–11975;
- Satokari R., Grönroos T., Laitinen K., Salminen S., Isolauri E. (2009). Bifidobacterium and Lactobacillus DNA in the human placenta. Lett. Appl. Microbiol. 48, 8–12;
- Aagaard K., Ma J., Antony K.M., Ganu R., Petrosino J., Versalovic J. (2014). The placenta harbors a unique microbiome. Sci. Transl. Med. 6, 237ra265;
- Oh K.J., Lee S.E., Jung H., Kim G., Romero R., Yoon B.H. (2010). Detection of ureaplasmas by the polymerase chain reaction in the amniotic fluid of patients with cervical insufficiency. J. Perinat. Med. 38, 261–268;
- DiGiulio D.B., Romero R., Amogan H.P., Kusanovic J.P., Bik E.M., Gotsch F. et al. (2008). Microbial prevalence, diversity and abundance in amniotic fluid during preterm labor: a molecular and culture-based investigation. PLoS One. 3, e3056;
- Jiménez E., Fernández L., Marín M.L., Martín R., Odriozola J.M., Nueno-Palop C. et al. (2005). Isolation of commensal bacteria from umbilical cord blood of healthy neonates born by cesarean section. Curr. Microbiol. 51, 270–274;
- Jimenez E., Marin M.L., Martin R., Odriozola J.M., Olivares M., Xaus J. et al. (2008). Is meconium from healthy newborns actually sterile? Res. Microbiol. 159, 187–193;
- Hu J., Nomura Y., Bashir A., Fernandez-Hernandez H., Itzkowitz S., Pei Z. et al. (2013). Diversified microbiota of meconium is affected by maternal diabetes status. PLoS One. 8, e78257;
- Mackie R.I., Sghir A., Gaskins H.R. (1999). Developmental microbial ecology of the neonatal gastrointestinal tract. Am. J. Clin. Nutr. 69, 1035S—1045S;
- Ravel J., Gajer P., Abdo Z., Schneider G.M., Koenig S.S., McCulle S.L. et al. (2011). Vaginal microbiome of reproductive-age women. Proc. Natl. Acad. Sci. USA. 108 Suppl 1, 4680–4687;
- Cohen J. (2016). Vaginal bacteria species can raise HIV infection risk and undermine prevention. Science;
- Witkin S.S. and Ledger W.J. (2012). Complexities of the uniquely human vagina. Sci. Transl. Med. 4, 132fs11;
- Backhed F., Roswall J., Peng Y., Feng Q., Jia H., Kovatcheva-Datchary P. et al. (2015). Dynamics and stabilization of the human gut microbiome during the first year of life. Cell Host Microbe. 17, 690–703;
- MacIntyre D.A., Chandiramani M., Lee Y.S., Kindinger L., Smith A., Angelopoulos N. et al. (2015). The vaginal microbiome during pregnancy and the postpartum period in a European population. Sci. Rep. 5, 8988;
- Insoft R.M., Sanderson I.S., Walker W.A. (1996). Development of immune function within the human intestine and its role in neonatal diseases. Pediatr. Clin. North Am. 43, 551–571;
- Jakobsson H.E., Abrahamsson T.R., Jenmalm M.C., Harris K., Quince C., Jernberg C. et al. (2014). Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section. Gut. 63, 559–566;
- Butte N., Lopez-Alarcon M., Garza C. Nutrient adequacy of exclusive breastfeeding for the term infant during the first six months of life. Geneva: World Health Organization, 2002. — 47 p.;
- WHO collaborative study team on the role of breastfeeding on the prevention of infant mortality. (2000). Effect of breastfeeding on infant and child mortality due to infectious diseases in less developed countries: a pooled analysis. Lancet. 355, 451–455;
- Horta B.L. and Victora C.G. Long-term effects of breastfeeding: a systematic review. Geneva: World Health Organization, 2013. — 69 p.;
- Horta B.L., de Mola C.L., Victora C.G. (2015). Long-term consequences of breastfeeding on cholesterol, obesity, systolic blood pressure, and type-2 diabetes: systematic review and meta-analysis. Acta Paediatr. 104, 30–37;
- Dorr H. and Sittel I. (1953). Bacteriological examination of human milk and its relation to mastitis. Zentralbl. Gynakol. 75, 1833–1835;
- Martín R., Langa S., Reviriego C., Jimínez E., Marín M.L., Xaus J. et al. (2003). Human milk is a source of lactic acid bacteria for the infant gut. J. Pediatr. 143, 754–758;
- Azad M.B., Konya T., Maughan H., Guttman D.S., Field C.J., Chari R.S. et al. (2013). Gut microbiota of healthy Canadian infants: profi les by mode of delivery and infant diet at 4 months. CMAJ. 185, 385–394;
- Yatsunenko T., Rey F.E., Manary M.J., Trehan I., Dominguez-Bello M.G., Contreras M. et al. (2012). Human gut microbiome viewed across age and geography. Nature. 486, 222–227;
- Gura T. (2014). Nature’s fi rst functional food. Science. 345, 747–749;
- De Leoz M.L., Kalanetra K.M., Bokulich N.A., Strum J.S., Underwood M.A., German J.B. et al. (2015). Human milk glycomics and gut microbial genomics in infant feces show a correlation between human milk oligosaccharides and gut microbiota: a proof-of-concept study. J. Proteome Res. 14, 491–502;
- Bourges D., Meurens F., Berri M., Chevaleyre C., Zanello G., Levast B. et al. (2008). New insights into the dual recruitment of IgA+ B cells in the developing mammary gland. Mol. Immunol. 45, 3354–3362;
- Latuga M.S., Stuebe A., Seed P.C. (2014). A review of the source and function of microbiota in breast milk. Semin. Reprod. Med. 32, 68–73;
- Hunt K.M., Foster J.A., Forney L.J., Schutte U.M., Beck D.L., Abdo Z. et al. (2011). Characterization of the diversity and temporal stability of bacterial communities in human milk. PLoS One. 6, e21313;
- Lif Holgerson P., Harnevik L., Hernell O., Tanner A.C., Johansson I. (2011). Mode of birth delivery affects oral microbiota in infants. J. Dent. Res. 90, 1183–1188;
- Cabrera-Rubio R., Collado M.C., Laitinen K., Salminen S., Isolauri E., Mira A. (2012). The human milk microbiome changes over lactation and is shaped by maternal weight and mode of delivery. Am. J. Clin. Nutr. 96, 544–551;
- Valles Y., Artacho A., Pascual-Garcia A., Ferrus M.L., Gosalbes M.J., Abellan J.J., Francino M.P. (2014). Microbial succession in the gut: directional trends of taxonomic and functional change in a birth cohort of Spanish infants. PLoS Genet. 10, e1004406;
- Artis D. (2008). Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nat. Rev. Immunol. 8, 411–420;
- McAuley J.L., Linden S.K., Png C.W., King R.M., Pennington H.L., Gendler S.J. et al. (2007). MUC1 cell surface mucin is a critical element of the mucosal barrier to infection. J. Clin. Invest. 117, 2313–2324;
- Shen L. and Turner J.R. (2006). Role of epithelial cells in initiation and propagation of intestinal inflammation. Eliminating the static: tight junction dynamics exposed. Am. J. Physiol. Gastrointest. Liver. Physiol. 290, G577–G582;
- Hooper L.V., Wong M.H., Thelin A., Hansson L., Falk P.G., Gordon J.I. (2001). Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291, 881–884;
- Vijay-Kumar M., Aitken J.D., Carvalho F.A. Cullender T.C., Mwangi S., Srinivasan S. et al. (2010). Metabolic syndrome and altered gut microbiota in mice lacking toll-like receptor 5. Science. 328, 228–231;
- Round J.L. and Mazmanian S.K. (2009). The gut microbiota shapes intestinal responses during health and disease. Nat. Rev. Immunol. 9, 313–323;
- O’Hara A.M. and Shanahan F. (2007). Gut microbiota: mining for therapeutic potential. Clin. Gastroenterol. Hepatol. 5, 274–284;
- Abreu M.T., Fukata M., Arditi M. (2005). TLR signaling in the gut in health and disease. J. Immunol. 174, 4453–4460;
- Claud E.C., Lu L., Anton P.M., Savidge T., Walker W.A., Cherayil B.J. (2004). Developmentally-regulated IκB expression in intestinal epithelium and susceptibility to flagellin-induced inflammation. Proc. Natl. Acad. Sci. USA. 101, 7404–7408;
- Mazmanian S.K. and Kasper D.L. (2006). The love—hate relationship between bacterial polysaccharides and the host immune system. Nat. Rev. Immunol. 6, 849–858;
- Atarashi K., Tanoue T., Shima T., Imaoka A., Kuwahara T., Momose Y. et al. (2011). Induction of colonic regulatory T cells by indigenous Clostridium species. Science. 331, 337–341;
- Зоопарк в моем животе;
- Kozyrskyj A.L., Ernst P., Becker A.B. (2007). Increased risk of childhood asthma from antibiotic use in early life. Chest. 131, 1753–1759;
- Risnes K.R., Belanger K., Murk W., Bracken M.B. (2011). Antibiotic exposure by 6 months, and asthma and allergy at 6 years: findings in a cohort of 1,401 US children. Am. J. Epidemiol. 173, 310–318;
- Hoskin-Parr L., Teyhan A., Blocker A., Henderson A.J. (2013). Antibiotic exposure in the first 2 years of life and development of asthma and other allergic diseases by 7.5 years: a dose-dependent relationship. Pediatr. Allergy Immunol. 24, 762–771;
- Bailey L.C., Forrest C.B., Zhang P., Richards T.M., Livshits A., DeRusso P.A. (2014). Association of antibiotics in infancy with early childhood obesity. JAMA Pediatr. 168, 1063–1069;
- Metsälä J., Lundqvist A., Virta L.J., Kaila M., Gissler M., Virtanen S.M. (2013). Mother’s and offspring’s use of antibiotics, and infant allergy to cow’s milk. Epidemiology. 24, 303–309;
- Kronman M.P., Zaoutis T.E., Haynes K., Feng R., Coffin S.E. (2012). Antibiotic exposure and IBD development among children: a population-based cohort study. Pediatrics. 130, e794–e803;
- Braegger C., Chmielewska A., Decsi T., Kolacek S., Mihatsch W., Moreno L. et al. (2011). Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN committee on nutrition. J. Pediatr. Gastroenterol. Nutr. 52, 238–250;
- Panduru M., Panduru N.M., Sălăvăstru C.M., Tiplica G.S. (2015). Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J. Eur. Acad. Dermatol. Venereol. 29, 232–242;
- Foolad N., Brezinski E.A., Chase E.P., Armstrong A.W. (2013). Effect of nutrient supplementation on atopic dermatitis in children: a systematic review of probiotics, prebiotics, formula and fatty acids. JAMA Dermatol. 149, 350–355;
- Doege K., Grajecki D., Zyriax B.C., Detinkina E., Zu Eulenburg C., Buhling K.J. (2012). Impact of maternal supplementation with probiotics during pregnancy on atopic eczema in childhood — a meta-analysis. Br. J. Nutr. 107, 1–6;
- Kim S.O., Ah Y.M., Yu Y.M., Choi K.H., Shin W.G., Lee J.Y. (2014). Effects of probiotics for the treatment of atopic dermatitis: a meta-analysis of randomized controlled trials. Ann. Allergy Asthma Immunol. 113, 217–226;
- Savino F., Cordisco L., Tarasco V., Palumeri E., Calabrese R., Oggero R. et al. (2010). Lactobacillus reuteri DSM 17938 in infantile colic: a randomized, double-blind, placebo-controlled trial. Pediatrics. 126, e526–e533;
- Song S.J., Lauber C., Costello E.K., Lozupone C.A., Humphrey G., Berg-Lyons D. et al. (2013). Cohabiting family members share microbiota with one another and with their dogs. Elife. 2, e00458;
- Sjögren Y.M., Jenmalm M.C., Böttcher M.F., Björkstén B., Sverremark-Ekström E. (2009). Altered early infant gut microbiota in children developing allergy up to 5 years of age. Clin. Exp. Allergy. 39, 518–526;
- Ownby D.R., Johnson C.C., Peterson E.L. (2002). Exposure to dogs and cats in the first year of life and risk of allergic sensitization at 6 to 7 years of age. J. Am. Med. Assoc. 288, 963–972;
- Normand A.C., Sudre B., Vacheyrou M., Depner M., Wouters I.M., Noss I. et al. (2011). Airborne cultivable microflora and microbial transfer in farm buildings and rural dwellings. Occup. Environ. Med. 68, 849–855;
- Ткаченко Е.И., Иванов С.В., Жигалова Т.Н., Ситкин С.И. (2008). Энтеральное питание при язвенном колите. Лечащий Врач. 6;
- Dominguez-Bello M.G., De Jesus-Laboy K.M., Shen N., Cox L.M., Amir A., Gonzalez A. et al. (2016). Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer. Nat. Med. 22, 250–253;
- Nuriel-Ohayon M., Neuman H., Koren O. (2016). Microbial changes during pregnancy, birth, and infancy. Front. Microbiol. 7, 1031;
- Newburg D.S. and Morelli L. (2015). Human milk and infant intestinal mucosal glycans guide succession of the neonatal intestinal microbiota. Pediatr. Res. 77, 115–120;
- Tamburini S., Shen N., Wu H.C., Clemente J.C. (2016). The microbiome in early life: implications for health outcomes. Nat. Med. 22, 713–722.
Микробиом человека – важная составляющая здоровья
Микробиом кишечника человека представляет собой сложную экосистему, состоящую из 39 триллионов микроорганизмов, и включает в себя не только бактерии, но и археи, грибы и вирусы. (1) Указанные микроорганизмы эволюционировали на протяжении тысяч лет в симбиозе с организмом хозяина. Кишечная микрофлора играет важную роль в пищеварении, иммунных реакциях, выполняет разнообразные метаболические функции. Так, бактерии продуцируют короткоцепочечные жирные кислоты, которые используются в качестве питательного вещества не только колоноцитами, но и клетками микроглии мозга. Обмен холестерина и гормонов в организме также осуществляется при участии кишечного микробиома. (2)
С развитием в конце ХХ века методов, позволяющих оценить состав и функции микроорганизмов, а именно секвенирования генома, появилась возможность изучить разнообразие микробных сообществ. Для качественной и количественной оценки бактериального разнообразия в образцах широко применяется секвенирование 16S рибосомальной РНК микроорганизмов, все более доступными становятся методы метагеномного анализа, позволяющие провести оценку метаболизма и функций того или иного вида бактерий. (3)
Наибольшее количество бактерий находится в толстой кишке, среди которых в норме преобладают два типа, Bacteroidetes и Firmicutes (∼90%). Тип Firmicutes состоит из более чем 250 родов бактерий, среди которых Lactobacillus и Clostridium, в то время как тип Bacteroidetes включает 20 родов, с преобладанием Bacteroides. Такие типы как Actinobacteria, Proteobacteria и Verrucomicrobia обнаруживаются в составе нормальной микрофлоры, но в гораздо меньших количествах. (1,4) Кроме того, среди здоровой микробиоты толстой кишки могут встречаться метанопродуцирующие археи, которые, в отличии от других живых организмов, не содержат пептидогликан в клеточной стенке и имеют особые рибосомы и рибосомные РНК, а также эукариоты (дрожжи) и вирусы.
Понятие «нормы» в отношении кишечного микробиома относительно, его состав может изменять множество различных факторов, воздействующих на кишечник и организм человека в целом. В настоящее время важным для поддержания равновесия между непатогенными и условно-патогенными бактериями считается отношение численности Bacteroidetes к Firmicutes (так называемый градиент Firmicutes/Bacteroidetes). (5)
Заселение кишечника микроорганизмами начинается с рождения, и состав микробиома определяется в значительной степени способом родоразрешения. В последующем микрофлора кишечника изменяется в зависимости от пищевых привычек, адаптируясь к новым продуктам в рационе человека. (6, 7) Вакцинация, различные заболевания, прием лекарственных препаратов, курение и другие факторы также влияют на композицию кишечного микробиома и его метаболизм. (8, 9) В то же время имеет место двустороннее взаимодействие между микро- и макроорганизмом. Очевидной демонстрацией этому служит важная роль кишечной микробиоты в формировании гипоталамо-гипофизарно-надпочечниковой оси, которая участвует в регуляции иммуномодуляции, обмена липидов, энергетического баланса и электрофизиологической активности энтеральной нервной системы. (11)
Влияние физических упражнений на изменение кишечного микробиома
Регулярные физические упражнения рекомендованы Всемирной организацией здравоохранения для укрепления здоровья и снижения риска развития многих заболеваний, в том числе психических, а также для увеличения продолжительности жизни. (12) Эти рекомендации основаны на данных множества исследований, демонстрирующих разнообразие патогенетических путей, посредством которых улучшается здоровье на фоне физической нагрузки. (13) С появлением возможности изучения микробиома кишечника, влияние на его таксономический состав и метаболизм с помощью упражнений служит предметом научного интереса.
Изучение микробного состава животных при физических упражнениях демонстрирует противоречивые результаты. Например, в некоторых исследованиях обнаружено увеличение градиента Firmicutes/Bacteroidetes, в то время как другие свидетельствуют о его снижении или отсутствии изменений. (Таблица 1)
Вероятно, это связано с отсутствием стандартизации вида физических упражнений, породы и возраста животных, их диеты.
Таблица 1. Влияние физических упражнений на кишечный микробиом животных
|
Авторы |
Модель |
Упражнения |
Результаты |
|
Hsu et al. (14) |
GF-, SPF-, BF-мыши |
Плавание |
↓ глутатиона ↓КЖК ↓ каталазы у GF— и BF-мышей |
|
Matsumoto et al. (15) |
Крысы Вистар |
Свободный бег в колесе 5 недель |
↑ бутирата ↑бутират-подуцирующих бактерий |
|
Campbell et al. (16) |
Дикие мыши с ожирением |
Свободный бег в колесе 12 недель |
↓Cox-2 ↑Faecalibacterium prausnitzii |
|
Evans et al. (17) |
Дикие мыши |
Свободный бег в колесе 12 недель |
↓градиента Firmicutes/Bacteroidetes; ↑Bacteroidetes, ↓Firmicutes; ↓Actinobacteria |
|
Cook et al. (18) |
Дикие мыши |
Тредмил (8-12 м/мин, 40 мин 5 раз в неделю, 6 недель) или бег в колесе (30 дней) |
↑диарея, ↑экспрессия IL-6, IL-1, IL-17, ↑смертность в группе с тредмил-тестом; снижение провоспалительных цитокинов в группе с бегом в колесе |
|
Kang et al. (19) |
Дикие мыши, мыши с индуцированным ожирением |
Бег в колесе с мотором (7 м /мин) 1 ч в день в течение 16 недель |
↓Bacteroidetes; ↑Firmicutes; ↑когнитивных способностей |
|
Denou al. (20) |
Дикие мыши |
Высокоинтенсивные интервальные тренировки 6 недель |
↓градиента Firmicutes/Bacteroidetes |
|
Liu et al. (21) |
Крысы с удаленными яичниками |
Свободный бег в колесе 6 недель |
↓Firmicutes у крыс с низкой толерантностью к физической нагрузке ↑Firmicutes у крыс с высокой толерантностью к физической нагрузке |
|
Allen et al. (22) |
Дикие мыши |
Свободный бег в колесе 6 недель |
↓таксономического разнообразия в группе бегающих мышей |
|
Lambert et al.(23) |
db/db мыши (модель для сахарного диабета 2 типа) |
Тредмил-тест низкой интенсивности 5 дней в неделю 6 недель |
↑Firmicutes, ↓Bacteroidetes:Prevotella spp. у тренированных и не тренированных мышей; ↑Bifidobacterium spp. у тренированных мышей без сахарного диабета |
|
Lamoureux et al. (24) |
Дикие мыши |
Тредмил-тест |
Увеличение таксономического разнообразия микробного сообщества, изменение воспалительных маркеров в тренируемой и контрольной группах |
|
Petriz et al. (25) |
Мыши с ожирением, артериальной гипертензией (SHR) и крысы Вистара |
Тредмил-тест 30 минут в день 4 недели |
↑Firmicutes; ↓Proteobacteria; ↑Lactobacillus во всех группах |
|
Mika et al. (26) |
F344 крысы, молодые и взрослые |
Свободный бег в колесе 6 недель |
↑Bacteroidetes, ↓Firmicutes, ↑таксономического разнообразия в группе молодых животных в сравнении со взрослыми |
Mailing et al продемонстрировали, что разный вид физической нагрузки — произвольный бег мышей в колесе и по беговой дорожке, изменяет микрофлору кишечника в разной степени. (27) В эксперименте Mika et al больших изменений в составе кишечного микробиома при одинаковых физических упражнениях удалось достигнуть молодым животным, эффект был менее значимым с увеличением возраста. (26) Другой группой ученых была подтверждена важная роль диеты в формировании микробиома. Так, при одинаковой физической нагрузке повышение разнообразия состава микрофлоры отмечалось лишь у мышей, получающих корм с большим содержанием жира. (17)
Ученые отмечают, что физическая активность может влиять не только на состав, но и метаболическую активность кишечного микробиома. В экспериментах на животных Matsumoto et al. обнаружено увеличение продукции бактериями бутирата на фоне физических упражнений в течение 5 недель. Бутират представляет собой короткоцепочечную жирную кислоту (КЖК), которая производится микрофлорой кишечника посредством ферментации пищевых волокон. Являясь важным питательным субстратом для колоноцитов, данная КЖК способствует ускорению пролиферации эпителия толстой кишки, поддержанию целостности кишечного барьера, участвует в регуляции иммунитета и экспрессии генов. (15)
Результаты экспериментов с участием животных не позволяют провести полную аналогию с изменением микробима людей при физической нагрузке ввиду отличий в таксономическом составе и метаболизме.
Доказательство влияния физических упражнений на состав кишечного микробиома человека были изначально получены из так называемых поперечных исследований, в которых данные собираются лишь один раз и другие факторы, за исключением искомого, принимаются за константу. (Таблица 2)
Таблица 2. Поперечные исследования с участием людей
|
Исследование |
Участники |
Влияние на кишечный микробиом |
|
Clarke et al., (28) |
Игроки в регби (n = 40), Контрольная группа с низким ИМТ (n = 23) и большим ИМТ (n = 23) |
Больше разнообразия в микробиоме спортсменов; ↑Akkermansia у спортсменов и лиц с низким ИМТ; ↑Erysipelotrichaceae, Prevotella, и Succinivibrio ↓Lactobacillaceae, Bacteroides, и Lactobacillus у спортсменов |
|
Estaki et al., (29) |
Здоровые взрослые добровольцы, занимающиеся фитнесом (n = 39) |
Сила физической нагрузки связана с повышением продукции бутирата и увеличением численности образующих его бактерий |
|
Stewart et al., (30) |
Мужчины, страдающие СД 1 типа с удовлетворительным гилкемическим контролем и занимающиеся физическими упражнениями (n = 10) и здоровые люди (n = 10) |
Не выявлено различий в микрофлоре кишечника при сравнении образцов пациентов с СД 1 типа и здоровых людей |
|
Bressa et al., (31) |
Активные женщины в предменопаузе, занимающиеся физическими упражнениями >3 ч в неделю (n = 19) и не активные (<30 минут 3 дня в неделю, n = 21) |
Повышение численности F. prausnitzii, R. hominis, и A. muciniphila, снижение численности Barnesiellaceae и Odoribacteraceae у активных женщин |
|
Yang et al., (32) |
Женщины в предменопаузе, разной степени физической активности, изначально с избыточным весом или ожирением (n = 71) |
Меньшая физическая нагрузка была связана с меньшим числом Bacteroides и збытком Eubacterium rectale и Clostridium coccoides |
|
Barton et al., (33) |
Игроки в регби (n = 40) и контрольная группа с низким (n = 22) и высоким ИМТ (n = 24) |
У спортсменов выявлено повышение синтеза аминокислот, ускорение метаболизма углеводов, повышение уровня КЖК в сравнении с контрольной группой |
|
Durk et al., (34) |
Здоровые мужчины (n = 20) и женщины (n = 17), занимающиеся регулярными физическими упражнениями |
Физическая нагрузка имела корреляцию с изменением отношения Firmicutes/ Bacteroidetes, увеличением таксономического разнообразия фекальной микробиоты |
Физическая нагрузка имела корреляцию с изменением отношения Firmicutes/ Bacteroidetes, увеличением таксономического разнообразия фекальной микробиоты
Clarke et al. обнаружили, что микробиом игроков в регби имеет большее разнообразие, в сравнении с людьми, не занимающимися спортом. При этом численность видов Bacteroides и Lactobacillus у спортсменов была ниже. (28) В исследовании Bressa et al. у женщин, выполняющих физические упражнения по меньшей мере 3 раза в неделю, отмечено повышение уровня Faecalibacterium prausnitzii, Roseburia hominis, Akkermansia muciniphila. F. prausnitzii и R. hominis известны как продуценты бутирата, в то время как A. muciniphila имеет отношение к снижению массы тела и улучшению метаболических показателей.(31)
Все больше работ посвящено влиянию фитнеса на состав и метаболизм кишечного микробиома. Многие из них подтверждают выявленную на модели животных тенденцию к расширению микробного разнообразия и увеличения продукции КЖК. (27,33) Ограничением указанных исследований служит их дизайн (перекрестные поперечные исследования), отсутствие учета диеты и многих других факторов, также вносящих вклад в изменение микрофлоры кишечника.
Указанные недостатки призваны исправить так называемые лонгитудинальные (протяженные) исследования, позволяющие оценить изменения изучаемого показателя во времени, с учетом влияния на него сопутствующих факторов. Более высокая стоимость, недостаточная приверженность участников и многие другие нюансы определяют меньшее количество научных работ по данной проблеме. (Таблица 3)
Таблица 3. Лонгитудинальные исследования с участием людей
|
Исследование |
Участники |
Физические упражнения |
Влияние на кишечный микробиом |
|
Paulsen et al., (35) |
Пациенты после первичного лечения рака молочной железы (n = 12) |
Пациенты письменно фиксировали физическую нагрузку в течение 3 месяцев |
Достоверное увеличение разнообразие таксономического состава кишечной микрофлоры в течение 3 месяцев |
|
Allen et al., (36) |
Люди с ожирением (ИМТ >30 кг/кв.м) и низкой массой тела (ИМТ<25 кг/кв.м)без предшествовавшей физической активности (n = 32) |
6 недель аэробных упражнений с увеличением нагрузки, 6 недель период без физических упражнений |
Зависимость состава микробиома от начального ИМТ: повышение численности Faecalibacterium у людей с низкой массой тела и снижение ее при ожирении; уменьшение численности Bacteroides у людей с низкой массой тела и повышение ее при ожирении; повышение продукции КЖК у всех. Эффект оказался временным с возвращением к исходным показателям через 6 недель без упражнений |
|
Cronin et al., (37) |
Люди с избыточным весом и ожирением , выполняющие упражнения, дополнительно принимающие протеин, и выполняющие упражнения и принимающие протеин (n = 30 в каждой группе) |
8 недель аэробных нагрузок с возрастанием их тяжести (18–32 мин) и тренировки на выносливость |
Не обнаружено изменений в составе микрофлоры, незначительное изменение метаболизма микрофлоры в группе, выполняющей упражнения и принимающей протеин |
|
Munukka et al., (38) |
Женщины с избыточным весом (n = 17) |
6 недель упражнений (велотренажер) |
Увеличение численности Akkermansia и снижение количества Proteobacteria. Изменения микробиома только у половины участников. Снижение активности генов, влияющих на метаболизм фруктозы и аминокислот |
В исследование Allen et al были включены 32 взрослых волонтера, не занимающиеся спортом, с индексом массы тела (ИМТ) <25 или >30, которым в течение 6 недель была назначена определенная программа упражнений (30-60 мин, 3 раза в неделю) со строгим контролем рациона. В результате ученые обнаружили значительные изменения микробного сообщества в кишечнике вне зависимости от ИМТ. В частности, отмечалось повышение доли Faecalibacterium у лиц с ИМТ< 25, но снижение их доли среди участников с ИМТ >30. Численность Bacteroides, наоборот, оказалась ниже у лиц с ИМТ< 25 после упражнений, в то время как среди участников с ИМТ >30 выявлено увеличение числа данных микроорганизмов. В завершении исследования также отмечалось повышение численности бутират-продуцирующих таксонов, однако лишь у субъектов с ИМТ< 25.(36)
Следующим этапом эксперимента стало изучение состава и метаболической активности кишечного микробиома участников исследования через 6 недель после окончания физических упражнений. В этот период все участники должны были воздержаться от избыточной физической активности, их рацион также учитывался. В результате отмечалось «возвращение» состава микробиоты кишечника к исходному, отмечавшемуся до начала упражнений. Исследователи пришли к выводу, что физические нагрузки имеют транзиторный и обратимый эффект в отношении изменений кишечной микробиоты.(36)
Схожие данные были получены другой группой ученых. Cronin et al. изучили влияние краткосрочных упражнений и биологически активных добавок (БАД), содержащих сывороточный белок, на состав и функции кишечного микробиома у людей с избыточной массой тела и ожирением (n=90). Физические упражнения представляли собой аэробную нагрузку длительностью до 30 мин 3 раза в неделю в течение 8 недель. В завершении исследования не было обнаружено значимых изменений в таксономическом составе или метаболизме среди участников, которые имели физическую нагрузку без приема БАД, в сравнении с началом эксперимента. У лиц, принимавших БАД и выполнявших упражнения имелась тенденция к увеличению разнообразия микробного сообщества, сохранявшаяся в сравнении с группой, получавшей БАД и не занимавшейся физическими упражнениями. Метагеномный анализ выявил незначительные изменения в метаболизме микробиома во всех группах. (37)
Munukka et al. также обратились к проблеме изменения метаболизма кишечного микробиома при физической нагрузке. Участниками исследования стали женщины с избыточным весом, имеющие сидячий образ жизни (n = 17). В завершении 6 недель занятий на велотренажере в составе их микрофлоры отмечалось относительное увеличение численности A. muciniphila и снижение Proteobacteria. Метагеномный анализ выявил снижение экспрессии генов, связанных с метаболизмом фруктозы и аминокислот. (38)
Таким образом, полученные данные свидетельствуют, что физические нагрузки имеют независимое влияние на микробиом кишечника. Тем не менее, для более значимых таксономических и метагеномных изменений, вероятно, требуется увеличение длительности и интенсивности аэробных нагрузок. Микробиота худых людей, вероятно, лучше поддается изменениям посредством упражнений, чем у лиц с избыточной массой тела и ожирением.
Потенциальные механизмы изменений кишечного микробиома при физических упражнениях
В настоящее время ученые не пришли к единой концепции относительно того, какие механизмы лежат в основе влияния физических упражнений на микробиом кишечника. Высказываются различные предположения о потенциальном влиянии многих факторов (Рисунок 1).
Рисунок 1. Модель воздействия физических упражнений на микробиом кишечника с потенциальным влиянием на здоровье человека.
Одной из гипотез служит воздействие на микробиом посредством изменений в лимфоидной ткани кишечника. Иммунные клетки находятся в непосредственной близости от микробного сообщества и производит защитные факторы. Hoffman-Goetz et al в экспериментах на животных продемонстрировали изменение экспрессии генов интраэпителиальных лимфоцитов, снижение регуляторной активности провоспалительных цитокинов, повышение продукции противовоспалительных цитокинов и антиоксидантов. (39)
Наряду с этим, упражнения могут способствовать поддержанию целостности слизистого барьера кишечника. Слизь играет важную роль в защите эпителиоцитов от микробной адгезии и служит необходимым субстратом для определенных бактерий, например, A.muciniphila.(40)
Физические упражнения увеличивают температуру тела и дают определенную нагрузку на сердечно-сосудистую систему, что приводит к снижению интестинального кровотока более чем на 50%, с развитием значительной ишемии через 10 минут в среднем, при упражнениях высокой интенсивности. Во время отдыха кровоток в органах быстро восстанавливается. Эпителиальные клетки кишечника в качестве источника энергии используют кислород, таким образом интенсивная физическая нагрузка приводит к транзиторному нарушению их метаболизма и кратковременному снижению функции белков плотных контактов, а следовательно целостности эпителиального барьера. (41) Предположительно, ввиду этого иммунные клетки, находящиеся в непосредственной близости от кишечного барьера, в короткий период ишемии непосредственно могут взаимодействовать с микробиотой, с последующим изменением ее таксономического состава. (42) Несмотря на то, что повышение кишечной проницаемости отмечается транзиторно при внезапной сильной физической нагрузке, этот эффект может быть нивелирован при регулярной физической активности. Ученые оценивают физические упражнения как положительный стрессовый фактор для кишечника, стимулирующий адаптацию и улучшающий прочность кишечного барьера в длительной перспективе. (43)
Не менее важным механизмом, посредством которого упражнения влияют на кишечный микробиом, служит изменение моторики и энтеральной нервной системы кишечника. Активность поперечнополосатой мускулатуры способствует активации гладких мышечных волокон в стенке ЖКТ, благодаря чему снижается время транзита содержимого в толстой кишке. (44) В то же время активация автономной нервной системы увеличивает одновременно симпатический тонус и влияние вагуса. Физические упражнения значительно ускоряют метаболический поток, что стимулирует высвобождение миокинов, нейроэндокринных гормонов, которые взаимодействуют с кишечником и его микрофлорой напрямую или через иммунные пути (45). (Рисунок 2)
Рисунок 2. Блок-схема функций микробиома кишечника и его взаимодействия с другими органами и системами в норме и при патологии.
Выделение большого количества лактата при физической нагрузке может менять рН внутри кишечника ввиду секреции данного вещества в его просвет.
Ускорение двигательной активности кишечной трубки опосредованно влияет на изменение рН, секрецию слизи, формирование биопленок микрофлорой и доступность питательных веществ для бактерий. Отмечается также повышение продукции мозгового нейротрофического фактора, который положительно влияет на настроение и снижает вероятность развития депрессивных и тревожных расстройств. (46)
Кроме того, физические упражнения могут способствовать изменению энтерогепатической циркуляции желчных кислот. Meissner et al. было установлено, что у мышей с гиперхолестеринемией после бега внутри колеса на протяжении 12 недель отмечается повышение секреции желчных кислот и их выделения с фекалиями. Желчные кислоты выделены в качестве одного из факторов, определяющих структуру кишечного микробиома, и изменение их экскреции может существенно отразиться на таксономическом составе микробиома кишечника. (47)
Еще одним механизмом, изученным недостаточно на сегодня, служит так называемый метаболический поток, под которым понимают скорость оборота молекул через метаболические пути. (48)
Таким образом, существует множество различных механизмов, потенциально ответственных за изменение кишечного микробиома на фоне физических упражнений. Необходимы дальнейшие исследования для уточнения приведенных гипотез.
Будущие перспективы
В целом, все больше данных свидетельствуют о том, что регулярные занятия физическими упражнениями благоприятно влияют на таксономический состав и метаболизм кишечной микробиоты. (49) Это может частично объяснять наблюдающийся положительный эффект регулярной физической активности на здоровье человека. Несмотря на увеличивающееся количество экспериментов в области изменений микробиома кишечника при физической нагрузке, остается много вопросов, ответить на которые призваны будущие исследования. В частности, необходимо выяснить, какая частота, режим и интенсивность упражнения лучше для профилактики заболеваний и их осложнений, как физические нагрузки влияют на кишечный микробиом детей и пожилых людей. Взаимодействие упражнений с рационом питания, возможность добавления пробиотиков и пребиотиков при этом также остается неизученным вопросом.
Важным недостатком исследований, который необходимо устранить в будущем, служит отсутствие оценки влияния упражнений на представителей, не относящихся к бактериям (археи, грибы, вирусы).
Тем не менее, с учетом возрастающей доступности метагеномных методов исследования микробиома, решение указанных вопросов представляется возможным. В перспективе полученные данные способны сформировать новый, основанный на индивидуальном подходе к изменению микробиома кишечника, с учетом физических упражнений и диеты.
Список литературы:
1. Codella R, Terruzzi I, Luzi L. Sugars, exercise and health. J. Affective Disord2017;224:76–86.
2. Brestoff JR, Artis D. Commensal bacteria at the interface of host metabolism and the immune system. Nat. Immunol. 2013; 14(7):676–84.
3. Morgan XC, Huttenhower C. Meta’omic analytic techniques for studying the intestinal microbiome. Gastroenterology. 2014; 146(6):1437–1448.e1.
4. Scott KP, Jean-Michel A, Midtvedt T, van Hemert S. Manipulating the gut microbiota to maintain health and treat disease. Microb. Ecol. Health
Dis. 2015; 26(1):25877.
5. HumanMicrobiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012; 486(7402):207–14.
6. Perez-Muñoz ME, Arrieta M-C, Ramer-Tait AE, Walter J. A critical assessment of the «sterile womb» and «in utero colonization» hypotheses: implications for research on the pioneer infant microbiome. Microbiome. 2017; 5(1):48.
7. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics. 2006; 118(2):511–21.
8. Marchesi JR, Adams DH, Fava F, et al. The gut microbiota and host health: a new clinical frontier. Gut. 2015; 65(2):330–9.
9. Maier L, Pruteanu M, Kuhn M, et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature. 2018; 555(7698):623–8.
10. David LA,Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014; 505(7484):559–63.
11. Evans JM, Morris LS, Marchesi JR. The gut microbiome: the role of a vir-tual organ in the endocrinology of the host. J Endocrinol 2013;218:R37–47
12. WHO Information sheet: global recommendations on physical activity forhealth 5–17 years old. WHO; 2015.
13. Clarke SF, Murphy EF, O’SullivanO, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014; 63(12):1913–20.
14. Hsu YJ, Chiu CC, Li YP, Huang WC, Huang Y Te, Huang CC, et al. Effect ofintestinal microbiota on exercise performance in mice. J Strength Cond Res2015;29:552–8
15. Matsumoto M, Inoue R, Tsukahara T, Ushida K, Chiji H, Matsubara N, et al.Voluntary running exercise alters microbiota composition and increasesn-butyrate concentration in the rat cecum. Biosci Biotechnol Biochem2008;72:572–6
16. Campbell SC, Wisniewski PJ, Noji M, McGuinness LR, Häggblom MM,Lightfoot SA, et al. The effect of diet and exercise on intestinalintegrity and microbial diversity in mice. PLoS One 2016;11:e0150502
17. Evans CC, LePard KJ, Kwak JW, Stancukas MC, Laskowski S, Dougherty J,et al. Exercise prevents weight gain and alters the gut microbiota in amouse model of high fat diet-induced obesity. PLoS One 2014;9:e92193
18. Cook MD, Allen JM, Pence BD, Wallig MA, Gaskins HR, White BA, et al. Exer-cise and gut immune function: evidence of alterations in colon immune cellhomeostasis and microbiome characteristics with exercise training. ImmunolCell Biol 2016;94:158–63
19. Dietand exercise orthogonally alter the gut microbiome and reveal indepen-dent associations with anxiety and cognition. Mol Neurodegener 2014;9:36,http://dx.doi.org/10.1186/1750-1326-9-36.
20. Denou E, Marcinko K, Surette MG, Steinberg GR, Schertzer JD. High-intensityexercise training increases the diversity and metabolic capacity of the mousedistal gut microbiota during diet-induced obesity. Am J Physiol EndocrinolMetab 2016;310:E982–93
21. Liu T-W, Park Y-M, Holscher HD, Padilla J, Scroggins RJ, Welly R, et al.Physical activity differentially affects the cecal microbiota of ovariectomizedfemale rats selectively bred for high and low aerobic capacity. PLoS One2015;10:e0136150
22. Allen JM, Berg Miller ME, Pence BD, Whitlock K, Nehra V, Gask-ins HR, et al. Voluntary and forced exercise differentially alters thegut microbiome in C57BL/6J mice. J Appl Physiol 2015;118:1059–66
23. Lambert JE, Myslicki JP, Bomhof MR, Belke DD, Shearer J, Reimer RA. Exercisetraining modifies gut microbiota in normal and diabetic mice. Appl PhysiolNutr Metab 2015;40:749–52
24. Lamoureux EV, Grandy SA, Langille MGI. Moderate exercise has lim-ited but distinguishable effects on the mouse microbiome. mSystems2017;2:e00006–17
25. Petriz BA, Castro AP, Almeida JA, Gomes CP, Fernandes GR, KrugerRH, et al. Exercise induction of gut microbiota modifications inobese, non-obese and hypertensive rats. BMC Genomics 2014;15:511
26. Mika A, Van Treuren W, González A, Herrera JJ, Knight R, Fleshner M. Exer-cise is more effective at altering gut microbial composition and producingstable changes in lean mass in juvenile versus adult male F344 rats. PLoS One2015; 10:e0125889
27. Mailing LJ, Allen JM, Buford TW, Fields CJ, Woods JA.Exercise and the Gut Microbiome: A Review of the Evidence, Potential Mechanisms, and Implications for Human Health.xerc Sport Sci Rev. 2019 Apr;47(2):75-85.
28. Clarke SF, Murphy EF, O’SullivanO, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014; 63(12):1913–20.
29. EstakiM, Pither J, Baumeister P, et al. Cardiorespiratory fitness as a predictor of intestinal microbial diversity and distinct metagenomic functions. Microbiome. 2016; 4:42.
30. Stewart CJ, Nelson A, Campbell MD, et al. Gut microbiota of Type 1 diabetes patients with good glycaemic control and high physical fitness is similar to people without diabetes: an observational study. Diabet. Med. 2017; 34:127–34.
31. Bressa C, Bailén-AndrinoM, Pérez-Santiago J, et al. Differences in gutmicrobiota profile between women with active lifestyle and sedentary women. PLoS One. 2017; 12(2):e0171352.
32. Yang Y, Shi Y,Wiklund P, et al. The association between cardiorespiratory fitness and gut microbiota composition in premenopausal women. Nutrients. 2017; 9(8):792.
33. Barton W, Penney NC, Cronin O, et al. The microbiome of professional athletes differs from that of more sedentary subjects in composition and particularly at the functional metabolic level. Gut. 2018; 67(4):625–33.
34. Durk RP, Castillo E, Márquez-Magaña L, et al. Gut microbiota composition is related to cardiorespiratory fitness in healthy young adults. Int. J. Sport Nutr. Exerc. Metab. 2018; 1–15.
35. Paulsen JA, Ptacek TS, Carter SJ, et al. Gut microbiota composition associated with alterations in cardiorespiratory fitness and psychosocial outcomes among breast cancer survivors. Support Care Cancer. 2017; 25(5):1563–70.
36. Allen JM, Mailing LJ, Niemiro GM, et al. Exercise alters gut microbiota composition and function in lean and obese humans. Med. Sci. Sports Exerc. 2018; 50(4):747–57.
37. Cronin O, Barton W, Skuse P, et al. A prospective metagenomic and metabolomic analysis of the impact of exercise and/or whey protein supplementation on the gut microbiome of sedentary adults. mSystems. 2018; 3(3):e00044–18.
38. Munukka E, Ahtiainen JP, Puigbó P, et al. Six-week endurance exercise alters gut metagenome that is not reflected in systemic metabolism in
39. PackerN,Hoffman-Goetz L. Exercise training reduces inflammatory mediators in the intestinal tract of healthy older adult mice. Can. J. Aging. 2012; 31(2):161–71.
40. Hoffman-Goetz L, Pervaiz N, Guan J. Voluntary exercise training in mice increases the expression of antioxidant enzymes and decreases the expression of TNF-alpha in intestinal lymphocytes. Brain Behav. Immun. 2009; 23(4):498–506.
41. vanWijck K, Lenaerts K, van Loon LJ, PetersWH, BuurmanWA,Dejong CH. Exercise-induced splanchnic hypoperfusion results in gut dysfunction in healthy men. PLoS One. 2011; 6(7):e22366.
42. Otte JA, Oostveen E,Geelkerken RH, GroeneveldAB, Kolkman JJ. Exercise induces gastric ischemia in healthy volunteers: a tonometry study. J. Appl. Physiol. 2001; 91(2):866–71.
43. Lira FS, Rosa JC, Pimentel GD, et al. Endotoxin levels correlate positively with a sedentary lifestyle and negatively with highly trained subjects. Lipids Health Dis. 2010; 9:82.
44. Dainese R, Serra J, Azpiroz F, Malagelada J-R. Effects of physical activity on intestinal gas transit and evacuation in healthy subjects. Am. J. Med. 2004; 116(8):536–9.
45. Freeman JV, Dewey FE, Hadley DM, Myers J, Froelicher VF. Autonomic nervous system interaction with the cardiovascular system during exercise. Prog. Cardiovasc. Dis. 2006; 48(5):342–62.
46. Song BK, Cho KO, Jo Y, Oh JW, Kim YS. Colon transit time according to physical activity level in adults. J. Neurogastroenterol. Motil. 2012; 18(1):64–9.
47. Meissner M, Lombardo E, Havinga R, Tietge UJ, Kuipers F, Groen AK. Voluntary wheel running increases bile acid as well as cholesterol excretion and decreases atherosclerosis in hypercholesterolemic mice. Atherosclerosis. 2011; 218(2):323–9.
48. Egan B, Zierath JR. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metab. 2013; 17(2):162–84.
49. Warburton DE,Nicol CW, Bredin SS.Health benefits of physical activity:the evidence. CMAJ. 2006; 174(6):801–9.
В кишечнике обитают миллионы бактерий, которые в совокупности известны как микробиом. Это сообщество микроорганизмов играет центральную роль в сохранении здоровья человека, «обучая» иммунные клетки поддерживать иммунный гомеостаз. Микробиота кишечника разнообразна и состоит из множества различных видов бактерий. Согласно данным проекта «Микробиом человека» (The Human Microbiome Project), в кишечнике содержится до 10 тысяч различных видов, насчитывающих триллионы клеток: полезные комменсальные бактерии, такие как Bifidobacterium и Lactobacillus, нейтральные штаммы, а также некоторые потенциально вредные бактерии, такие как Clostridia.
В зависимости от разнообразия и баланса бактерий кишечника микробиом может ингибировать либо способствовать развитию иммунного ответа. Несбалансированный микробиом, известный как дисбиоз, связан с хроническим воспалением и может увеличить риск развития воспалительных заболеваний кишечника, аутоиммунных патологий и других болезней. Однако воздействуя на микробиом кишечника, можно предотвратить развитие воспалительных реакций.
Регуляция баланса микроорганизмов

Ключ к созданию и управлению здоровой микробиотой кишечника и таким образом к реализации ее полезного воздействия на здоровье человека — в регуляции баланса между полезными и патогенными микроорганизмами.
Диета играет решающую роль, не только обеспечивая сбалансированность поступления энергии, но и поставляя определенные питательные вещества, которые непосредственно влияют на состав микробиоты.
Добавление пребиотиков необходимо для оптимальной функции кишечной микробиоты. Положительное влияние пребиотиков на рост и активность микробиоты хорошо изучено, в частности, способность питать полезные комменсальные бактерии, одновременно помогая подавлять вредные.
Роль микробиоты
Ключевые функции бактерий кишечника связаны с метаболизмом, синтезом многих веществ, защитой от инвазии патогенов и регуляцией иммунной системы.
Если бы не кишечный микробиом, организму не хватало бы ряда полезных для него веществ, включая витамины и аминокислоты. Одной из важнейших ролей кишечного микробиома является способность к ферментации неперевариваемых волокон. Эти волокна выступают питательными веществами для группы, производящей короткоцепочечные жирные кислоты (КЦЖК). Наиболее необходимые производимые КЦЖК — ацетат, пропионат и бутират.
Бутират является важным источником энергии для клеток внутренней оболочки толстой кишки (колоноцитов). Считается, что недостаток КЦЖК играет ключевую роль во многих проблемах, связанных с микробиомом, а также приводит к запуску местного воспаления. Бутират выполняет ряд функций в организме человека, включая способность вызывать апоптоз клеток рака толстой кишки, участвует в активации кишечного глюконеогенеза, что имеет значение для энергетического баланса и связано с патогенезом сахарного диабета. Кроме того, он также может стимулировать «иммуноуспокаивающие» Treg клетки.
Пропионат необходим для контроля уровня глюкозы, поскольку он регулирует глюконеогенез в печени и участвует в передаче сигналов о насыщении.
Ацетат участвует в регуляции метаболизма внекишечных тканей, включая метаболизм холестерина и липогенез.
Связь между кишечником и иммунной системой
Пищеварительную систему называют первичной системой иммунной защиты, поскольку она является основным звеном между внешней средой и внутренними системами нашего организма. Иммунная система и микробиота кишечника находятся в симбиотических отношениях, чтобы поддерживать и регулировать друг друга. Значимость этого взаимодействия подчеркивается тем фактом, что 70–80 % иммунных клеток организма находятся в кишечнике.
Микробиота кишечника формируется у новорожденных и сохраняется на протяжении всей жизни. По мере развития организма микробиота участвует в формировании иммунной системы, а та в свою очередь влияет на состав микробиоты. Здоровый пищеварительный тракт защищает организм от внешних факторов.
Полезные бактерии в кишечнике, такие как Bifidobacterium и Lactobacillus, принимаю участие в регуляции иммунной системы: подавляют рост патогенов, конкурируют за биологические вещества, поддерживают развитие иммунных клеток, борясь с воспалением, защищают кишечный барьер, вырабатывая продукты метаболизма и способствуя регуляции иммунных ответов.
Помимо «обучения» иммунных клеток, кишечные бактерии и их метаболиты могут «успокаивать» иммунную систему или вызывать развитие воспалительных реакций. Новые исследования также показывают, что состав микробиома может влиять на выработку интерлейкина-10, мощного противовоспалительного цитокина.
С другой стороны, некоторые бактерии производят провоспалительные вещества, активируя цитокины и Т-хелперы, запуская иммунный ответ.
Грамотрицательные бактерии содержат липополисахариды в своей внешней оболочке, эндотоксин, который способствует воспалительной реакции. Когда грамотрицательные бактерии погибают, эндотоксины выделяются в окружающую среду. Если эти соединения пересекают слизистую оболочку кишечника и попадают в кровоток, они могут привести к хроническому и системному воспалению.
В частности, дисбаланс в микробиоме связан с повышенной проницаемостью эпителиального барьера кишечника, более известной как «дырявый кишечник». Липополисахариды бактерий могут попасть в системный кровоток, вызывая развитие воспалительных реакций со стороны рецепторов клеток иммунитета.
В отличие от генов микробиом динамичен и реагирует на диету и образ жизни. Поэтому мы можем поддержать иммунное здоровье, соблюдая диету, богатую пребиотическими растительными волокнами и с низким содержанием жиров. Таким образом стимулирется выработка противовоспалительных метаболитов, таких как бутират.
Дисбаланс в кишечнике может стать активатором болезни
Изменения в микробиоте кишечника коррелируют почти со всеми известными иммунологическими заболеваниями, но в большинстве случаев остается неясным, являются ли эти изменения причиной или следствием заболевания либо просто отражением эпидемиологических различий между группами. Представители микробиоты кишечника участвуют в модуляции иммунитета организма, а также в развитии и прогрессировании множества заболеваний: атеросклероза, ожирения, СД 1-го типа, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, хронической обструктивной болезни легких, атопических заболеваний, депрессии, аутизма и др.
Есть мнение, что микробиота кишечника может быть связана с развитием таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона. Действительно, существует двунаправленная связь между кишечником и мозгом, так называемая ось «мозг — кишечник», и микробиота кишечника может влиять на взаимодействие этих органов. Вот почему наш кишечник иногда называют вторым мозгом.
Изменения микробиоты при первичных иммунодефицитах
Первичные иммунодефициты (ПИД) — группа гетерогенных генетических заболеваний, приводящих к развитию как качественной и (или) функциональной недостаточности, так и к неконтролируемой активации пролиферации иммунокомпетентных клеток и формированию аутоиммунных, аутовоспалительных и аллергических заболеваний. Генетические дефекты, вызывающие ПИД, приводят к нарушениям традиционных механизмов, лежащих в основе гомеостаза в кишечнике, при этом происходит нарушение иммунного надзора за кишечным барьером, изменение кишечной проницаемости, бактериальная транслокация.
Под влиянием определенных факторов окружающей среды и генетической предрасположенности человека аберрантные взаимодействия между микробиомом и иммунной системой хозяина способствуют развитию различных иммуноопосредованных нарушений.
Например, при ВЗК-подобных патологиях, часто возникающих у пациентов с ПИД, использование антибиотиков или диетические изменения при наличии генетической предрасположенности (например, мутация NOD2) могут привести к изменениям конфигурации микробиома кишечника, включая уменьшение богатства и нарушение таксономического и метаболитного состава. Эти изменения микробиома тесно связаны с аберрантными иммунными реакциями слизистых оболочек, включая усиленные реакции клеток типа Th17, Th1 и Th2, подавление Т-регуляторных клеток и нарушение регуляции гуморального иммунитета. В конечном итоге это может привести к хроническому, клинически выраженному воспалению кишечника и повреждению тканей.
По многочисленным литературным данным, ассоциированные со здоровьем микробные сообщества истощены у пациентов с ПИД. Микробные сообщества кишечника у таких пациентов значительно отличаются от здоровых по разнообразию и составу. Одной из объединяющих характеристик микробиома при ПИД является снижение разнообразия бактерий кишечника.
Другой общей чертой исследований у пациентов с ПИД является транслокация липосахаридов (ЛПС) в воспалительных очагах и в системном кровотоке. Бактериальный ЛПС связан с хронической иммунной активацией и иммунной дисрегуляцией.
Микробиота при аутоиммунных патологиях
Данные убедительно свидетельствуют о том, что существует определенная степень взаимодействия между аутоиммунным заболеванием и здоровьем микробиома кишечника. Однако необходимы дополнительные исследования, чтобы определить, являются ли нарушения микробиома причиной аутоиммунного заболевания, следствием или и тем, и другим сразу.
Микробиом пациентов с системной красной волчанкой, по литературным данным, характеризуется значительным снижением микробного разнообразия, а также увеличением численности вида Ruminococcus gnavus. Эти изменения также коррелируют с тяжестью течения заболевания.
Существует очевидная связь между обострениями болезни Крона и численностью бактерий Ruminococcus gnavus в кишечнике. R. gnavus является типичным представителем микробиома кишечника человека, но производит вредные полисахариды, оказывающие в большом количестве воспалительное действие на организм.
При СД 1-го типа у пациентов часто наблюдается «дырявый кишечник», Исследования показывают, что дисбиоз может влиять на патогенез СД 1-го типа, воздействуя на иммунный гомеостаз и тем самым приводя к данному патологическому состоянию.
Проводятся также исследования по анализу микробиома у пациентов с рассеянным склерозом: отмечается дисбиоз, особенно при отсутствии или чрезмерном преобладании нескольких родов и видов микробов.
Среди них некоторые виды вовлечены в повышенную экспрессию генов, которые участвуют как во врожденном, так и в адаптивном иммунитете.
Еще одним аутоиммунным заболеванием, при котором отмечаются изменения микробиома, является ревматоидный артрит: по сравнению с составом бактерий кишечника здоровых людей, у пациентов с ревматоидным артритом отмечается повышенная численность одних бактерий и сниженное количество других, что приводит к воспалительным реакциям в кишечнике.
Микробиом и онкология
Считается, что взаимодействие между микробиотой кишечника и иммунной системой влияет на иммунный надзор за онкологическими заболеваниями. При раке толстого кишечника уничтожение опухолей естественными киллерами (NK-клетками) напрямую ингибируется присутствием вида Fusobacterium nucleatum в микроокружении опухоли.
Более высокое количество бактерий F. nucleatum при колоректальном раке связано с более низкой плотностью CD3+T-клеток — популяции клеток иммунной системы, связанной с более благоприятным клиническим исходом. В печени комменсальные бактерии рода Clostridium желудочно-кишечного тракта используют желчные кислоты в качестве мессенджеров для усиления противоопухолевого эффекта печеночных клеток CXCR6+ NKT, поражая как первичные, так и метастатические опухоли печени.
Различные мировые исследователи пришли к выводу о том, что микробиом также модулирует ответы противоопухолевой иммунотерапии. Например, более высокое содержание комменсалов Bifidobacterium longum, Collinsella aerofaciens и Enterococcus faecium стимулирует более благоприятный Т-клеточно-опосредованный ответ на анти-PD-1-терапию у пациентов c меланомой.
Описана положительная корреляция между количеством таксона Akkermansia muciniphila и эффективностью блокады PD-1 у пациентов с эпителиальными опухолями. Иммунный ответ на другие противораковые методы лечения онкологических заболеваний, включая блокаду CTLA-4 и циклофосфамид, также был связан с различными конфигурациями микробиома кишечника. Выяснение роли кишечного микробиома в противоопухолевом иммунном надзоре и иммунотерапии может иметь большие перспективы в оптимизации ответа на лечение у онкологических больных.
Относительно недавно в медицинских кругах сложилось утверждение, что человеческим организмом, эмоциями, настроением, здоровьем и поступками правят…бактерии! Место обитания которых — кишечник. Публика мгновенно разделилась на 2 лагеря. Одни утверждают, что бактерии действительно обладают способностью управлять нами, и обосновывают мнение фактами, другие признают это полным антинаучным бредом и, как ни парадоксально, тоже приводят аргументы. Попробуем разобраться и понять, что такое микрофлора, зачем она нужна, как бактерии управляют нами, за что их называют вторым мозгом, и как помочь бактериям сделать управление эффективным.
Что такое микрофлора кишечника
Флора кишечника — это то, что человек получает с момента рождения и развивает на протяжении первых 7-10 лет. Со временем набор микроорганизмов становится разнообразнее и состоит из лактобактерий, бифидобактерий, грибков и кишечных палочек. Все они живут в дружном соседстве не только между собой, но и с патогенной микрофлорой, не позволяя ей размножаться и причинять организму вред.
Считается, что патогенная микрофлора составляет не более 15% от общей массы бактерий. А всего ученые умы насчитывают около 100 триллионов простейших микроорганизмов в нашем кишечнике, вес которых составляет в среднем 1,5 килограмма.
В норме, питанием и образом жизни человек способен длительно поддерживать удачный симбиоз своих поселенцев. Понимание этого процесса поможет значительно повысить качество жизни и здоровья.
За что отвечает микрофлора кишечника
Пищеварение
Одна из важнейших функций кишечных бактерий — участие в процессе переваривания пищи. Это такой гигантский завод по очистке зёрен от плевел. Когда вся поступающая пища, белки, жиры и углеводы расщепляются под воздействием ферментов, работу которых активизирует кишечник. Кишечник — финальная, но самая трудоемкая и времезатратная часть процесса пищеварения. Именно там с помощью микробиома запускается процесс сортировки полезных веществ от ненужного мусора. От того насколько здоров кишечник и весь пищеварительный тракт, зависит и качество сортировки пищи, и количество полезных веществ, которые всасываются и усваиваются именно в кишечнике.
Защита
Один в поле не воин — фраза, которая удачно характеризует работу кишечника. Чем меньше в нём “хороших” бактерий, тем больше места достается “плохим”. Полезные бактерии в процессе жизнедеятельности подавляют рост возбудителей инфекционных заболеваний, поддерживая тем самым защитные функции всего организма.
Иммунитет
Когда защита организма сильна, болезнь не пройдет. И большую роль в этом играет иммунитет, родина которого — кишечник. Как это происходит? Кишечные бактерии стимулируют синтез иммуноглобулинов – особых белков, повышающих защитные силы организма в отношении опасных инфекций. Иммуноглобулины населяют стенки кишечника, при достаточном количестве которых патогенные микроорганизмы не проникают. Также полезные бактерии содействуют созреванию системы фагоцитирующих клеток (неспецифический иммунитет), способных к поглощению и уничтожению патогенных микробов.
Синтез витаминов
Дружественные бактерии, живущие в кишечнике жизненно необходимы человеку для синтеза, хранения и поставки витаминов в организм:
- Витамин В-12
- Фолиевая кислота / Витамин В-9
- Витамин К
- Рибофлавин / Витамин В-2
- Биотин / Витамин В-7
- Никотиновая кислота / Витамин В-3
- Пантотеновая кислота / Витамин В-5
- Пиридоксин / Витамин В-6
- Тиамин / Витамин В-1
Среди них такие, которые нигде больше в организме не вырабатываются. Эта миссия возложена на бактерии. Витамины группы В жизненно необходимы человеку. Они содержат в порядке нервную систему, участвуют в обменных процессах, помогают противостоять стрессам и депрессии. Если нарушена микрофлора, синтез витаминов не происходит должным образом и неприятных последствий не избежать. Кроме того, никакие курсы витаминов не помогут. Вы не ощутите положительный эффект просто потому, что они не будут всасываться в кишечнике.
Как кишечная микрофлора помогает похудеть
Ещё один центр внимания ученых и исследователей — это зависимость веса человека от разнообразия микрофлоры. Так, недавние исследования американских ученых подтвердило этот факт. В ходе эксперимента наборы кишечных бактерий от людей-близнецов поместили в кишечник стерильных мышей. В одном наборе люди-близнецы были худые, в другом страдали ожирением. Микробы, взятые у худых близнецов вызывали похудение у мышей, а бактерии от полных близнецов вызывали у мышей ожирение. Но через время, когда мышей сажали в одну клетку, мыши с ожирением начинали стремительно терять вес.
Ученые сделали предположение, что микрофлора способна управлять пищевыми привычками, требуя от человека тех или иных продуктов, которые будут способствовать росту либо патогенных, либо “худых” бактерий. Лучшим рационом для некоторых бактерий являются жиры и они требуют их постоянно снова и снова, другим жизненно необходим сахар. Именно на зависимости пищевых потребностей и разнообразием бактерий в кишечнике, ученые выдвинули теорию, что кишечные поселенцы, стремятся брать верх над человеком и манипулировать химическим составом среды обитания ради собственных целей и выгоды. Это, в свою очередь, может означать манипуляции нашим поведением (нервничаем, если не едим сладкое, )путем воздействия с помощью нервных импульсов на центры голода, желание съесть тот или иной продукт, к тем или иным продуктам питания, или чувству отвращения от некоторых продуктов.
Почему нарушается баланс микрофлоры
Этот баланс очень хрупок и легко подвержен внешнему влиянию. И происходит это по нескольким причинам:
- прием антибиотиков
- нарушение режима питания
- злоупотребление сахаром и алкоголем
- отравления
- приём некоторых гормональных препаратов
- заболевания пищеварительной системы
- стресс
- приём некоторых лекарств — нестероидных противовоспалительных средств.
Признаки нарушения микрофлоры
- Нарушение стула — запоры, диарея, нерегулярный стул, вздутие, колики, боль
- Нарушения работы ЖКТ — появление тяжести, изжога, отрыжка, увеличение массы тела.
- Обезвоживание — появление ломкости и сухости волос и ногтей, кожных покровов,
- Интоксикация организма — тошнота, болезненный цвет лица, прыщи и угревая сыпь.
- Наличие неприятного запаха при дыхании, неприятный запах фекалий
- Изменения нервной системы — быстрая утомляемость, сонливость, отсутствие настроения, снижение работоспособности.
- Головокружения и головные боли
Как восстановить микрофлору кишечника
Процесс восстановления микрофлоры не быстрый. Важно не только скорректировать режим питания, но и активно помогать организму “наращивать” микробиом — правильно подобрать нужный препарат, содержащий пре- и пробиотики.
Линекс
Пробиолог
Пробифид
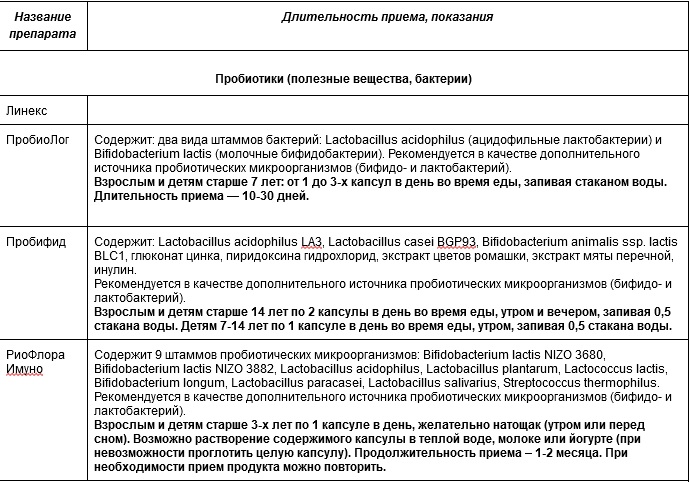


Бонус: могут ли микробы управлять человеческим поведением
Эта гипотеза сейчас становится очень популярной и, действительно, имеет на то ряд прямых и косвенных оснований. Кишечник называют вторым мозгом человека и бактерии, живущие в нем, действительно способны управлять человеком на уровне нервной системы.
В настоящий момент человечеству известно про наш организм многое, но не всё. Исследования в области микрофлоры кишечника и её влиянии на здоровье и качество организма находятся на зачаточной стадии, но привлекает всё больше внимания учёного мира. Так в ходе изучения микробиома человека подтвердилось существование сильной взаимосвязи между состоянием бактерий и работой иммунной, нервной и эндокринной систем. Некоторые ученые полагают, что бактерии могут выделять определенные сигнальные молекулы, влияющие на активность десятичного черепного нерва, проходящего от кишечника к головному мозгу, либо в данном процессе может быть задействован блуждающий нерв.
Сколько времени займет полное познание человека сказать невозможно, но можно быть уверенным, что мы подошли к чрезвычайно важным открытиям, которые, в будущем, решат множество проблем со здоровьем, помогут найти ключ к неизлечимым заболеваниям и тотально изменят привычную жизнь.
Будьте здоровы!
Автор: врач-инфекционист, аллерголог-иммунолог
Гордиенко Наталия Николаевна
Что такое микробиота человека, какие функции она выполняет, что негативно влияет на нее, и к каким последствиям приводит нарушение микробиома, расскажем в нашей статье.
Микробиота человека – новый взгляд на «микрофлору»
Термин микробиом был впервые предложен в 2001 году для обозначения коллективного сообщества микроорганизмов. Микробиом представляет собой всё разнообразие бактерий, которые находятся как внутри, так и снаружи нашего организма.
Раньше в этом понимании использовался термин «микрофлора», но от него отказались. Все-таки «флора» — это растительный мир, а не огромное разнообразия микромира человеческого организма.
Новая эпоха в изучении кишечного микробиома наступила всего лишь 5-10 лет назад и связана с появлением молекулярно-генетических методов исследования. Они перевернули представления о микромире.
Пришло абсолютно новое понимание необходимости присутствия в человеческом организме дружественных нам микроорганизмов не только для нашего пищеварения, но и для тела и здоровья в целом.
Сегодня организм человека рассматривается как сложнейший суперорганизм. Это симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, включая архибактерии и вирусы. Он обильно заселен микроорганизмами, численность которых составляет миллиарды. Количество видов бактерий колеблется от 2,5 до 4 тысяч, а штаммов – до 70 тысяч!
При этом микромир каждого человека индивидуален. Видовой состав относительно стабилен у каждого из нас. Общее содержание бактерий и количество их видов у разных людей может различаться в 12 – 2200 раз. Неповторим не только наш набор хромосом, но и свой набор микробиома.
Более 60% представителей всей микрофлоры колонизирует кишечник человека. Практически весь потенциал кишечной микробиоты локализован в толстой кишке.
Почему микробиота так важна для человека?
Микробиота играет важную роль в поддержании нашего здоровья. В настоящее время микробиом человека рассматривается как единый метаболически активный орган. Микробиота и слизистые нашего организма постоянно взаимодействуют и оказывают взаимное влияние друг на друга.
- Одна из основных функций микробиоты – это создание колонизационной резистентности. Это механизм на нашей слизистой оболочке, который предотвращает заселение «плохих», экзогенных или внешних микроорганизмов, и их избыточный рост. Природа не терпит пустоты. Если слизистые плотно закрыты нормальными здоровыми биопленками, то «заселять» болезнетворные бактерии эти слизистые не могут. Их не пустит нормальная микробиота. Это — важный защитный механизм.
- Синтез веществ. Это и синтез органических кислот, и синтез перекиси, и подавление роста экзогенных микробов за счет выработки тех же органических кислот или той же перекиси. Благодаря этой функции происходит санация нашей внутренней среды от болезнетворных бактерий.
- Конкуренция за места прикрепления на слизистых и источники питания. Конкуренция за прикрепление к слизистой бактерий жесткая в мире микроорганизмов. Есть такой научный термин как адгезия. Прежде чем наступит бактериальное воспаление, должна произойти адгезия или «прилипание» болезнетворной бактерии на том или ином участке слизистой, либо кожи. Наша здоровая микрофлора не дает возможности произойти адгезии.
- Газовый обмен. Микробиома участвует в регуляции газового обмена в кишечнике и других полостях организма.
- Производство энзимов, участвующих в метаболизме белков, жиров, углеводов.
- Детосикация. Нормальная здоровая микробиота активно проводит в организме детоксикацию. Интоксикация же организма происходит из-за экзогенных, попавших извне в организм токсинов, из-за эндогенных, продуцированных внутри организма токсичных субстратов и метаболитов, и, большей частью будет нейтрализована нашими «дружественными» бактериями. Микробиом — это огромный естественный био-сорбент.
- Образование свободных метаболитов, образование желчи.
- Повышение резистентности эпителиальных клеток к мутагенам или канцерогенам. Поступая из внешней или внутренней среды, мутгены способны вызвать мутацию на слизистых и, соответственно, привести к развитию онкозаболевания. Предотвращение воздействия мутагенов на клетку слизистой — это одна из функций микробиоты. Если микробиота будет качественной, слизистая будет защищена, в том числе и от воздействия мутагенов.
- Канцеролитическая функция. Если произошла поломка в геноме клетки, и она начинает безудержный рост, это означает образование онкозаболевания. Нормальная микробиота вырабатывая свои энзимы, интерфероны, будет оказывать «останавливающее» действие на опухоль.
- Функция хранилища генов. Микробиом является гигантским хранилищем микробных, плазмидных и хромосомных генов. Возможно удаление, встраивание генов, «ремонт поломки» генов происходит благодаря наличию хранилища микробных плазмидов. Получается, что у клеток иммунной системы, у клеток которые занимаются контролем генетической чистоты, всегда «под рукой» есть материал, чтобы «залатать», «подремонтировать» любые сбои в геноме человека.
Миробиота кишечника – источник иммунитета
Кишечник выполняет важную роль в иммунной системе в работе иммунных механизмов на уровне интестинального (желудочно-кишечного)тракта. В этом процессе принимают участие три ключевых компонента.
- Нормальная, здоровая микробиота
- Сама слизистая, правильнее сказать, лимфоидная ткань слизистой.
- Цитокины. Цитокины — это фактор межклеточного воздействия. Люди могут дотронуться друг до друга, сказать что-то вербально, а бактерии между собой общаются с помощью цитокинов . Цитокин воспринимается другой бактерией как информация.
Влияние микробиоты на формирование иммунитета
Врожденный адаптивный иммунитет вырабатывается при взаимодействии микробиоты и макроорганизма. Контакт с микробами в кишечнике приводит к активации различных клонов лимфоцитов. Они как бы учатся бороться с «врагом». Это влияние потом будет сохраняться, когда лимфоциты переместятся из подслизистого слоя в кишечнике в общий кровоток. Так будет формироваться стимуляция или «дрессировка» наших клеток иммунной системы постоянным присутствием бактерий. В роли «дрессировщика» будет выступать наша нормальная микробиота.
Влияние нормальной микробиоты человека на иммунную систему складывается из нескольких моментов.
Во-первых, это слизистая кишечника, особенно толстой кишки. Из-за массивного заселения бактериями она обильно инфильтрирована макрофагами, лимфоцитами, плазматическими клетками. «Клетки белой крови», которые присутствуют на слизистых, поддерживают там перманентно текущий или хронический воспалительный процесс. Они всегда пребывают в состоянии активности, «войны», к этому их и принуждает микробиота.
Почему это важно? Если в человеческий организм попал болезнетворный агент, а там уже присутствуют и лимфоциты, и макрофаги, они будут нейтрализовывать «врага».
Во-вторых, под воздействием нормальной микробиоты синтезируются естественные или нормальные антитела, которые будут реагировать на всевозможные антигены, возбудители. Если нормально работает иммунная система человека, она готова расправиться с «врагом». Именно микробиота будет стимулировать и дрессировать наши клетки иммунитета.
В-третьих, в кишечнике постоянно находятся до семидесяти процентов всех лимфоцитов, которые затем циркулируют в организме. Они контактируют с агентами и нормальной, и условно патогенной флоры, и болезнетворными бактериями. Затем лимфоциты, циркулируя в организме, разносятся и, так называемые, «клетки памяти», будут формировать уже отдалённую иммунную защиту.
В-четвертых, микробиота стимулирует и индуцирует синтез интерферонов, стимулирует лимфоидный аппарат кишечника.
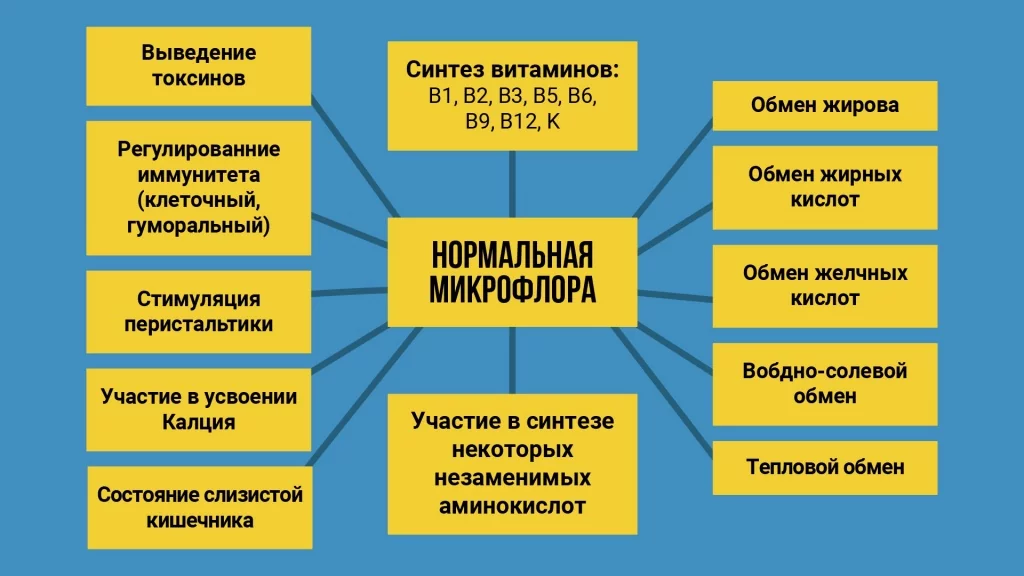
Какие условия необходимы для нормальной работы микробиоты
Что же это за факторы, которые будут угнетать или стимулировать микробиом человека. Чтобы нормально, как единый оркестр в унисон, работала наши дружественные бактерии им нужны определенные условия.
Факторы, влияющие на микробиом человека
- Химиотерапевтические. От воздействия химического агента, особенно химиотерапии (при лечении онобольных), микробиом будет сильно страдать.
- Постлучевое воздействие. Ионизирующее излучение воздействует на все живое пагубно и будет пагубно влиять на микробиом. Может развиваться аплазия костного мозга, гибель микробиоты в целом, гибель эпителия, слизистой кишечника. На фоне ионизирующей радиации механизм воздействия на иммунную систему нашей микробиоты будет практически обнуляться.
- Постинфекционной фактор. После перенесенных инфекций, в том числе и после коронавируса, состояние микробиоты ухудшается. Поскольку микробиом модулирует иммунный ответ, любой серьезный инфекционный агент, как-то — бактериальный, вирусный либо агрессивный грибковый — разрушительно влияет на нормальную микробиоту. Искажает, ухудшает, приводит к гибели определенных клонов и заселению клонами патогенных клеток.
- Стрессовые факторы. Любой стрессовый фактор будет негативно влиять на микробиому, будь это: психогенный стресс, тепловой стресс, химический стресс, длительное пребывание в депрессивном состоянии.
- Наследственность. Говоря о наследственности, стоит обратить внимание на присутствие или отсутствие ферментопатий. Если в желудочно-кишечном тракте существует генетически обусловленная ферментопатия, и есть ряд продуктов, которые человек не в состоянии переваривать из-за того, что не вырабатываются энзимы для расщепления этого продукта питания, микробиота будет тоже страдать.
- Экологические факторы. Загрязнение окружающей среды — не будет улучшать «внутренний мир» человека, и это отразится в конечном итоге на его здоровье.
- Использование антибиотиков. Как в питании, так и при лечении. Современные методы животноводства, птицеводства широко используют антибиотики. При изготовлении продуктов питания применяют консерванты, бытовые дезинфектанты. В супермаркетах продукты могут храниться неделями, иногда месяцами, не теряя своего товарного вида. В процессе хранения продуктов используются всевозможные средства воздействия для остановки бактериального роста. Они тоже проникают в наш организм.
Антибиотикотерапия, которую мы используем для лечения тех или иных инфекционных заболеваний, а, достаточно часто необоснованно и бесконтрольно, убивает собственную микробиоту. Конечно, прием антибиотиков предотвращает развитие грозных осложнений, тяжелых заболеваний, благодаря антибиотикам человечество смогло увеличить продолжительность жизни и снизить смертность. Но эра антибиотиков серьезно бумерангом ударила по микробиому.
Каковы последствия изменения микробиома
Изменения микробиомы человека, приводят к серьезным последствиям. Самые распространенные из них:
- синдром раздраженного кишечника
- развитие бронхиальной астмы
- развитие пищевых аллергий
- всевозможные воспалительные заболевания в кишечнике вплоть до формирования язвенного колита
- болезнь Крона
- аутоиммунные заболевания
- аторосклероз
- сахарный диабет второго типа
- заболевания печени
- заболевания нервной системы
- болезнь Паркинсона
- ранний детский аутизм
- некоторые виды рака
- депрессии
- шизофрении
- заболевания кожи: всевозможные гнойно-септические поражения, дерматит, экзема
Еще 20 лет назад ученые даже не предполагали, что аутизм, шизофрения, болезнь Паркинсона, онкология связаны с нарушением в микробиоме человека. Эпоха открытий в «микромире» только начинается. Интенсивные исследования в этом направлении активно ведутся и принесут множество неожиданных открытий. Но уже сегодня очевидно, что стоит уделить особое внимание «миру внутри нас». Профессиональные консультации врача помогут не ошибиться в этом и поддержать микробиоту и организм в отличном состоянии.
30.04.2021 15:57
Влияние диеты на микробиом кишечника и последствия для здоровья человека
Rasnik K. Singh, et al.
Influence of diet on the gut microbiome and implications for human health
J Transl Med. 2017; 15: 73.
Недавние исследования показали, что микробиом кишечника играет важную роль в модуляции риска нескольких хронических заболеваний, включая воспалительные заболевания кишечника, ожирение, диабет 2 типа, сердечно-сосудистые заболевания и рак. В то же время теперь понятно, что диета играет важную роль в формировании микробиома, и эксперименты показывают, что диетические изменения могут вызвать значительные временные микробные изменения в течение 24 часов. Учитывая эту связь, изменение микробного состава с помощью диеты может иметь значительную терапевтическую пользу. В этом обзоре систематически оцениваются текущие данные о влиянии нескольких общих диетических компонентов на кишечную микробиоту. Мы показываем, что потребление определенных видов пищи вызывает предсказуемые сдвиги в существующих родах бактерий-хозяев. Кроме того, идентичность этих бактерий влияет на иммунные и метаболические параметры хозяина, что имеет большое значение для здоровья человека. Знакомство с этими ассоциациями будет очень полезно как для врача, так и для пациента.
Микробиом кишечника
Микробиом кишечника человека включает 1014 резидентных микроорганизмов, включая бактерии, вирусы, грибы и простейшие, которые являются комменсальными кишечному тракту человека [1]. Среди них бактерии представляют собой наиболее хорошо изученную группу, и им будет уделено основное внимание в этом обзоре. В целом преобладающими бактериальными группами в микробиоме являются грамположительные Firmicutes и грамотрицательные Bacteroidetes [2, 3]. Недавно было показано, что микробиоту можно эффективно разделить на разные энтеротипы, каждый из которых обогащен определенными родами бактерий, но все они, по-видимому, обладают высокой функциональной однородностью [4]. Это единообразие существует независимо от нескольких свойств хозяина, таких как возраст, пол, индекс массы тела и национальность [5].
Большинство микроорганизмов обитают в более дистальных частях пищеварительного тракта, где их биомасса превышает 1011 клеток на грамм содержания [6]. Микробы в дистальном отделе кишечника способствуют здоровью хозяина за счет биосинтеза витаминов и незаменимых аминокислот, а также образования важных побочных продуктов метаболизма из пищевых компонентов, оставшихся непереваренными в тонком кишечнике [7]. Побочные продукты короткоцепочечных жирных кислот (SCFAs), такие как бутират, пропионат и ацетат, действуют как основной источник энергии для эпителиальных клеток кишечника и, следовательно, могут укреплять слизистый барьер [8]. Кроме того, исследования, проведенные на мышах без микробов, показывают, что микробиота непосредственно способствует местному кишечному иммунитету через их воздействие на экспрессию toll-подобных рецепторов (TLRs) [9], антигенпрезентирующие клетки, дифференцированные Т-клетки и лимфоидные фолликулы [10, 11], а также путем воздействия на системный иммунитет через увеличение селезеночных CD4+ Т-клеток и системную экспрессию антител [12].
Эти зарегистрированные преимущества и многое другое привели к растущему интересу к способности изменять микробиоту кишечника. Резкое изменение рациона — например, на строго животный или растительный — изменяет микробный состав всего за 24 часа после начала, с возвратом к исходному уровню в течение 48 часов после прекращения диеты [13]. Кроме того, микробиом кишечника животных, которых кормили диетой с высоким содержанием жиров или сахара, более склонен к нарушению циркадного ритма [14]. Исследования также показывают, что чрезмерный системный стресс и воспаление — например, вызванное тяжелым ожоговым повреждением — также могут вызывать характерные острые изменения микробиоты кишечника в течение всего одного дня после травмы [15].
Микробиом при болезни
Исследования, изучающие состав и роль кишечного микробиома в различных болезненных состояниях, выявили ассоциации с воспалительными заболеваниями кишечника (ВЗК), воспалительными кожными заболеваниями, такими как псориаз и атопический дерматит, аутоиммунный артрит, диабет 2 типа, ожирение и атеросклероз. Например, пациенты с ВЗК, как правило, имеют меньшее бактериальное разнообразие, а также меньшее количество Bacteroides и Firmicutes, что вместе может способствовать снижению концентрации бутирата микробного происхождения. Считается, что бутират и другие SCFAs оказывают прямое противовоспалительное действие на кишечник [16]. Кроме того, каждый из различных показателей активности болезни Крона характеризовался специфическими бактериями, прикрепленными к слизистой оболочке кишечника, на которые, в свою очередь, значительно влияет анти-TNF терапия [17]. Относительное количество различных бактерий может опосредовать воспаление кишечника и активность болезни Крона посредством воздействия на локальные популяции регуляторных Т-клеток [17, 18]. Более того, анализ репрезентативности показал, что ферменты, обогащенные микробиомами при ВЗК, чаще участвуют в мембранном транспорте, что может служить подтверждением «гипотезы дырявого кишечника», способствующей болезненному состоянию [19, 20]. Интересно, что дифференцировка аутоиммунного Th17 от наивных Т-клеток, по-видимому, зависит от сегментированных нитчатых бактерий. Исследования показали, что клетки Th17 отсутствуют в собственной пластинке тонкого кишечника безмикробных животных, которая является основным местом их дифференцировки. Более того, введение сегментированных нитчатых бактерий достаточно для запуска аутоиммунного артрита у этих животных за счет стимулирования развития клеток Th17 в собственной пластинке и селезенке [20, 21]. Микробиота кишечника пациентов с сахарным диабетом 2 типа функционально охарактеризована маркерами, связанными с диабетом, показывающими повышенный мембранный транспорт сахаров и аминокислот с разветвленной цепью, метаболизм ксенобиотиков и восстановление сульфатов наряду со снижением бактериального хемотаксиса, синтеза бутирата и метаболизма кофакторов и витаминов [22]. Ожирение характеризуется измененным соотношением кишечных бактерий Bacteroides / Firmicutes с большей относительной численностью Firmicutes. Кроме того, исследования, включающие трансплантацию микробиоты от тучных мышей к худым, показали, что фенотип ожирения передается и может поддерживаться микробиотой, которая обладает повышенной способностью собирать энергию из рациона хозяина [23]. Риск атеросклероза также был связан с микробиотой кишечника, в частности, из-за усиленного метаболизма холина и фосфатидилхолина, который продуцирует проатерогенное соединение, триметиламин-N-оксид (ТМАО) [24]. Недавнее исследование также показало, что кишечные бактерии могут продуцировать значительное количество амилоида и липополисахаридов, которые играют ключевую роль в патогенезе болезни Альцгеймера [25]. Эти наблюдения иллюстрируют важную роль микроорганизмов в здоровье человека и предполагают, что манипулирование ими может влиять на активность болезни. Хотя микробиом здорового человека относительно стабилен, на микробную динамику кишечника, безусловно, может влиять образ жизни хозяина и его диета [26].
В этом обзоре мы всесторонне исследуем способность рациона хозяина модулировать кишечные бактерии, надеясь, что эти знания помогут нам понять, как диетический выбор влияет на здоровье человека через изменение экосистемы желудочно-кишечного тракта (рис. 1, таблица 1).

Рис. 1. Влияние диеты на микробиом кишечника и здоровье человека
ССЗ – сердечно-сосудистые заболевания; CД2 — сахарный диабет 2 типа
Табл.1. Обзор отдельных родов и видов кишечных бактерий, обычно подверженных воздействию диеты
|
Бактерия |
Основные характеристики |
Сопутствующие физиологические изменения |
Ассоциированные болезненные состояния |
Ref. |
|
Bifidobacterium spp. |
Грамположительный облигатный анаэроб разветвленный; немотильный |
Выработка SCFA; улучшение слизистого барьера кишечника; снижение уровня LPS в кишечнике |
Снижение обилия при ожирении |
[166, 167] |
|
Lactobacillus spp. |
Грамположительный факультативный анаэроб палочковидной формы |
Продукция SCFA; противовоспалительная и противораковая активность |
Ослабление ВЗК |
[168, 169] |
|
Bacteroides spp. |
Грамотрицательные облигатные анаэробы палочковидной формы; переменная подвижность |
Активация CD4+ Т-клеток |
Повышенное обилие при ВЗК |
[170– 173] |
|
Alistipes spp. |
Грамотрицательный облигатный анаэроб палочковидной формы; желчеустойчивый и пигмент-продуцирующийа |
Сообщается в тканях от острого аппендицита, периректальных абсцессов и абсцессов головного мозга. |
[174] |
|
|
Bilophila spp. |
Грамотрицательный облигатный анаэроб уреаза-позитивный, желчеустойчивый, каталаза-позитивный |
Стимулирование провоспалительного иммунитета TH1 |
B. wadsworthia наблюдается при колите, перфорированном и гангренозном аппендиците, абсцессах печени и мягких тканей, холецистите, FG, эмпиеме, остеомиелите и HS |
[175, 176] |
|
Clostridium spp. |
Грамположительные облигатные анаэробы палочковидной формы; спорообразующие |
Стимулирование генерации ТН17 клеток |
Некоторые из них являются патогенными, вызывая столбняк, ботулизм, газовую гангрену или псевдомембранозный колит |
[177, 178] |
|
Roseburia spp. |
Грамположительный облигатный анаэроб изогнутый стержневидный; подвижный |
Производство SCFA |
Снижение обилия при ВЗК |
[179] |
|
Eubacterium spp. |
Грамположительные облигатные анаэробы палочковидной формы |
Производство SCFA; образует полезные фенольные кислоты |
Снижение обилия при ВЗК |
[180, 181] |
|
Enterococcus spp. |
Грамположительные факультативные анаэробные кокки |
Некоторые spp. являются патогенными, вызывающими ИМП, эндокардит или бактериемию |
[182] |
|
|
Faecalibacterium prausnitzii |
Грамположительный облигатный анаэроб палочковидной формы; немотильный |
Продукция SCFA; противовоспалительные эффекты |
Снижение обилия при ВЗК и ожирении |
[183, 184] |
|
Akkermansia muciniphila |
Грамотрицательный облигатный анаэроб овальной формы; немотильный |
Противовоспалительное действие |
Снижение изобилия при ВЗК, ожирении и псориатическом артрите |
[53, 133, 185] |
|
Escherichia coli |
Грамотрицательный факультативный анаэроб палочковидной формы |
TLR-активация |
Повышенная распространенность ВЗК при гастроэнтерите, ИМП и менингите |
[186– 188] |
|
Helicobacter pylori |
Грамотрицательный микроаэрофильный спиралевидный; подвижный |
Гастрит; язва; злокачественные новообразования MALT |
[189, 190] |
|
|
Streptococcus spp. |
Грамположительные факультативные анаэробные кокки |
Некоторые spp. являются патогенными, вызывающими менингит, пневмонию и эндокардит |
[191] |
spp. — виды, SCFA – короткоцепочечные жирные кислоты, LPS — липополисахарид, ВЗК – воспалительные заболевания кишечника, ТН — T-хэлпер, FG — гангрена Фурнье, HS гнойный гидраденит, ИМП — инфекция мочевыводящих путей, TLR — toll-подобный рецептор, MALT — лимфоидная ткань, ассоциированная со слизистой оболочкой.
aA. putredinis не производит пигментов и чувствителен к желчи
Методы
В сентябре 2015 года мы провели систематический обзор литературы, выполнив поиск в электронной базе данных MEDLINE через PubMed. Поисковые запросы включали комбинации терминов «микробиота», «слизистая оболочка кишечника / микробиология», «желудочно-кишечный тракт / микробиология», «желудочно-кишечные заболевания / микробиология», «диета», «еда», «полисахариды», «углеводы», « белки »,« мясо »,« жир», «лактоза», «олигофруктоза», «пребиотики», «пробиотики», «полифенолы», «крахмал», «соя», «сахароза», «фруктоза», «диета, вегетарианский», «диетический, западный», «злаки», «пищевые волокна» и «пищевые добавки». Статьи рецензировались независимо двумя исследователями, R.K.S. и K.M.L, и это было решено W.L. Мы ограничили наш поиск статьями, доступными на английском языке, исследованиями на людях и статьями, опубликованными между 1970 и 2015 годами. Мы исключили исследования, в которых прямо не рассматривалось влияние диетического вмешательства на микробный состав. Ручной поиск по спискам литературы к статьям также был выполнен для выявления дополнительных исследований. В результате для включения в этот обзор было отобрано 188 статей. Исследования, описывающие взаимосвязь между конкретными диетическими компонентами и составом кишечной микробиоты, варьировались от числа участников n = 3 до n = 344, при этом большинство исследований было сгруппировано вокруг числа субъектов n = 20-70. Проекты исследований были в основном рандомизированными контролируемыми исследованиями, перекрестными исследованиями, исследованиями случай-контроль и исследованиями in vitro. В дополнение к исследованиям на людях было также включено несколько исследований на животных, чтобы продемонстрировать влияние питания на микробиом в контролируемых экспериментальных условиях.
Диета и микробиота
Белок
Воздействие пищевого белка на микробиоту кишечника было впервые описано в 1977 году. Исследование на основе культуры продемонстрировало более низкое количество Bifidobacterium adolescentis и повышенное количество Bacteroides и Clostridia у субъектов, потребляющих диету с высоким содержанием говядины, по сравнению с субъектами, потребляющими диету без мяса [27]. С развитием секвенирования 16S рРНК, несколько исследований смогли всесторонне изучить влияние пищевого белка на микробный состав кишечника (исследования перечислены в таблице 2). В ходе этих исследований участникам давали различные формы белка, такие как тяжелый белок животного происхождения из мяса, яиц и сыров; сывороточный протеин; или чисто вегетарианские источники, такие как гороховый белок. В большинстве исследований отмечается, что потребление белка положительно коррелирует с общим микробным разнообразием [13, 28–30]. Например, потребление экстракта сывороточного протеина и горохового протеина, как сообщалось, увеличивает комменсальные кишечные Bifidobacterium и Lactobacillus, тогда как сыворотка дополнительно снижает патогенные Bacteroides fragilis и Clostridium perfringens [31–33]. Белок гороха также увеличивает уровни SCFAs в кишечнике, которые считаются противовоспалительными и важными для поддержания слизистого барьера [34]. Напротив, было отмечено увеличение количества устойчивых к желчи анаэробов, таких как Bacteroides, Alistipes и Bilophila, с потреблением белка животного происхождения (рис. 2) [13, 29, 30]. Это наблюдение может быть дополнительно подтверждено независимым исследованием, в котором исследователи сравнили микробиоту итальянских детей с микробиотой детей из сельской африканской деревни. Итальянские дети, которые ели больше животного белка, были обогащены бактериями Bacteroides и Alistipes в своей микробиоте [35]. Примечательно, что одно исследование, сравнивающее калорийно эквивалентный рацион с высоким содержанием животного белка и рационом с высоким содержанием углеводов / клетчатки на растительной основе, показало, что вес субъектов на растительной диете оставался стабильным, но на основе животного белка значительно снизился к 3 дню диеты (q < 0,05). Хотя потребление с высоким содержанием белка/низким содержанием углеводов может способствовать большей относительной потере веса, такая диета может нанести ущерб здоровью. Одно исследование показало, что у субъектов, придерживающихся диеты с высоким содержанием белка / низким содержанием углеводов, снижается уровень Roseburia и Eubacterium rectale в микробиоте кишечника и снижается доля бутирата в кале [36]. В своем исследовании De Filippo et al. [35] аналогичным образом отметили меньшее количество SCFAs в кале у итальянцев, которые придерживались богатой белком диеты. В качестве интересного клинического коррелята несколько исследований продемонстрировали, что пациенты с ВЗК обладают меньшим количеством фекальных Roseburia и других бактерий, продуцирующих бутират, чем здоровые люди. С другой стороны, у здоровых людей в кишечнике в 10 раз больше E. rectale [37–39]. Эти бактериальные изменения в кишечнике могут быть ответственны за обнаружение в крупном проспективном исследовании (n = 67 581), что высокое потребление общего белка, особенно животного белка, связано со значительно повышенным риском ВЗК [40]. Кроме того, несколько микробных родов, стимулируемых потреблением красного мяса, также были связаны с повышенным уровнем триметиламин-N-оксида (TMAO), проатерогенного соединения, которое увеличивает риск сердечно-сосудистых заболеваний [41].
Рис. 2. Влияние диетического белка на кишечную микробиоту и состояние здоровья. SCFA — Короткоцепочечные жирные кислоты, TMAO – триметиламин-N-оксид, Treg — регуляторные Т-клетки, ССЗ — сердечно-сосудистые заболевания; ВЗК — оспалительное заболевание кишечника.
Таблица 2. Влияние белка на микробиоту кишечника
|
Микробное разнообразие |
Bifido-bacteria |
Lacto-bacilli |
Bacteroides |
Alistipes |
Bilophila |
Clostridia |
Roseburia |
Eubacterium Rectale |
Ref. |
|
|
ЖБ |
↑ |
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
↓ |
↑↓ |
13, 29-35, 38-40 |
|
|
ЭСБ |
↑ |
↑ |
↑ |
↓ |
↓ |
32, 33 |
||||
|
ЭГБ |
↑ |
↑ |
↑ |
31 |
ЖБ – животный белок, ЭСБ – экстракт сывороточного белка, ЭГБ – экстракт горохового белка
Толщина стрелки соответствует относительному количеству исследований, подтверждающих эту взаимосвязь
Исследования на мышах показали, что высокое потребление белка увеличивает уровни инсулиноподобного фактора роста 1 (IGF-1), которые, в свою очередь, связаны с повышенным риском рака, диабета и общей смертности. В одном исследовании белки растительного происхождения связаны с более низкой смертностью, чем белки животного происхождения [42]. Соответственно, длительная практика таких диетических привычек может увеличить риск заболеваний толстой кишки и других заболеваний. Важно отметить, что диеты, основанные на животных белках, часто содержат большое количество жиров в дополнение к белку. Диетический жир также может влиять на микробный состав; поэтому потребуются дальнейшие исследования, чтобы выяснить, в каком качестве каждая отдельная макромолекула влияет на бактериальные сообщества и как они действуют согласованно.
Жиры
Считается, что потребление продуктов с высоким содержанием насыщенных жиров и трансжиров увеличивает риск сердечно-сосудистых заболеваний за счет повышения уровня общего холестерина и холестерина ЛПНП в крови [43, 44]. С другой стороны, полезные для здоровья жиры, такие как моно- и полиненасыщенные жиры, имеют решающее значение для снижения риска хронических заболеваний. Типичная западная диета отличается высоким содержанием насыщенных и трансжиров и низким содержанием моно- и полиненасыщенных жиров, что предрасполагает постоянных потребителей ко многим проблемам со здоровьем [45–47]. Несколько исследований на людях показали, что диета с высоким содержанием жиров увеличивает общую анаэробную микрофлору и количество Bacteroides [26, 29, 48, 49] (исследования перечислены в таблице 3). Чтобы специально исследовать влияние различных видов пищевых жиров на микробиоту кишечника человека, в работе Fava et al. испытуемые потребляли диеты с различным содержанием жира. Авторы отметили, что потребление диеты с низким содержанием жиров привело к увеличению содержания Bifidobacterium в кале с одновременным снижением уровня глюкозы натощак и общего холестерина по сравнению с исходным уровнем. С другой стороны, диета с высоким содержанием насыщенных жиров увеличивала относительную долю Faecalibacterium prausnitzii. Наконец, у испытуемых с высоким потреблением мононенасыщенных жиров не наблюдалось сдвигов в относительном обилии каких-либо родов бактерий, но наблюдалось общее снижение общей бактериальной нагрузки и общего холестерина в плазме и холестерина ЛПНП [49]. В соответствии с этими выводами, потребление лосося с высоким содержанием моно- и полиненасыщенных жиров также не изменило состав фекальной микробиоты у 123 испытуемых [50]. Исследования на крысах показали, что потребление диеты с высоким содержанием жиров приводит к значительно меньшему количеству Lactobacillus intestinalis и непропорционально большему количеству видов, продуцирующих пропионат и ацетат, включая Clostridiales, Bacteroides и Enterobacteriales. Кроме того, обилие Lactobacillus intestinalis отрицательно коррелирует с массой жира крыс и массой тела [51]. Было также показано, что микробные изменения контролируют воспаление, вызванное метаболической эндотоксемией, у мышей, потребляющих диету с высоким содержанием жиров [52]. Исследования на мышах также сравнивали дифференциальное влияние различных липидов на микрофлору кишечника. Сравнение липидов, полученных из свиного сала, и липидов, полученных из рыбьего жира, показало, что у мышей, получавших свиное сало, были увеличены бактерии Bacteroides и Bilophila, в то время как у мышей, получавших рыбий жир, были увеличены актинобактерии (Bifidobacterium и Adlercreutzia), молочнокислые бактерии (Lactobacillus и Streptococcus) и Verrucomicrobia (Akkermansia muciniphila). Кроме того, у мышей, получавших жир, наблюдалась повышенная системная TLR-активация, воспаление белой жировой ткани и нарушение чувствительности к инсулину по сравнению с мышами, потребляющими рыбий жир. Авторы продемонстрировали, что эти результаты, по крайней мере, частично связаны с различиями в микробиоте кишечника между двумя группами; Трансплантация микробиоты из одной группы в другую, которой до этого вводили антибиотик, не только обогатила кишечник реципиента трансплантата доминантными родами от видов-доноров, но также воспроизвела воспалительные и метаболические фенотипы донора. Эти результаты указывают на то, что микробиота кишечника может способствовать метаболическому воспалению посредством передачи сигналов TLR при введении диеты, богатой насыщенными липидами (рис. 3) [53].
Рис. 3. Влияние пищевых жиров на микробиоту кишечника и метаболизм хозяина. TLR — toll-подобный рецептор, WAT — белая жировая ткань, ЛПНП — липопротеин низкой плотности
Табл. 3. Влияние жиров на микробиоту кишечника
|
Lactic acid bacteriaa |
Bifido-bacteria |
Clostridiales |
Bacteroides |
Bilophila |
Faecalibacterium prausnitzii |
Akkermansia muciniphila |
Ref. |
|
|
С высоким содержанием жира |
↓ |
↑ |
↑ |
30, 49, 51, 52 |
||||
|
С низким содержанием жира |
↑ |
49 |
||||||
|
С высоким содержанием насыщенных жиров |
↑ |
↑ |
↑ |
26, 49 |
||||
|
С высоким содержанием ненасыщенных жиров |
↑ |
↑ |
↑ |
45, 49, 50 |
aМолочнокислые бактерии включают лактобактерии (Lactobacillus) и стрептококки (Streptococcus)
Углеводы
Легкоусвояемые углеводы (крахмал, сахар)
Углеводы, возможно, являются наиболее хорошо изученным диетическим компонентом из-за их способности изменять микробиом кишечника (исследования перечислены в таблице 4). Углеводы бывают двух видов: легкоусвояемые и неперевариваемые. Усвояемые углеводы ферментативно разлагаются в тонком кишечнике и включают крахмалы и сахара, такие как глюкоза, фруктоза, сахароза и лактоза. При деградации эти соединения высвобождают глюкозу в кровоток и стимулируют реакцию на инсулин [54]. У людей, получавших высокие уровни глюкозы, фруктозы и сахарозы в виде финиковых плодов [55], было увеличено относительное обилие бифидобактерий при снижении бактериоидов [56]. В отдельном исследовании добавление лактозы в рацион воспроизводило те же самые бактериальные сдвиги, а также уменьшало количество видов клостридий. Примечательно, что многие виды Clostridium cluster XIVa были связаны с синдромом раздраженного кишечника [57, 58]. Кроме того, было замечено, что добавление лактозы увеличивает концентрацию полезных SCFAs в кале [58]. Эти результаты являются довольно неожиданными, учитывая, что лактозу обычно считают потенциальным раздражителем желудочно-кишечного тракта (например, непереносимость лактозы). Дальнейшие исследования, подтверждающие эти наблюдения, могут помочь прояснить эффекты лактозы.
Табл. 4. Влияние натурального и искусственного сахара на микробиоту кишечника
|
Bifidobacteria |
Bacteroides |
Clostridia |
Lactobacilli |
References |
|
|
Глюкоза |
↑ |
↓ |
[55, 56] |
||
|
Фруктоза |
↑ |
↓ |
[55, 56] |
||
|
Сахароза |
↑ |
↓ |
[55, 56] |
||
|
Лактоза |
↑ |
↓ |
↓ |
↑ |
[58] |
|
Искусственные подсластители |
↓ |
↑ |
↓ |
↓ |
[59] |
Искусственные подсластители сахарин, сукралоза и аспартам представляют собой еще одно диетическое противоречие. Изначально искусственные подсластители продавались как безопасный для здоровья, не калорийный продукт, который можно было использовать вместо натурального сахара. Недавние данные Suez et al. показали, что потребление всех типов искусственных подсластителей на самом деле с большей вероятностью вызывает непереносимость глюкозы, чем потребление чистой глюкозы и сахарозы. Интересно, что считается, что искусственные подсластители опосредуют этот эффект за счет изменения микробиоты кишечника. Например, у мышей, получавших сахарин, был отмечен дисбактериоз кишечника с повышенным относительным содержанием Bacteroides и пониженным содержанием Lactobacillus reuteri [59]. Эти микробные сдвиги прямо противоположны изменениям, вызванным потреблением натуральных сахаров (глюкозы, фруктозы и сахарозы), как упоминалось выше. Судя по имеющимся данным, вопреки распространенному мнению, искусственные подсластители могут быть вреднее для здоровья, чем натуральные сахара.
Неперевариваемые углеводы (клетчатка)
В отличие от перевариваемых углеводов, неперевариваемые углеводы, такие как клетчатка и резистентный крахмал, не подвергаются ферментативному разложению в тонкой кишке. Вскоре, они попадают в толстую кишку, где подвергаются ферментации резидентными микроорганизмами. Соответственно, пищевые волокна являются хорошим источником «углеводов, доступных для микробиоты» (MACs), которые могут использоваться микробами для обеспечения хозяина энергией и источником углерода [25, 60, 61]. В процессе они могут изменять кишечную среду. Это свойство волокон требует их дополнительного обозначения как пребиотиков, которые по определению являются неперевариваемыми пищевыми компонентами, которые приносят пользу здоровью хозяина за счет избирательной стимуляции роста и / или активности определенных микроорганизмов [62]. Источники пребиотиков включают соевые бобы, инулины, нерафинированную пшеницу и ячмень, сырой овес и неперевариваемые олигосахариды, такие как фруктаны, полидекстроза, фруктоолигосахариды (FOS), галактоолигосахариды (GOS), ксилолигосахариды (XOS) и арабиноолигосахариды (AOS) [63]. Было показано, что диета с низким содержанием этих веществ снижает общую численность бактерий [64]. С другой стороны, высокое потребление этих углеводов у 49 субъектов с ожирением привело к увеличению богатства генов микробиоты [30]. Что касается их воздействия на определенные роды бактерий, многие исследования показывают, что диета, богатая неперевариваемыми углеводами, наиболее последовательно увеличивает количество кишечных бифидобактерий и молочнокислых бактерий (исследования, перечислены в таблице 5). Многочисленные исследования, перечисленные в таблице 5, соответствующие каждому типу пребиотиков, перечисленных выше, подтверждают эти выводы. Например, диета с неперевариваемыми углеводами, богатая цельнозерновыми и пшеничными отрубями, связана с увеличением количества кишечных бифидобактерий и лактобацилл [65, 66]. Другие неперевариваемые углеводы, такие как резистентный крахмал и цельнозерновой ячмень, по-видимому, также увеличивают численность Ruminococcus, E. rectale и Roseburia [3, 67, 68]. Кроме того, было отмечено, что пребиотики на основе FOS, полидекстрозы и AOS снижают количество видов клостридий (Clostridium) [69-72] и энтерококков (Enterococcus) [73-76]. Перекрестное исследование 344 пациентов с прогрессирующими колоректальными аденомами показало, что Roseburia и Eubacterium были значительно менее распространены, в то время как Enterococcus и Streptococcus были более распространены у этих субъектов по сравнению со здоровыми людьми из контрольной группы. Уменьшение количества пищевых волокон и стабильно более низкое производство SCFAs также наблюдались в группе аденомы [77].
Табл. 5. Влияние неперевариваемых углеводов на микробиоту кишечника
|
Обилие бактерий |
Генное богатство |
Lacto-bacilli |
Bifido-bacteria |
Clostridia |
Entero-coccus |
Roseburia |
Eubacteria |
Rumino-coccus |
Ref |
|
|
Волокно/ пребиотики |
↑ |
↑ |
↑ |
↑ |
↓ |
↑↓ |
30, 64– 66, 69– 76 |
|||
|
Резист. крахмал |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
3, 30, 67– 69, 72– 74 |
В дополнение к их влиянию на состав микробиоты и, вероятно, частично опосредованному этими эффектами, пребиотики также вызывают заметные сдвиги в метаболических и иммунных маркерах. Например, несколько групп наблюдали снижение провоспалительного цитокина IL-6, инсулинорезистентности и пикового уровня глюкозы после приема пищи, связанного с потреблением неперевариваемых углеводов, присутствующих в цельнозерновых продуктах [67, 78, 79]. Одна группа дополнительно наблюдала снижение общей массы тела и концентрации триглицеридов в сыворотке, общего холестерина, холестерина ЛПНП и гемоглобина A1c [79]. West et al. [80] отметили повышение уровня в плазме противовоспалительного цитокина IL-10 при потреблении бутирилированного кукурузного крахмала с высоким содержанием амилозы. Считается, что благотворное влияние пребиотиков на иммунную и метаболическую функцию кишечника связано с увеличением выработки SCFAs и укреплением ассоциированной с желудочно-кишечным трактом лимфоидной ткани (GALT) в результате ферментации клетчатки [81].
Пробиотики
Ферментированные продукты, содержащие молочнокислые бактерии, такие как кисломолочные продукты и йогурт, представляют собой источник съедобных микроорганизмов, которые могут положительно регулировать здоровье кишечника и даже лечить или предотвращать воспалительные заболевания кишечника [82]. Считается, что они достигают этого за счет своего воздействия на существующий микробиом кишечника (исследования перечислены в таблице 6) в дополнение к возможной индукции противовоспалительных цитокинов, таких как IL-10 [83]. На основании этих свойств продукты, обогащенные этими модулирующими микроорганизмами, называют пробиотиками. Несколько групп сообщили об увеличении общей бактериальной нагрузки после регулярного употребления ферментированного молока или йогурта [84–87]. Заметное увеличение количества полезных кишечных бифидобактерий и / или лактобацилл также постоянно наблюдалось при применении нескольких различных типов пробиотиков [85–97]. Рандомизированное плацебо-контролируемое испытание 60 здоровых взрослых с избыточным весом, получавших пробиотики, содержащие три штамма бифидобактерий, четыре штамма лактобактерий и один штамм стрептококков, сообщило о значительном увеличении концентрации общих аэробов, анаэробов, лактобацилл, бифидобактерий и стрептококков по сравнению с плацебо. У этих субъектов также было меньше общих колиформ и Escherichia coli, а также снижено содержание триглицеридов, общего холестерина, холестерина ЛПНП, холестерина ЛПОНП и высокочувствительного С-реактивного белка (вчСРБ). Чувствительность к холестерину ЛПВП и инсулину улучшилась после приема пробиотиков. Интересно, что у субъектов с исходным низким уровнем ЛПВП, повышенной инсулинорезистентностью и повышенным вчСРБ было отмечено значительно меньшее количество лактобацилл и бифидобактерий с большим количеством Escherichia coli и Bacteroides [98]. Было также показано, что йогурт, содержащий пробиотики, значительно снижает количество энтеропатогенной кишечной палочки и Helicobacter pylori [94, 99].
Таблица 6. Влияние пробиотиков на микробиоту кишечника
|
Обилие бактерий |
Bifido-bacteria |
Lacto-bacilli |
Streptococcus |
Всего аэробы / анаэробы |
Общие колиформы |
H. pylori |
E. coli |
Ref |
|
|
Пробиотики |
↑ |
↑ |
↑ |
↑ |
↑ |
↓ |
↓ |
↓ |
84-98 |
Другие зарегистрированные преимущества для здоровья от употребления ферментированных молочных продуктов включают облегчение симптомов непереносимости желудочно-кишечного тракта [86, 100–102], ускорение кишечного транзита [96], увеличение общего сывороточного IgA для усиления гуморального иммунного ответа [90, 93, 94, 103], ингибирование адгезии патогенов к слизистой оболочке кишечника [104] и уменьшение вздутия живота и асцита у пациентов с хроническими заболеваниями печени [99]. Одно исследование, в котором анализировался стул пациентов с СРК с преобладанием диареи, выявило снижение численности Lactobacillus [105]. Интересно, что лактобациллы и бифидобактерии действительно успешно использовались для профилактики диареи путешественников [106].
Полифенолы
Диетические полифенолы, которые включают катехины, флавонолы, флавоны, антоцианы, проантоцианидины и фенольные кислоты, активно изучаются на предмет их антиоксидантных свойств (исследования перечислены в таблице 7). Обычные продукты с высоким содержанием полифенолов включают фрукты, семена, овощи, чай, какао-продукты и вино [107]. Обычно обогащенные бактериальные роды среди исследований, анализирующих эти источники пищи, включают бифидобактерии и лактобактерии [56, 108-114]. Сообщалось также, что относительное обилие бактероидов увеличивается у лиц, потребляющих полифенолы красного вина [110, 115, 116]. Бифидобактерии являются широко используемым штаммом пробиотиков с зарегистрированными преимуществами для здоровья, такими как иммуномодуляция, профилактика рака и лечение воспалительных заболеваний кишечника [63]. С точки зрения дальнейшей пользы для здоровья потребление полифенолов, полученных из какао, было связано со значительным повышением уровня ЛПВП в плазме и значительным снижением концентрации триацилглицерина и С-реактивного белка в плазме [112, 117]. Кроме того, исследование антибактериальной активности фруктовых полифенолов показало высокую чувствительность к этим соединениям у энтеропатогенов Staphylococcus aureus и Salmonella typhimurium [118]. Более того, уменьшение количества патогенных видов Clostridium (C. perfringens и C. histolyticum) было отмечено после употребления полифенолов фруктов, семян, вина и чая [108, 112, 113, 119–122].
Таблица 7. Влияние полифенолов на микробиоту кишечника
|
Bifido-bacteria |
Lacto-bacilli |
Bacteroides |
Clostridia |
Salmonella typhimurium |
Staphylococcus aureus |
Ref |
|
|
Полифенолы |
↑ |
↑ |
↓ |
↓ |
↓ |
↓ |
56,108–116,119–122 |
Выберите диеты
Несколько популярных диет, в том числе западная, безглютеновая, всеядная, вегетарианская, веганская и средиземноморская, были изучены на предмет их способности модулировать кишечную микробиоту (рис. 4, исследования, перечисленные в таблице 8). В нескольких исследованиях было показано, что западная диета (с высоким содержанием животного белка и жира, с низким содержанием клетчатки) привела к заметному снижению общего количества бактерий и полезных видов Bifidobacterium и Eubacterium [26, 29, 48]. Потребление западной диеты также было связано с производством стимулирующих рак нитрозаминов [123, 124].
Рис. 4. Влияние популярных диет на микробиоту кишечника и кардиометаболические заболевания. ССЗ — сердечно-сосудистые заболевания, СД2 — сахарный диабет 2 типа.
Табл. 8. Влияние специальных диет на микробиоту кишечника
|
Диета |
Пищевые компоненты |
Всего бактерий |
Bifido-bacteria |
Lacto-bacilli |
Prevotella |
Eu-bacteria |
Rose-buria |
Bacteroides |
Entero-bacteria |
Ref |
|
Западная |
Высокое содержание животного жира / белка |
↓ |
↓ |
↓ |
↓ |
↑ |
↑ |
26, 29, 48 |
||
|
Средизем-номорская |
Высокое содержание клетчатки / Антиоксидантов / красное мясо с низким содержанием НЖК |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
41, 129, 192 |
|
|
Без-глютеновая |
Без глютена |
↓ |
↓ |
↓ |
↓ |
↓ |
↓ |
↑ |
125, 126, 193– 195 |
НЖК — Ненасыщенные жирные кислоты
В исследовании Sanz et al. 10 здоровых субъектов придерживались безглютеновой диеты в течение 30 дней. Популяции «здоровых бактерий» уменьшились (Bifidobacterium и Lactobacillus), в то время как популяции потенциально нездоровых бактерий увеличивались параллельно с сокращением потребления полисахаридов после начала диеты. В частности, было обнаружено увеличение количества E. coli и общего количества Enterobacteriaceae, которые могут включать и другие условно-патогенные микроорганизмы [125]. Bonder et al. [126] аналогичным образом исследовали влияние краткосрочной безглютеновой диеты, отметив уменьшение количества Ruminococcus bromii и Roseburia faecis с увеличением количества Victivallaceae и Clostridiaceae.
Веганские и вегетарианские диеты обогащены ферментируемыми растительными продуктами. Одно исследование сравнивало веганскую и вегетарианскую диеты с неограниченной контрольной диетой и обнаружило, что как веганы, так и вегетарианцы имели значительно меньшее количество видов Bifidobacterium и Bacteroides [127] (p <0,001). Интересно, что другое исследование обнаружило очень скромные различия в микробах кишечника веганов и всеядных субъектов [128]. Расхождение между этими двумя исследованиями может быть связано с разными методологиями профилирования микробиома (на основе посева или секвенирования), разными диетами контрольной группы и / или генетикой хозяина. Будущие исследования с тщательным экспериментальным дизайном потребуются, чтобы лучше понять дифференциальное влияние веганской и вегетарианской диеты на микробиом кишечника.
По всему спектру средиземноморская диета высоко ценится как здоровая сбалансированная диета. Она отличается полезным профилем жирных кислот, которая богата как мононенасыщенными, так и полиненасыщенными жирными кислотами, высоким уровнем полифенолов и других антиоксидантов, высоким потреблением клетчатки и других углеводов с низким гликемическим индексом, а также относительно большим потреблением растительного белка, чем животного. В частности, оливковое масло, различные фрукты, овощи, злаки, бобовые и орехи; умеренное потребление рыбы, птицы и красного вина; и более низкое потребление молочных продуктов, красного мяса, обработанного мяса и сладостей характеризует традиционную средиземноморскую диету [129]. De Filippis et al. исследовали потенциальные преимущества средиземноморской диеты, сравнивая обычных всеядных, вегетарианцев и веганов. Они заметили, что большинство веганов и вегетарианцев, но только 30% всеядных, строго придерживались средиземноморской диеты. Они обнаружили значительную связь между степенью приверженности средиземноморской диете и повышенным уровнем фекальных SCFAs, бактерий Prevotella и других Firmicutes. В то же время низкое соблюдение средиземноморской диеты было связано с повышенным уровнем триметиламиноксида в моче, что связано с повышенным риском сердечно-сосудистых заболеваний [41]. Несколько других исследований показали, что продукты, входящие в состав типичной средиземноморской диеты, также улучшают ожирение, липидный профиль и воспаление. Эти изменения могут быть опосредованы увеличением содержания Lactobacillus, Bifidobacterium и Prevotella в результате диеты и снижением Clostridium [49, 110, 114, 130–132].
Обсуждение
Возможность быстро идентифицировать и количественно определять роды кишечных бактерий помогла нам понять влияние диеты на микробный состав хозяина. Исследования, которые включают потребление определенного пищевого компонента, демонстрируют, как определенные бактерии склонны реагировать на проблему, связанную с питательными веществами. Белок, жиры, легкоусвояемые и неперевариваемые углеводы, пробиотики и полифенолы вызывают сдвиги в микробиоме, оказывая вторичное влияние на иммунологические и метаболические маркеры хозяина. Например, потребление животного белка положительно коррелирует с общим микробным разнообразием, увеличивает численность устойчивых к желчи организмов, таких как Bacteroides, Alistipes и Bilophila, и снижает представленность группы Roseburia / Eubacterium rectale. Диета с высоким содержанием насыщенных жиров, по-видимому, увеличивает количество анаэробной микрофлоры и относительное количество Bacteroides и Bilophila. Исследования на людях не показали, что диета с высоким содержанием ненасыщенных жиров значительно изменяет бактериальный профиль кишечника; однако исследования на мышах сообщили об увеличении количества актинобактерий (Bifidobacterium и Adlercreutzia), молочнокислых бактерий (Lactobacillus и Streptococcus) и веррукомикробии (Akkermansia muciniphila). В литературе обычно сообщается, что как усвояемые, так и неперевариваемые углеводы обогащают Bifidobacterium и подавляют Clostridia, в то время как только неперевариваемые углеводы дополнительно обогащают Lactobacillus, Ruminococcus, Eubacterium rectale и Roseburia. Наконец, как пробиотики, так и полифенолы усиливают действие Bifidobacterium и молочнокислых бактерий, одновременно уменьшая количество энтеропатогенных видов Clostridia.
Поддержание здорового микробиома кишечника имеет решающее значение для здоровья человека
Все больше данных свидетельствует о том, что микробиом кишечника оказывает огромное влияние на наше здоровье. В последнее десятилетие было показано, что кишечные микроорганизмы играют роль в широком спектре заболеваний человека, включая ожирение, псориаз, аутизм и расстройства настроения [133–136]. Тесная взаимосвязь между диетой, микробиомом кишечника и здоровьем предполагает, что мы можем улучшить свое здоровье, изменив свой рацион. Одним из способов воздействия микробиоты на здоровье хозяина является изменение иммунитета хозяина. Исследования на стерильных животных показали, что микробиом кишечника необходим для набора и дифференциации иммунных клеток [137]. Дальнейшие исследования выявили более специфические роли некоторых видов бактерий в опосредовании иммунитета хозяина и иммунологических заболеваний. В частности, было обнаружено, что сегментированные нитчатые бактерии способствуют развитию аутоиммунного артрита за счет усиленного ответа Th17 [20, 138]. С другой стороны, молочнокислые бактерии и бифидобактерии, как известно, секретируют факторы, которые ослабляют воспаление, подавляя экспрессию зависимых от NF-κB генов, секрецию IL-8 и уровни хемокинов, привлекающих макрофаги [139]. Также было показано, что молочнокислые бактерии и бифидобактерии непосредственно подавляют воспалительные реакции, опосредованные Т-эффекторными клетками, одновременно повышая экспрессию противовоспалительных Т-регуляторных клеток у мышей [140]. Точный механизм того, как эта кишечная флора модулирует иммунные реакции, до сих пор не совсем понятен; однако несколько исследований показывают, что SCFAs микробного происхождения могут вносить свой вклад через рецептор, связанный с G-белком, и эпигенетические механизмы [141, 142]. Также было показано, что кишечные SCFAs напрямую увеличивают количество Т-регуляторных клеток в кишечнике и защищают от аллергического воспаления дыхательных путей [17, 143–145]. Кроме того, они могут ингибировать фактор транскрипции NF-κB, что приводит к снижению секреции некоторых провоспалительных цитокинов [130]. Флора кишечника также может модулировать иммунитет хозяина посредством эпигенетических модификаций. Например, бутират микробного происхождения ингибирует гистондеацетилазы 6 и 9, что приводит к усилению ацетилирования в промоторе гена FOXP3 и более высокой пролиферации регуляторных Т-клеток [142]. Снижение метилирования в промоторах провоспалительных генов TLR2 и FFAR3 коррелирует со снижением численности Faecalibacterium prausnitzii у пациентов с диабетом 2 типа [146, 147]. Очевидно, что микробиом кишечника оказывает разнообразное воздействие на иммунитет хозяина, и сбалансированная микрофлора кишечника имеет решающее значение для здоровой иммунной системы (таблица 9).
Таблица 9. Влияние диетических компонентов на иммунные параметры
|
SCFA |
TLR |
WAT |
Met Endo |
LPS |
CRP |
IL-6 |
IL-10 |
IgA |
References |
|
|
Пребиотики |
↑ |
↓ |
↓ |
↑ |
[67, 78–81, 120] |
|||||
|
Пробиотики |
↑ |
↓ |
↑ |
↑ |
[83, 88, 97–99, 103] |
|||||
|
Полифенолы |
↓ |
↑ |
[115, 117, 122] |
|||||||
|
Ненасыщенные жиры |
↓ |
↓ |
↓ |
↓ |
[50, 120] |
|||||
|
Насыщенный жир |
↑ |
↑ |
↑ |
↑ |
[37, 52, 53, 58] |
|||||
|
Животный белок |
↓ |
[39–41] |
||||||||
|
Гороховый протеин |
↑ |
[31] |
SCFA – короткоцепочечные жирные кислоты,TLR — активация толл-подобных рецепторов, WAT — воспаление белой жировой ткани, MetEndo — метаболическая эндотоксемия, LPS — уровни липополисахаридов, CRP — С-реактивный белок, IL-6 — интерлейкин-6, IL-10 — интерлейкин-10, IgA — иммуноглобулин А
Помимо иммунитета, было показано, что кишечные микроорганизмы также влияют на метаболическое здоровье хозяина. Было показано, что люди с метаболическими нарушениями, такими как ожирение и диабет, имеют дисбактериоз кишечника по сравнению со здоровыми людьми [148, 149]. Дальнейшая характеристика связи между микробиомом кишечника и ожирением выявила несколько групп бактерий, которые могут конкретно способствовать развитию заболевания. В частности, люди с ожирением имеют высокое исходное соотношение Firmicutes и Bacteroidetes. У этих испытуемых было отмечено, что снижение потребления калорий снижает соотношение Firmicutes к Bacteroidetes [148]. Интересно, что хозяева с кишечным микробиомом, в котором доминируют фирмикуты, изменили метилирование в промоторах генов, связанных с сердечно-сосудистыми заболеваниями и ожирением [150]. Кроме того, было показано, что Lactobacillus spp. облегчает метаболические осложнения, связанные с ожирением [151, 152]. Благотворное влияние лактобацилл можно объяснить взаимодействием с бактериями, способствующими ожирению, в кишечнике и прямой модуляцией иммунитета хозяина и барьерной функции кишечника [153]. Интересно, что бактерии, разрушающие слизь, A. muciniphila также были связаны со здоровым метаболическим профилем. Тучные люди с более высоким исходным относительным обилием A. muciniphila, как правило, имеют большее улучшение метаболических параметров, связанных с ожирением (толерантность к инсулину, триглицериды плазмы и распределение жира в организме) после диетического вмешательства [154]. Интересно, что мыши без микробов более устойчивы к ожирению, вызванному диетой, возможно, из-за усиленного метаболизма жирных кислот в отсутствие определенной микрофлоры [155]. Вместе эти результаты демонстрируют важную роль микробиоты кишечника в поддержании метаболической целостности хозяина (таблица 10).
Таблица 10. Влияние диетических компонентов на метаболические параметры
|
Total chol |
LDL-chol |
HDL-chol |
Plasma TG |
Insulin sensitivity |
IGF-1 production |
References |
|
|
Пребиотики |
↓ |
↓ |
↓ |
↑ |
[73, 83, 84] |
||
|
Пробиотики |
↓ |
↓ |
↑ |
↓ |
↑ |
[104] |
|
|
Полифенолы |
↑ |
↓ |
[110, 117, 122] |
||||
|
Ненасыщенные жиры |
↓ |
↓ |
[41] |
||||
|
Насыщенный жир |
↓ |
[51–53] |
|||||
|
Животный белок |
↑ |
[42] |
|||||
|
Искусственные подсластители |
↓ |
[59] |
Chol — холестерин, LDL — липопротеин низкой плотности, HDL — липопротеин высокой плотности, TG — триглицериды, IGF-1 — инсулиноподобный фактор роста-1
Заключение и дальнейшие направления
В заключение, обзор литературы показывает, что диета может изменять микробиом кишечника, что, в свою очередь, оказывает глубокое влияние на общее состояние здоровья. Это воздействие может быть полезным или пагубным, в зависимости от относительной идентичности и численности составляющих бактериальных популяций. Например, было показано, что диета с высоким содержанием жиров отрицательно снижает количество A. muciniphila и Lactobacillus, которые связаны со здоровым метаболическим состоянием [53]. Это наблюдение является хорошим примером того, как диетическое вмешательство может потенциально использоваться для лечения сложных заболеваний, таких как ожирение и диабет. Кроме того, успехи в исследованиях микробиома открыли новые терапевтические возможности для лечения заболеваний, которые традиционно было трудно лечить. Например, трансплантат фекальной микробиоты успешно используется для лечения нескольких различных состояний, включая язвенный колит, колит, связанный с Clostridium difficile, синдром раздраженного кишечника и даже ожирение [156–160]. Возможно, что дерматологические состояния, в том числе псориаз и атопический дерматит, также могут выиграть от реинжиниринга микробиоты кишечника. Последние достижения в исследованиях микробиома предлагают новые захватывающие инструменты, которые могут улучшить здоровье человека. Большинство исследований, рассмотренных в этой рукописи, профилировали микробиом с помощью секвенирования ампликона 16S рРНК, которое использует гипервариабельные области бактериального гена 16S рРНК для идентификации бактерий, присутствующих в биологических образцах. Секвенирование 16S рРНК — это наиболее часто используемый медицинскими исследователями метод изучения микробного состава из-за его низкой стоимости и относительно простого рабочего процесса для подготовки проб и биоинформатических анализов. Однако секвенирование ампликона 16S рРНК в первую очередь предоставляет информацию о микробной идентичности, а не о функции. Чтобы изучить функции микробиома, многие исследователи обратились к метагеномному подходу, при котором секвенируется весь бактериальный геном. Несмотря на более высокую стоимость и более сложные требования к биоинформатике, метагеномика дробовика предоставляет информацию как о микробной идентичности, так и о составе генов. Знание того, какие гены кодируются бактериями, присутствующими в образце, позволяет исследователям лучше понять их роль в здоровье человека. Благодаря снижению затрат на секвенирование следующего поколения, улучшенным протоколам подготовки образцов и большему количеству биоинформатических инструментов, доступных для метагеномного анализа, этот метод станет мощным инструментом для изучения функциональности микробиома. Проведение метаанализов для корреляции микробиома с геномами, транскриптомами и иммунофенотипами хозяина представляет собой еще одно захватывающее направление для исследования взаимодействий человека и бактерий.
Точная (персонализированная) медицина — еще один привлекательный новый подход к лечению многих заболеваний с сильными генетическими ассоциациями. Важно отметить, что генотип хозяина также играет роль в формировании микробиома, и что это взаимодействие хозяина-микроба имеет решающее значение для поддержания здоровья человека [161]. Следовательно, лучшее понимание взаимодействия между генами, фенотипами и микробиомом обеспечит важное понимание полезности точной медицины.
Наблюдение за тем, что диета может модулировать взаимодействия хозяина и микробов, предвещает многообещающий будущий терапевтический подход. Уже было обнаружено, что микробиом кишечника влияет на реакцию на иммунотерапию рака [162, 163]. Действительно, персонализированное питание — это новая концепция, которая использует алгоритм машинного обучения для прогнозирования метаболических реакций на прием пищи [164, 165]. Этот инструмент имеет широкое значение для индивидуального ухода за пациентами посредством изменения диеты. В то время как эта и другие технологии находятся в процессе доработки и проверки, дальнейшие исследования с использованием крупных долгосрочных клинических испытаний для оценки большего разнообразия пищевых компонентов будут полезны для выработки конкретных диетических рекомендаций для пациентов.
О важности оси «диета-микробиом-хозяин» см. по ссылкам:
- Прецизионное питание и микробиом: Часть 1 и Часть 2
- Диета-взаимодействие микробиоты и персонализированное питание
- Питание, здоровье и микробиота кишечника
- Влияние диеты на эволюцию микробиоты и здоровье человека
- Роль диетических питательных веществ в модуляции микробиоты
- Кето диета и микробиом
- Взаимодействие микробиома и диеты: концепция гологенома
- Макро- и микронутриенты, а также пробиотики при лечении псориаза
- Западная диета может привести к псориазу
- Восстановление нарушений пищевого поведения и дисбаланса питания
- Симбионтное пищеварение
- Влияние диеты на структуру хроматина и экспрессию генов
- Функциональные пищевые продукты
Литература
- Gill SR, Pop M, DeBoy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Metagenomic Analysis of the human distal gut microbiome. Science. 2006;312:1355–9. http://www.sciencemag.org/cgi/doi/10.1126/science.1124234. [PMC free article] [PubMed]
- Flint HJ, Duncan SH, Scott KP, Louis P. Interactions and competition within the microbial community of the human colon: links between diet and health. Environ Microbiol. 2007;9:1101–1111. doi: 10.1111/j.1462-2920.2007.01281.x. [PubMed] [CrossRef] [Google Scholar]
- Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze X, et al. Dominant and diet-responsive groups of bacteria within the human colonic microbiota. ISME J. 2011;5:220–230. doi: 10.1038/ismej.2010.118. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, et al. Enterotypes of the human gut microbiome. Nature. 2011;473:174–80. http://www.nature.com/doifinder/10.1038/nature09944. [PMC free article] [PubMed]
- Kurokawa K, Itoh T, Kuwahara T, Oshima K, Toh H, Toyoda A, et al. Comparative metagenomics revealed commonly enriched gene sets in human gut microbiomes. DNA Res. 2007;14:169–181. doi: 10.1093/dnares/dsm018. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Walter J, Ley R. The human gut microbiome: ecology and recent evolutionary changes. Annu Rev Microbiol. 2011;65:411–429. doi: 10.1146/annurev-micro-090110-102830. [PubMed] [CrossRef] [Google Scholar]
- Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Host-bacterial mutualism in the human intestine. Science. 2005;307:1915–1920. doi: 10.1126/science.1104816. [PubMed] [CrossRef] [Google Scholar]
- Topping DL, Clifton PM. Short-chain fatty acids and human colonic function: roles of resistant starch and nonstarch polysaccharides. Physiol Rev. 2001;81:1031–1064. [PubMed] [Google Scholar]
- Lundin A, Bok CM, Aronsson L, Björkholm B, Gustafsson JA, Pott S, et al. Gut flora, toll-like receptors and nuclear receptors: a tripartite communication that tunes innate immunity in large intestine. Cell Microbiol. 2008;10:1093–1103. doi: 10.1111/j.1462-5822.2007.01108.x. [PubMed] [CrossRef] [Google Scholar]
- Lee YK, Mazmanian SK. Has the microbiota played a critical role in the evolution of the adaptive immune system? Science. 2010;330:1768–73. http://www.sciencemag.org/cgi/doi/10.1126/science.1195568. [PMC free article] [PubMed]
- Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation. Cell. 2014;157:121–41. http://linkinghub.elsevier.com/retrieve/pii/S0092867414003456. [PMC free article] [PubMed]
- Noverr MC, Huffnagle GB. Does the microbiota regulate immune responses outside the gut? Trends Microbiol. 2004;12:562–568. doi: 10.1016/j.tim.2004.10.008. [PubMed] [CrossRef] [Google Scholar]
- David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014;505:559–563. doi: 10.1038/nature12820. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Voigt RM, Forsyth CB, Green SJ, Mutlu E, Engen P, Vitaterna MH, et al. Circadian disorganization alters intestinal microbiota. PLoS ONE. 2014;9:e97500. doi: 10.1371/journal.pone.0097500. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Earley ZM, Akhtar S, Green SJ, Naqib A, Khan O, Cannon AR, et al. Burn Injury alters the intestinal microbiome and increases gut permeability and bacterial translocation. PLoS ONE. 2015;10:e0129996. http://dx.plos.org/10.1371/journal.pone.0129996. [PMC free article] [PubMed]
- Lucas López R, Grande Burgos MJ, Gálvez A, Pérez Pulido R. The human gastrointestinal tract and oral microbiota in inflammatory bowel disease: a state of the science review. APMIS. 2017. http://onlinelibrary.wiley.com/doi/10.1111/apm.12609/abstract. [PubMed]
- Schäffler H, Herlemann DP, Alberts C, Kaschitzki A, Bodammer P, Bannert K, et al. Mucosa-attached bacterial community in Crohn’s Disease coheres with the clinical disease activity index. Environ Microbiol Rep. 2016;8:614–621. doi: 10.1111/1758-2229.12411. [PubMed] [CrossRef] [Google Scholar]
- Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly-Y M, et al. The microbial metabolites, short-chain fatty acids, regulate colonic treg cell homeostasis. Science. 2013;341:569–573. doi: 10.1126/science.1241165. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Greenblum S, Turnbaugh PJ, Borenstein E. Metagenomic systems biology of the human gut microbiome reveals topological shifts associated with obesity and inflammatory bowel disease. Proc Natl Acad Sci. 2012;109:594–9. http://www.pnas.org/cgi/doi/10.1073/pnas.1116053109. [PMC free article] [PubMed]
- Schicho R, Marsche G, Storr M. Cardiovascular complications in inflammatory bowel disease. Curr Drug Targets. 2015;16:181–188. doi: 10.2174/1389450116666150202161500. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Wu HJ, Ivanov II, Darce J, Hattori K, Shima T, Umesaki Y, et al. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells. Immunity. 2010;32:815–827. doi: 10.1016/j.immuni.2010.06.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature. 2012;490:55–60. doi: 10.1038/nature11450. [PubMed] [CrossRef] [Google Scholar]
- Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444:1027–1031. doi: 10.1038/nature05414. [PubMed] [CrossRef] [Google Scholar]
- Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, et al. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 2013;19:576–585. doi: 10.1038/nm.3145. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pistollato F, et al. Role of gut microbiota and nutrients in amyloid formation and pathogenesis of Alzheimer disease. Nutr Rev. 2016;74:624–634. doi: 10.1093/nutrit/nuw023. [PubMed] [CrossRef] [Google Scholar]
- Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, et al. Linking long-term dietary patterns with gut microbial enterotypes. Science. 2011;334:105–108. doi: 10.1126/science.1208344. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hentges DJ, Maier BR, Burton GC, Flynn MA, Tsutakawa RK. Effect of a high-beef diet on the fecal bacterial flora of humans. Cancer Res. 1977;37:568–571. [PubMed] [Google Scholar]
- Clarke SF, Murphy EF, O’Sullivan O, Lucey AJ, Humphreys M, Hogan A, et al. Exercise and associated dietary extremes impact on gut microbial diversity. Gut. 2014;63:1913–1920. doi: 10.1136/gutjnl-2013-306541. [PubMed] [CrossRef] [Google Scholar]
- Reddy BS, Weisburger JH, Wynder EL. Effects of high risk and low risk diets for colon carcinogenesis on fecal microflora and steroids in man. J Nutr. 1975;105:878–884. [PubMed] [Google Scholar]
- Cotillard A, Kennedy SP, Kong LC, Prifti E, Pons N, Le Chatelier E, et al. Dietary intervention impact on gut microbial gene richness. Nature. 2013;500:585–588. doi: 10.1038/nature12480. [PubMed] [CrossRef] [Google Scholar]
- Świątecka D, Dominika Ś, Narbad A, Arjan N, Ridgway KP, Karyn RP, et al. The study on the impact of glycated pea proteins on human intestinal bacteria. Int J Food Microbiol. 2011;145:267–272. doi: 10.1016/j.ijfoodmicro.2011.01.002. [PubMed] [CrossRef] [Google Scholar]
- Meddah AT, Yazourh A, Desmet I, Risbourg B, Verstraete W, Romond MB. The regulatory effects of whey retentate from bifidobacteria fermented milk on the microbiota of the simulator of the human intestinal microbial ecosystem (SHIME) J Appl Microbiol. 2001;91:1110–1117. doi: 10.1046/j.1365-2672.2001.01482.x. [PubMed] [CrossRef] [Google Scholar]
- Romond MB, Ais A, Guillemot F, Bounouader R, Cortot A, Romond C. Cell-free whey from milk fermented with Bifidobacterium breve C50 used to modify the colonic microflora of healthy subjects. J Dairy Sci. 1998;81:1229–1235. doi: 10.3168/jds.S0022-0302(98)75683-8. [PubMed] [CrossRef] [Google Scholar]
- Kim CH, Park J, Kim M. Gut microbiota-derived short-chain fatty acids, T cells, and inflammation. Immune Netw. 2014;14:277. http://synapse.koreamed.org/DOIx.php?id=10.4110/in.2014.14.6.277. [PMC free article] [PubMed]
- De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA. 2010;107:14691–14696. doi: 10.1073/pnas.1005963107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Russell WR, Gratz SW, Duncan SH, Holtrop G, Ince J, Scobbie L, et al. High-protein, reduced-carbohydrate weight-loss diets promote metabolite profiles likely to be detrimental to colonic health. Am J Clin Nutr. 2011;93:1062–1072. doi: 10.3945/ajcn.110.002188. [PubMed] [CrossRef] [Google Scholar]
- Kang S, Denman SE, Morrison M, Yu Z, Dore J, Leclerc M, et al. Dysbiosis of fecal microbiota in Crohn’s disease patients as revealed by a custom phylogenetic microarray. Inflamm Bowel Dis. 2010;16:2034–42. http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00054725-201012000-00009. [PubMed]
- Eeckhaut V, Machiels K, Perrier C, Romero C, Maes S, Flahou B, et al. Butyricicoccus pullicaecorum in inflammatory bowel disease. Gut. 2013;62:1745–52. http://gut.bmj.com/cgi/doi/10.1136/gutjnl-2012-303611. [PubMed]
- Machiels K, Joossens M, Sabino J, De Preter V, Arijs I, Eeckhaut V, et al. A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis. Gut. 2014;63:1275–83. http://gut.bmj.com/cgi/doi/10.1136/gutjnl-2013-304833. [PubMed]
- Jantchou P, Morois S, Clavel-Chapelon F, Boutron-Ruault M-C, Carbonnel F. Animal protein intake and risk of inflammatory bowel disease: The E3N prospective study. Am J Gastroenterol. 2010;105:2195–2201. doi: 10.1038/ajg.2010.192. [PubMed] [CrossRef] [Google Scholar]
- DeFilippis F, Pellegrini N, Vannini L, Jeffery IB, La Storia A, Laghi L, et al. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut. 2015:gutjnl-2015. http://gut.bmj.com/lookup/doi/10.1136/gutjnl-2015-309957. [PubMed]
- Levine ME, Suarez JA, Brandhorst S, Balasubramanian P, Cheng CW, Madia F, et al. Low protein intake is associated with a major reduction in IGF-1, cancer, and overall mortality in the 65 and younger but not older population. Cell Metab. 2014;19:407–417. doi: 10.1016/j.cmet.2014.02.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Spady DK, Woollett LA, Dietschy JM. Regulation of plasma LDL-cholesterol levels by dietary cholesterol and fatty acids. Annu Rev Nutr. 1993;13:355–381. doi: 10.1146/annurev.nu.13.070193.002035. [PubMed] [CrossRef] [Google Scholar]
- Stamler J, Daviglus ML, Garside DB, Dyer AR, Greenland P, Neaton JD. Relationship of baseline serum cholesterol levels in 3 large cohorts of younger men to long-term coronary, cardiovascular, and all-cause mortality and to longevity. JAMA. 2000;284:311–318. doi: 10.1001/jama.284.3.311. [PubMed] [CrossRef] [Google Scholar]
- Kris-Etherton PM. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation. 2002;106:2747–57. http://circ.ahajournals.org/cgi/doi/10.1161/01.CIR.0000038493.65177.94. [PubMed]
- Simopoulos AP. Omega-3 fatty acids in inflammation and autoimmune diseases. J Am Coll Nutr. 2002;21:495–505. doi: 10.1080/07315724.2002.10719248. [PubMed] [CrossRef] [Google Scholar]
- Dietary fats: total fat and fatty acids in: dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). Washington, DC: National Academies Press; 2002. p. 335–432. [PubMed]
- Drasar BS, Crowther JS, Goddard P, Hawksworth G, Hill MJ, Peach S, et al. The relation between diet and the gut microflora in man. Proc Nutr Soc. 2007;32:49–52. http://www.journals.cambridge.org/abstract_S0029665173000170. [PubMed]
- Fava F, Gitau R, Griffin BA, Gibson GR, Tuohy KM, Lovegrove JA. The type and quantity of dietary fat and carbohydrate alter faecal microbiome and short-chain fatty acid excretion in a metabolic syndrome “at-risk” population. Int J Obes (Lond). 2013;37:216–223. doi: 10.1038/ijo.2012.33. [PubMed] [CrossRef] [Google Scholar]
- Urwin HJ, Miles EA, Noakes PS, Kremmyda LS, Vlachava M, Diaper ND, et al. Effect of salmon consumption during pregnancy on maternal and infant faecal microbiota, secretory IgA and calprotectin. Br J Nutr. 2014;111:773–784. doi: 10.1017/S0007114513003097. [PubMed] [CrossRef] [Google Scholar]
- Lecomte V, Kaakoush NO, Maloney CA, Raipuria M, Huinao KD, Mitchell HM, et al. Changes in gut microbiota in rats fed a high fat diet correlate with obesity-associated metabolic parameters. PLoS ONE. 2015;10:e0126931. http://dx.plos.org/10.1371/journal.pone.0126931. [PMC free article] [PubMed]
- Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes. 2008;57:1470–1481. doi: 10.2337/db07-1403. [PubMed] [CrossRef] [Google Scholar]
- Caesar R, Tremaroli V, Kovatcheva-Datchary P, Cani PD, Bäckhed F. Crosstalk between gut microbiota and dietary lipids aggravates WAT inflammation through TLR signaling. Cell Metab. 2015;22:658–68. http://linkinghub.elsevier.com/retrieve/pii/S1550413115003897. [PMC free article] [PubMed]
- Saltiel AR. Insulin signaling in the control of glucose and lipid homeostasis. Handb Exp Pharmacol. 2016. [PubMed]
- Parvin S. Nutritional analysis of date fruits (Phoenix dactylifera L.) in perspective of Bangladesh. Am J Life Sci. 2015;3:274. http://www.sciencepublishinggroup.com/journal/paperinfo.aspx?journalid=118&doi=10.11648/j.ajls.20150304.14.
- Eid N, Enani S, Walton G, Corona G, Costabile A, Gibson G, et al. The impact of date palm fruits and their component polyphenols, on gut microbial ecology, bacterial metabolites and colon cancer cell proliferation. J Nutr Sci. 2014;3:e46. http://www.journals.cambridge.org/abstract_S2048679014000160. [PMC free article] [PubMed]
- Jeffery I, O’Toole P. Diet-microbiota interactions and their implications for healthy living. Nutrients. 2013;5:234–52. http://www.mdpi.com/2072-6643/5/1/234/. [PMC free article] [PubMed]
- Francavilla R, Calasso M, Calace L, Siragusa S, Ndagijimana M, Vernocchi P, et al. Effect of lactose on gut microbiota and metabolome of infants with cow’s milk allergy. Pediatr Allergy Immunol. 2012;23:420–427. doi: 10.1111/j.1399-3038.2012.01286.x. [PubMed] [CrossRef] [Google Scholar]
- Suez J, Korem T, Zeevi D, Zilberman-Schapira G, Thaiss CA, Maza O, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature. 2014;514:181–186. [PubMed] [Google Scholar]
- Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Diversity, stability and resilience of the human gut microbiota. Nature. 2012;489:220–30. http://www.nature.com/doifinder/10.1038/nature11550. [PMC free article] [PubMed]
- Sonnenburg ED, Sonnenburg JL. Starving our microbial self: the deleterious consequences of a diet deficient in microbiota-accessible carbohydrates. Cell Metab. 2014;20:779–86. http://linkinghub.elsevier.com/retrieve/pii/S1550413114003118. [PMC free article] [PubMed]
- de Vrese M, Schrezenmeir J. Probiotics, prebiotics, and synbiotics. Adv Biochem Eng Biotechnol. 2008;111:1–66. [PubMed] [Google Scholar]
- Pandey KR, Naik SR, Vakil BV. Probiotics, prebiotics and synbiotics-a review. J Food Sci Technol. 2015;52:7577–7587. doi: 10.1007/s13197-015-1921-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Halmos EP, Christophersen CT, Bird AR, Shepherd SJ, Gibson PR, Muir JG. Diets that differ in their FODMAP content alter the colonic luminal microenvironment. Gut. 2015;64:93–100. doi: 10.1136/gutjnl-2014-307264. [PubMed] [CrossRef] [Google Scholar]
- Costabile A, Klinder A, Fava F, Napolitano A, Fogliano V, Leonard C, et al. Whole-grain wheat breakfast cereal has a prebiotic effect on the human gut microbiota: a double-blind, placebo-controlled, crossover study. Br J Nutr. 2008;99:110–120. doi: 10.1017/S0007114507793923. [PubMed] [CrossRef] [Google Scholar]
- Carvalho-Wells AL, Helmolz K, Nodet C, Molzer C, Leonard C, McKevith B, et al. Determination of the in vivo prebiotic potential of a maize-based whole grain breakfast cereal: a human feeding study. Br J Nutr. 2010;104:1353–1356. doi: 10.1017/S0007114510002084. [PubMed] [CrossRef] [Google Scholar]
- Keim NL, Martin RJ. Dietary whole grain–microbiota interactions: insights into mechanisms for human health. Adv Nutr. 2014;5:556–557. doi: 10.3945/an.114.006536. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Leitch ECM, Walker AW, Duncan SH, Holtrop G, Flint HJ. Selective colonization of insoluble substrates by human faecal bacteria. Environ Microbiol. 2007;9:667–679. doi: 10.1111/j.1462-2920.2006.01186.x. [PubMed] [CrossRef] [Google Scholar]
- Liu Z, Lin X, Huang G, Zhang W, Rao P, Ni L. Prebiotic effects of almonds and almond skins on intestinal microbiota in healthy adult humans. Anaerobe. 2014;26:1–6. doi: 10.1016/j.anaerobe.2013.11.007. [PubMed] [CrossRef] [Google Scholar]
- Gori A, Rizzardini G, Van’t Land B, Amor KB, van Schaik J, Torti C, et al. Specific prebiotics modulate gut microbiota and immune activation in HAART-naive HIV-infected adults: results of the “COPA” pilot randomized trial. Mucosal Immunol. 2011;4:554–563. doi: 10.1038/mi.2011.15. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Costabile A, Fava F, Röytiö H, Forssten SD, Olli K, Klievink J, et al. Impact of polydextrose on the faecal microbiota: a double-blind, crossover, placebo-controlled feeding study in healthy human subjects. Br J Nutr. 2012;108:471–481. doi: 10.1017/S0007114511005782. [PubMed] [CrossRef] [Google Scholar]
- Kedia G, Vázquez JA, Charalampopoulos D, Pandiella SS. In vitro fermentation of oat bran obtained by debranning with a mixed culture of human fecal bacteria. Curr Microbiol. 2009;58:338–342. doi: 10.1007/s00284-008-9335-1. [PubMed] [CrossRef] [Google Scholar]
- Yu ZT, Liu B, Mukherjee P, Newburg DS. Trametes versicolor extract modifies human fecal microbiota composition in vitro. Plant Foods Hum Nutr. 2013;68:107–112. doi: 10.1007/s11130-013-0342-4. [PubMed] [CrossRef] [Google Scholar]
- Flickinger EA, Hatch TF, Wofford RC, Grieshop CM, Murray SM, Fahey GC. In vitro fermentation properties of selected fructooligosaccharide-containing vegetables and in vivo colonic microbial populations are affected by the diets of healthy human infants. J Nutr. 2002;132:2188–2194. [PubMed] [Google Scholar]
- Kapiki A, Costalos C, Oikonomidou C, Triantafyllidou A, Loukatou E, Pertrohilou V. The effect of a fructo-oligosaccharide supplemented formula on gut flora of preterm infants. Early Hum Dev. 2007;83:335–339. doi: 10.1016/j.earlhumdev.2006.07.003. [PubMed] [CrossRef] [Google Scholar]
- François IEJA, Lescroart O, Veraverbeke WS, Marzorati M, Possemiers S, Hamer H, et al. Effects of wheat bran extract containing arabinoxylan oligosaccharides on gastrointestinal parameters in healthy preadolescent children. J Pediatr Gastroenterol Nutr. 2014;58:647–653. doi: 10.1097/MPG.0000000000000285. [PubMed] [CrossRef] [Google Scholar]
- Chen HM, Yu YN, Wang JL, Lin YW, Kong X, Yang CQ, et al. Decreased dietary fiber intake and structural alteration of gut microbiota in patients with advanced colorectal adenoma. Am J Clin Nutr. 2013;97:1044–1052. doi: 10.3945/ajcn.112.046607. [PubMed] [CrossRef] [Google Scholar]
- Martínez I, Lattimer JM, Hubach KL, Case JA, Yang J, Weber CG, et al. Gut microbiome composition is linked to whole grain-induced immunological improvements. ISME J. 2013;7:269–280. doi: 10.1038/ismej.2012.104. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Kim MS, Hwang SS, Park EJ, Bae JW. Strict vegetarian diet improves the risk factors associated with metabolic diseases by modulating gut microbiota and reducing intestinal inflammation. Environ Microbiol Rep. 2013;5:765–775. doi: 10.1111/1758-2229.12090. [PubMed] [CrossRef] [Google Scholar]
- West NP, Christophersen CT, Pyne DB, Cripps AW, Conlon MA, Topping DL, et al. Butyrylated starch increases colonic butyrate concentration but has limited effects on immunity in healthy physically active individuals. Exerc Immunol Rev. 2013;19:102–119. [PubMed] [Google Scholar]
- Schley PD, Field CJ. The immune-enhancing effects of dietary fibres and prebiotics. Br J Nutr. 2002;87(Suppl 2):S221–S230. doi: 10.1079/BJN/2002541. [PubMed] [CrossRef] [Google Scholar]
- Shen J, Zuo ZX, Mao AP. Effect of probiotics on inducing remission and maintaining therapy in ulcerative colitis, Crohnʼs disease, and pouchitis. Inflamm Bowel Dis. 2014;20:21–35. http://content.wkhealth.com/linkback/openurl?sid=WKPTLP:landingpage&an=00054725-201401000-00004. [PubMed]
- Foligné B, Parayre S, Cheddani R, Famelart MH, Madec MN, Plé C, et al. Immunomodulation properties of multi-species fermented milks. Food Microbiol. 2016;53:60–69. doi: 10.1016/j.fm.2015.04.002. [PubMed] [CrossRef] [Google Scholar]
- Matsumoto K, Takada T, Shimizu K, Moriyama K, Kawakami K, Hirano K, et al. Effects of a probiotic fermented milk beverage containing Lactobacillus casei strain Shirota on defecation frequency, intestinal microbiota, and the intestinal environment of healthy individuals with soft stools. J Biosci Bioeng. 2010;110:547–552. doi: 10.1016/j.jbiosc.2010.05.016. [PubMed] [CrossRef] [Google Scholar]
- He T, Priebe MG, Zhong Y, Huang C, Harmsen HJM, Raangs GC, et al. Effects of yogurt and bifidobacteria supplementation on the colonic microbiota in lactose-intolerant subjects. J Appl Microbiol. 2008;104:595–604. [PubMed] [Google Scholar]
- Zhong Y, Huang CY, He T, Harmsen HMJ. Effect of probiotics and yogurt on colonic microflora in subjects with lactose intolerance. Wei Sheng Yan Jiu. 2006;35:587–591. [PubMed] [Google Scholar]
- Goossens DAM, Jonkers DMAE, Russel MGVM, Stobberingh EE, Stockbrügger RW. The effect of a probiotic drink with Lactobacillus plantarum 299v on the bacterial composition in faeces and mucosal biopsies of rectum and ascending colon. Aliment Pharmacol Ther. 2006;23:255–263. doi: 10.1111/j.1365-2036.2006.02749.x. [PubMed] [CrossRef] [Google Scholar]
- Wang S, Zhu H, Lu C, Kang Z, Luo Y, Feng L, et al. Fermented milk supplemented with probiotics and prebiotics can effectively alter the intestinal microbiota and immunity of host animals. J. Dairy Sci. 2012;95:4813–4822. doi: 10.3168/jds.2012-5426. [PubMed] [CrossRef] [Google Scholar]
- Sairanen U, Piirainen L, Gråsten S, Tompuri T, Mättö J, Saarela M, et al. The effect of probiotic fermented milk and inulin on the functions and microecology of the intestine. J Dairy Res. 2007;74:367–373. doi: 10.1017/S0022029907002713. [PubMed] [CrossRef] [Google Scholar]
- TormoCarnicer R, Infante Piña D, Roselló Mayans E, Bartolomé Comas R. Intake of fermented milk containing Lactobacillus casei DN-114 001 and its effect on gut flora. An Pediatr (Barc) 2006;65:448–453. doi: 10.1157/13094251. [PubMed] [CrossRef] [Google Scholar]
- Spanhaak S, Havenaar R, Schaafsma G. The effect of consumption of milk fermented by Lactobacillus casei strain Shirota on the intestinal microflora and immune parameters in humans. Eur J Clin Nutr. 1998;52:899–907. doi: 10.1038/sj.ejcn.1600663. [PubMed] [CrossRef] [Google Scholar]
- Bouhnik Y, Flourie B, Andrieux C, Bisetti N, Briet F, Rambaud JC. Effects of Bifidobacterium sp. fermented milk ingested with or without inulin on colonic bifidobacteria and enzymatic activities in healthy humans. Eur J Clin Nutr. 1996;50:269–273. [PubMed] [Google Scholar]
- Link-Amster H, Rochat F, Saudan KY, Mignot O, Aeschlimann JM. Modulation of a specific humoral immune response and changes in intestinal flora mediated through fermented milk intake. FEMS Immunol Med Microbiol. 1994;10:55–63. doi: 10.1111/j.1574-695X.1994.tb00011.x. [PubMed] [CrossRef] [Google Scholar]
- Yang YJ, Sheu BS. Probiotics-containing yogurts suppress Helicobacter pylori load and modify immune response and intestinal microbiota in the Helicobacter pylori-infected children. Helicobacter. 2012;17:297–304. doi: 10.1111/j.1523-5378.2012.00941.x. [PubMed] [CrossRef] [Google Scholar]
- García-Albiach R, PozuelodeFelipe MJ, José M, deFelipe P, Angulo S, Morosini MI, et al. Molecular analysis of yogurt containing Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus in human intestinal microbiota. Am J Clin Nutr. 2008;87:91–96. [PubMed] [Google Scholar]
- Bartram HP, Scheppach W, Gerlach S, Ruckdeschel G, Kelber E, Kasper H. Does yogurt enriched with Bifidobacterium longum affect colonic microbiology and fecal metabolites in healthy subjects? Am J Clin Nutr. 1994;59:428–432. [PubMed] [Google Scholar]
- Inoguchi S, Ohashi Y, Narai-Kanayama A, Aso K, Nakagaki T, Fujisawa T. Effects of non-fermented and fermented soybean milk intake on faecal microbiota and faecal metabolites in humans. Int J Food Sci Nutr. 2012;63:402–410. doi: 10.3109/09637486.2011.630992. [PubMed] [CrossRef] [Google Scholar]
- Rajkumar H, Mahmood N, Kumar M, Varikuti SR, Challa HR, Myakala SP. Effect of probiotic (VSL#3) and omega-3 on lipid profile, insulin sensitivity, inflammatory markers, and gut colonization in overweight adults: a randomized, controlled trial. Med Inflamm. 2014;2014:348959. doi: 10.1155/2014/348959. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Liu JE, Zhang Y, Zhang J, Dong PL, Chen M, Duan ZP. Probiotic yogurt effects on intestinal flora of patients with chronic liver disease. Nurs Res. 2010;59:426–432. doi: 10.1097/NNR.0b013e3181fa4dc6. [PubMed] [CrossRef] [Google Scholar]
- 100.Yoon H, Park YS, Lee DH, Seo J-G, Shin CM, Kim N. Effect of administering a multi-species probiotic mixture on the changes in fecal microbiota and symptoms of irritable bowel syndrome: a randomized, double-blind, placebo-controlled trial. J Clin Biochem Nutr. 2015;57:129–134. doi: 10.3164/jcbn.15-14. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 101.del Campo R, Garriga M, PérezAragón A, Guallarte P, Lamas A, Máiz L, et al. Improvement of digestive health and reduction in proteobacterial populations in the gut microbiota of cystic fibrosis patients using a Lactobacillus reuteri probiotic preparation: a double blind prospective study. J Cyst Fibros. 2014;13:716–722. doi: 10.1016/j.jcf.2014.02.007. [PubMed] [CrossRef] [Google Scholar]
- 102.Kwak DS, Jun DW, Seo JG, Chung WS, Park SE, Lee KN, et al. Short-term probiotic therapy alleviates small intestinal bacterial overgrowth, but does not improve intestinal permeability in chronic liver disease. Eur J Gastroenterol Hepatol. 2014;26:1353–1359. [PubMed] [Google Scholar]
- 103.Akatsu H, Iwabuchi N, Xiao J-Z, Matsuyama Z, Kurihara R, Okuda K, et al. Clinical effects of probiotic Bifidobacterium longum BB536 on immune function and intestinal microbiota in elderly patients receiving enteral tube feeding. JPEN J Parenter Enteral Nutr. 2013;37:631–640. doi: 10.1177/0148607112467819. [PubMed] [CrossRef] [Google Scholar]
- 104.Collado MC, Surono IS, Meriluoto J, Salminen S. Potential probiotic characteristics of Lactobacillus and Enterococcus strains isolated from traditional dadih fermented milk against pathogen intestinal colonization. J Food Prot. 2007;70:700–705. doi: 10.4315/0362-028X-70.3.700. [PubMed] [CrossRef] [Google Scholar]
- 105.Malinen E, Rinttilä T, Kajander K, Mättö J, Kassinen A, Krogius L, et al. Analysis of the fecal microbiota of irritable bowel syndrome patients and healthy controls with real-time PCR. Am J Gastroenterol. 2005;100:373–382. doi: 10.1111/j.1572-0241.2005.40312.x. [PubMed] [CrossRef] [Google Scholar]
- 106.McFarland LV. Meta-analysis of probiotics for the prevention of traveler’s diarrhea. Travel Med Infect Dis. 2007;5:97–105. doi: 10.1016/j.tmaid.2005.10.003. [PubMed] [CrossRef] [Google Scholar]
- 107.Pérez-Jiménez J, Neveu V, Vos F, Scalbert A. Identification of the 100 richest dietary sources of polyphenols: an application of the phenol-explorer database. Eur J Clin Nutr. 2010;64:S112–S120. doi: 10.1038/ejcn.2010.221. [PubMed] [CrossRef] [Google Scholar]
- 108.Cuervo A, Valdés L, Salazar N, de los Reyes-Gavilán CG, Ruas-Madiedo P, Gueimonde M, et al. Pilot study of diet and microbiota: interactive associations of fibers and polyphenols with human intestinal bacteria. J Agric Food Chem. 2014;62:5330–5336. doi: 10.1021/jf501546a. [PubMed] [CrossRef] [Google Scholar]
- 109.Vendrame S, Guglielmetti S, Riso P, Arioli S, Klimis-Zacas D, Porrini M. Six-week consumption of a wild blueberry powder drink increases bifidobacteria in the human gut. J Agric Food Chem. 2011;59:12815–12820. doi: 10.1021/jf2028686. [PubMed] [CrossRef] [Google Scholar]
- 110.Queipo-Ortuno MI, Boto-Ordonez M, Murri M, Gomez-Zumaquero JM, Clemente-Postigo M, Estruch R, et al. Influence of red wine polyphenols and ethanol on the gut microbiota ecology and biochemical biomarkers. Am J Clin Nutr. 2012;95:1323–1334. doi: 10.3945/ajcn.111.027847. [PubMed] [CrossRef] [Google Scholar]
- 111.Jin JS, Touyama M, Hisada T, Benno Y. Effects of green tea consumption on human fecal microbiota with special reference to Bifidobacterium species. Microbiol Immunol. 2012;56:729–739. doi: 10.1111/j.1348-0421.2012.00502.x. [PubMed] [CrossRef] [Google Scholar]
- 112.Tzounis X, Rodriguez-Mateos A, Vulevic J, Gibson GR, Kwik-Uribe C, Spencer JPE. Prebiotic evaluation of cocoa-derived flavanols in healthy humans by using a randomized, controlled, double-blind, crossover intervention study. Am J Clin Nutr. 2011;93:62–72. doi: 10.3945/ajcn.110.000075. [PubMed] [CrossRef] [Google Scholar]
- 113.Cueva C, Sánchez-Patán F, Monagas M, Walton GE, Gibson GR, Martín-Álvarez PJ, et al. In vitro fermentation of grape seed flavan-3-ol fractions by human faecal microbiota: changes in microbial groups and phenolic metabolites. FEMS Microbiol Ecol. 2013;83:792–805. doi: 10.1111/1574-6941.12037. [PubMed] [CrossRef] [Google Scholar]
- 114.Bialonska D, Ramnani P, Kasimsetty SG, Muntha KR, Gibson GR, Ferreira D. The influence of pomegranate by-product and punicalagins on selected groups of human intestinal microbiota. Int J Food Microbiol. 2010;140:175–182. doi: 10.1016/j.ijfoodmicro.2010.03.038. [PubMed] [CrossRef] [Google Scholar]
- 115.Cuervo A, Hevia A, López P, Suárez A, Diaz C, Sánchez B, et al. Phenolic compounds from red wine and coffee are associated with specific intestinal microorganisms in allergic subjects. Food Funct. 2015. [PubMed]
- 116.Barroso E, VandeWiele T, Jiménez-Girón A, Muñoz-González I, Martín-Alvarez PJ, Moreno-Arribas MV, et al. Lactobacillus plantarum IFPL935 impacts colonic metabolism in a simulator of the human gut microbiota during feeding with red wine polyphenols. Appl Microbiol Biotechnol. 2014;98:6805–6815. doi: 10.1007/s00253-014-5744-1. [PubMed] [CrossRef] [Google Scholar]
- 117.Martin FPJ, Montoliu I, Nagy K, Moco S, Collino S, Guy P, et al. Specific dietary preferences are linked to differing gut microbial metabolic activity in response to dark chocolate intake. J Proteom Res. 2012;11:6252–6263. doi: 10.1021/pr300915z. [PubMed] [CrossRef] [Google Scholar]
- 118.Parkar SG, Stevenson DE, Skinner MA. The potential influence of fruit polyphenols on colonic microflora and human gut health. Int J Food Microbiol. 2008;124:295–298. doi: 10.1016/j.ijfoodmicro.2008.03.017. [PubMed] [CrossRef] [Google Scholar]
- 119.Lee HC, Jenner AM, Low CS, Lee YK. Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota. Res Microbiol. 2006;157:876–884. doi: 10.1016/j.resmic.2006.07.004. [PubMed] [CrossRef] [Google Scholar]
- 120.Druart C, Dewulf EM, Cani PD, Neyrinck AM, Thissen JP, Delzenne NM. Gut microbial metabolites of polyunsaturated fatty acids correlate with specific fecal bacteria and serum markers of metabolic syndrome in obese women. Lipids. 2014;49:397–402. doi: 10.1007/s11745-014-3881-z. [PubMed] [CrossRef] [Google Scholar]
- 121.Sánchez-Patán F, Cueva C, Monagas M, Walton GE, Gibson MGR, Quintanilla-López JE, et al. In vitro fermentation of a red wine extract by human gut microbiota: changes in microbial groups and formation of phenolic metabolites. J Agric Food Chem. 2012;60:2136–2147. doi: 10.1021/jf2040115. [PubMed] [CrossRef] [Google Scholar]
- 122.Tzounis X, Vulevic J, Kuhnle GGC, George T, Leonczak J, Gibson GR, et al. Flavanol monomer-induced changes to the human faecal microflora. Br J Nutr. 2008;99:782–792. doi: 10.1017/S0007114507853384. [PubMed] [CrossRef] [Google Scholar]
- 123.Mitsuoka T. The effect of nutrition on intestinal flora. Nahrung. 1984;28:619–625. doi: 10.1002/food.19840280616. [PubMed] [CrossRef] [Google Scholar]
- 124.Park JE, Seo JE, Lee JY, Kwon H. Distribution of seven N-nitrosamines in food. Toxicol Res. 2015;31:279–288. doi: 10.5487/TR.2015.31.3.279. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 125.Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult humans. Gut Microbes. 1:135–7. [PMC free article] [PubMed]
- 126.Bonder MJ, Tigchelaar EF, Cai X, Trynka G, Cenit MC, Hrdlickova B, et al. The influence of a short-term gluten-free diet on the human gut microbiome. Genome Med. 2016;8:45. Available from: http://genomemedicine.biomedcentral.com/articles/10.1186/s13073-016-0295-y. [PMC free article] [PubMed]
- 127.Wu GD, Compher C, Chen EZ, Smith SA, Shah RD, Bittinger K, et al. Comparative metabolomics in vegans and omnivores reveal constraints on diet-dependent gut microbiota metabolite production. Gut. 2014. [PMC free article] [PubMed]
- 128.Zimmer J, Lange B, Frick J-S, Sauer H, Zimmermann K, Schwiertz A, et al. A vegan or vegetarian diet substantially alters the human colonic faecal microbiota. Eur J Clin Nutr. 2012;66:53–60. doi: 10.1038/ejcn.2011.141. [PubMed] [CrossRef] [Google Scholar]
- 129.Lopez-Legarrea P, Fuller NR, Zulet MA, Martinez JA, Caterson ID. The influence of Mediterranean, carbohydrate and high protein diets on gut microbiota composition in the treatment of obesity and associated inflammatory state. Asia Pac J Clin Nutr. 2014;23:360–368. [PubMed] [Google Scholar]
- 130.Furet JP, Kong LC, Tap J, Poitou C, Basdevant A, Bouillot JL, et al. Differential adaptation of human gut microbiota to bariatric surgery-induced weight loss: links with metabolic and low-grade inflammation markers. Diabetes. 2010;59:3049–3057. doi: 10.2337/db10-0253. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 131.Clemente-Postigo M, Queipo-Ortuno MI, Murri M, Boto-Ordonez M, Perez-Martinez P, Andres-Lacueva C, et al. Endotoxin increase after fat overload is related to postprandial hypertriglyceridemia in morbidly obese patients. J Lipid Res. 2012;53:973–978. doi: 10.1194/jlr.P020909. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 132.Koloverou E, Panagiotakos DB, Pitsavos C, Chrysohoou C, Georgousopoulou EN, Grekas A, et al. Adherence to Mediterranean diet and 10-year incidence (2002–2012) of diabetes: correlations with inflammatory and oxidative stress biomarkers in the ATTICA cohort study. Diabetes Metab Res Rev. 2016;32:73–81. doi: 10.1002/dmrr.2672. [PubMed] [CrossRef] [Google Scholar]
- 133.Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Reddy SM, et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol. 2015;67:128–139. doi: 10.1002/art.38892. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 134.Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. Gut Microbiota from twins discordant for obesity modulate metabolism in mice. Science. 2013;341:1241214. Available from: http://www.sciencemag.org/cgi/doi/10.1126/science.1241214. [PMC free article] [PubMed]
- 135.Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders. Cell. 2013;155:1451–1463. doi: 10.1016/j.cell.2013.11.024. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 136.Mangiola F, Ianiro G, Franceschi F, Fagiuoli S, Gasbarrini G, Gasbarrini A. Gut microbiota in autism and mood disorders. World J Gastroenterol. 2016;22:361–368. doi: 10.3748/wjg.v22.i1.361. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 137.Haverson K, Rehakova Z, Sinkora J, Sver L, Bailey M. Immune development in jejunal mucosa after colonization with selected commensal gut bacteria: a study in germ-free pigs. Vet Immunol Immunopathol. 2007;119:243–253. doi: 10.1016/j.vetimm.2007.05.022. [PubMed] [CrossRef] [Google Scholar]
- 138.Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 2009;139:485–498. doi: 10.1016/j.cell.2009.09.033. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 139.Delcenserie V, Martel D, Lamoureux M, Amiot J, Boutin Y, Roy D. Immunomodulatory effects of probiotics in the intestinal tract. Curr Issues Mol Biol. 2008;10:37–54. [PubMed] [Google Scholar]
- 140.Kwon HK, Lee CG, So JS, Chae CS, Hwang JS, Sahoo A, et al. Generation of regulatory dendritic cells and CD4 + Foxp3 + T cells by probiotics administration suppresses immune disorders. Proc Natl Acad Sci USA. 2010;107:2159–2164. doi: 10.1073/pnas.0904055107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 141.Andrade MER, Araújo RS, de Barros PAV, Soares ADN, Abrantes FA, Generoso S, de Vasconcelos Generoso S, et al. The role of immunomodulators on intestinal barrier homeostasis in experimental models. Clin Nutr. 2015;34:1080–1087. doi: 10.1016/j.clnu.2015.01.012. [PubMed] [CrossRef] [Google Scholar]
- 142.Tilg H, Moschen AR. Food, immunity, and the microbiome. Gastroenterology. 2015;148:1107–1119. doi: 10.1053/j.gastro.2014.12.036. [PubMed] [CrossRef] [Google Scholar]
- 143.Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, DeRoos P, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature. 2013;504:451–455. doi: 10.1038/nature12726. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 144.Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature. 2013;504:446–450. doi: 10.1038/nature12721. [PubMed] [CrossRef] [Google Scholar]
- 145.Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat Med. 2014;20:159–166. doi: 10.1038/nm.3444. [PubMed] [CrossRef] [Google Scholar]
- 146.Remely M, et al. Effects of short chain fatty acid producing bacteria on epigenetic regulation of FFAR3 in type 2 diabetes and obesity. Gene. 2014;537:85–92. doi: 10.1016/j.gene.2013.11.081. [PubMed] [CrossRef] [Google Scholar]
- 147.Remely M, et al. Microbiota and epigenetic regulation of inflammatory mediators in type 2 diabetes and obesity. Benef Microbes. 2014;5:33–43. doi: 10.3920/BM2013.006. [PubMed] [CrossRef] [Google Scholar]
- 148.Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity. Nature. 2006;444:1022–1023. doi: 10.1038/4441022a. [PubMed] [CrossRef] [Google Scholar]
- 149.Karlsson F, Tremaroli V, Nielsen J, Bäckhed F. Assessing the human gut microbiota in metabolic diseases. Diabetes. 2013;62:3341–3349. doi: 10.2337/db13-0844. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 150.Kumar H, et al. Gut microbiota as an epigenetic regulator: pilot study based on whole-genome methylation analysis. MBio. 2014;5:e02113–14. http://mbio.asm.org/content/5/6/e02113-14.short. [PMC free article] [PubMed]
- 151.Aller R, De Luis DA, Izaola O, Conde R, Gonzalez Sagrado M, Primo D, et al. Effect of a probiotic on liver aminotransferases in nonalcoholic fatty liver disease patients: a double blind randomized clinical trial. Eur Rev Med Pharmacol Sci. 2011;15:1090–1095. [PubMed] [Google Scholar]
- 152.Nardone G, Compare D, Liguori E, Di Mauro V, Rocco A, Barone M, et al. Protective effects of Lactobacillus paracasei F19 in a rat model of oxidative and metabolic hepatic injury. Am J Physiol Gastrointest Liver Physiol. 2010;299:G669–G676. doi: 10.1152/ajpgi.00188.2010. [PubMed] [CrossRef] [Google Scholar]
- 153.Compare D, Coccoli P, Rocco A, Nardone OM, De Maria S, Cartenì M, et al. Gut–liver axis: The impact of gut microbiota on non alcoholic fatty liver disease. Nutr Metab Cardiovasc Dis. 2012;22:471–476. doi: 10.1016/j.numecd.2012.02.007. [PubMed] [CrossRef] [Google Scholar]
- 154.Dao MC, Everard A, Aron-Wisnewsky J, Sokolovska N, Prifti E, Verger EO, et al. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut. 2015. [PubMed]
- 155.Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice. Proc Natl Acad Sci USA. 2007;104:979–984. doi: 10.1073/pnas.0605374104. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 156.Tian Z, Liu J, Liao M, Li W, Zou J, Han X, et al. Beneficial effects of fecal microbiota transplantation on ulcerative colitis in mice. Dig Dis Sci. 2016. [PubMed]
- 157.Padua D, Pothoulakis C. Novel approaches to treating Clostridium difficile-associated colitis. Expert Rev Gastroenterol Hepatol. 2016;10:193–204. [PMC free article] [PubMed]
- 158.Lee CH, Steiner T, Petrof EO, Smieja M, Roscoe D, Nematallah A, et al. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection: a randomized clinical trial. JAMA. 2016;315:142–149. doi: 10.1001/jama.2015.18098. [PubMed] [CrossRef] [Google Scholar]
- 159.Konturek PC, Haziri D, Brzozowski T, Hess T, Heyman S, Kwiecien S, et al. Emerging role of fecal microbiota therapy in the treatment of gastrointestinal and extra-gastrointestinal diseases. J Physiol Pharmacol. 2015;66:483–491. [PubMed] [Google Scholar]
- 160.Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JFWM, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012;143:913. doi: 10.1053/j.gastro.2012.06.031. [PubMed] [CrossRef] [Google Scholar]
- 161.Goodrich JK, et al. Human genetics shape the gut microbiome. Cell. 2014;159:789–799. doi: 10.1016/j.cell.2014.09.053. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 162.West NR, Powrie F. Immunotherapy not working? check your microbiota. Cancer Cell. 2015;28:687–689. doi: 10.1016/j.ccell.2015.11.010. [PubMed] [CrossRef] [Google Scholar]
- 163.Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota. Science. 2015;350:1079–1084. doi: 10.1126/science.aad1329. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 164.von Schwartzenberg Jumpertz. R, Turnbaugh PJ. Siri, What should i eat? Cell. 2015;163:1051–1052. doi: 10.1016/j.cell.2015.11.012. [PubMed] [CrossRef] [Google Scholar]
- 165.Siddharth J, Holway N, Parkinson SJ. A western diet ecological module identified from the “humanized” mouse microbiota predicts diet in adults and formula feeding in children. PLoS ONE. 2013;8:e83689. http://dx.plos.org/10.1371/journal.pone.0083689. [PMC free article] [PubMed]
- 166.Pinzone MR, Celesia BM, DiRosa M, Cacopardo B, Nunnari G. Microbial translocation in chronic liver diseases. Int J Microbiol. 2012;2012:694629. doi: 10.1155/2012/694629. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 167.Schwiertz A, Taras D, Schäfer K, Beijer S, Bos NA, Donus C, et al. Microbiota and SCFA in lean and overweight healthy subjects. Obesity. 2010;18:190–195. doi: 10.1038/oby.2009.167. [PubMed] [CrossRef] [Google Scholar]
- 168.Chen X, Fruehauf J, Goldsmith JD, Xu H, Katchar KK, Koon H-W, et al. Saccharomyces boulardii inhibits EGF receptor signaling and intestinal tumor growth in Apc(min) mice. Gastroenterology. 2009;137:914–923. doi: 10.1053/j.gastro.2009.05.050. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 169.Venturi A, Gionchetti P, Rizzello F, Johansson R, Zucconi E, Brigidi P, et al. Impact on the composition of the faecal flora by a new probiotic preparation: preliminary data on maintenance treatment of patients with ulcerative colitis. Aliment Pharmacol Ther. 1999;13:1103–1108. doi: 10.1046/j.1365-2036.1999.00560.x. [PubMed] [CrossRef] [Google Scholar]
- 170.Raisch J, Dalmasso G, Bonnet R, Barnich N, Bonnet M, Bringer M-A. How some commensal bacteria would exacerbate colorectal carcinogenesis? Méd Sci. 2016;32:175–182. [PubMed] [Google Scholar]
- 171.Lucke K. Prevalence of Bacteroides and Prevotella spp. in ulcerative colitis. J Med Microbiol. 2006;55:617–24. http://jmm.microbiologyresearch.org/content/journal/jmm/10.1099/jmm.0.46198-0. [PubMed]
- 172.Wexler HM. Bacteroides: the Good, the Bad, and the Nitty-Gritty. Clin Microbiol Rev. 2007;20:593–621. http://cmr.asm.org/cgi/doi/10.1128/CMR.00008-07. [PMC free article] [PubMed]
- 173.Prindiville T. Bacteroides fragilis enterotoxin gene sequences in patients with inflammatory bowel disease. Emerg. Infect Dis. 2000;6:171–4. http://www.cdc.gov/ncidod/eid/vol6no2/prindiville.htm. [PMC free article] [PubMed]
- 174.Rautio M, Eerola E, Väisänen-Tunkelrott M-L, Molitoris D, Lawson P, Collins MD, et al. Reclassification of Bacteroides putredinis (Weinberg et al., 1937) in a new genus alistipes gen. nov., as Alistipes putredinis comb. nov., and description of Alistipes finegoldii sp. nov., from human sources. Syst Appl Microbiol. 2003;26:182–188. doi: 10.1078/072320203322346029. [PubMed] [CrossRef] [Google Scholar]
- 175.Baron EJ. Bilophila wadsworthia: a unique gram-negative anaerobic rod. Anaerobe. 1997;3:83–86. doi: 10.1006/anae.1997.0075. [PubMed] [CrossRef] [Google Scholar]
- 176.Kamada N, Seo SU, Chen GY, Núñez G. Role of the gut microbiota in immunity and inflammatory disease. Nat Rev Immunol. 2013;13:321–35. http://www.nature.com/doifinder/10.1038/nri3430. [PubMed]
- 177.Baron S. Clostridium. Baron’s Med. microbiol. 4. Galveston: University of Texas Medical Branch; 1996. [Google Scholar]
- 178.Gaboriau-Routhiau V, Rakotobe S, Lécuyer E, Mulder I, Lan A, Bridonneau C, et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses. Immunity. 2009;31:677–689. doi: 10.1016/j.immuni.2009.08.020. [PubMed] [CrossRef] [Google Scholar]
- 179.Eloe-Fadrosh EA, Brady A, Crabtree J, Drabek EF, Ma B, Mahurkar A, et al. Functional dynamics of the gut microbiome in elderly people during probiotic consumption. MBio. 2015;6:e00231. doi: 10.1128/mBio.00231-15. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 180.Barcenilla A, Pryde SE, Martin JC, Duncan SH, Stewart CS, Henderson C, et al. Phylogenetic relationships of butyrate-producing bacteria from the human gut. Appl Environ Microbiol. 2000;66:1654–1661. doi: 10.1128/AEM.66.4.1654-1661.2000. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 181.Schneider H, Simmering R, Hartmann L, Pforte H, Blaut M. Degradation of quercetin-3-glucoside in gnotobiotic rats associated with human intestinal bacteria. J Appl Microbiol. 2000;89:1027–1037. doi: 10.1046/j.1365-2672.2000.01209.x. [PubMed] [CrossRef] [Google Scholar]
- 182.Fisher K, Phillips C. The ecology, epidemiology and virulence of Enterococcus. Microbiology. 2009;155:1749–1757. doi: 10.1099/mic.0.026385-0. [PubMed] [CrossRef] [Google Scholar]
- 183.Miquel S, Martín R, Rossi O, Bermúdez-Humarán L, Chatel J, Sokol H, et al. Faecalibacterium prausnitzii and human intestinal health. Curr Opin Microbiol. 2013;16:255–261. doi: 10.1016/j.mib.2013.06.003. [PubMed] [CrossRef] [Google Scholar]
- 184.Walters WA, Xu Z, Knight R. Meta-analyses of human gut microbes associated with obesity and IBD. FEBS Lett. 2014;588:4223–4233. doi: 10.1016/j.febslet.2014.09.039. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 185.van Passel MWJ, Kant R, Zoetendal EG, Plugge CM, Derrien M, Malfatti SA, et al. The genome of Akkermansia muciniphila, a dedicated intestinal mucin degrader, and its use in exploring intestinal metagenomes. PLoS ONE. 2011;6:e16876. doi: 10.1371/journal.pone.0016876. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 186.Rallabhandi P, Awomoyi A, Thomas KE, Phalipon A, Fujimoto Y, Fukase K, et al. Differential activation of human TLR4 by Escherichia coli and Shigella flexneri 2a lipopolysaccharide: combined effects of lipid A acylation state and TLR4 polymorphisms on signaling. J Immunol. 2008;180:1139–1147. doi: 10.4049/jimmunol.180.2.1139. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 187.Todar K. Pathogenic E coli. Online textbook of bacteriology. Wisconsin: University of Wisconsin-Madison Deparment of Bacteriology; 2007. pp. 11–30. [Google Scholar]
- 188.Darfeuille-Michaud A, Boudeau J, Bulois P, Neut C, Glasser A-L, Barnich N, et al. High prevalence of adherent-invasive Escherichia coli associated with ileal mucosa in Crohn’s disease. Gastroenterology. 2004;127:412–421. doi: 10.1053/j.gastro.2004.04.061. [PubMed] [CrossRef] [Google Scholar]
- 189.Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 2006;19:449–490. doi: 10.1128/CMR.00054-05. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 190.Chang AH, Parsonnet J. Role of bacteria in oncogenesis. Clin Microbiol Rev. 2010;23:837–857. doi: 10.1128/CMR.00012-10. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- 191.Patterson M. Streptococcus. In: Baron S, editor. Baron’s Med Microbiol. 4th ed. Galveston: University of Texas Medical Branch.
- 192.Del Chierico F, Vernocchi P, Dallapiccola B, Putignani L. Mediterranean diet and health: food effects on gut microbiota and disease control. Int J Mol Sci. 2014;15:11678–99. [PMC free article] [PubMed]
- 193.De Palma G, Nadal I, Collado MC, Sanz Y. Effects of a gluten-free diet on gut microbiota and immune function in healthy adult human subjects. Br J Nutr. 2009;102:1154. doi: 10.1017/S0007114509371767. [PubMed] [CrossRef] [Google Scholar]
- 194.Lorenzo Pisarello MJ, Vintiñi EO, González SN, Pagani F, Medina MS. Decrease in lactobacilli in the intestinal microbiota of celiac children with a gluten-free diet, and selection of potentially probiotic strains. Can J Microbiol. 2015;61:32–37. doi: 10.1139/cjm-2014-0472. [PubMed] [CrossRef] [Google Scholar]
- 195.Wacklin P, Laurikka P, Lindfors K, Collin P, Salmi T, Lähdeaho ML, et al. Altered duodenal microbiota composition in celiac disease patients suffering from persistent symptoms on a long-term gluten-free diet. Am J Gastroenterol. 2014;109:1933–1941. doi: 10.1038/ajg.2014.355. [PubMed] [CrossRef] [Google Scholar]
Пожалуйста, авторизуйтесь, чтобы оставить комментарий.
ДОРОГИЕ ДРУЗЬЯ И КОЛЛЕГИ, А ТАКЖЕ ВСЕ, КТО ИНТЕРЕСУЕТСЯ ВЕСЬМА АКТУАЛЬНОЙ ПРОБЛЕМОЙ ПОДДЕРЖАНИЯ И ВОССТАНОВЛЕНИЯ КИШЕЧНОЙ МИКРОБИОТЫ!
По данным Всемирной организации здравоохранения, до 95% жителей земного шара страдают дисбактериозом (дисбиозом) кишечника. Практически ни одно заболевание не протекает без негативных последствий для кишечной микробиоты. Но самым распространенным губительным действием на кишечные микробы является использование антибиотиков. У относительно здорового человека с массой тела около 70-75 кг в толстой кишке находится около 2-2,5 кг живой биомассы микроорганизмов (нормобиоты), а количество видов достигает 1-1,5 тыс. (!).
Каждый врач, и пациент в том числе, должны понимать, что используемый антибиотик не выбирает точку приложения в организме и в конечном итоге будет подавлять все микробы, которые к нему чувствительны. Применение антибиотика при пневмонии, цистите, бронхите и т.д., как говорится, и лечит, и калечит. С одной стороны, помогает излечить основное заболевание, ради которого его назначили, а с другой, наносит огромный сопутствующий вред чувствительной микробиоте, и в первую очередь, кишечной, одновременно значительно понижая колонизационную резистентность слизистой оболочки желудка и кишечника. При банальном использовании антибиотиков содержание полезных микроорганизмов может снижаться в кишечнике на 3-6 порядков, т.е. в тысячу-миллион раз!
Уже более 50 лет как в нашей стране, так и во всем мире для коррекции микроэкологических нарушений в кишечнике (дисбактериоз, дисбиоз) основными средствами (95-97%) служили препараты на основе живых микробов — пробиотики. В обычной лечебной практике, если врач при анализе кала на дисбактериоз выявлял снижение того или иного вида нормальной микробиоты, то он в первую очередь назначал пациенту пробиотик на основе того вида нормобиоты, дефицит которого зафиксирован. Мало бифидобактерий, давайте «добавим» бифидобактерии в составе того препарата, который врачу больше нравится, и т.д.
В последние годы была пересмотрена стратегия по поддержанию и восстановлению кишечной микробиоты!
Группе российских ученых (около 60 научных работ, 2010-2019 гг., 2 Международных научных открытий, более 10 патентов на изобретения) удалось получить убедительные доказательства того, что использование традиционных препаратов на основе живых микробов — пробиотиков — является не самым эффективным и безопасным путем коррекции микроэкологических нарушений в кишечнике.
Было установлено:
До толстой кишки (основной ареал обитания нормобиоты) в среднем доходит живой всего 1 из 1 000 000 (миллиона) принятых внутрь микробных клеток в составе пробиотика. Выживаемость живых клеток при транзите по желудочно-кишечному тракту составляет менее одной десятимиллионной доли процента. И никакие кислотоустойчивые капсулы, применяемые в некоторых пробиотиках, не спасают ситуацию: выживает не 1, а 4-5 клеток.
У каждого человека в кишечнике находятся свои индивидуальные штаммы (аутоштаммы) лактобацилл, бифидобактерий, кишечной палочки и т.д. А пробиотики изготавливают на основе «универсальных» производственных штаммов микробов. Дошедшие живыми до толстой кишки пробиотические клетки более чем в 70% случаев вступают в антагонистические взаимоотношения с аутоштаммами микроорганизмов пациента, проще говоря, обладают бионесовместимостью.
Пробиотические микробы обладают лимфоцитотоксическим действием, т.к. иммунная система пациента способна определить, какие микроорганизмы (свои или чужие) поступают в желудочно-кишечный тракт. Пробиотические микроорганизмы всегда являются чужеродными для индивидуальной микробиоты пациента.
Существовавший несколько десятилетий тезис о заместительном действии пробиотиков оказался мифом. Пробиотические клетки, дошедшие до толстой кишки в жизнеспособном состоянии, не приживаются в слизистой оболочке кишечника.
В пробиотиках основным действующим началом оказались не микробные клетки, как априорно считалось ранее, а продукты их жизнедеятельности — экзометаболиты, а сами микробные клетки только тормозят процесс восстановления микробиоты при дисбактериозе.
Одновременный прием тех или иных пробиотиков с антибиотиками, о чем постоянно твердят телевизионные рекламные ролики, на самом деле является абсурдным с научной точки зрения и необоснованным. Пробиотические клетки чувствительны к большинству антибиотиков даже в тех небольших концентрациях, которые создаются антибиотиками в крови, а в кишечнике концентрации антибиотиков создаются в десятки-сотни раз выше. Очевидно, что такая реклама вводит потребителя в заблуждение и, видимо, преследует только коммерческие цели.
Получены убедительные доказательства того, что чужеродные пробиотические микроорганизмы обладают биологически опасным потенциалом – при повышенных дозировках способны инициировать транслокацию кишечной микробиоты в брюшную полость и кровоток экспериментальных животных, приводящей к их гибели от инфекционно-токсического шока. При этом культуры аутоштаммов кишечной микробиоты, вводимые в тех же дозах, патологических реакций не вызывают.
Извечный российский вопрос — что делать?
Ответ простой, и в настоящее время он находит полное понимание и согласие у специалистов в данной области — поддерживать и восстанавливать свою собственную индивидуальную микробиоту, ту, которая сформировалась у вас после рождения. Это значительно эффективнее и безопаснее, чем пытаться заселить кишечник «хорошими», но чужими штаммами микроорганизмов!
Самое важное, что этот вывод многократно доказан и научно обоснован.
Достигнуть этого можно только:
- Путем использования узконаправленных пребиотиков, т.е. препаратов, в составе которых отсутствуют живые микробы, но есть вещества, селективно стимулирующие размножение индивидуальной микробиоты пациента. Данный класс препаратов представлен на российском рынке. Наиболее эффективным и изученным из них являются Стимбифид.
- Путем использования метабиотиков (метаболитных пробиотиков), т.е. препаратов, содержащих продукты жизнедеятельности микроорганизмов нормальной микробиоты, — экзометаболитов. Данный класс современных препаратов находится на стадии разработки.
- Путем использования композиции пребиотиков и метабиотиков (метапребиотиков), т.к. механизмы действия у них разные, а цель одна – эффективное и безопасное поддержание и восстановление индивидуальной (индигенной) микробиоты ЖКТ. Первым в мире и наиболее изученным метапребиотиком является Стимбифид плюс.
Пребиотики и метабиотики имеют неоспоримые преимущества перед препаратами, содержащими живые микробы (пробиотиками), а именно:
- Высокая биодоступность, т.к. пребиотические вещества доходят до толстой кишки на 95-97% в неизменном виде (у пробиотиков — менее 0,00000001%). На них в отличие от пробиотиков не влияют агрессивные факторы желудочно-кишечного тракта — кислотность, ферменты, желчь, перекисные соединения, иммуноглобулины и т.д.
- В отличие от пробиотических микробов пребиотики не вступают в конфликт (антагонистические взаимоотношения) с собственной микробиотой пациента, они, наоборот, служат эксклюзивной пищей для нее.
- После ферментации (утилизации) собственными штаммами нормобиоты пациента пребиотики создают благоприятные метаболические условия для её дальнейшего существования в активном состоянии путем закисления внутриполостной среды (снижения pH).
- Пребиотики и метабиотики в отличие от пробиотиков не только можно, но и нужно при необходимости принимать одновременно с антибиотиками. Во-первых, антибактериальные препараты не инактивируют пребиотики и метабиотики, т.к. в них нет живых клеток, а во-вторых, одновременный прием позволяет защитить кишечную микробиоту пациента от негативного сопутствующего воздействия антибиотиков, назначенных при инфекционной патологии других органов.
Этот очень важный вывод научно обоснован в экспериментальных работах группы российских ученых и получил подтверждение в клинической практике Учебно-научного медицинского центра УД Президента РФ.
И самое главное, пребиотики и метабиотики поддерживают и восстанавливают собственную кишечную микробиоту пациента, а не пытаются безрезультатно заселить слизистую кишечника «хорошими», но чужими для него штаммами микроорганизмов. Процесс восстановления индигенной (собственной) микробиоты всегда протекает наиболее эффективно и безопасно, т.к. она является составной частью сформировавшегося микробиоценоза еще с рождения индивидуума и ей не нужно «проходить паспортный контроль» перед иммунной системой и организмом в целом.
Метапребитики, а именно Стимбифид плюс, существенно повышают колонизационную резистентность слизистой оболочки ЖКТ, приводя к выраженному противоинфекционному эффекту: в желудке – к эрадикации хеликобактер пилори (в виде монотерапии!), а в кишечнике – к блокированию бактериальных кишечных инфекций (сальмонеллёза, кишечного иерсиниоза, псевдотуберкулёза и токсигенного эшерихиоза).
C глубоким уважением, президент научного общества «Микробиота» Чичерин И.Ю.
В дополнение к написанному:
В последнее время не только у врачей и учёных сформировалось понимание того, как правильно поддерживать и восстанавливать кишечную микробиоту, но и у широкой общественности появилось аргументированное мнение, что настойчиво рекламируемые пробиотики не решают лечебных проблем и служат только коммерческим целям их производителей. Смотрите сюжет одного из центральных каналов российского ТВ.
doi: 10.21518/2079-701X-2021-4-136-143 Обзорная статья / Review article
Современные подходы к коррекции микробиоты кишечника
Н.В. Стуров, ORCID: 0000-0002-3138-8410, sturov-nv@rudn.ru С.В. Попов®, ORCID: 0000-0002-0567-4616, servit77@yandex.ru В.А. Жуков, ORCID: 0000-0001-9995-264X, vladimirzh94@gmail.com
Российский университет дружбы народов; 117198, Россия, Москва, ул. Миклухо-Маклая, д. 6 Резюме
В статье представлены современные данные о формировании, структуре, функциях и возможностях коррекции кишечной микробиоты. Кишечная микробиота является совокупностью живых организмов, населяющих кишечник человека и формирующих сложную микроэкологическую систему, выполняющую множество функций. Известно, что на состав и состояние кишечной микробиоты оказывают влияние факторы окружающей среды, такие как диета и образ жизни, а также особенности организма человека, включая генетическую предрасположенность. Нарушение в данной системе (дисбиоз) может спровоцировать развитие ряда заболеваний и патологических состояний, при которых коррекция кишечной микробиоты может оказаться перспективной терапевтической стратегией. Наиболее распространенными методами коррекции дисбиоза являются соблюдение диеты, применение про- и пребиотиков и трансплантация фекальной микробиоты. Диета оказывает влияние на качественно-количественный состав и функции кишечной микробиоты, активность отдельных ее представителей. Пробиотики используются для модуляции, сохранения кишечной микробиоты при дисбиозе, а также для профилактики его развития. Трансплантация фекальной микробиоты осуществляется путем переноса микробиоты от здорового донора. Данный метод является одним из эффективных способов лечения инфекции Clostridium difficile. В данной обзорной статье также представлены результаты применения трансплантации фекальной микробиоты у пациентов с воспалительными заболеваниями кишечника и печеночной энцефалопатией. Показано, что после трансплантации наблюдается быстрое изменение состава кишечной микробиоты, которая становится сходной с микробиотой здорового донора. Каждый из перечисленных способов коррекции демонстрирует различную степень влияния на кишечную микробиоту, а их терапевтическая эффективность зависит от непосредственных характеристик используемых методик, а также конкретного заболевания и требует дальнейшего изучения.
Ключевые слова: кишечная микробиота, дисбиоз, коррекция микробиоты, диета, пробиотики, трансплантация фекальной микробиоты
Благодарности. Работа выполнена в рамках НИР №033802-0-000 «Исследование микрофлоры кишечника и методов ее коррекции у пациентов с заболеваниями почек и мочевыводящих путей».
Для цитирования: Стуров Н.В., Попов С.В., Жуков В.А. Современные подходы к коррекции микробиоты кишечника. Медицинский совет. 2021;(4):136-143. doi: 10.21518/2079-701X-2021-4-136-143.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Modern approaches to the correction of the gut microbiota
Nikolay V. Sturov, ORCID: 0000-0002-3138-8410, sturov-nv@rudn.ru
Sergey V. Popov®, ORCID: 0000-0002-0567-4616, servit77@yandex.ru
Vladimir A. Zhukov, ORCID: 0000-0001-9995-264X, vladimirzh94@gmail.com
Peoples’ Friendship University of Russia; 6, Miklukho-Maklai St., Moscow, 117198, Russia
Abstract
The article presents modern data on the formation, structure, functions and possibilities of correction of the gut microbiota. The gut microbiota is a collection of living organisms that inhabit the human intestine and form a complex microecological system that performs many functions. It is known that the composition and state of the gut microbiota is influenced by both environmental factors, such as diet and lifestyle, and the human body, including genetic predisposition. A violation in this system (dysbiosis) can provoke the development of a number of diseases and pathological conditions, in which the correction of the gut microbiota may be a promising therapeutic strategy. The most common methods of correcting dysbiosis are dieting, the use of pro-and prebiotics, and fecal microbiota transplantation. The diet affects the qualitative and quantitative composition and functions of the gut microbiota, the activity of its individual representatives. Probiotics are used to modulate, preserve the gut microbiota in dysbiosis, as well as to prevent its development. Fecal microbiota transplantation is performed by transferring the microbiota from a healthy donor. This method is one of the most effective ways to treat Clostridium difficile infection. This review article also presents the results of fecal microbiota transplantation in patients with inflammatory bowel disease and hepatic encephalopathy. It is shown that after transplantation, there is a rapid change in the composition of the gut microbiota, which becomes similar to the microbiota of a healthy donor. Each of these methods of correction demonstrates a different degree of influence on the gut
136 МЕДИЦИНСКИЙ СОВЕТ 2021;(4):136-143
© Стуров Н.В., Попов С.В., Жуков В.А., 2021
microbiota, and their therapeutic effectiveness depends on the direct characteristics of the methods used, as well as the specific disease and requires further study.
Keywords: gut microbiota, dysbiosis, microbiota correction, diet, probiotics, fecal microbiota transplantation
Acknowledgments. This paper prepared according to Research Project №№033802-0-000 «Study of intestinal microflora and methods of its correction in patients with kidney and urinary tract diseases».
For citation: Sturov N.V., Popov S.V., Zhukov V.A. Modern approaches to the correction of the gut microbiota. Meditsinskiy sovet = Medical Council. 2021;(4):136-143. (In Russ.) doi: 10.21518/2079-701X-2021-4-136-143.
Conflict of interest: the authors declare no conflict of interest.
ВВЕДЕНИЕ
Кишечная микробиота (КМ) представляет собой совокупность микроорганизмов, населяющих кишечник человека. Помимо бактерий, микробиоту составляют археи и простейшие, вирусы и грибы, а также некоторые нематоды. Данные микроорганизмы образуют собственные микроэкологические ниши, формируя сложную и динамичную систему. Наибольшее количество исследований посвящено изучению бактериального состава КМ [1]. По оценкам специалистов, в состав КМ входят порядка 1014 бактерий, большинство которых являются анаэробами (соотношение между аэробами и анаэробами в норме около 1:10) [1, 2]. Они подразделяются на облигатных (резидентных) представителей, постоянно присутствующих в организме человека и выполняющих основные для человека функции, и транзиторных (факультативных), состав которых непостоянен [1]. КМ начинает формироваться еще во внутриутробном периоде и претерпевает ряд последовательных изменений [3]. Известно, что микробный профиль матери является одним из первоначальных факторов, влияющих на формирование КМ новорожденных. Большое значение имеют также способ родоразреше-ния (кесарево сечение или роды через естественные пути), способ кормления (грудное молоко или вскармливание с помощью смеси), использование антибиотиков, время введения твердой пищи и прекращения кормления грудью [3, 4]. При родоразрешении путем кесарева сечения, в отличие от родов через естественные пути, состав КМ новорожденного меньше похож на материнский и чаще включает представителей микробиоты кожи и полости рта, а также бактерии из операционной [5]. После рождения в КМ новорожденного временно преобладают Enterobacteriaceae и Staphylococcus [6]. Далее, на время грудного кормления, в микробиоте наблюдается преобладание Bifidobacterium, которое продолжается до введения в рацион питания ребенка твердой пищи и прекращения кормления грудью. Начинает формироваться КМ взрослого типа с соответствующим разнообразием видов и набором функций, который окончательно формируется к трехлетнему возрасту [3, 7]. Становление микробиоты в младенчестве является важным этапом в развитии иммунной системы. Известно, что нарушение этого процесса может иметь долгосрочные последствия, способствовать развитию заболеваний в более позднем возрасте, включая воспалительные заболевания кишечника (ВЗК), различные аллергии и бронхиальную астму [8].
Состав и состояние КМ зависят от влияния как факторов окружающей среды, таких как диета и образ жизни, так и организма хозяина, включая генетическую предрасположенность. Известно, что существует комплекс взаимодействий представителей КМ между собой и с макроорганизмом [9-12]. Контроль микробиоты со стороны макроорганизма осуществляется посредством следующих механизмов: воздействие на микроорганизмы механических факторов (десквамация эпителия слизистых оболочек, влияние секретов и перистальтики); выработка активных химических веществ (соляной кислоты желудочного сока, кишечного сока, желчных кислот в тонкой кишке, щелочного секрета слизистой оболочки тонкой кишки); выделение бактерицидных секретов слизистых оболочек; подавление адгезии бактерий на слизистых оболочках секреторными антителами класса IgA [10]. В кишечнике здорового взрослого человека доминирующими представителями являются бактерии филотипов Firmicutes (включая Lactobacillus) и Bacteroidetes, составляющих около 90% бактериальной структуры КМ. Меньшая часть приходится на Actinobacteria (включая Bifidobacterium), Proteobacteria, Verrucomicrobia и Fusobacteria (табл.) [13, 14]. Между тем здоровая микро-биота не является идеальным и строго установленным набором конкретных микроорганизмов. Комплекс функций в определенной среде может выполняться различными представителями КМ у людей, образуя «здоровое функциональное ядро». Исследование и определение необходимых и достаточных наборов микробов и их нормальных диапазонов, которые выполняют данные функции и поддерживают здоровье носителя, является важным и перспективным предметом изучения [15, 16]. Одной из потенциальных характеристик, свойственных здоровой КМ, является ее устойчивость к внешним факторам и способность к поддержанию нормального функционального состояния [15].
Здоровая КМ выполняет множество функций и поддерживает состояние гомеостаза. Она продуцирует ферменты и участвует в метаболизме желчных кислот, белков, липи-дов и углеводов, способствуя перевариванию пищи и усиливая перистальтику кишечника, а также синтезирует витамины (включая синтез небольшого количества витамина В12 лакто- и пропионобактериями) и незаменимые аминокислоты. Нормальная КМ поддерживает целостность слизистого барьера кишечника и играет важную роль в формировании иммунитета и защите макроорганизма от патогенов [9]. Комплексная защита от колонизации патогенами реализуется посредством активации иммунных механиз-
Таблица. Качественно-количественный состав микробиоты толстого кишечника у здоровых людей* Table. Qualitative and quantitative composition of the colon microbiota in healthy people
Возраст, годы
Виды микроорганизмов <1 1-60 >60
Содержание, КОЕ/г фекалий
Бифидобактерии 1010-1011 109-1010 108-109
Лактобактерии 106-107 107-108 106-107
Бактероиды 107-108 109-1010 1010-1011
Энтерококки 105-107 105-108 106-107
Фузобактерии <106 108-109 108-109
Эубактерии 106-107 109-1010 109-1010
Пептострептококки <105 109-1010 1010
Клостридии «103 «105 «106
E. coli типичные 107-108 107-108 107-108
E. coli лактозонегативные <105 <105 <105
E. coli гемолитические 0 0 0
Другие условно-патогенные энтеробактерии (Klebsiella, Enterobacter, Hafhia, Proteus и др.) <104 <104 <104
Стафилококк золотистый 0 0 0
Стафилококки (сапрофитный, эпидермальный) «104 «104 «104
Дрожжеподобные грибы рода Candida «103 «104 «104
Неферментирующие бактерии (Pseudomonas, Acinetobacter и др.) «103 «104 «104
* Согласно ОСТ 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника».
мов (в частности, индукции продуцирования антител класса IgA), препятствия адгезии и конкуренции за локусы обитания и питательные вещества, а также синтеза ряда веществ, подавляющих рост и размножение патогенов, прежде всего органических кислот, перекиси водорода и других биологически активных субстанций [9, 14]. Важными продуктами жизнедеятельности КМ являются короткоцепочечные жирные кислоты (КЦЖК), такие как ацетат, бутират и пропионат. Известно, что бутират, образующийся в результате метаболических процессов в основном представителями Firmicutes и Actinobacteria, способствует поддержанию барьерной функции кишечника, может препятствовать миграции бактерий и обладает противовоспалительной и противоопухолевой активностью, участвуя в модуляции регуляторных Т-клеток, а также сдерживая пролиферацию и избирательно способствуя апоптозу клеток [17-19].
Состав и функции КМ могут быть нарушены при дис-биозе. Данное состояние обуславливает снижение общего микробного разнообразия, нарушение защитных свойств микробиоты, а также рост условно-патогенных и патогенных микробов и их преобладание в экосистеме [20, 21]. Нарушаются обменные процессы КМ, в результате бакте-
риальной ферментации ароматических аминокислот образуются токсичные соединения, такие как нитриты, аммиак, полиамины, сульфиды и пр. Данные вещества обладают провоспалительной и канцерогенной активностью, участвуя в процессах алкилирования ДНК и окислительного стресса, а также нарушая обмен КЦЖК, в частности бутира-та. Некоторые патогены способны использовать полиамины для повышения вирулентности [19, 22]. Обменные процессы изменяются также вследствие нарушения метаболизма и синтеза витаминов. Снижение количества Bifidobacterium ведет к дефициту витамина B2, что сопровождается различными заболеваниями кожи [23]. Известно, что на состав КМ может влиять употребление и концентрация витамина D в крови. Изучается возможность прямого влияния витамина D на бактерии, а также связь данных взаимоотношений с развитием аутоиммунных заболеваний [24, 25]. Дисбиоз ассоциирован с различными заболеваниями, такими как ВЗК, синдром раздраженного кишечника (СРК), первичный склерозирую-щий холангит, хронический запор, осмотическая диарея, инфекции мочевыводящих путей, метаболический синдром и ожирение, колоректальный рак [19, 26-28]. Обсуждается роль нарушений КМ в развитии ревматоид-
ного артрита, рассеянного склероза, анкилозирующего спондилоартрита, системной красной волчанки и псориаза [29]. Коррекция нарушений микробиоты возможна с помощью модификации диеты, применения про- и пре-биотиков, а также трансплантации фекальной микробиоты (ТФМ) и других альтернативных методик.
ДИЕТА
Диета является одним из основополагающих факторов, влияющих на состав и функции КМ [17]. Каждый тип макроэлементов (белки, жиры, углеводы и пищевые волокна) специфическим образом влияет на качественно-количественный состав КМ и функции ее представителей [27]. Диета, основанная на продуктах растительного происхождения (овощи, фрукты, бобовые, злаковые), с употреблением достаточного количества пищевых волокон и ограничением в рационе или полным исключением мяса и яиц положительно влияет на общее микробное разнообразие. Такой рацион способствует увеличению в составе КМ количества полезных, продуцирующих бутират бактерий филотипа Firmicutes (в т.ч. Lactobacillus spp., Ruminococcus spp., Eubacterium rectale, Faecalibacterium prausnitzii и Roseburia spp), а также Actinobacteria (Bifidobacterium spp.) [27, 30-32]. Употребление в пищу мяса, яиц и молока отрицательно сказывается на общем микробном разнообразии. Данный тип питания с употреблением продуктов животного происхождения, высоким содержанием жиров и недостатком в пищевых волокнах уменьшает количество полезных Firmicutes, а также стимулирует рост патогенов в КМ. Краткосрочная диета подобного типа также способна оказывать влияние на КМ. В результате увеличивается количество гнилостных протеолитических бактерий (в основном Bacteroides), развивается гнилостный дисбиоз. Образуются токсичные соединения (аммиак, амины и фенолы), повышается риск развития ряда заболеваний [27, 30, 32-34].
В исследовании P. Smith-Brown et al. было проанализировано влияние продуктов питания на КМ 37 детей в возрасте 2-3 лет. Потребление молочных продуктов было ассоциировано со снижением микробного разнообразия, а потребление овощей было связано с увеличением относительной численности представителей рода Lachnospira. Также наблюдалась положительная корреляция между потреблением растительных белков (соя, бобовые и орехи) и относительной численностью Bacteroides xylanisolvens, которая в отличие от большинства других видов Bacteroides неспособна разлагать крахмал. Рост Bacteroides xylanisolvens, предположительно, является следствием того, что соевые бобы, послужившие источником питания для данного вида, содержат очень мало крахмала в отличие от большинства других бобовых [35]. Подобные результаты были продемонстрированы в работе F. De Filippis et al., где диета на основе растительных продуктов была связана с увеличением рода Lachnospira и Prevotella. При этом наблюдалась положительная корреляция между употреблением продуктов животного происхождения и содержанием в КМ Ruminococcus и Streptococcus [31]. Молочные продукты
в рационе также увеличивают численность Streptococcus в КМ [31, 35]. Стоит отметить, что относительное количество родов Lachnospira, Veillonella, Faecalibacterium и Rothia снижено у детей, относящихся к группе риска развития бронхиальной астмы [36].
ПРОБИОТИКИ И ПРЕБИОТИКИ
Пробиотиками являются живые микроорганизмы, применение которых в адекватной дозировке может оказывать положительное воздействие на организм человека [37]. Для успешного использования пробиотики должны обладать способностью сохранять свои свойства при прохождении по желудочно-кишечному тракту, а также быть способными к колонизации и существованию в конкурентной среде КМ. Штаммы пробиотиков должны принадлежать к видам, содержащимся в составе здоровой КМ в естественных условиях. Такие препараты должны быть безопасны, демонстрировать клиническую эффективность и оставаться стабильными при хранении. Пробиотики используются как для модуляции и сохранения КМ при дисбиозе, так и для профилактики ее нарушения [20, 38]. Благоприятное влияние пробиотических штаммов реализуется через иммунологические (активация макрофагов, стимулирование выработки IgA, модулирование цитокинового ответа и повышение толерантности к антигенам) и неиммунологические механизмы (метаболические процессы, участие в пищеварении, конкуренция с патогенами за локусы адгезии и питательные вещества, синтез бактериоцинов, изменение pH среды и др.) [39, 40]. Использование пробиотиков целесообразно для снижения потребности в антимикробных препаратах при некоторых инфекционных заболеваниях. Установлено, что совместное применение пробиотика с антибиотиком может обуславливать возможность сокращения продолжительности антимикробной терапии [41, 42]. Как правило, используются штаммы молочнокислых бактерий (Lactobacillus, Lactococcus, Leuconostoc, Pediococcus, Enterococcus, Streptococcus и т.д.), Bifidobacterium и Saccharomyces boulardii [43]. Lactobacillus и Bifidobacterium способны стимулировать иммунитет хозяина и способствовать образованию полезных КЦЖК. Результаты некоторых исследований демонстрируют, что пробиотики и пребиотики могут способствовать нормализации липид-ного профиля (снижение уровня общего холестерина (ОХ) и холестерина липопротеинов низкой плотности (ЛПНП), триглицеридов, увеличение холестерина липопротеинов высокой плотности (ЛПВП)), оказывая тем самым терапевтическое и профилактическое влияние на течение сердечно-сосудистых заболеваний [44]. Пробиотики (L. lactis, Bifidobacterium) секретируют аналог инсулина с характерным биологическим эффектом и могут применяться при лечении сахарного диабета второго типа [44, 45]. Обсуждается также возможность применения пробиотиков при ВИЧ-инфекции [46]. Активно изучаются пробиотики нового поколения (Akkermansia muciniphila, Clostridium IV, XIVa и XVIII, Faecalibacterium prausnitzi и др.) [20, 47-49]. Показано,
что количество Akkermansia muciniphila значительно снижается при ожирении, у пациентов с сахарным диабетом и другими метаболическими нарушениями [50, 51].
В метаанализе L.E. Miller et aL, включающем 21 исследование, было показано, что пробиотики с Lactobacillus или Bifidobacterium увеличивают частоту стула у взрослых пациентов с запором [52]. Недавний систематический обзор демонстрирует также эффективность применения Lactobacillus и Bifidobacterium при СРК. Назначение этих препаратов способствовало уменьшению симптоматики (боли в животе и метеоризма) и обуславливало улучшение качества жизни пациентов [53]. Существуют также данные о благоприятном влиянии пробиотиков на течение ВЗК. Сообщается, что подобная терапия может способствовать профилактике рецидивов язвенного колита (ЯК) [54]. Метаанализ 18 рандомизированных контролируемых исследований (РКИ) демонстрирует терапевтический эффект от применения комбинации из 8 штаммов (Lactobacillus casei, L. plantarum, L. acidophilus, L. delbrueckii, подвид bulgaricus, Bifidobacterium longum, B. breve, B. infantis и Streptococcus salivarius) при лечении пациентов с ЯК, включенных в группу приема данных пробиотиков, и снижение частоты рецидивов [55]. В отличие от ЯК при болезни Крона применение пробиотиков на сегодняшний день не имеет убедительных доказательств эффективности [40, 56]. Существуют данные о том, что дефицит витамина D или дефект соответствующих рецепторов может ослаблять благоприятное воздействие от приема пробиотиков при ВЗК и СРК. Это позволяет предположить, что положительный результат при терапии с применением пробиотиков в некоторых случаях отсутствовал вследствие дефицита витамина D [57]. Определено, что применение пробиотиков оказывает положительный клинический эффект на течение хронических заболеваний почек [58]. Результаты исследований свидетельствуют об уменьшении в крови концентрации мочевины, при этом отмечается повышение содержания мочевой кислоты [59]. Известно также о положительных эффектах пробиотиков при терапии неалкогольной жировой болезни печени (НАЖБП), нарушении всасываемости лактозы, а также при профилактике и лечении печеночной энцефалопатии и для эра-дикации Helicobacter pylori [40].
Пребиотики — это вещества, избирательно стимулирующие рост и метаболическую активность микроорганизмов, входящих в состав КМ [40]. В качестве пребиотиков используются фруктоолигосахариды, галактоолигосахариды, лак-тулоза и неперевариваемые полисахариды (инулин, целлюлоза, гемицеллюлоза, пектины и пр.) [20,44]. Большинство пребиотиков, включая фруктоолигосахариды и инулин, перевариваются бифидобактериями, что способствует стимулированию их роста [44]. Пребиотики естественным образом присутствуют в овощах, таких как артишоки, лук, цикорий, чеснок и лук-порей. Увеличение численности Latobacilli, Bacteroides, Lachnospiraceae и F. prausnitzii наблюдалось в результате дополнения рациона данными преби-отиками [27]. Комбинация пробиотика и пребиотика позволяет пробиотическим штаммам эффективнее развиваться в конкурентных условиях среды КМ. Такая комбинация
называется синбиотиком. Продуктами ферментации пребиотиков обычно являются КЦЖК [14, 20]. В систематическом обзоре, опубликованном A. Hadi et al., показано, что использование синбиотических добавок пациентами с НАЖБП может снизить массу тела, уровень сахара в крови натощак, инсулин, холестерин ЛПНП, ОХ, триглицериды, высокочувствительный С-реактивный белок, фактор некроза опухоли альфа, уровни аланинтрансаминазы и аспартат-трансаминазы. Напротив, синбиотик не оказал благоприятного воздействия на индекс массы тела (ИМТ), окружность талии и уровни холестерина ЛПВП [60]. Необходимо отметить, что результаты проведенных к настоящему времени исследований про- и пребиотиков гетерогенны и эффект от их применения часто зависит от тестируемых штаммов пробиотиков [44].
В систематическом обзоре N. Kristensen et al. на основании анализа 7 РКИ был сделан вывод об отсутствии убедительных данных о влиянии пробиотиков на состав фекальной микробиоты. Сообщается о значительной неоднородности данных в исследованиях, при этом вопросы о механизмах влияния пробиотиков продолжают оставаться предметом дискуссий [61]. На интеграцию пробиотических штаммов в кишечнике может повлиять уже существующая КМ и состояние доступных метаболических ниш [62]. Предполагается, что пробиотики могут способствовать стабильности состава КМ и противодействию внешних факторов либо ускорять восстановление после стресса [63]. Известно, что на состав КМ воздействует множество переменных, что затрудняет определение ведущих факторов влияния и формирование гипотез [64]. Несмотря на известные благоприятные эффекты и рекомендации по практическому применению, необходимы дополнительные исследования в отношении эффективности и безопасности использования про- и пребиотиков при различных заболеваниях, а также определения их возможности влиять на состав и функции КМ, способствовать сохранению гомеостаза и защите от внешних факторов [20, 40, 63].
ТРАНСПЛАНТАЦИЯ ФЕКАЛЬНОЙ МИКРОБИОТЫ
Методика ТФМ представляет собой прямой перенос микробиоты от здорового донора посредством перораль-ного приема соответствующего препарата либо ректальным путем. Данный метод является важным и эффективным способом лечения инфекции Clostridium difficile, в особенности не поддающейся стандартной антибиотико-терапии. Эффективность и безопасность этой процедуры была подтверждена многими исследованиями [20, 40, 65, 66]. Показано, что после ТФМ наблюдается быстрое изменение состава фекальной микробиоты, которая становится схожей с микробиотой здорового донора. Такие изменения сохраняются как минимум до 24 нед. [67]. В настоящее время изучается возможность применения ТФМ в терапии и профилактике рецидивов ВЗК. Ряд РКИ свидетельствует об эффективности и безопасности ТФМ при ЯК. Процент достижения ремиссии в группе ТФМ составил 24-44% от общего количества пациентов
(по сравнению с 5-20% пациентов в контрольных группах). В метаанализе С. BLanchaert et а1. было определено, что значительно больше пациентов в группе ТФМ достигают клинической ремиссии, по сравнению с контрольной группой (р = 0,01): 42,1% против 22,6% [68]. В недавнем пилотном РКИ у пациентов с БК в группе пациентов, перенесших ТФМ, отмечено увеличение длительности ремиссии и улучшение эндоскопической картины [69]. Благоприятное влияние ТФМ при ВЗК подтверждается результатами недавнего систематического обзора, при этом сообщается об относительно большей эффективности процедуры при БК, чем при ЯК [70]. Имеющиеся данные об эффективности ТФМ в терапии СРК неоднозначны и противоречивы. В отдельных исследованиях имеются сообщения о возможных благоприятных эффектах данной стратегии лечения, улучшении клинической картины заболевания [71]. Между тем в ряде систематических обзоров сообщается об отсутствии убедительных доказательств эффективности ТФМ при СРК [72-74].
Одним из возможных направлений применения методики ТФМ является терапия пациентов с печеночной энцефалопатией. Э. Као et а1. сообщили о клиническом случае улучшения течения заболевания, снижении уровня аммиака в сыворотке крови и положительном влиянии на качество жизни пациента с печеночной энцефалопатией после выполнения ТФМ [75]. Эффективность ТФМ подтверждена РКИ, в которых отмечено улучшение когнитивных функций и снижение частоты госпитализаций амбулаторных пациентов с печеночной энцефалопатией [76, 77]. Показано, что после ТФМ с применением капсул, дополнительно обогащенных 1асЬпо$р’!гасеае и ^ттососсасеае, произошло увеличение микробного разнообразия в кишечнике реципиентов: увеличение ^ттососсасеае, В|АСоЬайепасеае и снижение Б^ерк>соссасеае и УеШопеНасеае двенадцатиперстной кишки (р = 0,01); уменьшение количества УеШопеНасеае в сигмовидной кишке (р = 0,04) и кале (р = 0,05) [77]. Подтверждена также возможность переноса реципиенту собственных бактериофагов донора во время ТФМ. Такие бактериофаги являются частью КМ и, предположительно, могут быть использованы в перспективе для ее коррекции. Данная гипотеза согласуется с пилотным исследованием, в котором при ТФМ был использован препарат, лишенный бактерий, что в результате оказалось
эффективным подходом при лечении инфекции Clostridium difficile [78]. Между тем следует помнить о том, что ТФМ может привести к передаче патогенных штаммов, а польза и риски этой процедуры у различных групп пациентов могут быть неоднозначными. В частности, в двух независимых клинических исследованиях у двух пожилых пациентов после ТФМ от одного донора развилась бактериемия E. coli, ассоциированная с бета-лактамазой расширенного спектра (БЛРС). В одном из данных случаев последовали развитие сепсиса и смерть пациента [79]. Поэтому для того, чтобы избежать нежелательной инфекции, необходимо проводить предварительный скрининг доноров кала, используя стандартизированные подходы [80]. В соответствии с протоколами у потенциального донора должен проводиться забор крови и кала за 4-5 дней до сбора фекалий. Проводятся тесты на вирусы гепатита (A, B и C), ВИЧ, T. pallidum, C. difficile и распространенные желудочно-кишечные патогенные бактерии и паразиты. Существуют также рекомендации по предварительной оценке эубиоти-ческого статуса фекальной микробиоты доноров с помощью ПЦР и методов секвенирования генома [20].
ЗАКЛЮЧЕНИЕ
Структура и функциональное состояние КМ определяются генетическими факторами и влиянием окружающей среды (диеты, образа жизни). КМ здорового человека способствует поддержанию гомеостаза, участвует в обмене и синтезе полезных веществ, препятствуя развитию заболеваний. Изучение спектра бактерий, ответственных за эти функции, и их количественных характеристик является актуальным и перспективным предметом исследований. В настоящее время доказана связь развития ряда заболеваний с изменениями в КМ. Определено, что коррекция КМ возможна при назначении определенной диеты, использовании пробиотиков и пребиотиков, а также ТФМ. Для рационального применения этих методик коррекции КМ необходимы дальнейшие исследования их терапевтических и профилактических возможностей.
Поступила / Received: 02.02.2021 Поступила после рецензирования / Revised: 24.02.2021 Принята в печать / Accepted: 26.02.2021
-Список литературы / References-
1. Никонов Е.Л., Попова Е.Н. (ред.). Микробиота. М.: Медиа Сфера; 2019. 255 с. Режим доступа: https://endoexpert.ru/stati/monografiya_mikrobio-ta_pod_redaktsiey_e_l_nikonova_i_e_n_popovoy_2019/. Nikonov E.L., Popova E.N. (eds.) Mikrobiota. Moscow: Media Sfera; 2019. 255 p. (In Russ.) Available at: https://endoexpert.ru/stati/monografiya_mikrobiota_pod_ redaktsiey_e_l_nikonova_i_e_n_popovoy_2019/.
2. Sender R., Fuchs S., Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body. PLoSBiology. 2016;14(8):e1002533.
doi: 10.1371/journal.pbio.1002533.
3. 3. Tanaka M., Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life. Allergol Int. 2017;66(4):515-522. doi: 10.1016/j.alit.2017.07.010.
4. Dunn A.B.,Jordan S., Baker BJ., Carlson N.S.The Maternal Infant Microbiome: Considerations for Labor and Birth. MCN Am J Matern Child Nurs. 2017;42(6):318-325. doi: 10.1097/NMC.0000000000000373.
5. Bäckhed F., Roswall J., Peng Y., Feng О., Jia H., Kovatcheva-Datchary P. et al. Dynamics and Stabilization of the Human Gut Microbiome during the First Year of Life. Cell Host Microbe. 2015;17(6):852. doi: 10.1016/j. chom.2015.04.004.
6. Matsuki T., Yahagi K., Mori H., Matsumoto H., Hara T., Tajima S. et al. A key genetic factor for fucosyllactose utilization affects infant gut microbiota development. Nat Commun. 2016;7:11939. doi: 10.1038/ncomms11939.
7. Nuriel-Ohayon M., Neuman H., Koren O. Microbial Changes during Pregnancy, Birth, and Infancy. Front Microbiol. 2016;7:1031. doi: 10.3389/ fmicb.2016.01031.
8. Gensollen T., Iyer S.S., Kasper D.L., Blumberg R.S. How colonization by microbiota in early life shapes the immune system. Science. 2016;352(6285):539-544. doi: 10.1126/science.aad9378.
9. Thursby E., Juge N. Introduction to the human gut microbiota. Biochem J. 2017;474(11):1823-1836. doi: 10.1042/BCJ20160510.
10. Adair K.L., Douglas A.E. Making a microbiome: the many determinants
of host-associated microbial community composition. Curr Opin Microbiol. 2017;35:23-29. doi: 10.1016/j.mib.2016.11.002.
11. Hall A.B., Tolonen A.C., Xavier RJ. Human genetic variation and the gut microbiome in disease. Nat Rev Genet. 2017;18(11):690-699. doi: 10.1038/ nrg.2017.63.
12. Abdul-Aziz M.A., Cooper A., Weyrich L.S. Exploring Relationships between Host Genome and Microbiome: New Insights from Genome-Wide Association Studies. Front Microbiol. 2016;7:1611. doi: 10.3389/ fmicb.2016.01611.
13. Harmsen HJ. M., de Goffau M.C. The Human Gut Microbiota. AdvExp Med Biol. 2016;902:95-108. doi: 10.1007/978-3-319-31248-4_7.
14. Jandhyala S.M., Talukdar R., Subramanyam C., Vuyyuru H., Sasikala M., Reddy D.N. Role of the normal gut microbiota. World J Gastroenterol. 2015;21(29):8787-803. doi: 10.3748/wjg.v21.i29.8787.
15. Lloyd-Price J., Abu-Ali G., Huttenhower C. The healthy human microbiome. Genome Med. 2016;8(1):51. doi: 10.1186/s13073-016-0307-y.
16. Shafquat A., Joice R., Simmons S.L., Huttenhower C. Functional and phylo-genetic assembly of microbial communities in the human microbiome. Trends Microbiol. 2014;22(5):261-266. doi: 10.1016/j.tim.2014.01.011.
17. Nagai M., Obata Y., Takahashi D., Hase K. Fine-tuning of the mucosal barrier and metabolic systems using the diet-microbial metabolite axis.
Int Immunopharmacol. 2016;37:79-86. doi: 10.1016/j.intimp.2016.04.001.
18. Flint HJ., Duncan S.H., Scott K.P., Louis P. Links between diet, gut microbiota composition and gut metabolism. Proc Nutr Soc. 2015;74(1):13-22.
doi: 10.1017/S0029665114001463.
19. Meng X., Zhang G., Cao H., Yu D., Fang X., Vos W.M., Wu H. Gut dysbacterio-sis and intestinal disease: mechanism and treatment. J Appl Microbiol. 2020;129(4):787-805. doi: 10.1111/jam.14661.
20. Gagliardi A., Totino V., Cacciotti F., lebba V., Neroni B., Bonfiglio G. et al. Rebuilding the Gut Microbiota Ecosystem. Int J Environ Res Public Health. 2018;15(8):1679. doi: 10.3390/ijerph15081679.
21. Bäumler AJ., Sperandio V. Interactions between the microbiota and pathogenic bacteria in the gut. Nature. 2016;535(7610):85-93. doi: 10.1038/ nature18849.
22. Amabebe E., Robert F.O., Agbalalah T., Orubu E.S. F. Microbial dysbiosis-induced obesity: role of gut microbiota in homoeostasis of energy metabolism. Br J Nutr. 2020;123(10):1127-1137. doi: 10.1017/ S0007114520000380.
23. Kwak MJ., Kwon S.K., Yoon J.K., Song J.Y., Seo J.G., Chung MJ., Kim JF. Evolutionary architecture of the infant-adapted group of Bifidobacterium species associated with the probiotic function. Syst Appl Microbiol. 2016;39(7):429-439. doi: 10.1016/j.syapm.2016.07.004.
24. Shang M., Sun J. Vitamin D/VDR, probiotics, and gastrointestinal diseases. Curr Med Chem. 2017;24(9):876-887. doi: 10.2174/0929867323666161202 150008.
25. Yamamoto E.A., Jorgensen T.N. Relationships Between Vitamin D, Gut Microbiome, and Systemic Autoimmunity. Front Immunol. 2020;10:3141. doi: 10.3389/fimmu.2019.03141.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
26. Celiberto L.S., Bedani R., Rossi E.A., Cavallini D.C. U. Probiotics: The scientific evidence in the context of inflammatory bowel disease. Crit Rev Food Sci Nutr. 2017;57(9):1759-1768. doi: 10.1080/10408398.2014.941457.
27. Tidjani Alou M., Lagier J.-C., Raoult D. Diet influence on the gut microbiota and dysbiosis related to nutritional disorders. Hum Microbiome J. 2016;1:3-11. doi: 10.1016/j.humic.2016.09.001.
28. Magruder M., Sholi A.N., Gong C., Zhang L., Edusei E., Huang J. et al. Gut uropathogen abundance is a risk factor for development of bacteriuria and urinary tract infection. Nat Commun. 2019;10(1):5521. doi: 10.1038/ s41467-019-13467-w.
29. Forbes J.D., Van Domselaar G., Bernstein C.N. The Gut Microbiota in Immune-Mediated Inflammatory Diseases. Front Microbiol. 2016;7:1081. doi: 10.3389/fmicb.2016.01081.
30. Simpson H.L., Campbell BJ. Review article: dietary fibre — microbiota interactions. Aliment Pharmacol Ther. 2015;42(2):158-179. doi: 10.1111/ apt.13248.
31. Filippis F.D., Pellegrini N., Vannini L., Jeffery I.B., Storia A.L., Laghi L. et al. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut. 2016;65(11):1812-1821. doi: 10.1136/gutjnl-2015-309957.
32. Sakkas H., Bozidis P., Touzios C., Kolios D., Athanasiou G., Athanasopoulou E. et al. Nutritional Status and the Influence of the Vegan Diet on the Gut Microbiota and Human Health. Medicina (Kaunas). 2020;56(2):88. doi: 10.3390/medicina56020088.
33. David L.A., Maurice C.F., Carmody R.N., Gootenberg D.B., Button J.E., Wolfe B.E. et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014;505(7484):559-563. doi: 10.1038/nature12820.
34. Murphy E.A., Velazquez K.T., Herbert K.M. Influence of High-Fat-Diet on Gut Microbiota: A Driving Force for Chronic Disease Risk. Curr Opin Clin Nutr Metab Care. 2015;18(5):515-520. doi: 10.1097/MC0.0000000000000209.
35. Smith-Brown P., Morrison M., Krause L., Davies P.S. W. Dairy and plant based food intakes are associated with altered faecal microbiota in 2
to 3 year old Australian children. Sci Rep. 2016;6:32385. doi: 10.1038/ srep32385.
36. Arrieta M.-C., Stiemsma L.T., Dimitriu P.A., Thorson L., Russell S., Yurist-Doutsch S. et al. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Sci Transl Med. 2015;7(307):307ra152.
doi: 10.1126/scitranslmed.aab2271.
37. Hill C., Guarner F., Reid G., Gibson G.R., Merenstein DJ., Pot B. et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-514. doi: 10.1038/nrgastro.2014.66.
38. Sebastián Domingo JJ. Review of the role of probiotics in gastrointestinal diseases in adults. Gastroenterol Hepatol. 2017;40(6):417-429.
doi: 10.1016/j.gastrohep.2016.12.003.
39. Daliri E., Lee B.H. New perspectives on probiotics in health and disease. Food Sci Hum Wellness. 2015;4(2):56-65. doi: 10.1016/j.fshw.2015.06.002.
40. Guarner F., Sanders M.E., Eliakim R., Fedorak R., Gangl A., Garisch J. et al. Probiotics and prebiotics. World Gastroenterology Organisation. 2017. Available at: https://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics/probiotics-and-prebiotics-english.
41. Ouwehand A.C., Forssten S., Hibberd A.A., Lyra A., Stahl B. Probiotic approach to prevent antibiotic resistance. Ann Med. 2016;48(4):246-255. doi: 10.3109/07853890.2016.1161232.
42. Korpela K., Salonen A., Virta LJ., Kumpu M., Kekkonen R.A., de Vos W.M. Lactobacillus rhamnosus GG Intake Modifies Preschool Children’s Intestinal Microbiota, Alleviates Penicillin-Associated Changes, and Reduces Antibiotic Use. PLoS One. 2016;11(4):e0154012. doi: 10.1371/journal. pone.0154012.
43. Ivashkin V.T., Mayev I.V., Abdulganieva D.I., Alekseenko S.A., Ivashkina N.Yu., Korochanskaya N.V, et al, Practical Recommendations of Scientific Society for the Study of Human Microbiome and Russian Gastroenterological Association (RGA) for Probiotics in Treatment and Prevention of Gastroenterological Diseases in Adults. Rossiyskiy zhurnal gastroehnterologii, gepatologii, kolo-proktologii = Russian Journal of Gastroenterology, Hepatology Coloproctology. 2020;30(2):76-89. (In Russ.) doi: 10.22416/1382-4376-2020-30-2-76-89.
44. Yoo J.Y., Kim S.S. Probiotics and Prebiotics: Present Status and Future Perspectives on Metabolic Disorders. Nutrients. 2016;8(3):173.
doi: 10.3390/nu8030173.
45. Sun J., Buys N. Effects of probiotics consumption on lowering lipids and CVD risk factors: a systematic review and meta-analysis of randomized controlled trials. Ann Med. 2015;47(6):430-440. doi: 10.3109/07853890.20 15.1071872.
46. Kim CJ., Walmsley S.L., Raboud J.M., Kovacs C., Coburn B., Rousseau R. et al. Can Probiotics Reduce Inflammation and Enhance Gut Immune Health in People Living with HIV: Study Designs for the Probiotic Visbiome for Inflammation and Translocation (PROOV IT) Pilot Trials. HIV Clin Trials, 2016;17(4):147-157. doi: 10.1080/15284336.2016.1184827.
47. Cani P.D., Van Hul M. Novel opportunities for next-generation probiotics targeting metabolic syndrome. Curr Opin Biotechnol, 2015;32:21-27. doi: 10.1016/j.copbio.2014.10.006.
48. Patel R., DuPont H.L. New approaches for bacteriotherapy: prebiotics, new-generation probiotics, and synbiotics. Clin Infect Dis, 2015;60(2 Suppl.):108-121. doi: 10.1093/cid/civ177.
49. Martín R., Miquel S., Benevides L., Bridonneau C., Robert V., Hudault S. et al. Functional Characterization of Novel Faecalibacterium prausnitzii Strains Isolated from Healthy Volunteers: A Step Forward in the Use of F. prausnitzii as a Next-Generation Probiotic. Front Microbiol. 2017;8:1226. doi: 10.3389/fmicb.2017.01226.
50. Cani P.D., Everard A. Akkermansia muciniphila: a novel target controlling obesity, type 2 diabetes and inflammation? Med Sci (Paris), 2014;30(2):125-127. (In French) doi: 10.1051/medsci/20143002003.
51. Schneeberger M., Everard A., Gómez-Valadés A.G., Matamoros S., Ramírez S., Delzenne N.M. et al. Akkermansia muciniphila inversely correlates with the onset of inflammation, altered adipose tissue metabolism and metabolic disorders during obesity in mice. Sci Rep, 2015;5:16643. doi: 10.1038/srep16643.
52. Miller L.E., Ouwehand A.C., Ibarra A. Effects of probiotic-containing products on stool frequency and intestinal transit in constipated adults: systematic review and meta-analysis of randomized controlled trials.
Ann Gastroenterol, 2017;30(6):629-639. doi: 10.20524/aog.2017.0192.
53. Asha M.Z., Khalil S.F. H. Efficacy and Safety of Probiotics, Prebiotics and Synbiotics in the Treatment of Irritable Bowel Syndrome. Sultan Qaboos Univ Med J, 2020;20(1):e13-24. doi: 10.18295/squmj.2020.20.01.003.
54. Derwa Y., Gracie DJ., Hamlin PJ., Ford A.C. Systematic review with metaanalysis: the efficacy of probiotics in inflammatory bowel disease. Aliment Pharmacol Ther, 2017;46(4):389-400. doi: 10.1111/apt,14203.
55. Ganji-Arjenaki M., Rafieian-Kopaei M. Probiotics are a good choice in remission of inflammatory bowel diseases: A meta analysis and systematic review. J Cell Physiol. 2018;233(3):2091-2103. doi: 10.1002/jcp,25911.
56. Oka A., Sartor R.B. Microbial-Based and Microbial-Targeted Therapies for Inflammatory Bowel Diseases. Dig Dis Sci, 2020;65(3):757-788.
doi: 10.1007/s10620-020-06090-z.
57. Luthold R.V., Fernandes G.R., Franco-de-Moraes A.C., Folchetti L.G. D., Ferreira S.R. G. Gut microbiota interactions with the immunomodulatory role of vitamin D in normal individuals. Metabolism. 2017;69:76-86. doi: 10.1016/j.metabol.2017.01.007.
58. Yacoub R., Kaji D., Patel S.N., Simoes P.K., Busayavalasa D., Nadkarni G.N. et al. Association between probiotic and yogurt consumption and kidney disease: insights from NHANES. Nutr J. 2016;15:10. doi: 10.1186/s12937-016-0127-3.
59. Firouzi S., Haghighatdoost F. The effects of prebiotic, probiotic, and synbiotic supplementation on blood parameters of renal function: A systematic review and meta-analysis of clinical trials. Nutrition. 2018;51-52:104-113.
doi: 10.1016/j.nut.2018.01.007.
60. Hadi A., Mohammadi H., Miraghajani M., Ghaedi E. Efficacy of synbiotic supplementation in patients with nonalcoholic fatty liver disease: A systematic review and meta-analysis of clinical trials: Synbiotic supplementation and NAFLD. Crit Rev Food Sci Nutr. 2019;59(15):2494-2505. doi: 10. 1080/10408398.2018.1458021.
61. Kristensen N.B., Bryrup T., Allin K.H., Nielsen T., Hansen T.H.,
Pedersen O. Alterations in fecal microbiota composition by probiotic supplementation in healthy adults: a systematic review of randomized controlled trials. Genome Med. 2016;8(1):52. doi: 10.1186/s13073-016-0300-5.
62. Satokari R. Modulation of Gut Microbiota for Health by Current and Next-Generation Probiotics. Nutrients. 2019;11(8):1921. doi: 10.3390/nu11081921.
63. Sanders M.E. Probiotics and microbiota composition. BMC Med. 2016;14(1):82. doi: 10.1186/s12916-016-0629-z.
64. Falony G., Joossens M., Vieira-Silva S., Wang J., Darzi Y., Faust K. et al. Population-level analysis of gut microbiome variation. Science. 2016;352(6285):560-564. doi: 10.1126/science.aad3503.
65. Mullish B.H., Ouraishi M.N., Segal J.P., McCune V. L., Baxter M., Marsden G.L. et al. The use of faecal microbiota transplant as treatment for recurrent or refractory Clostridium difficile infection and other potential indications: joint British Society of Gastroenterology (BSG) and Healthcare Infection Society (HIS) guidelines. Gut. 2018;67(11):1920-1941.
doi: 10.1136/gutjnl-2018-316818.
66. Saha S., Mara K., Pardi D.S., Khanna S. Long-term Safety of Fecal Microbiota Transplantation for Recurrent Clostridioides difficile Infection. Gastroenterology. 2021;(April 08). (In press) doi: 10.1053/j.gas-tro.2021.01.010.
67. Grehan MJ., Borody TJ., Leis S.M., Campbell J., Mitchell H.,
Wettstein A. Durable alteration of the colonic microbiota by the administration of donor fecal flora. J Clin Gastroenterol. 2010;44(8):551-561. doi: 10.1097/MCG.0b013e3181e5d06b.
68. Blanchaert C., Strubbe B., Peeters H. Fecal microbiota transplantation
in ulcerative colitis. Acta Gastroenterol Belg. 2019;82(4):519-528. Available at: https://pubmed.ncbi.nlm.nih.gov/31950808/.
69. Sokol H., Landman C., Seksik P., Berard L., Montil M., Nion-Larmurier I. et al. Fecal microbiota transplantation to maintain remission in Crohn’s disease:
a pilot randomized controlled study. Microbiome. 2020;8(1):12. doi: 10.1186/s40168-020-0792-5.
70. Caldeira L.F., Borba H.H., Tonin F.S., Wiens A., Fernandez-Llimos F., Pontarolo R. Fecal microbiota transplantation in inflammatory bowel disease patients: A systematic review and meta-analysis. PLoS One. 2020;15(19):e0238910. doi: 10.1371/journal.pone.0238910.
71. El-Salhy M., Mazzawi T. Fecal microbiota transplantation for managing irritable bowel syndrome. Expert Rev Gastroenterol Hepatol. 2018;12(5):439-445. doi: 10.1080/17474124.2018.1447380.
72. Xu D., Chen V.L., Steiner C.A., Berinstein J.A., Eswaran S., Waljee A.K. et al. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis. Am
J Gastroenterol. 2019;114(7):1043-1050. doi: 10.14309/ ajg.0000000000000198.
73. Ianiro G., Eusebi L.H., Black C.J., Gasbarrini A., Cammarota G., Ford A.C. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 2019;50(3):240-248. doi: 10.1111/ apt.15330.
74. Myneedu K., Deoker A., Schmulson M.J., Bashashati M. Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J. 2019;7(8):1033-1041. doi: 10.1177/2050640619866990.
75. Kao D., Roach B., Park H., Hotte N., Madsen K., Bain V., Tandon P. Fecal microbiota transplantation in the management of hepatic encephalopa-thy. Hepatology. 2016;63(1):339-340. doi: 10.1002/hep.28121.
76. Bajaj J.S., Kassam Z., Fagan A., Gavis E.A., Liu E., Cox I.J. et al. Fecal Microbiota Transplant from a Rational Stool Donor Improves Hepatic Encephalopathy: A Randomized Clinical Trial. Hepatology. 2017;66(6):1727-1738. doi: 10.1002/hep.29306.
77. Bajaj J.S., Salzman N.H., Acharya C., Sterling R.K., White M.B., Gavis E.A. et al. Fecal Microbial Transplant Capsules are Safe in Hepatic Encephalopathy: A Phase 1, Randomized, Placebo-Controlled Trial. Hepatology. 2019;70(5):1690-1703. doi: 10.1002/hep.30690.
78. Vemuri R., Shankar E.M., Chieppa M., Eri R., Kavanagh K. Beyond Just Bacteria: Functional Biomes in the Gut Ecosystem Including Virome, Mycobiome, Archaeome and Helminths. Microorganisms. 2020;8(4):483. doi: 10.3390/microorganisms8040483.
79. DeFilipp Z., Bloom P.P., Soto M.T., Mansour M.K., Sater M.R.A., Huntley M. H et al. Drug-Resistant E. coli Bacteremia Transmitted by Fecal Microbiota Transplant. N Engl J Med. 2019;381(21):2043-2050. doi: 10.1056/ NEJMoa1910437.
80. Cammarota G., Ianiro G., Tilg H., RajiliC-Stojanovic M., Kump P., Satokari R. et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569-580. doi: 10.1136/ gutjnl-2016-313017.
Информация об авторах:
Стуров Николай Владимирович, к.м.н., доцент, заведующий кафедрой общей врачебной практики, заместитель директора по учебной работе Медицинского института, Российский университет дружбы народов; 117198, Россия, Москва, ул. Миклухо-Маклая, д. 6; sturov-nv@ rudn.ru
Попов Сергей Витальевич, д.м.н., профессор кафедры общей врачебной практики Медицинского института, Российский университет дружбы народов; 117198, Россия, Москва, ул. Миклухо-Маклая, д. 6; servit77@yandex.ru
Жуков Владимир Андреевич, аспирант кафедры общей врачебной практики Медицинского института, Российский университет дружбы народов; 117198, Россия, Москва, ул. Миклухо-Маклая, д. 6; vladimirzh94@gmail.com
Information about the authors:
Nikolay V. Sturov, Cand. Sci. (Med.), Associate Professor, Head of the Department of General Practice, Deputy Director of Medical Institute, Peoples’ Friendship University of Russia; 6, Miklukho-Maklai St., Moscow, 117198, Russia; sturov-nv@rudn.ru
Sergey V. Popov, Dr. Sci. (Med.), Professor of the Department of General Practice of Medical Institute, Peoples’ Friendship University of Russia; 6, Miklukho-Maklai St., Moscow, 117198, Russia; servit77@yandex.ru
Vladimir A. Zhukov, Graduate Student of the Department of General Practice of Medical Institute, Peoples’ Friendship University of Russia; 6, Miklukho-Maklai St., Moscow, 117198, Russia; vladimirzh94@gmail.com