Как грамотно восстановить микрофлору кишечника
Кишечник человека содержит миллионы бактерий. Но не все из них являются полезными. В кишечнике иногда обитают вредоносные микроорганизмы, вызывающие различные заболевания. Что вызывает рост вредных бактерий, и как же восстановить нормальную микрофлору, поговорим далее.
Содержание:
-
Важность восстановления микрофлоры
-
Как восстановить микрофлору
Важность восстановления микрофлоры
Нормальная кишечная микрофлора – это баланс полезных и вредных бактерий, населяющих кишечник человека. Если преобладают вредные, а полезные находятся в меньшинстве, такое состояние называется дисбалансом микрофлоры и требует коррекции. Этим занимаются врачи-гастроэнтерологи.
Они рекомендуют сдать анализ кала на дисбактериоз и бактериальный посев при заметных нарушениях в работе кишечника (вздутие, понос, тошнота, запор, боли и т.д.).
По результатам анализов назначается соответствующее лечение, после которого микрофлора нормализуются, самочувствие человека улучшается. Нормальная микрофлора кишечника важна для выработки необходимых витаминов, укрепления иммунитета и защиты от различных болезней.
Различные факторы могут ухудшать состояние микрофлоры кишечника, это:
-
прием антибиотиков и НПВС;
-
увлечение западной диетой (с наличием фастфудов);
-
недостаточность клетчатки в рационе;
-
прием обезболивающих средств;
-
лечение ингибиторами протонного насоса;
-
применение блокаторов Н2- гистаминовых рецепторов.
Некоторые врачи считают, что среда кишечника не должна быть стерильной. Но вредные бактерии должны составлять не более 15 процентов всей микрофлоры. Только тогда дисбаланс сохранится.
Микрофлора может меняться в зависимости от возраста, настроения, самочувствия человека, климата, сезона.
Нарушение микрофлоры может вызывать следующие заболевания:
-
онкология;
-
астма;
-
колит;
-
аутизм;
-
экзема;
-
диабет;
-
ожирение;
-
рассеянный склероз;
-
заболевания сердца.
Именно поэтому мы должны заботиться о состоянии микрофлоры кишечника. Рассмотрим некоторые полезные советы по этому поводу.
Как восстановить микрофлору
Полноценный рацион
Человек должен за день съедать разнообразную пищу, а не скудную, состоящую в преимуществе из углеводов и жиров. Так питается большинство людей, перекусывая, за неимением времени, фастфудами, булками и т.д.. Надо включать в рацион каждый день клетчатку.
Это:
-
свежие овощи;
-
фрукты;
-
зерновой хлеб;
-
бобовые;
-
зелень;
-
орехи.
Полезен для нормализации микрофлоры православный пост. Замечено, кто соблюдает посты, меньше страдает заболеваниями кишечника, даже раком. Пост исключает животные жиры (мясо, сливочное масло, яйца) и делает акцент на свежих овощах и фруктах, ягодах, крупах.
Известно, что инулин, обладающий пребиотическим действием, находится в следующих продуктах:
-
чеснок;
-
лук;
-
лук-порей;
-
спаржа;
-
цикорий;
-
артишок.
Эти продукты помогают наладить микрофлору кишечника и победить вредные бактерии. Их обязательно необходимо включать в свой рацион, если есть проблемы с кишечником.
Источниками бифидобактерий, полезных для человека, являются:
-
яблоки;
-
черника;
-
артишок;
-
миндаль;
-
фисташки.
Они обязательно должны присутствовать на столе как можно чаще.
Ферментирование продуктов
Полезно есть ферментированные, т.е. квашеные продукты. В результате процесса квашения простые продукты становятся фантастически полезными, потому что изменяют свой состав благодаря бактериям. Они помогают восстановить микрофлору кишечника.
Самые распространенные квашеные продукты:
-
квашеная капуста;
-
кефир;
-
йогурт;
-
чайный гриб.
У некоторых народов принято квасить овощи, даже острые. Такое блюдо из квашеных острых овощей называется «кимчхи». Квашеные соевые бобы называются «темпе».
Молочные квашеные продукты имеют в составе лактобактерии, так необходимые для нормальной микрофлоры. Людям, страдающим заболеванием почек, они просто необходимы, т.к. при таких болезнях нарушается микрофлора.
Искусственные подсластители — вред
Заместители сахара (аспартам, сахарин) являются вредными продуктами. Они действуют разрушительно на микрофлору кишечника. Кроме того, они повышают уровень глюкозы в крови. Поэтому их надо исключить из рациона.
Больше пребиотиков
Пребиотики содержат полезные бактерии, которые помогают выселять вредные, попадая в кишечник человека. Они находятся в овощах, фруктах, бобовых, зерновых. Их надо есть как можно чаще. Они также понижают уровень триглицеридов, холестерина, инсулина в организме. Значит пребиотики снижают риск сердечно-сосудистых заболеваний, смерти от инфаркта, инсульта.
Цельные зерна
Польза цельных зерен в том, что они содержат клетчатку и неперевариваемые углеводы, которые не усваиваются в тонком кишечнике, а поступают в толстый. Там они расщепляются и вызывают рост полезных бактерий.
Цельные зерна содержат:
-
витамины группы В;
-
железо;
-
цинк;
-
белки;
-
углеводы.
Они продаются в целом виде, а также из них изготовляется цельнозерновой хлеб. Также из них изготовляется цельная пшеничная мука.
Искусственные пробиотики
Насчет препаратов-пробиотиков ведутся споры. Есть сведения о некоторой пользе, которую оказывают такие препараты. Но она полностью не доказана. Тем более, что среди препаратов немало подделок. Надо осторожнее выбирать пробиотики, руководствуясь рекомендациями врача. Рекомендуем обратить внимание на Максилак.
Остальные советы
Есть еще несколько советов для нормализации микрофлоры:
-
Надо меньше перекусывать, чтобы дать возможность кишечнику восстановиться.
-
При возможности голодать, именно в таком состоянии кишечник сам нормализует микрофлору.
-
Работайте в огороде. Замечено, что у людей, живущих на свежем воздухе и ведущим активный образ жизни, микрофлора богаче.
-
Заведите собаку. Доказано, что те, у кого есть собаки дома, легче справляются с вредными бактериями.
-
Меньше употреблять антибиотики.
-
Больше двигаться и пить чистой воды.
У каждого человека организм индивидуален, поэтому каждый может знать свои способы нормализации микрофлоры.
Ребенок появляется на свет со стерильным кишечником, но уже к году состав микрофлоры совпадает со взрослым человеком. На протяжении жизни под влиянием питания, болезней и других факторов баланс микроорганизмов в пищеварительном тракте изменяется, но постепенно восстанавливается до нормальных концентраций. Иногда этот процесс затягивается. Тогда врач может рекомендовать пребиотики и пробиотики для кишечника.
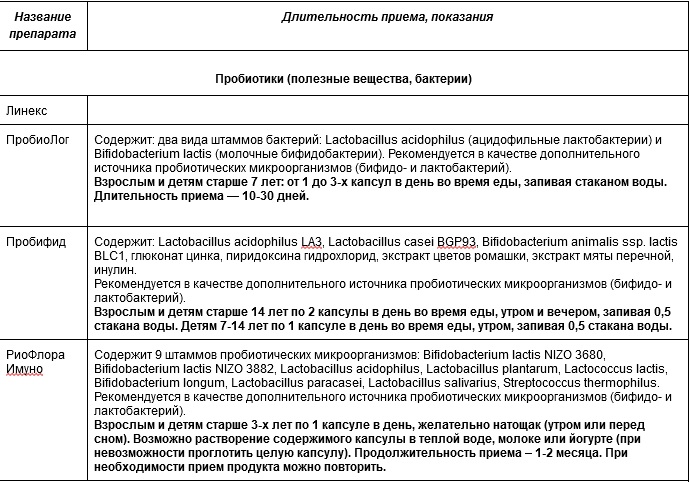
Виды пробиотиков
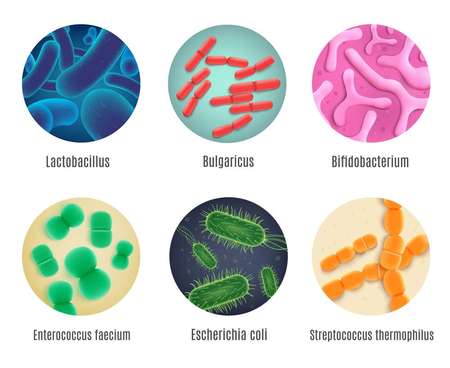
Для восстановления кишечника применяют два типа лечебных средств. Пробиотики – это препараты, которые содержат полезные бактерии в высушенном или растворенном виде. Чаще всего это микроорганизмы из рода Lactobacillus и Bifidobacterium, которые в норме доминируют в пищеварительном тракте человека.
Пребиотиками называются вещества, необходимые для роста хорошей микрофлоры. В некоторых случаях без них можно обойтись, но после тяжелых болезней, лечения антибиотиками или отравления они ускорят восстановление за счет создания благоприятной среды для бактерий.
В пищеварительном тракте здорового взрослого человека обитает несколько десятков видов бактерий, но преобладают два типа микробов: бифидобактерии и лактобактерии. Другие находятся в меньшинстве. Поэтому выделяют следующие виды пробиотиков в зависимости от состава:
- состоят только из лактобактерий – рекомендуют принимать при кишечных вирусных инфекциях;
- в составе только бифидобактерии – врачи назначают их при кандидозном поражении кишечника и как восстановление женщинам после вагинального кандидоза;
- комбинированные препараты – содержат бифидо- и лактобактерии, полезны при бактериальной инфекции кишечника.
Восстанавливать нормальную микрофлору можно разными формами препаратов. Пробиотики выпускают в сухой форме, из которой перед применением самостоятельно готовят суспензию. Существуют готовые жидкие формы лекарства, которые удобно давать маленькому ребенку. Некоторые средства производят в капсулах в желатиновой оболочке. Она не повреждается в желудке и растворяется только в кишечнике. Это защищает бактерии от действия соляной кислоты.
Создание препаратов для решения проблем с пищеварением проходило в несколько этапов. Поэтому фармацевты выделяют несколько поколений пробиотиков:
- 1 поколение – это монопрепараты, которые состоят из одного типа бактерий, обитающих в кишечнике, к ним относятся Бифидумбактерин, Лактобактерин.
- 2 поколение – содержат хорошие бактерии, которые являются антагонистами вредной флоры. Они выделяют вещества, которые уничтожают опасные микроорганизмы и подготавливают среду для заселения полезной микрофлорой. К препаратам этого типа относится Энтерол и Бактисубтил.
- 3 поколение – пробиотики, которые содержат от 2 до 30 штаммов одного живого микроорганизма или комбинацию из нескольких видов бактерий. К этой группе препаратов относятся Линекс, Бификол, Бифилонг.
- 4 поколение – содержат не только хорошие бактерии, но и вещества из группы пребиотиков. Они служат питательной средой, помогают расти, размножаться микрофлоре и ускоряют ее восстановление. К этой группе препаратов относят Бифилиз, Кипацид.
- 5 поколение – синбиотики, это несколько типов полезных бактерий и вещества, необходимые для колонизации кишечника. Они способны регулировать рост и метаболическую активность микробиоты. К этой группе относятся Флористин, Бифиформ и другие средства.
Какой препарат подойдет в конкретном случае, должен решать врач с учетом состояния пациента, его возраста. Для взрослых требуется большая дозировка и кратность приема пробиотиков.
ТОП-10 лучших пробиотиков
В аптеках продается большое количество пробиотиков, из которых тяжело выбрать нужный препарат. Правильное решение – обратиться к врачу-гастроэнтерологу или терапевту, чтобы назначили лекарственное средство с хорошим эффектом.
Чтобы решить, какой из них лучше, можно ориентироваться на список ТОП-10:
- Линекс – один из самых популярных препаратов, который помогает восстановить микрофлору кишечника. В его составе живые лиофилизированные бифидо- и лактобактерии, а также энтерококки. Линекс выпускается в капсулах и порошке, его можно применять у грудных детей, смешивая содержимое оболочки с молоком.
- Хилак Форте – капли для лечения дисбактериоза, в состав входят лактобациллы, их эффект дополняет непатогенная кишечная палочка и стрептококки. Может использоваться при синдроме раздраженного кишечника, гастроэнтерите, колите, болезнях желчного пузыря и печени, вызванных патологией пищеварительного тракта.
- Флорин Форте – восстанавливает микрофлору за счет присутствия бифидо- и лактобактерий. В состав входит лактоза, необходимая для процесса брожения, смещения рН в кишечнике в кислую сторону. Выпускается в виде саше с порошком, который необходимо растворять перед использованием.
- Нормобакт L – помогает восстанавливать кишечную флору при помощи молочнокислых бактерий и пребиотиков, необходимых для их размножения. В состав входят фруктоолигосахариды, которые являются питательной средой, увеличивают выживаемость микробиоты и увеличивают эффективность лечения.
- Аципол – средство для лечения дисбактериоза у взрослых и детей. Он помогает после длительного лечения антибиотиками терапевтических заболеваний, используется для лечения острых кишечных инфекций, хронического колита, у склонных к аллергии и атопическому дерматиту.
- Бифиформ – пробиотик, в состав которого входят энтеробактерии и бифидобактерии. В кишечнике они образуют естественный симбиоз и поддерживают существование друг друга. Энтерококк заселяет петли тонкой кишки, а используемый тип бифидобактерий обладает высокой скоростью роста, поэтому быстро восстанавливает микробиоту толстого кишечника.
- Нормофлорин Л – жидкий пробиотик, состоящий их лактобактерий. Он положительно влияет на организм благодаря добавлению в раствор пребиотика лактита, который улучшает рост бактерий. Перед использованием необходимую дозу препарата смешивают с любой жидкостью.
- Флорок – пробиотик, который состоит из лактобацилл, бифидобактерий и лактозы, необходимой для нормальной колонизации пищеварительного тракта. Может использоваться как для восстановления микрофлоры, так и для предотвращения диареи во время путешествий.
- Бак-сет Форте – это капсулы, в состав которых входит 14 видов живых полезных бактерий. Препарат рекомендован для детей старше 3 лет и взрослых для лечения нарушений стула и профилактики дисбактериоза.
- Риофлора – комплексный пробиотик, включает несколько штаммов бифидобатерий и лактобацилл, а также непатогенные стрептококки. Но в капсулах могут быть следы лактозы, молока и сои, поэтому производитель не рекомендует их использовать при повышенной чувствительности к этим веществам.
Советы по выбору
Какой из перечисленных пробиотиков поможет справиться с проблемами пищеварения, зависит от заболевания. Если организму необходима помощь после курса лечения антибиотиками, лучше использовать комплексные препараты, где добавлен пребиотик. Он ускорит заселение бактериями слизистой кишечника.
Вне зависимости от названия, для взрослых походят препараты в виде порошка, капсул или раствора. Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
При использовании средств с пробиотическими эффектами, симптомы вздутия живота, урчания, метеоризм могут усилиться из-за процесса брожения. Но это проходит самостоятельно и не требует отмены терапии. Если на фоне приема пробиотиков появилась аллергическая сыпь, лечение прекращают.
Относительно недавно в медицинских кругах сложилось утверждение, что человеческим организмом, эмоциями, настроением, здоровьем и поступками правят…бактерии! Место обитания которых — кишечник. Публика мгновенно разделилась на 2 лагеря. Одни утверждают, что бактерии действительно обладают способностью управлять нами, и обосновывают мнение фактами, другие признают это полным антинаучным бредом и, как ни парадоксально, тоже приводят аргументы. Попробуем разобраться и понять, что такое микрофлора, зачем она нужна, как бактерии управляют нами, за что их называют вторым мозгом, и как помочь бактериям сделать управление эффективным.
Что такое микрофлора кишечника
Флора кишечника — это то, что человек получает с момента рождения и развивает на протяжении первых 7-10 лет. Со временем набор микроорганизмов становится разнообразнее и состоит из лактобактерий, бифидобактерий, грибков и кишечных палочек. Все они живут в дружном соседстве не только между собой, но и с патогенной микрофлорой, не позволяя ей размножаться и причинять организму вред.
Считается, что патогенная микрофлора составляет не более 15% от общей массы бактерий. А всего ученые умы насчитывают около 100 триллионов простейших микроорганизмов в нашем кишечнике, вес которых составляет в среднем 1,5 килограмма.
В норме, питанием и образом жизни человек способен длительно поддерживать удачный симбиоз своих поселенцев. Понимание этого процесса поможет значительно повысить качество жизни и здоровья.
За что отвечает микрофлора кишечника
Пищеварение
Одна из важнейших функций кишечных бактерий — участие в процессе переваривания пищи. Это такой гигантский завод по очистке зёрен от плевел. Когда вся поступающая пища, белки, жиры и углеводы расщепляются под воздействием ферментов, работу которых активизирует кишечник. Кишечник — финальная, но самая трудоемкая и времезатратная часть процесса пищеварения. Именно там с помощью микробиома запускается процесс сортировки полезных веществ от ненужного мусора. От того насколько здоров кишечник и весь пищеварительный тракт, зависит и качество сортировки пищи, и количество полезных веществ, которые всасываются и усваиваются именно в кишечнике.
Защита
Один в поле не воин — фраза, которая удачно характеризует работу кишечника. Чем меньше в нём “хороших” бактерий, тем больше места достается “плохим”. Полезные бактерии в процессе жизнедеятельности подавляют рост возбудителей инфекционных заболеваний, поддерживая тем самым защитные функции всего организма.
Иммунитет
Когда защита организма сильна, болезнь не пройдет. И большую роль в этом играет иммунитет, родина которого — кишечник. Как это происходит? Кишечные бактерии стимулируют синтез иммуноглобулинов – особых белков, повышающих защитные силы организма в отношении опасных инфекций. Иммуноглобулины населяют стенки кишечника, при достаточном количестве которых патогенные микроорганизмы не проникают. Также полезные бактерии содействуют созреванию системы фагоцитирующих клеток (неспецифический иммунитет), способных к поглощению и уничтожению патогенных микробов.
Синтез витаминов
Дружественные бактерии, живущие в кишечнике жизненно необходимы человеку для синтеза, хранения и поставки витаминов в организм:
- Витамин В-12
- Фолиевая кислота / Витамин В-9
- Витамин К
- Рибофлавин / Витамин В-2
- Биотин / Витамин В-7
- Никотиновая кислота / Витамин В-3
- Пантотеновая кислота / Витамин В-5
- Пиридоксин / Витамин В-6
- Тиамин / Витамин В-1
Среди них такие, которые нигде больше в организме не вырабатываются. Эта миссия возложена на бактерии. Витамины группы В жизненно необходимы человеку. Они содержат в порядке нервную систему, участвуют в обменных процессах, помогают противостоять стрессам и депрессии. Если нарушена микрофлора, синтез витаминов не происходит должным образом и неприятных последствий не избежать. Кроме того, никакие курсы витаминов не помогут. Вы не ощутите положительный эффект просто потому, что они не будут всасываться в кишечнике.
Как кишечная микрофлора помогает похудеть
Ещё один центр внимания ученых и исследователей — это зависимость веса человека от разнообразия микрофлоры. Так, недавние исследования американских ученых подтвердило этот факт. В ходе эксперимента наборы кишечных бактерий от людей-близнецов поместили в кишечник стерильных мышей. В одном наборе люди-близнецы были худые, в другом страдали ожирением. Микробы, взятые у худых близнецов вызывали похудение у мышей, а бактерии от полных близнецов вызывали у мышей ожирение. Но через время, когда мышей сажали в одну клетку, мыши с ожирением начинали стремительно терять вес.
Ученые сделали предположение, что микрофлора способна управлять пищевыми привычками, требуя от человека тех или иных продуктов, которые будут способствовать росту либо патогенных, либо “худых” бактерий. Лучшим рационом для некоторых бактерий являются жиры и они требуют их постоянно снова и снова, другим жизненно необходим сахар. Именно на зависимости пищевых потребностей и разнообразием бактерий в кишечнике, ученые выдвинули теорию, что кишечные поселенцы, стремятся брать верх над человеком и манипулировать химическим составом среды обитания ради собственных целей и выгоды. Это, в свою очередь, может означать манипуляции нашим поведением (нервничаем, если не едим сладкое, )путем воздействия с помощью нервных импульсов на центры голода, желание съесть тот или иной продукт, к тем или иным продуктам питания, или чувству отвращения от некоторых продуктов.
Почему нарушается баланс микрофлоры
Этот баланс очень хрупок и легко подвержен внешнему влиянию. И происходит это по нескольким причинам:
- прием антибиотиков
- нарушение режима питания
- злоупотребление сахаром и алкоголем
- отравления
- приём некоторых гормональных препаратов
- заболевания пищеварительной системы
- стресс
- приём некоторых лекарств — нестероидных противовоспалительных средств.
Признаки нарушения микрофлоры
- Нарушение стула — запоры, диарея, нерегулярный стул, вздутие, колики, боль
- Нарушения работы ЖКТ — появление тяжести, изжога, отрыжка, увеличение массы тела.
- Обезвоживание — появление ломкости и сухости волос и ногтей, кожных покровов,
- Интоксикация организма — тошнота, болезненный цвет лица, прыщи и угревая сыпь.
- Наличие неприятного запаха при дыхании, неприятный запах фекалий
- Изменения нервной системы — быстрая утомляемость, сонливость, отсутствие настроения, снижение работоспособности.
- Головокружения и головные боли
Как восстановить микрофлору кишечника
Процесс восстановления микрофлоры не быстрый. Важно не только скорректировать режим питания, но и активно помогать организму “наращивать” микробиом — правильно подобрать нужный препарат, содержащий пре- и пробиотики.
Линекс
Пробиолог
Пробифид


Бонус: могут ли микробы управлять человеческим поведением
Эта гипотеза сейчас становится очень популярной и, действительно, имеет на то ряд прямых и косвенных оснований. Кишечник называют вторым мозгом человека и бактерии, живущие в нем, действительно способны управлять человеком на уровне нервной системы.
В настоящий момент человечеству известно про наш организм многое, но не всё. Исследования в области микрофлоры кишечника и её влиянии на здоровье и качество организма находятся на зачаточной стадии, но привлекает всё больше внимания учёного мира. Так в ходе изучения микробиома человека подтвердилось существование сильной взаимосвязи между состоянием бактерий и работой иммунной, нервной и эндокринной систем. Некоторые ученые полагают, что бактерии могут выделять определенные сигнальные молекулы, влияющие на активность десятичного черепного нерва, проходящего от кишечника к головному мозгу, либо в данном процессе может быть задействован блуждающий нерв.
Сколько времени займет полное познание человека сказать невозможно, но можно быть уверенным, что мы подошли к чрезвычайно важным открытиям, которые, в будущем, решат множество проблем со здоровьем, помогут найти ключ к неизлечимым заболеваниям и тотально изменят привычную жизнь.
Будьте здоровы!
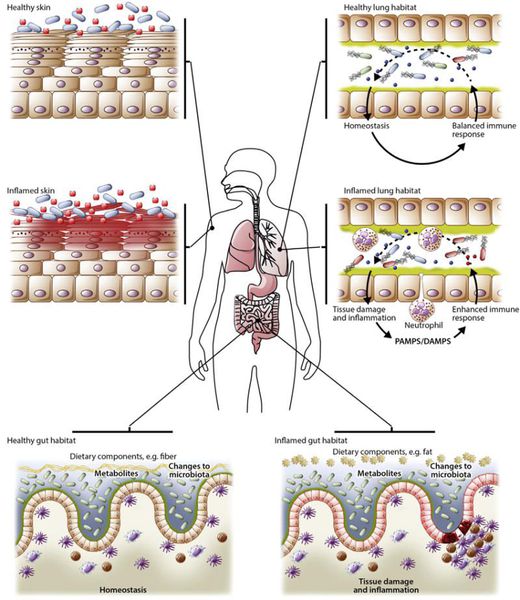
Только представьте – примерно 2 кг вашего веса составляют бактерии, обитающие на коже, слизистых оболочках и в кишечнике. Но не стоит сразу волноваться: эти микробы – наши друзья. Миллионы лет они живут с нами, принося ощутимую пользу здоровью. Все сообщество микробов тела ученые называют микробиомом, а конкретно кишечных представителей – нормальной микрофлорой кишечника.
Микробы важны для формирования, развития и укрепления нашего иммунитета, переваривания пищи, синтеза отдельных витаминов (витамин К и часть из группы В), защиты организма от некоторых инфекций, вызванных патогенной флорой. Они вытесняют захватчиков с насиженной территории, активно защищая свое жилище — просвет вашего кишечника.
Но бывают ситуации, когда собственная микрофлора страдает. Это состояние именуют термином «дисбактериоз». Если говорить просто – это нарушение соотношения полезных микробов и условно-патогенных, а также изменение количества наших дружественных бацилл, их массовая гибель в силу различных влияний. Это некачественная пища, которая не по вкусу микробам, влияние экологии, принимаемых лекарств (особенно – антибиотиков и кишечных антисептиков), частые кишечные инфекции, отравления, стрессы.
Чтобы поддержать наших полезных микробов, нужны пробиотики. Но что это и как выбрать самые полезные?
Рейтинг топ-5 по версии КП
Пробиотики – этот термин вы могли слышать в аптеке, с экрана телевизора или читали о них в статьях. Пробиотиками называют препараты или продукты, в которых содержится полезная для кишечника микрофлора.
В составе аптечных пробиотиков содержится полезная микрофлора разных штаммов – бифидобактерии, полезные штаммы кишечной палочки, лактобациллы. Помощь кишечнику также оказывают некоторые дрожжеподобные грибки, сахаромицеты, аэро- или энтерококки.
Препараты могут иметь жидкую форму (преимущественно, с живыми формами микробов) или порошковую (микробы высушены, но при попадании в кишечник – активируются и растут).
Основная функция пробиотиков – это заселение просвета кишки новыми полезными микроорганизмами вместо тех, которые по каким-то причинам погибли. Кроме того, они активно борются с патогенной микрофлорой, которая:
- провоцирует кишечные инфекции (температура, понос, рвота);
- дает крайне неприятные симптомы так называемого «несварения» (вздутие живота, запоры, сменяющиеся диареей, спазмы кишечника, метеоризм, отрыжки и т.д.).
И еще одно немаловажное свойство пробиотиков – они помогают повышать иммунитет, бороться с различными недомоганиями, улучшают работу нервной системы и повышают настроение.
Симбиолакт Плюс
Современный немецкий пробиотик, помогающий восстанавливать микрофлору кишечника и поддерживать здоровье и красоту кожи.
В состав Симбиолакт Плюс входят важнейшие пробиотические бактерии и биотин.
Состав (четыре штамма бактерий Lactobacillus acidophilus, Lactobacillus paracasei, Lactococcus lactis, Bifidobacterium animalis в необходимом количестве) + биотин, сбалансирован таким образом, чтобы действовать сразу на тонкий и толстый кишечник. Эти бактерии в необходимом количестве поддерживают микрофлору кишечника, особенно после курсов антибактериальной терапии, оказывают поддержку печени и иммунной системе, а также коже. А биотин усиливает действие бактерий и дополнительно улучшает состояние кожи.
Упаковка пробиотика рассчитана на месячный курс приема – 30 саше, которого достаточно для восстановления микрофлоры. Содержимое каждого саше не имеет вкуса и запаха, и его можно разводить в воде или соке, добавлять в йогурт или творог.
Симбиолакт Плюс
Пробиотик со сбалансированным составом
Симбиолакт Плюс совмещает в своем составе основные пробиотические бактерии и биотин. Первые поддерживают микрофлору кишечника, помогают печени и иммунной системе, а биотин усиливает их действие и улучшает состояние кожи.
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Лактобактерин
Основу средства составляют специально высушенные (лиофилизированные) лактобациллы (Lactobacillus) в форме порошка, разводимого водой до суспензии. Лактобактерии при попадании в кишечник активизируются и активно заселяют просвет кишки. Основное их действие – синтез молочной кислоты, которая создает неблагоприятные условия для роста патогенной флоры. Кроме того, лакто-микробы и сами вытесняют неприятеля, подавляя их рост и размножение.
Препарат предназначен для:
- нормализации работы пищеварительной системы, в том числе у беременных и кормящих;
- улучшения работы иммунитета;
- нормализации обменных процессов, в том числе у людей с хроническими заболеваниями (гастриты, колиты, диабет, метаболический синдром, ожирение);
- лечения гинекологических патологий, включая дисбактериоз влагалища и молочницу;
- повышения общей неспецифической резистентности (сопротивляемости) организма.
Флорин Форте
Этот препарат содержит в своем составе как бифидобактерии (Bifidobacterium), так и лактобациллы (Lactobacillus). Выпускается в форме порошка или капсул. За счет комбинированного действия сразу двух видов самых многочисленных кишечных микробов применяется как для профилактики различных проблем со здоровьем, так и в лечебных целях, для коррекции дисбактериоза после приема антибиотиков, кишечных антисептиков и других лекарств. Бактерии в его составе стимулируют синтез интерферона, защитных иммуноглобулинов, помогают в восстановлении слизистой оболочки кишки при воспалительных процессах.
Препарат применяется при:
- лечении кишечных и острых респираторных инфекций, в том числе у беременных и кормящих;
- восстановлении микробной флоры кишки после лечения антибиотиками, НПВС (нестероидными противовоспалительными средствами), кишечными антисептиками;
- нормализации пищеварения при гастритах, энтеритах и колитах, патологиях печени;
- стимуляции иммунитета у пациентов с хроническими заболеваниями или часто и длительно болеющих;
- нормализации обмена веществ у людей с высоким холестерином;
- общем укреплении организма у людей, подверженных хроническому стрессу.
Энтерол
Этот препарат содержит в своем составе несколько иные, чем предыдущие препараты, культуры – лиофилизированные (высушенные) Saccharomyces boulardii. Эти бактерии проходят через кишечник транзитом, подавляя активность патогенных представителей флоры. Препарат стимулирует ферментативную активность кишки, помогает формировать устойчивость к токсинам, но на фоне его приема нужно пить много жидкости.
Энтерол применяется при:
- инфекционной диарее любого происхождения (в том числе в сочетании с антибиотиками);
- лечении дисбактериоза, вызванного клостридиями, кандидами, клебсиеллой, стафилококком.
Бифиформ
Комбинированный препарат, содержащий два вида микробов – бифидобактерии (Bifidobacterium) и энтерококки (Enterococcus faecium). Комбинация двух полезных для нашего кишечника микробов позволяет усиливать действие каждого из компонентов. Выпускается в форме капсул либо масляного раствора. Средство помогает нормализовать количество полезной флоры до нормативных показателей. Дополнительно стимулирует синтез защитного иммуноглобулина слизистых (IgA) с выработкой интерферонов.
Показан при:
- патологиях тонкого кишечника и толстой кишки с признаками несварения (вздутие, спазмы, метеоризм, поносы);
- восстановлении после кишечных инфекций, пищевых отравлений;
- стимуляции иммунитета, улучшения пищеварения и общей сопротивляемости.
Как выбрать пробиотики для кишечника
Правильно выбирать пробиотики для кишечника совместно с врачом. Выбор препарата зависит от возраста пациента, целей приема – лечение или профилактика проблем с кишечником, а также конкретных проблем, возникших в пищеварительной системе.
Если это микробные диареи, пищевые токсикоинфекции (отравления пищей) или активация условно-патогенной флоры, идеально подойдут комплексы с лакто- или же бифидофлорой. Если предполагается вирусное поражение – самыми оптимальными будут преимущественно лактобациллы.
Если необходимо лечение инфекционной диареи, нужен комплексный препарат с сахаромицетами и полезными собственными микробами. Хорошо, если в составе препарата будет содержаться еще и среда для приживления микробов (так называемые пребиотики). Если же нет, тогда необходимо дополнительно соблюдать диету, содержащую большое количество пребиотических волокон, чтобы бациллы хорошо прижились.
Важно обратить внимание на форму препарата – удобно ли вам будет ее принимать, а также сроки хранения и годности, условия для хранения. Многие из препаратов с живыми бактериями требуют строго соблюдать условия хранения в холодильнике, при заданной температуре, иначе они просто погибнут.
Кроме того, важно обращать внимание на показатель КОЕ – это колониеобразующие единицы. Он должен быть не менее чем 5 миллиардов, в противном случае препарат не будет высокоэффективным.
Популярные вопросы и ответы
Мы задали вопросы относительно приема пробиотиков врачу-гастроэнтерологу Вере Самсоновой.
Чем отличаются пробиотики от пребиотиков?
Пробиотики – это живые микроорганизмы, которые составляют нормальную флору вашего кишечника. Препараты могут содержать один или сразу несколько штаммов микробов, которые в кишечнике начинают размножаться.
Пребиотики – это органические вещества, которые поддерживают рост и размножение полезных микробов. Проще говоря, это еда для вашей микрофлоры, на которой микробы поправляются и набираются сил.
Нужно ли пить пробиотики?
Здоровому человеку не нужно.
Пробиотики показаны для людей с патологиями пищеварительного тракта, проблем с иммунитетом, проблем с эндокринной системой, анемии, патологии сердца, сосудов, неврологические расстройств.
Также пробиотики назначают людям, получавшим курс мощных антибиотиков, прошедшим лечение от опухолей и часто длительно болеющих.
Могут ли навредить пробиотики?
Любой препарат может навредить, если принимать его нерационально и без контроля врача. В некоторых случаях возможны неблагоприятные реакции (аллергия, непереносимость компонентов) на отдельные вещества. Также на фоне приема у некоторых людей в начале курса может быть усиление дискомфорта (вздутия, метеоризма), которое постепенно проходит.
Подбирать препараты всегда нужно с врачом.
Фото: market.yandex.ru
Нормальная микрофлора человека имеет чрезвычайно важное общебиологическое значение. Сформировано представление, согласно которому кишечный микробиоценоз представляет собой высокоорганизованную систему, реагирующую качественными и количественными сдвигами на динамическое состояние организма человека в различных условиях жизнедеятельности, здоровья и болезни. Примечательно, что приоритет в формировании классических представлений о роли микробиоценозов, характере взаимоотношений между ними и макроорганизмом принадлежит отечественным исследователям (Мечников И. И., 1908; Уголев А. М., 1972, 1985).
В последнее время широкое внедрение анаэробных техник и молекулярно-генетических исследований привело к лавинообразному нарастанию информации и существенному расширению наших представлений о бактериях, вирусах, прионах и их главенствующей роли в обеспечении гомеостаза человека. Сегодня убедительно доказано, что микрофлора пищеварительного тракта выполняет ряд жизненно важных функций (Уголев А. М., 1985; Шендеров Б. А., 1998; Осипов Г. А., 2003; Минушкин О. Н., 2007; Ардатская М. Д., 2001).
Следует признать, что традиционные микробиологические техники, в том числе и анаэробные, не только не смогли обеспечить адекватное изучение качественных и количественных характеристик микробиоценозов организма человека, но и не позволили анализировать особенности популяционных взаимодействий микроорганизмов, микробных «сигнальных систем» и т. д., т. е. не решали задачи, стоящие перед новым направлением в науке о человеке — микроэкологии человека. Новые технологии, прежде всего молекулярно-генетические, создали предпосылки к появлению принципиально новых направлений в изучении как самих микробных популяций, так и особенностей межмикробных взаимоотношений и взаимовлияния микро- и макроорганизмов. Результатом явилось появление метагеномики, метапротеомики, метаболома человека (Handelsman J.; Rondon M. R., 1998; Chen K., Pachter L., 2005; Oliver S. G., Winson M. K., 1998).
Одним из «некультуральных» способов оценки микрофлоры является метод масс-спектрометрии микробных маркеров (Осипов Г. А., 1995). Так, например, при синдроме раздраженного кишечника дисбиотические изменения в кишечнике носят преимущественно «дефицитный» характер [Осипов, 2003]. В то же время отмечается увеличение численности анаэробов — Bacteroides fragilis, Porphyromonas, Propinobacterium acnes, а также Campylobacter mucosalis, энтерококков, псевдомонад, Acinetobacter, бацилл и стрептококков. Применение традиционных «аэробных» микробиологических методов исследования позволило бы выявить лишь наличие дефицита нормофлоры. Доступные в ограниченном числе лабораторий анаэробные техники, теоретически, могли бы способствовать повышению достоверности исследования, но не все анаэробные бактерии могут быть культивированы в лабораторных условиях. Полученные с помощь метода масс-спектрометрии данные позволяют планировать проведение рациональной этиотропной терапии, в частности у больных себореей (Осипов Г. А., Федосова Н. Ф., Лядов К. В., 2007) или при участии в инфекционном процессе таких микроорганизмов, как стрептомицеты, нокардии и родококки (McNeil M. M. et al., 1990).
В пищеварительном тракте человека присутствует до 100 триллионов бактерий, это почти в 10 раз больше эукариотических клеток человека. Почти 99% симбиотической микрофлоры пищеварительного тракта — облигатно-анаэробные бактерии, принадлежащие к более 7000 видам. При этом более 50% основных представителей микрофлоры здорового человека не могут быть культивируемы современными техниками, а среди новых видов, выявляемых при секвенировании генов 16S рДНК, до 80% относятся к некультивируемым (Gill S. R. et al., 2006). Большинство из предполагаемых новых видов микроорганизмов являются представителями таксонов Firmicutes (Bacillales, Lactobacillales, Clostridia, Mollicutes) и Bacteroides (Eckburg P. B., Bik E. M., Bernstein C. N. et al., 2005; Ed. J.-C. Rambaud et al., 2006). Примечательно, что виды Ruminococcus obeum, Eubacterium halii, Fusobacterium prausnitzii, Bifidobacterium adolescentis обнаружены только у Homo sapiens. В пищеварительном тракте человека также присутствуют более 1200 видов вирусов.
Общий геном «кишечных» микроорганизмов включает около 400000–600000 генов, тогда как геном человека содержит порядка 25000 различных генов. По приблизительным оценкам общее количество микробных генов в 100 раз больше, чем генов человека (Versalovic J., 2005). При этом 40–45% всего генома человека — это всевозможные мобильные и повторяющиеся элементы, обладающие способностью перемещаться по геному, т. е. бывшие вирусы или размножившиеся вирусоподобные объекты.
Известно, что микробиота реализует свои функции в составе микробно-тканевого комплекса, образованного микроколониями бактерий и продуцируемыми ими экзополисахаридами; слизью; эпителиальными клетками слизистой оболочки и их гликокаликсом, а также клетками стромы слизистой оболочки. Структурная связь бактерий пристеночных колоний и кишечного эпителия реализуется посредством специфических рецепторов на клетках слизистой оболочки, к каждому из которых адгезируются определенные виды бактерий. Последние содержат на своей поверхности лектины, ответственные за специфическую адгезию к эпителию. Своеобразие рецепторов генетически детерминировано у каждого индивидуума.
В пределах микробно-тканевого комплекса между микроорганизмами и эпителиальной выстилкой кишечника происходит постоянный обмен генетическим материалом, регуляторными молекулами, фрагментами структурных генов, плазмидами, что обеспечивает не только формирование индивидуального варианта нормальной кишечной микрофлоры, но и взаимодействие организма человека с кишечным микробиоценозом в целом. Результатом этого взаимодействия является обеспечение равновесных метаболических взаимоотношений не только в пределах микробиоценоза, но и в системе «организм человека — нормальная микрофлора».
В микробных сообществах, относящихся к нормальной микрофлоре человека, эволюционно сформировались межклеточные кооперации, представляющие систему трофических и энергетических взаимосвязей внутри кишечного микробиоценоза. Практически ни один биосубстрат, находящийся в распоряжении того или иного микробного эпитопа, не используется только в интересах одной популяции микроорганизмов (Верховцева Н. В., Осипов Г. А., 2004; Steven R. Gill et al., 2006). Таких сложных цепочек существует огромное множество.
Таким образом, человека следует рассматривать как «сверхорганизм», чей обмен веществ обеспечивается четко организованной работой ферментов, кодируемых не столько геномом собственно Homo sapiens, сколько геномами всех симбиотических микроорганизмов (Steven R. Gill et al., 2006).
Клиницисту для понимания сути патогенетической терапии важно четко представлять, что в роли ведущего регуляторного механизма со стороны макроорганизма выступает модуляция характера секреторных и моторно-эвакуаторных взаимоотношений в составе желудочно-кишечного тракта (ЖКТ). Результирующим фактором в этих условиях является плазморея, то есть поступление компонентов плазмы крови непосредственно в пристеночную зону слизистой оболочки. Таким образом, кишечная микрофлора постоянно и оперативно реагирует на изменяющееся состояние внутренней среды макроорганизма модуляцией своей метаболической активности, а также количественными соотношениями в составе микробиоценоза.
Сложный характер межклеточных, межпопуляционных взаимоотношений в микробиоценозах организма человека, не менее сложные регуляторные воздействия со стороны макроорганизма предопределяют многофакторность наших терапевтических воздействий.
Приходится констатировать, что сегодня мы продолжаем использовать преимущественно антагонистическую («наступательную») стратегию влияния на микробиоценозы. Нам остро не хватает понимания механизмов «кооперативных» взаимодействий микроорганизмов в микробно-тканевом комплексе и новых возможностей тонкой (метаболитной и т. п.) регуляции микробных сообществ.
Основными доступными в настоящее время в клинической практике «точками приложения» лечебного воздействия на микробиоту человека является минимизация (нейтрализация) наиболее часто встречающихся факторов, приводящих к изменениям состояния кишечного микробиоценоза, а впоследствии — к возникновению заболеваний человека:
-
стрессы, особенно хрониостресс;
-
погрешности в питании (нерегулярное и/или несбалансированное по составу нутриентов питание);
-
заболевания внутренних органов, прежде всего органов ЖКТ;
-
острые инфекционные заболевания ЖКТ;
-
снижение иммунного статуса различного генеза;
-
ксенобиотики различного происхождения;
-
ятрогенные воздействия, в том числе:
– антибактериальная терапия;
– гормонотерапия;
– применение цитостатиков;
– лучевая терапия;
-
оперативные вмешательства;
-
нарушение биоритмов;
-
повышенный радиационный фон и др.
Как известно, в процессе адаптации человека к неблагоприятным факторам окружающей среды закономерно происходят и изменения в системе «организм человека — нормальная микрофлора».
В частности, при стрессе, в условиях гипоксии слизистой оболочки, происходит переключение метаболизма эпителиоцитов с цикла Кребса на анаэробный гликолиз с активизацией гексозомонофосфатного шунта. При этом экзогенные (бактериальные) летучие жирные кислоты перестают использоваться колоноцитами в качестве основного источника энергии с последующей дистрофизацией эпителия — важнейшей составляющей микробно-тканевого комплекса. Последующее изменение продукции и состава слизи как основной среды обитания нормальной пристеночной микрофлоры разрушает привычный регуляторный стереотип. Такая дезинтеграция микробно-тканевого комплекса приводит к изменению метаболических взаимоотношений как внутри микробиоценотического сообщества, так и в системе «организм человека — нормальная микрофлора» в целом.
Все это приводит к пониманию важнейшего положения, согласно которому изменения кишечной микрофлоры встречаются не только у абсолютного большинства больных с патологией органов ЖКТ, но и при других заболеваниях внутренних органов и кожи (атеросклероз, артериальная гипертензия, злокачественные новообразования, артриты, мочекаменная болезнь, бронхиальная астма, аллергические заболевания, заболевания соединительной ткани, анемии, коагулопатии, подагра, дерматиты, дерматозы и многие другие), что необходимо учитывать при выборе тактики терапии.
Очевидным является также и то, что дисбиотические изменения кишечника становятся самостоятельным фактором агрессии и обуславливают ухудшение клинического течения заболеваний. В этих условиях прогредиентно нарастает выраженность клинических симптомов, удлиняются сроки их существования, ухудшаются показатели результатов лечения и качество жизни пациентов, клиническое течение приобретает часто рецидивирующий характер.
Таким образом, исходя из особенностей формирования и функционирования микробно-тканевого комплекса, патогенеза дисбиотических состояний основными направлениями (принципами) их коррекции являются:
-
минимизация хрониостресса;
-
адекватное питание;
-
восстановление естественных процессов полостного и пристеночного пищеварения:
– коррекция моторно-эвакуаторных нарушений ЖКТ;
– коррекция секреторных расстройств (желудочной, панкреатической и тонкокишечной секреции, желчеотделения);
-
собственно воздействие на кишечный микробиоценоз:
– пребиотики;
– пробиотики;
– симбиотики;
– синбиотики;
– антимикробные средства.
Антимикробные средства, а также лечебные бактериофаги рассматриваются всегда в аспекте «эрадикационной терапии» и находят достаточно широкое применение в повседневной практике. В рамках же данной статьи авторы хотели привлечь внимание к двум наиболее распространенным и важным группам лекарственных препаратов — про- и пребиотикам.
Согласно Б. А. Шендерову и М. А.Манвеловой (1997), пробиотики — это живые микроорганизмы и вещества микробного и иного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические функции, биохимические и поведенческие реакции организма через оптимизацию его микроэкологического статуса. Сегодня к ним принято относить препараты, содержащие живые культуры микроорганизмов.
По результатам исследований, проведенных в соответствии с принципами доказательной медицины, хорошо документированными направлениями эффективного применения пробиотиков являются: антибиотико-ассоциированная (ААД) диарея, C. difficile-ассоциированная (CD) диарея, острые кишечные инфекции и диарея путешественников, воспалительные заболевания кишечника, синдром раздраженного кишечника (СРК), вагиноз, инфекции мочевыводящей системы, аллергия, атопический дерматит, экзема, непереносимость лактозы, гиперлипидемия и некоторые другие. Пробиотики могут рассматриваться как альтернативные средства антибиотикам для профилактики диареи путешественников, ААД и CD-диарей, нозокомиальных диарей, а также лечения вирусных диарей у детей и СРК (McFarland L., 2007; McFarland L. V., 2006; D’Souza A. L., 2002).
Пробиотики могут содержать как монокультуру, так и комбинацию из нескольких видов микроорганизмов (симбиотики), а комбинацию пробиотика и пребиотика обозначают термином синбиотик. В России наиболее известными бактериопрепаратами являются Линекс (L. cidophilus, B. infantis v. liberorum и E. faecium), Бифиформ (B. longum и E. faecium) и Ламинолакт (E. faecium L-3).
Высокий уровень безопасности бактериопрепаратов на основе энтерококков обеспечивается как детальным изучением свойств конкретных штаммов, так и проведением дальнейшего контроля соответствия штаммов, входящих в препарат эталонным образцам. В Европе в составе пробиотиков используется около полутора десятков разных штаммов энтерококков — E. faecium, E. faecalis, E. durans, E. gallinarum и др. В состав зарегистрированного в РФ пробиотика «Линекс» также включен штамм энтерококка. Анализ 16SRNA из этого штамма, выполненный профессором А. Н. Суворовым (2008) показал, что штамм характеризуется ДНК-последовательностью, практически идентичной штаммам Enterococcus lactis, депонированных в базу данных GenBank, и родственной штамму энтерококков, выделенных из рубца коровы. Штамм энтерококка, включенный в состав Линекса, обладает выраженным антагонизмом к патогенным и условно-патогенным бактериям, в то же время полученные ранее данные о безопасности штамма в опытах на лабораторных животных, результаты двойных слепых плацебо-контролируемых клинических исследований препарата-пробиотика, дополненные молекулярно-биологическими исследованиями, позволяют отнести данный штамм к безопасным (Суворов А. Н., Захаренко С. М., Алехина Г. Г., 2003; Bellomo G., Mangiagle A., Nicastro L. et al., 1980; Wunderlich P. F., Braun L., Apuzzo V. D. et al., 1989).
Свидетельством безопасности всех штаммов, включенных в препарат, является разрешение на его применение с периода новорожденности, а также во время беременности и в период грудного вскармливания. Адекватная дозировка Линекса для разных возрастных групп и при разных клинических ситуациях обеспечивается оптимальным количеством жизнеспособных микроорганизмов в одной капсуле препарата. Технологическая цепочка от получения биомассы бактерий до изготовления самого препарата, заключенного в защитную капсулу, позволяет сохранять не менее 1,2×107 жизнеспособных бактериальных клеток на всем протяжении срока годности Линекса.
Препараты на основе энтерококков оказались высокоэффективными в профилактике антибиотико-ассоциированной диареи (Wunderlich P. F., Braun L., Fumagalli I. et al., 1989), лечении инфекционной диареи у детей и взрослых (Buydens P., Debeuckelaere S., 1996). Природная устойчивость энтерококков и, в меньшей степени, лактобактерий, включенных в состав Линекса, к некоторым антимикробным препаратам позволяет с высокой эффективностью применять его в составе комплексных схем терапии одновременно с антибиотиками. При неинвазивных диарейных инфекциях у детей эффективность патогенетической терапии с включением Линекса достоверно выше по сравнению со стандартными схемами. А проведенные гистологические, гистохимические и морфометрические исследования показали, что использование Линекса в комплексной терапии при острых кишечных инфекциях оказывало более благоприятное воздействие на репаративные процессы в слизистой оболочке толстой кишки по сравнению с лактобактерином и бифидумбактерином (Грачева Н. М. и соавт., 2007).
При назначении в качестве пищевой добавки в эксперименте на собаках E. faecium SF 68 существенно повышал активность клеточного и гуморального звеньев иммунитета (Benyacoub J., Czarnecki-Maulden G. L., 2003, а в эксперименте на мышах выявлена активация образования антител к лямблиям (Benyacoub J., Perez P. F., Rochat F. et al., 2005). В исследованиях, проведенных в Германии, выявлена гипохолестеринемическая активность ферментированного молока, содержащего E. faecium SF 68 (GAIO; MD Foods, Aarhus, Denmark) (Agerbaek M., Gerdes L. U., 1995). Целесообразным оказалось применение Линекса для лечения язвенного колита, болезни Крона и болезни Уиппла (Mach T., 2006; Парфенов А. И., 2007).
Одним из преимуществ пробиотиков является возможность применения жизнеспособных бактерий на любом этапе терапии как инфекционных, так и неинфекционных болезней человека. Пробиотики способны обеспечить как «протезирование» (восполнение) утраченных функций при выраженном дефиците естественной нормофлоры, так и добавление/усиление «по требованию» тех функций и свойств, которые требуются на конкретном этапе лечения или реабилитации после перенесенного заболевания, — антагонистическая активность в отношении патогенных и условно-патогенных микроорганизмов, витаминопродукция, ферментативная активность, иммуномодуляция и др. Пробиотики успешно применяются в сочетании с пребиотиками.
Пребиотики — неперевариваемые в кишечнике ингредиенты различного происхождения, способные оказывать благоприятный эффект на организм хозяина через селективную стимуляцию роста и/или активности представителей нормальной микрофлоры кишечника.
Одним из первых комбинированных средств с максимальным пребиотическим эффектом является Эубикор.
Эубикор представляет собой комплекс, который содержит натуральные пищевые волокна, в том числе водорастворимые, инактивированные клетки специально селектированного штамма лечебных дрожжей — Saccharomyces cerevisiae (vini) и продукты их метаболизма.
Пищевые волокна (ПВ) представляют сумму полисахаридов и лигнина. Полисахариды пищевых волокон включают: водорастворимые компоненты — пектин, камеди, слизи, гемицеллюлозу, инулин, гуар; водонерастворимые — целлюлозу. Лигнин не является углеводом, и его следует рассматривать как отдельное водонерастворимое волокно. ПВ не перевариваются эндогенными секретами ЖКТ человека и легко достигают толстой кишки, где они метаболизируются анаэробной микрофлорой до короткоцепочечных жирных кислот (КЦЖК). КЦЖК (ацетат, пропионат, бутират) являются главными энергетическими источниками для эпителия слизистой оболочки толстой кишки, стимулирующими пролиферацию клеток, образование слизи и трофику слизистой оболочки. Кроме того, пищевые волокна создают обширную дополнительную поверхность, на которой фиксируются облигатные микроорганизмы, что приводит к резкому увеличению их количества на единицу объема кишки и возрастанию метаболической активности кишечного содержимого. С другой стороны, хорошо известен элиминационный эффект пищевых волокон в отношении патогенных микроорганизмов и их токсинов.
Вторым важнейшим компонентом Эубикора являются инактивированные дрожжи S. cerevisiae (vini). Оболочка их клеток имеет полисахаридное строение. В ее состав входят, главным образом, три олигосахарида — маннан, глюкан и гликогеноподобный компонент. Маннан и глюкан обладают способностью связывать патогенные и условно-патогенные микроорганизмы, их токсины, а также являются неспецифическими стимуляторами иммунитета. Цитоплазма дрожжевых клеток богата биологически активными веществами: аминокислотами, ферментами, убихинонами, микро- и макроэлементами, витаминами А, Д3, Е, С, группы В. Указанные компоненты оказывают положительное влияние как на нормальную микрофлору, так и на организм человека в целом. В частности, дрожжевые бета-глюканы проявляют себя в качестве стимуляторов иммунного ответа (Seljelid R., Bogwald J., 1981) При производстве препарата важно, что используется технология, обеспечивающая инактивацию дрожжей с одновременной высокой степенью сохранности биологически активных веществ.
К настоящему времени, по данным мультицентровых исследований, высокая клиническая эффективность Эубикора подтверждена для пациентов различных возрастных категорий с СРК (Ляляева Т. В., 2003), хроническим панкреатитом (Антонов П. Ф., 2003), язвенной болезнью (Захарченко М. М., 2003), гастроэзофагеальной рефлюксной болезнью (Гончар Н. В., 2004), заболеваниями билиарной системы, хроническим, в т. ч. вирусным, гепатитом (Тимофеева Е. А., 2006), внебольничной пневмонией (Крюков А. Е., 2006), различными формами туберкулеза (Галицкий Л. А., Данцев В. В., 2004, 2008), циррозом печени, сахарным диабетом 2-го типа (Сас Е. И., 2007), дефицитом массы тела, адаптационным синдромом (Добренко В. А., 2004; Нилова Е. А., 2008).
Эубикор эффективно предотвращает развитие дисбактериоза у всех больных, получающих антибактериальную терапию. Преимуществом препарата является возможность его приема в процессе лечения антибиотиками.
Следует подчеркнуть, что ни одно из приведенных выше направлений воздействия на микробиоценозы ЖКТ не имеет абсолютного приоритета перед другими. Выбор терапевтической тактики на основе рекламы в средствах массовой информации или личного мнения того или иного специалиста не может рассматриваться как оптимальный. Опора на данные, полученные методами доказательной медицины,— вот основа эффективной стратегии и тактики современной терапии. Обсуждению именно этих важнейших положений авторы планируют посвятить серию последующих публикаций.
В. Б. Гриневич, доктор медицинских наук, профессор
С. М. Захаренко, кандидат медицинских наук
Г. А. Осипов*, доктор биологических наук
ВМА им. С. М. Кирова, Санкт-Петербург
* НЦССХ им. А. Н. Бакулева, Москва
Дата публикации 1 августа 2019Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
От редакции: диагноз «дисбактериоз» не включён в международную классификацию болезней (МКБ-10), его используют врачи только в России и странах СНГ. Дисбактериоз сопутствует другим патологиям, но было бы неверно однозначно утверждать, что эти патологии вызывает именно нарушение баланса микрофлоры. Изучение взаимосвязи между деятельностью микробиома и возникновением различных заболеваний — одно из перспективных направлений в медицинских исследованиях.
Что такое микрофлора кишечника и для чего она нужна
Организм человека населяют свыше триллиона бактерий. В их микробиоме в сто раз больше генов, чем в нашем собственном геноме. Они живут на коже, слизистых, в пищеварительном тракте.
Кишечное сообщество, которое мы приютили в своём организме, обладает метаболической активностью, как у целого органа. Оно помогает нам выжить, поэтому мы в корне зависим от наших колонизаторов, как и они от нас.
В норме кишечник обеспечивает среду для роста микроорганизмов, а флора поддерживает «равновесие» в организме хозяина:
- стимулирует рост энтероцитов — клеток кишечной стенки;
- помогает перерабатывать и усваивать питательные вещества;
- подавляет рост патогенных микроорганизмов;
- регулирует иммунитет и воздействует на его нарушенные звенья;
- контролирует энергетический и липидный обмен;
- участвует в развитии и функционировании мозга.
Микрофлора или микробиота — это экосистема, в которой преобладают бактерии, в основном строгие анаэробы, которым для жизни не нужен кислород. В ней есть и другие микроорганизмы: вирусы и бактериофаги, простейшие, археи (одноклеточные живые организмы) и грибы. Всего в микробиоте свыше семи тысяч штаммов.
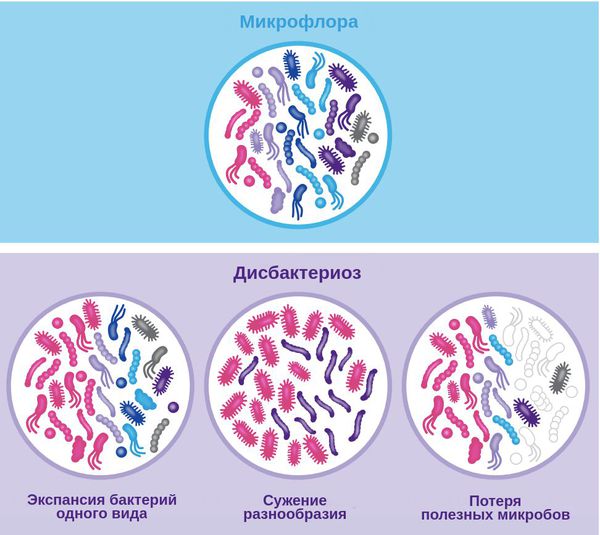
Дисбактериоз, или дисбиоз — это синдром, при котором нарушается соотношение между представителями микрофлоры. Он не является болезнью, но лежит в основе множества заболеваний — кишечных, общевоспалительных, аутоиммунных и нейропсихических.
Нарушение состава микрофлоры также может влиять на поведение человека и скорость старения: при сужении микробного разнообразия оно происходит быстрее в сравнении с темпами здорового старения[1].
Соотношение различных видов микроорганизмов нарушается по многим причинам:
- Диета и режим питания — пища с высоким содержанием животных жиров, сахара и крахмала, ограничением клетчатки и избытком животных белков.
- Продукты с пищевыми добавками — бисульфитом и сульфитом натрия, наночастицами металлов и антибиотиками[3][4].
- Избыточная гигиена — нарушение водно-жировой мантии кожи из-за использования бактерицидных средств для умывания (особенно с салицилатами).
- Гормональный дисбаланс. При избытке андрогена у женщин состав микробиоты нарушается, а при низком альфа- и бета-разнообразии сообществ бактерий в кишечнике повышается риск развития синдрома поликистозных яичников[5].
- Употребление алкоголя — уменьшается количество лактобактерий и появляются микроорганизмы, которые могут повредить слизистую. Например, Neisseria из этанола синтезирует такое ядовитое вещество, как ацетальдегид[26].
- Первичный и вторичный иммунодефицит. Из-за нарушения звеньев иммунитета растёт число микроорганизмов и формируется новая микрофлора, которая меняет иммунный ответ, образуя порочный круг.
- Травма и острое воспаление. В ответ на нарушение целостности тканей организма иммунитет экстренно активируется и нарушает соотношение бактерий[6].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы дисбактериоза
Когда защитная функция слизистой оболочки кишечника нарушается, иммунная система перестаёт адекватно реагировать на кишечную микрофлору. В связи с этим возникают разнообразные симптомы:
- При нарушении дисбактериозе кишечника могут беспокоить запоры, диарея или их сочетание, вздутие, урчание в животе, отрыжка, чувство тяжести после еды, повышенная чувствительность к определённой пище (особенно злаковой и молочной), боли и дискомфорт.
- При нарушении кожной микрофлоры появляются разнообразные сыпи, шелушение, покраснение, зуд, сухость или жирность кожи.
- При генитальном дисбактериозе типичным признаком является кандидоз (молочница). Иногда могут возникать нетипичные выделения и дискомфорт вплоть до болезненности.
- При дисбактериозе полости рта развиваются стоматит, пародонтоз и кариес, появляется неприятный привкус и запах изо рта, постоянный налёт на языке.
Когда под влиянием дисбиоза начинают развиваться различные болезни, появляются другие симптомы:
- При нейропсихических заболеваниях появляется усталость, апатия, тревога, снижается настроение, ухудшается концентрации внимания, возникают навязчивые мысли, усиленная реакция на стресс, судороги.
- При инсулинорезистентности происходит набор веса, повышение сахаров и липидов в крови, возникает тяжесть в правом боку.
- При системном воспалении и аутоиммунитете до полноценного развития болезни и постановки диагноза появляются отдельные проявления в виде болей в суставах, кожных высыпаний, неадекватных сосудистых реакций, примесей слизи или крови в кале, неинфекционного подъёма температуры тела, озноба, общей слабости.
- При аллергии появляется диарея после употребления аллергенных продуктов (особенно молочных, злаковых, цитрусовых, красных фруктов и овощей, ягод, шоколада, орехов) и зудящий дерматит.
Патогенез дисбактериоза
Колонизация кишечника бактериями начинается при прохождении младенца через родовой канал. В этот момент он получает микробиоту своей матери — лактобациллы, Prevotella и другие. При кесаревом сечении микробный состав изменяется. Он напоминает кожу матери: появляются стафилоккоки, коринебактерии и пропионобактерии.
Во время грудного вскармливания увеличивается количество бифидобактерий. Они необходимы для использования олигосахаридов материнского молока. При недостаточном питании формирование этих бактерий нарушается, что приводит к стойкой незрелости микробиоты и риску развития дисбактериоза.
В зависимости от типа дисбиоза и особенностей организма могут включаться различные патологические пути.
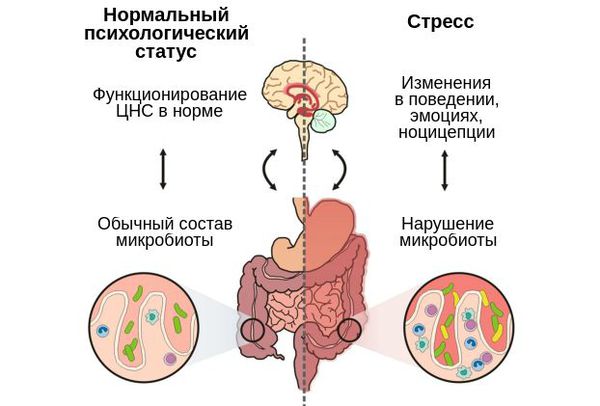
Путь «Дисбактериоз — кишечник — мозг»
Микробиота кишечника влияет не только на физическое, но и на психологическое состояние человека. Её связь с мозгом осуществляется через блуждающий нерв (вагус) и ключевые центральные медиаторы:
- бифидобактерии infantis влияют на центральную передачу серотонина[11];
- лактобациллы и бифидобактерии продуцируют гамма-аминомаслянную кислоту (ГАМК);
- кишечные палочки, Bacillus и Saccharomyces spp. могут производить норадреналин;
- кандида, стрептококки, кишечные палочки и энтерококки синтезируют серотонин;
- Bacillus может продуцировать дофамин;
- лактобациллы способны производить ацетилхолин.
Ось гипоталамус-гипофиз-надпочечник регулирует реакции на стресс и может значительно влиять на ось микробиом-кишечник-мозг[12].
Путь «Микробиота — воспаление — инсулинорезистентность»
Полезные бактерии вырабатывают короткоцепочечные жирные кислоты, которые усиливают связи между клетками кишечника, препятствуя попаданию токсичных соединений в кровоток[8]. Когда численность нормальной флоры снижается, изменяется состав кишечной слизи — муцина. В связи с этим защитный барьер слабеет, развивается так называемый “синдром дырявого кишечника” — токсины из пищеварительной системы попадают в кровоток, запуская системное воспаление[14].
Организм разделяет флору на “свой-чужой” при помощи толл-рецепторов. Когда к рецептору присоединяется патоген, происходит передача информации об опасности внутрь клетки, где через каскад реакций запускается иммунный ответ, направленный на борьбу с возбудителем. Высвобождаются секреторный IgA, антимикробные пептиды и хемокины[15]. Это ведёт к активации макрофагов, которые начинают выделять интерлейкин-1b и фактор некроза опухоли альфа. Эти вещества блокируют путь инсулина внутрь клетки. В результате развивается инсулинорезистентность[7][17]. Без своего проводника глюкоза накапливается в крови,что приводит к диабету II типа.
Путь «Дисбактериоз — ожирение — печень»
О количестве съеденного организм узнаёт по уровню всё тех же короткоцепочечных жирных кислот, вырабатываемых флорой. При низком потреблении клетчатки — овощей и отрубей — этих жирных кислот вырабатывается мало. В ответ на это кишечник замедляет эвакуацию, чтобы запасти побольше энергии. В итоге запускается адипогенез — отложение жира.
Ещё одним веществом, которое обеспечивает передачу сигналов о чувстве сытости из кишечника в гипоталамус, является гуанилилциклаза C. При дисбиозе эта передача ослабляется, что ведёт к перееданию и набору веса[18].
При синдроме избыточного бактериального роста запускается процесс местного воспаления, повышается проницаемость кишечной стенки. Это ведёт к попаданию токсинов в кровь и общей воспалительной реакции, в результате которой поражается различный органы, в том числе и печень. При развитии инсулинорезистентности запускается глюкокиназный путь поступления глюкозы в клетки печени, из-за чего в органе накапливаются жировые включения. В дальнейшем развивается неалкогольная жировая болезнь печени[19].
Путь «Дисбактериоз — аутоиммунитет»
Изменённая композиция микробиоты воздействует на кишечную иммунную систему. Иммунитет, активированный дисбактериозом кишечника, запускает каскад воспалительных реакций, что приводит к поражению суставов, кожи, почек, кишечника и т. д. Если реакция защитных сил чрезмерна, развиваются аутоиммунные заболевания.
Хронический воспалительный ответ, который вызывает дисбиоз, также может поспособствовать развитию ревматических заболеваний.
Путь «Дисбактериоз — аллергия»
Полезные бактерии поддерживают баланс иммунного ответа в организме.
Они стимулируют подавление IgE и лимфоцитов Th1 и Th2, которые сдерживают паразитарную инфекцию. Если популяция полезных микроорганизмов не развивается, это может привести к аллергическим ответам.
Полезная микрофлора формируется во младенчестве и сохраняется на всю жизнь вместе с особенностями иммунных ответов[9]. Помешать появлению адекватного альфа-разнообразия микробиомов в этот период, помимо рождения через кесарево сечение, могут такие факторы, как:
- раннее воздействие антибиотиков;
- отсутствие домашних животных;
- постоянная обработка дома обеззараживающими средствами.
В итоге, если слишком тщательно оберегать ребёнка от столкновения с инфекциями, у него резко повышается риск развития аллергических заболеваний.
Классификация и стадии развития дисбактериоза
Из-за разнообразия агентов микрофлоры и проявлений дисбиоза, классификация нарушения микрофлоры весьма условна.
Традиционно выделяют три степени дисбиоза:
- I степень — снижение нормофлоры;
- II степень — развитие условно-патогенной флоры;
- III степень — присоединение патогенной флоры.
Кроме изменений микрофлоры важно знать, в микробиоме какого органа произошло нарушение. В связи с этим различают кишечный и внекишечный дисбактериоз. К внекишечным формам относятся:
- дисбиоз ротовой полости;
- дисбиоз кожи;
- дисбиоз половых органов;
- дисбиоз мочевыводящих путей;
- дисбиоз дыхательной системы.
По течению дисбактериоз кишечника условно подразделяют на три стадии:
- латентный дисбиоз — без проявлений, выявляется только по результатам анализов;
- дисбиоз с кишечной симптоматикой — возникает нарушение стула, боли в животе;
- стадия развития осложнений — инсулинорезистентности, нейровегетативных нарушений, хронического колита, дерматита и вагинита.
В зависимости от того, в каком отделе кишечника возникло нарушение, выделяют:
- дисбактериоз тонкого кишечника — диарея водянистая, вздутие живота появляется сразу после еды;
- дисбактериоз толстого кишечника — кал кашицеобразный, вздутие возникает к вечеру.
Осложнения дисбактериоза
Симптомы дисбактериоза кишечника с трудом можно отличить от симптомов его осложнений. Всё потому, что дисбиоз — синдром, который вносит существенный вклад в развитие многих болезней.
Осложнения можно разделить на несколько групп:
- нейропсихические болезни: депрессия, болезнь Альцгеймера, рассеянный склероз, тревожное расстройство, шизофрения, аутистические расстройства, болезнь Паркинсона;
- болезни, связанные с невосприимчивостью к инсулину: инсулинорезистентность, дислипидемия, ожирение, сахарный диабета II типа, гипертония, неалкогольная жировая болезнь печени[7];
- аутоиммунные патологии: сахарный диабет I типа, ревматоидный артрит, системная красная волчанка, первичный склерозирующий холагнит[8];
- аллергические заболевания — бронхиальная астма, атопический дерматит, пищевая аллергия[9];
- системные воспаления — болезнь крона, язвенный колит, синдром раздражённого кишечника, целиакия и колоректальный рак.
Нейропсихические болезни
Депрессия и тревожное расстройство коррелируют с преобладанием Firmicutes над Bacteroides[12].
Рассеянный склероз связан с значительным сокращением видов Clostridia XIVa и IV, увеличением содержания Methanobrevibacter и Akkermansia и уменьшением числа Butyricimonas[8].
На мышиной модели болезни Альцгеймера в амилоидных бляшках накапливается микробиота[13].
Связь шизофрении, аутистических расстройств и болезни Паркинсона с дисбиозом доказана. Но о том, являются ли эта связь основной или сопутствующей, до сих пор ведутся споры.
Аутоиммунные патологии
Сахарный диабет I типа связан с положительной корреляцией между аутоантителами и микрофлорой — островковыми клеткам, Bacteriodes и Bilophila. Также обнаружена отрицательная связь со Streptococcus и Ruminococcaceae. Кроме того, распространение Faecalibacterium приводит к снижению уровня гликированного гемоглобина[8].
Ревматоидный артрит усиливается из-за молекулярной мимикрии — бактерии Prevotella copri, Parabacteroides sp. и Butyricimonas воспроизводят структуру двух аутоантигенов организма. В результате антигенов в воспалённой синовиальной ткани становится намного больше. И чем больше антител GNS, тем выраженнее симптомы артрита(8). Снизить боль, отёчность и улучшить показатели крови во время различных фаз артрита можно с помощью пробиотиков[22].
Системная красная волчанка сопровождается снижением видового разнообразия микрофлоры. При это в пять раз увеличивается число бактерии Ruminococcus gnavus. Количество антител к этим бактериям напрямую связано с активностью заболевания[20].
Первичный склерозирующий холагнит связан с уменьшением разнообразия микрофлоры. После трансплантации фекальной микробиоты альфа-разнообразие увеличивается. Из-за этого щелочная фосфатаза снижается более чем в два раза, что свидетельствует о влиянии микробиоты на аутоиммунные процессы в протоках печени[21].
Аллергические заболевания
Бронхиальная астма связана с увеличением респираторной микрофлоры — гемофильной палочки, стрептококков, бактерий Moraxella — и снижением кишечного микробиома — бифидобактерий, бактерий Akkermansia, Faecalibacterium, Morganella, Lactobacillus. Ослабить аллергическую реакцию может вдыхание «сельскохозяйственной пыли», которая насыщена бактериями и их компонентами.
Атопический дерматит возникает при колонизации кожи золотистым стафилококком на фоне повышенной чувствительности иммунной системы и нарушения кожного барьера. Суперантигены стафилококков усиливают концентрацию IgE — антител, призванных защищать организм от паразитов. Если антитела отсутствуют, антигены атакуют собственные ткани и вызывают аллергию — активируют воспалительные лимфоциты Th2 / Th22 и способствуют появлению дендритных клеток[23].
Обратный эффект достигается при эпидермальном стафилококке. Он подавляет выработку CD4 — белых кровяных телец, участвующих в иммунном ответе. Мембранный белок TLR-2, связываясь с нормальной флорой кожи, стимулирует выработку антимикробных пептидов и увеличение плотных контактов, что усиливает кожный барьер.
Аллергия на еду появляется при чрезмерном разнообразии микрофлоры. Избыточное микробное обогащение кишечника у 3-месячных детей увеличивает риск развития гиперчувствительности к пище к годовалому возрасту. При обогащении кишечника микробами в 12 месяцев этого уже не происходит.
Когда количество бактерий Ruminococcaceae и Lachnospiraceae повышается, у детей развивается аллергия на молоко. Если же флора обогащена бактериями Firmicutes, включая Clostridia, то аллергия может разрешиться к школьному возрасту.
Аллергии на арахис или древесные орехи возникает при уменьшенном микробном разнообразии и увеличении числа бактерий Bacteroidetes. Выраженность симптомов аллергии и диарея могут ослабнуть при наличии или пероральном введении 17 штаммов Clostridia.
Системные воспаления
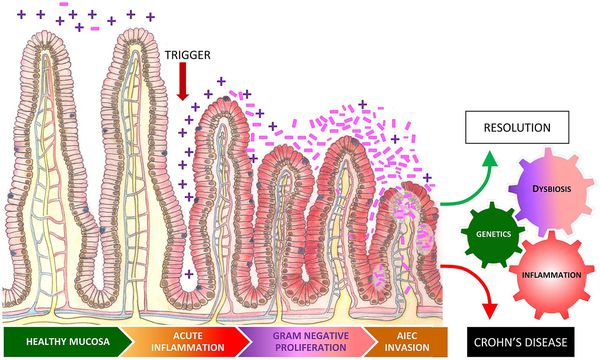
Болезнь Крона и язвенный колит возникают из-за чрезмерно агрессивного иммунного ответа на полезную кишечную флору у генетически восприимчивых людей. Разложение флорой белков, пептидов и аминокислот в дистальной части толстой кишки приводит к образованию различных биологически активных метаболитов, которые могут влиять на жизнеспособность клеток эпителия. Снижение количества видов бактерий, которые вырабатывают бутират, ведёт к чрезмерной активация толл-рецепторов, которая может нарушить иммунитет за счёт изменения в активности работы генов.
Синдром раздражённого кишечника связан с уменьшением количества лактобацилл, бифидобактерий и повышением числа аэробов по сравнению с анаэробами. Это нарушение микрофлоры модифицирует болевые и моторные реакции[12].
Микробиота в данном случае становится и причиной, и мишенью нарушений моторики кишечника, висцеральной гиперчувствительности и нейроиммунных сигналов. Происходит это из-за нарушения слизистого барьера, активации рецепторов, к которым крепятся бактерии, а также дисфункции оси гипоталамус-гипофиз-надпочечник (ось ГГН).
Как возникает дисфункция оси ГГН? Цитокины и избыток короткоцепочечных жирных кислот повышают уровень кортизола — гормона стресса. Он поступает в гипофиз, гипоталамус, миндалину, гиппокамп и префронтальную кору. Обратный сигнал из мозга приводит к изменению моторики и чувствительности кишечника, нарушается эпителиальный барьер и выработка нейротрансмиттеров в виде повышенной реакции на факторы окружающей среды.
Почему нарушается моторика кишечника? Микробиота модулирует моторную функцию кишечника. Её состав может измениться через толл- и нод-рецепторы. В результате повышается проницаемость кишечной стенки, и метаболиты бактерий получают доступ к подслизистой оболочке. Это изменяет экспрессию генов, которые участвуют в работе гладких мышц и нейротрансмиссии. Нормальная кишечная палочка усиливает сокращение толстой кишки, а патогенные штаммы E. coli нарушают сократимость мышечных клеток и угнетают моторику. Воздействие Lactobacillus rhamnosus значительно ухудшает ацетилхолин-стимулируемое сокращение.
Целиакия — уникальное аутоиммунное заболевание. Его причиной являются генетические факторы DQ2 / DQ8 и триггер среды — глютен, но их недостаточно для развития болезни. Пусковой механизм целиакии — нарушение микробиоты у предрасположенных детей в момент введения прикорма — высокие пропорции Firmicutes, Proteobacteria, Corynebacterium, Gemella, Clostridium, Enterobacteriaceae и Raoultella и более низкие Actinobacteria, Bifidobacterium[32].
Так как непереносимость глютена во взрослой жизни после многих лет употребления злаков встречается всё чаще, дополнительным фактором формирования целиакии становится воздействие окружающей среды.
Колоректальный рак — рак прямой кишки — также связан с нарушением микрофлоры. Запущенный дисбактериоз запускает хроническое воспаление. Из-за этого накапливаются продуцируемые хозяином антибактериальные пептиды, секреторные IgA, муцины, цитокины или нейромедиаторы. Также в организме скапливаются остатки повреждённых клеток и много активных форм кислорода и азота. При ошибках копирования во время деления кишечных клеток (дисплазии) эти вещества способствуют злокачественному перерождению.
Развитие рака происходит по модели «водитель — пассажир»:
- «водители» — определённые штаммы бактерий — нарушают микросреду слизистой оболочки, повреждая ДНК;
- «пассажиры» — патологическая флора — после повреждения оболочки колонизируют её, что приводит к хроническому воспалению, прямому повреждению тканей и зарождению опухоли[15].
Другие осложнения дисбактериоза
Повышается риск заражения венерическими заболеваниями, в том числе ВИЧ-инфекцией. У девушек этому способствует дефицит бактерий Lactobacillus, которые продуцируют молочную кислоту и пероксид водорода для защиты от патогенных микроорганизмов[29]. У мужчин риск приобретения ВИЧ-инфекции повышается при высокой концентрации анаэробных бактерий в микробиоте под крайней плотью.
Угроза преждевременных родов. У женщин до 24 недели беременности маркером такого риска могут служить более низкие вагинальные уровни Lactobacillus crispatus и более высокие уровни BVAB1, Sneathia amnii, TM7-H1, Prevotella и девять дополнительных таксонов[7].
Риск развития сердечно-сосудистых заболеваний. ДНК бактерий пародонта была обнаружена в атеросклеротических бляшках у пациентов, страдающих ишемической болезнью сердца и атеросклерозом. Бактерии могут инициировать или усугублять атеросклеротические процессы. При этом активируется врождённый иммунитет, напрямую вовлекаются медиаторы, которые активируются антигенами зубного налёта[15].
Риск развития рака пищевода — аденокарциномы и плоскоклеточного рака. Этот риск связан с составом микробиома полости рта. Пародонтальные патогены Tannerella forsythia и Porphyromonas gingivalis коррелируют с повышенным риском аденокарциномы. Более низкий риск этой болезни наблюдался в связи с истощением полезного рода Neisseria и Streptococcus pneumoniae. Также есть взаимосвязь бактериального биосинтеза каротиноидов с защитой от развития аденокарциномы[27].
Диагностика дисбактериоза
Диагностика дисбактериоза проводится:
- для лабораторной оценки состояния больного в момент обращения;
- для научно-исследовательской работы, чтобы понять механизмы возникновения заболеваний и разработать методы их лечения, направленные на блокирование механизмов развития патологий.
Исследователи чаще используют генотипирование микробиоты методами ПЦР Real-time (в режиме реального времени), исследуя 16S pРНК бактерий. В клинической практике врач проводит посевы микрофлоры, реже ПЦР и микроскопию.
Молекулярная идентификация — это определение последовательностей ДНК или РНК представителей микрофлоры. Проводится не для всех видов бактерий и вирусов, но их число становится всё больше. Бывают одноцелевые (видовые) и мультиплексные (таксонные) анализы.
Для увеличения количества копий ДНК и улучшения качества идентификации используют амплификацию — многократный повтор исследования. Она позволяет обнаружить даже незначительное количество микроорганизмов.
Существует несколько вариантов амплификации:
- целевая амплификация — к ней относятся ПЦР и обратная транскриптаза-ПЦР;
- амплификация транскрипции и смещения цепи;
- аплификация сигнала — гибридный захват и анализ разветвлённой ДНК;
- ПЦР Real-time — анализ микроматрицы и кривой ликвидуса.
Чаще всего разнообразие микрофлоры изучается с помощью метода ПЦР. Ген 16S рРНК является идеальной мишенью для классификации бактерий из-за его девяти областей, которые помогают различить виды с помощью отдельных нуклеотидных полиморфизмов.
Методы биоинформатики — QIIME, Mothur и Genboree — были разработаны для обработки таксономической информации, полученной из исследований 16S. Эти инструменты упрощают процесс фильтрации качества, выбора таксономических единиц работы, удаления химерной последовательности и назначения таксономии. Они также могут выполнять базовый анализ микрофлоры, включая измерение альфа-разнообразия (в пределах сообщества) и бета-разнообразия (между сообществами). При этом необходимо учитывать вклад вирусов и грибов в микробиомные взаимодействия[29].
Посевы (тест-культура) — исследования, которые выявляют рост микробов на питательной твёрдой или жидкой среде для дальнейшей идентификации и определения чувствительности к антибиотикам. Они особенно важны в клинической практике, так как позволяют подобрать лечение при обнаружении инфекции на фоне дисбактериоза.
Хотя большинство образцов материала высевают на среду общего назначения (например, кровяной или шоколадный агар), некоторые болезнетворные микроорганизмы требуют определённых питательных веществ, ингибиторов или других специальных условий. Если есть подозрение на наличие особых микроорганизмов, если пациент принимал антибактериальные препараты, а также при некоторых особых случаях (например, при наличии ВИЧ-инфекци), нужно об этом сообщить в лабораторию.
Микроскопия охватывает не все микроорганизмы, зато проста и помогает в предварительном выборе антибиотиков при подозрении на инфекцию, пока ожидаются результаты окончательной идентификации.
Научные открытия в области диагностики
Благодаря комплексным исследованиям микробных сообществ MetaHit и Human Microbiome Project стал известен состав и молекулярный профиль здорового кишечного микробиома. Это знание позволило более точно анализировать последовательности ДНК хозяина, микробной ДНК (генома) и РНК (транскриптома)[34].
Недавние достижения в технологиях молекулярной биологии — омикс-технологиях — позволили контролировать концентрации различных биологических молекул. Благодаря этому теперь можно определить их вариации микроорганизмов в различных биологических состояниях в масштабе генома.
Несколько популярных «омических» платформ включают:
- транскриптомику, которая измеряет уровни транскриптов мРНК;
- протеомику, которая количественно определяет содержание белка;
- метаболомику, которая определяет содержание мелких клеточных метаболитов;
- интерактомику, которая разрешает весь набор молекулярных взаимодействий в клетках;
- флюксомику, которая устанавливает динамические изменения молекул внутри клетки с течением времени.
Лечение дисбактериоза
Диета
Рацион питания оказывает сильнейшее влияние на микробиоту кишечника. Достичь здорового статуса микрофлоры можно при низком потреблении животных жиров и простых углеводов, включении в рацион овощей и пищи с высоким содержанием клетчатки, а также при разнообразии потребляемых продуктов.
Диета при нарушении микробиома должна быть максимально полной: чем шире рацион, тем богаче микробное разнообразие. При наличии симптомов метеоризма и неустойчивого стула следует избегать сырых овощей (лучше есть их в виде рагу) и фруктов натощак.
Если есть пищевые непереносимости, приводящие к дисбиозу, то придётся исключить:
- молочные продукты при лактазной недостаточности;
- глютен — при целиакии;
- продукты, на которые есть подтверждённая кишечная аллергия.
Кишечник и флора не любят зажаристую мясную корочку, поэтому тушение продуктов всегда лучше, чем жарка.
Пробиотики
Однозначного мнения о пользе приёма пробиотиков для лечения дисбактериоза пока нет. В исследованиях отмечалось такие положительные эффекты:
- улучшение по шкале Бека при депрессии;
- уменьшение висцеральной чувствительности и нормализация моторики кишечника при синдроме раздражения кишечника и инфекционном энтероколите;
- снижение активности аутоиммунитета при воспалительных заболеваниях кишечника, системной красной волчанки и ревматоидном артрите.
О снижении инсулинорезистентности данные неоднородны.
В западных странах терапия пробиотиками является дополнением к патогенетическому лечению — блокировки механизмов развития болезни. Решение о её назначении остаётся за врачом.
В России лакто-бифидопробиотики в дозах от 109 бактерий в капсуле рекомендованы при болезнях кишечника и как дополнительная терапия аутоиммунных и аллергических заболеваний. Тем не менее, остаётся вопрос длительности применения пробиотиков, так как изолированные заселяемые бактерии (в отличие от фекалотрансплантации) не приживаются, но помогают вытеснить патобионтов и дают возможность угнетённой нормофлоре самостоятельно восстановиться.
Важно, что для лечения различных патологий нужны различные штаммы бактерий:
- при болезни Крона и аллергии эффективен и безопасен Lactococcus lactis, экспрессирующий IL-10;
- при диабете добавление пробиотиков в течение восьми недель предотвращает повышение FPG, снижает уровень hs-CRP в сыворотке и увеличивает общий GSH в плазме[35];
- при диабете у беременных приём пробиотических добавок в течение 12 недель в первой половине беременности благотворно влияют на маркеры метаболизма инсулина, триглицериды, биомаркеры воспаления и окислительный стресс;
- при запоре добавки с некоторыми пробиотическими штаммами Lactobacillus или Bifidobacterium увеличивают частоту стула и снижают время транзита содержимого кишечника;
- при диарее живые пробиотики высокой концентрации (1010 КОЕ/мл) замедляют сокращение мышц толстой кишки[36];
- при ревматоидном артрите приём добавок пробиотика в течение 8 недель снижает активность заболевания, уровень инсулина и его выделение[37];
- при атопическом дерматите и пищевой аллергии пробиотики улучшают их течение[9].
Пребиотики
Эти питательные вещества выступают в качестве «удобрений» для полезных видов бактерий кишечника. К пребиотикам относятся неперевариваемые олигосахариды, инулин, масляная кислота, многоатомные спирты, аминокислоты и пептиды, лактулоза и пищевые волокна.
Применение БАДов с пребиотическим эффектом, таких как «Максилак«, «Лактофильтрум«, «Закофальк», «Эубикор» и других, обоснованно и является перспективным методом лечения[38]. Например, при выраженной тревожности у пациентов с синдромом раздражённого кишечника ежедневный приём пребиотической смеси галактоолигосахаридов в течение четырёх недель снижает чувство тревоги и положительно влияет на качество жизни[12].
Метабиотики (постбиотики)
Они являются структурными компонентами пробиотиков и их метаболитов. Препараты этой группы недостаточно изучены, хотя различные продукты распада бактерий содержатся в кисломолочных и квашеных продуктах питания. В аптеке можно встретить такие метабиотики, как «Хилак форте» и «Бактистатин«, однако их эффективность не доказана ни в одном крупном исследовании. Поэтому лечение метабиотиками остаётся пока только на уровне концепции.
Антибиотики
При воспалительных заболеваниях кишечника и тяжёлых формах дисбактериоза лечение состоит в том, чтобы устранить микрофлору, которая активировала иммунный ответ, может приём метронидазола и ципрофлоксацина, тогда как пробиотики и пребиотики предотвращают рецидив колита[38].
При колоректальном раке рост Fusobacterium nucleatum (палочки Плаута) предсказывает агрессивность течения болезни, её устойчивость к химиотерапии и вероятность рецидива. В связи с этим химиотерапию рекомендуется проводить вместе с приёмом антибиотиков, направленных на борьбу с патогенными бактериями[15].
Улучшить течение ревматоидного артрита может подавление роста бактерией Prevotella copri, так как именно этот патобионт участвует в развитии заболевания[8].
При синдроме раздражённого кишечника для уменьшения симптомов, в т. ч. вздутия, показано использование местных неабсорбируемых антисептиков неомицина и рифаксимина[38].
Фекалотрансплантация
В отличие от приёма пробиотиков пересадка кала имеет долгосрочный устойчивый эффект. Сейчас она активно применяется только для лечения от псевдомембранозного колита, вызванного бактериями C. Difficile[33]. Также проводятся множественные исследования об эффекте фекалотрансплантации в лечении аутоиммунных, неврологических заболеваний и инсулинорезистентости.
Бактериофаги
Бактериофаги (вирусы, избирательно поражающие бактериальные клетки) эффективны для борьбы с инфекцией — дисбактериозом 2 степени. Препарат подбирают по результатам посевов кала с чувствительностью к фагам. Однако этот метод применяется крайне редко из-за высокой стоимости препаратов и сложности их использования. Выпивать «бульон» с фагами нужно за час до еды 3 раза в день, предварительно выпивая большое количество воды, чтобы разбавить желудочную кислоту, в которой бактериофаги разрушаются. Сейчас этот метод лечения чаще используют в педиатрии, когда нет возможности дать антибиотик.
Иммуномодуляторы
Использование иммуномодуляторов для лечения дисбактериоза кишечника обсуждается, однако убедительных данных пока нет. Хорошо зарекомендовали себя только витамин Д и Омега-3, дефицит которых однозначно негативно сказывается на взаимодействии кишечной стенки с микробиомом.
Могут ли помочь народные средства
Суть народности метода в его популярности среди людей без наличия доказательной базы. Когда какой-то метод лечения проходит клинические испытания, он становится лекарством традиционной практики. Из фитотерапии положительно воздействуют на слизистую пищеварительного тракта и флору настои календулы, ромашки, шалфея и солодки.
Прогноз. Профилактика
Прогноз при дисбактериозе благоприятный. Восстановление нормальной флоры — процесс не быстрый, но достижимый.
Начинать профилактику дисбактериоза у детей необходимо с нормализации вагинальной и кишечной микрофлоры будущих мам. Роды лучше проводить естественным способом.
Следующий шаг на пути правильного формирования микрофлоры кишечного — грудное вскармливание, в ходе которого в организме появляются бифидобактерии. Слишком раннее введение глютенового прикорма поможет избежать возможного развития местного воспаления и целиакии.
Основная микробиота формируется только в первый год жизни. Воздействия на организм после года, в том числе терапевтические, влияют на бактериальные сообщества намного меньше[9].
В дальнейшей жизни важнейшее значение в профилактике дисбактериоза имеет образ питания, разнообразие рациона и режим приёма пищи. Диета должна быть обогащена кисломолочными продуктами, овощами, фруктами и отрубями. Преобладание растительных масел над животными жирами способствует балансу жирных кислот и противовоспалительной активности в кишечнике.
На фоне погрешности в диете, стресса и после перенесённых инфекций могут появиться первые симптомы кишечного дискомфорта — вздутие, нарушение стула, нарастание висцеральной чувствительности.
Отказ от вредных привычек (курения, злоупотребления алкоголем), минимизация консервантов, потребляемых с пищей, а также амортизация стресса помогут избежать запуска воспалительных процессов и нарушения микрофлоры, связанного с иммунным ответом.
В современном мире инфекции распространяются с огромной скоростью, поэтому отказ от антибиотиков невозможен. Важно применять их разумно, только по назначению врача и с одновременным приёмом пробиотиков.
Регулярное мытьё рук, фруктов и овощей, отказ от косметических средств с антимикробной активностью защищают от инфекций и сохраняют естественную нормофлору.
С возрастом разнообразие микробиоты естественным образом снижается. Это повышает склонность к запорам, ослабляет иммунную защиту и вызывает общую слабость. В таких ситуациях профилактикой дальнейшего развития дисбиоза будет своевременный приём курсов про- и пребиотиков или их постоянное поддерживающее применение.
Правильное, сбалансированное содержание белков, жиров и углеводов является ключом к здоровью на долгие годы. Продукты не способны в полной мере обеспечить организм человека всем необходимым. Есть целый перечень лекарств, которые помогают держать себя в хорошей форме и не болеть от легкого дуновения ветра.
Предлагаем список лучших пробиотиков. Перед началом терапии рекомендуется проконсультироваться с врачом, чтобы исключить наличие противопоказаний и правильно рассчитать дозировку.
Полезные свойства
Пробиотики – живые микроорганизмы, которые могут принести пользу человеку. В большинстве случаев это бактерии, но могут быть и другие представители микробов (например, дрожжи). Пробиотики несут пользу для кишечника, нормализуя микрофлору и устраняя дисбактериоз.
Даже лучшие пробиотики для восстановления микрофлоры нужно принимать правильно, чтобы достичь заявленного производителем результата:
- пить за час до еды;
- курс терапии – до полного исчезновения симптомов;
- запивать небольшим количеством воды.
Лечение дисбактериоза должно проводиться в несколько этапов. Пробиотики первого поколения принимать от 2 до 4 недель, второго – от 5 до 7 дней, третьего и четвертого – не более 7 дней.
Нормы и различные вариации
Пробиотики колонизируют кишечник полезными бактериями, противодействуют патогенной (вредной) флоре, вызывающей запор или диарею, повышают иммунитет.
Основную массу бактерий – пробиотиков можно разделить на 2 вида: лакто- и бифидобактерии. В каждом из них существует значительное количество подвидов. Они оказывают то или иное благотворное влияние на организм человека.
Существуют различные типы пробиотиков:
- Монокомпонентные. Первое поколение, содержащее бактерии одного вида (коли- бифидо- или лактосодержащие).
- Антагонисты. Второе поколение, которое включает препараты конкурентного действия. Они не являются представителями естественной микрофлоры желудочно-кишечного тракта.
- Поликомпонентные симбиотики. Третье поколение, которое состоит из более одного штамма полезных микроорганизмов. Они, как правило, усиливают действие друг друга.
- Сорбированные бифидосодержащие. Четвертое поколение отличается наличием активных компонентов, которые обладают выраженным иммуномодулирующим действием.
- Синбиотики. Пятое поколение, содержащее облигатную флору и вещества пребиотического действия.
В зависимости от поколения препарата в рецептуру могут быть включены энтерококки. Названия звучат жутко, но ингредиенты препарата не вредят человеку. Продукты изготавливаются в сухом и жидком виде.
Отклонения от нормы
Многие из необходимых микроорганизмов находятся в ежедневной пище (молочные продукты, овощи, фрукты), но в некоторых случаях необходим дополнительный прием пробиотиков:
- частые простуды для укрепления иммунной системы;
- синдром раздраженного кишечника для улучшения подвижности и восстановления слизистой оболочки кишечника;
- пищевая аллергия (бактерии образуют защитный слой, который предотвращает проникновение аллергена в кровь);
- непереносимость лактозы;
- дефицит витаминов B, H или K;
- во время грудного вскармливания (пробиотики положительно влияют на здоровье матери и ребенка);
- после приема антибиотиков для восстановления микрофлоры.
Непатогенные живые микроорганизмы поддерживают синтез интерферона, снимая симптомы аллергии. Действующие компоненты нейтрализуют бактерии Helicobacter Pylori, которые вызывают язвенную болезнь желудка.
Чем отличаются пробиотики от пребиотиков?
Обе группы биоактивных препаратов разработаны для восстановления полезной микрофлоры кишечника. Но их действие несколько различно, т. к. они имеют различную биологическую структуру:
- Пробиотики. Состоят из дрожжей, бифидо- и лактобактерий. В норме в небольшом количестве они населяют организм человека, помогая усваивать питательные вещества и переваривать пищу.
- Пребиотики. Включают фруктозоолигосахариды, низкомолекулярные углеводы, лактулозу и инсулин. В достаточном количестве можно получить из таких продуктов питания, как чеснок, бананы, крупы и горох.
Могут ли навредить пробиотики?
Пробиотики практически не имеют противопоказания. Не рекомендуется принимать при онкологических заболеваниях, поражении лимфатический и кровеносной системы, ВИЧ. С осторожностью рекомендуется принимать в период беременности и лактации. Маленьким детям допустимо давать только те препараты, которые не имеют возрастных ограничений.
Как выбрать пробиотики для кишечника?
Лучшие пробиотики для восстановления кишечника может посоветовать только врач. Должны быть учтены основные критерии: возраст пациента, состояние организма, характер дисфункций, противопоказания и пр. Самолечение может не дать должного результата и привести к развитию проблем со здоровьем.
В список препаратов включены лучшие пробиотики для восстановления микрофлоры кишечника. Рейтинг основан на эффективности, безопасности и соотношении цена-качество.
№1 – «Нормофлорин-Д» (Бифилюкс, Россия)
Биологически активная добавка разработана на основе лактобактерий и их метаболитов. Используется в комплексном лечении язвы двенадцатиперстной кишки и желудка, при ожирении и метаболическом синдроме. Назначается после антибактериальной терапии для восстановления нарушенного микробиоценоза.
№2 – «Бифиформ» (Ferrosan, Дания)
Противодиарейный препарат регулирует равновесие микрофлоры кишечника. Содержит Bifidobacterium longum и Enterococcus faecium. МИБП-эубиотик назначается при непереносимости лактозы, для восстановления микрофлоры кишечника и для лечения хеликобактерной инфекции в составе комплексной терапии.
№3 – «Линекс» (Lek d. d., Словения)
Находится в первых рядах списка пробиотиков для кишечника. Основные активные компоненты этого препарата стимулируют изменение рН путем брожения лактозы. Это тормозит развитие патогенных и условно-патогенных микроорганизмов и создает благоприятные условия для пищеварительных ферментов.
Активные вещества, входящие в «Линекс» устойчивы к антибиотикам. Они оказывают влияние не только на нижние отделы кишечника, но и на верхние (этими свойствами обладают далеко не все пробиотики). Многокомпонентное средство, пригодно практически для всех пациентов, включая детей (даже тех, кто находится на искусственном питании).
№4 – «Хилак Форте» (Merckle, Германия)
Комбинированный препарат для нормализации кислотности желудка в соответствии с физиологической нормой. Биологически восстанавливает микрофлору кишечника. Таким образом, создает неблагоприятную среду для жизнедеятельности патогенных и условно-патогенных бактерий.
№5 – «Линекс Форте» (Sandoz, Словения)
Пробиотик регулирует равновесие микрофлоры кишечника. Разработан на основе молочнокислых живых бактерий, которые представляют собой составляющие естественной микрофлору. Широко используется при дисбактериоза, запорах и хеликобактериозе у детей и взрослых.
№6 – «Бифидумбактерин» (Ланафарм, Россия)
Лучший пробиотик для восстановления микрофлоры, который устойчив ко многим лекарственным средствам и антибиотикам. «Бифидумбактерин» является антагонистом достаточно широкого спектра болезнетворных и условно болезнетворных микроорганизмов. Выпускается в форме ректальных суппозиториев и капсул.
Эффективность препарата обусловлена сильной концентрацией бифидобактерий. Быстро нормализует микрофлору кишечника, которая, будучи естественной, накапливает токсические вещества (как поступающие в организм извне, так и находящиеся в нем) и разлагает их на нетоксичные компоненты. Нельзя давать детям, страдающим непереносимостью молочных продуктов.
№7 – «Бак-Сет Форте» (Probiotics International, Великобритания)
Мульти-пробиотик нового поколения, который включает в состав 14 видов пробиотических живых бактерий. Они дополняют действие друг друга, устраняя проблемы с пищеварением у детей от 3-х летнего возраста и у взрослых. Усовершенствованная микрокапсулированная технология способствует сохранению полезных свойств бактерий на протяжении всего срока хранения препарата.
№8 – «Бифиформ Баланс» (Pfizer, Россия)
Один из лучших пробиотиков для восстановления микрофлоры кишечника. разработан на основе лакто- и бифидобактерий. Биологически активная добавка к пище назначается для лечения дисбактериоза различной этиологии и поддерживает микрофлору кишечника. Способствует коррекции функциональных нарушений желудочно-кишечного тракта.
№9 – «Флорин Форте» (Партнер, Россия)
Лакто- и бифидобактерии, входящие в состав, принимают участие в процессах синтеза аскорбиновой кислоты, калия, витаминов группы В. В результате повышается устойчивость к агрессивным воздействиям окружающей среды. Также действующие компоненты участвуют в обменных процессах желчных кислот и пигментов. В их присутствии происходит синтез веществ, оказывающих антибактериальное действие. Также препарат повышает иммунную-реактивность человеческого организма.
№10 – «Бактериофаг» (Микроген НПО, Россия)
Стафилококковый раствор входит в список лучших пробиотиков для кишечника для взрослых и детей. Используется преимущественно в составе комплексной терапии с антибактериальными препаратами и другими лекарственными средствами.
№11 – «Секстафаг» (Микроген НПО, Россия)
Завершает список препаратов пробиотиков для кишечника. Иммунобиологический препарат специфически лизирует бактерии стрептококков и стафилококков, протеи, кишечной и синегнойной палочки. Назначается при энтеральных и гнойно-воспалительных заболеваниях. При необходимости может быть использован в составе комплексной терапии.
Выводы
Пробиотические средства нормализуют процессы пищеварения, активируя перистальтику кишечника и восстанавливая микрофлору. Препараты способствуют синтезу полиаминов, укрепляют клеточный цитоскелет и регенерируют кишечный эпителий, повышая защитные функции организма. Они не только уменьшают газообразование, н и тормозят рост вредоносных микроорганизмов.
Какие пробиотики принимать в том или ином случае может посоветовать врач. Специалист отталкивается от показаний и общего состояния организма пациента, исключая развитие передозировки или побочных реакций.
Литература:
https://www.vidal.ru/drugs/clinic-pointer/11.12.01.01
https://medi.ru/info/15562/
https://www.rlsnet.ru/fg_index_id_626.htm
https://medi.ru/spisok/probiotiki/
Согласно определению Всемирной организации здравоохранения, пробиотики — это живые микроорганизмы которые, которые при искусственном введении в организм в допустимой дозе оказывают полезное действие на здоровье человека. Иногда этот термин путают с пребиотиками. Пребиотиками называются вещества и растворы для успешного роста полезных бактерий.
Содержание
- Для чего нужны пробиотики взрослым и детям и могут ли они заменить собственную флору человека?
- Лучшие пробиотики — принципы терапии и требования к качеству
- Лучшие пробиотики на российском рынке
Для чего нужны пробиотики взрослым и детям и могут ли они заменить собственную флору человека?
Натуральная микрофлора здорового человека выполняет большое количество функций, но не стоит приравнивать ее активность к пробиотикам. Информация о ценности природной микробиоты нужна для бережного к ней отношения, ибо восстановление ее баланса зачастую не под силу любым современным средствам.
В кишечнике человека в норме находится около 50 триллионов микроорганизмов, большая часть которых составляют бактерии 30-40 видов (в основном это различные виды бифидо и лактобактерий). Функции микробиоты:
- подавление роста болезнетворных бактерий;
- участие в формировании иммунитета;
- синтез некоторых витаминов, например: К, В1, В2, В3, В5, В6, В9;
- синтез определенных видов аминокислот и белков;
- участие в переваривании пищи, осуществление пристеночного пищеварения;
- усиление всасывания кальция, железа и витамина D;
- барьерная функция в стенке кишечника — препятствуют проникновению различных токсинов и патогенов в кровь.
Мы рассмотрели функции естественной флоры здорового человека, а что делают пробиотики?
Несмотря на массовую рекламу и прием БАД на основе пробиотиков, доказательная медицина приводит лишь несколько патологий при которых целесообразно использование подобных добавок. Если посмотреть состав большинства средств с полезными бактериями, то к сожалению, окажется, что они не соответствуют требованиям.
Международная научная ассоциация пробиотиков и пребиотиков (International Scientific Association for Probiotics and Prebiotics, ISAPP) пробиотиками называет только те добавки или препараты, в составе которых указан конкретный штамм, прошедший исследование на эффективность и безопасность (должно быть проведено как минимум одно рандомизированное контролируемое исследование — РКИ). Также у них есть требование к количеству жизнеспособных бактерий к концу срока годности. Обычно покупатель видит в содержании множество видов лакто и бифидобактерий и он уже уверен, что ему это подходит. А на упаковке должно быть следующее: род, например: Lactobacillus, вид Acidophilus и точный штамм — NCFM. Кроме того, штамм должен быть зарегистрирован в международном депозитарии.
Итак, мы с вами выяснили чем отличается пробиотик на основе эффективного изученного штамма от других добавок из бактерий. Скорее всего вышеназванным требованиям будут удовлетворять средства из раздела лекарств, а не БАД.
Зачем нужны пробиотики, т.е. при каких заболеваниях их назначают:
- Чаще всего подобные лекарства назначают при ААД — антибиотик-ассоциированной диарее. Пациенты, принимающие в стационарах инъекционные формы антибиотиков почти всегда страдают от нарушения баланса флоры. Это выражается болью, вздутием, сильной диареей, кишечник выходит из строя и принимаемая пища почти не всасывается. Но если с первого дня врач прописывает препарат из S. boulardii или лактобактерий определенных штаммов, то неприятные симптомы не появляется. Эти же препараты можно принимать при лечении антибиотиками в виде таблеток. Доказательная медицина располагает данными об эффективности указанных пробиотиков в 23 РКИ. Все штаммы подавляют рост болезнетворной бактерии Clostridium difficile.
- Лечение язвенной болезни желудка с применением антибиотиков может включать дополнительный прием пробиотиков. В этом случае побочные эффекты будут выражены в меньшей степени.
- Профилактика диареи путешественников включает прием препаратов из S. boulardii за несколько дней до начала поездки.
- Терапия пациентов с язвенным колитом и синдромом раздраженного кишечника также не обходится без использования ЛС из S. boulardii, лакто и бифидобактерий.
- Специфические штаммы выделены для лечения инфекционной диареи детей и взрослых.
Лучшие пробиотики — принципы терапии и требования к качеству
Опытный врач не проводит экспериментов. Штаммы одного и того же вида бацилл различаются по терапевтической эффективности, а в некоторых случаях могут оказывать противоположный эффект. Также специалисты понимают, что не существует универсального вида микроорганизма, способного улучшить здоровье кишечника. К терапии допускаются лишь определенные штаммы под конкретное заболевание. Врач иногда назначает исследование крови на микробиоту, чтобы понять каких бактерий не хватает.
Производитель пробиотиков высокого класса рекомендует специальную схему дозирования препарата. Пациент должен знать, что меньшая дозировка просто не поможет.
Польза пробиотиков напрямую зависит от условий хранения. Это нужно учитывать при покупке лекарства в аптеке.
Часто в рекламных целях компании “объясняют” потребителю зачем пить пробиотики всем людям, особенно если они в возрасте. Но ответ гастроэнтерологов на такое предложение всегда один — здоровым людям эти средства не нужны и даже могут повредить.
Зачем нужны пробиотики во время беременности?
В действительности препараты из этой группы не нужны беременным, но если пациентка страдает от расстройства кишечника, врач ей подберет полезные бактерии, не противопоказанные в ее положении.
Лучшие пробиотики на российском рынке
Имеются противопоказания. Необходима консультация специалиста.
Энтерол
В составе лекарства французской фирмы Биокодекс находится хорошо изученый штамм Сахаромицеты Буларди — Saccharomyces boulardii CNCM I-745, это живые дрожжи. В классификации позиция представлена, как противодиарейный препарат. Назначается врачом в следующих случаях:
- дисбактериоз;
- выведение Helicobacter pylori при заболеваниях желудка;
- диарея на фоне приема антибиотиков;
- диарея бактериальной или вирусной природы;
- энтероколит и синдром раздраженного кишечника.
Пробиолог Форте
БАД содержит комбинацию двух штаммов: Lactobacillus acidophilus (LA-5®) и Bifidobacterium animalis subs. lactis (BB-12®).
Показания:
- укрепление иммунитета в период ОРВИ;
- диарея, запор, вздутие живота, рвота, аллергия;
- диарея на фоне лечения антибиотиками;
- диарея инфекционной и вирусной природы.
Линекс
Содержит Lactobacillus acidophilus (species L.gasseri), Bifidobacterium infantis, Enterococcus faecium. Средство относится к лекарствам.
У Линекса есть только одно показание: лечение и профилактика дисбиоза.
Ацилакт
Относится в лекарствам, включает один вид лактобактерий — Lactobacillus acidophilus. В виде порошка для приема внутрь Ацилакт имеет следующие показания:
- стоматит, гингивит и другие заболевания полости рта;
- бактериальные и вирусные инфекции кишечника;
- язвенный колит, энтероколит;
- хронические воспаления в кишечнике;
- снижение иммунитета;
- дисбиоз;
- детский атопический дерматит в сочетании с дисбиозом;
- заболевания женской половой сферы.
Бифидумбактерин
Также классифицирован, как лекарство. Содержит только Bifidobacterium bifidum. Широко назначается при заболеваниях кишечника, особенно при дисбиозе. Показан при некоторых заболеваниях в гинекологии.
Хилак форте
В этом препарате нет бактерий, так как это пребиотик, содержащий водный раствор продуктов метаболизма полезных бацилл. Хилак Форте разрешен к применению младенцам и беременным. Показания у него несколько отличаются:
- поддержка кишечника во время лечения антибиотиками и лучевой терапии;
- диспепсия;
- сальмонеллез в период выздоровления;
- дисбиоз (вздутие, запоры, диарея);
- колит;
- синдром старческого кишечника;
- проблемы в работе кишечника из-за перемены климата;
- снижение кислотности желудочного сока;
- заболевания печени и желчного пузыря;
- аллергия.
Заключение
Итак, с проблемами ухудшения работы ЖКТ стоит обратиться к гастроэнтерологу. Далеко не всегда нарушения связаны с дисбактериозом. Поэтому самостоятельно пить пробиотики нельзя, есть большой риск потерять баланс собственной микробиоты. В стационарах обычно пациенты получают проверенные лекарства типа Бифидумбактерина или Энтерола, а вот в процессе амбулаторного лечения врач может рекомендовать пробиотики, не уточняя бренда. В этих случаях следует покупать пробиотики, зарегистрированные, как лекарства, поскольку в БАД может и не быть их нужной концентрации. К тому же производители не обязаны проводить клинические исследования на добавки. В тоже время надо признать, что БАДы есть и высокого качества, содержащие клинически проверенные штаммы. По всем возникающим вопросам о качестве лучше обратиться к врачу, а если он не располагает информацией, то к производителю.
Источники
- Пробиотики с позиции доказательной медицины // Mediasphera;
- Пробиотики // Справочник лекарственных средств Видаль // 2022.
Информация представлена в ознакомительных целях и не является медицинской консультацией или руководством к лечению со стороны uteka.ru.