Механизм действия буферных систем:
1.
Разбавление.
При разбавлении водой происходит
уменьшение концентрации обоих компонентов
в буферной системе в одинаковой степени,
поэтому величина их соотношения не
изменится. рК(кислоты)
и рК(основания)
являются постоянными при данной
температуре и не зависят от разбавления.
Действительно, одновременное понижение
концентраций кислоты и соли в ацетатной
буферной системе от 0,1М до 0,001М при
разбавлении водой изменяет рН буферного
раствора с 4,63 до 4,73 (это ничтожное
изменение рН при разбавлении буферного
раствора в 100 раз обусловлено некоторым
изменением коэффициента активности
соли). Следовательно, разбавление
в конечном итоге мало
изменяет рН буферных систем.
2.
Добавление
кислот и оснований. При
добавлении небольших количеств сильных
кислот или оснований рН буферных систем
изменяется незначительно. Например,
рассмотрим ацетатный буфер:
СН3СООН
/
СН3СОО–
кислотный компонент
– основной компонент–
слабая кислота
сопряженное основание
а)
При добавлении к ацетатному буферу
небольшого количества HCl, происходит
взаимодействие ионов Н+
с основным компонентом буферного
раствора:
Н+
+ СН3СОО–
⇄
СН3СООН.
Степень
диссоциации СН3СООН
мала и концентрация [H+]
практически не меняется. рН буферного
раствора уменьшится, но незначительно.
Таким
образом, если к ацетатному буферу
добавить Х моль/л HCl,
то уравнение для расчета рН буферной
системы принимает вид:
рН
= рК(кислоты)
+ lg
б)
При добавлении
небольшого количества NaOH, –
ионы нейтрализуются кислотным компонентом
буферного раствора:
+
СН3СООН
⇄
СН3СОО
–
+ Н2О.
В
результате этого, добавленное сильное
основание заменяется эквивалентным
количеством слабого сопряженного
основания (СН3СОО–),
которое в меньшей степени влияет на
реакцию cреды. рН буферного раствора
увеличивается, но незначительно.
Таким
образом, если к ацетатному буферу
добавить У моль/л NaOH,
то уравнение для расчета рН буферной
системы принимает вид:
рН
= рК(кислоты)
+ lg
-
Буферная емкость
Способность
буферного раствора сохранять значение
рН при добавлении сильной кислоты или
щелочи приблизительно на постоянном
уровне характеризует буферная емкость.
Буферная емкость
(В) — это число молей эквивалента сильной
кислоты или щелочи, которое необходимо
добавить к 1 л буферного раствора, чтобы
сместить его рН на единицу.
Буферная
емкость системы определяется по отношению
к добавляемым кислоте (Вкисл.)
или основанию (щелочи) (Восн.)
и рассчитывается по формулам:
Вкисл.=
Восн.=
где
V(HA), V(B) — объемы добавленных кислоты или
щелочи, л.; Сн(НА),
Сн(В)
— молярные концентрации эквивалента
соответственно кислоты и щелочи; V(б.р.)
— объем исходного буферного раствора,
л.; рНо,
рН — значения рН буферного раствора до
и после добавления кислоты или щелочи;
|рН-рНо|
— разность рН по модулю.
Буферная
емкость по отношению к кислоте (Вкисл.)
определяется концентрацией (количеством
эквивалентов) компонента с основными
свойствами; буферная емкость по отношению
к основанию (Восн.)
определяется концентрацией (количеством
эквивалентов) компонента с кислотными
свойствами в буферном растворе.
Максимальная
буферная емкость при добавлении сильных
кислот и оснований достигается при
соотношении компонентов буферного
раствора равном единице, когда рН = рК,
при этом Восн.
= В кисл.
(рис.1).
Рис.1. Изменение
буферной емкости в зависимости от
величины
отношения
[соль]/[кислота].
Поэтому, применение
любой буферной смеси ограничено
определенной областью рН (областью
буферирования), а именно:
рН
= рК(кислоты)
1 для кислотных систем, или
рН=
14 – (рК(основания)
1) для основных систем.
Буферная емкость
зависит не только от отношения концентраций
компонентов буферного раствора, но и
от общей концентрации буферной смеси.
Пусть, например,
даны два буферных раствора, один из
которых содержит по 100, а другой – по 10
миллимолей уксусной кислоты и ацетата
натрия. Сравним, как изменяются их рН
при добавлении к 1 л каждого раствора 5
миллимолей соляной кислоты.
Добавляемая кислота
вступит в реакцию с ацетатом натрия, и
это отношение в первом растворе станет
равным 0,9, а во втором 0,33. В итоге у первого
раствора отношение соль/кислота и,
следовательно, величина рН изменились
меньше. Отсюда видно, что первый буферный
раствор обладает большей буферной
емкостью.
Таким
образом, буферная
емкость в основном зависит от соотношения
концентраций компонентов и их абсолютных
концентраций, а следовательно, от
разбавления.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
A buffer solution (more precisely, pH buffer or hydrogen ion buffer) is an acid or a base aqueous solution consisting of a mixture of a weak acid and its conjugate base, or vice versa. Its pH changes very little when a small amount of strong acid or base is added to it. Buffer solutions are used as a means of keeping pH at a nearly constant value in a wide variety of chemical applications. In nature, there are many living systems that use buffering for pH regulation. For example, the bicarbonate buffering system is used to regulate the pH of blood, and bicarbonate also acts as a buffer in the ocean.
Principles of buffering[edit]
Figure 1. Simulated titration of an acidified solution of a weak acid (pKa = 4.7) with alkali
Buffer solutions resist pH change because of a chemical equilibrium between the weak acid HA and its conjugate base A−:
HA ⇌ H+ + A−
When some strong acid is added to an equilibrium mixture of the weak acid and its conjugate base, hydrogen ions (H+) are added, and the equilibrium is shifted to the left, in accordance with Le Chatelier’s principle. Because of this, the hydrogen ion concentration increases by less than the amount expected for the quantity of strong acid added.
Similarly, if strong alkali is added to the mixture, the hydrogen ion concentration decreases by less than the amount expected for the quantity of alkali added. In figure 1, the effect is illustrated by the simulated titration of a weak acid with pKa = 4.7. The relative concentration of undissociated acid is shown in blue, and of its conjugate base in red. The pH changes relatively slowly in the buffer region, pH = pKa ± 1, centered at pH = 4.7, where [HA] = [A−]. The hydrogen ion concentration decreases by less than the amount expected because most of the added hydroxide ion is consumed in the reaction
OH− + HA → H2O + A−
and only a little is consumed in the neutralization reaction (which is the reaction that results in an increase in pH)
OH− + H+ → H2O.
Once the acid is more than 95% deprotonated, the pH rises rapidly because most of the added alkali is consumed in the neutralization reaction.
Buffer capacity[edit]
Buffer capacity is a quantitative measure of the resistance to change of pH of a solution containing a buffering agent with respect to a change of acid or alkali concentration. It can be defined as follows:[1][2]
where 
where 
With either definition the buffer capacity for a weak acid HA with dissociation constant Ka can be expressed as[3][4][2]
where [H+] is the concentration of hydrogen ions, and 
Figure 2. Buffer capacity β for a 0.1 M solution of a weak acid with a pKa = 7
This equation shows that there are three regions of raised buffer capacity (see figure 2).
- In the central region of the curve (coloured green on the plot), the second term is dominant, and
Buffer capacity rises to a local maximum at pH = pKa. The height of this peak depends on the value of pKa. Buffer capacity is negligible when the concentration [HA] of buffering agent is very small and increases with increasing concentration of the buffering agent.[2] Some authors show only this region in graphs of buffer capacity.[1] Buffer capacity falls to 33% of the maximum value at pH = pKa ± 1, to 10% at pH = pKa ± 1.5 and to 1% at pH = pKa ± 2. For this reason the most useful range is approximately pKa ± 1. When choosing a buffer for use at a specific pH, it should have a pKa value as close as possible to that pH.[1]
- With strongly acidic solutions, pH less than about 2 (coloured red on the plot), the first term in the equation dominates, and buffer capacity rises exponentially with decreasing pH:
This results from the fact that the second and third terms become negligible at very low pH. This term is independent of the presence or absence of a buffering agent.
- With strongly alkaline solutions, pH more than about 12 (coloured blue on the plot), the third term in the equation dominates, and buffer capacity rises exponentially with increasing pH:
This results from the fact that the first and second terms become negligible at very high pH. This term is also independent of the presence or absence of a buffering agent.
Applications of buffers[edit]
The pH of a solution containing a buffering agent can only vary within a narrow range, regardless of what else may be present in the solution. In biological systems this is an essential condition for enzymes to function correctly. For example, in human blood a mixture of carbonic acid (H
2CO
3) and bicarbonate (HCO−
3) is present in the plasma fraction; this constitutes the major mechanism for maintaining the pH of blood between 7.35 and 7.45. Outside this narrow range (7.40 ± 0.05 pH unit), acidosis and alkalosis metabolic conditions rapidly develop, ultimately leading to death if the correct buffering capacity is not rapidly restored.
If the pH value of a solution rises or falls too much, the effectiveness of an enzyme decreases in a process, known as denaturation, which is usually irreversible.[5] The majority of biological samples that are used in research are kept in a buffer solution, often phosphate buffered saline (PBS) at pH 7.4.
In industry, buffering agents are used in fermentation processes and in setting the correct conditions for dyes used in colouring fabrics. They are also used in chemical analysis[4] and calibration of pH meters.
Simple buffering agents[edit]
-
Buffering agent pKa Useful pH range Citric acid 3.13, 4.76, 6.40 2.1–7.4 Acetic acid 4.8 3.8–5.8 KH2PO4 7.2 6.2–8.2 CHES 9.3 8.3–10.3 Borate 9.24 8.25–10.25
For buffers in acid regions, the pH may be adjusted to a desired value by adding a strong acid such as hydrochloric acid to the particular buffering agent. For alkaline buffers, a strong base such as sodium hydroxide may be added. Alternatively, a buffer mixture can be made from a mixture of an acid and its conjugate base. For example, an acetate buffer can be made from a mixture of acetic acid and sodium acetate. Similarly, an alkaline buffer can be made from a mixture of the base and its conjugate acid.
«Universal» buffer mixtures[edit]
By combining substances with pKa values differing by only two or less and adjusting the pH, a wide range of buffers can be obtained. Citric acid is a useful component of a buffer mixture because it has three pKa values, separated by less than two. The buffer range can be extended by adding other buffering agents. The following mixtures (McIlvaine’s buffer solutions) have a buffer range of pH 3 to 8.[6]
-
0.2 M Na2HPO4 (mL) 0.1 M citric acid (mL) pH 20.55 79.45 3.0 38.55 61.45 4.0 51.50 48.50 5.0 63.15 36.85 6.0 82.35 17.65 7.0 97.25 2.75 8.0
A mixture containing citric acid, monopotassium phosphate, boric acid, and diethyl barbituric acid can be made to cover the pH range 2.6 to 12.[7]
Other universal buffers are the Carmody buffer[8] and the Britton–Robinson buffer, developed in 1931.
Common buffer compounds used in biology[edit]
For effective range see Buffer capacity, above. Also see Good’s buffers for the historic design principles and favourable properties of these buffer substances in biochemical applications.
| Common name (chemical name) | Structure | pKa, 25 °C |
Temp. effect, dpH/dT (K−1)[9] |
Mol. weight |
|---|---|---|---|---|
| TAPS, ([tris(hydroxymethyl)methylamino]propanesulfonic acid) |
 |
8.43 | −0.018 | 243.3 |
| Bicine, (2-(bis(2-hydroxyethyl)amino)acetic acid) |
 |
8.35 | −0.018 | 163.2 |
| Tris, (tris(hydroxymethyl)aminomethane, or 2-amino-2-(hydroxymethyl)propane-1,3-diol) |
 |
8.07[a] | −0.028 | 121.14 |
| Tricine, (N-[tris(hydroxymethyl)methyl]glycine) |
 |
8.05 | −0.021 | 179.2 |
| TAPSO, (3-[N-tris(hydroxymethyl)methylamino]-2-hydroxypropanesulfonic acid) |
 |
7.635 | 259.3 | |
| HEPES, (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) |
 |
7.48 | −0.014 | 238.3 |
| TES, (2-[[1,3-dihydroxy-2-(hydroxymethyl)propan-2-yl]amino]ethanesulfonic acid) |
 |
7.40 | −0.020 | 229.20 |
| MOPS, (3-(N-morpholino)propanesulfonic acid) |
 |
7.20 | −0.015 | 209.3 |
| PIPES, (piperazine-N,N′-bis(2-ethanesulfonic acid)) |
 |
6.76 | −0.008 | 302.4 |
| Cacodylate, (dimethylarsenic acid) |
 |
6.27 | 138.0 | |
| MES, (2-(N-morpholino)ethanesulfonic acid) |
 |
6.15 | −0.011 | 195.2 |
- ^ Tris is a base, the pKa = 8.07 refers to its conjugate acid.
Calculating buffer pH[edit]
Monoprotic acids[edit]
First write down the equilibrium expression
HA ⇌ A− + H+
This shows that when the acid dissociates, equal amounts of hydrogen ion and anion are produced. The equilibrium concentrations of these three components can be calculated in an ICE table (ICE standing for «initial, change, equilibrium»).
-
ICE table for a monoprotic acid
[HA] [A−] [H+] I C0 0 y C −x x x E C0 − x x x + y
The first row, labelled I, lists the initial conditions: the concentration of acid is C0, initially undissociated, so the concentrations of A− and H+ would be zero; y is the initial concentration of added strong acid, such as hydrochloric acid. If strong alkali, such as sodium hydroxide, is added, then y will have a negative sign because alkali removes hydrogen ions from the solution. The second row, labelled C for «change», specifies the changes that occur when the acid dissociates. The acid concentration decreases by an amount −x, and the concentrations of A− and H+ both increase by an amount +x. This follows from the equilibrium expression. The third row, labelled E for «equilibrium», adds together the first two rows and shows the concentrations at equilibrium.
To find x, use the formula for the equilibrium constant in terms of concentrations:
Substitute the concentrations with the values found in the last row of the ICE table:
Simplify to
With specific values for C0, Ka and y, this equation can be solved for x. Assuming that pH = −log10[H+], the pH can be calculated as pH = −log10(x + y).
Polyprotic acids[edit]
Polyprotic acids are acids that can lose more than one proton. The constant for dissociation of the first proton may be denoted as Ka1, and the constants for dissociation of successive protons as Ka2, etc. Citric acid is an example of a polyprotic acid H3A, as it can lose three protons.
-
Stepwise dissociation constants
Equilibrium Citric acid H3A ⇌ H2A− + H+ pKa1 = 3.13 H2A− ⇌ HA2− + H+ pKa2 = 4.76 HA2− ⇌ A3− + H+ pKa3 = 6.40
When the difference between successive pKa values is less than about 3, there is overlap between the pH range of existence of the species in equilibrium. The smaller the difference, the more the overlap. In the case of citric acid, the overlap is extensive and solutions of citric acid are buffered over the whole range of pH 2.5 to 7.5.
Calculation of the pH with a polyprotic acid requires a speciation calculation to be performed. In the case of citric acid, this entails the solution of the two equations of mass balance:
CA is the analytical concentration of the acid, CH is the analytical concentration of added hydrogen ions, βq are the cumulative association constants. Kw is the constant for self-ionization of water. There are two non-linear simultaneous equations in two unknown quantities [A3−] and [H+]. Many computer programs are available to do this calculation. The speciation diagram for citric acid was produced with the program HySS.[10]
N.B. The numbering of cumulative, overall constants is the reverse of the numbering of the stepwise, dissociation constants.
-
Relationship between cumulative association constant (β) values and stepwise dissociation constant (K) values for a tribasic acid.
Equilibrium Relationship A3− + H+ ⇌ AH2+ Log β1= pka3 A3− + 2H+ ⇌ AH2+ Log β2 =pka2 + pka3 A3− + 3H+⇌ AH3 Log β3 = pka1 + pka2 + pka3
Cumulative association constants are used in general-purpose computer programs such as the one used to obtain the speciation diagram above.
See also[edit]
- Henderson–Hasselbalch equation
- Buffering agent
- Good’s buffers
- Common-ion effect
- Metal ion buffer
- Mineral redox buffer
References[edit]
- ^ a b c Skoog, Douglas A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2014). Fundamentals of Analytical Chemistry (9th ed.). Brooks/Cole. p. 226. ISBN 978-0-495-55828-6.
- ^ a b c Urbansky, Edward T.; Schock, Michael R. (2000). «Understanding, Deriving and Computing Buffer Capacity». Journal of Chemical Education. 77 (12): 1640–1644. Bibcode:2000JChEd..77.1640U. doi:10.1021/ed077p1640.
- ^ Butler, J. N. (1998). Ionic Equilibrium: Solubility and pH calculations. Wiley. pp. 133–136. ISBN 978-0-471-58526-8.
- ^ a b Hulanicki, A. (1987). Reactions of acids and bases in analytical chemistry. Translated by Masson, Mary R. Horwood. ISBN 978-0-85312-330-9.
- ^ Scorpio, R. (2000). Fundamentals of Acids, Bases, Buffers & Their Application to Biochemical Systems. ISBN 978-0-7872-7374-3.
- ^ McIlvaine, T. C. (1921). «A buffer solution for colorimetric comparaison» (PDF). J. Biol. Chem. 49 (1): 183–186. doi:10.1016/S0021-9258(18)86000-8. Archived (PDF) from the original on 2015-02-26.
- ^ Mendham, J.; Denny, R. C.; Barnes, J. D.; Thomas, M. (2000). «Appendix 5». Vogel’s textbook of quantitative chemical analysis (5th ed.). Harlow: Pearson Education. ISBN 978-0-582-22628-9.
- ^ Carmody, Walter R. (1961). «Easily prepared wide range buffer series». J. Chem. Educ. 38 (11): 559–560. Bibcode:1961JChEd..38..559C. doi:10.1021/ed038p559.
- ^ «Buffer Reference Center». Sigma-Aldrich. Archived from the original on 2009-04-17. Retrieved 2009-04-17.
- ^ Alderighi, L.; Gans, P.; Ienco, A.; Peters, D.; Sabatini, A.; Vacca, A. (1999). «Hyperquad simulation and speciation (HySS): a utility program for the investigation of equilibria involving soluble and partially soluble species». Coordination Chemistry Reviews. 184 (1): 311–318. doi:10.1016/S0010-8545(98)00260-4. Archived from the original on 2007-07-04.
External links[edit]
«Biological buffers». REACH Devices.
From Wikipedia, the free encyclopedia
A buffer solution (more precisely, pH buffer or hydrogen ion buffer) is an acid or a base aqueous solution consisting of a mixture of a weak acid and its conjugate base, or vice versa. Its pH changes very little when a small amount of strong acid or base is added to it. Buffer solutions are used as a means of keeping pH at a nearly constant value in a wide variety of chemical applications. In nature, there are many living systems that use buffering for pH regulation. For example, the bicarbonate buffering system is used to regulate the pH of blood, and bicarbonate also acts as a buffer in the ocean.
Principles of buffering[edit]
Figure 1. Simulated titration of an acidified solution of a weak acid (pKa = 4.7) with alkali
Buffer solutions resist pH change because of a chemical equilibrium between the weak acid HA and its conjugate base A−:
HA ⇌ H+ + A−
When some strong acid is added to an equilibrium mixture of the weak acid and its conjugate base, hydrogen ions (H+) are added, and the equilibrium is shifted to the left, in accordance with Le Chatelier’s principle. Because of this, the hydrogen ion concentration increases by less than the amount expected for the quantity of strong acid added.
Similarly, if strong alkali is added to the mixture, the hydrogen ion concentration decreases by less than the amount expected for the quantity of alkali added. In figure 1, the effect is illustrated by the simulated titration of a weak acid with pKa = 4.7. The relative concentration of undissociated acid is shown in blue, and of its conjugate base in red. The pH changes relatively slowly in the buffer region, pH = pKa ± 1, centered at pH = 4.7, where [HA] = [A−]. The hydrogen ion concentration decreases by less than the amount expected because most of the added hydroxide ion is consumed in the reaction
OH− + HA → H2O + A−
and only a little is consumed in the neutralization reaction (which is the reaction that results in an increase in pH)
OH− + H+ → H2O.
Once the acid is more than 95% deprotonated, the pH rises rapidly because most of the added alkali is consumed in the neutralization reaction.
Buffer capacity[edit]
Buffer capacity is a quantitative measure of the resistance to change of pH of a solution containing a buffering agent with respect to a change of acid or alkali concentration. It can be defined as follows:[1][2]
where 
where 
With either definition the buffer capacity for a weak acid HA with dissociation constant Ka can be expressed as[3][4][2]
where [H+] is the concentration of hydrogen ions, and 
Figure 2. Buffer capacity β for a 0.1 M solution of a weak acid with a pKa = 7
This equation shows that there are three regions of raised buffer capacity (see figure 2).
- In the central region of the curve (coloured green on the plot), the second term is dominant, and
Buffer capacity rises to a local maximum at pH = pKa. The height of this peak depends on the value of pKa. Buffer capacity is negligible when the concentration [HA] of buffering agent is very small and increases with increasing concentration of the buffering agent.[2] Some authors show only this region in graphs of buffer capacity.[1] Buffer capacity falls to 33% of the maximum value at pH = pKa ± 1, to 10% at pH = pKa ± 1.5 and to 1% at pH = pKa ± 2. For this reason the most useful range is approximately pKa ± 1. When choosing a buffer for use at a specific pH, it should have a pKa value as close as possible to that pH.[1]
- With strongly acidic solutions, pH less than about 2 (coloured red on the plot), the first term in the equation dominates, and buffer capacity rises exponentially with decreasing pH:
This results from the fact that the second and third terms become negligible at very low pH. This term is independent of the presence or absence of a buffering agent.
- With strongly alkaline solutions, pH more than about 12 (coloured blue on the plot), the third term in the equation dominates, and buffer capacity rises exponentially with increasing pH:
This results from the fact that the first and second terms become negligible at very high pH. This term is also independent of the presence or absence of a buffering agent.
Applications of buffers[edit]
The pH of a solution containing a buffering agent can only vary within a narrow range, regardless of what else may be present in the solution. In biological systems this is an essential condition for enzymes to function correctly. For example, in human blood a mixture of carbonic acid (H
2CO
3) and bicarbonate (HCO−
3) is present in the plasma fraction; this constitutes the major mechanism for maintaining the pH of blood between 7.35 and 7.45. Outside this narrow range (7.40 ± 0.05 pH unit), acidosis and alkalosis metabolic conditions rapidly develop, ultimately leading to death if the correct buffering capacity is not rapidly restored.
If the pH value of a solution rises or falls too much, the effectiveness of an enzyme decreases in a process, known as denaturation, which is usually irreversible.[5] The majority of biological samples that are used in research are kept in a buffer solution, often phosphate buffered saline (PBS) at pH 7.4.
In industry, buffering agents are used in fermentation processes and in setting the correct conditions for dyes used in colouring fabrics. They are also used in chemical analysis[4] and calibration of pH meters.
Simple buffering agents[edit]
-
Buffering agent pKa Useful pH range Citric acid 3.13, 4.76, 6.40 2.1–7.4 Acetic acid 4.8 3.8–5.8 KH2PO4 7.2 6.2–8.2 CHES 9.3 8.3–10.3 Borate 9.24 8.25–10.25
For buffers in acid regions, the pH may be adjusted to a desired value by adding a strong acid such as hydrochloric acid to the particular buffering agent. For alkaline buffers, a strong base such as sodium hydroxide may be added. Alternatively, a buffer mixture can be made from a mixture of an acid and its conjugate base. For example, an acetate buffer can be made from a mixture of acetic acid and sodium acetate. Similarly, an alkaline buffer can be made from a mixture of the base and its conjugate acid.
«Universal» buffer mixtures[edit]
By combining substances with pKa values differing by only two or less and adjusting the pH, a wide range of buffers can be obtained. Citric acid is a useful component of a buffer mixture because it has three pKa values, separated by less than two. The buffer range can be extended by adding other buffering agents. The following mixtures (McIlvaine’s buffer solutions) have a buffer range of pH 3 to 8.[6]
-
0.2 M Na2HPO4 (mL) 0.1 M citric acid (mL) pH 20.55 79.45 3.0 38.55 61.45 4.0 51.50 48.50 5.0 63.15 36.85 6.0 82.35 17.65 7.0 97.25 2.75 8.0
A mixture containing citric acid, monopotassium phosphate, boric acid, and diethyl barbituric acid can be made to cover the pH range 2.6 to 12.[7]
Other universal buffers are the Carmody buffer[8] and the Britton–Robinson buffer, developed in 1931.
Common buffer compounds used in biology[edit]
For effective range see Buffer capacity, above. Also see Good’s buffers for the historic design principles and favourable properties of these buffer substances in biochemical applications.
| Common name (chemical name) | Structure | pKa, 25 °C |
Temp. effect, dpH/dT (K−1)[9] |
Mol. weight |
|---|---|---|---|---|
| TAPS, ([tris(hydroxymethyl)methylamino]propanesulfonic acid) |
 |
8.43 | −0.018 | 243.3 |
| Bicine, (2-(bis(2-hydroxyethyl)amino)acetic acid) |
 |
8.35 | −0.018 | 163.2 |
| Tris, (tris(hydroxymethyl)aminomethane, or 2-amino-2-(hydroxymethyl)propane-1,3-diol) |
 |
8.07[a] | −0.028 | 121.14 |
| Tricine, (N-[tris(hydroxymethyl)methyl]glycine) |
 |
8.05 | −0.021 | 179.2 |
| TAPSO, (3-[N-tris(hydroxymethyl)methylamino]-2-hydroxypropanesulfonic acid) |
 |
7.635 | 259.3 | |
| HEPES, (4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid) |
 |
7.48 | −0.014 | 238.3 |
| TES, (2-[[1,3-dihydroxy-2-(hydroxymethyl)propan-2-yl]amino]ethanesulfonic acid) |
 |
7.40 | −0.020 | 229.20 |
| MOPS, (3-(N-morpholino)propanesulfonic acid) |
 |
7.20 | −0.015 | 209.3 |
| PIPES, (piperazine-N,N′-bis(2-ethanesulfonic acid)) |
 |
6.76 | −0.008 | 302.4 |
| Cacodylate, (dimethylarsenic acid) |
 |
6.27 | 138.0 | |
| MES, (2-(N-morpholino)ethanesulfonic acid) |
 |
6.15 | −0.011 | 195.2 |
- ^ Tris is a base, the pKa = 8.07 refers to its conjugate acid.
Calculating buffer pH[edit]
Monoprotic acids[edit]
First write down the equilibrium expression
HA ⇌ A− + H+
This shows that when the acid dissociates, equal amounts of hydrogen ion and anion are produced. The equilibrium concentrations of these three components can be calculated in an ICE table (ICE standing for «initial, change, equilibrium»).
-
ICE table for a monoprotic acid
[HA] [A−] [H+] I C0 0 y C −x x x E C0 − x x x + y
The first row, labelled I, lists the initial conditions: the concentration of acid is C0, initially undissociated, so the concentrations of A− and H+ would be zero; y is the initial concentration of added strong acid, such as hydrochloric acid. If strong alkali, such as sodium hydroxide, is added, then y will have a negative sign because alkali removes hydrogen ions from the solution. The second row, labelled C for «change», specifies the changes that occur when the acid dissociates. The acid concentration decreases by an amount −x, and the concentrations of A− and H+ both increase by an amount +x. This follows from the equilibrium expression. The third row, labelled E for «equilibrium», adds together the first two rows and shows the concentrations at equilibrium.
To find x, use the formula for the equilibrium constant in terms of concentrations:
Substitute the concentrations with the values found in the last row of the ICE table:
Simplify to
With specific values for C0, Ka and y, this equation can be solved for x. Assuming that pH = −log10[H+], the pH can be calculated as pH = −log10(x + y).
Polyprotic acids[edit]
Polyprotic acids are acids that can lose more than one proton. The constant for dissociation of the first proton may be denoted as Ka1, and the constants for dissociation of successive protons as Ka2, etc. Citric acid is an example of a polyprotic acid H3A, as it can lose three protons.
-
Stepwise dissociation constants
Equilibrium Citric acid H3A ⇌ H2A− + H+ pKa1 = 3.13 H2A− ⇌ HA2− + H+ pKa2 = 4.76 HA2− ⇌ A3− + H+ pKa3 = 6.40
When the difference between successive pKa values is less than about 3, there is overlap between the pH range of existence of the species in equilibrium. The smaller the difference, the more the overlap. In the case of citric acid, the overlap is extensive and solutions of citric acid are buffered over the whole range of pH 2.5 to 7.5.
Calculation of the pH with a polyprotic acid requires a speciation calculation to be performed. In the case of citric acid, this entails the solution of the two equations of mass balance:
CA is the analytical concentration of the acid, CH is the analytical concentration of added hydrogen ions, βq are the cumulative association constants. Kw is the constant for self-ionization of water. There are two non-linear simultaneous equations in two unknown quantities [A3−] and [H+]. Many computer programs are available to do this calculation. The speciation diagram for citric acid was produced with the program HySS.[10]
N.B. The numbering of cumulative, overall constants is the reverse of the numbering of the stepwise, dissociation constants.
-
Relationship between cumulative association constant (β) values and stepwise dissociation constant (K) values for a tribasic acid.
Equilibrium Relationship A3− + H+ ⇌ AH2+ Log β1= pka3 A3− + 2H+ ⇌ AH2+ Log β2 =pka2 + pka3 A3− + 3H+⇌ AH3 Log β3 = pka1 + pka2 + pka3
Cumulative association constants are used in general-purpose computer programs such as the one used to obtain the speciation diagram above.
See also[edit]
- Henderson–Hasselbalch equation
- Buffering agent
- Good’s buffers
- Common-ion effect
- Metal ion buffer
- Mineral redox buffer
References[edit]
- ^ a b c Skoog, Douglas A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2014). Fundamentals of Analytical Chemistry (9th ed.). Brooks/Cole. p. 226. ISBN 978-0-495-55828-6.
- ^ a b c Urbansky, Edward T.; Schock, Michael R. (2000). «Understanding, Deriving and Computing Buffer Capacity». Journal of Chemical Education. 77 (12): 1640–1644. Bibcode:2000JChEd..77.1640U. doi:10.1021/ed077p1640.
- ^ Butler, J. N. (1998). Ionic Equilibrium: Solubility and pH calculations. Wiley. pp. 133–136. ISBN 978-0-471-58526-8.
- ^ a b Hulanicki, A. (1987). Reactions of acids and bases in analytical chemistry. Translated by Masson, Mary R. Horwood. ISBN 978-0-85312-330-9.
- ^ Scorpio, R. (2000). Fundamentals of Acids, Bases, Buffers & Their Application to Biochemical Systems. ISBN 978-0-7872-7374-3.
- ^ McIlvaine, T. C. (1921). «A buffer solution for colorimetric comparaison» (PDF). J. Biol. Chem. 49 (1): 183–186. doi:10.1016/S0021-9258(18)86000-8. Archived (PDF) from the original on 2015-02-26.
- ^ Mendham, J.; Denny, R. C.; Barnes, J. D.; Thomas, M. (2000). «Appendix 5». Vogel’s textbook of quantitative chemical analysis (5th ed.). Harlow: Pearson Education. ISBN 978-0-582-22628-9.
- ^ Carmody, Walter R. (1961). «Easily prepared wide range buffer series». J. Chem. Educ. 38 (11): 559–560. Bibcode:1961JChEd..38..559C. doi:10.1021/ed038p559.
- ^ «Buffer Reference Center». Sigma-Aldrich. Archived from the original on 2009-04-17. Retrieved 2009-04-17.
- ^ Alderighi, L.; Gans, P.; Ienco, A.; Peters, D.; Sabatini, A.; Vacca, A. (1999). «Hyperquad simulation and speciation (HySS): a utility program for the investigation of equilibria involving soluble and partially soluble species». Coordination Chemistry Reviews. 184 (1): 311–318. doi:10.1016/S0010-8545(98)00260-4. Archived from the original on 2007-07-04.
External links[edit]
«Biological buffers». REACH Devices.
Растворы
2. Буферные растворы
Буферные системы – это системы, способные сохранять постоянное значение рН при разбавлении и при добавлении определенных количеств сильных кислот и оснований.
Буферные системы могут быть образованы:
1. слабой кислотой и ее солью (СН3СООН + СН3СООNa; С6Н5СООН + С6Н5СООNa; НСООН + НСООNa;)
2. слабым основанием и его солью (NН4ОН (NН3.Н2О) + NН4С1)
3. кислой и средней солью слабой кислоты (NаНСО3 + Nа2СО3; Nа2НРО4 + Nа3РО4)
4. одно- и двухзамещенной солью слабой кислоты (Nа2НРО4 + NаН2РО4)
Растворы, содержащие буферные смеси, способные вследствие этого противостоять изменению рН, называются буферными растворами.
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.
Буферная емкость – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (понизить при добавлении кислоты и повысить при добавлении щелочи)
|
В |
= |
ν(1/Z*кислоты) |
или |
В |
= |
ν(1/Z*основания) |
|
ΔpH×V |
ΔpH×V |
где V – объем буферного раствора, л.;
ν(1/Z*Х) — количество эквивалента кислоты или щелочи, моль;
ν(1/ Z*Х) = C(1/ Z*Х)×V(Х);
c(1/ Z*Х) – молярная концентрация эквивалента кислоты (щелочи), моль/л;
V(Х) – объем раствора кислоты (щелочи), л;
∆рН – изменение рН после добавления кислоты (щелочи).
Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения между этими концентрациями. С увеличением концентрации компонентов буферной смеси буферная емкость увеличивается. При разбавлении буферной смеси буферная емкость уменьшается.
Буферная емкость максимальна при одинаковых концентрациях соли и кислоты или соли и основания в буферной смеси. Если молярные концентрации эквивалента кислоты и соли равны, то рН буферной смеси будет равен рК к-ты.
Следовательно, для приготовления буферной системы с наибольшей буферной емкостью надо выбирать кислоту с наиболее близкой к заданному значению рН величиной рКк-ты (рН ≈ рКк-ты).
Для смесей, образованных слабым основанием и его солью, рН = 14 – рКосн., т.е. рКосн. ≈ 14 — рН.
Свойства буферных растворов
1. рН буферного раствора зависит от отношения концентраций компонентов буферных систем, а также свойств буферной пары и растворителя.
2. Различные буферные растворы обладают определенной буферной емкостью и сохраняют постоянство рН только до прибавления определенного количества кислоты или щелочи.
3. Буферная емкость тем больше, чем выше концентрация компонентов буферного раствора. Максимальная буферная емкость наблюдается у растворов, которые содержат равные концентрации компонентов буферной пары.
Во внеклеточной и внутриклеточной жидкости существуют четыре основные буферные системы:
– бикарбонатная;
– белковая;
– гемоглобиновая;
– фосфатная.
Главными буферами внеклеточной жидкости является бикарбонатный и гемоглобиновый, в то время как белки и фосфаты — это основные внутриклеточные буферы.
Бикарбонатный буфер является основным и наиболее лабильным внеклеточным буфером. Он состоит из угольной кислоты и бикарбоната (гидрокарбоната) натрия; константой, характеризующей буфер соотношение концентраций кислоты и ее кислой соли.
Внеклеточная буферная система угольной кислоты и гидрокарбоната натрия нейтрализует примерно 40% всех высвобождаемых ионов водорода.
Эта буферная система уникальна тем, что Н2СО3 может диссоциировать на Н2О воду и СО2. В то время как другие буферы быстро становятся неэффективными в результате связывания водородных ионов и анионов слабой кислоты, бикарбонатные системы поддерживают работоспособность в связи с удалением Н2СО3в виде СО2. Лимитирующим параметром эффективности бикарбонатной системы является, по сути дела, начальная концентрация бикарбоната
Гемоглобиновый буфер играет важную роль в регуляции концентрации Н+. Его буферная емкость определяется наличием полярных групп в аминокислотных остатках гемоглобина. Гемоглобин является более важным буфером по сравнению с другими белками, что определяется тремя причинами:
– относительно высокой молярной концентрацией гемоглобина;
– относительно высокой концентрацией в гемоглобине гистидина, рК которого (~7) близко к значению pH крови;
– ролью гемоглобина в транспорте газов крови.
Белковый буфер. Белки, отличные от гемоглобина, представляют собой относительно слабый буфер во внеклеточной жидкости, но в связи с высокой концентрацией белков внутри клеток эта буферная система важна в нейтрализации внутриклеточных сдвигов pH.
Фосфатная буферная пара (НРО2-4 и Н2РО—4) во внеклеточной жидкости представлена в низких концентрациях, но является важной буферной системой мочи.
Буферные системы организма
– Буферы ограничивают изменения pH, вызываемые внесением сильной кислоты или основания.
– Основные буферы внеклеточной жидкости — бикарбонатный и гемоглобиновый.
– Основные буферы внутриклеточной жидкости — белковый и фосфатный.
ПЛОТНОСТЬ ВОДЫ В ИНТЕРВАЛЕ -10÷100 °С
|
t, °С |
ρ·10-3, кг/м3 |
t, °С |
ρ·10-3, кг/м3 |
t, °С |
ρ·10-3, кг/м3 |
t, °С |
ρ·10-3, кг/м3 |
t, °С |
ρ·10-3, кг/м3 |
|
-10 |
0,99815 |
17 |
0,99880 |
24 |
0,99732 |
35 |
0,99406 |
70 |
0,97781 |
|
-5 |
0,99930 |
18 |
0,99862 |
25 |
0,99707 |
40 |
0,99224 |
75 |
0,97489 |
|
0 |
0,99987 |
19 |
0,99843 |
26 |
0,99681 |
45 |
0,99025 |
80 |
0,97183 |
|
4 |
1,00000 |
20 |
0,99823 |
27 |
0,99654 |
50 |
0,98807 |
85 |
0,96865 |
|
5 |
0,99999 |
21 |
0,99802 |
28 |
0,99626 |
55 |
0,98573 |
90 |
0,96534 |
|
10 |
0,99973 |
22 |
0,99780 |
29 |
0,99597 |
60 |
0,98324 |
95 |
0,96192 |
|
15 |
0,99913 |
23 |
0,99756 |
30 |
0,99567 |
65 |
0,98059 |
100 |
0,95838 |
|
16 |
0,99897 |
* Источник: Краткий справочник физико-химических величин. Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой — СПб.: «Иван Федоров», 2003 г. С. 15

Приготовление буферных растворов — распространенная процедура в химических и биохимических лабораториях. Буферный раствор — это смесь слабой кислоты и сопряженного с ней основания или слабого основания и сопряженной с ним кислоты. Буферные растворы позволяют поддерживать стабильный уровень pH другого раствора, смешанного с буферным. Если в раствор попадает небольшое количество другой кислоты или щелочи или они образуются в ходе химической реакции, буферный раствор не допустит изменения значения pH всего раствора. Поэтому буферы очень полезны в разных задачах, где требуется поддержание стабильного уровня pH. Другие названия буферных растворов — также pH-буферы, водород-ионные буферы или просто буферы.
Например, в крови человека содержатся естественные буферы для поддержания рН в диапазоне от 7,35 до 7,45 — именно при таком уровне могут нормально действовать энзимы. Поскольку активность энзимов зависит от pH, при проведении биохимических анализов необходимо поддержание этого параметра на постоянном уровне. Буферные растворы применяются в шампунях для предотвращения раздражения кожи, в детских лосьонах для противодействия росту бактерий, а также в растворах для контактных линз, чтобы уровень pH жидкости оставался совместимым с уровнем рН глаз.
Приготовление буферного раствора состоит из нескольких этапов: взвешивание компонентов, растворение компонентов, корректировка pH и дополнение до заданного объема. Поскольку итоговое значение pH в буфере зависит от соотношения кислоты и основания, чрезвычайно важно взвешивать компоненты с высокой точностью. Все используемое оборудование (весы, пипетки и рН-метр) должно быть правильно откалибровано и иметь достаточную точность.
Видео: приготовление буферного раствора — простота, удобство и точность
Для приготовления буферного раствора нужны время и особая тщательность, иначе раствор не будет действовать так, как требуется. Если качество продукции или биохимических анализов зависит от качества буферных растворов, ошибки при приготовлении буферов недопустимы.
Посмотрите видео и узнайте, как можно сэкономить время и силы, если готовить буферные растворы с помощью технических весов и рН-метров МЕТТЛЕР ТОЛЕДО.
Перейдите в один из следующих разделов, чтобы узнать больше:
- Как готовить буферные растворы? Стандартная процедура.
- Секреты работы с буферными растворами
- Как действуют буферные растворы?
- Разновидности буферных растворов
- На что следует обращать внимание при приготовлении буферного раствора
- Преимущества универсальных буферных растворов
- Дополнительные советы по приготовлению и использованию буферных растворов
- Запросить консультацию по процедурам приготовления буферных растворов
- Сложности при приготовлении буферных растворов
- Специальное решение МЕТТЛЕР ТОЛЕДО для точного и удобного приготовления буферного раствора
- Руководство по эффективному взвешиванию
- Приготовление буферных растворов: оптимизированный рабочий процесс с комплексным управлением данными
- Как обеспечить правильную калибровку pH-метра
- Часто задаваемые вопросы о приготовлении буферных растворов
Как готовить буферные растворы? Стандартная процедура
Приготовление буферного раствора состоит из нескольких этапов: расчет концентрации и количества компонентов в соответствии с назначением и нужным объемом раствора; взвешивание компонентов; растворение компонентов; корректировка pH; дополнение до заданного объема; маркировка и документирование; использование раствора или его сохранение для применения в будущем.
- Выберите рецептуру из базы данных.
- Рассчитайте количество компонентов, указанных в рецептуре, в соответствии с требуемым объемом буферного раствора.
- Взвесьте компоненты и поместите их в сосуд.
- Растворите компоненты в подходящем растворителе (обычно в воде).
- С помощью рН-метра проверьте и скорректируйте значение pH.
- Долейте раствор до необходимого объема.
- Переместите раствор в бутыль для хранения и нанесите на нее соответствующую маркировку.
- Задокументируйте результаты.

Нужна помощь?
Буферные растворы чрезвычайно важны для решения многих практических задач. Однако приготовление буферного раствора требует много времени и сил и должно производиться тщательно, чтобы избежать ошибок. Если вам нужна помощь в приготовлении буферных растворов или при подборе весов с требуемым уровнем точности, проконсультируйтесь с экспертами МЕТТЛЕР ТОЛЕДО. В случае сомнений обратитесь к специалистам.

Сложности при приготовлении буферных растворов
Хотя простейший буферный раствор состоит только из кислоты, основания и воды, лаборантам часто приходится готовить по несколько буферных растворов в день. Обычно буферы состоят из 2–5 компонентов, но иногда их количество достигает 20. В обычной лаборатории может быть более 20 рецептур, рассчитанных на приготовление одного литра буферного раствора.
Расчеты буферных растворов
Если в базе данных содержится несколько десятков рецептур для буферных растворов, лаборанту нужно сначала удостовериться, что рецептура выбрана правильно. Если нужный объем буферного раствора отличается от одного литра, необходимо пересчитать количество всех компонентов и записать в журнал новые значения. Ошибки в вычислениях или при записи новых значений могут привести к неправильному уровню pH в буферном растворе. При ручной системе записи данных риск ошибок выше.
Взвешивание и запись результатов взвешивания
При взвешивании компонентов буферного раствора необходимо строго следить за соответствием типа и количества компонентов. Фактическую массу всех компонентов нужно записывать в журнал. Если запись результатов выполняется вручную или вводом значений в компьютер, необходимо внимательно следить за отсутствием ошибок.
Возможно, придется использовать несколько весов в зависимости от требуемой массы компонентов буферного раствора и минимальной массы, с которой могут работать весы. Это усложняет процесс и снижает эффективность.
Правильная работа с рН-метрами
Проверка уровня pH буферного раствора чрезвычайно важна. Но если рН-метр не откалиброван и не поддерживается в надлежащем состоянии, измерения рН могут быть неточными. Использование буферного раствора с неправильным pH может серьезно повлиять на последующий анализ или качество продукта.
Документация
Полученный буферный раствор должен быть правильно промаркирован. На этикетке нужно указать все данные, необходимые для предотвращения ошибок. Важно знать срок годности, чтобы буферный раствор сохранял эффективность. Все данные, связанные с приготовлением буферного раствора, нужно внести в журнал. Эта информация должна храниться для справки и обеспечения прослеживаемости.

Специальное решение МЕТТЛЕР ТОЛЕДО для точного и удобного приготовления буферного раствора
Технические весы МЕТТЛЕР ТОЛЕДО XSR упрощают приготовление буферных растворов и значительно снижают нагрузку на лаборантов.
Хранение рецептур
Непосредственно на весах можно хранить до 50 рецептур буферных растворов в виде методов взвешивания. Сохранив на весах наиболее часто используемые рецептуры буферных растворов, можно быстро найти нужный метод и начать работу. Весы выдают пошаговые инструкции, поэтому лаборантам легко следить за тем, на каком этапе приготовления буферного раствора они находятся.
Автоматические расчеты и подсказки по взвешиванию
При запуске метода вводится требуемый объем буферного раствора, и массы компонентов рассчитываются автоматически. В ходе взвешивания компонентов на индикаторе SmartTrac графически отображается соответствие фактической массы целевому значению. Цветная полоска становится зеленой, как только масса добавляемого компонента войдет в заданный диапазон допусков. Это позволяет специалистам быстрее и точнее дозировать компоненты.
Эффективные процессы и автоматическая регистрация данных
После добавления каждого компонента весы регистрируют фактический результат взвешивания, а затем выполняют автоматическое тарирование. Записывать результаты вручную не нужно, поэтому эффективность работы повышается. Весы можно настроить на автоматическую печать результатов взвешивания после добавления всех компонентов.
Удобное измерение pH
pH-метры SevenExcellence МЕТТЛЕР ТОЛЕДО — лучший выбор для точного измерения pH. В этих удобных приборах с сенсорным управлением предусмотрена возможность прямого измерения одним нажатием кнопки и реализована технология цифрового управления датчиками (ISM).
Точность измерения рН определяется качеством буферных растворов, используемых для калибровки. МЕТТЛЕР ТОЛЕДО предлагает большой выбор калибровочных буферных растворов высокого качества для самых разных задач.

Guide: Biological Buffer Preparation
Discover how you can make your buffer preparation process easy and reliable.
Download the guide and get useful tips and hints to help improve the productivity of your preparation process, ensure quality standards and traceability for buffer solutions.
- Step-by-step SOP user guidance and accessible buffer recipes directly on the balance screen improves workflows
- Accurate weighing in compounds is vital for the quality of buffer solutions
- Exact and reliable pH measurement is important for the correct preparation of buffers
- Using and operating pipettes the correct way helps to ensure that pH buffer is properly adjusted
- Automatic calculation, labeling and reporting ensure safe data transfer and data traceability

Приготовление буферных растворов: оптимизированный рабочий процесс с комплексным управлением данными
Технические весы МЕТТЛЕР ТОЛЕДО Excellence (XPR и XSR) и pH-метры SevenExcellence можно подключить к фирменному лабораторному ПО LabX и создать полностью оптимизированную систему, обладающую рядом важных преимуществ:
- Автоматические расчеты и документирование
- Все результаты сохраняются в защищенной базе данных.
- Полная прослеживаемость
- Централизованное управление задачами, пользователями и приборами.
Соответствие требованиям части 11 раздела 21 CFR (Свода федеральных постановлений США)
LabX обеспечивает полное управление данными, практически исключая их ручную регистрацию. В автоматическом режиме можно даже печатать этикетки с подробной информацией. Благодаря централизованной базе данных все подключенные пользователи и приборы имеют доступ к одним и тем же сохраненным СОП для приготовления буферных растворов. Таким образом, все лаборанты будут выполнять приготовление буферных растворов с одними и теми же настройками и параметрами. Все результаты и метаданные процесса автоматически сохраняются в защищенной базе данных, что обеспечивает полную прослеживаемость.

Как обеспечить правильную калибровку pH-метра
Для точной калибровки рН-метра нужны качественные калибровочные буферные растворы с известным уровнем рН. МЕТТЛЕР ТОЛЕДО предлагает ряд качественных буферных растворов, в том числе максимально точные растворы, соответствующие требованиям NIST/DIN.
Буферные растворы поставляются с сертификатами испытаний, которые помогут обеспечить соответствие нормативным требованиям и прослеживаемость. В ассортименте МЕТТЛЕР ТОЛЕДО найдутся буферные растворы для любых задач — как технические буферы, так и растворы, сертифицированные аккредитованными организациями.
Часто задаваемые вопросы о приготовлении буферных растворов
Выберите вопрос:
- Что такое анализатор влажности?
- Как работает анализатор влажности?
- Какой анализатор влажности лучше всего подойдет для моих задач?
- Что необходимо учитывать при выборе анализатора влажности?
- Почему при выборе анализатора влажности важно учитывать тип образца?
1. Как повысить эффективность взвешивания при приготовлении буферных растворов?
Пользователи могут сохранять собственные методы взвешивания на весах МЕТТЛЕР ТОЛЕДО XPR/XSR. Для приготовления буферных растворов подходит метод «Простое взвешивание по рецептурам с шаблоном». На весах в виде рецептуры хранятся данные о всех компонентах раствора с заданной массой и интервалом допуска. После запуска метода весы будут выдавать указания по каждому этапу процедуры. Не нужно постоянно сверяться с рецептурой, а этапы процедуры невозможно перепутать. Результаты взвешивания сохраняются автоматически и в конце могут быть распечатаны. Можно сэкономить время, избавившись от необходимости записывать все результаты взвешивания вручную.
2. Какие весы лучше всего подходят для приготовления буферных растворов?
Выбор весов зависит от индивидуальных требований. Нужно знать минимальную и максимальную массу взвешиваемых компонентов, а также требуемую точность взвешивания (допуски или допустимые погрешности). МЕТТЛЕР ТОЛЕДО предлагает бесплатную услугу по подбору весов с учетом специфики применения. Бесплатную рекомендацию по весам можно получить у местного представителя МЕТТЛЕР ТОЛЕДО. В рамках этой же услуги можно определить, соответствуют ли требованиям имеющиеся весы.
- GWP Recommendation
3. При приготовлении буферного раствора нужно записывать очень много данных. Как избежать ошибок? Нужно найти безошибочное решение.
Прежде всего подключите к весам сканер штрихкодов. Это позволит в электронном виде регистрировать идентификаторы образцов, номера партий, номера заказов и т. д. Во-вторых, подключите к весам принтер. В конце процедуры взвешивания принтеры МЕТТЛЕР ТОЛЕДО P-5x могут автоматически распечатывать результаты, метаданные, а также дату и время. Другой вариант — подключить весы к лабораторному программному обеспечению LabX, которое обеспечивает комплексное управление данными, включая создание настраиваемых отчетов, которые можно отправлять прямо в системы LIMS или ERP.
4. Как обеспечить надежность при измерении pH буферного раствора?
Показания рН-метра будут точными, если прибор регулярно проходит калибровку и проверку. Ознакомьтесь с руководством МЕТТЛЕР ТОЛЕДО и решениями для калибровки рН-метров. Посмотрите видео «Калибровка pH-метров — удобное руководство».
5. Что делать, если компонент был добавлен в большем объеме, чем нужно?
Если вы случайно добавили слишком большое количество какого-то компонента, необязательно выбрасывать всю смесь. Можно добавить к ней дополнительное количество других компонентов. Но при ручном расчете объемов это может быть непросто, и риск ошибок высок. Не исключено также, что потребуется добавить очень небольшое количество вещества, и имеющиеся весы не подойдут для его взвешивания. Могут потребоваться вторые весы с более высокой точностью и меньшей минимальной массой. Если весы подключены к LabX, то ПО сможет выполнить все необходимые перерасчеты и проследить за ходом процедуры.

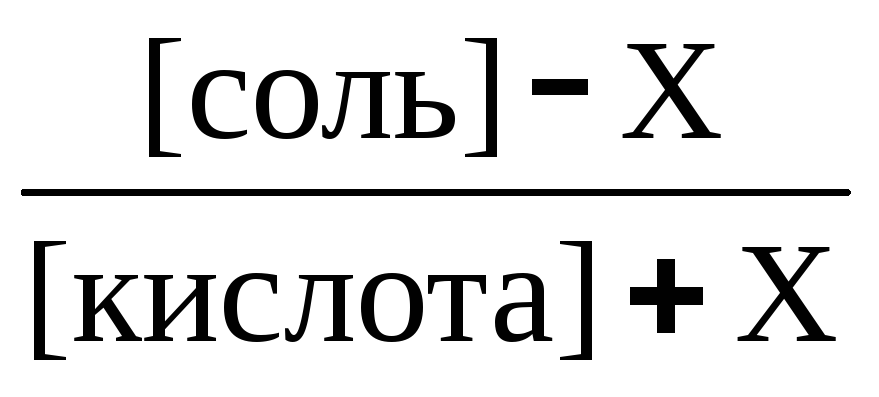




![{displaystyle beta =2.303left([{ce {H+}}]+{frac {T_{{ce {HA}}}K_{a}[{ce {H+}}]}{(K_{a}+[{ce {H+}}])^{2}}}+{frac {K_{text{w}}}{[{ce {H+}}]}}right),}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bf8b7c2c34d12f8145df3299a061593aaa76643a)

![{displaystyle beta approx 2.303{frac {T_{{ce {HA}}}K_{a}[{ce {H+}}]}{(K_{a}+[{ce {H+}}])^{2}}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec0e3ba9d065bfb822350b58e375d1f4630c6235)


![{displaystyle K_{text{a}}={frac {[{ce {H+}}][{ce {A-}}]}{[{ce {HA}}]}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/89cb17f8ab679cc14a5d23888ed230c1a71b7384)



![{displaystyle {begin{aligned}C_{{ce {A}}}&=[{ce {A^3-}}]+beta _{1}[{ce {A^3-}}][{ce {H+}}]+beta _{2}[{ce {A^3-}}][{ce {H+}}]^{2}+beta _{3}[{ce {A^3-}}][{ce {H+}}]^{3},\C_{{ce {H}}}&=[{ce {H+}}]+beta _{1}[{ce {A^3-}}][{ce {H+}}]+2beta _{2}[{ce {A^3-}}][{ce {H+}}]^{2}+3beta _{3}[{ce {A^3-}}][{ce {H+}}]^{3}-K_{text{w}}[{ce {H+}}]^{-1}.end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/611bf20542dfc1dbd8256ee6465883f1534f527a)