Контрольный срез за I полугодие в 10 классе
Вариант 1
А1. Составьте электронную формулу атома элемента с порядковым номером 7. Распределите электроны по энергетическим ячейкам и ответьте, возможно ли для него возбужденное состоя ние: 1) да; 2) нет; 3) возможно после ионизации?
А2. В молекуле какого вещества степень окисления атома фосфора наименьшая:
1) Н3РО4; 2) НзР03; 3) НР03; 4) Н3Р02; 5)Н4Р2О7?
А3. Определите, в каких соединениях существует ионная связь. Укажите правильный ответ: а) хлор С12; б) хлорид натрия NaCl; в) аммиак NH3;
г) сульфид калия K2S.
А4. Укажите гомогенную систему:
- СаСОз = СаО + С02
- С02 + С = 2СО
- 2СО + 02 = 2С02
- С + 02 = С02
А5. При какой температуре начинают разрушаться водородные связи в воде:
1) 70 °С; 2) 90 °С; 3) 100 °С; 4) 1000 °С?
А6. В какую сторону сместится равновесие N204=2N02 при повышении давления:
1) вправо; 2) влево; 3) не сместится?
А7. Вещество, при электролитической диссоциации 1 моль ко торого образуется равное число положительных и отрица тельных ионов, — это:
1)СаС12; 2)FeCl3; 3)NH4C1; 4) K2S04. Напишите уравнение диссоциации этого вещества.
А8. Какой электролит при диссоциации образует только ОН— ионы:
1) Н20; 2) Zn(OH)2; 3) NaOH, 4) СН3СООН?
В1. Вычислите массовую долю (%) соли в растворе, содер жащем 50 г соли и 200 г воды.
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид фосфора (V) А) бескислородная кислота
2) гидроксид алюминия Б) щелочь
3) гидросульфид натрия В) кислотный оксид
4) сернистая кислота Г) амфотерный гидроксид
Д) кислородсодержащая кислота
Е) кислая соль
С. Перечислите и охарактеризуйте типы химической связи, приведите примеры.
Контрольный срез за I полугодие в 10 классе
Вариант 2
А1. Составьте электронную формулу атома хлора, рас пределите электроны по энергетическим ячейкам. Укажи те число электронных пар в атоме, находящемся в нор мальном состоянии.
А2. Степени окисления атомов марганца в соединениях MnO, MnO2, Mn2O7 последовательно записаны в ряду:
1) +7, +2, +4 3) +4, +2, +7
2) +2, +4, +7 4) +2, +7, +4
А3. В какой из приведенных молекул образуется преи мущественно ионная связь: 1) CuCI2; 2) NaCl; 3) S02C12; 4) СО? Ответ поясните.
А4. Какая из приведенных систем гетерогенная:
- 2НВг = Н2 + Вг2
- 4Н20 + 3Fe = 4Н2 + Fe304
- N204=2N02
- 2СО + 02 = 2C02
А5. Как изменит положительный катализатор скорость реакции 1) понизит; 2) не изменит; 3) повысит?
А6. В какую сторону сместится равновесие в системе Н2 + I2= 2НI
при увеличении давления вдвое:
1) вправо; 2) влево; 3) не сместится?
А7. Установите соответствие:
формула вещества число ступеней
электролитической диссоциации
- Н3Р04 Б) NaHC03 1) одна 2) три 3) две
- НС1 Г) HN03
Напишите уравнения диссоциации вещества, диссоциирую щего по трем ступеням.
А8. В каком случае реакция пойдет до конца:
1) MgS04+Ba(N03)2;
2) MgCl2+Ba (N03) 2;
3) BaCl2+Mg(N03)2;
4) BaS04 + Mg(N03)2?
В1. Смешали 200 г раствора с массовой долей растворенного вещества 1 % и 50 г раствора с массовой долей 4 %. Вычислите массовую долю полученного раствора.
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) гидрокарбонат натрия А) кислородсодержащая кислота
2) оксид фосфора (V) Б) кислая соль
3) фосфат кальция В) несолеобразующий оксид
4) оксид стронция Г) кислотный оксид
Д) средняя соль
Е) основной оксид
С. Перечислите и охарактеризуйте типы кристаллических решеток. Приведите примеры.
Контрольный срез за I полугодие в 10 классе
Вариант 3
А1. В каком из приведенных рядов элементов электроотрицательность возрастает (слева направо):
- F—C1 — Вг- I;
- Li -Na -K — Rb;
- S—Se —Te — Po;
- Si—P -S —CI?
А2. Степень окисления +4 атом углерода имеет в каждом из соединений
ряда:
- CH4, Al4C3, CS2 3 )CCl4, Na2CO3, CO2
- Na2CO3, CO, CCl4 4 )CO, CaCO3, C2H6
А3. Между атомами, каких элементов возникает ионная связь:
1) между атомами металлов; 2) между атомами металлов и неметаллов;
3) между атомами неметаллов?
А4. Какой реакции соответствует выражение v = k{02}:
- C + 02= C02
- N2 + 02 = 2NO
- 2H2 + 02 = 2H20
А5. Как следует изменить давление, чтобы равновесие в системе сместить вправо: 2СО + 02=2С02 1) повысить; 2) понизить; 3) не изменять?
А6. Как влияет катализатор на смещение химического равновесия:
1) усиливает; 2) уменьшает; 3) не влияет?
А7. Сильными электролитами являются обе кислоты:
а) СН3СООН и НС1; в) Н3Р04 и HN03; 6)H2S04, H2S; г)НС1, H2S04.
Напишите уравнения электролитической диссоциации этих кислот.
А8. В каком случае реакция между ионами не протекает:
1) Ag+ + CI—; 2) Са2+ + СО3-; 3) К+ + РО4; 4) Ва2++ SO2-; 5) Zn2+ + PO4?
В1. Какую массу воды следует прибавить к раствору гидроксида калия массой 150 г с массовой долей 2 %, чтобы получить раствор с массовой долей 1 %?
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) гидросиликат калия А) щелочь
2) оксид серы (VI) Б) основной оксид
3) гидроксид алюминия В) кислотный оксид
4) оксид бария Г) амфотерный гидроксид
Д) средняя соль
Е) кислая соль
С. Дайте определение гомогенных и гетерогенных реакций. Напишите формулы для вычисления средней скорости реакций, чему равна молярная концентрация.
Контрольный срез за I полугодие в 10 классе
Вариант 4
А1. Какой из приведенных элементов относится к d-элементам:
1) Са; 2) Zn; 3) Ga; 4) Ge; 5) Rb?
А2. Степени окисления азота в соединениях (NH4)2SO4, KNO3, NO последовательно записаны в ряду:
1) +2, -3, +5 3) +5, -3, +2
2) -3, +5, +2 4) -3, +2, +5
А3. В каком веществе образуется металлическая связь:
1) I2(к); 2) Р4(к); 3) S8(k); 4) Си(к)?
А4. Как влияет повышение температуры на скорость химических реакций:
1) увеличивает; 2) понижает; 3) не изменяет?
А5. B каком случае скорость реакции будет зависеть от концентрации обоих взаимодействующих веществ:
- С + 02 = С02
- СО + 02 = С02
- С02 + С = СО
А6. Как изменится скорость реакции 2NO + 02 = 2N02
если увеличить концентрацию N0 в 3 раза?
1) возрастет в 27 раз; 2) понизится в 27 раз; 3) воз растет в 9 раз?
А7. Сильными электролитами являются оба основания: а)Ва(ОН)2 и NH4OH; в) КОН и Ва(ОН)2; б) Mg(OH)2 и Са(ОН)2; г) NaOH и Mg(OH)2. Напишите уравнения электролитической диссоциации этих оснований.
А8. Какие ионы совместно могут находиться в растворе:
1) Na+ и ОН—; 2) Zn2+ и ОН—; 3) А13+ и ОН—; 4) Си+ и ОН—?
В1. Вычислите молярную концентрацию раствора серной кислоты, содержащего 5 г кислоты в 300см3
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) оксид углерода (IV) А) кислородсодержащая кислота
2) гидросульфат натрия Б) кислая соль
3) оксид кальция В) несолеобразующий оксид
4) карбонат меди (II) Г) кислотный оксид
Д) средняя соль
Е) основной оксид
С. Как влияет температура на скорость химической реакции. Правило Вант-Гоффа.
Контрольный срез за I полугодие в 10 классе
Вариант 5
А1. У какого атома большее число неспаренных элек тронов в нормальном состоянии:
1) Na; 2) Si; 3) Р; 4) S; 5) С1?
А2. Степень окисления +4 атом серы имеет в каждом из соединений ряда:
1)Na2SO3, SO2, H2SO3 3) H2SO4, MgSO4, SO2
- SO, H2S, CaSO3 4) SCl2, H2SO4, SO2
А3. В какой из приведенных молекул связь полярная ковалентная: 1) Н2; 2) 02; 3) О3; 4) Н20? Составьте схемы строения молекул.
А4. Во сколько раз возрастает скорость реакции при повышении температуры на 50 °С? Температурный коэф фициент равен 2.
А5. В какую сторону сместится равновесие реакции 2S02 + 02=2S03; Q = -192 кДж при понижении температуры:
1) влево; 2) вправо; 3) не сместится?
А6. Как следует изменить концентрацию СО2, чтобы сместить равновесие
2СО = СО2 + С вправо:
1) понизить; 2) повысить; 3) не изменять?
А7. Слабыми электролитами являются вещества ряда:
а) НС104, NaOH, КНС03; в) H2C03, Mg(OH)2, NH4OH;
б) НС1, NaCl, HF; г) H2S04, Mg(HS04)2, КОН.
Напишите уравнения электролитической диссоциации ве ществ этого ряда.
А8. Запишите отдельно вещества электролиты и неэлектролиты: НСI, СаО, Al2(S04)3, Fe203, NaOH, C02, Ba(OH)2, Ca(N03)2, P2O5, Н20, H2Se04.
В1. Вычислите молярную концентрацию растворенного вещества в растворе с массовой долей гидроксида калия 60%. Плотность которого равна 1, 54 г/см3
В2. Установите соответствие между названием вещества и классом неорганических соединений, к которому оно принадлежит:
Название вещества Класс соединений
1) гидрокарбонат натрия А) бескислородная кислота
2) серная кислота Б) щелочь
3) гидроксид алюминия В) кислотный оксид
4) оксид серы (VI) Г) амфотерный гидроксид
Д) кислородсодержащая кислота
Е) кислая соль
С. Дайте определение – обратимые и необратимые реакции. Принцип Ле Шателье.
-
Влияние катализатора на скорость химических реакций
Вещества,
которые участвуют в реакциях и увеличивают
ее скорость, оставаясь к концу реакции
неизменными, называются катализаторами.
Явление
изменения скорости реакции под действием
таких веществ называется катализом.
Реакции, протекающие под действием
катализаторов, называются каталитическими.
В
большинстве случаев действие катализатора
объясняется тем, что он снижает энергию
активации реакции. В присутствии
катализатора реакция проходит через
другие промежуточные стадии, чем без
него, причем эти стадии энергетически
более доступны. Иначе говоря, в присутствии
катализатора возникают другие
активированные комплексы, причем для
их образования требуется меньше энергии,
чем для образования активированных
комплексов, возникающих без катализатора.
Таким образом, энергия активации резко
понижается: некоторые молекулы, энергия
которых была недостаточна для активных
столкновений, теперь оказываются
активными.
Для
ряда реакций промежуточные соединения
изучены; как правило, они представляют
собою весьма активные нестойкие
продукты.
Механизм
действия катализаторов связан с
уменьшением энергии активации реакции
за счет образования промежуточных
соединений. Катализ можно представить
следующим образом:
А + К = А*
А*
+ В = С + D
+ К,
где
А*
— промежуточное активированное соединение.
В
химической промышленности катализаторы
применяются весьма широко. Под влиянием
катализаторов реакции могут ускоряться
в миллионы раз и более. В некоторых
случаях под действием катализаторов
могут возбуждаться такие реакции,
которые без них в данных условиях
практически не протекают.
Различают
гомогенный
и гетерогенный катализ.
В
случае гомогенного
катализа
катализатор и реагирующие вещества
образуют одну фазу (газ или раствор). В
случае гетерогенного
катализа
катализатор находится в системе в виде
самостоятельной фазы.
Примеры
гомогенного катализа:
1.
окисление SO2
+ 1/2O2
= SO3
в присутствии NO.
NO
легко окисляется до NO2,
а NO2
уже окисляет SO2;
2.
разложение пероксида водорода в водном
растворе на воду и кислород. Ионы Сг2О2=7,
WO2-4,
МоО2-4,
катализирующие разложение пероксида
водорода, образуют с ним промежуточные
соединения, которые далее распадаются
с выделением кислорода.
Гомогенный
катализ осуществляется через промежуточные
реакции с катализатором и в результате
происходит замена одной реакции с
высокой энергией активации, несколькими,
у которых энергии активации ниже,
скорость их выше:
CO
+ 1/2O2
= CO2
(катализатор — пары воды)
Широкое
применение в химической промышленности
находит гетерогенный катализ. Большая
часть продукции, вырабатываемой в
настоящее время этой промышленностью,
получается с помощью гетерогенного
катализа. При гетерогенном катализе
реакция протекает на поверхности
катализатора. Отсюда следует, что
активность
катализатора зависит от величины и
свойств его поверхности. Для того чтобы
иметь большую («развитую») поверхность,
катализатор должен обладать
пористой структурой или находиться в
сильно раздробленном (высокодисперсном)
состоянии. При практическом применении
катализатор обычно наносят на носитель,
имеющий пористую структуру (пемза,
асбест и др.).
Как
и в случае гомогенного катализа, при
гетерогенном катализе реакция протекает
через активные промежуточные соединения.
Но здесь эти соединения представляют
собой поверхностные соединения
катализатора с реагирующими веществами.
Проходя через ряд стадий, в которых
участвуют эти промежуточные соединения,
реакция заканчивается образованием
конечных продуктов, а катализатор в
результате не расходуется.
Все
каталитические гетерогенные реакции
включают в себя стадии адсорбции и
десорбции.
Каталитическое
действие поверхности сводится к двум
факторам: увеличение концентрации на
границе раздела и активирование
адсорбированных молекул.
Примеры гетерогенного
катализа:
2H2O
= 2H2O
+ O2
(катализатор – MnO2,)
Н2
+ 1/2 О2
= Н2О
(катализатор — платина)
Очень
большую роль играет катализ в биологических
системах. Большинство химических
реакций, протекающих в пищеварительной
системе, в крови и в клетках животных и
человека, являются каталитическими
.реакциями. Катализаторы, называемые в
этом случае ферментами, представляют
собою простые или сложные белки. Так,
слюна содержит фермент птиалин, который
катализирует превращение крахмала в
сахар. Фермент, имеющийся в желудке, —
пепсин — катализирует расщепление
белков. В организме человека находится
около 30 000 различных ферментов: каждый
из них служит эффективным катализатором
соответствующей реакции.
Селективность
действия катализатора – продукты
реакции могут быть разными в зависимости
от того, каким катализатором мы пользуемся.
Резко
замедлить протекание нежелательных
химических процессов в ряде случаев
можно добавляя в реакционную среду
ингибиторы
(явление «отрицательного катализа»).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
682
Создан на
11 января, 2022 По Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите все реакции, для которых увеличение давления приводит к увеличению скорости реакции.
1) 2Fe(тв) + 3Cl2(г) = 2FeCl3(тв)
2) 4FeS2(тв) + 11O2(г) = 2Fe2O3(тв) + 8SO2(г)
3) Fe + S = FeS
4) Zn(тв) + 2H+(р-р) = Zn2+(р-р) + H2(г)
5) Мg(тв) + 2HBr(р-р) = MgBr2(р-р) + H2(г)
Запишите номера выбранных ответов.
2 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между оксидом меди(II) и соляной кислотой.
1) измельчение оксида меди(II)
2) понижение температуры
3) добавление воды
4) увеличение концентрации HCl
5) повышение давления в системе
Запишите номера выбранных ответов.
3 / 10
Из предложенного перечня выберите все реакции, для которых измельчение твёрдого вещества приводит к увеличению скорости реакции.
1) Cl2 + H2 = 2HCl
2) 2C2H2 + 5O2 = 4CO2 + 2H2O
3) Fe + S = FeS
4) Zn + 2HCl = ZnCl2 + H2
5) CO + 2H2 = CH3OH
Запишите номера выбранных ответов.
4 / 10
Из предложенного перечня выберите все внешние воздействия, которые уменьшают скорость химической реакции между цинком и раствором сульфата меди(II).
1) нагревание реакционной смеси
2) добавление воды
3) охлаждение реакционной смеси
4) использование индикатора
5) уменьшение давления
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня выберите все внешние воздействия, которые приведут к уменьшению скорости реакции между цинком и раствором серной кислоты.
1) понижение давления
2) добавление воды
3) увеличение концентрации кислоты
4) измельчение цинка
5) понижение температуры
Запишите номера выбранных ответов.
6 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к уменьшению скорости реакции этилена с водородом.
1) понижение температуры
2) увеличение концентрации этилена
3) использование катализатора
4) уменьшение концентрации водорода
5) повышение давления в системе
Запишите номера выбранных ответов.
7 / 10
Из предложенного списка химических реакций выберите все, скорость которых увеличивается при повышении давления
1) N2 + 3H2 = 2NH3
2) CO + 2H2 = CH3OH
3) Zn + 2HCl = ZnCl2 + H2
4) 2Na + S = Na2S
5) C + Si = SiC
8 / 10
Из предложенного списка химических реакций выберите те, скорость которых уменьшается при понижении концентрации кислоты.
1) Ca + 2HCl = CaCl2 + H2
2) H2O + N2O5 = 2HNO3
3) C6H6 + HNO3 = C6H5NO2 + H2O
4) NH4H2PO4 = NH3 + H3PO4
5) SO3 + H2O = H2SO4
9 / 10
Из предложенного перечня выберите все способы увеличить скорость пиролиза октана в газовой фазе
1) увеличение объёма реактора
2) увеличение концентрации октана
3) увеличение общего давления в системе
4) нагревание
5) уменьшение концентрации водорода
10 / 10
Из предложенного перечня выберите все внешние воздействия, которые приводят к уменьшению скорости реакции азота с водородом.
1) понижение температуры
2) использование катализатора
3) уменьшение концентрации азота
4) увеличение концентрации водорода
5) уменьшение концентрации аммиака
Запишите номера выбранных ответов.
Ваша оценка
Средний балл 39%
Вещества, как и люди, могут передвигаться пешком, а могут ездить на такси. О том, как это происходит, расскажем в этой статье.
На этой странице вы узнаете
- Катализатор – ваш лучший друг?
- Что общего у реагентов и продавцов-консультантов из магазина одежды?
- Можно ли пантеру превратить в черепаху?
Химические реакции на ускорении
Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
Важно понять, от чего может зависеть скорость химической реакции. Есть шесть основных факторов:
- наличие катализатора,
- температура,
- концентрация реагентов,
- давление,
- площадь соприкосновения реагентов,
- природа реагентов.
От чего зависит скорость реакции
- От наличия катализатора (k)
Всё понятно, кроме одного: что же такое катализатор?
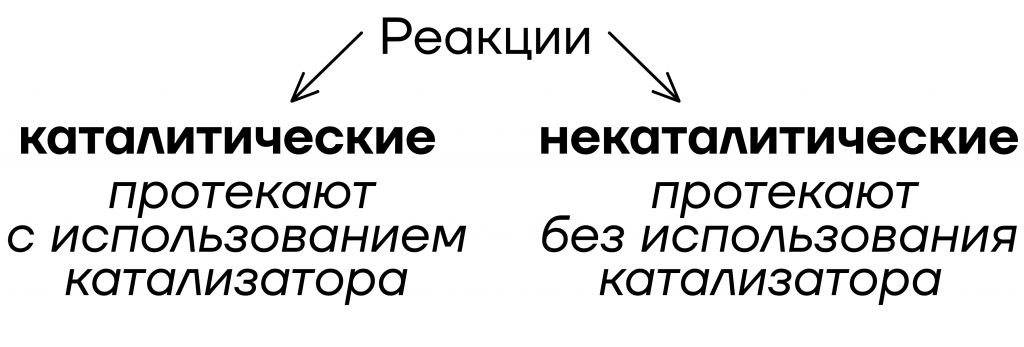
Катализатор – вещество, которое ускоряет реакцию, но не расходуется в процессе.
Представьте, что вы пришли на вечеринку, где никого не знаете. Как вы себя чувствуете? Наверное, немного неловко!
Вы решили вспомнить несколько анекдотов. Общаться будет намного проще, то есть юмор послужил ускорителем вашего разговора с кем-то! Но запас шуток имеет свойство заканчиваться, поэтому назвать его катализатором мы не можем!
Теперь давайте представим, что на вечеринке вы встретили лучшего друга. Вдвоём легче знакомиться, не так страшно, согласитесь. Получается, что друг – катализатор вашего общения с кем-то, ведь он не расходуется в процессе в отличие от алкоголя!
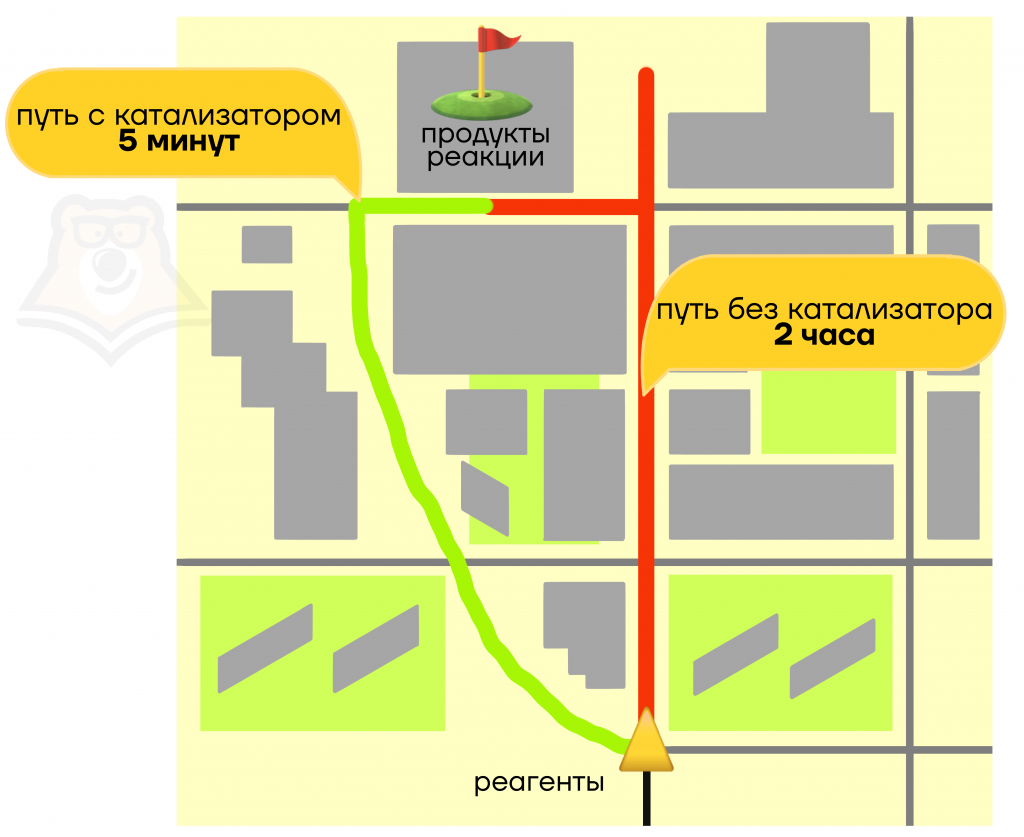
У катализатора есть своя реакция, которую он вызывает. Каталитическая реакция – это реакция которая протекает быстрее обычной за счет использования катализатора.
Если перевести это на человеческий язык, то люди пешком (без катализатора) идут медленнее, чем едут на такси (с катализатором).
У катализатора есть двойник с абсолютно обратными характеристиками – ингибитор. Раз катализатор увеличивает скорость реакции, значит, ингибитор будет её уменьшать.
Важно! Если реакция некаталитическая, то добавление катализатора не будет влиять на скорость реакции.
- От температуры (t)

Важно понимать, что молекулы/частицы при нагревании начинают быстрее двигаться и чаще сталкиваться.
Представим, что мы лежим на пляже. Если погода облачная, то нам тепло, а если погода ясная, нам становится жарче (увеличивается температура тела), и тем быстрее мы загораем или обгораем (скорость реакции увеличивается).
- От концентрации реагентов
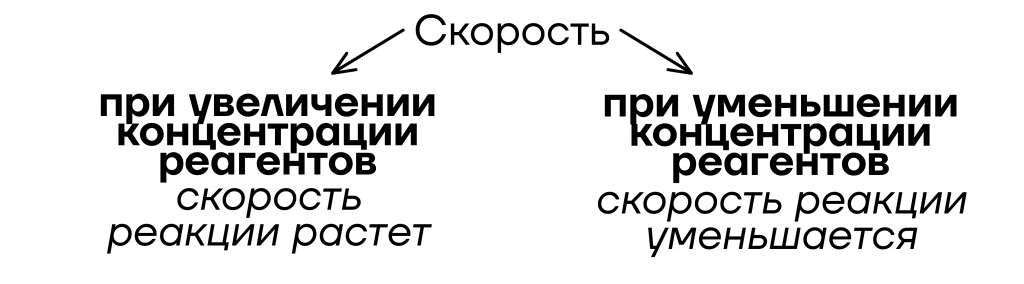
Уточнение: только для жидкостей и газов
Важно! Понятие концентрации распространяется только на газы и жидкости, то есть добавление твердого вещества обычно не влияет на скорость реакции.
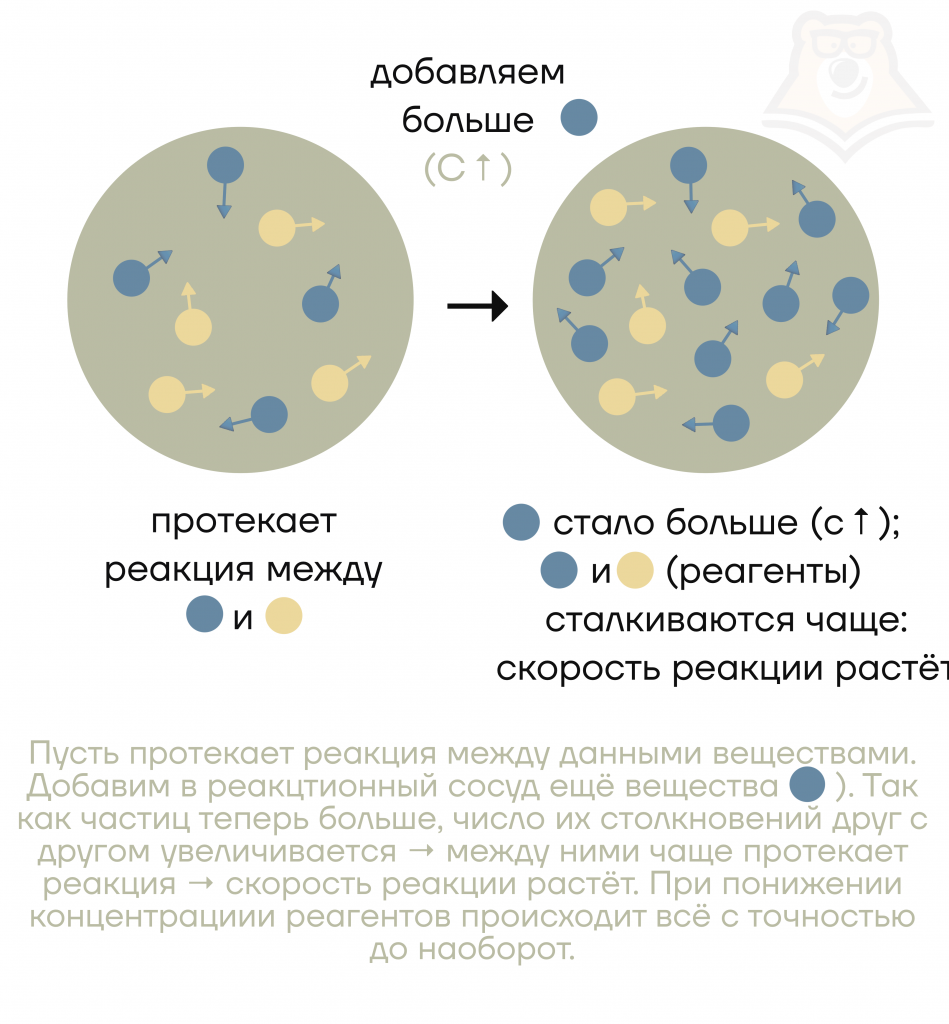
Почему добавление твердого вещества чаще всего не влияет на скорость реакции?
Потому что при добавлении твердого вещества увеличение концентрации реагента не произойдет. А без реагентов реакция не захочет разогнаться и скорость останется неизменной.
- От давления
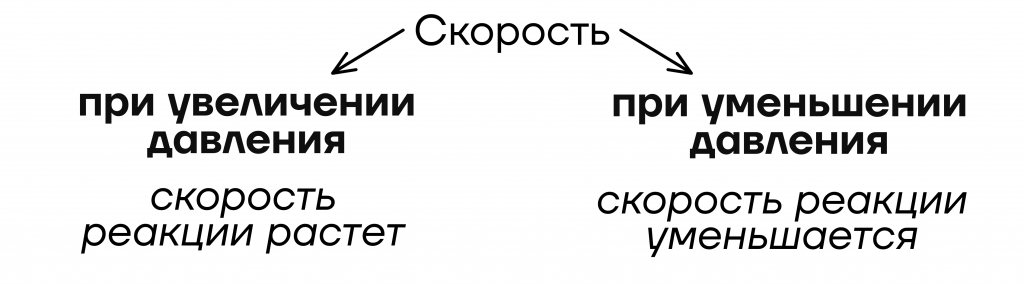
Уточнение: только для газов
Важно! Так как газы – это единственные по агрегатному состоянию вещества, которые способны распределяться по всему объему реакционного сосуда, то изменение давления будет влиять только на них.
Значит, если в реагентах есть хотя бы один газ – изменение давления будет влиять на скорость реакции.
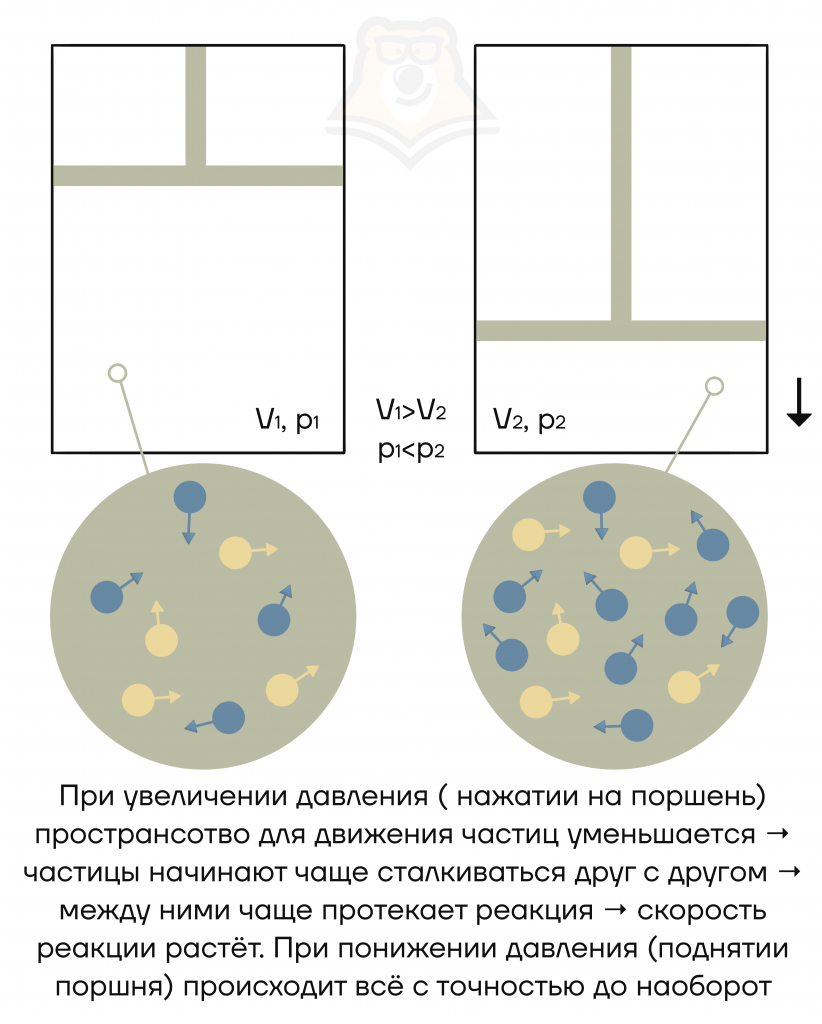
Как связаны между собой давление и объем?
Это две противоположные величины:
- увеличение давления = уменьшение объема;
- уменьшение давления = увеличение объема.
Как это запомнить? Специально для этого мы приготовили простую картинку. Просто уделите ей минутку внимания, и всё уложится в голове.
- От площади соприкосновения реагентов = степени измельчения
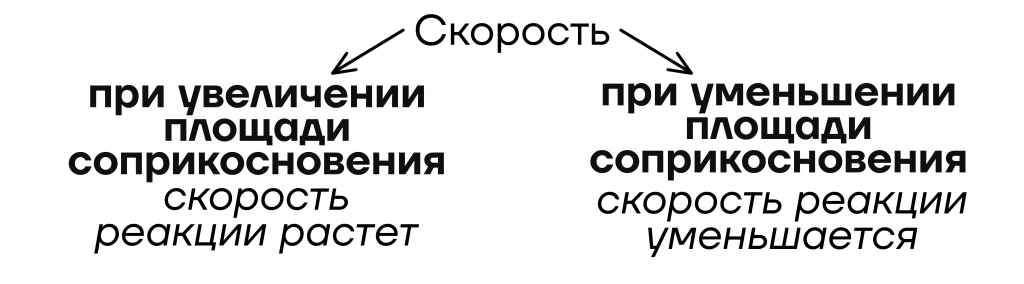
Уточнение: только если в реагентах есть хотя бы одно твердое вещество
Давайте наглядно посмотрим на реакцию между цинком и соляной кислотой. В первом стакане будет протекать медленнее, чем во втором.
Чтобы понять реакцию, вернемся ненадолго в человеческий мир. Представим, что мы попали на распродажу в магазин одежды. Сотня людей (много молекул кислоты) пришла за новой одеждой. А в этом центре работает только один продавец-консультант (кусок цинка). Люди будут очень долго ждать своей очереди и возможности задать вопрос, попросить нужный размер, примерить одежду. Это будет очень медленно. Если же в этом же центре будет работать 40 специалистов (порошок цинка, состоящий из 40 мелких частиц), то люди (соляная кислота) намного быстрее получат помощь!
Перемешивание веществ тоже увеличит скорость реакции за счет увеличения скорости соприкосновения веществ.
Чтобы это понять, достаточно представить чай. Если туда добавить ложку сахара и не перемешивать его, равномерное распределение сахара по стакану будет происходить очень медленно. Однако если размешать его ложкой, то скорость возрастет!
- От природы реагентов
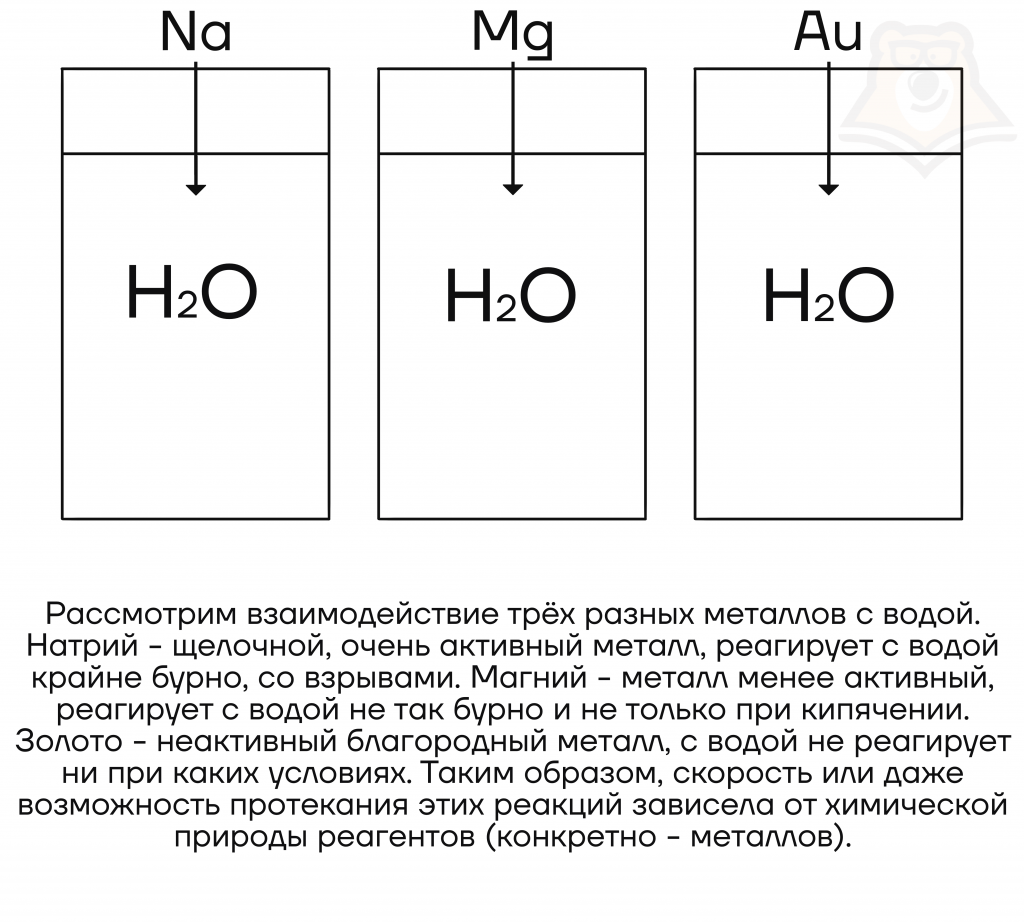
При реакции воды с металлами скорость реакции уменьшается с уменьшением активности металла. То есть активнее всего с водой будут реагировать именно щелочные металлы.
У людей всё также. Скорость поиска друзей или работы зависит от активности человека. Чем более активный человек, тем быстрее он достигнет цели.
Еще нужно помнить, что быстрее всего протекают реакции между газами и между растворами.
А можно ли пантеру превратить в черепаху при помощи химии?
Можно, и это даже не магия. Для этого всего лишь нужно замедлить скорость реакции. Это можно сделать путем добавления ингибитора, уменьшения температуры, концентрации реагентов, давления, площади соприкосновения веществ, а также снижения активности реагентов.
Фактчек
- Скорость химической реакции – быстрота её протекания. То есть она показывает, насколько быстро расходуются реагенты и образуются продукты.
- Скорость абсолютно всех реакций зависит от температуры и от природы реагентов.
- Скорость некоторых реакций зависит ещё от нескольких факторов:
- газы зависят от давления и объема реакционного сосуда;
- катализатор применим только для каталитических реакций;
- концентрация вещества влияет чаще всего только на жидкости и газы;
- площадь соприкосновения реагентов – только на те реакции, где есть хотя бы один твердый реагент.
Проверь себя
Задание 1.
Что произойдет со скоростью реакции при увеличении концентрации водорода в следующей реакции: H2 + Cl2 = 2HCl
- Увеличится
- Уменьшится
- Не изменится
Задание 2.
Какой фактор не влияет на скорость реакции: 6Li +N2 = 2Li3N
- Давление
- Добавление катализатора
- Температура
- Площадь поверхности соприкосновения веществ
Задание 3.
Какой фактор влияет на скорость реакции: NaOH + HCl = NaCl + H2O
- Давление
- Разбавление смеси водой
- Добавление катализатора
- Площадь поверхности соприкосновения веществ
Ответы: 1. — 1; 2. — 2; 3. — 2.
1.4.3. Скорость реакции, ее зависимость от различных факторов.
Некоторые химические реакции происходят практически мгновенно (взрыв кислородно-водородной смеси, реакции ионного обмена в водном растворе), вторые — быстро (горение веществ, взаимодействие цинка с кислотой), третьи — медленно (ржавление железа, гниение органических остатков). Известны настолько медленные реакции, что человек их просто не может заметить. Так, например, преобразование гранита в песок и глину происходит в течение тысяч лет.
Другими словами, химические реакции могут протекать с разной скоростью.
Но что же такое скорость реакции? Каково точное определение данной величины и, главное, ее математическое выражение?
Скоростью реакции называют изменение количества вещества за одну единицу времени в одной единице объема. Математически это выражение записывается как:
Где n1 и n2 – количество вещества (моль) в момент времени t1 и t2 соответственно в системе объемом V.
То, какой знак плюс или минус (±) будет стоять перед выражением скорости, зависит от того, на изменение количества какого вещества мы смотрим – продукта или реагента.
Очевидно, что в ходе реакции происходит расход реагентов, то есть их количество уменьшается, следовательно, для реагентов выражение (n2 — n1) всегда имеет значение меньше нуля. Поскольку скорость не может быть отрицательной величиной, в этом случае перед выражением нужно поставить знак «минус».
Если же мы смотрим на изменение количества продукта, а не реагента, то перед выражением для расчета скорости знак «минус» не требуется, поскольку выражение (n2 — n1) в этом случае всегда положительно, т.к. количество продукта в результате реакции может только увеличиваться.
Отношение количества вещества n к объему, в котором это количество вещества находится, называют молярной концентрацией С:
Таким образом, используя понятие молярной концентрации и его математическое выражение, можно записать другой вариант определения скорости реакции:
Скоростью реакции называют изменение молярной концентрации вещества в результате протекания химической реакции за одну единицу времени:
Факторы, влияющие на скорость реакции
Нередко бывает крайне важно знать, от чего зависит скорость той или иной реакции и как на нее повлиять. Например, нефтеперерабатывающая промышленность в буквальном смысле бьется за каждые дополнительные полпроцента продукта в единицу времени. Ведь учитывая огромное количество перерабатываемой нефти, даже полпроцента вытекает в крупную финансовую годовую прибыль. В некоторых же случаях крайне важно какую-либо реакцию замедлить, в частности коррозию металлов.
Так от чего же зависит скорость реакции? Зависит она, как ни странно, от множества различных параметров.
Для того чтобы разобраться в этом вопросе прежде всего давайте представим, что происходит в результате химической реакции, например:
A + B → C + D
Написанное выше уравнение отражает процесс, в котором молекулы веществ А и В, сталкиваясь друг с другом, образуют молекулы веществ С и D.
То есть, несомненно, для того чтобы реакция прошла, как минимум, необходимо столкновение молекул исходных веществ. Очевидно, если мы повысим количество молекул в единице объема, число столкновений увеличится аналогично тому, как возрастет частота ваших столкновений с пассажирами в переполненном автобусе по сравнению с полупустым.
Другими словами, скорость реакции возрастает при увеличении концентрации реагирующих веществ.
В случае, когда один из реагентов или сразу несколько являются газами, скорость реакции увеличивается при повышении давления, поскольку давление газа всегда прямо пропорционально концентрации составляющих его молекул.
Тем не менее, столкновение частиц является, необходимым, но вовсе недостаточным условием протекания реакции. Дело в том, что согласно расчетам, число столкновений молекул реагирующих веществ при их разумной концентрации настолько велико, что все реакции должны протекать в одно мгновение. Тем не менее, на практике этого не происходит. В чем же дело?
Дело в том, что не всякое соударение молекул реагентов обязательно будет эффективным. Многие соударения являются упругими – молекулы отскакивают друг от друга словно мячи. Для того чтобы реакция прошла, молекулы должны обладать достаточной кинетической энергией. Минимальная энергия, которой должны обладать молекулы реагирующих веществ для того, чтобы реакция прошла, называется энергией активации и обозначается как Еа. В системе, состоящей из большого количества молекул, существует распределение молекул по энергии, часть из них имеет низкую энергию, часть высокую и среднюю. Из всех этих молекул только у небольшой части молекул энергия превышает энергию активации.
Как известно из курса физики, температура фактически есть мера кинетической энергии частиц, из которых состоит вещество. То есть, чем быстрее движутся частицы, составляющие вещество, тем выше его температура. Таким образом, очевидно, повышая температуру мы по сути увеличиваем кинетическую энергию молекул, в результате чего возрастает доля молекул с энергией, превышающей Еа и их столкновение приведет к химической реакции.
Факт положительного влияния температуры на скорость протекания реакции еще в 19м веке эмпирически установил голландский химик Вант Гофф. На основании проведенных им исследований он сформулировал правило, которое до сих пор носит его имя, и звучит оно следующим образом:
Скорость любой химической реакции увеличивается в 2-4 раза при повышении температуры на 10 градусов.
Математическое отображение данного правила записывается как:
где V2 и V1 – скорость при температуре t2 и t1 соответственно, а γ – температурный коэффициент реакции, значение которого чаще всего лежит в диапазоне от 2 до 4.
Часто скорость многих реакций удается повысить, используя катализаторы.
Катализаторы – вещества, ускоряющие протекание какой-либо реакции и при этом не расходующиеся.
Но каким же образом катализаторам удается повысить скорость реакции?
Вспомним про энергию активации Ea . Молекулы с энергией меньшей, чем энергия активации в отсутствие катализатора друг с другом взаимодействовать не могут. Катализаторы, изменяют путь, по которому протекает реакция подобно тому, как опытный проводник проложит маршрут экспедиции не напрямую через гору, а с помощью обходных троп, в результате чего даже те спутники, которые не имели достаточно энергии для восхождения на гору, смогут перебраться на другую ее сторону.
Не смотря на то что катализатор при проведении реакции не расходуется, тем не менее он принимает в ней активное участие, образуя промежуточные соединения с реагентами, но к концу реакции возвращается к своему изначальному состоянию.
Кроме указанных выше факторов, влияющих на скорость реакции, если между реагирующими веществами есть граница раздела (гетерогенная реакция), скорость реакции будет зависеть также и от площади соприкосновения реагентов. Например, представьте себе гранулу металлического алюминия, которую бросили в пробирку с водным раствором соляной кислоты. Алюминий – активный металл, который способен реагировать с кислотами неокислителями. С соляной кислотой уравнение реакции выглядит следующим образом:
2Al + 6HCl → 2AlCl3 + 3H2↑
Алюминий представляет собой твердое вещество, и это значит, что реакция с соляной кислотой идет только на его поверхности. Очевидно, что если мы увеличим площадь поверхности, предварительно раскатав гранулу алюминия в фольгу, мы тем самым предоставим большее количество доступных для реакции с кислотой атомов алюминия. В результате этого скорость реакции увеличится. Аналогичным образом увеличения поверхности твердого вещества можно добиться измельчением его в порошок.
Также на скорость гетерогенной реакции, в которой реагирует твердое вещество с газообразным или жидким, часто положительно влияет перемешивание, что связано с тем, что в результате перемешивания достигается удаление из зоны реакции скапливающихся молекул продуктов реакции и «подносится» новая порция молекул реагента.
Последним следует отметить также огромное влияние на скорость протекания реакции и природы реагентов. Например, чем ниже в таблице Менделеева находится щелочной металл, тем быстрее он реагирует с водой, фтор среди всех галогенов наиболее быстро реагирует с газообразным водородом и т.д.
Резюмируя все вышесказанное, скорость реакции зависит от следующих факторов:
1) концентрация реагентов: чем выше, тем больше скорость реакции.
2) температура: с ростом температуры скорость любой реакции увеличивается.
3) площадь соприкосновения реагирующих веществ: чем больше площадь контакта реагентов, тем выше скорость реакции.
4) перемешивание, если реакция происходит между твердым веществом и жидкостью или газом перемешивание может ее ускорить.




