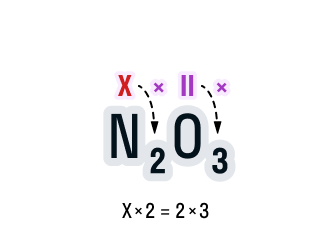Трудно переоценить роль железа для человеческого организма, ведь именно оно способствует «творению» крови, его содержание влияет на уровень гемоглобина и миоглобина, железо нормализует работу ферментной системы. Но что это за элемент с точки зрения химии? Какая валентность железа? Об этом будет рассказано в данной статье.
Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.
Данный металл наиболее всего распространен в природе в виде руды, встречается в воде как минерал, а также в различных соединениях.
Наибольшее количество запасов железа в виде руды, находится в России, Австралии, Украине, Бразилии, США, Индии, Канаде.
Физические свойства
Прежде чем переходить к валентности железа, необходимо подробнее рассмотреть его физические свойства, так сказать, приглядеться к нему поближе.
Этот металл имеет серебристый цвет, достаточно пластичный, но способен к увеличению твердости путем его взаимодействия с другими элементами (например, с углеродом). Также он обладает магнитными свойствами.
Во влажной среде железо может корродировать, то есть ржаветь. Хотя абсолютно чистый металл устойчивее к влаге, но если в нем есть примеси, именно они провоцируют коррозию.
Железо хорошо взаимодействует с кислотной средой, даже может образовывать соли железной кислоты (при условии сильного окислителя).
В воздушной среде быстро покрывается оксидной пленкой, которая защищает его от взаимодействий.
Химические свойства
Также этот элемент обладает рядом химических свойств. Железо, как и остальные элементы таблицы Менделеева, имеет заряд атомного ядра, который соответствует порядковому номеру +26. А возле ядра вращается 26 электронов.
А вообще, если рассматривать свойства железа – химического элемента, то он является металлом с невысокой активной способностью.
Взаимодействуя с окислителями более слабыми, железо образует соединения, где оно двухвалентно (то есть его степень окисления +2). А если с сильными окислителями, то степень окисления железа достигает +3 (то есть валентность его становится равной 3).
При взаимодействии с химическими элементами, которые не являются металлами, Fe выступает по отношению к ним восстановителем, при этом степень окисления его становиться, кроме +2 и +3, даже +4, +5, +6. Такие соединения имеют очень сильные окислительные свойства.
Как уже отмечалось выше, железо в воздушной среде покрывается оксидной пленкой. А при нагревании скорость реакции повышается и может образоваться оксид железа с валентностью 2 (температура менее 570 градусов по Цельсию) или оксид с валентностью 3 (температурный показатель более 570 градусов).
Взаимодействие Fe с галогенами, приводит к образованию солей. Элементы фтор и хлор окисляют его до +3. Бром же – до +2 или +3 (все зависит от того, какие условия осуществления химического превращения при взаимодействии с железом).
Вступая во взаимодействия с йодом, элемент окисляется до +2.
Нагревая железо и серу, получается сульфид железа с валентностью 2.
Если феррум расплавить и соединить его с углеродом, фосфором, кремнием, бором, азотом, то получатся соединения называемые сплавами.
Железо является металлом, поэтому оно вступает во взаимодействие и с кислотами (об этом кратко также говорилось чуть выше). Например, кислоты серная и азотная, имеющие высокую концентрацию, в среде с пониженной температурой, на железо не оказывают воздействия. Но стоит ей повысится, как происходит реакция, в результате которой железо окисляется до +3.
Чем выше концентрация кислоты, тем большую температуру необходимо дать.
Нагревая 2-х валентное железо в воде, получим его оксид и водород.
Также Fe обладает способностью вытеснять из водных растворов солей металлы, которые имеют пониженную активность. При этом он окисляется до +2.
При повышении температуры, железо восстанавливает металлы из оксидов.
Что такое валентность
Уже в предыдущем разделе немного встречалось понятие валентности, а также степени окисления. Пришло время рассмотреть валентность железа.
Но для начала необходимо понять, что это вообще за такое свойство химических элементов.
Химические вещества почти всегда постоянны в своем составе. Например, в формуле воды Н2О – 1 атом кислорода и 2 атома водорода. То же самое и с другими соединениями, в которых задействованы два химических элемента, один из которых водород: к 1 атому химического элемента может добавиться 1-4 атома водорода. Но никак не наоборот! А потому, видно, что водород присоединяет к себе всего 1 атом другого вещества. И именно это явление называют валентностью – способностью атомов химического элемента присоединять конкретное количество атомов других элементов.
Значение валентности и графическая формула
Есть элементы таблицы Менделеева, которые обладают постоянной валентностью – это кислород и водород.
А есть такие химические элементы, у которых она изменяется. Например, железо чаще 2-х и 3-х валентно, сера 2, 4, 6-ти, углерод 2 и 4-х. Это элементы с переменной валентностью.
Далее, понимая, что такое валентность, можно правильно написать графическую формулу соединений. Она отображает последовательность соединения атомов в молекуле.
Также, зная валентность одного из элементов в соединении, можно определить валентность другого.
Валентность железа
Как было отмечено, железо относится к элементам с переменной валентностью. И она может колебаться не только между показателями 2 и 3, но и достигать 4, 5 и даже 6.
Конечно, более подробно изучает валентность железа неорганическая химия. Рассмотрим этот механизм кратко на уровне простейших частиц.
Железо является д-элементом, к которому причисляется еще 31 элемент таблицы Менделеева (это 4-7 периоды). С возрастанием порядкового номера, свойства д-элементов приобретают небольшие изменения. Атомный радиус у этих веществ также медленно возрастает. Они обладают переменной валентностью, которая зависит от того, что предвнешний д-электронный подуровень является незавершенным.
Потому для железа валентными есть не только с-электроны, находящиеся во внешнем слое, но и неспаренные 3д-электроны предвнешнего слоя. И, как следствие, валентность Fe в химических соединениях может равнятся 2, 3, 4, 5, 6. В основном, она равна 2 и 3 – это более устойчивые соединения железа с другими веществами. В менее устойчивых — он проявляет валентность 4, 5, 6. Но, такие соединения встречаются реже.
Двухвалентный феррум
При взаимодействии 2 валентного железа с водой получается оксид железа (2). Такое соединение обладает черным цветом. Достаточно легко взаимодействует с соляной (малой концентрации) и азотной (высокой концентрации) кислотами.
Если такому оксиду 2-х валентного железа провзаимодействовать или с водородом (температура 350 градусов по Цельсию), или с углеродом (коксом) при 1000 градусов, то оно восстанавливается до чистого состояния.
Добывают оксид железа 2-х валентного такими способами:
- через соединение оксида 3-х валентного железа с угарным газом;
- при нагревании чистого Fe, при этом низкое давление кислорода;
- при раскладывании оксалата 2-х валентного железа в вакуумной среде;
- при взаимодействии чистого железа с его оксидами, температура при этом 900-1000 градусов по Цельсию.
Что касается природной среды, то оксид железа 2-х валентного, присутствует в виде минерала вюстита.
Есть еще способ, как в растворе определить валентность железа – в данном случае, имеющего ее показатель 2. Необходимо провести реакции с красной солью (гексацианоферрат калия) и с щелочью. В первом случае наблюдается получение осадка темно-синего цвета – комплексной соли железа 2-х валентного. Во втором – получение темного серо-зеленого осадка – гидроксида железа также 2-х валентного, в то время, как гидроксид железа 3-х валентного имеет цвет в растворе темно-бурый.
Трехвалентное железо
Оксид 3-х валентного феррума имеет порошкообразную структуру, цвет которой красно-коричневый. Имеет также наименования: окись железа, железный сурик, красный пигмент, пищевой краситель, крокус.
В природе это вещество встречается в виде минерала – гематита.
Оксид такого железа с водой уже не взаимодействует. Но соединяется с кислотами и щелочами.
Применяется оксид железа (3) для окрашивания материалов, применяемых в строительстве:
- кирпичей;
- цемента;
- керамических изделий;
- бетона;
- тротуарной плитки;
- напольных покрытий (линолеум).
Железо в организме человека
Как отмечалось в начале статьи, вещество железо является важной составляющей человеческого организма.
Когда этого элемента является недостаточно, то могут возникнуть следующие последствия:
- повышенная усталость и чувствительность к холоду;
- сухость кожи;
- снижение мозговой деятельности;
- ухудшение прочности ногтевой пластины;
- головокружение;
- проблемы с пищеварением;
- седина и выпадение волос.
Накапливается железо, как правило, в селезенке и печени, а также почках и поджелудочной железе.
В рационе человека должны быть продукты, содержащие железо:
- говяжья печень;
- гречневая каша;
- арахис;
- фисташки;
- зеленый горошек консервированный;
- сушенные белые грибы;
- куриные яйца;
- шпинат;
- кизил;
- яблоки;
- груши;
- персики;
- свекла;
- морепродукты.
Недостаток железа в крови, приводит к снижению гемоглобина и развитию такого заболевания, как железодефицитная анемия.
Поможем понять и полюбить химию
Начать учиться
Валентность
Из этой статьи вы узнаете, что называется валентностью в химии, научитесь находить ее значение и использовать для составления химических формул.
Понятие валентности
Валентность — это способность атома химического элемента образовывать определенное число химических связей с другими атомами.
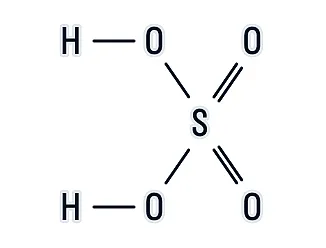
Рассмотрим структурную формулу H2SO4, с помощью которой можно определить, как атомы связаны между собой в веществе:
Исходя из структуры, можно сделать выводы:
-
атомы водорода H имеют одну химическую связь, то есть одновалентны;
-
сера S имеет шесть химических связей, то есть шестивалентна;
-
каждый атом кислорода O имеет две химические связи — двухвалентен.
Валентность обозначается римской цифрой над знаком химического элемента в формуле. Например:
Атом натрия имеет валентность, равную 1, а атом кислорода — равную 2.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Постоянная и переменная валентность
Среди всех элементов выделяют две группы: с постоянной и переменной валентностью.
У элементов с постоянной валентностью в любом соединении она одинакова. Эти элементы и проявляемую ими валентность придется выучить.
|
Элемент |
Валентность |
|---|---|
|
H, F, Li, Na, K, Ag |
I |
|
O, Be, Mg, Ca, Ba, Zn |
II |
|
Al |
III |
Переменная валентность меняется в зависимости от соединения. Элементов с переменной валентностью большинство. Как правило, они характеризуются высшей, промежуточной и низшей валентностью:
-
высшая валентность для элементов главных подгрупп совпадает с номером группы (№гр);
-
низшая валентность вычисляется по формуле: 8 − №гр;
-
промежуточная валентность — число между низшей и высшей валентностью. Обычно промежуточные валентности соответствуют четности группы.
Пример: как определить валентность по таблице Менделеева
Сера S располагается в группе VIА таблицы Менделеева. Значит:
-
высшая валентность серы равна VI;
-
вычислим низшую валентность: 8 − 6 = 2. Низшая валентность равна II;
-
сера расположена в группе VI — это четное число. Значит, промежуточными валентностями будут все четные числа между низшей и высшей валентностью. В случае с серой между числами 2 и 6 расположено только одно четное число — 4. Промежуточная валентность серы — IV.
В таблице собрали все возможные валентности для некоторых химических элементов.
|
Элемент |
Валентность |
|---|---|
|
C, Si |
II, IV |
|
N |
I, II, III, IV |
|
P |
III, V |
|
S |
II, IV, VI |
|
Cl, Br, I |
I, III, V, VII |
|
Fe |
II, III |
|
Cu |
I, II |
Обратите внимание
Понятия «степень окисления» и «валентность» — это не одно и то же, хотя в большинстве случаев они численно совпадают. Степень окисления — это условный заряд атома, он бывает положительным или отрицательным. А валентность — способность атома образовывать связи, она не может принимать отрицательные значения.
Как определить валентность химического элемента с переменной валентностью в соединении
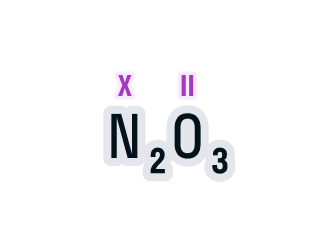
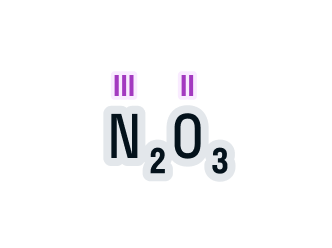
Определим валентность азота в соединении N2O3.
-
Над элементами с постоянной валентностью подпишем ее значение, в нашем случае это кислород:
-
Общее число валентностей каждого элемента в соединении должно совпадать. Находится общее число валентностей с помощью умножения валентности на число атомов данного химического элемента в соединении.
Считаем: общее число валентностей кислорода равно 2 · 3. Значит, общее число валентностей азота в данном соединении будет равно x · 2. Получаем уравнение: х · 2 = 2 · 3.
-
Вычислим х в получившемся уравнении:
2х = 6;
х = 3.
-
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.
В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Как составить формулу химического соединения по значениям валентностей элементов
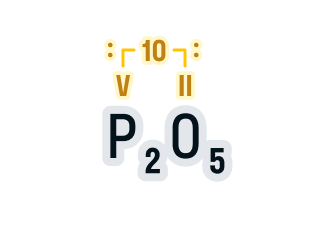
Составим формулу оксида фосфора (V).
-
Записываем обозначения элементов и над ними указываем валентности.
Валентность фосфора в данном соединении указана в названии вещества (V), а валентность кислорода всегда равна II. -
Находим НОК валентностей, в нашем случае 5 · 2 = 10. Для удобства запишем его над формулой:
-
Делим НОК на валентность каждого элемента, а результат записываем в индекс:
10 : 5 = 2 — индекс фосфора;
10 : 2 = 5 — индекс кислорода.
Получаем соединение P2O5.
Вопросы для самопроверки
-
Что такое валентность в химии? Можно ли сказать, что валентность и степень окисления — это одно и то же?
-
Как узнать высшую и низшую валентность какого-либо химического элемента?
-
Назовите три химических элемента с валентностью, равной единице.
-
Среди перечисленных химических элементов выберите те, у которых валентность переменная: K, S, Al, Cu, Ca, P, Si, Mn, Mg, O.
-
Определите значения валентностей каждого химического элемента в следующих соединениях: FeCl3, Cl2O7, CuS, AlP.
-
Составьте химические формулы веществ:
-
Хлорид железа (II).
-
Оксид углерода (IV).
-
Оксид магния.
-
-
Верно ли, что значение высшей валентности химических элементов увеличивается по периоду слева направо в таблице Менделеева?
Тему «Валентность» проходят на уроках химии в 8-м классе, и без ее понимания сложно двигаться дальше, а уж тем более сдавать государственные экзамены. Онлайн-курс подготовки к ЕГЭ по химии от Skysmart поможет освежить знания за все годы школьной программы, заполнить пробелы и снять стресс перед экзаменом. Вводный урок бесплатный!
Валентность железа.
Валентность железа:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Валентность железа равна II, III. Железо проявляет переменную валентность.
| Валентность железа в соединениях | |
| II | FeO, Fe(OH)2, FeCl2, FeBr2 |
| III | Fe2O3, Fe(OH)3, FeCl3, Fe2S3 |
Все свойства атома железа
Источник: https://ru.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
920
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
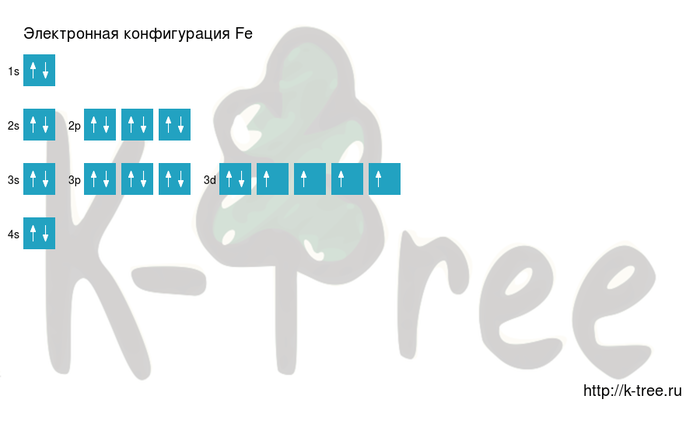
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на
‘d’ — до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
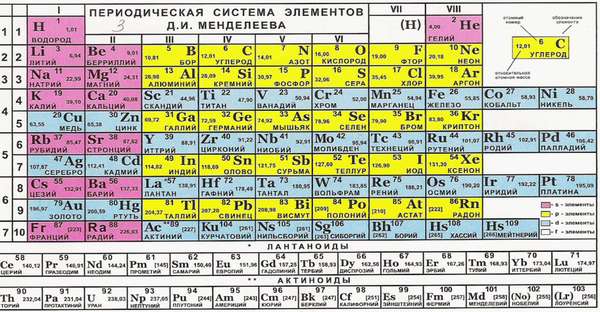
Чем поможет периодическая таблица?

Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
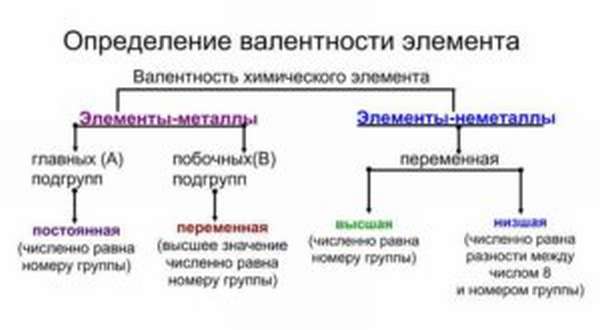
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод,
- сера,
- хлор,
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны. Подарки от онлайн казино можно взять на этой странице — https://www.casinobonus-ruu.com и активировать их после регистрации.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.