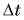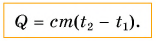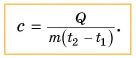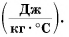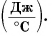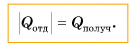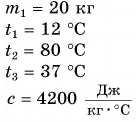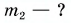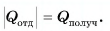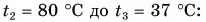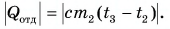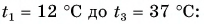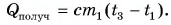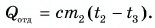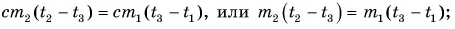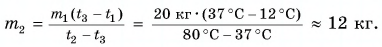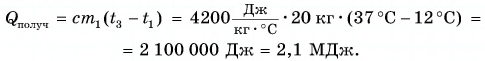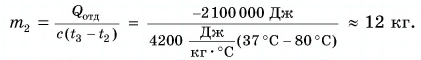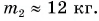Расчет количества теплоты при нагревании и охлаждении:
Вы уже знаете, что изменить внутреннюю энергию тела можно передачей ему количества теплоты. Как связано изменение внутренней энергии тела, т. е. количество теплоты, с характеристиками самого тела?
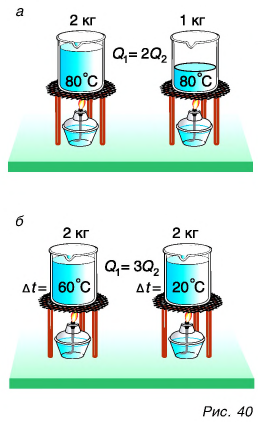
Внутренняя энергия тела есть суммарная энергия всех его частиц. Значит, если массу данного тела увеличить в два или три раза, то и количество теплоты, необходимое для его нагревания на одно и то же число градусов, увеличится в два или три раза. Например, на нагревание двух килограммов воды от 20 °C до 80 °C потребуется в два раза больше теплоты, чем на нагревание одного килограмма воды (рис. 40, а).
Очевидно также, что для нагревания воды на
Из этих рассуждений следует подтвержденный опытами вывод. Количество теплоты, необходимое для нагревания тела, прямо пропорционально его массе и изменению температуры.
А зависит ли количество теплоты, идущее на нагревание, от рода вещества, которое нагревается?
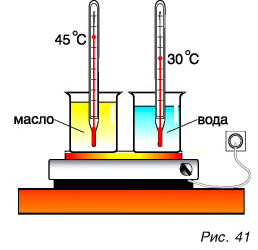
Для ответа на этот вопрос проведем опыт. В два одинаковых стакана нальем по 150 г подсолнечного масла и воды. Поместим в них термометры и поставим на нагреватель (рис. 41).
Получив за одинаковое время от нагревателя равное с водой количество теплоты, масло нагрелось больше, чем вода. Значит, для изменения температуры масла на одну и ту же величину требуется меньше теплоты, чем для изменения температуры такой же массы воды.
Поэтому для всех веществ вводят специальную величину — удельную теплоемкость вещества. Эту величину обозначают буквой с (от лат. capacite — емкость, вместимость). Теперь мы можем записать строгую формулу для количества теплоты, необходимого для нагревания:
Выразим из этой формулы с:
Удельная теплоемкость есть физическая величина, численно равная количеству теплоты, которое необходимо передать 1 кг данного вещества, чтобы изменить его температуру на 1 °C. Удельная теплоемкость измеряется в джоулях на килограмм-градус Цельсия
Для любознательных:
Часто формулу 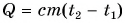
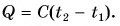
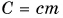
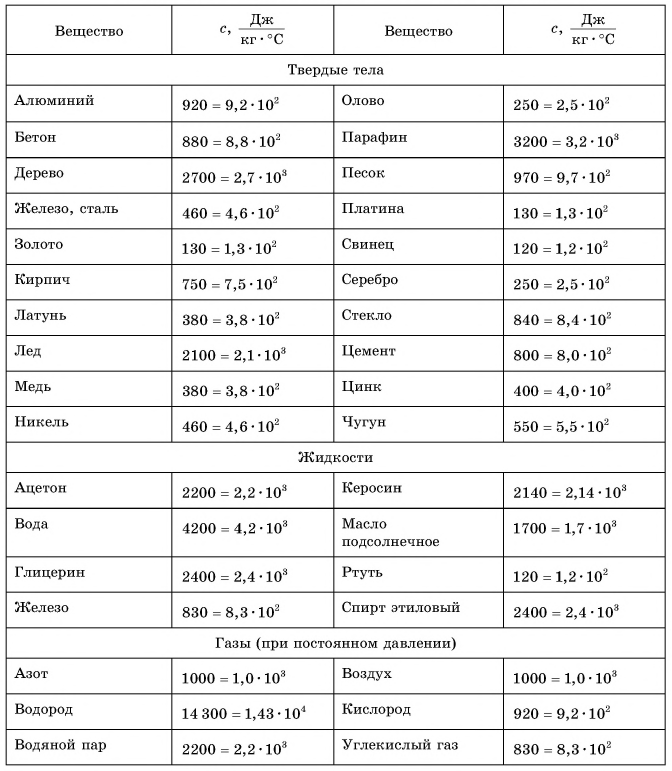
В таблице 1 представлены значения удельной теплоемкости различных веществ (в различных состояниях). Как следует из этой таблицы, среди жидкостей максимальное значение удельной теплоемкости имеет вода: для нагревания 1 кг воды на 1 °C требуется 4200 Дж теплоты — это почти в 2,5 раза больше, чем для нагревания 1 кг подсолнечного масла, и в 35 раз больше, чем для нагревания 1 кг ртути.
Формула 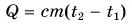
В заключение заметим, что при теплообмене двух или нескольких тел абсолютное значение количества теплоты, которое отдано более нагретым телом (телами), равно количеству теплоты, которое получено более холодным телом (телами):
Это равенство называется уравнением теплового баланса и выражает, по сути, закон сохранения энергии. Оно справедливо при отсутствии потерь теплоты.
Таблица 1. Удельная теплоемкость некоторых веществ
Главные выводы:
- Количество теплоты, необходимое для нагревания тела (выделившееся при охлаждении), прямо пропорционально его массе, изменению температуры тела и зависит от вещества тела.
- Удельная теплоемкость вещества численно равна количеству теплоты, которое надо передать 1 кг данного вещества, чтобы изменить его температуру на 1 °C.
- При теплообмене количество теплоты, отданное более горячим телом, равно по модулю количеству теплоты, полученному более холодным телом, если нет потерь теплоты.
- Заказать решение задач по физике
Пример решения задачи:
Для купания ребенка в ванночку влили холодную воду массой 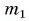
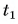
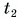
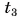
Дано:
Решение
По закону сохранения энергии
Отдавала теплоту горячая вода, изменяя свою температуру от
Холодная вода получила эту теплоту и нагрелась от
Так как нас интересует только модуль 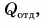
Тогда
При решении мы пренебрегали потерями теплоты на нагревание ванночки, окружающего воздуха и т. д.
Возможен и другой вариант решения.
Рассчитаем сначала количество теплоты, которое было получено холодной водой:
Полагая, что эта теплота отдана горячей водой, запишем: 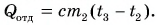
Ответ:
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Поверхностное натяжение жидкости
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
- Количество теплоты в физике
Порядок выполнения работы
1. Закрыть
кран 3 и, осторожно нагнетая воздух
насосом в баллон, пока разность уровней
не достигнет 20-25 см.
2. Когда
давление в баллоне окончательно
установиться (закончится процесс 2
изохорического охлаждения и установиться
состояние 2), показателем чего служит
прекращение движения уровней в коленях
манометра, производят отчет разности
уровней
и записывают показания в таблицу.
Таблица–Экспериментальные и расчетные
значения
|
№ опыта |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
h1i |
||||||||
|
h2i |
||||||||
|
γi |
3. Открыть
кран 3 и как только уровни жидкости в
коленях манометра выровняются, тут же
закрыть его.
4. Когда
закончится процесс 4 изохорического
нагревания и установится состояние 4
(перестанут смещаться уровни жидкости)
измерить разность уровней
и полученный результат занести в таблицу.
5.
Повторить эксперимент 7-8 раз.
Обработка результатов измерений
1. По
формуле (9.8) рассчитайте значение
показателя адиабаты для каждого опыта,
а результаты запишите в таблицу.
2.
Рассчитайте среднее значение
.
3. Оцените
абсолютную погрешность
.
4. Оцените
относительную погрешность
.
5.
Окончательный результат запишите в
виде:
Контрольные вопросы
-
Что
называется внутренней энергией
идеального газа и как определяется? -
Что
называется числом степеней свободы
механической системы и как она
определяется для молекул газа? -
Сделайте
вывод формулы для определения внутренней
энергии многоатомного газа. -
Первый
закон термодинамики и его применение
к изопроцессам и адиабатическому
изменению состояния. -
Адиабатический
процесс и вывод уравнения Пуассона. -
Теплоемкости
тела и их связь между собой. -
Показать,
что отношение молярных теплоемкостей
равно коэффициенту Пуассона. -
Как
определяется количество теплоты,
которое необходимо передать телу, чтобы
изменить его температуру? -
Вычислите
теоретические значения показателя
адиабаты для
иНе.
-
Опишите
процессы и состояния газа, которые были
проделаны в данном лабораторном
эксперименте.
-
Определение изменения энтропии
-
определить
изменение энтропии при изохорическом
охлаждении и нагревании газа.
-
стеклянный
баллон с краном, соединенный с водяным
манометром и ручным насосом.
Краткая теория
Основу термодинамики составляют два
начала. Первое начало устанавливает
количественные соотношения, имеющие
место при превращениях энергии из одних
видов в другие. Оно утверждает: количество
теплоты
5,
переданное системе, увеличивает ее
внутреннюю энергию на
и превращается в работу
,
совершаемую системой против внешних
сил:
. (10.1)
Второе
начало термодинамики определяет условия,
при которых возможны превращения
энергии, т.е. определяет возможные
направления процессов, происходящих в
системе.
Величины,
характеризующие состояния системы,
называются параметрами состояния.
Состояние системы, при котором все
параметры имеют значения, остающиеся
неизменными сколь угодно долго, называется
равновесным. Равновесный процесс может
быть проведен в обратном направлении
(обратный процесс) через те же промежуточные
состояния, что и прямой.
Функция S, дифференциал
которой
, (10.2)
называется энтропией
системы. Здесь
– количество полученного системой при
обратном процессе тепла,Т–
температура системы.
Если
количество теплоты
сообщается системе в ходе необратимого
процесса, то энтропия возрастает как
вследствие сообщения тепла, так и
вследствие необратимости процесса.
Поэтому
. (10.3)
Формулы
(10.2) и (10.3) можно объединить
. (10.4)
Знак равенства относится
к обратимым, знак неравенства – к
необратимым процессам.
Состояние
макроскопического тела или макросостояние
может быть осуществлено различными
способами, каждому из которых соответствует
некоторое микросостояние тела. Число
различных микросостояний, соответствующих
данному макросостоянию, называется
статистическим весом или термодинамической
вероятностью макросостояния Ω. Энтропия
системы пропорциональна Ω:
. (10.5)
Энтропия
изолированной системы при протекании
необратимого процесса возрастает,
стремясь к максимуму. Действительно,
изолированная система переходит из
менее вероятных в более вероятные
состояния, что сопровождается ростом
Ω и S. Это максимальное
значение достигается системой, когда
она переходит в состояние термодинамического
равновесия:
, (10.6)
. (10.7)
Энтропия изолированной
системы не может убывать:
. (10.8)
Это утверждение одна
из формулировок второго начала
термодинамики.
Изменение
энтропии в обратимом процессе равно
. (10.9)
По знаку
можно судить о направлении протекания
термодинамического процесса.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
«Количество теплоты. Удельная теплоёмкость»
Количество теплоты
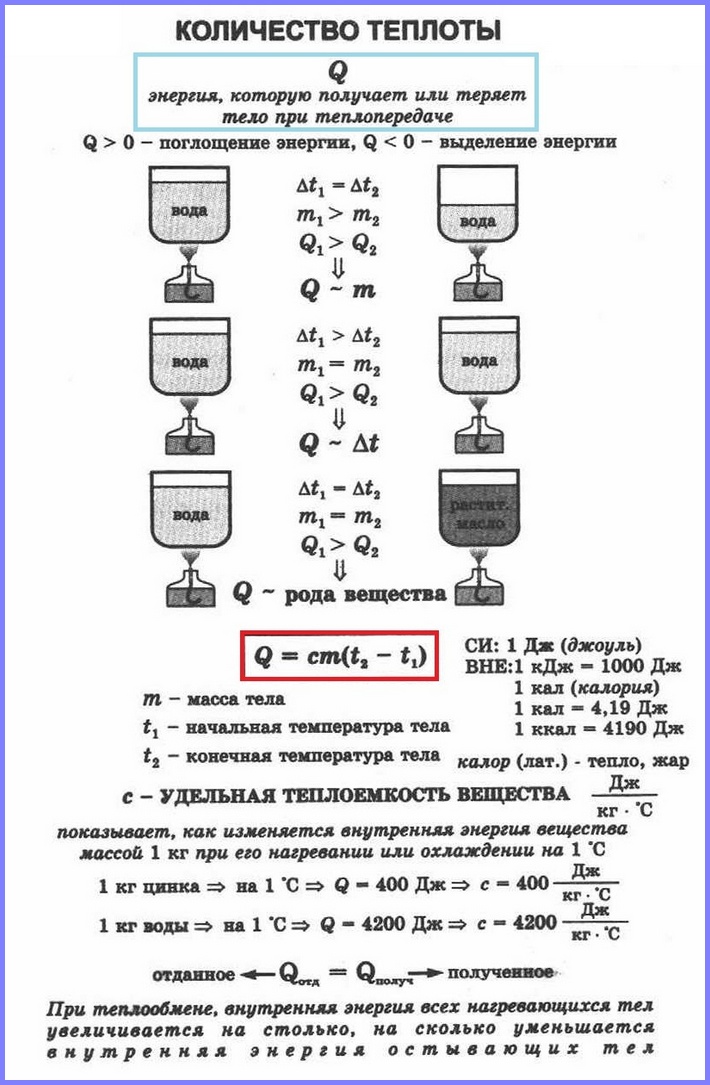
Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количествоv теплоты.
Количество теплоты – это изменение внутренней энергии тела в процессе теплопередачи без совершения работы. Количество теплоты обозначают буквой Q.
Работа, внутренняя энергия и количество теплоты измеряются в одних и тех же единицах — джоулях (Дж), как и всякий вид энергии.
В тепловых измерениях в качестве единицы количества теплоты раньше использовалась особая единица энергии — калория (кал), равная количеству теплоты, необходимому для нагревания 1 грамма воды на 1 градус Цельсия (точнее, от 19,5 до 20,5 °С). Данную единицу, в частности, используют в настоящее время при расчетах потребления тепла (тепловой энергии) в многоквартирных домах. Опытным путем установлен механический эквивалент теплоты — соотношение между калорией и джоулем: 1 кал = 4,2 Дж.
При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. Таким образом, чем больше масса тела, тем большее количество тепла требуется ему для нагревания. То же самое и с охлаждением.
Количество теплоты, необходимое для нагревания тела зависит еще и от рода вещества, из которого это тело сделано. Эта зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
Удельная теплоёмкость
Удельная теплоёмкость – это физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К). Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой с. Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг °К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Поскольку кол-во теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на 1 °С. В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.
Количество теплоты Q, необходимое для нагревания тела массой m от температуры t1°С до температуры t2°С, равно произведению удельной теплоёмкости вещества, массы тела и разности конечной и начальной температур, т.е.
Q = c ∙ m (t2 — t1)
По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.
Это конспект по теме «Количество теплоты. Удельная теплоёмкость». Выберите дальнейшие действия:
- Перейти к следующему конспекту: «Уравнение теплового баланса»
- Вернуться к списку конспектов по Физике
- Посмотреть решение типовых задач на количество теплоты
Количество теплоты — еще один изученный нами вид энергии. Эту энергию тело получает или отдает при теплопередаче. Мы установили, что количество теплоты, необходимое для нагревания тела, зависит от массы тела, разности температур и рода вещества. Нам известен физический смысл удельной теплоемкости и некоторые ее табличные значения для разных веществ. В этом уроке мы перейдем к численному расчету количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении.
Зачем это нужно? На самом деле, на практике очень часто используют подобные расчеты.
При строительстве зданий и проектировании систем отопления важно знать, какое количество теплоты необходимо отдавать для полного обогрева всех помещений. С другой стороны, также необходима информация о том, какое количество теплоты будет уходить через окна, стены и двери.
Формула для расчета количества теплоты
Допустим, на нужно узнать, какое количество теплоты получила при нагревании железная деталь. Масса детали $3 space кг$. Деталь нагрелась от $20 degree C$ до $300 degree C$.
Возьмем значение теплоемкости железа из таблицы — $460 frac{Дж}{кг cdot degree C}$. Объясним смысл этой величины: на нагревание куска железа массой $1 space кг$ на $1 degree C$ необходимо затратить количество теплоты, равное $460 space Дж$.
- Масса детали у нас в 3 раза больше, значит, на ее нагрев потребуется в 3 раза большее количество теплоты — $1380 space Дж$
- Температура изменилась не на $1 degree C$, а на $280 degree C$
- Значит, необходимо в 280 раз большее количество теплоты: $1380 space Дж cdot 280 = 386 400 space Дж$
Тогда, формула для расчета количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении примет вид:
$Q = cm(t_2 — t_1)$,
где $Q$ — количество теплоты,
$c$ — удельная теплоемкость вещества, из которого состоит тело,
$m$ — масса тела,
$t_1$ — начальная температура тела,
$t_2$ — конечная температура тела.
Чтобы рассчитать количество теплоты, которое необходимо затратить для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость умножить на массу тела и на разность конечной и начальной температур.
Рассмотрим подробнее особенности расчета количества теплоты на примерах решения задач.
Расчет количества теплоты, затраченного на нагревание двух тел
В железный котелок массой $4 space кг$ налили воду массой $10 space кг$ (рисунок 1). Их температура $25 degree C$. Какое количество теплоты нужно затратить, чтобы нагреть котелок и воду до температуры $100 degree C$?
Обратите внимание, что нагреваться будут сразу два тела: и котелок, и вода в нем. Между постоянно будет происходить теплообмен. Поэтому их температуры мы можем считать одинаковыми.
Отметим, что массы котелка и воды различные. Также они имеют различные теплоемкости. Значит, полученные ими количества теплоты будет различными.
Теперь мы можем записать условие задачи и решить ее.
Дано:
$m_1 = 4 space кг$
$c_1 = 460 frac{Дж}{кг cdot degree C}$
$m_2 = 10 space кг$
$c_2 = 4200 frac{Дж}{кг cdot degree C}$
$t_1 = 25 degree C$
$t_2 = 100 degree C$
Q-?
Посмотреть решение и ответ
Скрыть
Решение:
Для расчета полученного количества теплоты используем формулу $Q = cm(t_2 — t_1)$.
Запишем эту формулу для количества теплоты, полученного котелком:
$Q_1 = c_1m_1(t_2 — t_1)$.
Рассчитаем это количество теплоты:
$Q_1 = 460 frac{Дж}{кг cdot degree C} cdot 4 space кг cdot (100 degree C — 25 degree C) = 1840 frac{Дж}{degree C} cdot 75 degree C = 138 000 space Дж = 138 space кДж$.
Количество теплоты, полученное водой при нагревании будет равно:
$Q_2 = c_2m_2(t_2 — t_1)$.
Подставим численные значения и рассчитаем:
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 10 space кг cdot (100 degree C — 25 degree C) = 42000 frac{Дж}{degree C} cdot 75 degree C = 3 150 000 space Дж = 3150 space кДж$.
Общее количество теплоты, затраченное на нагревание котелка и воды:
$Q = Q_1 +Q_2$,
$Q = 138 space кДж + 3150 space кДж = 3288 space кДж$.
Ответ: $Q = 3288 space кДж$.
Расчет количества теплоты при смешивании жидкостей
Горячую воду разбавили холодной и получили температуру смеси $30 degree C$. Горячей воды с температурой $100 degree C$ при этом было $0.3 space кг$. Холодная вода имела массу $1.4 space кг$ и температуру $15 degree C$. Рассчитайте, какое количество теплоты было отдано горячей водой при остывании и получила холодная вода при нагревании. Сравните эти количества теплоты.
Дано:
$c_1 = c_2 = c = 4200 frac{Дж}{кг cdot degree C}$
$m_1 = 0.3 space кг$
$m_2 = 1.4 space кг$
$t_1 = 100 degree C$
$t_2 = 15 degree C$
$t = 30 degree C$
$Q_1 — ?$
$Q_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты, отданного горячей водой при остывании от $100 degree C$ до $30 degree C$:
$Q_1 = cm_1(t_1 — t)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 0.3 space кг cdot (100 degree C — 30 degree C) = 1260 frac{Дж}{degree C} cdot 70 degree C = 88 200 space Дж = 88.2 space кДж$.
Запишем формулу для расчета количества теплоты, полученного холодной водой при нагревании от $15 degree C$ до $30 degree C$:
$Q_2 = cm_2(t — t_2)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 1.4 space кг cdot (30 degree C — 15 degree C) = 5880 frac{Дж}{degree C} cdot 15 degree C = 88 200 space Дж = 88.2 space кДж$.
$Q_1 = Q_2 = 88.2 space кДж$.
Ответ: $Q_1 = Q_2 = 88.2 space кДж$.
В ходе решения этой задачи мы увидели, что количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны. Другие опыты дают схожие результаты.
Значит,
Если между телами происходит теплоообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел.
На практике часто получается так, что отданная горячей водой энергия больше, чем полученная холодной. На самом деле, горячая вода при охлаждении передает какую-то часть своей внутренней энергии воздуху и сосуду, в котором происходит смешивание.
Есть 2 способа учесть этот фактор:
- Если мы максимально сократим потери энергии, то добьемся приблизительного равенства отданной и полученной энергий
- Если рассчитать и учесть потери энергии, то можно получить точное равенство
Расчет температуры при известной величине количества теплоты
При нагревании куска меди было затрачено $22 space кДж$. Масса этого куска составляет $300 space г$. Начальная температура была равна $20 degree C$. До какой температуры нагрели кусок меди?
Дано:
$m = 300 space г$
$t_1 = 20 degree C$
$c = 400 frac{Дж}{кг cdot degree C}$
$Q = 22 space кДж$
СИ:
$0.3 space кг$
$22 000 space Дж$
$t_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты:
$Q = cm(t_2 — t_1)$.
Постепенно выразим из этой формулы искомую температуру $t_2$:
$t_2 — t_1 = frac{Q}{cm}$,
$t_2 = frac{Q}{cm} + t_1$.
Рассчитаем $t_2$:
$t_2 = frac{22 000 space Дж}{400 frac{Дж}{кг cdot degree C} cdot 0.3 space кг} + 20 degree C approx 183 degree C + 20 degree C approx 203 degree C$.
Ответ: $t_2 approx 203 degree C$.
Содержание:
- Определение и формула количества теплоты
- Формула расчета теплоты при изменении температуры
- Формула количества теплоты при фазовых переходах
- Единицы измерения количества теплоты
- Примеры решения задач
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем,
что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом
случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система
микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии,
которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой).
Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики.
Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $delta Q$. Обратим внимание,
что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом.
Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$delta Q=C d T(1)$$
где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$delta Q=c m d T=nu c_{mu} d T(2)$$
где $c=frac{C}{m}$ – удельная теплоемкость тела, m – масса тела,
$c_{mu}=c cdot mu$ — молярная теплоемкость,
$mu$ – молярная масса вещества,
$nu=frac{m}{mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты
($Delta Q$), которое получает тело при увеличении его температуры на величину
$Delta t = t_2 — t_1$ можно вычислить как:
$$Delta Q=c m Delta t(3)$$
где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности
($Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты,
которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты
($delta Q$) равное:
$$delta Q=lambda d m$$
где $lambda$ – удельная теплота плавления, dm – элемент массы тела.
При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества.
При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$delta Q=r d m$$
где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура
одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$
где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 —
количество теплоты части воды температурой t1 и массой m1;
Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$
begin{array}{l}
mathrm{cmt}=mathrm{cm}_{1} t_{1}+mathrm{~cm}_{2} t_{2} rightarrow mathrm{mt}=mathrm{m}_{1} t_{1}+mathrm{~m}_{2} t_{2} rightarrow \
rightarrow rho mathrm{Vt}=rho V_{1} t_{1}+rho mathrm{V}_{2} t_{2} rightarrow mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2)
end{array}
$$
При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$
V=V_{1}+V_{2}(1.3)
$$$
Так, мы получаем систему уравнений:
$$
left{begin{array}{c}
V t=V_{1} t_{1}+V_{2} t_{2} \
V=V_{1}+V_{2}
end{array}right.
$$
Решив ее получим:
$$
begin{array}{l}
V_{1}=frac{left(t_{2}-tright)}{t_{2}-t_{1}} V \
V_{2}=frac{left(t-t_{1}right)}{t_{2}-t_{1}} V
end{array}
$$
Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$
begin{array}{l}
V_{1}=frac{(60-40)}{60-10} 200=80 text { (л) } \
V_{2}=frac{(40-10)}{60-10} 200=120 text { (л) }
end{array}
$$
Ответ. V1=80 л, V2=120 л.

236
проверенных автора готовы помочь в написании работы любой сложности
Мы помогли уже 4 396 ученикам и студентам сдать работы от решения задач до дипломных на отлично! Узнай стоимость своей работы за 15 минут!
Пример
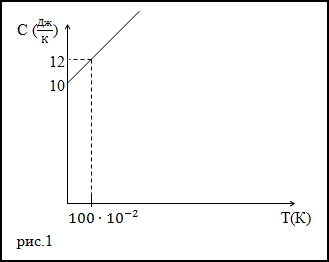
Задание. Теплоемкость тела изменяется по линейному закону (рис.1) в зависимости от абсолютной температуры в
рассматриваемом интервале $T_{1} leq T leq T_{2}$ .
Какое количество теплоты получает тело, если T1=300 К, T2=400 К.
Решение. Исследуя график функции теплоемкости (C(T)) (рис.1) запишем его аналитическое выражение, оно получится:
$C(T)=10+2 cdot 10^{-2} T$ (Дж/К)
Основой для решения задачи послужит формула для количества теплоты в виде:
$$delta Q=C d T(2.2)$$
Подставим полученное выражение для теплоемкости (2.1) в формулу (2.2) поведем интегрирование в заданном интервале температур:
$$
begin{array}{c}
Delta Q=int_{300}^{400}left(10+2 cdot 10^{-2} Tright) d T=left.left(10 cdot T+10^{-2} T^{2}right)right|_{300} ^{400}= \
=left(10 cdot 400+10^{-2} cdot(400)^{2}right)-left(10 cdot 300+10^{-2} cdot(300)^{2}right)=1700left(mathrm{~A}^{*}right)
end{array}
$$
Ответ. $Delta Q$=1700 Дж
Читать дальше: Формула напряженности магнитного поля.
На
прошлых уроках мы говорили о том, что изменить состояние термодинамической
системы можно двумя способами. Первый характеризуется передачей энергии в
процессе механического взаимодействия тел. Такую форму передачи энергии в
термодинамике (как и в механике) называют работой.
Второй
способ передачи энергии осуществляется при непосредственном обмене энергией
между хаотически движущимися частицами взаимодействующих тел. Если, например,
привести в соприкосновение два тела с разными температурами, то частицы более
нагретого тела будут передавать часть своей энергии частицам более холодного
тела. В результате внутренняя энергия первого тела уменьшается, а второго —
увеличивается.
Процесс
передачи энергии от одного тела к другому без совершения работы называют
теплопередачей.
Ещё
в восьмом классе мы говорили о том, что существуют три вида теплопередачи: это
теплопроводность, конвекция и излучение.
Давайте
вспомним, что теплопроводностью называется процесс теплообмена между телами
(или частями тела) при их непосредственном контакте. При теплопроводности
не происходит переноса вещества.
Конвекция
представляет собой теплопередачу нагретыми потоками жидкости или газа от одних
участков занимаемого ими объёма в другие (то есть конвекция сопровождается
переносом вещества). Она может протекать только в жидкостях и
газах, так как в твёрдом теле вещество не может перемещаться по объёму.
А
теплообмен при излучении осуществляется на расстоянии посредством
электромагнитных волн. Главной особенностью излучения
является то, что оно возможно не только в среде, но и в вакууме.
Количественной
мерой энергии, переходящей от одного тела к другому в процессе теплопередачи,
является количество теплоты.
Напомним,
что обозначается количество теплоты большой латинской буквой Q.
А единицей её измерения в СИ является джоуль (Дж). Но иногда для измерения
количества теплоты используют и внесистемную единицу — калорию.
Одна
калория — это количество теплоты, которое необходимо затратить, чтобы нагреть
один грамм воды на один градус Цельсия^ 1 кал = 4,19 Дж.
Основное
отличие работы от количества теплоты состоит в том, что работа характеризует
процесс изменения внутренней энергии системы, сопровождающийся превращением
энергии из одного вида в другой. Количество теплоты же характеризует процесс
передачи внутренней энергии от одних тел к другим (от более нагретых к менее
нагретым), не сопровождающийся превращениями энергии.
А
теперь давайте с вами вспомним от чего зависит количество теплоты. Для этого
давайте проведём несколько простых экспериментов. Возьмём два одинаковых сосуда
в которых находится разное количество воды, но при одинаковой температуре.
При
помощи электроплитки будем подводить тепло к сосудам. Спустя несколько минут
после включения плитки мы с вами заметим, что вода в сосуде с меньшим
количеством воды нагрелась на большее число градусов, хотя оба сосуда получили
одно и тоже количество теплоты. Следовательно, чем больше масса тела, тем
большее количество теплоты требуется к нему подвести для нагревания на одно и
тоже число градусов.
Продолжим
опыты. Опять берём два одинаковых сосуда, но с равным количеством воды при
одинаковой температуре. Будем нагревать воду в первом сосуде на 20 оС,
а во втором — на 60 оС. Включим секундомер одновременно с плиткой и
немного подождём.
На
нагревание воды на 20 оС тратится почти в три раза меньше времени,
чем на нагревание такой же массы воды, но на 60 оС. Значит, количество
теплоты пропорционально изменению температуры тела.
Теперь
пусть у нас в одном из сосудов находится вода, а во втором — такое же
количество бензина. Через несколько минут после включения нагревателей,
проверим температуры обеих жидкостей.
Не
трудно заметить, что, получив за одинаковый промежуток времени от нагревателя
равное с водой количество теплоты, бензин нагрелся сильнее. Значит, количество
теплоты, которое необходимо затратить для увеличения температуры тела, зависит
и от рода вещества, из которого это тело сделано:
При
остывании тела его конечная температура оказывается меньше начальной, и,
поэтому, количество теплоты, отдаваемой телом, отрицательно.
В
полученной нами в формуле коэффициент с — это удельная теплоёмкость
вещества. Она численно равна количеству теплоты, которую получает или отдаёт
вещество массой один килограмм при изменении его температуры на один кельвин
(или один градус Цельсия, так изменение температуры в этих шкалах совпадают).
Из
определения следует, что единицей удельной теплоёмкости в СИ является:
Значения
удельной теплоёмкости веществ определяют экспериментально.
Самую
большую удельную теплоёмкость, из представленных в таблице веществ, имеет вода.
Для нагревания одного её килограмма всего на один кельвин необходимо затратить
4200 Дж теплоты.
Обратите
внимание ещё и на то, что в этой таблице нет удельных теплоёмкостей газов. Дело
в том, что их удельная теплоёмкость зависит от того, при каком процессе
осуществляется теплопередача. Например, для нагревания газа при постоянном
давлении ему нужно передать большее количество теплоты, чем для его нагревания
при постоянном объёме, так как в первом случае газ будет расширяться и
совершать работу, а во втором — только нагреваться. Но об удельной теплоёмкости
газов мы с вами поговорим в одном из следующих уроков.
Следует
помнить, что формула, которую мы получили для определения количества теплоты,
справедлива только в том случае, если процесс теплопередачи НЕ сопровождается
изменением агрегатного состояния вещества. Давайте посмотрим, что же будет
происходить при фазовых переходах. Для этого проведём такой опыт. Возьмём два
сосуда в которые поместим разное количество льда, находящегося при температуре
плавления, и будем их нагревать. Не трудно заметить, что несмотря на постоянное
подведение теплоты, температура льда остаётся постоянной. И она не будет
изменяться до тех пор, пока весь лёд не перейдёт в жидкое состояние. Только
после этого температура образовавшейся изо льда воды начинает повышаться. При
этом, обратите внимание, что количество теплоты, которое необходимо
затратить на плавление кристаллического вещества, предварительно нагретого до
температуры плавления, прямо пропорционально массе этого вещества:
При
обратном процессе, то есть в процессе кристаллизации, такое же количество
теплоты вещество будет отдавать:
Коэффициент
пропорциональности λ, входящий в формулу, называется удельной
теплотой плавления. Она численно равна количеству теплоты, необходимому для
превращения кристаллического вещества массой один килограмм, взятого при
температуре плавления, в жидкость той же температуры:
Из
определения следует, что единицей измерения удельной теплоты плавления в СИ
является джоуль, делённый на килограмм:
Продолжим
наши опыты. Пусть у нас есть сосуд с водой, к которому постоянно подводится
теплота. Пока нагреваемая жидкость не кипит, часть сообщаемой ей энергии
расходуется на компенсацию потери энергии при испарении, а часть — на
увеличение внутренней энергии, о чём свидетельствует увеличение её температуры.
Однако,
когда жидкость закипит, её температура перестаёт меняться, хотя теплота
продолжает подводится. Очевидно, что теперь вся подводимая теплота расходуется
на переход жидкости в газообразное состояние. И так происходит до тех пор, пока
вся жидкость не превратится в пар.
Таким
образом, чтобы превратить в пар жидкость при температуре кипения, необходимо
передать ей определённое количество теплоты, которое прямо пропорционально
массе жидкости:
При
конденсации пара происходит выделение такого же количества теплоты:
Коэффициент
пропорциональности «Эр» (r),
входящий в формулу, называется удельной теплотой парообразования. Он
численно равен количеству теплоты, которое необходимо передать жидкости массой
один килограмм, находящейся при температуре кипения, для превращения её при
постоянной температуре в пар:
Из
определения следует, что единицей измерения удельной теплоты плавления в СИ
является джоуль на килограмм:
В
заключение отметим, что при теплообмене двух или нескольких тел абсолютное
значение количества теплоты, которое отдало более нагретое тело, равно
количеству теплоты, которое было получено более холодным телом.
Учитывая,
что отданное количество теплоты считается отрицательным, а полученное —
положительным, получается, что при теплообмене между телами, образующими
теплоизолированную систему, суммарное количество теплоты, полученное ими,
равняется нулю:
Записанное
нами равенство называется уравнением теплового баланса и выражает, по
сути, закон сохранения энергии.
Расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении
- Школьникам: Сотка, Фоксфорд, Тетрика, Skysmart, Алгоритмика.
- Английский: Инглекс, Skyeng, Puzzle, Novakid.
- Взрослым: Skillbox, Нетология, Geekbrains, Яндекс, SkillFactory, Уроки легенд, Skypro.
Для решения практических задач требуется знать количество теплоты, потребное для нагревания конкретного тела до определенной температуры. Такие ситуации могут возникнуть, например, при расчете систем отопления зданий и сооружений, при оценке потерь тепла через системы вентиляции, проемы в стенах и т.п. Также приходится решать и обратные задачи – расчет количества тепла, отдаваемого телом при остывании. Это может понадобиться при расчете систем нагрева воды для использования ее для обогрева и т.п.
Исходные данные для расчета количества теплоты
Чтобы рассчитать количество теплоты, потребное для нагрева тела или количество теплоты, отдаваемого при остывании, необходимы следующие данные:
- с — удельная теплоемкость вещества, из которого состоит тело (берется из справочников);
- ∆t — изменение температуры, которое надо в итоге получить (вычисляется, как разность начальной и конечной температур тела
);
- масса тела m.
Требуемое количество теплоты вычисляется по формуле .
Примеры расчетов количества теплоты
В качестве итога – несколько примеров на расчет количества теплоты в различных ситуациях.
Пример 1 – расчет количества теплоты для нагревания тела
Вычислить величину Q, потребную для нагревания медной пластины весом 2 кг от 25 до 200 градусов.
Для этого надо воспользоваться формулой . Разность температур
составит 200-25=175 градусов.
Удельная теплоемкость меди берется из таблицы, она равна 385 . Окончательно подставляя все данные в формулу, можно получить потребное количество теплоты Q=385*2*175=134750 Джоулей или 134,75 кДж.
Пример 2 – определение количества теплоты при остывании
Какое количество теплоты отдадут три литра воды при остывании от 100 до 20 градусов?
Теплоемкость воды (справочные данные) – 4200 (точнее – 4183) , разность температур – 80 градусов. Вычисления дают результат Q=4183*3*80, что приблизительно равно 1000000 Джоулей=1000 кДж, или 1 МДж. В калориях эта величина составит 1000000*0,2388 – около 240000 кал=240 килокалорий.
Эту величину можно получить другим путем. Как известно, 1 калория – это количество теплоты, потребное для нагревания 1 г воды на 1 градус. В данном примере 3000 г воды нагревается на 80 градусов, отсюда 3000*80=240000 калорий. Поэтому калорию, как единицу измерения, удобно применять в теплотехнике там, где применяется водяное отопление.
Пример 3 — нагревание одновременно двух тел
Пусть имеется железный чайник массой 1 кг. В него налили воду объемом 2 литра (при нормальных условиях). Начальная температура чайника и воды — +25 градусов С. Какое количество теплоты потребуется, чтобы вскипятить воду?
В данном случае чайник и вода нагреваются одновременно, между ними существует постоянный теплообмен. Поэтому оба тела надо нагреть до одной и той же температуры, и .
, и
. При вычислении получается, что
=439*1*75=3675 Дж. Чтобы нагреть воду потребуется
4200*2*75=63000 Дж. И общее количество теплоты, потребное для того, чтобы вскипятить чайник, равно Q=63000+3675=63375 Дж.
Пример 4 – смешивание воды с различной температурой
Приготовлена смесь из 800 граммов воды с температурой 25 градусов и 200 граммов воды с температурой 100 градусов. Полученная смесь имеет температуру 40 градусов. Какое количество теплоты получила первая (холодная) порция смеси? Какое количество теплоты отдала вторая (горячая) порция смеси?
Холодная порция воды нагрелась от 25 градусов до 40, и =15 градусов. Учитывая, что масса порции равна 0,8 кг, а теплоемкость воды равна 4200 , можно вычислить, что для нагревания потребовалось Q=4200*0,8*15=50400 Дж.
Горячая порция остыла со 100 до 40 градусов, отсюда =100-40=60 градусов. Воспользовавшись формулой для количества теплоты, получается, что горячая порция отдала Q=4200*0,2*60=50400 Дж. Следовательно, горячая вода отдала столько же тепловой энергии, сколько получила холодная.