Тест «Щелочные и
щелочноземельные металлы, алюминий, железо»
1. Самый
распространенный металл, входящий в состав земной коры, – это …
А) железо; Б) кальций; В) алюминий;
Г) натрий.
I. Щелочные и щелочноземельные металлы и их
соединения.
2. При горении натрия на
воздухе образуется …
А) Na2O; Б) NaO2; В) Na2O2; Г) Na3N.
3. Какие из перечисленных
металлов способны вытеснять водород из воды при комнатной температуре?
А) медь; Б) натрий; В) железо; Г)
кальций.
4. С какими из следующих
веществ реагирует калий?
А) Na2O; Б) S; В)
H2O; Г) Ca(OH)2.
5. С какими из следующих
веществ реагирует гидроксид калия?
А) CO2; Б)
NaCl; В) HNO3; Г) Zn(OH)2.
6. Все s-металлы
очень активны и поэтому …
А) самовоспламеняются на воздухе;
Б) хранятся в воде;
В) хранятся в керосине;
Г) способны взаимодействовать со всеми
металлами, стоящими в ряду активности после водорода.
7. Поскольку внешние
электроны s-металлов находятся далеко от ядра и легко
переходят к другим элементам, все s-металлы
являются …
А) типичными изоляторами;
Б) сильными восстановителями;
В) окислителями;
Г) типичными катализаторами в
органических реакциях.
8. Элементы всех s-металлов
встречаются в природе только в виде …
А) свободных металлов;
Б) гидрокарбонатов или карбонатов;
В) соединений;
Г) ионов в морской воде.
9. При взаимодействии
щелочных металлов с водой образуются …
А) гидриды и кислород; В) пероксиды и водород;
Б) щелочи и водород; Г) супероксиды и
озон.
II. Алюминий и его соединения.
10. Какова электронная конфигурация иона Al3+?
А) 1s2; В) 1s22s22p63s23p6;
Б) 1s22s22p6;
Г) 1s22s22p63s23p1.
11. С какими из следующих
веществ реагирует оксид алюминия?
А) H2O; В)
NaOH;
Б) N2;
Г) H2SO4.
12. С какими из следующих
веществ реагирует алюминий?
А)
СO2; В)
NaCl;
Б) Br2; Г) KOH.
13. Какие вещества
образуются при взаимодействии Al2O3 с КОН?
А)
Al(OH)3; В)
H2O;
Б) K2O; Г)
KAlO2.
14. Растворы каких
веществ имеют кислую реакцию среды (рН<7)?
А)
KAlO2; В)
KAlO3;
Б) Al2(SO4)3;
Г) Al(NO3)2.
15. В чем растворяется Al(OH)3?
А)
раствор NaOH; В) H2O;
Б) раствор KCl; Г) раствор H2SO4.
16. В виде свободного
металла алюминий в природе не встречается, он входит в состав нескольких руд и
минералов, например, таких как …
А)
мрамор, кварц, бура; В) асбест, битум, гликоль;
Б) бирюза, малахит, пирит; Г)
боксит, глинозем, нефелин.
17. Алюминий в
промышленности получают …
А)
электролизом раствора Al(OH)3;
Б) электролизом расплава AlCl3;
В) реакцией железотермии: Al2O3 + 2Fe = 2Al + Fe2O3;
Г) электролизом расплава Al2O3.
18. Одним из самых
известных сплавов алюминия является …
А)
бронза; В) дюралюмин;
Б) латунь; Г)
чугун.
III. Железо и его соединения.
19. В каких из указанных
соединений железо имеет степень окисления +3?
А) NaFeO2; В) K3[Fe(CN)6];
Б) K4[Fe(CN)6]; Г)
FeO3.
20. При помощи каких
веществ можно обнаружить в растворе ионы Fe3+?
А) K3[Fe(CN)6]; В)
KCNS;
Б) K4[Fe(CN)6];
Г) NaOH.
21. С какими из указанных
веществ реагирует Fe(OH)2?
А) О2 + Н2О; В)
раствор HCl;
Б) раствор NaCl; Г) раствор NaOH.
22. Какие вещества
образуются при взаимодействии Fe(OH)3 и H2SO4?
А) Н2О; Б) FeSO4; В) Fe2(SO4)3; Г) FeS.
23. Растворы каких
веществ имеют щелочную реакцию среды (рН>7)?
А) FeCl2; Б) KFeO2; В) FeCl3; Г) FeSO4.
24. Назовите ошибочное
утверждение, относящееся к гидроксиду железа (III): Fe(OH)3 – это …
А) очень слабое основание;
Б) амфотерный гидроксид, дающий ферриты при сплавлении
со щелочами;
В) практически нерастворимое в воде вещество;
Г) очень сильный электролит.
25. Как можно очистить раствор
сульфата железа (II) от примеси сульфата меди (II)?
А) добавить раствор BaCl2;
Б) добавить раствор AgNO3;
В) опустить в раствор на некоторое время железный
гвоздь;
Г) осторожно прилить к раствору царскую водку.
26. При горении порошкообразного
железа на воздухе в интервале температур 150-6000С образуется
…
А) Fe3O4; Б) FeO; В) Fe2O3; Г) FeO3.
27. В какой цвет
окрашивают пламя соли, содержащие катионы натрия и кальция?
28. Напишите качественную
реакцию на катион алюминия в ионном виде.
29. Напишите две наиболее
известные качественные реакции на катион железа (II) в ионном виде.
Железо и его соединения
Автор скрыт
14.02.2022.
Тест. Химия, 11 класс
Внимание! Все тесты в этом разделе разработаны пользователями сайта для собственного
использования.
Администрация сайта не
проверяет возможные ошибки,
которые могут встретиться в тестах.
Тест «Железо и его соединения» позволит оценить знания обучающихся по основным вопросам темы, что важно при подготовке к ЕГЭ.
Список вопросов теста
Вопрос 1
В КАКИХ из указанных соединений железо имеет степень окисления +3?
А) NaFeO2;
Б) K4[Fe(CN)6];
В) K3[Fe(CN)6];
Г) FeO3.
Вопрос 2
При помощи КАКИХ веществ можно обнаружить в растворе ионы Fe3+?
А) K3[Fe(CN)6];
Б) K4[Fe(CN)6];
В) KCNS;
Г) NaOH.
Вопрос 3
С какими из указанных веществ реагирует Fe(OH)2?
А) О2 + Н2О;
Б) раствор NaCl;
В) раствор HCl;
Г) раствор NaOH.
Вопрос 4
Какие два вещества образуются при взаимодействии Fe(OH)3 и H2SO4?
А) Н2О;
Б) FeSO4;
В) Fe2(SO4)3;
Г) FeS.
Вопрос 5
Раствор какого вещества имеет щелочную реакцию среды (рН>7)?
А) FeCl2;
Б) KFeO2;
В) FeCl3;
Г) FeSO4.
Вопрос 6
Назовите ошибочное утверждение, относящееся к гидроксиду железа (III): Fe(OH)3 – это …
Варианты ответов
- очень слабое основание
- амфотерный гидроксид, дающий ферриты при сплавлении со щелочами
- практически нерастворимое в воде вещество
- очень сильный электролит
Вопрос 7
Как можно очистить раствор сульфата железа (II) от примеси сульфата меди (II)?
Варианты ответов
- добавить раствор BaCl2
- добавить раствор AgNO3
- опустить в раствор на некоторое время железный гвоздь
- осторожно прилить к раствору царскую водку
Вопрос 8
При горении порошкообразного железа на воздухе в интервале температур 150-6000С образуется …
Варианты ответов
- Fe3O4
- FeO
- Fe2O3
- FeO3
Вопрос 9
Восстановление железа происходит в реакции:
А) 2Fe + 3Cl2 = 2FeCl3;
Б) FeCl3 + 3NaOH = Fe(OH)3¯ + 3NaCl;
В) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
Г) FeO + CO = Fe + CO2.
Вопрос 10
Наибольшая массовая доля железа в руде (около 72%), которая называется:
Варианты ответов
- магнитный железняк
- красный железняк
- бурый железняк
- пирит или железный колчедан
[2] сильнейший
восстановитель;
[3] растворимая в
воде соль фиолетового цвета;
[4] реактив, используемый
для качественного обнаружения
фторид-ионов.
20. При прокаливании
перманганата калия происходит следующее
превращение:
[1] 2КМn04
= К2МnO4
+ МnO2
+ O2↑;
[2] 2КМn04
= К2O2
+ 2МnO2
+ O2↑;
[3]
4КМn04
= 2КаМnO4
+ 2МnО
+ 5O2↑;
[4] соль возгоняется.
21. Высшую степень
окисления +7 марганец имеет в…
[1] манганате натрия
Na2Mn04;
[2] оксиде Мn02;
[3] сульфате
марганца MnS04;
[4] перманганате
калия КМn04.
22. При окислении
толуола перманганатом калия или
дихроматом калия в кислой среде
получают…
[1] щавелевую кислоту;
[2] стеариновую
кислоту;
[3] берлинскую лазурь;
[4] бензойную кислоту.
23. Назовите неизвестные
вещества
Х1
и Х2
следующей последовательности превращений:
Fe(OH)3
X1
X2
FeS
[1] X1—FeO;
X2—Fe(SO4)3.
[2] X1.—FeCl3
;
X2—Fe(NO3)3
[3] X1
–Fe2O3
; X2—FeCl2
[4] X1-Fe(N
O
3)3;X2—FeBr3
24. Назовите ошибочное
утверждение, относящееся к гидро-ксиду
железа (III);
Fe(OH)3
— это…
[1] очень слабое
основание;
[2] амфотерный
гидроксид, дающий ферриты при сплавлении
со щелочами;
[3] практически
нерастворимое в воде вещество;
[4] очень сильный
электролит.
25. . Пентакарбонил
железа Fe(C
O)5
— это…
[1] желтая летучая
жидкость;
[2] кристаллическое
вещество оранжевого цвета;
[3] газ, разлагающийся
на Fe
и Со при легком нагревании;
[4] высокоэффективное
ракетное топливо.
26. Какие два вещества
вступили в реакцию, если в результате
образовалось единственное вещество —
гидроксид железа (III)?
[1] Fe2O3
и Н2O;
[2] Fe
и Н2O
2;
[3] Fe(OH)2
и Н2O
2;
[4] Fe3O
4 и Н2O
2.
27. В каком соотношении
по массе следует взять две навески меди,
чтобы при внесении одной в концентрированную
серную кислоту, а второй — в разбавленную
азотную кислоту выделились равные
объемы газов?
[1] 2 : 3;
[2] 3 : 2;
[3] 1 : 1;
[4] 1:4.
28. Из известных
медных руд наиболее богат медью…
[1] куприт Cu2O;
[2] халькозин Cu2S;
[3] халькопирит
CuFeS2;
[4] малахит CuCO
3
3Cu(OH)2.
29. Какие два вещества
вступили в реакцию, если в результате
образовались Cu2S
+ NH4HS
+ Н2O?
[1] CuNO3 +
H2SO4(KOHЦ);
[2] CuS +
HNO3(paз6);
[3]
[Cu(NH3)2]OH
+ H2S;
[4]
[Cu(NH3)2]SO4
+ H2O2.
30. Как можно очистить
раствор сульфата железа (II)
от примеси сульфата меди (II)?
[1] добавить раствор
ВаС12;
[2] добавить раствор
AgNO3;
[3] опустить в раствор
на некоторое время железный гвоздь;
[4] осторожно прилить
к раствору царскую водку.
31. Для качественного
обнаружения катионов Fe3*
используют реакцию с…
[1] желтой кровяной
солью;
[2] гексацианоферратом
(П) калия;
[3] роданидом аммония;
[4] красной кровяной
солью.
ПРОМЫШЛЕННОЕ
ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВАЖНЕЙШИХ
НЕОРГАНИЧЕСКИХ
ВЕЩЕСТВ
1. В химической
промышленности вместо привычных
школьнику понятий «химические соединения»,
«реагенты» и т. п. гораздо чаще используются
термины «исходные материаы», «сырье»,
«руда», «полезные ископаемые», «минералы».
Минералами называют…
[1] химические
соединения, содержащее максимальное
количество определенного химического
элемента;
[2] природные твердые
вещества с определенным химическим
составом и кристаллической структурой;
[3] все драгоценные
камни и металлы;
[4] кристаллические
вещества, нерастворимые в воде.
2. Минералы могут
образовываться в результате физических
и химических процессов, происходящих…
[1] в глубинах и на
поверхности Земли;
[2] на Луне, других
планетах Солнечной системы;
[3] при высоких
температурах и давлениях в химических
реакторах;
[4] в атмосфере Земли
при мощных грозовых разрядах.
3. Укажите на ошибочное
утверждение относительно минералов.
Минералы могут быть составной частью…
[1] горных пород;
[2] руд;
[3] метеорологии;
[4] метеоритов.
4.Руда — это…
[1] любое вещество,
образовавшееся в природных условиях;
[2] природное
минеральное образование с таким
содержанием металлов, или неметаллов,
или полезных минералов, которое
обеспечивает экономическую целесообразность
их извлечения;
[3] минерал, извлеченный
из метеорита;
[4] исходное сырье
для получения аммиака.
5. Чтобы химический
процесс, проводимый в промышленных
масштабах, был экономически оправдан,
необходимо…
[1] использовать
высокоэффективные катализаторы;
[2] чтобы процесс был
экзотермическим;
[3] обеспечить
максимально достижимый выход продукта
реакции;
[4] достичь оптимального
выхода целевого продукта из сырьевых
материалов.
6. Наука о наиболее
экономичных и экологически целесообразных
методах химической переработки сырьевых
природных материалов в продукты
потребления называется…
[1] физическая химия;
[2] политическая
экономия;
[3] химическая
технология;
[4] химическая
кибернетика.
7. Примерами руд или
минералов могут служить…
[1] негашеная известь,
сода, желтая кровяная соль;
[2] гашеная известь,
поташ, тиосульфат натрия, поваренная
соль;
[3] бертолетова соль,
хлорная известь, дихромат калия,
олеум;
[4] гипс, пирит,
глауберова соль, куприт.
8.Назовите вещества,
для промышленного получения которых
главным исходным сырьем является морская
вода.
[1] хлор, фтор, натрий;
[2] бром, иод, магний;
[3] калий, бор, алюминий;
[4]
медь, золото,
бром.
9. Одно из наиболее
распространенных веществ в морской
воде — хлорид магния. В кубическом
километре морской воды содержится 6,75
106
т этого вещества. Вычислите максимальное
количество хлорида магния, которое
можно извлечь из 1 м3
морской воды.
[1] 18 моль MgCl2;
[2] 36 моль MgCl2;
[3] 1 кмоль MgCl2;
[4] 2 кмоль MgCl2.
10. Получение многих
веществ в промышленности производится
электролитически. Так, электролизом
водного раствора NaCI
получают одновременно…
[1] кислород
и хлор;
[2] натрий и водород;
[3] кислород,
водород и оксид натрия;
[4] водород, хлор и
гидроксид натрия.
12. Медь получают из
минерала…
[1]
боксита;
[2] пирита;
[3] халькопирита;
[4] глинозема.
13. Среди всех металлов
бесспорными лидерами в практическом
использовании являются два металла:
[1] медь
и золото;
[2] медь и железо;
[3] цинк и алюминий;
[4] алюминий и железо.
14. Исходным сырьем
при электролитическом получении алюминия
(рис. 20.2) служит…
Контейнер
для оксида алюминия
Графитовый
анод
Оксид
алюминия в криолите
Расплавленный
алюминий
Покрытый
графитом стальной катод
Рис. 20.2. Схема
электролитического получения алюминия
[1] магнетит;
[2] боксит;
[3] малахит;
[4] мрамор.
15. Схема на рис. 20.2
подсказывает, что для выплавки алюминия
« электропечах используют криолит.
Криолит в
свою очередь
получают обработкой плавиковой кислотой
смеси, содержащей гидроксид алюминия
и гидроксид натрия. Напишите уравнение
реакции получения криолита.
[1] NaOH+А1(ОН)3+НС1
= Na[Al(OH)4]
+ NaCl
+ Н2O;
[2] NaOH +
Al(OH)3
+ 2H2SO4
= NaAl(SO4)2
H2O;
[3] NaOH
+2А1(ОН)3+H2C03
=А12O3
+NaHCO3
+4Н2O;
[4] 3NaOH
+ А1(ОН)3
+ 6HF
= Na3AlF6
+ 6Н2O.
16. С помощью электролиза
проводят очистку некоторых металлов.
Какой анод необходимо использовать при
получении электролитически чистой
меди, подвергая электролизу хлорид меди
(II)?
[1] медный;
[2] платиновый;
[3] графитовый;
[4] стальной.
17. На практике
основные количества железа используют
не в чистом виде, а в виде сплавов с
углеродом и некоторыми другими
компонентами; а) чугуны и б) стали — это
сплавы железа, содержащие…
[1] а)
> 2% углерода; б) < 1,5% углерода;
[2] а)
< 2% углерода; б) > 2,0% углерода;
[3] а) до 10% никеля; б)
до 10% хрома;
[4]
а) > 2,5% кремния;
б) до 5% кремния.
18. Содержание углерода
в чугуне обусловлено химическими
процессами, происходящими в доменной
печи (рис. 20.3). Загрузку доменной печи
компонентами производят через ее верхнюю
часть. Загрузка содержит три основных
компонента, перечисленных ниже; один
из компонентов назван ошибочно, отметьте
его:
Топочный газ
4000С
8000С
14000С
Шлак
Горячее дутье
Чугун в чушках
Шлак
Железо
Рис. 20.3. Схема
доменного процесса
[1] железная руда —
источник железа;
[2] кокс — топливо и
восстанавливающий агент;
[3] криолит — для
понижения температуры плавления смеси;
[4]
известняк —
для образования шлака, растворяющего
примеси, имеющие высокие температуры
плавления.
19. Неочищенное железо
из доменной печи (чугун) содержит в
качестве примесей > 2% углерода (из
кокса),
а также кремний (иногда еще фосфор и
серу) из песчаных примесей, присутствующих
в руде. Эти примеси делают железо очень
хрупким, поэтому их необходимо удалить.
Это происходит…
[1]
в аппарате
Киппа при обработке чугуна соляной
кислотой;
[2] в
особом контейнере, где происходит
реакция алюмотермии;
[3] в конверторе
Бессемера или Томаса при превращении
чугуна в сталь;
[4] в
диафрагменном электролизере с платиновыми
электродами, на которых происходит
полное удаление примесей.
20. Конвертор,
используемый для производства стали,
представляет собой…
[1] большой грушевидный
(ретортообразный) металлический
резервуар, футерованный изнутри
огнеупорным материалом и способный
вращаться вокруг горизонтальной оси;
[2] компактный сосуд,
выполненный из жаропрочного полимера
— тефлона;
[3] электрическую
печь, в которой примеси чугуна окисляются
кислородом;
[4] жаропрочный сосуд,
выполненный из высокочистого аллотропа
углерода — фуллерена.
21. Перечислите
вещества, которые в бессемеровском
способе получения сталей являются а)
окислителями, б) восстановителями.
[1] а) O2,
FeO;
б) С, Si,
P,
Мn;
[2] а) СO2,
СО; б) O2,
SiO2,
P2O5;
[3] а) СО, Fe2O3,
Si;
б) Р2O8,
Мn,
СO2;
[4] а)
С12,
S, Fe; б)
С12O,
SO2,
FeO.
22. Огромные количества
аммиака необходимы для получения
азотсодержащих удобрений. В настоящее
время во всем мире ежегодно производится
более… аммиака.
[1] 500 т;
[2] 5 млн. т;
[3J
1000 т;
[4] 20000 кг.
23. Современный
процесс получения аммиака основан на…
[1] реакции гидролиза
цианамида: CaCN2
+ 3Н2O
=
= 2NH3↑
+ CaCO3;
[2] действии гашеной
извести на хлорид аммония при нагревании:
Са(ОН)2+
2NH4C1=СаС12+
2NH3↑+
2Н2O;
[3] разложении фосфата
аммония при нагревании:
(NH4)3PO
4
Н3РO
4 + 3NH3
↑;
[4] его синтезе из
азота и водорода при температура
400-500°С и давлениях 250-300 атм с использванием
специального катализатора: N2
+ Н2
↔
2NH3.
24. Ежегодное
производство серной кислоты с помощью
контактного процесса к концу 20 столетия
достигла 100 млн. т. Контактный способ
получения H2S04
включает три стадии. Запишите уравнения
химических реакций, происходящих на
каждой стадии.
[1] 1) S
+ 4HNO3
= SO2↑
+ 4NO2↑
+ 2Н2O;
-
2NO2
+ 2SO2
= 2SO3
+ 2NO;
-
SO3
+ H2O
= H2SO
4;
[2] 1) S
+ O2
= SO2;
2) 2SO2
+ O2
↔ 2SO3;
3) SO3
+ H2O
= H2SO
4;
[3]
1)
4FeS2
+ 11O2
= 2Fe2O3
+ 8SO2↑;
2) 2SO2
+ O2↔
2SO3;
3) SO3
+ H2O
= H2SO4;
[4] 1) 2NaOH +
SO2
= Na2SO3
+ H2O;
-
Na2SO3
+ 2НС1 = H2SO3
+ 2NaCl;
-
H2SO3
+ H2O2
= H2SO4
+ H2O.
25. На третьей стадии
получения серной кислоты поглощение
SO3
на самом деле производят не водой, а
98%-ным раствором серной кислоты. Это
связано с тем, что…
[1] при
растворении SO3
в 98%-ном растворе процесс каталитически
ускоряется;
[2]
непосредственное
поглощение SO3
водой малоэффективно, поскольку пары
воды над ее поверхностью образуют туман
из крошечных капелек серной кислоты,
препятствующих дальнейшему растворению
SO3;
[3] непосредственная
реакция S03
+ H20
= H2S04
требует больших затрат теплоты
(эндотермическая реакция);
[4] оксид серы (VI)
не растворяется в воде, поскольку сразу
же oбразуются
нерастворимые гидраты SO3xH2O¯.
26. Из 240 кг пирита
было получено 294 кг серной кислоты.
Рассчитайте выход серной кислоты.
[1] 89%;
[2] 75%;
[3] 50%
[4] 39,5%.
27. Процесс промышленного
получения азотной кислоты включает
следующие три стадии:
[1] 1)
(NH4)2Cr2O7
= Cr2O3
+ N2
↑ + 4Н2O;
-
2N2
+ 5O2
— 2N2O5;
-
N2O5
+ Н2O
= 2HNO3;
[2] 1) 4NH3
+ 3O2
= 2N2
↑ +
6Н2O;
-
2N2
+ 5O2
= 2N2O5;
-
N2O5
+ H2O
= 2HNO3;
[3] 1) NH4NO3
= N2O
+ 2H2O;
-
2N2O
+ 3O2
= 4NO2;
-
4NO2
+ O2
+ 2H2O
= 4HNO3;
[4] 1) NH3
+ 5O2
4NO↑
+ 6H2O;
-
2NO +
O2
= 2NO2;
-
4N02
+ O2
+ 2H2O
= 4HNO3.
28. Высокоэффективное
фосфорное удобрение — преципитат
получают…
[1] взаимодействием
аммиака с фосфорной кислотой:
NH3
+ Н3Р04
= NH4H2P04
+ Н20;
[2] обработкой апатита
серной кислотой: Са3(Р04)2
+
+ H2S04
— Са(Н2Р04)2
2CaS04;
[3] частичной
нейтрализацией раствора фосфорной
кислоты гидроксидом кальция: Са(ОН)2
+ Н2Р04
=
= СаНР04
2Н20;
[4] обработкой
фосфорита фосфорной кислотой: Са3(Р04)2
+ 4Н3Р04
= 3Са(Н2Р04)2.
29. Рассчитайте
необходимые массы кремнезема, карбоната
натрия и известняка для приготовления
оконного стекла массой 150 кг следующего
состава: 6,813SiO2
СаО
l,535Na2O.
[1] 100 кг Si,
200 кг Na2CO3
и 115 кг Са(ОН)2;
[2] 1095 кг SiO2,
435 кг Na2CO3
и 270 кг СаС03;
[3] 964 кг Na2SiO3,
415 кг Na2CO3
и 196 кг СаО;
[4] 1115 кг CaSiO3,
444 кг Na2C03
и 250 кг [Са(ОН)]2С03.
30. Для получения
цветных стекол в исходную шихту добавляют
оксиды переходных d-металлов.
Добавка какого оксида определяет а)
фиолетовый и б) изумрудно-зеленый цвет
стекла?
[1] а) СuО;
б) Ag2O;
[2] а) МnО;
б) Сr2O3;
[3] a)
ZnO;
б) МnО;
[4] a)
Fe2O3;
б) СuО.
31. В порошковой
металлургии высокочистый порошок железа
получают разложением пентакарбонила
железа. Вычислите необходимую массу
пентакарбонила железа для получения 5
кг порошкообразного железа.
[1] 12,9 кг
K4[Fe(CN)6];
[2] 13,8 кг
K3[Fe(CN)6];
[3] 10 кг
Fe4[Fe(CN)6]3;
[4] 17,5 кг
Fe(CO)5.
32. Сера встречается
в природе в свободном виде (самородная
сера), однако извлечение ее из подземных
залежей — непростая задача. Решают эту
задачу…
[1] методом Сольвэ;
[2] с помощью процесса
Габера;
[3] по принципу Паули;
[4] методом Фраша
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
11.02.2015656.9 Кб3А.doc
- #
| Гидроксид железа(III) | |
| Общие | |
|---|---|
| Систематическое наименование | Гидроксид железа(III) |
| Традиционные названия | Гидроокись железа |
| Химическая формула | Fe(OH)3 |
| Физические свойства | |
| Состояние (ст. усл.) | красновато-коричневые кристаллы |
| Молярная масса | 106,87 г/моль |
| Плотность | 3,4-3,9 г/см³ |
| Термические свойства | |
| Температура плавления | разл. 500 °C |
| Энтальпия образования (ст. усл.) | -824,5 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 2,03·10-8 г/100 мл |
Гидроксид железа(III) — неорганическое соединение, гидроксид металла железа с формулой Fe(OH)3, красновато-коричневые кристаллы, не растворяется в воде.
Получение
- В природе встречается минерал лимнит (разновидность лимонита), по составу совпадает с Fe(OH)3.
- Действие щелочей на растворимые соли железа(III):
Физические свойства
Гидроксид железа(III) образует красновато-коричневые кристаллы кубической сингонии, параметры ячейки a = 0,571 нм.
Трудно растворим в воде, легко образует коллоидные растворы.
Химические свойства
- При частичной дегидратации разлагается до железистой кислоты (или метагидроксида железа):
- Разлагается при нагревании:
- Реагирует с кислотами:
- и щелочами:
Применение
- Очистка газов от сероводорода.
- Противоядие при отравлении мышьяком.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
|
Соединения железа |
|---|
|
Арсениды железа • Бромид железа(II) (FeBr2) • Бромид железа(II,III) (Fe3Br8) • Бромид железа(III) (FeBr3) • Гексацианоферрат(II) калия (K4[Fe(CN)6]) • Гексацианоферрат(III) калия (K3[Fe(CN)6]) • Гидроксид железа(II) (Fe(OH)2) • Гидроксид железа(III) (Fe(OH)3) • Динитрозилдикарбонилжелезо (Fe(CO)2(NO)2) • Диоксоферрат(III) натрия (NaFeO2) • Дисульфид(2-) железа(II) (Fe(S2)) • Додекакарбонилтрижелезо (Fe3(CO)12) • Железистосинеродистая кислота (H4[Fe(CN)6]) • Железосинеродистая кислота (H3[Fe(CN)6]) • Иодид железа(II) (FeI2) • Иодид железа(II,III) (Fe3I8) • Карбиды железа • Карбонат железа(II) (FeCO3) • Метагидроксид железа (FeO(OH)) • Нитрат железа(II) (Fe(NO3)2) • Нитрат железа(III) (Fe(NO3)3) • Нитрид дижелеза (Fe2N) • Нитрид тетражелеза (Fe4N) • Нитропруссид калия (K2[Fe(CN)5NO]) • Нитропруссид натрия (Na2[Fe(CN)5NO]) • Нонакарбонилдижелезо (Fe2(CO)9) • Оксалат железа(II) (FeC2O4) • Оксалат железа(III) (Fe2(C2O4)3) • Оксид железа(II) (FeO) • Оксид железа(III) Fe2O3 • Оксид железа(II,III) (Fe3O4) • Оксид железа(III) (Fe2O3) • Оксихлорид железа FeOCl • Олеат железа(III) ((C17H33COO)3Fe) • Пентакарбонилжелезо (Fe(CO)5) • Резинат железа(III) ((C19H29COO)3Fe) • Соль Мора (FeSO4·(NH4)2SO4·6H2O) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат железа(III)-калия (KFe(SO4)2) • Сульфид железа(II) (FeS) • Сульфид железа(II,III) (Fe3S4) • Сульфид железа(III) (Fe2S3) • Тартрат железа(II) (C4H4FeO6) • Тетракарбонилдигидриджелезо (H2Fe(CO)4) • Тетракарбонилжелезо (Fe(CO)4) • Тетранитрозил железа (Fe(NO)4) • Тиоцианат железа(II) (Fe(SCN)2) • Тиоцианат железа(III) (Fe(SCN)3) • Титанат железа(II) (FeTiO3) • Феррат калия (K2FeO4) • Фосфат железа(II) (Fe3(PO4)2) • Фосфат железа(II,III) (Fe4(PO4)3) • Фосфат железа(III) (FePO4) • Фосфиды железа • Фторид железа(II) (FeF2) • Фторид железа(III) (FeF3) • Хлорид железа(II) (FeCl2) • Хлорид железа(II,III) (Fe3Cl8) • Хлорид железа(III) (FeCl3) • Хромат железа(III) (Fe2(CrO4)3) • Хромит железа(II) (Fe(CrO2)2) Цианид железа(II) (Fe(CN)2) |
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
-
ЕГЭ по химии 2023
- /
-
Задание 5
- /
- Задача 205
- /
В перечне веществ А) Fe(OH)3 Б) NaHCO 3 В) H 2 O Г) H 2 O 2 Д) Ca(OH) 2 Е) …
Разбор сложных заданий в тг-канале:
Сложность:
Среднее время решения: 14 сек.
ЕГЭ по химии 2023 задание 5: номер 205 | В перечне веществ А) Fe(OH)3 …
15
В перечне веществ
А) Fe(OH)3 Б) NaHCO3 В) H2O Г) H2O2 Д) Ca(OH)2 Е) NaOH
гидроксидами являются
- АБГ
- АДЕ
- БГД
- ВДЕ
Объект авторского права ООО «Легион»
Вместе с этой задачей также решают:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позици…
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позици…
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позици…
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позици…
Популярные материалы
- Задание 34. Установление молекулярной и структурной формулы вещества
- Задание 33. Расчётная задача
- Задание 8. Химические свойства простых веществ, оксидов, гидроксидов и солей
- Задание 26. Расчёты с использованием понятия «массовая доля вещества в растворе»
- Теория к заданию 34
- Теория к заданию 8
Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
-
Пишем слово «гидроксид».
-
Указываем название второго химического элемента в родительном падеже.
-
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оснований:
Ni(OH)2 — гидроксид никеля (II);
Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
-
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
-
нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
-
амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
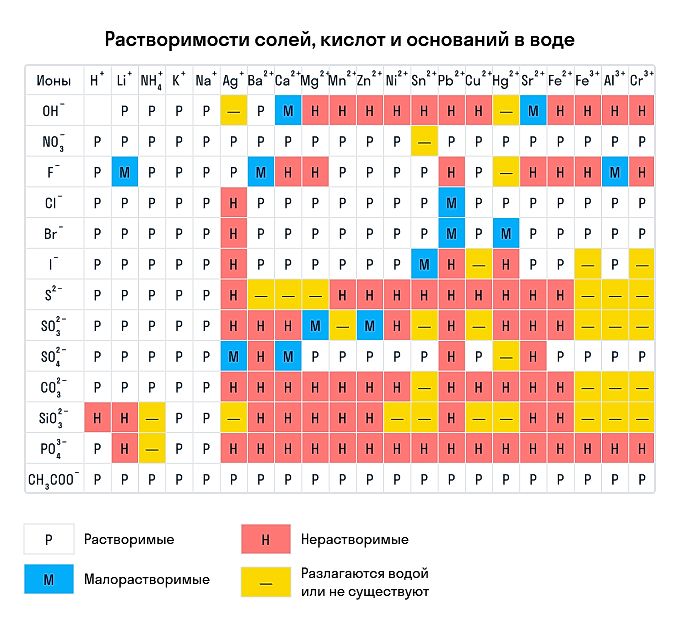
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
-
однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
-
трехкислотные: Al(OH)3, Fe(OH)3.
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Химические свойства оснований
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.
Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Кислотный оксид + основание = соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
Основание + кислота = соль + вода
Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание
оксид металла + вода
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
-
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
Например: Al(OH)3 + KOH = KAlO2 + 2H2O
-
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
Например: Al(OH)3 + KOH = K[Al(OH)4]
Получение оснований
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Например: Na + H2O = NaOH + H2↑
Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Например: CaO + H2O = Ca(OH)2
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
KCl + H2O = KOH + H2↑ + Cl2↑
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Вопросы для самопроверки
-
Вспомните определение оснований и приведите 2 примера этих веществ.
-
Какие виды оснований существуют? Чем они отличаются?
-
К какому виду оснований относится Zn(OH)2?
-
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
-
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!
From Wikipedia, the free encyclopedia

|
|
| Names | |
|---|---|
| IUPAC name
Iron(III) oxide-hydroxide |
|
| Other names
Metaferric acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.039.754 |
| EC Number |
|
| MeSH | Goethite |
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
FeO(OH) |
| Appearance | Vivid, dark orange, opaque crystals |
| Odor | odorless |
| Density | 4.25 g/cm3 |
|
Solubility in water |
insoluble at pH 7 |
|
Solubility product (Ksp) |
2.79×10−39 for Fe(OH)3[1] |
| Hazards | |
| NFPA 704 (fire diamond) |
1 0 0 |
| Pharmacology | |
|
ATC code |
B03AB04 (WHO) |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Iron(III) oxide-hydroxide or ferric oxyhydroxide[2] is the chemical compound of iron, oxygen, and hydrogen with formula FeO(OH).
The compound is often encountered as one of its hydrates, FeO(OH)·nH
2O [rust]. The monohydrate FeO(OH)·H
2O is often referred to as iron(III) hydroxide Fe(OH)
3,[3] hydrated iron oxide, yellow iron oxide, or Pigment Yellow 42.[3]
Natural occurrences[edit]
Minerals[edit]
Anhydrous ferric hydroxide occurs in the nature as the exceedingly rare mineral bernalite, Fe(OH)3·nH2O (n=0.0-0.25).[4][5] Iron oxyhydroxides, FeOOH, are much more common and occur naturally as structurally different minerals (polymorphs) denoted by the Greek letters α, β, γ and δ.
- Goethite, α-FeO(OH), has been used as an ochre pigment since prehistoric times.
- Akaganeite is the β polymorph,[6] formed by weathering and noted for its presence in some meteorites and the lunar surface. However, recently it has been determined that it must contain some chloride ions to stabilize its structure, so that its more accurate formula is FeO
0.833(OH)
1.167Cl
0.167 or Fe
6O
5(OH)
7Cl.[7]
- Lepidocrocite, the γ polymorph, is commonly encountered as rust on the inside of steel water pipes and tanks.
- Feroxyhyte (δ) is formed under the high pressure conditions of sea and ocean floors, being thermodynamically unstable with respect to the α polymorph (goethite) at surface conditions.
Non-mineral[edit]
- Siderogel is a naturally occurring colloidal form of iron(III) oxide-hydroxide.
Goethite and lepidocrocite, both crystallizing in orthorhombic system, are the most common forms of iron(III) oxyhydroxide and the most important mineral carriers of iron in soils.
Mineraloids[edit]
Iron(III) oxyhydroxide is the main component of other minerals and mineraloids:
- Limonite is a commonly occurring mixture of mainly goethite, lepidocrocite, quartz and clay minerals.
- Ferrihydrite is an amorphous or nanocrystalline hydrated mineral, officially FeOOH•1.8H
2O but with widely variable hydration.
Properties[edit]
The color of iron(III) oxyhydroxide ranges from yellow through dark-brown to black, depending on the degree of hydration, particle size and shape, and crystal structure.
Structure[edit]
The crystal structure of β-FeOOH (akaganeite) is that of hollandite or BaMn
8O
16. The unit cell is tetragonal with a=1.048 and c=0.3023 nm, and contains eight formula units of FeOOH. Its dimensions are about 500 × 50 × 50 nm. Twinning often produces particles with the shape of hexagonal stars. [2]
Chemistry[edit]
On heating, β-FeOOH decomposes and recrystallizes as α-Fe
2O
3 (hematite).[2]
Uses[edit]
Limonite, a mixture of various hydrates and polymorphs of ferric oxyhydroxide, is one of the three major iron ores, having been used since at least 2500 BC.[8][9]
Yellow iron oxide, or Pigment Yellow 42, is Food and Drug Administration (FDA) approved for use in cosmetics and is used in some tattoo inks.
Iron oxide-hydroxide is also used in aquarium water treatment as a phosphate binder.[10]
Iron oxide-hydroxide nanoparticles have been studied as possible adsorbents for lead removal from aquatic media.[11]
Medication[edit]
Iron polymaltose is used in treatment of iron-deficiency anemia.
Production[edit]
Iron(III) oxyhydroxide precipitates from solutions of iron(III) salts at pH between 6.5 and 8.[12]
Thus the oxyhydroxide can be obtained in the lab by reacting an iron(III) salt, such as ferric chloride or ferric nitrate, with sodium hydroxide:[13]
- FeCl
3 + 3 NaOH → Fe(OH)
3 + 3 NaCl - Fe(NO
3)
3 + 3 NaOH → Fe(OH)
3 + 3 NaNO
3
In fact, when dissolved in water, pure FeCl
3 will hydrolyze to some extent, yielding the oxyhydroxide and making the solution acidic:[12]
- FeCl
3 + 2 H
2O ↔ FeOOH + 3 HCl
Therefore, the compound can also be obtained by the decomposition of acidic solutions of iron(III) chloride held near the boiling point for days or weeks:[14]
- FeCl
3 + 2 H
2O → FeOOH(s) + 3 HCl(g)
(The same process applied to iron(III) nitrate Fe(NO
3)
3 or perchlorate Fe(ClO
4)
3 solutions yields instead particles of α-Fe
2O
3.[14])
Another similar route is the decomposition of iron(III) nitrate dissolved in stearic acid at about 120 °C.[15]
The oxyhydroxide prepared from ferric chloride is usually the β polymorph (akaganeite), often in the form of thin needles.[14][16]
The oxyhydroxide can also be produced by a solid-state transformation from iron(II) chloride tetrahydrate FeCl
2·4H
2O.[6]
The compound also readily forms when iron(II) hydroxide is exposed to air:
- 4Fe(OH)
2 + O
2 → 4 FeOOH + 2 H
2O
The iron(II) hydroxide can also be oxidized by hydrogen peroxide in the presence of an acid:
- 2Fe(OH)
2 + H
2O
2 → 2 Fe(OH)
3
See also[edit]
- Rust
- Iron oxide
- Yellow boy, a yellow precipitate when acidic runoff such as mine waste, is then neutralised
References[edit]
- ^ «Solubility product constants at 25 oC». Archived from the original on 2015-02-26. Retrieved 2015-02-23.
- ^ a b c A. L. Mackay (1960): «β-Ferric Oxyhydroxide». Mineralogical Magazine (Journal of the Mineralogical Society), volume 32, issue 250, pages 545-557. doi:10.1180/minmag.1960.032.250.04
- ^ a b CAS 51274-00-1, C.I. 77492
- ^ «Bernalite».
- ^ «List of Minerals». 21 March 2011.
- ^ a b A. L. Mackay (1962): «β-Ferric oxyhydroxide—akaganéite», Mineralogical Magazine (Journal of the Mineralogical Society), volume 33, issue 259, pages 270-280 doi:10.1180/minmag.1962.033.259.02
- ^ C. Rémazeilles and Ph. Refait (2007): «On the formation of β-FeOOH (akaganéite) in chloride-containing environments». Corrosion Science, volume 49, issue 2, pages 844-857. doi:10.1016/j.corsci.2006.06.003
- ^ MacEachern, Scott (1996): «Iron Age beginnings north of the Mandara Mountains, Cameroon and Nigeria». In In Pwiti, Gilbert and Soper, Robert (editors) (1996) Aspects of African Archaeology: Proceedings of the Tenth Pan-African Congress University of Zimbabwe Press, Harare, Zimbabwe, ISBN 978-0-908307-55-5, pages 489-496. Archived here on 2012-03-11.
- ^ Diop-Maes, Louise Marie (1996): «La question de l’Âge du fer en Afrique» («The question of the Iron Age in Africa»). Ankh, volume4/5, pages 278-303. Archived on 2008-01-25.
- ^ Iron Oxide Hydroxide (GFO) Phosphate Binders
- ^ Safoora Rahimi, Rozita M. Moattari, Laleh Rajabi, Ali Ashraf Derakhshan, and Mohammad Keyhani (2015): «Iron oxide/hydroxide (α,γ-FeOOH) nanoparticles as high potential adsorbents for lead removal from polluted aquatic media». Journal of Industrial and Engineering Chemistry, volume 23, pages 33-43. doi:10.1016/j.jiec.2014.07.039
- ^ a b Tim Grundl and Jim Delwiche (1993): «Kinetics of ferric oxyhydroxide precipitation». Journal of Contaminant Hydrology, volume 14, issue 1, pages 71-87. doi:10.1016/0169-7722(93)90042-Q
- ^ K. H. Gayer and Leo Woontner (1956): «The Solubility of Ferrous Hydroxide and Ferric Hydroxide in Acidic and Basic Media at 25°». Journal of Physical Chemistry, volume 60, issue 11, pages 1569–1571. doi:10.1021/j150545a021
- ^ a b c Egon Matijević and Paul Scheiner (1978): «Ferric hydrous oxide sols: III. Preparation of uniform particles by hydrolysis of Fe(III)-chloride, -nitrate, and -perchlorate solutions». Journal of Colloid and Interface Science, volume 63, issue 3, pages 509-524. doi:10.1016/S0021-9797(78)80011-3
- ^ Dan Li, Xiaohui Wang, Gang Xiong, Lude Lu, Xujie Yang and Xin Wang (1997): «A novel technique to prepare ultrafine Fe
2O
3 via hydrated iron(III) nitrate». Journal of Materials Science Letters volume 16, pages 493–495 doi:10.1023/A:1018528713566 - ^ Donald O.
Whittemore and Donald Langmuir (1974): «Ferric Oxyhydroxide Microparticles in Water». Environmental Health Perspective, volume 9, pages 173-176. doi:10.1289/ehp.749173













![mathsf{Fe(OH)_3 + 3KOH xrightarrow{} K_3[Fe(OH)_6] }](https://dic.academic.ru/dic.nsf/ruwiki/371706b602a2c235a35aeb1650ef5992.png)