И так были приобретены «универсальные» ПТФ коих сейчас пруд пруди от фирмы (Лидер до чайна ориджинал деталь). Их огромен выбор от квадратных до круглых, от «универсальных» до модельных (под определенное авто).
Мой выбор пал на самые лояльные по цене фирмы Лидер. Не буду вдаваться в подробности подключения и установки т.к. сейчас совсем не об этом (но если что, каждый режим через реле и предохранительную колодку 2А т.к. предпочитаю спокойно спать). Речь пойдет конкретно о свето-теневой границе, вернее о ее отсутствие! Дело в том, что для этого у меня было как минимум две причины: 1.не один из продавцов не уведомлял, что эти ПТФ/ДХО изначально предназначены для установки над бампером (мне же нужно под ним), но даже и это не спасло бы мою ситуацию т.к. имеется еще одно… 2.причина это безупречная сборка или ОТК фирмы Лидер! Дело в том что одна из ДХОшек была действительно вверх ногами и имела СТГ но не в нужном мне направлении, а вот вторая не имела ее вообще! Разобравшись в этом было принято решение исправлять косяки своими пальцами).
Полный размер
снимаем ПТФ с наших чудесных креплений (не прыгают в ходу)
Полный размер
Откручиваем винты крепления передней крышки к основному корпусу.
Полный размер
Откручиваем внутреннюю крышку и аккуратно отводим в сторону что бы не повредить провода подключения ДХО
Полный размер
Для удобства лучше вывесить нашу ПТФ обратно на крепление или жестко закрепив ее перейти к самой доработке!
Полный размер
Откручиваем линзу/кристалл. Вот именно с этой ПТФ я и начал и именно у нее и отсутствовала СТГ!
Полный размер
Вынимаю линзу и наблюдаю, что выборка отвечающая за фокус отличается от той которая осталась расположением скосом углов. Т.е. по отношению одна другой, фокусы линз направлены по разному. Это и огорчило (качество) и обрадовало, их можно переворачивать
Полный размер
Включив ПТФ, поставив на расстоянии метра лист фанеры выставил обе линзы так что бы верхние части лучей заканчивались резко и составляли прямую линию (просто перекрутив обе линзы одинаково и нужной стороной) я преступил к обратной сборке.
Полный размер
Вторую ПТФ по аналогии выставляем линзы и собираем. Обязательно проверив перед сборкой!
Дожидаемся вечера!
Полный размер
Свет ПТФ без ближнего света
Полный размер
Свет ПТФ с ближним головным светом.
И наконец совет и вывод! Сейчас на рынке имеется множество приборов использующую подобные линзы. Проверяйте перед покупкой хотя бы с метрового расстояния, возможно и у Вас попадется «уставший сборщик ДХОшек». В целом если не брать во внимание полгода свечения «в пол» то за такие деньги еще и норм конструкция!
Цена вопроса: 0 грн
Всем доброго времени суток!
Плохой свет? Включил фары и думаешь вкл или не вкл фары? Тебе значит сюда!
Столкнулся с проблемой ну вообще нулевого света, решил хоть как-то «вдохнуть жизнь» в уставшие фары.
Для полировки фар нам понадобятся следующие компоненты:
— Малярный скотч
— Наждачная бумага шероховатостью Р1000 и Р2000 (можно ещё меньше шероховатость) P. S. для тех кто не знает, чем выше число, тем меньше шероховатость)
— Полировочная паста (в моем случае K2 Lamp Doctor)
— Полировальный диск с полировочными кругами (шерстяной и губка)
— Лак для фар, именно для фар! Потому, что он имеет определённую светопропускаемость!
— Ну и саму полировальную машину (Можно использовать шуруповерт или перфоратор на минимальных оборотах, в моем случае шуруповерт) Если выберете шуруповерт желательно 2 акб или подключение к сети иначе замучаетесь с 1 акб)
Полный размер
Полировальный диск с кругами
Полный размер
Левая фара, до полировки
Полный размер
Правая фара, до полировки
И так, перейдём к самому процессу.
В первую очередь необходимо проклеить сам кузов вокруг фар малярным скотчем. (P. S. не используйте изоленту и прочие ленты — это чревато повреждением ЛКП в особенности бампера! Пишу на опыте ибо использовал изоленту думая, что могу протереть наждачкой малярный скотч и повредить лкп, быть внимательней и работать аккуратно наждачкой!)
Далее берём небольшой кусочек наждачки Р1000, смачиваем водой (можно намочить фару тоже) и начинаем полировать фару строго движением вверх-вниз, круговыми движениями не нужно полировать!
Далее полируем гаждачкой Р2000 до матового состояния фары.
Полный размер
Заматованная фара
После того как заматовали фару, хорошо промойте её и протрите насухо.
Берём полироль, наносим на центр полировального круга из шерсти и начинаем полировать, после первой выработки пасты эффекта может и не быть, повторяем процедуру пока не станет становиться прозрачной фара, параллельно не перегревая её!
Для идеального эффекта закрепляем всё полировкой фары кругом из губки с нанесенной на неё полировочной пастой.
Полный размер
Фара после полировки пастой и кругом из губки
Ну и финальное, после всех монипуляций с фарой, тщательно удаляем остатки полироли, чтобы фара была чистой и не жирной. Закрываем более большой радиус кузова вокруг фары и наносим лак снизу вверх (я рекомендую так) можно и сверху вниз, все зависит от ваших навыков. Но лучше наносить лак с помощью пистолета ибо можно распылить тонким слоем дать высохнуть лаку (зависит от лака, читайте инструкцию по применению), что в нашем случае идеально подойдёт)
P. S. Последнюю операцию лучше выполнять в гараже или в помещение без пыли и ветра.
Полный размер
Ну и конечный результат, фото сделано позже, после эксплуатации фар
Введение
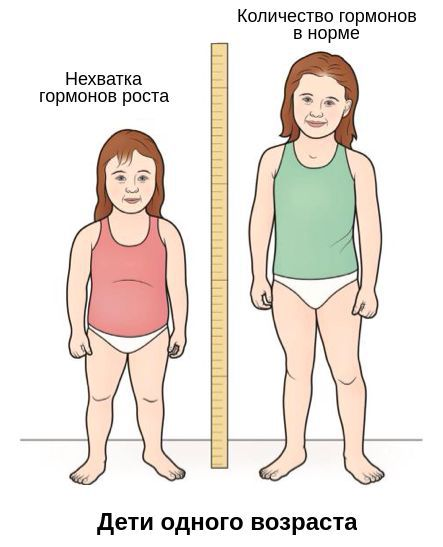
Дети с установленным дефицитом гормона роста получают заместительную терапию рекомбинатным гормоном роста до совершеннолетия и достижения генетически прогнозируемого конечного роста. Несмотря на то, что основной спектр физиологических эффектов соматотропный гормон (СТГ) оказывает на организм в детском возрасте, а в последующем его выработка снижается, СТГ играет важную роль в нормальном функционировании органов и систем взрослого человека. В настоящее время в России разработана система оказания медицинской помощи детям с дефицитом гормона роста [1, 2], однако отсутствуют клинические рекомендации, посвященные диагностике и заместительной терапии СТГ-дефицита взрослых.
Первые исследования, посвященные лечению СТГ-дефицита у взрослых пациентов с гипопитуитаризмом, были опубликованы в 1989 г. [3, 4]. В Российской Федерации первый опыт применения человеческого гормона роста у взрослых пациентов с СТГ-дефицитом был опубликован в 2004 г. [5]. Клинические проявления заболевания у взрослых пациентов неспецифичны и в случаях приобретенного СТГ-дефицита часто маскируются проявлениями недостаточностей других тропных гормонов гипофиза, что затрудняет диагностику.
Целью данного обзора является обобщение современных данных по диагностике, лечению и системному влиянию заместительной терапии соматропином у взрослых пациентов с СТГ-дефицитом.
Клинические проявления
Дефицит СТГ у взрослых характеризуется системными изменениями метаболизма при неспецифичных клинических проявлениях [6].
– Состав тела. Увеличение массы жировой ткани, преимущественно за счет висцерального жира, уменьшение тощей массы [7–9], снижение объема внеклеточной жидкости и общей концентрации натрия [10].
– Физическая активность. Снижение толерантности к физическим нагрузкам, уменьшение мышечной силы на фоне уменьшения количества мышечной ткани [11]. Нарушение терморегуляции [12].
– Сердечно-сосудистая система, липидный обмен и система свертывания крови. Увеличение сердечно-сосудистого риска за счет дислипидемии, нарушений углеводного обмена и ускоренного развития атеросклероза. Уменьшение массы миокарда, нарушение проводимости, сократимости и ударного объема, снижение нагнетательной функции и фракции выброса, диастолическая дисфункция [13]. Дислипидемия вследствие повышения концентрации общего холестерина, холестерина ЛПНП и триглицеридов [14]. Повышение активности фибриногена и ингибитора активаторов плазминогена 1-го типа (PAI-1) [15].
– Углеводный обмен. Нарушение толерантности к глюкозе, инсулинорезистентность [16].
– Костная система. Уменьшение костной массы и минеральной плотности кости (МПК), повышение риска переломов [17–19].
– Качество жизни и когнитивные функции. Снижение качества жизни: дезадаптация, сниженная самооценка, тревожность, апатия, депрессия, социальная изоляция [20].
Диагностика
Диагностика СТГ-дефицита взрослых сложна по ряду причин. Клинические проявления данного заболевания неспецифичны и потому имеют невысокую диагностическую ценность [21]. В физиологических условиях секреция СТГ имеет импульсный характер, на нее влияют возраст, пол и индекс массы тела, в связи с чем определение базальной концентрации СТГ не имеет диагностического значения [22]. Нормальные показатели ИРФ-1 сыворотки крови не исключают диагноз СТГ-дефицита. ИРФ-1, ИРФ-связывающий белок 3 (ИРФСБ-3) имеют ориентировочное значение для диагностики, поскольку показатели у пациентов с СТГ-дефицитом и здоровых людей могут частично совпадать [23].
В настоящее время общепринятым методом диагностики СТГ-дефицита взрослых являются стимуляционные пробы [22, 24], протоколы которых представлены в табл. 1.
Таблица 1. Этиология СТГ-дефицита взрослых [24]
|
Врожденные |
Приобретенные |
|
Генетические нарушения дефекты транскрипционных факторов (PIT-1, PROP-1, LHX3/4, HESX-1, PITX-2) дефекты гена СТГ, рецептора соматолиберина, секретагогов СТГ, СТГ, пострецепторные дефекты Врожденные структурные аномалии головного мозга агенезия мозолистого тела септооптическая дисплазия синдром пустого турецкого седла голопрозэнцефалия энцефалоцеле гидроцефалия арахноидальные кисты Дефекты срединной линии лицевого скелета единственный центральный резец расщелины губы/неба |
Травмы перинатальные постнатальные Инфекции центральной нервной системы Опухоли гипоталамо-гипофизарной области аденома гипофиза краниофарингиома киста кармана Ратке глиома/астроцитома герминома метастазы другие Инфильтративные/гранулематозные заболевания гистиоцитоз Лангерганса саркоидоз туберкулез гипофизит другие Облучение головы Хирургическое вмешательство на гипофизе Кровоизлияние спонтанное синдром Шихана Идиопатический |
Зарубежные клинические руководства рекомендуют проводить пробы только тем пациентам, у которых высока вероятность наличия заболевания, а заместительная гормональная терапия соматотропином будет способствовать улучшению метаболических параметров и качества жизни. Проведения провокационных проб не требуется при наличии одного из двух условий:
- Наличие трех из четырех составляющих:
– значительный дефицит роста (<-3 SDS);
– как минимум одна дополнительная тропная недостаточность;
– низкая концентрация ИФР-1 в крови;
– врожденный дефект гипоталамо-гипофизарной области по данным МРТ: «триада» (гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза);
или
– оперативное лечение опухоли гипоталамо-гипофизарной области в анамнезе;
или
– облучение области «голова–шея» в анамнезе.
- Мутации генов, ассоциированных с развитием гипопитуитаризма: GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др. [22, 24, 25].
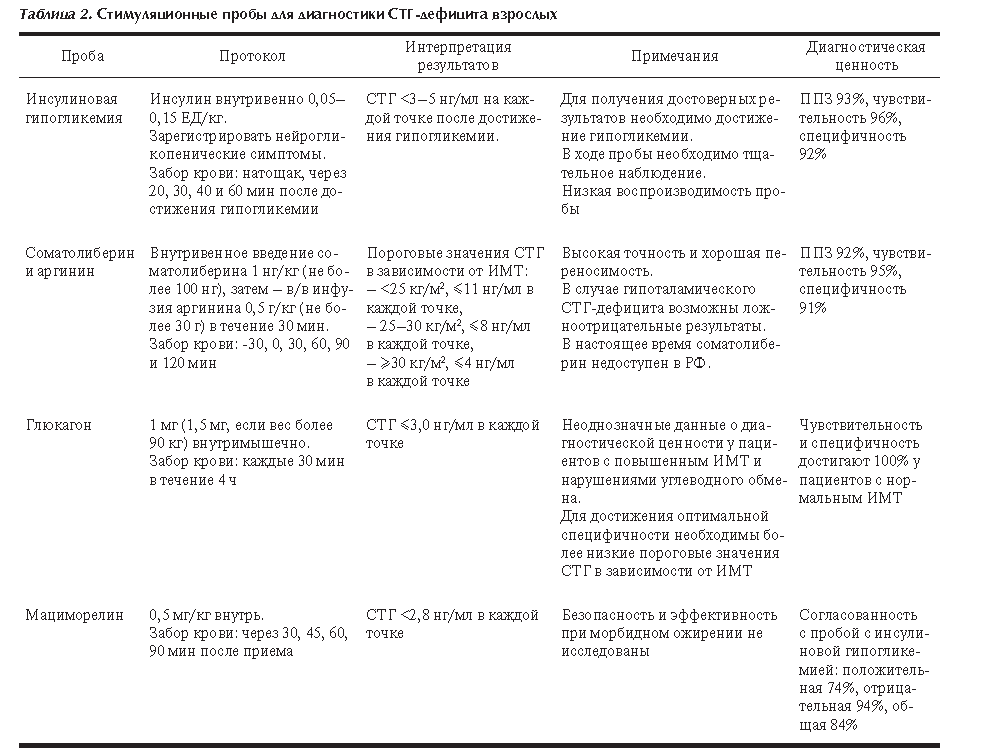
Таблица 2. Стимуляционные пробы для диагностики СТГ-дефицита взрослых
|
Проба |
Протокол |
Интерпретация результатов |
Примечания |
Диагностическая ценность |
|
Инсулиновая гипогликемия |
Инсулин внутривенно 0,05–0,15 ЕД/кг. Зарегистрировать нейрогликопенические симптомы. Забор крови: натощак, через 20, 30, 40 и 60 мин после достижения гипогликемии |
СТГ <3–5 нг/мл на каждой точке после достижения гипогликемии. |
Для получения достоверных результатов необходимо достижение гипогликемии. В ходе пробы необходимо тщательное наблюдение. Низкая воспроизводимость пробы |
ППЗ 93%, чувствительность 96%, специфичность 92% |
|
Соматолиберин и аргинин |
Внутривенное введение соматолиберина 1 нг/кг (не более 100 нг), затем – в/в инфузия аргинина 0,5 г/кг (не более 30 г) в течение 30 мин. Забор крови: -30, 0, 30, 60, 90 и 120 мин |
Пороговые значения СТГ в зависимости от ИМТ: – <25 кг/м2, ≤11 нг/мл в каждой точке, – 25–30 кг/м2, ≤8 нг/мл в каждой точке, – ≥30 кг/м2, ≤4 нг/мл в каждой точке |
Высокая точность и хорошая переносимость. В случае гипоталамического СТГ-дефицита возможны ложноотрицательные результаты. В настоящее время соматолиберин недоступен в РФ. |
ППЗ 92%, чувствительность 95%, специфичность 91% |
|
Глюкагон |
1 мг (1,5 мг, если вес более 90 кг) внутримышечно. Забор крови: каждые 30 мин в течение 4 ч |
СТГ ≤3,0 нг/мл в каждой точке |
Неоднозначные данные о диагностической ценности у пациентов с повышенным ИМТ и нарушениями углеводного обмена. Для достижения оптимальной специфичности необходимы более низкие пороговые значения СТГ в зависимости от ИМТ |
Чувствительность и специфичность достигают 100% у пациентов с нормальным ИМТ |
|
Мациморелин |
0,5 мг/кг внутрь. Забор крови: через 30, 45, 60, 90 мин после приема |
СТГ <2,8 нг/мл в каждой точке |
Безопасность и эффективность при морбидном ожирении не исследованы |
Согласованность с пробой с инсулиновой гипогликемией: положительная 74%, отрицательная 94%, общая 84% |
В табл. 2 представлены используемые в мире пороговые значения диагностических проб для диагностики СТГ дефицита у взрослых.
Проба с инсулиновой гипогликемией
Стимуляция секреции СТГ при гипогликемии была впервые описана в 1963 г. [26]. Данная проба считается «золотым стандартом» в диагностике СТГ-дефицита взрослых [22, 24], однако у нее имеется ряд недостатков. Требуется тщательное медицинское наблюдение для мониторинга потенциальных нежелательных явлений (судорожных приступов или потери сознания вследствие гипогликемии). Кроме того, в связи с наличием инсулинорезистентности у пациентов с ожирением, у данной категории может понадобиться использование более высоких доз инсулина (0,15–0,20 ЕД/кг массы тела), что увеличивает риск отсроченной гипогликемии [27]. Проба с инсулиновой гипогликемией противопоказана пожилым пациентам, лицам с высоким сердечно-сосудистым риском и эпилепсией. И хотя чувствительность пробы высока, отмечаются ограничения в ее воспроизводимости. Кроме того, вариабельность пиков секреции СТГ отмечалась у здоровых добровольцев в зависимости от времени проведения и в разные фазы менструального цикла [22].
В настоящее время в качестве диагностического значения стимулированной секреции СТГ при гипогликемии используется диапазон 3,0–5,0 нг/мл [22, 24].
Согласно зарубежным рекомендациям, при противопоказаниях к пробе с инсулиновой гипогликемией возможно проведение комбинированной пробы со стимуляцией соматолиберином и аргинином, однако, применение аргинина для диагностики СТГ-дефицита в РФ не зарегистрировано.
Проба с соматолиберином и аргинином
Проба с соматолиберином и аргинином, как и проба с инсулиновой гипогликемией, считается достаточно чувствительной и специфичной для диагностики СТГ-дефицита [28, 29], однако в настоящее время на фармацевтическом рынке отсутствует препарат соматолиберина.
Точность данной пробы определяется совместным применением двух стимулирующих веществ: соматолиберин стимулирует синтез и высвобождение СТГ гипофизом [30], а аргинин усиливает этот эффект путем подавления высвобождения соматостатина [31]. Концентрация СТГ на фоне стимуляции не зависит от пола и возраста, однако, результат зависит от ИМТ, в связи с чем используются три пороговых значения (табл. 3). В связи с тем, что в ходе данной пробы стимулируется и гипофиз, и гипоталамус, при гипоталамическом генезе заболевания (например, после лучевой терапии) возможны ложноположительные результаты [32].
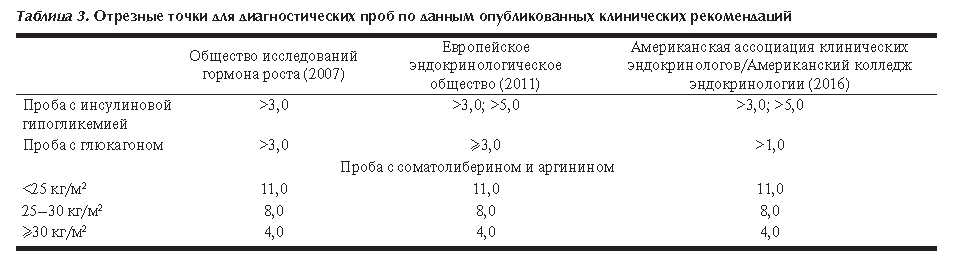
Таблица 3. Отрезные точки для диагностических проб по данным опубликованных клинических рекомендаций
|
Общество исследований гормона роста (2007) |
Европейское эндокринологическое общество (2011) |
Американская ассоциация клинических эндокринологов/Американский колледж эндокринологии (2016) |
|
|
Проба с инсулиновой гипогликемией |
>3,0 |
>3,0; >5,0 |
>3,0; >5,0 |
|
Проба с глюкагоном |
>3,0 |
≥3,0 |
>1,0 |
|
Проба с соматолиберином и аргинином |
|||
|
<25 кг/м2 |
11,0 |
11,0 |
11,0 |
|
25–30 кг/м2 |
8,0 |
8,0 |
8,0 |
|
≥30 кг/м2 |
4,0 |
4,0 |
4,0 |
Проба с глюкагоном
В связи с тем, что основная альтернативная проба для диагностики недоступна, активно изучается возможность применения пробы с глюкагоном при противопоказаниях к пробе с инсулиновой гипогликемией.
Глюкагон – сильный стимулятор секреции СТГ, однако, механизм стимуляции остается неясным. Стимулирующий эффект более выражен при внутримышечном или подкожном введении по сравнению с внутривенным [33].
Достоинства пробы с глюкагоном – воспроизводимость и безопасность, на ее результаты не влияет пол и гипоталамический генез СТГ-дефицита. Недостатки – длительность пробы (3–4 ч) и необходимость внутримышечного введения глюкагона. Побочные эффекты пробы более выражены у пожилых пациентов: гипотония, гипогликемии и приступы эпилепсии [34]. Кроме того, имеется риск отсроченных гипогликемий, в связи с чем данная проба не вошла в рутинную клиническую практику.
В двух исследованиях сравнивались диагностические возможности пробы с глюкагоном и пробы с инсулиновой гипогликемией, группы пациентов и контроль были сопоставлены по полу и возрасту [35, 36]. В исследовании J. Gómez и соавт. группы пациентов были также сопоставлены по ИМТ, в данном исследовании выявлена обратная корреляция возраста и ИМТ с пиковыми концентрациями СТГ у здоровых добровольцев.
Изначально пороговым значением концентрации СТГ принималось 3,0 нг/мл. В дальнейших исследованиях выявлено, что использование такого значения приводит к гипердиагностике СТГ-дефицита [37]. Принимая это во внимание, рекомендации Американской ассоциации эндокринологов предлагают использовать пороговое значение 1,0 нг/мл для пациентов с ИМТ более 25 кг/м2. Авторы также отмечают, что для уточнения диагностической точности сниженного порогового значения необходимо проведение больших проспективных исследований среди пациентов с различным ИМТ и нарушениями углеводного обмена [22].
Секретагоги гормона роста
К данному классу относятся молекулы, проявляющие сильный дозозависимый и специфичный стимуляционный эффект на соматотрофы [38]. Они связываются с рецептором СТГ секретагога-1а (growth hormone secretagogue receptor 1a, GHS-R1a) в гипоталамусе и гипофизе. Естественным лигандом данного рецептора является грелин [39]. Другие агонисты его рецептора являются аналогами грелина: GHRP-2 (GH-releasing peptide-2, СТГ-рилизинг пептид-2), GHRP-6, гексарелин, все данные вещества вводятся парентерально. Также существуют аналоги грелина для перорального введения.
Достоинство секретагогов СТГ – возможность перорального приема [40]. Они устойчивы к протеолизу, так как многие представители являются небелковыми молекулами либо содержат D-изомеры аминокислот [41]. Недостаток – возможность получения ложноположительных результатов при гипоталамическом генезе СТГ-дефицита [42].
Проводились исследования, оценивающие диагностическую ценность проб с GHRP-6, GHRP-2 и комбинаций соматолиберина с гексарелином, пиридостигмином, аципимоксом, GHRP-6 в сравнении с пробой с инсулиновой гипогликемией [43–48].
В исследованиях теста с соматолиберином и GHRP-6 для диагностики СТГ-дефицита взрослых отмечена хорошая переносимость пробы (единственный побочный эффект – «приливы»), высокая чувствительность и воспроизводимость. GHRP-6 назначается внутривенно, пик ответа СТГ развивается на 15–30-й минуте – значительно раньше, чем при использовании других фармакологических стимуляторов. Пороговое значение для нормального ответа 20 нг/мл, для СТГ-дефицита 10 нг/мл [49, 50]. На результаты данного теста не влияют возраст, пол или избыточная масса тела, за исключением случаев, когда ИМТ превышает 35 кг/м2, – пороговое значение снижается до 5 нг/мл [51].
Пробу с GHRP-2 с 2006 г. используют в Японии, так как она безопасна и удобна, в качестве порогового значения используется концентрация СТГ 9 нг/мл. Пиковой концентрации СТГ после стимуляции достигает на 60-й минуте [52].
В исследовании, где в качестве стимулирующего агента использовался ацетилированный грелин, наиболее диагностически значимыми значениями концентрации СТГ для диагностики были 7,3 нг/мл при нормальной массе тела, 2,9 нг/мл при избыточной массе тела и 0,6 нг/мл при ожирении, диагностическая точность составила 89,3, 94,1 и 62,5% соответственно. Авторы делают вывод, что ожирение значительно снижает ответ СТГ на стимуляцию грелином, однако данная проба является надежным инструментом в диагностике у пациентов с нормальной и избыточной массой тела [53].
В настоящее время применение вышеуказанных методов в Российской Федерации невозможно, так как на рынке отсутствуют препараты соматолиберина и секретагогов СТГ.
Пероральный секретагог СТГ
В 2017 г. Food and Drugs Administration (FDA) одобрило применение мациморелина для диагностики СТГ-дефицита у взрослых [54].
Мациморелин – агонист GHS-R1a с высокой стабильностью, которая позволяет назначать его перорально. В исследовании I фазы у 36 здоровых добровольцев при пероральном приеме мациморелина отмечалось быстрое дозозависимое повышение концентрации препарата в плазме, пик концентрации достигался на 50–75-й минуте после приема. Дозозависимая стимуляция секреции СТГ соотносилась по времени с максимальной концентрацией препарата в плазме, повышение концентрации СТГ длилось около 120 мин после перорального приема или интрадуоденального введения. Препарат хорошо переносился, нежелательных явлений не выявлено [55].
В многоцентровом открытом исследовании сравнивали диагностическую ценность и безопасность мациморелина в сравнении с пробой соматолиберин + аргинин, среди взрослых пациентов с СТГ-дефицитом и здоровых добровольцев. Согласно ROC-анализу, оптимальная пороговая концентрация СТГ составила 2,7 нг/мл: чувствительность 82%, специфичность 92%, доля ошибок в распознавании 13%. Среди пациентов, которым назначали оба диагностических теста, диагностическая ценность методов была сопоставима. Пиковые концентрации СТГ обратно коррелировали с ИМТ в контрольной группе. При единственном заборе крови через 45 мин после приема мациморелина, при использовании пороговых значений, согласно ИМТ (6,8 нг/мл при ИМТ <30 кг/м2, 2,7 нг/мл при ИМТ ≥30 кг/м2) чувствительность пробы составила 90%, специфичность – 85%, доля ошибок в распознавании – 12,2% [56].
В 2018 г. опубликованы результаты многоцентрового, открытого, рандомизированного, двойного перекрестного исследования, целью которого было установить эффективность и безопасность применения однократного приема мациморелина в дозе 0,5 мг/кг для диагностики СТГ-дефицита взрослых, по сравнению с пробой с инсулиновой гипогликемией. Пациенты были поделены на три группы согласно вероятности наличия заболевания: высокой (n=38), средней (n=37) и низкой (n=39), также подобрана группа здоровых добровольцев (n=25). При использовании в качестве «точки отсечения» значения концентрации СТГ 2,8 нг/мл для мациморелина и 5,1 нг/мл для пробы с инсулиновой гипогликемией, отрицательная согласованность составила 95,38% (95% ДИ 87–99%), положительная согласованность – 74,32% (95% ДИ 63–84%), чувствительность 87%, специфичность 96%. Воспроизводимость пробы с мациморелином составила 97% (n=33). В ходе вторичного анализа выявлено, что использование отрезной точки 5,1 нг/мл позволяет достигнуть отрицательной согласованности 94% (95% ДИ 85–98%), положительной согласованности 82% (95% ДИ 72–90%), чувствительности 92% и специфичности 96% [57].
В настоящее время не опубликовано результатов по безопасности и диагностической ценности данного теста у пациентов с морбидным ожирением. К наиболее частым побочным эффектам относятся искажение вкуса, головокружение, головная боль, утомляемость и нарушения работы желудочно-кишечного тракта (тошнота, голод и диарея). Следует избегать назначения совместно с препаратами, удлиняющими интервал QT, так как это может привести к развитию желудочковой тахикардии. CYP3A4 – основной фермент, метаболизирующий мациморелин, поэтому при применении совместно с препаратами, активирующими его, возможно получение ложноположительных результатов [54].
Стандартизация наборов для определения СТГ
Результаты стимулирующих проб трактуются согласно пороговым значениям концентраций, в связи с чем точность лабораторного определения СТГ крайне важна. Циркулирующий СТГ представлен различными изоформами и изомерами: в наибольшей доле присутствует вариант массой 22 кДа, также присутствуют молекулы меньшей массы. Моноклональные антитела способны специфично связываться с изоформами массой 22 кДа, но будут пропускать другие изоформы. Молекулы сходного с СТГ строения (плацентарный СТГ, пролактин), а также СТГ-связывающий белок (с которым связано около 50% циркулирующего СТГ) могут вступать в перекрестные реакции и влиять на точность измерения. Также существуют различия и несогласованность в калибровках, что ограничивает возможности сравнения пороговых значений в разных исследованиях. Кроме того, лаборатории могут использовать разные единицы измерения концентрации либо активности СТГ [58].
Для борьбы с данными ограничениями в настоящее время предложен единый калибровочный стандарт для СТГ – 98/574. Все производители наборов должны уточнять определяемые изоформы, специфичность используемых антител и наличие перекрестных реакций с СТГ-связывающим белком [59].
Протеомные биомаркеры СТГ-дефицита
На момент подачи статьи публикации по протеомным биомаркерам СТГ-дефицита взрослых отсутствовали. В 2018 г. опубликованы результаты исследования, в котором методом протеомного анализа нового поколения SWATH-MS исследовались циркулирующие белки у детей с СТГ-дефицитом в сравнении со здоровыми добровольцами. Обнаружено три белка, которые могут являться биомаркерами для неинвазивной диагностики СТГ-дефицита у детей: аполипопротеин A-IV, CFHR4 (complement factor H-related protein 4) и PBP (platelet basic protein) [60]. Вопрос исследования данных белков при СТГ-дефиците у взрослых остается открытым.
Полиморфизмы рецептора гормона роста
У человека ген рецептора гормона роста (r-СТГ) расположен на 5-й хромосоме. Ген состоит из девяти экзонов, кодирующих рецептор, и нескольких дополнительных экзонов в 5’ нетранслируемой области. Известны две основные изоформы r-СТГ, отличающиеся наличием (fl-GHR, full-length), либо отсутствием экзона 3 (d3-GHR, exon 3-deficient). Отсутствие экзона 3 приводит к потере 22 аминокислот во внеклеточном домене рецептора [61]. В настоящее время считается, что связывающая способность обеих изоформ одинакова. Изоформа d3 доминирует над fl, около 50% европейцев гетеро- или гомозиготны по d3 [62]. Носительство d3 ассоциировано с высоким ростом, более высокой чувствительностью к СТГ и является фактором долгожительства у мужчин [63].
У пациентов с генотипом fl/fl отмечался более выраженный ответ на введение соматропина после лечения в течение 1 нед, по сравнению с пациентами с аллелями d3 [64]. В другом исследовании с длительностью лечения 12 мес, повышение ИРФ-1 в ответ на терапию было достоверно большим в группе d3/d3. Различий по концентрации ИРФ-1 между группами fl/d3 и fl/fl не выявлено [65]. По данным S. Meyer и соавт., не выявлено достоверных различий концентрации ИРФ-1 на фоне терапии между носителями одного или двух аллелей d3 и генотипа fl/fl [66]. У взрослых пациентов с СТГ-дефицитом с аллелями d3 снижен риск переломов позвонков независимо от получения заместительной терапии СТГ [67].
Также опубликованы исследования, в которых между генотипами не обнаруживалось различий по клиническим проявлениям и нежелательным явлениям, качеству жизни, концентрациям ИРФ-1, составу тела и жировой массе [68–71].
Проведено два исследования, в которых оценивали влияние полиморфизмов r-СТГ на различные показатели на фоне заместительной терапии СТГ спустя 1 год и после 5 лет лечения. В исследовании Van der А. Klaauw и соавт. после первого года лечения в группе носителей d3 отмечалось более выраженное повышение ИФР-1 при одинаковых средних дозах соматотропина в группах. Среди носителей d3 общий холестерин снижался менее выраженно, а концентрация холестерина ЛПВП достигала более высоких значений по сравнению с fl/fl. Однако, через 5 лет данных различий между группами обнаружено не было [72]. По данным С. Giavoli и соавт., лечение соматропином нормализует концентрацию ИРФ-1 и снижает процентную долю жировой массы после 1 года и после 5 лет лечения, независимо от присутствия аллеля d3. После одного года лечения в группах носителей d3 отмечалось повышение концентрации холестерина ЛПВП, после пяти лет – снижение концентрации общего холестерина и холестерина ЛПНП. При исходно одинаковой распространенности нарушений углеводного обмена через 5 лет после лечения в группе fl/fl она снизилась, а в группах носителей d3 двукратно увеличилась [73].
В настоящее время данные по влиянию полиморфизма r-СТГ на клиническую картину СТГ-дефицита взрослых малочисленны, а имеющиеся публикации по взаимоотношениям носительства аллели d3 и ответа на заместительную терапию противоречивы.
Лечение
Определение показаний к заместительной терапии
Целесообразность заместительной терапии СТГ-дефицита взрослых определяется предполагаемой пользой для каждого конкретного пациента. С наибольшей вероятностью пользу от лечения будут получать пациенты с выраженным СТГ-дефицитом, подтвержденным с помощью стимуляционных проб и низкой сывороточной концентрацией ИРФ-1. Клиническими проявлениями, указывающими на необходимость лечения, являются остеопения, повышенный сердечно-сосудистый риск, а также сниженное качество жизни, которое необходимо подтвердить валидизированными опросниками для данного заболевания [74].
Важной категорией являются пациенты, достигшие целевого роста на фоне заместительной терапии и переходящие под наблюдение взрослого эндокринолога. У таких пациентов полное созревание костной и мышечной систем может продолжаться в течение последующих 10 лет [75–77]. На фоне отмены соматропина после достижения целевого роста отмечалось ухудшение показателей липидного обмена, состава тела и качества жизни [76, 78, 79]. После достижения конечного роста необходимо проводить редиагностику СТГ-дефицита, через 1–3 мес после перерыва в лечении соматропином (табл. 4).
Таблица 4. Ре-диагностика СТГ-дефицита после достижения конечного роста
|
Нуждаются в ре-диагностике |
Не нуждаются в ре-диагностике |
|
Изолированный СТГ-дефицит при наличии нормального уровня ИФР-1 (на фоне отмены соматотропина) |
Две тропных недостаточности и более, помимо СТГ-дефицита |
|
Помимо СТГ-дефицита, имеется одна тропная недостаточность при наличии нормального уровня ИФР-1 (на фоне отмены соматропина) |
Приобретенные гипоталамо-гипофизарные повреждения вследствие операций на гипофизе и облучение гипоталамо-гипофизарной области (при условии низкого уровня ИФР-1 на фоне отмены соматотропина) |
|
При наличии дополнительной тропной недостаточности необходима ее компенсация перед проведением стимуляционных проб |
«Триада» на МРТ: гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза |
|
Отсутствие молекулярно-генетического подтверждения диагноза |
Дефекты генов системы СТГ-ИФР-1 (GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др.) |
Негативные клинические проявления СТГ-дефицита и положительное действие заместительной терапии соматотропином распространяется и на пациентов старше 65 лет [80]. Несмотря на известный факт снижения секреции СТГ с возрастом, диагностические пробы позволяют разграничить физиологическое снижение от патологического, обусловленного СТГ-дефицитом [81]. Таким образом, к пожилым пациентам применяются те же критерии, что и к другим возрастным категориям. Однако, для таких пациентов необходимо выбирать более низкую стартовую дозировку, о чем подробнее будет написано ниже.
Начало лечения и подбор дозировок
Лечение СТГ-дефицита у взрослых рекомендуется начинать с низких доз (0,2-0,4 мг/сут подкожно), это позволяет снизить вероятность развития побочных эффектов [82]. Титровать дозу рекомендуется с интервалом 6–8 нед, в зависимости от клинического ответа и концентрации ИРФ-1, которую рекомендуется поддерживать в верхней половине референсного диапазона. У пациентов моложе 30 лет рекомендуется выбирать большую стартовую дозу (0,4–0,5 мг/сут), а у пожилых (старше 60 лет) – меньшую (0,1–0,2 мг/сут), чтобы минимизировать риск развития побочных эффектов, поскольку с возрастом отмечается физиологическое снижение потребности в соматотропине. Женщинам, получающим заместительную терапию пероральными эстроген-содержащими препаратами, требуется бо́льшая доза соматропина, поскольку пероральные препараты ингибируют синтез и секрецию ИРФ-1 печенью [83]. При применении трансдермальных форм эстрогенов коррекции доз соматотропина, как правило, не требуется.
После подбора стабильной дозировки анализ крови на ИРФ-1 и оценку на предмет побочных эффектов рекомендуется проводить каждые 6 мес, анализ липидного профиля и глюкозы плазмы натощак – каждые 12 мес или сразу после повышения дозы соматотропина. Физикальное обследование с измерением АД, веса, окружности талии и ИМТ рекомендуется проводить ежегодно и на каждом визите. Если по данным впервые проведенной рентгеновской денситометрии выявлено снижение МПК, повторное исследование проводится 1 раз в 2 года. Также для оценки качества жизни рекомендуется ежегодное заполнение соответствующих опросников.
Максимальная длительность лечения в настоящее время не определена. Однако в случае, если эффекта от лечения нет в течение 1 года, необходимо решить вопрос об отмене соматотропина [24].
Побочные эффекты
Основные побочные эффекты заместительной терапии обусловлены изменением имеющихся при СТГ-дефиците нарушений водно-электролитного обмена либо задержкой жидкости при передозировке препарата: артралгии, скованность суставов, миалгии, парестезии и периферические отеки. Такие побочные эффекты быстро регрессируют при снижении дозы соматотропина. Поскольку ранее начальная доза подбиралась по массе тела, побочные эффекты встречались чаще, чем при титрации дозы начиная с минимальной.
К очень редким побочным эффектам относятся доброкачественная внутричерепная гипертензия (ДВГ) и макулярный отек. Распространенность ДВГ в популяции детей, получающих терапию соматотропином, приблизительно в 100 раз больше, чем в здоровой популяции [84]. В литературе есть только одно описание ДВГ как побочного эффекта заместительной терапии СТГ-дефицита у взрослого пациента [85]. Описано 2 случая макулярного отека у пациентов без сахарного диабета: у девочки 11 лет, получавшей терапию соматотропином по поводу синдрома Шерешевского–Тернера, и у взрослого пациента 31 года с травматическим повреждением гипоталамо-гипофизарной области. В обоих случаях побочный эффект развился на фоне увеличения дозы соматотропина [86].
Влияние на заместительную терапию других недостаточностей
СТГ ингибирует 11-β-гидроксистероиддегидрогеназу 1-го типа и способствует большему синтезу кортизона и снижению синтеза кортизола. Необходимо внимательное наблюдение за пациентами с надпочечниковой недостаточностью (НН) при начале лечения соматотропином, поскольку возможно развитие клинической картины НН и повышение риска декомпенсации даже при легких инфекционных заболеваниях [87]. Кроме того, у пациентов с субклиническим гипокортицизмом после начала терапии соматропином возможна манифестация клинических проявлений НН.
При назначении соматропина пациентам без вторичного гипотиреоза наблюдается снижение концентрации тироксина сыворотки (Т4), однако концентрация трийодтиронина (Т3) остается стабильной. Пациентам на заместительной терапии Т4 часто требуется увеличение доз. Предполагается, что СТГ может увеличивать периферическую конверсию Т4 в Т3 и при этом подавлять высвобождение ТТГ в гипофизе, однако точный механизм неизвестен [88, 89].
Чувствительность к СТГ снижена у пациенток, получающих пероральные эстрогенсодержащие препараты. Данное явление объясняется феноменом первого прохождения через печень и ингибированием продукции ИРФ-1. На фоне применения трансдермальных форм эстрогенов этот эффект практически отсутствует [90, 91].
Тестостерон стимулирует секрецию СТГ и усиливает его стимулирующее влияние на выработку ИРФ-1. Дигидроэпиандростерон (ДГЭА) потенцирует выработку ИРФ-1 – пациентки на терапии ДГЭА достигают целевых показателей ИРФ-1 на меньших дозах соматотропина. Механизм такого эффекта неизвестен. Поскольку ДГЭА метаболизируется до тестостерона, существует предположение, что именно увеличение концентрации сывороточного тестостерона объясняет этот эффект [92].
Онкологический риск
Согласно эпидемиологическим исследованиям, возможно, существует взаимосвязь между высоконормальной концентрацией СТГ и ИРФ-1 в крови и распространенностью онкологических заболеваний [93]. При акромегалии риск развития некоторых онкологических заболеваний выше, чем в общей популяции [94].
В настоящее время нет данных об увеличении частоты рецидивов вне- и внутричерепных новообразований у взрослых пациентов, получающих соматотропин по поводу СТГ-дефицита. При этом лечение соматотропином противопоказано при наличии активного онкологического заболевания [24]. В 2017 г. опубликовано исследование D. Olsson и соавт., в которое включены 426 пациентов с гормонально-неактивными аденомами: 207 получали соматотропин (медиана длительности лечения 12,2 г.), 219 не получали лечения соматотропином (медиана наблюдения 8,2 г.). Среди пациентов, получавших заместительную терапию, отмечено снижение общей смертности и не выявлено повышения частоты смертности от онкологических заболеваний [95].
По данным метаанализа, в котором проанализированы данные семи проспективных и двух ретроспективных исследований (n=11 191). Заместительная терапия соматотропином связана со снижением онкологических рисков при СТГ-дефиците взрослых (относительный риск 0,69; 95% ДИ 0,59–0,82). Снижение риска сохранялось при дополнительных анализах по подгруппам, с исключением ретроспективных исследований, с количеством наблюдений менее 100, исследований среди пациентов с краниофарингиомами и исследований с длительностью наблюдения менее 3 лет [96].
Таким образом, согласно существующим данным, польза от заместительной терапии соматотропином у взрослых превышает теоретический риск новообразований. Скрининг на предмет новообразований у пациентов, получающих заместительную терапию соматотропином, не отличается от общей популяции. При этом стоит пристальнее наблюдать пациентов зрелого возраста, пациентов с онкологическим анамнезом и семейной предрасположенностью, а также группу с доказанным повышением онкологического риска – пациентов после лучевой терапии [97].
Качество жизни
Качество жизни взрослых пациентов с СТГ-дефицитом оценивается с помощью соответствующих опросников: QoL-AGHDA [98] и PGWB [99].
В 2012 г. опубликован метаанализ A. Hazem и соавт., в который включались данные рандомизированных плацебо-контролируемых исследований – всего 54 исследования (n=3400). Из отобранных исследований качество жизни оценивалось в 16, однако авторы не смогли провести метаанализ по причине гетерогенности данных и недостатка количественных данных. В 11 исследованиях отмечалось достоверное улучшение качества жизни согласно как минимум одному методу оценки [100].
Смертность
В исследовании по данным Голландского государственного регистра по лечению гормоном роста сравнили 2229 пациентов, получающих лечение соматотропином, с первой контрольной группой из 109 пациентов с СТГ-дефицитом, не получающих лечения, и второй контрольной группой из 356 пациентов после отмены соматотропина. Стандартизованный показатель смертности в группе лечения составил 1,27 (1,04–1,56) по отношению к общей популяции. После исключения из анализа пациентов с акромегалией и болезнью Иценко–Кушинга показатель составил 1,29 (1,05–1,59), после исключения пациентов высокого риска (краниофарингиомы или другие образования гипоталамо-гипофизарной области) – 1,00 (0,79–1,26). Также выявлено достоверное повышение стандартизованного показателя смертности среди женщин в группе лечения – 2,52 (1,57–4,06), и оно наблюдалось даже после исключения пациентов высокого риска. Авторы отмечают, что это может быть связано с длительным течением некомпенсированного СТГ-дефицита, негативно повлиявшего на сердечно-сосудистый риск, однако данное предположение требует дальнейшего изучения [101].
В исследовании R. Gaillard и соавт. среди 13 983 пациентов с СТГ дефицитом, получающих соматропин (средний период наблюдения 4,9 года), отмечено повышение общей смертности на 13% в сравнении с общей популяцией (стандартизованный показатель смертности 1,13 (1,04–1,24)), при этом показатели смертности от сердечно-сосудистых и онкологических заболеваний не отличались [102]. По результатам метаанализа J. Pappachan и соавт., стандартизованный показатель смертности составил 2,40 [95% ДИ 1,46–3,34] у пациентов с СТГ дефицитом без лечения и 1,15 [95% ДИ 1,05–1,24] у пациентов, получающих соматотропин [103]. K. Stochholm и G. Johansson также продемонстрировали более низкую смертность среди получающих соматотропин пациентов по сравнению с пациентами без лечения: отношение рисков по смертности от всех причин 0,34 (95% ДИ 0,15–0,77) [104].
Метаболические эффекты заместительной терапии
Поскольку СТГ является одним из значимых регуляторов метаболизма и энергетического гомеостаза [105], лечение СТГ-дефицита у взрослых пациентов оказывает влияние на состав тела, липидный, углеводный и костно-минеральный обмены, что подтверждается данными метаанализов.
Состав тела. В мета-анализ А. Hazem и соавт. были включены 54 РКИ (n~3400). Лечение соматропином достоверно снижает массу тела (–2,31 кг, 95% ДИ –2,66– –1,96) и жировую массу (–2,56 кг, 95% ДИ –2,97– –1,3) и увеличивает тощую массу тела (1,38 кг, 95% ДИ 1,10–1,65). При этом достоверного влияния на минеральную плотность кости (МПК) выявлено не было, что может быть обусловлено малым количеством наблюдений [100].
В метаанализ C. Newman и соавт., целью которого было сравнить эффективность низких и более высоких доз соматропина в отношении влияния на состав тела и липидный обмен, включены результаты 22 РКИ (n=1153). Тощая масса тела достоверно увеличивалась в группах лечения по сравнению с плацебо, а жировая масса снижалась. Изменения тощей массы тела и жировой массы демонстрировали дозозависимый эффект – лечение более высокими дозами было эффективнее [106].
Сердечно-сосудистая система и липидный обмен. По данным метаанализа P. Maison и P. Chanson, в который были включены 16 исследований, компенсация СТГ-дефицита способствует увеличению массы левого желудочка, толщины межжелудочковой перегородки и задней стенки левого желудочка, увеличению диаметра левого желудочка в диастолу и ударного объема [107]. Известно, что толщина комплекса интима–медиа сонных артерий – предиктор прогрессирования ишемической болезни сердца [108]. Было показано, что лечение СТГ-дефицита приводит к снижению этого показателя [109]. В проведенных исследованиях продемонстрировано снижение общего холестерина сыворотки, практически полностью за счет снижения концентрации холестерина ЛПНП. Эффект более выражен у пациентов с исходно большими показателями общего холестерина, при этом степень снижения не зависит от факторов, связанных с ожирением. Согласно результатам метаанализа, проведенного P. Maison и соавт., лечение СТГ-дефицита приводило к достоверному снижению холестерина ЛПНП, общего холестерина, жировой массы, диастолического давления и увеличению тощей массы тела, концентраций глюкозы плазмы натощак и инсулина сыворотки [110]. В вышеупомянутом мета-анализе С. Newman и соавт. отмечено снижение общего холестерина и холестерина ЛПНП в группах лечения по сравнению с плацебо, но дозозависимого эффекта не выявлено [106]. Метаанализ V. Giagulli и соавт. также обнаружил достоверное снижение концентрации холестерина ЛПНП, однако не выявил достоверного действия на артериальное давление и снижение сердечно-сосудистого риска как при краткосрочной, так и при долгосрочной терапии соматотропином [111]. Среди пациентов, у которых на фоне лечения снижался холестерин ЛПНП, отмечено повышение концентрации сывороточного липопротеина (а), при этом данные остаются противоречивыми из-за различий в наборах по определению липопротеина (а). Влияние этого явления на сердечно-сосудистый риск также неясно [112].
Углеводный обмен. В раздел метаанализа P. Maison и соавт., в котором анализировались показатели глюкозы и на фоне лечения, были включены данные 13 исследований (n=511): отмечено достоверное влияние заместительной терапии на тощаковые показатели глюкозы – [+0,43 (0,26; 0,60)]. Показатели оставались в пределах референсных значений как в группе лечения [5,1 ммоль/л (±0,5)], так и в группе плацебо [4,8 ммоль/л (±0,4)]. Концентрацию инсулина оценивали в 11 исследованиях (n=378): отмечено влияние заместительной терапии соматотропином на тощаковые показатели концентрации инсулина [+0,42 (0,23; 0,61)]. Средневзвешенное различие концентрации инсулина плазмы между группами лечения и плацебо составило 8,7 пмоль/л (7,0). Авторы заключают, что для надежных выводов по влиянию заместительной терапии соматропином на инсулинорезистентность необходимы исследования с прямым измерением чувствительности к инсулину [110].
В систематическом обзоре K. Stochholm и G. Johansson, опубликованном в 2015 г., оценены результаты 27 исследований – РКИ и открытых. Авторы отмечают, что данные по нарушениям углеводного обмена противоречивы: одни исследования отмечают повышенную встречаемость сахарного диабета (СД) на фоне лечения, по данным других – различий с популяционными данными нет. При этом исследования согласованно заключают, что риск развития СД на фоне заместительной терапии зависит от классических факторов риска, таких как ИМТ и возраст. Авторы обзора делают вывод, что встречаемость СД среди пациентов на заместительной терапии соматотропином не повышена и зависит, скорее, от классических факторов риска СД [104].
В метаанализе V. Giagulli и соавт. отмечена дискордантность показателей гликемии, однако достоверного изменения показателей гликемии не выявлено. В тех случаях, когда отмечалось повышение гликемии, показатели всегда находились в пределах референсных значений и не достигали диагностических значений в ходе орального теста на толератность к глюкозе. Среди 10 исследований, в которых измерялся гликированный гемоглобин, только в 2 отмечалось его повышение, но и в данных исследованиях показатель никогда не превышал нормальных значений [111].
Костное ремоделирование и минеральная плотность кости. Лечение СТГ-дефицита у взрослых в третьей декаде жизни приводит к увеличению минеральной плотности костей (МПК) и способствует достижению пика костной массы [113]. При родолжении или возобновлении терапии соматотропином в течение 2 лет после закрытия зон роста у пациентов с СТГ-дефицитом, дебютировавшим в детстве, отмечается достоверное повышение МПК по сравнению с контрольной группой без лечения [76].
Прибавка МПК на фоне лечения наблюдается через 18–24 мес после начала лечения, составляет около 4–10%, более заметное увеличение отмечается в позвонках [114]. В проспективном исследовании с 18 пациентами с СТГ-дефицитом, получавшими лечение соматотропином в течение 7 лет, отмечено повышение МПК и сохранение показателей на фоне длительной терапии; однако, достоверного положительного влияния на микроархитектонику кости не выявлено [115]. В когорте из 230 взрослых пациентов с СТГ-дефицитом, получавших терапию соматропином, которых наблюдали в течение 15 лет, отмечено устойчивое повышение МПК в позвонках, более заметное среди мужчин, и стабилизация МПК в шейке бедра. В данном исследовании авторы сделали вывод, что частота переломов на фоне длительной терапии соматропином не увеличивается [116]. Согласно метаанализу P. Xue и соавт., в который вошло 20 исследований, существует достоверная взаимосвязь между лечением СТГ-дефицита и увеличением МПК в позвонках, шейке бедра и по данным total-body денситометрии. При этом корреляции между лечением и МПК в позвонках и total-body не обнаружено в группах пациентов, получавших лечение фиксированными дозами соматотропина менее 2 лет. Также отмечены взаимосвязи лечения и total-body МПК при измерении на денситометрах Hologic и GE-Lunar. Авторы заключают, что лечение СТГ-дефицита оказывает положительное влияние на МПК у взрослых, однако в некоторых когортах это влияние неочевидно [117]. В метаанализ M. Barake и соавт. включены данные 31 исследования. Заместительная терапия приводит к повышению МПК в поясничных позвонках и шейке бедра при лечении длительностью более 12 мес. При этом отсутствуют данные по влиянию заместительной терапии на риск переломов. Степень положительного влияния заместительной терапии СТГ-дефицита зависит от пола, возраста, дозы и длительности лечения [118].
Стоит отметить, что в указанных исследованиях не принималось во внимание потребление кальция, витамина D и антирезорбтивных препаратов, в связи с чем сделать однозначный вывод о положительном влиянии затруднительно [119, 120]. К настоящему времени нет опубликованных данных РКИ, в которых бы оценивалось влияние лечения СТГ-дефицита у взрослых на частоту переломов.
Препараты СТГ длительного действия
В настоящее время на российском фармацевтическом рынке доступны препараты СТГ для ежедневного подкожного введения различных фирм-производителей, в том числе отечественных.
Депо-препарат LB03002 для еженедельного подкожного введения одобрен для лечения СТГ-дефицита у детей в Южной Корее. Также препарат был одобрен Европейским агентством лекарственных средств (EMA) в 2013 г. [121], однако в настоящее время разрешение отозвано, так как в течение 3 лет после одобрения препарат не поступил в продажу [122].
В настоящее время на разных стадиях исследований находятся препараты СТГ длительного действия: депо-формы, пегилированные препараты, пролекарства, СТГ, нековалентно связанный с альбумином, гибридные белки на основе СТГ [123]. Согласно обзору Общества исследований гормона роста, у каждого из препаратов свой профиль фармакокинетики и фармакодинамики, главными вопросами безопасности являются нефизиологическое повышение СТГ и ИРФ-1 и нефизиологическое тканевое распределение. Согласно данным, имеющимся в настоящее время, препараты длительного действия не вызывают тахифилаксию и проявляют клиническое действие, сравнимое с препаратами для ежедневного введения [124].
Заключение
СТГ-дефицит взрослых – системное полиэтиологическое заболевание, требующие соблюдения четких диагностических критериев для предотвращения гипердиагностики. В настоящее время из представленных провокационных проб в Российской Федерации доступны проба с инсулиновой гипогликемией и проба с глюкагоном, однако пороговые значения СТГ у последней окончательно не отработаны. Проба с глюкагоном представляется перспективной альтернативой пробе с инсулиновой гипогликемией; в настоящее время не опубликовано данных по сравнению данных проб на российской популяции пациентов.
Положительный эффект заместительной терапии соматотропином у взрослых пациентов с СТГ-дефицитом признается в отношении состава тела, физической активности, структуры костной ткани, липидного профиля и качества жизни, но влияние на смертность, риск переломов и сердечно-сосудистые риски остается недостаточно изученным. Существующие исследования ограничены отсутствием плацебо-контроля и малой длительностью наблюдения. Кроме того, срок воздействия некомпенсированного СТГ-дефицита среди пациентов и, как следствие, его вклад в развитие коморбидностей могут различаться.
Перспективы развития заместительной терапии заключаются в создании препаратов пролонгированного действия, что позволит повысить приверженность пациентов лечению. Имеющиеся данные позволяют рассчитывать на сходный профиль эффективности и безопасности по сравнению с препаратами для ежедневного приема, что необходимо подтвердить в длительных проспективных исследованиях.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-15-00398).
Участие авторов: А.С. Луценко, Е.В. Нагаева, Т.С. Зенкова, О.С. Чухачева – сбор и анализ данных литературы, написание основного текста статьи; Ж.Е. Белая, Г.А. Мельниченко – редактирование текста статьи. Все авторы внесли значимый вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
1. Vorontsova MV. Incidence and prevalence of growth hormone deficiency in the russian federation according to the official medical statistics data and the growth hormone deficiency patients registry. Problemy endokrinologii. 2016;62(4):18-26. doi: 10.14341/probl201662418-26
2. Vorontsova MV, Nagaeva EV, Naygovzina NB. Economic and social aspects of pituitary dwarfism treatment with recombinant growth hormone. Problemy endokrinologii. 2017;63(2):82−91. doi: 10.14341/probl201763282-91
3. Jørgensen JO, Thuesen L, Ingemann-Hansen T, et al. Beneficial effects of growth hormone treatment in GH-deficient adults. Lancet. 1989;333(8649):1221-1225. doi: https://doi.org/10.1016/S0140-6736(89)92328-3
4. Salomon F, Cuneo RC, Hesp R, Sönksen PH. The effects of treatment with recombinant human growth hormone on body composition and metabolism in adults with growth hormone deficiency. N Engl J Med. 1989;321(26):1797-1803. doi: https://doi.org/10.1056/NEJM198912283212605
5. Dedov II, Bezlepkina OB, Koledova EB, et al. The first domestic experience with the use of human growth hormone in adult patients with growth hormone deficiency. Problemy endokrinologii. 2004;50(1):30-33.
6. Bezlepkina OB. Sindrom gipofizarnoy karlikovosti u vzroslykh: diagnostika, klinika, mediko-sotsial’naya reabilitatsiya. [dissertation abstract] Moscow; 2004. 40 р. https://search.rsl.ru/ru/record/01002734135
7. Bezlepkina OB, Nagaeva EV, Tsybina LV, et al. Densitometricheskaya otsenka vliyaniya chelovecheskogo gormona rosta na zhirovuyu i toshchuyu massu tela u vzroslykh patsientov s somatotropnoy nedostatochnost’yu. Osteoporosis and bone diseases. 2003;2:2-4.
8. Mersebach H, Feldt-Rasmussen U. Growth hormone and body composition. In: Jørgensen JO, Christiansen JS (eds). Growth hormone deficiency in adults. Vol. 33. Basel: Karger; 2005. Рр. 185-195. doi: https://doi.org/10.1159/000088423
9. Vaks VV, Gerasimenko OA, Dzeranova LK. Priobretennaya nedostatochnost’ gormona rosta u vzroslykh: etiologiya, klinicheskie proyavleniya, diagnostika i vozmozhnosti lecheniya. Obesity and metabolism. 2011;8(2):11-17. doi: 10.14341/2071-8713-4947
10. Mоller J, Frandsen E, Fisker S, et al. Decreased plasma and extracellular volume in growth hormone deficient adults and the acute and prolonged effects of GH administration: a controlled experimental study. Clin Endocrinol (Oxf). 1996;44(5):533-539. doi: https://doi.org/10.1046/j.1365-2265.1996.728550.x
11. Widdowson WM, Gibney J. The effect of growth hormone replacement on exercise capacity in patients with GH deficiency: a metaanalysis. J Clin Endocrinol Metab. 2008;93(11):4413-4417. doi: https://doi.org/10.1210/jc.2008-1239
12. Juul A, Behrenscheer A, Tims T, et al. Impaired thermoregulation in adults with growth hormone deficiency during heat exposure and exercise. Clin Endocrinol (Oxf). 1993;38(3):237-244. doi: https://doi.org/10.1111/j.1365-2265.1993.tb01001.x
13. Dedov II, Bondarenko IZ, Bezlepkina OB. Endokrinnye mekhanizmy modulyatsii serdechnoydeyatel’nosti u patsientov s khronicheskoy serdechnoy nedostatochnost’yu: rol’ gormona rosta. Obesity and metabolism. 2010;7(4):4-7. doi: 10.14341/2071-8713-5080
14. Gazzaruso C, Gola M, Karamouzis I, et al. Cardiovascular risk in adult patients with growth hormone (GH) deficiency and following substitution with gh – an update. J Clin Endocrinol Metab. 2014;99(1):18-29. doi: https://doi.org/10.1210/jc.2013-2394
15. Johansson JO, Landin K, Tengborn L, et al. High fibrinogen and plasminogen activator inhibitor activity in growth hormone-deficient adults. Arterioscler Thromb A J Vasc Biol. 1994;14(3):434-437. doi: https://doi.org/10.1161/01.ATV.14.3.434
16. Giovannini L, Tirabassi G, Muscogiuri G, et al. Impact of adult growth hormone deficiency on metabolic profile and cardiovascular risk [Review]. Endocr J. 2015;62(12):1037-1048. doi: https://doi.org/10.1507/endocrj.EJ15-0337
17. Bouillon R, Koledova E, Bezlepkina O, et al. Bone status and fracture prevalence in Russian adults with childhood-onset growth hormone deficiency. J Clin Endocrinol Metab. 2004;89(10):4993-4998. doi: https://doi.org/10.1210/jc.2004-0054
18. Dedov II, Bezlepkina OB, Nagaeva EV, et al. Rasprostranennost’ perelomov pri gipopituitarizme. Osteoporosis and bone diseases. 2004;3:6-8.
19. Mazziotti G, Doga M, Frara S, et al. Incidence of morphometric vertebral fractures in adult patients with growth hormone deficiency. Endocrine. 2016;52(1):103-110. doi: https://doi.org/10.1007/s12020-015-0738-z
20. Rosilio M, Blum WF, Edwards DJ, et al. Long-term improvement of quality of life during growth hormone (GH) replacement therapy in adults with GH deficiency, as measured by questions on life satisfaction-hypopituitarism (QLS-H). J Clin Endocrinol Metab. 2004;89(4):1684-1693. doi: https://doi.org/10.1210/jc.2003-030134
21. Boguszewski CL. Update on GH therapy in adults. F1000 Research. 2017;6:2017. doi: https://doi.org/10.12688/f1000research.12057.1
22. Yuen KC, Tritos NA, Samson SL, et al. American Association of Clinical Endocrinologists and American College of Endocrinology Disease State Clinical Review: update on growth hormone stimulation testing and proposed revised cut-point for the glucagon stimulation test in the diagnosis of adult. Endocr Pract. 2016;22(10):1235-1244. doi: https://doi.org/10.4158/EP161407.DSCR
23. Mukherjee A, Shalet SM. The value of IGF1 estimation in adults with GH deficiency. Eur J Endocrinol. 2009;161(suppl_1):S33−S39. doi: https://doi.org/10.1530/EJE-09-0247
24. Molitch ME, Clemmons DR, Malozowski S, et al. Evaluation and treatment of adult growth hormone deficiency: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96(6):1587−1609. doi: https://doi.org/10.1210/jc.2011-0179
25. Nagaeva EV, Shiryaeva TY, Peterkova VA, et al. Russian national consensus. Diagnostics and treatment of hypopituitarism in children and adolescences. Problemy endokrinologii. 2018;64(6):402-411. doi: 10.14341/probl10091.
26. Roth J, Glick SM, Yalow RS, Berson SA. Hypoglycemia: a potent stimulus to secretion of growth hormone. Science. 1963;140(3570): 987-988. doi: https://doi.org/10.1126/science.140.3570.987
27. Lee P, Greenfield JR, Ho KK. Factors determining inadequate hypoglycaemia during insulin tolerance testing (ITT) after pituitary surgery. Clin Endocrinol (Oxf). 2009;71(1):82-85. doi: https://doi.org/10.1111/j.1365-2265.2008.03466.x
28. Aimaretti G, Corneli G, Razzore P, et al. Comparison between insulin-induced hypoglycemia and growth hormone (GH)-releasing hormone + arginine as provocative tests for the diagnosis of GH deficiency in adults 1. J Clin Endocrinol Metab. 1998;83(5):1615-1618. doi: https://doi.org/10.1210/jcem.83.5.4837
29. Ghigo E, Aimaretti G, Arvat E. Growth hormone-releasing hormone combined with arginine or growth hormone secretagogues for the diagnosis of growth hormone deficiency in adults. Endocrine. 2001;15(1):029−038. doi: https://doi.org/10.1385/ENDO:15:1:029
30. Barinaga M, Bilezikjian LM, Vale WW, et al. Independent effects of growth hormone releasing factor on growth hormone release and gene transcription. Nature. 1985;314(6008):279-281. doi: https://doi.org/10.1038/314279a0
31. Alba-Roth J, Müller OA, Schopohl J, von Werder K. Arginine stimulates growth hormone secretion by suppressing endogenous somatostatin secretion. J Clin Endocrinol Metab. 1988;67(6):1186-1189. doi:10.1210/jcem-67-6-1186.
32. Darzy KH, Thorner MO, Shalet SM. Cranially irradiated adult cancer survivors may have normal spontaneous GH secretion in the presence of discordant peak GH responses to stimulation tests (compensated GH deficiency). Clin Endocrinol (Oxf). 2009; 70(2):287-293. doi: https://doi.org/10.1111/j.1365-2265.2008.03359.x
33. Ghigo E, Bartolotta E, Imperiale E, et al. Glucagon stimulates GH secretion after intramuscular but not intravenous administration. Evidence against the assumption that glucagon per se has a GH-releasing activity. J Endocrinol Invest. 1994;17(11):849-854. doi: https://doi.org/10.1007/bf03347790
34. Tavares AB, Seixas da Silva IA, Silvestre DH, et al. Potential risks of glucagon stimulation test in elderly people. Growth Horm IGF Res. 2015;25(1):53-56. doi: https://doi.org/10.1016/j.ghir.2014.11.002
35. Gómez JM, Espadero RM, Escobar-Jiménez F, et al. Growth hormone release after glucagon as a reliable test of growth hormone assessment in adults. Clin Endocrinol (Oxf). 2002;56(3):329-334. doi: https://doi.org/10.1046/j.1365-2265.2002.01472.x
36. Conceição FL, da Costa e Silva A, Leal Costa AJ, Vaisman M. Glucagon stimulation test for the diagnosis of GH deficiency in adults. J Endocrinol Invest. 2003;26(11):1065-1070. doi: https://doi.org/10.1007/bf03345251
37. Boguszewski CL. Glucagon stimulation test: has its time come? Endocrine. 2017;57(3):361-363. doi: https://doi.org/10.1007/s12020-017-1356-8
38. Bowers CY. GH releasing peptides ― structure and kinetics. J Pediatr Endocrinol. 1993;6(1):21-31. doi: https://doi.org/10.1515/jpem.1993.6.1.21
39. Wang G, Lee HM, Englander E, Greeley GH. Ghrelin – not just another stomach hormone. Regul Pept. 2002;105(2):75-81. doi: https://doi.org/10.1016/S0167-0115(02)00012-5
40. Smith RG. Development of growth hormone secretagogues. Endocr Rev. 2005;26(3):346-360. doi: https://doi.org/10.1210/er.2004-0019
41. Yuen KC. Growth hormone stimulation tests in assessing adult growth hormone deficiency. In: Feingold KR, Anawalt B, Boyce A, et al., ed. Source Endotext [Internet]. South Dartmouth (MA): MD Text.com, Inc.; 2000-2019.
42. Popovic V, Pekic S, Golubicic I, et al. The impact of cranial irradiation on GH responsiveness to GHRH plus GH-releasing peptide-6. J Clin Endocrinol Metab. 2002;87(5):2095-2099. doi: https://doi.org/10.1210/jcem.87.5.8485
43. Procopio M, Maccario M, Savio P, et al. GH response to GHRH combined with pyridostigmine or arginine in different conditions of low somatotrope secretion in adulthood: obesity and Cushing’s syndrome in comparison with hypopituitarism. Panminerva Med. 1998;40(1):13-17.
44. Gasperi M, Aimaretti G, Scarcello G, et al. Low dose hexarelin and growth hormone (GH)-releasing hormone as a diagnostic tool for the diagnosis of GH deficiency in adults: comparison with insulin-induced hypoglycemia test 1. J Clin Endocrinol Metab. 1999;84(8):2633-2637. doi: https://doi.org/10.1210/jcem.84.8.5904
45. Petersenn S, Jung R, Beil FU. Diagnosis of growth hormone deficiency in adults by testing with GHRP-6 alone or in combination with GHRH: comparison with the insulin tolerance test. Eur J Endocrinol. 2002;146(5):667-672. doi: https://doi.org/10.1530/eje.0.1460667
46. Cordido F, Alvarez-Castro P, Isidro ML, et al. Comparison between insulin tolerance test, growth hormone (GH)-releasing hormone (GHRH), GHRH plus acipimox and GHRH plus GH-releasing peptide-6 for the diagnosis of adult GH deficiency in normal subjects, obese and hypopituitary patients. Eur J Endocrinol. 2003;149(2):117-122. doi: https://doi.org/10.1530/eje.0.1490117
47. Chihara K, Shimatsu A, Hizuka N, et al. A simple diagnostic test using GH-releasing peptide-2 in adult GH deficiency. Eur J Endocrinol. 2007;157(1):19-27. doi: https://doi.org/10.1530/EJE-07-0066
48. Alaioubi B, Mann K, Petersenn S. Diagnosis of adrenal insufficiency using the GHRP-6 test: comparison with the insulin tolerance test in patients with hypothalamic-pituitary-adrenal disease. Horm Metab Res. 2010;42(3):198-203. doi: https://doi.org/10.1055/s-0029-1243184
49. Popovic V, Leal A, Micic D, et al. GH-releasing hormone and GH-releasing peptide-6 for diagnostic testing in GH-deficient adults. Lancet. 2000;356(9236):1137-142. doi: https://doi.org/10.1016/S0140-6736(00)02755-0
50. Popovic V, Pekic S, Micic D, et al. Evaluation of the reproducibility of the GHRH plus GHRP-6 test of growth hormone reserve in adults. Clin Endocrinol (Oxf). 2004;60(2):185-191. doi: https://doi.org/10.1046/j.1365-2265.2003.01955.x
51. Kelestimur F, Popovic V, Leal A, et al. Effect of obesity and morbid obesity on the growth hormone (GH) secretion elicited by the combined GHRH + GHRP-6 test. Clin Endocrinol (Oxf). 2006;64(6):667-671. doi: https://doi.org/10.1111/j.1365-2265.2006.02525.x
52. Fukuda I, Hizuka N, Muraoka T, Ichihara A. Adult growth hormone deficiency: current concepts. Neurol Med Chir (Tokyo). 2014;54(8):599-605. doi: https://doi.org/10.2176/nmc.ra.2014-0088
53. Gasco V, Beccuti G, Baldini C, et al. Acylated ghrelin as a provocative test for the diagnosis of GH deficiency in adults. Eur J Endocrinol. 2013;168(1):23-30. doi: https://doi.org/10.1530/EJE-12-0584
54. Center for drug evaluation and research. Macrilen for oral solution: application number 205598Orig1s000 [Internet]. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2017/205598Orig1s000Approv.pdf
55. Piccoli F, Degen L, MacLean C, et al. Pharmacokinetics and pharmacodynamic effects of an oral ghrelin agonist in healthy subjects. J Clin Endocrinol Metab. 2007;92(5):1814-1820. doi: https://doi.org/10.1210/jc.2006-2160
56. Garcia JM, Swerdloff R, Wang C, et al. Macimorelin (AEZS-130)-stimulated growth hormone (GH) test: validation of a novel oral stimulation test for the diagnosis of adult GH deficiency. J Clin Endocrinol Metab. 2013;98(6):2422-2429. doi: https://doi.org/10.1210/jc.2013-1157
57. Garcia JM, Biller BM, Korbonits M, et al. Macimorelin as a diagnostic test for adult GH deficiency. J Clin Endocrinol Metab. 2018;103(8):3083-3093. doi: https://doi.org/10.1210/jc.2018-00665
58. Junnila RK, Strasburger CJ, Bidlingmaier M. Pitfalls of insulin-like growth factor-I and growth hormone assays. Endocrinol Metab Clin North Am. 2015;44(1):27-34. doi: https://doi.org/10.1016/j.ecl.2014.10.003
59. Clemmons DR. Consensus statement on the standardization and evaluation of growth hormone and insulin-like growth factor assays. Clin Chem. 2011;57(4):555-559. doi: https://doi.org/10.1373/clinchem.2010.150631
60. Ortea I, Ruiz-Sánchez I, Cañete R, et al. Identification of candidate serum biomarkers of childhood-onset growth hormone deficiency using SWATH-MS and feature selection. J Proteomics. 2018;175:105-113. doi: https://doi.org/10.1016/j.jprot.2018.01.003
61. Godowski PJ, Leung DW, Meacham LR, et al. Characterization of the human growth hormone receptor gene and demonstration of a partial gene deletion in two patients with laron-type dwarfism. Proc Natl Acad Sci. 1989;86(20):8083-8087. doi: https://doi.org/10.1073/pnas.86.20.8083
62. Dos Santos C, Essioux L, Teinturier C, et al. A common polymorphism of the growth hormone receptor is associated with increased responsiveness to growth hormone. Nat Genet. 2004;36(7):720-724. doi: https://doi.org/10.1038/ng1379
63. Ben-Avraham D, Govindaraju DR, Budagov T, et al. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. 2017;3(6):e1602025. doi: https://doi.org/10.1126/sciadv.1602025
64. Glad CA, Barbosa EJ, Filipsson Nyström H, et al. SNPs within the GH-signaling pathway are associated with the early IGF1 response to GH replacement therapy in GHD adults. Eur J Endocrinol. 2014;170(1):101-107. doi: https://doi.org/10.1530/EJE-13-0685
65. Moyes VJ, Walker DM, Owusu-Antwi S, et al. D3-GHR genotype does not explain heterogeneity in GH responsiveness in hypopituitary adults. Clin Endocrinol (Oxf). 2009;72(6):807-813. doi: https://doi.org/10.1111/j.1365-2265.2009.03768.x
66. Meyer S, Schaefer S, Stolk L, et al. Association of the exon 3 deleted/full-length GHR polymorphism with recombinant growth hormone dose in growth hormone-deficient adults. Pharmacogenomics. 2009;10(10):1599-1608. doi: https://doi.org/10.2217/pgs.09.91
67. Mormando M, Chiloiro S, Bianchi A, et al. Growth hormone receptor isoforms and fracture risk in adult-onset growth hormone-deficient patients. Clin Endocrinol (Oxf). 2016;85(5):717-724. doi: https://doi.org/10.1111/cen.13161
68. Barbosa EJ, Palming J, Glad CA, et al. Influence of the exon 3-deleted/full-length growth hormone (GH) receptor polymorphism on the response to GH replacement therapy in adults with severe GH deficiency. J Clin Endocrinol Metab. 2009;94(2):639-644. doi: https://doi.org/10.1210/jc.2008-0323
69. Andujar-Plata P, Fernandez-Rodriguez E, Quinteiro C, et al. Influence of the exon 3 deletion of GH receptor and IGF-I level at diagnosis on the efficacy and safety of treatment with somatotropin in adults with GH deficiency. Pituitary. 2015;18(1):101-107. doi: https://doi.org/10.1007/s11102-014-0562-0
70. Adetunji OR, Blair JC, Javadpour M, et al. Deletion of exon 3 in the growth hormone receptor gene in adults with growth hormone deficiency: comparison of symptomatic and asymptomatic patients. Clin Endocrinol (Oxf). 2010;72(3):422-423. doi: https://doi.org/10.1111/j.1365-2265.2009.03638.x
71. Adetunji OR, MacFarlane IA, Javadpour M, A et al. The d3/fl-GH receptor gene polymorphism does not influence quality of life and body composition in GH-deficient adults receiving GH replacement therapy. Eur J Endocrinol. 2009;161(4):541-546. doi: https://doi.org/10.1530/EJE-09-0405
72. Van der Klaauw AA, van der Straaten T, Baak-Pablo R, et al. Influence of the d3-growth hormone (GH) receptor isoform on short-term and long-term treatment response to GH replacement in GH-deficient adults. J Clin Endocrinol Metab. 2008;93(7):2828-2834. doi: https://doi.org/10.1210/jc.2007-2728
73. Giavoli C, Ferrante E, Profka E, et al. Influence of the d3GH receptor polymorphism on the metabolic and biochemical phenotype of GH-deficient adults at baseline and during short- and long-term recombinant human GH replacement therapy. Eur J Endocrinol. 2010;163(3):361-368. doi: https://doi.org/10.1530/EJE-10-0317
74. Reed ML, Merriam GR, Kargi AY. Adult growth hormone deficiency ― benefits, side effects, and risks of growth hormone replacement. Front Endocrinol (Lausanne). 2013;4:64. doi: https://doi.org/10.3389/fendo.2013.00064
75. Bex M, Abs R, Maiter D, et al. The effects of growth hormone replacement therapy on bone metabolism in adult-onset growth hormone deficiency: a 2-year open randomized controlled multicenter trial. J Bone Miner Res. 2002;17(6):1081-1094. doi: https://doi.org/10.1359/jbmr.2002.17.6.1081
76. Underwood LE, Attie KM, Baptista J. Growth hormone (GH) dose-response in young adults with childhood-onset GH deficiency: a two-year, multicenter, multiple-dose, placebo-controlled study. J Clin Endocrinol Metab. 2003;88(11):5273−5280. doi: https://doi.org/10.1210/jc.2003-030204
77. Shalet SM, Shavrikova E, Cromer M, et al. Effect of growth hormone (GH) treatment on bone in postpubertal GH-deficient patients: a 2-year randomized, controlled, dose-ranging study. J Clin Endocrinol Metab. 2003;88(9):4124-4129. doi: https://doi.org/10.1210/jc.2003-030126
78. Mauras N, Pescovitz OH, Allada V, et al. Limited efficacy of growth hormone (GH) during transition of GH-deficient patients from adolescence to adulthood: a phase III multicenter, double-blind, randomized two-year trial. J Clin Endocrinol Metab. 2005;90(7):3946−3955. doi: https://doi.org/10.1210/jc.2005-0208
79. Yang H, Wang L, Qiu X, et al. Body composition and metabolic health of young male adults with childhood-onset multiple pituitary hormone deficiency after cessation of growth hormone treatment. J Pediatr Endocrinol Metab. 2018;31(5):533-537. doi: https://doi.org/10.1515/jpem-2018-0019
80. Kokshoorn NE, Biermasz NR, Roelfsema F, et al. GH replacement therapy in elderly GH-deficient patients: a systematic review. Eur J Endocrinol. 2011;164(5):657-665. doi: https://doi.org/10.1530/EJE-10-1170
81. Toogood AA, O’Neill PA, Shalet SM. Beyond the somatopause: growth hormone deficiency in adults over the age of 60 years. J Clin Endocrinol Metab. 1996;81(2):460-465. doi: https://doi.org/10.1210/jcem.81.2.8636250
82. Nagaeva EV. Klinicheskie, gormonal’nye i metabolicheskie proyavleniya vrozhdennoy somatotropnoy nedostatochnosti u vzroslykh karlikov na fone zamestitel’noy terapii gormonom rosta. [dissertation] Moscow; 2002.
83. Span JP, Pieters GF, Sweep CG, et al. Gender difference in insulin-like growth factor I response to growth hormone (GH) treatment in GH-deficient adults: role of sex hormone replacement. J Clin Endocrinol Metab. 2000;85(3):1121-1125. doi: https://doi.org/10.1210/jcem.85.3.6463
84. Clayton PE, Cowell CT. Safety issues in children and adolescents during growth hormone therapy – a review. Growth Horm IGF Res. 2000;10(6):306-317. doi: https://doi.org/10.1054/ghir.2000.0175
85. Malozowski S, Tanner LA, Wysowski D, Fleming GA. Growth hormone, insulin-like growth factor I, and benign intracranial hypertension. N Engl J Med. 1993;329(9):665-666. doi: https://doi.org/10.1056/NEJM199308263290917
86. Koller EA, Green L, Gertner JM, et al. Retinal changes mimicking diabetic retinopathy in two nondiabetic, growth hormone-treated patients 1. J Clin Endocrinol Metab. 1998;83(7):2380-2383. doi: https://doi.org/10.1210/jcem.83.7.4953
87. Filipsson H, Johannsson G. GH replacement in adults: interactions with other pituitary hormone deficiencies and replacement therapies. Eur J Endocrinol. 2009;161(suppl 1):S85-S95. doi: https://doi.org/10.1530/EJE-09-0319
88. Feldt-Rasmussen U, Klose M. Central hypothyroidism and its role for cardiovascular risk factors in hypopituitary patients. Endocrine. 2016;54(1):15-23. doi: https://doi.org/10.1007/s12020-016-1047-x
89. Glynn N, Kenny H, Quisenberry L, et al. The effect of growth hormone replacement on the thyroid axis in patients with hypopituitarism: in vivo and ex vivo studies. Clin Endocrinol (Oxf). 2017;86(5):747-754. doi: https://doi.org/10.1111/cen.13272
90. Weissberger AJ, Ho KK, Lazarus L.Contrasting effects of oral and transdermal routes of estrogen replacement therapy on 24-hour growth hormone (GH) secretion, insulin-like growth factor I, and GH-binding protein in postmenopausal women. J Clin Endocrinol Metab. 1991;72(2):374-381. doi: https://doi.org/10.1210/jcem-72-2-374
91. Wolthers T, Hoffman DM, Nugent AG, et al. Oral estrogen antagonizes the metabolic actions of growth hormone in growth hormone-deficient women. Am J Physiol Metab. 2001;281(6):E1191-E1196. doi: https://doi.org/10.1152/ajpendo.2001.281.6.E1191
92. Brooke AM, Kalingag LA, Miraki-Moud F, et al. Dehydroepiandrosterone (DHEA) replacement reduces growth hormone (GH) dose requirement in female hypopituitary patients on GH replacement. Clin Endocrinol (Oxf). 2006;65(5):673-680. doi: https://doi.org/10.1111/j.1365-2265.2006.02648.x
93. Renehan AG, Zwahlen M, Minder C, et al. Insulin-like growth factor (IGF)-I, IGF binding protein-3, and cancer risk: systematic review and meta-regression analysis. Lancet. 2004;363(9418): 1346-1353. doi: https://doi.org/10.1016/S0140-6736(04)16044-3
94. Dal J, Leisner MZ, Hermansen K, et al. Cancer incidence in patients with acromegaly: a cohort study and meta-analysis of the literature. J Clin Endocrinol Metab. 2018;103(6):2182-2188. doi: https://doi.org/10.1210/jc.2017-02457
95. Olsson DS, Trimpou P, Hallén T, et al. Life expectancy in patients with pituitary adenoma receiving growth hormone replacement. Eur J Endocrinol. 2017;176(1):67-75. doi: https://doi.org/10.1530/EJE-16-0450
96. Li Z, Zhou Q, Li Y, et al. Growth hormone replacement therapy reduces risk of cancer in adult with growth hormone deficiency: a meta-analysis. Oncotarget. 2016;7(49):81862-81869. doi: https://doi.org/10.18632/oncotarget.13251
97. Pekic S, Stojanovic M, Popovic V. Controversies in the risk of neoplasia in GH deficiency. Best Pract Res Clin Endocrinol Metab. 2017;31(1):35−47. doi: https://doi.org/10.1016/j.beem.2017.02.004
98. McKenna SP, Doward LC, Alonso J, et al. The QoL-AGHDA: an instrument for the assessment of quality of life in adults with growth hormone deficiency. Qual Life Res. 1999;8(4):373-383. doi: https://doi.org/10.1023/A:1008987922774
99. Revicki DA, Leidy NK, Howland L. Evaluating the psychometric characteristics of the psychological general well-being index with a new response scale. Qual Life Res. 1996;5(4):419-425. doi: https://doi.org/10.1007/bf00449916
100. Hazem A, Elamin MB, Bancos I, et al. Body composition and quality of life in adults treated with GH therapy: a systematic review and meta-analysis. Eur J Endocrinol. 2012;166(1):13-20. doi: https://doi.org/10.1530/EJE-11-0558
101. Van Bunderen CC, van Nieuwpoort IC, Arwert LI, et al. Does growth hormone replacement therapy reduce mortality in adults with growth hormone deficiency? Data from the Dutch National Registry of growth hormone treatment in adults. J Clin Endocrinol Metab. 2011;96(10):3151-3159. doi: https://doi.org/10.1210/jc.2011-1215
102. Gaillard RC, Mattsson AF, Аkerblad AC, et al. Overall and cause-specific mortality in GH-deficient adults on GH replacement. Eur J Endocrinol. 2012;166(6):1069−1077. doi: https://doi.org/10.1530/EJE-11-1028
103. Pappachan JM, Raskauskiene D, Kutty VR, Clayton RN. Excess mortality associated with hypopituitarism in adults: a meta-analysis of observational studies. J Clin Endocrinol Metab. 2015;100(4):1405-1411. doi: https://doi.org/10.1210/jc.2014-3787
104. Stochholm K, Johannsson G. Reviewing the safety of GH replacement therapy in adults. Growth Horm IGF Res. 2015;25(4):149-157. doi: https://doi.org/10.1016/j.ghir.2015.06.006
105. Vorotnikova SYu, Pigarova EA, Dzeranova LK. Metabolicheskie effekty gormona rosta. Obesity and metabolism. 2011;8(4):55-59. doi: 10.14341/2071-8713-5308
106. Newman CB, Carmichael JD, Kleinberg DL. Effects of low dose versus high dose human growth hormone on body composition and lipids in adults with GH deficiency: a meta-analysis of placebo-controlled randomized trials. Pituitary. 2015;18(3):297-305. doi: https://doi.org/10.1007/s11102-014-0571-z
107. Maison P, Chanson P. Cardiac effects of growth hormone in adults with growth hormone deficiency. Circulation. 2003;108(21): 2648-2652. doi: https://doi.org/10.1161/01.CIR.0000100720.01867.1D
108. Kablak-Ziembicka A. Association of increased carotid intima-media thickness with the extent of coronary artery disease. Heart. 2004;90(11):1286-1290. doi: https://doi.org/10.1136/hrt.2003.025080
109. Gibney J, Wallace JD, Spinks T, et al. The effects of 10 years of recombinant human growth hormone (GH) in adult GH-deficient patients. J Clin Endocrinol Metab. 1999;84(8):2596-2602. doi: https://doi.org/10.1210/jcem.84.8.5916
110. Maison P, Griffin S, Nicoue-Beglah M, et al. Impact of growth hormone (GH) treatment on cardiovascular risk factors in GH-deficient adults: a metaanalysis of blinded, randomized, placebo-controlled trials. J Clin Endocrinol Metab. 2004;89(5):2192-2199. doi: https://doi.org/10.1210/jc.2003-030840
111. Giagulli VA, Castellana M, Perrone R, et al. GH supplementation effects on cardiovascular risk in GH deficient adult patients: a systematic review and meta-analysis. Endocr Metab Immune Disord Drug Targets. 2017;17(4):285-296. doi: https://doi.org/10.2174/1871530317666170919121729
112. Wieringa G, Toogood AA, Ryder WD, et al. Changes in lipoprotein(a) levels measured by six kit methods during growth hormone treatment of growth hormone-deficient adults. Growth Horm IGF Res. 2000;10(1):14-19. doi: https://doi.org/10.1054/ghir.2000.0134
113. Tritos NA, Klibanski A. Effects of growth hormone on bone. Prog Mol Biol Transl Sci. 2016;138:193-211. doi: https://doi.org/10.1016/bs.pmbts.2015.10.008
114. Biller BM, Sesmilo G, Baum HB, et al. Withdrawal of long-term physiological growth hormone (GH) administration: differential effects on bone density and body composition in men with adult-onset GH deficiency 1. J Clin Endocrinol Metab. 2000;85(3):970-976. doi: https://doi.org/10.1210/jcem.85.3.6474
115. Allo Miguel G, Serraclara Plá A, Partida Muñoz ML, et al. Seven years of follow up of trabecular bone score, bone mineral density, body composition and quality of life in adults with growth hormone deficiency treated with rhGH replacement in a single center. Ther Adv Endocrinol Metab. 2016;7(3):93-100. doi: https://doi.org/10.1177/2042018816643908
116. Appelman-Dijkstra NM, Claessen KM, Hamdy NA, et al. Effects of up to 15 years of recombinant human GH (rhGH) replacement on bone metabolism in adults with Growth Hormone Deficiency (GHD): The Leiden Cohort Study. Clin Endocrinol (Oxf). 2014;81(5):727-735. doi: https://doi.org/10.1111/cen.12493
117. Xue P, Wang Y, Yang J, Li Y. Effects of growth hormone replacement therapy on bone mineral density in growth hormone deficient adults: a meta-analysis. Int J Endocrinol. 2013;2013:216107. doi: https://doi.org/10.1155/2013/216107
118. Barake M, Klibanski A, Tritos NA. Effects of recombinant human growth hormone therapy on bone mineral density in adults with growth hormone deficiency: a meta-analysis. J Clin Endocrinol Metab. 2014;99(3):852-860. doi: https://doi.org/10.1210/jc.2013-3921
119. Appelman-Dijkstra NM, Claessen KM, Roelfsema F, et al. Therapy of endocrine disease: long-term effects of recombinant human GH replacement in adults with GH deficiency: a systematic review. Eur J Endocrinol. 2013;169(1):R1-R14. doi: https://doi.org/10.1530/EJE-12-1088
120. Díez JJ, Sangiao-Alvarellos S, Cordido F. Treatment with growth hormone for adults with growth hormone deficiency syndrome: benefits and risks. Int J Mol Sci. 2018;19(3):893. doi: https://doi.org/10.3390/ijms19030893
121. Committee for Medicinal Products for Human Use (CHMP) Assessment report Somatropin Biopartners International non-proprietary name: somatropin. EMA/CHMP/229458/2013 [Internet]. Available from: https://www.ema.europa.eu/en/documents/assessment- report/somatropin-biopartners-epar-public-assessment-report_en.pdf.
122. European Medicines Agency. Somatropin Biopartners [Internet]. Available from: https://www.ema.europa.eu/en/medicines/human/EPAR/somatropin-biopartners.
123. Hоybye C, Cohen P, Hoffman AR, et al. Status of long-acting-growth hormone preparations − 2015. Growth Horm IGF Res. 2015; 25(5):201-206. doi: https://doi.org/10.1016/j.ghir.2015.07.004
124. Christiansen JS, Backeljauw PF, Bidlingmaier M, et al. Growth hormone research society perspective on the development of long-acting growth hormone preparations. Eur J Endocrinol. 2016;174(6):C1-C8. doi: https://doi.org/10.1530/EJE-16-0111
Введение
Дети с установленным дефицитом гормона роста получают заместительную терапию рекомбинатным гормоном роста до совершеннолетия и достижения генетически прогнозируемого конечного роста. Несмотря на то, что основной спектр физиологических эффектов соматотропный гормон (СТГ) оказывает на организм в детском возрасте, а в последующем его выработка снижается, СТГ играет важную роль в нормальном функционировании органов и систем взрослого человека. В настоящее время в России разработана система оказания медицинской помощи детям с дефицитом гормона роста [1, 2], однако отсутствуют клинические рекомендации, посвященные диагностике и заместительной терапии СТГ-дефицита взрослых.
Первые исследования, посвященные лечению СТГ-дефицита у взрослых пациентов с гипопитуитаризмом, были опубликованы в 1989 г. [3, 4]. В Российской Федерации первый опыт применения человеческого гормона роста у взрослых пациентов с СТГ-дефицитом был опубликован в 2004 г. [5]. Клинические проявления заболевания у взрослых пациентов неспецифичны и в случаях приобретенного СТГ-дефицита часто маскируются проявлениями недостаточностей других тропных гормонов гипофиза, что затрудняет диагностику.
Целью данного обзора является обобщение современных данных по диагностике, лечению и системному влиянию заместительной терапии соматропином у взрослых пациентов с СТГ-дефицитом.
Клинические проявления
Дефицит СТГ у взрослых характеризуется системными изменениями метаболизма при неспецифичных клинических проявлениях [6].
– Состав тела. Увеличение массы жировой ткани, преимущественно за счет висцерального жира, уменьшение тощей массы [7–9], снижение объема внеклеточной жидкости и общей концентрации натрия [10].
– Физическая активность. Снижение толерантности к физическим нагрузкам, уменьшение мышечной силы на фоне уменьшения количества мышечной ткани [11]. Нарушение терморегуляции [12].
– Сердечно-сосудистая система, липидный обмен и система свертывания крови. Увеличение сердечно-сосудистого риска за счет дислипидемии, нарушений углеводного обмена и ускоренного развития атеросклероза. Уменьшение массы миокарда, нарушение проводимости, сократимости и ударного объема, снижение нагнетательной функции и фракции выброса, диастолическая дисфункция [13]. Дислипидемия вследствие повышения концентрации общего холестерина, холестерина ЛПНП и триглицеридов [14]. Повышение активности фибриногена и ингибитора активаторов плазминогена 1-го типа (PAI-1) [15].
– Углеводный обмен. Нарушение толерантности к глюкозе, инсулинорезистентность [16].
– Костная система. Уменьшение костной массы и минеральной плотности кости (МПК), повышение риска переломов [17–19].
– Качество жизни и когнитивные функции. Снижение качества жизни: дезадаптация, сниженная самооценка, тревожность, апатия, депрессия, социальная изоляция [20].
Диагностика
Диагностика СТГ-дефицита взрослых сложна по ряду причин. Клинические проявления данного заболевания неспецифичны и потому имеют невысокую диагностическую ценность [21]. В физиологических условиях секреция СТГ имеет импульсный характер, на нее влияют возраст, пол и индекс массы тела, в связи с чем определение базальной концентрации СТГ не имеет диагностического значения [22]. Нормальные показатели ИРФ-1 сыворотки крови не исключают диагноз СТГ-дефицита. ИРФ-1, ИРФ-связывающий белок 3 (ИРФСБ-3) имеют ориентировочное значение для диагностики, поскольку показатели у пациентов с СТГ-дефицитом и здоровых людей могут частично совпадать [23].
В настоящее время общепринятым методом диагностики СТГ-дефицита взрослых являются стимуляционные пробы [22, 24], протоколы которых представлены в табл. 1.
Зарубежные клинические руководства рекомендуют проводить пробы только тем пациентам, у которых высока вероятность наличия заболевания, а заместительная гормональная терапия соматотропином будет способствовать улучшению метаболических параметров и качества жизни. Проведения провокационных проб не требуется при наличии одного из двух условий:
1. Наличие трех из четырех составляющих:
– значительный дефицит роста (<-3 SDS);
– как минимум одна дополнительная тропная недостаточность;
– низкая концентрация ИФР-1 в крови;
– врожденный дефект гипоталамо-гипофизарной области по данным МРТ: «триада» (гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза);
– оперативное лечение опухоли гипоталамо-гипофизарной области в анамнезе;
– облучение области «голова–шея» в анамнезе.
2. Мутации генов, ассоциированных с развитием гипопитуитаризма: GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др. [22, 24, 25].
В табл. 2 представлены
Проба с инсулиновой гипогликемией
Стимуляция секреции СТГ при гипогликемии была впервые описана в 1963 г. [26]. Данная проба считается «золотым стандартом» в диагностике СТГ-дефицита взрослых [22, 24], однако у нее имеется ряд недостатков. Требуется тщательное медицинское наблюдение для мониторинга потенциальных нежелательных явлений (судорожных приступов или потери сознания вследствие гипогликемии). Кроме того, в связи с наличием инсулинорезистентности у пациентов с ожирением, у данной категории может понадобиться использование более высоких доз инсулина (0,15–0,20 ЕД/кг массы тела), что увеличивает риск отсроченной гипогликемии [27]. Проба с инсулиновой гипогликемией противопоказана пожилым пациентам, лицам с высоким сердечно-сосудистым риском и эпилепсией. И хотя чувствительность пробы высока, отмечаются ограничения в ее воспроизводимости. Кроме того, вариабельность пиков секреции СТГ отмечалась у здоровых добровольцев в зависимости от времени проведения и в разные фазы менструального цикла [22].
В настоящее время в качестве диагностического значения стимулированной секреции СТГ при гипогликемии используется диапазон 3,0–5,0 нг/мл [22, 24].
Согласно зарубежным рекомендациям, при противопоказаниях к пробе с инсулиновой гипогликемией возможно проведение комбинированной пробы со стимуляцией соматолиберином и аргинином, однако, применение аргинина для диагностики СТГ-дефицита в РФ не зарегистрировано.
Проба с соматолиберином и аргинином
Проба с соматолиберином и аргинином, как и проба с инсулиновой гипогликемией, считается достаточно чувствительной и специфичной для диагностики СТГ-дефицита [28, 29], однако в настоящее время на фармацевтическом рынке отсутствует препарат соматолиберина.
Точность данной пробы определяется совместным применением двух стимулирующих веществ: соматолиберин стимулирует синтез и высвобождение СТГ гипофизом [30], а аргинин усиливает этот эффект путем подавления высвобождения соматостатина [31]. Концентрация СТГ на фоне стимуляции не зависит от пола и возраста, однако, результат зависит от ИМТ, в связи с чем используются три пороговых значения (табл. 3).
Проба с глюкагоном
В связи с тем, что основная альтернативная проба для диагностики недоступна, активно изучается возможность применения пробы с глюкагоном при противопоказаниях к пробе с инсулиновой гипогликемией.
Глюкагон – сильный стимулятор секреции СТГ, однако, механизм стимуляции остается неясным. Стимулирующий эффект более выражен при внутримышечном или подкожном введении по сравнению с внутривенным [33].
Достоинства пробы с глюкагоном – воспроизводимость и безопасность, на ее результаты не влияет пол и гипоталамический генез СТГ-дефицита. Недостатки – длительность пробы (3–4 ч) и необходимость внутримышечного введения глюкагона. Побочные эффекты пробы более выражены у пожилых пациентов: гипотония, гипогликемии и приступы эпилепсии [34]. Кроме того, имеется риск отсроченных гипогликемий, в связи с чем данная проба не вошла в рутинную клиническую практику.
В двух исследованиях сравнивались диагностические возможности пробы с глюкагоном и пробы с инсулиновой гипогликемией, группы пациентов и контроль были сопоставлены по полу и возрасту [35, 36]. В исследовании J. Gómez и соавт. группы пациентов были также сопоставлены по ИМТ, в данном исследовании выявлена обратная корреляция возраста и ИМТ с пиковыми концентрациями СТГ у здоровых добровольцев.
Изначально пороговым значением концентрации СТГ принималось 3,0 нг/мл. В дальнейших исследованиях выявлено, что использование такого значения приводит к гипердиагностике СТГ-дефицита [37]. Принимая это во внимание, рекомендации Американской ассоциации эндокринологов предлагают использовать пороговое значение 1,0 нг/мл для пациентов с ИМТ более 25 кг/м2. Авторы также отмечают, что для уточнения диагностической точности сниженного порогового значения необходимо проведение больших проспективных исследований среди пациентов с различным ИМТ и нарушениями углеводного обмена [22].
Секретагоги гормона роста
К данному классу относятся молекулы, проявляющие сильный дозозависимый и специфичный стимуляционный эффект на соматотрофы [38]. Они связываются с рецептором СТГ секретагога-1а (growth hormone secretagogue receptor 1a, GHS-R1a) в гипоталамусе и гипофизе. Естественным лигандом данного рецептора является грелин [39]. Другие агонисты его рецептора являются аналогами грелина: GHRP-2 (GH-releasing peptide-2, СТГ-рилизинг пептид-2), GHRP-6, гексарелин, все данные вещества вводятся парентерально. Также существуют аналоги грелина для перорального введения.
Достоинство секретагогов СТГ – возможность перорального приема [40]. Они устойчивы к протеолизу, так как многие представители являются небелковыми молекулами либо содержат D-изомеры аминокислот [41]. Недостаток – возможность получения ложноположительных результатов при гипоталамическом генезе СТГ-дефицита [42].
Проводились исследования, оценивающие диагностическую ценность проб с GHRP-6, GHRP-2 и комбинаций соматолиберина с гексарелином, пиридостигмином, аципимоксом, GHRP-6 в сравнении с пробой с инсулиновой гипогликемией [43–48].
В исследованиях теста с соматолиберином и GHRP-6 для диагностики СТГ-дефицита взрослых отмечена хорошая переносимость пробы (единственный побочный эффект – «приливы»), высокая чувствительность и воспроизводимость. GHRP-6 назначается внутривенно, пик ответа СТГ развивается на 15–30-й минуте – значительно раньше, чем при использовании других фармакологических стимуляторов. Пороговое значение для нормального ответа 20 нг/мл, для СТГ-дефицита 10 нг/мл [49, 50]. На результаты данного теста не влияют возраст, пол или избыточная масса тела, за исключением случаев, когда ИМТ превышает 35 кг/м2, – пороговое значение снижается до 5 нг/мл [51].
Пробу с GHRP-2 с 2006 г. используют в Японии, так как она безопасна и удобна, в качестве порогового значения используется концентрация СТГ 9 нг/мл. Пиковой концентрации СТГ после стимуляции достигает на 60-й минуте [52].
В исследовании, где в качестве стимулирующего агента использовался ацетилированный грелин, наиболее диагностически значимыми значениями концентрации СТГ для диагностики были 7,3 нг/млпри нормальной массе тела, 2,9 нг/мл при избыточной массе тела и 0,6 нг/мл при ожирении, диагностическая точность составила 89,3, 94,1 и 62,5% соответственно. Авторы делают вывод, что ожирение значительно снижает ответ СТГ на стимуляцию грелином, однако данная проба является надежным инструментом в диагностике у пациентов с нормальной и избыточной массой тела [53].
В настоящее время применение вышеуказанных методов в Российской Федерации невозможно, так как на рынке отсутствуют препараты соматолиберина и секретагогов СТГ.
Пероральный секретагог СТГ
В 2017 г. Food and Drugs Administration (FDA) одобрило применение мациморелина для диагностики СТГ-дефицита у взрослых [54].
Мациморелин – агонист GHS-R1a с высокой стабильностью, которая позволяет назначать его перорально. В исследовании I фазы у 36 здоровых добровольцев при пероральном приеме мациморелина отмечалось быстрое дозозависимое повышение концентрации препарата в плазме, пик концентрации достигался на 50–75-й минуте после приема. Дозозависимая стимуляция секреции СТГ соотносилась по времени с максимальной концентрацией препарата в плазме, повышение концентрации СТГ длилось около 120 мин после перорального приема или интрадуоденального введения. Препарат хорошо переносился, нежелательных явлений не выявлено [55].
В многоцентровом открытом исследовании сравнивали диагностическую ценность и безопасность мациморелина в сравнении с пробой соматолиберин + аргинин, среди взрослых пациентов с СТГ-дефицитом и здоровых добровольцев. Согласно ROC-анализу, оптимальная пороговая концентрация СТГ составила 2,7 нг/мл: чувствительность 82%, специфичность 92%, доля ошибок в распознавании 13%. Среди пациентов, которым назначали оба диагностических теста, диагностическая ценность методов была сопоставима. Пиковые концентрации СТГ обратно коррелировали с ИМТ в контрольной группе. При единственном заборе крови через 45 мин после приема мациморелина, при использовании пороговых значений, согласно ИМТ (6,8 нг/мл при ИМТ <30 кг/м2, 2,7 нг/мл при ИМТ ≥30 кг/м2) чувствительность пробы составила 90%, специфичность – 85%, доля ошибок в распознавании – 12,2% [56].
В 2018 г. опубликованы результаты многоцентрового, открытого, рандомизированного, двойного перекрестного исследования, целью которого было установить эффективность и безопасность применения однократного приема мациморелина в дозе 0,5 мг/кг для диагностики СТГ-дефицита взрослых, по сравнению с пробой с инсулиновой гипогликемией. Пациенты были поделены на три группы согласно вероятности наличия заболевания: высокой (n=38), средней (n=37) и низкой (n=39), также подобрана группа здоровых добровольцев (n=25). При использовании в качестве «точки отсечения» значения концентрации СТГ 2,8 нг/мл для мациморелина и 5,1 нг/мл для пробы с инсулиновой гипогликемией, отрицательная согласованность составила 95,38% (95% ДИ 87–99%), положительная согласованность – 74,32% (95% ДИ 63–84%), чувствительность 87%, специфичность 96%. Воспроизводимость пробы с мациморелином составила 97% (n=33). В ходе вторичного анализа выявлено, что использование отрезной точки 5,1 нг/мл позволяет достигнуть отрицательной согласованности 94% (95% ДИ 85–98%), положительной согласованности 82% (95% ДИ 72–90%), чувствительности 92% и специфичности 96% [57].
В настоящее время не опубликовано результатов по безопасности и диагностической ценности данного теста у пациентов с морбидным ожирением. К наиболее частым побочным эффектам относятся искажение вкуса, головокружение, головная боль, утомляемость и нарушения работы желудочно-кишечного тракта (тошнота, голод и диарея). Следует избегать назначения совместно с препаратами, удлиняющими интервал QT, так как это может привести к развитию желудочковой тахикардии. CYP3A4 – основной фермент, метаболизирующий мациморелин, поэтому при применении совместно с препаратами, активирующими его, возможно получение ложноположительных результатов [54].
Стандартизация наборов для определения СТГ
Результаты стимулирующих проб трактуются согласно пороговым значениям концентраций, в связи с чем точность лабораторного определения СТГ крайне важна. Циркулирующий СТГ представлен различными изоформами и изомерами: в наибольшей доле присутствует вариант массой 22 кДа, также присутствуют молекулы меньшей массы. Моноклональные антитела способны специфично связываться с изоформами массой 22 кДа, но будут пропускать другие изоформы. Молекулы сходного с СТГ строения (плацентарный СТГ, пролактин), а также СТГ-связывающий белок (с которым связано около 50% циркулирующего СТГ) могут вступать в перекрестные реакции и влиять на точность измерения. Также существуют различия и несогласованность в калибровках, что ограничивает возможности сравнения пороговых значений в разных исследованиях. Кроме того, лаборатории могут использовать разные единицы измерения концентрации либо активности СТГ [58].
Для борьбы с данными ограничениями в настоящее время предложен единый калибровочный стандарт для СТГ – 98/574. Все производители наборов должны уточнять определяемые изоформы, специфичность используемых антител и наличие перекрестных реакций с СТГ-связывающим белком [59].
Протеомные биомаркеры СТГ-дефицита
На момент подачи статьи публикации по протеомным биомаркерам СТГ-дефицита взрослых отсутствовали. В 2018 г. опубликованы результаты исследования, в котором методом протеомного анализа нового поколения SWATH-MS исследовались циркулирующие белки у детей с СТГ-дефицитом в сравнении со здоровыми добровольцами. Обнаружено три белка, которые могут являться биомаркерами для неинвазивной диагностики СТГ-дефицита у детей: аполипопротеин A-IV, CFHR4 (complement factor H-related protein 4) и PBP (platelet basic protein) [60]. Вопрос исследования данных белков при СТГ-дефиците у взрослых остается открытым.
Полиморфизмы рецептора гормона роста
У человека ген рецептора гормона роста (r-СТГ) расположен на 5-й хромосоме. Ген состоит из девяти экзонов, кодирующих рецептор, и нескольких дополнительных экзонов в 5’ нетранслируемой области. Известны две основные изоформы r-СТГ, отличающиеся наличием (fl-GHR, full-length), либо отсутствием экзона 3 (d3-GHR, exon 3-deficient). Отсутствие экзона 3 приводит к потере 22 аминокислот во внеклеточном домене рецептора [61]. В настоящее время считается, что связывающая способность обеих изоформ одинакова. Изоформа d3 доминирует над fl, около 50% европейцев гетеро- или гомозиготны по d3 [62]. Носительство d3 ассоциировано с высоким ростом, более высокой чувствительностью к СТГ и является фактором долгожительства у мужчин [63].
У пациентов с генотипом fl/fl отмечался более выраженный ответ на введение соматропина после лечения в течение 1 нед, по сравнению с пациентами с аллелями d3 [64]. В другом исследовании с длительностью лечения 12 мес, повышение ИРФ-1 в ответ на терапию было достоверно большим в группе d3/d3. Различий по концентрации ИРФ-1 между группами fl/d3 и fl/fl не выявлено [65]. По данным S. Meyer и соавт., не выявлено достоверных различий концентрации ИРФ-1 на фоне терапии между носителями одного или двух аллелей d3 и генотипа fl/fl [66]. У взрослых пациентов с СТГ-дефицитом с аллелями d3 снижен риск переломов позвонков независимо от получения заместительной терапии СТГ [67].
Также опубликованы исследования, в которых между генотипами не обнаруживалось различий по клиническим проявлениям и нежелательным явлениям, качеству жизни, концентрациям ИРФ-1, составу тела и жировой массе [68–71].
Проведено два исследования, в которых оценивали влияние полиморфизмов r-СТГ на различные показатели на фоне заместительной терапии СТГ спустя 1 год и после 5 лет лечения. В исследовании Van der А. Klaauw и соавт. после первого года лечения в группе носителей d3 отмечалось более выраженное повышение ИФР-1 при одинаковых средних дозах соматотропина в группах. Среди носителей d3 общий холестерин снижался менее выраженно, а концентрация холестерина ЛПВП достигала более высоких значений по сравнению с fl/fl. Однако, через 5 лет данных различий между группами обнаружено не было [72]. По данным С. Giavoli и соавт., лечение соматропином нормализует концентрацию ИРФ-1 и снижает процентную долю жировой массы после 1 года и после 5 лет лечения, независимо от присутствия аллеля d3. После одного года лечения в группах носителей d3 отмечалось повышение концентрации холестерина ЛПВП, после пяти лет – снижение концентрации общего холестерина и холестерина ЛПНП. При исходно одинаковой распространенности нарушений углеводного обмена через 5 лет после лечения в группе fl/fl она снизилась, а в группах носителей d3 двукратно увеличилась [73].
В настоящее время данные по влиянию полиморфизма r-СТГ на клиническую картину СТГ-дефицита взрослых малочисленны, а имеющиеся публикации по взаимоотношениям носительства аллели d3 и ответа на заместительную терапию противоречивы.
Лечение
Определение показаний к заместительной терапии
Целесообразность заместительной терапии СТГ-дефицита взрослых определяется предполагаемой пользой для каждого конкретного пациента. С наибольшей вероятностью пользу от лечения будут получать пациенты с выраженным СТГ-дефицитом, подтвержденным с помощью стимуляционных проб и низкой сывороточной концентрацией ИРФ-1. Клиническими проявлениями, указывающими на необходимость лечения, являются остеопения, повышенный сердечно-сосудистый риск, а также сниженное качество жизни, которое необходимо подтвердить валидизированными опросниками для данного заболевания [74].
Важной категорией являются пациенты, достигшие целевого роста на фоне заместительной терапии и переходящие под наблюдение взрослого эндокринолога. У таких пациентов полное созревание костной и мышечной систем может продолжаться в течение последующих 10 лет [75–77]. На фоне отмены соматропина после достижения целевого роста отмечалось ухудшение показателей липидного обмена, состава тела и качества жизни [76, 78, 79]. После достижения конечного роста необходимо проводить редиагностику СТГ-дефицита, через 1–3 мес после перерыва в лечении соматропином (табл. 4).
Негативные клинические проявления СТГ-дефицита и положительное действие заместительной терапии соматотропином распространяется и на пациентов старше 65 лет [80]. Несмотря на известный факт снижения секреции СТГ с возрастом, диагностические пробы позволяют разграничить физиологическое снижение от патологического, обусловленного СТГ-дефицитом [81]. Таким образом, к пожилым пациентам применяются те же критерии, что и к другим возрастным категориям. Однако, для таких пациентов необходимо выбирать более низкую стартовую дозировку, о чем подробнее будет написано ниже.
Начало лечения и подбор дозировок
Лечение СТГ-дефицита у взрослых рекомендуется начинать с низких доз (0,2−0,4 мг/сут подкожно), это позволяет снизить вероятность развития побочных эффектов [82]. Титровать дозу рекомендуется с интервалом 6–8 нед, в зависимости от клинического ответа и концентрации ИРФ-1, которую рекомендуется поддерживать в верхней половине референсного диапазона. У пациентов моложе 30 лет рекомендуется выбирать большую стартовую дозу (0,4–0,5 мг/сут), а у пожилых (старше 60 лет) – меньшую (0,1–0,2 мг/сут), чтобы минимизировать риск развития побочных эффектов, поскольку с возрастом отмечается физиологическое снижение потребности в соматотропине. Женщинам, получающим заместительную терапию пероральными эстроген-содержащими препаратами, требуется бо́льшая доза соматропина, поскольку пероральные препараты ингибируют синтез и секрецию ИРФ-1 печенью [83]. При применении трансдермальных форм эстрогенов коррекции доз соматотропина, как правило, не требуется.
После подбора стабильной дозировки анализ крови на ИРФ-1 и оценку на предмет побочных эффектов рекомендуется проводить каждые 6 мес, анализ липидного профиля и глюкозы плазмы натощак – каждые 12 мес или сразу после повышения дозы соматотропина. Физикальное обследование с измерением АД, веса, окружности талии и ИМТ рекомендуется проводить ежегодно и на каждом визите. Если по данным впервые проведенной рентгеновской денситометрии выявлено снижение МПК, повторное исследование проводится 1 раз в 2 года. Также для оценки качества жизни рекомендуется ежегодное заполнение соответствующих опросников.
Максимальная длительность лечения в настоящее время не определена. Однако в случае, если эффекта от лечения нет в течение 1 года, необходимо решить вопрос об отмене соматотропина [24].
Побочные эффекты
Основные побочные эффекты заместительной терапии обусловлены изменением имеющихся при СТГ-дефиците нарушений водно-электролитного обмена либо задержкой жидкости при передозировке препарата: артралгии, скованность суставов, миалгии, парестезии и периферические отеки. Такие побочные эффекты быстро регрессируют при снижении дозы соматотропина. Поскольку ранее начальная доза подбиралась по массе тела, побочные эффекты встречались чаще, чем при титрации дозы начиная с минимальной.
К очень редким побочным эффектам относятся доброкачественная внутричерепная гипертензия (ДВГ) и макулярный отек. Распространенность ДВГ в популяции детей, получающих терапию соматотропином, приблизительно в 100 раз больше, чем в здоровой популяции [84]. В литературе есть только одно описание ДВГ как побочного эффекта заместительной терапии СТГ-дефицита у взрослого пациента [85]. Описано 2 случая макулярного отека у пациентов без сахарного диабета: у девочки 11 лет, получавшей терапию соматотропином по поводу синдрома Шерешевского–Тернера, и у взрослого пациента 31 года с травматическим повреждением гипоталамо-гипофизарной области. В обоих случаях побочный эффект развился на фоне увеличения дозы соматотропина [86].
Влияние на заместительную терапию других недостаточностей
СТГ ингибирует 11-β-гидроксистероиддегидрогеназу 1-го типа и способствует большему синтезу кортизона и снижению синтеза кортизола. Необходимо внимательное наблюдение за пациентами с надпочечниковой недостаточностью (НН) при начале лечения соматотропином, поскольку возможно развитие клинической картины НН и повышение риска декомпенсации даже при легких инфекционных заболеваниях [87]. Кроме того, у пациентов с субклиническим гипокортицизмом после начала терапии соматропином возможна манифестация клинических проявлений НН.
При назначении соматропина пациентам без вторичного гипотиреоза наблюдается снижение концентрации тироксина сыворотки (Т4), однако концентрация трийодтиронина (Т3) остается стабильной. Пациентам на заместительной терапии Т4 часто требуется увеличение доз. Предполагается, что СТГ может увеличивать периферическую конверсию Т4 в Т3 и при этом подавлять высвобождение ТТГ в гипофизе, однако точный механизм неизвестен [88, 89].
Чувствительность к СТГ снижена у пациенток, получающих пероральные эстрогенсодержащие препараты. Данное явление объясняется феноменом первого прохождения через печень и ингибированием продукции ИРФ-1. На фоне применения трансдермальных форм эстрогенов этот эффект практически отсутствует [90, 91].
Тестостерон стимулирует секрецию СТГ и усиливает его стимулирующее влияние на выработку ИРФ-1. Дигидроэпиандростерон (ДГЭА) потенцирует выработку ИРФ-1 – пациентки на терапии ДГЭА достигают целевых показателей ИРФ-1 на меньших дозах соматотропина. Механизм такого эффекта неизвестен. Поскольку ДГЭА метаболизируется до тестостерона, существует предположение, что именно увеличение концентрации сывороточного тестостерона объясняет этот эффект [92].
Онкологический риск
Согласно эпидемиологическим исследованиям, возможно, существует взаимосвязь между высоконормальной концентрацией СТГ и ИРФ-1 в крови и распространенностью онкологических заболеваний [93]. При акромегалии риск развития некоторых онкологических заболеваний выше, чем в общей популяции [94].
В настоящее время нет данных об увеличении частоты рецидивов вне- и внутричерепных новообразований у взрослых пациентов, получающих соматотропин по поводу СТГ-дефицита. При этом лечение соматотропином противопоказано при наличии активного онкологического заболевания [24]. В 2017 г. опубликовано исследование D. Olsson и соавт., в которое включены 426 пациентов с гормонально-неактивными аденомами: 207 получали соматотропин (медиана длительности лечения 12,2 г.), 219 не получали лечения соматотропином (медиана наблюдения 8,2 г.). Среди пациентов, получавших заместительную терапию, отмечено снижение общей смертности и не выявлено повышения частоты смертности от онкологических заболеваний [95].
По данным метаанализа, в котором проанализированы данные семи проспективных и двух ретроспективных исследований (n=11 191). Заместительная терапия соматотропином связана со снижением онкологических рисков при СТГ-дефиците взрослых (относительный риск 0,69; 95% ДИ 0,59–0,82). Снижение риска сохранялось при дополнительных анализах по подгруппам, с исключением ретроспективных исследований, с количеством наблюдений менее 100, исследований среди пациентов с краниофарингиомами и исследований с длительностью наблюдения менее 3 лет [96].
Таким образом, согласно существующим данным, польза от заместительной терапии соматотропином у взрослых превышает теоретический риск новообразований. Скрининг на предмет новообразований у пациентов, получающих заместительную терапию соматотропином, не отличается от общей популяции. При этом стоит пристальнее наблюдать пациентов зрелого возраста, пациентов с онкологическим анамнезом и семейной предрасположенностью, а также группу с доказанным повышением онкологического риска – пациентов после лучевой терапии [97].
Качество жизни
Качество жизни взрослых пациентов с СТГ-дефицитом оценивается с помощью соответствующих опросников: QoL-AGHDA [98] и PGWB [99].
В 2012 г. опубликован метаанализ A. Hazem и соавт., в который включались данные рандомизированных плацебо-контролируемых исследований – всего 54 исследования (n=3400). Из отобранных исследований качество жизни оценивалось в 16, однако авторы не смогли провести метаанализ по причине гетерогенности данных и недостатка количественных данных. В 11 исследованиях отмечалось достоверное улучшение качества жизни согласно как минимум одному методу оценки [100].
Смертность
В исследовании по данным Голландского государственного регистра по лечению гормоном роста сравнили 2229 пациентов, получающих лечение соматотропином, с первой контрольной группой из 109 пациентов с СТГ-дефицитом, не получающих лечения, и второй контрольной группой из 356 пациентов после отмены соматотропина. Стандартизованный показатель смертности в группе лечения составил 1,27 (1,04–1,56) по отношению к общей популяции. После исключения из анализа пациентов с акромегалией и болезнью Иценко–Кушинга показатель составил 1,29 (1,05–1,59), после исключения пациентов высокого риска (краниофарингиомы или другие образования гипоталамо-гипофизарной области) – 1,00 (0,79–1,26). Также выявлено достоверное повышение стандартизованного показателя смертности среди женщин в группе лечения – 2,52 (1,57–4,06), и оно наблюдалось даже после исключения пациентов высокого риска. Авторы отмечают, что это может быть связано с длительным течением некомпенсированного СТГ-дефицита, негативно повлиявшего на сердечно-сосудистый риск, однако данное предположение требует дальнейшего изучения [101].
В исследовании R. Gaillard и соавт. среди 13 983 пациентов с СТГ дефицитом, получающих соматропин (средний период наблюдения 4,9 года), отмечено повышение общей смертности на 13% в сравнении с общей популяцией (стандартизованный показатель смертности 1,13 (1,04–1,24)), при этом показатели смертности от сердечно-сосудистых и онкологических заболеваний не отличались [102]. По результатам метаанализа J. Pappachan и соавт., стандартизованный показатель смертности составил 2,40 [95% ДИ 1,46–3,34] у пациентов с СТГ дефицитом без лечения и 1,15 [95% ДИ 1,05–1,24] у пациентов, получающих соматотропин [103]. K. Stochholm и G. Johansson также продемонстрировали более низкую смертность среди получающих соматотропин пациентов по сравнению с пациентами без лечения: отношение рисков по смертности от всех причин 0,34 (95% ДИ 0,15–0,77) [104].
Метаболические эффекты заместительной терапии
Поскольку СТГ является одним из значимых регуляторов метаболизма и энергетического гомеостаза [105], лечение СТГ-дефицита у взрослых пациентов оказывает влияние на состав тела, липидный, углеводный и костно-минеральный обмены, что подтверждается данными метаанализов.
Состав тела. В мета-анализ А. Hazem и соавт. были включены 54 РКИ (n~3400). Лечение соматропином достоверно снижает массу тела (–2,31 кг, 95% ДИ –2,66– –1,96) и жировую массу (–2,56 кг, 95% ДИ –2,97– –1,3) и увеличивает тощую массу тела (1,38 кг, 95% ДИ 1,10–1,65). При этом достоверного влияния на минеральную плотность кости (МПК) выявлено не было, что может быть обусловлено малым количеством наблюдений [100].
В метаанализ C. Newman и соавт., целью которого было сравнить эффективность низких и более высоких доз соматропина в отношении влияния на состав тела и липидный обмен, включены результаты 22 РКИ (n=1153). Тощая масса тела достоверно увеличивалась в группах лечения по сравнению с плацебо, а жировая масса снижалась. Изменения тощей массы тела и жировой массы демонстрировали дозозависимый эффект – лечение более высокими дозами было эффективнее [106].
Сердечно-сосудистая система и липидный обмен. По данным метаанализа P. Maison и P. Chanson, в который были включены 16 исследований, компенсация СТГ-дефицита способствует увеличению массы левого желудочка, толщины межжелудочковой перегородки и задней стенки левого желудочка, увеличению диаметра левого желудочка в диастолу и ударного объема [107]. Известно, что толщина комплекса интима–медиа сонных артерий – предиктор прогрессирования ишемической болезни сердца [108]. Было показано, что лечение СТГ-дефицита приводит к снижению этого показателя [109]. В проведенных исследованиях продемонстрировано снижение общего холестерина сыворотки, практически полностью за счет снижения концентрации холестерина ЛПНП. Эффект более выражен
Выработка СТГ происходит в головном мозге, а именно в изолированном участке мозга — гипофизе. С работой гормона роста связаны такие процессы в организме, как выработка инсулина, регулирование углеводного обмена, рост мышечной ткани и другое.
Самый активный синтез соматотропина приходится на детство и подростковый возраст, далее постепенно снижается и приостанавливается, что вызывает старение организма. Снижение концентрации в тканях происходит после 20 лет и более интенсивно начинается после 25.
Достаточно интересен тот факт, что данный гормон не вырабатывается в организме постоянно одинаковыми порциями, в течение суток у него есть пики и спады. Так, наибольшая выработка приходится на время сна и занятий активным физическим трудом (пробежки, плавание, подъем веса и т.п.).
Основная роль, какое количество СТГ будет выработано, зависит от генетической предрасположенности. Встречаются случаи, когда уже с рождения для нормального развития детям требуется дополнительно количество соматотропина.
Часто можно увидеть вопрос о том, какое заболевание сопровождается дефицитом гормона роста, так вот, пациенты с развитым остеопорозом практически всегда имеют нехватку соматотропина.
По МКБ код Е23 у данной патологии (Международной классификации болезней).
Основные функции
Уже было отмечено, что основная роль соматотропина заключается в росте костей, однако, это не все его функции, необходимо упомянуть еще ряд:
- способствует образованию белков, которые являются строительным материалом для органов и тканей;
- контролирует процесс накопления жировых отложений, регулирует соотношение жировой и мышечной ткани в теле (чем выше гормон роста, тем быстрее «сжигается» жир и больше мышц на теле образовывается);
- регулирует углеводный обмен и работу инсулина;
- не просто дает кости расти, но помогает кальцию успешно попадать внутрь для ее укрепления.
Существуют еще функции, которые выполняет гормон роста, но самые значимые из них перечислены.
Причины дефицита гормона роста у взрослых
Дефицит соматотропного гормона может быть вызван такими нарушениями:
- врожденные опухоли мозга злокачественного и доброкачественного характера;
- нарушения, в том числе опухоли мозга, которые вызваны травмами;
- излишнее радиоактивное облучение;
- некоторые инфекции могут провоцировать дефицит, особенно у детей (менингит, туберкулез и др.).
Не исключаются наследственные предрасположенности к небольшой выработке гормона роста по той или иной причине.
Сколько живут люди с дефицитом гормона роста сложно сказать, так как все зависит от причины дефицита и его характера.
Причины развития дефицита гормона роста у ребенка
Имеются случаи, когда организм ребенка не вырабатывает достаточное количество соматотропина, а это значит, что не будет роста и развития. Обычно это обусловлено генетическими факторами: наследственность или мутация генов. Реже встречаются у детей опухоли в гипофизе и вирусные инфекции, приводящие к недостатку гормона роста.
Гормон роста у детей может перестать вырабатывать в нужном количестве в любом возрасте, если его причиной не является генетический фактор. Если же проблема в генах, то в первые годы жизни это будет заметно.
Родителям необходимо внимательно следить за состоянием своего ребенка. При рождении может не возникнуть мысли в каких-либо патологиях, обычно такие дети рождаются нормальными и растут как все в первые месяцы, однако дальше можно заметить, что рост костей не соответствует норме. Половые признаки могут развиваться очень медленно или не развиваться вообще, из-за чего в подростковом возрасте возникает масса проблем: не приходят менструации, у мальчика недостаточно развит половой орган и другое.
Умственные отклонения не являются ярко выраженными для такого рода заболевания, ребенок может ходить в обычную школу, нормально общаться со сверстниками, однако изучение нового материала, его усвоение будет даваться очень тяжело.
Лечение детей с такой дисфункцией заключается во введении синтетического гормона роста. Инъекции необходимо делать постоянно для нормального развития и последующей жизни ребенка.
Если патология была выявлена рано, то медикаментозное лечение будет крайне успешным, в то время как обнаружение проблемы в позднем возрасте, после 8 лет и начатая гормонзаместительная терапия может не дать серьезных результатов.
Принципы лечения недостатка гормона роста
Лечение пациентов с подтвержденным диагнозом будет сформировано, опираясь на причины, вызвавшие дефицит СТГ.
Если виной диагноза послужила опухоль, то по возможности ее удаляют (это может быть сделано, как инвазивными, так и не инвазивными методами, в зависимости от места расположения образования, его размера и степени развития). Основным же пунктом лечения для большинства людей с недостатком гормона роста является заместительная гормональная терапия. В некоторых случаях необходимо дополнительное введение самого соматотропина в тело человека, в других случаях вводят гормоны, которые будут стимулировать естественную выработку гормона роста.
Так как чаще всего опухоль при данном отклонении развивается в гипофизе, то ее удаление хирургическим путем затруднено, а ребенок после такой операции может остаться с частично поврежденным гипофизом.
К какому врачу обратиться
При нарушенной работе гормональной системы человеку необходимо обратиться в первую очередь к врачу-эндокринологу. Врачи данной специальности смогут разобраться в проблеме, будут сделаны соответствующие диагностические процедуры, поставлен диагноз и назначено лечение. Нельзя самостоятельно ставить себе диагноз, опираясь на форумы и тем более назначать лечение.
Я, Романов Георгий Никитич, являюсь опытным врачом-эндокринологом, владею современными методиками лечения. В числе моих пациентов за более чем 20 лет работы, были случаи дефицита гормона роста, мы выявляли первопричины и успешно проводили их устранение. Сейчас я веду приема в платной клинике в г.Гомеле, а также провожу онлайн консультации на удобных для пациента платформах. В рамках платной онлайн консультации я могу изучить симптоматику, порекомендовать необходимые методы диагностики, помочь с расшифровкой анализов и проводить корректировку лечения. Для записи на прием необходимо написать в мой личный профиль в одном из представленных мессенджеров: ВКонтакте, instagram, WhatsApp, skype, Viber.
Выводы
Нарушения секреции и действия соматотропного гормона (СТГ) у детей служат главной причиной низкорослости. Существует множество причин дефицита СТГ, и поэтому дифференциальный диагноз при низкорослости сложен и складывается из многих элементов: тщательного сбора анамнеза и осмотра, антропометрии, инструментальных и лабораторных исследований. Основным методом лечения дефицита СТГ у детей является заместительная терапия генно-инженерным человеческим СТГ — соматропином. Соматропин эффективен при изолированном дефиците СТГ, при сочетанном дефиците СТГ и других гипофизарных тропных гормонов, а также при ряде синдромов, сопровождающихся задержкой роста. Побочные эффекты при применении соматропина минимальны.
Введение
Задержка роста, обусловленная дефицитом соматотропного гормона (СТГ, гормон роста) – одна из актуальных проблем детской эндокринологии. В последние годы благодаря развитию методов молекулярного анализа достигнуты значительные успехи в изучении механизмов экспрессии и расшифровке структуры генов системы “СТГ – инсулиноподобные факторы роста (ИФР)”. С внедрением генно-инженерных методов синтеза человеческого СТГ (соматропина) кардинально изменилась судьба больных с гипофизарной карликовостью. Применение соматропина для лечения детей с дефицитом СТГ позволяет достичь нормального окончательного роста и обеспечить полноценную жизнь.
Человеческий СТГ секретируется соматотропными клетками аденогипофиза и представляет собой пептид, содержащий 191 аминокислоту. В крови циркулирует множество форм СТГ, из них 75 % приходится на мономерную форму СТГ с молекулярной массой 22000. Эта форма СТГ обладает максимальной биологической активностью и максимальным сродством к рецепторам СТГ. Секреция СТГ имеет импульсный характер с выраженным суточным ритмом. Основное количество СТГ секретируется в ночное время, в начале глубокого сна, что особенно выражено у детей.
СТГ – главный регулятор роста. Он стимулирует продольный рост костей, рост хряща, рост и дифференцировку внутренних органов и мышечной ткани. Сам по себе СТГ на рост не влияет: его эффекты опосредуются ИФР-I и ИФР-II, которые синтезируются, главным образом, в печени под влиянием СТГ.
Этиология и эпидемиология
Различают врожденный и приобретенный дефицит СТГ, органический (как результат внутричерепных повреждений разной этиологии) и идиопатический (при отсутствии какой-либо органической патологии гипоталамо-гипофизарной области). В зависимости от уровня нарушений секреции и действия СТГ различают гипофизарный дефицит (первичная патология гипофиза); гипоталамический дефицит (нарушения синтеза и секреции соматолиберина); периферическую резистентность к СТГ (дефекты рецепторов СТГ в тканях-мишенях).
Классификация причин дефицита
Врожденный дефицит СТГ
- Наследственный:
- изолированный дефицит СТГ: мутации гена СТГ (известно 4 вида мутаций), мутации гена рецептора соматолиберина;
- множественный дефицит гормонов аденогипофиза (мутации генов РIT-1, POU1F1, PROP1, LHX3, LHX4).
- Идиопатический дефицит соматолиберина
- Дефекты развития гипофиза или гипоталамуса:
- пороки развития срединных структур головного мозга (анэнцефалия, голопрозэнцефалия, септооптическая дисплазия);
- дисгенезия гипофиза (врожденная аплазия, гипоплазия, эктопия).
Приобретенный дефицит СТГ
- Опухоли гипоталамуса и гипофиза (краниофарингиома, гамартома, нейрофиброма, дисгерминома, аденома гипофиза).
- Опухоли других отделов головного мозга (например, глиома зрительного нерва).
- Травмы (черепно-мозговая травма, хирургическое повреждение ножки гипофиза).
- Инфекция и воспаление (менингит, энцефалит, аутоиммунный гипофизит).
- Супраселлярная киста, гидроцефалия, синдром пустого турецкого седла.
- Сосудистая патология (аневризма в области турецкого седла, инфаркт гипофиза).
- Облучение.
- Токсический побочный эффект химиотерапии.
- Инфильтративные заболевания (гистиоцитоз, саркоидоз).
- Транзиторный (конституциональные и психосоциальные причины).
Периферическая резистентность к СТГ
- Дефекты рецепторов СТГ (синдром Ларона).
- Пострецепторные дефекты передачи сигнала СТГ.
- Мутации генов ИФР-I и рецептора ИФР-I.
- Биологически неактивный СТГ.
- Супраселлярная киста, гидроцефалия, синдром пустого турецкого седла.
Дефицит СТГ встречается с частотой 1 : 10000 – 1 : 15000. Наиболее распространен идиопатический дефицит СТГ (65–75 %), но по мере совершенствования методов диагностики доля детей с идиопатическим дефицитом СТГ уменьшается, а частота органических форм дефицита СТГ растет.
Диагностика
Анамнез
При сборе анамнеза учитывают:
- сроки появления задержки роста (пренатальная; постнатальная – в первые месяцы жизни, до 5 лет, после 5–6 лет);
- перинатальную патологию (асфиксия, респираторный дистресс-синдром, родовая травма);
- эпизоды гипогликемии (судороги, потливость, беспокойство, повышенный аппетит);
- семейный анамнез (случаи низкорослости и задержки полового развития у ближайших родственников);
- хронические заболевания, влияющие на рост (болезни желудочно-кишечного тракта, почек, сердечно-сосудистой системы, болезни крови, наследственные нарушения метаболизма, эндокринные болезни, болезни костей).
Осмотр
При осмотре обращают внимание на пропорции тела ребенка, черты лица, волосы, тембр голоса, вес, размеры полового члена. Исключают пангипопитуитаризм (по отсутствию симптомов дефицита других гормонов гипофиза – ТТГ, АКТГ, ЛГ, ФСГ, антидиуретического гормона). Наличие помимо низкорослости таких жалоб, как головная боль, нарушения зрения, рвота, позволяет заподозрить внутричерепную патологию. Детальный осмотр позволяет выявить наследственные синдромы, для которых характерна низкорослость (Шерешевского-Тернера, Рассела-Сильвера, Секкеля, Прадера-Вилли, Лоренса-Муна-Бидля, Гетчинсона-Гилфорда и др.); хондродисплазии (ахондроплазия и др.); эндокринные заболевания (врожденный гипотиреоз, гипофизарный синдром Кушинга, синдром Мориака); нарушения питания.
Распознавание многих редких синдромов задержки роста основано, главным образом, на типичном фенотипе.
Антропометрия
Оценка роста на момент обследования. Для каждого ребенка с задержкой роста педиатр должен строить кривую роста на процентильных таблицах роста и веса, составленных по данным измерений этих параметров в репрезентативной группе детей данной национальности. До двухлетнего возраста рост ребенка измеряют лежа, старше 2 лет – стоя, с помощью ростомера.
Прогноз роста. Для исключения диагностических ошибок большое значение имеет анализ кривой роста ребенка с учетом границ его окончательного роста, рассчитанных на основании среднего роста родителей. Если расчетный окончательный рост ребенка на момент осмотра, с учетом костного возраста, ниже предела рассчитанного интервала окончательного роста, следует говорить о патологической низкорослости. Задержка роста у детей с дефицитом СТГ усиливается с возрастом и к моменту установления диагноза рост у таких детей, как правило, более чем на 3 стандартных отклонения отличается от среднего в популяции для данного паспортного возраста и пола.
Скорость роста. Помимо абсолютных показателей роста, важным параметром является скорость роста. Это весьма чувствительный индикатор даже самых малых изменений динамики роста ребенка, который отражает как ростостимулирующие воздействия (например, на фоне лечения соматропином, половыми гормонами, левотироксином), так и тормозящие (например, при прогрессирующем росте краниофарингиомы). Скорость роста рассчитывают за 6 месяцев 2 раза в год. У детей с дефицитом СТГ скорость роста обычно ниже третьего процентиля и не превышает 4 см/г.
Пропорции тела. Оценка пропорций тела важна для исключения хондродисплазий. Существует множество форм скелетных дисплазий (остеохондродисплазия, диссоциированное развитие хряща и фиброзного компонента скелета, дизостозы и др.). Самая распространенная форма хондродисплазии – ахондроплазия.
Рентгенологические исследования
Определение костного возраста. Степень оссификации эпифизарных зон роста является важным критерием в диагностике карликовости и прогнозе конечного роста. Для дефицита СТГ характерно значительное отставание костного возраста от паспортного (более 2 лет).
Для определения костного возраста используют методы Гролиха и Пайла или Таннера и Уайтхауса. Наиболее популярен первый метод, основанный на сравнительной оценке рентгенограмм лучезапястного сустава со стандартами Radiographic Atlas of Skeletal Development of the Hand and Wrist (Greulich W.W., Pyle S.I., 2nd Ed., Stanford University Press, 1959). Показатели скорости роста и костного возраста являются одним из дифференциально-диагностических признаков гипофизарной карликовости и конституциональной задержки роста и полового развития.
Рентгенография черепа. Рентгенологическое исследование черепа проводят для оценки формы и размеров турецкого седла и состояния костей черепа. При дефиците СТГ турецкое седло нередко малых размеров. При краниофарингиоме наблюдаются характерные изменения турецкого седла: истончение и порозность стенок, расширение входа, супраселлярные или интраселлярные очаги обызвествления. При повышенном внутричерепном давлении видно усиление пальцевых вдавлений, расхождение черепных швов.
КТ и МРТ головного мозга. Морфологические и структурные изменения при дефиците СТГ включают гипоплазию гипофиза, разрыв или истончение гипофизарной ножки, эктопию нейрогипофиза, пустое турецкое седло. КТ и МРТ показаны при подозрении на любую внутричерепную патологию (объемное образование). Целесообразно более широкое, чем ранее, использование МРТ у детей перед началом лечения соматропином с целью исключения объемного образования даже при отсутствии неврологической симптоматики.
Лабораторная диагностика
Однократное измерение СТГ в крови не имеет диагностического значения вследствие импульсного характера секреции СТГ и вероятности получения крайне низких (нулевых) базальных значений даже у здоровых детей. В связи с этим используются другие методы – изучение ритма секреции СТГ, оценка стимулируемой секреции СТГ, измерение уровней ИФР и ИФР-связывающих белков, измерение экскреции СТГ с мочой.
Оценка ритма и интегрированной суточной секреции СТГ. Диагностическим критерием дефицита СТГ считается суточная спонтанная интегрированная секреция гормона менее 3,2 нг/мл. Высокоинформативно также определение интегрированного ночного пула СТГ, который у детей с дефицитом СТГ составляет менее 0,7 нг/мл. Поскольку спонтанную суточную секрецию СТГ можно исследовать только с помощью специальных катетеров, позволяющих получать пробы крови каждые 20 минут в течение 12–24 часов, данный метод в клинической практике широко не используется.
Стимуляционные пробы. Эти пробы основаны на способности разных веществ стимулировать секрецию и выброс СТГ соматотропными клетками. Наиболее распространены пробы с инсулином, клонидином, соматорелином, аргинином, леводопой, пиридостигмином. Любой из перечисленных стимуляторов вызывает значительный выброс СТГ (свыше 10 нг/мл) у 75–90 % здоровых детей. Полный дефицит СТГ диагностируют при его уровне после стимуляции менее 7 нг/мл, частичный дефицит – при уровнях от 7 до 10 нг/мл. Пробу с соматорелином проводят с целью дифференциальной диагностики между первичным гипофизарным и гипоталамическим дефицитом СТГ. Применяются и комбинированные стимуляционные пробы: леводопа + пропранолол, глюкагон + пропранолол, аргинин + инсулин, соматорелин + атенолол; прогестагены + инсулин + аргинин.
Для одновременной оценки нескольких гипофизарных функций удобно проводить комбинированные пробы с разными стимуляторами и разными либеринами: инсулин + протирелин + гонадорелин, соматорелин + протирелин + гонадорелин, соматорелин + кортикорелин + гонадорелин + протирелин. Например, при пробе с соматорелином, протирелином и гонадорелином низкие базальные уровни тиреотропного гормона и свободного тироксина в сочетании с отсутствием или заторможенным выбросом тиреотропного гормона говорят о сопутствующем вторичном гипотиреозе, а отсутствие выброса гонадотропинов в ответ на гонадолиберин в сочетании с низкими базальными уровнями этих гормонов указывает на вторичный гипогонадизм.
Необходимое условие проведения стимуляционных проб – эутиреоз. Сниженная реакция на стимуляцию наблюдается у детей с ожирением. Все пробы проводят натощак, в положении лежа. Обязательно присутствие врача. Противопоказанием для проведения пробы с инсулином является гипогликемия натощак (уровень глюкозы крови менее 3,0 ммоль/л), надпочечниковая недостаточность, а также наличие в анамнезе эпилепсии или текущая терапия противоэпилептическими препаратами. При пробе с клонидином возможны падение артериального давления и выраженная сонливость. Проба с леводопой в 20–25 % случаев может сопровождаться тошнотой и рвотой.
Экскреция СТГ с мочой. Для диагностики дефицита СТГ у детей в последние годы рекомендуется измерение экскреции СТГ с мочой. Преимущества метода состоят в безболезненном взятии материала и возможности неограниченного повтора анализа. Экскреция СТГ с мочой у здоровых детей значительно выше, чем у детей с дефицитом СТГ и идиопатической задержкой роста. Ночная экскреция СТГ с мочой коррелирует с суточной экскрецией, в связи с чем целесообразно исследовать только утреннюю порцию мочи. Вместе с тем данный метод оценки секреции СТГ еще не стал рутинным в клинической практике. Это связано с тем, что концентрации СТГ в моче очень малы (ниже 1 % от уровня СТГ в крови) и для их измерения требуются чувствительные методы, а также с наличием значительного числа интерферирующих факторов, таких как нарушения функции почек.
Измерение ИФР и ИФР-связывающих белков. Уровни ИФР-I и ИФР-II – наиболее значимые показатели в диагностике дефицита СТГ у детей. Дефицит СТГ четко коррелирует со сниженными уровнями ИФР-I и ИФР-II в плазме крови. Высокоинформативным показателем является также уровень ИФР-связывающего белка типа 3 (ИФРСБ-3). Его уровень в крови снижен у детей с дефицитом СТГ.
Диагностика резистентности к СТГ (синдрома Ларона)
Молекулярная основа этого синдрома – генетические дефекты рецепторов СТГ. Клиническая картина при синдроме Ларона близка к таковой при гипофизарной карликовости, но имеет ряд отличий:
- высокую степень задержки роста с рождения;
- костный возраст отстает от паспортного, но опережает костный возраст для роста на момент обследования;
- пубертатный период начинается в относительно нормальные сроки примерно у половины больных;
- возможны пубертатные ускорения роста;
- частые приступы гипогликемии в раннем детстве;
- высокую частоту врожденных пороков развития.
Гормональный статус у детей с синдромом Ларона включает высокий или нормальный базальный уровень СТГ, повышенную реакцию СТГ при стимуляционных пробах, низкие уровни ИФР-I, ИФР-II и ИФРСБ-3. Для диагностики синдрома Ларона используют стимуляционную пробу для оценки секреции ИФР-I. Эта проба заключается во введении соматропина в течение 4 дней и определении уровней ИФР-I и ИФРСБ-3 до первой инъекции соматропина и через день после завершения пробы. У детей с синдромом Ларона, в отличие от детей с гипофизарной карликовостью, уровни ИФР-I и ИФРСБ-3 на фоне стимуляции не возрастают. Лечение больных с синдромом Ларона соматропином неэффективно, для этих целей предлагается использовать рекомбинантный ИФР-I.
Лечение
Обобщенный алгоритм заместительной гормональной терапии у детей с дефицитом СТГ и других гипофизарных гормонов представлен в табл. 1.
До 1985 г. во всех странах для заместительной терапии дефицита СТГ использовались препараты этого гормона, полученные путем экстракции из гипофизов трупов людей. С 1985 г., после регистрации в ряде стран (США, Франция, Великобритания) случаев болезни Крейтцфельда-Якоба, использование таких препаратов было официально запрещено.
С этого момента для лечения детей с дефицитом СТГ используются исключительно генно-инженерный СТГ – соматропин. В настоящее время в России прошли клинические испытания и разрешены к использованию следующие препараты соматропина: Генотропин, Нордитропин Симплекс, Сайзен и Хуматроп.
Дозы и режимы введения соматропина
При лечении гипофизарной карликовости у детей существует четкая связь “доза – ростостимулирующий эффект”, особенно выраженная в первый год лечения. Рекомендуемая стандартная доза соматропина при лечении классического дефицита СТГ составляет 0,1 МЕ/кг/сут (0,033 мг/кг/сут) подкожно, ежедневно в 20.00–22.00. Места введения: плечи, бедра, передняя брюшная стенка. Кратность введения составляет 6–7 инъекций в неделю. Считается, что данный режим примерно на 25 % эффективнее, чем 3 внутримышечные инъекции в неделю.
Показания и противопоказания
Показанием для назначения соматропина считается подтвержденный лабораторными и инструментальными диагностическими методами дефицит СТГ гипофизарного или гипоталамо-гипофизарного генеза. Лечение продолжают до закрытия зон роста или до достижения социально приемлемого роста.
Соматропин не назначают при закрытых зонах роста, злокачественных новообразованиях, прогрессирующем увеличении внутричерепных опухолей. Относительным противопоказанием является сахарный диабет. До начала лечения внутричерепные повреждения должны быть устранены, а противоопухолевая терапия завершена.
Эффективность лечения соматропином
Скорость роста в начале пубертатного периода определяет конечный рост пациента. Поэтому лечение соматропином должно быть направлено на нормализацию роста к началу пубертата. Для достижения расчетного окончательного роста необходимы раннее выявление и раннее начало лечения дефицита СТГ.
Эффективность лечения соматропином зависит не только от дозы и режима его введения, но и от статуса больного до начала терапии. Клинические данные свидетельствуют о том, что в целом эффективность лечения выше у детей младшего возраста, с меньшей скоростью роста до лечения, с большей задержкой роста и костного созревания, с большим дефицитом СТГ.
Лечение соматропином обычно прекращают при достижении скорости роста менее 2 см/год или при костном возрасте более 14 лет у девочек и более 16–17 лет у мальчиков.
Критерием эффективности терапии является увеличение скорости роста в несколько раз от исходной. Максимальная скорость роста – от 8 до 15 см/г – отмечается в первый год лечения, особенно в первые 3–6 месяцев. На втором году лечения скорость снижается до 5–6 см/г. Показатели скорости роста на втором и третьем годах терапии достоверно не различаются.
Опыт детской клиники Эндокринологического научного центра РАМН по лечению детей с гипофизарной карликовостью разными генно-инженерными препаратами СТГ [1, 2] и огромный опыт зарубежных эндокринологов [3–6] свидетельствуют о высокой эффективности заместительной терапии соматропином. При рано начатом и регулярном лечении удается достичь прогнозируемого роста. Детям с пангипопитуитаризмом помимо лечения соматропином необходима сопутствующая заместительная терапия другими гормонами по показаниям (см. табл. 1).
Известно, что окончательный рост у детей с сочетанным дефицитом СТГ и гонадотропинов больше, чем у детей с изолированным дефицитом СТГ. Это объясняется задержкой полового созревания и, как следствие, замедлением закрытия эпифизарных зон роста при вторичном гипогонадизме. Поэтому спонтанное или индуцированное половыми гормонами пубертатное развитие и связанное с ним ускоренное созревание костей расценивается многими авторами как фактор, снижающий эффективность соматропина и уменьшающий окончательный рост. В связи с этим оправдано искусственное притормаживание полового созревания у детей с изолированным дефицитом СТГ путем комбинированного применения в начале пубертатного периода соматропина и длительно действующих аналогов гонадолиберина. Исходя из тех же соображений, у детей с множественным дефицитом гормонов гипофиза при поздно начатом лечении соматропином половое созревание стимулируют как можно позже, по возможности после достижения прогнозируемого роста.
Помимо увеличения линейного роста, в процессе терапии соматропином отмечаются положительные сдвиги в гормональном, метаболическом, психическом статусе больных. Анаболический, липолитический и контринсулярный эффекты соматропина проявляются увеличением мышечной силы, улучшением почечного кровотока, повышением сердечного выброса, увеличением всасываемости кальция в кишечнике и минерализации костей. В крови снижаются уровни липопротеидов низкой плотности, увеличиваются в пределах нормы уровни щелочной фосфатазы, фосфора, мочевины, свободных жирных кислот. Повышается жизненный тонус пациентов, значительно улучшается качество их жизни. Дети охотно принимают лечение, многие делают инъекции самостоятельно.
Рекомендации по наблюдению за детьми, получающими лечение соматропином, представлены в табл. 2.
Побочные эффекты соматропина
Риск новообразований
В начале использования соматропина высказывались предположения о повышении риска рецидивов у детей, ранее леченых по поводу злокачественных новообразований (лейкозов и опухолей мозга). Однако до настоящего времени нет никаких данных о том, что лечение соматропином повышает риск рецидивов у детей с опухолями мозга. Рецидивы на фоне терапии соматропином после лечения лейкозов всегда ассоциированы с другими показателями плохого прогноза. Также отсутствуют доказательства, что лечение соматропином повышает риск лейкоза у детей с идиопатическим дефицитом СТГ при отсутствии других дополнительных факторов риска. Дети с дефицитом СТГ, обусловленным органической патологией (объемные процессы мозга), должны тщательно обследоваться на предмет ее прогрессирования или рецидива. Дети после вмешательств по поводу опухолей мозга, получающие соматропин, должны наблюдаться онкологом и нейрохирургом.
Иммунологические нарушения
Ранее при использовании гипофизарных и метионил-содержащих препаратов СТГ у 30–40 % детей с гипофизарной карликовостью образовывались антитела к СТГ. В связи с этим одним из осложнений лечения дефицита СТГ было снижение скорости роста у детей с высоким уровнем антител к СТГ. Использование генно-инженерных препаратов последнего поколения приводит к образованию антител к СТГ лишь в единичных случаях.
Влияние на углеводный обмен
Лечение детей с дефицитом СТГ соматропином не повышает риск сахарного диабета. Тем не менее при длительном лечении рекомендуется периодически контролировать состояние углеводного обмена (см. табл. 2). При продолжительном применении больших доз соматропина у детей без классического дефицита СТГ и с сопутствующим сахарным диабетом возможно усугубление течения последнего. Имеются сообщения о том, что лечение соматропином нормализует уровни глюкозы натощак у детей, склонных к гипогликемии.
Влияние на гормональный статус
Лечение соматропином может провоцировать клиническое проявление скрытого гипотиреоза. На фоне длительного лечения препаратом возможно развитие субклинического или тяжелого гипотиреоза. В связи с этим необходим контроль функционального состояния щитовидной железы.
Выраженные побочные эффекты
При лечении соматропином очень редки. Они включают доброкачественную внутричерепную гипертензию, препубертатную гинекомастию, артралгию, задержку жидкости. Для их выявления достаточны тщательно собранный анамнез и внимательный осмотр. Для устранения побочных эффектов может потребоваться временное снижение дозы либо временная отмена соматропина.
Благодаря практически неограниченным возможностям получения соматропина показания к его применению значительно расширились и в настоящее время не ограничиваются только рамками лечения гипофизарной карликовости. Имеются данные об эффективности соматропина при лечении детей с внутриутробной задержкой роста, семейной низкорослостью, синдромами Шерешевского-Тернера, Рассела-Сильвера, Прадера-Вилли, Нунан, анемией Фанкони, гипофизарным синдромом Кушинга, гликогенозами, хондродисплазией, состоянием после облучения по поводу лейкозов и опухолей мозга, после трансплантации почки, с хронической почечной недостаточностью.
- Дедов И.И., Тюльпаков А.Н., Петеркова В.А. Соматотропная недостаточность. М., 1998. 302 с.
- Фофанова О.В., Волеводз Н.Н., Безлепкина О.Б. Проект национального консенсуса по диагностике и лечению соматотропной недостаточности у детей. Материалы конференции по детской эндокринологии. Москва, 27-28 ноября 2003.
- Consensus guidelines for the diagnosis and treatment of Growth Hormone Deficiency in childhood and adolescence: summary statement of the GH Research Society. GH Research Society. J Clin Endocrinol Metab 2000;85(11):3990-93.
- AACE Medical Guidelines for Clinical Practice: For Growth Hormone Use in Adults and Children — 2003 Update. Endocr Pract 2003;9:65-76.
- Saggese G, Ranke MB, Saenger P, Rosenfeld RG, Tanaka T, Chaussain JL, Savage MO. Diagnosis and treatment of growth hormone deficiency in children and adolescents: towards a consensus. Ten years after the availability of recombinant human growth hormone. Workshop held in Pisa, Italy, 27-28 March 1998. Horm Res 1998;50:320-40.
- Fidotti E. A history of growth hormone injections devices. J Pediatr Endocrinol Metab 2001;14: 497-501.
А.С. Луценко*, Е.В. Нагаева, Ж.Е. Белая,
О.С. Чухачева, Т.С. Зенкова, Г.А. Мельниченко
Национальный медицинский исследовательский
центр эндокринологии
Введение
Дети с установленным дефицитом гормона роста получают заместительную терапию рекомбинатным гормоном роста до совершеннолетия и достижения генетически прогнозируемого конечного роста.
Несмотря на то, что основной спектр физиологических эффектов соматотропный гормон (СТГ) оказывает на организм в детском возрасте, а в последующем его выработка снижается, СТГ играет важную роль в нормальном функционировании органов и систем взрослого человека. В настоящее время в России разработана система оказания медицинской помощи детям с дефицитом гормона роста [1, 2], однако отсутствуют клинические рекомендации, посвященные диагностике и заместительной терапии СТГ-дефицита взрослых.
Первые исследования, посвященные лечению СТГ-дефицита у взрослых пациентов с гипопитуитаризмом, были опубликованы в 1989 г. [3, 4]. В Российской Федерации первый опыт применения человеческого гормона роста у взрослых пациентов с СТГ-дефицитом был опубликован в 2004 г. [5]. Клинические проявления заболевания у взрослых пациентов неспецифичны и в случаях приобретенного СТГ-дефицита часто маскируются проявлениями недостаточностей других тропных гормонов гипофиза, что затрудняет диагностику.
Целью данного обзора является обобщение современных данных по диагностике, лечению и системному влиянию заместительной терапии соматропином у взрослых пациентов с СТГ-дефицитом.
Клинические проявления
Дефицит СТГ у взрослых характеризуется системными изменениями метаболизма при неспецифичных клинических проявлениях [6].
- Состав тела. Увеличение массы жировой ткани, преимущественно за счет висцерального жира, уменьшение тощей массы [7–9], снижение объема внеклеточной жидкости и общей концентрации натрия [10].
- Физическая активность. Снижение толерантности к физическим нагрузкам, уменьшение мышечной силы на фоне уменьшения количества мышечной ткани [11]. Нарушение терморегуляции [12].
- Сердечно-сосудистая система, липидный обмен и система свертывания крови. Увеличение сердечно-сосудистого риска за счет дислипидемии, нарушений углеводного обмена и ускоренного развития атеросклероза. Уменьшение массы миокарда, нарушение проводимости, сократимости и ударного объема, снижение нагнетательной функции и фракции выброса, диастолическая дисфункция [13]. Дислипидемия вследствие повышения концентрации общего холестерина, холестерина ЛПНП и триглицеридов [14]. Повышение активности фибриногена и ингибитора активаторов плазминогена 1-го типа (PAI-1) [15].
- Углеводный обмен. Нарушение толерантности к глюкозе, инсулинорезистентность [16].
- Костная система. Уменьшение костной массы и минеральной плотности кости (МПК), повышение риска переломов [17–19].
- Качество жизни и когнитивные функции. Снижение качества жизни: дезадаптация, сниженная самооценка, тревожность, апатия, депрессия, социальная изоляция [20].
Диагностика
Диагностика СТГ-дефицита взрослых сложна по ряду причин. Клинические проявления данного заболевания неспецифичны и потому имеют невысокую диагностическую ценность [21]. В физиологических условиях секреция СТГ имеет импульсный характер, на нее влияют возраст, пол и индекс массы тела, в связи с чем определение базальной концентрации СТГ не имеет диагностического значения [22].
Нормальные показатели ИРФ-1 сыворотки крови не исключают диагноз СТГ-дефицита. ИРФ-1, ИРФ-связывающий белок 3 (ИРФСБ-3) имеют ориентировочное значение для диагностики, поскольку показатели у пациентов с СТГ-дефицитом и здоровых людей могут частично совпадать [23].
В настоящее время общепринятым методом диагностики СТГ-дефицита взрослых являются стимуляционные пробы [22, 24], протоколы которых представлены в табл. 1.
Зарубежные клинические руководства рекомендуют проводить пробы только тем пациентам, у козаместительная гормональная терапия соматотропином будет способствовать улучшению метаболических параметров и качества жизни. Проведения провокационных проб не требуется при наличии одного из двух условий:
1. Наличие трех из четырех составляющих:
– значительный дефицит роста (<-3 SDS);
– как минимум одна дополнительная тропная недостаточность;
– низкая концентрация ИФР-1 в крови;
– врожденный дефект гипоталамо-гипофизарной области по данным МРТ: «триада» (гипоплазия аденогипофиза, эктопия нейрогипофиза, аплазия/гипоплазия ножки гипофиза);
или
– оперативное лечение опухоли гипоталамо-гипофизарной области в анамнезе;
или
– облучение области «голова–шея» в анамнезе.
2. Мутации генов, ассоциированных с развитием гипопитуитаризма: GH1, GHRHR, HESX1, LHX3, PROP1, POU1F1 [PIT1] и др. [22, 24, 25].
В табл. 2 представлены используемые в мире пороговые значения диагностических проб для диагностики СТГ дефицита у взрослых.
Проба с инсулиновой гипогликемией Стимуляция секреции СТГ при гипогликемии была впервые описана в 1963 г. [26]. Данная проба считается «золотым стандартом» в диагностике СТГ-дефицита взрослых [22, 24], однако у нее имеется ряд недостатков. Требуется тщательное медицинское наблюдение для мониторинга потенциальных нежелательных явлений (судорожных приступов или потери сознания вследствие гипогликемии). Кроме того, в связи с наличием инсулинорезистентности у пациентов с ожирением, у данной категории может понадобиться использование более высоких доз инсулина (0,15–0,20 ЕД/кг массы тела), что увеличивает риск отсроченной гипогликемии [27]. Проба с инсулиновой гипогликемией противопоказана пожилым пациентам, лицам с высоким сердечно-сосудистым риском и эпилепсией. И хотя чувствительность пробы высока, отмечаются ограничения в ее воспроизводимости. Кроме того, вариабельность пиков секреции СТГ отмечалась у здоровых добровольцев в зависимости от времени проведения и в разные фазы менструального цикла [22].
В настоящее время в качестве диагностического значения стимулированной секреции СТГ при гипогликемии используется диапазон 3,0–5,0 нг/мл [22, 24].
Согласно зарубежным рекомендациям, при противопоказаниях к пробе с инсулиновой гипогликемией возможно проведение комбинированной пробы со стимуляцией соматолиберином и аргинином, однако, применение аргинина для диагностики СТГ-дефицита в РФ не зарегистрировано.
Проба с соматолиберином и аргинином
Проба с соматолиберином и аргинином, как и проба с инсулиновой гипогликемией, считается достаточно чувствительной и специфичной для диагностики СТГ-дефицита [28, 29], однако в настоящее время на фармацевтическом рынке отсутствует препарат соматолиберина.
Точность данной пробы определяется совместным применением двух стимулирующих веществ: соматолиберин стимулирует синтез и высвобождение СТГ гипофизом [30], а аргинин усиливает этот эффект путем подавления высвобождения соматостатина [31]. Концентрация СТГ на фоне стимуляции не зависит от пола и возраста, однако, результат зависит от ИМТ, в связи с чем используются три пороговых значения (табл. 3).
В связи с тем, что в ходе данной пробы стимулируется и гипофиз, и гипоталамус, при гипоталамическом генезе заболевания (например, после лучевой терапии) возможны ложноположительные результаты [32].
Проба с глюкагоном
В связи с тем, что основная альтернативная проба для диагностики недоступна, активно изучается возможность применения пробы с глюкагоном при противопоказаниях к пробе с инсулиновой гипогликемией.
Глюкагон – сильный стимулятор секреции СТГ, однако, механизм стимуляции остается неясным.
Стимулирующий эффект более выражен при внутримышечном или подкожном введении по сравнению с внутривенным [33].
Достоинства пробы с глюкагоном – воспроизводимость и безопасность, на ее результаты не влияет пол и гипоталамический генез СТГ-дефицита. Недостатки – длительность пробы (3–4 ч) и необходимость внутримышечного введения глюкагона. Побочные эффекты пробы более выражены у пожилых пациентов: гипотония, гипогликемии и приступы эпилепсии [34]. Кроме того, имеется риск отсроченных гипогликемий, в связи с чем данная проба не вошла в рутинную клиническую практику.
В двух исследованиях сравнивались диагностические возможности пробы с глюкагоном и пробы с инсулиновой гипогликемией, группы пациентов и контроль были сопоставлены по полу и возрасту [35, 36]. В исследовании J. Gómez и соавт. группы пациентов были также сопоставлены по ИМТ, в данном исследовании выявлена обратная корреляция возраста и ИМТ с пиковыми концентрациями СТГ у здоровых добровольцев.
Изначально пороговым значением концентрации СТГ принималось 3,0 нг/мл. В дальнейших исследованиях выявлено, что использование такого значения приводит к гипердиагностике СТГ-дефицита [37]. Принимая это во внимание, рекомендации Американской ассоциации эндокринологов предлагают использовать пороговое значение 1,0 нг/мл для пациентов с ИМТ более 25 кг/м2. Авторы также отмечают, что для уточнения диагностической точности сниженного порогового значения необходимо проведение больших проспективных исследований среди пациентов с различным ИМТ и нарушениями углеводного обмена [22].
Секретагоги гормона роста
К данному классу относятся молекулы, проявляющие сильный дозозависимый и специфичный стимуляционный эффект на соматотрофы [38]. Они связываются с рецептором СТГ секретагога-1а (growth hormone secretagogue receptor 1a, GHS-R1a) в гипоталамусе и гипофизе. Естественным лигандом данного рецептора является грелин [39]. Другие агонисты его рецептора являются аналогами грелина: GHRP-2 (GH-releasing peptide-2, СТГ-рилизинг пептид-2), GHRP-6, гексарелин, все данные вещества вводятся парентерально. Также существуют аналоги грелина для перорального введения.
Достоинство секретагогов СТГ – возможность перорального приема [40]. Они устойчивы к протеолизу, так как многие представители являются небелковыми молекулами либо содержат D-изомеры аминокислот [41]. Недостаток – возможность получения ложноположительных результатов при гипоталамическом генезе СТГ-дефицита [42].
Проводились исследования, оценивающие диагностическую ценность проб с GHRP-6, GHRP-2 и комбинаций соматолиберина с гексарелином, пиридостигмином, аципимоксом, GHRP-6 в сравнении с пробой с инсулиновой гипогликемией [43–48].
В исследованиях теста с соматолиберином и GHRP-6 для диагностики СТГ-дефицита взрослых отмечена хорошая переносимость пробы (единственный побочный эффект – «приливы»), высокая чувствительность и воспроизводимость. GHRP-6 назначается внутривенно, пик ответа СТГ развивается на 15–30-й минуте – значительно раньше, чем при использовании других фармакологических стимуляторов. Пороговое значение для нормального ответа 20 нг/мл, для СТГ-дефицита 10 нг/мл [49, 50]. На результаты данного теста не влияют возраст, пол или избыточная масса тела, за исключением случаев, когда ИМТ превышает 35 кг/м2, – пороговое значение снижается до 5 нг/мл [51].
Пробу с GHRP-2 с 2006 г. используют в Японии, так как она безопасна и удобна, в качестве порогового значения используется концентрация СТГ 9 нг/мл.
Пиковой концентрации СТГ после стимуляции достигает на 60-й минуте [52].
В исследовании, где в качестве стимулирующего агента использовался ацетилированный грелин, наиболее диагностически значимыми значениями концентрации СТГ для диагностики были 7,3 нг/мл при нормальной массе тела, 2,9 нг/мл при избыточной массе тела и 0,6 нг/мл при ожирении, диагностическая точность составила 89,3, 94,1 и 62,5% соответственно. Авторы делают вывод, что ожирение значительно снижает ответ СТГ на стимуляцию грелином, однако данная проба является надежным инструментом в диагностике у пациентов с нормальной и избыточной массой тела [53].
В настоящее время применение вышеуказанных методов в Российской Федерации невозможно, так как на рынке отсутствуют препараты соматолиберина и секретагогов СТГ.
Пероральный секретагог СТГ
В 2017 г. Food and Drugs Administration (FDA) одобрило применение мациморелина для диагностики СТГ-дефицита у взрослых [54].
Мациморелин – агонист GHS-R1a с высокой стабильностью, которая позволяет назначать его перорально. В исследовании I фазы у 36 здоровых добровольцев при пероральном приеме мациморелина отмечалось быстрое дозозависимое повышение концентрации препарата в плазме, пик концентрации достигался на 50–75-й минуте после приема. Дозозависимая стимуляция секреции СТГ соотносилась по времени с максимальной концентрацией препарата в плазме, повышение концентрации СТГ длилось около 120 мин после перорального приема или интрадуоденального введения. Препарат хорошо переносился, нежелательных явлений не выявлено [55].
В многоцентровом открытом исследовании сравнивали диагностическую ценность и безопасность мациморелина в сравнении с пробой соматолиберин + аргинин, среди взрослых пациентов с СТГ-дефицитом и здоровых добровольцев. Согласно ROC-анализу, оптимальная пороговая концентрация СТГ составила 2,7 нг/мл: чувствительность 82%, специфичность 92%, доля ошибок в распознавании 13%. Среди пациентов, которым назначали оба диагностических теста, диагностическая ценность методов была сопоставима.
Пиковые концентрации СТГ обратно коррелировали с ИМТ в контрольной группе. При единственном заборе крови через 45 мин после приема мациморелина, при использовании пороговых значений, согласно ИМТ (6,8 нг/мл при ИМТ <30 кг/м2, 2,7 нг/мл при ИМТ ≥30 кг/м2) чувствительность пробы составила 90%, специфичность – 85%, доля ошибок в распознавании – 12,2% [56].
В 2018 г. опубликованы результаты многоцентрового, открытого, рандомизированного, двойного перекрестного исследования, целью которого было установить эффективность и безопасность применения однократного приема мациморелина в дозе 0,5 мг/кг для диагностики СТГ-дефицита взрослых, по сравнению с пробой с инсулиновой гипогликемией.
Пациенты были поделены на три группы согласно вероятности наличия заболевания: высокой (n=38), средней (n=37) и низкой (n=39), также подобрана группа здоровых добровольцев (n=25).
При использовании в качестве «точки отсечения» значения концентрации СТГ 2,8 нг/мл для мациморелина и 5,1 нг/мл для пробы с инсулиновой гипогликемией, отрицательная согласованность составила 95,38% (95% ДИ 87–99%), положительная согласованность – 74,32% (95% ДИ 63–84%), чувствительность 87%, специфичность 96%. Воспроизводимость пробы с мациморелином составила 97% (n=33). В ходе вторичного анализа выявлено, что использование отрезной точки 5,1 нг/мл позволяет достигнуть отрицательной согласованности 94% (95% ДИ 85–98%), положительной согласованности 82% (95% ДИ 72–90%), чувствительности 92% и специфичности 96% [57].
В настоящее время не опубликовано результатов по безопасности и диагностической ценности данного теста у пациентов с морбидным ожирением. К наиболее частым побочным эффектам относятся искаляемость и нарушения работы желудочно-кишечного тракта (тошнота, голод и диарея). Следует избегать назначения совместно с препаратами, удлиняющими интервал QT, так как это может привести к развитию желудочковой тахикардии. CYP3A4 – основной фермент, метаболизирующий мациморелин, поэтому при применении совместно с препаратами, активирующими его, возможно получение ложноположительных результатов [54].
Стандартизация наборов для определения СТГ Результаты стимулирующих проб трактуются согласно пороговым значениям концентраций, в связи с чем точность лабораторного определения СТГ крайне важна.
Циркулирующий СТГ представлен различными изоформами и изомерами: в наибольшей доле присутствует вариант массой 22 кДа, также присутствуют молекулы меньшей массы. Моноклональные антитела способны специфично связываться с изоформами массой 22 кДа, но будут пропускать другие изоформы. Молекулы сходного с СТГ строения (плацентарный СТГ, пролактин), а также СТГ-связывающий белок (с которым связано около 50% циркулирующего СТГ) могут вступать в перекрестные реакции и влиять на точность измерения. Также существуют различия и несогласованность в калибровках, что ограничивает возможности сравнения пороговых значений в разных исследованиях. Кроме того, лаборатории могут использовать разные единицы измерения концентрации либо активности СТГ [58].
Для борьбы с данными ограничениями в настоящее время предложен единый калибровочный стандарт для СТГ – 98/574. Все производители наборов должны уточнять определяемые изоформы, специфичность используемых антител и наличие перекрестных реакций с СТГ-связывающим белком [59].
Протеомные биомаркеры СТГ-дефицита
На момент подачи статьи публикации по протеомным биомаркерам СТГ-дефицита взрослых отсутствовали. В 2018 г. опубликованы результаты исследования, в котором методом протеомного анализа нового поколения SWATH-MS исследовались циркулирующие белки у детей с СТГ-дефицитом в сравнении со здоровыми добровольцами. Обнаружено три белка, которые могут являться биомаркерами для неинвазивной диагностики СТГ-дефицита у детей: аполипопротеин A-IV, CFHR4 (complement factor H-related protein 4) и PBP (platelet basic protein) [60]. Вопрос исследования данных белков при СТГ-дефиците у взрослых остается открытым.
Полиморфизмы рецептора гормона роста У человека ген рецептора гормона роста (r-СТГ) расположен на 5-й хромосоме. Ген состоит из девяти экзонов, кодирующих рецептор, и нескольких дополнительных экзонов в 5’ нетранслируемой области. Известны две основные изоформы r-СТГ, отличающиеся наличием (fl-GHR, full-length), либо отсутствием экзона 3 (d3-GHR, exon 3-deficient). Отсутствие экзона 3 приводит к потере 22 аминокислот во внеклеточном домене рецептора [61]. В настоящее время считается, что связывающая способность обеих изоформ одинакова. Изоформа d3 доминирует над fl, около 50% европейцев гетероили гомозиготны по d3 [62]. Носительство d3 ассоциировано с высоким ростом, более высокой чувствительностью к СТГ и является фактором долгожительства у мужчин [63].
У пациентов с генотипом fl/fl отмечался более выраженный ответ на введение соматропина после лечения в течение 1 нед, по сравнению с пациентами с аллелями d3 [64]. В другом исследовании с длительностью лечения 12 мес, повышение ИРФ-1 в ответ на терапию было достоверно большим в группе d3/d3. Различий по концентрации ИРФ-1 между группами fl/d3 и fl/fl не выявлено [65]. По данным S. Meyer и соавт., не выявлено достоверных различий концентрации ИРФ-1 на фоне терапии между носителями одного или двух аллелей d3 и генотипа fl/fl [66]. У взрослых пациентов с СТГ-дефицитом с аллелями d3 снижен риск переломов позвонков независимо от получения заместительной терапии СТГ [67].
Также опубликованы исследования, в которых между генотипами не обнаруживалось различий по клиническим проявлениям и нежелательным явлениям, качеству жизни, концентрациям ИРФ-1, составу тела и жировой массе [68–71].
Проведено два исследования, в которых оценивали влияние полиморфизмов r-СТГ на различные показатели на фоне заместительной терапии СТГ спустя 1 год и после 5 лет лечения. В исследовании Van der А. Klaauw и соавт. после первого года лечения в группе носителей d3 отмечалось более выраженное повышение ИФР-1 при одинаковых средних дозах соматотропина в группах. Среди носителей d3 общий холестерин снижался менее выраженно, а концентрация холестерина ЛПВП достигала более высоких значений по сравнению с fl/fl. Однако, через 5 лет данных различий между группами обнаружено не было [72]. По данным С. Giavoli и соавт., лечение соматропином нормализует концентрацию ИРФ-1 и снижает процентную долю жировой массы после 1 года и после 5 лет лечения, независимо от присутствия аллеля d3. После одного года лечения в группах носителей d3 отмечалось повышение концентрации холестерина ЛПВП, после пяти лет – снижение концентрации общего холестерина и холестерина ЛПНП.
При исходно одинаковой распространенности нарушений углеводного обмена через 5 лет после лечения в группе fl/fl она снизилась, а в группах носителей d3 двукратно увеличилась [73].
В настоящее время данные по влиянию полиморфизма r-СТГ на клиническую картину СТГ-дефицита взрослых малочисленны, а имеющиеся публикации по взаимоотношениям носительства аллели d3 и ответа на заместительную терапию противоречивы.
Лечение
Определение показаний к заместительной терапии Целесообразность заместительной терапии СТГ-дефицита взрослых определяется предполагаемой пользой для каждого конкретного пациента. С наибольшей вероятностью пользу от лечения будут получать пациенты с выраженным СТГ-дефицитом, подтвержденным с помощью стимуляционных проб и низкой сывороточной концентрацией ИРФ-1. Клиническими проявлениями, указывающими на необходимость лечения, являются остеопения, повышенный сердечно-сосудистый риск, а также сниженное качество жизни, которое необходимо подтвердить валидизированными опросниками для данного заболевания [74].
Важной категорией являются пациенты, достигшие целевого роста на фоне заместительной терапии и переходящие под наблюдение взрослого эндокринолога. У таких пациентов полное созревание костной и мышечной систем может продолжаться в течение последующих 10 лет [75–77]. На фоне отмены соматропина после достижения целевого роста отмечалось ухудшение показателей липидного обмена, состава тела и качества жизни [76, 78, 79]. После достижения конечного роста необходимо проводить редиагностику СТГ-дефицита, через 1–3 мес после
перерыва в лечении соматропином (табл. 4).
Негативные клинические проявления СТГ-дефицита и положительное действие заместительной терапии соматотропином распространяется и на пациентов старше 65 лет [80]. Несмотря на известный факт снижения секреции СТГ с возрастом, диагностические пробы позволяют разграничить физиологическое снижение от патологического, обусловленного СТГ-дефицитом [81].
Таким образом, к пожилым пациентам применяются те же критерии, что и к другим возрастным категориям. Однако, для таких пациентов необходимо выбирать более низкую стартовую дозировку, о чем подробнее будет написано ниже.
Начало лечения и подбор дозировок
Лечение СТГ-дефицита у взрослых рекомендуется начинать с низких доз (0,2-0,4 мг/сут подкожно), это позволяет снизить вероятность развития побочных эффектов [82]. Титровать дозу рекомендуется с интервалом 6–8 нед, в зависимости от клинического ответа и концентрации ИРФ-1, которую рекомендуется поддерживать в верхней половине референсного диапазона. У пациентов моложе 30 лет рекомендуется выбирать большую стартовую дозу (0,4–0,5 мг/сут), а у пожилых (старше 60 лет) – меньшую (0,1–0,2 мг/сут), чтобы минимизировать риск развития побочных эффектов, поскольку с возрастом отмечается физиологическое снижение потребности в соматотропине. Женщинам, получающим заместительную терапию пероральными эстроген-содержащими препаратами, требуется бо́льшая доза соматропина, поскольку пероральные препараты ингибируют синтез и секрецию ИРФ-1 печенью [83]. При применении трансдермальных форм эстрогенов коррекции доз соматотропина, как правило, не требуется.
После подбора стабильной дозировки анализ крови на ИРФ-1 и оценку на предмет побочных эффектов рекомендуется проводить каждые 6 мес, анализ липидного профиля и глюкозы плазмы натощак – каждые 12 мес или сразу после повышения дозы соматотропина. Физикальное обследование с измерением АД, веса, окружности талии и ИМТ рекомендуется проводить ежегодно и на каждом визите. Если по данным впервые проведенной рентгеновской денситометрии выявлено снижение МПК, повторное исследование проводится 1 раз в 2 года. Также для оценки качества жизни рекомендуется ежегодное заполнение соответствующих опросников.
Максимальная длительность лечения в настоящее время не определена. Однако в случае, если эффекта от лечения нет в течение 1 года, необходимо решить вопрос об отмене соматотропина [24].
Побочные эффекты
Основные побочные эффекты заместительной терапии обусловлены изменением имеющихся при СТГ-дефиците нарушений водно-электролитного обмена либо задержкой жидкости при передозировке препарата: артралгии, скованность суставов, миалгии, парестезии и периферические отеки. Такие побочные эффекты быстро регрессируют при снижении дозы соматотропина.
Поскольку ранее начальная доза подбиралась по массе тела, побочные эффекты встречались чаще, чем при титрации дозы начиная с минимальной.
К очень редким побочным эффектам относятся доброкачественная внутричерепная гипертензия (ДВГ) и макулярный отек. Распространенность ДВГ в популяции детей, получающих терапию соматотропином, приблизительно в 100 раз больше, чем в здоровой популяции [84]. В литературе есть только одно описание ДВГ как побочного эффекта заместительной терапии СТГ-дефицита у взрослого пациента [85]. Описано 2 случая макулярного отека у пациентов без сахарного диабета: у девочки 11 лет, получавшей терапию соматотропином по поводу синдрома Шерешевского–Тернера, и у взрослого пациента 31 года с травматическим повреждением гипоталамо-гипофизарной области. В обоих случаях побочный эффект развился на фоне увеличения дозы соматотропина [86].
Влияние на заместительную терапию других недостаточностей
СТГ ингибирует 11-β-гидроксистероиддегидрогеназу 1-го типа и способствует большему синтезу кортизона и снижению синтеза кортизола. Необходимо внимательное наблюдение за пациентами с надпочечниковой недостаточностью (НН) при начале лечения соматотропином, поскольку возможно развитие клинической картины НН и повышение риска декомпенсации даже при легких инфекционных заболеваниях [87]. Кроме того, у пациентов с субклиническим гипокортицизмом после начала терапии соматропином возможна манифестация клинических проявлений НН.
При назначении соматропина пациентам без вторичного гипотиреоза наблюдается снижение концентрации тироксина сыворотки (Т4), однако концентрация трийодтиронина (Т3) остается стабильной. Пациентам на заместительной терапии Т4 часто требуется увеличение доз. Предполагается, что СТГ может увеличивать периферическую конверсию Т4 в Т3 и при этом подавлять высвобождение ТТГ в гипофизе, однако точный механизм неизвестен [88, 89].
Чувствительность к СТГ снижена у пациенток, получающих пероральные эстрогенсодержащие препараты. Данное явление объясняется феноменом первого прохождения через печень и ингибированием продукции ИРФ-1. На фоне применения трансдермальных форм эстрогенов этот эффект практически отсутствует [90, 91].
Тестостерон стимулирует секрецию СТГ и усиливает его стимулирующее влияние на выработку ИРФ-1. Дигидроэпиандростерон (ДГЭА) потенцирует выработку ИРФ-1 – пациентки на терапии ДГЭА достигают целевых показателей ИРФ-1 на меньших дозах соматотропина. Механизм такого эффекта неизвестен. Поскольку ДГЭА метаболизируется до тестостерона, существует предположение, что именно увеличение концентрации сывороточного тестостерона объясняет этот эффект [92].
Онкологический риск
Согласно эпидемиологическим исследованиям, возможно, существует взаимосвязь между высоконормальной концентрацией СТГ и ИРФ-1 в крови и распространенностью онкологических заболеваний [93]. При акромегалии риск развития некоторых онкологических заболеваний выше, чем в общей популяции [94].
В настоящее время нет данных об увеличении частоты рецидивов вне- и внутричерепных новообразований у взрослых пациентов, получающих соматотропин по поводу СТГ-дефицита. При этом лечение соматотропином противопоказано при наличии ак-тивного онкологического заболевания [24]. В 2017 г. опубликовано исследование D. Olsson и соавт., в которое включены 426 пациентов с гормонально-неактивными аденомами: 207 получали соматотропин (медиана длительности лечения 12,2 г.), 219 не получали лечения соматотропином (медиана наблюдения 8,2 г.). Среди пациентов, получавших заместительную терапию, отмечено снижение общей смертности и не выявлено повышения частоты смертности от онкологических заболеваний [95].
По данным метаанализа, в котором проанализированы данные семи проспективных и двух ретроспективных исследований (n=11 191).
Заместительная терапия соматотропином связана со снижением онкологических рисков при СТГ-дефиците взрослых (относительный риск 0,69; 95% ДИ 0,59–0,82). Снижение риска сохранялось при дополнительных анализах по подгруппам, с исключением ретроспективных исследований, с количеством наблюдений менее 100, исследований среди пациентов с краниофарингиомами и исследований с длительностью наблюдения менее 3 лет [96].
Таким образом, согласно существующим данным, польза от заместительной терапии соматотропином у взрослых превышает теоретический риск новообразований. Скрининг на предмет новообразований у пациентов, получающих заместительную терапию соматотропином, не отличается от общей популяции. При этом стоит пристальнее наблюдать пациентов зрелого возраста, пациентов с онкологическим анамнезом и семейной предрасположенностью, а также группу с пациентов после лучевой терапии [97].
Качество жизни
Качество жизни взрослых пациентов с СТГ-дефицитом оценивается с помощью соответствующих опросников: QoL-AGHDA [98] и PGWB [99].
В 2012 г. опубликован метаанализ A. Hazem и соавт., в который включались данные рандомизированных плацебо-контролируемых исследований – всего 54 исследования (n=3400). Из отобранных исследований качество жизни оценивалось в 16, однако авторы не смогли провести метаанализ по причине гетерогенности данных и недостатка количественных данных. В 11 исследованиях отмечалось достоверное улучшение качества жизни согласно как минимум одному методу оценки [100].
Смертность
В исследовании по данным Голландского государственного регистра по лечению гормоном роста сравнили 2229 пациентов, получающих лечение соматотропином, с первой контрольной группой из 109 пациентов с СТГ-дефицитом, не получающих лечения, и второй контрольной группой из 356 пациентов после отмены соматотропина. Стандартизованный показатель смертности в группе лечения составил 1,27 (1,04–1,56) по отношению к общей популяции. После исключения из анализа пациентов с акромегалией и болезнью Иценко–Кушинга показатель составил 1,29 (1,05–1,59), после исключения пациентов высокого риска (краниофарингиомы или другие образования гипоталамо-гипофизарной области) – 1,00 (0,79–1,26). Также выявлено достоверное повышение стандартизованного показателя смертности среди женщин в группе лечения – 2,52 (1,57–4,06), и оно наблюдалось даже после исключения пациентов высокого риска.
Авторы отмечают, что это может быть связано с длительным течением некомпенсированного СТГ-дефицита, негативно повлиявшего на сердечно-сосудистый риск, однако данное предположение требует дальнейшего изучения [101].
В исследовании R. Gaillard и соавт. среди 13 983 пациентов с СТГ дефицитом, получающих соматропин (средний период наблюдения 4,9 года), отмечено повышение общей смертности на 13% в сравнении с общей популяцией (стандартизованный показатель смертности 1,13 (1,04–1,24)), при этом показатели смертности от сердечно-сосудистых и онкологических заболеваний не отличались [102]. По результатам метаанализа J. Pappachan и соавт., стандартизованный показатель смертности составил 2,40 [95% ДИ 1,46–3,34] у пациентов с СТГ дефицитом без лечения и 1,15 [95% ДИ 1,05–1,24] у пациентов, получающих соматотропин [103]. K. Stochholm и G. Johansson также продемонстрировали более низкую смертность среди получающих соматотропин пациентов по сравнению с пациентами без лечения: отношение рисков по смертности от всех причин 0,34 (95% ДИ 0,15–0,77) [104].
Метаболические эффекты заместительной терапии
Поскольку СТГ является одним из значимых регуляторов метаболизма и энергетического гомеостаза [105], лечение СТГ-дефицита у взрослых пациентов оказывает влияние на состав тела, липидный, углеводный и костно-минеральный обмены, что подтверждается данными метаанализов.
Состав тела. В мета-анализ А. Hazem и соавт. были включены 54 РКИ (n~3400). Лечение соматропином достоверно снижает массу тела (–2,31 кг, 95% ДИ –2,66– –1,96) и жировую массу (–2,56 кг, 95% ДИ –2,97– –1,3) и увеличивает тощую массу тела (1,38 кг, 95% ДИ 1,10–1,65). При этом достоверного влияния на минеральную плотность кости (МПК) выявлено не было, что может быть обусловлено малым количеством наблюдений [100].
В метаанализ C. Newman и соавт., целью которого было сравнить эффективность низких и более высоких доз соматропина в отношении влияния на состав тела и липидный обмен, включены результаты 22 РКИ (n=1153). Тощая масса тела достоверно увеличивалась в группах лечения по сравнению с плацебо, а жировая масса снижалась. Изменения тощей массы тела и жировой массы демонстрировали дозозависимый эффект – лечение более высокими дозами было эффективнее [106].
Сердечно-сосудистая система и липидный обмен. По данным метаанализа P. Maison и P. Chanson, в который были включены 16 исследований, компенсация СТГ-дефицита способствует увеличению массы левого желудочка, толщины межжелудочковой перегородки и задней стенки левого желудочка, увеличению диаметра левого желудочка в диастолу и ударного объема [107].
Известно, что толщина комплекса интима–медиа сонных артерий – предиктор прогрессирования ишемической болезни сердца [108].
Было показано, что лечение СТГ-дефицита приводит к снижению этого показателя [109]. В проведенных исследованиях продемонстрировано снижение общего холестерина сыворотки, практически полностью за счет снижения концентрации холестерина ЛПНП. Эффект более выражен у пациентов с исходно большими показателями общего холестерина, при этом степень снижения не зависит от факторов, связанных с ожирением. Согласно результатам метаанализа, проведенного P. Maison и соавт., лечение СТГ-дефицита приводило к достоверному снижению холестерина ЛПНП, общего холестерина, жировой массы, диастолического давления и увеличению тощей массы тела, концентраций глюкозы плазмы натощак и инсулина сыворотки [110]. В вышеупомянутом мета-анализе С. Newman и соавт. отмечено снижение общего холестерина и холестерина ЛПНП в группах лечения по сравнению с плацебо, но дозозависимого эффекта не выявлено [106]. Метаанализ V. Giagulli и соавт. также обнаружил достоверное снижение концентрации холестерина ЛПНП, однако не выявил достоверного действия на артериальное давление и снижение сердечно-сосудистого риска как при краткосрочной, так и при долгосрочной терапии соматотропином [111]. Среди пациентов, у которых на фоне лечения снижался холестерин ЛПНП, отмечено повышение концентрации сывороточного липопротеина (а), при этом данные остаются противоречивыми из-за различий в наборах по определению липопротеина (а).
Влияние этого явления на сердечно-сосудистый риск также неясно [112].
Углеводный обмен. В раздел метаанализа P. Maison и соавт., в котором анализировались показатели глюкозы и на фоне лечения, были включены данные 13 исследований (n=511): отмечено достоверное влияние заместительной терапии на тощаковые показатели глюкозы – [+0,43 (0,26; 0,60)]. Показатели оставались в пределах референсных значений как в группе лечения [5,1 ммоль/л (±0,5)], так и в группе плацебо [4,8 ммоль/л (±0,4)]. Концентрацию инсулина оценивали в 11 исследованиях (n=378): отмечено влияние заместительной терапии соматотропином на тощаковые показатели концентрации инсулина [+0,42 (0,23; 0,61)]. Средневзвешенное различие концентрации инсулина плазмы между группами лечения и плацебо составило 8,7 пмоль/л (7,0). Авторы заключают, что для надежных выводов по влиянию заместительной терапии соматропином на инсулинорезистентность необходимы исследования с прямым измерением чувствительности к инсулину [110].
В систематическом обзоре K. Stochholm и G. Johansson, опубликованном в 2015 г., оценены результаты 27 исследований – РКИ и открытых. Авторы отмечают, что данные по нарушениям углеводного обмена противоречивы: одни исследования отмечают повышенную встречаемость сахарного диабета (СД) на фоне лечения, по данным других – различий с популяционными данными нет. При этом исследования согласованно заключают, что риск развития СД на фоне заместительной терапии зависит от классических факторов риска, таких как ИМТ и возраст.
Авторы обзора делают вывод, что встречаемость СД среди пациентов на заместительной терапии соматотропином не повышена и зависит, скорее, от классических факторов риска СД [104].
В метаанализе V. Giagulli и соавт. отмечена дискордантность показателей гликемии, однако достоверного изменения показателей гликемии не выявлено. В тех случаях, когда отмечалось повышение гликемии, показатели всегда находились в пределах референсных значений и не достигали диагностических значений в ходе орального теста на толератность к глюкозе. Среди 10 исследований, в которых измерялся гликированный гемоглобин, только в 2 отмечалось его повышение, но и в данных исследованиях показатель никогда не превышал нормальных значений [111].
Костное ремоделирование и минеральная плотность кости. Лечение СТГ-дефицита у взрослых в третьей декаде жизни приводит к увеличению минеральной плотности костей (МПК) и способствует достижению пика костной массы [113]. При родолжении или возобновлении терапии соматотропином в течение 2 лет после закрытия зон роста у пациентов с СТГ-дефицитом, дебютировавшим в детстве, отмечается достоверное повышение МПК по сравнению с контрольной группой без лечения [76].
Прибавка МПК на фоне лечения наблюдается через 18–24 мес после начала лечения, составляет около 4–10%, более заметное увеличение отмечается в позвонках [114]. В проспективном исследовании с 18 пациентами с СТГ-дефицитом, получавшими лечение соматотропином в течение 7 лет, отмечено повышение МПК и сохранение показателей на фоне длительной терапии; однако, достоверного положительного влияния на микроархитектонику кости не выявлено [115]. В когорте из 230 взрослых пациентов с СТГ-дефицитом, получавших терапию соматропином, которых наблюдали в течение 15 лет, отмечено устойчивое повышение МПК в позвонках, более заметное среди мужчин, и стабилизация МПК в шейке бедра. В данном исследовании авторы сделали вывод, что частота переломов на фоне длительной терапии соматропином не увеличивается [116]. Согласно метаанализу P. Xue и соавт., в который вошло 20 исследований, существует достоверная взаимосвязь между лечением СТГ-дефицита и увеличением МПК в позвонках, шейке бедра и по данным total-body денситометрии. При этом корреляции между лечением и МПК в позвонках и totalbody не обнаружено в группах пациентов, получавших лечение фиксированными дозами соматотропина менее 2 лет. Также отмечены взаимосвязи лечения и total-body МПК при измерении на денситометрах Hologic и GE-Lunar.
Авторы заключают, что лечение СТГ-дефицита оказывает положительное влияние на МПК у взрослых, однако в некоторых когортах это влияние неочевидно [117]. В метаанализ M. Barake и соавт. включены данные 31 исследования. Заместительная терапия приводит к повышению МПК в поясничных позвонках и шейке бедра при лечении длительностью более 12 мес. При этом отсутствуют данные по влиянию заместительной терапии на риск переломов. Степень положительного влияния заместительной терапии СТГ-дефицита зависит от пола, возраста, дозы и длительности лечения [118].
Стоит отметить, что в указанных исследованиях не принималось во внимание потребление кальция, витамина D и антирезорбтивных препаратов, в связи с чем сделать однозначный вывод о положительвремени нет опубликованных данных РКИ, в которых бы оценивалось влияние лечения СТГ-дефицита у взрослых на частоту переломов.
Препараты СТГ длительного действия
В настоящее время на российском фармацевтическом рынке доступны препараты СТГ для ежедневного подкожного введения различных фирмпроизводителей, в том числе отечественных.
Депо-препарат LB03002 для еженедельного подкожного введения одобрен для лечения СТГ-дефицита у детей в Южной Корее. Также препарат был одобрен Европейским агентством лекарственных средств (EMA) в 2013 г. [121], однако в настоящее время разрешение отозвано, так как в течение 3 лет после одобрения препарат не поступил в продажу [122].
В настоящее время на разных стадиях исследований находятся препараты СТГ длительного действия: депо-формы, пегилированные препараты, пролекарства, СТГ, нековалентно связанный с альбумином, гибридные белки на основе СТГ [123]. Согласно обзору Общества исследований гормона роста, у каждого из препаратов свой профиль фармакокинетики и фармакодинамики, главными вопросами безопасности являются нефизиологическое повышение СТГ и ИРФ-1 и нефизиологическое тканевое распределение. Согласно данным, имеющимся в настоящее время, препараты длительного действия не вызывают тахифилаксию и проявляют клиническое действие, сравнимое с препаратами для ежедневного введения [124].
Заключение
СТГ-дефицит взрослых – системное полиэтиологическое заболевание, требующие соблюдения четких диагностических критериев для предотвращения гипердиагностики. В настоящее время из представленных провокационных проб в Российской Федерации доступны проба с инсулиновой гипогликемией и проба с глюкагоном, однако пороговые значения СТГ у последней окончательно не отработаны. Проба с глюкагоном представляется перспективной альтернативой пробе с инсулиновой гипогликемией; в настоящее время не опубликовано данных по сравнению данных проб на российской популяции пациентов.
Положительный эффект заместительной терапии соматотропином у взрослых пациентов с СТГ-дефицитом признается в отношении состава тела, физической активности, структуры костной ткани, липидного профиля и качества жизни, но влияние на смертность, риск переломов и сердечно-сосудистые риски остается недостаточно изученным. Существующие исследования ограничены отсутствием плацебо-контроля и малой длительностью наблюдения.
Кроме того, срок воздействия некомпенсированного СТГ-дефицита среди пациентов и, как следствие, его вклад в развитие коморбидностей могут различаться.
Перспективы развития заместительной терапии заключаются в создании препаратов пролонгированного действия, что позволит повысить приверженность пациентов лечению. Имеющиеся данные позволяют рассчитывать на сходный профиль эффективности и безопасности по сравнению с препаратами для ежедневного приема, что необходимо подтвердить в длительных проспективных исследованиях.
Дополнительная информация
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Источники финансирования. Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-15-00398).
Участие авторов: А.С. Луценко, Е.В. Нагаева, Т.С. Зенкова, О.С. Чухачева – сбор и анализ данных литературы, написание основного текста статьи; Ж.Е. Белая, Г.А. Мельниченко – редактирование текста статьи. Все авторы внесли значимый вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Список литературы смотрите здесь.
Источник: Журнал «Проблемы эндокринологии» №5, 2019
Ссылка на оригинал: https://probl-endojournals.ru/probl/article/view/10322/9456

Задержка роста может быть обусловлена мутациями в генах, приобретенными заболеваниями и / или экологическими факторами.
Генетические факторы, влияющие на рост, включают факторы, участвующие в развитии гипофиза (PROP1, POU1F1, HESX1, LHX3 и LHX4), а также в выработке релизинг-гормона гипоталамуса (соматотропин-релизинг гормон (GHRH) или гормона роста (GH), инсулиноподобного фактора роста-1 (IGF-1 ), инсулиноподобного фактора роста-2 (IGF-2), инсулина (INS)) или регулирующие работу их рецепторов (GHRHR, GHSR, GHR, IGF1R, IGF2R и INSR), а также факторы транскрипции, контролирующие передачу сигналов гормона роста. При дефектах в генах, которые регулируют все выше перечисленные процессы, может наблюдаться как изолированный дефицит гормона роста (Isolated Growth Hormone Deficiency, IGHD) или резистентность к гормону роста, так и множественный дефицит других гормонов гипофиза (Multiple Pituitary Hormone Deficiency, MPHD).
Изолированный дефицит гормона роста или изолированный СТГ-дефицит, распространенность которого в мире оценивается от 1:4000 до 1:10000 новорожденных, при этом 5-30% случаев являются врожденными, наиболее часто- результатом мутаций в гене гормона роста (ген GH1) или в гене рецепторе релизинг-гормона роста (ген GHRHR).
Основные клинические признаки врожденного изолированного СТГ-дефицита:
- Низкий рост (ниже 3-го процентиля или -2 SD)
- Низкая скорость роста.
- Внешние признаки: мелкие черты лица, крупный лоб, запавшая переносица, голубоватые склеры
- Особый высокий тембр голоса (писклявый).
- В анамнезе могут быть указания на гипогликемические состояния (быстрая утомляемость, потери сознания и положительный эффект на фоне приема сладкой пищи).
- Равномерный тип распределения жировой клетчатки, она рыхлая; умеренная диффузная пастозность.
- Позднее прорезывание зубов или поздняя смена молочных зубов на постоянные.
Стоит отметить, что характерной особенностью является манифестация после 1 года жизни, а также часто отягощенный семейный анамнез (у братьев или сестер могут быть аналогичные признаки).
Основные диагностические критерии постановки диагноза:
- В крови: низкий уровень ИФР-1, низкий выброс СТГ на СТГ-стимуляционных пробах. Остальные гормоны (пролактин, кортизол, АКТГ, ТТГ, св.Т4, св.Т3) в норме.
- МРТ головного мозга: гипофиз может быть нормальных размеров или гипоплазирован.
- Отставание костного возраста от паспортного более чем на 2 года.
- При проведении молекулярно-генетического исследования возможно обнаружение мутаций в генах.
Врачу следует всегда помнить о том, что задержка роста или замедление динамики роста, могут быть первыми признаками наличия объемного образования головного мозга.
Основным способом лечения изолированного СТГ-дефицита является назначение ростстимулирующей терапии рекомбинантным гормоном роста (рГР), которую ребенок получает ежедневно в вечернее время, до достижения социально приемлемого роста и до закрытия зон роста.