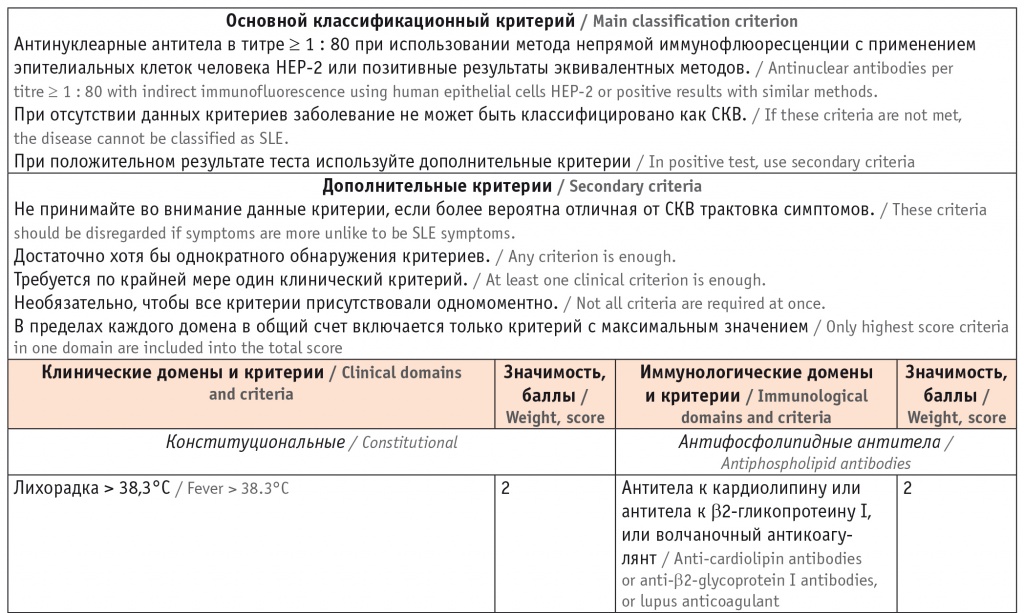
Красная волчанка (КВ) – мультифакториальное аутоиммунное воспалительное заболевание соединительной ткани, характеризующееся гиперпродукцией органонеспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов и имеющее широкий спектр клинических проявлений: артрит, серозит, поражение почек и центральной нервной системы (ЦНС), нерубцовая алопеция, язвы слизистых оболочек [1, 2].
В Российской Федерации, как и во всем мире, с середины 1980-х годов наблюдается рост заболеваемости системной красной волчанкой (СКВ) [3, 4]. Распространенность СКВ составляет от 48 до 250 случаев на 100 тыс. населения, а ежегодная первичная заболеваемость — около 50–70 случаев на 1 млн человек в год [5].
Йозеф Смолен на Третьем международном конгрессе по дискуссионным проблемам ревматологии и аутоиммунитета в Сорренто в 2015 г. назвал СКВ «самым сложным заболеванием в мире» [6].
Дискоидная красная волчанка (ДКВ) — заболевание кожи из группы коллагенозов, обусловленное повышенной чувствительностью к ультрафиолетовому излучению и характеризующееся последовательным развитием эритематозных высыпаний, фолликулярного гиперкератоза и рубцовой атрофии [3].
Системная и кожная форма КВ имеют ряд общих черт: болеют преимущественно женщины молодого и среднего возраста, отмечается сосудистая эритема, фотосенсибилизация. При кожной форме КВ наблюдается изолированное или преимущественное поражение кожи, для СКВ характерна многосиндромность [7].
В основе терапии больных ДКВ лежит использование системных противомалярийных препаратов и глюкокортикостероидов (ГКС) для наружного применения. Основное место в лечении СКВ занимают ГКC, цитостатики и аминохинолиновые препараты.
Клинический случай
Пациентка Н., 24 лет, поступила в клинику ГБУ СО УрНИИДВиИ в ноябре 2018 г. с жалобами на распространенные высыпания на коже лица, верхних конечностей, ушных раковин, в носовой полости, без субъективных ощущений; ноющие боли в суставах.
Считает себя больной с августа 2018 г., когда впервые появились ноющие боли в плечевых, локтевых суставах, мелких суставах кистей, что связывала с работой официантки. С сентября 2018 г. начала постоянно отмечать усталость, слабость, головную боль, головокружение, субфебрильную температуру тела. Больная расценила данные симптомы как вирусное заболевание и самостоятельно принимала противовирусные препараты, парацетамол, амоксициллин 500 мг 2 раза в день в течение 5 дней, без эффекта.
В этот же период появились высыпания: сначала одно пятно диаметром до 2,0 см, без четких границ на подушечке указательного пальца правой руки, затем высыпания стремительно распространились на все пальцы обеих рук, субъективных ощущений не отмечала. Пациентка продолжала связывать данные изменения с работой. Обратилась к дерматологу по месту жительства в начале октября 2018 г. в связи с появлением высыпаний на коже лица. Выставлен диагноз «токсико-аллергический дерматит».
ОАК от 12.10.2018 г.: СОЭ — 31 мм/ч, лейкопения (2,7 × 109/л). УЗИ органов брюшной полости, почек, щитовидной железы от 12.10.2018 г.: патологии не выявлено. Обследована на ВИЧ, гепатиты В и С (28.10.2018 г.) — результаты отрицательные.
Проведено амбулаторное лечение: дипроспан 1,0 в/м, № 1; глюконат кальция по 2 таблетки (1,0) 3 раза в день, панкреатин 25 тыс. ед. 3 раза в день, Магнерот по 2 таблетки (1,0) 3 раза в день, дезлоратадин 5 мг в сутки. Наружно — Цинковая мазь, мазь Белодерм. Эффекта от лечения не наблюдала.
С ноября 2018 г. отметила появление нового пятна на подушечке большого пальца правой стопы. Постепенно стали нарастать боли в суставах, отметила затруднения при самообслуживании (невозможность носить сумки, открывать бутылки), снижение массы тела на 7 кг при хорошем аппетите в течение последних 6 месяцев.
В связи с отсутствием эффекта от амбулаторного лечения, нарастанием симптоматики, прогрессированием заболевания пациентка направлена в клинику УрНИИДВиИ с целью уточнения диагноза и подбора терапии.
Из анамнеза жизни заслуживает внимания: страдает папилломатозом гортани с 2 лет (лечение хирургическое — 11 операций); дермоидная киста правого уха (оперирована в детстве); курит в течение 3 лет по 4 сигареты в день. Наследственность по кожным заболеваниям отягощена: у двоюродного брата псориаз. В течение 3 лет использовала гормональную контрацепцию: Зоэли (номегэстрол + эстрадиол), последние 2 месяца — пластырь Евра.
Объективно: состояние удовлетворительное, сознание ясное, положение активное, температура тела — 36,8 °С. Периферические лимфоузлы не увеличены. Дыхание везикулярное, хрипов нет, ЧДД — 16 в минуту. Тоны сердца ясные, ритмичные, шумы не выслушиваются. Пульс — 72 удара в минуту, артериальное давление — 110/60 мм рт. ст. Язык обложен белым налетом. Слизистые оболочки губ, щек, дужек миндалин, неба, задней стенки глотки розовые, чистые, гладкие, блестящие. Живот мягкий безболезненный. Симптом поколачивания отрицательный. Почки не пальпируются. Отеков нет. Физиологические отправления в норме.
Status localis. Кожный процесс носит распространенный симметричный полиморфный характер, локализуется на коже лица, верхних и нижних конечностей; представлен пятнами без четких границ застойно красно-розового цвета, 1,0–3,0 см в диаметре; папулами с четкими границами темно-розового цвета, отечными, 2,0–3,5 см в диаметре. На поверхности отдельных элементов визуализируются точечные экскориации в небольшом количестве, покрытые геморрагическими корочками. В области пальцев — пятна застойно-розового цвета, размерами 2,0–3,0 см, местами мишеневидной формы, склонные к слиянию. Дермографизм розовый. Ногтевые пластинки кистей и стоп не изменены (рис. 1, А, Б, В).
Лабораторные данные: ОАК: лейкопения (2,9 × 109/л); незначительный моноцитоз — 9,9%; гемоглобин — 122 г/л; тромбоцитопения (162 × 109/л); повышение СОЭ до 21 мм/ч. Ревмопробы: С-реактивный белок — 3,92 мкг/мл (отрицательный). Иммуноглобулины: повышение IgG до 17,2 г/л. LE-клетки 04.12.2018 г. — не обнаружены. ИФА на ГПИ: обнаружены антитела к описторхам (1:100). Биохимический анализ крови: гиперглобулинемия (40 г/л), понижение креатинина — 58 мкмоль/л, повышение АСТ — 51,1 МЕ/л, повышение СРБ-ультра до 2,26 мг/л, незначительное повышение ЛДГ до 255,2 МЕ/л. Молекулярно-биологическое исследование (ПЦР) на вирус простого герпеса (Herpes simplex virus) — результат отрицательный, ПЦР на вирус Эпштейна–Барр (Epstein–Barr virus) — обнаружено. Микробиологическое исследование материала с кожи лица: Staph. epidermidis умеренный рост. Микробиологическое исследование слизи с миндалин и задней стенки глотки — Candida albicans умеренный рост, чувствительный к флуконазолу.
На основании жалоб пациентки, анамнеза заболевания, клинико-лабораторных данных выставлен предварительный диагноз: «Острая кожная форма красной волчанки? Системная красная волчанка?»
Пациентке проведена конфокальная лазерная сканирующая микроскопия (КЛСМ) образования на коже лица. В эпидермальном слое (глубина 13,72 мкм) отмечается наличие фолликулярного гиперкератоза (рис. 2, красная звезда), перифолликулярных полей вакуольной дистрофии клеток с единичными воспалительными гиперрефрактильными клетками (рис. 2, голубой круг).
В эпидермально-дермальном соединении (глубина — 74,68 мкм) также визуализируются фолликулярные гиперкератотические пробки (рис. 3, красная звезда), очаги перифолликулярного инфильтрата из воспалительных клеток (рис. 3, красный круг), расположенные перифолликулярно утолщенные коллагеновые волокна (рис. 3, голубой круг).
Заключение: визуализированные КЛСМ признаки свидетельствуют о перифолликулярном воспалительном процессе в эпидермисе и дерме, совокупность выявленных симптомов позволяет предположить диагноз «красная волчанка».
При поступлении выполнена инцизионная биопсия кожи из очага поражения в области спины. В исследуемом препарате эпидермис тонкий за счет атрофии шиповатого слоя с диффузным и фолликулярным гиперкератозом, умеренным неравномерным акантозом, резкой вакуольной дистрофией клеток, в том числе базального слоя. Пигмент в базальном слое отсутствует. Роговые массы в устьях фолликулов содержат клетки дрожжеподобных грибов.
В сосочковом слое дермы выражен интерстициальный отек с формированием крупной субэпидермальной, унилокулярной полости, содержащей некротизированные эпидермоциты и акантолитические клетки. Эпидермис в области пузыря с серозным пропитыванием и клеточным детритом. Мелкие сосуды расширены, полнокровны. Определяются базофильная дегенерация и фокальный муциноз коллагеновых волокон. Инфильтрат очаговый эпидермо- и фолликулотропный, лимфогистиоцитарный с примесью плазмоцитов и меланофагов (рис. 4, А, Б, В).
Заключение: морфологическая картина соответствует острому интерфейс-дерматиту, возможна при дерматомиозите, СКВ и многоформной экссудативной эритеме.
Консультирована гинекологом: отмена гормональной контрацепции (пластырь Евра), рекомендованы только барьерные методы контрацепции.
В клинике ГБУ СО УрНИИДВиИ пациентка с диагнозом «подострая кожная форма красной волчанки» получала лечение: преднизолон 30 мг с раствором натрия хлорида 0,9% — 200,0, внутривенно капельно № 4, р-р глюконата кальция 10% — 5,0 внутримышечно № 15, р-р никотиновой кислоты 1% — 1,0 внутримышечно № 10, гидроксихлорохин (плаквенил) 200 мг 2 раза в день, токоферола ацетат 100 мг в день во время еды, эторикоксиб (Аркоксиа) 90 мг 1 раз в день после еды. Наружно: крем Комфодерм 0,1% (метилпреднизолона ацепонат) на кожу лица, на верхние конечности крем Акридерм гента (бетаметазон и гентамицин), крем Сикальфат на лицо.
На фоне проводимой терапии больная отмечала значительное улучшение общего состояния, уменьшение болезненности и слабости в области суставов, отсутствие головных болей, положительную динамику по кожному процессу (рис. 5, А, Б, В).
Пациентка была направлена на консультацию к ревматологу ГБУЗ СО Свердловская ОКБ № 1. Выполнена рентгенография кистей: костно-суставных изменений не выявлено. Ревматологом выполнены внутрисуставные инъекции препарата дипроспан 1,0 в области проксимальных межфаланговых суставов (ПМФ) с обеих сторон.
Проведены дополнительные методы обследования: антитела (АТ) к двухцепочечной ДНК — 36 (норма до 10), снижение С3 и С4 компонентов комплемента, анти-Sm (антитела к U1, U2, U4-рибонуклеопротеинам) в пределах нормы, ANA-screen (антинуклеарные антитела) — 14 (норма до 0,7). Повторная консультация ревматолога в ОКБ № 1 с предварительным диагнозом: «Системная красная волчанка?». Проведено дообследование: выявлен АНФ (антинуклеарный фактор) — 1:2560. В связи с чем в январе 2019 г. пациентка госпитализирована в ревматологическое отделение МАУ ГКБ № 40 Екатеринбурга, где проходила лечение с диагнозом: «Системная красная волчанка, подострое течение с поражением кожи, суставов, гематологическим синдромом (лейкопения), иммунологическими изменениями (АНФ, АТ к ДНК) А2».
Проведенная терапия: преднизолон 20 мг/сут, гидроксихлорохин 200 мг 2 раза/сут, диклофенак 50 мг/сут, омепразол 20 мг/сут. На фоне проводимой терапии достигнута стойкая положительная динамика по кожному процессу — высыпания регрессировали полностью, оставив гиперпигментированные пятна, суставные боли отсутствуют, слабости, температуры, головных болей нет. Выписана с рекомендациями продолжить прием метилпреднизолона по 16 мг/сут в течение 1 месяца, гидроксихлорохина — 200 мг 2 раза в день, далее снижение дозы метилпреднизолона по 1/2 таблетки в 2 недели, далее по 1/4 раз в 2 недели до 6 мг (поддерживающая доза).
На фоне лечения: антитела к двухцепочечной ДНК снизились до 7,6 МЕ/мл (норма до 10). Положительная динамика сохраняется и в настоящее время: суставные боли отсутствуют, слабости, головных болей нет, увеличение массы тела на 2 кг, кожный процесс стабилен — свежих высыпаний нет, сохраняются гиперпигментированные пятна. Пациентка удовлетворена результатами лечения (рис. 6, А, Б, В).
Обсуждение
При постановке диагноза ДКВ в первую очередь следует исключить признаки системного заболевания, от чего зависят тактика лечения и прогноз для жизни больного. При СКВ, в отличие от ДКВ, фолликулярный кератоз отсутствует, а атрофия выражена незначительно. Для СКВ клинически характерны артралгия, полисерозиты, эндокардит с поражением митрального клапана, поражения центральной нервной системы, почек, тяжелые васкулиты [8]. LE-клетки при СКВ в острой фазе заболевания обнаруживаются у 90–100%, при ДКВ — в 3–7%, что расценивается как неблагоприятный фактор. Антинуклеарные антитела при СКВ встречаются более чем у 95% больных, при ДКВ — у 30–40% больных. Аутоиммунная гемолитическая анемия, лейкопения и лимфопения с ускоренной СОЭ в крови, белок и цилиндры в моче — косвенные признаки системного заболевания [4].
Поражение кожи при КВ характеризуется значительной гетерогенностью клинических проявлений. В масштабном многоцентровом исследовании, проведенном C. Biazar и соавт. (2013 г.), две и более клинические формы кожной КВ наблюдались у 34,6% больных, острая кожная КВ была ассоциирована с дискоидной КВ у 30,3%, с подострой кожной КВ — у 13,8%, с дискоидной и подострой кожной КВ — у 15,3% пациентов [3].
Острая кожная форма КВ всегда служит проявлением СКВ, которая манифестирует с поражения кожи в 70—85% случаев. Острая форма КВ характеризуется развитием на коже лица в области скул и носа эритемы с цианотичным оттенком в центре и отеком. Реже встречаются распространенные пятнисто-папулезные высыпания [3, 9].
Подострая кожная КВ проявляется развитием папуло-сквамозных или кольцевидных эритематозных высыпаний. При псориазиформной КВ элементы представлены гиперемическими папулами и небольшими бляшками в области плеч, верхней части груди и спины, редко — на коже лица, ушных раковин, волосистой части головы, которые могут сливаться между собой. На поверхности пятен и бляшек имеются плотно сидящие чешуйки и незначительный гиперкератоз, усиливающийся в области устьев волосяных фолликулов. Высыпания при подострой кожной КВ могут разрешаться без рубцов, образуя длительно существующие очаги гипопигментации (гиперпигментации) с телеангиэктазиями на поверхности, или формировать поверхностную рубцовую атрофию. У данной категории больных часто имеются относительно нетяжелые системные проявления КВ: артралгии, артриты без вовлечения почек, ЦНС и серозных оболочек [1].
У большинства пациентов с подострой кожной формой КВ выявляются ANA (60-80%). При проведении дифференциальной диагностики важно учитывать, что для СКВ характерно наличие антител к экстрагируемому ядерному антигену Sm (Smith) — анти-Sm и положительные тесты на анти-dsDNA (антитела к двухцепочечной ДНК) [3].
Следует отметить, что не у всех пациентов будут положительными все иммунологические показатели, характерные при СКВ.
Неврологические симптомы возникают у 25–80% пациентов при СКВ. Нарушения когнитивных функций представлены снижением памяти, внимания, эмоционально-личностными расстройствами. В клинической картине неврологических проявлений встречаются головные боли, чаще мигренозного характера [3].
Заключение
В последние годы участились случаи стертых, молниеносных, атипичных форм диффузных заболеваний соединительной ткани, в частности СКВ. Разнообразие клинической картины, малые кожные проявления в сочетании с яркой, выступающей на первый план патологией внутренних органов приводят к поздней верификации данной нозологической единицы [4, 10].
Дифференциальный диагноз СКВ и кожной формы КВ на сегодняшний день представляется достаточно сложным и трудоемким процессом.
Диагноз СКВ должен устанавливаться на основании клинико-лабораторных данных и в соответствии с классификационными критериями: критерии диагноза Американской коллегии ревматологов (American College of Rheumatology — ACR, 1997 г.) — наличие 4 и более из 11 критериев (чувствительность 90%, специфичность 80%) и критерии диагноза Клиники международного сотрудничества по системной красной волчанке (The Systemic Lupus International Collaborating Clinics — SLISS, 2012 г.) — 4 критерия, один из которых должен быть клинический и один — иммунологический (любой из следующих лабораторных показателей: а-ДНК, АНФ, Sm, aКЛ, C3, C4) (чувствительность 95%, специфичность 74%) [6, 10].
В описанном случае у пациентки при поступлении в клинику ГБУ СО УрНИИДВиИ имелись следующие критерии: фотосенсибилизация (работа официантом на открытом воздухе на крыше здания в летний период); дискоидная сыпь; артрит (не менее 2 периферических суставов, проявляющийся болезненностью, отеком); гематологические нарушения (лейкопения). Таким образом, при наличии 4 критериев, характерных для СКВ, на догоспитальном этапе данное заболевание заподозрено не было. Пациентка была госпитализирована в клинику с направительным диагнозом «токсико-аллергический дерматит».
Данное клиническое наблюдение приведено с целью привлечения внимания врачей к проблеме ранней диагностики СКВ и своевременного начала лечения до развития фатальных событий, особенно учитывая, что больными чаще являются женщины репродуктивного возраста. Ошибки диагностики связаны с отсутствием настороженности врачей в отношении СКВ. В связи с этим следует обращать внимание на такие клинические особенности, как начало заболевания в молодом возрасте, суставные боли, наличие высыпаний на коже, язв в ротовой полости, нарушение общего состояния, фотосенсибилизация, гематологические нарушения, предшествующий прием препаратов, способных исказить истинную картину заболевания, и необходимость иммунологических исследований в ранние сроки.
Литература
- Попкова Т. В., Панафидина Т. А., Соловьев С. К. По материалам обновленных рекомендаций Европейской антиревматической лиги (EULAR) по лечению системной красной волчанки — 2019: дискуссионные вопросы и комментарии // Научно-практическая ревматология. 2019; 57 (5): 496–510.
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л. и др. Системная красная волчанка: междисциплинарный подход к диагностике // Российский журнал кожных и венерических болезней. 2016; 3: 141–147.
- Biazar C., Sigges J., Patsinakidis N., Ruland V., Amler S. et al. Cutaneous lupus erythematosus: first multicenter database analysis of 1002 patients from the European Society of Cutaneous Lupus Erythematosus (EUSCLE) // Autoimmun Rev. 2013; 12: 444–454.
- Юсупова Л. А., Мавлютова Г. И., Юнусова Е. И., Гараева З. Ш. Красная волчанка // Лечащий Врач. 2015; 7: 34–38.
- Егорова О. Н. Системная красная волчанка или генерализованная герпетическая вирусная инфекция? // Consilium Medicum. Дерматология. 2013; 2 (3): 21–28.
- Romero-Diaz J., Isenberg D., Ramsey-Goldman R. Measures of adult systemic lupus erythematosus: Updated Version of British Isles Lupus Assessment Group (BILAG 2004), European Consensus Lupus Activity Measurements (ECLAM), Systemic Lupus Activity Measure, Revised (SLAM-R), Systemic Lupus Activity Questi // Arthritis Care Res. 2011; 63: 37–46.
- Потехин Н. П., Филатова Е. А., Фурсов А. Н., Гладько В. В., Орлов Ф. А. Системная красная волчанка: взаимосвязь кожных проявлений с активностью заболевания // Военно-медицинский журнал. 2012; 4: 50–54.
- Клюквина Н. Г. Проблема коморбидности при системной красной волчанке // РМЖ. 2015; 7: 370–377.
- Трофимов П. Н., Антонова О. В., Швырев Д. Н., Хайрутдинов В. Р., Белоусова И. Э., Самцов А. В. Кожные формы красной волчанки: патогенез, клиника, диагностика, терапия // Вестник дерматологии и венерологии. 2015; 5: 24–33.
- Федеральные клинические рекомендации по диагностике и лечению системной красной волчанки. Ассоциация ревматологов России. 2016 г., доступно на: https://rheumatolog.ru/experts/klinicheskie-rekomendacii.
Н. В. Зильберберг, доктор медицинских наук, профессор
М. М. Кохан, доктор медицинских наук, профессор
Н. Н. Филимонкова, доктор медицинских наук, профессор
Я. В. Кащеева1, кандидат медицинских наук
Е. П. Топычканова, кандидат медицинских наук
О. Г. Римар
П. С. Гилёва
ГБУ СО УрНИИДВиИ, Екатеринбург
1 Контактная информация: yan-kashheeva@yandex.ru
DOI: 10.26295/OS.2020.84.96.007
Сложности в диагностике системной красной волчанки. Клиническое наблюдение/ Н. В. Зильберберг, М. М. Кохан, Н. Н. Филимонкова, Я. В. Кащеева, Е. П. Топычканова, О. Г. Римар, П. С. Гилёва
Для цитирования: Лечащий врач № 5/2020; Номера страниц в выпуске: 36-41
Теги: кожа, иммуновоспалительное повреждение, коллагеноз, высыпания
Системная красная волчанка (СКВ) — хроническое мультисистемное аутоиммунное заболевание неизвестной этиологии с широким спектром клинических проявлений и непредсказуемым течением. Серологически СКВ характеризуется присутствием высоких титров органонеспецифических аутоантител к различным компонентам клеточного ядра [1, 2]. В патогенезе СКВ участвуют как врожденные, так и приобретенные иммунные реакции. Взаимодействие генов с факторами окружающей среды приводит к многочисленным иммунологическим изменениям, результатом которых являются иммунные реакции против аутологичных нуклеиновых кислот. Аутоантитела и отложение иммунных комплексов могут повреждать ткани в почках, сердце, сосудах, центральной нервной системе, коже, легких, мышцах и суставах.
Заболевание начинается с доклинической бессимптомной фазы, характеризующейся появлением антинуклеарных антител/антинуклеарного фактора (АНА/АНФ), общих для аутоиммунных заболеваний, в последующем — высокоспецифичных для СКВ: антител к двуспиральной ДНК (анти-дс-ДНК), к Смит/Smith антигену (анти-Sm), антифосфолипидных антител (аФЛ) [3] (рис. 1). Ретроспективный анализ показал, что позитивные уровни АНА определяются за 10 лет до верификации диагноза у 47% пациентов с СКВ, аФЛ — за 7,6 года (в среднем за 3 года) у 18%, анти-дс-ДНК — за 2,5 года у 55%, анти-Sm — за несколько месяцев до диагностированной болезни [4–7].
Рис. 1. Течение системной красной волчанки на фоне стандартной терапии и применения стратегии «лечения до достижения цели» [3]
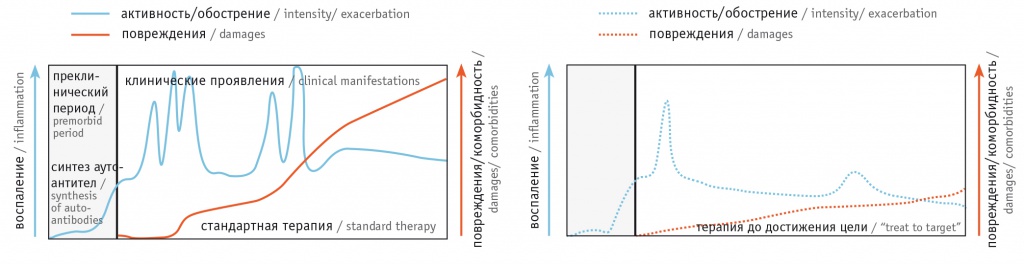
Период развернутой клинической картины отличается волнообразным течением: чередованием обострений («вспышек») и низкой активности/ремиссий. Частые обострения, которые оценивают с помощью индексов активности СКВ [8], вызванные аутоиммунным воспалением, терапия СКВ и сопутствующие заболевания (инфекции, ранний атеросклероз, злокачественные новообразования) приводят к накоплению необратимых повреждений различных органов (измеряют индексом повреждения по шкале Systemic Lupus International Collaborating Clinics Damage Index, SLICC) [9] (см. рис. 1). Эффективная и ранняя терапия, уменьшающая активность заболевания или приводящая к ремиссии, не только снижает частоту и тяжесть обострений, но и минимизирует связанные с ними повреждения [3].
ЭПИДЕМИОЛОГИЯ
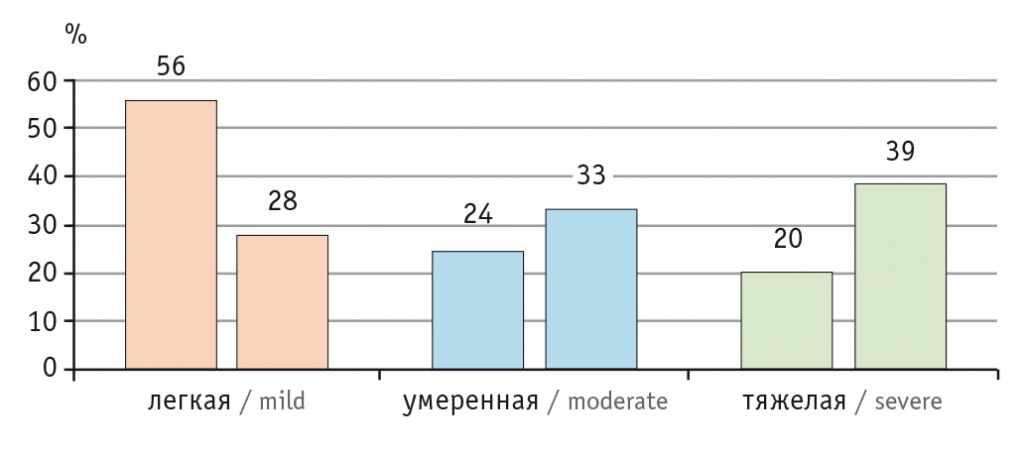
В последние 40 лет участились случаи СКВ, что может быть связано с совершенствованием диагностики, результаты которой колеблются в пределах от 0,3 до 31,5 случая на 100 тысяч человек в год. Распространенность заболевания во всем мире приблизилась к 50–100 случаям на 100 тысяч человек среди взрослого населения [3]. В Российской Федерации распространенность СКВ составляет 9,0–20,6 случая на 100 тысяч человек в зависимости от региона, а заболеваемость — 0,3–1,6 случая на 100 тысяч человек среди всего населения страны [10]. Среди заболевших СКВ преобладают женщины молодого и среднего возраста, что по отношению к пациентам мужского пола составляет 10:1, — это преимущественно больные с легкой степенью активности заболевания в дебюте (рис. 2) [11]. Однако со временем болезнь прогрессирует, так что число пациентов с легкой, средней и тяжелой степенями активности заболевания становится приблизительно одинаковым (около трети в каждой категории) (рис. 3) [12].
Рис. 2. Активность системной красной волчанки в дебюте заболевания [11]
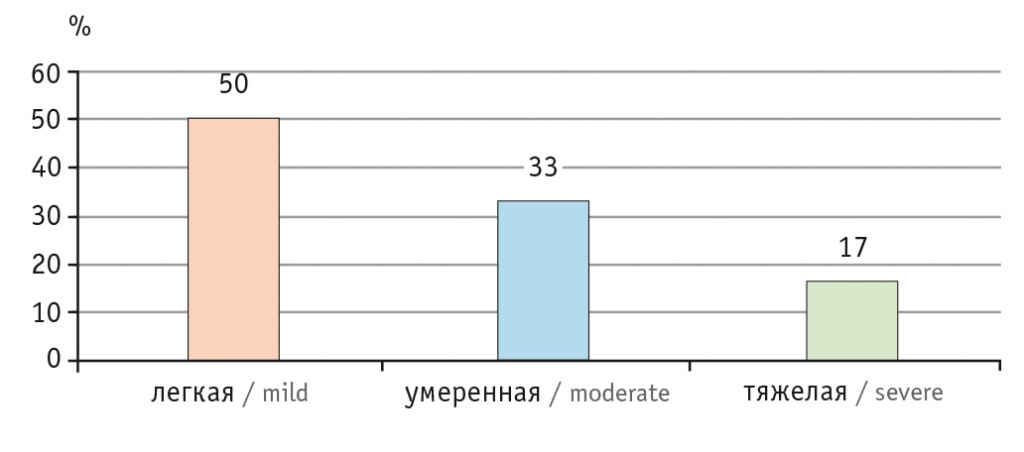
Рис. 3. Активность системной красной волчанки в дебюте и по мере прогрессирования болезни [12].
Примечание: первый столбец в каждой группе отражает частоту определенной степени активности заболевания в дебюте, второй — по мере прогрессирования болезни
Тяжесть СКВ варьирует в зависимости от этнической принадлежности и, как правило, тяжелее протекает у пациентов африканского и латиноамериканского происхождений [3].
ВЛИЯНИЕ ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ И ГЕНЕТИКИ
К факторам окружающей среды, запускающим патогенез СКВ, относят ультрафиолетовое облучение, курение, наркотики и некоторые лекарственные препараты (известно около 118 наименований: эстрогены, прокаинамид, гидралазин, сульфасалазин и др.) [13]. Так, курение ассоциировано с гиперпродукцией анти-дс-ДНК и аФЛ, а терапия ингибиторами ФНО-α — с анти-дс-ДНК [14–16]. Патогенетическая роль эстрогенов связана с их способностью влиять на гуморальные реакции: они стимулируют пролиферацию В-клеток и продукцию антител и одновременно оказывают ингибирующий эффект на пролиферативную активность Т-клеток [17, 18].
В настоящее время признана полигенная аддитивная модель семейной агрегации аутоиммунных заболеваний и, в частности, СКВ. Согласно общенациональному исследованию, проведенному на Тайване, относительный риск развития СКВ среди близнецов равен 316, среди братьев и сестер — 24, среди родителей — 11, среди детей — 14, и даже среди неродственных супругов он составляет 4. Конкордантность в отношении заболевания у монозиготных близнецов равна 25%, вклад генетически детерминированной наследуемости в развитие СКВ определен на уровне 44%, «семейных» общих факторов окружающей среды — на уровне 26%, необщих факторов окружающей среды — на 30% [19–21]. Относительный риск СКВ при наличии у родственников первой линии других аутоиммунных заболеваний колеблется от 5,87 для болезни Шегрена, 5,40 для системной склеродермии, 2,66 для ревматоидного артрита, 2,58 для рассеянного склероза, 1,68 для СД 1 типа до 1,39 для воспалительных заболеваний кишечника. Эти данные могут быть основой для определения генетической закономерности (или ее отсутствия) развития аутоиммунных заболеваний. Возможно, наличие редких генетических вариаций в сигнальном пути Т-клеточных рецепторов является общим знаменателем для существующей семейной агрегации [21].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ: «БОЛЬШИЕ И МАЛЫЕ»
В отличие от других аутоиммунных заболеваний, таких как СД 1 типа, рассеянный склероз, тиреоидит Хашимото, характеризующихся органоспецифичностью, при СКВ отмечают системное поражение органов и тканей, многообразие клинических проявлений. Болезнь может дебютировать одним или двумя симптомами, однако для СКВ характерно полиорганное поражение, ввиду которого страдают кожа, слизистые, опорно-двигательный аппарат, легкие, почки, сердечно-сосудистая и нервная системы. Клинические проявления существенно варьируют у разных больных и в разные периоды заболевания. Течение СКВ волнообразное, с чередованием ремиссий и обострений, при которых возможно вовлечение в патологический процесс новых органов и систем.
В таблице 1 представлены характер и частота клинических проявлений при СКВ в европейской когорте, согласно данным D. Nicolopoulos и соавт. [22], и собственные данные ФГБНУ «НИИР им. В.А. Насоновой».
Таблица 1
Частота поражения органов при системной красной волчанке
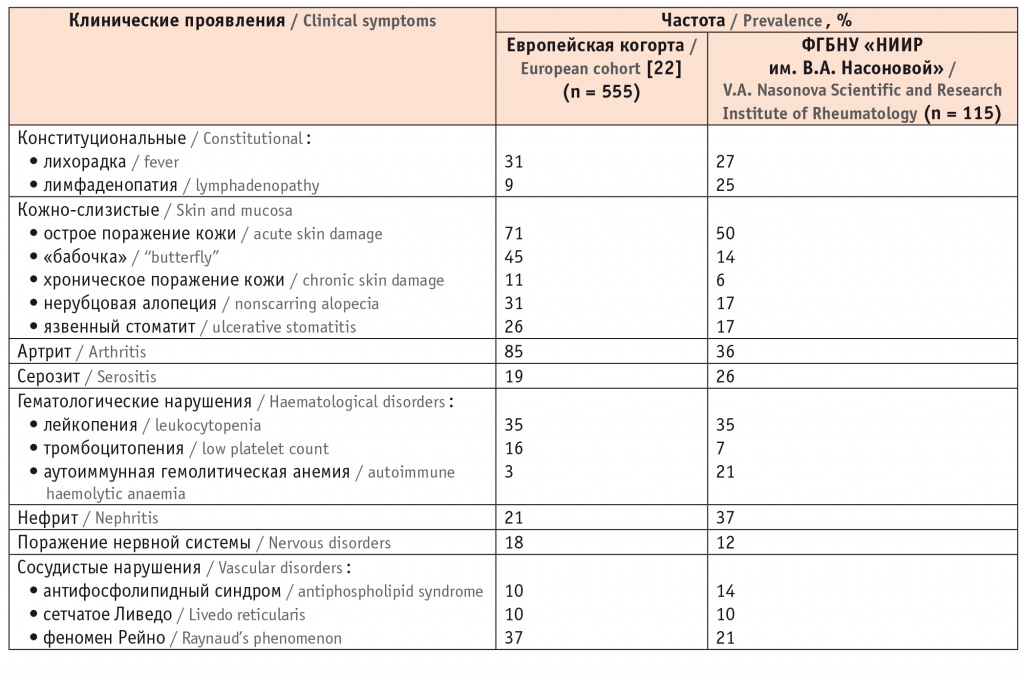
У кавказоидов самыми частыми клиническими проявлениями СКВ являются острое поражение кожи, артрит, лейкопения, нефрит и лихорадка. Поражения органов, не входящие в критерии СКВ (например, альвеолит, васкулит, люпус-гепатит), встречаются у 19% больных. Пациенты детского и пожилого возраста имеют свои особенности. Ювенильная СКВ характеризуется острым и более тяжелым течением с лихорадкой (46%), поражением почек (42%) и нервной системы (17%) [22]. Дебют СКВ в пожилом возрасте ассоциируется с поражением сердечно-сосудистой системы, серозитом, синдромом Шегрена. Тяжелые формы нефрита и вовлечение нервной системы редки. Характерны высокие значения индекса повреждения SDI, частоты коморбидных состояний и инфекционных осложнений [23].
Диагноз СКВ является клиническим, но требующим обязательного лабораторного подтверждения с определением АНФ и высокоспецифических биомаркеров: аутоантител (анти-дс-ДНК, анти-Sm, аФЛ) и гипокомплементемии. Верификацию диагноза, лечение и мониторинг должен осуществлять ревматолог.
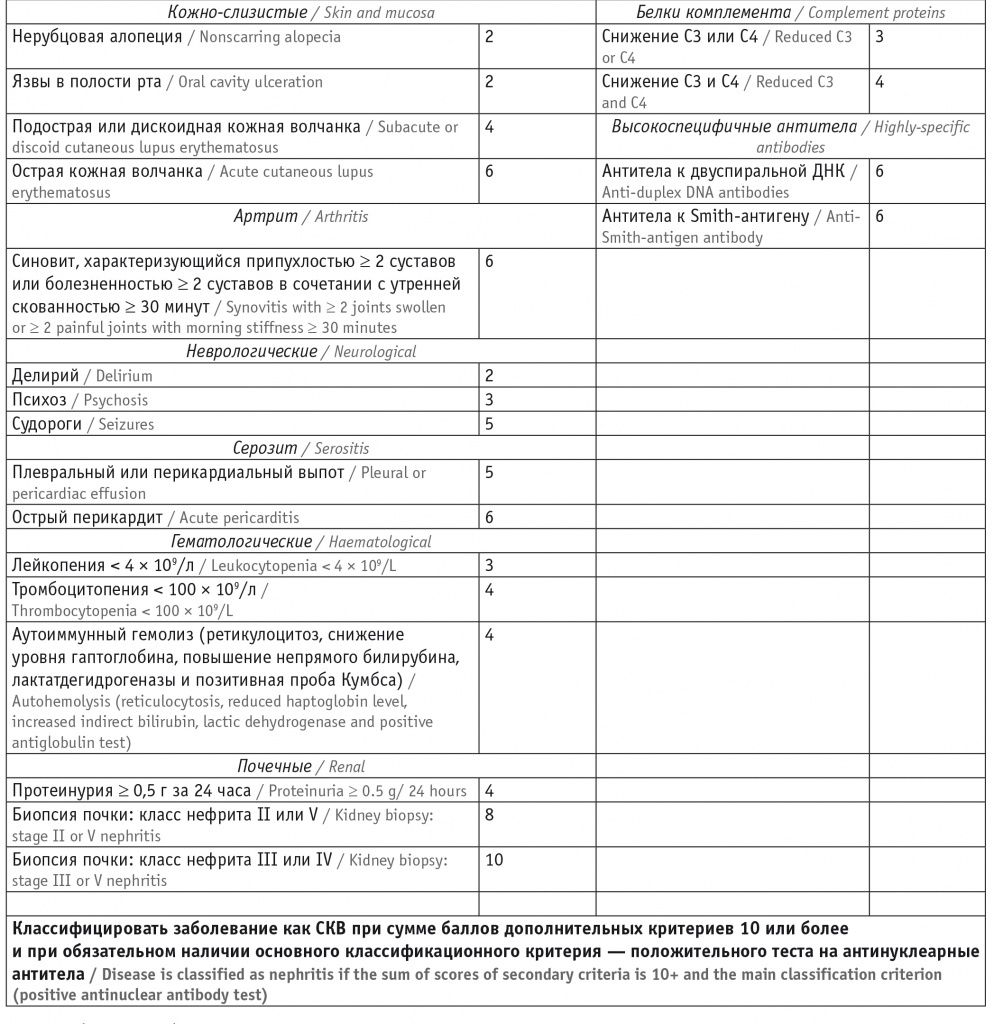
Постоянно совершенствуются критерии диагностики СКВ, позволяющие своевременно установить верный диагноз и назначить адекватное лечение, что является основой повышения продолжительности и качества жизни больных. В 2019 году European League Against Rheumatism (EULAR) и American College of Radiology (ACR) опубликовали новые классификационные критерии СКВ (табл. 2) [24, 25], превосходящие по чувствительности и специфичности те критерии, которые были разработаны ранее (ACR — в 1997 году [26] и SLICC — в 2012 году [27]). Классификационные критерии успешно используются в реальной практике для постановки диагноза. Благодаря их применению время с момента появления первого симптома до подтверждения диагноза СКВ прогрессивно сократилось: с 59 месяцев в период до 1980 года до 9 месяцев после 2000 года [28].
Таблица 2
Классификационные критерии системной красной волчанки (СКВ) EULAR/ACR 2019 года [24]
С какими трудностями можно столкнуться при диагностике СКВ? Во-первых, крайне редко, но все же могут встречаться АНА-негативные формы СКВ. Во-вторых, на ранней стадии болезни может отсутствовать необходимое для диагностики количество клинических и лабораторных признаков, характерных для СКВ.
В критериях EULAR/ACR 2019 года указано, что положительный тест на АНА/АНФ — это главный показатель для постановки диагноза СКВ, что является важнейшим отличием этих критериев от предыдущих. Негативный результат этого теста исключает диагноз [24, 25]. Однако важно учитывать сопутствующие заболевания. Например, повышение титров АНФ в сочетании хотя бы с одним из следующих признаков: артритом/артралгиями, кожной сыпью, алопецией, феноменом Рейно, серозитом, сухим синдромом, — позволяет заподозрить дебют или высокий риск развития в будущем аутоиммунного ревматического заболевания. И, напротив, положительный тест на АНФ в отсутствие перечисленных симптомов, вероятнее всего, связан с наличием других заболеваний (аутоиммунного тиреоидита, гепатита и др.), с использованием некоторых лекарственных препаратов или с бессимптомным носительством (по некоторым данным, частота выявления АНФ у здоровых людей может достигать 20% [29]). Нормальное содержание АНФ среди пациентов с СКВ крайне редко определяется в дебюте болезни (0,5% [30]) и относительно редко (5–20%) — в последующие годы вследствие влияния интенсивной терапии и/или особенностей методик исследования [29]. Некоторые исследователи рекомендуют увеличить титр, позволяющий зафиксировать позитивность по АНФ, с ≥ 1/80 до > 1/160 с целью повышения его диагностической значимости как основного входящего критерия [31]. Мы поддерживаем данную рекомендацию, учитывая, что АНФ в титре > 1/160 в здоровой популяции встречается гораздо реже, чем в титре ≥ 1/80 (соответственно в 5% и 20% случаев) [32, 33].
Следует иметь в виду, что упомянутые критерии СКВ классификационные, а не диагностические, и выполнение всех условий не является строгой необходимостью для постановки диагноза. В тех очень редких случаях, когда у пациента присутствуют специфические для СКВ клинические и иммунологические нарушения при отрицательном значении АНФ, целесообразно в качестве основного критерия EULAR/ACR 2019 года для постановки диагноза применить гипокомплементемию или позитивность по аФЛ [3] или использовать критерии SLICC 2012 года, в которых положительный тест на АНФ не является обязательным условием диагностики СКВ.
Вторая отличительная особенность критериев EULAR/ACR 2019 года — это градация каждого клинического и лабораторного показателя по его диагностической значимости. Максимальные баллы (от 10 до 6) имеют гистологически подтвержденный волчаночный нефрит (ВН), острый перикардит, синовит двух и более суставов, острая кожная волчанка, позитивность по анти-дс-ДНК, анти-Sm [24]. Подобная оценка способствует ранней диагностике болезни, так как при позитивности по АНФ наличие даже одного (ВН III или IV классов) или двух значимых признаков позволяет установить диагноз СКВ.
При подозрении на раннюю СКВ (медиана длительности — 48 месяцев) критерии EULAR/ACR 2019 года демонстрируют большую специфичность и дают меньше ложноположительных результатов (табл. 3) [34].
Таблица 3
Сравнение чувствительности и специфичности классификационных критериев у пациентов с ранней системной красной волчанкой [34]

На наш взгляд, одновременное использование комбинации критериев с наибольшей чувствительностью и специфичностью — EULAR/ACR 2019 года и SLICC 2012 года — сводит к минимуму возможность диагностической ошибки даже на ранней стадии болезни.
В реальной клинической практике при диагностике и мониторинге больных СКВ необходимо обратить внимание на следующее:
-
повторный тест на АНА/АНФ при его положительном результате нецелесообразен;
-
нет необходимости в частом контроле серологических биомаркеров, специфичных для СКВ, при низкой активности и/или ремиссии;
-
обязательно исследование анализов мочи в рутинном лабораторном контроле;
-
не следует относить все симптомы к проявлениям СКВ, необходимо исключать другие причины, не связанные с СКВ (инфекции, новообразования и др.).
ЭНДОТИПЫ И ОРГАНО-ДОМИНАНТНАЯ СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА
СКВ отличается многообразием симптомов. Течение болезни, тактика лечения и прогноз различаются в зависимости от формы болезни. В связи с этим некоторые исследователи предлагают ввести понятие «эндотипов» СКВ, включающих ювенильную СКВ с дебютом в детском возрасте, СКВ с преобладающим поражением определенных органов и систем (например, суставную, почечную, неврологическую, гематологическую формы), СКВ в сочетании с антифосфолипидным синдромом или СКВ с синдромом Шегрена [3]. Ювенильная СКВ развивается, как правило, остро, характеризуется высокой активностью в дебюте, приводящей к накоплению повреждений и требующей агрессивной терапии. Наличие антифосфолипидного синдрома сопряжено с риском нервно-психических нарушений, тромботических и акушерских осложнений [13].
КЛИНИЧЕСКОЕ ТЕЧЕНИЕ БОЛЕЗНИ И ФАКТОРЫ НЕБЛАГОПРИЯТНОГО ПРОГНОЗА
Согласно результатам многолетнего проспективного когортного исследования (n = 267), длившегося ≥ 10 лет, активность СКВ распределялась следующим образом: большинство пациентов (68%) имели интермиттирующее течение (чередование обострений с ≥ 2 периодами ремиссии), 10% больных достигли длительной ремиссии, 9% имели персистирующе активное проявление болезни, 13% — «гибридное» (обострения в сочетании с одним периодом ремиссии) [35]. В итальянской когорте больных (n = 224) длительная ремиссия встречалась в 37% случаев, наличие васкулита, гломерулонефрита, гематологических нарушений осложняет достижение этого состояния [36]. К факторам, определяющим тяжелое течение СКВ, относят ювенильное начало, мужской пол, позитивность по аФЛ, гипокомплементемию, высокий «интерфероновый профиль», умеренную и высокую активность болезни [13] (рассчитанную с использованием валидированных индексов активности — The Systemic Lupus Erythematosus Disease Activity Index (SLEDAI) [37] и его модификаций — SELENA [38] и 2К [8]; The British Isles Lupus assessment Group Index (BILAG) [39]). Указанные шкалы применяются для глобальной общей оценки состояния больного СКВ, но могут использоваться и органоспецифические индексы, оценивающие степень поражения и/или улучшения функции определенного органа, например при нефрите или поражении кожи.
После непрерывной двухлетней ремиссии прекращается накопление необратимых органных повреждений [36], оцениваемых с помощью Silt Density Index (SDI) [9]. Его повышенное значение ассоциировано с неблагоприятным исходом и смертью. SDI — это единственный на сегодня валидированный и простой в использовании инструмент широкого диапазона для мониторинга осложнений в органах и системах или их дисфункций при СКВ. На его уровень влияет активность СКВ, сопутствующие заболевания и терапия в первую очередь глюкокортикоидами. При максимальном счете в 46 баллов даже небольшое повышение SDI имеет клиническое и прогностическое значение, отражающее тяжесть заболевания [40].
Применение любого из индексов активности при каждом визите пациента и определение SDI ежегодно рекомендовано EULAR [40, 41] и Ассоциацией ревматологов России [1], калькуляторы доступны в онлайн режиме1, 2.
Последние 30 лет в клинических исследованиях лекарственных препаратов (порядка 40 наименований) для лечения СКВ оценку эффективности проводили с помощью глобальных индексов, в то время как в более успешных испытаниях раннего периода ответ на лечение измеряли органоспецифическими критериями [3]. Возможно, в будущем стоит заменить глобальные индексы на органоспецифические или внедрить новые улучшенные варианты (строго определить критерии ремиссии и низкой активности заболевания).
ЛЕЧЕНИЕ
В 2019 году были обновлены рекомендации EULAR по лечению и мониторингу пациентов с СКВ [40, 41] и сформулированы основные цели терапии — достижение длительной выживаемости, предупреждение необратимых органных повреждений и улучшение качества жизни больных.
Основные рекомендации (рис. 4):
-
лечение при СКВ должно быть направлено на достижение ремиссии или минимальной активности заболевания и предотвращение обострений;
-
при отсутствии противопоказаний гидроксихлорохин рекомендуется назначать всем пациентам в дозе, не превышающей 5 мг/кг в сутки;
-
для поддерживающей терапии следует использовать минимально возможную дозу глюкокортикоидов (≤ 7,5 мг/сут в пересчете на преднизолон);
-
своевременное назначение иммуносупрессантов (метотрексата), азатиоприна, микофенолата мофетила приводит к стероидсберегающему эффекту, позволяющему снизить дозу глюкокортикоидов до минимально эффективной или отменить их совсем;
-
при персистирующе активном течении заболевания или при частых обострениях следует рассмотреть белимумаб как дополнительное средство;
-
ритуксимаб и циклофосфамид могут быть использованы при рефрактерном течении заболевания;
-
следует опираться на схемы лечения кожных, нервно-психических, гематологических и почечных проявлений;
-
у всех пациентов с СКВ следует определять уровень аФЛ, оценивать профиль риска инфекционных и сердечно-сосудистых заболеваний; все профилактические мероприятия необходимо проводить соответствующим образом.
Рис. 4. Терапия системной красной волчанки согласно рекомендациям European League Against Rheumatism (EULAR) 2019 года: дополнительные методы коррекции, основные препараты, цель терапии [40].
Примечание. АД — артериальное давление, АЗА — азатиоприн, аФЛ — антитела к фосфолипидам, БЛ — белимумаб, в/в ― внутривенное введение, в/м — внутримышечное введение, ГК — глюкокортикоиды, ГХ — гидроксихлорохин, ИК — ингибиторы кальциневрина, ММФ — микофенолата мофетил, МТ — метотрексат, ПЗ — преднизолон, РА — ревматоидный артрит, РТМ — ритуксимаб, СКВ — системная красная волчанка, ЦФ — циклофосфамид; SLEDAI, BILAG — глобальные индексы активности СКВ

ВОЛЧАНОЧНЫЙ НЕФРИТ
Тяжелый ВН развивается в 20% случаев у больных СКВ. К факторам риска ВН относят юный возраст дебюта, мужской пол, выраженные серологические нарушения, умеренную и высокую активность внепочечных проявлений СКВ. Факторы риска терминальной почечной недостаточности (ТПН) при ВН — мужской пол, АГ, повышенный исходный уровень креатинина, индексов активности и хронизации при гистологическом исследовании почечного биоптата, отсутствие поддерживающей иммуносупрессивной терапии. В последние годы выживаемость больных без ТПН в течение 20 лет возросла с 80% до 90% главным образом благодаря широкому распространению ранней диагностической нефробиопсии и своевременному назначению иммуносупрессантов [42].
В обновленных рекомендациях EULAR/European Renal Association — European Dialysis and Transplant Association (ERA-EDTA) 2019 года были выдвинуты цели терапии ВН: к 3-му месяцу лечения снижать протеинурию до ≥ 25% при стабильной скорости клубочковой фильтрации (СКФ) (± 10% от исходного уровня), к 6-му месяцу — до ≥ 50% и к 12–24 месяцам терапии достигать протеинурии уровня < 0,5–0,7 г/сут (при стабильной СКФ) [40].
При активном пролиферативном гистологически подтвержденном ВН лечение состоит из двух фаз: индукционной (начальной) и поддерживающей (продолжительной). Микофенолата мофетил (2–3 г/сут) и циклофосфамид (по 500 мг в/в каждые 2 недели в течение 3-х месяцев) в сочетании с глюкокортикоидами (пульс-терапия метилпреднизолоном, преднизолоном перорально в дозе 0,3–0,5 мг/кг/сут) — препараты выбора для индукционной фазы. Комбинация микофенолата мофетила с ингибиторами кальциневрина или высокодозный режим введения циклофосфамида (в/в в дозе 0,5–1 г/м2
раз в месяц в течение 6 месяцев в сочетании с преднизолоном перорально по 0,7–1,0 мг/кг/сут) — альтернативная схема лечения ВН с протеинурией нефротического уровня и неблагоприятными прогностическими факторами ТПН. В течение поддерживающей длительной фазы терапии применяется ММФ (1–2 г/сут) или азатиоприн (1,5–2 мг/кг/сут) [40].
НЕРВНО-ПСИХИЧЕСКИЕ ПРОЯВЛЕНИЯ
Нейропсихические нарушения при СКВ (НПСКВ) разнообразны, среди них наиболее частыми являются судороги, цереброваскулярные нарушения и когнитивная дисфункция. Риск ишемического инсульта повышен более чем в 2 раза по сравнению с общей популяцией, и чаще всего инсульт происходит в первый год после постановки диагноза СКВ. Важно отметить, что 60% инсультов возникает на фоне высокой общей активности СКВ [3]. Диагностика НПСКВ требует междисциплинарного подхода для исключения сходных состояний, вызванных другими заболеваниями (инфекциями, опухолями, метаболическими нарушениями и др.). Необходимо учитывать факторы, характерные как для НПСКВ (тип и сроки манифестации, экстраневрологические проявления активности СКВ, аномальные изменения при нейровизуализации и исследовании спинномозговой жидкости, а также позитивность по аФЛ), так и для альтернативных диагнозов [41]. Лечение НПСКВ зависит от того, какой патофизиологический механизм лежит в основе этих нарушений: воспалительный или тромботический/ишемический [43]. В первом случае назначают глюкокортикоиды и иммуносупрессанты, во втором — антитромботические препараты (антикоагулянты, антиагреганты). Различия между двумя патофизиологическими процессами трудно четко дифференцировать, у некоторых пациентов они могут встречаться одновременно, в такой ситуации необходимо назначить сочетание иммуносупрессивной и антитромботической терапий [43].
Пациентам с СКВ и цереброваскулярным поражением проводят обследование и лечение в соответствии с рекомендациями, разработанными для острой фазы цереброваскулярных заболеваний в общей популяции. Дополнительно осуществляют контроль экстраневрологических проявлений СКВ. Целесообразность иммуносупрессивной терапии в этих случаях можно рассматривать при нормальных значениях аФЛ, отсутствии факторов риска атеросклероза (то есть в отсутствие факторов риска тромбозов) или при рецидивирующих цереброваскулярных событиях. Симптоматическая терапия показана при определенных типах психических расстройств: антипсихотики — при психозе, анксиолитики — при тревожных расстройствах и т. п. [40]
ГЕМАТОЛОГИЧЕСКИЕ НАРУШЕНИЯ
При СКВ часто встречаются аутоиммунные цитопении. Это гематологические проявления, требующие иммуносупрессивной терапии, — аутоиммунная тромбоцитопения и гемолитическая анемия [40]. При сочетании тромбоцитопении с анемией необходимо проводить обязательное цитологическое исследование мазка периферической крови на предмет выявления шизоцитов (фрагментированных эритроцитов) для исключения микроангиопатической гемолитической анемии (МАГА) и тромботической микроангиопатии (ТМА). МАГА характеризуется неиммунным (реакция Кумбса отрицательная) внутрисосудистым гемолизом, вызванным механическим разрушением эритроцитов при взаимодействии с поврежденным эндотелием. ТМА — синдром, включающий тромботическую тромбоцитопеническую пурпуру (ТТП) (дефицит ADAMTS13, или ADAM-протеаз, A disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13) и МАГА в сочетании с тромбоцитопенией и повреждением внутренних органов вследствие тромбоза артериол и капилляров. Не всегда МАГА сопровождается ТМА, но всегда ТМА характеризуется МАГА и тромбоцитопенией. Сочетание СКВ с ТТП встречается редко в отличие от сочетания СКВ с ТМА/МАГА. При МАГА использование иммуносупрессантов демонстрирует положительный эффект, не требующий плазмафереза, развитие ТМА при СКВ сопряжено с его обязательным применением [3].
Синдром активации макрофагов — редкое, но потенциально фатальное осложнение СКВ, проявляющееся фебрильной лихорадкой, панцитопенией, коагулопатией, нарушением функции печени и центральной нервной системы, имитирующее обострение СКВ, может рецидивировать у 10% больных. Препаратами первой линии терапии являются высокие дозы глюкокортикоидов, внутривенный человеческий Ig, циклофосфамид, ритуксимаб, этопозид [44].
ПОРАЖЕНИЕ СЕРДЦА
Самым частым проявлением поражения сердца является перикардит, реже встречаются клапанные нарушения и еще реже — миокардит [45]. Согласно собственным данным (n = 87), патология перикарда была обнаружена у 45% пациентов (преобладал адгезивный перикардит, у 62%); недостаточность клапанов с разной степенью регургитации, не требующая хирургической коррекции, — у 92%; эндокардит — у 30%; пролапс створок митрального или трикуспидального клапанов — у 33% пациентов; миокардит — у 5% больных СКВ. Применение высокочувствительных тропониновых тестов и МРТ с парамагнитным контрастным усилением (информативный метод визуализации очагов воспаления в миокарде, повреждения и некроза миоцитов) позволяет в последние годы диагностировать миокардит чаще [46].
Легочная АГ — редкое, но серьезное осложнение СКВ. Выделяют два фенотипа: васкулопатический с низкой активностью СКВ («чистая легочная АГ») и васкулитический тип с высокой общей активностью СКВ. Последний более чувствительный к иммуносупрессивной терапии [47]. При СКВ может встречаться вторичная легочная АГ, обусловленная тромбоэмболическими осложнениями или возникшая на фоне интерстициального поражения легких [45].
Антималярийная кардиомиопатия — малоизученное и крайне редко встречающееся осложнение длительного приема антималярийных препаратов, представляющее собой гипертрофическую рестриктивную кардиомиопатию с нарушениями проводимости сердца или без них [48].
КОМОРБИДНОСТЬ
Риск инфекций при СКВ ассоциирован как с самой болезнью (вследствие высокой активности, тяжелой лейкопении; вследствие ВН, сопровождающегося гипогаммаглобулинемией при нефротическом синдроме), так и с лекарственными препаратами (с высокими дозами глюкокортикоидов, циклофосфамида, микофенолата мофетила и ритуксимаба) независимо друг от друга. Меры по защите от инфекционных осложнений должны осуществляться очень активно, они включают в себя как первичную профилактику (сезонную иммунизацию против вируса гриппа и пневмококковой инфекции вне обострения и высокой активности болезни), так и своевременную диагностику с адекватной терапией. Следует обратить внимание на уровень СРБ: его повышение с большей вероятностью ассоциировано с присоединением бактериальной инфекции, нежели с обострением СКВ [49].
Повышение риска ССЗ при СКВ может быть обусловлено как традиционными кардиоваскулярными факторами риска, так и факторами, связанными с самим заболеванием (активностью болезни, ВН, aФЛ и использованием глюкокортикоидов) [50]. Основанием для назначения статинов может быть дислипидемия в сочетании с другими традиционными факторами риска. Риск развития сердечно-сосудистых осложнений у пациентов с СКВ недооценивается. Рекомендуют рассчитывать 10-летний риск ССЗ с использованием шкалы Systematic COronary Risk Evaluation (SCORE) [51].
Поддержание уровня АД < 140/90 мм рт. ст. при почечной дисфункции может снизить риск сосудистого события. У пациентов с уже имеющимися клиническими проявлениями ССЗ или высоким значением SCORE (> 10%) целевые уровни АД должны быть < 130/80 мм рт. ст. и < 120/80 мм рт. ст.; для этих целей обязательно использование ингибиторов ренин-ангиотензин-альдостероновой системы [52].
У пациентов с СКВ повышен риск злокачественных новообразований легких, щитовидной железы, печени, шейки матки, снижен в отношении рака молочной и предстательной желез. Риск развития лимфом превышен в 3 раза, ассоциирован с активностью многочисленных цитокинов и вирусными инфекциями [53].
ВЗГЛЯД В БУДУЩЕЕ
Модифицирующие болезнь традиционные и биологические препараты, применяемые в качестве монотерапии, комбинации или используемые последовательно, позволили гораздо чаще достигать целей лечения, включая минимизацию дозы глюкокортикоидов и снижение частоты необратимых органных повреждений (измеряемых по шкале SDI). В исследовании AURA-LN обнадеживающие результаты показала мультитаргетная терапия с использованием комбинации ингибитора кальциневрина (воклоспорина) и микофенолата мофетила в индукционную фазу лечения ВН [54]. Применение белимумаба снижает значение SDI при долгосрочном наблюдении и демонстрирует положительный эффект в лечении ВН [55, 56]. Введение анифролумаба (человеческого моноклонального антитела к субъединице 1 рецептора интерферона I типа) не привело к достижению конечной точки в исследовании TULIP-1, но позволило уменьшить общую активность СКВ, по шкале BILAG, в исследовании TULIP-2 [57]. В настоящее время ученые исследуют эффективность низких доз IL-2 для усиления регуляторной функции Т-клеток [58]. Для будущих клинических исследований обсуждается целесообразность выделения эндотипов СКВ с преимущественным поражением определенных органов и систем и применением органоспецифических шкал оценки активности и исхода [3].
ЗАКЛЮЧЕНИЕ
Таким образом, проблема ранней диагностики и прогнозирования течения СКВ продолжает оставаться одной из центральных в современной ревматологии. Разработка рекомендаций по лечению и их внедрение в клиническую практику могут улучшить результаты терапии этого заболевания и его исход.
Поступила: 15.03.2021
Принята к публикации: 06.06.2021
ГБУЗ «Московский научно-практический центр дерматовенерологии и косметологии» Департамента здравоохранения Москвы, Москва, Россия
Минкина О.В.
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения
Вавилов В.В.
МНПЦДК Департамент здравоохранения Москвы;
Первый МГМУ им. И.М. Сеченова
Бобров М.А.
ГУ МОНИКИ им. М.Ф. Владимирского
Красная волчанка, системная и дискоидная: имитация различных дерматозов (клинические наблюдения)
Авторы:
Потекаев Н.Н., Минкина О.В., Вавилов В.В., Бобров М.А.
Журнал:
Клиническая дерматология и венерология. 2014;12(1): 81‑85
Как цитировать:
Потекаев Н.Н., Минкина О.В., Вавилов В.В., Бобров М.А.
Красная волчанка, системная и дискоидная: имитация различных дерматозов (клинические наблюдения). Клиническая дерматология и венерология.
2014;12(1):81‑85.
Potekaev NN, Minkina OV, Vavilov VV, Bobrov MA. Systemic lupus erythematosus and discoid lupus erytematosus imitating different dermatoses. Case reports. Klinicheskaya Dermatologiya i Venerologiya. 2014;12(1):81‑85. (In Russ.).

?>
Постоянно увеличивающийся интерес к проблемам нарушения иммунологической реактивности определяется существенным ростом патологий, ассоциированных с нарушениями деятельности иммунной системы человека. Аутоиммунные заболевания включают в свою группу более 80 нозологических форм и относятся к числу наиболее распространенных и тяжелых болезней человека, частота которых в популяции составляет 5-8% [1]. По-видимому, не существует такой медицинской специальности, представителю которой не приходилось бы сталкиваться с аутоиммунными болезнями и их проявлениями. Увеличение частоты встречаемости проявлений аутоиммунной патологии в дерматологической практике, теоретические и практические сложности создания алгоритмов диагностики, преимущественное поражение лиц трудоспособного возраста, нередко инвалидизирующее течение патологических процессов, и несвоевременное назначение таргетной и эффективной терапии ставят эту проблему в ряд наиболее актуальных.
Красная волчанка (КВ) представляет собой хроническое, воспалительное аутоиммунное иммунокомплексное заболевание с вариабельным течением, прогнозом и широким спектром дерматологических и системных проявлений, которые более века являются предметом клинических исследований и привлекают внимание разных специалистов — дерматологов, ревмотологов, невропатологов, нефрологов, гематологов и др. В 1851 г. P.L.A. Cazenave [2] предложил термин «lupus erythemateux» для разграничения проявлений туберкулеза кожи и дерматологических проявлений волчаночной этиологии. В 1845 г. Ferdinand von Hebra описал эритематозные поражения кожи лица на щеках и переносице, которые, сливаясь друг с другом, по форме напоминали «бабочку», и предложил термин «seborrhoea congestive», позднее замененный «lupus erythematosus». Период с 1875 по 1895 г. в мире дерматологии ознаменовался тем, что M. Kaposi, J. Hutchinson и W. Osler [3-5] предложили основополагающие патогенетические теории развития КВ, также предположив, что некий фактор окружающей среды, такой как инсоляция, может индуцировать заболевание.
Несмотря на то что патогенез КВ до конца не ясен, согласно наиболее распространенной классификации, различают две основные формы этого заболевания — кожную (или интегументную; ККВ) с длительным, но относительно доброкачественным течением, и системную (СКВ). В настоящее время сложилась четкая дифференцированная система наблюдения и лечения пациентов с указанными формами КВ, предусматривающая ведение пациентов только с кожными проявлениями заболевания специалистами-дерматологами, оставляя в компетенции специалистов-ревматологов пациентов с системным процессом. Однако нет единодушного профессионального мнения по поводу единства и различия кожной и системной форм заболевания. Некоторые специалисты придерживаются точки зрения, согласно которой две формы КВ — это два разных самостоятельных заболевания, и аргументируют свою позицию низкой частотой трансформации кожной формы в системную (всего у 3-5% больных), разным уровнем нарушения иммуногенеза [6] и степенью выраженности лабораторных изменений (нуклеиновый обмен в циркулирующих нейтрофилах и моноцитах, титр антител к нуклеарным антигенам), отличающимся характером течения заболевания и прогнозом для жизни, разными алгоритмами терапии. К числу аргументов сторонников этой точки зрения также относятся диффузность и обратимость алопеции при СКВ и рубцовый, а следовательно, необратимый характер алопеции при интегументных формах КВ [7, 8].
Однако существует и противоположная точка зрения, согласно которой разделение кожной и системной форм условно, и рассматривать КВ необходимо в рамках теории единого заболевания с вариабельностью проявлений при разной иммунологической реактивности. Действительно, при обеих формах заболевания больными преимущественно являются женщины [9], имеется повышенная чувствительность к солнечному облучению, обе формы, как правило, сопровождаются поражениями кожного покрова, наблюдается общность гистологических и гистохимических признаков.
Кожный покров традиционно является одним из органов, наиболее часто вовлекаемых в воспалительный процесс при КВ [10-12]. Дерматологическая симптоматика имеет определяющее значение в диагностике не только кожной формы заболевания, но и СКВ. По данным литературы [13], примерно у 20-25% больных кожный синдром является начальным проявлением системного заболевания, у 60-70% высыпания на коже появляются на разных этапах болезни. Закономерна высокая первичная обращаемость больных с жалобами на высыпания на коже в специализированные дерматологические клиники, а это, в свою очередь, обусловливает необходимость знания и использование диагностического алгоритма клинико-лабораторного обследования пациентов для исключения или своевременного определения волчаночного процесса.
В связи с этим представляют интерес два клинических наблюдения.
Клинический случай 1
Под нашим наблюдением находилась больная N., 1957 года рождения, направленная районным дерматологом с предположительным диагнозом «красный плоский лишай, атрофическая форма, L 43» с целью коррекции терапии. На момент обращения пациентка считала себя больной 9 мес и предъявляла жалобы на единичное безболезненное мягкое при пальпации высыпание на коже спины до 7 см в диаметре в области поясницы: первоначально в виде буровато-красного пятна, которое позже приобрело характер «выпуклого и неровного элемента» с нечеткими прерывистыми границами (рис. 1, a).

Данные гистопатологической экспертизы: «Эпидермис с орто- и парагиперкератозом, вакуолизацией базального слоя, истончен. На отдельных участках отмечается утолщение базальной мембраны. В ретикулярной дерме — склероз, дегенеративные изменения коллагеновых волокн, отложение муциноподобного вещества, периваскулярные лимфогистиоцитарные с единичными плазматическими клетками инфильтраты. Часть мелких сосудов с явлениями лимфоцитарного васкулита. Волосяные фолликулы, сальные и потовые железы в биоптате отсутствуют. Гистологические изменения более всего соответствуют «старому» элементу глубокой КВ».
В связи с выявленными изменениями в лабораторных анализах, с учетом результатов патоморфологического исследования и впервые возникшими жалобами на болезненность коленных и голеностопных суставов, периодически возникающее онемение пальцев кистей, усилившееся выпадение волос, потерю веса и общую слабость пациентке были рекомендованы консультация и обследование у ревматолога с целью исключения системности процесса. В течение последующего месяца пациентка была госпитализирована в ревматологический стационар с уточненным диагнозом «СКВ, хронического течения, ативность 2 (SLEDAI 16 баллов) с поражением кожи, суставов, почек, трофическими нарушениями (алопеция, похудание), полинейропатией, гематологическими и иммунологическими нарушениями. Вторичный антифосфолипидный синдром». Фотодокументальный анализ клинического наблюдения позволяет констатировать, что на фоне системной терапии наблюдалась достоверная тенденция к редукции патологических высыпаний на коже спины (см. рис. 1, б).
Клиническое наблюдение 2
Больной Х., 1961 года рождения, направлен районным дерматологом с предположительным диагнозом «пиодермия волосистой части головы, приводящая к облысению, L 66.2» с целью коррекции терапии. На момент обращения пациент считал себя больным в течение 2 лет и предъявлял жалобы на периодически возникающий интенсивный зуд кожи волосистой части головы, высыпания в виде узелковых и сливных гнойничковых элементов и очаговую потерю волос (рис. 2).

Для диагностики заболеваний волосистой части головы визуальная оценка патологического процесса не всегда полноценна и недостаточно объективна. Дифференциальную диагностику следует проводить между нутриционными нарушениями, побочными эффектами лекарственных препаратов, нарушением поведения (трихотилломания), микотическим инфицированием, эндокринными, инфекционными, воспалительными и аутоиммунными заболеваниями, одним из которых является КВ [9, 13-16]. С целью верификации клинических вариантов алопеций, особенно рубцующих форм, важнейшее значение традиционно придается гистологическому исследованию кожи скальпа [17, 18]. У обследуемого пациента произведена биопсия двух образцов кожи с разных участков головы.
Гистологическое описание первого образца:
«В эпидермисе субатрофические изменения эпителия. В поверхностных слоях дермы продуктивные васкулиты сосудов микроциркуляции с периваскулярными лимфомакрофагальными инфильтратами и неравномерным склерозом». Гистологическое описание второго образца: «В эпидермисе субатрофические изменения эпителия. В поверхностных слоях дермы массивные очаговые лимфомакрофагальные инфильтраты, располагающиеся преимущественно в периваскулярной ткани и распространяющиеся по ходу сосудов и в жировую клетчатку. В дерме и жировой клетчатке обнаруживаются продуктивные васкулиты сосудов микроциркуляции с периваскулярными лимфомакрофагальными инфильтратами и неравномерным склерозом. Воспалительный инфильтрат также распространяется на волосяные фолликулы, что приводит к дистрофическим изменениям эпителия луковицы, вплоть до гибели одного из фолликулов с замещением его рубцовой тканью. Отмечается склероз дермы. Сальные железы в препарате отсутствуют. Встречаются единичные потовые железы в состоянии субатрофии».
Заключение по препаратам: «Сочетание воспалительного лимфомакрофагального инфильтрата со склерозом дермы и васкулитами микрососудов, а также с атрофическими изменениями эпидермиса и придатков кожи свидетельствуют в пользу диагноза дискоидной КВ».
В работе дерматолога, несмотря на наглядность проявлений кожных заболеваний и кажущуюся простоту определения дерматоза, ежедневно возникают диагностические ситуации, требующие адекватной оценки анамнеза заболевания, навыков ассоциативного, клинического мышления, взвешенного подхода к тем или иным диагностическим тестам, объективной оценки их информативности для последующей верификации диагноза, умения правильно и критически осмысливать результаты обследования пациента. Диагностический процесс усложняется не только открытием новых заболеваний. В нашей стране нет официальных статистических данных о врачебной некомпетентности. Однако согласно некоторым источникам, в Российской Федерации примерно у 40% больных зарегистрированы диагностические ошибки [19, 20]. В свете этого, нам кажется, что практика обсуждения клинических случаев диагностических удач и ошибок является наиболее продуктивной в рамках, пусть и одностороннего, но профессионального общения.
Разбор клинических ситуаций — это минимизация вероятностного характера диагностического процесса, профилактика возможных последующих неблагоприятных исходов оказания медицинской помощи и выявление потенциально новых подходов к работе с каждым конкретным пациентом. Представленные нами клинические наблюдения наглядно иллюстрируют такой подход.
В заключение хотелось бы отметить, что при оперативной диагностике системных и нетипично протекающих форм аутоиммунных заболеваний предполагается максимально раннее начало базисной терапии, повышается эффективность последующей поддерживающей терапии и качество жизни пациентов, а риск развития вторичных изменений и прогноз течения болезни улучшаются.
Системная красная волчанка
Утратил силу — Архив
РЦРЗ (Республиканский центр развития здравоохранения МЗ РК)
Версия: Клинические протоколы МЗ РК — 2016 (Казахстан)
Категории МКБ:
Системная красная волчанка (M32)
Разделы медицины:
Ревматология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией По качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «29» сентября 2016 года
Протокол №12
Системная красная волчанка (СКВ) – это хроническое воспалительное аутоиммунное заболевание неизвестной этиологии, с разнообразием проявлений, течений и прогноза. Заболевание характеризуется периодами относительной ремиссии и обострения, которые могут вовлекать любой орган или систему в различных комбинациях.
В патогенез СКВ вовлечены генетические, иммунологические, гормональные факторы и условия среды.
Соотношение кодов МКБ-10 и МКБ-9[1-7]:
| Код | МКБ-10 | Код | МКБ-9 |
| M32 | Системная красная волчанка | — | — |
| M32.0 | Лекарственная системная красная волчанка | — | — |
| M32.1 | Системная красная волчанка с поражением других органов или систем | — | — |
| M32.8 | Другие формы системной красной волчанки | — | — |
|
M32.9 |
Системная красная волчанка неуточненная | — | — |
Дата разработки протокола: 2016 год (пересмотренный с 2013 года).
Пользователи протокола: врачи общей практики, терапевты, ревматологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация [1-3,5]:
I. По характеру течения, началу болезни и дальнейшему прогрессированию:
· Острое течение болезни характеризуется быстрым развитием от 3 до 6 месяцев полиорганного поражения с вовлечением жизненно важных органов и систем (почек и ЦНС) и высокой иммунологической активностью.
· Подострое течение протекает волнообразно, с периодическими обострениями и развитием полиорганной симптоматики в течение 2-3 лет. В дебюте возникают конституциональные симптомы, неспецифическое поражение кожи и суставов.
· При первично-хроническом течении длительно превалирует одно или несколько проявлений (дискоидное поражение кожи, артрит, гематологические нарушения, феномен Рейно, эпилептиформные припадки, синдром Шегрена). Множественные органные поражения появляются к 5-10-му году болезни.
II.По степени активности: в соответствии с выраженностью клинических симптомов и уровнем лабораторных показателей:
· очень высокая активность – IV (20 баллов и выше);
· высокая активность – III (11-19 баллов);
· умеренная активность – II (6-10 баллов);
· минимальная активность – I (1-5 баллов);
· отсутствие активности – 0 баллов.
Таблица 1. Индекс активности СКВ SELENA /SLEDAI
| Балл | Проявление | Определение |
| 8 | Эпиприступ | Недавно возникший (в последние 10 дней), исключая метаболические, инфекционные и лекарственные причины |
| 8 | Психоз | Нарушение способности выполнять нормальные действия в нормальном режиме вследствие выраженного изменения восприятия действительности, включая органические мозговые синдромы, зрительные нарушения, расстройство со стороны ЧМН, головная боль или нарушение мозгового кровообращения |
| 8 | Зрительные нарушения | Изменения в глазу или на сетчатке, включая клеточные тельца, кровоизлияния, серозный экссудат и геморрагии сосудистой оболочки или неврит зрительного нерва, склерит, эписклерит. Исключить случаи подобных изменений при гипертензии, инфекции и лекарственных воздействиях |
| 8 | Расстройство со стороны черепно-мозговых нервов | Впервые возникшая чувствительная или двигательная невропатия ЧМН, включая вертиго, развившаяся вследствие волчанки |
| 8 | Головная боль | Выраженная персистирующая головная боль (может быть мигренозной), не отвечающая на наркотические анальгетики |
| 8 | Нарушение мозгового кровообращения | Впервые возникшее, исключая развившееся вследствие атеросклероза и гипертензии |
| 8 | Васкулит | Язвы, гангрена, болезненные узелки на пальцах, околоногтевые инфаркты и геморрагии или данные биопсии или ангиограммы, подтверждающие васкулит |
| 4 | Артрит | Более 2-х болезненных суставов с признаками воспаления (болезненность, отек или выпот) |
| 4 | Миозит | Проксимальная мышечная боль/слабость, ассоциированная с повышенным уровнем КФК/альдолазы или данные ЭМГ или биопсии, подтверждающие миозит |
| 4 | Цилиндрурия | Зернистые или эритроцитарные цилиндры |
| 4 | Гематурия | >5 эритроцитов в поле зрения, исключая камни, инфекционные и другие причины |
| 4 | Протеинурия | Острое начало или недавнее появление в количестве >0,5 г/сутки |
| 4 | Пиурия | >5 лейкоцитов в поле зрения, исключая инфекционные причины |
| 2 | Высыпания | Новые или продолжающиеся высыпания на коже воспалительного характера |
| 2 | Алопеция | Впервые возникшее или продолжающееся повышенное очаговое или диффузное выпадение волос вследствие активности волчанки |
| 2 | Язвы слизистых оболочек | Впервые возникшее или продолжающееся изъязвление слизистых оболочек рта и носа вследствие активности волчанки |
| 2 | Плеврит | Боль в грудной клетке с шумом трения плевры, или выпотом, или утолщение плевры вследствие волчанки |
| 2 | Перикардит | Перикардиальная боль с одним из следующих признаков: шум трения перикарда, ЭКГ подтверждение |
| 2 | Низкий комплемент | Снижение СН50, С3 или С4 ниже границы нормы тестирующей лаборатории |
| 2 | Повышение уровня антител к ДНК | >25% связывания по методу Farr или превышение нормальных значений тестирующей лаборатории |
| 1 | Лихорадка | >380С, исключить инфекционные причины |
| 1 | Тромбоцитопения | <100 000 клеток/мм3 |
| 1 | Лейкопения | <3 000 клеток/мм3, исключая лекарственные причины |
| ВСЕГО |
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ[1-7, 9-13,21]
Диагностические критерии
Жалобы:
· усталость, слабость, быстрая утомляемость, похудание;
· повышение температуры без видимой причины;
· боли или отечность крупных и мелких суставов;
· боли в мышцах;
· покраснения кожи щек и носа — симптом «бабочки», покраснение зоны декольте, усиливающееся от волнения, пребывания на солнце, воздействия мороза и ветра; высыпания на коже;
· выпадение волос;
· язвы на слизистых губ, полости рта, носоглотки;
· одышка, кашель, боли в грудной клетке, в области сердца;
· головная боль;
· судороги (при исключении метаболических, инфекционных и лекарственных причин);
· синяки на коже и другие разнообразные жалобы
Анамнез [1, 3, 6]:
Следует уточнить:
· предшествовавшие началу СКВ — перенесенная вирусная инфекция, вакцинация, чрезмерное пребывание на солнце, роды, аборт, тяжелые эмоциональные переживания, аллергия на медикаменты и пищевые продукты;
· сведения о наличии в роду родственников, страдающих СКВ, ССЗ;
· наличие вредных привычек (курение, алкоголь);
· прием контрацептивов, гормональных препаратов;
· для верификации вторичного АФС: наличие тромбозов, патологии беременности (внутриутробная гибель плода, преждевременные роды, спонтанные аборты).
Физикальное обследование:
Клинические проявления СКВ зависят от пораженной системы органов.
При поражении кожи и слизистых оболочек – сыпь на скулах в виде фиксированной эритемы на скуловых выступах, имеющая тенденцию к распространению к носогубной зоне; дискоидная сыпь в виде эритематозных приподнимающихся бляшек с прилипающими кожными чешуйками и фолликулярными пробками, на старых очагах могут быть гиперпигментации с атрофическими изменениями кожи; высыпания в виде красных колец с более бледной кожей внутри кольца, изъязвление губ, полости рта или носоглотки, обычно безболезненное; поражение сосудов кожи: васкулиты (капилляриты) — точечные эритемы на концевых фалангах пальцев рук, ладонях; высыпания геморрагического характера (геморрагические петехии); бледность кожных покровов.
При поражении костно-суставной системы: неэрозивные артриты, с поражением 2 или более периферических суставов, с болезненностью, отёком и выпотом.
При поражении легких: шум трения плевры, при поражении сердца – шум трения перикарда.
При поражении почек: отеки, которые располагаются на лице, особенно на веках [1,3,6].
Таблица 2- Диагностические критерии для СКВ.
| ПРИЗНАК | ОПРЕДЕЛЕНИЕ |
| Сыпь на скулах | Фиксированная эритема, плоская или возвышающаяся, на скуловых выступах, имеющая тенденцию к распространению к носогубной зоне |
| Дискоидная сыпь | Эритематозные возвышающиеся бляшки с прилегающими кожными чешуйками и фолликулярными пробками; на старых очагах могут быть атрофические рубцы |
| Фотосенсибилизация | Кожная сыпь, возникающая в результате необычной реакции на солнечный свет |
| Язвы в ротовой полости | Изъязвление полости рта или носоглотки; обычно безболезненное |
| Неэрозивный артрит | Поражающий 2 или более периферических сустава, проявляющийся болезненностью, отёком и выпотом |
| Плеврит или перикардит |
Плеврит (плевральные боли, или шум трения плевры, или наличие плеврального выпота), или Перикардит (подтверждённый с помощью эхокардиографии или выслушиванием шума трения перикарда) |
| Поражение почек |
Персистирующая протеинурия >0,5 г/сут, или Цилиндрурия (эритроцитарная, гемоглобиновая, зернистая или смешанная) |
| Поражение ЦНС | Судороги или психоз (в отсутствие, являющихся причиной, приёма ЛС или метаболических нарушений) |
| Гематологические нарушения |
Гемолитическая анемия с ретикулоцитозом, или Лейкопения <4,0х109/л (зарегистри-рованная ≥2 раз), или Лимфоцитопения < 1,5х109/л (зарегистрированная ≥ 2 раз), или Тромбоцитопения < 100х109/л (в отсутствии являющегося причиной, приёма ЛС) |
| Иммунологические нарушения |
Анти-ДНК: антитела к анти-дсДНК в повышенном титре, или Анти-Sm: наличие антител к антигену Смита, или Положительный результат на антифосфолипидные антитела на основании: 1). Увеличение уровня IgG или IgM антител кардиолипину 2). Положительный тест на волчаночный антикоагулянт при использовании стандартных методов, или 3). Ложноположительный тест на сифилис, в течение как минимум 6 мес |
|
Положительный тест на антинуклеарные антитела |
Повышение титров антинуклеарных антител методом иммунофлуоресценции или эквивалентным методом, в любом промежутке времени, при отсутствии приёма ЛС, вызывающих волчаночноподобный синдром |
Диагноз СКВ (см. таблицу 2) должен быть обоснован наличием клинических проявлений и данными лабораторных исследований. Для подтверждения диагноза требуется не менее 4 из 11 критериев.
В случае включения пациента в клиническое исследование рекомендуется использовать диагностические критерии, согласно которым для установления диагноза СКВ должно быть 4 критерия, один из которых должен быть иммунологический ( любой из: а-ДНК, АНФ, Sm, a—KL, C3, C4).
Таблица 3- Диагностические критерии СКВ.
| КЛИНИЧЕСКИЕ КРИТЕРИИ: | |||
| 1 | Острое, активное поражение кожи: | ||
| q | Сыпь на скулах (не учитываются дискоидные высыпания) | ||
| q | Буллезные высыпания | ||
| q | Токсический эпидермальный некроз как вариант СКВ | ||
| q | Макулопапулезная сыпь | ||
| q | Фотосенсибилизация: кожная сыпь, возникающая в результате реакции на | ||
| солнечный свет | |||
| q | Или подострая кожная волчанка (неиндурированные псориазоформные и/или | ||
| круговые полициклические повреждения, которые проходят без образования | |||
| рубцов, но с возможной поствоспалительной депигментацией или телеангиоэктазиями) | |||
| 2 | Хроническая кожная волчанка: | ||
| q | Классическая дискоидная сыпь | ||
| q | Локализованная (выше шеи) | ||
| q | Генерализованная (выше и ниже шеи) | ||
| q | Гипертрофические (бородавчатые) поражения кожи | ||
| q | Панникулит | ||
| q | Поражение слизистых | ||
| q | Отечные эритематозные бляшки на туловище | ||
| q | Капилляриты (Красная волчанка обморожения, Гатчинсона, проявляющаяся поражением | ||
| кончиков пальцев, ушных раковин, пяточных и икроножных областей) | |||
| q | Дискоидная красная волчанка по типу красного плоского лишая или overlap | ||
| 3 | Язвы слизистых: (В отсутствии следующих причин, таких как: васкулит, болезнь Бехчета ¸ инфекция вирусом герпеса, воспалительные заболевания кишечника, реактивный артрит, и употребление кислых пищевых продуктов) | ||
| q | Ротовой полости | ||
| q | неба | ||
| q | щек | ||
| q | языка | ||
| q | Носовой полости | ||
| 4 |
Нерубцовая алопеция: (диффузное истончение волос или повышенная хрупкость волос с видимыми обломанными участками) (В отсутствии следующих причин, таких как: очаговая алопеция, лекарственная, вследствии дефицита железа, и андрогенная ) |
||
| 5 | Артрит: | ||
| q | Синовит с участием 2 или более суставов, характеризующееся отеком или выпотом | ||
| q | Или Болезненность 2 или более суставов и утренняя скованность по крайней мере 30 минут | ||
| 6 | Серозит: | ||
| q | Типичный плеврит в течении более чем 1 дня | ||
| q | Или Плевральный выпот | ||
| q | Или шум трения плевры | ||
| q | Типичная перикардиальная боль (боль в положении лежа, купирующаяся при положении сидя с наклоном вперед) в течении более чем 1 дня | ||
| q | Или Перикардиальный выпот | ||
| q | Или шум трения перикарда | ||
| q | Или электрокардиографические признаки перикардита (В отсутствии следующих причин, таких как: инфекция, уремия, и перикардит Дресслера) | ||
| 7 | Поражение почек: | ||
| q | Соотношение уровня белок/креатинин (или суточная протенурия) в моче, более 500 мг белка за 24 часа | ||
| q | Или эритроциты в моче 5 или более или цилиндры в моче 5 или более | ||
| 8 | Нейропсихические поражения: | ||
| q | Эпилептический приступ | ||
| q | Психоз | ||
| q | Моно/полиневрит (в отсутствии других причин, таких как первичный васкулит) | ||
| q | Миелит | ||
| q | Патология черпно-мозговых нервов/периферическая нейропатия (в отсутствии других причин, таких как: первичный васкулит, инфекции и сахарного диабета) | ||
| q | Острое нарушение сознания (в отсутствие других причин, в том числе токсических / метаболических, уремии, лекарственных) | ||
| 9 | Гемолитическая анемия: | ||
| 10 | q | Лейкопения (<4,0 х10 9 /л по крайней мере один раз) (в отсутствии других причин, таких как: синдром Фелти, лекарственные и портальной гипертензии) | |
| q | Или Лимфопения (<1,0 х10 9 /л по крайней мере один раз (в отсутствии других причин, таких как: кортикостероиды, лекарства, и инфекция) | ||
| 11 | Тромбоцитопения (<100 х10 9 /л по крайней мере один раз) (в отсутствии других причин, таких как: лекарства, портальная гипертензия, и тромботическая тромбоцитопеническая пурпура) | ||
| ИММУНОЛОГИЧЕСКИЕ КРИТЕРИИ: | |||
| 1 | ANA выше уровня диапазона референс-лаборатории | ||
| 2 | Anti—dsDNA выше уровня диапазона референс-лаборатории (или >2-х кратного увеличения методом ELISA) | ||
| 3 | Anti—Sm наличие антител к ядерному антигену Sm | ||
| 4 | Антифосфолипидные антитела положительные определенные любым из следующих способов: | ||
| q | Положительный волчаночный антикоагулянт | ||
| q | Ложно положительная реакция Вассермана | ||
| q | Средний или высокий титр антител к кардиолипину уровня (IgA, IgG, или IgM) | ||
| q | Положительный результат теста на анти-β2-гликопротеин I (IgA, IgG,или IgM) | ||
| 5 | Низкий комлемент | ||
| Низкий С3 | |||
| Низкий С4 | |||
| Низкий СH50 | |||
| 6 | Положительная р-ция Кумбса при отсутствии гемолитической анемии |
□ Клинические критерии
□ Иммунологические критерии
Диагностические критерии вторичного АФС при СКВ [1,3]:
АФС диагностируется на основании наличия одного клинического и одного лабораторного критерия. АФС исключается, если имеют место аФЛ без клинических проявлений или клинические проявления без аФЛ в течение менее 12 недель или более 5 лет. Наличие врожденных или приобретенных факторов риска тромбозов не исключают АФС. Клинические критерии АФС:
· Тромбоз – один или более эпизодов артериального, венозного тромбоза или тромбоза мелких сосудов в любом органе;
· Патология беременности – один или более случай внутриутробной гибели морфологически нормального плода после 10-й недели гестации, или один или более случай преждевременных родов морфологически нормального плода до 34-й недели гестации, или три или более последовательных случая спонтанных абортов до 10-й недели гестации;
· Лабораторные критерии АФС:
− AT к кардиолипину (IgG и/или IgM) в крови в средних или высоких титрах в 2 или более исследованиях с промежутком не менее 12 нед;
− Волчаночный антикоагулянт в плазме крови в 2 или более исследованиях с промежутком не менее 6 нед;
− AТ к β2-ГП I изотипов IgG или IgM в средних или высоких титрах в 2 или более исследованиях с промежутком не менее 12 нед (стандартный ИФА).
Критерии диагностики волчаночного нефрита [16,19]:
· Клинические и лабораторные проявления в виде протеинурии > 0,5 г в сутки (или более 3 «+» при определении тест-полоской), и/или
· Наличие клеточных скоплений, включая скопления эритроцитов и цилиндров (гемоглобиновых, зернистых, тубулярных или смешанных);
− Результаты гистологического исследования биоптата почки с подтверждением наличия характерного для ВН иммунокомплексного поражения почек;
· Биопсия почки с диагностической целью показана всем пациентам с СКВ с клиническими признаками активного ВН (при отсутствии строгих противопоказаний). Результаты гистологического исследования биоптата почки являются единственным надежным методом диагностики ВН (рекомендации EULAR), необходимым для инициации терапии.
Лабораторные исследования [1,3,6]:
· ОАК (6 параметров): увеличение СОЭ, лейкопения (обычно лимфопения), тромбоцитопения; возможно развитие аутоиммунной гемолитической анемии, гипохромной анемии, связанной с хроническим воспалением, скрытым желудочным кровотечением или приемом некоторых ЛС.
· ОАМ: протеинурия, гематурия, лейкоцитурия, цилиндрурия.
· Коагулограмма: определение функций адгезии и агрегации тромбоцитов: контроль гемостаза, маркеров тромбоза при АФС, контроль тромбоцитарного звена гемостаза; гиперкоагуляция при АФС.
· БАК (креатинин, общий белок, альбумин, АЛТ, АСТ, общий и прямой билирубин, общий холестерин, глюкоза, СРБ, сывороточное железо);
· определение СКФ.
Иммунологические исследования [1,3, 6, 9-12]:
· определение антинуклеарных антител методом АНА на клетках Нер-2 с помощью непрямой иммунофлюоресценции или эквивалентным методом (при первичном установлении диагноза), анти-дсДНК, С3-С4 компоненты комплемента;
· при установленном диагнозе с целью мониторинга активности СКВ: анти-дсДНК, С3-С4 компоненты комплемента;
· реакция микропреципитации с кардиолипиновым антигеном на сифилис;
· исследование кала на гельминты и простейшие;
Инструментальные исследования:
· рентгенография ОГК или флюрография;
· ЭКГ;
· ЭхоКГ (при поражении сердца);
· УЗИ ОБП, УЗИ почек;
· Денситометрия.
Диагностический алгоритм: Алгоритм диагностики СКВ
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ [1-4,8,9,12,13,16,17,20,21]
Диагностические критерии: см. амбулаторный уровень.
Диагностический алгоритм: см. амбулаторный уровень.
Перечень основных диагностических мероприятий:
Лабораторное обследования:
· ОАК;
· БАК: общий белок, белковые фракции, мочевина, креатинин, АЛТ, АСТ, билирубин, прямой билирубин, общий холестерин, глюкоза;
· определение СКФ по формуле Кокрофта-Голта;
· коагулограмма;
· ОАМ.
Инструментальные исследования: см. амбулаторный уровень.
Перечень дополнительных диагностических мероприятий:
Лабораторные исследования:
· калий, натрий, кальций, сывороточное железо, определение общей альфа-амилазы в сыворотке;
· определение суточной протеинурии в моче;
· обнаружение скрытой крови в кале;
· бактериологическое исследование мочи;
· ИФА (определение антигена и антител к вирусам гепатитов В и С);
· ИФА (определение антигена и антител к ВИЧ);
· Прокальцитонин;
· кровь на стерильность.
Инструментальные исследования:
· ЭхоКГ (при поражении сердца);
· УЗИ ОБП, почек;
· УЗДГ сосудов головы, шеи, верхних и нижних конечностей – для диагностики поражения сосудов;
· ФГДС – для мониторинга осложнений;
· Пункционная биопсия почки – для определения морфологического типа люпус нефрита;
· МРТ головного мозга-для диагностики поражения ЦНС.
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [1,2,4,11]:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Ревматоидный артрит | Преимущественное поражение женщин, симметричный полиартрит мелких суставов кистей, висцеральные проявления (дигитальный артериит, полисерозиты, поражение почек). У 25% больных РА выявляют положительный тест на АНФ | ИФА : АЦЦП, РФ, рентген кистей с захватом лучезапястных суставов |
Поражение суставов носит стойкий, прогрессирующий характер. Выражена утренняя скованность. По мере прогрессирования заболевания развиваются деструкция суставных поверхностей и деформации суставов. Типичные эрозивные изменения на рентгенограммах. Тяжелое поражение внутренних органов встречается относительно редко. |
| Синдром Стилла у взрослых | Поражение суставов, миалгии, высокая лихорадка, пятнисто-папулезная сыпь, лимфоаденопатия, спленомегалия, серозит |
Определение ферритина в крови УЗИ оганов брюшной полости |
В период активности — нейтрофильный лейкоцитоз (а не лейкопения, как при СКВ). Тест на АНФ отрицательный. Кожные изменения носят кратковременный характер. |
| Системные васкулиты | Лихорадка, поражение кожи, суставов, почек, ЦНС, легких |
Иммунологические исследования (АНЦА). УЗДГИ сосудов |
Чаще болеют мужчины (за исключением неспецифического аортроартериита). Нередко триггером бывает инфекции (вирусная, бактериальная). Клиническая симптоматика определяется ишемическими изменениями в органах и тканях вследствие воспаления и некроза сосудистой стенки. Поражение нервной системы преимущественно в виде множественных мононевритов. Лейкоцитоз, тромбоцитоз, положительные АНЦА |
| Системная склеродермия | Симметричный полиартрит, синдром Рейно, полисерозит, конституциональные нарушения | Иммунологические исследования: антицентромерные антитела, АНФ, антитела к Scl-70, биопсия кожно-мышечного лоскута. | Типичные изменения кожи и подкожной клетчатки (уплотнение, атрофия, нарушение пигментации), суставов (преобладание фиброзных изменений), ЖКТ. Рентгенологические признаки (остеолиз, резорбция концевых фаланг), кальциноз мягких тканей. |
| Синдром лекарственной волчанки | Полиартрит, кожный синдром, фотосенсибилизация, гепатоспленомегалия, полисерозит, лихорадка, лейкопения, положительный анализы на АНФ, LE-клетки). | В анамнезе длительный прием лекарственного средства, способного индуцировать волчаночноподобный синдром (антигипертензивные, антиаритмические, противосудорожные препараты, сульфаниламиды, пероральные контрацептивы). | Редко встречают тяжелое поражение почек и ЦНС, тромбоцитопению. После отмены лекарственного препарата клиническая симптоматика регрессируют в течение 4-6 нед (положительный тест на АНФ сохраняется до 1 года). |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Азатиоприн (Azathioprine) |
| Азитромицин (Azithromycin) |
| Алпростадил (Alprostadil) |
| Альбумин человека (Albumin human) |
| Амлодипин (Amlodipine) |
| Амоксициллин (Amoxicillin) |
| Атенолол (Atenolol) |
| Ацетилсалициловая кислота (Acetylsalicylic acid) |
| Белимумаб (Belimumab) |
| Валсартан (Valsartan) |
| Верапамил (Verapamil) |
| Гепарин натрия (Heparin sodium) |
| Гидроксихлорохин (Hydroxychloroquine) |
| Гидрохлоротиазид (Hydrochlorothiazide) |
| Декстран (Dextran) |
| Дигоксин (Digoxin) |
| Диклофенак (Diclofenac) |
| Дилтиазем (Diltiazem) |
| Дипиридамол (Dipyridamole) |
| Иммуноглобулин человеческий нормальный (Human normal immunoglobulin) |
| Клавулановая кислота (Clavulanic acid) |
| Лозартан (Losartan) |
| Лорноксикам (Lornoxicam) |
| Мелоксикам (Meloxicam) |
| Метилпреднизолон (Methylprednisolone) |
| Метопролол (Metoprolol) |
| Метотрексат (Methotrexate) |
| Микофеноловая кислота (Микофенолата мофетил) (Mycophenolic acid (Mycophenolate mofetil)) |
| Надропарин кальция (Nadroparin calcium) |
| Пентоксифиллин (Pentoxifylline) |
| Плазма свежезамороженная |
| Преднизолон (Prednisolone) |
| Фозиноприл (Fosinopril) |
| Фуросемид (Furosemide) |
| Цефазолин (Cefazolin) |
| Циклоспорин (Cyclosporine) |
| Циклофосфамид (Cyclophosphamide) |
| Эналаприл (Enalapril) |
| Эноксапарин натрия (Enoxaparin sodium) |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ[1-7, 9-13,21]
Тактика лечения [4,5,7-10,13,21]
Немедикаментозное лечение:
· Общие рекомендации.
· Всем пациентам с СКВ необходима образовательная программа с целью обеспечения информации, знаний и навыков для самоконтроля заболевания. Необходимо исключить психоэмоциональную нагрузку, уменьшить пребывание на солнце, использовать защитные средства от ультрафиолетовых лучей, активно лечить сопутствующие инфекционные заболевания. В период обострения заболевания и на фоне лечения цитотоксическими препаратами необходима эффективная контрацепция (уровень рекомендации А для безопасных пероральных контрацептивов). Не следует принимать пероральные контрацептивы с высоким содержанием эстрогенов, поскольку они могут вызывать обострение СКВ.
· С целью профилактики остеопороза рекомендуется: прекращение курения, употребление пищи с высоким содержанием кальция и витамина D; физические упражнения.
· С целью профилактики атеросклероза, диабета рекомендуется: диета с низким содержанием жиров и холестерина, прекращение курения, контроль массы тела, физические упражнения.
Режим: II, свободный;
Стол №15.
Медикаментозное лечение:
Лечение должно быть максимально индивидуализированным в зависимости от клинических проявлений и активности заболевания. Ведение пациента с СКВ должно основываться на общих решениях между информированным пациентом и его врачом. Ведение пациентов с СКВ требует проведения регулярного мониторинга и коррекции терапии при неудовлетворительном контроле активности СКВ.
Независимо от применения других препаратов, особое значение следует придавать применению противомалярийных препаратов.
Строго рекомендуется раннее распознавание и лечение поражения почек.
При волчаночном нефрите рекомендуется как минимум 3-х летняя иммуносупрессивная поддерживающая терапия после индукционной терапии.
Поддерживающее лечение при СКВ должно быть направлено на снижение до минимальной, по возможности, вплоть до полной отмены, дозы ГКС, требуемой для контроля активности заболевания.
Профилактика и лечение АФС при СКВ. Принципы лечения не отличаются от лечения первичного АФС
Следует помнить, что больные СКВ обычно имеют склонность к развитию аллергических реакций на многие антибактериальные ЛС, в особенности сульфаниламидные.
Перечень основных лекарственных средств:
| Лекарственное средство (международное непатентованное название) | Фармакологические группы | Способ введения | Разовая доза | Кратность применения | Длительность курса лечения | Уровень доказательности |
| Глюкокортикостероиды | ||||||
|
Метилпреднизолон |
Синтетичский глюкокортикостероидный гормональный препарат | Внутрь | 4мг- | 3-4 р в сутки; | длительно | УД – А [6, 20,21,22, 23] |
| Метилпреднизолон | Синтетический глюкокортикостероидный гормональный препарат |
внутрь |
16мг | 1-2 р в сутки | длительно | УД – А [6, 20,21,22, 23] |
| Преднизолон | Синтетический глюкокортикостероидный гормональный препарат |
внутрь |
5мг-60мг в сутки | 3–4 р в сутки | длительно | УД – А [6, 20,21,22, 23] |
|
Метилпреднизолон |
Синтетический глюкокортикостероидный гормональный препарат |
в/в |
500мг- | 1-2 р в сутки | курсами | УД – А [6, 20,21,22, 23] |
| Преднизолон | Синтетический глюкокортикостероидный гормональный препарат | в/в | 30мг | 3-5р в сутки | курсами | УД – А [6, 20,21,22, 23] |
| Базисные противовоспалительные препараты | ||||||
|
Циклофосфамид |
цитостатик |
в/в |
200 мг | 400-1000мг раза в сутки |
1-2 раза в месяц курсами |
УД – А [6, 20,21,22, 24] |
|
Микофенолата мофетил |
цитостатик |
внутрь |
250-500 мг | 2-4 р в сутки | длительно | УД – А/В [6, 20,21, 22, 25,26] |
| Азатиоприн | цитостатик | внутрь | 50мг | 1-2р в сутки | длительно |
УД – В [6, 20,21,22 22,25] |
| Циклоспорин | Циклоспорин | внутрь | 25-50мг | 2-3р в сутки | длительно |
УД – В [6,20,21,22, 27] |
| Гидроксихлорохин | Аминохинолиновые производные | внутрь | 200мг | 1-2р в сутки | длительно |
УД – А [6,21,22,28] |
| Метотрексат | цитостатик | внутрь | 2,5мг | 3-4рв неделю | длительно | УД – А [6,20,21,22,29] |
| метотрексат | цитостатик | подкожно | 15-20мг | 1р в неделю | длительно | УД – А [6,20,21,22,29] |
Перечень дополнительных лекарственных средств:
| Лекарственное средство (международное непатентованное название) | Фармакологические группы | Способ введения | Разовая доза | Кратность применения | Длительность курса лечения | Уровень доказательности |
| Нестероидные противовоспалительные препараты | ||||||
| Диклофенак | Производный уксусной кислоты | Внутрь | 75-200 мг | 1-3р в сутки | курсами | УД – D [6] |
| Диклофенак натрия | Производный уксусной кислоты | в/м | 75 мг | 1-2р в сутки | курсами | УД – D [6] |
| мелоксикам | производное оксикама, селективный ингибитор ЦОГ-2 | Внутрь | 7,5-15 мг | 1-2 р в сутки | курсами | УД – D [6] |
| лорноксикам | производное оксикама, селективный ингибитор ЦОГ-2 | Внутрь | 8-32мг в сутки | 1-2 р в сутки | курсами | УД – D [6] |
| лорноксикам | производное оксикама, селективный ингибитор ЦОГ-2 | в/м, в/в | 8-32мг в сутки | 1-2 р в сутки | курсами | УД – D [6] |
| Генно-инженерные биологические препараты | ||||||
| Белимумаб | человеческий моноклональный антитела класса IgGλ, | в/в | 10 мг/кг | 1 р в 0, 14, 28 дни; | курсами | УД – А [6,20,21,22,30] |
|
Иммуноглобулин человека нормальный |
||||||
| Иммуноглобулин человека нормальный | Иммуноглобулин | в/в | 0,4-2г/кг/сут | 3-5 дн | курсами | УД – С [33] |
| Антиагреганты | ||||||
| Ацетилсалициловая кислота | Производное салициловой кислоты | внутрь | 100мг | 1р в сутки | курсами | УД – D (первичная профилактика АФС); УД – B (у пожилых) [6, 34, 40] |
| Дипиридамол | Ангиопротектор и корректор микроциркуляции | внуть | 25-75 мг | 2-3-р в сутки | курсами | УД – А при АФС у не беременных (втор профилактика) [6] |
| Антикоагулянты | ||||||
| Гепарин | Антикоагулянт прямого действия | п/к | 5000-7500 МЕ | 3-4р в сутки | 5-7дней |
УД – А при АФС у беременных [6, 35,40] |
| Эноксапарин натрия | Антикоагулянт прямого действия | п/к | 140 мг/0,4 мл | 1-2 р в сутки | 5-7дней | УД – А при АФС у беременных [6, 40] |
| Надропарин кальция | Антикоагулянт прямого действия | п/к | 23800-8550 МЕ | 1-2р в сутки | 5-7дней | УД – А при АФС у беременных [6, 40] |
| Ангиопротекторы | ||||||
| Пентоксифиллин |
Селективные ингибиторы обратного захвата серотонина |
в/в | 100-300 мг | 1р в сутки | 5-10дн | УД – С [36] |
| Алпростадил | Синтетический аналог естественного простагландина E1 | в/в | 140-60 мкг | 1р в сутки | 5-10дн | УД – D [37] |
| Ингибиторы АПФ | ||||||
| Эналаприл | гипотензивное, вазодилатирующее, кардиопротективное, натрийуретическое | внутрь | 5-40 мг | 1-2р в сутки | длительно | УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] |
| Фозиноприл | гипотензивное, вазодилатирующее, кардиопротективное, натрийуретическое | внутрь | 10-20 мг | 1раз в сутки | длительно |
УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] |
| Антагонисты кальция | ||||||
| Амлодипин | Антогонист кальциевых каналов | внутрь | 5-10 мг | 1р в сутки | длительно | УД – В [6, 20,21,40] |
| Дилтиазем | Антогонист кальциевых каналов | внутрь | 180-360 мг | 2 р в сутки | длительно | УД – В [6, 20,21,40] |
| Верапамил | Антогонист кальциевых каналов | внутрь | 240-480 мг | 3-4 р в сутки | длительно | УД – В [6, 20,21,40] |
| Бета-блокаторы | ||||||
| Атенолол | Бета-адреноблокатор | внутрь | 25-100 мг/сут | 1-2 р в сутки | длительно | УД – С [6, 20,21,40] |
| Метопролол | Бета-адреноблокатор | внутрь | 25-100 мг/сут | 1-2 р в сутки | длительно | УД – С[6, 20,21,40] |
| Блокаторы рецепторов ангиотензина | ||||||
| Лозартан | Антагонист рецепторов ангиотензина II | внутрь | 100 мг | 1 р в сутки | длительно | УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] |
| Валсартан | Антагонист рецепторов ангиотензина II | внутрь | 80-320 мг | 1 р в сутки | длительно |
УД — А (у больных с ВН с протеинурией ≥0,5 г/ сутки) [6,20,21,40] |
| Антибактериальные препараты | ||||||
| Цефазолин | Цефалоспориновый антибиотик I поколения | в/в, в/м | 1 г | 1-2р в сутки | 7-10 дней | УД – D [21, 41-43] |
| Амоксиклав | полусинтетический пенициллин и ингибитор β-лактамаз клавулановая кислота. | в/в | 600мг | 1 раз в сутки | 7-10 дней | УД – D [21, 41-43] |
| Азитромицин | Антибиотик группы макролидов | внутрь | 500 мг | 2раз в сутки | 7-10 дней | УД – D [21, 41-43] |
| Сердечные гликозиды | ||||||
| Дигоксин | Сердечный гликозид | в/в | 0,25-0,5 мг | 1р в сутки | 10дней | УД – GPP |
| Дигоксин | Сердечный гликозид | внутрь | 0,25 мг | 1р в сутки | длительно | УД – GPP |
|
Диуретики |
||||||
| Фуросемид | Петлевой диуретик | в/в,в/м | 20-40мг | 1р в сутки | 5-7дней | УД – D [47] |
| Фуросемид | Петлевой диуретик | внутрь | 20-40мг | 1р в сутки | курсами | УД – D [47] |
| Гидрохлортиазид | производные бензотиадиазина | внутрь | 25-100 мг | 1р в сутки | курсами | УД – D [48] |
· Решение о терапии ГИБП принимает региональная экспертная комиссия (согласно инструкции по проведению ГИБТ).
· Лечение ГИБП проводится под контролем врача-ревматолога, имеющего опыт диагностики и лечения СКВ; Инфузии проводятся в кабинете генно-инженерной терапии согласно инструкции.
Алгоритм действий при неотложных ситуациях: предусмотрено соответствующим протоколом по оказанию скорой неотложной помощи.
Другие виды лечения: нет.
Показания для консультации специалистов:
· консультация нефролога – с целью определения тактики лечения при волчаночном нефрите;
· консультация невролога – в случае развития неврологической симптоматики;
· консультация психиатра – при наличии психотических расстройств для решения вопроса о назначении психотропной терапии, необходимости лечения в специализированном стационаре (психоз, депрессия, сопровождающиеся суицидальными мыслями);
· консультация офтальмолога – для уточнения генеза зрительных нарушений;
· консультация акушер-гинеколога – совместное наблюдение в период беременности;
· консультация хирурга – при наличии боли в животе, сопровождающейся рвотой «кофейной гущей», диареей;
· консультация ангиохирурга – при АФС с тромбозами сосудов;
· консультация эндокринолога – при аутоиммунном тиреоидите и др.эндокринной патологии;
· консультация инфекциониста – при подозрении на развитие интеркуррентной инфекции;
· консультация гастроэнтеролога – при поражении слизистой рта, при дисфагии (часто ассоциируется с феноменом Рейно), при анорексии, тошноте, рвоте, диарее, пептических язвах (их развитие нередко обусловлено побочными эффектами медикаментозной терапии).
Профилактические мероприятия [1-5,7]:
Первичная профилактика: СКВ – это полисистемное аутоиммунное заболевание с невыясненной этиологией и комплексным нарушением иммунной регуляции; в связи с этим в настоящее время первичная профилактика СКВ отсутствует.
Вторичная профилактика:
Вторичная профилактика обострений СКВ (особенно тяжелых обострений) – это достижимая терапевтическая цель при СКВ. Профилактические мероприятия сводятся к предотвращению обострения заболевания и развития побочных эффектов лекарственной терапии:
· Ранее начало лечения СКВ предотвращает повреждение органов и является фактором стабильной ремиссии.
· Своевременная диагностика ВН (путем биопсии почек) и начало иммуносупрессивной терапии снижает частоту ренальных обострений.
· Необходимо установить четкий баланс между терапевтической и токсической дозой препаратов. Рекомендуется снижение дозы кортикостероидов вплоть до полной отмены.
Пациенты с СКВ имеют высокий риск развития сопутствующих заболеваний, либо в связи основным заболеванием, либо в связи с терапией. Сопутствующие заболевания включают инфекции (инфекции мочевыводящих путей, другие локализации), атеросклероз, гипертонию, дислипидемию, диабет, остеопороз, аваскулярный некроз, злокачественные новообразования (особенно неходжкинская лимфома). Рекомендуется минимизация факторов риска наряду с высоким уровнем настороженности врача, своевременная оценка и тщательное наблюдение за пациентами с СКВ. Необходимо рекомендовать защиту от солнечной инсоляции. Она особенно эффективна у пациентов с поражением кожи. Изменение образа жизни – избавление от курения, контроль веса, физические упражнения, также эффективно влияют на исход болезни. С учетом индивидуального лечения и клинической картины необходим рассмотреть применение низких доз ацетилсалициловой кислоты, препаратов кальция и витамина Д, статинов, гипотензивных препаратов, включая ингибиторы АПФ. Возможно применение эстрогенов (пероральных контрацептивов, заместительной гормональной терапии после оценки риска/пользы для пациента.
Мониторинг состояния пациента:
Все больные подлежат диспансерному наблюдению.
Цель наблюдения: распознавание осложнений лекарственной терапии, выявления обострения, мониторинг клинико-лабораторной активности СКВ и профилактика побочного действия лекарственной терапии.
Посещение ревматолога 2 раза в 3 месяца (не реже), каждые 3 месяца – общие анализы крови и мочи, биохимический анализ крови.
Ежегодно: исследование липидного профиля, денситометрия, офтальмологическое обследование, определение титров АФЛ (при наличии вторичного АФС и планирования беременности), рентгенография костей таза (выявление асептического некроза головки бедренной кости).
При назначении высоких доз ГКС и цитостатиков в индукционную фазу необходимо контролировать основные клинико-лабораторные показатели (ОАК, ОАМ, БАК) 2 раза в месяц (не реже). При достижении эффекта и назначении поддерживающей терапии — 1 раз в 2 месяца (не реже). При достижении ремиссии — 1 раз в год.
Необходимость госпитализации пациента с СКВ определяет ревматолог или врач скорой помощи. Продолжительность и частота повторных госпитализаций зависит от течения, активности и тяжести СКВ. Повторные госпитализации обоснованы при активном волчаночном нефрите; при полиорганном поражении; при наличии большого числа диагностических критериев СКВ по ACR; при неудаче проведенной агрессивной терапии, когда не достигнут контроль активности процесса; при развитии осложнений, связанных с СКВ и с токсичностью препаратов.
Прогностически неблагоприятными критериями у пациентов с СКВ являются частые госпитализации в начале заболевания, сопутствующие инфекции, молодой возраст. Волчаночный нефрит является маркером агрессивного течения СКВ. Пациентам с очень высокой активностью СКВ в начале заболевания требуется тщательный мониторинг и интенсивное лечение.
Для мониторинга за течением заболевания и эффективностью проводимой терапии пациентам СКВ необходимо оценивать:
· Активность СКВ с помощью индекса SELENA /SLEDAI (таблица 1), которая проводится при каждом визите пациента;
· Степень повреждения органов с помощью Индекса Повреждения SLICC/ACR. (таблица 3). Проводится 1 раз в год;
· Наличие сопутствующей патологии;
· Безопасность принимаемых препаратов.
Индикатор эффективности лечения:
· Полная ремиссия – клинико-серологическая ремиссия у пациентов с СКВ на фоне отсутствия применения препаратов.
· Клиническая ремиссия – отсутствие признаков, симптомов, изменений в анализах мочи и крови, у пациентов с СКВ на фоне отсутствия приема ГКС. Случаи, когда у пациента отсутствует симптоматика СКВ на фоне приема ГКС, не относятся к полной клинической ремиссии, так как они нуждаются в медикаментозном контроле СКВ.
· Частичная клиническая ремиссия – отсутствие признаков, симптомов, изменений в анализах мочи и крови, у пациентов с СКВ на фоне приема низких доз ГКС (≤5 мг/сут).
Лечение (скорая помощь)
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Диагностические мероприятия:
· сбор жалоб, анамнез. Экспресс методом ОАК,ОАМ,БАК (общ. Белок,креатинин, мочевина,сахар,Алт,АСТ), коагулограмма,ЭКГ, обзорная рентгенография грудной клетки.
Медикаментозное лечение:
· Метилпреднизолон 500-1000мг в/в кап-но.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ [1-4,8,9,12,13,16,17,20,21]
Тактика лечения [4,5,7-10,13,21]: см. амбулаторный уровень.
Немедикаментозное лечение: см. амбулаторный уровень.
Режим: II, свободный;
Стол №15.
Медикаментозное лечение: см. амбулаторный уровень.
Перечень основных лекарственных средств:
| Лекарственное средство (международное непатентованное название) | Фармакологические группы | Способ введения | Разовая доза | Кратность применения |
Длительность курса лечения |
Уровень доказательности |
| Глюкокортикостероиды | ||||||
|
Метилпреднизолон |
Синтетический глюкокортикостероидный гормональный препарат | Внутрь | 4мг- | 3-4 р в сутки; | длительно | УД – А [6, 20,21,22, 23] |
| Метилпреднизолон | Синтетический глюкокортикостероидный гормональный препарат |
внутрь |
16мг | 1-2 р в сутки | длительно | УД – А [6, 20,21,22, 23] |
| Преднизолон | Синтетический глюкокортикостероидный гормональный препарат |
внутрь |
5мг-60мг в сутки | 3–4 р в сутки | длительно | УД – А [6, 20,21,22, 23] |
|
Метилпреднизолон |
Синтетический глюкокортикостероидный гормональный препарат |
в/в |
500мг- | 1-2 р в сутки | курсами | УД – А [6, 20,21,22, 23] |
| Преднизолон | Синтетический глюкокортикостероидный гормональный препарат | в/в | 30мг | 3-5р в сутки | курсами | УД – А [6, 20,21,22, 23] |
| Базисные противовоспалительные препараты | ||||||
|
Циклофосфамид |
цитостатик |
в/в |
200 мг | 400-1000мг раза в сутки |
1-2 раза в месяц курсами |
УД – А [6, 20,21,22, 24] |
|
Микофенолата мофетил |
цитостатик |
внутрь |
250-500 мг | 2-4 р в сутки | длительно | УД – А/В [6, 20,21, 22, 25,26] |
| Азатиоприн | цитостатик | внутрь | 50мг | 1-2р в сутки | длительно |
УД – В [6, 20,21,22 22,25] |
| Циклоспорин | Циклоспорин | внутрь | 25-50мг | 2-3р в сутки | длительно |
УД – В [6,20,21,22, 27] |
| Гидросихлорохин | Аминохинолиновые производные | внутрь | 200мг | 1-2р в сутки | длительно |
УД – А [6,21,22,28] |
| Метотрексат | цитостатик | внутрь | 2,5мг | 3-4рв неделю | длительно | УД – А [6,20,21,22,29] |
| метотрексат | цитостатик | подкожно | 15-20мг | 1р в неделю | длительно | УД – А [6,20,21,22,29] |
Перечень дополнительных лекарственных средств
| Лекарственное средство (международное непатентованное название) | Фармакологические группы | Способ введения | Разовая доза | Кратность применения | Длительность курса лечения | Уровень доказательности | |
| Нестероидные противовоспалительные препараты | |||||||
| Диклофенак | Производный уксусной кислоты | Внутрь | 75-200 мг | 1-3р в сутки | курсами | УД – D [6] | |
| мелоксикам | производное оксикама, селективный ингибитор ЦОГ-2 | Внутрь | 7,5-15 мг | 1-2 р в сутки | курсами | УД – D [6] | |
| лорноксикам | производное оксикама, селективный ингибитор ЦОГ-2 | Внутрь, в/м, в/в | 8-32мг в сутки | 1-2 р в сутки | курсами | УД – D [6] | |
| лорноксикам | производное оксикама, селективный ингибитор ЦОГ-2 | в/м, в/в | 8-32мг в сутки | 1-2 р в сутки | курсами | УД – D [6] | |
| Генно-инженерные биологические препараты | УД – D [6] | ||||||
| Белимумаб | человеческий моноклональный антитела класса IgGλ, | в/в | 10 мг/кг | 1 р в 0, 14, 28 дни; | курсами | УД – А [6,20,21,22,30] | |
|
Иммуноглобулин человека нормальный |
|||||||
| Иммуноглобулин человека нормальный | Иммуноглобулин | в/в | 0,4-2г/кг/сут | 3-5 дн | курсами | УД – С [33] | |
| Антиагреганты | |||||||
| Ацетилсалициловая кислота | Производное салициловой кислоты | внутрь | 100мг | 1р в сутки | курсами | УД – D (первичная профилактика АФС); УД – B (у пожилых) [6, 34, 40] | |
| Дипиридамол | Ангиопротектор и корректор микроциркуляции | внуть | 25-75 мг | 2-3-р в сутки | курсами | УД – А при АФС у не беременных (втор профилактика) [6] | |
| Антикоагулянты | |||||||
| Гепарин | Антикоагулянт прямого действия | п/к | 5000-7500 МЕ | 3-4р в сутки | 5-7дней |
УД – А при АФС у беременных [6, 35,40] |
|
| Эноксапарин натрия | Антикоагулянт прямого действия | п/к | 140 мг/0,4 мл | 1-2 р в сутки | 5-7дней | УД – А при АФС у беременных [6, 40] | |
| Надропарин кальция | Антикоагулянт прямого действия | п/к | 23800-8550 МЕ | 1-2р в сутки | 5-7дней | УД – А при АФС у беременных [6, 40] | |
| Ангиопротекторы | |||||||
| Пентоксифиллин |
Селективные ингибиторы обратного захвата серотонина |
в/в | 100-300 мг | 1р в сутки | 5-10дн | УД – С [36] | |
| Алпростадил | Синтетический аналог естественного простагландина E1 | в/в | 140-60 мкг | 1р в сутки | 5-10дн | УД – D [37] | |
| Ингибиторы АПФ | |||||||
| Эналаприл | гипотензивное, вазодилатирующее, кардиопротективное, натрийуретическое | внутрь | 5-40 мг | 1-2р в сутки | длительно | УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] | |
| Фозиноприл | гипотензивное, вазодилатирующее, кардиопротективное, натрийуретическое | внутрь | 10-40 мг | 1-2р в сутки | длительно |
УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] |
|
| Антагонисты кальция | |||||||
| Амлодипин | Антогонист кальциевых каналов | внутрь | 5-10 мг | 1р в сутки | длительно | УД – В [6, 20,21,40] | |
| Дилтиазем | Антогонист кальциевых каналов | внутрь | 180-360 мг | 2 р в сутки | длительно | УД – В [6, 20,21,40] | |
| Верапамил | Антогонист кальциевых каналов | внутрь | 240-480 мг | 3-4 р в сутки | длительно | УД – В [6, 20,21,40] | |
| Бета-блокаторы | |||||||
| Атенолол | Бета-адреноблокатор | внутрь | 25-100 мг/сут | 1-2 р в сутки | длительно | УД – С [6, 20,21,40] | |
| Метопролол | Бета-адреноблокатор | внутрь | 25-100 мг/сут | 1-2 р в сутки | длительно | УД – С[6, 20,21,40] | |
| Блокаторы рецепторов ангиотензина | |||||||
| Лозартан | Антагонист рецепторов ангиотензина II | внутрь | 100 мг | 1 р в сутки | длительно | УД — А (у больных с ВН с протеинурией≥0,5 г/сутки) [6,20,21,40] | |
| Валсартан | Антагонист рецепторов ангиотензина II | внутрь | 80-320 мг | 1 р в сутки | длительно | УД — А (у больных с ВН с протеинурией ≥0,5 г/сутки) [6,20,21,40] | |
| Антибактериальные препараты | |||||||
| Цефазолин | Цефалоспориновый антибиотик I поколения | в/в, в/м | 1 г | 1-2р в сутки | 7-10дней | УД – D [21, 41-43] | |
| Амоксициллин + клавулановая кислота | полусинтетический пенициллин и ингибитор β-лактамаз клавулановая кислота. | в/в | 600мг | 1 раз в сутки | 7-10 дней | УД – D [21, 41-43] | |
| Азитромицин | Антибиотик группы макролидов | внутрь | 500 мг | 2раз в сутки | 7-10 дней | УД – D [21, 41-43] | |
|
Сердечные гликозиды |
|||||||
| Дигоксин | Сердечный гликозид | в/в | 0,25-0,5 мг | 1р в сутки | 10дней | УД – GPP | |
| Дигоксин | Сердечный гликозид | внутрь | 0,25 мг | 1р в сутки | длительно | УД – GPP | |
|
Диуретики |
|||||||
| Фуросемид | Петлевой диуретик | в/в,в/м | 20-40мг | 1р в сутки | 5-7дней | УД – D [47] | |
| Фуросемид | Петлевой диуретик | 20-40 мгвнутрь | 20-40мг | 1р в сутки | курсами | УД – D [47] | |
| Гидрохлортиазид | производные бензотиадиазина | внутрь | 25-100 мг | 1р в сутки | курсами | УД – D [48] | |
|
Препараты крови |
|||||||
| СЗП | Препарат крови | в/в | 1 доза | 1-2р в сутки | 3-5дней | УД – D [53] | |
| Альбумин | Заменители плазмы и других компонентов крови | в/в | 10% | 1-2р в сутки | 5-10дней |
УД – GPP |
|
|
Заменители плазмы и других компонентов крови |
|||||||
|
Декстран
|
Плазмозамещающее средство | в/в | 200мл | 1-2р в сутки | 5-7дней |
УД – GPP |
Решение о терапии ГИБП принимает региональная экспертная комиссия (согласно инструкции по проведению ГИБТ).
Лечение ГИБП проводится под контролем врача-ревматолога, имеющего опыт диагностики и лечения СКВ; Инфузии проводятся в кабинете генно-инженерной терапии согласно инструкции.
Другие виды лечения: плазмаферез (ПФ) показан при цитопении, криоглобулинемии, васкулите, поражении ЦНС, тромботической тромбоцитопенической пурпуре. ПФ используют для наиболее тяжелых больных с быстро нарастающим нарушением функций жизненно — важных органов (пневмонит, поражение ЦНС, быстропрогрессирующий люпус-нефрит с почечной недостаточностью) в сочетании с активной терапией ЦФ и ГКС.
Хирургическое лечение: [1,2,12] при тяжелом поражении опорно-двигательного аппарата (асептическом некрозе головки бедренной кости) проводят эндопротезирование суставов.
Показания для консультации специалистов: см. амбулаторный уровень.
Показания для перевода в отделение интенсивной терапии и реанимации:
· СКВ с быстропрогрессирующим поражением жизненно важных органов (пневмонит, поражение ЦНС, люпус нефрит с почечной недостаточностью).
Индикаторы эффективности лечения:
· Полная ремиссия – клинико-серологическая ремиссия у пациентов с СКВ на фоне отсутствия применения препаратов.
· Клиническая ремиссия – отсутствие признаков, симптомов, изменений в анализах мочи и крови, у пациентов с СКВ на фоне отсутствия приема ГКС. Случаи, когда у пациента отсутствует симптоматика СКВ на фоне приема ГКС, не относятся к полной клинической ремиссии, так как они нуждаются в медикаментозном контроле СКВ.
· Частичная клиническая ремиссия – отсутствие признаков, симптомов, изменений в анализах мочи и крови, у пациентов с СКВ на фоне приема низких доз ГКС (≤5 мг/сут).
Дальнейшее ведение [2-,4,6]:
· своевременно распознавать обострения заболевания и осложнения лекарственной терапии путем мониторинга клинико-лабораторной активности СКВ и профилактики побочного действия терапии при помощи оценки;
· посещение ревматолога 2 раза в 3 месяца (не реже): каждые 3 месяца – ОАК, ОАМ, БАК; ежегодно: исследование липидного профиля, денситометрия, офтальмологическое обследование, определение титров аФЛ (при наличии вторичного АФС и планирования беременности), рентгенография костей таза (выявление асептического некроза головки бедренной кости);
· при назначении высоких доз ГКС и цитостатиков в индукционную фазу необходимо контролировать ОАК, ОАМ, БАК 2 раза в месяц (не реже). При достижении эффекта и назначении поддерживающей терапии – 1 раз в 2 месяца (не реже). При достижении ремиссии — 1 раз в год;
· необходимость госпитализации пациента с СКВ определяет ревматолог или врач скорой помощи; продолжительность и частота повторных госпитализаций зависит от течения, активности и тяжести СКВ; повторные госпитализации обоснованы при активном ВН; при полиорганном поражении; при наличии большого числа диагностических критериев СКВ по ACR; при неудаче проведенной агрессивной терапии, когда не достигнут контроль активности процесса; при развитии осложнений, связанных с СКВ и с токсичностью препаратов;
· проведение оценки прогноза СКВ.
Госпитализация
Показания для плановой госпитализации:
· Уточнение диагноза, подбор иммуносупрессивной терапии;
· II, III степени активности СКВ при остром и подостром течении;
· Средне-тяжелые и тяжелые (неугрожающие жизни) состояния, развившиеся от побочного действия лекарственной терапии;
· Программное плановое проведение пульс терапии для достижения индукции ремиссии;
· Плановое проведение I и II инфузий генно-инженерной биологической терапии.
Показания для экстренной госпитализации:
· III-IV степень активности СКВ с угрожающими жизни состояниями при любом типе течения;
Подозрение на:
· развитие сопутствующей инфекции;
· развитие цитопении;
· диффузное поражение ЦНС;
· активные формы волчаночного нефрита;
· пневмонит;
· тромбозы и тромбоэмболии.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1. Ревматология: национальное руководство/ под ред. Е.Л. Насонова, В.А. Насо-новой. М.: ГЭОТАР- Медиа, 2010 г. — 711 с.
2. Smolen J.S., Landewe R., Breedveld F.C. et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann.Rheum.Dis, 2010; 69:964–75.
3. Диффузные болезни соединительной ткани: руководство для врачей/ под ред. проф. В.И. Мазурова. – СПб: Спец.Лит, 2009г. 192 с.
4. Диффузные заболевания соединительной ткани, руководство для врачей под редакцией В.И.Мазурова, 2009г.
5. Клинические рекомендации. Ревматология / под ред. Е.Л. Насо¬нова. — М.: ГЭОТАР-Медиа, 2008. — 288 с
6. EULAR recommendations for the management of systemic lupus erуthematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics. G. Bertsias, J.P.A. Ioannidis, J. Boletis et. al. Annals of the Rheumatic Diseases, 2008; 67: 195-205
7. Вест С.Дж. — Секреты ревматологии, 2008.
8. Рациональная фармакотерапия ревматических заболеваний: Сompendium/ На-сонова В.А., Насонов Е.Л., Алекперов Р.Т., Алексеева Л.И. и др.; Под общ. ред. В.А. Насоновой, Е.Л. Насонова. – М.: Литтера, 2007 г. – 448с.
9. Казахстанский Национальный формуляр лекарственных средств. www.knf.kz
10. Белоусов Ю.Б. Рациональная фармакотерапия ревматических заболеваний, 2005г
11. Дифференциальный диагноз внутренних болезней: алгоритмический подход. П.М. Хили, Э.Дж. Джекобсон. Бином, Москва, 2003
12. Рациональная фармакотерапия ревматических заболеваний. Руководство для практикующих врачей. Под редакцией В.А. Насоновой, Е.Л.Насонова. Литтера, Москва, 2003
13. Васкулиты и васкулопатии. Е.Л. Насонов, А.А. Баранов, Н.П. Шилкина. Верх-няя Волга, Ярославль, 1999
14. Hospitalization of individuals with systemic lupus erythematosus: characteristics and predictors of outcome. C J Edwards, T Y Lian, H Badsha, C L Teh, N Arden and H H Chng. Lupus. 2003 12: 672
15. Optimizing outcome in SLE: treating-to-target and definition of treatment goals. Andrea Doria et al. Division of Rheumatology, University of Padova, Padua, Italy. Autoimmunity Reviews 13 (2014) 770–777
16. ANA screening: an old test with new recommendations. Pier L. M., Peter H Schur.. Ann Rheum Dis 2010; 69:1420–1422. doi:10.1136/ard.2009.127100
17. Evidence-Based Guidelines for the Use of Immunologic Tests: Antinuclear Anti-body testing. Daniel h. Solomon, Arthur j. Kavanaugh et al. and the American college of rheumatology ad hoc committee on immunologic testing guidelines. Arthritis & Rheumatism (Arthritis Care & Research). Vol. 47, No. 4, August 15, 2002, pp 434–444
18. The use of laboratory tests in the diagnosis of SLE. William Egner, J Clin Pathol 2000; 53:424–432
19. Системные ревматические заболевания: Классификация и методы определе-ния АНА. Лаборатория диагностики аутоиммунных заболеваний. http://autoimmun.ru/index.php?link=sctd&id_2=42&li=y
20. Pragmatic approaches to therapy for systemic lupus erythematosus. Wen Xiong, Robert G. Lahita. Nature reviews Rheumatology. 10, 2014, P. 97-107
21. Diagnosis of systemic lupus erythematosus. James M et al., American Family phy-sicians, Volume 68, Number11, December 1, 2003. P. 2179 — 2186
- 1. Ревматология: национальное руководство/ под ред. Е.Л. Насонова, В.А. Насо-новой. М.: ГЭОТАР- Медиа, 2010 г. — 711 с.
Информация
Сокращения, используемые в протоколе:
АТ – антитела
Анти-дсДНК – аутоантитела, направленные против собственной двухспиральной дезоксирибонуклеиновой кислоте. Синонимы: анти-ДНК, антитела к нативной ДНК, антитела к двуспиральной ДНК
Анти-РНП – антитела к ядерным рибонуклеопротеидам
Анти-Sm – антитела к антигену Sm (Smith)
Анти-snRNP – antibodies to small nuclear ribonucleic particles, антитела к малым ядерным рибонуклеиновым частицам
Анти-Ro/SSA – антитела к антигену Ro/SSA, Ro по фамилии больного Robair /SS-A — Sjogren’s syndrome A antigen. Синонимы: антитела к SS-A антигену молекулярной массы 52 и 60 кДа, анти-Ro
Анти-La/SS-B – антитела к антигену La/SS-B, по фамилии больного Lapiere/Sjogren’s syndrome B antigen, анти-La
АЗА — азатиоприн
АНА – антинуклеарные антитела
АНФ – антинуклеарный фактор
АНЦА – антинейтрофильные цитоплазматические антитела
aβ2-ГП I – антитела к β2-гликопротеиду 1
АПФ – ангиотензин-превращающий фермент
АЛТ – аланинаминотрансфеpаза
АСТ – аспартатаминотрансфераза
АФС – антифосфолипидный синдром
АФЛ — антифосфолипидные антитела
АСК – ацетилсалициловая кислота
БАК – биохимический анализ крови
БРА – блокаторы рецепторов ангиотензина II
ВН – волчаночный нефрит
ГКС – глюкокортикостероиды
ГИБП – генно-инженерный биологический препарат
ГИБТ – генно-инженерная биологическая терапия
ЖКТ – желудочно-кишечный тракт
ИФА – иммуноферментный анализ
ЛС – лекарственные средства
MHO – международное нормализованное отношение
ММФ – мофетила микофенолат
МП – метипреднизолон
НПВП — нестероидные противовоспалительные препараты
нРИФ – непрямая реакция иммунофлуоресценции
ОАК – общий анализ крови
ОАМ — общий анализ мочи
ПЗШ – предварительно заполненный шприц
ПТ – пульс-терапия
РА – ревматоидный артрит
РеА – реактивный артрит
СОЭ — скорость оседания эритроцитов
СКВ – системная красная волчанка
СКФ – скорость клубочковой фильтрации
СРБ — С-реактивный белок
СЗП – свежезамороженная плазма
ССЗ – сердечно-сосудистые заболевания
ССД – системная склеродермия
УЗИ ОБП — ультразвуковое исследование органов брюшной полости
УЗДГ – ультразвуковая допплерография сосудов
ФГДС – фиброгастродуоденоскопия
ХПН — хроническая почечная недостаточность
ЦНС – центральная нервная система
ЦОГ-2 – циклооксигеназа-2
ЦФ – циклофосфан
ЦсА – циклоспорин А
ЭКГ – электрокардиография
ЭХО-КГ – эхокардиография
ACR – American College of Rheumatology, Американская Коллегия Ревматологии
ANA – antinuclear antibodies, антинуклеарные антитела
HELLP-синдром – hemolysis, elеvated liver enzymes, lоw рlаtelet соunt, гемолиз, повышение активности ферментов печени, тромбоцитопения
Hep-2 – Human epithelial type 2 сells, перевиваемая линия эпителиальных клеток аденокарциномы гортани человека, являются очень удобным субстратом для лабораторного исследования, так как обладают крупными ядрами и на стеклах растут в один слой. АНА выявляются при связывании с внутриклеточными антигенами клеток НЕр-2
SLICC/ACR – Systemic Lupus International Collaborating Clinics / American College of Rheumatology, индекс повреждения, разработанный Международной организацией сотрудничества клиник СКВ при содействии Американской коллегии ревматологов
SELENA-SLEDAI – Safety of Estrogens in Lupus Erythematosus: National Assessment — systemic lupus erythematosus disease activity index, валидированный индекс активности СКВ, модифицированный во время проведения исследования SELENA
EULAR – European League against Rheumatism, Европейская Лига против Ревматизма
Список разработчиков протокола:
1) Турдалин Нурлан Бостыбаевич – кандидат медицинских наук, директор, ГКП на ПХВ «Городской ревматологический центр» Управления здравоохранения города Алматы, главный внештатный ревматолог МЗСРРК.
2) Сапарбаева Майра Максутовна – Казахский Национальный медицинский Университет им. С.Д. Асфендиярова, кафедра общей врачебной практики №1, ассистент.
3) Аубакирова Бакыт Амантаевна – главный внештатный ревматолог г.Астана, руководитель Городского ревматологического центра при Городской поликлинике №7 Управления здравоохранения г.Астаны.
4) Сарсенбайулы Мукан Сарсенбаевич — главный внештатный ревматолог Восточно-Казахстанской области.
5) Смагулова Газиза Ажмагиевна – доцент, кандидат медицинских наук, руководитель кафедры пропедевтики внутренних болезней и клинической фармакологии Западно-Казахстанского государственного медицинского университета им.М.Оспанова г.Актобе, клинический фармаколог.
Конфликта интересов: нет.
Список рецензентов:
1) Иванова Раифа Латыфовна – доктор медицинских наук, профессор кафедры постдипломного образования Государственного медицинского университета г.Семей.
2) Исаева Бакытшолпан Габдулхакимовна — доктор медицинских наук, профессор, заведующая кафедрой общей врачебной практики №1 КазНМУ имени С.Д.Асфендиярова, ревматолог.
Условия пересмотра: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение
Список использованной литературы по определению шкалы уровня доказательности основных лекарственных средств:
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
20. Bevra H. Hahn, Maureen A. Mcmahon, Alan Wilkinson et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research Vol. 64, No. 6, June 2012, pp 797– 808 DOI 10.1002/acr.21664. Available from: http://www.rheumatology.org/Portals/0/Files/ACR%20Guidelines%20for%20Screening,%20Treatment,%20and%20Management%20of%20Lupus%20Nephritis.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
22. KDIGO Clinical Practice Guideline for Glomerulonephritis. Volume 2 | issue 2 | JUNE 2012. Available from: http://www.kdigo.org/clinical_practice_guidelines/pdf/KDIGO-GN-Guideline.pdf
23. Hoes JN, Jacobs JW, Boers M et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2007 Dec;66(12):1560-7. Available from: http://ard.bmj.com/content/66/12/1560.full.pdf+html
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
20. Bevra H. Hahn, Maureen A. Mcmahon, Alan Wilkinson et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research Vol. 64, No. 6, June 2012, pp 797– 808 DOI 10.1002/acr.21664. Available from: http://www.rheumatology.org/Portals/0/Files/ACR%20Guidelines%20for%20Screening,%20Treatment,%20and%20Management%20of%20Lupus%20Nephritis.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
22. KDIGO Clinical Practice Guideline for Glomerulonephritis. Volume 2 | issue 2 | JUNE 2012. Available from: http://www.kdigo.org/clinical_practice_guidelines/pdf/KDIGO-GN-Guideline.pdf
23. Hoes JN, Jacobs JW, Boers M et al. EULAR evidence-based recommendations on the management of systemic glucocorticoid therapy in rheumatic diseases. Ann Rheum Dis 2007 Dec;66(12):1560-7. Available from: http://ard.bmj.com/content/66/12/1560.full.pdf+html
24. Virginia Fernandes Moça Trevisani , Aldemar A Castro , João Ferreira Neves Neto and Álvaro N Atallah. Cyclophosphamide versus methylprednisolone for treating neuropsychiatric involvement in systemic lupuserythematosus. Cochrane Database of Systematic Reviews. Online Publication Date: February 2013. DOI: 10.1002/14651858.CD002265.pub3. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002265.pub3/full
25. Lorna Henderson , Philip Masson , Jonathan C Craig , Robert S Flanc , Matthew A Roberts , Giovanni FM Strippoli and Angela C Webster. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews. Online Publication Date: December 2012. DOI: 10.1002/14651858.CD002922.pub3. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002922.pub3/full
26. Systemic lupus erythematosus: oral mycophenolate. NICE advice [ESUOM36]. Published date: November 2014. Available from: https://www.nice.org.uk/advice/esuom36/chapter/Key-points-from-the-evidence
25. Lorna Henderson , Philip Masson , Jonathan C Craig , Robert S Flanc , Matthew A Roberts , Giovanni FM Strippoli and Angela C Webster. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews. Online Publication Date: December 2012. DOI: 10.1002/14651858.CD002922.pub3. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002922.pub3/full 10.1002/14651858.CD002922.pub3. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002922.pub3/full
27. Zavada J, Pesickova S, Rysava R et al. Cyclosporine A or intravenous cyclophosphamide for lupus nephritis: the Cyclofa-Lune study. Lupus 2010; 19: 1281–1289. Available from: http://lup.sagepub.com/content/early/2010/07/05/0961203310371155.full.pdf+html 25. Lorna Henderson , Philip Masson , Jonathan C Craig , Robert S Flanc , Matthew A Roberts , Giovanni FM Strippoli and Angela C Webster. Treatment for lupus nephritis. Cochrane Database of Systematic Reviews. Online Publication Date: December 2012. DOI: 10.1002/14651858.CD002922.pub3. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD002922.pub3/full
28. Kimberly Legault and Carlos A Cuello-García. Hydroxychloroquine for systemic lupus erythematosus in adults. Cochrane Database of Systematic Reviews. Online Publication Date: February 2016. DOI: 10.1002/14651858.CD012098. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD012098/full 1. Kimberly Legault and Carlos A Cuello-García. Hydroxychloroquine for systemic lupus erythematosus in adults. Cochrane Database of Systematic Reviews. Online Publication Date: February 2016. DOI: 10.1002/14651858.CD012098. Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD012098/full
29. Sakthiswary R, Suresh E. Methotrexate in systemic lupus erythematosus: a systematic review of its efficacy. Lupus. 2014 Mar;23(3):225-35. doi: 10.1177/0961203313519159. Epub 2014 Jan 7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24399812
2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2011;70:896-904 doi:10.1136/ard.2011.151027 Published Online: 2 May 2011. Available from: http://ard.bmj.com/content/70/6/896.full.pdf+html
10. Michael M. Ward, Atul Deodhar, Elie A. Akl, Andrew Lui, Joerg Ermann, et al. American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis & Rheumatology. DOI 10.1002/ART.39298 VC 2015, American College Of Rheumatology. Available from: http://www.rheumatology.org/Portals/0/Files/Recommendations%20for%20the%20Treatment%20of%20Ankylosing%20Spondylitis.pdf
11. P Mandl, V Navarro-Compán, L Terslev, P Aegerter, D van der Heijde, M A D’Agostino, X Baraliakos, S J Pedersen, A G Jurik, E Naredo, C Schueller-Weidekamm, U Weber, M C Wick, P A C Bakker, E Filippucci, P G Conaghan, M Rudwaleit, G Schett, J Sieper, S Tarp, H Marzo-Ortega, M Østergaard. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015;74:1327-1339 doi:10.1136/annrheumdis-2014-206971
12. Van der Heijde, D., Purcaru, O., Kavanaugh, A. High economic burden of axial spondyloarthritis related to paid work and household productivity at baseline in the rapid-axspa study: differences and similarities between ankylosing spondylitis and non-radiographic axial spondyloarthritis. Ann Rheum Dis 2013;72:A523-A524 doi:10.1136/annrheumdis-2013-eular.1566.
13. TNF-alpha inhibitors for ankylosing spondylitis and non-radiographic axial spondyloarthritis. NICE technology appraisal guidance [TA383]. Published date: 01 February 2016. Available from: https://www.nice.org.uk/Guidance/TA383
14. Vera Golder, Lionel Schachna. Ankylosing spondylitis: An update. The Royal Australian College of General Practitioners . Australian Family Physician. Volume 42, No.11, November 2013 Pages 780-784. Available from: http://www.racgp.org.au/download/Documents/AFP/2013/November/201311golder.pdf
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
3. J Braun, R van den Berg, X Baraliakos, H Boehm, R Burgos-Vargas, E Collantes-Estevez, H Dagfinrud, B Dijkmans, M Dougados, P Emery, P Geher, M Hammoudeh, RD Inman, M Jongkees, MA Khan, U Kiltz, TK Kvien, M Leirisalo-Repo, WP Maksymowych, I Olivieri, K Pavelka, J Sieper, E Stanislawska-Biernat, D Wendling, S Özgocem, C van Drogen, BJ van Royen, D Van der Heijde
2010 update of the ASAS/EULAR recommendations for the management of ankylosing spondylitis. Ann Rheum Dis 2011;70:896-904 doi:10.1136/ard.2011.151027 Published Online: 2 May 2011. Available from: http://ard.bmj.com/content/70/6/896.full.pdf+html 10. Michael M. Ward, Atul Deodhar, Elie A. Akl, Andrew Lui, Joerg Ermann, et al. American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network 2015 Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis & Rheumatology. DOI 10.1002/ART.39298 VC 2015, American College Of Rheumatology. Available from: http://www.rheumatology.org/Portals/0/Files/Recommendations%20for%20the%20Treatment%20of%20Ankylosing%20Spondylitis.pdf
11. P Mandl, V Navarro-Compán, L Terslev, P Aegerter, D van der Heijde, M A D’Agostino, X Baraliakos, S J Pedersen, A G Jurik, E Naredo, C Schueller-Weidekamm, U Weber, M C Wick, P A C Bakker, E Filippucci, P G Conaghan, M Rudwaleit, G Schett, J Sieper, S Tarp, H Marzo-Ortega, M Østergaard. EULAR recommendations for the use of imaging in the diagnosis and management of spondyloarthritis in clinical practice. Ann Rheum Dis 2015;74:1327-1339 doi:10.1136/annrheumdis-2014-206971
12. Van der Heijde, D., Purcaru, O., Kavanaugh, A. High economic burden of axial spondyloarthritis related to paid work and household productivity at baseline in the rapid-axspa study: differences and similarities between ankylosing spondylitis and non-radiographic axial spondyloarthritis. Ann Rheum Dis 2013;72:A523-A524 doi:10.1136/annrheumdis-2013-eular.1566.
13. TNF-alpha inhibitors for ankylosing spondylitis and non-radiographic axial spondyloarthritis. NICE technology appraisal guidance [TA383]. Published date: 01 February 2016. Available from: https://www.nice.org.uk/Guidance/TA383
14. Vera Golder, Lionel Schachna. Ankylosing spondylitis: An update. The Royal Australian College of General Practitioners . Australian Family Physician. Volume 42, No.11, November 2013 Pages 780-784. Available from: http://www.racgp.org.au/download/Documents/AFP/2013/November/201311golder.pdf
30. Systemic lupus erythematosus (autoantibody-positive) — belimumab [ID416]. NICE technology appraisal guidance [TA397]. Published date: 22 June 2016. Available from: https://www.nice.org.uk/guidance/indevelopment/gid-tag273
33. Heyneman CA, Gudger CA, Beckwith JV. Intravenous immune globulin for inducing remissions in systemic lupus erythematosus. Ann Pharmacother. 1997 Feb;31(2):242-4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9034428
34. Cohen D, Berger SP, Steup-Beekman GM, Bloemenkamp KW, Bajema IM. Diagnosis and management of the antiphospholipid syndrome. BMJ 2010 May;340:c2541. Available from: http://www.bmj.com/content/340/bmj.c2541
40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
35. R Rai et al., Randomised controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholipid antibodies (or antiphospholipid antibodies). BMJ 1997; 314 doi: http://dx.doi.org/10.1136/bmj.314.7076.253 (Published 25 January 1997). Available from: http://www.bmj.com/content/314/7076/253/rapid-responses 40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
36. Galindo-Rodríguez G1, Bustamante R, Esquivel-Nava G, Salazar-Exaire D, Vela-Ojeda J, Vadillo-Buenfil M, Aviña-Zubieta JA. Pentoxifylline in the treatment of refractory nephrotic syndrome secondary to lupus nephritis. J Rheumatol. 2003 Nov;30(11):2382-4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/14677181
37. Yoshikawa Y, Mizutani H, Shimizu M. Systemic lupus erythematosus with ischemic peripheral neuropathy and lupus anticoagulant: response to intravenous prostaglandin E1. Cutis. 1996 Dec;58(6):393-6. Review. Available from: http://www.ncbi.nlm.nih.gov/pubmed/8970775
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long 20. Bevra H. Hahn, Maureen A. Mcmahon, Alan Wilkinson et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research Vol. 64, No. 6, June 2012, pp 797– 808 DOI 10.1002/acr.21664. Available from: http://www.rheumatology.org/Portals/0/Files/ACR%20Guidelines%20for%20Screening,%20Treatment,%20and%20Management%20of%20Lupus%20Nephritis.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
20. Bevra H. Hahn, Maureen A. Mcmahon, Alan Wilkinson et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research Vol. 64, No. 6, June 2012, pp 797– 808 DOI 10.1002/acr.21664. Available from: http://www.rheumatology.org/Portals/0/Files/ACR%20Guidelines%20for%20Screening,%20Treatment,%20and%20Management%20of%20Lupus%20Nephritis.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
20. Bevra H. Hahn, Maureen A. Mcmahon, Alan Wilkinson et al. American College of Rheumatology Guidelines for Screening, Treatment, and Management of Lupus Nephritis. Arthritis Care & Research Vol. 64, No. 6, June 2012, pp 797– 808 DOI 10.1002/acr.21664. Available from: http://www.rheumatology.org/Portals/0/Files/ACR%20Guidelines%20for%20Screening,%20Treatment,%20and%20Management%20of%20Lupus%20Nephritis.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
40. Wajed J, Ahmad Y, Durrington PN, Bruce IN. Prevention of cardiovascular disease in systemic lupus erythematous: proposed guidelines for risk factor management. Rheumatology (Oxford) 2004 Jan;43(1):7-12. Available from: http://rheumatology.oxfordjournals.org/content/43/1/7.full.pdf
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
41. Gilliland W. and Tsokos G. Prophylactic use of antibiotics and immunisations in patients with SLE. Ann Rheum Dis. 2002 Mar; 61(3): 191–192. doi: 10.1136/ard.61.3.191. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1754039/pdf/v061p00191.pdf
42. Goldblatt F, Chambers S, Rahman A, Isenberg DA. Serious infections in British patients with systemic lupus erythematosus: hospitalisations and mortality. Lupus 2009 Jul;18(8):682-9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19502263
43. Ruiz-Irastorza G, Olivares N, Ruiz-Arruza I, Martinez-Berriotxoa A, Egurbide MV, Aguirre C. Predictors of major infections in systemic lupus erythematosus. Arthritis Res Ther 2009;11(4):R109.
44. Sato M1, Saku N, Takeda A, Suzuki N, Saito T, Minato N, Saito K, Kano S. [A case report—pulmonary cryptococcosis associated with systemic lupus erythematosus and review of 44 cases in Japan]. [Article in Japanese]. Ryumachi. 1993 Feb;33(1):56-62. Available from: http://www.ncbi.nlm.nih.gov/pubmed/8493585
47. Lee FO, Quismorio FP Jr, Troum OM, Anderson PW, Do YS, Hsueh WA. Mechanisms of hyperkalemia in systemic lupus erythematosus. Arch Intern Med. 1988 Feb;148(2):397-401.
48. Brown CW Jr, Deng JS. Thiazide diuretics induce cutaneous lupus-like adverse reaction. J Toxicol Clin Toxicol. 1995;33(6):729-33.
45. LH Sandholdt, R Laurinaviciene, and A Bygum. Proton pump inhibitor-induced subacute cutaneous lupus erythematosus. Br J Dermatol. 2014 Feb; 170(1): 342–351. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4232902/
46. Matsukawa Y, Sawada S, Horie T. Effects of famotidine on various immunological parameters in patients with rheumatic diseases: decreased lymphocyte DR expression by famotidine. Immunopharmacol Immunotoxicol. 1992;14(3):477-89.
6. G K Bertsias, J P A Ioannidis, J Boletis, S Bombardieri, R Cervera, C Dostal, J Font, I M Gilboe, F Houssiau, T Huizinga, D Isenberg, C GM Kallenberg, M Khamashta, J C Piette, M Schneider, J Smolen, G Sturfelt, A Tincani, R van Vollenhoven, C Gordon and D T Boumpas. EULAR recommendations for the management of systemic lupus erytematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis, Feb 2008; 67: 195-205. Available from: http://ard.bmj.com/content/67/2/195.long
21. Guidelines for the Screening, Treatment and Monitoring of Lupus Nephritis in Adults . Lupus Nephritis Evidence Report. Available from: http://www.rheumatology.org/Portals/0/Files/Lupus%20Nephritis%20Evidence%20Report.pdf
49. Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter., Suppl. 2012; 2: 279–335. Available from: http://www.kdigo.org/clinical_practice_guidelines/pdf/KDIGO-Anemia%20GL.pdf
47. Heran BS, Musini VM, Bassett K, Taylor RS, Wright JM. Angiotensin receptor blockers for heart failure. Cochrane Database of Systematic Reviews 2012, Issue 4. Art. No.: CD003040. DOI: 10.1002/14651858.CD003040.pub2.
50. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
51. Wang HY1, Huang TL. Benzodiazepines in catatonia associated with systemic lupus erythematosus. Psychiatry Clin Neurosci. 2006 Dec;60(6):768-70.
52. Bertsias GK, Ioannidis JP, Aringer M et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010 Dec;69(12):2074-82. Available from: http://ard.bmj.com/content/69/12/2074.full.pdf+html
50. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
51. Wang HY1, Huang TL. Benzodiazepines in catatonia associated with systemic lupus erythematosus. Psychiatry Clin Neurosci. 2006 Dec;60(6):768-70.
52. Bertsias GK, Ioannidis JP, Aringer M et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010 Dec;69(12):2074-82. Available from: http://ard.bmj.com/content/69/12/2074.full.pdf+html
50. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
51. Wang HY1, Huang TL. Benzodiazepines in catatonia associated with systemic lupus erythematosus. Psychiatry Clin Neurosci. 2006 Dec;60(6):768-70.
52. Bertsias GK, Ioannidis JP, Aringer M et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010 Dec;69(12):2074-82. Available from: http://ard.bmj.com/content/69/12/2074.full.pdf+html
50. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
51. Wang HY1, Huang TL. Benzodiazepines in catatonia associated with systemic lupus erythematosus. Psychiatry Clin Neurosci. 2006 Dec;60(6):768-70.
52. Bertsias GK, Ioannidis JP, Aringer M et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010 Dec;69(12):2074-82. Available from: http://ard.bmj.com/content/69/12/2074.full.pdf+html
50. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
51. Wang HY1, Huang TL. Benzodiazepines in catatonia associated with systemic lupus erythematosus. Psychiatry Clin Neurosci. 2006 Dec;60(6):768-70.
52. Bertsias GK, Ioannidis JP, Aringer M et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs. Ann Rheum Dis 2010 Dec;69(12):2074-82. Available from: http://ard.bmj.com/content/69/12/2074.full.pdf+html
53. Keller E , Beeser H , Peter HH , Arnold A and Kotitschke R. Comparison of fresh frozen plasma with a standardized serum protein solution following therapeutic plasma exchange in patients with autoimmune disease: a prospective controlled clinical trial. Therapeutic apheresis : official journal of the International Society for Apheresis and the Japanese Society for Apheresis, 2000, 4(5), 332. Available from: http://onlinelibrary.wiley.com/wol1/doi/10.1046/j.1526-0968.2000.004005332.x/full
54. Sabugo F, Espinoza-Araya R, Meneses MF, Cuchacovich M. Acute herpes simplex virus 1 pneumonitis in a patient with systemic lupus erythematosus. J Clin Rheumatol. 2014 Jan;20(1):42-4. doi: 10.1097/RHU.0000000000000060. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24356475
55. Ramos-Casals M, Cuadrado MJ, Alba P, Sanna G, Brito-Zerón P, Bertolaccini L, Babini A, Moreno A, D’Cruz D, Khamashta MA. Acute viral infections in patients with systemic lupus erythematosus: description of 23 cases and review of the literature. Medicine (Baltimore). 2008 Nov;87(6):311-8. doi: 10.1097/MD.0b013e31818ec711. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19011502
56. John A Reynolds, Ian N Bruce. Overview of the management of systemic lupus erythematosus. Reports on the Rheumatic Diseases. Spring 2013; Series 7; Topical Reviews No 2; 1-12. Available from: http://www.arthritisresearchuk.org/health-professionals-and-students/reports/topical-reviews/topical-reviews-spring-2013.aspx
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Системная красная волчанка (СКВ) – аутоиммунное заболевание неизвестной этиологии, при котором вследствие гиперпродукции органонеспецифических аутоантител развивается иммунокомплексное повреждение органов. СКВ свойственны хроническое течение и широкий спектр симптоматики. На ранних стадиях ведущую роль играют проявления основного заболевания, являющиеся основной мишенью терапевтического воздействия. По мере увеличения давности заболевания картина меняется: наряду с возникновением обострений с поражением ранее интактных органов или ухудшением со стороны ранее заинтересованных систем отмечаются симптомы, обусловленные сопутствующей патологией или осложнениями лекарственной терапии. Нередко коморбидные состояния доминируют, определяют качество жизни больного, влияют на прогноз и требуют особых подходов к лечению [1–5].
Проблема коморбидности при СКВ всегда вызывала пристальный интерес. Само заболевание и длительное использование огромного арсенала лекарственных средств рассматриваются как факторы риска развития тяжелых сопутствующих (коморбидных) хронических состояний. Следует напомнить, что под коморбидностью подразумевают «существование или возникновение любого сопутствующего заболевания во время течения конкретной болезни» [6]. Сопутствующая патология может иметь единые патогенетические механизмы (например, раннее развитие атеросклеротического поражения сосудов) или развиваться на фоне течения и лечения основного заболевания (например, хроническая болезнь почек как исход волчаночного нефрита (ВН) или глюкокортикоидный остеопороз (ОП) и сахарный диабет (СД)) [7].
Наиболее частыми коморбидными заболеваниями при СКВ считают кардиоваскулярную патологию, ОП, интерстициальное поражение легких (ИПЛ), хроническую болезнь почек, злокачественные новообразования, депрессию. Особое место занимают инфекционные осложнения, т. к. они зачастую определяют не только тяжесть состояния больного, но и прогноз, вплоть до летального исхода [8, 9]. За последние десятилетия 5–летняя выживаемость больных СКВ достигла 95%, однако до сих пор возможно развитие фатальных ситуаций [10]. Показатели смертности при СКВ в 3 раза выше по сравнению с популяцией, при этом четко наблюдается бимодальная кривая летальности. Ранняя летальность (в первые несколько лет развития заболевания), как правило, связана с активностью СКВ и инфекционными осложнениями, а поздняя летальность главным образом обусловлена развитием сердечно-сосудистой патологии и инфекциями [11]. Именно поэтому актуальными задачами современной ревматологии являются профилактика, выявление и коррекция сопутствующих состояний, что четко отражено в рекомендациях EULAR (The European League Against Rheumatism) 2010 г. по мониторингу больных СКВ [12].
Инфекционные осложнения
Врожденные и приобретенные дефекты иммунной системы при СКВ повышают склонность к развитию инфекционных заболеваний, включая бактериальные, вирусные, грибковые и паразитарные инфекции, а также туберкулез [13].
Серьезные инфекции являются причиной смерти около 25% больных СКВ. Риск развития инфекционной патологии связан как с люпус-опосредованными факторами (поражение легких, нефрит, лимфопения, патология системы комплемента и функциональный гипоспленизм), так и с проводимой терапией (кумулятивная экспозиция глюкокортикоидов (ГК) и иммуносупрессантов). Наиболее типичными бактериальными патогенами являются Streptococcus pneumoniae, Escherichia coli, Staphylococcus aureus. Вторичный гипоспленизм (обусловленный избыточным депонированием иммунных комплексов) повышает риск развития инфекций, вызванных инкапсулированными микроорганизмами (такими как Streptococcus pneumoniae, Haemophilus influenzae, Salmonella typhi). На фоне лимфопении нередко развиваются оппортунистические инфекции (вызванные Mycobacterium (М.) tuberculosis, Pneumocystis jirovecii и реактивацией цитомегаловирусной инфекции) [14, 15].
Самой частой причиной госпитализации больных являются бактериальные инфекции, в первую очередь пневмонии. Основными возбудителями респираторных внебольничных инфекций у больных СКВ считаются Staphylococcus aureus и Streptococcus pyogenes, тогда как у стационарных пациентов ключевыми патогенами являются Klebsiella spр., Pseudomonas aeruginosa и Escherichia coli [16].
В последние годы все большее внимание привлекает проблема пневмоний, вызванных Pneumocystis jirovecii [17]. По данным метаанализа, включавшего 11 905 больных ревматическими заболеваниями, пневмоцистная пневмония (ППн) обнаружена у 5% больных СКВ, а частота лечения в стационаре по этому поводу составляла 12 случаев на 10 тыс. госпитализаций в год. Предполагается, что в качестве факторов риска развития ППн у больных СКВ следует рассматривать высокую активность заболевания, патологию почек, интерстициальный легочный фиброз, большую суточную дозу ГК, лимфопению и малое количество CD4+ Т-клеток. Имеются сообщения о развитии ППн у больных СКВ при лечении ритуксимабом [18–20].
Инфекции мочевыводящих путей (ИМП) относятся к одним из наиболее распространенных коморбидных инфекций и встречаются в 14–36% случаев, превышая частоту в популяции в 8–10 раз. Факторами риска развития ИМП являются возраст (относительный риск (ОР) 1,1, 95% доверительный интервал (ДИ) 1–1,1; p=0,002), ИМП в анамнезе (ОР 4,5, 95% ДИ 2–10; p=0,0001), люпус-нефрит (ОР 2,5, 95% ДИ 1,1–5,7; p=0,036), повышение титров антинуклеарного фактора >1/80 МЕ/мл (ОР 2,8, 95% ДИ 1,2–6,8; p=0,022), тромбоцитопения (ОР 4,3, 95% ДИ 1,3–14,8; p=0,02). В большинстве случаев основным возбудителем ИМП при СКВ считаются Escherichia coli, реже – Klebsiella, Proteus, Pseudomonas aeruginosa, коагулазонегативные стафилококки [21–24]. Наиболее склонны к развитию ИМП, в т. ч. к рецидивирующему течению, больные женского пола [25].
Инфекции, вызванные сальмонеллами, – ведущая причина бактериемии после употребления загрязненной пищи; частота этих осложнений особенно высока в слаборазвитых странах. При инфицировании больных СКВ различными сероварами Salmonella возрастает риск развития остеомиелита, септического артрита и инфекционного эндокардита. Отмечены высокие показатели летальности, главным образом у больных пожилого возраста и при микст-инфекции [15].
Частота грибковых инфекций достигает 3%, наиболее частыми формами являются криптококковый менингит, кандидоз, легочный аспергиллез и микозы. Грибковые инфекции развиваются, как правило, в первые годы заболевания, на фоне высокой активности СКВ, нередко сочетаются с бактериальными и вирусными ко-инфекциями; показатели летальности составляют 25–70%. К предрасполагающим факторам относятся поражение почек, легких, центральной нервной системы (ЦНС), цитопении, терапия высокими дозами ГК (в т. ч. пульс-терапия) и цитотоксическими препаратами. У каждого пятого больного грибковые инфекции выявляются только при аутопсии. Высказывается мнение о необходимости настороженности в отношении развития сопутствующих грибковых инфекций у больных с высокой степенью активности СКВ, особенно на фоне лечения высокими дозами иммуносупрессантов [25].
Наиболее значимыми коморбидными вирусными инфекциями у больных СКВ являются инфекции, вызванные парвовирусом В19 и представителями семейства Herpesviridae, в первую очередь цитомегаловирусом, вирусом Эпштейна – Барр и Herpes zoster. Клиническая картина вирусных инфекций может быть схожей с таковой при СКВ и имитировать обострение основного заболевания. При развитии коморбидных вирусных инфекций прогноз больных СКВ ухудшается [26].
Нередко встречаются инфекции, вызванные вирусом папилломы человека (ВПЧ). Эта патология отличается высокой контагиозностью и значительным уровнем малигнизации. Заболеваемость ВПЧ у больных СКВ в 3–7 раз выше по сравнению с таковой в популяции, при этом наиболее значимыми предшествующими факторами являются высокие кумулятивные дозы ГК и циклофосфамида (ЦФ) [27–31].
В последние годы все большее внимание клиницистов привлекает прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) – тяжелое и, как правило, фатальное демиелинизирующее заболевание ЦНС, вызываемое паповавирусом JC, принадлежащим к группе ДНК-содержащих полиомавирусов. Данная инфекция является оппортунистической; клиническая манифестация отмечается на фоне выраженного нарушения клеточного иммунитета. Развитие ПМЛ у больных СКВ ассоциируется главным образом с терапией генно-инженерными биологическими препаратами (ГИБП). В связи с этим возникновение новой неврологической симптоматики у больных СКВ на фоне терапии ГИБП требует применения дополнительных методов обследования, с помощью которых можно получить подтверждение диагноза ПМЛ (множественные очаги пониженной плотности в белом веществе головного мозга при МРТ, выявление JC-вируса в ликворе) [32].
Встречаются паразитарные инфекции, особенно в тропических зонах и развивающихся странах: основными возбудителями являются Toxoplasma gondii, Strongyloides stercoralis, Plasmodium и др. [33].
Следует упомянуть о некоторых особенностях интеркуррентных инфекций у больных СКВ. Во-первых, имеются доказательства того, что некоторые инфекции, особенно вирусные, могут участвовать в инициации, обострении или усугублении тяжести активной СКВ. Во-вторых, некоторые клинические проявления, включая лихорадку, лимфаденопатию, легочные инфильтраты, поражение кожи и слизистых оболочек, коагулопатии, необъяснимые нарушения сознания, могут быть как проявлением обострения основной патологии, так и симптомами инфекционного заболевания. Важно помнить, что больные СКВ склонны к развитию внутрибольничных инфекций в несколько раз чаще по сравнению с больными с другими нозологическими формами [34, 35].
Наряду с направленностью на раннюю диагностику разрабатываются меры специфической профилактики инфекционных заболеваний, в первую очередь вакцинопрофилактика. Современные рекомендации подразумевают вакцинацию больных СКВ против гриппа и пневмококковой инфекции, которую необходимо проводить в неактивную фазу заболевания. Всем женщинам, страдающим СКВ, вплоть до 25-летнего возраста, рекомендуется вакцинация против ВПЧ. Также следует помнить, что живые вакцины противопоказаны больным, получающим иммуносупрессивную терапию (включая ГК в дозе более 20 мг/сут) [26, 36].
Туберкулез
Микобактериальные инфекции можно разделить на 2 группы: инфекции, вызванные M. tuberculosis, и инфекции, вызванные нетуберкулезными микобактериями (M. avium, M. chelonae, M. haemophilum, M. fortuitum). Первые наиболее часто развиваются на ранних стадиях СКВ, связаны с активностью заболевания и проводимой терапией и, как правило, обусловлены реактивацией предшествующей латентной инфекции или реинфицированием. Инфекции 2-й группы встречаются при большой давности заболевания, на фоне высоких кумулятивных доз ГК, преимущественно в виде нового очага в коже и мягких тканях [37, 38].
Инфекции, вызванные M. tuberсulosis, представляют общемировую проблему. В течение первого года заболевания частота обнаружения туберкулеза у больных СКВ в некоторых странах (Индия, Китай) может достигать 60% [38, 39]. В эндемичных регионах инфицирование М. tuberculosis встречается более чем у 5% больных (3,6–16,7%); преобладают милиарные (27–50% случаев легочного туберкулеза) и внелегочные формы (32–67% всех случаев туберкулеза). Предрасполагающими факторами развития туберкулезного процесса у больных СКВ являются иммуносупрессивная терапия (в т. ч. предшествующий прием высоких доз ГК), наличие туберкулезной инфекции в анамнезе, длительность заболевания и поражение почек. Особенностями туберкулеза при СКВ являются высокая частота внелегочных форм и поздняя диагностика вследствие атипичной локализации и стертой клинической картины на фоне глюкокортикоидной терапии [40–43, 48].
В настоящее время эксперты EULAR советуют проводить скрининговое обследование на туберкулез всем больным СКВ, особенно перед назначением иммуносупрессивных препаратов. Следует помнить о возможности ложноотрицательных результатов туберкулиновой кожной пробы, т. к. на фоне терапии ГК больные могут быть анергичны [44]. Альтернативным методом диагностики туберкулеза у данной категории больных является проведение интерфероновых тестов, что обеспечивает большую точность при диагностике латентной туберкулезной инфекции [45–47].
В некоторых странах профилактическое назначение противотуберкулезных препаратов (изониазида) позволило в несколько раз снизить частоту туберкулезной инфекции у больных СКВ.
Сердечно-сосудистые заболевания
Риск развития сердечно-сосудистой патологии при СКВ в 5–6 раз превышает таковой в популяции; наблюдается раннее атеросклеротическое поражение. Выявлено развитие сердечно-сосудистых заболеваний у больных СКВ даже до менопаузы, при этом у женщин в возрасте 44–50 лет отмечается 50-кратное увеличение риска инфаркта миокарда по сравнению с контролем (Фрамингемское исследование), а относительный риск ишемической болезни сердца составляет 7,5 [49, 50]. Сообщается о высокой частоте субклинического атеросклероза в виде утолщения комплекса интима-медиа и нарушения перфузии миокарда [51–55].
Рост частоты кардиоваскулярных заболеваний (КВЗ) у больных СКВ обусловлен сочетанием традиционных факторов риска (курение, артериальная гипертензия (АГ), дислипидемия и СД 2-го типа) и факторов риска, связанных с заболеванием и проводимой терапией (активность СКВ, поражение почек, терапия ГК). Дополнительный вклад вносят такие факторы, как антифосфолипидные антитела (аФЛ), гипергомоцистеинемия и проатерогенное действие хронического системного воспаления [56, 57].
Неоднозначно влияние терапии СКВ на развитие сосудистых осложнений. В ряде исследований было показано, что экспозиция ГК непосредственно связана с частотой кардиоваскулярных событий, но при длительном наблюдении было установлено, что более агрессивная терапия (например, с использованием ЦФ) ассоциируется со снижением частоты сердечно-сосудистой патологии. Новые данные появляются о кардиопротективном действии аминохинолиновых производных и микофенолата мофетила [58–62].
Влияние КВЗ на прогноз больных СКВ не вызывает сомнения, однако значимость этой коморбидности определяется не только показателями летальности. В последние годы получены новые сведения об ассоциативных связях КВЗ с когнитивными нарушениями и депрессией, низким социальным статусом [63]. Так, у больных СКВ с КВЗ частота когнитивных нарушений достигала 15% и коррелировала с инсультом в анамнезе, гипертензией и позитивностью по аФЛ. У белых американок с низким уровнем дохода, страдающих СКВ, риск инфаркта миокарда и инсульта значительно повышен (ОР 3,24 и 2,85 соответственно). Обнаружена связь депрессии с субклиническими проявлениями атеросклероза [64–66].
Поражение легких
Клинические и/или рентгенологические признаки поражения легких встречаются у 25–30% больных. Симптоматика легочного поражения крайне разнообразна и может быть связана с активностью заболевания; поражение легких может быть и коморбидным состоянием [67]. На фоне активности заболевания встречаются плеврит (45–60%), острый волчаночный пневмонит (2–8%), диффузные альвеолярные геморрагии (2–5,4%). У молодых больных и при небольшой давности СКВ чаще развиваются 2 последних проявления, которые имеют крайне неблагоприятный прогноз [68, 69]. Поражение легких, обусловленное активным волчаночным процессом, хорошо отвечает на терапию ГК, однако в некоторых случаях требуется назначение иммуносупрессантов или ГИБП.
С точки зрения сопутствующей патологии следует отдельно рассмотреть хроническое ИПЛ и легочную гипертензию (ЛГ).
Частота ИПЛ достигает 3% и возрастает с увеличением давности заболевания, главным образом развивается у мужчин и пожилых больных. Клинически ИПЛ проявляется постепенно нарастающей одышкой, хроническим сухим кашлем, при аускультации выявляются двусторонние сухие хрипы на вдохе. Деформация по типу «барабанных пальцев» при СКВ формируется редко. Рентгенологическая картина не отличается от таковой при идиопатическом легочном фиброзе: встречаются диффузные изменения по типу «матового стекла», «сотовое легкое», диффузные интерстициальные инфильтраты, тяжистые бронхоэктазы. Прогноз при ИПЛ при СКВ благоприятнее, чем при идиопатических формах ИПЛ, течение медленно прогрессирующее. В то же время развитие ИПЛ у больных СКВ нередко выходит на передний план в клинической картине и негативно влияет на состояние пациентов [70].
Частота ЛГ варьирует от 0,5 до 15%, по мнению некоторых авторов, ЛГ чаще развивается у больных СКВ с синдромом Рейно. Патогенез осложнения до конца не изучен, рассматривается возможное участие аФЛ и обусловленные ими хронические венозные тромбоэмболии легочных сосудов; легочный циркуляторный вазоспазм, васкулопатия, тромбоз in situ и эндотелиальная дисфункция. Прогноз у больных СКВ с развитием ЛГ хуже, чем у больных с идиопатической ЛГ: 5-летняя выживаемость у больных СКВ и ЛГ составляет 17%, тогда как при идиопатической ЛГ – 68% [71].
Возможно поражение легких на фоне терапии иммуносупрессантами. Осложнения при лечении метотрексатом встречаются редко (менее 1% больных), как правило, в виде пневмонита с кашлем, лихорадкой и одышкой. Симптоматика обычно развивается в течение первого года лечения, прогноз в целом благоприятный, однако в 10% случаев может отмечаться прогрессирование вплоть до развития легочного фиброза [72].
Терапия ЦФ также может осложняться развитием пневмонита. Острый пневмонит появляется в первые 6 мес. от начала лечения, сопровождается непродуктивным кашлем, лихорадкой и одышкой. При развитии острого пневмонита требуется дифференциальный диагноз с инфекционным процессом в легких. Положительная динамика при остром пневмоните достигается после отмены ЦФ и назначения высоких доз ГК. Поздний пневмонит развивается после нескольких лет экспозиции ЦФ, медленно прогрессирует, проявляется нарастающей одышкой и сухим кашлем. На рентгенограммах легких обычно выявляются признаки интерстициального фиброза в верхних долях, эффекта от ГК не наблюдается [68, 73].
Хроническая болезнь почек
Примерно 35% больных СКВ имеют признаки почечного поражения на момент установления диагноза; в течение первых 10 лет болезни нефрит развивается у 50–60% больных. Частота ВН достоверно выше у афроамериканцев и испанцев по сравнению с кавказоидами и выше у мужчин по сравнению с женщинами [74–79]. Неблагоприятные исходы ВН продолжают оставаться одной из ведущих проблем ревматологии, несмотря на доступность новых терапевтических подходов. 25–30% больных диффузным пролиферативным ВН достигают конечной стадии хронической почечной недостаточности в течение 20-летнего периода [80].
Предикторами неблагоприятного исхода при ВН считают мужской пол, принадлежность к черной расе, возраст моложе 24 лет, низкий социальный статус, некомплаентность, повышенные уровни креатинина, нефротическую протеинурию, отсутствие ответа на терапию при нефритическом синдроме, выраженную анемию, гипертензию, низкие уровни комплемента, позитивность по аФЛ, ряд гистологических признаков (диффузная пролиферация, полулуния, высокие индексы активности и хронизации), особенности терапии [81].
Неблагоприятное влияние на исходы заболевания оказывают и рецидивы ВН. Частота рецидивов ВН составляет около 25% к 5-му году, 46% – к 10-му году заболевания. У 36% больных рецидивы развиваются в течение первого года после отмены терапии. Предикторами рецидивов ВН являются высокий индекс активности, высокие уровни протеинурии, мужской пол, молодой возраст, АГ на ранних стадиях почечного поражения, позднее начало цитотоксической терапии, позднее развитие ответа на терапию, короткий курс индукционной терапии. Больные с частичным ответом на терапию более склонны к развитию обострений по сравнению с больными с полным ответом (63 и 40% соответственно). Стойкое повышение уровней сывороточного креатинина чаще встречается у пациентов с большим количеством почечных обострений, в первую очередь с ранними протеинурическими и нефритическими обострениями [82]. Риск развития хронической почечной недостаточности у больных с почечными обострениями (особенно нефритическими) увеличивается примерно в 7 раз [83].
Таким образом, современная терапия больных ВН должна быть основана на своевременной диагностике почечного поражения, выборе адекватного метода лечения, «настойчивости» терапии с целью быстрого достижения ремиссии ВН и профилактики рецидивов почечного поражения [84]. Больные СКВ нуждаются в постоянном мониторинге для своевременного принятия решения об инициации или экскалации иммуносупрессивной терапии, необходимости нефробиопсии (в т. ч. повторной), мультидисциплинарном подходе (скрининг на аФЛ, контроль сопутствующей инфекции, коррекция кардиоваскулярных факторов риска и др.) [85].
Тромботические осложнения
Больным СКВ свойственны гиперкоагуляция и возникновение тромбозов различной локализации и, как следствие, органная недостаточность в зависимости от топики и диаметра пораженного сосуда. Вклад в развитие тромботических осложнений у больных СКВ вносят высокая активность заболевания, поражение почек, АГ и аФЛ. Гиперпродукция аФЛ ассоциируется с развитием у 10–15% больных СКВ вторичного антифосфолипидного синдрома (АФС), проявляющегося рецидивирующими артериальными и/или венозными тромбозами, и акушерской патологией (чаще синдромом потери плода) [86]. По данным некоторых авторов, наличие вторичного АФС у больных СКВ сопровождается быстрым развитием необратимого органного поражения и негативно влияет на выживаемость [87].
Всем больным СКВ на момент установления диагноза рекомендуются определение исходного уровня аФЛ, выявление и коррекция факторов риска развития и рецидивирования тромбозов. Согласно рекомендациям по ведению больных с АФС проводится тромбопрофилактика в зависимости от локализации тромбоза, степени риска рецидива тромботических осложнений, факторов риска кровотечений. Больные с достоверным АФС и тромбозами должны длительно (пожизненно) получать антитромботическую терапию. Также профилактика необходима всем больным с положительными аФЛ (независимо от их уровней) в ситуациях высокого риска развития тромбоза, таких как хирургические вмешательства, длительная иммобилизация и послеродовый период [88–91].
Для небеременных женщин с АФС целесообразны: длительный прием антиагрегантов или антикоагулянтов; во время беременности – терапия прямыми антикоагулянтами для профилактики потери плода. Беременным бессимптомным аФЛ-позитивным женщинам с СКВ рекомендуется назначение аминохинолиновых препаратов для первичной профилактики [92, 93].
Остеопороз
Частота ОП при СКВ варьирует от 4 до 6% у женщин пременопаузального возраста и от 3 до 48% у женщин в менопаузе. Риск развития ОП и остеопоротических переломов у больных СКВ выше по сравнению с популяцией, что связано с традиционными и связанными с заболеваниями факторами риска (отказ от инсоляции, хроническое воспаление, прием ГК или ранняя менопауза вследствие самого заболевания или терапии цитотоксиками) [94, 95]. Непосредственное влияние СКВ на качество кости было подтверждено наблюдением, что у женщин пременопаузального возраста даже с небольшой давностью заболевания, не получавших ГК, минеральная плотность костной ткани (МПКТ) оказалась достоверно ниже по сравнению с сопоставимым по возрасту контролем [96]. И, конечно, длительная иммуносупрессивная терапия оказывает огромное влияние на МПКТ у больных СКВ.
ГК являются наиболее важным фактором ОП и переломов. Потеря костной массы начинается на ранних этапах лечения ГК (5–15% в течение первого года терапии) и продолжается в течение всего периода приема препарата; преимущественно поражается трабекулярная кость; переломы развиваются при более высоких показателях МПКТ, чем у больных, не принимающих ГК, что предполагает нарушение качества костной ткани [97, 98].
Профилактика и лечение ОП у больных включает воздействие на традиционные (отказ от курения, физические упражнения) и специфичные факторы риска (контроль активности СКВ, разумное использование ГК); оптимизацию уровня витамина D, прием препаратов кальция и при необходимости назначение бисфосфонатов [99].
Гиповитаминоз D
В последние годы появились убедительные доказательства патогенетической роли витамина D в развитии злокачественных новообразований, кардиоваскулярной патологии, СД 2-го типа, депрессии и аутоиммунных заболеваний [100]. Обнаружено, что гиповитаминоз D является независимым фактором риска общей летальности в популяции [101].
Солнечные лучи являются хорошо известным триггером СКВ. Отказ от инсоляции и использование солнцезащитных кремов являются компонентами терапии СКВ, поэтому при данном заболевании наличие дефицита витамина D неудивительно. Другими важными факторами, способствующими развитию гиповитаминоза D при СКВ, являются почечная недостаточность, длительное использование некоторых лекарств (ГК, аминохинолиновые производные, противоэпилептические средства), а также наличие антител к витамину D, усиливающих его клиренс [102].
По данным исследований последних лет, недостаточность витамина D выявляется у 2/3, дефицит витамина D – у каждого пятого больного СКВ [103]. Получены данные о связи низких сывороточных уровней гидроксивитамина D c риском развития, активностью, тяжестью и прогнозом заболевания. Обнаружены доказательства ассоциации низких уровней витамина D у больных СКВ с традиционными факторами риска КВЗ (АГ, гиперлипидемией, СД, повышенным индексом массы тела), уровнями фибриногена, С-реактивного белка, высокими уровнями антиядерных антител (АЯА), слабостью [102, 104]. В свете полученных данных инициировано несколько исследований по изучению значения витамина D при СКВ с фокусом на возможную предрасположенность к возникновению заболевания, развитию обострений и коморбидных состояний. Обсуждается целесообразность коррекции гиповитаминоза D у больных СКВ. Следует отметить, что недавно обнаруженные антирезорбтивные, противовоспалительные и иммуномодулирующие свойства метаболитов витамина D могут оказаться полезными при хронических воспалительных заболеваниях при использовании в комбинации с традиционными средствами [105].
Синдром фибромиалгии
Распространенность фибромиалгии среди взрослой популяции составляет 0,7–13%. Для фибромиалгии, как и при СКВ, характерно преобладание заболевших женщин над мужчинами (7–9:1) [106]. Нередко больным с фибромиалгией ошибочно ставится диагноз системного заболевания соединительной ткани. H. Dinerman et al. обнаружили, что 14% больных фибромиалгией могут иметь положительные результаты определения АЯА, у 30% больных встречается синдром Рейно и 18% больных имеют признаки синдрома Шегрена [107].
По мнению большинства исследователей, фибромиалгия как сопутствующая патология встречается по меньшей мере у 20–25% больных СКВ, при этом в некоторых странах отмечается и более высокая частота синдрома [108].
G.D. Middleton et al. отмечали, что больные СКВ, сочетающейся с фибромиалгией, имеют высокую частоту генерализованной боли, миалгий, нарушений сна, депрессии, абдоминальных болей, дисменореи и повышенной чувствительности к свету и шуму. Некоторые проявления фибромиалгии могут имитировать активность СКВ. Наличие фибромиалгического синдрома у больных СКВ в несколько раз утяжеляет клиническую картину основного заболевания и требует особых подходов к лечению [109, 110].
Нейропсихические нарушения
Кумулятивная частота нейропсихических нарушений у больных СКВ достигает 30–40%. Поражение ЦНС ассоциируется не только с более тяжелым течением, повышенным риском неблагоприятного исхода, но и с низкими показателями качества жизни. Показано отрицательное влияние на качество жизни фибромиалгического синдрома, усталости, синдрома генерализованной слабости, психологических особенностей (таких как тревожность, подверженность стрессу и самовнушение стресса) и депрессии [111, 112].
Частота встречаемости тревожно-депрессивных расстройств при СКВ составляет 50–83%, при этом примерно у половины больных депрессия может предшествовать дебюту СКВ. До сих пор ведутся споры о том, является ли депрессия при СКВ следствием хронического страдания или относится к нейропсихическим проявлениям заболевания [113]. С одной стороны, существует точка зрения относительно участия некоторых аутоантител (антитела к рибосомальному белку Р, аФЛ и др.) в развитии депрессии. С другой стороны, получены данные о том, что предикторами развития депрессии у больных СКВ являются активность заболевания и СД [114].
Несмотря на высокую частоту депрессии, патология часто остается нераспознанной в силу ряда причин: нежелания больного обсуждать существующие психологические проблемы, отсутствия информированности медперсонала о значимости депрессивных расстройств. Кроме того, выявление депрессии осложняется тем, что некоторые симптомы (например, хроническая усталость, двигательная заторможенность, снижение аппетита и массы тела, бессонница) рассматриваются как проявления основного заболевания. По имеющимся данным, только каждый четвертый больной получает адекватную психофармакологическую и психотерапевтическую помощь. Следует заметить, что депрессия, особенно в отсутствие адекватной коррекции, может способствовать сохранению воспалительного процесса (ввиду общности патогенеза), влиять на соблюдение больным медицинских рекомендаций и тем самым – на течение и исход основного заболевания [115].
В 2010 г. были опубликованы рекомендации EULAR по ведению больных с нейропсихическими проявлениями, в которых наряду с обязательной оценкой качества жизни больных (с использованием опросника LupusQol) подчеркивается необходимость пристального внимания к выявлению и коррекции специфических проявлений (депрессии, слабости, утомляемости) [116].
Злокачественные новообразования
Злокачественные новообразования являются важной составляющей коморбидности. Развитие опухолей при ревматических заболеваниях связано с патофизиологией основного заболевания (хроническое воспаление, иммунологические нарушения – в первую очередь хроническая активация В- и Т-клеток, факторы окружающей среды – например, вирусные инфекции или курение) и иммуномодуляторной терапией (особенно использованием цитотоксических препаратов) [117].
В большом мультицентровом исследовании, включавшем 9547 больных, при длительности наблюдения в среднем 8 лет было зарегистрировано повышение риска развития злокачественных новообразований у больных СКВ, в основном за счет лимфопролиферативных заболеваний. В целом ОР развития рака при СКВ составлял 1,15 (95% ДИ = 1,05, 1,27), для гематологических заболеваний – 2,75, для неходжкинских лимфом – 3,65. Самый высокий риск зарегистрирован в отношении наиболее агрессивной формы – диффузной В-крупноклеточной лимфомы [118]. Имеются доказательства высокого риска развития рака легких (ОР=1,37) и гепатобилиарного рака (ОР=2,60). Ряд исследователей подчеркивает возможность увеличения частоты других злокачественных новообразований, включая рак щитовидной (ЩЖ), молочной железы и шейки матки, плоскоклеточную карциному [119–121].
К факторам риска развития злокачественных новообразований у больных СКВ относят хроническое воспаление и активность заболевания, иммунологические дефекты и гиперэкспрессию Bcl-2 онкогенов, а также вирусы – Эпштейна – Барр и ВПЧ [122].
Лейкопения, независимо от иммуносупрессивного лечения, является фактором риска развития лейкемии. Поэтому больным СКВ со стойкой лейкопенией и анемией рекомендовано исследование костного мозга. Факторами риска развития неходжкинской лимфомы у больных СКВ считают длительность заболевания и стойкое сохранение активности болезни с развитием тяжелого органного повреждения [123].
В связи с тем, что СКВ и лимфомы имеют ряд схожих проявлений (лихорадка, лимфаденопатия, цитопении, моноклональная гиперсекреция), следует сохранять настороженность в отношении развития данной сопутствующей патологии и проводить дифференциально-диагностический поиск. Риск развития гематологических опухолей увеличивается, как правило, в 5-летний период после прекращения иммуносупрессивной терапии.
Развитие цервикальной дисплазии у женщин с СКВ рассматривается как результат нарушенного клиренса ВПЧ вследствие экспозиции цитотоксиков, главным образом ЦФ (было показано, что повышение кумулятивной дозы ЦФ на 1 г сопровождается нарастанием риска карциномы шейки матки на 13%) [117].
Эндокринная патология
Частота аутоиммунного поражения ЩЖ (3,9–24%) и выявления положительных антитиреоидных антител (11–51%) широко варьирует в различных когортах больных СКВ. На 1-е место среди сопутствующих диагнозов выходит гипотиреоз, частота которого (от 4 до 10%) значительно выше по сравнению с популяцией (менее 1%) [124].
Ассоциация между СКВ и патологией ЩЖ была впервые описана в 1961 г., однако до сих пор остаются вопросы относительно связи с активностью заболевания и роли антитиреоидных антител; неизвестно влияние глюкокортикоидной и иммуносупрессивной терапии на частоту и эволюцию нарушений ЩЖ [125, 126].
При обследовании 100 больных в Бразилии, не имевших до установления диагноза СКВ признаков поражения ЩЖ, у 76% были обнаружены клинические симптомы, подразумевавшие ее дисфункцию. К наиболее частым симптомам относились: эмоциональная нестабильность (39,5%), тревожность (36,8%), слабость и утомляемость (35,5%), нарушения сна (27,6%). Патологические лабораторные тесты выявлены у 17% больных, наиболее часто встречалось повышение уровней тиреотропного гормона (10%). У 4% больных имелись лабораторные критерии первичного гипотиреоза, антитиреоидные аутоантитела выявлялись у 6% больных. Следует отметить, что в исследовании не было выявлено прямой связи между признаками дисфункции ЩЖ и параметрами активности СКВ [127].
D. Pyne et al. при обследовании 300 больных обнаружили, что наиболее частой формой поражения ЩЖ был гипотиреоз (5,7% больных), при этом у 8 из 17 больных поражение ЩЖ было выявлено до появления признаков СКВ, у 6 – на фоне имеющейся СКВ и у 3 – одновременно с установлением диагноза СКВ. Что касается частоты гипертиреоза (1,7%) в данной когорте, то она не отличалась от таковой в популяции (1,9%) [128, 129]. В то же время имеются описания сочетания тиреотоксикоза (болезни Грейвса) и СКВ, при этом в большинстве случаев тиреотоксикоз предшествует (а по мнению некоторых авторов, и индуцирует) СКВ. Отмечаются возможность развития волчаночноподобного синдрома на фоне лечения антитиреоидными препаратами и трудность дифференциального диагноза между тиреотоксикозом и идиопатической СКВ [130].
L. Dong et al. показали, что субклинический гипотиреоз у больных СКВ ассоциируется с более низкой скоростью достижения ремиссии и более высокими показателями необратимого органного повреждения в будущем. Таким образом, у больных СКВ (особенно при наличии симптоматики) необходимо определять функциональное состояние ЩЖ для адекватной коррекции терапии [131]. Кроме того, ряд симптомов, обусловленных поражением ЩЖ, могут имитировать проявления активности СКВ.
Отмечены более высокая частота СД и нарушения толерантности к глюкозе по сравнению с популяцией [132]. Около 1/3 больных СКВ имеют метаболический синдром, который развивается у молодых женщин даже на ранней стадии заболевания [133, 134]. Факторами риска развития метаболического синдрома являются высокие средние суточные дозы ГК, поражение почек и применение иммуносупрессантов. Высказывается мнение, что глюкокортикоидный СД может развиваться у каждого четвертого больного СКВ, особенно у больных пожилого возраста, при наличии в семейном анамнезе СД и вследствие применения высоких доз ГК и микофенолата мофетила [135].
Заключение
СКВ – заболевание с полиорганной симптоматикой. Клинические и лабораторные проявления могут быть следствием активности заболевания, но также могут отражать наличие сопутствующей патологии. Дифференциальная диагностика и уточнение генеза имеющихся проявлений крайне необходимы для выбора лечебной тактики, которая может коренным образом отличаться у больных с активизацией СКВ и у больных СКВ с присоединением коморбидных состояний. Кроме того, необходим скрининг с целью выявления сопутствующих состояний на момент установления диагноза, перед назначением или усилением иммуносупрессивной терапии, в процессе наблюдения за больными для профилактики или своевременной коррекции коморбидной патологии, а также осложнений заболевания и терапии. Тактика обследования и мониторинга больных СКВ подробно изложена в отечественных и зарубежных рекомендациях [136, 137].
Как с практических, так и с научных позиций представляет интерес изучение влияния коморбидных состояний на прогноз больных СКВ. В медицине для этих целей давно используется индекс коморбидности Чарлсона, который зарекомендовал себя хорошим прогностическим показателем. У больных ревматоидным артритом было обнаружено, что исходное определение коморбидности при помощи индекса Чарлсона оказалось более значимым предиктором летальности по сравнению с индексами тяжести ревматоидного артрита и лабораторными параметрами [138]. Что касается СКВ, то аналогичные исследования крайне малочисленны. Однако недавно были опубликованы результаты длительного наблюдения больных СКВ в 2-х когортах и было показано, что показатели индекса коморбидности Чарлсона ассоциировались с более низкими показателями выживаемости независимо от возраста больных, активности СКВ и органного повреждения. Рассматривается вопрос об использовании индекса коморбидности (наряду с определением индекса повреждения и других инструментов) в качестве одного из прогностических параметров при СКВ [139].
Литература
1. Клинические рекомендации по ревматологии. 2-е изд., испр. и доп. / под ред. акад. РАМН Е.Л. Насонова. М.: ГЭОТАР-Медиа, 2010. С. 429–481.
2. Клюквина Н.Г., Насонов Е.Л. Особенности клинических и лабораторных проявлений системной красной волчанки // Современная ревматология. 2012. № 4. С. 40–48.
3. Bertsias G.K., Salmon J.E., Boumpas D.T. Therapeutic opportunities in systemic lupus erythematosus: state of the art and prospects for the new decade // Ann Rheum Dis. 2010. Vol. 69. Р. 1603–1611.
4. Peterson J.C., Paget S.A., Lachs M.S., Reid M.C., Charlson M.E. The risk of comorbidity // Ann Rheum Dis. 2012. Vol. 71. Р. 635–637.
5. Насонов Е.Л. Достижения ревматологии в XXI веке // Научно-практическая ревматология. 2014. № 52 (2). С. 133–140.
6. Radner H., Yoshida K., Smolen J.S., Solomon D.H. Multimorbidity and rheumatic conditions-enhancing the concept of comorbidity // Nat Rev Rheumatol. 2014 Apr. Vol. 10 (4). Р. 252–256.
7. Гордеев А.В., Галушко Е.А., Насонов Е.Л. Концепция мультиморбидности в ревматологической практике // Научно-практическая ревматология. 2014. № 52 (4). С. 362–365.
8. Prados-Torres A. Multimorbidity patterns: a systematic review // J Clin Epidemiol. 2014. Vol. 67 (3). Р. 254–266.
9. Campbell-Scherer D. Multimorbidity: a challenge for evidence-basrd medicine // Evid Based Med. 2010. Vol. 15 (6). Р. 165–166.
10. Petri M. Epidemiology of systemic lupus erythematosus // Best Pract Res Clin Rheumatol. 2002. Vol. 16 (5). Р. 847–858.
11. Urowitz M.B., Bookman A.A., Koehler B.E., Gordon D.A., Smythe H.A., Ogryzlo M.A. The bimodal mortality pattern of systemic lupus erythematosus // Am J Med. 1976. Vol. 60 (2). Р. 221–225.
12. Mosca M., Tani C., Aringer M .et al. European League Against Rheumatism recommendations for monitoring patients with systemic lupus erythematosus in clinical practice and in observational studies // Ann Rheum Dis. 2010. Vol. 69 (7). Р. 1269–1274.
13. Doria A., Canova M., Tonon M. et al. Infections as triggers and complications of systemic lupus erythematosus // Autoimmun Rev. 2008. Vol. 8. Р. 24–28.
14. Goldblatt F., Chambers S., Rahman A., Isenberg D.A. Serious infections in British patients with systemic lupus erythematosus: hospitalizations and mortality // Lupus. 2009. Vol. 18 (8). Р. 682–689.
15. Barber C., Gold W.L., Fortin P.R. Infections in the lupus patient: perspectives on prevention // Curr Opin Rheumatol. 2011. Vol. 23 (4). Р. 358–365.
16. Petri M. Infection in systemic lupus erythematosus // Rheum Dis Clin North Am. 2008. Vol. 24. N 2 (May). P. 423–456.
17. Bosch X., Guilabert A., Pallares L. et al. Infections in systemic lupus erythematosus: a prospective and controlled study of 110 patients // Lupus. 2006. Vol. 15 (9). Р. 584–589.
18. Wang L.R., Barber C.E., Johnson A.S., Barnabe C. Invasive fungal disease in systemic lupus erythematosus: A systematic review of disease characteristics, risk factors, and prognosis // Semin Arthritis Rheum. 2014. Vol. 44 (3). Р. 325–330.
19. Tsai M.J., Chou C.W., Lin F.C., Chang S.C. Pneumocystis jiroveci pneumonia in patients with systemic lupus erythematosus after rituximab therapy // Lupus. 2012. Vol. 21 (8). Р. 914–918.
20. Bonilla-Abadia F., Betancurt J.F., Pineda J.C. et al. Pneumocystis jirovecii pneumonia in two patients with systemic lupus erythematosus after rituximab therapy // Clin Rheumatol. 2014. Vol. 33 (3). Р. 415–418.
21. Stamp L.K., Hurst M. Is there a role for consensus guidelines for P. jiroveci pneumonia prophylaxis in immunosuppressed patients with rheumatic diseases? // J Rheumatol. 2010. Vol. 37 (4). Р. 686–688.
22. Mohamed D.F., Habeeb R.A., Hosny S.M., Ebrahim S.E. Incidence and risk of infection in egyptian patients with systemic lupus erythematosus // Clin Med Insights Arthritis Musculoskelet Disord. 2014. Vol. 7. Р. 41–48.
23. Hidalgo-Tenorio C., Jimenez-Alonso J., de Dios Luna J. et al. Urinary tract infections and lupus erythematosus // Ann Rheum Dis. 2004. Vol. 63 (4). Р. 431–437.
24. Duran-Barragan S., Ruvalcaba-Naranjo H., Rodriguez-Gutierrez L. Recurrent urinary tract infections and bladder dysfunction in systemic lupus erythematosus // Lupus. 2008. Vol. 17 (12). Р. 1117–1121.
25. Tsai Y.C., Hou C.L., Yao T.C. et al. Risk factors and bacterial profiles of urinary tract infections in patients with systemic lupus erythematosus // Asian Pac J Allergy Immunol. 2007. Vol. 25 (2–3). Р. 155–161.
26. Белов Б.С., Насонов Е.Л. Коморбидные хронические вирусные инфекции в ревматологической практике // РМЖ. 2012. № 7. С. 345–349.
27. Ramos-Casals M., Cuadrado M.J., Alba P. et al. Acute viral infections in patients with systemic lupus erythematosus: description of 23 cases and review of the literature // Medicine (Baltimore). 2008. Vol. 87 (6). Р. 311–318.
28. Klumb E.M., Pinto A.C., Jesus G.R. et al. Are women with lupus at higher risk of HPV infection? // Lupus. 2010. Vol. 19 (13). Р. 1485–1491.
29. Lyrio L.D., Grassi M.F., Santana I.U. et al. Prevalence of cervical human papillomavirus infection in women with systemic lupus erythematosus // Rheumatol Int. 2013. Vol. 33 (2). Р. 335–340.
30. Santana I.U., Gomes Ado N. et al. Systemic lupus erythematosus, human papillomavirus infection, cervical pre-malignant and malignant lesions: a systematic review // Clin Rheumatol. 2011. Vol. 30 (5). Р. 665–672.
31. Mendoza-Pinto C., Garcia-Carrasco M., Vallejo-Ruiz V. et al.The impact of glucocorticoids and anti-cd20 therapy on cervical human papillomavirus infection risk in women with systemic lupus erythematosus // Clinics (Sao Paulo). 2013 Dec. Vol. 68 (12). Р. 1475–1480.
32. Molloy E., Calabrese L.H. Progressive multifocal leucoencephalopaty associated with biological therapy in rheumatic diseases // Arthritis Rheum. 2014. Vol. 66 (Suppl 10). Abstr. 837.
33. Seta N., Shimizu T., Nawata M. et al. A possible novel mechanism of opportunistic infection in systemic lupus erythematosus, based on a case of toxoplasmic encephalopathy // Rheumatology. 2002. Vol. 41. N 9 (Sept). P. 1072–1073.
34. Ramurez-Gуmez L.A., Velysquez J.F., Granda P., Alfonzo-Builes C., Jaimes F. Association between disease activity and risk of nosocomial infection in patients from a University Hospital at Medellyn: prospective study 2001-2004 // Rev Col Reumatol. 2007. Vol. 24. N 3 (Sept). P. 177–186.
35. Al-Arfaj A.S., Khallil N. Clinical and immunological manifestations in 624 SLE patients in Saudi Arabia // Lupus. 2009. Vol. 18. N 5 (Apr). P. 465–473.
36. Millet A., Decaux O., Perlat A., Grosbois B., Jego P. Systemic lupus erythematosus and vaccination // Eur J Intern Med. 2009. Vol. 20 (3). Р. 236–241.
37. Mok M.Y., Wong S.S., Chan T.M., Fong D.Y., Wong W.S., Lau C.S. Nontuberculous mycobacterial infection in patients with systemic lupus erythematosus // Rheumatology. 2007. Vol. 46. N 2 (Febr). P. 280–284.
38. Cuchacovich R., Gedalia A. Pathophysiology and clinical spectrum of infections in systemic lupus erythematosus // Rheum Dis Clin North Am. 2009. Vol. 35. N 1 (Febr). P. 75–93.
39. Shyam C., Malaviya A.N. Infection-related morbidity in systemic lupuserythematosus: a clinical-epidemiological study from northern India // Rheumatol Int. 1996. Vol. 16. N 1. P. 1–3.
40. Yun J.E., Lee S.W., Kim T.H. et al. The incidence and clinical characteristics of Mycobacterium tuberculosis infection among systemic lupus erythematosus and rheumatoid arthritis patients in Korea // Clin Exp Rheumatol. 2002. Vol. 20. Р. 127–132.
41. Tam L.S., Li E.K., Wong S.M., Szeto C.C. Risk factors and clinical features for tuberculosis among patients with systemic lupus erythematosus in Hong Kong // Scand J Rheumatol. 2002. Vol. 31. Р. 296–300.
42. Sayarlioglu M., Inanc M., Kamali S. et al. Tuberculosis in Turkish patients with systemic lupus erythematosus: increased frequency of extrapulmonary localization // Lupus. 2004. Vol. 13. Р. 274–278.
43. Pasoto S.G., Borba E.F., Bonfa E., Shinjo S.K. Lupus pleuritis: a relevant risk factor for pulmonary tuberculosis // Lupus. 2010. Vol. 19. Р. 1585–1590.
44. Lee E., Holzman R.S. Evolution and current use of the tuberculin test // Clin Infect Dis. 2002. Vol. 34. Р. 365–370.
45. Mosca M., Tani C., Aringer M. et al. European League Against Rheumatism recommendations for monitoring patients with systemic lupus erythematosus in clinical practice and in observational studies // Ann Rheum Dis. 2010. Vol. 69 (7). Р. 1269–1274.
46. Arenas Miras Mdel M., Hidalgo-Tenorio C., Jimenez-Gamiz P., Jimenez-Alonso J. Diagnosis of latent tuberculosis in patients with systemic lupus erythematosus: T.SPOT.TB versus tuberculin skin test // Biomed Res Int. 2014. 291031.
47. Kadavath S., Zapantis E., Henriquez W. et al. Effectiveness of combining tuberculin skin test and interferon gamma release assays as a screening strategy for detecting latent tuberculosis infection in high risk patients with systemic lupus erythematosus // Ann Rheum Dis. 2013. Vol. 72. Suppl 3. Р. 478.
48. Белов Б.С. Ревматологические аспекты туберкулеза // РМЖ. 2007. № 15 (8). С. 670–672.
49. Manzi S., Meilahn E.N., Rairie J.E. et al. Age-specific incidence rates of myocardial infarction and angina in women with systemic lupus erythematosus: comparison with the Framingham Study // Am J Epidemiol. 1997. Vol. 145. Р. 408–415.
50. Frostegard J. Systemic lupus erythematosus and cardiovascular disease // Lupus. 2008. Vol. 17. Р. 364–367.
51. Hak A.E., Karlson E.W., Feskanich D. et al. Systemic lupus erythematosus and the risk of cardiovascular disease: results from the nurses’ health study // Arthritis Rheum. 2009. Vol. 61. Р. 1396–1402.
52. Rajagopalan S., Somers E.C., Brook R.D. et al. Endothelial cell apoptosis in systemic lupus erythematosus: a common pathway for abnormal vascular function and thrombosis propensity // Blood. 2004. Vol.103. Р. 3677–3683.
53. Roman M.J., Shanker B.A., Davis A. et al. Prevalence and correlates of accelerated atherosclerosis in systemic lupus erythematosus // N Engl J Med. 2003. Vol. 349. Р. 2399–2406.
54. Bruce I.N., Burns R.J., Gladman D.D., Urowitz M.B. Single photon emission computed tomography dual isotope myocardial perfusion imaging in women with systemic lupus erythematosus. I. Prevalence and distribution of abnormalities // J Rheumatol. 2000. Vol. 27. Р. 2372–2377.
55. Esdaile J.M., Abrahamowicz M., Grodzicky T. et al. Traditional Framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus // Arthritis Rheum. 2001. Vol. 44. Р. 2331–2337.
56. Symmons D.P., Gabriel S.E. Epidemiology of CVD in rheumatic disease, with a focus on RA and SLE // Nat Rev Rheumatol. 2011. Vol. 7 (7). Р. 399–408.
57. Wajed J., Ahmad Y., Durrington P.N., Bruce I.N. Prevention of cardiovascular disease in systemic lupus erythematosus: proposed guidelines for risk factor management // Rheumatology (Oxford). 2004. Vol. 43 (1). Р. 7–12.
58. Jung H., Bobba R., Su J. et al. The protective effect of antimalarial drugs on thrombovascular events in systemic lupus erythematosus // Arthritis Rheum. 2010. Vol. 62. Р. 863–868.
59. Van Leuven S.I., van Wijk D.F., Volger O.L. et al. Mycophenolate mofetil attenuates plaque inflammation in patients with symptomatic carotid artery stenosis // Atherosclerosis. 2010. Vol. 211. Р. 231–236.
60. David K.M., Morris J.A., Steffen B.J. et al. Mycophenolate mofetil vs. azathioprine is associated with decreased acute rejection, late acute rejection, and risk for cardiovascular death in renal transplant recipients with pretransplant diabetes // Clin Transplant. 2005. Vol. 19. Р. 279–285.
61. Van Leuven S.I., Mendez-Fernandez Y.V., Wilhelm A.J. et al. Mycophenolate mofetil but not atorvastatin attenuates atherosclerosis in lupus-prone LDLr (/) mice // Ann Rheum Dis. 2012. Vol. 71. Р. 408–414.
62. Petri M.A., Kiani A.N., Post W. et al. Lupus Atherosclerosis Prevention Study (LAPS) // Ann Rheum Dis. 2011. Vol. 70. Р. 760–765.
63. Knight J.S., Kaplan M.J. Cardiovascular disease in lupus. Insigts and updates // Curr Opin Rheum. 2013. Vol. 25 (5). Р. 597–605.
64. Murray S.G., Yazdany J., Kaiser R. et al. Cardiovascular disease and cognitive dysfunction in systemic lupus erythematosus // Arthritis Care Res (Hoboken). 2012. Vol. 64. Р. 1328–1333.
65. Greco C.M., Li T., Sattar A. et al. Association between depression and vascular disease in systemic lupus erythematosus // J Rheumatol. 2012. Vol. 39. P. 262–268.
66. Maynard J.W., Fang H., Petri M. Low socioeconomic status is associated with cardiovascular risk factors and outcomes in systemic lupus erythematosus // J Rheumatol. 2012. Vol. 39. P. 777–783.
67. Gutsche M., Rosen G.D., Swigris J. Connective tissue disease-associated interstitial lung disease: a review // Curr Respir Care Rep. 2013. Vol. 1. P. 224–232.
68. Pego-Reigosa J.M., Medeiros D.A., Isenberg D.A. Respiratory manifestations of systemic lupus erythematosus: old and new concepts // Best Pract Res Clin Rheumatol. 2009. Vol. 23. P. 469–480.
69. Quadrelli S.A., Alvarez C., Arce S.C., Paz L., Sarano J., Sobrino E.M., Manni J. Pulmonary involvement of systemic lupus erythematosus: analysis of 90 necropsies // Lupus 2009. Vol. 18. P. 1053–1060.
70. Swigris J.J., Fischer A., Gillis J., Meehan R.T., Brown K.K. Pulmonary and thrombotic manifestations of systemic lupus erythematosus // Chest. 2008. Vol. 133. P. 271–280.
71. Tanaka E., Harigai M., Tanaka M., Kawaguchi Y., Hara M., Kamatani N. Pulmonary hypertension in systemic lupus erythematosus: evaluation of clinical characteristics and response to immunosuppressive treatment // J Rheumatol. 2002. Vol. 29. P. 282–287.
72. Lateef O., Shakoor N., Balk R.A. Methotrexate pulmonary toxicity // Expert Opin Drug Saf. 2005. Vol. 4. P. 723–730.
73. Malik S.W., Myers J.L., DeRemee R.A., Specks U. Lung toxicity associated with cyclophosphamide use. Two distinct patterns // Am J Respir Crit Care Med. 1996. Vol. 154. P. 1851–1856.
74. Dooley M.A., Aranow C., Ginzler E.M. Review of ACR renal criteria in systemic lupus erythematosus // Lupus. 2004. Vol. 13(11). P. 857–860.
75. Kasitanon N., Magder L.S., Petri M. Predictors of survival in systemic lupus erythematosus // Medicine (Baltimore). 2006. Vol. 85(3). P. 147–156.
76. Ward M.M., Pyun E., Studenski S. Mortality risks associated with specific clinical manifestations of systemic lupus erythematosus // Arch Intern Med. 1996. Vol. 156 (12). P. 1337–1344.
77. Alarcon G.S., McGwin G. Jr, Petri M., Reveille J.D., Ramsey-Goldman R., Kimberly R.P. Baseline characteristics of a multiethnic lupus cohort: PROFILE // Lupus. 2002. Vol. 11 (2). P. 95–101.
78. Bernatsky S., Boivin J.F., Joseph L., Manzi S., Ginzler E., Gladman D.D., Urowitz M., Fortin P.R., Petri M., Barr S. et al. Mortality in systemic lupus erythematosus // Arthritis Rheum. 2006. Vol. 54 (8). P. 2550– 2557.
79. Cervera R., Khamashta M.A., Font J., Sebastiani G.D., Gil A., Lavilla P., Mejia J.C., Aydintug A.O., Chwalinska-Sadowska H., de Ramon E. et al. Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients // Medicine (Baltimore). 2003. Vol. 82 (5). P. 299–308.
80. Cameron J.S. Lupus nephritis // J Am Soc Nephrol. 1999. Vol. 10. P. 413–424.
81. Contreras G. et al. Factors associated with poor outcomes in patients with lupus nephritis // Lupus. 2005. Vol. 14. P. 890–895.
82. Tesar V., Hruskova Z. Treatment of proliferative lupus nephritis: a slowly changing landscape // Nat. Rev.Nephrol. 2011. Vol. 7. P. 96–109.
83. Moroni G., Quaglini S., Gallelli B., Banfi G., Messa P., Ponticelli C. The long-term outcome of 93 patients with proliferative lupus nephritis // Nephrol Dial Transplant. 2007. Vol. 22. P. 2531–2539.
84. Соловьев С.К., Цанян М.Э., Бекетова Т.В., Асеева Е.А., Николаева Е.В. Принципы интенсифицированной терапии системных аутоиммунных ревматических заболевания // РМЖ. 2014. № 28. С. 2055–2062.
85. Masood S., Jayne D., Karim Y. Beyond immunosuppression – challenges in the clinical management of lupus nephritis // Lupus. 2009. Vol. 18. P. 106–115.
86. Решетняк Т.М. Антифосфолипидный синдром: диагностика и клинические проявления // Научно-практическая ревматология. 2014. № 1. С. 56–71.
87. Ruiz-Irastorza G., Egurbide M.-V., Ugalde J., Aguirre C. High impact of antiphospholipid syndrome on irreversible organ damage and survival of patients with systemic lupus erythematosus // Arch. Intern. Med. 2004. Vol. 164. P. 77–82.
88. Ruiz-Irastoza G., Hunt B.I., Khamashta M.A. A systematic review of secondary thromboprophylaxis in patients with antiphospholipid antibodies // Arthr. Rheum. 2007. Vol. 57. P. 1487–1495.
89. Ruiz-Irastorza G., Cuadrado M., Ruiz-Arruza L. Evidence-based recommendation for the prevention and long-term management of thrombosis in antiphospholipid antibody-positive patients: report of task force at the 13th international congress on antiphospholipid antibodies // Lupus. 2011. Vol. 20. P. 206–218.
90. Kaiser R., Cleveland C., Criswell L.A. Risk and protective factors for thrombosis in systemic lupus erythematosus: results from a large, multi-ethnic cohort // Ann. Rheu. Dis. 2009. Vol. 68. P. 238–241.
91. Danowski A., de Azevedo M.N., de Souza Papi J.A., Petri M.A. Determinants of risk for venous and arterial thrombosis in primary antiphospholipid syndrome and antiphospholipid syndrome with systemic lupus erythematosus // J Rheumatol. 2009. Vol. 36. P. 1195–1199.
92. Cohen D., Berger S.P., Steup-Beekman G.M., Bloemenkamp K.W., Bajema I.M. Diagnosis and management of the antiphospholipid syndrome // BMJ. 2010. Vol. 340. P. 2541.
93. Baer A.N., Witter F.R., Petri M. Lupus and pregnancy // Obstet Gynecol Surv. 2011. Vol. 66 (10). P. 639–653.
94. Becker A., Fischer R., Schneider M. Osteoporosis screening in systemic lupus erythematosus: impact of disease duration and organ damage // Lupus. 2001. Vol. 10. P. 809–814.
95. Nabg H.L., Zhu T.Y., Hung V.W., Qin L., Wong C.-K., Kun E.W., Tam L.S., Li E.K. Increased organ damage associated with deterioration in volumetric bone density and bone mictoarchitecture in patients with systemic lupus erythematosus on longterm glucocorticoid rgerapy // J Rheumatok. 2012. Vol. 39. P. 1955–1963.
96. Lee C., Almador O., Dunlop D.D., Manzi S., Spies S., Chadha A.B. Disease damage and low bone mineral density: an analysis of women with systemic lupus erythematosus ever and never receiving corticosteroids // Rheumatology. 2006. Vol. 45. P. 53–60.
97. Steinbuch M., Youket T.E., Cohen S. Oral glucocorticoid use is associated with an increased risk of fracture // Osteoporosis International. 2004. Vol. 15. P. 323–328.
98. Van Staa T.P., Leufkens H.G.M., Abenhaim L. et al. Use of oral corticosteroids and risk of fractures // The Journal of Bone and Mineral Research. 2000. Vol. 15. P. 993–1000.
99. Bhattoa H.P., Bettembuk P., Balogh A., Szegedi G., Kiss E. Bone mineral density in women with systemic lupus erythematosus // Clin Rheumatol. 2002. Vol. 21 (2). P. 135–141.
100. Melamed M.L., Michos E.D., Post W., Astor V. 25-hydroxyvitamin D levels and the risk of mortality in the general population // Arch Intern Med. 2008. Vol. 168. P. 1629–1637.
101. Autier P., Gandini S. Vitamin D supplementation and total mortality: A meta-analysis of randomized controlled trials // Arch Intern Med. 2007. Vol. 167. Р. 1730–1737.
102. Mok С.С., Birmingham D.J., Ho L.Y., Hebert L.A., Song H., Rovin B.H. Vitamin D deficiency as marker for disease activity and damage in systemic lupus erythematosus: a comparison with anti-dsDNA and anti-C1q // Lupus. 2012. Vol. 21. Р. 36–42.
103. Kamen D.L., Cooper G.S., Bouali H., Shaftman S.R., Hallis B.W., Gilkeson G.S. Vitamin D deficiency in systemic lupus erythematosus // Autoimmun Rev. 2006. Vol. 5. Р. 114–117.
104. Mok C.C., Birmingham D.J., Leung H.W., Hebert L.A., Song H., Rovin B.H. Vitamin D levels in Chinese patients with systemic lupus erythematosus: relationship with disease activity, vascular risk factors and atherosclerosis // Rheumatology. 2012. Vol. 51. Р. 644–652.
105. Abe J., Nakamura K., Takita Y., Nakano T., Irie H., Nishii Y. Prevention of immunological disorders in MRL/l mice by a new synthetic analogue of vitamin D3: 22-oxa-1 alpha, 25-dihydroxyvitamin D3 // J Nutr Sci Vitaminol (Tokyo). 1990. Vol. 36. Р. 21–31.
106. Moork P.J., Nilsen T.I. Sleep problems and risk of fibromyalgia: longitudinal data on an adult female population in Norway // Atrthritis Rheum. 2012. Vol. 64 (1). Р. 281–284.
107. Dinerman H., Goldenberg D.L., Feison D.T. A prospective evaluation of 118 patients with fibromyalgia syndrome: prevalence of Raynaud’s phenomenon, ANA, low complement, and IgG deposition at the dermal-epidermal junction // J Rheumatol. 1986. Vol. 13. Р. 368–373.
108. Buskila D., Sarzi-Puttini P. Fibromyalgia and autoimmune diseases: the pain behing autoimmunity // IMAJ. 2008. Vol. 10. Р. 77–78.
109. Middleton G.D., McFarlin J.E., Lipsky P.E. The prevalence and clinical impact of fibromyalgia in systemic lupus erythematosus // Arthritis Rheum. 1994. Vol. 37. Р. 1181–1188.
110. Wolfe F., Petri M., Alarcon G.S., Goldman J., Chakravarty E.F., Katz R.S., Karlson E.W., Michaud K. Fibromyalgia, systemic lupus erythematosus and the evaluation of SLE activity // J Rheumatol. 2009. Vol. 36 (1). Р. 82–88.
111. Moldovan I., Katsaros E., Carr F.N. et al. The Patient Reported Outcomes in Lupus (PATROL) study: role of depression in health-related quality of life in a Southern California lupus cohort // Lupus. 2011. Vol. 20 (12). Р. 1285–1292.
112. Choi S.T., Kang J.I., Park I.H. et al. Subscale analysis of quality of life in patients with systemic lupus erythematosus: association with depression, fatique, disease activity and damage // Clin Exp Rheumatol. 2012. Vol. 30 (5). Р. 665–662.
113. Kozora E., Arciniegas D.B., Zhang L., West S. Neuropsychological patterns in systemic lupus erythematosus patients with depression // Arthritis Research & Therapy. 2007. Vol. 9. Р. 48.
114. Julian L.J., Tonner C., Yelin E.D., Yasdany J., Trupin L., Criswell L.A., Katz P.P. Cardiovascular and disease-related predictors of depression in systemic lupus erythematosus // Arthritis Care & Research. 2011. Vol. 63 (4). Р. 542–549.
115. Лисицына Т.А., Вельтищев Д.Ю., Насонов Е.Л. Стрессовые факторы и депрессивные расстройства при ревматических заболеваниях // Научно-практическая ревматология. 2013. № 51 (2). С. 98–103.
116. Bertsias G.K., Ioannidis J.P., Aringer M. et al. EULAR recommendations for the management of systemic lupus erythematosus with neuropsychiatric manifestations: report of a task force of the EULAR standing committee for clinical affairs // Ann Rheum Dis. 2010. Vol. 69 (12). Р. 2074–2082.
117. Turesson C., Matteson E.L. Malignancy as a comorbidity in rheumatic diseases // Rheumatology. 2013. Vol. 52 (1). Р. 5–14.
118. Bernatsky S., Boivin J.-F., Clarke Q.A., Rajan R. Cancer risk in systemic lupus erythematosus: a meta-analysis // Arthritis Rheum. 2001. Vol. 44. Suppl. 9. Р. 244.
119. Bernatsky S., Boivin J.F., Joseph L. et al. An international cohort study of cancer in systemic lupus erythematosus // Arthritis Rheum. 2005. Vol. 52. Р. 1481–1490.
120. Parikh-Patel A.R., White H., Allen M., Cress R. Cancer risk in a cohort of patients with systemic lupus erythematosus in California // Cancer Causes Control. 2008. Vol. 19. Р. 887–994.
121. Bernatsky S.R., Cooper G.S., Mill C. et al. Cancer screening in patients with systemic lupus erythematosus // J Rheumatol. 2006. Vol. 33. Р. 45–49.
122. Gayed M., Bernatsky S., Ramsey-Goldman R., Clarke A., Gordon C. Lupus and cancer // Lupus. 2009. Vol. 18. Р. 479–485.
123. King J.K., Costenbader K.H. Characteristics of patients with systemic lupus erythematosus and non-Hodgkin’s lymphoma // Clin Rheum. 2007. Vol. 26. Р. 1491–1494.
124. Miller F.W., Moore G.F., Weintraub B.D., Steinberg A.D. Prevalence of thyroid disease and abnormal thyroid function test results in patients with systemic lupus erythematosus // Arthritis Rheum. 1987. Vol. 30. Р. 1124–1131.
125. Hijmans W., Doniach D., Roitt I.M., Holborow E.J. Serological overlap between lupus erythematosus, rheumatoid arthritis, and thyroid autoimmune disease // Br Med J. 1961. Vol. 2. Р. 909–914.
126. Boey M.L., Fong P.H., Lee J.S., Ng W.Y., Thai A.C. Autoimmune thyroid disorders in SLE in Singapore // Lupus. 1993. Vol. 2. Р. 51–54.
127. Kakehasi A.M., Dias V.N., Duarte J.E., Lanna C.C.D., Parreiras M.A., Carvalho M.A.P. Thyroid abnormalities in systemic lupus erythematosus: a study in 100 Brazilian Patients // Rev Bras Reumatol. 2006. Vol. 46 (6). Р. 375–379.
128. Tunbridge W.M.G., Evered D.C., Hall R. The spectrum of thyroid disease in a community: the Whickham survey // Clin Endocrinol (Oxf). 1977. Vol. 7. Р. 481–493.
129. Pyne D., Isenberg D.A. Autoimmune thyroid disease in systemic lupus erythematosus // Ann Rheum Dis. 2002 Jan. Vol. 61 (1). Р. 70–72.
130. Baleva M., Nikolov K., Manov E., Stoikov A., Shabani R., Dourmishev L., Nikolova M. The Coexistence of systemic lupus erythematosus and thyrotoxicosis: the diagnostic value of antihistone antibodies // Case Reports in Rheumatology. 2012. Atticle ID 517059, doi: 10.1155/2012/17059.
131. Dong L., Jia L., Hong X., Chen G., Mo H. Subclinical hypothyroidism is a risk factor for delayed clinical complete response in patients with systemic lupus erythematosus // Int J Clin Exp Med. 2014. Vol. 7 (9). Р. 2836–2843.
132. Gazareen S., Fayez D., El-Najjar M., Dawood A., Essa E., El-zorkany K. Study of insulin resistance in patients with systemic lupus erythematosus and rheumatoid arthritis // Menoufia Medical Journal. 2014. Vol. 27. Р. 215–225.
133. Gheita T.A., Raafat H.A., Sayed S., El-Fishawy H., Nasrallah M.M., Abdel-Rasheed E. Metabolic syndrome and insulin resistance comorbidity in systemic lupus erythematosus // Z Rgeumatol. 2012. doi 10.1007/s00393-012-1058.
134. Parker B., Urowitz M.B., Gladman D.D. et al. Clinical associations of the metabolic syndrome in systemic lupus erythematosus: data from an international inception cohort // Ann Rheum Dis. 2013. Vol. 72. Р. 1308–1314.
135. Clore J.N., Thurby-Hay L. Glucocorticoid-induced hyperglycemia // Endocr Pract. 2009. Vol. 15 (5). Р. 469–474.
136. Попкова Т.В., Лисицына Т.А. Рекомендации по ведению больных системной красной волчанкой в клинической практике (по материалам рекомендаций Европейской антиревматической лиги – EULAR) // Современная ревматология. 2011. № 1. С. 4–12.
137. Bertsias G., Ioannidis J., Boletis J. et al. EULAR recommendations for the management of systemic lupus erythematosus. Report of a task force of the EULAR Standing Committee for International Clinical Studies including Therapeutics // Ann. Rheum. Dis. 2008. Vol. 67. Р. 195–205.
138. Radovits B.J., Fransen J., Al Shamma S. et al. Excess mortality emerges after qo years in an inception cohort of early rheumatoid arthritis // Arthritis Care Res. 2010. Vol. 62. Р. 362–370.
139. Jonsen A., Clarke A.E., Joseph L., Belisle P. et al. Association of the Charlson Comorbidity Index with mortality in systemic lupus erythematosus // Arthritis Care & Research. 2011. Vol. 63 (9). Р. 1233–1237.
- ИНВИТРО
- Библиотека
- Справочник заболеваний
- Системная красная…
Системная красная волчанка
Системная красная волчанка: причины появления, симптомы, диагностика и способы лечения.
Определение
Системная красная волчанка (СКВ) – это хроническое аутоиммунное заболевание неустановленной этиологии, при котором иммунная система организма становится гиперактивной и поражает здоровые ткани.
Системную красную волчанку называют «болезнью с тысячей лиц», поскольку она затрагивает многие органы, следовательно, может проявляться большим количеством симптомов, при этом постановка диагноза часто затруднена.
СКВ характеризуется генерализованным поражением микроциркуляторного русла и системной дезорганизацией соединительной ткани с кожными, суставными и висцеральными изменениями.
Заболеваемость СКВ составляет порядка 40-50 случаев на 100 000 населения в год. Заболевание наиболее часто развивается в течение второго и третьего десятилетий жизни у девушек и молодых женщин. Около 20% пациентов заболевают в возрасте до 16 лет.
Причины появления системной красной волчанки
Волчанка является аутоиммунным заболеванием, но точная причина возникновения болезни неясна.
Иммунная система защищает организм и борется с антигенами, такими как вирусы, бактерии и микробы. Это происходит благодаря синтезу белков, называемых антителами.
Когда человек страдает аутоиммунным заболеванием, таким как красная волчанка, иммунная система не может отличить чужеродные вещества (или антигены) от клеток собственного организма.
В результате иммунная система направляет антитела как против здоровой ткани, так и против антигенов. Это вызывает воспаление и повреждение тканей.
Поскольку точные причины возникновения системной красной волчанки до сих пор не обнаружены, ученые выдвигают теории и делают предположения. На первое место они ставят генетическую предрасположенность. Ученым удалось определить более 60 локусов (местоположений определенного гена на генетической или цитологической карте хромосомы) предрасположенности к СКВ, которые можно разделить на несколько групп. Интересно, что многие локусы риска являются общими для СКВ и других аутоиммунных заболеваний.
Одним из механизмов, запускающих аутоиммунный ответ, является ультрафиолетовое излучение, поскольку после воздействия солнечного света у пациентов на коже часто проявляются покраснения и сыпь.
Развитие болезни, по-видимому, может спровоцировать и вирусная инфекция. Нельзя исключать, что в этом случае аутоиммунные реакции возникают из-за молекулярной мимикрии вирусов — феномена сходства вирусных антигенов с собственными молекулами организма.
Гормональная теория развития СКВ может объяснить тот факт, что, во-первых, у женщин заболевание отмечается в 10 раз чаще, чем у мужчин, а во-вторых, симптомы обычно появляются в фертильном возрасте — от 15 до 45 лет и только 20% — после 50 лет.
Классификация заболевания
По характеру течения:
- острое;
- подострое;
- хроническое.
По степени активности:
- высокая;
- умеренная;
- минимальная.
Общепризнанной классификации системной красной волчанки нет. Однако для установления диагноза врачи пользуются международной классификацией по критериям (последний пересмотр был в 2018 г.), в которой учитываются поражения различных органов и систем, иммунологические нарушения согласно результатам лабораторных анализов. Каждый критерий имеет свой балл. Для установления диагноза у пациента должно быть минимум 10 баллов и наличие определенного количества антинуклеарных антител в крови.
В классификации учитываются общие проявления, такие как лихорадка, поражение кожи, суставов, неврологические нарушения, воспаление оболочки сердца и легких, нарушения в кровеносной системе, поражение почек.
Симптомы системной красной волчанки
Симптомы системной красной волчанки могут быть весьма разнообразны, поэтому перечислим основные:
- боли в суставах;
- лихорадка (повышение температуры тела);
- головная боль;
- колебания настроения, ухудшение памяти;
- нарушение зрения;
- боль в грудной клетке;
- нарушение аппетита;
- выпадение волос;
- сухость кожи;
- отечность ног и/или периорбитальной зоны;
- увеличение лимфатических узлов;
- кожные высыпания;
- язвы во рту;
- бледные или пурпурные пальцы рук или ног от холода или стресса;
- эритематозный дерматит на лице по типу «бабочки».
Чаще всего волчанка начинается с появления красноты, отека и боли в области суставов, повышения температуры тела, различных кожных высыпаний, недомогания, слабости, снижения веса. Реже бывает острое начало с высокой температурой, резкими болями и припухлостью суставов, симптомом «бабочки», отеками ног, лица, сухостью кожи, снижением количества мочи, что говорит о поражении почек.
Диагностика системной красной волчанки
В первую очередь при постановке диагноза врач должен обращать внимание на жалобы и характерные симптомы заболевания. Для уточнения диагноза и оценки степени поражения потребуются следующие лабораторные и инструментальные обследования:
- Клинический анализ крови с развернутой лейкоцитарной формулой.
Общий белок (в крови) (Protein total)
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок.
Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР.
Краткая характеристика определяемого вещества Общий бе�…
С-реактивный белок (СРБ, CRP)
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме.
Синонимы: Анализ крови на СРБ; С-реактивн�…
Креатинин (в крови) (Creatinine)
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat.
Краткая характеристика определя�…
Калий, натрий, хлор в сыворотке крови (К+, Potassium, Na+, Sodium, Сl-, Chloride, Serum)
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl.
Краткая характеристика определяемых �…
Кальций общий (Ca, Calcium total)
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в …
Гемостазиограмма (коагулограмма), скрининг
Синонимы: Гемостазиограмма, коагулограмма.
Coagulation studies (coagulation profile, coag panel, coagulogram).
Состав профиля:
№ 2 Протромбин (протромбиновое время, протромбин (по Квику), МНО…
Антинуклеарные антитела, IgG, скрининг, ИФА (Антиядерные антитела, Аntinuclear antibodies, ANAs, EIA)
Синонимы: Антинуклеарные антитела, Антинуклеарный фактор; АНФ.
Antinuclear Antibody; ANA; Antinuclear factor; ANF.
Краткое описание теста «Антинуклеарные антитела, IgG, скрининг, И…
Эхокардиография
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
К каким врачам обращаться
Лечением системной красной волчанки занимаются врачи-ревматологи, однако заподозрить заболевание может
врач-терапевт
, к которому чаще всего обращаются при появлении недомогания.
При выявлении системной красной волчанки также могут потребоваться консультации
врача-кардиолога
,
невролога
, эндокринолога, гастроэнтеролога, гематолога, нефролога, дерматолог.
Лечение системной красной волчанки
Системная красная волчанка – хроническое заболевание, которое, к сожалению, вылечить его невозможно. Поэтому задача терапии — добиться стойкой ремиссии (минимального проявления симптомов или их полного исчезновения) и уменьшить риск поражения внутренних органов. Выбор лечения зависит от течения заболевания.
При легком течении требуется минимальная терапия: назначение нестероидных противовоспалительных лекарственных средств и аминохолиновых препаратов.
При тяжелом течении болезни, сопровождающемся поражением почек, выраженным суставным синдромом, неврологическими нарушениями, проблемами системы кроветворения, показана длительная медикаментозная терапия следующими группами препаратов:
- глюкокортикостероидные гормоны (терапия может начаться с внутривенного введения с последующим переходом на таблетированную форму) с целью снятия острого воспаления;
- иммуносупрессивные препараты для подавления чрезмерной активности иммунной системы;
- внутривенное введение препаратов моноклональных антител при высокоактивном заболевании без поражения почек и центральной нервной системы с целью подавления активности аутоантител, которые организм вырабатывает против собственных клеток;
- в некоторых случаях может потребоваться введение иммуноглобулина.
Осложнения
Воспаление, вызванное волчанкой, затрагивает многие органы и системы, что приводит к различным осложнениям.
Со стороны почек
. Нефрит, гломерулонефрит.
Со стороны центральной нервной системы
. Нарушения когнитивных функций (памяти, внимания, мышления), снижение интеллекта, эмоционально-личностные расстройства, головные боли, в том числе мигренозного характера; психозы, инсульты, полиневропатия.
Со стороны ЖКТ
. Поражение мезентериальных сосудов (васкулит, тромбоз) с развитием геморрагий, инфарктов, некрозов кишечника.
Со стороны легких
. Легочное кровотечение, пневмония.
Со стороны сердца
. Перикардит, увеличение риска развития сердечно-сосудистых заболеваний и сердечных приступов.
Со стороны органов зрения
. Эписклерит.
Осложнения беременности
. Женщины с волчанкой имеют повышенный риск преждевременных родов, преэклампсии. Чтобы снизить вероятность этих осложнений, врачи рекомендуют отложить беременность до тех пор, пока болезнь не будет под контролем в течение как минимум шести месяцев.
Профилактика системной красной волчанки
Предотвратить заболевание невозможно, поэтому важно сосредоточить усилия на профилактике осложнений. Достижение низкой активности СКВ или ремиссии снижает смертность и дает возможность в определенной степени держать под контролем развитие необратимых повреждений внутренних органов.
Источники:
- Клюквина Н.Г. Системная красная волчанка: многообразие форм и вариантов течения. Современная ревматология, журнал. 2011. № 4. С. 25-30.
- Клинические рекомендации Министерства здравоохранения РФ. Системная красная волчанка. – 2016. – С. 64.
- Алексеева Е.И., Дворяковская Т.М., Никишина И.П., Денисова Р.В., Подчерняева Н.С., Сухоруких О.А., Шубина Л.С. Системная красная волчанка: клинические рекомендации. Часть 1. Вопросы современной педиатрии, журнал. 2018. № 1. Том 17. С 20-37.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы — 19 лет
Поделитесь этой статьей сейчас
Рекомендации
-
3778
09 Февраля
-
3754
09 Февраля
-
3775
08 Февраля
Похожие статьи
Шок
Шок: причины появления, симптомы, диагностика и способы лечения.
Кардиосклероз
Кардиосклероз: причины появления, симптомы, диагностика и способы лечения.