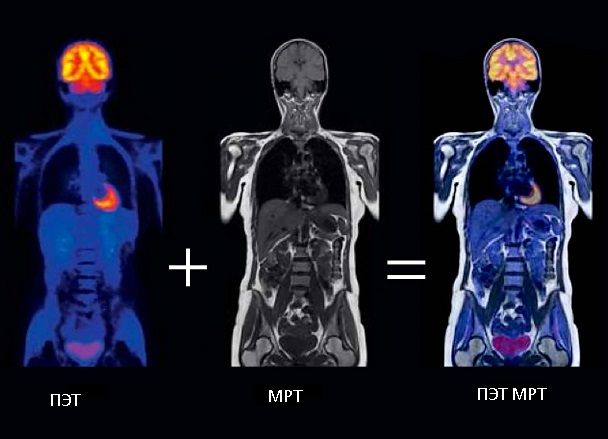
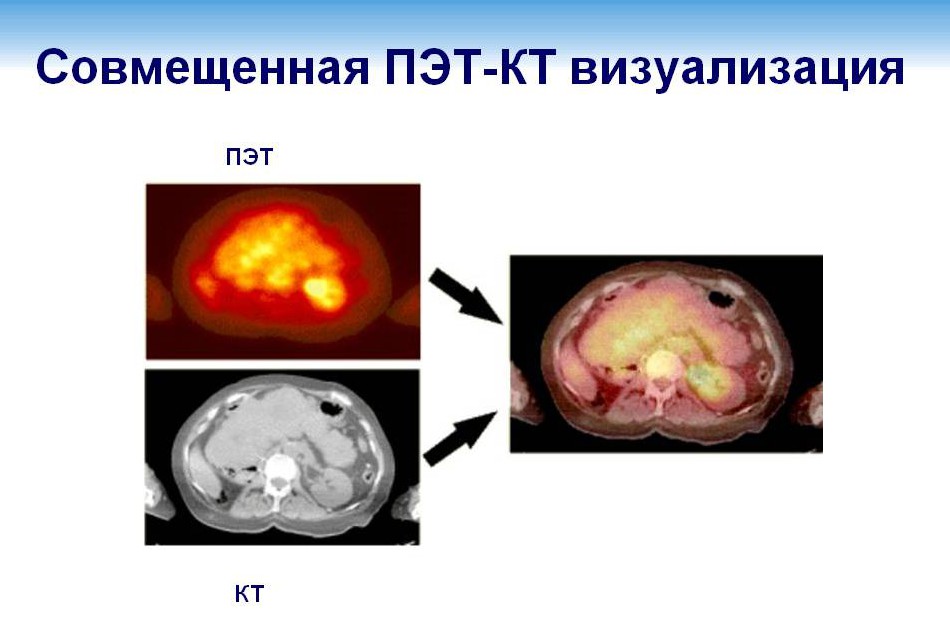
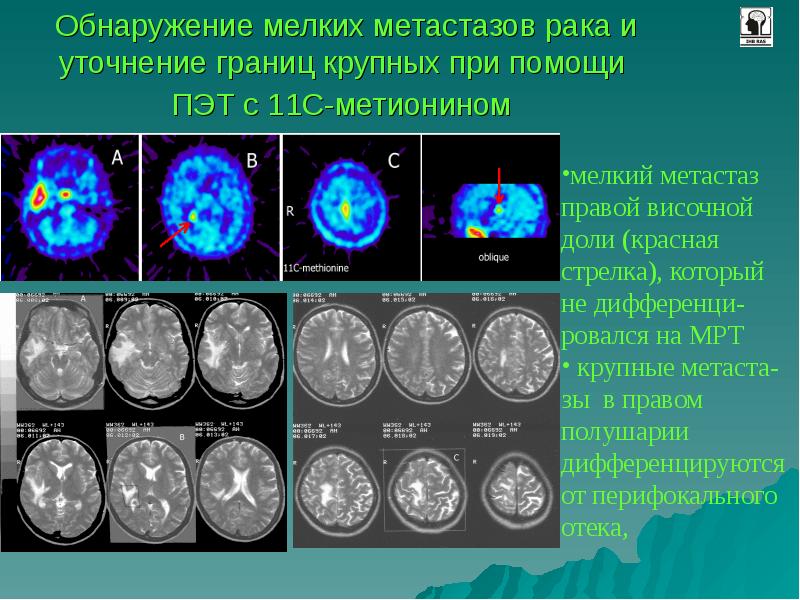
ПЭТ-КТ — это современный метод обследования, совмещающий позитронно-эмиссионную томографию (ПЭТ) и компьютерную томографию (КТ). Иногда метод называется просто ПЭТ. В его основе лежит регистрация гамма-излучения от введенного в организм радиофармпрепарата.
КАК ЧАСТО ОШИБАЕТСЯ ПЭТ-КТ, БЫВАЮТ ЛИ ОШИБКИ ПЭТ-КТ?
Вопрос важный, ведь это обследование проходят те, кому очень нужен точный диагноз!
Увы, ошибки диагностики при ПЭТ-КТ встречаются в определенном проценте случаев. Это обусловлено двумя факторами.
1. Объективный фактор, заключающийся в самой методике. В любом диагностическом методе, будь то КТ, МРТ или ПЭТ, изначально заложен определенный процент ошибок. Если мы возьмем какую-нибудь болезнь — например, рак молочной железы, то не все случаи рака молочной железы могут быть выявлены с помощью ПЭТ (это называется ложноотрицательный результат). Кроме того, иногда при отсутствии рака на снимках ПЭТ-КТ могут выявляться ее признаки (это называется ложноположительный результат). Есть несколько причин этого феномена: несовершенство аппаратуры, наличие сопутствующих болезней, имеющих сходную симптоматику, плохая выявляемость болезни на ранней стадии. Нужно отметить, что с каждым годом аппаратура ПЭТ-КТ становится все точнее, и поэтому процент ложных результатов постепенно уменьшается.
2. Субъективный фактор — более важный. Он обусловлен неверной трактовкой результатов ПЭТ-КТ. Врач, анализирующий снимки ПЭТ-КТ, может совершить ошибку и неправильно описать имеющиеся изменения! Нужно понимать, что любая аппаратура, даже самая современная — это всего лишь «железо» для получения изображений. А расшифровка изображений ПЭТ-КТ — это дело врача-радиолога, и от его опыта и знаний напрямую зависит достоверность диагностики.
Диагностические ошибки ПЭТ-КТ, обусловленные неправильной расшифровкой снимков, встречаются не так уж редко. В России этот метод только начинает развиваться. Количество квалифицированных специалистов по ПЭТ пока ограничено, и почти все они работают в нескольких профильных центрах в крупных городах (например, Институт мозга человека РАН). Встречается ситуация, когда в лечебное учреждение поставили новое оборудование ПЭТ, а опытного специалиста для работы на нем не найти. Это касается как государственных, так и частных центров ПЭТ.
В этих случаях не нужно отчаиваться. Если у вас или ваших лечащих врачей после проведения ПЭТ-КТ остаются вопросы по диагнозу, снимки можно проконсультировать у более опытного специалиста. Сегодняшняя ситуация такова, что такой специалист не обязательно должен жить в том же городе — результаты можно переслать ему по сети интернет.
ПЭТ-КТ В ДИАГНОСТИКЕ РАКА — КАК ИЗБЕЖАТЬ ОШИБОК?
Второе мнение по ПЭТ-КТ — распространенная услуга во всем мире. Для онкологических пациентов крайне важно не ошибиться с диагнозом — например, знать точную стадию рака, количество пораженных лимфатических узлов, достоверно исключить метастазы в печень, кости и другие органы. Пересмотр ПЭТ-КТ опытным врачом-диагностом — это способ свести риск ошибки к минимуму.
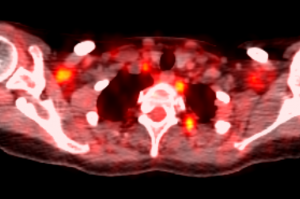
Может ли ПЭТ-КТ дать ошибку по метастазам? На примере — очаги накопления радиофармпрепарата [18F]-дезоксиглюкозы в подмышечной области и вдоль позвоночника, которые первоначально были расценены как метастазы в лимфатические узлы. Более внимательный анализ в ходе второго мнения показал, что эти очаги не являются злокачественной опухолью, а представляют собой участки бурого жира, отличающиеся повышенной метаболической активностью. На этом примере мы видим, как пересмотр результатов ПЭТ-КТ помог сделать диагноз менее опасным.
Заказать второе мнение по ПЭТ-КТ можно из любого города России, не выходя из дома. Врачи-радиологи Санкт-Петербургского Института мозга человека обладают огромным опытом в расшифровке ПЭТ-КТ головного мозга с метионином, ПЭТ-КТ всего тела с глюкозой, и других видов ПЭТ. Достаточно отправить им снимки через систему Национальной телерадиологической сети, и получить в течение суток подробное и квалифицированное заключение. Пересмотр результатов ПЭТ осуществляется под руководством З. Л. Бродской — корифея отечественной радиологии, многолетнего соратника знаменитой Н. П. Бехтеревой.
ПЭТ-КТ при раке молочной железы. Тщательный анализ характеристик накопления РФП (SUV) в подмышечных лимфатических узлах помогают различить метастазы и доброкачественное увеличение узлов.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине
Кандидат медицинских наук, член Европейского общества радиологов
Позитронно-эмиссионная томография (ПЭТ) представляет собой метод исследования, при котором оборудование регистрирует попадание на детекторы пары гамма-фотонов, испущенных в результате аннигиляции позитрона и электрона.
Для доставки позитронов к тканям и органам в организм вводят специальное вещество, в состав которого входит радионуклид. Последний в организме распадется с образованием позитрона, который и аннигилирует с расположенным поблизости электроном. При этом испущенные гамма-кванты имеют одинаковую энергию и двигаются строго по прямой в противоположных направлениях.
Когда пара детекторов, расположенных друг против друга, регистрируют получение квантов одинаковой мощности, компьютер вносит данные об этом событии в модель, формируя таким образом трехмерное изображение.
На сегодняшний день наиболее широко используются радиофармпрепараты на основе изотопа фтор-18 (18F-фтордезоксиглюкоза или 18-ФДГ). У этого изотопа есть важное преимущество: его период полураспада составляет почти 109,8 минуты, по сравнению с 2-20 минут у других изотопов. Это позволяет успеть доставить препарат в клинику и провести процедуру без лишней спешки. Кроме того, 18F-фтордезоксиглюкоза в организме ведет себя как обычная глюкоза, легко проникая в клетки тканей, позволяя получить наиболее полную картину.
Современные ПЭТ-КТ аппараты позволяют обнаружить новообразования с размерами от 4-5 мм.
В каких случаях назначается ПЭТ
ПЭТ диагностика применяется для выявления широкого спектразлокачественных опухолей костей, мягких тканей и различных органов, а также для того, чтобы оценить результативность промежуточного лечения. Метод также позволяет с большой долей вероятности отличить злокачественные опухоли от доброкачественных без проведения биопсии.
ПЭТ-КТ применяется при:
- Опухолях, расположение которых не выявлено;
- Опухолях головы, шеи и головного мозга;
- Раке щитовидной железы;
- Меланоме;
- Опухоли легкого;
- Ракемолочной железы;
- Раке пищевода, желудка и толстой кишки;
- Лимфоме;
- Болезни Ходжкина;
- Раке шейки матки, яичников, тимуса и яичек;
- Саркоме мягких тканей;
- Неходжкинскихлимфомах;
- Опухолях костей.
Стоит сказать, что, хотя ПЭТ и относится к неинвазивным обследованиям, пациент получает значительную дозу облучения от 14мЭв до 26мЭв (при ПЭТ-КТ всего тела). Кроме того, вводимый препарат в организме ведёт себя как глюкоза, вследствие чего обследование не назначают беременным, больным туберкулезом, а также имеющим повышенный уровень сахара в крови.Обследование с осторожностью назначают больным сахарным диабетом, имеющим почечную недостаточность, и женщинам в период лактации.
Возможны ли ошибки при ПЭТ-диагностике
К сожалению, как и при большинстве обследований, вполне возможно возникновение ошибок, которые могут иметь объективные и субъективные причины. Методы ПЭТ и ПЭТ-КТ не являются абсолютно точными. Отчасти это происходит потому, что точность применяемой аппаратуры не идеальна и, хотя она постоянно улучшается, все еще остается вероятность получить ошибочный результат. Кроме того, за злокачественные опухоли могут быть приняты совершенно другие болезни, дающие на ПЭТ очень сходную картинку. В этом случае пациенту будет поставлен диагноз рак, который впоследствии не будет подтвержден по результатам биопсии и гистологии.
Второй источник ошибок ПЭТ-КТ диагностики – неправильная интерпретация. Аппарат ПЭТ-КТ просто фиксирует полученные фотоны и складывает их в общую картину, а ее анализом занимается врач-радиолог. Учитывая, что метод появился относительно недавно, большого количества специалистов в стране еще нет, а у имеющихся часто недостаточно личного опыта, что и порождает неточности в постановке диагноза или составлении плана лечения.
Второе мнение
Учитывая риск ошибки при анализе результатов сканирования, чрезвычайно важной является возможность получения альтернативного или, лучше сказать, второго мнения. Возможно, это и не поможет снизить ошибки, связанные с неточностью аппаратной части, но наверняка позволит в несколько раз уменьшить влияние человеческого фактора.
К сожалению, сегодня далеко не всегда в городе можно найти двух врачей, имеющих высокую квалификацию в ПЭТ-КТ. С другой стороны, результаты сканирования можно передать по интернету в любую точку планеты. В России для этого вы можете воспользоваться услугами Национальной телерадиологической сети. Загрузив данные, вы уже через сутки получите второе заключение, составленное врачами-радиологами, работающими в Санкт-Петербургском институте мозга человека и других ведущих учреждениях.
Второе мнение не только даст возможность минимизировать риск ошибки, но и позволит правильно подобрать лечение и спланировать оперативное вмешательство.
ПОЛУЧИТЬ ВТОРОЕ МНЕНИЕ ПО ПЭТ-КТ
- Case report
- Open Access
- Published: 05 March 2020
BMC Medical Imaging
volume 20, Article number: 26 (2020)
Cite this article
-
4987 Accesses
-
2 Citations
-
1 Altmetric
-
Metrics details
Abstract
Background
The F-18 fluorodeoxyglucose positron emission/computed tomography (FDG PET/CT) has become an established diagnostic imaging for malignancy. However, there are other diseases that can also be identified with FDG, some of them are infections such as tuberculosis.
Case presentation
In this case report, two patients showed multiple hypermetabolic tuberculosis lesions on FDG PET/CT, with one of the patients having history of malignancy. The objective of the present case report is to emphasize the need to use other differential diagnosis techniques for tuberculosis especially in tuberculosis-endemic countries when interpreting FDG PET/CT.
Conclusion
By analyzing diagnostic imaging alone, there is a high chance of misinterpreting asymptomatic tuberculosis patient as having malignancy. Therefore, there is need for correlation with clinical data as well as other imaging modalities and PET/CT with more specific tracer in order to differentiate malignancy from benign disease such as tuberculosis.
Peer Review reports
Background
The bacteria responsible for tuberculosis is Mycobacterium tuberculosis, which is a serious contagious pathogen in many countries. Based on the data released by the World Health Organization in 2009, one-third of the world’s population, almost 2 billion people, are infected with M. tuberculosis [1, 2].
Tuberculosis is a major health problem in most developing countries including Indonesia. The incidence rate of tuberculosis in Indonesia was 391 per 100,000 population in 2015 and was marked as the ninth most common country with Tuberculosis [3].
M. Tuberculosis usually affects the lung but to some extent may also involve other susceptible extra-pulmonary organs. Also, there is a challenge with the identifying the infection at the extra-pulmonary site as it is often difficult to obtain specimen for definitive diagnosis of tuberculosis [4, 5].
FDG PET/CT is a diagnostic imaging procedure which provides a unique information of cellular glucose metabolism. By using the anomalous hallmark of cancer cell in reprogramming glucose metabolism and upregulating glucose transporter, the uptake of FDG is markedly increased in cancer cells [6]. However, there are some limitations with respect to the specificity of FDG PET/CT in that it sometimes gives false negative or positive results. The false positive findings are majorly associated with high FDG uptake in infectious or inflammatory tissue [7]. Granulocytes and mononuclear cells use glucose as an energy source during their metabolic burst [8], consequently, high FDG uptake could be seen in tuberculosis. Two cases of malignancy-like lesions in tuberculosis patients were reported which resulted in false positive findings with FDG PET/CT (Table 1).
Full size table
Case presentation
The FDG PET/CT images were acquired on a PET/CT scanner (Gemini, Phillips Healthcare, USA). All patients were subjected to fasting for over 6 h with blood sugar level below 150 mg/dL before the intravenous injection of FDG with a dose of 0.10 mCi/kgBW. The images were then acquired between 45 to 90 min after the injection. The acquisition was carried out from head to feet with arms above the head position using 700-mm field of view (FOV) and slice thickness of 10 mm. Also, three-dimensional data acquisition was performed for 3 min per bed position, followed by image reconstruction with the 3D-ordered-subsets expectation maximization method. Segmented attenuation was corrected by X-ray CT (140 kV, 120–240 mAs) to produce 128 × 128 matrix image. CT images were reconstructed using a conventional filtered back projection method.
Case 1
A 47-year old male with nasopharyngeal cancer for 2 years complained of a stuffed nose and hearing derivation in the right ear for about 2 weeks before being subjected to FDG PET/CT. He had no history of exposure to tuberculosis patient, weight loss, cough, low-grade fever, decreased appetite, or night sweat.
The results from laboratory tests showed normal blood count and serum carcinoma embryonic antigen (CEA) level. Contrast enhanced head and neck CT scan showed no sign of relapse in the nasopharyngeal wall with multiple metastases neck lymphadenopathies.
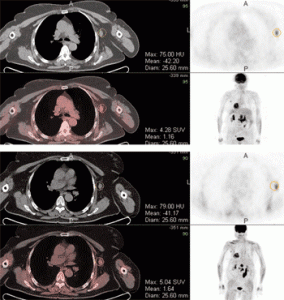
However, FDG PET/CT showed high FDG uptake by these multiple neck lymphadenopathies and the right nasopharyngeal wall (Fig. 1). The highest SUVmax of multiple neck lymphadenopathies was 11.05 that located in the right jugular superior, meanwhile SUVmax of the right nasopharyngeal wall was 4.51. Mild FDG-avid ground glass opacities with thick cavitation and calcification were also found at the apex of the left lung. Based on these FDG PET/CT findings, the biopsy was performed in the right nasopharyngeal that positive for tuberculous infection.
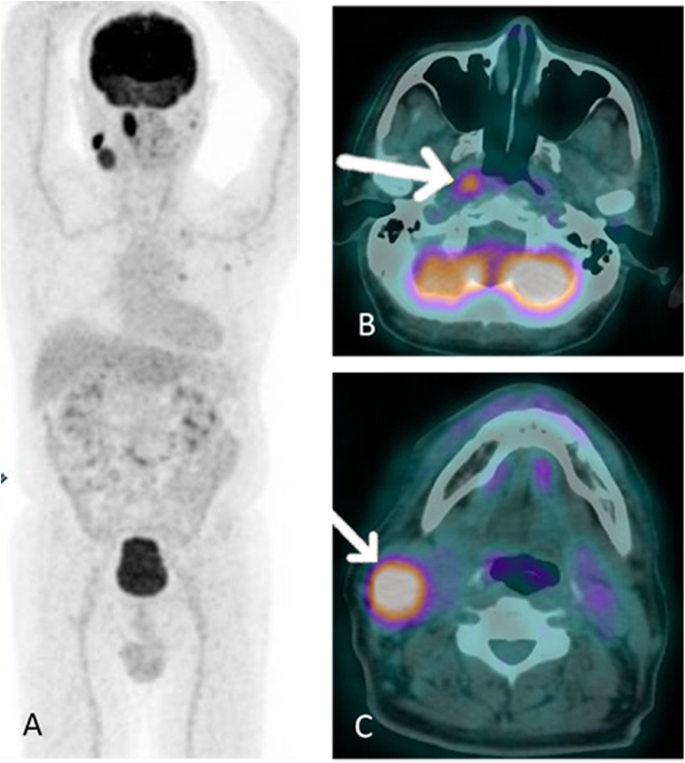
FDG PET/CT of patient number 1. Hypermetabolic lesions in several parts of head and neck. a MIP. b hypermetabolic lesion at right nasopharyngeal wall. c hypermetabolic enlarge lymph node at neck region
Full size image
Case 2
A 58-year old female presented with occasional dizziness for almost 4 months. She had history of smoking but none for tuberculosis exposure.
The CT scan on the brain showed multiple metastatic nodules (Fig. 2b). Also, the FDG PET/CT showed high FDG uptake at the left superior bronchial wall (Fig. 2c) and mild FDG uptake of bronchial thickening at posterior region of the left superior lung lobe. There were also multiple high FDG uptakes at the neck, mediastinal, abdominal, and pelvic lymphadenopathies with the highest SUVmax was 4.05 that located at left hilar. High FDG uptake of lytic lesion at fourth lumbar and right parieto-occipital nodule were also seen. All these findings were interpreted as metastatic lung cancer to the lymph nodes, brain, and bone. Based on these FDG PET/CT findings, the biopsy was performed at the left hilar lymph node and positive for tuberculous infection.
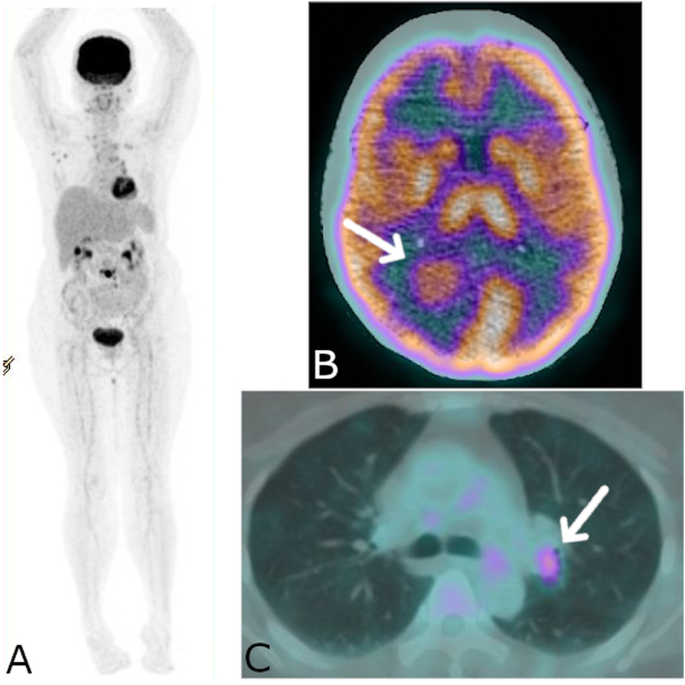
FDG PET/CT of patient number 2. a MIP showed multiple hypermetabolic lesions. b hypermetabolic nodule at brain highly suspicious for metastasis. c hypermetabolic lesion at left hilar region
Full size image
All patients underwent lymph nodes biopsy and were reported as tuberculosis infections. Consequently, anti-tuberculosis drugs such as rifampicin, pyrazinamide, isoniazid, and streptomycin were administered according to the histopathology results. Also, all the patients underwent contrast enhanced CT scan three to 5 months after the initial anti-tuberculosis treatment for response evaluation. All cases showed good response to the treatment and were all considered as complete remission.
Discussion and conclusion
There were two reported cases of malignancy-like lesions in tuberculosis patients that resulted in false positive findings with FDG PET/CT. All the lesions showed high FDG malignant-like lesions uptake and the FDG PET/CT findings misinterpreted as malignancy. However, tuberculosis was confirmed as final diagnosis by the histopathology studies.
In all these cases, the initial CT scan did not show typical characteristics finding for extrapulmonary tuberculosis, however, the FDG PET/CT showed high FDG lesions uptake which is generally viewed as malignant lesions. The extrapulmonary tuberculosis commonly develop from the pulmonary tuberculosis which subsequently spread outside the lungs through the lymphatic system. However, there are conditions whereby extrapulmonary tuberculosis develops without any evidence of pulmonary lesions [9, 10]. These two cases were found with mild FDG uptake of pulmonary lesions without any typical radiological findings for tuberculosis.
The case number one showed marked hypermetabolic lesion at right nasopharyngeal wall, suggesting nasopharyngeal cancer recurrence. This case was misinterpreted as malignancy because of the patients’ history, lesions sites, and atypical pulmonary radiologic finding lesions for tuberculosis. However, subject in case number two had no history of malignancy but showed typical metastatic distribution with hypermetabolic lesion at bronchial wall which is a suspicious sign for malignancy.
According to WHO criteria for classification, extrapulmonary tuberculosis is defined as an infection caused by M. Tuberculosis which affects tissues and organs outside the pulmonary parenchyma. The incidence rate of extrapulmonary tuberculosis is between 20 and 25% of all tuberculosis cases [11]. One of the most common extrapulmonary tuberculosis form is lymphadenopathy tuberculosis that counts for 30–40% of all extrapulmonary tuberculosis. The most common predilection site for lymphadenopathy tuberculosis is neck region (63–77%), however, it can also be found in other regions [12]. Fever and other typical systemic symptoms may not always present until the late stage of extrapulmonary tuberculosis [13].
The PET/CT study using F-18 FDG as a glucose analogue is a rapidly producing functional imaging modality which has been very beneficial in the detection of primary, recurrent, and metastatic tumour, planning, and therapy monitoring. The growth of cancer cell is an energy-related process which is supported by increased glucose metabolism. It is widely known that glucose transporter (GLUT) proteins, a membrane protein, are responsible for the transport of glucose across cellular membranes. Consequently, cancer cells have higher rates of GLUT expressions compared to normal cells. Together with this mechanism, some types of tumour is also associated with a higher rate of phosphorylation, lower rate of dephosphorylation of intracellular phosphorylated glucose, and higher activity of hexokinase.
These characteristics of cancer cell make the FDG accumulation much higher than normal cell. FDG PET/CT is known as superior but less specific for diagnostic imaging in malignancy. Through glucose transporters that are overexpressed both in cancer and inflammatory cells hence result in FDG accumulation, is not only visible in cancer cells but also in inflammatory cells such as activated macrophages, lymphocytes, and neutrophils at the site of inflammation or infection [14].
There is a similarity between the FDG uptake mechanism of both cancer and inflammatory cells. Both cells need high glucose consumption to fulfill the high energy demands. Glucose enter the cells through energy-dependent transporters. There are seven types of glucose transporter, known as GLUT-1 to GLUT-7 [11]. It was discovered in a study that a relative higher FDG uptake was observed in some of the inflammatory lesions, in which the expression level of GLUT-3 was much higher compared to GLUT-1. Also, Fu et all found that mRNA analysis in inflammatory cells showed GLUT-1 expression increased to 3.5 times, whereas GLUT-3 increased to 6 times, following the activation of inflammatory factors [9, 12]. The expressions of GLUT-1 and GLUT-3 in the inflammatory lesions are related to the type, quantity, and degree of activation of the inflammatory cells. Another study reported the important roles played by cytokines and growth factors in promoting the affinity of glucose transporter. Therefore, FDG uptake mechanism in inflammatory cells is almost similar compared to tumour setting though different situations [9].
Many studies have been conducted in attempting to differentiate between malignancy and inflammation in FDG PET study, including variation of protocols, characteristic, and parameter. Traditionally, a threshold for single time point using SUV max has been proposed to differentiate the two processes, however this method was proven not effective with false positive rate above 60%. Other widely accepted method is using dual-time imaging, based on varying levels of glucose-6-phosphatase activity among different tumour cell types, inflammatory and normal cells. However, this method is not dependable for several reasons including histologic type of tumours, the combination or the coexisting of chronic and acute inflammation, necrosis, hypoxia, and degree of angiogenesis. Most recent proposed method is using influx rate constant (Ki). It is reported in lung inflammatory lesions that this parameter is closely related to neutrophil activation. However, it is not applicable in daily practice and therefore requires further study in various type of tumours.
Familiarity with oncologic pattern and correlation with other modalities such as tumour marker and anatomical imaging are important in FDG PET/CT interpretation to produce more accurate assessment in clinical setting. Also, it is important to understand the pitfall of tumour markers and other clinical assessments commonly used in diagnosing malignancy. Several studies showed CEA level which might also increase in inflammatory process in the lung [15, 16]. New specific radiopharmaceutical for tuberculosis, such as Tc-99 m-ethambutol might also be helpful in these setting [17, 18].
Conclusively, two cases of malignancy-like lesions in tuberculosis patients were reported but resulted in false positive findings in FDG PET/CT. By analyzing only diagnostic imaging, asymptomatic tuberculosis patient can be easily misinterpreted as having malignancy. There is need for correlation with clinical data, as well as other imaging modalities and PET/CT with more specific tracer, in order to be able to differentiate malignancy from benign disease such as tuberculosis.
Availability of data and materials
The datasets generated and/or analysed during the current study are de-identified and not publicly available considering the fact that not all the patients consented to it for publication but are available from the corresponding author on reasonable request.
Abbreviations
- CEA:
-
Carcinoma Embryonic Antigen
- CT:
-
Computed tomography
- FDG:
-
18F-fluorodeoxyglucose
- GLUT:
-
Glucose transporter
- PET:
-
Positron emission tomography
References
-
Polley P, Dunn R. Noncontiguous spinal tuberculosis: incidence and management. Eur Spine J. 2009;18(8):1096–101..
Article
Google Scholar
-
Khue PM, Truffot-Pernot C, Texier-Maugein J, Jarlier V, Robert J. A 10-year prospective surveillance of mycobacterium tuberculosis drug resistance in France 1995–2004. Eur Respir J. 2007;30(5):937–44.
Article
CASGoogle Scholar
-
Who report 2009. Global Tuberculosis control: epidemiología, strategy, financing. Geneva: World Health; 2009.
Google Scholar
-
Kanga I, Taylor JA, Jacobs C, Outerbridge G. Tuberculosis of the neuromusculoskeletal system: a review of two cases presenting as chiropractic patients. J Can Chiropr Assoc. 2015;59(1):13.
PubMed
PubMed CentralGoogle Scholar
-
Lee JY. Diagnosis and treatment of extra pulmonary tuberculosis. Tuberc Respir Dis. 2015;78:47–55.
Article
Google Scholar
-
Fletcher JW, Djulbegovic B, Soares HP, Siegel BA, Lowe VJ, Lyman GH, Coleman RE, Wahl R, Paschold JC, Avril N, Einhorn LH, Suh WW, Samson D, Delbeke D, Gorman M, Shields AF. Recommendation on the use of 18F-FDG PET in oncology. J Nucl Med. 2008;49:480–508.
Article
Google Scholar
-
Bakheet SM, Powe J, Kandil A, Ezzat A, Rostom A, Amartey J. F-18 FDG uptake in breast infection and inflammation. Clin Nucl Med. 2000;25:100–3.
Article
CASGoogle Scholar
-
Weisdorf DJ, Craddock PR, Jacob HS. Glycogenolysis versus glucose transport in human granulocytes: differential activation in phagocytosis and chemotaxis. Blood. 1982;60:888–93.
Article
CASGoogle Scholar
-
Fisher D, Elwood K. Nonrespiratory tuberculosis. In: Canadian thoracic society, Canadian Lung Association, and the Public Health Agency of Canada, editor. Canadian tuberculosis standards. 7th ed. Ottawa: Canadian Thoracic Society; 2013.
Google Scholar
-
Zuang H, Pourdehnad M, Lambright ES, Yamamoto AJ, Lanuti M, Li P, Mozley PD, Rossman MD, Albelda SM, Alavi A. Dual time point 18F-FDG PET imaging for differentiating malignant from inflammatory process. J Nucl Med. 2001;42:1412–7.
Google Scholar
-
Metser U, Even-Sapir E. Increased 18 F-fluorodeoxyglucose uptake in benign, nonphysiologic lesions found on whole-body positron emission tomography/computed tomography (PET/CT): accumulated data from four years of experience with PET/CT. In: Seminars in nuclear medicine. Philadelphia: Elsevier; 2007. p. 206–22.
Google Scholar
-
Wang ZG, Yu MM, Han Y, Wu FY, Yang GJ, Li DC, Liu SM. Correlation of Glut-2 and Glut-3 expression with F-18 FDG uptake in pulmonary inflammatory lesion. Medicine. 2016;95:48.
Google Scholar
-
Hammoudeh M, Khanjar I. Skeletal tuberculosis mimicking seronegative spondyloarthropathy. Rheumatol Int. 2004;24(1):50–2.
Article
Google Scholar
-
Kim IJ, Lee JS, Kim SJ, Kim YK, Jeong YJ, Jun S, Nam HY, Kim JS. Double-phase 18F-FDG PET-CT for determina- tion of pulmonary tuberculoma activity. Eur J Nucl Med Mol Imaging. 2008;35:808–14.
Article
Google Scholar
-
Quist J, Hill AR. Serum lactate dehydrogenase (LDH) in Pneumocystis carinii pneumonia, tuberculosis and bacterial pneumonia. Chest. 1995;108(2):415–8.
Article
CASGoogle Scholar
-
No JI, Yang JY, Hyun HJ, Yeon CS, Choi HJ. Factors associated with serum levels of carcinoembryonic antigen in healthy non-smokers. Korean J Fam Med. 2013;34(6):413–9. https://doi.org/10.4082/kjfm.2013.34.6.413.
Article
PubMed
PubMed CentralGoogle Scholar
-
Houshmand S, Salavati A, Basu S, et al. The role of dual and multiple time point imaging of FDG uptake in both normal and disease states. Clin Transl Imaging. 2014;2:281. https://doi.org/10.1007/s40336-014-0075-x.
Article
Google Scholar
-
Kartamihardja AHS, Kurniawati Y, Gunawan R. Diagnostic value of 99mTc-ethambutol scintigraphy in tuberculosis: compared to microbiological and histopathological tests. Ann Nucl Med. 2018;32(1):60–8.
Article
CASGoogle Scholar
Download references
Acknowledgements
Not Applicable.
Funding
There was no funding received for this study.
Author information
Authors and Affiliations
-
Department of Nuclear Medicine, Mochtar Riady Comprehensive Cancer Centre Siloam Hospital, Jakarta, Indonesia
Febby Hutomo, Ryan Yudistiro, Ivana Dewi Mulyanto & Hendra Budiawan
-
Department of Nuclear Medicine, School of Medicine of Pelita Harapan University, Tangerang, Indonesia
Ryan Yudistiro & Ivana Dewi Mulyanto
-
Department of Nuclear Medicine and Molecular Imaging, School of Medicine of Padjadjaran University, Dr Hasan Sadikin Hospital, Bandung, Indonesia
Hendra Budiawan
Authors
- Febby Hutomo
You can also search for this author in
PubMed Google Scholar - Ryan Yudistiro
You can also search for this author in
PubMed Google Scholar - Ivana Dewi Mulyanto
You can also search for this author in
PubMed Google Scholar - Hendra Budiawan
You can also search for this author in
PubMed Google Scholar
Contributions
FH collected patient data and drafted the manuscript. FH, RY, and IDM designed and organized this report and participated in writing the manuscript. HB reviewed and approved the final manuscript. All authors read and approved the final manuscript.
Corresponding author
Correspondence to
Ryan Yudistiro.
Ethics declarations
Ethics approval and consent to participate
Not Applicable.
Consent for publication
Not Applıcable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Hutomo, F., Yudistiro, R., Mulyanto, I.D. et al. False positive finding from malignancy-like lesions on FDG PET/CT: case report of tuberculosis patients.
BMC Med Imaging 20, 26 (2020). https://doi.org/10.1186/s12880-020-00427-w
Download citation
-
Received: 04 June 2019
-
Accepted: 21 February 2020
-
Published: 05 March 2020
-
DOI: https://doi.org/10.1186/s12880-020-00427-w
Keywords
- Tuberculosis
- Malignancy
- FDG
- PET/CT
- Case report
- Open Access
- Published: 05 March 2020
BMC Medical Imaging
volume 20, Article number: 26 (2020)
Cite this article
-
4987 Accesses
-
2 Citations
-
1 Altmetric
-
Metrics details
Abstract
Background
The F-18 fluorodeoxyglucose positron emission/computed tomography (FDG PET/CT) has become an established diagnostic imaging for malignancy. However, there are other diseases that can also be identified with FDG, some of them are infections such as tuberculosis.
Case presentation
In this case report, two patients showed multiple hypermetabolic tuberculosis lesions on FDG PET/CT, with one of the patients having history of malignancy. The objective of the present case report is to emphasize the need to use other differential diagnosis techniques for tuberculosis especially in tuberculosis-endemic countries when interpreting FDG PET/CT.
Conclusion
By analyzing diagnostic imaging alone, there is a high chance of misinterpreting asymptomatic tuberculosis patient as having malignancy. Therefore, there is need for correlation with clinical data as well as other imaging modalities and PET/CT with more specific tracer in order to differentiate malignancy from benign disease such as tuberculosis.
Peer Review reports
Background
The bacteria responsible for tuberculosis is Mycobacterium tuberculosis, which is a serious contagious pathogen in many countries. Based on the data released by the World Health Organization in 2009, one-third of the world’s population, almost 2 billion people, are infected with M. tuberculosis [1, 2].
Tuberculosis is a major health problem in most developing countries including Indonesia. The incidence rate of tuberculosis in Indonesia was 391 per 100,000 population in 2015 and was marked as the ninth most common country with Tuberculosis [3].
M. Tuberculosis usually affects the lung but to some extent may also involve other susceptible extra-pulmonary organs. Also, there is a challenge with the identifying the infection at the extra-pulmonary site as it is often difficult to obtain specimen for definitive diagnosis of tuberculosis [4, 5].
FDG PET/CT is a diagnostic imaging procedure which provides a unique information of cellular glucose metabolism. By using the anomalous hallmark of cancer cell in reprogramming glucose metabolism and upregulating glucose transporter, the uptake of FDG is markedly increased in cancer cells [6]. However, there are some limitations with respect to the specificity of FDG PET/CT in that it sometimes gives false negative or positive results. The false positive findings are majorly associated with high FDG uptake in infectious or inflammatory tissue [7]. Granulocytes and mononuclear cells use glucose as an energy source during their metabolic burst [8], consequently, high FDG uptake could be seen in tuberculosis. Two cases of malignancy-like lesions in tuberculosis patients were reported which resulted in false positive findings with FDG PET/CT (Table 1).
Full size table
Case presentation
The FDG PET/CT images were acquired on a PET/CT scanner (Gemini, Phillips Healthcare, USA). All patients were subjected to fasting for over 6 h with blood sugar level below 150 mg/dL before the intravenous injection of FDG with a dose of 0.10 mCi/kgBW. The images were then acquired between 45 to 90 min after the injection. The acquisition was carried out from head to feet with arms above the head position using 700-mm field of view (FOV) and slice thickness of 10 mm. Also, three-dimensional data acquisition was performed for 3 min per bed position, followed by image reconstruction with the 3D-ordered-subsets expectation maximization method. Segmented attenuation was corrected by X-ray CT (140 kV, 120–240 mAs) to produce 128 × 128 matrix image. CT images were reconstructed using a conventional filtered back projection method.
Case 1
A 47-year old male with nasopharyngeal cancer for 2 years complained of a stuffed nose and hearing derivation in the right ear for about 2 weeks before being subjected to FDG PET/CT. He had no history of exposure to tuberculosis patient, weight loss, cough, low-grade fever, decreased appetite, or night sweat.
The results from laboratory tests showed normal blood count and serum carcinoma embryonic antigen (CEA) level. Contrast enhanced head and neck CT scan showed no sign of relapse in the nasopharyngeal wall with multiple metastases neck lymphadenopathies.
However, FDG PET/CT showed high FDG uptake by these multiple neck lymphadenopathies and the right nasopharyngeal wall (Fig. 1). The highest SUVmax of multiple neck lymphadenopathies was 11.05 that located in the right jugular superior, meanwhile SUVmax of the right nasopharyngeal wall was 4.51. Mild FDG-avid ground glass opacities with thick cavitation and calcification were also found at the apex of the left lung. Based on these FDG PET/CT findings, the biopsy was performed in the right nasopharyngeal that positive for tuberculous infection.

FDG PET/CT of patient number 1. Hypermetabolic lesions in several parts of head and neck. a MIP. b hypermetabolic lesion at right nasopharyngeal wall. c hypermetabolic enlarge lymph node at neck region
Full size image
Case 2
A 58-year old female presented with occasional dizziness for almost 4 months. She had history of smoking but none for tuberculosis exposure.
The CT scan on the brain showed multiple metastatic nodules (Fig. 2b). Also, the FDG PET/CT showed high FDG uptake at the left superior bronchial wall (Fig. 2c) and mild FDG uptake of bronchial thickening at posterior region of the left superior lung lobe. There were also multiple high FDG uptakes at the neck, mediastinal, abdominal, and pelvic lymphadenopathies with the highest SUVmax was 4.05 that located at left hilar. High FDG uptake of lytic lesion at fourth lumbar and right parieto-occipital nodule were also seen. All these findings were interpreted as metastatic lung cancer to the lymph nodes, brain, and bone. Based on these FDG PET/CT findings, the biopsy was performed at the left hilar lymph node and positive for tuberculous infection.

FDG PET/CT of patient number 2. a MIP showed multiple hypermetabolic lesions. b hypermetabolic nodule at brain highly suspicious for metastasis. c hypermetabolic lesion at left hilar region
Full size image
All patients underwent lymph nodes biopsy and were reported as tuberculosis infections. Consequently, anti-tuberculosis drugs such as rifampicin, pyrazinamide, isoniazid, and streptomycin were administered according to the histopathology results. Also, all the patients underwent contrast enhanced CT scan three to 5 months after the initial anti-tuberculosis treatment for response evaluation. All cases showed good response to the treatment and were all considered as complete remission.
Discussion and conclusion
There were two reported cases of malignancy-like lesions in tuberculosis patients that resulted in false positive findings with FDG PET/CT. All the lesions showed high FDG malignant-like lesions uptake and the FDG PET/CT findings misinterpreted as malignancy. However, tuberculosis was confirmed as final diagnosis by the histopathology studies.
In all these cases, the initial CT scan did not show typical characteristics finding for extrapulmonary tuberculosis, however, the FDG PET/CT showed high FDG lesions uptake which is generally viewed as malignant lesions. The extrapulmonary tuberculosis commonly develop from the pulmonary tuberculosis which subsequently spread outside the lungs through the lymphatic system. However, there are conditions whereby extrapulmonary tuberculosis develops without any evidence of pulmonary lesions [9, 10]. These two cases were found with mild FDG uptake of pulmonary lesions without any typical radiological findings for tuberculosis.
The case number one showed marked hypermetabolic lesion at right nasopharyngeal wall, suggesting nasopharyngeal cancer recurrence. This case was misinterpreted as malignancy because of the patients’ history, lesions sites, and atypical pulmonary radiologic finding lesions for tuberculosis. However, subject in case number two had no history of malignancy but showed typical metastatic distribution with hypermetabolic lesion at bronchial wall which is a suspicious sign for malignancy.
According to WHO criteria for classification, extrapulmonary tuberculosis is defined as an infection caused by M. Tuberculosis which affects tissues and organs outside the pulmonary parenchyma. The incidence rate of extrapulmonary tuberculosis is between 20 and 25% of all tuberculosis cases [11]. One of the most common extrapulmonary tuberculosis form is lymphadenopathy tuberculosis that counts for 30–40% of all extrapulmonary tuberculosis. The most common predilection site for lymphadenopathy tuberculosis is neck region (63–77%), however, it can also be found in other regions [12]. Fever and other typical systemic symptoms may not always present until the late stage of extrapulmonary tuberculosis [13].
The PET/CT study using F-18 FDG as a glucose analogue is a rapidly producing functional imaging modality which has been very beneficial in the detection of primary, recurrent, and metastatic tumour, planning, and therapy monitoring. The growth of cancer cell is an energy-related process which is supported by increased glucose metabolism. It is widely known that glucose transporter (GLUT) proteins, a membrane protein, are responsible for the transport of glucose across cellular membranes. Consequently, cancer cells have higher rates of GLUT expressions compared to normal cells. Together with this mechanism, some types of tumour is also associated with a higher rate of phosphorylation, lower rate of dephosphorylation of intracellular phosphorylated glucose, and higher activity of hexokinase.
These characteristics of cancer cell make the FDG accumulation much higher than normal cell. FDG PET/CT is known as superior but less specific for diagnostic imaging in malignancy. Through glucose transporters that are overexpressed both in cancer and inflammatory cells hence result in FDG accumulation, is not only visible in cancer cells but also in inflammatory cells such as activated macrophages, lymphocytes, and neutrophils at the site of inflammation or infection [14].
There is a similarity between the FDG uptake mechanism of both cancer and inflammatory cells. Both cells need high glucose consumption to fulfill the high energy demands. Glucose enter the cells through energy-dependent transporters. There are seven types of glucose transporter, known as GLUT-1 to GLUT-7 [11]. It was discovered in a study that a relative higher FDG uptake was observed in some of the inflammatory lesions, in which the expression level of GLUT-3 was much higher compared to GLUT-1. Also, Fu et all found that mRNA analysis in inflammatory cells showed GLUT-1 expression increased to 3.5 times, whereas GLUT-3 increased to 6 times, following the activation of inflammatory factors [9, 12]. The expressions of GLUT-1 and GLUT-3 in the inflammatory lesions are related to the type, quantity, and degree of activation of the inflammatory cells. Another study reported the important roles played by cytokines and growth factors in promoting the affinity of glucose transporter. Therefore, FDG uptake mechanism in inflammatory cells is almost similar compared to tumour setting though different situations [9].
Many studies have been conducted in attempting to differentiate between malignancy and inflammation in FDG PET study, including variation of protocols, characteristic, and parameter. Traditionally, a threshold for single time point using SUV max has been proposed to differentiate the two processes, however this method was proven not effective with false positive rate above 60%. Other widely accepted method is using dual-time imaging, based on varying levels of glucose-6-phosphatase activity among different tumour cell types, inflammatory and normal cells. However, this method is not dependable for several reasons including histologic type of tumours, the combination or the coexisting of chronic and acute inflammation, necrosis, hypoxia, and degree of angiogenesis. Most recent proposed method is using influx rate constant (Ki). It is reported in lung inflammatory lesions that this parameter is closely related to neutrophil activation. However, it is not applicable in daily practice and therefore requires further study in various type of tumours.
Familiarity with oncologic pattern and correlation with other modalities such as tumour marker and anatomical imaging are important in FDG PET/CT interpretation to produce more accurate assessment in clinical setting. Also, it is important to understand the pitfall of tumour markers and other clinical assessments commonly used in diagnosing malignancy. Several studies showed CEA level which might also increase in inflammatory process in the lung [15, 16]. New specific radiopharmaceutical for tuberculosis, such as Tc-99 m-ethambutol might also be helpful in these setting [17, 18].
Conclusively, two cases of malignancy-like lesions in tuberculosis patients were reported but resulted in false positive findings in FDG PET/CT. By analyzing only diagnostic imaging, asymptomatic tuberculosis patient can be easily misinterpreted as having malignancy. There is need for correlation with clinical data, as well as other imaging modalities and PET/CT with more specific tracer, in order to be able to differentiate malignancy from benign disease such as tuberculosis.
Availability of data and materials
The datasets generated and/or analysed during the current study are de-identified and not publicly available considering the fact that not all the patients consented to it for publication but are available from the corresponding author on reasonable request.
Abbreviations
- CEA:
-
Carcinoma Embryonic Antigen
- CT:
-
Computed tomography
- FDG:
-
18F-fluorodeoxyglucose
- GLUT:
-
Glucose transporter
- PET:
-
Positron emission tomography
References
-
Polley P, Dunn R. Noncontiguous spinal tuberculosis: incidence and management. Eur Spine J. 2009;18(8):1096–101..
Article
Google Scholar
-
Khue PM, Truffot-Pernot C, Texier-Maugein J, Jarlier V, Robert J. A 10-year prospective surveillance of mycobacterium tuberculosis drug resistance in France 1995–2004. Eur Respir J. 2007;30(5):937–44.
Article
CASGoogle Scholar
-
Who report 2009. Global Tuberculosis control: epidemiología, strategy, financing. Geneva: World Health; 2009.
Google Scholar
-
Kanga I, Taylor JA, Jacobs C, Outerbridge G. Tuberculosis of the neuromusculoskeletal system: a review of two cases presenting as chiropractic patients. J Can Chiropr Assoc. 2015;59(1):13.
PubMed
PubMed CentralGoogle Scholar
-
Lee JY. Diagnosis and treatment of extra pulmonary tuberculosis. Tuberc Respir Dis. 2015;78:47–55.
Article
Google Scholar
-
Fletcher JW, Djulbegovic B, Soares HP, Siegel BA, Lowe VJ, Lyman GH, Coleman RE, Wahl R, Paschold JC, Avril N, Einhorn LH, Suh WW, Samson D, Delbeke D, Gorman M, Shields AF. Recommendation on the use of 18F-FDG PET in oncology. J Nucl Med. 2008;49:480–508.
Article
Google Scholar
-
Bakheet SM, Powe J, Kandil A, Ezzat A, Rostom A, Amartey J. F-18 FDG uptake in breast infection and inflammation. Clin Nucl Med. 2000;25:100–3.
Article
CASGoogle Scholar
-
Weisdorf DJ, Craddock PR, Jacob HS. Glycogenolysis versus glucose transport in human granulocytes: differential activation in phagocytosis and chemotaxis. Blood. 1982;60:888–93.
Article
CASGoogle Scholar
-
Fisher D, Elwood K. Nonrespiratory tuberculosis. In: Canadian thoracic society, Canadian Lung Association, and the Public Health Agency of Canada, editor. Canadian tuberculosis standards. 7th ed. Ottawa: Canadian Thoracic Society; 2013.
Google Scholar
-
Zuang H, Pourdehnad M, Lambright ES, Yamamoto AJ, Lanuti M, Li P, Mozley PD, Rossman MD, Albelda SM, Alavi A. Dual time point 18F-FDG PET imaging for differentiating malignant from inflammatory process. J Nucl Med. 2001;42:1412–7.
Google Scholar
-
Metser U, Even-Sapir E. Increased 18 F-fluorodeoxyglucose uptake in benign, nonphysiologic lesions found on whole-body positron emission tomography/computed tomography (PET/CT): accumulated data from four years of experience with PET/CT. In: Seminars in nuclear medicine. Philadelphia: Elsevier; 2007. p. 206–22.
Google Scholar
-
Wang ZG, Yu MM, Han Y, Wu FY, Yang GJ, Li DC, Liu SM. Correlation of Glut-2 and Glut-3 expression with F-18 FDG uptake in pulmonary inflammatory lesion. Medicine. 2016;95:48.
Google Scholar
-
Hammoudeh M, Khanjar I. Skeletal tuberculosis mimicking seronegative spondyloarthropathy. Rheumatol Int. 2004;24(1):50–2.
Article
Google Scholar
-
Kim IJ, Lee JS, Kim SJ, Kim YK, Jeong YJ, Jun S, Nam HY, Kim JS. Double-phase 18F-FDG PET-CT for determina- tion of pulmonary tuberculoma activity. Eur J Nucl Med Mol Imaging. 2008;35:808–14.
Article
Google Scholar
-
Quist J, Hill AR. Serum lactate dehydrogenase (LDH) in Pneumocystis carinii pneumonia, tuberculosis and bacterial pneumonia. Chest. 1995;108(2):415–8.
Article
CASGoogle Scholar
-
No JI, Yang JY, Hyun HJ, Yeon CS, Choi HJ. Factors associated with serum levels of carcinoembryonic antigen in healthy non-smokers. Korean J Fam Med. 2013;34(6):413–9. https://doi.org/10.4082/kjfm.2013.34.6.413.
Article
PubMed
PubMed CentralGoogle Scholar
-
Houshmand S, Salavati A, Basu S, et al. The role of dual and multiple time point imaging of FDG uptake in both normal and disease states. Clin Transl Imaging. 2014;2:281. https://doi.org/10.1007/s40336-014-0075-x.
Article
Google Scholar
-
Kartamihardja AHS, Kurniawati Y, Gunawan R. Diagnostic value of 99mTc-ethambutol scintigraphy in tuberculosis: compared to microbiological and histopathological tests. Ann Nucl Med. 2018;32(1):60–8.
Article
CASGoogle Scholar
Download references
Acknowledgements
Not Applicable.
Funding
There was no funding received for this study.
Author information
Authors and Affiliations
-
Department of Nuclear Medicine, Mochtar Riady Comprehensive Cancer Centre Siloam Hospital, Jakarta, Indonesia
Febby Hutomo, Ryan Yudistiro, Ivana Dewi Mulyanto & Hendra Budiawan
-
Department of Nuclear Medicine, School of Medicine of Pelita Harapan University, Tangerang, Indonesia
Ryan Yudistiro & Ivana Dewi Mulyanto
-
Department of Nuclear Medicine and Molecular Imaging, School of Medicine of Padjadjaran University, Dr Hasan Sadikin Hospital, Bandung, Indonesia
Hendra Budiawan
Authors
- Febby Hutomo
You can also search for this author in
PubMed Google Scholar - Ryan Yudistiro
You can also search for this author in
PubMed Google Scholar - Ivana Dewi Mulyanto
You can also search for this author in
PubMed Google Scholar - Hendra Budiawan
You can also search for this author in
PubMed Google Scholar
Contributions
FH collected patient data and drafted the manuscript. FH, RY, and IDM designed and organized this report and participated in writing the manuscript. HB reviewed and approved the final manuscript. All authors read and approved the final manuscript.
Corresponding author
Correspondence to
Ryan Yudistiro.
Ethics declarations
Ethics approval and consent to participate
Not Applicable.
Consent for publication
Not Applıcable.
Competing interests
The authors declare that they have no competing interests.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Hutomo, F., Yudistiro, R., Mulyanto, I.D. et al. False positive finding from malignancy-like lesions on FDG PET/CT: case report of tuberculosis patients.
BMC Med Imaging 20, 26 (2020). https://doi.org/10.1186/s12880-020-00427-w
Download citation
-
Received: 04 June 2019
-
Accepted: 21 February 2020
-
Published: 05 March 2020
-
DOI: https://doi.org/10.1186/s12880-020-00427-w
Keywords
- Tuberculosis
- Malignancy
- FDG
- PET/CT
ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
Важенин А.В.
ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
Зотова А.С.
ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
Важенина Д.А.
ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
ПЭТ-КТ с 18F-NaF в диагностике метастатического поражения костной системы (первый опыт)
Авторы:
Афанасьева Н.Г., Важенин А.В., Зотова А.С., Важенина Д.А.
Журнал:
Онкология. Журнал им. П.А. Герцена. 2021;10(3): 25‑28
Как цитировать:
Афанасьева Н.Г., Важенин А.В., Зотова А.С., Важенина Д.А.
ПЭТ-КТ с 18F-NaF в диагностике метастатического поражения костной системы (первый опыт). Онкология. Журнал им. П.А. Герцена.
2021;10(3):25‑28.
Afanasyeva NG, Vazhenin AV, Zotova AS, Vazhenina DA. 18F-NaF PET/CT in the diagnosis of metastatic bone system damage (the first experience). P.A. Herzen Journal of Oncology. 2021;10(3):25‑28. (In Russ.).
https://doi.org/10.17116/onkolog20211003125

?>
Поражение костной системы наблюдается при многих онкологических заболеваниях. Наиболее часто поражение костей скелета происходит при опухолях, метастазирующих преимущественно гематогенным и/или лимфогенным путем: в случае рака молочной железы (до 85%), предстательной железы (до 85%), щитовидной железы (до 60%), почки (36—50%), легкого (до 40%). С учетом высокой распространенности в популяции злокачественных новообразований молочной железы и простаты на долю этих опухолей приходится до 80% всех клинически значимых метастатических поражений скелета [1]. В настоящий момент радионуклидные методы диагностики вторичного поражения костной системы демонстрируют выраженные преимущества перед рентгенологическими. Одним из наиболее перспективных радионуклидных методов исследования является ПЭТ-КТ с 18F-NaF, который является специфичным агентом костной ткани как остеолитических, так и остеобластических смешанных типов метастазов ввиду своей общности с минеральным составом кости. Отношения между активностью клеток остеобластов и остеокластов определяет включение 18F-NaF в ткани костной матрицы. Известно, что фосфатные комплексы, активно включаясь в обменные процессы кости, обладают специфической аффинитивностью к костным гидроксиапатитам (связываются через фосфатную группу с ионами Са+ кристалла гидроксиапатита, а также с незрелым коллагеном) [2]. 18F-NaF обладает высокой чувствительностью при выявлении костных метастазов, его поглощение, представляющее увеличение кровотока и метаболизма костной ткани, характерно для злокачественных новообразований в костной ткани. Исследование костной системы с 18F-NaF обеспечивает превосходную клиническую альтернативу со значительными преимуществами по сравнению с традиционными сцинтиграфическими методами исследования с 99mTc метилдифосфонатом. Исследования с 18F-NaF также имеют более высокую чувствительность и специфичность по сравнению со сцинтиграфическими методами [3]. 18F-NaF обеспечивает большее пространственное разрешение и лучшее качество изображения, что приводит к большей чувствительности и специфичности. Кроме того, ПЭТ-КТ с 18F-NaF способна более точно оценить ответ на терапию и обнаружить костные метастазы на этапе отсутствия рентгенологически видимого морфологического субстрата по сравнению с обычным ОФЭКТ — исследованием с препаратами, меченными 99mTc. Благодаря меньшей вводимой дозе и более короткому периоду полураспада 18F-NaF общая фактически поглощенная доза излучения почти сравнима с обычной сцинтиграфией костей скелета с препаратами, меченными 99mTc [4, 5]. По данным различных авторов, чувствительность ПЭТ-КТ с 18F-NaF в выявлении метастатического поражения костей при первичных опухолях различной локализации составляет 100% (в сравнении: ОФЭКТ с 99mTc метилдифосфонатом 88—92%), а специфичность метода — 87—100% (в сравнении: ОФЭКТ с 99mTc метилдифосфонатом 74—82%) [6—11]. При раке предстательной железы также показано сравнение с препаратами на основе холина. Чувствительность ПЭТ-КТ с 18F-NaF (86,9%) незначительно превосходит таковую при ПЭТ-КТ с препаратами на основе холина (85,2%), в то время как специфичность исследования с препаратами на основе холина выше (96,5%), чем при исследовании с 18F-NaF (79,9%), что обусловлено отсутствием накопления радиофармпрепаратов (РФП) на основе холина в дегенеративных изменениях [12—14]. Однако при первичных опухолях иной локализации ПЭТ-КТ с 18F-NaF в выявлении метастатического поражения костной системы является методом выбора.
Цель исследования — определить возможности метода ПЭТ-КТ, совмещенной с 18F-NaF, оценить его преимущества и недостатки в диагностике метастатического поражения костей скелета у пациентов с выявленной онкологической патологией.
Проанализированы результаты 277 ПЭТ-КТ-исследований у 272 пациентов (150 мужчин, 122 женщины); средний возраст которых составил 62,9+8,9 года. Из них по поводу дообследования при впервые выявленном злокачественном новообразовании (ЗНО) или подозрении на него обследованы 167 пациентов, для уточнения наличия метастатического поражения костей при подозрении на прогрессирование процесса при ЗНО после проведенного лечения — 105 пациентов. У всех пациентов использована совмещенная ПЭТ-КТ с РФП 18F-NaF по стандартному протоколу. Предварительная подготовка к исследованию не требуется. РФП 18F-NaF (для взрослого человека активность 185—370 МБк) вводится внутривенно, однократно, исследование проводилось через 30—45 мин на спиральных ПЭТ-КТ-томографах Biograph 64 и Biograph 40 (Siemens). Область сканирования: от макушки до кончиков пальцев ног включительно. Вначале пациентам делали нативную мультиспиральную компьютерную томографию, затем — позитронно-эмиссионную томографию.
В обследуемой группе преобладали пациенты с ЗНО предстательной (109 человек) и молочной (85 человек) желез, реже встречались пациенты с ЗНО легкого (11), с подозрением на метастатическое поражение костей скелета без выявленного первичного очага (10), с ЗНО прямой кишки (8), почки (7), первично-множественным раком и ЗНО желудка (по 6), также среди обследуемых были пациенты с ЗНО толстой кишки, яичников, шейки матки и первичными ЗНО костей (по 4), ЗНО вульвы, тела матки, с метастатическим поражением подмышечных лимфатических узлов без выявленного первичного очага, внеорганными ЗНО забрюшинного пространства, с меланомой кожи и ЗНО средостения (по 2) и единичные пациенты с ЗНО мочевого пузыря и ЗНО слизистой оболочки полости рта. При ПЭТ-КТ-обследовании с 18F-NaF признаки метастатического поражения костной системы выявлены у 81 пациента; из них у 47 пациентов имело место множественное поражение костей скелета, у 13 выявлены солитарные метастатические очаги, у 12 — единичные очаги и у 9 пациентов — субтотальное поражение костной системы. Ниже приводим наши наблюдения.
Клинический пример 1 (рис. 1 на цв. вклейке).

Рис. 1. Пациент Б., диагноз: ЗНО предстательной железы.
Пациент Б., диагноз: ЗНО предстательной железы. По данным планарной сцинтиграфии выявлено изолированное метастатическое поражение костей таза; по данным ПЭТ-КТ с 18F-NaF — множественное метастатическое поражение костной системы. Как показывает данный клинический пример, ПЭТ-КТ-исследование с 18F-NaF помогает не только выявить наличие вторичного поражения костной системы, но и достаточно точно оценить количество очагов (в сравнении с планарной сцинтиграфией).
Клинический пример 2 (рис. 2 на цв. вклейке).

Рис. 2. Пациентка Р., диагноз ЗНО правой молочной железы, после комплексного лечения.
Пациентка Р., диагноз: ЗНО правой молочной железы, после комплексного лечения. По поводу подозрения на генерализацию процесса пациентке выполнено ПЭТ-КТ-исследование с 18F-FDG, при котором выявлены метаболически неактивные очаги в костях, подозрительные на вторичное поражение. Для уточнения характера процесса пациентка была направлена на ПЭТ-КТ костной системы с 18F-NaF, при которой в проекции указанных очагов регистрировалась очаговая гиперфиксация 18F-NaF, что подтвердило наличие метастатического поражения костей скелета.
Клинический пример 3 (рис. 3 на цв. вклейке).

Рис. 3. Пациентка Ф., диагноз ЗНО левой молочной железы.
Пациентка Ф., диагноз: ЗНО левой молочной железы (первичное). При планарной сцинтиграфии данных, подтверждающих метастатическое поражение, не получено. При ПЭТ-КТ-исследовании костной системы с 18F-NaF в проекции тела позвонка ThXI выявлен литический очаг с ПЭТ-признаками гиперфиксации 18F-NaF.
Клинический пример 4 (рис. 4 на цв. вклейке).

Рис. 4. Пациентка В., диагноз ЗНО левой молочной железы.
Пациентка В., диагноз: ЗНО левой молочной железы (первичное). При ПЭТ-КТ-исследовании с 18F-NaF в проекции тела позвонка LI визуализировался очаг гиперфиксации 18F-NaF без наличия четко визуализирующегося морфологического субстрата на МСКТ-сканах. Аналогичные случаи с наличием единичных очагов гиперфиксации 18F-NaF, не имеющих четко визуализирующегося субстрата на МСКТ-сканах, представляют наибольшую сложность. Возникает вопрос: есть ли метастатическое поражение или нет, что предусматривает необходимость замены тактики лечения. Спустя 6 мес пациентке была выполнена ПЭТ-КТ с 18F-FDG (пациентке в это время проводилась гормонотерапия), при которой выявлен метаболически неактивный очаг бластического характера в проекции тела позвонка LI. Данный клинический пример в очередной раз доказывает высокую чувствительность ПЭТ-КТ с 18F-NaF.
У 170 пациентов ПЭТ-КТ-признаков метастатического поражения костной системы на момент обследования выявлено не было.
Клинический пример 5.
Пациентка Д. диагноз: ЗНО левой молочной железы, после комплексного лечения, генерализация процесса (метастатическое поражение паренхимы обоих легких), в процессе химиотерапии. Пациентке выполнено ПЭТ-КТ-исследование с 18F-FDG. В проекции костей скелета выявлены 2 очага умеренного гиперметаболизма 18F-FDG, морфологический субстрат на МСКТ-сканах отсутствовал. Пациентка отправлена на ПЭТ-КТ костной системы с 18F-NaF для уточнения характера процесса, при которой очагов гиперфиксации РФП не выявлено и подозрение на поражение костей скелета было опровергнуто. Как показывает данный клинический пример, отсутствие морфологического субстрата, характерного для метастатического процесса, на МСКТ-сканах и очагов гиперфиксации РФП на ПЭТ-сканах достоверно означает, что метастатическое поражение костей не зафиксировано.
У 21 пациента был сомнительный результат, в связи с чем рекомендовано ПЭТ-КТ-исследование в динамике через 3—4 мес. У 2 из них после ПЭТ-КТ через указанный срок метастатическое поражение костной системы было опровергнуто.
Клинический пример 6.
Пациент К., диагноз: ЗНО предстательной железы, после лечения, стабилизация процесса. При ПЭТ-КТ-исследовании с 18F-NaF в проекции VII ребра слева визуализировался единичный очаг неравномерного остеосклероза с признаками гиперфиксации РФП, не поддающийся однозначной трактовке на момент первичного исследования. При ПЭТ-КТ в динамике через 4 мес (в указанный промежуток времени пациент специфическое лечение не получал) отмечалось выраженное снижение уровня гиперфиксации 18F-NaF. Это свидетельствовало в пользу травматического характера повреждения.
Еще 3 пациента, которым было проведено по 2 исследования, направлены на повторное исследование для оценки динамики проводимого лечения вследствие выявленного при первом ПЭТ-КТ-исследовании метастатического поражения костей скелета. У 2 пациентов установлено прогрессирование процесса за счет появления новых очагов, у 1 — положительная динамика: снижение уровня гиперфиксации 18F-NaF и уменьшение размеров очагов. У пациентов с подозрением на метастатическое поражение костей скелета без выявленного первичного очага указанная патология опровергнута в 7 случаях, подтверждена в 1 случае; в одном высказано предположение о дисгормональном характере изменений в проекции костной системы и рекомендовано динамическое наблюдение и в одном случае имел место дифференциальный диагноз метастатического поражения и миеломной болезни.
1. ПЭТ-КТ-исследование с РФП 18F-NaF является весьма чувствительным методом как в диагностике метастазов литического характера (в отличие от остеосцинтиграфии), так и бластических метастазов (в отличии от ПЭТ-КТ с 18F-FDG).
2. ПЭТ-КТ-исследование с РФП 18F-NaF позволяет выявлять метастатическое поражение костей на доклинической стадии, когда на МСКТ-сканах морфологический субстрат еще не визуализируется.
3. Данный метод дает возможность дифференцировать вторичное поражение от изменений не только посттравматического, но и дегенеративного характера.
4. При ПЭТ-КТ-исследовании с РФП 18F-NaF можно установить большее количество очагов, чем при остеосцинтиграфии, что дает возможность точнее оценить распространенность процесса.
5. Исходя из полученных результатов, с целью дифференциальной диагностики изменений в проекции костной системы для исключения/подтверждения наличия метастатического поражения у пациентов с выявленной онкологической патологией, а также с подозрением на метастатическое поражение костей скелета без выявленного первичного очага рекомендуется выполнять ПЭТ-КТ с РФП 18F-NaF. ПЭТ-КТ с 18F-NaF позволяет в большинстве случаев определить природу изменений в проекции костей скелета, а при наличии метастатического поражения оценить распространенность процесса и в дальнейшем динамику на фоне проводимой терапии.
Участие авторов:
Концепция и дизайн исследования — Н.Г. Афанасьева, А.С. Зотова, Д.А.Важенина
Сбор и обработка материала — А.С. Зотова, Д.А. Важенина
Статистическая обработка — А.С. Зотова
Написание текста — А.С. Зотова
Редактирование — Н.Г. Афанасьева, А.В. Важенин
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
ПЭТ-КТ — это комплексное исследование тканей организма в рамках онкологического поиска. Методика основана на применении двух отдельных составляющих:
- ПЭТ или позитронно-эмиссионной томографии. Представляет собой способ визуализации измененных, чаще всего раковых тканей, основываясь на контрастировании наиболее «прожорливых» клеток препаратами на основе глюкозы и специального радиоактивного компонента.
- КТ — классическая компьютерная томография, которая позволяет визуализировать здоровые ткани.
Более чем в 90% случаев ПЭТ-КТ проводится для диагностики рака, уточнения характера и особенностей патологического процесса.
- В каких случаях назначают ПЭТ-КТ
- Противопоказания к исследованию
- Суть диагностики методом ПЭТ-КТ
- Всегда ли этот метод на сто процентов информативен
- Нужна ли специальная подготовка
- Преимущества методики
- Недостатки методики
- Как часто следует проводить исследование
В каких случаях назначают ПЭТ-КТ
ПЭТ-КТ — методика визуализации преимущественно раковых опухолей. Поскольку они отличаются повышенной потребностью в питании. Если говорить о показаниях более подробно, методика требуется в рамках:
- Дифференциальной диагностики злокачественных и доброкачественных опухолей. Первые копят специальный контрастирующий препарат. Вторые — нет или в минимальной, ничтожной степени.
- Оценка стадии злокачественного процесса. Определение фазы онкологического заболевания.
- Изучение характера опухоли, степени ее агрессивности по скорости обмена веществ.
- Планирование биопсии. В рамках позитронно-эмиссионной томографии врачи ищут наиболее активную область опухоли, где клетки претерпели наибольшее изменение, и их плотность физически выше.
- Мониторинг состояния после пройденного лечения. ПЭТ-КТ могут проходить раз в год или реже. В зависимости от того, какой был рак, насколько агрессивный, радикальное ли лечение получил пациент. ПЭТ нужен чтобы на ранних стадиях обнаружить рецидив онкологического процесса.
- Планирование хирургического лечение или лучевой терапии. Чтобы определить агрессивность неоплазии и проработать грамотную тактику борьбы с образованием. ПЭТ не помогает понять тип опухоли. Потому помимо требуется еще и гистологическое исследование образца.
- Поиск первичного очага при наличии метастазов.
ПЭТ-КТ универсальная методика диагностики и изучения деталей онкологических процессов. Но при низкой интенсивности обменных процессов в опухоли возможны опасные с точки зрения информативности погрешности и ошибки.
Противопоказания к исследованию
ПЭТ-КТ – исследование безопасное. Но ряд противопоказаний у него все же есть:
- Острые воспалительные процессы асептического характера. То есть не связанные с инфекционными агентами: поражениями грибками, вирусами или бактериями.
- Инфекционно-воспалительные процессы в острой и подострой фазах. Пока не наступило полного выздоровления. До тех пор, пока состояние полностью не нормализуется.
- Беременность, независимо от фазы. Исключая случаи, когда провести диагностику жизненно необходимо и других вариантов не остается.
- Психические расстройства в декомпенсированной фазе. Тяжелые психозы, алкогольный делирий, бредовый состояния. Пока человек не придет в себя.
- Период грудного вскармливания. Если пройти КТ жизненно необходимо, после процедуры мать отказываться от естественного вскармливания и переходит на специальные смеси.
- Общее тяжелое состояние человека.
- Диабет, как 1-го, так и 2-го типа.
- Тяжелые поражения печени или почек. Поскольку препарат будет выводиться непозволительно медленными темпами. Отсюда повышенный риск интоксикации всего организма.
Перед проведением ПЭТ-КТ следует проконсультироваться с врачом. На случай, если имеются противопоказания. Он взвесит все «за» и «против». Решит, стоит ли проводить позитронно-эмиссионную томографию несмотря на формальные основания этого не делать.
Суть диагностики методом ПЭТ-КТ
В основе ПЭТ-КТ лежат две технологии.
Первая, на которой зиждется ПЭТ — это качественная оценка метаболизма тканей. Раковый опухоли отличаются крайней «прожорливостью». Для роста и развития им требуется много веществ. Настолько много, что остальной организм остается в состоянии дефицита. Для определения таких ненасытных тканей используется вещество, которое универсально и нужно всем клеткам – глюкоза.
Чтобы зафиксировать интенсивность и степень накопления глюкозы в измененных клетках, ее маркируют специальным радиоактивным веществом. В значительной части случаев используются препараты радиоактивного фтора. Они отличаются большим периодом полураспада, без проблем транспортируются и хранятся. А с другой стороны, не вызывают токсического и радиоактивного поражения организма пациентов.
Препарат с такой маркировкой накапливается в измененных тканях, окрашивая наиболее агрессивные области. Врачи получают визуальное подтверждение, картинку. Результаты исследования дают возможность сделать выводы, какая опухоль имеет место.
Минус технологии — ПЭТ показывает только измененные ткани. Чтобы посмотреть, как опухоль соотносится с тканями здоровыми, применяют КТ. Картину компьютерной томографии накладывают на картину ПЭТ, получая единый снимок высокого качества.
Всегда ли этот метод на сто процентов информативен
К несчастью, даже такой высокочувствительный способ диагностики как ПЭТ-КТ не может быть на все сто информативным. Некоторые неоплазии обладают малой скоростью метаболизма:
- Раковые неоплазии щитовидки.
- Опухоли печени.
- Неоплазии почек.
- Раковые образования предстательной железы.
- Раковые опухоли костной ткани.
- Некоторые саркомы и лимфомы.
Недостаточная визуализация не означает, что проблемы нет. Требуются другие методы диагностики.
Ровно так же и окрашивание тканей не говорит о наличии рака. Старые поколения препаратов для контрастирования могут копиться и в здоровых тканях. Поэтому при расшифровке специалисты ориентируются на комплексную картину.
Нужна ли специальная подготовка
Подготовка простая:
- За сутки до исследования нужно снизить углеводную нагрузку. Углеводы исключают из рациона. Жевательная резинка также запрещена. В том числе с сахарозаменителем.
- За 8-10 часов нужно отказаться от пищи. Исследования проходят натощак. Воду пить разрешается.
- За сутки до процедуры стоит избегать интенсивной физической нагрузки.
Важно взять с собой заключения врачей и результаты иных диагностических мероприятий.
Преимущества методики
ПЭТ-КТ обладает несколькими весомыми плюсами:
- Комплексный характер, универсальность. Позитронно-эмиссионная и компьютерная томография позволяют исследовать любые органы.
- Высокая точность и информативность исследования.
- Возможность диагностики рака на ранних стадиях.
- Отсутствие боли и дискомфорта.
- Отсутствие необходимости госпитализации. Все проходит амбулаторно.
Есть и минусы.
Недостатки методики
Самый главный недостаток – это необходимость применения радиоактивных препаратов. Но при должном подходе есть возможность снизить лучевую нагрузку на организм.
Как часто следует проводить исследование
Частоту проведения исследования определяет врач, отталкиваясь от клинического случая. ПЭТ-КТ может проводиться как методика первичной диагностики, а также в рамках мониторинга патологического, онкологического процесса.
ПЭТ-КТ – это гибридный метод обследования. Он объединяет:
ПЭТ – это метод ядерной медицины, который показывает уровень обмена веществ (метаболизм) в различных участках тела. Для этого в организм пациента вводят небольшие количества радиоактивных веществ, которые называют радиотрейсерами или радиофармпрепаратами. Они накапливаются в опухолях, местах воспаления или связываются с определенными белками в организме. С помощью ПЭТ можно увидеть интенсивность накопления радиотрейсера и диагностировать заболевание на ранних стадиях.
КТ — метод получения поперечных изображений (срезов) костей, кровеносных сосудов и мягких тканей тела. Во время КТ серию рентгеновских снимков, сделанных под разными углами, объединяют с помощью компьютерной обработки. В результате можно получить детальное послойное изображение органов и тканей, установить местоположение опухоли и ее границы.
При объединении ПЭТ с КТ, врач может получить детальную информацию об изменениях в строении и метаболизме еще на клеточном уровне. В результате, после ПЭТ-КТ пациент раньше получает правильное лечение, что увеличивает шансы на выздоровление.
Когда используют ПЭТ-КТ?
ПЭТ-КТ никогда не назначают полностью здоровым людям. Чаще всего исследование необходимо при уже установленном диагнозе рака. ПЭТ-КТ в онкологии позволяет:
- определить стадию рака (степень распространения злокачественного процесса по организму);
- подобрать наиболее подходящее лечение;
- оценить ответ на лечение, например эффективность химио- или лучевой терапии;
- диагностировать рецидив рака до появления симптомов.
ПЭТ-КТ используют не только при раке. Метод позволяет максимально точно оценить строение и работу мозга и сердца, что помогает:
- оценить метаболизм и жизнеспособность тканей;
- определить последствия перенесенного инфаркта миокарда;
- предсказать возможную пользу от ангиопластики или коронарного шунтирования;
- выявить и изучить аномалии головного мозга — опухоли, нарушения памяти, судороги и другие заболевания центральной нервной системы.
Противопоказания и риски при ПЭТ-КТ
ПЭТ-КТ — это безболезненный и безопасный метод диагностики. Все же возможны редкие нежелательные явления связанные с:
- реакцией или аллергией на радиофармпрепарат;
- пребыванием в закрытом тоннеле аппарата, что может быть неприятным для людей с клаустрофобией.
Для того чтобы сделать процедуру максимально комфортной, в некоторых медицинских центрах, например турецкой клинике Медиполь, аппараты для ПЭТ-КТ способны создавать декорацию небосвода.
Из-за возможного негативного влияния рентгеновских лучей и радиотрейсера на плод, не желательно делать ПЭТ-КТ при беременности. Все же это противопоказание не абсолютное, поэтому в редких ситуациях ПЭТ-КТ проводят и беременным. Анализ подобных случаев не выявил плохого влияния на плод.
Мифы, связанные с ПЭТ-КТ
В интернете и на многих пациентских форумах можно найти много неправдивой информации о ПЭТ-КТ. Часто, это умозаключения людей, не связанных с медициной, которые не подтверждены результатами исследований.
ПЭТ-КТ — лишняя трата денег, можно обойтись обычной КТ или МРТ
Ряд клинических исследований сравнивали ПЭТ-КТ с другими методами визуализации. Было установлено, что у трети пациентов технология ПЭТ/КТ выявляет изменения, которых не было найдено на обычной ПЭТ или КТ. Это позволяет сразу подобрать правильное лечение и увеличить шанс на выздоровление.
Для примера, у одного из реальных пациентов с раком легкого, ПЭТ/КТ выявило не только первичную опухоль в легком, которую ранее обнаружили на КТ, но и дополнительную опухоль, которую на КТ видно не было.
Если бы врач руководствовался только результатами КТ, он бы рекомендовал операцию. Дополнительная опухоль, обнаруженная с помощью ПЭТ/КТ, показала, что рак распространился и был неоперабельным. Основываясь на этой информации, врач приступил к лучевой терапии, что дало пациенту больше шансов на выживание.
Доза радиации при ПЭТ-КТ большая и может вызвать прогрессирование рака
Мир вокруг нас постоянно излучает радиацию. Так, жители России и США ежегодно получают дозу фонового радиационного излучения около 3 миллизиверта (мЗв). В Рамсаре и Иране ежегодное фоновое облучение в разы выше и составляет до 260 мзВ. Радиационный фон формируют многие источники, включая:
- космическое излучение;
- радиоактивность окружающей среды от естественных радиоактивных материалов, например, радона и радия;
- излучение в результате испытаний ядерного оружия и радиационных аварий.
При этом не все люди вокруг болеют раком. Дело в том, что человеческое тело оснащено механизмами восстановления для борьбы с повреждениями, вызванными низкими дозами радиации. Таким образом, люди могут переносить низкие дозы радиации без риска развития рака. Средняя доза облучения при ПЭТ-КТ составляет всего 25 мЗв, а значит организм может легко с ней справиться.
Я буду излучать радиацию много дней после процедуры
Некоторые люди думают, что радиоактивный изотоп долго не выводиться. На самом деле, через 12 часов после ПЭТ-КТ доза выделяемой радиации будет настолько низкой, что можно безопасно кормить ребенка грудью. Через сутки после процедуры в вашем организме совсем не останется радиотрейсера.
Как подготовиться к ПЭТ-КТ?
Для того чтобы результаты ПЭТ-КТ были максимально точными, следует придерживаться нескольких простых правил.
- За сутки до обследования нужно воздержаться от интенсивных физических нагрузок.
- Последний прием пищи должен быть не позже, чем за 4-6 часов перед процедурой.
- Следует пить достаточно жидкости, чтобы избежать обезвоживания.
- Нельзя жевать жевательную резинку или рассасывать любые карамельки или леденцы, в том числе и от кашля;
- Кольца, серьги и другие украшения перед обследованием нужно будет снять, поэтому лучше изначально оставить их дома.
- Желательно одевать удобную свободную одежду, хотя, перед процедурой на вас наденут одноразовую медицинскую робу.
Радиофармпрепараты, которые используют при ПЭТ-КТ, содержат глюкозу, поэтому, пациентам с сахарным диабетом нужна более тщательная подготовка к процедуре. Иногда нужно отменить сахаропонижающие лекарства за несколько дней до обследования. При использовании инсулина, последнюю дозу следует вводить не позже, чем за 4 часа до процедуры.
Обязательно сообщите врачу если вы:
- имеете хронические заболевания;
- принимаете какие-либо лекарства, включая витамины и растительные препараты;
- подозреваете беременность или беременны;
- когда-либо имели аллергию.
Чего ожидать во время ПЭТ-КТ?
Обследование включает в себя два этапа — поглощения и сканирования.
І — Этап поглощения
На этапе поглощения пациенту вводят радиотрейсер, чаще внутривенно, и ждут, пока он распределится по организму. Во время введения индикатора и 45-60 минут после, пациенту:
- нужно сидеть или лежать неподвижно;
- нельзя разговаривать и не жевать, чтобы избежать усиленного накопления радиофармпрепарата в мышцах гортани и шеи и искажения результатов ПЭТ-КТ;
- следует находиться в тепле.
Последнее нужно не только для комфорта пациента. Во время процедуры важно не мерзнуть, так как это может привести к накоплению препарата в жировой ткани. В идеале, обследуемого следует укрыть за 30–60 минут до введения радиотрейсера и согревать в течение всей ПЭТ-КТ.
ІІ — Этап сканирования и получения изображений
- Пациента помещают в специальный аппарат для ПЭТ-КТ.
- Через тонкие слои его тела в разных направлениях пропускают рентгеновские лучи.
- Электронные рентгеновские детекторы фиксируют излучение с разных участков тела и передают его на компьютер.
- Параллельно, специальные датчики гамма-излучения фиксируют излучение от введенного внутривенно радиотрейсера.
- Полученное изображение активности обмена веществ “накладывают” на послойное изображения тела.
В результате врач получает информацию о строении и обмене веществ различных органов в высоком разрешении. Процедура непосредственного сканирования длится около 30 минут.
Как вести себя после ПЭТ-КТ?
ПЭТ-КТ – это амбулаторная процедура. Для ее проведения не нужно ложиться в больницу. Покинуть клинику можно сразу после окончания сканирования.
В течение некоторого времени после обследования человек излучает небольшую дозу радиации. Для того чтобы обезопасить себя и окружающих, в течение 12 часов после процедуры следует:
- Ограничить близкие контакты с маленькими детьми и беременными женщинами;
- Отказаться от грудного вскармливания. В течение 12 часов молоко следует просто сцеживать, после чего можно возобновить привычный режим кормления.
Для того чтобы ускорить выведение радиотрейсера с организма пейте много жидкости. Сразу после обследования можно вернуться к обычному режиму питания.
Зачем ехать на ПЭТ-КТ за границу?
ПЭТ-КТ является золотым стандартом диагностики большинства злокачественных заболеваний. В тоже самое время, во многих странах метод остается недоступным. Например, в Украине существует всего 4 аппарата ПЭТ-КТ. В результате, не так много отечественных специалистов знают, как расшифровать полученные результаты, а многие пациенты не попадают на диагностику из-за очередей.
Преимуществами проведения ПЭТ-КТ за рубежом является:
- современное материально-техническое оснащение;
- отсутствие многомесячных очередей;
- процедуру проводят и интерпретируют врачи с 30-летним стажем в ядерной медицине.
Где можно сделать ПЭТ-КТ за границей?
ПЭТ-КТ пациентам из-за рубежа успешно делают в клиниках Турции, Германии, Испании, Израиля. При выборе клиники следует учитывать множество факторов, включая:
- диагноз;
- сопутствующие заболевания;
- пожелания пациента.
Оставьте заявку и наши врачи-координаторы бесплатно подберут наиболее подходящий центр, с учетом ваших пожеланий и особенностей заболевания.
На каких аппаратах делают ПЭТ-КТ за границей?
Хотя ПЭТ-КТ и так является инновационным методом диагностики, в клиниках за рубежом ее проводят на самых совеременных аппаратах. Так, в медицинском госпитале Медиполь (Турция), для ПЭТ-КТ используют томограф премиум-класса Philips Gemini TF. Главными преимуществами аппарата являются:
- сниженная лучевая нагрузка;
- использование более низких доз радифармпрепарата, что уменьшает стоимость диагностики;
- меньшая длительность обследования;
- повышенная точность полученных изображений;
- возможность обследовать крупных пациентов;
- открытый дизайн, который обеспечивает повышенный комфорт для тревожных пациентов и пациентов с клаустрофобией.
Сколько стоит ПЭТ-КТ за рубежом?
Стоимость ПЭТ-КТ за рубежом стартует от $650, однако широко варьируется и зависит от многих факторов. На цену влияет:
- заболевание, из-за которого проводят обследование;
- тип радиофармпрепарата;
- страна и клиника.
Так, цена ПЭТ-КТ с Галлием, которая является золотым стандартом диагностики рака простаты, начинается уже от $2000. Воспользовавшись формой справа, можно оставить заявку и получить детальную консультацию от наших врачей-координаторов и узнать актуальную стоимость ПЭТ-КТ в каждой из клиник.
Вопрос №1. Что такое исследование «всего тела»?
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18F-фтордезоксиглюкоза (18F-ФДГ). В данном соединении 18F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18F-ФДГ, 11С-холином, 11С-метионином, 68Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
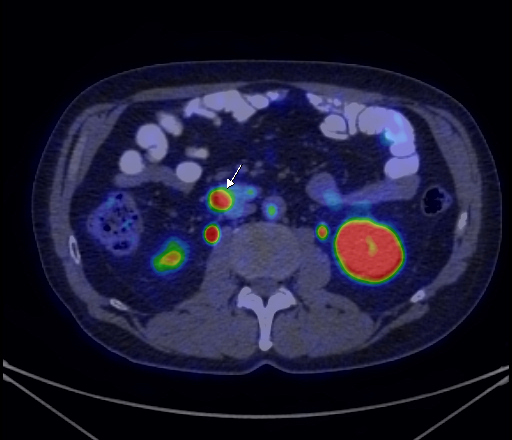 |
| Данные ПЭТ/КТ с 68Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
 |
| Данные ПЭТ/КТ с 18F-ФДГ у пациента с метаболически неактивным образованием правого легкого (доброкачественная опухоль — гамартома). |
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
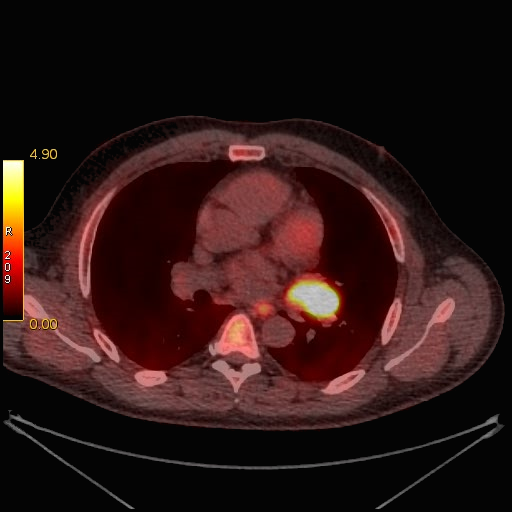 |
| Данные ПЭТ/КТ с 11С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
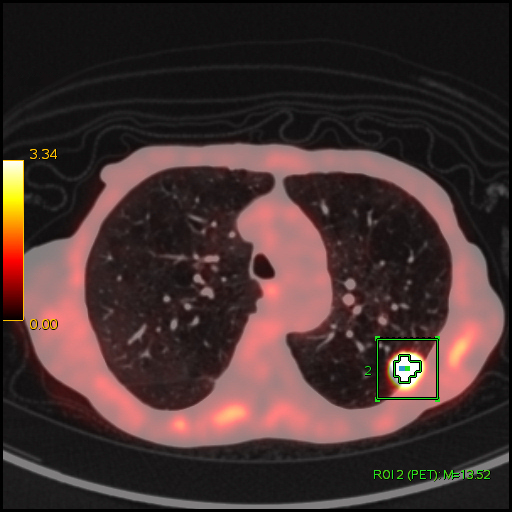 |
| Данные ПЭТ/КТ с 18F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
- Частичный метаболический ответ – устанавливается при уменьшении значения SUV в опухоли на 25% и более;
- Полный метаболический ответ – заключается в отсутствии повышенного накопления РФП в опухоли;
- Метаболическое прогрессирование – устанавливается при увеличении SUV на 25% и более и/или при появлении новых очагов патологической гиперфиксации РФП;
- Метаболическая стабилизация – регистрируется при отсутствии достоверных (менее 25%) изменений показателя SUV в опухоли.
Результаты ПЭТ с 18F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
Новости онкологии
17.02.2020
К дискуссии о роли ПЭТ-КТ в лечении рака молочной железы
Строяковский Даниил Львович
Руководитель химиотерапевтического отделения Городской онкологической больницы №62, член правления RUSSCO, кандидат медицинских наук, Москва
Выражаю исключительно свое собственное мнение, основанное на каждодневной работе и постоянном просмотре дисков КТ, ПЭТ-КТ, МРТ и других рентгенологических исследований, во время консультаций пациентов.
1. Качество ПЭТ-КТ исследования
На мой взгляд, сегодня независимо от нозологии выполнение ПЭТ-КТ исследования без введения внутривенного (в/в) контрастирования делает это исследование неполноценным. Без в/в контрастирования зачастую сложно оценить размер патологических образований и, самое главное, это исследование невозможно использовать в дальнейшем для оценки динамики процесса при сравнении с КТ исследованием. Если сделано ПЭТ-КТ без в/в контраста, то пациенту необходимо делать еще одно исследование – КТ с в/в контрастированием 3 зон (грудная клетка, брюшная полость и малый таз), чтобы дальше можно было оценивать эффективность лечения с помощью КТ. Если сделано сразу ПЭТ-КТ исследование с в/в контрастированием, то КТ-часть этого исследования с в/в контрастированием отлично подходит для оценки эффективности при дальнейшем использовании КТ. На мой взгляд, ПЭТ-КТ без в/в контраста должно быть очень редким исследованием и проводиться только при наличии жестких противопоказаний для введения в/в контраста (например, аллергическая реакция на йод или тяжелая почечная недостаточность). Не должно быть так, что ПЭТ-КТ исследование делают без в/в контраста из-за того, что тариф ОМС при добавлении стоимости контрастного вещества делает исследование менее прибыльным (к сожалению, сегодня это распространенная практика). Как результат – скупой платит дважды: пациенту приходится делать еще одно исследование – КТ с в/в контрастом.
2. Собственно ПЭТ-КТ и рак молочной железы
Для чего нужно делать более углубленные методы исследований при онкологических заболеваниях, такие как КТ, МРТ, ПЭТ-КТ? Углубленное исследование практически может привести к повышению стадии заболевания или, крайне маловероятно, к снижению стадии. Всегда ли это необходимо? Это необходимо делать в том случае, если дополнительные знания о наличии метастатических очагов (регионарных или метастатических), которые не были видны при рутинном обследовании, приведут к изменению тактики лечения. Данное изменение тактики лечения должно быть более благоприятно для лечения пациента, как с точки зрения прогноза и выбора метода, так и последовательности лечения. Если углубленное исследование не приводит к изменению тактики лечения или может создать дополнительные сложности в принятии решения, за которыми не стоит реальное излечение или увеличение продолжительности жизни пациента, то проведение подобного исследования может носить негативный характер.
Локальный рак молочной железы (операбельный). Независимо от биологического подтипа опухоли не требуется проведение ПЭТ-КТ исследования, так как шансы, что будут найдены клинически значимые отдаленные метастазы, очень невелики. Случайно выявленные бессимптомные находки могут затянуть начало лечения, и у некоторых пациенток опухоль может стать местнораспространенной (особенно при агрессивных подтипах, таких как Her2 позитивный, базальный, трижды негативный, или люминальный В с высоким уровнем пролиферативной активности). Ранние локальные стадии рака молочной железы нуждаются в эффективном и безопасном локальном лечении без проведения КТ, ПЭТ-КТ и т.д. и затем в эффективной адъювантной терапии, в зависимости от подтипа опухоли. Например, у больной локальный рак молочной железы, мы делаем ПЭТ-КТ исследование и видим несколько очагов в легочной ткани малых размеров, которые глубоко расположены от плевры и немного накапливают радиофармпрепарат. Данные очаги могут быть как неспецифическими (воспалительными), так и метастатическими. Начинается «пляска» вокруг этих очагов: метастазы, значит IV стадия? значит паллиативное лечение? взять биопсию? торакоскопически? открыто? один очаг возьмем – окажется не метастаз, значит остальные очаги не метастазы? и т.д. Бесконечное количество вопросов…. Действие клинициста или консилиума: берем на себя ответственность, волевое решение – не метастазы. Лечим как раннюю стадию. Но в голове у всех червь сомнений, а вдруг ошибка. Пациентка жить спокойно не может. Врач ёрзает, потому что нет истины в последней инстанции. Начинаем каждые 3-6 месяцев проверять. Увеличивает ли данная информация шансы пациентки на излечение или продолжительность жизни? Обследование затягивается, лечение затягивается, сомнения в правильности, отслеживания и т.д., а всего лишь хотели углубленно посмотреть и обрадоваться, что все прекрасно.
Местнораспространенный рак молочной железы: IIB-III стадии. Более сложная проблема. Здесь очень много факторов влияют на выбор тактики лечения. Основные: биологический тип опухоли, возраст и сопутствующая патология.
Если у больной Her2 позитивный вариант рака молочной железы, то предоперационная химиотаргетная терапия с очень высокой вероятностью перекрывает отсутствие информации о возможных клинически незначимых метастазах, пропущенных при рутинном обследовании. На мой взгляд, лучше лечить пациентку как с III стадией, проводить интенсивное лечение, т.к. это подразумевает куративный (а не паллиативный) подход. Получается, что у ПЭТ-КТ задача: перевести пациентку с III стадией в IV стадию, т.к. будут визуализированы субклинические очаги! А надо ли это? При использовании химиотерапии, с двойной таргетной блокадой, у больной имеются высокие шансы (50-75%) достичь полного лечебного патоморфоза первичной опухоли и л/у (pCR), как суррогат элиминации микрометастазов. При этом понятно, что дистанция между микрометастазами, которые мы еще не видим, и мелкими видимыми метастазами, которые начинаем видеть, очень эфемерная. Соответственно, маленькие, подозрительные или слегка видимые метастазы будут также уничтожены эффективным системным лечением. Лучше для больной и для врачей не знать об их наличии и не сомневаться в необходимости использования эффективной программы для IIB-III стадии. Если мы по какой-то причине решим, что выявленные изменения по КТ или ПЭТ-КТ являются отдаленными метастазами (неважно, так это на самом деле или нет), то терапия будет деэскалирована, хирургический компонент может быть отменен, лучевая терапия отменена, таргетная терапия будет проводиться до прогрессирования или токсичности (а она практически нетоксична) и лечение с паллиативным настроем будет проводиться бесконечно (или очень долго). Причем никто не знает, как долго ее проводить!
Но у больных преклонного возраста с выраженной сопутствующей патологией имеет смысл уточнить стадию процесса, так как данная категория больных с трудом может перенести всю программу радикального лечения, и риск осложнений может превышать потенциальную пользу. В этом случае ПЭТ-КТ может помочь избежать ненужной агрессии, если мы сразу поймем, что имеем дело с IV стадией болезни, и далее безопасно, но при этом достаточно эффективно, длительно лечить пациентку с помощью лекарственной терапии. Но если с помощью ПЭТ-КТ (или КТ) подтвердилась III стадия, то тогда у врачей имеется четкое обоснование для радикального подхода к лечению больной.
Если у пациентки агрессивный вариант трижды-негативного рака. Базальный подтип ~85% от всех трижды-негативных вариантов. Прогноз в данной биологической подгруппе в настоящее время существенно хуже, чем при Her2 позитивном варианте. При локальных, малых опухолях, которые чаще всего являются случайной находкой: хирургия на первом этапе и затем химиотерапия (на мой взгляд, включая карбоплатин) являются основными. Риск выявления отдаленных метастазов незначительный, значит, углубленное обследование не обосновано. Лучше не затягивать начало лечение (чтобы «за время пути собачка не могла подрасти»). При местнораспространенном потенциально операбельном раке IIB-IIIA(B?) лечение должно начаться с неоадъювантной интенсивной химиотерапии, и в данной группе имеются 30-50% шансы на полный патоморфологический ответ, что опять-таки является хорошим предсказательным маркером. В недалеком будущем к неоадъювантной химиотерапии в этой группе будет добавлена иммунотерапия, что еще повысит на 14-15% шансы на pCR и, самое главное, позволит снизить риск раннего прогрессирования (что при трижды-негативном раке бывает очень часто). Отдельная группа трижды-негативного рака – больные с явно неоперабельными IIIB-IIIC стадиями. В этом случае, конечно, очень вероятна конверсия III стадии в IV стадию при проведении ПЭТ-КТ исследования (или просто КТ). И тут стоит задуматься индивидуально, стоит ли это делать. Это индивидуальное решение. IV стадия трижды-негативного рака пока не может быть излечена. Надо ли сразу иметь паллиативную направленность лечения? Или попробовать идти по радикальному пути? Тем более что пациентки (первоначально) очень хорошо отвечают на химиотерапию в большинстве случаев, особенно если химиотерапия дозоинтенсивная и с добавлением платины? Нет однозначного ответа на этот вопрос… Или пожилые пациентки с трижды-негативным вариантом (такие тоже встречаются). В этом случае, на мой взгляд, лучше знать истинную стадию и не откладывать информацию о ней в долгий ящик, так как переносимость интенсивной химиотерапии в этой группе неудовлетворительная, и конверсия стадии, если таковая произойдет (благодаря ПЭТ-КТ), послужит обоснованному паллиативному подходу.
Еще одна, самая многочисленная группа – гормонопозитивный, Her2 негативный вариант. Очень гетерогенная группа.
Пациентки с ранними формами, их много, не нуждаются в углубленном дообследовании. Шансы найти отдаленные метастазы и повысить стадию малы. У больных с местнораспространенным раком шансы найти отдаленные метастазы довольно большие – примерно 20-25%. У молодых и/или у пациентов без существенной сопутствующей патологии нет смысла усугублять стадию с помощью ПЭТ-КТ. Это лишает пациенток радикального подхода к лечению. Конечно, у значительной доли больных с течением времени реализуются отдаленные метастазы. Но это может быть через 3-5-10 лет. Зачем об этом знать с самого начала? Это вопрос спорный. С одной стороны, ранняя информация о наличии бессимптомной метастатической болезни не увеличивает продолжительность жизни (сегодня пока так), просто пациентка живет с информацией о неизлечимости болезни и о том, что лечение (гормонотерапия, химиотерапия и т.д.) будут проводиться всю оставшуюся жизнь, а это многие-многие годы. С другой стороны, если у пациентки изначально 4 стадия, то 1 год жизни (неоадъювантная химиотерапия, операция, лучевое лечение) она потратит на агрессивное лечение, которое не приведет к увеличению общей выживаемости, при этом снизит качество жизни (удаление молочной железы, полгода токсичной химиотерапии, лучевое лечение). Не все пациентки этого бы хотели, и эти обсуждения, безусловно, должны приниматься совместно с пациенткой и, в том числе, в зависимости от ее настроя. Надо объяснить, что мы ждем от ПЭТ-КТ и какие изменения тактики могут быть.
Опять стоит задуматься о больных преклонного возраста и/или с сопутствующей патологией. В этом случае конверсия стадии из III в IV позволяет избежать избыточного химиотерапевтического и локального лечения, которое входит в программу лечения местнораспространенных стадий. В этом случае мы основной упор делаем на гормонотерапию +/- ингибиторы CDK 4/6. И лечение может быть очень эффективным. Долгие годы метастатический процесс контролируется с помощью минимально токсичного лечения. В этой группе знание – сила.
При этом стоит также сказать о «пользе» КТ/ПЭТ-КТ в подходе к диагностике местнораспространенных раков молочной железы. Такой метод исследования дает нам более точное представление об N-cтадировании, в частности, о вовлечении над-подключичных лимфатических узлов или парастернальных, и диктует подход к хирургической агрессии, а также лучевой терапии.
Также стоит отметить, что такие спорные обсуждения и индивидуальные решения не могут быть масштабированы или применяться рутинно вне экспертных центров.
Теперь о метастатическом раке молочной железы. Надо ли делать ПЭТ-КТ и отслеживать эффективность по ПЭТ-КТ? Возникает вопрос: а что такого может дополнительно дать ПЭТ-КТ в сравнении с КТ с контрастом? КТ хорош тем (сейчас практически все КТ мультиспиральные), что воспроизводим, не очень дорог, видит очевидную патологию, удобен для динамического контроля, много аппаратов. Может ли информация о каком-либо дополнительным очаге или группе очагов, которые пропущены на КТ трех зон, поменять тактику лечения? Мой ответ – в небольшом проценте случаев может, так как ПЭТ-КТ делается всего тела (а не только 3-х зон). На ПЭТ-КТ видна голова, проксимальная часть рук и ноги: можно увидеть там какие-либо изменения. Например, увидеть подозрительный бессимптомный очаг в головном мозге, врач направит на МРТ, и если окажется метастаз, то будет проведен гамма-нож (например). Но много ли таких случаев в рутинной клинической практике? Мой опыт говорит, что не более 3-5%, это я сужу по своим ощущениям. Статистику не делал. Может быть, раз в месяц или два вижу подобные находки благодаря ПЭТ-КТ, которые меняют мой подход к выбору лечения. Может ли накопление радиофармпрепарата (SUV) диктовать мне необходимость каких-либо действий, если нет явного очага? КТ тем и хорош, что видит явный очаг (плюс ткань), пропускает клинически незначимые малые очаги (которые практически всегда бессимптомные). Врачу-клиницисту не нужна избыточная и бессмысленная информация, это мешает, создает информационный шум, мешает увидеть главное. Те врачи-клиницисты, кто регулярно смотрит КТ и ПЭТ-КТ, все время видят, что нет совершенного метода, который может со 100% вероятностью отличить онкопатологию от воспаления или неспецифики.
Терапия метастатического рака молочной железы требует видения проблемы болезни и пациентки в целом, и очень редко детализации. На продолжительность и качество жизни практически не влияет, на 1-2 мм больше метастаз или меньше, стал ли немного больше SUV или чуть уменьшился. Для оценки эффективности химиотерапии метастатического рака молочной железы отлично подходит КТ с контрастом. ПЭТ-КТ с контрастом может быть на старте (обезопасить себя, что не прозевали метастаз в мозг или диафиз бедренной кости, например), а затем отслеживать динамику стоит на основании КТ трех зон с в/в контрастом. Некоторые формы метастатического рака молочной железы, например, дольковый рак, вообще плохо видны на ПЭТ-КТ с точки зрения SUV. На фоне гормонотерапии изменения в костных метастазах происходят небыстро, и может быть симптом вспышки (как при сканировании костей), когда на фоне эффективной гормонотерапии сначала SUV может вырасти. При этом структура метастазов начинает меняться в сторону склерозирования, что отражает положительную динамику на фоне лечения (я очень много видел формальных заключений ПЭТ-КТ о прогрессировании на основании роста SUV, тогда как по КТ части исследования и клинически была явная положительная динамика, и вынужден брать на себя ответственность, успокаивать пациентку и продолжать лечение без изменений). Проведение ПЭТ-КТ исследования может быть оправданно, если у больной мы видим олигометастатическую болезнь и задумали какое-то локальное лечение (например, удалить единственный метастаз), тут ПЭТ-КТ очевидный помощник в принятии решения.
В целом, при метастатическом раке молочной железы ПЭТ-КТ практически не имеет преимуществ в сравнении с качественным КТ. Может быть, оправдан на старте терапии. Но не в оценке динамики. Лишь в отдельных случаях, на усмотрение клинициста, ПЭТ-КТ может дать дополнительную ценную информацию.
3. Надо ли делать ПЭТ-КТ при динамическом наблюдении после радикального лечения?
Категорически нет!!! Также как и КТ, МРТ, УЗИ, маркеры, анализы крови и т.д. Раннее выявление бессимптомных метастазов не приводит к увеличению продолжительности жизни. Это не то же самое, что рано выявить первичную опухоль. Это – рано выявить фактически IV и неизлечимую стадию. При отсутствии симптоматики не нужно искать метастазы – это несет вред в большинстве случаев. Иногда, правда, можно случайно выявить другую опухоль ранней стадии (например, рак толстой кишки) и тогда вовремя прооперируют, но это все как случайный выстрел, который попал в десятку (в жизни все бывает). Не стоит заниматься скринингом с помощью ПЭТ-КТ. А что делать? Только маммографию неудаленной железы или обеих, если была органосохранная операция. Почему? Потому что у больных, перенесших рак молочной железы, повышается риск повторного первичного рака молочной железы. И лучше его выявить раньше. Повторная радикальная терапия локальной стадии имеет практически такой же шанс на успех, как и предыдущая.
Заключение
У ПЭТ-КТ есть ограниченная роль в лечении рака молочной железы. Назначение ПЭТ-КТ должно быть инициировано врачом-клиницистом, который реально разбирается во всех тонкостях болезни и понимает, для чего ему будет нужна потенциально новая информация. Ни в коем случае нельзя делать ПЭТ-КТ по требованию пациентки или ее родственников (сегодня медицина зачастую работает по принципу: чего изволите-с). ПЭТ-КТ не должно быть заменой КТ только потому, что проще направить и быстрее сделают, так как на КТ очередь, а ПЭТ-КТ оплачивает ОМС.
Вместе с тем, я благодарен системе, что ПЭТ-КТ была включена в ОМС почти 5 лет назад и так распространилась. Это значительно добавило мне знаний и понимания биологии разных болезней, в том числе рака молочной железы. Без этого я не смог бы сегодня поделиться своими мыслями (их бы просто не было). И еще (для врачей клиницистов, которые решают, как лечить): чтобы легко просматривать диски (КТ, МРТ, ПЭТ-КТ) скачайте из инета RADIANT для Windows. Это бесплатная программа. «Жует» практически все диски и виды DICOM программ. Последняя версия позволяет создать собственный архив, что очень важно при повторном визите пациента. Относительно быстро грузит (зависит от диска). Позволяет выводить фронтальную и сагитальную проекции, если сделаны тонкие срезы. Кнопочка F (фьюжен) позволяет сделать отличную картину ПЭТ-КТ со свечением. Нажатием на колесико мыши можно регулировать яркость ПЭТ изображения (спасибо Максиму Смолярчуку). Рекомендую, всегда смотреть imaging своих пациентов и не принимать решения на основании формальных заключений.