ПЭТ-КТ — это современный метод обследования, совмещающий позитронно-эмиссионную томографию (ПЭТ) и компьютерную томографию (КТ). Иногда метод называется просто ПЭТ. В его основе лежит регистрация гамма-излучения от введенного в организм радиофармпрепарата.
КАК ЧАСТО ОШИБАЕТСЯ ПЭТ-КТ, БЫВАЮТ ЛИ ОШИБКИ ПЭТ-КТ?
Вопрос важный, ведь это обследование проходят те, кому очень нужен точный диагноз!
Увы, ошибки диагностики при ПЭТ-КТ встречаются в определенном проценте случаев. Это обусловлено двумя факторами.
1. Объективный фактор, заключающийся в самой методике. В любом диагностическом методе, будь то КТ, МРТ или ПЭТ, изначально заложен определенный процент ошибок. Если мы возьмем какую-нибудь болезнь — например, рак молочной железы, то не все случаи рака молочной железы могут быть выявлены с помощью ПЭТ (это называется ложноотрицательный результат). Кроме того, иногда при отсутствии рака на снимках ПЭТ-КТ могут выявляться ее признаки (это называется ложноположительный результат). Есть несколько причин этого феномена: несовершенство аппаратуры, наличие сопутствующих болезней, имеющих сходную симптоматику, плохая выявляемость болезни на ранней стадии. Нужно отметить, что с каждым годом аппаратура ПЭТ-КТ становится все точнее, и поэтому процент ложных результатов постепенно уменьшается.
2. Субъективный фактор — более важный. Он обусловлен неверной трактовкой результатов ПЭТ-КТ. Врач, анализирующий снимки ПЭТ-КТ, может совершить ошибку и неправильно описать имеющиеся изменения! Нужно понимать, что любая аппаратура, даже самая современная — это всего лишь «железо» для получения изображений. А расшифровка изображений ПЭТ-КТ — это дело врача-радиолога, и от его опыта и знаний напрямую зависит достоверность диагностики.
Диагностические ошибки ПЭТ-КТ, обусловленные неправильной расшифровкой снимков, встречаются не так уж редко. В России этот метод только начинает развиваться. Количество квалифицированных специалистов по ПЭТ пока ограничено, и почти все они работают в нескольких профильных центрах в крупных городах (например, Институт мозга человека РАН). Встречается ситуация, когда в лечебное учреждение поставили новое оборудование ПЭТ, а опытного специалиста для работы на нем не найти. Это касается как государственных, так и частных центров ПЭТ.
В этих случаях не нужно отчаиваться. Если у вас или ваших лечащих врачей после проведения ПЭТ-КТ остаются вопросы по диагнозу, снимки можно проконсультировать у более опытного специалиста. Сегодняшняя ситуация такова, что такой специалист не обязательно должен жить в том же городе — результаты можно переслать ему по сети интернет.
ПЭТ-КТ В ДИАГНОСТИКЕ РАКА — КАК ИЗБЕЖАТЬ ОШИБОК?
Второе мнение по ПЭТ-КТ — распространенная услуга во всем мире. Для онкологических пациентов крайне важно не ошибиться с диагнозом — например, знать точную стадию рака, количество пораженных лимфатических узлов, достоверно исключить метастазы в печень, кости и другие органы. Пересмотр ПЭТ-КТ опытным врачом-диагностом — это способ свести риск ошибки к минимуму.
Может ли ПЭТ-КТ дать ошибку по метастазам? На примере — очаги накопления радиофармпрепарата [18F]-дезоксиглюкозы в подмышечной области и вдоль позвоночника, которые первоначально были расценены как метастазы в лимфатические узлы. Более внимательный анализ в ходе второго мнения показал, что эти очаги не являются злокачественной опухолью, а представляют собой участки бурого жира, отличающиеся повышенной метаболической активностью. На этом примере мы видим, как пересмотр результатов ПЭТ-КТ помог сделать диагноз менее опасным.
Заказать второе мнение по ПЭТ-КТ можно из любого города России, не выходя из дома. Врачи-радиологи Санкт-Петербургского Института мозга человека обладают огромным опытом в расшифровке ПЭТ-КТ головного мозга с метионином, ПЭТ-КТ всего тела с глюкозой, и других видов ПЭТ. Достаточно отправить им снимки через систему Национальной телерадиологической сети, и получить в течение суток подробное и квалифицированное заключение. Пересмотр результатов ПЭТ осуществляется под руководством З. Л. Бродской — корифея отечественной радиологии, многолетнего соратника знаменитой Н. П. Бехтеревой.
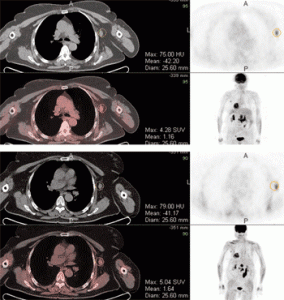
ПЭТ-КТ при раке молочной железы. Тщательный анализ характеристик накопления РФП (SUV) в подмышечных лимфатических узлах помогают различить метастазы и доброкачественное увеличение узлов.
Читать подробнее о Втором мнении
Читать подробнее о телемедицине
Кандидат медицинских наук, член Европейского общества радиологов
Новости онкологии
17.02.2020
К дискуссии о роли ПЭТ-КТ в лечении рака молочной железы
Строяковский Даниил Львович
Руководитель химиотерапевтического отделения Городской онкологической больницы №62, член правления RUSSCO, кандидат медицинских наук, Москва
Выражаю исключительно свое собственное мнение, основанное на каждодневной работе и постоянном просмотре дисков КТ, ПЭТ-КТ, МРТ и других рентгенологических исследований, во время консультаций пациентов.
1. Качество ПЭТ-КТ исследования
На мой взгляд, сегодня независимо от нозологии выполнение ПЭТ-КТ исследования без введения внутривенного (в/в) контрастирования делает это исследование неполноценным. Без в/в контрастирования зачастую сложно оценить размер патологических образований и, самое главное, это исследование невозможно использовать в дальнейшем для оценки динамики процесса при сравнении с КТ исследованием. Если сделано ПЭТ-КТ без в/в контраста, то пациенту необходимо делать еще одно исследование – КТ с в/в контрастированием 3 зон (грудная клетка, брюшная полость и малый таз), чтобы дальше можно было оценивать эффективность лечения с помощью КТ. Если сделано сразу ПЭТ-КТ исследование с в/в контрастированием, то КТ-часть этого исследования с в/в контрастированием отлично подходит для оценки эффективности при дальнейшем использовании КТ. На мой взгляд, ПЭТ-КТ без в/в контраста должно быть очень редким исследованием и проводиться только при наличии жестких противопоказаний для введения в/в контраста (например, аллергическая реакция на йод или тяжелая почечная недостаточность). Не должно быть так, что ПЭТ-КТ исследование делают без в/в контраста из-за того, что тариф ОМС при добавлении стоимости контрастного вещества делает исследование менее прибыльным (к сожалению, сегодня это распространенная практика). Как результат – скупой платит дважды: пациенту приходится делать еще одно исследование – КТ с в/в контрастом.
2. Собственно ПЭТ-КТ и рак молочной железы
Для чего нужно делать более углубленные методы исследований при онкологических заболеваниях, такие как КТ, МРТ, ПЭТ-КТ? Углубленное исследование практически может привести к повышению стадии заболевания или, крайне маловероятно, к снижению стадии. Всегда ли это необходимо? Это необходимо делать в том случае, если дополнительные знания о наличии метастатических очагов (регионарных или метастатических), которые не были видны при рутинном обследовании, приведут к изменению тактики лечения. Данное изменение тактики лечения должно быть более благоприятно для лечения пациента, как с точки зрения прогноза и выбора метода, так и последовательности лечения. Если углубленное исследование не приводит к изменению тактики лечения или может создать дополнительные сложности в принятии решения, за которыми не стоит реальное излечение или увеличение продолжительности жизни пациента, то проведение подобного исследования может носить негативный характер.
Локальный рак молочной железы (операбельный). Независимо от биологического подтипа опухоли не требуется проведение ПЭТ-КТ исследования, так как шансы, что будут найдены клинически значимые отдаленные метастазы, очень невелики. Случайно выявленные бессимптомные находки могут затянуть начало лечения, и у некоторых пациенток опухоль может стать местнораспространенной (особенно при агрессивных подтипах, таких как Her2 позитивный, базальный, трижды негативный, или люминальный В с высоким уровнем пролиферативной активности). Ранние локальные стадии рака молочной железы нуждаются в эффективном и безопасном локальном лечении без проведения КТ, ПЭТ-КТ и т.д. и затем в эффективной адъювантной терапии, в зависимости от подтипа опухоли. Например, у больной локальный рак молочной железы, мы делаем ПЭТ-КТ исследование и видим несколько очагов в легочной ткани малых размеров, которые глубоко расположены от плевры и немного накапливают радиофармпрепарат. Данные очаги могут быть как неспецифическими (воспалительными), так и метастатическими. Начинается «пляска» вокруг этих очагов: метастазы, значит IV стадия? значит паллиативное лечение? взять биопсию? торакоскопически? открыто? один очаг возьмем – окажется не метастаз, значит остальные очаги не метастазы? и т.д. Бесконечное количество вопросов…. Действие клинициста или консилиума: берем на себя ответственность, волевое решение – не метастазы. Лечим как раннюю стадию. Но в голове у всех червь сомнений, а вдруг ошибка. Пациентка жить спокойно не может. Врач ёрзает, потому что нет истины в последней инстанции. Начинаем каждые 3-6 месяцев проверять. Увеличивает ли данная информация шансы пациентки на излечение или продолжительность жизни? Обследование затягивается, лечение затягивается, сомнения в правильности, отслеживания и т.д., а всего лишь хотели углубленно посмотреть и обрадоваться, что все прекрасно.
Местнораспространенный рак молочной железы: IIB-III стадии. Более сложная проблема. Здесь очень много факторов влияют на выбор тактики лечения. Основные: биологический тип опухоли, возраст и сопутствующая патология.
Если у больной Her2 позитивный вариант рака молочной железы, то предоперационная химиотаргетная терапия с очень высокой вероятностью перекрывает отсутствие информации о возможных клинически незначимых метастазах, пропущенных при рутинном обследовании. На мой взгляд, лучше лечить пациентку как с III стадией, проводить интенсивное лечение, т.к. это подразумевает куративный (а не паллиативный) подход. Получается, что у ПЭТ-КТ задача: перевести пациентку с III стадией в IV стадию, т.к. будут визуализированы субклинические очаги! А надо ли это? При использовании химиотерапии, с двойной таргетной блокадой, у больной имеются высокие шансы (50-75%) достичь полного лечебного патоморфоза первичной опухоли и л/у (pCR), как суррогат элиминации микрометастазов. При этом понятно, что дистанция между микрометастазами, которые мы еще не видим, и мелкими видимыми метастазами, которые начинаем видеть, очень эфемерная. Соответственно, маленькие, подозрительные или слегка видимые метастазы будут также уничтожены эффективным системным лечением. Лучше для больной и для врачей не знать об их наличии и не сомневаться в необходимости использования эффективной программы для IIB-III стадии. Если мы по какой-то причине решим, что выявленные изменения по КТ или ПЭТ-КТ являются отдаленными метастазами (неважно, так это на самом деле или нет), то терапия будет деэскалирована, хирургический компонент может быть отменен, лучевая терапия отменена, таргетная терапия будет проводиться до прогрессирования или токсичности (а она практически нетоксична) и лечение с паллиативным настроем будет проводиться бесконечно (или очень долго). Причем никто не знает, как долго ее проводить!
Но у больных преклонного возраста с выраженной сопутствующей патологией имеет смысл уточнить стадию процесса, так как данная категория больных с трудом может перенести всю программу радикального лечения, и риск осложнений может превышать потенциальную пользу. В этом случае ПЭТ-КТ может помочь избежать ненужной агрессии, если мы сразу поймем, что имеем дело с IV стадией болезни, и далее безопасно, но при этом достаточно эффективно, длительно лечить пациентку с помощью лекарственной терапии. Но если с помощью ПЭТ-КТ (или КТ) подтвердилась III стадия, то тогда у врачей имеется четкое обоснование для радикального подхода к лечению больной.
Если у пациентки агрессивный вариант трижды-негативного рака. Базальный подтип ~85% от всех трижды-негативных вариантов. Прогноз в данной биологической подгруппе в настоящее время существенно хуже, чем при Her2 позитивном варианте. При локальных, малых опухолях, которые чаще всего являются случайной находкой: хирургия на первом этапе и затем химиотерапия (на мой взгляд, включая карбоплатин) являются основными. Риск выявления отдаленных метастазов незначительный, значит, углубленное обследование не обосновано. Лучше не затягивать начало лечение (чтобы «за время пути собачка не могла подрасти»). При местнораспространенном потенциально операбельном раке IIB-IIIA(B?) лечение должно начаться с неоадъювантной интенсивной химиотерапии, и в данной группе имеются 30-50% шансы на полный патоморфологический ответ, что опять-таки является хорошим предсказательным маркером. В недалеком будущем к неоадъювантной химиотерапии в этой группе будет добавлена иммунотерапия, что еще повысит на 14-15% шансы на pCR и, самое главное, позволит снизить риск раннего прогрессирования (что при трижды-негативном раке бывает очень часто). Отдельная группа трижды-негативного рака – больные с явно неоперабельными IIIB-IIIC стадиями. В этом случае, конечно, очень вероятна конверсия III стадии в IV стадию при проведении ПЭТ-КТ исследования (или просто КТ). И тут стоит задуматься индивидуально, стоит ли это делать. Это индивидуальное решение. IV стадия трижды-негативного рака пока не может быть излечена. Надо ли сразу иметь паллиативную направленность лечения? Или попробовать идти по радикальному пути? Тем более что пациентки (первоначально) очень хорошо отвечают на химиотерапию в большинстве случаев, особенно если химиотерапия дозоинтенсивная и с добавлением платины? Нет однозначного ответа на этот вопрос… Или пожилые пациентки с трижды-негативным вариантом (такие тоже встречаются). В этом случае, на мой взгляд, лучше знать истинную стадию и не откладывать информацию о ней в долгий ящик, так как переносимость интенсивной химиотерапии в этой группе неудовлетворительная, и конверсия стадии, если таковая произойдет (благодаря ПЭТ-КТ), послужит обоснованному паллиативному подходу.
Еще одна, самая многочисленная группа – гормонопозитивный, Her2 негативный вариант. Очень гетерогенная группа.
Пациентки с ранними формами, их много, не нуждаются в углубленном дообследовании. Шансы найти отдаленные метастазы и повысить стадию малы. У больных с местнораспространенным раком шансы найти отдаленные метастазы довольно большие – примерно 20-25%. У молодых и/или у пациентов без существенной сопутствующей патологии нет смысла усугублять стадию с помощью ПЭТ-КТ. Это лишает пациенток радикального подхода к лечению. Конечно, у значительной доли больных с течением времени реализуются отдаленные метастазы. Но это может быть через 3-5-10 лет. Зачем об этом знать с самого начала? Это вопрос спорный. С одной стороны, ранняя информация о наличии бессимптомной метастатической болезни не увеличивает продолжительность жизни (сегодня пока так), просто пациентка живет с информацией о неизлечимости болезни и о том, что лечение (гормонотерапия, химиотерапия и т.д.) будут проводиться всю оставшуюся жизнь, а это многие-многие годы. С другой стороны, если у пациентки изначально 4 стадия, то 1 год жизни (неоадъювантная химиотерапия, операция, лучевое лечение) она потратит на агрессивное лечение, которое не приведет к увеличению общей выживаемости, при этом снизит качество жизни (удаление молочной железы, полгода токсичной химиотерапии, лучевое лечение). Не все пациентки этого бы хотели, и эти обсуждения, безусловно, должны приниматься совместно с пациенткой и, в том числе, в зависимости от ее настроя. Надо объяснить, что мы ждем от ПЭТ-КТ и какие изменения тактики могут быть.
Опять стоит задуматься о больных преклонного возраста и/или с сопутствующей патологией. В этом случае конверсия стадии из III в IV позволяет избежать избыточного химиотерапевтического и локального лечения, которое входит в программу лечения местнораспространенных стадий. В этом случае мы основной упор делаем на гормонотерапию +/- ингибиторы CDK 4/6. И лечение может быть очень эффективным. Долгие годы метастатический процесс контролируется с помощью минимально токсичного лечения. В этой группе знание – сила.
При этом стоит также сказать о «пользе» КТ/ПЭТ-КТ в подходе к диагностике местнораспространенных раков молочной железы. Такой метод исследования дает нам более точное представление об N-cтадировании, в частности, о вовлечении над-подключичных лимфатических узлов или парастернальных, и диктует подход к хирургической агрессии, а также лучевой терапии.
Также стоит отметить, что такие спорные обсуждения и индивидуальные решения не могут быть масштабированы или применяться рутинно вне экспертных центров.
Теперь о метастатическом раке молочной железы. Надо ли делать ПЭТ-КТ и отслеживать эффективность по ПЭТ-КТ? Возникает вопрос: а что такого может дополнительно дать ПЭТ-КТ в сравнении с КТ с контрастом? КТ хорош тем (сейчас практически все КТ мультиспиральные), что воспроизводим, не очень дорог, видит очевидную патологию, удобен для динамического контроля, много аппаратов. Может ли информация о каком-либо дополнительным очаге или группе очагов, которые пропущены на КТ трех зон, поменять тактику лечения? Мой ответ – в небольшом проценте случаев может, так как ПЭТ-КТ делается всего тела (а не только 3-х зон). На ПЭТ-КТ видна голова, проксимальная часть рук и ноги: можно увидеть там какие-либо изменения. Например, увидеть подозрительный бессимптомный очаг в головном мозге, врач направит на МРТ, и если окажется метастаз, то будет проведен гамма-нож (например). Но много ли таких случаев в рутинной клинической практике? Мой опыт говорит, что не более 3-5%, это я сужу по своим ощущениям. Статистику не делал. Может быть, раз в месяц или два вижу подобные находки благодаря ПЭТ-КТ, которые меняют мой подход к выбору лечения. Может ли накопление радиофармпрепарата (SUV) диктовать мне необходимость каких-либо действий, если нет явного очага? КТ тем и хорош, что видит явный очаг (плюс ткань), пропускает клинически незначимые малые очаги (которые практически всегда бессимптомные). Врачу-клиницисту не нужна избыточная и бессмысленная информация, это мешает, создает информационный шум, мешает увидеть главное. Те врачи-клиницисты, кто регулярно смотрит КТ и ПЭТ-КТ, все время видят, что нет совершенного метода, который может со 100% вероятностью отличить онкопатологию от воспаления или неспецифики.
Терапия метастатического рака молочной железы требует видения проблемы болезни и пациентки в целом, и очень редко детализации. На продолжительность и качество жизни практически не влияет, на 1-2 мм больше метастаз или меньше, стал ли немного больше SUV или чуть уменьшился. Для оценки эффективности химиотерапии метастатического рака молочной железы отлично подходит КТ с контрастом. ПЭТ-КТ с контрастом может быть на старте (обезопасить себя, что не прозевали метастаз в мозг или диафиз бедренной кости, например), а затем отслеживать динамику стоит на основании КТ трех зон с в/в контрастом. Некоторые формы метастатического рака молочной железы, например, дольковый рак, вообще плохо видны на ПЭТ-КТ с точки зрения SUV. На фоне гормонотерапии изменения в костных метастазах происходят небыстро, и может быть симптом вспышки (как при сканировании костей), когда на фоне эффективной гормонотерапии сначала SUV может вырасти. При этом структура метастазов начинает меняться в сторону склерозирования, что отражает положительную динамику на фоне лечения (я очень много видел формальных заключений ПЭТ-КТ о прогрессировании на основании роста SUV, тогда как по КТ части исследования и клинически была явная положительная динамика, и вынужден брать на себя ответственность, успокаивать пациентку и продолжать лечение без изменений). Проведение ПЭТ-КТ исследования может быть оправданно, если у больной мы видим олигометастатическую болезнь и задумали какое-то локальное лечение (например, удалить единственный метастаз), тут ПЭТ-КТ очевидный помощник в принятии решения.
В целом, при метастатическом раке молочной железы ПЭТ-КТ практически не имеет преимуществ в сравнении с качественным КТ. Может быть, оправдан на старте терапии. Но не в оценке динамики. Лишь в отдельных случаях, на усмотрение клинициста, ПЭТ-КТ может дать дополнительную ценную информацию.
3. Надо ли делать ПЭТ-КТ при динамическом наблюдении после радикального лечения?
Категорически нет!!! Также как и КТ, МРТ, УЗИ, маркеры, анализы крови и т.д. Раннее выявление бессимптомных метастазов не приводит к увеличению продолжительности жизни. Это не то же самое, что рано выявить первичную опухоль. Это – рано выявить фактически IV и неизлечимую стадию. При отсутствии симптоматики не нужно искать метастазы – это несет вред в большинстве случаев. Иногда, правда, можно случайно выявить другую опухоль ранней стадии (например, рак толстой кишки) и тогда вовремя прооперируют, но это все как случайный выстрел, который попал в десятку (в жизни все бывает). Не стоит заниматься скринингом с помощью ПЭТ-КТ. А что делать? Только маммографию неудаленной железы или обеих, если была органосохранная операция. Почему? Потому что у больных, перенесших рак молочной железы, повышается риск повторного первичного рака молочной железы. И лучше его выявить раньше. Повторная радикальная терапия локальной стадии имеет практически такой же шанс на успех, как и предыдущая.
Заключение
У ПЭТ-КТ есть ограниченная роль в лечении рака молочной железы. Назначение ПЭТ-КТ должно быть инициировано врачом-клиницистом, который реально разбирается во всех тонкостях болезни и понимает, для чего ему будет нужна потенциально новая информация. Ни в коем случае нельзя делать ПЭТ-КТ по требованию пациентки или ее родственников (сегодня медицина зачастую работает по принципу: чего изволите-с). ПЭТ-КТ не должно быть заменой КТ только потому, что проще направить и быстрее сделают, так как на КТ очередь, а ПЭТ-КТ оплачивает ОМС.
Вместе с тем, я благодарен системе, что ПЭТ-КТ была включена в ОМС почти 5 лет назад и так распространилась. Это значительно добавило мне знаний и понимания биологии разных болезней, в том числе рака молочной железы. Без этого я не смог бы сегодня поделиться своими мыслями (их бы просто не было). И еще (для врачей клиницистов, которые решают, как лечить): чтобы легко просматривать диски (КТ, МРТ, ПЭТ-КТ) скачайте из инета RADIANT для Windows. Это бесплатная программа. «Жует» практически все диски и виды DICOM программ. Последняя версия позволяет создать собственный архив, что очень важно при повторном визите пациента. Относительно быстро грузит (зависит от диска). Позволяет выводить фронтальную и сагитальную проекции, если сделаны тонкие срезы. Кнопочка F (фьюжен) позволяет сделать отличную картину ПЭТ-КТ со свечением. Нажатием на колесико мыши можно регулировать яркость ПЭТ изображения (спасибо Максиму Смолярчуку). Рекомендую, всегда смотреть imaging своих пациентов и не принимать решения на основании формальных заключений.
ПЭТ-КТ – методика диагностики онкологических заболеваний и редких воспалительных процессов.
Подробнее про само исследование.
Позволяет выявить доброкачественную или злокачественную опухоль. Однако чаще всего назначается для уточнения ее размеров, определения области разрастания и реакции на лечение.
Процедура сочетает в себе принципы позитронно-эмиссионной и компьютерной томографии.
Но что делать после прохождения ПЭТ-КТ? Как узнать максимально подробную информацию по итогам диагностики?
Возможно получить не только заключение специалиста, назначившего исследование. Очень часто важно получить второе, независимое мнение эксперта в ПЭТ диагностике.
Второе мнение
Мы предлагаем возможность получить мнение врача высокой квалификации, специализирующегося именно по Вашей проблеме.
Почему важно второе мнение ПЭТ-КТ?
Исключить сомнения в результатах.
Не каждый врач-онколог может подробно прочитать расшифровку ПЭТ-КТ исследования. Получить подробную расшифровку и для Вас, и для врача поможет заключение врача-эксперта. Это поможет и детальнее изучить снимки, и минимизировать риск ошибок.
Узнать мнение врача-эксперта по конкретно Вашему вопросу.
Мы привлекаем экспертов не просто специалистов в ПЭТ-КТ, а специалистов именно по патологии иили в области исследования.
Точнее определиться с диагнозом и лечением.
Иногда вариантов лечения бывает несколько. И когда необходимо выбрать самый эффективный, вам на помощь может прийти второе мнение специалиста. Благодаря этому можно совместно с врачом с точностью определить лучший путь выздоровления.
Как получить второе мнение по ПЭТ-КТ?
Главное в проведении «второго мнения» – высокая компетентность специалистов. В федеральной сети «ПЭТ-Технолоджи» помощь оказывается опытными специалистами, которые проводят диагностику и лечение пациентов с онкологическими заболеваниями, в том числе в рамках ОМС. Сеть принимает более 120 000 пациентов в год по всей России.
Сотрудники «ПЭТ-Технолоджи» постоянно повышают уровень квалификации, посещая семинары и форумы, а протоколы обследования соответствуют международным стандартам.
Диагностические центры «ПЭТ-Технолоджи» оснащены новейшим оборудованием, которое позволяет проводить исследования на высочайшем уровне. А протоколы «второго мнения» содержат не только подробное описание, но и иллюстрации основных зон обследования.
Второе мнение
Перейдите по ссылке, определите специалиста, который будет проводить оценку снимков и следуйте инструкции.
Для корректной оценки потребуется файл в виде ссылки на облачное хранилище.
Получить второе мнение онкологического консилиума или врача-онколога в К+31.
Кто может быть привлечен для получения второго мнения?
Соломяный Виктор Вячеславович
Врач-радиолог, рентгенолог. Главный врач ПЭТ-Технолоджи. Опыт работы с 2009 г.
Основная специализация: онкология, радионуклидная терапия (тераностика), кардиорадиология.
Иванников Виталий Валерьевич
Главный радиолог центров ядерной медицины «ПЭТ-Технолоджи». Опыт работы с 2007 г.
Николаев Александр Евгеньевич
Ведущий специалист, врач-рентгенолог, радиолог. Заведующий центром дистанционных описаний.
Основная специализация: визуализация в онкологии, торакальная радиология, костно-мышечная система, нейровизуализация, кардиовизуализация.
Хасанова Ксения Андреевна
Врач-рентгенолог, радиолог, кандидат медицинских наук.
Основная специализация: онковизуализация у взрослых и в педиатрии.
Королев Денис Григорьевич
Врач-рентгенолог, онколог, заведующий отделением лучевой диагностики.
Основная специализация: торакальная и абдоминальная онкология.
Решетник Павел Викторович
Врач-рентгенолог, радиолог.
Большой опыт работы в экстренной радиологии, педиатрии, онкологии, фтизиатрии. Специалист по радионуклидной диагностике.
Используя сайт, Вы даете согласие на использование файлов cookie, а также согласие на обработку персональных данных.
Используем cookie , работаем с данными.
Принимаю
ПЭТ-КТ — это комплексное исследование тканей организма в рамках онкологического поиска. Методика основана на применении двух отдельных составляющих:
- ПЭТ или позитронно-эмиссионной томографии. Представляет собой способ визуализации измененных, чаще всего раковых тканей, основываясь на контрастировании наиболее «прожорливых» клеток препаратами на основе глюкозы и специального радиоактивного компонента.
- КТ — классическая компьютерная томография, которая позволяет визуализировать здоровые ткани.
Более чем в 90% случаев ПЭТ-КТ проводится для диагностики рака, уточнения характера и особенностей патологического процесса.
- В каких случаях назначают ПЭТ-КТ
- Противопоказания к исследованию
- Суть диагностики методом ПЭТ-КТ
- Всегда ли этот метод на сто процентов информативен
- Нужна ли специальная подготовка
- Преимущества методики
- Недостатки методики
- Как часто следует проводить исследование
В каких случаях назначают ПЭТ-КТ
ПЭТ-КТ — методика визуализации преимущественно раковых опухолей. Поскольку они отличаются повышенной потребностью в питании. Если говорить о показаниях более подробно, методика требуется в рамках:
- Дифференциальной диагностики злокачественных и доброкачественных опухолей. Первые копят специальный контрастирующий препарат. Вторые — нет или в минимальной, ничтожной степени.
- Оценка стадии злокачественного процесса. Определение фазы онкологического заболевания.
- Изучение характера опухоли, степени ее агрессивности по скорости обмена веществ.
- Планирование биопсии. В рамках позитронно-эмиссионной томографии врачи ищут наиболее активную область опухоли, где клетки претерпели наибольшее изменение, и их плотность физически выше.
- Мониторинг состояния после пройденного лечения. ПЭТ-КТ могут проходить раз в год или реже. В зависимости от того, какой был рак, насколько агрессивный, радикальное ли лечение получил пациент. ПЭТ нужен чтобы на ранних стадиях обнаружить рецидив онкологического процесса.
- Планирование хирургического лечение или лучевой терапии. Чтобы определить агрессивность неоплазии и проработать грамотную тактику борьбы с образованием. ПЭТ не помогает понять тип опухоли. Потому помимо требуется еще и гистологическое исследование образца.
- Поиск первичного очага при наличии метастазов.
ПЭТ-КТ универсальная методика диагностики и изучения деталей онкологических процессов. Но при низкой интенсивности обменных процессов в опухоли возможны опасные с точки зрения информативности погрешности и ошибки.
Противопоказания к исследованию
ПЭТ-КТ – исследование безопасное. Но ряд противопоказаний у него все же есть:
- Острые воспалительные процессы асептического характера. То есть не связанные с инфекционными агентами: поражениями грибками, вирусами или бактериями.
- Инфекционно-воспалительные процессы в острой и подострой фазах. Пока не наступило полного выздоровления. До тех пор, пока состояние полностью не нормализуется.
- Беременность, независимо от фазы. Исключая случаи, когда провести диагностику жизненно необходимо и других вариантов не остается.
- Психические расстройства в декомпенсированной фазе. Тяжелые психозы, алкогольный делирий, бредовый состояния. Пока человек не придет в себя.
- Период грудного вскармливания. Если пройти КТ жизненно необходимо, после процедуры мать отказываться от естественного вскармливания и переходит на специальные смеси.
- Общее тяжелое состояние человека.
- Диабет, как 1-го, так и 2-го типа.
- Тяжелые поражения печени или почек. Поскольку препарат будет выводиться непозволительно медленными темпами. Отсюда повышенный риск интоксикации всего организма.
Перед проведением ПЭТ-КТ следует проконсультироваться с врачом. На случай, если имеются противопоказания. Он взвесит все «за» и «против». Решит, стоит ли проводить позитронно-эмиссионную томографию несмотря на формальные основания этого не делать.
Суть диагностики методом ПЭТ-КТ
В основе ПЭТ-КТ лежат две технологии.
Первая, на которой зиждется ПЭТ — это качественная оценка метаболизма тканей. Раковый опухоли отличаются крайней «прожорливостью». Для роста и развития им требуется много веществ. Настолько много, что остальной организм остается в состоянии дефицита. Для определения таких ненасытных тканей используется вещество, которое универсально и нужно всем клеткам – глюкоза.
Чтобы зафиксировать интенсивность и степень накопления глюкозы в измененных клетках, ее маркируют специальным радиоактивным веществом. В значительной части случаев используются препараты радиоактивного фтора. Они отличаются большим периодом полураспада, без проблем транспортируются и хранятся. А с другой стороны, не вызывают токсического и радиоактивного поражения организма пациентов.
Препарат с такой маркировкой накапливается в измененных тканях, окрашивая наиболее агрессивные области. Врачи получают визуальное подтверждение, картинку. Результаты исследования дают возможность сделать выводы, какая опухоль имеет место.
Минус технологии — ПЭТ показывает только измененные ткани. Чтобы посмотреть, как опухоль соотносится с тканями здоровыми, применяют КТ. Картину компьютерной томографии накладывают на картину ПЭТ, получая единый снимок высокого качества.
Всегда ли этот метод на сто процентов информативен
К несчастью, даже такой высокочувствительный способ диагностики как ПЭТ-КТ не может быть на все сто информативным. Некоторые неоплазии обладают малой скоростью метаболизма:
- Раковые неоплазии щитовидки.
- Опухоли печени.
- Неоплазии почек.
- Раковые образования предстательной железы.
- Раковые опухоли костной ткани.
- Некоторые саркомы и лимфомы.
Недостаточная визуализация не означает, что проблемы нет. Требуются другие методы диагностики.
Ровно так же и окрашивание тканей не говорит о наличии рака. Старые поколения препаратов для контрастирования могут копиться и в здоровых тканях. Поэтому при расшифровке специалисты ориентируются на комплексную картину.
Нужна ли специальная подготовка
Подготовка простая:
- За сутки до исследования нужно снизить углеводную нагрузку. Углеводы исключают из рациона. Жевательная резинка также запрещена. В том числе с сахарозаменителем.
- За 8-10 часов нужно отказаться от пищи. Исследования проходят натощак. Воду пить разрешается.
- За сутки до процедуры стоит избегать интенсивной физической нагрузки.
Важно взять с собой заключения врачей и результаты иных диагностических мероприятий.
Преимущества методики
ПЭТ-КТ обладает несколькими весомыми плюсами:
- Комплексный характер, универсальность. Позитронно-эмиссионная и компьютерная томография позволяют исследовать любые органы.
- Высокая точность и информативность исследования.
- Возможность диагностики рака на ранних стадиях.
- Отсутствие боли и дискомфорта.
- Отсутствие необходимости госпитализации. Все проходит амбулаторно.
Есть и минусы.
Недостатки методики
Самый главный недостаток – это необходимость применения радиоактивных препаратов. Но при должном подходе есть возможность снизить лучевую нагрузку на организм.
Как часто следует проводить исследование
Частоту проведения исследования определяет врач, отталкиваясь от клинического случая. ПЭТ-КТ может проводиться как методика первичной диагностики, а также в рамках мониторинга патологического, онкологического процесса.
- Review
- Open Access
- Published: 04 January 2022
- Amir Iravani2,
- Kevin Prigent1,
- Diane Kottler3,
- Ramin Alipour4 &
- …
- Rodney J. Hicks4,5
Cancer Imaging
volume 22, Article number: 3 (2022)
Cite this article
-
8623 Accesses
-
4 Citations
-
1 Altmetric
-
Metrics details
Abstract
18F-FDG PET/CT plays an increasingly pivotal role in the staging and post-treatment monitoring of high-risk melanoma patients, augmented by the introduction of therapies, including tyrosine kinase inhibitors (TKI) and immune checkpoint inhibitors (ICIs), that have novel modes of action that challenge conventional response assessment. Simultaneously, technological advances have been regularly released, including advanced reconstruction algorithms, digital PET and motion correction, which have allowed the PET community to detect ever-smaller cancer lesions, improving diagnostic performance in the context of indications previously viewed as limitations, such as detection of in-transit disease and confirmation of the nature of small pulmonary metastases apparent on CT.
This review will provide advice regarding melanoma-related PET protocols and will focus on variants encountered during the imaging of melanoma patients. Emphasis will be made on pitfalls related to non-malignant diseases and treatment-related findings that may confound accurate interpretation unless recognized. The latter include signs of immune activation and immune-related adverse events (irAEs). Technology-related pitfalls are also discussed, since while new PET technologies improve detection of small lesions, these may also induce false-positive cases and require a learning curve to be observed. In these times of the COVID 19 pandemic, cases illustrating lessons learned from COVID 19 or vaccination-related pitfalls will also be described.
Background
Epidemiological studies report a rapid increase in the incidence of melanoma over the past 50 years or so, primarily in Caucasians, despite some slowing of the rate of increase around 1990–2000, probably reflecting increased awareness of the risk of excessive sun exposure and consequent UV damage to DNA. Unlike other solid tumors, melanoma mostly affects young and middle-aged people. The median age at the time of diagnosis of melanoma is 57 years [1]. However, in Australia, which has one of the highest incidences of melanoma in the world, the rate of new diagnoses increases with age, particularly in males. Close to 80% of cases present with early-stage disease (https://ncci.canceraustralia.gov.au/diagnosis/distribution-cancer-stage/distribution-cancer-stage) and have high survival rates. High-risk melanoma represents a major burden on society through both direct costs and loss of productivity.
Mucosal/cutaneous vs uveal melanoma
Less than 5% of all primary melanomas arise from sites other than the skin. These include mucosal surfaces, meninges and the choroidal layer of the eye, which have a common ectodermal origin [2]. Mucosal melanomas can arise in the nasopharynx, larynx, tracheobronchial tracts, esophagus, anorectal and genitourinary tracts. Approximately 50% affect the head and neck region with a predominance in the sinuses and nasal cavities [3]. Mucosal melanomas are considered to be more aggressive than their cutaneous counterparts, possibly linked to delayed diagnosis with larger tumor masses, and metastatic extension at diagnosis (30%).
Uveal melanoma is a distinct clinico-pathological entity, differing in many aspects from cutaneous melanoma, including a distinct set of associated mutations [4, 5]. Its clinical course is unpredictable and metastatic disease can develop after a long disease-free interval.
Approximately 3% of metastatic melanomas are of unknown primary [6]. This potentially reflects spontaneous regression of the primary as a result of innate immune responses.
Pattern of spread of melanoma
The main cause of death in melanoma patients is widespread metastasis. Metastases develop in regional lymph nodes, as satellite or in-transit lesions, or in distant organs. In-transit metastases occur in 5 to 8% of patients with high-risk melanoma of the limb and can present as single or multiple (sub) cutaneous nodules close to the primary tumour (satellitosis if < 3 cm from the primary tumour) or scattered over the whole extremity [7]. They can appear synchronously together with the primary tumour or as a regional relapse, and frequently precede the appearance of systemic metastases [8]. Prolonged survival can occur following locoregional therapies [9].
When it comes to distant metastases, autopsy cases have shown that multiple organ metastases were present in 95% of the patients, the most common organs involved being lymph nodes (73.6%), lungs (71.3%), liver (58.3%), brain (49.1%), bone (48.6%), heart (47.2%), adrenal glands (46.8%), and gastrointestinal tract (43.5%) [10]. A varying percentage (14% [11] to 67% [12]) of patients presenting with single organ metastasis at the time of tumor relapse has been reported in large series of patients referred to surgery, though these figures were reported at a time when modern PET sytems were not routinely used for staging and restaging of melanoma patients.
Rather than spreading to regional nodes, uveal melanoma metastasizes haematogenously, predominantly to the liver [13, 14]. Metastases to the liver develop within 15 years after the initial diagnosis and treatment in approximately 50% of patients with posterior uveal melanoma [4, 5].
PET/CT protocol
18F-FDG PET/CT has been proven to have high diagnostic performance for the detection of soft-tissue, nodal and visceral metastases at initial staging or during follow-up [15] and is able to identify tumor response early in the course of TKI treatment [16]. In the framework of immunotherapy, 18F-FDG PET/CT has the unparalleled capability of assessing tumor response on a whole-body basis and detecting signs of immune activation as well as immune-related adverse effects (irAEs) [17,18,19,20,21,22].
In addition to the usual compliance with PET tumour imaging guidelines and harmonizing standards [23], several points regarding the PET acquisition protocol need to be raised. First, while including the brain in the field of view is not routine at many PET centres, the skull base should be included, at least for therapy assessment examinations, so that immune-related hypophysitis can be detected. While MRI is the preferred method for assessing brain and leptomeningeal metastases from melanoma, the high metabolic activity of melanoma, particularly when accompanied by surrounding vasogenic oedema can make intracranial involvement readily apparent on PET and given the small incremental imaging time to acquire from the vertex of the skull, this is recommended by the authors. When the arms are elevated to improve imaging of the thorax and axillae, more of the upper limbs are also included when whole-brain imaging is acquired.
Second, accurate staging or restaging of patients with melanoma of the extremities requires a whole-body acquisition in the case of primary tumour located on the lower limbs and the arms along the body for primary tumours located on the upper limbs. Indeed, digital PET using small-voxel reconstructions [24] or modern reconstruction algorithms [25] brings an additional value for the detection of in-transit metastases in melanoma patients, by reducing the number of indeterminate findings and minimizing falsely negative scans compared to earlier PET systems. It is noteworthy that for overweight patients, hands should be positioned on the pelvis to avoid any truncation artefact of the arms at the edges of the field of view [26].
If myocardial metastases are suspected, a special diet, long fasting period and heparin can be used to suppress physiological myocardial 18F-FDG uptake [27].
PET reports for therapy monitoring of patients receiving immune checkpoint inhibitors (ICIs) should include therapy response according to validated criteria, presence of signs of immune activation and signs of toxicity, especially immune-related adverse events (irAEs) requiring withdrawal of ICIs and/or corticosteroids, e.g., colitis and pneumonitis. Proposals for structured PET report can be found elsewhere [17, 28, 29].
Pitfalls related to non-malignant diseases
Acne and furunculosis
Benign uptake related to acne and cutaneous infectious processes should not be mistaken for subcutaneous or in-transit metastases. While acne lesions tend to occur on the trunk and face, as shown in Fig. 1. Quick clinical examination before discharging the patient from the PET unit will avoid false-positive reports in the case of evident infectious skin disorders, while more complex situations may require skin examination by a dermatologist.
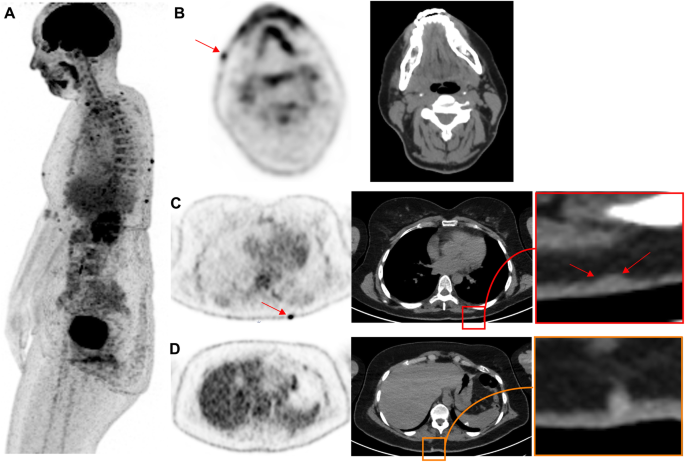
44-year-old woman, referred for initial staging for prior melanoma on the left cheek. Panel A displays lateral MIP view. Multiple subcutaneous 18F-FDG foci can be seen on the face (B) and the trunk (C), all located close to the midline related to dermoepidermitis. These could be confused with subcutaneous metastases without clinical correlation. It is noteworthy that some non 18F-FDG avid cystic lesions are also seen (D). Sebaceous cysts and other benign lesions apparent on correlative CT are usually readily diagnosed by clinical examination
Full size image
Venous varicosities
The PET reader should be aware of potential technology-related pitfalls, as new PET technologies, such as advanced reconstruction algorithms and digital PET using small-voxel reconstruction, have improved detection of small lesions [24], but may also induce false-positive cases by significantly increasing apparent uptake in benign lesions (Figs. 2 and 3).
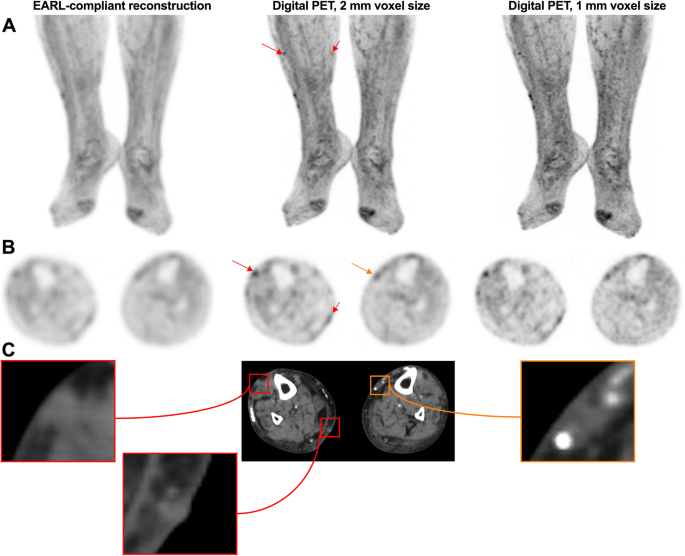
89-year-old woman with previous localization of melanoma on the right lower limb, who was on active surveillance. A: zoomed MIP images; B: transverse PET slices and C corresponding CT slices. Subcutaneous 18F-FDG foci related to in-transit metastases can be seen on the right leg (red arrows). Also visible are foci related to venous varicosity, not to be mistaken for subcutaneous metastases (orange arrow). It is noteworthy that in-transit metastases are only clearly visible on digital images reconstructed with small-voxels. EARL-compliant images, which mimic former generation PET systems by applying a post-reconstruction filtering step [23], are equivocal. EARL: European Association of Nuclear Medicine Research limited
Full size image
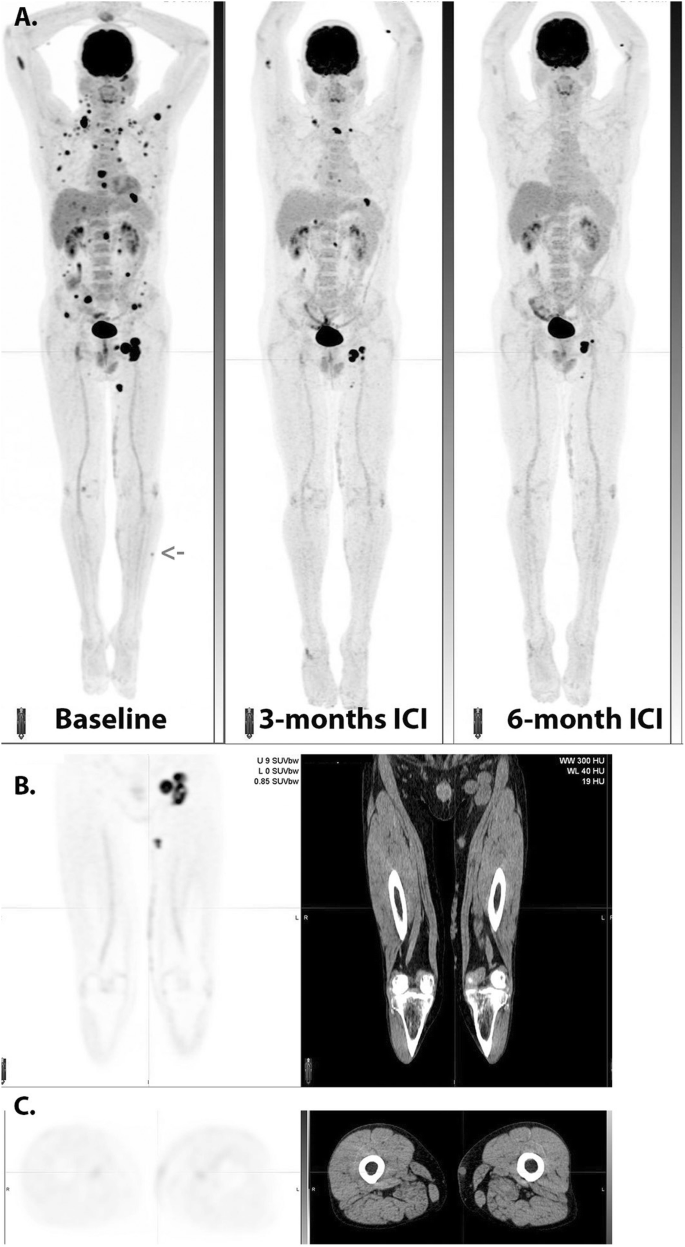
Serial MIP images (A) in a patient with widespread metastatic melanoma demonstrate resolution of an in-transit deposit on the lateral aspect of the left leg (arrow on baseline scan) and gradual regression of metastatic disease over time despite residual left inguinal nodal abnormality after 6 months of immune checkpoint therapy. On coronal PET and CT images (B), nodular but contiguous linear uptake in the subcutaneous fat along the medial left thigh demonstrates no change over time on the MIP images above and clinically correlated with a varicose vein. Transaxial images (C) are more difficult to interpret than the coronal images in demonstrating mildly 18F-FDG -avid nodularity and a rounded shape on correlative CT, emphasizing the importance of review of images in orthogonal planes
Full size image
Post vaccine nodal uptake
PET centers scanning cancer patients after the introduction of the COVID 19 vaccination program have witnessed moderate to intense local or systemic inflammatory responses in some patients [30]. It is noteworthy that such local nodal inflammatory responses have already been observed in patients having received Influenza vaccines [31], but the frequency of these observations with COVID19 vaccine and the presence of multiple nodal uptake at higher echelon nodal stations is unprecedented.
While some of them may be pretty obvious, appearing as subcutaneous and/or muscular uptake at the site of injection and contiguous nodal uptake, some other situations may be misleading for tumour uptake, especially in patients staged or followed-up for melanoma of the upper limbs. Concerning nodal uptake, it is noteworthy that foci may vary in intensity and can co-exist with both benign CT patterns (oblong shape, fatty hilum) and suspicious round shape may occur, as shown in Fig. 4. Also misleading can be the presence of benign nodal uptake in secondary echelon nodes. These lymph nodes may remain 18F-FDG -avid up to 10 weeks or later after vaccination [32]. For these reasons, it is prudent to adapt PET scheduling not only within treatment constraints but also accommodate the vaccination scheme of melanoma patients, as suggested recently in the largest series of vaccination-related inflammatory changes reported in the Israeli population [33].
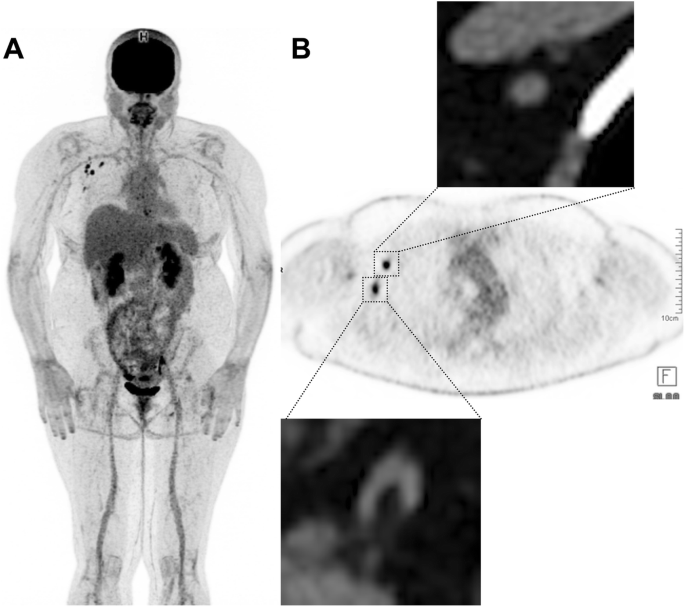
48-year-old woman with previous localization of melanoma on the left knee, who had been treated by TKI for 6 months. This patient received her first dose of COVID 19 vaccine in the right deltoid muscle (Pfizer-BioNtec Cominarty) 21 days prior to the PET examination. Multiple reactive nodes can be seen on the right axillae. Note that some of these nodes have benign CT patterns (bottom right panel: fatty hilum) while others may be considered suspicious based on CT appearance (top right panel: round shape, loss of the fatty hilum pattern). In this case, spread to the contralateral axilla from a leg primary without regional nodal or distant metastatic involvement should alert the reader to a low likelihood of malignancy
Full size image
Sarcoid-like granuloma, especially mediastinal but sometimes systemic sarcoid
Both at diagnosis and during therapy of melanoma, granulomatous disease involving nodes and other organs may cause diagnostic difficulties. Although the typical distribution of sarcoid-like lymphadenopathy includes symmetrical, generally non-enlarged hilar and mediastinal nodes with increased uptake, atypical patterns can occur. Peri-portal nodes and focal splenic lesions are not uncommon. The evolution of the sarcoid-like granulomatous disease in response to immune checkpoint therapy is highly variable and can persist beyond the withdrawal of ICIs and fluctuate in activity over time (Fig. 5).
Serial MIP images. In this patient with a gastric primary and liver metastasis at baseline evaluation, the development of immune-related hepatitis led to the withdrawal of ICI treatment. Nevertheless, the patient developed pulmonary infiltrates and cutaneous lesions, particularly over the right elbow (arrow). These were confirmed on biopsy to be sarcoidosis and continued to wax and wane in response to treatment with steroids despite lack of continuing ICI treatment and ongoing complete metabolic response at prior sites of disease
Full size image
Technology-related pitfalls: characterization of pulmonary nodules
Due to respiratory movement, the 18F-FDG uptake and CT characteristics of the pulmonary nodules in the base of lungs may be subject to partial volume effect (Fig. 6). In these cases, a dedicated fine slice CT of the chest in full inspiration may further characterize the suspected findings. Upon detection of pulmonary nodules, other differential diagnosis needs to be considered including benign and neoplastic process and ultimately a histopathologic confirmation may be needed.
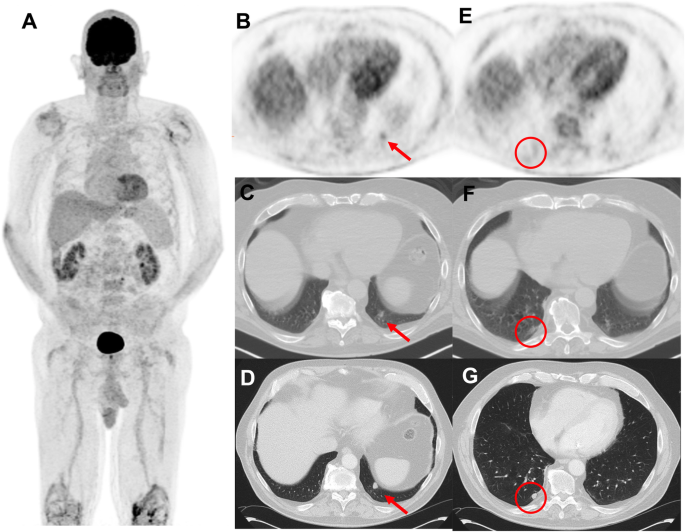
69-year-old man with prior melanoma of the right forearm, 2.1 mm Breslow-depth without ulceration and 1/mm2 mitoses and positive axillary sentinel lymph node (0.2 mm focus with no extracapsular extension) with no adjuvant therapy on observation. Panel A displays surveillance 18F-FDG PET MIP 5 months post-resection of the primary lesion. A new FDG-avid nodule was noted in the left lower lobe (panel B and C) which due to respiratory movement appeared ill-defined. A dedicated CT of the chest 7 days later confirmed the nodule in the left lower lobe (panel D) and also showed an additional nodule in the right lower lobe (panel G) which went undetected on the PET/CT (panel E and F) and were suspicious for metastatic melanoma. Wedge resection of the left lower lobe revealed caseation granuloma and the patient continued on surveillance
Full size image
It is expected in the near future that advancements in PET motion correction will allow to better characterize small nodules located in the base of the lungs. Specifically, data-driven motion correction and the emergence of artificial intelligence tools are opening new opportunities for motion handling in clinical PET [34].
Variants: false-negative or very low uptake in liver metastases from choroidal melanoma
Uveal melanoma metastasizes haematogenously, predominantly to the liver and metastases may be of small volume. Attention should be paid to doubtful 18F-FDG foci, as small volume liver metastases may occur, and uptake intensity may be lower than that observed in other histological subtypes of melanoma. This is more problematic in overweight or obese patients in whom statistical considerations lead to greater inhomogeneity of apparent 18F-FDG uptake (as shown in Figs. 7 and 8 below), indeterminate 18F-FDG foci should lead to follow-up PET or additional radiological exploration. It is expected that technological evolutions such as digital PET with small-voxel reconstruction and/or enhancement of images with the convolutional neural network will further improve image quality in the liver and detection of small volume metastatic disease [34]. Because of the para-magnetic properties of melanin, MRI is a relatively sensitive technique for the detection of uveal melanoma metastases to liver and should be recommended in the setting of clinical suspicion or equivocal PET/CT findings.
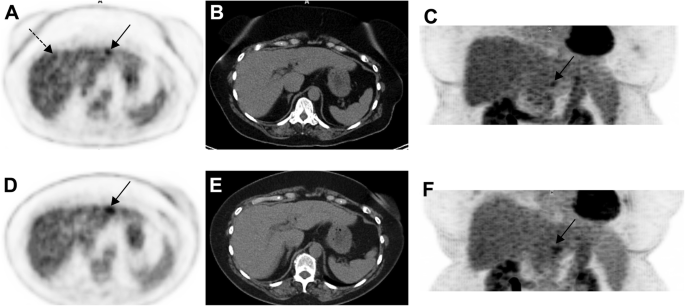
63-year-old woman with choroidal melanoma. The patient’s body mass index was 32.5. 18F-FDG PET images (axial slice A, zoomed MIP view B) show an indeterminate 18F-FDG focus located in the left liver lobe, segment 2 (black arrows) slightly more intense than the surrounding background seen in the right liver lobe (A, dotted black arrow). Given that liver metastasis is the main pattern of spread of uveal melanoma, follow-up was performed at 3 months and confirmed metastatic liver disease (D, E and F, black arrow)
Full size image
71-year-old woman with metastatic uveal melanoma, and previous central liver resection for solitary metastasis. Follow-up 18F-FDG PET images 6 months post-surgery showed at least two foci of low-grade 18F-FDG uptake in the liver, slightly above the physiological background activity (black arrows, image A – zoomed MIP). The lesion in segment 4a just left to the surgical margin (red arrow on image B — axial fused image) was subsequently confirmed to be metastatic melanoma on histology. The lesion in segment 6 (red arrow on image C – axial fused image), which was associated with a subtle area of hypo-attenuation on low dose CT, showed further progression on follow-up CT after 3 months (image not provided)
Full size image
Pitfalls related to treatment
Frequently encountered patterns
Colitis
Colitis may be a life-threatening irAE, requiring withdrawal of ICI and/or treatment with corticosteroids. It is noteworthy that colitis often presents as intense circumferential uptake without wall thickening and/or fat stranding on CT, and should therefore not be confused with benign uptake due to metformin treatment in diabetic patients.
A typical feature of immune-related colitis is prominent of the haustra as well giving rise to an appearance similar to a “string of pearls”. Unlike physiological bowel activity, which is often segmental, the entire colon is generally involved by autoimmune colitis. It should be noted that immune-related adverse events can occur simultaneously or be temporally unrelated (Fig. 9).
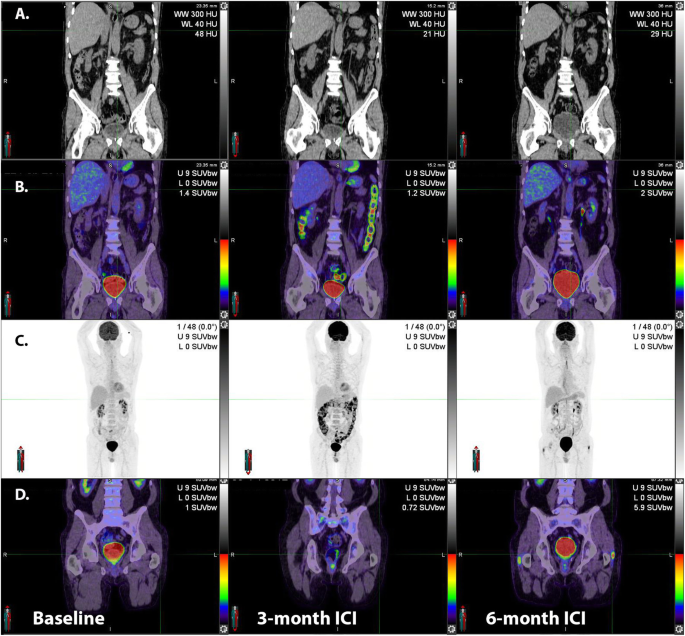
Following the introduction of adjuvant immunotherapy for resected stage IIIC disease, despite normal CT appearances (A, middle panel), fused 18F-FDG PET/CT (B, middle panel) and MIP (C, middle panel) images revealed intense uptake throughout the large bowel with a typical “string of pearls” distribution. The patient was asymptomatic at the time of the scan but within 24-h had developed severe diarrhea consistent with this diagnosis. Despite successful treatment of this complication the patient subsequently developed bilateral trochanteric bursitis as a second potential irAE
Full size image
Diffuse enteritis masking small bowel and serosal metastases
Small bowel is a common site for gastrointestinal metastasis in melanoma, however, the history and clinical findings are nonspecific and may mimic immune-related gastritis and enteritis. The presence of the latter, could potentially mask small bowel metastases on 18F-FDG PET/CT (Fig. 10).
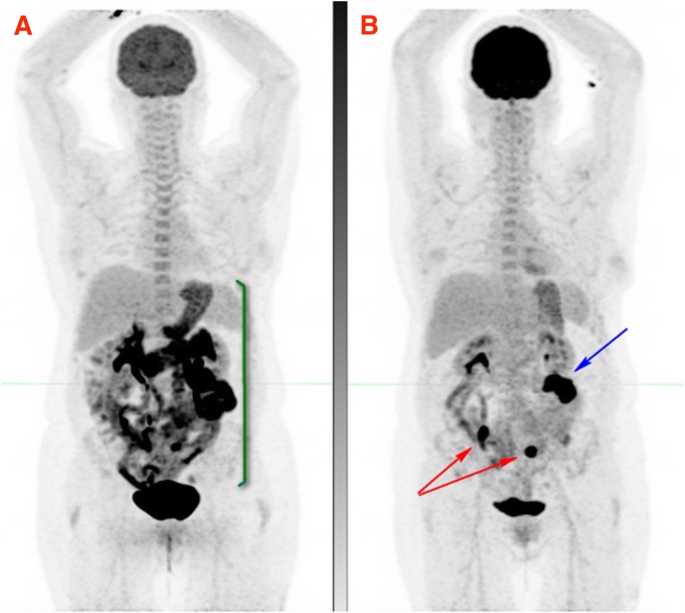
Patient with stage 4 melanoma in CMR on single-agent nivolumab with symptoms of intermittent nausea, vomiting and diarrhoea and clinical diagnosis of immune-related enteritis underwent 18F-FDG PET which showed moderate to intense diffuse uptake in the stomach, duodenum and small bowel in keeping with immune-related gastritis, duodenitis and enteritis (MIP image A). Short interval 18F-FDG PET after successful treatment of irAEs (MIP image B), showed two foci of intense FDG uptake in the small bowel (red arrows) in keeping with metastases and a third focus in the left abdomen near the transverse colon, in keeping with serosal metastasis (blue arrow)
Full size image
Pneumonitis
Along with colitis, pneumonitis (Fig. 11) may be a life-threatening irAE, requiring withdrawal of ICI and/or treatment with corticosteroids.
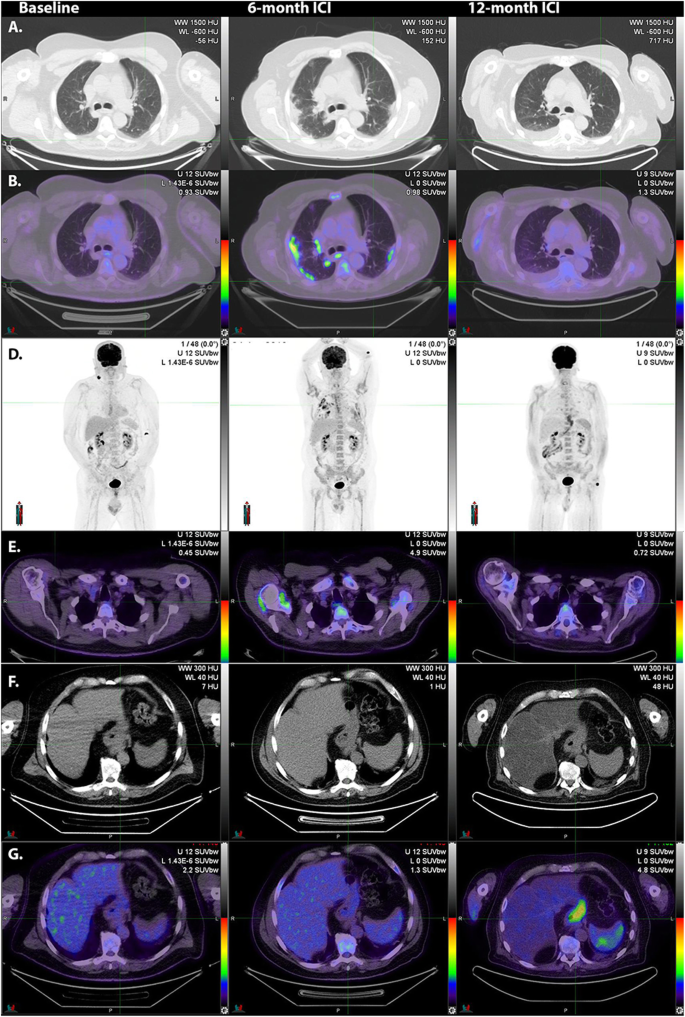
Following resection of nodal metastasis in the right lower cervical region, adjuvant immune checkpoint inhibitor therapy was commenced. At 6-month surveillance 18F-FDG PET/CT, lung infiltrates were apparent on correlative CT (A). These had high 18F-FDG -avidity (B, middle panel). Serial MIP images (C) demonstrate the patchy, bilateral nature of these changes as well as generalized bone marrow activation and increased activity in both shoulders consistent with synovitis as confirmed on transaxial fused 18F-FDG PET/CT images (D, middle panel). With the introduction of corticosteroids, the pneumonitis resolved but a fatty change was noted in the liver (F, right panel) and diffuse oesophagogastric uptake was observed (G, right panel). Gastroscopy confirmed enteritis. Increased spleen to liver ratio on the late scan likely reflects a combination of reduced hepatic activity related to steatosis and splenic activation
Full size image
Although immune-related pneumonitis is the most common cause of patchy increased 18F-FDG uptake in the lung, other pathologies should always be considered. In the COVID-19 era, these include pulmonary manifestations of viral infection [35]. Pulmonary sarcoidosis is also a differential diagnosis but is more often nodular than of a ground-glass or diffuse subpleural distribution. Of course, both conditions may co-exist.
Hepatitis
Autoimmune hepatitis is relatively common as a side effect of ICI therapy but is usually detected on routine biochemistry surveillance. Occasionally it can persist and be apparent on 18F-FDG PET/CT (Fig. 12).
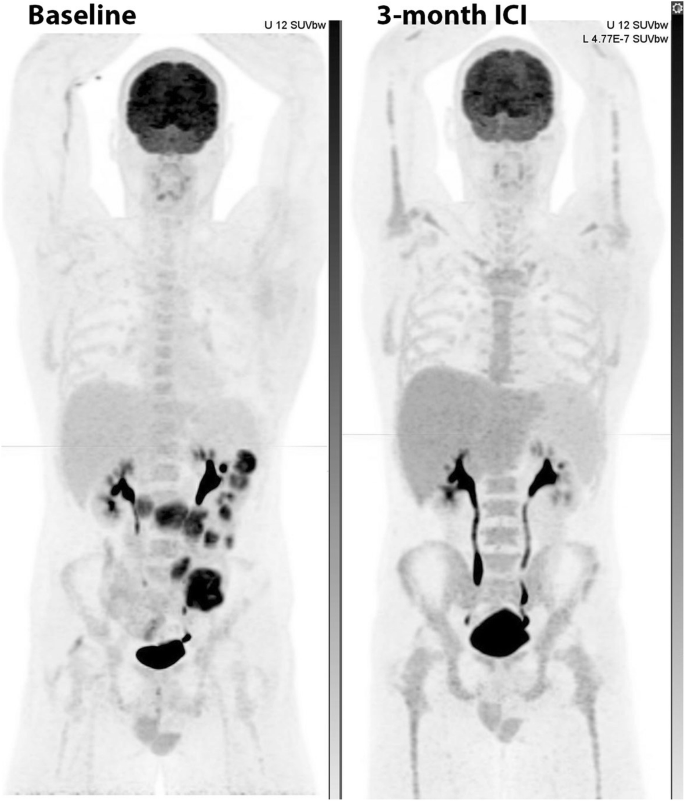
Note the relatively high uptake in the liver relative to the spleen on the post-treatment scan, which was associated with biochemical evidence of hepatitis. Note also that the generalized bone marrow activation with peripheral marrow expansion in the context of a complete metabolic response in prior small bowel metastases was interpreted as being reactive
Full size image
Unusual irAEs during immunotherapy
Pancreatitis mimicking malignancy
Pancreatitis has been reported to occur in 2.7% of patients receiving ICIs, more frequently with anti-CTLA4 (3.08% versus 0.94% for anti PD1) [36]. Also, melanoma patients treated with ICIs have increased incidence of pancreatitis as compared to other solid tumours. Although not misleading when appearing as homogeneous increased 18F-FDG uptake involving the whole gland, pancreatitis can also appear as focal uptake mimicking either primary tumour or metastatic disease (Fig. 13).
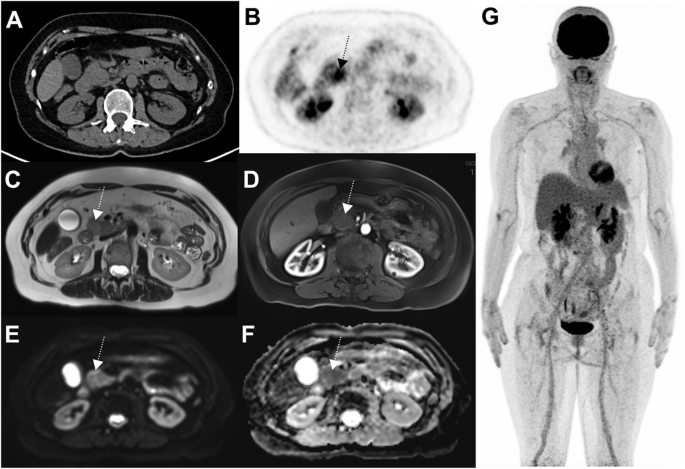
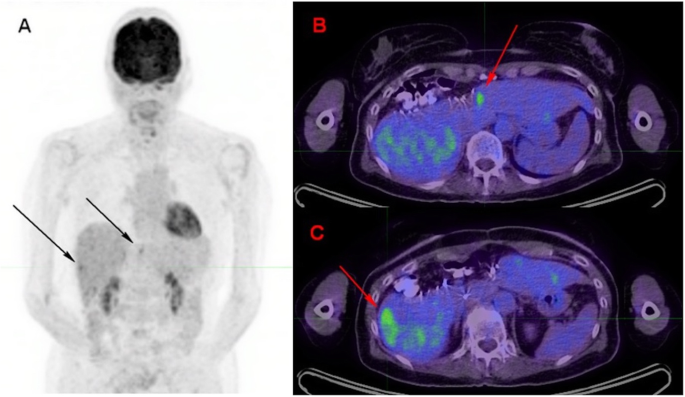
63-year-old woman with prior localization of melanoma on the left thigh, who had been treated by ICIs for 16 months. A nodular 18F-FDG focus can be seen in the pancreatic head (B: axial PET slice) without concordant anomaly at CT (A). Given that this pattern was unusual, MRI was performed a week later and showed patterns consistent with pancreatic adenocarcinoma: ill-defined mass of the pancreatic head on T2 sequence (C), this lesion appearing hypointense on T1 sequence arterial phase after gadolinium injection (D), hyperintense on diffusion sequence and displaying hypercellularity on ADC sequence. Given that PET was otherwise normal, a biopsy was performed and confirmed pancreatitis. Subsequent PET showed spontaneous recovery (data not shown)
Full size image
Peripheral vasculitis (Fig. 14).
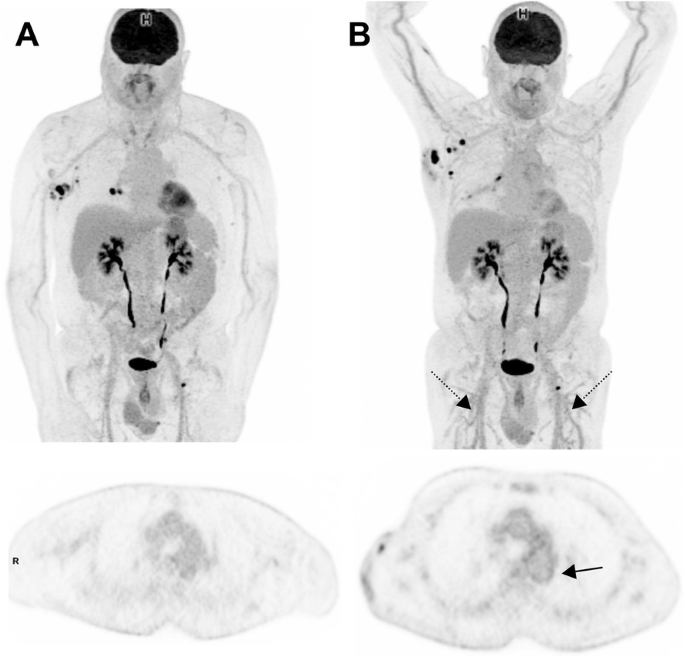
69-year-old man with prior localization of melanoma on the trunk. Baseline images (MIP view and transaxial slice at the level of the descending aorta) are shown at baseline (A) and interim PET (B). Recurrent nodal disease in the right axillae and the right hilum can be seen. Interim PET, performed at the time the patient who had been treated with ICIs for 5 months, shows the appearance of a diffuse vasculitis pattern involving not only the thoracic aorta but also brachial and femoral arteries (including small-caliber arteries, black dotted arrows) but lack of response in axillary nodal disease
Full size image
Fasciitis (Fig. 15).
-
1.
TKI-induced Hemophagocytic lymphohistiocytosis (HLH): Not to be confused with a “banal” inversion of the liver to spleen ratio
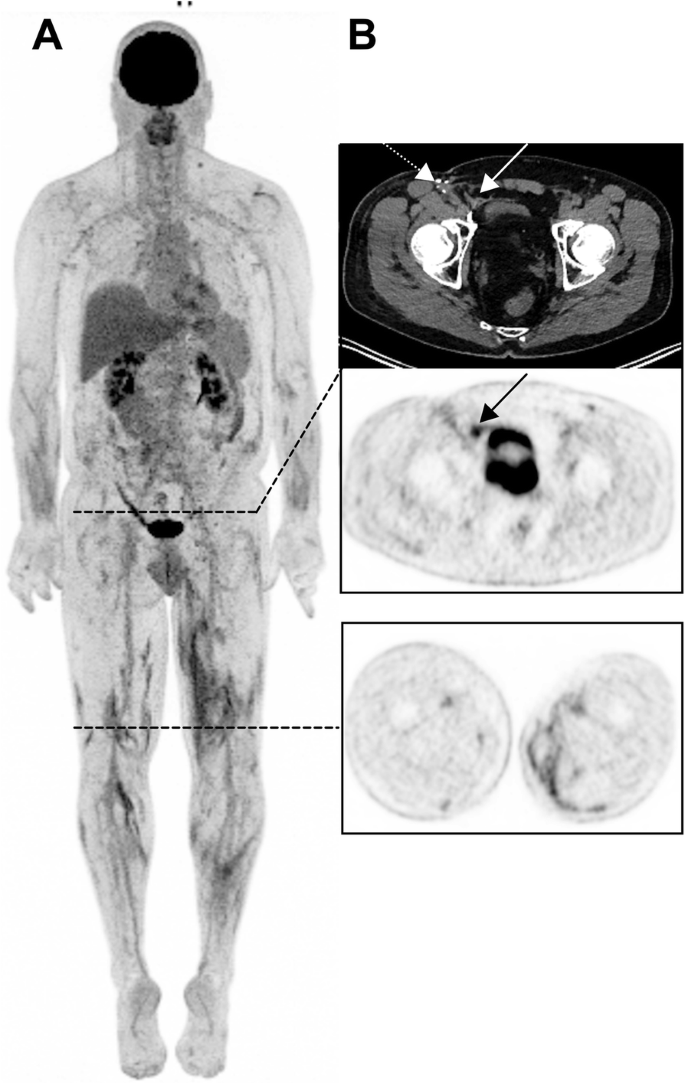
55-year-old man with an unknown primary melanoma who had been treated with ICIs for 35 months (Pembrolizumab). 3D MIP view shows multiple intermuscular foci in the lower limbs (B, lower panel). Also noteworthy is a benign uptake in the right groin (B, black arrow) related to a right inguinal mesh repair (white arrow), not to be confounded with a recurrence in the area of the lymphadenectomy (white dotted arrow)
Full size image
HLH is related to an excessive immune activation leading to high fever, cytopenia, hepatosplenomegaly and multi-organ injury. HLH has been reported to induce an increased splenic uptake on 18F-FDG PET/CT greater than that observed during sepsis [37]. HLH can be observed during treatment with BRAF/MEK inhibitors, as shown in the case below (Fig. 16), and has also been reported in patients receiving ICIs.
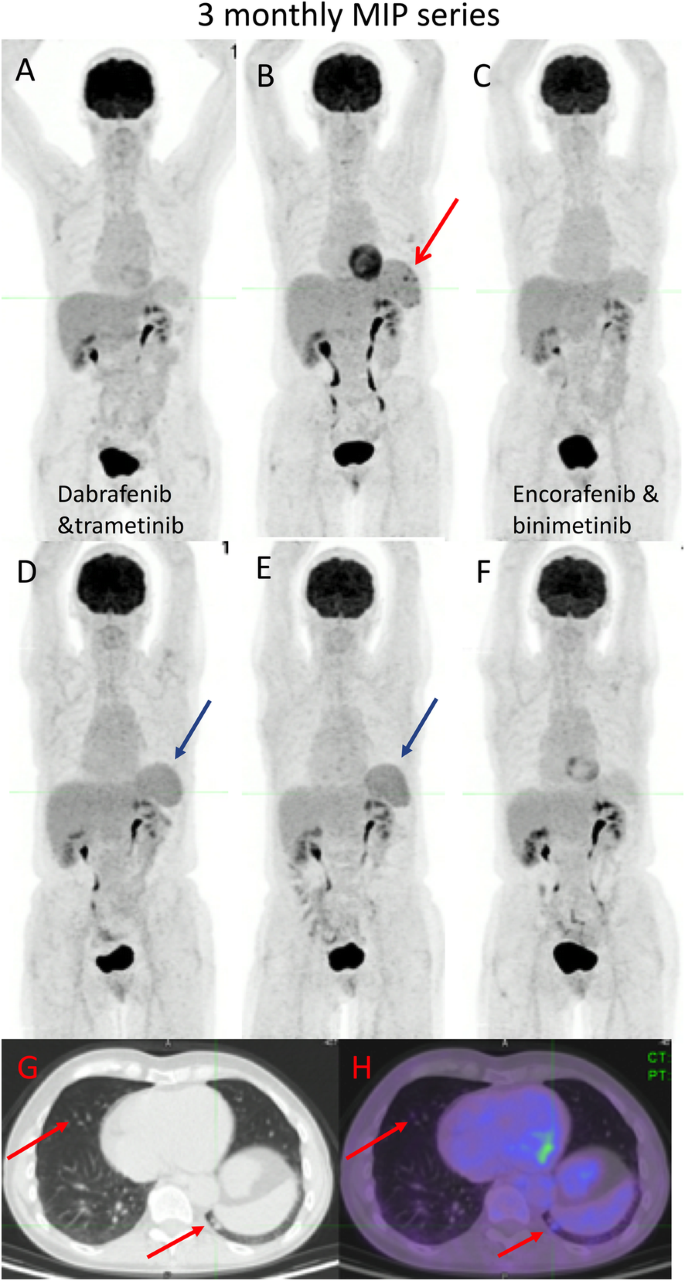
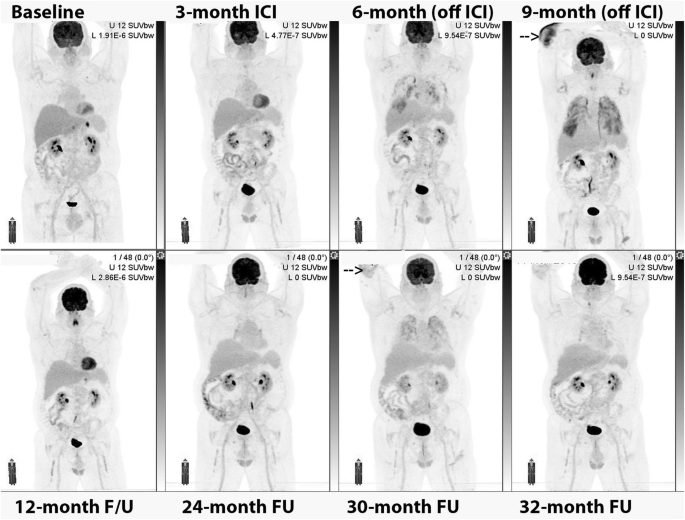
68-year-old female with primary melanoma in the upper back (1 mm Breslow thickness, no ulceration, mitotic rate < one, no peri-neural or lymphovascular invasion) with negative sentinel node biopsy at diagnosis (5 years ago) who developed self-detected right axillary metastasis one year later (images not provided). Axillary nodal dissection demonstrated 1/9 lymph nodes involved with 8 mm deposit and 0.3 mm extra-nodal extension (stage IIIB) BRAF V600K. Started on ICI (Ipilimumab and Nivolumab) afterwards and developed multifocal acquired demyelinating sensory and motor neuropathy treated with steroids, plasmapheresis and rituximab. Surveillance 18F-FDG PET/CT (A) showed new small pulmonary nodules (not evident on MIP),red arrows axial fused image(G and H); which were confirmed to be metastatic melanoma on wedge resection. MRI brain also showed small new cerebral metastases (stage IV-M1b). Treatment subsequently changed to Dabrafenib and Trametinib, which was poorly tolerated with recurrent episodes of fever, myalgia and fatigue. Surveillance 18F-FDG PET/CT scans were performed 3 monthly afterwards; the 1st follow-up 18F-FDG PET/CT showed an enlarged spleen with multiple foci of moderately increased FDG uptake (red arrow — B). The treatment regimen changed to 4 days on and 3 days off; however, this was also poorly tolerated and the patient was switched to Encorafenib and binimetinib with subsequent scans showing a mild interval splenic enlargement and reversal of the spleen to liver activity (blue arrows – D,E). The patient remained in CMR on subsequent scan and reversal of spleen to hepatic activity normalised
Full size image
Bullous pemphigoid
Severe autoimmune skin involvement is an uncommon but recognized complication of ICI. Bullous pemphigoid is the most common of these (Fig. 17).
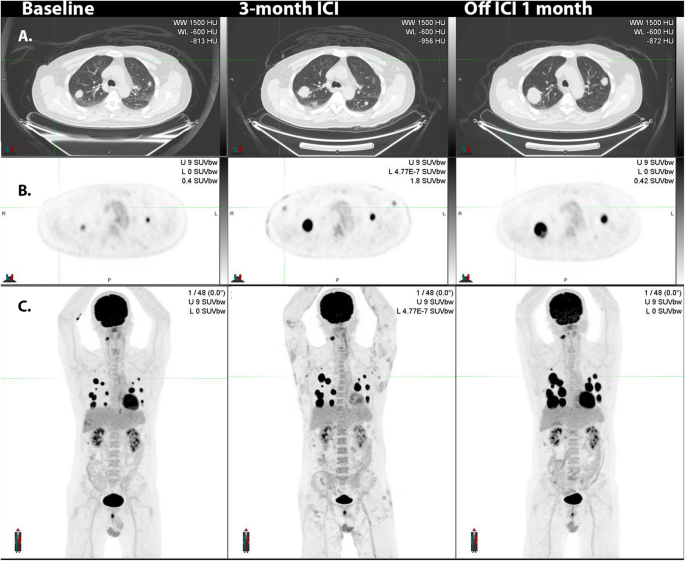
A: in this patient with multiple lung metastases identified at baseline evaluation, which were highly 18F-FDG-avid (B). ICI administration led to the development of widespread cutaneous lesions with associated axillary and inguinal nodal uptake apparent on 18F-FDG PET/CT. Biopsy confirmed bullous pemphigoid and the ICI therapy was ceased. Serial MIPs demonstrate resolution of the skin changes and nodal changes consistent with an inflammatory basis, but the progression of disease, as suggested already on both CT and PET at early evaluation
Full size image
Multiorgan irAEs including nephritis
Autoimmune renal pathologies are rare but important irAEs related to ICI treatment and normally diagnosed by routine laboratory testing but occasionally apparent on 18F-FDG PET/CT. Typical features are renal enlargement with increased renal parenchymal retention of tracer (Fig. 18).
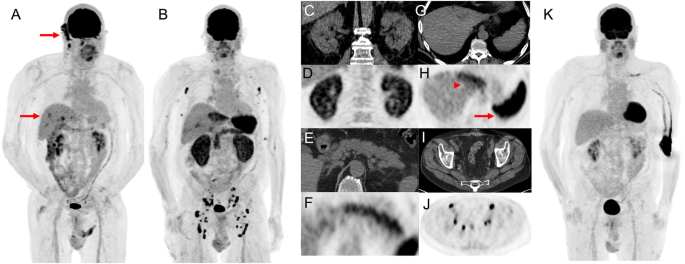
69 year-old man with ulcerated right occipital scalp melanoma, 5 mm deep, mitotic rate of 4 with locoregional nodal metastasis in the right sub-occipital and cervical stations as well as biopsy proven distant metastatic disease in the liver demonstrated on 18F-FDG PET MIP (arrows, panel A). Following three cycles of combination ipilimumab and nivolumab presented to emergency department with acute kidney injury (serum creatinine rose from 0.8 mg/dL to 2.8 mg/dL) with progressive fatigue, generalized weakness and poor oral intake. 18F-FDG PET MIP (panel B) at 3 months showed resolution of all disease in the right neck and liver and development of FDG-avidity of multiple organs including diffuse parenchymal 18F-FDG uptake by both kidneys (panel C and D), diffuse FDG uptake in the pancreas (panel E and F), diffuse 18F-FDG uptake in the left lobe of the live (arrow heads, panel G and H), marked diffuse 18F-FDG uptake in the spleen (arrows, panel G and H) as well as bilateral axillary, iliac and inguinal lymphadenopathy (panel I an J) suggestive of, interstitial nephritis, pancreatitis, likely cholangitis and granulomatous disease, respectively. The patient discontinued ICIs and was treated with high dose corticosteroid and all findings resolved at 5 months follow-up with gradual improvement in serum creatinine (Panel K)
Full size image
Conclusion and perspectives
Technological improvements allow us to revisit clinical problems previously viewed as limitations of PET such as detection of in-transit disease, evaluation of small pulmonary nodules apparent on CT and detection of liver metastases in choroidal melanoma, but sometimes produce artefacts and pitfalls requiring a learning curve to be observed.
Knowledge of variants and treatment-related pitfalls is crucial to avoid misinterpretation. ICIs-related pitfalls should not be regarded as a drawback of PET imaging, as they actually reflect the unique capability of PET to perform whole-body imaging and capture signs of immune activation in addition to performing therapy monitoring.
In these times of COVID 19 pandemic, PET scheduling should probably be adapted not only within treatment constraints but also accommodate the vaccination scheme of melanoma patients to avoid false-positive results. Despite this, tricky situations may occur, such as differentiating active COVID-19 related lung involvement from immune-pneumonitis. In any case, PET reporting should be made with knowledge of clinical findings (if needed quick physical examination in the PET unit may be required), laboratory and correlative morphological imaging, and obviously, collaboration with the referring physician and discussion at tumour boards remains crucial for an efficient patient’s management.
Availability of data and materials
Not applicable.
Abbreviations
- TKI:
-
tyrosine kinase inhibitors
- ICIs:
-
immune checkpoint inhibitors
- irAEs :
-
immune-related adverse events
- UV:
-
ultraviolet
- DNA:
-
deoxyribonucleic acid
- PET:
-
positron emission tomography
- CT:
-
computed tomography
18F-FDG :-
Fluorodeoxyglucose
- MRI:
-
magnetic resonance imaging
- MIP:
-
maximum intensity projection
- EARL:
-
European association of nuclear medicine research limited
- HLH:
-
Hemophagocytic lymphohistiocytosis
References
-
Rastrelli M, Tropea S, Rossi CR, Alaibac M. Melanoma: epidemiology, risk factors, pathogenesis, diagnosis and classification. In vivo. 2014;28:1005–11.
PubMed
Google Scholar
-
Thoelke A, Willrodt S, Hauschild A, Schadendorf D. Primary Extracutaneous malignant melanoma: a comprehensive review with emphasis on treatment. Onkologie. 2004;27(5):492–9. https://doi.org/10.1159/000080372.
Article
CAS
PubMedGoogle Scholar
-
Papaspyrou G, Garbe C, Schadendorf D, Werner JA, Hauschild A, Egberts F. Mucosal melanomas of the head and neck: new aspects of the clinical outcome, molecular pathology, and treatment with C-kit inhibitors. Melanoma Res. 2011;21(6):475–82. https://doi.org/10.1097/CMR.0b013e32834b58cf.
Article
CAS
PubMedGoogle Scholar
-
Wöll E, Bedikian A, Legha SS. Uveal melanoma: natural history and treatment options for metastatic disease. Melanoma Res. 1999;9(6):575–81. https://doi.org/10.1097/00008390-199912000-00006.
Article
PubMedGoogle Scholar
-
Singh AD, Bergman L, Seregard S. Uveal Melanoma: Epidemiologic Aspects. Ophthalmol Clin N Am. 2005;18(1):75–84. https://doi.org/10.1016/j.ohc.2004.07.002.
Article
Google Scholar
-
Del Fiore P, Rastrelli M, Dall’Olmo L, Cavallin F, Cappellesso R, Vecchiato A, et al. Melanoma of unknown primary: evaluation of the characteristics, treatment strategies, prognostic factors in a monocentric retrospective study. Front Oncol. 2021;11:627527. https://doi.org/10.3389/fonc.2021.627527.
Article
PubMed
PubMed CentralGoogle Scholar
-
Grunhagen DJ, Brunstein F, Graveland WJ, van Geel AN, de Wilt JH, Eggermont AM. One hundred consecutive isolated limb perfusions with Tnf-alpha and Melphalan in melanoma patients with multiple in-transit metastases. Ann Surg. 2004;240(6):939–47. https://doi.org/10.1097/01.sla.0000146147.89667.ed.
Article
PubMed
PubMed CentralGoogle Scholar
-
Roses DF, Harris MN, Rigel D, Carrey Z, Friedman R, Kopf AW. Local and in-transit metastases following definitive excision for primary cutaneous malignant melanoma. Ann Surg. 1983;198(1):65–9. https://doi.org/10.1097/00000658-198307000-00013.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Nan Tie E, Na LH, Hicks RJ, Spillane J, Speakman D, Henderson MA, et al. The prognosis and natural history of in-transit melanoma metastases at a high-volume Centre. Ann Surg Oncol. 2019;26(13):4673–80. https://doi.org/10.1245/s10434-019-07965-w.
Article
PubMedGoogle Scholar
-
Patel JK, Didolkar MS, Pickren JW, Moore RH. Metastatic pattern of malignant melanoma. A study of 216 autopsy cases. Am J Surg. 1978;135(6):807–10. https://doi.org/10.1016/0002-9610(78)90171-x.
Article
CAS
PubMedGoogle Scholar
-
Barth A, Wanek LA, Morton DL. Prognostic factors in 1,521 melanoma patients with distant metastases. J Am Coll Surg. 1995;181(3):193–201.
CAS
PubMedGoogle Scholar
-
Meyer T, Merkel S, Goehl J, Hohenberger W. Surgical therapy for distant metastases of malignant melanoma. Cancer. 2000;89(9):1983–91. https://doi.org/10.1002/1097-0142(20001101)89:9<1983::aid-cncr15>3.3.co;2-j.
Article
CAS
PubMedGoogle Scholar
-
Rajpal S, Moore R, Karakousis CP. Survival in metastatic ocular melanoma. Cancer. 1983;52(2):334–6. https://doi.org/10.1002/1097-0142(19830715)52:2<334::aid-cncr2820520225>3.0.co;2-e.
Article
CAS
PubMedGoogle Scholar
-
Rietschel P, Panageas KS, Hanlon C, Patel A, Abramson DH, Chapman PB. Variates of survival in metastatic uveal melanoma. J Clin Oncol. 2005;23(31):8076–80. https://doi.org/10.1200/JCO.2005.02.6534.
Article
PubMedGoogle Scholar
-
Reinhardt MJ, Joe AY, Jaeger U, Huber A, Matthies A, Bucerius J, et al. Diagnostic performance of whole body dual modality 18F-FDG PET/CT imaging for N- and M-staging of malignant melanoma: experience with 250 consecutive patients. J Clin Oncol. 2006;24(7):1178–87. https://doi.org/10.1200/JCO.2005.03.5634.
Article
PubMedGoogle Scholar
-
Wong ANM, McArthur GA, Hofman MS, Hicks RJ. The advantages and challenges of using FDG PET/CT for response assessment in melanoma in the era of targeted agents and immunotherapy. Eur J Nucl Med Mol Imaging. 2017;44(S1):67–77. https://doi.org/10.1007/s00259-017-3691-7.
Article
PubMedGoogle Scholar
-
Aide N, Hicks RJ, Le Tourneau C, Lheureux S, Fanti S, Lopci E. FDG PET/CT for assessing tumour response to immunotherapy : report on the Eanm symposium on immune modulation and recent review of the literature. Eur J Nucl Med Mol Imaging. 2019;46(1):238–50. https://doi.org/10.1007/s00259-018-4171-4.
Article
PubMedGoogle Scholar
-
Iravani A, Osman MM, Weppler AM, Wallace R, Galligan A, Lasocki A, et al. FDG PET/CT for Tumoral and systemic immune response monitoring of advanced melanoma during first-line combination Ipilimumab and Nivolumab treatment. Eur J Nucl Med Mol Imaging. 2020;47(12):2776–86. https://doi.org/10.1007/s00259-020-04815-w.
Article
CAS
PubMedGoogle Scholar
-
Prigent K, Lasnon C, Ezine E, Janson M, Coudrais N, Joly E, et al. Assessing immune organs on (18)F-FDG PET/CT imaging for therapy monitoring of immune checkpoint inhibitors: inter-observer variability, prognostic value and evolution during the treatment course of melanoma patients. Eur J Nucl Med Mol Imaging. 2021;48(8):2573–85. https://doi.org/10.1007/s00259-020-05103-3.
Article
CAS
PubMedGoogle Scholar
-
Seban RD, Champion L, Schwartz LH, Dercle L. Spleen glucose metabolism on [(18)F]-FDG PET/CT: a dynamic double-edged biomarker predicting outcome in Cancer patients. Eur J Nucl Med Mol Imaging. 2021;48(8):2309–11. https://doi.org/10.1007/s00259-020-05126-w.
Article
PubMedGoogle Scholar
-
Seban RD, Moya-Plana A, Antonios L, Yeh R, Marabelle A, Deutsch E. Prognostic 18F-FDG PET biomarkers in metastatic mucosal and cutaneous melanoma treated with immune checkpoint inhibitors targeting PD-1 and CTLA-4. Eur J Nucl Med Mol Imaging. 2020;47(10):2301–12.
Article
CASGoogle Scholar
-
Seban RD, Nemer JS, Marabelle A, Yeh R, Deutsch E, Ammari S. Prognostic and Theranostic 18F-FDG PET Biomarkers for Anti-PD1 Immunotherapy in Metastatic Melanoma: Association with Outcome and Transcriptomics. Eur J Nucl Med Mol Imaging. 2019;46(11):2298–310.
Article
CASGoogle Scholar
-
Aide N, Lasnon C, Veit-Haibach P, Sera T, Sattler B, Boellaard R. Eanm/Earl harmonization strategies in pet quantification: from daily practice to multicentre oncological studies. Eur J Nucl Med Mol Imaging. 2017;44(S1):17–31. https://doi.org/10.1007/s00259-017-3740-2.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Zimmermann PA, Houdu B, Cesaire L, Nakouri I, De Pontville M, Lasnon C, et al. Revisiting detection of in-transit metastases in melanoma patients using digital (18)F-FDG PET/CT with small-voxel reconstruction. Ann Nucl Med. 2021;35(6):669–79. https://doi.org/10.1007/s12149-021-01608-5.
Article
CAS
PubMedGoogle Scholar
-
Liberini V, Messerli M, Husmann L, Kudura K, Grunig H, Maurer A, et al. Improved detection of in-transit metastases of malignant melanoma with Bsrem reconstruction in digital [(18)F] FDG PET/CT. Eur Radiol. 2021;31(10):8011–20. https://doi.org/10.1007/s00330-021-07852-7.
Article
PubMed
PubMed CentralGoogle Scholar
-
Beyer T, Bockisch A, Kühl H, Martinez MJ. Whole-body 18F-FDG PET/CT in the presence of truncation artifacts. J Nucl Med. 2006;47(1):91–9.
-
Dudoignon D, Pattison DA, Legallois D, Hicks RJ, Aide N. The utility of pharmacological and radiological interventions to optimize diagnostic information from PET/CT. Cancer Imaging. 2020;20(1):68. https://doi.org/10.1186/s40644-020-00344-9.
Article
PubMed
PubMed CentralGoogle Scholar
-
Hicks RJ, Iravani A, Sandhu S. 18F-Fluorodeoxyglucose Positron Emission Tomography/Computed Tomography for Assessing Tumor Response to Immunotherapy in Solid Tumors: Melanoma and Beyond. PET Clin. 2020;15:11–22. https://doi.org/10.1016/j.cpet.2019.08.007.
Article
PubMedGoogle Scholar
-
Prigent K, Aide N. 18F-Fludeoxyglucose Pet/Computed Tomography for Assessing Tumor Response to Immunotherapy and Detecting Immune-Related Side Effects: A Checklist for the Pet Reader. PET Clin. 2020;15:1–10. https://doi.org/10.1016/j.cpet.2019.08.006.
Article
PubMedGoogle Scholar
-
Steinberg J, Thomas A, Iravani A. 18F-Fluorodeoxyglucose PET/CT findings in a systemic inflammatory response syndrome after Covid-19 vaccine. Lancet. 2021;397:e9. https://doi.org/10.1016/S0140-6736(21)00464-5.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Shirone N, Shinkai T, Yamane T, Uto F, Yoshimura H, Tamai H, et al. Axillary lymph node accumulation on FDG-PET/CT after influenza vaccination. Ann Nucl Med. 2012;26(3):248–52. https://doi.org/10.1007/s12149-011-0568-x.
Article
PubMedGoogle Scholar
-
Eshet Y, Tau N, Alhoubani Y, Kanana N, Domachevsky L, Eifer M. Prevalence of increased FDG PET/CT axillary lymph node uptake beyond 6 weeks after Mrna Covid-19 vaccination. Radiology. 2021;210886(3):E345–7. https://doi.org/10.1148/radiol.2021210886.
Article
Google Scholar
-
Cohen D, Krauthammer SH, Wolf I, Even-Sapir E. Hypermetabolic lymphadenopathy following administration of Bnt162b2 Mrna Covid-19 vaccine: incidence assessed by [(18)F] FDG-PET/CT and relevance to study interpretation. Eur J Nucl Med Mol Imaging. 2021;48(6):1854–63. https://doi.org/10.1007/s00259-021-05314-2.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Aide N, Lasnon C, Kesner A, Levin CS, Buvat I, Iagaru A, et al. New pet technologies — embracing Progress and pushing the limits. Eur J Nucl Med Mol Imaging. 2021;48(9):2711–26. https://doi.org/10.1007/s00259-021-05390-4.
Article
PubMed
PubMed CentralGoogle Scholar
-
Czernin J, Fanti S, Meyer PT, Allen-Auerbach M, Hacker M, Sathekge M, et al. Nuclear medicine operations in the times of Covid-19: strategies, precautions, and experiences. J Nucl Med. 2020;61(5):626–9. https://doi.org/10.2967/jnumed.120.245738.
Article
CAS
PubMedGoogle Scholar
-
George J, Bajaj D, Sankaramangalam K, Yoo JW, Joshi NS, Gettinger S, et al. Incidence of pancreatitis with the use of immune checkpoint inhibitors (Ici) in advanced cancers: a systematic review and Meta-analysis. Pancreatology. 2019;19(4):587–94. https://doi.org/10.1016/j.pan.2019.04.015.
Article
CAS
PubMedGoogle Scholar
-
Ahn SS, Hwang SH, Jung SM, Lee SW, Park YB, Yun M, et al. The clinical utility of splenic fluorodeoxyglucose uptake for diagnosis and prognosis in patients with macrophage activation syndrome. Medicine (Baltimore). 2017;96:e7901. https://doi.org/10.1097/MD.0000000000007901.
Article
CASGoogle Scholar
Download references
Acknowledgements
The authors are grateful to the staff members of their PET units (secretaries, technologists, Radiopharmacists and Medical Physicists) and colleagues from tumour boards for fruitful discussions around the difficults cases presented in this review.
Author information
Authors and Affiliations
-
PET Centre, University Hospital, Service de Médecine Nucléaire, CHU de Caen, Avenue Côte de Nacre, 14000, Caen, France
Nicolas Aide & Kevin Prigent
-
Mallinckrodt Institute of Radiology, Washington University School of Medicine, Saint Louis, USA
Amir Iravani
-
Dermatology Department, University Hospital, Caen, France
Diane Kottler
-
Peter MacCallum Cancer Institute, Melbourne, Australia
Ramin Alipour & Rodney J. Hicks
-
The Sir Peter MacCallum Department of Oncology, University of Melbourne, Melbourne, Australia
Rodney J. Hicks
Authors
- Nicolas Aide
You can also search for this author in
PubMed Google Scholar - Amir Iravani
You can also search for this author in
PubMed Google Scholar - Kevin Prigent
You can also search for this author in
PubMed Google Scholar - Diane Kottler
You can also search for this author in
PubMed Google Scholar - Ramin Alipour
You can also search for this author in
PubMed Google Scholar - Rodney J. Hicks
You can also search for this author in
PubMed Google Scholar
Contributions
NA: cases collection, manuscript writing, AI: cases collection, manuscript writing, KP: cases collection, DK: manuscript writing, RA: cases collection, manuscript writing, RJH: cases collection, manuscript writing. All authors read and approved the final version of the manuscript.
Corresponding author
Correspondence to
Nicolas Aide.
Ethics declarations
Ethics approval and consent to participate
cases from the Peter MacCallum Cancer Centre Ethics Committee approval number 17/231R. Due to retrospective nature of the study and no intervention the consent from the individuals were waived. Cases from the Caen University Hospital: French observational studies without any additional therapy or monitoring procedure do not need the approval of an ethics committee. Notheless, in accordance with the European General Data Protection Regulation, we sought approval to collect data for this work from the national committee for data privacy, with the registration no. 2081250 v 0.
Consent for publication
Cases from the Peter MacCallum Cancer Centre: waived or covered by pre-existing consent provided within various clinical trials in which individual patients were enrolled. Cases from the Caen University Hospital: all patients refered to the PET unit receive written information for the use of anonymised images from their examinations for teaching and research purposes and may opt out.
Competing interests
Professor Hicks is the Co-Editor-in-Chief of Cancer Imaging but had no role in assigning reviewers or any other aspect of the review process. For other authors there are none to disclose.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Aide, N., Iravani, A., Prigent, K. et al. PET/CT variants and pitfalls in malignant melanoma.
Cancer Imaging 22, 3 (2022). https://doi.org/10.1186/s40644-021-00440-4
Download citation
-
Received: 23 September 2021
-
Accepted: 05 December 2021
-
Published: 04 January 2022
-
DOI: https://doi.org/10.1186/s40644-021-00440-4
Keywords
- Melanoma
- Pitfalls, variants
- FDG
- PET
- Immunotherapy
- PET technology
- COVID19
- Review
- Open Access
- Published: 04 January 2022
- Amir Iravani2,
- Kevin Prigent1,
- Diane Kottler3,
- Ramin Alipour4 &
- …
- Rodney J. Hicks4,5
Cancer Imaging
volume 22, Article number: 3 (2022)
Cite this article
-
8623 Accesses
-
4 Citations
-
1 Altmetric
-
Metrics details
Abstract
18F-FDG PET/CT plays an increasingly pivotal role in the staging and post-treatment monitoring of high-risk melanoma patients, augmented by the introduction of therapies, including tyrosine kinase inhibitors (TKI) and immune checkpoint inhibitors (ICIs), that have novel modes of action that challenge conventional response assessment. Simultaneously, technological advances have been regularly released, including advanced reconstruction algorithms, digital PET and motion correction, which have allowed the PET community to detect ever-smaller cancer lesions, improving diagnostic performance in the context of indications previously viewed as limitations, such as detection of in-transit disease and confirmation of the nature of small pulmonary metastases apparent on CT.
This review will provide advice regarding melanoma-related PET protocols and will focus on variants encountered during the imaging of melanoma patients. Emphasis will be made on pitfalls related to non-malignant diseases and treatment-related findings that may confound accurate interpretation unless recognized. The latter include signs of immune activation and immune-related adverse events (irAEs). Technology-related pitfalls are also discussed, since while new PET technologies improve detection of small lesions, these may also induce false-positive cases and require a learning curve to be observed. In these times of the COVID 19 pandemic, cases illustrating lessons learned from COVID 19 or vaccination-related pitfalls will also be described.
Background
Epidemiological studies report a rapid increase in the incidence of melanoma over the past 50 years or so, primarily in Caucasians, despite some slowing of the rate of increase around 1990–2000, probably reflecting increased awareness of the risk of excessive sun exposure and consequent UV damage to DNA. Unlike other solid tumors, melanoma mostly affects young and middle-aged people. The median age at the time of diagnosis of melanoma is 57 years [1]. However, in Australia, which has one of the highest incidences of melanoma in the world, the rate of new diagnoses increases with age, particularly in males. Close to 80% of cases present with early-stage disease (https://ncci.canceraustralia.gov.au/diagnosis/distribution-cancer-stage/distribution-cancer-stage) and have high survival rates. High-risk melanoma represents a major burden on society through both direct costs and loss of productivity.
Mucosal/cutaneous vs uveal melanoma
Less than 5% of all primary melanomas arise from sites other than the skin. These include mucosal surfaces, meninges and the choroidal layer of the eye, which have a common ectodermal origin [2]. Mucosal melanomas can arise in the nasopharynx, larynx, tracheobronchial tracts, esophagus, anorectal and genitourinary tracts. Approximately 50% affect the head and neck region with a predominance in the sinuses and nasal cavities [3]. Mucosal melanomas are considered to be more aggressive than their cutaneous counterparts, possibly linked to delayed diagnosis with larger tumor masses, and metastatic extension at diagnosis (30%).
Uveal melanoma is a distinct clinico-pathological entity, differing in many aspects from cutaneous melanoma, including a distinct set of associated mutations [4, 5]. Its clinical course is unpredictable and metastatic disease can develop after a long disease-free interval.
Approximately 3% of metastatic melanomas are of unknown primary [6]. This potentially reflects spontaneous regression of the primary as a result of innate immune responses.
Pattern of spread of melanoma
The main cause of death in melanoma patients is widespread metastasis. Metastases develop in regional lymph nodes, as satellite or in-transit lesions, or in distant organs. In-transit metastases occur in 5 to 8% of patients with high-risk melanoma of the limb and can present as single or multiple (sub) cutaneous nodules close to the primary tumour (satellitosis if < 3 cm from the primary tumour) or scattered over the whole extremity [7]. They can appear synchronously together with the primary tumour or as a regional relapse, and frequently precede the appearance of systemic metastases [8]. Prolonged survival can occur following locoregional therapies [9].
When it comes to distant metastases, autopsy cases have shown that multiple organ metastases were present in 95% of the patients, the most common organs involved being lymph nodes (73.6%), lungs (71.3%), liver (58.3%), brain (49.1%), bone (48.6%), heart (47.2%), adrenal glands (46.8%), and gastrointestinal tract (43.5%) [10]. A varying percentage (14% [11] to 67% [12]) of patients presenting with single organ metastasis at the time of tumor relapse has been reported in large series of patients referred to surgery, though these figures were reported at a time when modern PET sytems were not routinely used for staging and restaging of melanoma patients.
Rather than spreading to regional nodes, uveal melanoma metastasizes haematogenously, predominantly to the liver [13, 14]. Metastases to the liver develop within 15 years after the initial diagnosis and treatment in approximately 50% of patients with posterior uveal melanoma [4, 5].
PET/CT protocol
18F-FDG PET/CT has been proven to have high diagnostic performance for the detection of soft-tissue, nodal and visceral metastases at initial staging or during follow-up [15] and is able to identify tumor response early in the course of TKI treatment [16]. In the framework of immunotherapy, 18F-FDG PET/CT has the unparalleled capability of assessing tumor response on a whole-body basis and detecting signs of immune activation as well as immune-related adverse effects (irAEs) [17,18,19,20,21,22].
In addition to the usual compliance with PET tumour imaging guidelines and harmonizing standards [23], several points regarding the PET acquisition protocol need to be raised. First, while including the brain in the field of view is not routine at many PET centres, the skull base should be included, at least for therapy assessment examinations, so that immune-related hypophysitis can be detected. While MRI is the preferred method for assessing brain and leptomeningeal metastases from melanoma, the high metabolic activity of melanoma, particularly when accompanied by surrounding vasogenic oedema can make intracranial involvement readily apparent on PET and given the small incremental imaging time to acquire from the vertex of the skull, this is recommended by the authors. When the arms are elevated to improve imaging of the thorax and axillae, more of the upper limbs are also included when whole-brain imaging is acquired.
Second, accurate staging or restaging of patients with melanoma of the extremities requires a whole-body acquisition in the case of primary tumour located on the lower limbs and the arms along the body for primary tumours located on the upper limbs. Indeed, digital PET using small-voxel reconstructions [24] or modern reconstruction algorithms [25] brings an additional value for the detection of in-transit metastases in melanoma patients, by reducing the number of indeterminate findings and minimizing falsely negative scans compared to earlier PET systems. It is noteworthy that for overweight patients, hands should be positioned on the pelvis to avoid any truncation artefact of the arms at the edges of the field of view [26].
If myocardial metastases are suspected, a special diet, long fasting period and heparin can be used to suppress physiological myocardial 18F-FDG uptake [27].
PET reports for therapy monitoring of patients receiving immune checkpoint inhibitors (ICIs) should include therapy response according to validated criteria, presence of signs of immune activation and signs of toxicity, especially immune-related adverse events (irAEs) requiring withdrawal of ICIs and/or corticosteroids, e.g., colitis and pneumonitis. Proposals for structured PET report can be found elsewhere [17, 28, 29].
Pitfalls related to non-malignant diseases
Acne and furunculosis
Benign uptake related to acne and cutaneous infectious processes should not be mistaken for subcutaneous or in-transit metastases. While acne lesions tend to occur on the trunk and face, as shown in Fig. 1. Quick clinical examination before discharging the patient from the PET unit will avoid false-positive reports in the case of evident infectious skin disorders, while more complex situations may require skin examination by a dermatologist.

44-year-old woman, referred for initial staging for prior melanoma on the left cheek. Panel A displays lateral MIP view. Multiple subcutaneous 18F-FDG foci can be seen on the face (B) and the trunk (C), all located close to the midline related to dermoepidermitis. These could be confused with subcutaneous metastases without clinical correlation. It is noteworthy that some non 18F-FDG avid cystic lesions are also seen (D). Sebaceous cysts and other benign lesions apparent on correlative CT are usually readily diagnosed by clinical examination
Full size image
Venous varicosities
The PET reader should be aware of potential technology-related pitfalls, as new PET technologies, such as advanced reconstruction algorithms and digital PET using small-voxel reconstruction, have improved detection of small lesions [24], but may also induce false-positive cases by significantly increasing apparent uptake in benign lesions (Figs. 2 and 3).

89-year-old woman with previous localization of melanoma on the right lower limb, who was on active surveillance. A: zoomed MIP images; B: transverse PET slices and C corresponding CT slices. Subcutaneous 18F-FDG foci related to in-transit metastases can be seen on the right leg (red arrows). Also visible are foci related to venous varicosity, not to be mistaken for subcutaneous metastases (orange arrow). It is noteworthy that in-transit metastases are only clearly visible on digital images reconstructed with small-voxels. EARL-compliant images, which mimic former generation PET systems by applying a post-reconstruction filtering step [23], are equivocal. EARL: European Association of Nuclear Medicine Research limited
Full size image

Serial MIP images (A) in a patient with widespread metastatic melanoma demonstrate resolution of an in-transit deposit on the lateral aspect of the left leg (arrow on baseline scan) and gradual regression of metastatic disease over time despite residual left inguinal nodal abnormality after 6 months of immune checkpoint therapy. On coronal PET and CT images (B), nodular but contiguous linear uptake in the subcutaneous fat along the medial left thigh demonstrates no change over time on the MIP images above and clinically correlated with a varicose vein. Transaxial images (C) are more difficult to interpret than the coronal images in demonstrating mildly 18F-FDG -avid nodularity and a rounded shape on correlative CT, emphasizing the importance of review of images in orthogonal planes
Full size image
Post vaccine nodal uptake
PET centers scanning cancer patients after the introduction of the COVID 19 vaccination program have witnessed moderate to intense local or systemic inflammatory responses in some patients [30]. It is noteworthy that such local nodal inflammatory responses have already been observed in patients having received Influenza vaccines [31], but the frequency of these observations with COVID19 vaccine and the presence of multiple nodal uptake at higher echelon nodal stations is unprecedented.
While some of them may be pretty obvious, appearing as subcutaneous and/or muscular uptake at the site of injection and contiguous nodal uptake, some other situations may be misleading for tumour uptake, especially in patients staged or followed-up for melanoma of the upper limbs. Concerning nodal uptake, it is noteworthy that foci may vary in intensity and can co-exist with both benign CT patterns (oblong shape, fatty hilum) and suspicious round shape may occur, as shown in Fig. 4. Also misleading can be the presence of benign nodal uptake in secondary echelon nodes. These lymph nodes may remain 18F-FDG -avid up to 10 weeks or later after vaccination [32]. For these reasons, it is prudent to adapt PET scheduling not only within treatment constraints but also accommodate the vaccination scheme of melanoma patients, as suggested recently in the largest series of vaccination-related inflammatory changes reported in the Israeli population [33].

48-year-old woman with previous localization of melanoma on the left knee, who had been treated by TKI for 6 months. This patient received her first dose of COVID 19 vaccine in the right deltoid muscle (Pfizer-BioNtec Cominarty) 21 days prior to the PET examination. Multiple reactive nodes can be seen on the right axillae. Note that some of these nodes have benign CT patterns (bottom right panel: fatty hilum) while others may be considered suspicious based on CT appearance (top right panel: round shape, loss of the fatty hilum pattern). In this case, spread to the contralateral axilla from a leg primary without regional nodal or distant metastatic involvement should alert the reader to a low likelihood of malignancy
Full size image
Sarcoid-like granuloma, especially mediastinal but sometimes systemic sarcoid
Both at diagnosis and during therapy of melanoma, granulomatous disease involving nodes and other organs may cause diagnostic difficulties. Although the typical distribution of sarcoid-like lymphadenopathy includes symmetrical, generally non-enlarged hilar and mediastinal nodes with increased uptake, atypical patterns can occur. Peri-portal nodes and focal splenic lesions are not uncommon. The evolution of the sarcoid-like granulomatous disease in response to immune checkpoint therapy is highly variable and can persist beyond the withdrawal of ICIs and fluctuate in activity over time (Fig. 5).

Serial MIP images. In this patient with a gastric primary and liver metastasis at baseline evaluation, the development of immune-related hepatitis led to the withdrawal of ICI treatment. Nevertheless, the patient developed pulmonary infiltrates and cutaneous lesions, particularly over the right elbow (arrow). These were confirmed on biopsy to be sarcoidosis and continued to wax and wane in response to treatment with steroids despite lack of continuing ICI treatment and ongoing complete metabolic response at prior sites of disease
Full size image
Technology-related pitfalls: characterization of pulmonary nodules
Due to respiratory movement, the 18F-FDG uptake and CT characteristics of the pulmonary nodules in the base of lungs may be subject to partial volume effect (Fig. 6). In these cases, a dedicated fine slice CT of the chest in full inspiration may further characterize the suspected findings. Upon detection of pulmonary nodules, other differential diagnosis needs to be considered including benign and neoplastic process and ultimately a histopathologic confirmation may be needed.

69-year-old man with prior melanoma of the right forearm, 2.1 mm Breslow-depth without ulceration and 1/mm2 mitoses and positive axillary sentinel lymph node (0.2 mm focus with no extracapsular extension) with no adjuvant therapy on observation. Panel A displays surveillance 18F-FDG PET MIP 5 months post-resection of the primary lesion. A new FDG-avid nodule was noted in the left lower lobe (panel B and C) which due to respiratory movement appeared ill-defined. A dedicated CT of the chest 7 days later confirmed the nodule in the left lower lobe (panel D) and also showed an additional nodule in the right lower lobe (panel G) which went undetected on the PET/CT (panel E and F) and were suspicious for metastatic melanoma. Wedge resection of the left lower lobe revealed caseation granuloma and the patient continued on surveillance
Full size image
It is expected in the near future that advancements in PET motion correction will allow to better characterize small nodules located in the base of the lungs. Specifically, data-driven motion correction and the emergence of artificial intelligence tools are opening new opportunities for motion handling in clinical PET [34].
Variants: false-negative or very low uptake in liver metastases from choroidal melanoma
Uveal melanoma metastasizes haematogenously, predominantly to the liver and metastases may be of small volume. Attention should be paid to doubtful 18F-FDG foci, as small volume liver metastases may occur, and uptake intensity may be lower than that observed in other histological subtypes of melanoma. This is more problematic in overweight or obese patients in whom statistical considerations lead to greater inhomogeneity of apparent 18F-FDG uptake (as shown in Figs. 7 and 8 below), indeterminate 18F-FDG foci should lead to follow-up PET or additional radiological exploration. It is expected that technological evolutions such as digital PET with small-voxel reconstruction and/or enhancement of images with the convolutional neural network will further improve image quality in the liver and detection of small volume metastatic disease [34]. Because of the para-magnetic properties of melanin, MRI is a relatively sensitive technique for the detection of uveal melanoma metastases to liver and should be recommended in the setting of clinical suspicion or equivocal PET/CT findings.

63-year-old woman with choroidal melanoma. The patient’s body mass index was 32.5. 18F-FDG PET images (axial slice A, zoomed MIP view B) show an indeterminate 18F-FDG focus located in the left liver lobe, segment 2 (black arrows) slightly more intense than the surrounding background seen in the right liver lobe (A, dotted black arrow). Given that liver metastasis is the main pattern of spread of uveal melanoma, follow-up was performed at 3 months and confirmed metastatic liver disease (D, E and F, black arrow)
Full size image

71-year-old woman with metastatic uveal melanoma, and previous central liver resection for solitary metastasis. Follow-up 18F-FDG PET images 6 months post-surgery showed at least two foci of low-grade 18F-FDG uptake in the liver, slightly above the physiological background activity (black arrows, image A – zoomed MIP). The lesion in segment 4a just left to the surgical margin (red arrow on image B — axial fused image) was subsequently confirmed to be metastatic melanoma on histology. The lesion in segment 6 (red arrow on image C – axial fused image), which was associated with a subtle area of hypo-attenuation on low dose CT, showed further progression on follow-up CT after 3 months (image not provided)
Full size image
Pitfalls related to treatment
Frequently encountered patterns
Colitis
Colitis may be a life-threatening irAE, requiring withdrawal of ICI and/or treatment with corticosteroids. It is noteworthy that colitis often presents as intense circumferential uptake without wall thickening and/or fat stranding on CT, and should therefore not be confused with benign uptake due to metformin treatment in diabetic patients.
A typical feature of immune-related colitis is prominent of the haustra as well giving rise to an appearance similar to a “string of pearls”. Unlike physiological bowel activity, which is often segmental, the entire colon is generally involved by autoimmune colitis. It should be noted that immune-related adverse events can occur simultaneously or be temporally unrelated (Fig. 9).

Following the introduction of adjuvant immunotherapy for resected stage IIIC disease, despite normal CT appearances (A, middle panel), fused 18F-FDG PET/CT (B, middle panel) and MIP (C, middle panel) images revealed intense uptake throughout the large bowel with a typical “string of pearls” distribution. The patient was asymptomatic at the time of the scan but within 24-h had developed severe diarrhea consistent with this diagnosis. Despite successful treatment of this complication the patient subsequently developed bilateral trochanteric bursitis as a second potential irAE
Full size image
Diffuse enteritis masking small bowel and serosal metastases
Small bowel is a common site for gastrointestinal metastasis in melanoma, however, the history and clinical findings are nonspecific and may mimic immune-related gastritis and enteritis. The presence of the latter, could potentially mask small bowel metastases on 18F-FDG PET/CT (Fig. 10).

Patient with stage 4 melanoma in CMR on single-agent nivolumab with symptoms of intermittent nausea, vomiting and diarrhoea and clinical diagnosis of immune-related enteritis underwent 18F-FDG PET which showed moderate to intense diffuse uptake in the stomach, duodenum and small bowel in keeping with immune-related gastritis, duodenitis and enteritis (MIP image A). Short interval 18F-FDG PET after successful treatment of irAEs (MIP image B), showed two foci of intense FDG uptake in the small bowel (red arrows) in keeping with metastases and a third focus in the left abdomen near the transverse colon, in keeping with serosal metastasis (blue arrow)
Full size image
Pneumonitis
Along with colitis, pneumonitis (Fig. 11) may be a life-threatening irAE, requiring withdrawal of ICI and/or treatment with corticosteroids.

Following resection of nodal metastasis in the right lower cervical region, adjuvant immune checkpoint inhibitor therapy was commenced. At 6-month surveillance 18F-FDG PET/CT, lung infiltrates were apparent on correlative CT (A). These had high 18F-FDG -avidity (B, middle panel). Serial MIP images (C) demonstrate the patchy, bilateral nature of these changes as well as generalized bone marrow activation and increased activity in both shoulders consistent with synovitis as confirmed on transaxial fused 18F-FDG PET/CT images (D, middle panel). With the introduction of corticosteroids, the pneumonitis resolved but a fatty change was noted in the liver (F, right panel) and diffuse oesophagogastric uptake was observed (G, right panel). Gastroscopy confirmed enteritis. Increased spleen to liver ratio on the late scan likely reflects a combination of reduced hepatic activity related to steatosis and splenic activation
Full size image
Although immune-related pneumonitis is the most common cause of patchy increased 18F-FDG uptake in the lung, other pathologies should always be considered. In the COVID-19 era, these include pulmonary manifestations of viral infection [35]. Pulmonary sarcoidosis is also a differential diagnosis but is more often nodular than of a ground-glass or diffuse subpleural distribution. Of course, both conditions may co-exist.
Hepatitis
Autoimmune hepatitis is relatively common as a side effect of ICI therapy but is usually detected on routine biochemistry surveillance. Occasionally it can persist and be apparent on 18F-FDG PET/CT (Fig. 12).

Note the relatively high uptake in the liver relative to the spleen on the post-treatment scan, which was associated with biochemical evidence of hepatitis. Note also that the generalized bone marrow activation with peripheral marrow expansion in the context of a complete metabolic response in prior small bowel metastases was interpreted as being reactive
Full size image
Unusual irAEs during immunotherapy
Pancreatitis mimicking malignancy
Pancreatitis has been reported to occur in 2.7% of patients receiving ICIs, more frequently with anti-CTLA4 (3.08% versus 0.94% for anti PD1) [36]. Also, melanoma patients treated with ICIs have increased incidence of pancreatitis as compared to other solid tumours. Although not misleading when appearing as homogeneous increased 18F-FDG uptake involving the whole gland, pancreatitis can also appear as focal uptake mimicking either primary tumour or metastatic disease (Fig. 13).

63-year-old woman with prior localization of melanoma on the left thigh, who had been treated by ICIs for 16 months. A nodular 18F-FDG focus can be seen in the pancreatic head (B: axial PET slice) without concordant anomaly at CT (A). Given that this pattern was unusual, MRI was performed a week later and showed patterns consistent with pancreatic adenocarcinoma: ill-defined mass of the pancreatic head on T2 sequence (C), this lesion appearing hypointense on T1 sequence arterial phase after gadolinium injection (D), hyperintense on diffusion sequence and displaying hypercellularity on ADC sequence. Given that PET was otherwise normal, a biopsy was performed and confirmed pancreatitis. Subsequent PET showed spontaneous recovery (data not shown)
Full size image
Peripheral vasculitis (Fig. 14).

69-year-old man with prior localization of melanoma on the trunk. Baseline images (MIP view and transaxial slice at the level of the descending aorta) are shown at baseline (A) and interim PET (B). Recurrent nodal disease in the right axillae and the right hilum can be seen. Interim PET, performed at the time the patient who had been treated with ICIs for 5 months, shows the appearance of a diffuse vasculitis pattern involving not only the thoracic aorta but also brachial and femoral arteries (including small-caliber arteries, black dotted arrows) but lack of response in axillary nodal disease
Full size image
Fasciitis (Fig. 15).
-
1.
TKI-induced Hemophagocytic lymphohistiocytosis (HLH): Not to be confused with a “banal” inversion of the liver to spleen ratio

55-year-old man with an unknown primary melanoma who had been treated with ICIs for 35 months (Pembrolizumab). 3D MIP view shows multiple intermuscular foci in the lower limbs (B, lower panel). Also noteworthy is a benign uptake in the right groin (B, black arrow) related to a right inguinal mesh repair (white arrow), not to be confounded with a recurrence in the area of the lymphadenectomy (white dotted arrow)
Full size image
HLH is related to an excessive immune activation leading to high fever, cytopenia, hepatosplenomegaly and multi-organ injury. HLH has been reported to induce an increased splenic uptake on 18F-FDG PET/CT greater than that observed during sepsis [37]. HLH can be observed during treatment with BRAF/MEK inhibitors, as shown in the case below (Fig. 16), and has also been reported in patients receiving ICIs.

68-year-old female with primary melanoma in the upper back (1 mm Breslow thickness, no ulceration, mitotic rate < one, no peri-neural or lymphovascular invasion) with negative sentinel node biopsy at diagnosis (5 years ago) who developed self-detected right axillary metastasis one year later (images not provided). Axillary nodal dissection demonstrated 1/9 lymph nodes involved with 8 mm deposit and 0.3 mm extra-nodal extension (stage IIIB) BRAF V600K. Started on ICI (Ipilimumab and Nivolumab) afterwards and developed multifocal acquired demyelinating sensory and motor neuropathy treated with steroids, plasmapheresis and rituximab. Surveillance 18F-FDG PET/CT (A) showed new small pulmonary nodules (not evident on MIP),red arrows axial fused image(G and H); which were confirmed to be metastatic melanoma on wedge resection. MRI brain also showed small new cerebral metastases (stage IV-M1b). Treatment subsequently changed to Dabrafenib and Trametinib, which was poorly tolerated with recurrent episodes of fever, myalgia and fatigue. Surveillance 18F-FDG PET/CT scans were performed 3 monthly afterwards; the 1st follow-up 18F-FDG PET/CT showed an enlarged spleen with multiple foci of moderately increased FDG uptake (red arrow — B). The treatment regimen changed to 4 days on and 3 days off; however, this was also poorly tolerated and the patient was switched to Encorafenib and binimetinib with subsequent scans showing a mild interval splenic enlargement and reversal of the spleen to liver activity (blue arrows – D,E). The patient remained in CMR on subsequent scan and reversal of spleen to hepatic activity normalised
Full size image
Bullous pemphigoid
Severe autoimmune skin involvement is an uncommon but recognized complication of ICI. Bullous pemphigoid is the most common of these (Fig. 17).

A: in this patient with multiple lung metastases identified at baseline evaluation, which were highly 18F-FDG-avid (B). ICI administration led to the development of widespread cutaneous lesions with associated axillary and inguinal nodal uptake apparent on 18F-FDG PET/CT. Biopsy confirmed bullous pemphigoid and the ICI therapy was ceased. Serial MIPs demonstrate resolution of the skin changes and nodal changes consistent with an inflammatory basis, but the progression of disease, as suggested already on both CT and PET at early evaluation
Full size image
Multiorgan irAEs including nephritis
Autoimmune renal pathologies are rare but important irAEs related to ICI treatment and normally diagnosed by routine laboratory testing but occasionally apparent on 18F-FDG PET/CT. Typical features are renal enlargement with increased renal parenchymal retention of tracer (Fig. 18).

69 year-old man with ulcerated right occipital scalp melanoma, 5 mm deep, mitotic rate of 4 with locoregional nodal metastasis in the right sub-occipital and cervical stations as well as biopsy proven distant metastatic disease in the liver demonstrated on 18F-FDG PET MIP (arrows, panel A). Following three cycles of combination ipilimumab and nivolumab presented to emergency department with acute kidney injury (serum creatinine rose from 0.8 mg/dL to 2.8 mg/dL) with progressive fatigue, generalized weakness and poor oral intake. 18F-FDG PET MIP (panel B) at 3 months showed resolution of all disease in the right neck and liver and development of FDG-avidity of multiple organs including diffuse parenchymal 18F-FDG uptake by both kidneys (panel C and D), diffuse FDG uptake in the pancreas (panel E and F), diffuse 18F-FDG uptake in the left lobe of the live (arrow heads, panel G and H), marked diffuse 18F-FDG uptake in the spleen (arrows, panel G and H) as well as bilateral axillary, iliac and inguinal lymphadenopathy (panel I an J) suggestive of, interstitial nephritis, pancreatitis, likely cholangitis and granulomatous disease, respectively. The patient discontinued ICIs and was treated with high dose corticosteroid and all findings resolved at 5 months follow-up with gradual improvement in serum creatinine (Panel K)
Full size image
Conclusion and perspectives
Technological improvements allow us to revisit clinical problems previously viewed as limitations of PET such as detection of in-transit disease, evaluation of small pulmonary nodules apparent on CT and detection of liver metastases in choroidal melanoma, but sometimes produce artefacts and pitfalls requiring a learning curve to be observed.
Knowledge of variants and treatment-related pitfalls is crucial to avoid misinterpretation. ICIs-related pitfalls should not be regarded as a drawback of PET imaging, as they actually reflect the unique capability of PET to perform whole-body imaging and capture signs of immune activation in addition to performing therapy monitoring.
In these times of COVID 19 pandemic, PET scheduling should probably be adapted not only within treatment constraints but also accommodate the vaccination scheme of melanoma patients to avoid false-positive results. Despite this, tricky situations may occur, such as differentiating active COVID-19 related lung involvement from immune-pneumonitis. In any case, PET reporting should be made with knowledge of clinical findings (if needed quick physical examination in the PET unit may be required), laboratory and correlative morphological imaging, and obviously, collaboration with the referring physician and discussion at tumour boards remains crucial for an efficient patient’s management.
Availability of data and materials
Not applicable.
Abbreviations
- TKI:
-
tyrosine kinase inhibitors
- ICIs:
-
immune checkpoint inhibitors
- irAEs :
-
immune-related adverse events
- UV:
-
ultraviolet
- DNA:
-
deoxyribonucleic acid
- PET:
-
positron emission tomography
- CT:
-
computed tomography
18F-FDG :-
Fluorodeoxyglucose
- MRI:
-
magnetic resonance imaging
- MIP:
-
maximum intensity projection
- EARL:
-
European association of nuclear medicine research limited
- HLH:
-
Hemophagocytic lymphohistiocytosis
References
-
Rastrelli M, Tropea S, Rossi CR, Alaibac M. Melanoma: epidemiology, risk factors, pathogenesis, diagnosis and classification. In vivo. 2014;28:1005–11.
PubMed
Google Scholar
-
Thoelke A, Willrodt S, Hauschild A, Schadendorf D. Primary Extracutaneous malignant melanoma: a comprehensive review with emphasis on treatment. Onkologie. 2004;27(5):492–9. https://doi.org/10.1159/000080372.
Article
CAS
PubMedGoogle Scholar
-
Papaspyrou G, Garbe C, Schadendorf D, Werner JA, Hauschild A, Egberts F. Mucosal melanomas of the head and neck: new aspects of the clinical outcome, molecular pathology, and treatment with C-kit inhibitors. Melanoma Res. 2011;21(6):475–82. https://doi.org/10.1097/CMR.0b013e32834b58cf.
Article
CAS
PubMedGoogle Scholar
-
Wöll E, Bedikian A, Legha SS. Uveal melanoma: natural history and treatment options for metastatic disease. Melanoma Res. 1999;9(6):575–81. https://doi.org/10.1097/00008390-199912000-00006.
Article
PubMedGoogle Scholar
-
Singh AD, Bergman L, Seregard S. Uveal Melanoma: Epidemiologic Aspects. Ophthalmol Clin N Am. 2005;18(1):75–84. https://doi.org/10.1016/j.ohc.2004.07.002.
Article
Google Scholar
-
Del Fiore P, Rastrelli M, Dall’Olmo L, Cavallin F, Cappellesso R, Vecchiato A, et al. Melanoma of unknown primary: evaluation of the characteristics, treatment strategies, prognostic factors in a monocentric retrospective study. Front Oncol. 2021;11:627527. https://doi.org/10.3389/fonc.2021.627527.
Article
PubMed
PubMed CentralGoogle Scholar
-
Grunhagen DJ, Brunstein F, Graveland WJ, van Geel AN, de Wilt JH, Eggermont AM. One hundred consecutive isolated limb perfusions with Tnf-alpha and Melphalan in melanoma patients with multiple in-transit metastases. Ann Surg. 2004;240(6):939–47. https://doi.org/10.1097/01.sla.0000146147.89667.ed.
Article
PubMed
PubMed CentralGoogle Scholar
-
Roses DF, Harris MN, Rigel D, Carrey Z, Friedman R, Kopf AW. Local and in-transit metastases following definitive excision for primary cutaneous malignant melanoma. Ann Surg. 1983;198(1):65–9. https://doi.org/10.1097/00000658-198307000-00013.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Nan Tie E, Na LH, Hicks RJ, Spillane J, Speakman D, Henderson MA, et al. The prognosis and natural history of in-transit melanoma metastases at a high-volume Centre. Ann Surg Oncol. 2019;26(13):4673–80. https://doi.org/10.1245/s10434-019-07965-w.
Article
PubMedGoogle Scholar
-
Patel JK, Didolkar MS, Pickren JW, Moore RH. Metastatic pattern of malignant melanoma. A study of 216 autopsy cases. Am J Surg. 1978;135(6):807–10. https://doi.org/10.1016/0002-9610(78)90171-x.
Article
CAS
PubMedGoogle Scholar
-
Barth A, Wanek LA, Morton DL. Prognostic factors in 1,521 melanoma patients with distant metastases. J Am Coll Surg. 1995;181(3):193–201.
CAS
PubMedGoogle Scholar
-
Meyer T, Merkel S, Goehl J, Hohenberger W. Surgical therapy for distant metastases of malignant melanoma. Cancer. 2000;89(9):1983–91. https://doi.org/10.1002/1097-0142(20001101)89:9<1983::aid-cncr15>3.3.co;2-j.
Article
CAS
PubMedGoogle Scholar
-
Rajpal S, Moore R, Karakousis CP. Survival in metastatic ocular melanoma. Cancer. 1983;52(2):334–6. https://doi.org/10.1002/1097-0142(19830715)52:2<334::aid-cncr2820520225>3.0.co;2-e.
Article
CAS
PubMedGoogle Scholar
-
Rietschel P, Panageas KS, Hanlon C, Patel A, Abramson DH, Chapman PB. Variates of survival in metastatic uveal melanoma. J Clin Oncol. 2005;23(31):8076–80. https://doi.org/10.1200/JCO.2005.02.6534.
Article
PubMedGoogle Scholar
-
Reinhardt MJ, Joe AY, Jaeger U, Huber A, Matthies A, Bucerius J, et al. Diagnostic performance of whole body dual modality 18F-FDG PET/CT imaging for N- and M-staging of malignant melanoma: experience with 250 consecutive patients. J Clin Oncol. 2006;24(7):1178–87. https://doi.org/10.1200/JCO.2005.03.5634.
Article
PubMedGoogle Scholar
-
Wong ANM, McArthur GA, Hofman MS, Hicks RJ. The advantages and challenges of using FDG PET/CT for response assessment in melanoma in the era of targeted agents and immunotherapy. Eur J Nucl Med Mol Imaging. 2017;44(S1):67–77. https://doi.org/10.1007/s00259-017-3691-7.
Article
PubMedGoogle Scholar
-
Aide N, Hicks RJ, Le Tourneau C, Lheureux S, Fanti S, Lopci E. FDG PET/CT for assessing tumour response to immunotherapy : report on the Eanm symposium on immune modulation and recent review of the literature. Eur J Nucl Med Mol Imaging. 2019;46(1):238–50. https://doi.org/10.1007/s00259-018-4171-4.
Article
PubMedGoogle Scholar
-
Iravani A, Osman MM, Weppler AM, Wallace R, Galligan A, Lasocki A, et al. FDG PET/CT for Tumoral and systemic immune response monitoring of advanced melanoma during first-line combination Ipilimumab and Nivolumab treatment. Eur J Nucl Med Mol Imaging. 2020;47(12):2776–86. https://doi.org/10.1007/s00259-020-04815-w.
Article
CAS
PubMedGoogle Scholar
-
Prigent K, Lasnon C, Ezine E, Janson M, Coudrais N, Joly E, et al. Assessing immune organs on (18)F-FDG PET/CT imaging for therapy monitoring of immune checkpoint inhibitors: inter-observer variability, prognostic value and evolution during the treatment course of melanoma patients. Eur J Nucl Med Mol Imaging. 2021;48(8):2573–85. https://doi.org/10.1007/s00259-020-05103-3.
Article
CAS
PubMedGoogle Scholar
-
Seban RD, Champion L, Schwartz LH, Dercle L. Spleen glucose metabolism on [(18)F]-FDG PET/CT: a dynamic double-edged biomarker predicting outcome in Cancer patients. Eur J Nucl Med Mol Imaging. 2021;48(8):2309–11. https://doi.org/10.1007/s00259-020-05126-w.
Article
PubMedGoogle Scholar
-
Seban RD, Moya-Plana A, Antonios L, Yeh R, Marabelle A, Deutsch E. Prognostic 18F-FDG PET biomarkers in metastatic mucosal and cutaneous melanoma treated with immune checkpoint inhibitors targeting PD-1 and CTLA-4. Eur J Nucl Med Mol Imaging. 2020;47(10):2301–12.
Article
CASGoogle Scholar
-
Seban RD, Nemer JS, Marabelle A, Yeh R, Deutsch E, Ammari S. Prognostic and Theranostic 18F-FDG PET Biomarkers for Anti-PD1 Immunotherapy in Metastatic Melanoma: Association with Outcome and Transcriptomics. Eur J Nucl Med Mol Imaging. 2019;46(11):2298–310.
Article
CASGoogle Scholar
-
Aide N, Lasnon C, Veit-Haibach P, Sera T, Sattler B, Boellaard R. Eanm/Earl harmonization strategies in pet quantification: from daily practice to multicentre oncological studies. Eur J Nucl Med Mol Imaging. 2017;44(S1):17–31. https://doi.org/10.1007/s00259-017-3740-2.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Zimmermann PA, Houdu B, Cesaire L, Nakouri I, De Pontville M, Lasnon C, et al. Revisiting detection of in-transit metastases in melanoma patients using digital (18)F-FDG PET/CT with small-voxel reconstruction. Ann Nucl Med. 2021;35(6):669–79. https://doi.org/10.1007/s12149-021-01608-5.
Article
CAS
PubMedGoogle Scholar
-
Liberini V, Messerli M, Husmann L, Kudura K, Grunig H, Maurer A, et al. Improved detection of in-transit metastases of malignant melanoma with Bsrem reconstruction in digital [(18)F] FDG PET/CT. Eur Radiol. 2021;31(10):8011–20. https://doi.org/10.1007/s00330-021-07852-7.
Article
PubMed
PubMed CentralGoogle Scholar
-
Beyer T, Bockisch A, Kühl H, Martinez MJ. Whole-body 18F-FDG PET/CT in the presence of truncation artifacts. J Nucl Med. 2006;47(1):91–9.
-
Dudoignon D, Pattison DA, Legallois D, Hicks RJ, Aide N. The utility of pharmacological and radiological interventions to optimize diagnostic information from PET/CT. Cancer Imaging. 2020;20(1):68. https://doi.org/10.1186/s40644-020-00344-9.
Article
PubMed
PubMed CentralGoogle Scholar
-
Hicks RJ, Iravani A, Sandhu S. 18F-Fluorodeoxyglucose Positron Emission Tomography/Computed Tomography for Assessing Tumor Response to Immunotherapy in Solid Tumors: Melanoma and Beyond. PET Clin. 2020;15:11–22. https://doi.org/10.1016/j.cpet.2019.08.007.
Article
PubMedGoogle Scholar
-
Prigent K, Aide N. 18F-Fludeoxyglucose Pet/Computed Tomography for Assessing Tumor Response to Immunotherapy and Detecting Immune-Related Side Effects: A Checklist for the Pet Reader. PET Clin. 2020;15:1–10. https://doi.org/10.1016/j.cpet.2019.08.006.
Article
PubMedGoogle Scholar
-
Steinberg J, Thomas A, Iravani A. 18F-Fluorodeoxyglucose PET/CT findings in a systemic inflammatory response syndrome after Covid-19 vaccine. Lancet. 2021;397:e9. https://doi.org/10.1016/S0140-6736(21)00464-5.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Shirone N, Shinkai T, Yamane T, Uto F, Yoshimura H, Tamai H, et al. Axillary lymph node accumulation on FDG-PET/CT after influenza vaccination. Ann Nucl Med. 2012;26(3):248–52. https://doi.org/10.1007/s12149-011-0568-x.
Article
PubMedGoogle Scholar
-
Eshet Y, Tau N, Alhoubani Y, Kanana N, Domachevsky L, Eifer M. Prevalence of increased FDG PET/CT axillary lymph node uptake beyond 6 weeks after Mrna Covid-19 vaccination. Radiology. 2021;210886(3):E345–7. https://doi.org/10.1148/radiol.2021210886.
Article
Google Scholar
-
Cohen D, Krauthammer SH, Wolf I, Even-Sapir E. Hypermetabolic lymphadenopathy following administration of Bnt162b2 Mrna Covid-19 vaccine: incidence assessed by [(18)F] FDG-PET/CT and relevance to study interpretation. Eur J Nucl Med Mol Imaging. 2021;48(6):1854–63. https://doi.org/10.1007/s00259-021-05314-2.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Aide N, Lasnon C, Kesner A, Levin CS, Buvat I, Iagaru A, et al. New pet technologies — embracing Progress and pushing the limits. Eur J Nucl Med Mol Imaging. 2021;48(9):2711–26. https://doi.org/10.1007/s00259-021-05390-4.
Article
PubMed
PubMed CentralGoogle Scholar
-
Czernin J, Fanti S, Meyer PT, Allen-Auerbach M, Hacker M, Sathekge M, et al. Nuclear medicine operations in the times of Covid-19: strategies, precautions, and experiences. J Nucl Med. 2020;61(5):626–9. https://doi.org/10.2967/jnumed.120.245738.
Article
CAS
PubMedGoogle Scholar
-
George J, Bajaj D, Sankaramangalam K, Yoo JW, Joshi NS, Gettinger S, et al. Incidence of pancreatitis with the use of immune checkpoint inhibitors (Ici) in advanced cancers: a systematic review and Meta-analysis. Pancreatology. 2019;19(4):587–94. https://doi.org/10.1016/j.pan.2019.04.015.
Article
CAS
PubMedGoogle Scholar
-
Ahn SS, Hwang SH, Jung SM, Lee SW, Park YB, Yun M, et al. The clinical utility of splenic fluorodeoxyglucose uptake for diagnosis and prognosis in patients with macrophage activation syndrome. Medicine (Baltimore). 2017;96:e7901. https://doi.org/10.1097/MD.0000000000007901.
Article
CASGoogle Scholar
Download references
Acknowledgements
The authors are grateful to the staff members of their PET units (secretaries, technologists, Radiopharmacists and Medical Physicists) and colleagues from tumour boards for fruitful discussions around the difficults cases presented in this review.
Author information
Authors and Affiliations
-
PET Centre, University Hospital, Service de Médecine Nucléaire, CHU de Caen, Avenue Côte de Nacre, 14000, Caen, France
Nicolas Aide & Kevin Prigent
-
Mallinckrodt Institute of Radiology, Washington University School of Medicine, Saint Louis, USA
Amir Iravani
-
Dermatology Department, University Hospital, Caen, France
Diane Kottler
-
Peter MacCallum Cancer Institute, Melbourne, Australia
Ramin Alipour & Rodney J. Hicks
-
The Sir Peter MacCallum Department of Oncology, University of Melbourne, Melbourne, Australia
Rodney J. Hicks
Authors
- Nicolas Aide
You can also search for this author in
PubMed Google Scholar - Amir Iravani
You can also search for this author in
PubMed Google Scholar - Kevin Prigent
You can also search for this author in
PubMed Google Scholar - Diane Kottler
You can also search for this author in
PubMed Google Scholar - Ramin Alipour
You can also search for this author in
PubMed Google Scholar - Rodney J. Hicks
You can also search for this author in
PubMed Google Scholar
Contributions
NA: cases collection, manuscript writing, AI: cases collection, manuscript writing, KP: cases collection, DK: manuscript writing, RA: cases collection, manuscript writing, RJH: cases collection, manuscript writing. All authors read and approved the final version of the manuscript.
Corresponding author
Correspondence to
Nicolas Aide.
Ethics declarations
Ethics approval and consent to participate
cases from the Peter MacCallum Cancer Centre Ethics Committee approval number 17/231R. Due to retrospective nature of the study and no intervention the consent from the individuals were waived. Cases from the Caen University Hospital: French observational studies without any additional therapy or monitoring procedure do not need the approval of an ethics committee. Notheless, in accordance with the European General Data Protection Regulation, we sought approval to collect data for this work from the national committee for data privacy, with the registration no. 2081250 v 0.
Consent for publication
Cases from the Peter MacCallum Cancer Centre: waived or covered by pre-existing consent provided within various clinical trials in which individual patients were enrolled. Cases from the Caen University Hospital: all patients refered to the PET unit receive written information for the use of anonymised images from their examinations for teaching and research purposes and may opt out.
Competing interests
Professor Hicks is the Co-Editor-in-Chief of Cancer Imaging but had no role in assigning reviewers or any other aspect of the review process. For other authors there are none to disclose.
Additional information
Publisher’s Note
Springer Nature remains neutral with regard to jurisdictional claims in published maps and institutional affiliations.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Aide, N., Iravani, A., Prigent, K. et al. PET/CT variants and pitfalls in malignant melanoma.
Cancer Imaging 22, 3 (2022). https://doi.org/10.1186/s40644-021-00440-4
Download citation
-
Received: 23 September 2021
-
Accepted: 05 December 2021
-
Published: 04 January 2022
-
DOI: https://doi.org/10.1186/s40644-021-00440-4
Keywords
- Melanoma
- Pitfalls, variants
- FDG
- PET
- Immunotherapy
- PET technology
- COVID19
Рак легкого является ведущей причиной смерти от рака во всем мире и обусловливает 1,59 миллионов смертей в год. Несмотря на прогресс, достигнутый в лечении пациентов, страдающих этой болезнью, пятилетняя выживаемость все еще остается невысокой, составляя приблизительно 15–16%. Основным фактором риска развития рака является табакокурение, повышающим вероятность его возникновения более чем в десять раз по сравнению с некурящими людьми. Другими состояниями, при которых повышен развития новообразования, являются идиопатический легочный фиброз и воздействие канцерогенов, например, асбеста.
Правильное определение стадии является крайне важным и необходимым моментом, позволяющим правильно спланировать лечение и оценить выживаемость. У больных раком легких является методом выбора при определении стадии опухоли, более эффективным, чем другие лучевые методы, такие как КТ или рентгенография. Благодаря возможности одновременной оценки анатомических и функциональных изменений, ПЭТ-КТ позволяет добиться большей точности по сравнению с ПЭТ и КТ в отдельности.
Этот метод диагностики позволяет более четко определить первичную опухоль, отличить опухолевую ткань от участков ателектаза и фиброзных изменений, расположенных рядом. Доказана высокая эффективность в оценке состояния лимфоузлов, а также обнаружения отдаленных метастазов. Также была подтверждена ценность этого метода как инструмента прогнозирования выживаемости путем оценки метаболизма в опухоли при первичном исследовании и в определении раннего (промежуточного) и завершающего ответа на химиотерапию. В последних литературных источниках этот метод был упомянут как рекомендуемый с экономической точки зрения.
Содержание
- Что такое ПЭТ-КТ?
- Стадии рака легкого
- Варианты рака легкого
- Визуализация первичной опухоли: Т-стадия
- ПЭТ-КТ лимфоузлов: N-стадия
- Оценка метастазов: M-стадия
- Второе мнение по ПЭТ-КТ
- Стадирование метастазов в головной мозг
- Одновременное присутствие легочной и внелегочной опухоли
- ПЭТ-КТ: планирование лучевой терапии
- Контроль лечения и прогноз рака легкого
- Метаболический синдром — симптомы и лечение
- Определение болезни. Причины заболевания
- Симптомы метаболического синдрома
- Патогенез метаболического синдрома
- Классификация и стадии развития метаболического синдрома
- Осложнения метаболического синдрома
- Диагностика метаболического синдрома
Что такое ПЭТ-КТ?
ПЭТ-КТ является комбинированным методом визуализации, позволяющим совместить информацию об анатомических изменениях, полученную с помощью КТ, и данные об изменениях метаболизма, полученные при использовании ПЭТ; при этом исследовании существует возможность просмотра данных методов по отдельности, либо при наложении друг на друга на трехмерных реконструкциях или плоских (двухмерных) срезах. Чаще всего применяется радиофармпрепарат F18-фтордезоксиглюкова (ФДГ), использование которого позволяет обнаружить как первичную опухоль, так и метастазы. Это происходит потому, что большинство патологических очагов злокачественной природы в легких захватывают глюкозу, и видны на сканах в виде ярких участков. При ПЭТ-КТ обычно не используются йодсодержащие контрастные средства, в то же время возможно дополнительное КТ-сканирование с применением контрастных веществ. Использование йодсодержащего контрастного вещества улучшает визуализацию сосудов средостения и позволяет лучше определить их отношение к опухоли, помогает также оценить средостение и плевру, дает возможность исключить сопутствующую тромбоэмболию легочной артерии (если была выполнена КТ-ангиопульмонография).
Стадии рака легкого
В первичном обследовании пациента, страдающего раком легкого, должны принимать участие несколько специалистов: опытный рентгенолог, специалист по ядерной медицине (радионуклидным методам — сцинтиграфии и ПЭТ), рентгенохирург (специалист в области интервенционной радиологии), пульмонолог, торакальный хирург; необходимо также использовать точные и экономически эффективные методы диагностики. Существующие на данный момент руководства содержат рекомендации, что методы нужно выполнять любому пациенту, у которого имеется высокий риск рака, предпочтительно с выполнением гистологического исследования и взятием образцов ткани. Это позволяет не только установить точный гистологический вариант опухоли, но и правильно стадировать заболевание. Во многих случаях предпочтительнее выполнить биопсию подозрительных лимфоузлов средостения, а не первичной опухоли, что позволяет лучше оценить стадию (например, при биопсии лимофузла с выполнением ПЭТ ставится стадия T2N2, в то время как без ее использования – T2Nx). Кроме того, для опухолей, осложненных обструктивной пневмонией, и образований с выраженными некротическими изменениями, данные играют важную роль для определения области биопсии.
Опухоль левого легкого с частичным некрозом и деструкцией ребер. Визуализируются два метастаза в подключичных лимфоузлах и в мышцах (стрелки), которые на КТ не видны. Необходимо выполнить трансторакальную биопсию той части опухоли, которая расположена в периферических отделах, чтобы получить образец жизнеспособных тканей.
Варианты рака легкого
В 85–95% случаев рак легкого является немелкоклеточным и представляет собой аденокарциному, плоскоклеточный рак или крупноклеточный рак. Аденокарцинома может возникать как у курящих, так и некурящих пациентов; обычно представляет собой периферическую опухоль; рано дает отдаленные метастазы. Степень захвата аденокарциномой F18-ФДГ имеет тенденцию быть ниже по сравнению с опухолями иного гистологического строения; некоторые опухоли, характеризующиеся низким уровнем метаболизма глюкозы, могут обуславливать ложноотрицательный результат.
Плоскоклеточный рак тесно связан с курением, в большинстве случаев является центральным. Крупноклеточный рак обычно представляет собой периферическое объемное образование в легочной ткани большого размера с наличием метастазов на момент установления диагноза. Крупноклеточный и плоскоклеточный рак характеризуются повышенным накоплением F18-ФДГ. Стадирование немелкоклеточного рака легкого осуществляется в соответствии со шкалой TNM; таким образом, информация о стадии заболевания дает возможность планирования лечения и прогнозирования выживаемости.
Остальные 10–15% случаев обусловлены мелкоклеточным раком, биологически более агрессивным, при котором стадирование, лечение и прогноз отличаются от таковых при немелкоклеточном раке. Этот тип рака очень тесно связан с курением. Выделяют две стадии заболевания: ограниченную, при которой опухоль располагается в половине грудной клетки на стороне поражения, в том числе в средостении и ипсилатеральной надключичной области; и распространенную, когда опухоль распространяется за пределы одной половины грудной клетки. Поскольку мелкоклеточный рак легочной ткани в корне отличается от немелкоклеточного, его диагностика при помощи будет обсуждаться в специально отведенной главе в конце этой статьи.
Визуализация первичной опухоли: Т-стадия
С помощью КТ можно достоверно оценить размер опухоли практически во всех случаях. Тем не менее, при наличии обусловленных опухолью осложнений, например, ателектаза легкого или обструктивной пневмонии, истинный размер первичной опухоли оценить сложнее. Позволяет отличить паренхиму спавшегося участка легочной ткани от злокачественной опухоли, т. к. опухоль характеризуется интенсивным захватом ФДГ, а спавшееся легкое — нет. Также он помогает оценить опухолевую инвазию (прорастание) в плевру и средостение. Накопление плеврой ФДГ всегда является патологическим, и при наличии новообразования органов дыхания крайне подозрительно на метастатическое поражение. При прорастании опухоли в средостение необходимо выполнять КТ с внутривенным введением йодсодержащего контрастного вещества с целью определения взаимоотношения опухоли, крупных кровеносных сосудов и перикарда.
Интенсивный захват ФДГ первичной опухолью обусловлен ее биологическим типом и степенью «агрессивности» опухолевых клеток; повышенный захват ФДГ может становиться прогностическим фактором рецидива. В исследовании Kim et al. была продемонстрирована группа пациентов, подвергшихся оперативному вмешательству по поводу новообразований легких, у которых при патологическом исследовании была установлена стадия N0. У пациентов, у которых возник рецидив опухоли, максимальный стандартизированный уровень накопления (SUV max) первичной опухолью легкого был выше, чем у пациентов, у которых рецидива не было. Пороговое значение SUV max, отделяющее пациентов с высоким уровнем рецидива, было определено равным 6,9. Было также сделано заключение, что для пациентов высокой группы риска по развитию рецидива предпочтительна изначально более «агрессивная» терапия. Таким образом, помогает точно спрогнозировать, как будет вести себя опухоль после лечения.
ПЭТ-КТ лимфоузлов: N-стадия
С помощью ПЭТ можно обнаружить метастатическое поражение лимфоузлов корней легких и средостения лучше, чем с помощью любого другого метода, так как метаболически активные лимфоузлы при ПЭТ-КТ, даже малого размера, характеризуются повышенным захватом ФДГ. Это справедливо и для тех случаев, когда морфологические признаки злокачественного поражения узлов могут не обнаруживаться на КТ-изображениях. Также метод позволяет оценить увеличенные лимфоузлы, не накапливающие или минимально накапливающие радиофармпрепарат, которые часто носят реактивный характер или отражают остаточные изменения в отсутствие опухолевого поражения. При определении стадии N чувствительность составляет 81% против 61% у КТ, и специфичность 90%, в то время как КТ характеризуется специфичностью 79%.
Наибольшее преимущество в оценке средостения — это возможность исключить злокачественное поражение любого лимфоузла с высокой степенью точности. То есть, отсутствие интенсивного захвата ФДГ лимфоузлом достоверно говорит об истинном отсутствии метастазов (прогностическое значение отрицательного результата равно 99%). В то же время не все лимфоузлы средостения, характеризующиеся повышенным метаболизмом, обязательно являются злокачественными; ложноположительный результат может быть обусловлен воспалительными изменениями. Это объясняет, почему изменения со стороны средостения должны оцениваться количественно с использованием SUV (стандартизированного уровня накопления). Пороговое значение SUV max в пределах 4,0–5,3 позволяет рассматривать изменения со стороны лимфоузлов средостения как положительные (то есть, метастатическое поражение есть).
Лучшее картирование лимфоузлов средостения позволяет избежать медиастиноскопии, ограничившись трансбронхиальной игольной аспирацией под контролем УЗИ, особенно в труднодоступных областях, таких как аортопульмональное окно или область, находящаяся позади бифуркации трахеи.
Особенное значение в стадировании поражения лимфатических узлов имеет на ранних стадиях заболевания (I и II), что позволяет избежать ненужной торакотомии.
Оценка метастазов: M-стадия
У 40–50% пациентов, страдающих раком органов дыхания, в момент установления диагноза присутствуют метастазы. Наличие отдаленных метастазов в корне меняет план лечения этих пациентов, делая оперативное вмешательство намного более сложным, что приводит к гораздо более неблагоприятному прогнозу. ПЭТ-КТ имеет неоспоримые преимущества в диагностике метастазов по сравнению с традиционными методами исследования, особенно в случаях одновременного метастатического поражения множества органов, часто без какой-то определенной локализации вследствие диссеминации процесса. Повышенное накопление ФДГ в метастазах рака легкого и возможность исследования всего тела делают методом выбора при выявлении метастазов (вне головного мозга). Также метод позволяет выявить отдаленные метастазы, о которых до проведения исследования ничего не было известно, вплоть до 30% всех случаев.
Читайте также: Ранняя диагностика рака. Памятка от врача-онколога какой анализ показывает онкологию в организме
Самые частые вторичные изменения при раке легкого – метастазы в кости, которые имеют место у 8–27% пациентов на момент установления диагноза. Вторичные изменения костей лучше обнаруживаются при помощи ПЭТ, чем при использовании других методов диагностики. Так, больше чем в половине случаев костных метастазов поражается только костный мозг и не происходит существенного нарушения костной структуры, из-за чего при помощи рентгенографии и КТ их не удается обнаружить, и даже сцинтиграфия скелета с использованием метилендифосфоната Tc-99m оказывается малоспецифичной при обнаружении этого типа поражений. Метастазы в кости могут иметь исключительно литический характер и интенсивно накапливать ФДГ, но в то же время гиперфиксация препарата в очагах поражения может и не определяться.
Типы метастазов в кости при раке легкого. (a) Остеобластический. (b) Остеолитический. (c) Смешанный. (d) Поражение костного мозга.
У пациентов, страдающих раком легкого, часто возникают метастазы в органы брюшной полости. Чаще всего поражаются печень и надпочечники. Поскольку также могут встречаться доброкачественные изменения печени и надпочечников, необходимо использовать диагностические методы, позволяющие распознать их и отличить от метастазов. В случаях изменений со стороны надпочечников, умеренное или выраженное накопление ФДГ обладает высокой прогностической ценностью положительного результата для метастазов. Чувствительность и специфичность ПЭТ с использованием SUV (стандартизированного уровня накопления) в целом в популяции составляет 87% и 87%, в то время как у пациентов с раком легкого 94% и 82% соответственно. Лучшим пороговым значением SUV max, позволяющим дифференцировать злокачественные и доброкачественные поражения, по-видимому, является 2,5.
В случаях метастазов в печень, практически все доброкачественные поражения (кисты, гемангиомы, фокальная нодулярная гиперплазия) характеризуются меньшим или идентичным по сравнению с паренхимой печени уровнем накопления ФДГ. Любой узел, любые объемные образования, накапливающие ФДГ интенсивнее, чем нормальная паренхима печени, крайне подозрительны на злокачественные изменения.
Метастазы в печени при аденокарциноме правого легкого. Определяется один метастаз в печени, который не виден на КТ с контрастным усилением.
Для обнаружения метастазов в надпочечники, почки и кости, в случаях, когда невозможно проведение, приемлемой альтернативой является МРТ всего тела с выполнением программы DWI. Позволяет оценить метастазы в областях, изменения в которых не стадируются при традиционных методах диагностики, например, в коже, скелетных мышцах, мягких тканях, поджелудочной железе, почках.
Второе мнение по ПЭТ-КТ
Необходимым условием достоверного определения стадии злокачественного новообразования является правильная оценка результатов ПЭТ-исследования. При неоднозначных или противоречивых результатах рекомендуется получить второе мнение специализированного радиолога. Повторный экспертный анализ исследования в профильном центре позволяет избежать ошибки интерпретации снимков, сделать более обоснованные выводы о стадии процесса, наличии или отсутствии метастазов, вторичных очагов в лимфатических узлов. Это исключительно важно и планировании тактики операции, химио- и лучевого лечения.
Стадирование метастазов в головной мозг
Даже несмотря на то, что вторичные изменения головного мозга не так часто встречаются у пациентов с раковыми опухолями легких, они имеют большое значение, поскольку их наличие приводит к высокому уровню заболеваемости и смертности, чего в некоторых случаях можно избежать или минимизировать путем подбора соответствующего лечения. Поскольку головной мозг характеризуется высоким базовым метаболизмом глюкозы, вторичные очаги в нем могут быть замаскированы, а чувствительность ПЭТ-исследования в обнаружении метастазов – ограничена. В связи с этим, в соответствии с существующими на данный момент протоколами рекомендуется дополнительное использование МРТ. В случаях, когда провести МРТ невозможно, можно сделать КТ с внутривенным контрастным усилением. Это дает схожие результаты с МРТ головного мозга.
Одновременное присутствие легочной и внелегочной опухоли
У 1–8% пациентов, страдающих раком легкого, на момент установления диагноза обнаруживается рак иной локализации. Большинство этих новообразований также тесно связаны с табакокурением. И, действительно, у 6,5% хронических курильщиков, которым была выставлена та или иная стадия рака любого типа, на момент установления диагноза обнаруживался одновременно существующий рак других органов и систем.
В случаях множественного рака используемые диагностические критерии являются следующими:
- Оба очага гистологически различны.
- Гистологический тип один и тот же, но нет поражения лимфоузлов и экстраторакальных метастазов.
На основании этих критериев, частота синхронного множественного рака легкого, описанная в литературе, составляет 0,5–3,3%. Наиболее часто одновременно существующие раковые опухоли, обнаруживаемые у пациентов, страдающих раком легкого, располагается в молочных железах, в голове и шее, пищеводе и щитовидной железе. Более чем 80% этих синхронных поражений обнаруживаются на ранней стадии, что предполагает возможность лечения, устраняющего причину заболевания. Тем не менее, возможность лечения в значительной степени зависит от того, насколько далеко зашла раковая опухоль на момент установления диагноза.
ПЭТ-КТ: планирование лучевой терапии
Возможность ПЭТ различить метаболически активную ткань опухоли от ателектаза, обструктивной пневмонии или фиброзных изменений имеет решающее значение в определении объема опухоли. Это очень полезно при планировании лучевой терапии, так как позволяет скорректировать форму и размер облучаемого объема тканей и уменьшить степень облучения непораженных опухолью органов (например, пищевода, сердца, спинного мозга), находящихся вблизи опухоли. Кроме того, использование ПЭТ значительно изменяет поле облучения по сравнению с КТ. Так, использование ПЭТ в дополнение к традиционным методам диагностики приводило к изменению объема облучаемых тканей более чем у 20% пациентов, и изменение стадии происходило в 20–50% случаев. В различных источниках описывается, что изменения планируемого целевого объема достигают 50% у пациентов с немелкоклеточным раком.
Контроль лечения и прогноз рака легкого
Наиболее важный прогностический фактор опухоли, подвергаемой хирургическому лечению — это степень ее диссеминации на время установления диагноза. В случает отсутствия метастазов пятилетняя выживаемость равна 57–67%; в случае вторичного поражения лимфоузлов ворот легкого — 47% , при поражении лимфоузлов средостения на стороне, противоположной опухоли — 23%. Обнаружение отдаленных метастазов является одним из основных критериев невозможности удаления опухоли хирургическим путем. Ввиду важности изложенных фактов особое значение принимает второе мнение по ПЭТ.
Метаболический синдром — симптомы и лечение
Что такое метаболический синдром? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чернышев А. В., кардиолога со стажем в 33 года.
Над статьей доктора Чернышев А. В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Метаболический синдром (синдром Reaven) представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, инсулинорезистентность, гипергликемию (повышенное содержание глюкозы в крови), дислипидемию и артериальную гипертензию. Все эти нарушения связаны в одну патогенетическую цепь. Кроме того, такой синдром часто сочетается с гиперурикемией (избытком мочевой кислоты в крови), нарушением гемостаза (свёртываемости крови), субклиническим воспалением, синдромом обструктивного апноэ-гипопноэ сна (остановкой дыхания во сне). [4]
Метаболический синдром – хроническое, распространённое (до 35% в российской популяции), полиэтиологическое заболевание (возникающее по многим причинам), в котором главная роль принадлежит поведенческим факторам (гиподинамия, нерациональное питание, стресс). Имеет значение также наследственная предрасположенность к артериальной гипертензии, атеросклероззависимым заболеваниям и сахарному диабету второго типа. [5]
Практикующим врачам важно выделять группу риска метаболического синдрома. К данной группе относятся пациенты с начальными признаками заболевания и его осложнениями: артериальная гипертензия, углеводные изменения, ожирение и повышенное питание, ишемическая болезнь сердца, атеросклеротические заболевания периферических и мозговых артерий, нарушение пуринового обмена, жировая болезнь печени; синдром поликистозных яичников; постменопаузальный период у женщин и эректильная дисфункция у мужчин; гиподинамия, злоупотребление алкоголем, табакокурение, наследственная отягощенность по сердечно-сосудистым и обменным заболеваниям. [3] [7]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы метаболического синдрома
Клинические проявления метаболического синдрома соответствуют симптомам его составляющих:
- абдоминального ожирения;
- артериальной гипертензии;
- изменениям углеводного, липидного и пуринового обмена.
Если изменения составляющих синдрома Reaven носят субклинический характер (что встречается довольно часто), то и течение заболевания носит асимптомный характер.
Патогенез метаболического синдрома
Инсулинорезистентность — первопричина развития метаболического синдрома. Представляет собой нарушение утилизации глюкозы в органах-мишенях (поперечнополосатой мускулатуре, липоцитах и печени), связанное с дисфункцией инсулина. Инсулинорезистентность уменьшает усвоение и поступление в клетки скелетной мускулатуры глюкозы; стимулирует липолиз и гликогенолиз, что приводит к липидным и углеводным патологическим изменениям. Кроме того, инсулинорезистентность усиливает секрецию инсулина, в результате чего возникает компенсаторная гиперинсулинемия и активация эндокринных систем (симпатоадреналовой, ренин-ангиотензин-альдостероновой) с формированием артериальной гипертензии, дальнейшим нарушением метаболических процессов, гиперкоагуляции, субклинического воспаления, дисфункции эндотелия и атерогенеза. Эти изменения, в свою очередь, способствуют усилению инсулинорезистентности, стимулируя патогенетический «порочный круг».
Читайте также: Диета при аденоме простаты у мужчин Список продуктов можно ли пить минеральную воду при онкологии.
Классификация и стадии развития метаболического синдрома
Чёткой классификации и стадийности метаболического синдрома не существует. Его деление некоторыми авторами на полный, включающий все составляющие синдрома, и неполный представляется необоснованным. Несмотря на это, выраженность симптомов, количество компонентов синдрома Reaven и наличие осложнений оказывают влияние на стратификацию риска и выбор тактики лечения у конкретного пациента. Для этого следует учитывать:
- степень ожирения и артериальной гипертензии;
- выраженность метаболических изменений;
- наличие или отсутствие сахарного диабета и заболеваний, связанных с атеросклерозом.
В зависимости от индекса массы тела (ИМТ), который рассчитывается делением веса (кг) на рост (м 2 ), классифицируются следующие типы массы тела (МТ):
- нормальная МТ — ИМТ ≥18,5
- избыточная МТ — ≥25
- ожирение I степени — ≥30
- ожирение II степени — ≥35
- ожирение III степени — ≥40.
Важную роль играет распределение жировой ткани. Различают два типа ожирения:
- гиноидный (по типу «груша»), когда избыточная жировая ткань распределяется преимущественно на бёдрах и ягодицах;
- андроидный (по типу «яблоко»; абдоминальное ожирение), с преимущественной локализацией жира в области верхней половины тела (живот, грудь, плечи, спина).
Второй тип ожирения является более патогенным в плане риска возникновения сердечно-сосудистых заболеваний и сахарного диабета. Это связано с ожирением внутренних органов, в том числе печени (висцеральное ожирение, неалкогольная жировая болезнь печени), снижением сатурации крови кислородом из-за перехода дыхания на грудной, поверхностный тип и эндокринной активностью висцеральной жировой ткани с патологическим изменением выработки адипокинов (лептин, грелин, адипонектин). Выявлена чёткая корреляция между увеличением абдоминальной жировой ткани и индекса массы тела с риском сопутствующих заболеваний. Считается, что риски начинают нарастать при увеличении окружности талии (ОТ) >80 см у женщин и 94 см у мужчин, а при ОТ >88 см и 102 см соответственно риск возрастает значительно.
Ещё один важный компонент метаболического синдрома — артериальная гипертензия, которая может носить вторичный характер. Нормальным считается систолическое артериальное давление (САД) 120-129 мм рт.ст и диастолическое артериальное давление (ДАД) 80-84 мм рт.ст. САД
- 1 ст. – САД 140-159, ДАД 90-99;
- 2 ст. — САД 160-179, ДАД 100-109;
- 3 ст. — САД ≥180, ДАД ≥110.
Повышение артериального давления характеризуется повышением риска сердечно-сосудистых событий.
Для метаболического синдрома характерны также изменения липидного обмена, которые классифицированы в таблице ниже (в ммоль/л).
Параметры
| ОХ | ≤5,5 | ≤5 | ≤4,5 | ≤4 |
| ХС-ЛПНП | ≤3,5 | ≤3 | ≤2,5 | ≤1,8 |
| ХС-ЛПВП | муж. >1 жен. >1,2 |
муж. >1 жен. >1,2 |
муж. >1 жен. >1,2 |
муж. >1 жен. >1,2 |
| Триглицериды | ≤1,7 | ≤1,7 | ≤1,7 | ≤1,7 |
| ХС не-ЛПВП |
≤4,3 | ≤3,8 | ≤3,3 | ≤2,6 |
| Примечание: ОХ — общий холестерин; ХС-ЛПНП — холестерин липопротеинов низкой плотности; ХС-ЛПВП — холестерин липопротеинов высокой плотности; ХС не-ЛПВП — холестерин, не связанный с липопротеинами высокой плотности. |
липидовРискнизкийРискумеренныйРисквысокийРиск оченьвысокий
Осложнения метаболического синдрома
Так как метаболический синдром является сочетанием факторов риска сердечно-сосудистых и обменных заболеваний, именно эти патологии и являются его осложнениями. Речь идёт, в первую очередь, о сахарном диабете, ишемической болезни сердца и их осложнениях: диабетическая ангио-, нейро- и нефропатия, острая коронарная недостаточность, сердечная недостаточность, нарушение сердечного ритма и проводимости, внезапная сердечная смерть, цереброваскулярные заболевания и болезни периферических артерий. [17] Прогрессирование артериальной гипертензии также приводит к поражению органов-мишеней и ассоциированным клиническим состояниям.
Диагностика метаболического синдрома
Для диагностики метаболического синдрома необходимо выявить у пациента основной признак — абдоминальное ожирение по измерению ОТ (>80 см у женщин и >94 см у мужчин) и хотя бы два дополнительных критерия, которые включают в себя:
- артериальную гипертензию (артериальное давление ≥140/90 мм рт.ст.);
- липидные показатели (ммоль/л) — повышение концентрации в крови триглицеридов ≥1,7; снижение ХС ЛПВП 3,0;
- углеводные показатели (ммоль/л) — гипергликемия натощак ≥6,1 и НТГ 7,8 – 11,1. [8]
В клинических условиях нужно дифференцировать метаболический синдром от механического сочетания факторов риска, например артериальной гипертензии, избыточной массы тела без признаков абдоминального ожирения и повышения уровня ОХ крови, что встречается довольно часто (до 30%). В сомнительных случаях рекомендовано дополнительное определение инсулинорезистентности по следующим методикам:
- оценка базальной гиперинсулинемии в крови натощак (гиперинсулинемия — >18 мкед/мл);
- показатель HOMA-IR — произведение значения инсулина натощак (мкед/мл) на величину глюкозы (ммоль/л), разделить на 22,5 (значение большее, чем 2,27, считается инсулинорезистентностью);
- индекс Caro — соотношение тощаковой глюкозы (в ммоль/л) к инсулину (в мкед/мл) (инсулинорезистентность – значение Читайте также: Анализ крови общий биохимический иммунологический гармональный при онкологии какие показатели крови