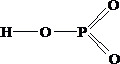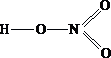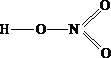Квантовые числа
- Форма обитали отражается квантовым числом
- Ориентацию орбитали в пространстве около ядра отражает квантовое число
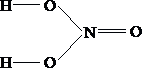
- Ошибочной является электронная формула
- Электронная формула атома хлора в основном состоянии
- В соответствии с правилом Клечковского после подуровня 3d должен заполняться подуровень
- В соответствии с правилом Гунда число непарных электронов на продуровне 3d7
- Валентный слой атома алюминия в основном состоянии
- В соответствии с правилом Клечковского после подуровня 4f должен заполняться подуровень
- В соответствии с принципом Паули максимальное число электронов на р подуровне
- Магнитное квантовое число при l=1 может принимать значения
Водородный показатель
- Водородный показатель отражает:
- Установите соответствие между названием вещества и значение рН в его водном растворе. А) гидроксид натрия Б) серная кислота В) хлороводород Г) калиевая щёлочь
- В водном растворе азотной кислоты присутствуют ионы водорода, обусловливающие кислую среду с значением рН ….. 7
- В водном растворе бромоводорода присутствуют ионы водорода, обусловливающие кислую среду с значением рН ….. 7
- В водном растворе гидроксида аммония присутствуют гидроксид ионы, обусловливающие щелочную среду с значением рН …. 7.
- Концентрация ионов водорода в растворе с значением рН=3 составляет в …. моль/л
- Концентрация ионов водорода в водном растворе равна 0,05 моль/л. рН этого раствора равно
- рН раствора, каждый литр которого содержит 8 г гидроксида натрия, равен
Гидролиз солей
- Гидролизу по катиону подвергается
- Гидролизу по аниону подвергается
- Гидролизу не подвергается
- Гидролизу по катиону и аниону подвергается
- Кислую среду имеет раствор
- Щелочную среду имеет раствор
- Нейтральная среда в растворе
- Для усиления гидролиза FeCl3 в его водном растворе необходимо
- При медленном добавлении раствора карбоната натрия к раствору нитрата магния в результате взаимного усиления гидролиза солей образуются продукты
- Гидролиз невозможен для следующих соединений
Смещение химического равновесия
- В системе 2HBr⇆H2+Br2 – Q увеличение концентрации водорода сместит равновесие
- В системе 2HgO(к) ⇆ 2Hg(к)+O2(г) – Q для смещения равновесия вправо, необходимо
- Выберите уравнение реакции, в которой изменение давления не приведет к смещению равновесия
- Гомогенная реакция, в которой все вещества газообразны CO2 + 2SO3 ⇄CS2 + 4O2 – Q. Равновесие в этой системе сместится влево (←) при:
- Для равновесной системы CO2(г)+H2(г) ⇆CO(г)+H2O(г) – Q содержание СО можно увеличить при:
- Для смещения равновесия в системе S(тв)+H2(г) ⇆H2S(г), ∆H=-21 кДж в сторону образования сероводорода необходимо
- Для увеличения выхода продуктов реакции 2Pb(NO3)2(тв) ⇆ 2PbO(тв)+4NO2(г)+O2(г), ∆H>0 необходимо
- На смещение химического равновесия не влияет …
- Повышение давления вызовет смещение равновесия в реакции вправо
- Повышение давления и понижение температуры вызовут смещение равновесия в одну сторону в реакции:
Скорость химических реакций
- Для увеличения скорости реакции в 16 раз (температурный коэффициент равен 4), температуру следует повысить на:
- Зависимость скорости химической реакции от температуры определяют, используя уравнение
- При повышении температуры на 30 °C скорость реакции увеличилась в 8 раз. Температурный коэффициент скорости реакции равен:
- С ростом температуры возрастает скорость реакций
- Катализатор ускоряет химическую реакцию вследствие:
- Основным фактором, определяющим возможность протекания реакции при столкновении частиц, является:
- При прочих равных условиях медленнее идет реакция c
- C наибольшей скоростью реагирует с водородом:
- В сосуде находятся два газа – А и В, реагирующие с образованием твердого продукта АВ. При повышении давления в 2 раза скорость реакции
- Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует:
Химическая связь
- Атомы соединены ионной связью в веществе
- Атомы соединены ковалентной полярной связью в веществе
- Атомы соединены ковалентной неполярной связью в веществе
- Число σ-связей в молекуле серной кислоты равно
- Число π-связей в угольной кислоте равно
- В молекуле СО2 атом углерода находится в состоянии гибридизации
- Наиболее полярная связь в молекуле
- В состоянии возбуждения атом хлора находится в молекуле
- Число общих электронных пар в молекуле азота равно
- Октет электронов на внешнем слое атома серы в веществе
Ионный обмен
- Осадок хлорида серебра выпадает при добавлении раствора нитрата серебра к раствору
- В результате взаимодействия хлорида аммония с гидроксидом кальция при нагревании образуется
- Слабый электролит образуется в реакции
- Молярная масса осадка, образовавшегося в результате взаимодействия нитрата свинца с сульфатом алюминия равна [[1]]
- Пары ионов, которые не могут находиться совместно в водном растворе
- Выберите реакцию с образованием осадка
- Сокращённому ионно-молекулярному уравнению S2- + Ni2+ = NiS↓ соответствует реакция между
- Газ образуется в результате реакции
- Сокращённое ионно-молекулярное уравнение для реакции между сульфатом железа (II) гидроксидом натрия имеет вид
- Газ будет выделяться при взаимодействии карбоната натрия с
тест
«Строение атома»
Вопрос:
Укажите
квантовое число, характеризующее размер
электронного облака:
1.
главное
2.
орбитальное
3.
магнитное
4.
спиновое
Ответ: 1
Правильно!
Вопрос:
Укажите
расположение подуровней 3d 4f 5s 6p в порядке
возрастания их емкости:
1.
3d
4f 5s 6p
2.
3d 5s 4f 6p
3.
3d 6p 5s 4f
4.
5s 6p 3d 4f
5.
4f 3d 6p 5s
Ответ: 5
Неправильно!
Вопрос:
Укажите
сумму (n+l) для 4f-, 3p- и 5d- подуровней:
1.
4,3 и 5
2.
7,4 и 7
3.
14,6 и 10
4.
7,3 и 5
5.
32,8 и 18
Ответ: 4
Неправильно!
Вопрос:
Укажите
электронную формулу, соответствующую
атому в стационарном состоянии:
1.
…3d104p44d1
2.
…3p64s23d104p34d1
3.
…6s25d14f7
4.
…4s13d104p1
5.
…6s15d14f145d96p1
Ответ: 1
Неправильно!
Вопрос:
Укажите
положение ( № группы, подгруппу и №
периода) в таблице Д.И.Менделеева элемента
, у которого на 3d -подуровне есть 5
неспаренных электронов:
1.
IV период IVА группа
2.
IV период VIIB группа
3.
V период IVА группа
4.
III период IVВ группа
5.
V период IVВ группа
Ответ: 2
Правильно!
тест
«Строение атома»
Вопрос:
Укажите
квантовое число, изменяющееся в пределах
от 1 до ∞:
1.
главное
2.
орбитальное
3.
магнитное
4.
спиновое
5.
побочное
Ответ: 1
Правильно!
Вопрос:
Укажите
емкость p- и d- подуровней второго
энергетического уровня:
1.
2 и 6
2.
6 и 0
3.
5 и 0
4.
0 и 10
5.
3 и 5
Ответ: 1
Неправильно!
Вопрос:
Укажите
последовательность заполнения следующих
подуровней 4p3d 6d 4f 5s:
1.
4p
3d 6d 4f 5s
2.
3d 4p 4f 5s 6d
3.
5s 4p 3d 6d 4f
4.
3d 4p 5s 4f 6d
5.
5s
3d 4p 6d 4f
Ответ: 3
Неправильно!
Вопрос:
Укажите
электронную формулу, соответствующую
атому в возбужденном состоянии:
1.
…6s24f145d7
2.
…6s24f145d5
3.
…6s14f145d56p1
4.
…6s24f145d106p67s1
5.
…6s24f145d106p67s2
Ответ: 4
Неправильно!
Вопрос:
Укажите
положение ( № группы, подгруппу и №
периода) в таблице Д.И.Менделеева элемента
, у которого на 4 р-подуровне есть 3
неспаренных электронов:
1.
Ш период IVА группа
2.
IV период IVB группа
3.
V период IVА группа
4.
III период IVВ группа
5.
IV период VА группа
Ответ: 2
Неправильно!
тест
«Строение атома»
Вопрос:
Укажите,
какие значения принимает спиновое
квантовое число, если главное квантовое
число равно 5, а орбитальное 3:
1.
0,1,2,3,4
2.
0,1,2,3
3.
-3,-2,-1,0,+1,+2,+3
4.
+1/2,-1/2
5.
-3,0,+3
Ответ: 4
Правильно!
Вопрос:
Укажите
емкость p- и d- подуровней второго
энергетического уровня:
1.
2 и 6
2.
6 и 0
3.
5 и 0
4.
0 и 10
5.
3 и 5
Ответ: 1
Неправильно!
Вопрос:
Укажите
относительную энергию электронов на
подуровнях 6d 6p 4f 3s:
1.
6,6,6,3
2.
2,1,3,0
3.
5,3,7,1
4.
10,6,14,2
5.
8,7,7,3
Ответ: 3
Неправильно!
Вопрос:
Укажите
электронную формулу, соответствующую
атому в стационарном состоянии:
1.
…3s23p43d1
2.
…4s23d1
3.
…5s14d105p1
4.
…4s13d104p1
5.
…3s23p33d2
Ответ: 2
Правильно!
Вопрос:
Укажите
положение (№ группы, подгруппу и №
периода) в таблице Д.И.Менделеева элемента
электронный паспорт которого заканчивается
на ….3d2
1.
III период IVА группа
2.
IV период IVB группа
3.
V период IVА группа
4.
III период IVВ группа
5.
V период IVВ группа
Ответ: 2
Правильно!
тест
«Классификация неорганических
соединений для МП,ЭКТ, ЭТМО»
Вопрос:
Укажите
формулы амфотерных оксидов
1.
ZnO
2.
Na2O
3.
Al2O3
4.
CO2
5.
N2O
Ответ: 1,3
Правильно!
Вопрос:
Укажите
формулу основного оксида
1.
SiO
2.
K2O
3.
ZnO
4.
SnO2
5.
Fe2O3
Ответ: 2
Правильно!
Вопрос:
Укажите
оксид, не реагирующий с PbO
1.
Li2O
2.
N2O5
3.
CO2
4.
CO
5.
P2O3
Ответ: 5
Неправильно!
Вопрос:
Укажите
формулу хлорной кислоты.
1.
HCl
2.
HClO
3.
HClO2
4.
HClO3
5.
HClO4
Ответ: 5
Правильно!
Вопрос:
Укажите
название солей метаборной кислоты.
1.
ортобораты
2.
бораты
3.
метабораты
4.
бориты
5.
бориды
Ответ: 3
Правильно!
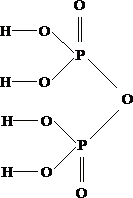
Вопрос:
Укажите
схему суммарной диссоциации пирофосфорной
кислоты.
1.
H4P2O7 ⇄
H+ +
H3P2O72-
2.
H4P2O7 ⇄
2H+ +
H2P2O72-
3.
H4P2O7 ⇄
4H+ +
P2O74-
4.
H3PO4 ⇄
3H+ +
PO43-
5.
HPO3 ⇄
H+ +
PO3—
Ответ: 3
Правильно!
Вопрос:
Укажите
вещества, при добавлении которых
усиливается диссоциация гидроксида
цинка.
1.
NaOH
2.
HCl
3.
H2O
4.
Zn(NO3)2
5.
Cu(OH)2
Ответ: 4,3,2
Неправильно!
Вопрос:
Укажите
группу формул, соответствующих следующим
солям: сульфит бария; сульфид натрия;
сульфат кальция.
1.
BaSO4;
Na2SO3;
CaS
2.
BaSO3;
Na2S;
CaSO4
3.
BaSO3;
Na2SO3;
CaSO4
4.
BaS; Na2SO4;
CaSO3
5.
BaS;
Na2SO4;
CaSO3
Ответ: 1
Неправильно!
Вопрос:
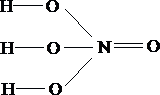
Укажите
формулу пирофосфорной кислоты
1.
2.
H — O — P ═ O
3.
4.
5.
Ответ: 3
Правильно!
Вопрос:
Укажите
формулу смешанной соли
1.
K2SO4
2.
KAl(SO4)2
3.
CaClNO3
4.
CaOHNO3
5.
Ca(HS)2
Ответ: 2
Неправильно!
Вопрос:
Укажите
формулу кислой соли
1.
NaHSO3
2.
KAl(SO4)2
3.
Cr(OH)2NO3
4.
[Zn(NH3)4]SO4
5.
Na2SO4
Ответ: 1
Правильно!
Вопрос:
Укажите
формулу основной соли
1.
Na2SO4
2.
NaHSO4
3.
ZnOHCl
4.
ZnCl2
5.
KAl(SO4)2
Ответ: 3
Правильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить основную соль
1.
2.
3.
CaCl2 + NaOH →
4.
H2SO4 + NaCl →
5.
Ответ: 4
Неправильно!
Вопрос:
Укажите
реакции, в результате которых можно
получить кислые соли
1.
2.
3.
Al(OH)3 + KOH →
4.
Ответ: 3,4
Неправильно!
Вопрос:
Укажите
формулу сульфата дигидроксоалюминия
1.
KAl(SO4)2
2.
Na2CrO4
3.
Al(HSO4)3
4.
[Al(OH)2]2SO4
5.
AlOHSO4
Ответ: 4
Правильно!
Вопрос:
Для
последовательного осуществления
превращений по схеме
BeO → Be(NO3)2 →
Be(OH)2 → Na2BeO2 → BeSO4
необходимы
вещества____
1.
HNO3;
NaOH; NaOH; H2SO4
2.
NO2; H2О;
NaF; SO3
3.
N2O3; NH4ОН;
Na2S; H2SO4
4.
HNO2;
Na2SO4;BeO; SO2
Ответ: 1
Правильно!
Вопрос:
С
помощью какого реагента можно отличить
в растворах NaCl и Na2SO4
1.
HNO3
2.
KCl
3.
Al(NO3)3
4.
BaCl2
5.
H2SO4
Ответ: 4
Правильно!
тест
«Классификация неорганических
соединений для МП,ЭКТ, ЭТМО»
Вопрос:
Укажите
формулы амфотерных оксидов
1.
ZnO
2.
Na2O
3.
Al2O3
4.
CO2
5.
N2O
Ответ: 1,3
Правильно!
Вопрос:
Укажите
формулу кислотного гидроксида
1.
HCl
2.
HBr
3.
H2ZnO2
4.
HNO3
5.
Mg(OH)2
Ответ: 4
Правильно!
Вопрос:
Укажите
оксид, реагирующий с K2O.
1.
MgO
2.
FeO
3.
CO
4.
N2O5
5.
Bi2O3
Ответ: 3
Неправильно!
Вопрос:
Укажите
формулу метафосфорной кислоты.
1.
HPO2
2.
H3PO4
3.
HPO3
4.
H4P2O7
5.
H3PO3
Ответ: 3
Правильно!
Вопрос:
Укажите
название солей ортофосфорной кислоты.
1.
фосфиды
2.
фосфаты
3.
пирофосфаты
4.
метафосфаты
5.
ортофосфиты
Ответ: 2
Правильно!
Вопрос:
Укажите
схему суммарной диссоциации гидроксида
бериллия.
1.
H2BeO2 ⇄
H+ +
HBeO2—
2.
H3BO3 ⇄
3H+ +
BO33-
3.
Be(OH)2 ⇄
BeOH+ +
OH—
4.
H2BeO2 ⇄
2H+ +
BeO22-
5.
Be2+ +
2OH— ⇄
H2BeO2 ⇄
2H+ +
BeO22-
Ответ: 3
Неправильно!
Вопрос:
Укажите
вещество, при добавлении которого к
раствору Ba(NO3)2 выпадает
осадок.
1.
NaOH
2.
H2SO4
3.
HCl
4.
HNO3
5.
Zn(OH)2
Ответ: 2
Правильно!
Вопрос:
Укажите
группу формул, соответствующих следующим
солям: метафосфат кальция; сульфид
никеля (II); сульфит хрома (III)
1.
K3PO4;
NiSO3;
Cr2S3
2.
NiSO4;
Cr2(SO3)3;
KPO3
3.
Ca(PO3)2;
NiS; Cr2(SO3)3
4.
Ca(PO2)2;
NiSO3;
Cr2(SO4)3
5.
KPO2;
Ni(HS)2;
Cr(NO3)3
Ответ: 3
Правильно!
Вопрос:
Укажите
формулу азотной кислоты
1.
H — O — N ═ O
2.
3.
4.
5.
Ответ: 2
Правильно!
Вопрос:
Укажите
формулу средней (нормальной) соли
1.
NaHSO3
2.
KAl(SO4)2
3.
Cr(OH)2NO3
4.
[Zn(NH3)4]SO4
5.
Na2SO4
Ответ: 5
Правильно!
Вопрос:
Укажите
формулу кислой соли
1.
[Ag(NH3)2]Cl
2.
[Al(OH)2]2SO4
3.
Na2CrO4
4.
Mg(HSe)2
5.
KAl(SO4)2
Ответ: 5
Неправильно!
Вопрос:
Укажите
формулу основной соли
1.
K2Cr2O7
2.
KАl(SO4)2
3.
CrOHSO4
4.
Cr(HSO4)3
5.
CaClBr
Ответ: 5
Неправильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить основную соль
1.
2.
3.
4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 3,5
Неправильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить кислую соль
1.
2.
3.
4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 2
Правильно!
Вопрос:
Укажите
формулу сульфата дигидроксоалюминия
1.
KAl(SO4)2
2.
Na2CrO4
3.
Al(HSO4)3
4.
[Al(OH)2]2SO4
5.
AlOHSO4
Ответ: 4
Правильно!
Вопрос:
Для
последовательного осуществления
превращений по схеме
MgO → MgCl2 →
Mg(OH)2 →(MgOH)2SO4 →
MgSO4
необходимы
вещества___
1.
HClO;
Cl2O7;
H2О;
H2SO4(изб.).
2.
Cl2;
H2О;
NH4OH;
H2SO3
3.
HCl; NaOH; H2SO4(нед.);H2SO4(изб.)
4.
HClO4;
H2О;(NH4)2SO4 ;
Н2SO4(изб)
Ответ: 3
Правильно!
Вопрос:
С
помощью какого реагента можно отличить
в растворах NaCl и NaI
1.
HNO3
2.
KCl
3.
Al(NO3)3
4.
BaCl2
5.
H2SO4
Ответ: 4
Неправильно!
тест
«Окислительно-восстановительные
реакции»
Вопрос:
Окислитель
в ОВР ________ электроны
1.
и отдает и принимает
2.
только принимает
3.
только отдает
Ответ: 2
Правильно!
Вопрос:
С
уменьшением потенциала ионизации
восстановительные свойства __________
1.
ослабевают
2.
усиливаются
3.
не изменяются
Ответ: 2
Правильно!
Вопрос:
Из
приведенных примеров наиболее сильным
окислителем является
1.
C
2.
P
3.
S
4.
Cl2
5.
B
Ответ: 3
Неправильно!
Вопрос:
Ионы
Cr3+ в
ОВР могут быть ________
1.
и окислителями и восстановителями
2.
только восстановителями
3.
только окислителями
Ответ: 2
Неправильно!
Вопрос:
Превращение
_________ соответствует процессу окисления
1.
SO42- →
H2S
2.
MnO2 →
MnO42-
3.
Zn2+ →
Zn
4.
NO3— →
N2
5.
MnO4— →
MnO2
Ответ: 1
Неправильно!
Вопрос:
В
реакции
S + KClO4 +
H2O
→ Cl— +
SO42- окислителем
является ________
1.
S
2.
KClO4
3.
H2O
4.
Cl—
5.
SO42-
Ответ: 1
Неправильно!
Вопрос:
Окислительно-восстановительная
реакция
H2S
+ Br2 →
HBr + S относится к типу _______
1.
внутримолекулярного ОВ
2.
диспропорционирования
3.
межмолекулярного ОВР
Ответ: 2
Неправильно!
Вопрос:
В
реакции
Al + KClO4 +
H2SO4 →
Al3+ +
Cl— участвует
______ электронов
1.
3
2.
11
3.
24
4.
8
5.
12
Ответ: 2
Неправильно!
тест
«Классификация неорганических
соединений для МП,ЭКТ, ЭТМО»
Вопрос:
Укажите
формулы амфотерных оксидов
1.
ZnO
2.
Na2O
3.
Al2O3
4.
CO2
5.
N2O
Ответ: 1,3
Правильно!
Вопрос:
Укажите
формулу кислотного гидроксида
1.
HCl
2.
HBr
3.
H2ZnO2
4.
HNO3
5.
Mg(OH)2
Ответ: 4
Правильно!
Вопрос:
Укажите
оксид, реагирующий с K2O.
1.
MgO
2.
FeO
3.
CO
4.
N2O5
5.
Bi2O3
Ответ: 3
Неправильно!
Вопрос:
Укажите
формулу метафосфорной кислоты.
1.
HPO2
2.
H3PO4
3.
HPO3
4.
H4P2O7
5.
H3PO3
Ответ: 3
Правильно!
Вопрос:
Укажите
название солей ортофосфорной кислоты.
1.
фосфиды
2.
фосфаты
3.
пирофосфаты
4.
метафосфаты
5.
ортофосфиты
Ответ: 2
Правильно!
Вопрос:
Укажите
схему суммарной диссоциации гидроксида
бериллия.
1.
H2BeO2 ⇄
H+ +
HBeO2—
2.
H3BO3 ⇄
3H+ +
BO33-
3.
Be(OH)2 ⇄
BeOH+ +
OH—
4.
H2BeO2 ⇄
2H+ +
BeO22-
5.
Be2+ +
2OH— ⇄
H2BeO2 ⇄
2H+ +
BeO22-
Ответ: 3
Неправильно!
Вопрос:
Укажите
вещество, при добавлении которого к
раствору Ba(NO3)2 выпадает
осадок.
1.
NaOH
2.
H2SO4
3.
HCl
4.
HNO3
5.
Zn(OH)2
Ответ: 2
Правильно!
Вопрос:
Укажите
группу формул, соответствующих следующим
солям: метафосфат кальция; сульфид
никеля (II); сульфит хрома (III)
1.
K3PO4;
NiSO3;
Cr2S3
2.
NiSO4;
Cr2(SO3)3;
KPO3
3.
Ca(PO3)2;
NiS; Cr2(SO3)3
4.
Ca(PO2)2;
NiSO3;
Cr2(SO4)3
5.
KPO2;
Ni(HS)2;
Cr(NO3)3
Ответ: 3
Правильно!
Вопрос:
Укажите
формулу азотной кислоты
1.
H — O — N ═ O
2.
3.
4.
5.
Ответ: 2
Правильно!
Вопрос:
Укажите
формулу средней (нормальной) соли
1.
NaHSO3
2.
KAl(SO4)2
3.
Cr(OH)2NO3
4.
[Zn(NH3)4]SO4
5.
Na2SO4
Ответ: 5
Правильно!
Вопрос:
Укажите
формулу кислой соли
1.
[Ag(NH3)2]Cl
2.
[Al(OH)2]2SO4
3.
Na2CrO4
4.
Mg(HSe)2
5.
KAl(SO4)2
Ответ: 5
Неправильно!
Вопрос:
Укажите
формулу основной соли
1.
K2Cr2O7
2.
KАl(SO4)2
3.
CrOHSO4
4.
Cr(HSO4)3
5.
CaClBr
Ответ: 5
Неправильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить основную соль
1.
2.
3.
4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 3,5
Неправильно!
Вопрос:
Укажите
реакцию, в результате которой можно
получить кислую соль
1.
2.
3.
4.
H2SO4 +
Ba(OH)2 →
5.
CoSO4 +
NH4OH
→
Ответ: 2
Правильно!
Вопрос:
Укажите
формулу сульфата дигидроксоалюминия
1.
KAl(SO4)2
2.
Na2CrO4
3.
Al(HSO4)3
4.
[Al(OH)2]2SO4
5.
AlOHSO4
Ответ: 4
Правильно!
Вопрос:
Для
последовательного осуществления
превращений по схеме
MgO → MgCl2 →
Mg(OH)2 →(MgOH)2SO4 →
MgSO4
необходимы
вещества___
1.
HClO;
Cl2O7;
H2О;
H2SO4(изб.).
2.
Cl2;
H2О;
NH4OH;
H2SO3
3.
HCl; NaOH; H2SO4(нед.);H2SO4(изб.)
4.
HClO4;
H2О;(NH4)2SO4 ;
Н2SO4(изб)
Ответ: 3
Правильно!
Вопрос:
С
помощью какого реагента можно отличить
в растворах NaCl и NaI
1.
HNO3
2.
KCl
3.
Al(NO3)3
4.
BaCl2
5.
H2SO4
Ответ: 4
Неправильно!
тест
«Окислительно-восстановительные
реакции»
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Квантовые числа
- Форма обитали отражается квантовым числом
- Ориентацию орбитали в пространстве около ядра отражает квантовое число
- Ошибочной является электронная формула
- Электронная формула атома хлора в основном состоянии
- В соответствии с правилом Клечковского после подуровня 3d должен заполняться подуровень
- В соответствии с правилом Гунда число непарных электронов на продуровне 3d7
- Валентный слой атома алюминия в основном состоянии
- В соответствии с правилом Клечковского после подуровня 4f должен заполняться подуровень
- В соответствии с принципом Паули максимальное число электронов на р подуровне
- Магнитное квантовое число при l=1 может принимать значения
Водородный показатель
- Водородный показатель отражает:
- Установите соответствие между названием вещества и значение рН в его водном растворе. А) гидроксид натрия Б) серная кислота В) хлороводород Г) калиевая щёлочь
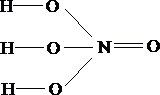
- В водном растворе азотной кислоты присутствуют ионы водорода, обусловливающие кислую среду с значением рН ….. 7
- В водном растворе бромоводорода присутствуют ионы водорода, обусловливающие кислую среду с значением рН ….. 7
- В водном растворе гидроксида аммония присутствуют гидроксид ионы, обусловливающие щелочную среду с значением рН …. 7.
- Концентрация ионов водорода в растворе с значением рН=3 составляет в …. моль/л
- Концентрация ионов водорода в водном растворе равна 0,05 моль/л. рН этого раствора равно
- рН раствора, каждый литр которого содержит 8 г гидроксида натрия, равен
Гидролиз солей
- Гидролизу по катиону подвергается
- Гидролизу по аниону подвергается
- Гидролизу не подвергается
- Гидролизу по катиону и аниону подвергается
- Кислую среду имеет раствор
- Щелочную среду имеет раствор
- Нейтральная среда в растворе
- Для усиления гидролиза FeCl3 в его водном растворе необходимо
- При медленном добавлении раствора карбоната натрия к раствору нитрата магния в результате взаимного усиления гидролиза солей образуются продукты
- Гидролиз невозможен для следующих соединений
Смещение химического равновесия
- В системе 2HBr⇆H2+Br2 – Q увеличение концентрации водорода сместит равновесие
- В системе 2HgO(к) ⇆ 2Hg(к)+O2(г) – Q для смещения равновесия вправо, необходимо
- Выберите уравнение реакции, в которой изменение давления не приведет к смещению равновесия
- Гомогенная реакция, в которой все вещества газообразны CO2 + 2SO3 ⇄CS2 + 4O2 – Q. Равновесие в этой системе сместится влево (←) при:
- Для равновесной системы CO2(г)+H2(г) ⇆CO(г)+H2O(г) – Q содержание СО можно увеличить при:
- Для смещения равновесия в системе S(тв)+H2(г) ⇆H2S(г), ∆H=-21 кДж в сторону образования сероводорода необходимо
- Для увеличения выхода продуктов реакции 2Pb(NO3)2(тв) ⇆ 2PbO(тв)+4NO2(г)+O2(г), ∆H>0 необходимо
- На смещение химического равновесия не влияет …
- Повышение давления вызовет смещение равновесия в реакции вправо
- Повышение давления и понижение температуры вызовут смещение равновесия в одну сторону в реакции:
Скорость химических реакций
- Для увеличения скорости реакции в 16 раз (температурный коэффициент равен 4), температуру следует повысить на:
- Зависимость скорости химической реакции от температуры определяют, используя уравнение
- При повышении температуры на 30 °C скорость реакции увеличилась в 8 раз. Температурный коэффициент скорости реакции равен:
- С ростом температуры возрастает скорость реакций
- Катализатор ускоряет химическую реакцию вследствие:
- Основным фактором, определяющим возможность протекания реакции при столкновении частиц, является:
- При прочих равных условиях медленнее идет реакция c
- C наибольшей скоростью реагирует с водородом:
- В сосуде находятся два газа – А и В, реагирующие с образованием твердого продукта АВ. При повышении давления в 2 раза скорость реакции
- Для увеличения скорости взаимодействия железа с хлороводородной кислотой следует:
Химическая связь
- Атомы соединены ионной связью в веществе
- Атомы соединены ковалентной полярной связью в веществе
- Атомы соединены ковалентной неполярной связью в веществе
- Число σ-связей в молекуле серной кислоты равно
- Число π-связей в угольной кислоте равно
- В молекуле СО2 атом углерода находится в состоянии гибридизации
- Наиболее полярная связь в молекуле
- В состоянии возбуждения атом хлора находится в молекуле
- Число общих электронных пар в молекуле азота равно
- Октет электронов на внешнем слое атома серы в веществе
Ионный обмен
- Осадок хлорида серебра выпадает при добавлении раствора нитрата серебра к раствору
- В результате взаимодействия хлорида аммония с гидроксидом кальция при нагревании образуется
- Слабый электролит образуется в реакции
- Молярная масса осадка, образовавшегося в результате взаимодействия нитрата свинца с сульфатом алюминия равна [[1]]
- Пары ионов, которые не могут находиться совместно в водном растворе
- Выберите реакцию с образованием осадка
- Сокращённому ионно-молекулярному уравнению S2- + Ni2+ = NiS↓ соответствует реакция между
- Газ образуется в результате реакции
- Сокращённое ионно-молекулярное уравнение для реакции между сульфатом железа (II) гидроксидом натрия имеет вид
- Газ будет выделяться при взаимодействии карбоната натрия с
Тема «Строение атома»
Часть А. Тестовые задания с выбором одного ответа
1 Электронная формула внешнего энергетического уровня атома серы
А) 3s23p2 В) 3s23p4 С) 3s13p4 D) 4s24p4 E) 4s24p4 F)3s33p4 G)4s24p2 H)3s23p6
2. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронных слоев в атоме
D) значение электроотрицательности элемента
Е) число энергетических подуровней на электронном слое
F) значение атомной массы элемента
G) число нейтронов в атоме
H) максимальную валентность элемента в соединениях с кислородом
3. Ряд чисел 2,8,5 соответствует распределению электронов по энергетическим уровням атома
А) алюминия В) фосфора С) азота D) хлора Е) сера F) аргон G) кремний H) магний
4. Электронная формула атома 1s22s22p63s23p2. Химический знак и формула водородного соединения этого элемента
А) C и CH4 В) Si и SiH4 С) О и Н2О D) Cl и HCl
Е) S и H2S F) P и PH3 G) N и NH3 H) F и HF
5. Пара элементов, имеющих сходное строение внешнего и предвнешнего энергетических уровней:
А) В и Si В) S и Se С) К и Са D) Na и K Е) Мn и Fe F) G) H)
6. Является s-элементом
А) барий В) марганец С) сера D) углерод Е) цинк F) кремний G) кислород H)азот
7. Элемент с электронной формулой 1s22s22p63s23p3 образует высший оксид, соответствующий формуле
А) Э2О В) Э2О3 С) ЭО2 D) ЭО Е) Э2О5 F) ЭО3 G) Э2О7 H) ЭО4
8. Атом неона Ne, катион натрия Na+ и анион фтора F— имеют одинаковое
A) число протонов B)число электронов C) значение максимальной валентности D) число нейтронов E) энергетических подуровней F) значение максимальной степени окисления
G) значение атомной массы H) значение электроотрицательности
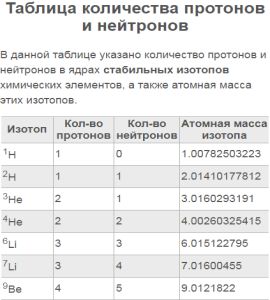
9. Число протонов, нейтронов и электронов в атоме 40Ar соответственно равно
A) 18, 22, 18 B) 40, 18, 40 C) 22, 18, 40 D) 18, 40, 18 E) 22, 40, 22 F) 18, 22, 40 G) 40, 22, 18 H) 22,18,18
10. Распределение электронов в атоме элемента четвертого периода IА группы соответствует ряду чисел
А) 2,8,8,2 В) 2,8,8,1 С) 2,8,18,2 D) 2,8,18,1 Е) 2,8,18,3 F) 2,8,18,3 G)2,8,18,1 H) 2,8,18,2
11. В четвертом электронном слое содержит пять электронов атом
А) V B) Р C) As D) Sn E) Zr F) Сu G) Sb H) N
12. Одинаковое число электронов и нейтронов в
A) атоме Ве B) ионе S2- C) ионе F— D) атоме Cr E) атоме S F) Ar G) Li H) Na
13 Атом кислорода и атом серы сходны по
A) числу электронов на внешнем слое B) значению максимальной степени окисления C) числу энергетических уровней D) числу нейтронов в ядре E) числу электронов в атоме F) заряду ядра
G) значению атомной массы H) значению электроотрицательности
14. В ядре атома элемента с электронной формулой 1s2 2s2 2p6 3s2 3p2 число протонов равно
A) 18 B) 10 C) 14 D) 12 E) 16 F) 24 G) 15 H)2
15. Атом металла, высший оксид которого Ме2О3, имеет электронную формулу внешнего энергетического уровня
A) ns2nр1 B) ns2nр2 C) ns2np3 D) ns2np E) ns2np F) ns1np2 G) ns0np1 H) ns1np2
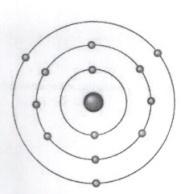
16. Ниже приведена томная модель атома химического элемента. Укажите данный элемент.
A) Mg B) Na C) Al D) Ar E) Cl F) P G) Si H) S
17. У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
А) 4 и + 16 В) 6 и + 32 С) 4 и + 32 D) 6 и + 16 E) 4 и 16 F) 16 и +4 G) 3 и +32 H) 3 и +6
18. Одинаковое электронное строение имеют частицы
А) Na0 и Na+ В) Na+ и F— С) Na0 и K0 D) Cr2+ и Сr3+
E) Na0 и F— F) Na0 и K+ G) K0 и Cl0 H) K0 и Cl—
19. Является p-Элементом является
А) натрий B) фосфор C) уран D) кальций E) калий F) литий G) рубидий H)цезий
20. Формула высшего оксида элемента, электронная формула которого 1s22s22p63s23p3
А) B2O3 В) N2O5 C) P2O5 D) Al2O3 E) As2O5 F) SO3 G) P2O3 H) SiO3
21. В пятом электронном слое содержит четыре электрона атом
А) V B) Sb C) As D) Sn E) Zr F) Si G) Pb H) Sr
Часть В. Задания с выбором нескольких правильных ответов.
-
Состав аниона серы
А) протонов 32 В) электронов 18 С) нейтронов 16 D) электронов 16 Е) электронов 32
F) протонов 16 G) электронов 14 H) протонов 18
2. Относятся к s- элементам
А) Zn В) Na С) Mg D) S Е) Li F) C G)Zn H) Cu
3. На внешнем энергетическом уровне пять электрон у
A) N B) Cl C) Si D) C E) Н F) Na G) P H) As
4. Атомы углерода и кремния различаются между собой
A) относятся к р-элементам
B) числом валентных электронов
C) относятся к неметаллам
D) числом вакантных орбиталей на внешнем энергетическом уровне
E) зарядом ядра
F) количеством электронов на последнем энергетическом уровне
G) значением максимальной валентности
H) числом энергетических уровней
5. Порядковый номер элемента в Периодической системе указывает на
A) заряд ядра атома
В) число электронов в наружном слое атома
С) число электронов в атоме
D) число нейтронов в атоме
Е) число энергетических подуровней на электронном слое
F) число протонов
G) максимальную валентность элемента в соединениях с кислородом
H) число электронных слоев в атоме
6. На последнем энергетическом уровне находится 8 электронов у
А) aтом аргона Ar B) атом кальция С) атом калия K D) анион хлора Сl—
Е) атом калия К F)катион кальция Са2+ G) атом хлора H) анион фтора F—
7. Электронная формула 1s22s22р6 соответствует
А) атому неона B) аниону кислорода C) атому кислорода D) аниону фтора
E) атому фтора F) атом кислорода G) атому натрия H) аниону хлора
8. Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np1
A) В B) O C) P D) As E) Аl F) C G) Ga H)Si
9. В реакциях элемент отдает один электрон
А) Li В) Zn С) Cl D) Rb Е) Na F) Аl G) Ca H) F
10. Двухэлектронную внешнюю оболочку имеет ион
А) S6+ В) S2- С) Br5+ D) S4+ Е) С2+ F) Sn4+ G) С4+ H) Br—
11. Является p- элементом
А) S В) Na С) Ca D) P Е) O F) K G) Zn H) Li
12. В реакциях элемент принимает один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
13. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
14. Частицы в паре имеют одинаковую электронную структуру
А) F— и Na+ В) F и Na+ С) Mg и Ca D) Mg2+ и Si2+
Е) F— и Na F) Mg и Si4+ G) H) Mg и Si2+ H) K и Cl—
15. На s-подуровне находится 2 электрона (основное состояние) у
А) Са В) S С) Na D) Mg Е) Li F)К G) Rb H) H
16. Состав аниона фтора
А) протонов 19
В) электронов 10
С) нейтронов 10
D) электронов 16
Е) электронов 19
F) протонов 9
G) нейтронов 19
H) протонов 18
17. Относятся к d- элементам
А) Ag В) Zn С) K D) Cu Е) Na F) C G) S H) Cl
18. На внешнем энергетическом уровне 4 электрона у
A) N B) Cl C) Si D) C E) Н F) Na G) P H) Sn
19. Атомы азота и фосфора различаются между собой
A) значением максимальной валентности
B) числом валентных электронов
C) относятся к неметаллам
D) числом вакантных орбиталей на внешнем энергетическом уровне
E) зарядом ядра
F) количеством электронов на последнем энергетическом уровне
G) относятся к р-элементам
H) числом энергетических уровней
20. Порядковый номер элемента в Периодической системе указывает на:
A) число нейтронов в атоме
В) заряд ядра атома
С) число электронов в атоме
D) число протонов
Е) число энергетических подуровней на электронном слое
F) число электронов в наружном слое атома
G) число электронных слоев в атоме
H) максимальную валентность элемента в соединениях с кислородом
21 . Имеет 18 электронов
А) атом кальция B) атом фтора F С) атом калия К D) анион хлора Сl—
Е) катион калия K+ F)катион кальция Са2+ G) атом хлора H) анион фтора F—
22. Электронная формула 1s22s22р6 3 s23р6 соответствует
А) атому аргона B) аниону кислорода C) атому кислорода D) катиону кальция
E) атому фтора F) катиону калия G) атому натрия H) атому хлора
23 . Атом данного металла имеет электронную формулу внешнего энергетического уровня ns2np3
A) В B) O C) P D) As E) Аl F) N G) Ga H)Si
24. Данные элементы при взаимодействии отдают два электрона
А) Li В) Zn С) Cl D) Rb Е) Mg F) K G) Ca H) F
25. Двухэлектронную внешнюю оболочку имеет ион
А) S6+ В) Br5+ С) S2- D) S4+ Е) С4+ F) Sn4+ G) С2+ H) Br—
26. Данные химические элементы относятся к s — элементам
А) S В) Р С) Ca D) Аl Е) O F) K G) C H) Li
27. Данные элементы при взаимодействии принимают один электрон
А) Li В) Zn С) Cl D) Rb Е) Вr F) K G) Ca H) F
28. Атом элемента, максимальная степень окисления которого + 4, в основном состоянии может иметь электронную конфигурацию внешнего энергетического уровня:
А) 3s23p4 В) 2s22p2 С) 2s22p4 D)3s23p2 Е) 2s22p6 F) 3s23p4 G) 4s24p2 H) 2s22p5
29. Частицы в паре имеют одинаковую электронную структуру
А) F— и Na+ В) F и Na+ С) Mg и Ca D) Mg2+ и Si2+
Е) F— и Na F) Mg и Si4+ G) Mg и Si2+ H) K и Cl—
30. На s-подуровне находится 1 электрона (основное состояние)
А) Са В) S С) Na D) Mg Е) Li F) Ва G) Rb H) H
Часть С. Тестовые задания на соотнесение.
-
Установите соответствие элементом и его электронной формулой
Элемент
Электронная формула
-
Берилий
-
Натрий
-
Хлор
А) 1s22s22p3
В) 1s22s2
С) 1s22s22p63s23p5D) 1s22s1
E) 1s22s22p63s¹F) 1s22s22p63s23p6
-
-
Установите соответствие между энергетическим подуровнем и числом орбиталей на нем:
Энергетический подуровень
Число орбиталей
1) s -подуровень
2) p-подуровень
3) d -подуровень
А) 2
В) 7
С) 1D) 3
E) 5
F) 4
-
Установите соответствие между ионом и его электронной формулой:
Ион
Электронная формула
1) Ca2+
2) O2-
3) Rb+
А) 1s22s22р63s23р6 4s23d104 р65s1
В) 1s22s22р63s23р64s2
С) 1s22s22р63s23р6
D) 1s22s22р6
E) 1s22s22р4
F) 1s22s22р63s23р6 4s23d104 р6
-
Установите соответствие между атомом элемента и количеством электронов, которые он отдает или принимает для завершения внешней электронной оболочки:
|
Атом элемента |
Количество электронов |
|
А) отдает 1 электрон В) отдает 2 электронa D) принимает 1 электрон E) принимает 2 электронa F) принимает 3 электронa |
-
Установите соответствие элементом и его электронной формулой
Элемент
Электронная формула
-
Алюминий
-
Калий
3) Сера
А) 1s22s22p63s23p64s1
В) 1s22s22p63s23p6
С) 1s22s22p63s23p4
D) 1s22s22p63s23p3
E) 1s22s22p63s23p1
F) 1s22s22p63s23p64s2 -
-
Установите соответствие между энергетическим подуровнем и числом орбиталей на нем:
Энергетический подуровень
Число орбиталей
1) s -подуровень
2) p-подуровень
3) d -подуровень
А) 1
В) 2
С) 3D) 5
E) 7
F) 14
-
Установите соответствие между ионом и его электронной формулой
|
Ион |
Электронная формула |
|
1) Cl— 2) F— 3) C+2 |
А) 1s22s22р2 С) 1s22s22р63s23р6 D) 1s22s22р63s23р5 E) 1s22s2 |
8. Установите соответствие между атомом элемента и количеством электронов, которые он отдает
или принимает для завершения внешней электронной оболочки:
|
Атом элемента |
Количество электронов |
|
А) отдает 1 электрон В) принимает 1 электрона С) отдает 2 электронa D) принимает 2 электронa E) отдает 3 электронa F) принимает 3 электронa |
КЛЮЧ
|
Часть А. Тестовые задания с выбором одного ответа |
|
|
1 |
B |
|
2 |
A |
|
3 |
B |
|
4 |
B |
|
5 |
D |
|
6 |
A |
|
7 |
E |
|
8 |
B |
|
9 |
A |
|
10 |
B |
|
11 |
C |
|
12 |
E |
|
13 |
А |
|
14 |
С |
|
15 |
С |
|
16 |
C |
|
17 |
D |
|
18 |
B |
|
19 |
B |
|
20 |
C |
|
21 |
D |
|
Часть В. Задания с выбором нескольких правильных ответов. |
|
|
1 |
B C F |
|
2 |
B C E |
|
3 |
A H G |
|
4 |
D E H |
|
5 |
A C F |
|
6 |
A D F |
|
7 |
A B D |
|
8 |
A E G |
|
9 |
A D E |
|
10 |
C D E |
|
11 |
A D E |
|
12 |
C E H |
|
13 |
B D G |
|
14 |
A G H |
|
15 |
A B D |
|
16 |
B C F |
|
17 |
A B D |
|
18 |
C D H |
|
19 |
D E H |
|
20 |
B C D |
|
21 |
D E F |
|
22 |
A D F |
|
23 |
C D F |
|
24 |
B E G |
|
25 |
B D G |
|
26 |
C F H |
|
27 |
C E H |
|
28 |
B D G |
|
29 |
A G H |
|
30 |
C E H |
|
Часть С. Тестовые задания на соотнесение. |
|
|
1 |
1-B 2- Е, 3- С |
|
2 |
|
|
3 |
1- C 2- D 3- F |
|
4 |
1- A 2- E 3-C |
|
5 |
1-E 2-A 3-C |
|
6 |
1-A 2-C 3-D |
|
7 |
1-C 2-F 3-E |
|
8 |
|
Электронные формулы атомов химических элементов (Таблица)
Таблица содержит электронные формулы атомов химических элементов (слои расположены в порядке заполнения подуровней)
Электронная формула показывает распределение электронов на орбиталях в атоме:
Формирование электронной оболочки атома происходит в соответствии с 3-мя принципами:
1. Принцип минимума энергии, который определяет заполнение атомных орбиталей с наименьшей энергией
(1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s)
2. Принцип Паули, который диктует присутствие на атомной орбитали не более 2 электронов с противоположно направленными спинами
3. Правило Хунда, по которому происходит заполнение атомных орбиталей электронами так, чтобы их суммарный спин был максимальным.
Ниже показаны примеры графического изображения электронных формул атомов некоторых химических элементов:
Таблица электронных формул атомов химических элементов
|
№ элемента |
Химический знак |
Название элемента |
Электронная формула |
|
1 |
H |
водород |
1s1 |
|
2 |
He |
гелий |
1s2 |
|
II период |
|||
|
3 |
Li |
литий |
1s22s1 |
|
4 |
Be |
бериллий |
1s22s2 |
|
5 |
B |
бор |
1s22s22p1 |
|
6 |
C |
углерод |
1s22s22p2 |
|
7 |
N |
азот |
1s22s22p3 |
|
8 |
O |
кислород |
1s22s22p4 |
|
9 |
F |
фтор |
1s22s22p5 |
|
10 |
Ne |
неон |
1s22s22p6 |
|
III период |
|||
|
11 |
Na |
натрий |
1s22s22p63s1 |
|
12 |
Mg |
магний |
1s22s22p63s2 |
|
13 |
Al |
алюминий |
1s22s22p63s23p1 |
|
14 |
Si |
кремний |
1s22s22p63s23p2 |
|
15 |
P |
фосфор |
1s22s22p63s23p3 |
|
16 |
S |
сера |
1s22s22p63s23p4 |
|
17 |
Cl |
хлор |
1s22s22p63s23p5 |
|
18 |
Ar |
аргон |
1s22s22p63s23p6 |
|
IV период |
|||
|
19 |
K |
калий |
1s22s22p63s23p64s1 |
|
20 |
Ca |
кальций |
1s22s22p63s23p64s2 |
|
21 |
Sc |
скандий |
1s22s22p63s23p64s23d1 |
|
22 |
Ti |
титан |
1s22s22p63s23p64s23d2 |
|
23 |
V |
ванадий |
1s22s22p63s23p64s23d3 |
|
24 |
Cr |
хром |
1s22s22p63s23p64s13d5 |
|
25 |
Mn |
марганец |
1s22s22p63s23p64s23d5 |
|
26 |
Fe |
железо |
1s22s22p63s23p64s23d6 |
|
27 |
Co |
кобальт |
1s22s22p63s23p64s23d7 |
|
28 |
Ni |
никель |
1s22s22p63s23p64s23d8 |
|
29 |
Cu |
медь |
1s22s22p63s23p64s13d10 |
|
30 |
Zn |
цинк |
1s22s22p63s23p64s23d10 |
|
31 |
Ga |
галлий |
1s22s22p63s23p64s23d104p1 |
|
32 |
Ge |
германий |
1s22s22p63s23p64s23d104p2 |
|
33 |
As |
мышьяк |
1s22s22p63s23p64s23d104p3 |
|
34 |
Se |
селен |
1s22s22p63s23p64s23d104p4 |
|
35 |
Br |
бром |
1s22s22p63s23p64s23d104p5 |
|
36 |
Kr |
криптон |
1s22s22p63s23p64s23d104p6 |
|
V период |
|||
|
37 |
Rb |
рубидий |
1s 22s 22p 63s 23p64s 23d104p65s1 |
|
38 |
Sr |
стронций |
1s 22s 22p 63s 23p64s 23d104p65s2 |
|
39 |
Y |
иттрий |
1s 22s 22p 63s 23p64s 23d104p65s24d1 |
|
40 |
Zr |
цирконий |
1s 22s 22p 63s 23p64s 23d104p65s24d2 |
|
41 |
Nb |
ниобий |
1s 22s 22p 63s 23p64s 23d104p65s14d4 |
|
42 |
Mo |
молибден |
1s 22s 22p 63s 23p64s 23d104p65s14d5 |
|
43 |
Tc |
технеций |
1s 22s 22p 63s 23p64s 23d104p65s24d5 |
|
44 |
Ru |
рутений |
1s 22s 22p 63s 23p64s 23d104p65s14d7 |
|
45 |
Rh |
родий |
1s 22s 22p 63s 23p64s 23d104p65s14d8 |
|
46 |
Pd |
палладий |
1s 22s 22p 63s 23p64s 23d104p65s04d10 |
|
47 |
Ag |
серебро |
1s 22s 22p 63s 23p64s 23d104p65s14d10 |
|
48 |
Cd |
кадмий |
1s 22s 22p 63s 23p64s 23d104p65s24d10 |
|
49 |
In |
индий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
|
50 |
Sn |
олово |
1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
|
51 |
Sb |
сурьма |
1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
|
52 |
Te |
теллур |
1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
|
53 |
I |
йод |
1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
|
54 |
Xe |
ксенон |
1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
|
VI период |
|||
|
55 |
Cs |
цезий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
|
56 |
Ba |
барий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
|
57 |
La |
лантан |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
|
58 |
Ce |
церий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
|
59 |
Pr |
празеодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
|
60 |
Nd |
неодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
|
61 |
Pm |
прометий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
|
62 |
Sm |
самарий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
|
63 |
Eu |
европий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
|
64 |
Gd |
гадолиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
|
65 |
Tb |
тербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
|
66 |
Dy |
диспрозий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
|
67 |
Ho |
гольмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
|
68 |
Er |
эрбий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
|
68 |
Tm |
тулий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
|
70 |
Yb |
иттербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
|
71 |
Lu |
лютеций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
|
72 |
Hf |
гафний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
|
73 |
Ta |
тантал |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
|
74 |
W |
вольфрам |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
|
75 |
Re |
рений |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
|
76 |
Os |
осмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
|
77 |
Ir |
иридий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
|
78 |
Pt |
платина |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
|
79 |
Au |
золото |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
|
80 |
Hg |
ртуть |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
|
81 |
Tl |
таллий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
|
82 |
Pb |
свинец |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
|
83 |
Bi |
висмут |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
|
84 |
Po |
полоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
|
85 |
At |
астат |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
|
86 |
Rn |
радон |
1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
|
VII период |
|||
|
87 |
Fr |
франций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
|
88 |
Ra |
радий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
|
89 |
Ac |
актиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
|
90 |
Th |
торий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
|
91 |
Pa |
протактиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
|
92 |
U |
уран |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
|
93 |
Np |
нептуний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
|
94 |
Pu |
плутоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
|
95 |
Am |
америций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
|
96 |
Cm |
кюрий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
|
97 |
Bk |
берклий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
|
98 |
Cf |
калифорний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
|
99 |
Es |
эйнштейний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
|
100 |
Fm |
фермий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
|
101 |
Md |
менделеевий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
|
102 |
No |
нобелий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
|
103 |
Lr |
лоуренсий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
|
104 |
Rf |
резерфордий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
|
105 |
Db |
дубний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
|
106 |
Sg |
сиборгий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
|
107 |
Bh |
борий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
|
108 |
Hs |
хассий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
|
109 |
Mt |
мейтнерий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
|
s-элементы |
p-элементы |
d-элементы |
f-элементы |
Здесь представлены электронные формулы химических элементов периодической таблицы Менделеева. Более подробную информацию о структуре каждого элемента
(электронные формулы, графические схемы, распределение электронов по энергетическим уровням) можно посмотреть здесь.
| № | Элемент | Электронная формула |
|---|---|---|
| 1 | H (водород) | 1s1 |
| 2 | He (гелий) | 1s2 |
| 3 | Li (литий) | [He] 2s1 |
| 4 | Be (бериллий) | [He] 2s2 |
| 5 | B (бор) | [He] 2s2 2p1 |
| 6 | C (углерод) | [He] 2s2 2p2 |
| 7 | N (азот) | [He] 2s2 2p3 |
| 8 | O (кислород) | [He] 2s2 2p4 |
| 9 | F (фтор) | [He] 2s2 2p5 |
| 10 | Ne (неон) | [He] 2s2 2p6 |
| 11 | Na (натрий) | [Ne] 3s1 |
| 12 | Mg (магний) | [Ne] 3s2 |
| 13 | Al (алюминий) | [Ne] 3s2 3p1 |
| 14 | Si (кремний) | [Ne] 3s2 3p2 |
| 15 | P (фосфор) | [Ne] 3s2 3p3 |
| 16 | S (сера) | [Ne] 3s2 3p4 |
| 17 | Cl (хлор) | [Ne] 3s2 3p5 |
| 18 | Ar (аргон) | [Ne] 3s2 3p6 |
| 19 | K (калий) | [Ar] 4s1 |
| 20 | Ca (кальций) | [Ar] 4s2 |
| 21 | Sc (скандий) | [Ar] 3d1 4s2 |
| 22 | Ti (титан) | [Ar] 3d2 4s2 |
| 23 | V (ванадий) | [Ar] 3d3 4s2 |
| 24 | Cr (хром) | [Ar] 3d5 4s1 |
| 25 | Mn (марганец) | [Ar] 3d5 4s2 |
| 26 | Fe (железо) | [Ar] 3d6 4s2 |
| 27 | Co (кобальт) | [Ar] 3d7 4s2 |
| 28 | Ni (никель) | [Ar] 3d8 4s2 |
| 29 | Cu (медь) | [Ar] 3d10 4s1 |
| 30 | Zn (цинк) | [Ar] 3d10 4s2 |
| 31 | Ga (галлий) | [Ar] 3d10 4s2 4p1 |
| 32 | Ge (германий) | [Ar] 3d10 4s2 4p2 |
| 33 | As (мышьяк) | [Ar] 3d10 4s2 4p3 |
| 34 | Se (селен) | [Ar] 3d10 4s2 4p4 |
| 35 | Br (бром) | [Ar] 3d10 4s2 4p5 |
| 36 | Kr (криптон) | [Ar] 3d10 4s2 4p6 |
| 37 | Rb (рубидий) | [Kr] 5s1 |
| 38 | Sr (стронций) | [Kr] 5s2 |
| 39 | Y (иттрий) | [Kr] 4d1 5s2 |
| 40 | Zr (цирконий) | [Kr] 4d2 5s2 |
| 41 | Nb (ниобий) | [Kr] 4d4 5s1 |
| 42 | Mo (молибден) | [Kr] 4d5 5s1 |
| 43 | Tc (технеций) | [Kr] 4d5 5s2 |
| 44 | Ru (рутений) | [Kr] 4d7 5s1 |
| 45 | Rh (родий) | [Kr] 4d8 5s1 |
| 46 | Pd (палладий) | [Kr] 4d10 |
| 47 | Ag (серебро) | [Kr] 4d10 5s1 |
| 48 | Cd (кадмий) | [Kr] 4d10 5s2 |
| 49 | In (индий) | [Kr] 4d10 5s2 5p1 |
| 50 | Sn (олово) | [Kr] 4d10 5s2 5p2 |
| 51 | Sb (сурьма) | [Kr] 4d10 5s2 5p3 |
| 52 | Te (теллур) | [Kr] 4d10 5s2 5p4 |
| 53 | I (йод) | [Kr] 4d10 5s2 5p5 |
| 54 | Xe (ксенон) | [Kr] 4d10 5s2 5p6 |
| 55 | Cs (цезий) | [Xe] 6s1 |
| 56 | Ba (барий) | [Xe] 6s2 |
| 57 | La (лантан) | [Xe] 5d1 6s2 |
| 58 | Ce (церий) | [Xe] 4f1 5d1 6s2 |
| 59 | Pr (празеодим) | [Xe] 4f3 6s2 |
| 60 | Nd (неодим) | [Xe] 4f4 6s2 |
| 61 | Pm (прометий) | [Xe] 4f5 6s2 |
| 62 | Sm (самарий) | [Xe] 4f6 6s2 |
| 63 | Eu (европий) | [Xe] 4f7 6s2 |
| 64 | Gd (гадолиний) | [Xe] 4f7 5d1 6s2 |
| 65 | Tb (тербий) | [Xe] 4f9 6s2 |
| 66 | Dy (диспрозий) | [Xe] 4f10 6s2 |
| 67 | Ho (гольмий) | [Xe] 4f11 6s2 |
| 68 | Er (эрбий) | [Xe] 4f12 6s2 |
| 69 | Tm (тулий) | [Xe] 4f13 6s2 |
| 70 | Yb (иттербий) | [Xe] 4f14 6s2 |
| 71 | Lu (лютеций) | [Xe] 4f14 5d1 6s2 |
| 72 | Hf (гафний) | [Xe] 4f14 5d2 6s2 |
| 73 | Ta (тантал) | [Xe] 4f14 5d3 6s2 |
| 74 | W (вольфрам) | [Xe] 4f14 5d4 6s2 |
| 75 | Re (рений) | [Xe] 4f14 5d5 6s2 |
| 76 | Os (осмий) | [Xe] 4f14 5d6 6s2 |
| 77 | Ir (иридий) | [Xe] 4f14 5d7 6s2 |
| 78 | Pt (платина) | [Xe] 4f14 5d9 6s1 |
| 79 | Au (золото) | [Xe] 4f14 5d10 6s1 |
| 80 | Hg (ртуть) | [Xe] 4f14 5d10 6s2 |
| 81 | Tl (таллий) | [Xe] 4f14 5d10 6s2 6p1 |
| 82 | Pb (свинец) | [Xe] 4f14 5d10 6s2 6p2 |
| 83 | Bi (висмут) | [Xe] 4f14 5d10 6s2 6p3 |
| 84 | Po (полоний) | [Xe] 4f14 5d10 6s2 6p4 |
| 85 | At (астат) | [Xe] 4f14 5d10 6s2 6p5 |
| 86 | Rn (родон) | [Xe] 4f14 5d10 6s2 6p6 |
| 87 | Fr (франций) | [Rn] 7s1 |
| 88 | Ra (радий) | [Rn] 7s2 |
| 89 | Ac (актиний) | [Rn] 6d1 7s2 |
| 90 | Th (торий) | [Rn] 6d2 7s2 |
| 91 | Pa (протактиний) | [Rn] 5f2 6d1 7s2 |
| 92 | U (уран) | [Rn] 5f3 6d1 7s2 |
| 93 | Np (нептуний) | [Rn] 5f4 6d1 7s2 |
| 94 | Pu (плутоний) | [Rn] 5f6 7s2 |
| 95 | Am (амерций) | [Rn] 5f7 7s2 |
| 96 | Cm (кюрий) | [Rn] 5f7 6d1 7s2 |
| 97 | Bk (берклий) | [Rn] 5f9 7s2 |
| 98 | Cf (калифорний) | [Rn] 5f10 7s2 |
| 99 | Es (эйнштейний) | [Rn] 5f11 7s2 |
| 100 | Fm (фермий) | [Rn] 5f12 7s2 |
| 101 | Md (менделевий) | [Rn] 5f13 7s2 |
| 102 | No (нобелий) | [Rn] 5f14 7s2 |
| 103 | Lr (лоуренсий) | [Rn] 5f14 6d1 7s2 |
| 104 | Rf (резерфордий) | [Rn] 5f14 6d2 7s2 |
| 105 | Db (дубний) | [Rn] 5f14 6d3 7s2 |
| 106 | Sg (сиборгий) | [Rn] 5f14 6d4 7s2 |
| 107 | Bh (борий) | [Rn] 5f14 6d5 7s2 |
| 108 | Hs (хассий) | [Rn] 5f14 6d6 7s2 |
| 109 | Mt (мейтнерий) | [Rn] 5f14 6d7 7s2 |
| 110 | Ds (дармштадтий) | [Rn] 5f14 6d8 7s2 |
| 111 | Rg (рентгений) | [Rn] 5f14 6d9 7s2 |
| 112 | Cn (коперниций) | [Rn] 5f14 6d10 7s2 |
| 113 | Nh (нихоний) | [Rn] 5f14 6d10 7s2 7p1 |
| 114 | Fl (флеровий) | [Rn] 5f14 6d10 7s2 7p2 |
| 115 | Mc (московий) | [Rn] 5f14 6d10 7s2 7p3 |
| 116 | Lv (ливерморий) | [Rn] 5f14 6d10 7s2 7p4 |
| 117 | Ts (теннесcин) | [Rn] 5f14 6d10 7s2 7p5 |
| 118 | Og (оганесон) | [Rn] 5f14 6d10 7s2 7p6 |
Другие таблицы