Версия: Справочник заболеваний MedElement
Категории МКБ:
Острый инфаркт миокарда неуточненный (I21.9)
Разделы медицины:
Кардиология
Общая информация
Краткое описание
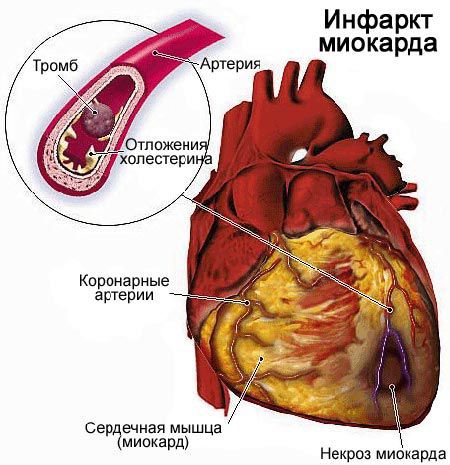
Инфаркт миокарда (ИМ) — это острое заболевание, вызванное развитием очага
ишемическогонекроза
мышцы сердца, возникшего вследствие закупорки коронарной артерии тромбом. В дальнейшем развивается острое несоответствие между потребностью миокарда в кислороде и доставкой его по коронарной артерии (абсолютная или относительная недостаточность коронарного кровотока).
Критерии острого инфаркта миокарда
Термин ИМ используется, когда присутствуют признаки
некроза
миокарда, согласующиеся в клинической картине с ишемией миокарда. При таких условиях диагнозу ИМ соответствует любой из нижеперечисленных критериев:
1. Выявление подъема и/или падения уровня сердечных биохимических маркеров (преимущественно тропонина), а также при наличии признаков ишемии миокарда одновременно с одним из следующих признаков:
— симптомы ишемии;
— визуализация признаков новой потери жизнеспособности миокарда или новой региональной аномалии движения стенки;
— изменения ЭКГ, указывающие на новую ишемию (новые ST-T изменения или новая блокада левой ножки пучка Гиса (БЛНПГ));
— развитие патологических зубцов Q на ЭКГ.
2. Внезапная сердечная смерть (ВСС), включающая остановку сердца. Часто она имеет симптомы, предполагающие ишемию миокарда, и сопровождается, вероятно, новым подъемом ST или вновь возникшей БЛНПГ, и/или со свидетельством наличия свежего тромба на
коронарографии
и/или
аутопсии
. Однако смерть наступает еще до того, как становится возможным получить образцы крови или в то время, когда сердечные биохимические маркеры еще не появились в крови.
3. Для аортокоронарного шунтирования (АКШ) у пациентов с нормальным уровнем тропонина подъем сердечных маркеров служит указателем на перипроцедурный некроз миокарда. Признаками ИМ вследствие АКШ являются:
— подъем уровней биохимических маркеров больше, чем в пять раз по отношению к норме;
— патологические зубцы Q либо БЛНПГ;
— ангиографически задокументированная
окклюзия
венечной артерии или шунта;
— визуализация признаков потери жизнеспособности миокарда.
4. При выполнении чрескожных вмешательств на коронарных артериях (ЧВКА) у больных с исходно нормальным уровнем тропонина, повышение концентрации специфических маркеров повреждения миокарда указывает на развитие
некроза
миокарда в ходе выполнения вмешательства. При увеличении концентрации биомаркеров более чем в 3 раза по сравнению с нормой принято диагностировать ИМ, связанный с выполнением ЧВКА. Выделяют также ИМ, обусловленный подтвержденным тромбозом
стента
.
5. Патоморфологические находки, которые свидетельствуют о наличии острого ИМ.
Критерии для постановки диагноза «первичный инфаркт миокарда»
Любой из приведенных ниже критериев соответствует диагнозу первичного ИМ:
— визуализация свидетельств о регионе потери жизнеспособности миокарда, то есть истончение стенки и утеря способности к сокращению, при отсутствии неишемических причин;
— развитие новых патологических зубцов Q с симптомами или без них;
— наличие вылеченного или лечащегося ИМ.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Клиническая классификация различных типов инфаркта миокарда
| Тип 1 | Спонтанный инфаркт миокарда, связанный с ишемией вследствие первичного коронарного события, такого как эрозия и/или разрыв, трещина или расслоение бляшки. |
| Тип 2 | Инфаркт миокарда, вторичный по отношению к ишемии, возникшей либо из-за повышения потребности в кислороде, либо из-за снижения его доставки, например, из-за спазма коронарной артерии, коронарной эмболии, анемии, гипертонии или гипотонии. |
| Тип 3 | Внезапная сердечная смерть, включая остановку сердца, часто с симптомами, заставляющими предположить наличие ишемии миокарда, сопровождающимися новыми подъемами сегмента ST, или новой блокады левой ножки пучка Гиса, или признаками свежего тромба в коронарной артерии по данным ангиографии и/или аутопсии. Смерть наступает или до взятия проб крови, или до появления сердечных биомаркеров в крови. |
| Тип 4а | Инфаркт миокарда, связанный (ассоциируемый) с чрескожным коронарным вмешательством (ЧКВ). |
| Тип 4b | Инфаркт миокарда, связанный с тромбозом стента, что документировано ангиографией или аутопсией. |
| Тип 5 | Инфаркт миокарда, связанный с операцией аорто-коронарного шунтирования. |
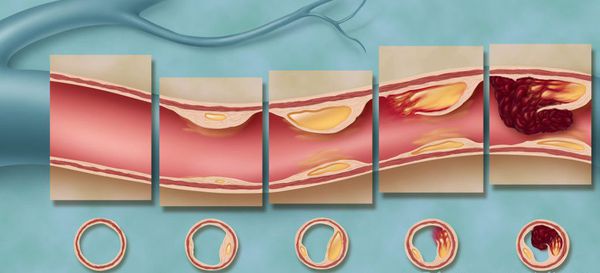
В зависимости от размеров очагового поражения сердечной мышцы, выделяют два вида инфаркта миокарда:
— мелкоочаговый;
— крупноочаговый.
Около 20% клинических случаев приходится на долю мелкоочаговых инфарктов миокарда, однако часто мелкие очаги некроза в сердечной мышце трансформируются в крупноочаговый инфаркт миокарда (у 30% пациентов).
При мелкоочаговых инфарктах, в отличие от крупноочаговых, не возникают
аневризма
и разрыв сердца. Также течение мелкоочаговых инфарктов реже осложняется сердечной недостаточностью,
тромбоэмболией
,
фибрилляцией желудочков
.
В соответствии с глубиной некротического поражения сердечной мышцы различают следующие виды инфаркта миокарда:
— трансмуральный — с некрозом всей толщи мышечной стенки сердца (чаще крупноочаговый);
— интрамуральный – с некрозом в толще миокарда;
— субэндокардиальный – с некрозом миокарда в зоне прилегания к эндокарду;
— субэпикардиальный — с некрозом миокарда в зоне прилегания к эпикарду.
Согласно изменениям, фиксируемым на ЭКГ, выделяют:
— «Q-инфаркт» — с формированием патологического зубца Q, иногда желудочкового комплекса QS (чаще — крупноочаговый трансмуральный инфаркт миокарда);
— «не Q-инфаркт» – не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами (чаще — мелкоочаговый инфаркт миокарда).
По топографии и в зависимости от поражения определенных ветвей коронарных артерий, инфаркт миокарда бывает:
— правожелудочковый;
— левожелудочковый: передней, боковой и задней стенок, межжелудочковой перегородки.
По кратности возникновения инфаркт миокарда подразделяется на:
— первичный;
— рецидивирующий (развивается в срок до 8 недель после первичного);
— повторный (развивается спустя 8 недель после предыдущего).
По развитию осложнений инфаркт миокарда может быть:
— осложненный;
— неосложненный.
По наличию и локализации болевого синдрома различают следующие формы инфаркта миокарда:
— типичная – с локализацией боли за грудиной или в
прекордиальной области
;
— атипичная — с атипичными болевыми проявлениями:
а) периферические: леволопаточная, леворучная, гортанно-глоточная, нижнечелюстная, верхнепозвоночная, гастралгическая (абдоминальная);
б) безболевые: коллаптоидная, астматическая, отечная, аритмическая, церебральная;
— малосимптомная (стертая);
— комбинированная.
В соответствии с периодом и динамикой развития инфаркта миокарда выделяют:
— стадию ишемии (острейший период);
— стадию некроза (острый период);
— стадию организации (подострый период);
— стадию рубцевания (постинфарктный период).
Этиология и патогенез
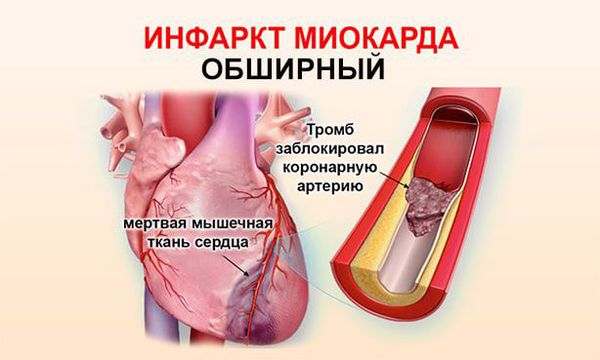
Непосредственной причиной развития инфаркта миокарда (ИМ) является остро наступающее несоответствие коронарного кровообращения запросам миокарда вследствие окклюзии коронарной артерии или резкого уменьшения притока крови по ней с последующей ишемией и некрозом.
Инфаркт миокарда с патологическими зубцами Q (тромботическая окклюзия коронарной артерии) развивается у 80% больных с инфарктом миокарда и приводит к трансмуральному некрозу миокарда и появлению зубца Q на ЭКГ.
Инфаркт миокарда без патологических зубцов Q наиболее часто возникает при спонтанном восстановлении
перфузии
или хорошо развитых
коллатералях
. Размер инфаркта в этом случае меньше, функция левого желудочка страдает меньше, больничная летальность ниже. Однако частота повторных инфарктов миокарда выше, чем при инфаркте миокарда с патологическими зубцами Q, вследствие того, что такие инфаркты миокарда — «незавершенные» (то есть миокард, оставшийся жизнеспособным, снабжается пораженной коронарной артерией); к концу первого года летальность уравнивается. Поэтому при инфаркте миокарда без патологических зубцов Q следует придерживаться более активной лечебно-диагностической тактики.
В основе развития ИМ лежат три патофизиологических механизма:
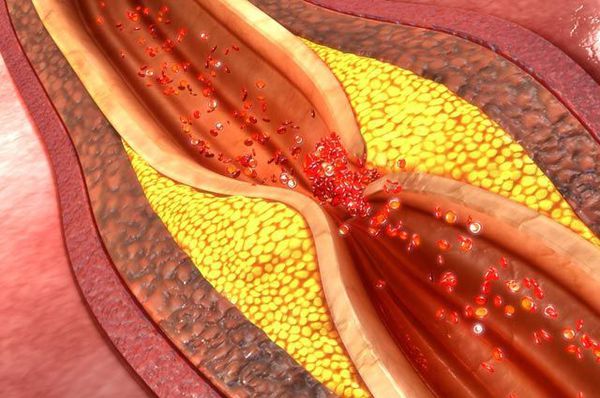
1. Разрыв атеросклеротической бляшки, спровоцированный внезапным повышением активности симпатической нервной системы (резкое повышение артериального давления, частоты и силы сердечных сокращений, усиление венечного кровообращения).
2. Тромбоз на месте разорванной или даже
интактной
бляшки в результате повышения тромбогенной способности крови (за счет усиления
агрегации
тромбоцитов, активации коагулянтной системы и/или ингибирования
фибринолиза
).
3.
Вазоконстрикция
: локальная (участка коронарной артерии, где находится бляшка) или генерализованная (всей коронарной артерии).
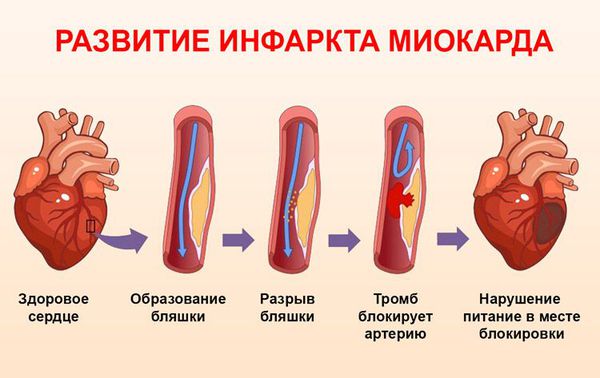
Первый этап развития острого инфаркта миокарда (ОИМ), хотя и не всегда обязательный — разрыв атеросклеротической бляшки, который в дальнейшем может иметь различное течение:
1. Благоприятное течение — когда после разрыва бляшки происходит кровоизлияние в бляшку, так называемый «внутреннеинтимальный» тромб, что не вызывает развития инфаркта миокарда, но в дальнейшем может способствовать прогрессированию клинической картины ишемической болезни сердца (ИБС).
2. Неблагоприятное течение — с формированием тромба, который полностью или практически полностью перекрывает просвет венечной артерии.
Выделяют три стадии формирования тромба,
обтурирующего
коронарную артерию:
1. Кровоизлияние в бляшку.
2. Формирование внутрисосудистого неокклюзирующего тромба.
3. Распространение тромба до полной закупорки сосуда.
Внутреннеинтимальный тромб состоит в основном из тромбоцитов. Формирование тромба является ключевым в развитии ОИМ.
Гораздо реже ОИМ возникает не как результат атеротромбоза. Ведущим патогенетическим механизмом в этом случае рассматривается
вазоспазм
.
Инфаркт миокарда как результат
коронароспазма
достаточно часто наблюдается у людей, принимающих наркотики, так называемый «кокаиновый» инфаркт миокарда.
Значительно реже инфаркт миокарда развивается в результате других причин.
Морфологические особенности
Инфаркт — заболевание всегда острое и стадийное. При инфаркте миокарда отмечают, что в первые сутки зона инфаркта внешне никак не отличается от здоровых участков миокарда. Зона инфаркта в это время носит мозаичный характер, то есть среди погибших клеток встречаются также частично или даже полностью работоспособные миоциты. На вторые сутки зона постепенно отграничивается от здоровой ткани и между ними формируется периинфарктная зона.
Часто в периинфарктной зоне различают зону очаговой дистрофии, граничащую с некротической зоной, и зону обратимой ишемии, примыкающую к участкам неповрежденного миокарда.
Все структурные и функциональные изменения в зоне очаговой дистрофии в большинстве случаев подлежат восстановлению (частично или даже полностью).
В зоне обратимой ишемии изменения бывают полностью обратимы. После отграничения зоны инфаркта наступает постепенное размягчение и растворение погибших миоцитов, элементов соединительной ткани, участков сосудов, нервных окончаний.
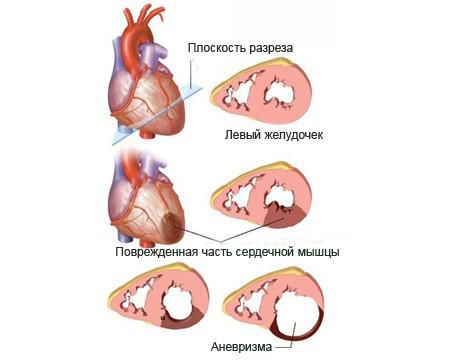
При крупноочаговом инфаркте миокарда примерно на 10-е сутки на периферии очага некроза уже образуется молодая грануляционная ткань, из которой в дальнейшем формируется соединительная ткань, выполняющая рубец. Заместительные процессы идут от периферии к центру, поэтому в центре очага какое-то время могут еще оставаться очаги размягчения, а это участок, который способен растягиваться, формируя аневризму сердца или даже разрываться при грубом несоблюдении двигательного режима или других нарушениях. В месте некроза плотная рубцовая ткань окончательно формируется не ранее чем через 3-4 месяца.
При мелкоочаговом инфаркте миокарда рубец иногда образуется в более ранние сроки. На скорость рубцевания влияют не только размеры очага некроза, но и состояние коронарного кровообращения в миокарде, в особенности в периинфарктных участках. Помимо этого, имеют значение следующие факторы:
— возраст больного;
— уровень АД;
— двигательный режим;
— состояние обменных процессов;
— обеспеченность пациента полноценными аминокислотами, витаминами;
— адекватность проводимого лечения;
— наличие сопутствующих заболеваний.
Все это определяет интенсивность восстановительных процессов в организме в целом и в миокарде в частности.
Даже относительно небольшая нагрузка в период формирования первичного рубца может привести к развитию аневризмы сердца (выпячиванию стенки желудочка, формированию своеобразного мешка), тогда как уже через месяц такая же нагрузка оказывается полезной и даже необходимой для укрепления сердечной мышцы и формирования более прочного рубца.
Эпидемиология
Признак распространенности: Очень распространено
Сегодня в развитых странах число пациентов с коронарной патологией постоянно растет, причем происходит сдвиг в сторону более молодого возраста, что делает проблему диагностики, лечения и профилактики ишемической болезни социально значимой.
Заболеваемость среди мужчин гораздо выше, чем среди женщин: в среднем 500 на 100 000 мужчин и 100 на 100 000 женщин, в возрасте старше 70 лет эта разница нивелируется.
Возрастной пик заболеваемости инфарктом миокарда — 50-70 лет.
У мужчин пик заболеваемости приходится на зимнее время, у женщин — на осень, снижение заболеваемости у мужчин и женщин происходит одновременно в летний период времени.
Самыми опасным временем суток у мужчин считаются предутренние часы (4-8 часов утра), когда частота развития ИМ достигает 23,9%; у женщин аналогичный показатель составляет 25,9% в утренние часы (8-12 часов). Такая частота развития ИМ в зависимости от сезонности и времени суток совпадает с аналогичными показателями «внезапной смерти».
Внезапная смерть обычно происходит в утренние часы при подъеме больного с постели, что вероятнее всего связано с повышением активности симпатической нервной системы при пробуждении. Это вызывает увеличение вязкости крови и агрегационную активность тромбоцитов с выбросом
вазоактивных
биологических веществ, за чем следует спазм сосудов и тромбообразование, с развитием ишемического инсульта или острого инфаркта миокарда (ОИМ).
Примерно одна треть всех случаев ОИМ (а у более молодых больных еще чаще) завершается летальным исходом на догоспитальном этапе, в большинстве случаев уже через 1 час после появления острых симптомов. Среди пациентов с ОИМ, доживших до поступления в больницу, в результате проведенной современной терапии отмечаются меньшая летальность и более продолжительная выживаемость.
Смерть больных ОИМ в первые 4 часа связана с появлением аритмий и развитием
фибрилляции желудочков
(аритмогенная смерть), а в более поздние сроки — с нарастанием острой сердечной недостаточности (кардиогенный шок).
Факторы и группы риска
Факторы риска развития инфаркта миокарда (ИМ) совпадают с таковыми при ишемической болезни сердца (ИБС).
Немодифицируемые факторы риска:
1. Наследственность. Считается отягощенной по ИБС, если у близких родственников (родители, братья, сестры, дедушки, бабушки) были случаи ИБС по мужской линии до 55 лет, по женской до 65 лет.
2. Возраст. В разных популяциях выявлена прямая зависимость между возрастом человека и частотой возникновения ИБС — чем старше человек, тем выше заболеваемость ИБС.
3. Пол. Мужчины гораздо чаще болеют ИБС. У женщин до 50-55 лет (возраст наступления стойкой менопаузы) ИБС диагностируется крайне редко. Исключение составляют женщины с ранней менопаузой и различными гормональными нарушениями при отягчающих обстоятельствах:
артериальная гипертония
,
гиперлипидемия
, сахарный диабет. После наступления менопаузы частота возникновения ИБС у женщин начинает неуклонно расти, и после 70-75 лет вероятность развития ИБС у мужчин и женщин одинакова.
Модифицируемые факторы риска:
1. Неправильное питание. Употребление пищи, богатой насыщенными жирами животного происхождения, с высоким содержанием поваренной соли и низким содержанием пищевой клетчатки.
2. Артериальная гипертония. Значение повышенного артериального давления, как одного из факторов риска, доказано многочисленными исследованиями во всем мире.
3.
Гиперхолестеринемия
. Повышенное содержание в крови общего холестерина, холестерина липопротеидов низкой плотности. Холестерин липопротеидов высокой плотности рассматривается как фактор антириска — чем выше его уровень, тем меньше риск возникновения ИБС.
4. Слабая физическая активность или отсутствие регулярных физических нагрузок. У людей, ведущих малоподвижный образ жизни, вероятность возникновения ИБС в 1,5-2,4 выше, чем у физически активных.
5. Ожирение. Особенно опасно ожирение по абдоминальному типу, когда жир откладывается в области живота.
6. Табакокурение. Прямая связь курения с развитием и прогрессированием атеросклероза хорошо известна и не нуждается в комментариях.
7. Сахарный диабет. Относительный риск смерти даже у лиц с нарушением толерантности к глюкозе выше на 30%, а у больных сахарным диабетом 2 типа — на 80%.
8. Злоупотребление алкоголем. Однако фактором антириска является употребление до 30 г чистого алкоголя в сутки для мужчин и 20 г — для женщин.
9. Во всем мире сейчас уделяется внимание изучению таких факторов риска, как хронический психоэмоциональный стресс, повышенная частота сердечных сокращений, нарушение системы свертываемости, гомоцистеинемия (повышение уровня в крови
гомоцистеина
).
Ученые также установили зависимость риска развития инфаркта миокарда в зависимости от психо-эмоционального типа человека. Так, холерики имеют в 2 раза больше шансов получить первый инфаркт и в 5 раз больше — повторный, а смертность от инфаркта у них встречается в 6 раз чаще.
Провоцирующими моментами для развития острого инфаркта миокарда (ОИМ) являются интенсивное физическое или психоэмоциональное напряжение. На протяжении часа после значительного физического напряжения риск развития ОИМ возрастает в 6 раз, причем у лиц, ведущих малоподвижный образ жизни, — в 10,7 раза, а у лиц, занимающихся интенсивными физическими упражнениями, — в 2,4 раза. Подобным эффектом обладают и сильные переживания. В течение 2 часов после психоэмоционального перенапряжения риск развития ОИМ возрастает в 2,3 раза.
Частота развития ОИМ возрастает в утренние часы, в течение первого часа после пробуждения. Это касается и частоты развития внезапной смерти, инсульта, транзиторной ишемии миокарда, по данным Холтеровского наблюдения. Повышение риска связывают с увеличением в это время артериального давления и
ЧСС
, усилением
агрегационных
свойств тромбоцитов и снижением
фибринолитической
активности плазмы крови, повышением уровня
катехоламинов
,
АКТГ
,
кортизола
.
Похолодание и изменение атмосферного давления также способствуют повышению риска развития ОИМ. Так, при снижении температуры на 10°С, по сравнению со среднегодовой для данного времени года, риск развития первого ИМ возрастает на 13%, а повторного — на 38%. Изменения атмосферного давления, как в одну, так и в другую сторону, сопровождаются учащением развития ИМ на 11-12%, а повторного — на 30%.
Клиническая картина
Cимптомы, течение
Фазы острого инфаркта миокарда (ОИМ):
1. Продромальный период (длится до 30 суток, может отсутствовать).
2. Острейший период (продолжается до 2 часов от начала
ангинозного статуса
).
3. Острый период (длится до 10 дней от начала инфаркта миокарда).
4. Подострый период (начинается с 10 дня и продолжается до 1-2 месяцев).
5. Период рубцевания (в среднем длится от 2-3 месяцев до полугода, иногда завершается лишь спустя 2-3 года).
В зависимости от стадии болезни ее проявления сильно варьируют.
Продромальный период
В этот период у пациентов развиваются признаки
нестабильной стенокардии
:
— учащаются боли в груди;
— боли появляются при меньших физических нагрузках, а то и вовсе в покое;
— боли хуже снимаются нитратами, требуется большая доза нитратов, чтобы боль прошла.
Острый коронарный синдром (ОКС) объединяет такие заболевания, как нестабильная стенокардия, острый инфаркт миокарда и внезапная сердечная смерть. В основе всех этих состояний, несмотря на разные их проявления, лежит один механизм. Как при инфаркте, так и при
нестабильной стенокардии
нарушается целостность одной из холестериновых бляшек в коронарной артерии. Организм реагирует на образовавшийся дефект, отправляя в очаг тромбоциты и активируя свертывающую систему крови. Как следствие, образуется тромб, перекрывающий ток крови. Кратковременное или неполное перекрытие просвета сосуда вызывает развитие симптомов
нестабильной стенокардии
. Если закупорка усугубляется, происходит инфаркт.
В связи с этим пациентов с нестабильной стенокардией необходимо экстренно госпитализировать.
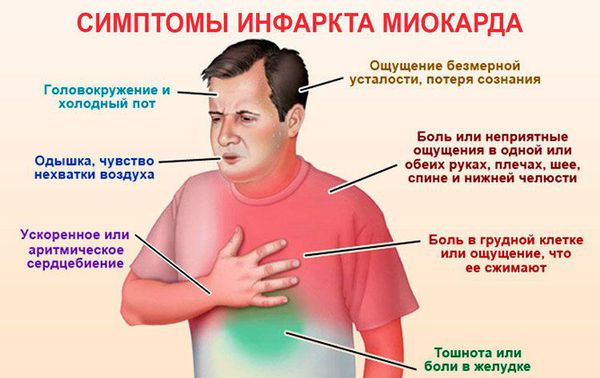
Острейший период
В этот период наблюдается самая высокая летальность от инфаркта миокарда. В то же время, острейший период – самый благоприятный в плане терапии. Существуют препараты, которые разрушают образовавшийся тромб, тем самым восстанавливая нарушенный ток крови по сосуду. Однако эти лекарства эффективны лишь в течение первых 12 часов с момента развития инфаркта, и чем раньше они применены, тем лучше будет результат.
В острейший период появляется ангинозный статус — очень интенсивная боль, которая локализуется либо за грудиной, либо в левой половине грудной клетки. Пациенты описывают боль как кинжальную, сверлящую или давящую («сердце сжало в тисках»). Зачастую боль накатывает волнами, может отдавать в левое плечо, руку, межлопаточную область, нижнюю челюсть. Иногда она распространяется на правую половину грудной клетки и в верхнюю половину живота.
Боль в целом схожа с таковою во время приступа стенокардии, но интенсивность ее гораздо выше, она не проходит после приема 2-3 таблеток нитроглицерина и обычно длится от 30 минут и дольше.
Помимо боли нередко наблюдается холодный пот, выраженная общая слабость. Артериальное давление чаще снижается в результате уменьшения силы сокращений поврежденного сердца, реже — повышается, поскольку организм в ответ на стресс выбрасывает большое количество адреналина, оказывающего стимулирующее влияние на работу сердечно-сосудистой системы. Почти всегда при инфаркте миокарда пациенты испытывают выраженную тревогу, страх смерти.
Важно знать, что у 20% пациентов острейший период инфаркта протекает малосимптомно (так называемая «безболевая» форма инфаркта миокарда). Такие пациенты отмечают неясную тяжесть в груди («сердечную тоску»), выраженную утомляемость, недомогание, бессонницу, «беспричинную» тревогу.
Еще у части больных инфаркт миокарда может проявлять себя развитием нарушений ритма и проводимости. Такие пациенты ощущают перебои в работе сердца, возможно — резкое учащение, или, напротив, замедление пульса. Могут появляться головокружение, выраженная слабость, эпизоды потери сознания.
Иногда инфаркт миокарда может манифестировать внезапно возникшей одышкой или отеком легких.
Симптоматика клинических вариантов острейшей фазы инфаркта миокарда
|
Болевой (status anginosus) |
Типичное клиническое течение, основным проявлением при котором служит ангинозная боль, не зависящая от позы и положения тела, от движений и дыхания, устойчивая к нитратам. Боль имеет давящий, душащий, жгущий или раздирающий характер с локализацией за грудиной, во всей передней грудной стенке с возможной иррадиацией в плечи, шею, руки, спину, эпигастальную область. Характерно сочетание с гипергидрозом, резкой общей слабостью, бледностью кожных покровов, возбуждением, двигательным беспокойством. |
|
Абдоминальный (status gastralgicus) |
Проявляется сочетанием эпигастральных болей с диспептическими явлениями — тошнотой, не приносящей облегчения рвотой, икотой, отрыжкой, резким вздутием живота. Возможны иррадиация болей в спину, напряжение брюшной стенки и болезненность при пальпации в эпигастрии. |
| Атипичный болевой | Болевой синдром имеет атипичный характер по локализации (например, только в зонах иррадиации — горле и нижней челюсти, плечах, руках и т.д.) и/или по характеру. |
|
Астматический (status astmaticus) |
Единственный признак — приступ одышки, являющийся проявлением острой застойной сердечной недостаточности (сердечная астма или отек легких). |
| Аритмический | Нарушения ритма служат единственным клиническим проявлением или преобладают в клинической картине. |
| Цереброваскулярный | В клинической картине преобладают признаки нарушения мозгового кровообращения (чаще — динамического): обморок, головокружение, тошнота, рвота. Возможна очаговая неврологическая симптоматика. |
| Малосимптомный (бессимптомный) | Наиболее сложный для распознавания вариант, нередко диагностируемый ретроспективно по данным ЭКГ. |
Острый период
В этом периоде острая боль стихает, поскольку процесс разрушения кардиомиоцитов завершен, а некротизированные ткани не чувствительны к боли. Большинство больных могут отмечать сохранение остаточных болей: глухих и постоянных, как правило, локализующихся за грудиной.
На вторые сутки ферменты из поврежденных клеток и разрушенные ткани попадают в кровь, вызывая температурную реакцию: может появляться лихорадка до 39°С, а также недомогание, слабость, потливость.
Действие стрессовых гормонов (адреналина, норадреналина, дофамина) утихает, в результате чего артериальное давление снижается, иногда очень значительно.
В этот период могут появляться тупые боли в груди, усиливающиеся при дыхании, что является признаком развития плевроперикардита. У части больных интенсивные давящие боли в сердце могут возобновиться — в таком случае диагностируется постинфарктная стенокардия либо рецидив инфаркта миокарда.
Поскольку рубец еще не сформирован, а часть мышечных клеток сердца разрушена, в этот период очень важно минимизировать физическую активность, стресс. При несоблюдении этих правил может развиться аневризма сердца или наступить смерть от разрыва сердца.
Подострый период
В этот период болевые ощущения, как правило, отсутствуют. Учитывая тот факт, что сократительная способность сердца снижена, поскольку участок миокарда «выключен» из работы, могут появиться симптомы сердечной недостаточности: одышка, отеки ног. В целом же состояние пациента улучшается: температура нормализуется, артериальное давление стабилизируется, риск развития аритмии уменьшается.
В сердце происходят процессы рубцевания: организм устраняет образовавшийся дефект, замещая разрушенные кардиомиоциты соединительной тканью.
Период рубцевания инфаркта миокарда
В этот период продолжается и завершается образование полноценного рубца из грубоволокнистой соединительной ткани. Самочувствие пациента зависит от величины площади поражения и наличия или отсутствия осложнений инфаркта миокарда.
В целом, состояние нормализуется. Болевых ощущений в сердце нет либо имеется стабильная стенокардия определенного функционального класса. Человек привыкает к новым условиям жизни.
Диагностика
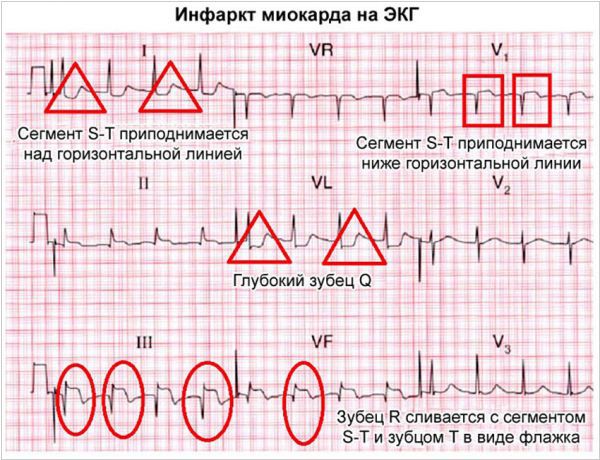
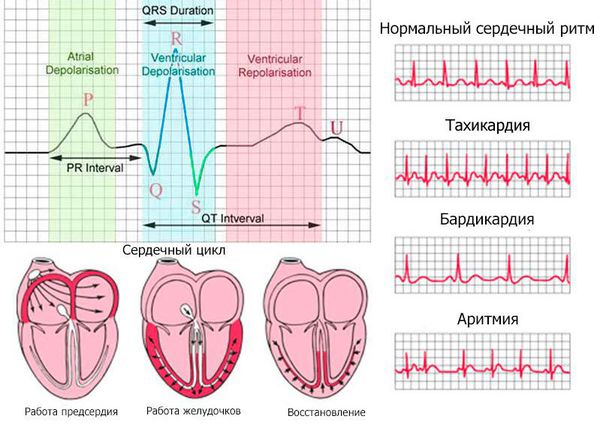
Электрокардиография — важнейший метод диагностики инфаркта миокарда (ИМ), позволяющий:
— выявить ИМ;
— установить локализацию ИМ, его глубину и распространенность;
— диагностировать осложнения ИМ (аритмии, формирование аневризмы сердца)
ЭКГ при ИМ формируется под влиянием трех зон, образующихся в области инфаркта и представленных в таблице ниже (Bayley)
|
Зона некроза — в центре очага поражения |
Трансмуральный ИМ | Патологический зубец Q |
| Нетрансмуральный ИМ | Отсутствие или невыраженность патологического зубца Q | |
| Зона повреждения — к периферии от зоны некроза, окружает ее | Субэндокардиальный ИМ | Депрессия сегмента ST |
| Субэпикардиальный или трансмуральный ИМ | Элевация сегмента ST | |
| Зона ишемии — кнаружи от зоны повреждения | Субэндокардиальный ИМ | Высокий и широкий зубец Т (высокий коронарный зубец Т) |
| Субэпикардиальный илитрансмуральный ИМ | Отрицательный симметричный зубец Т с заостренной вершиной (отрицательный коронарный зубец Т) |
Диагностика стадии ИМ (в динамике)
Топическая диагностика (локализация) ИМ
В таблице знаком (+) обозначено смещение вверх сегмента RS-Т или положительный зубец Т, знаком (–) — смещение сегмента RS-Т вниз от изолинии или отрицательный зубец Т.
| Локализация ИМ |
Отведения |
Характер изменений ЭКГ |
| Переднеперегородочный |
V1-V3 |
1) Q или QS 2) +(RS-T) 3) -Т |
| Передневерхушечный |
V3,V4 |
1) Q или QS 2) +(RS-T) 1) -Т |
| Переднебоковой |
I, aVL, V5, V6 |
1) Q 2) +(RS-T) 3) -Т |
| Распространенный передний |
I, aVL, V1-V6 |
1) Q или QS 2) +(RS-T) 3) -Т |
|
III, aVF |
Реципрокные изменения: 1) -(RS-T) 2) + Т (высокие) |
|
| Высокий передний (переднебазальный) |
V24-V26, V34- V36 |
1) Q или QS 2) +(RS-T) 3) -Т |
| Заднедиафрагмальный (нижний) |
III, aVF или III, II, aVF |
1) Q или QS 2) + (RS-T) 3) -T |
|
V1-V4 |
Реципрокные изменения: 1) -{RS-T) 2) + Т (высокие) |
|
| Заднебазальный |
V7–V9 (не всегда) |
1) Q или QS 2) +(RS-T) 3) -Т. |
|
V1– V3 |
Реципрокные изменения: 1) -(RS-T), 2) +Т (высокие); 3) Увеличение R. |
|
| Заднебоковой |
V5, V6, Ill, aVF |
1) Q 2) +(RS-T) 3) -Т |
|
V1-V3 |
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) + T (высокие). |
|
| Распространенный задний |
III, aVF, III, V5, V6, V7-9 |
1) Q или QS 2) +(RS-T) 3) -Т |
|
V1-V3 |
Реципрокные изменения: 1) увеличение R 2) -(RS-T) 3) +T (высокие). |
Прекардиальное электрокардиографическое картирование сердца
Исследование применяется при остром инфаркте миокарда передней и переднебоковой стенок левого желудочка для косвенного определения размеров зоны некроза и периинфарктной зоны (участок ишемического повреждения). С этой целью после регистрации ЭКГ с 35 точек на поверхности грудной клетки строят картограмму, состоящую из 35 квадратов, каждый из которых соответствует одному из 35 отведений.
Размеры зоны некроза условно оценивают по количеству отведений, в которых выявляются признаки трансмурального некроза – комплекс QS. Это так называемая «площадь трансмурального некроза» (AQS).
Параметры определения величины периинфарктной зоны:
1. Количество отведений (квадратов), в которых регистрируется подъем сегмента RS-Т выше изолинии. Это площадь RS-T (ARS-T).
2. Величина суммарного подъема сегмента RS-Т во всех отведениях (квадратах) картограммы, в которых фиксируется ишемическое повреждение миокарда (ERS-Т).
3. Значение среднего индивидуального подъема сегмента RS-T (NRS-T), который рассчитывается по формуле: NRS – T= ERS – T/ARS–T
Указанные картографические показатели с успехом используются для наблюдения за динамикой зон некроза и периинфарктной зоны в процессе лечения больных острым инфарктом миокарда, а также для оценки прогноза заболевания; чем выше все описанные показатели, тем больше площадь и глубина поражения миокарда и, соответственно, тем хуже прогноз заболевания.
Коронарография
«Золотой стандарт» диагностики ишемической болезни сердца (ИБС). Больные с многососудистым поражением или поражением ствола левой венечной артерии имеют более высокий риск сердечно-сосудистых событий. Роль коронарографии в оценки критичности бляшки и других повреждений исключительно важна, если предполагается последующая
реваскуляризация
.
Сложные стенозы, бифуркационные поражения и извитость стенозированных сосудов служат показателями высокого риска. Самый высокий риск имеется при дефектах наполнения, так как при этом существуют внутрисосудистые тромбы. У 10-15% пациентов с болью в груди нет поражения венечных артерий и у них диагноз ИБС исключается.
Компьютерная томография
В настоящее время данное исследование не может заменить коронарографию при остром коронарном синдроме из-за субоптимальной диагностической точности.
КТ сердца не является оптимальным методом диагностики у больных с острым коронарным синдром из-за высокой вероятности в необходимости выполнения коронарной ангиопластики со стентированием. Это обусловлено тем, что на проведение КТ теряется время, пациент получает контрастный препарат и дозу облучения.
Двухмерная ЭхоКГ
Систолическая функция левого желудочка — важный прогностический показатель для больного с ИБС. Регионарные нарушения сократимости могут наступить сразу после ишемии, задолго до некроза, но они неспецифичны для острых событий и могут быть результатом старого инфаркта миокарда.
Транзиторная локальная акинезия и гипокинезия сегментов левого желудочка могут определяться в ходе ишемии, с восстановлением нормальной кинетики стенки при прохождении ишемии.
Отсутствие нарушений локальной сократимости исключает наличие ИМ.
ЭхоКГ имеет ценность для диагностики других причин болей в груди — расслоение и разрыв аорты, гипертрофическая
кардиомиопатия
,
перикардит
и массивная
ТЭЛА
.
Перфузионная сцинтиграфия
Обычно этот метод исследования недоступен, поэтому у острых больных он используется редко. Нормальная сцинтиграмма миокарда с 99Th в покое достоверно исключает крупноочаговый ИМ. Однако ненормальная сцинтиграмма не указывает на острый ИМ, если только нет данных, что раньше сцинтиграмма была нормальной, до наступления острого состояния, но она указывает на наличие ИБС и необходимость дальнейшего обследования.
Магнитно-резонансная томография
МРТ сердца еще пока не стала рутинной процедурой для визуализации венечных сосудов, но позволяет получить информацию о регионарной сократимости, перфузии и жизнеспособности миокарда. Это позволяет идентифицировать больных с ОКС и острым ИМ. Кроме того, МРТ может исключить или подтвердить другие причины боли в груди — миокардит,
перикардит
, расслаивающую аневризму аорты и
ТЭЛА
Лабораторная диагностика
Лабораторное подтверждение острого инфаркта миокарда (ОИМ) основано на выявлении:
— неспецифических показателей тканевого некроза и воспалительной реакции миокарда;
— гиперферментемии (входит в классическую триаду признаков ОИМ: болевой синдром, типичные изменения ЭКГ, гиперферментемия).
Неспецифические показатели тканевого некроза и воспалительной реакции миокарда:
1. Лейкоцитоз, не превышающий обычно 12-15*109/л (выявляются обычно к концу первых суток от начала заболевания и при неосложненном течении инфаркта сохраняются примерно в течение недели).
2. Анэозинофилия.
3. Небольшой палочкоядерный сдвиг формулы крови влево.
4. Увеличение СОЭ (увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2-3 недель и дольше даже при отсутствии осложнений ИМ).
Правильная трактовка этих показателей возможна только при сопоставлении с клинической картиной заболевания и данными ЭКГ.
Длительное сохранение (более 1 недели) лейкоцитоза или/и умеренной лихорадки у больных ОИМ свидетельствует о возможном развитии осложнений: (пневмония,
плеврит
, перикардит, тромбоэмболия мелких ветвей легочной артерии и другие).
Гиперферментемия
Основной причиной повышения активности и содержания ферментов в сыворотке крови у больных ОИМ является разрушение кардиомиоцитов и выход высвобождающихся клеточных ферментов в кровь.
Наиболее ценным для диагностики ОИМ является определение активности нескольких ферментов в сыворотке крови:
— креатинфосфокиназы (КФК) и особенно ее МВ-фракции (МВ-КФК);
— лактатдегидрогеназы (ЛДГ) и ее изофермента 1 (ЛДГ1);
— аспартатаминотрансферазы (АСТ);
— тропонина;
— миоглобина.
Повышение активности МВ-фракции КФК, содержащейся преимущественно в миокарде, специфично для повреждения сердечной мышцы, в первую очередь, для ОИМ. МВ-фракция КФК не реагирует на повреждение скелетных мышц, головного мозга и щитовидной железы.
Динамика МВ-КФК при ОИМ:
— через 3-4 часа активность начинает возрастать;
— через 10-12 часов достигает максимума;
— через 48 часов от начала ангинозного приступа возвращается к исходным цифрам.
Степень повышения активности МВ-КФК в крови в целом хорошо коррелирует с размером ИМ — чем больше объем поражения сердечной мышцы, тем выше активность МВ-КФК 1.
Динамика КФК при ОИМ:
— к концу первых суток уровень фермента в 3-20 раз превышает норму;
— через 3-4 суток от начала заболевания возвращается к исходным значениям.
1 Следует помнить, что любые кардиохирургические вмешательства (включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию), как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК.
В литературе имеются также указания на возможность повышения уровня МВ-КФК при тяжелой пароксизмальной тахиаритмии, миокардитах и длительных приступах стенокардии покоя, расцениваемых как проявление нестабильной стенокардии.
В ряде случаев при обширных инфарктах миокарда вымывание ферментов в общий кровоток замедлено, поэтому абсолютное значение активности МВ-КФК и скорость его достижения могут оказаться меньше, чем при обычном вымывании фермента, хотя и в том, и в другом случае площадь под кривой “концентрация-время” остается одинаковой.
Лактатдегидрогеназа
Активность ЛДГ при ОИМ нарастает медленнее, чем КФК и МВ-КФК, и дольше остается повышенной 2.
Динамика ЛДГ при ОИМ:
— через 2-3 суток от начала инфаркта наступает пик активности;
— к 8-14 суткам происходит возвращение к исходному уровню.
2 Следует помнить, что активность общей ЛДГ повышается также при заболеваниях печени, шоке, застойной недостаточности кровообращения, гемолизе эритроцитов и мегалобластной анемии, ТЭЛА, миокардите, воспалении любой локализации, коронароангиографии, электроимпульсной терапии, тяжелой физической нагрузке и т. д.
Изофермент ЛДГ1 более специфичен для поражений сердца, хотя он также присутствует не только в мышце сердца, но и в других органах и тканях, включая эритроциты.
Аспартатаминотрансфераза
Динамика АСТ при ОИМ:
— через 24-36 часов от начала инфаркта относительно быстро наступает пик повышения активности;
— через 4-7 суток концентрация АСТ возвращается к исходному уровню.
Изменение активности АСТ неспецифично для ОИМ: уровень АСТ вместе с активностью АЛТ повышается при многих патологических состояниях, в том числе при заболеваниях печени 3.
3 При поражениях паренхимы печени в большей степени возрастает активность АЛТ, а при заболеваниях сердца в большей степени возрастает активность АСТ. При ИМ отношение АСТ/АЛТ (коэффициент де Ритиса) больше 1,33, а при заболеваниях печени отношение АСТ/АЛТ меньше 1,33.
Тропонин
Тропонин представляет собой универсальную для поперечно-полосатой мускулатуры структуру белковой природы, локализующуюся на тонких миофиламентах сократительного аппарата миокардиоцита.
Сам тропониновый комплекс состоит из трех компонентов:
— тропонин С — ответственный за связывание кальция;
— тропонин Т — предназначен для связывания тропомиозина;
— тропонина I — предназначен для ингибирования выше указанных двух процессов.
Тропонин Т и I существуют в специфичных для миокарда изоформах, отличающихся от изоформ скелетных мышц, чем и обусловливается их абсолютная кардиоспецифичность 4.
Динамика тропонинов при ОИМ:
— спустя 4-5 часов после гибели кардиомиоцитов вследствие развития необратимых некротических изменений, тропонин поступает в периферический кровоток и определяются в венозной крови;
— в первые 12-24 часа от момента возникновения ОИМ достигается пик концентрации.
Кардиальные изоформы тропонина длительно сохраняют свое присутствие в периферической крови:
— тропонин I определяется на протяжении 5-7 дней;
— тропонин Т определяется до 14 дней.
Присутствие этих изоформ тропонина в крови пациента выявляется при помощи
ИФА
с использованием специфических антител.
4 Следует помнить, что тропонины не являются ранними биомаркерами ОИМ, поэтому у рано обратившихся больных с подозрением на острый коронарный синдром при отрицательном первичном результате необходимо повторное (через 6-12 часов после болевого приступа) определение содержания тропонинов в периферической крови. В этой ситуации даже незначительное повышение уровня тропонинов свидетельствует о дополнительном риске для больного, поскольку доказано существование четкой корреляции между уровнем возрастания тропонина в крови и размером зоны поражения миокарда.
Многочисленными наблюдениями было показано, что повышенный уровень тропонина в крови больных с острым коронарным синдромом может рассматриваться как достоверный показатель наличия у пациента ОИМ. В то же время низкий уровень тропонина у этой категории больных свидетельствует в пользу постановки более мягкого диагноза нестабильной стенокардии.
Миоглобин
Специфичность миоглобина для диагностики ОИМ примерно такая же, как КФК, но ниже, чем МВ-КФК.
Уровень миоглобина может повышаться в 2-3 раза после внутримышечных инъекций, и диагностически значимым обычно считают повышение в 10 и более раз.
Подъем уровня миоглобина в крови начинается даже раньше, чем повышение активности КФК. Диагностически значимый уровень зачастую достигается уже через 4 часа и в подавляющем большинстве случаев наблюдается через 6 часов после болевого приступа.
Высокая концентрация миоглобина в крови наблюдается только в течение нескольких часов, поэтому, если не повторять анализ каждые 2-3 часа, пик концентрации можно пропустить. Измерение концентрации миоглобина может быть применено только в случаях поступления больных в стационар менее чем через 6-8 часов после начала болевого приступа.
Принципы ферментативной диагностики ОИМ
1. У пациентов, поступивших в течение первых 24 часов после ангинозного приступа, производится определение активности КФК в крови — это следует делать даже в тех случаях, когда по клиническим и электрокардиографическим данным диагноз инфаркта миокарда не вызывает сомнения, так как степень повышения активности КФК информирует врача о размерах инфаркта миокарда и прогнозе.
2. Если активность КФК находится в пределах нормы или повышена незначительно (в 2-3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КФК.
3. Нормальные величины активности КФК и МВ-КФК, полученные при однократном заборе крови в момент поступления больного в клинику, недостаточны для исключения диагноза ОИМ. Анализ необходимо повторить хотя бы еще 2 раза через 12 и 24 часа.
4. Если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КФК и МВ-КФК нормальный, то целесообразно определить активность ЛДГ в крови (предпочтительнее — отношение активности ЛДГ1 и ЛДГ2), АСТ вместе с АЛТ и расчетом коэффициента де Ритиса.
5. Если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КФК и МВ-КФК сразу после приступа и через 12 и 24 часа.
6. Миоглобин в крови целесообразно определять только в первые часы после болевого приступа, повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный уровень миоглобина отнюдь не исключает инфаркта.
7. Определение ферментов нецелесообразно у бессимптомных больных с нормальной ЭКГ. Диагноз на основании одной только гиперферментемии ставить все равно нельзя — должны быть клинические и (или) ЭКГ-признаки, указывающие на возможность ИМ.
8. Контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения ОИМ.
9. Исследование уровня активности КФК и МВ-КФК целесообразно проводить только в течение 1-2 суток от предположительного начала заболевания.
10. Исследование уровня активности АСТ целесообразно проводить только в течение 4-7 суток от предположительного начала заболевания.
11. Повышение активности КФК, МВ-КФК, ЛДГ, ЛДГ1, АСТ не является строго специфичным для ОИМ, хотя при прочих равных условиях активность МВ-КФК отличается более высокой информативностью.
12. Отсутствие гиперферментемии не исключает развития ОИМ.
Дифференциальный диагноз
1. Аллергический и инфекционно-токсический шок.
Симптомы: загрудинная боль, одышка, падение артериального давления.
Анафилактический шок может возникать при любой лекарственной непереносимости. Начало болезни острое, четко приурочено к причинному фактору (инъекция антибиотика, прививка с целью профилактики инфекционного заболевания, введение противостолбнячной сыворотки и др.). В некоторых случаях заболевание начинается через 5-8 дней от момента ятрогенного вмешательства, развивается по типу
феномена Артюса
, в котором сердце выступает в роли шок-органа.
Инфекционно-токсический шок с поражением миокарда может возникнуть при любом тяжелом инфекционном заболевании.
Клинически заболевание очень напоминает инфаркт миокарда (ИМ), отличаясь от него по этиологическим факторам. Дифференциация затрудняется в связи с тем, что при аллергическом и инфекционно-аллергическом шоке могут возникать некоронарогенные некрозы миокарда с грубыми изменениями ЭКГ, лейкоцитозом, увеличением СОЭ, гиперферментемией АСТ, ЛДГ,
ГБД
, КФК, МВ-КФК.
В отличие от типичного ИМ, при данных шоках на ЭКГ не бывает глубокого зубца Q и комплекса QS, дискордантности изменений конечной части.
2. Перикардит (миоперикардит).
Этиологические факторы перикардита: ревматизм, туберкулез, вирусная инфекция (чаще — вирус Коксаки или ECHO), диффузные болезни соединительной ткани; нередко — терминальная ХПН.
При остром перикардите в процесс часто вовлекаются субэпикардиальные слои миокарда.
В типичном варианте при сухом перикардите возникают тупые, давящие (реже — острые) боли в прекордиальной области без иррадиации в спину, под лопатку, в левую руку, свойственные инфаркту миокарда.
Шум трения перикарда регистрируется в те же дни, что и повышение температуры тела, лейкоцитоз, увеличение СОЭ. Шум стойкий, выслушивается в течение нескольких дней или недель.
При ИМ шум трения перикарда кратковременный; предшествует лихорадке и увеличению СОЭ.
Если у больных перикардитом появляется сердечная недостаточность, то она правожелудочковая или бивентрикулярная. Для ИМ характерна левожелудочковая сердечная недостаточность.
Дифференциально-диагностическая ценность энзимологических тестов невелика. Вследствие поражения субэпикардиальных слоев миокарда у больных перикардитом может регистрироваться гиперферментемия АСТ, ЛДГ, ЛДГ1,
ГБД
, КФК и даже изоэнзима МВ-КФК.
В правильной постановке диагноза помогают данные ЭКГ. При перикардите имеются симптомы субэпикардиального повреждения в виде элевации интервала ST во всех 12 общепринятых отведениях (нет дискордантности, свойственной ИМ). Зубец Q при перикардите, в отличие от ИМ, не выявляется. Зубец Т при перикардите может быть отрицательным, он становится положительным через 2-3 недели от начала болезни.
При появлении перикардиального экссудата очень характерной становится рентегнологическая картина.
3. Левосторонняя пневмония.
При пневмонии могут появляться боли в левой половине грудной клетки, иногда интенсивные. Однако в отличие от прекордиальных болей при ИМ, они четко связаны с дыханием и кашлем, не имеют типичной для ИМ иррадиации.
Для пневмонии характерен продуктивный кашель. Начало болезни (озноб, повышение температуры, бои в боку, шум трения плевры) совершенно не типично для ИМ.
Физикальные и рентгенологические изменения в легких помогают диагностировать пневмонию.
ЭКГ при пневмонии может меняться (низкий зубец Т, тахикардия), но никогда не бывает изменений, напоминающих таковые при ИМ.
Как и при ИМ, при пневмонии можно обнаружить лейкоцитоз, увеличение СОЭ, гиперферментемию АСТ, ЛДГ, но только при поражении миокарда повышается активность
ГБД
, ЛДГ1, МВ-КФК.
4. Спонтанный пневмоторакс.
При пневмотораксе возникают сильная боль в боку, одышка, тахикардия. В отличие от ИМ, спонтанный пневмоторакс сопровождается тимпаническим перкуторным тоном на стороне поражения, ослаблением дыхания, рентгенологическими изменениями (газовый пузырь, коллапс легкого, смещение сердца и средостения в здоровую сторону).
Показатели ЭКГ при спонтанном пневмотораксе либо нормальные, либо выявляется преходящее снижение зубца Т.
Лейкоцитоза, увеличения СОЭ при пневмотораксе не бывает. Активность сывороточных ферментов нормальная.
5. Ушиб грудной клетки.
Как и при ИМ возникают сильные боли в груди, возможен шок. Сотрясение и ушиб грудной клетки приводят к повреждению миокарда, что сопровождается элевацией или депрессией интервала ST, негативизацией зубца Т, а в тяжелых случаях — даже появлением патологического зубца Q.
В постановке правильного диагноза решающую роль играет анамнез.
Клиническая оценка ушиба грудной клетки с изменениями ЭКГ должна быть достаточно серьезной, поскольку в основе этих изменений лежат некоронарогенные некрозы миокарда.
6. Остеохондроз грудного отдела позвоночника с компрессией корешка.
При остеохондрозе с корешковым синдромом боли в грудной клетке слева могут быть очень сильными, нестерпимыми. Но, в отличие от болей при ИМ, они исчезают, когда больной принимает неподвижное вынужденное положение, и резко усиливаются при поворотах туловища и дыхании.
Нитроглицерин, нитраты при остеохондрозе совершенно не эффективны.
При грудном «радикулите» определяется четкая локальная болезненность в паравертебральных точках, реже по ходу межреберий.
Количество лейкоцитов, а также значения СОЭ, энзимологических показателей, ЭКГ в пределах нормы.
7. Опоясывающий лишай.
Клиника опоясывающего лишая весьма напоминает описанную выше (см. описание симптомов корешкового синдрома при остеохондрозе позвоночника в грудном отделе).
У некоторых больных может регистрироваться лихорадка в сочетании с умеренным лейкоцитозом, увеличением СОЭ.
ЭКГ, ферментные тесты, как правило, часто помогают исключить диагноз ИМ.
Диагноз «опоясывающий лишай» становится достоверным со 2-4 дня болезни, когда по ходу межреберий появляется характерная пузырьковая (везикулярная) сыпь.
8. Бронхиальная астма.
Астматический вариант ИМ в чистом виде встречается редко, чаще удушье сочетается с болями в предсердечной области, аритмией, симптомами шока.
9. Острая левожелудочковая недостаточность осложняет течение многих болезней сердца, в числе которых кардиомиопатии, клапанные и врожденные пороки сердца, миокардиты и другие.
10. Острый холецистопанкреатит.
При остром холецистопанкреатите, как и при гастралгическом варианте ИМ, возникают сильные боли в эпигастральной области, сопровождающиеся слабостью, потливостью, гипотензией. Однако боли при остром холецистопанкреатите локализуются не только в эпигастрии, но и в правом подреберье, иррадиируют вверх и вправо, в спину, иногда могут быть опоясывающими. Характерно сочетание болей с тошнотой, рвотой, причем в рвотных массах определяется примесь желчи.
Пальпаторно определяется болезненность в точке желчного пузыря, проекции поджелудочной железы, положительные
симптом Кера
,
симптом Ортнера
,
симптом Мюсси
, что не характерно для ИМ.
Вздутие живота, локальное напряжение в правом верхнем квадранте не типично для ИМ.
Лейкоцитоз, увеличение СОЭ, гиперферментемия АСТ, ЛДГ могут появляться при обоих заболеваниях. При холецистопанкреатите отмечается увеличение активности альфа-амилазы сыворотки крови и мочи, ЛДГ 3-5. При ИМ следует ориентироваться на высокие показатели ферментной активности КФК, МВ-КФК,
ГБД
.
ЭКГ при остром холецистопанкреатите: снижение интервала ST в ряде отведений, слабо отрицательный или двухфазный зубец Т.
Крупноочаговое метаболическое повреждение миокарда существенно ухудшает прогноз панкреатита, нередко является ведущим фактором в летальном исходе.
11. Прободная язва желудка.
Как при ИМ, характерны острые боли в эпигастрии. Однако при прободной язве желудка отмечаются нестерпимые, «кинжальные» боли, максимально выраженные в момент прободения и затем уменьшающиеся в интенсивности, при этом эпицентр болей смещается несколько вправо и вниз.
При гастралгическом варианте ИМ боли в эпигастрии могут быть интенсивными, но для них не характерно столь острое, мгновенное начало с последующим спадом.
При прободной язве желудка через 2-4 часа от момента прободения симптоматика меняется. У больных с прободной гастродуоденальной язвой появляются симптомы интоксикации; язык становится сухим, черты лица заостряются; живот становится втянутым, напряженным; отмечаются положительные симптомы раздражения; перкуторно определяется «исчезновение» печеночной тупости; рентгенологически выявляется воздух под правым куполом диафрагмы.
Как при ИМ, так и при прободении язвы температура тела может быть субфебрильной, отмечается умеренный лейкоцитоз в течение первых суток.
Для ИМ типично увеличение активности сывороточных ферментов (ЛДГ, КФК, МВ КФК).
ЭКГ при прободной язве желудка в течение первых суток, как правило, не меняется. На следующий день возможны изменения конечной части за счет электролитных нарушений.
12. Рак кардиального отдела желудка.
При раке кардии нередко возникают интенсивные давящие боли в эпигастрии и под мечевидным отростком, сочетающиеся с транзиторной гипотонией.
В отличие от ИМ при раке кардии эпигастральные боли закономерно повторяются ежедневно, они связаны с приемом пищи.
СОЭ увеличивается при обоих заболеваниях, однако динамика активности ферментов КФК, МВ КФК, ЛДГ,
ГБД
характерна только для ИМ.
Для исключения гастралгического варианта ИМ необходимо ЭКГ-исследование. На ЭКГ выявляются изменения интервала ST (чаще депрессия) и зубца Т (изоэлектричный или слабо отрицательный) в III, avF отведениях, что служит поводом для диагностики мелкоочагового заднего ИМ.
При раке кардии ЭКГ «застывшая», на ней не удается определить характерной для ИМ динамики.
Диагноз рака уточняется при проведении
ФГДС
, рентгенологического исследования желудка в различных положениях тела исследуемого, в том числе и в положении антиортостаза.
13. Пищевая токсикоинфекция.
Как и при ИМ появляются боли в эпигастрии, падает артериальное давление. Однако при пищевой токсикоинфекции боль в эпигастрии сопровождается тошнотой, рвотой, гипотермией. Диарея не всегда встречается при пищевой токсикоинфекции, но ее никогда не бывает при ИМ.
ЭКГ при пищевой токсикоинфекции либо не меняется, либо во время исследования определяются «электролитные нарушения» в виде корытообразного смещения вниз интервала ST, слабоотрицательного или изоэлектрического зубца Т.
Лабораторные исследования при пищевой токсикоинфекции показывают умеренный лейкоцитоз, эритроцитоз (сгущение крови), небольшое повышение активности АЛТ, АСТ, ЛДГ без существенных изменений активности КФК, МВ-КФК,
ГБД
, свойственных ИМ.
14. Острое нарушение мезентерального кровообращения.
Боль в эпигастрии, падение артериального давления возникают при обоих заболеваниях. Дифференциация усложняется тем, что тромбоз мезентеральных сосудов, как и ИМ, поражает, как правило, людей пожилого возраста с различными клиническим проявлениями ИБС, с артериальной гипертонией.
При нарушении кровообращения в системе мезентеральных сосудов боли локализуются не только в эпигастрии, но и по всему животу. Живот умеренно вздут, аускультативно не выявляются звуки перистальтики кишечника, возможно обнаружение симптомов раздражения брюшины.
Для уточнения диагноза проводится обзорная рентгенография брюшной полости и определяется наличие или отсутствие перистальтики кишечника и скопления газа в кишечных петлях.
Нарушение мезентерального кровообращения не сопровождается изменениями ЭКГ и ферментных показателей, характерных для ИМ.
При затруднении в диагностике тромбоза мезентеральных сосудов патогномоничные изменения могут быть обнаружены при лапароскопии и ангиографии.
15. Расслаивающая аневризма абдоминального отдела аорты.
При абдоминальной форме расслаивающей аневризмы аорты в отличие от гастралгического варианта ИМ, характерны следующие признаки:
— начало болезни с болей в груди;
— волнообразный характер болевого синдрома с иррадиацией в поясницу по ходу позвоночника;
— появление опухолевидного образования эластичной консистенции, пульсирующего синхронно с сердцем;
— появление систолического шума над опухолевидным образованием;
— нарастание анемии.
16. Некоронарогенные некрозы миокарда могут возникать при тиреотоксикозе, лейкозах и анемиях, системных васкулитах, гипо- и гипергликемических состояниях.
Клинически на фоне симптоматики основной болезни отмечаются боли в сердце (временами сильные), одышка.
Данные лабораторных исследований бывают малоинформативными в дифференциации некоронарогенных некрозов с ИМ атеросклеротического генеза. Гиперферментемия ЛДГ, ЛДГ1,
ГБД
, КФК, МВ-КФК обусловлены миокардиальными некрозами как таковыми, вне зависимости от их этиологии.
На ЭКГ при некоронарогенных некрозах миокарда выявляются изменения конечной части – депрессия или, реже, элевация интервала ST, негативные зубцы Т, с последующей динамикой, соответствующей нетрансмуральному ИМ.
Точный диагноз устанавливается на основе всей симптоматики заболеваний. Только такой подход дает возможность методически правильно оценить собственно сердечную патологию.
18. Опухоли сердца (первичные и метастатические).
При опухолях сердца могут появляться упорные интенсивные боли в прекордиальной области, резистентные к нитратам, сердечная недостаточность, аритмии.
На ЭКГ отмечаются патологический зубец Q, элевация интервала ST, отрицательный зубец Т. В отличие от ИМ при опухоли сердца не бывает типичной эволюции ЭКГ, она малодинамична.
Сердечная недостаточность, аритмии рефрактерны к лечению. Диагноз уточняется при тщательном анализе клинико-рентгенологических и Эхо-КГ-данных.
19. Посттахикардиальный синдром.
Посттахикардиальным синдромом называется ЭКГ-феномен, выражающийся в преходящей ишемии миокарда (депрессия интервала ST, негативный зубец Т) после купирования тахиаритмии. Данный симптомокомплекс необходимо оценивать очень осторожно.
Во-первых, тахиаритмия может быть началом ИМ и ЭКГ после ее купирования зачастую лишь выявляет инфарктные изменения.
Во-вторых, приступ тахиаритмии в такой степени нарушает гемодинамику и коронарный кровоток, что он может приводить к развитию миокардиальных некрозов, особенно при изначально дефектном коронарном кровообращении у больных со стенозирующим коронарным атеросклерозом. Следовательно, диагноз посттахикардиального синдрома достоверен после тщательного наблюдения за больным с учетом динамики клинических, ЭхоКГ-, лабораторных данных.
20. Синдром преждевременной реполяризации желудочков.
Синдром выражается в элевации интервала ST в вильсоновских отведениях, начинающегося с точки J, расположенной на нисходящем колене зубца R.
Этот синдром регистрируется у здоровых людей, спортсменов, больных с нейроциркуляторной дистонией.
Для постановки правильного диагноза надо знать о существовании ЭКГ-феномена — синдрома преждевременной реполяризации желудочков. При этом синдроме отсутствует клиника ИМ, не бывает свойственной ему динамика ЭКГ.
Примечание
При трактовке симптома «острая боль в эпигастрии» в сочетании с гипотензией при проведении дифференциального диагноза с ИМ надо иметь в виду и более редкие болезни: острую надпочечниковую недостаточность; разрыв печени, селезенки или полого органа при травме; сифилитическую сухотку спинного мозга с табетическими желудочными кризами (анизокория, птоз, рефлекторная неподвижность глазных яблок, атрофия зрительного нерва, атаксия, отсутствие коленных рефлексов); абдоминальные кризы при гипергликемии, кетоацидозе у больных с сахарным диабетом.
Осложнения
Группы осложнений инфаркта миокарда (ИМ):
1. Электрические — нарушения ритма и проводимости:
— брадитахиаритмии;
— экстрасистолии;
— внутрижелудочковые блокады;
— АВ-блокады.
Данные осложнения практически постоянно встречаются при крупноочаговом ИМ. Часто аритмии не являются угрожающими для жизни, но свидетельствуют о серьезных нарушениях (электролитных, продолжающейся ишемии, вагальной гиперактивности и др.), требующих коррекции.
2. Гемодинамические осложнения:
2.1 Вследствие нарушений насосной функции сердца:
— острая левожелудочковая недостаточность;
— острая правожелудочковая недостаточность;
— бивентрикулярная недостаточность;
— кардиогенный шок;
— аневризма желудочка;
— расширение инфаркта.
2.2 Вследствие дисфункции сосочковых мышц.
2.3 Вследствие механических нарушений:
— острая митральная регургитация вследствие разрыва сосочковых мышц;
— разрывы сердца, свободной стенки или межжелудочковой перегородки;
— аневризмы левого желудочка;
— отрывы сосочковых мышц.
2.4 Вследствие электромеханической диссоциации.
3. Реактивные и прочие осложнения:
— эпистенокардический перикардит;
— тромбоэмболии сосудов малого и большого круга кровообращения;
— ранняя постинфарктная стенокардия;
—
синдром Дресслера
.
По времени появления осложнения ИМ классифицируют на:
1. Ранние осложнения, возникающие в первые часы (нередко на этапе транспортировки больного в стационар) или в острейший период (3-4 дня):
— нарушения ритма и проводимости (90%), вплоть до фибрилляции желудочков и полной АВ-блокады (самые частые осложнения и причина летальности на догоспитальном этапе);
— внезапная остановка сердца;
— острая недостаточность насосной функции сердца — острая левожелудочковая недостаточность и кардиогенный шок (до 25%);
— разрывы сердца — наружные, внутренние; медленнотекущие, одномоментные (1-3%);
— острая дисфункция сосочковых мышц (митральная регургитация);
— ранний эпистенокардический перикардит.
2. Поздние осложнения (возникают на 2-3-й неделе, в период активного расширения режима):
— постинфарктный
синдром Дресслера
(3%);
— пристеночный тромбоэндокардит (до 20%);
— хроническая сердечная недостаточность;
— нейротрофические расстройства (плечевой синдром, синдром передней грудной стенки).
Как на ранних, так и на поздних стадиях течения ИМ могут возникать следующие осложнения:
— острая патология желудочно-кишечного тракта (острые язвы, желудочно-кишечный синдром, кровотечения и др.);
— психические изменения (депрессия, истерические реакции, психоз);
— аневризмы сердца (у 3-20% больных);
— тромбоэмболические осложнения: системные (вследствие пристеночного тромбоза) и ТЭЛА (из-за тромбоза глубоких вен голеней).
Тромбоэмболии клинически выявляются у 5-10% больных (на аутопсии — у 45%). Часто они имеют бессимптомное течение и являются причиной смерти у ряда госпитализированных больных с ИМ (до 20%).
У некоторых пожилых мужчин с доброкачественной гипертрофией предстательной железы развивается острая атония мочевого пузыря (снижается его тонус, нет позывов к мочеиспусканию) с увеличением объема пузыря до 2 л, задержкой мочеиспускания на фоне постельного режима и лечения наркотическими препаратами, атропином.
Лечение
Цели неотложной терапии инфаркта миокарда (ИМ):
— купирование болевого синдрома;
— восстановление коронарного кровотока;
— уменьшение работы сердца и потребности миокарда в кислороде;
— ограничение размеров ИМ;
— лечение и профилактика осложнений ИМ.
Купирование болевого приступа
Морфин — препарат выбора для купирования болевого синдрома при ИМ на догоспитальном этапе. Морфин обладает необходимыми эффектами и достаточной для транспортировки длительностью действия.
Препарат вводится внутривенно дробно: 1 мл 1% раствора разводят физиологическим раствором натрия хлорида до 20 мл (1 мл полученного раствора содержит 0,5 мг активного вещества) и вводят 2-5 мг каждые 5-15 минут до полного устранения болевого синдрома либо до появления побочных эффектов (гипотензии, угнетения дыхания, рвоты).
Суммарная доза не должна превышать 10-15 мг (1-1,5 мл 1% раствора) морфина (на догоспитальном этапе не допускается превышение дозы 20 мг).
При невыраженном болевом синдроме, пациентам старческого возраста и ослабленным больным наркотические анальгетики могут вводиться подкожно или внутримышечно. Не рекомендуется вводить подкожно более 60 мг морфина в течение 12 часов.
Для решения вопроса о возможности использования наркотических анальгетиков необходимо:
— убедиться, что типичный или атипичный болевой синдром не является проявлением “острого живота”, и изменения ЭКГ являются специфическим проявлением ИМ, а не неспецифической реакцией на катастрофу в брюшной полости;
— выяснить, имеются ли в анамнезе хронические заболевания системы дыхания (в частности — бронхиальная астма);
— уточнить, когда было последнее обострение бронхообструктивного синдрома;
— установить, имеются ли в настоящее время признаки дыхательной недостаточности, какие, какова степень ее выраженности;
— выяснить, имеется ли у больного в анамнезе судорожный синдром, когда был последний припадок.
Восстановление коронарного кровотока в острейшей фазе ИМ
Поскольку непосредственной причиной развития ИМ является окклюзия коронарной артерии, в основе лечения лежит восстановление коронарного кровотока — коронарная реперфузия путем системного тромболизиса.
Все больные ИМ должны быть безотлагательно обследованы для уточнения показаний и противопоказаний к восстановлению коронарного кровотока.
Показания к проведению тромболизиса:
1. Наличие подъема сегмента ST более чем на 1 mm по крайней мере в двух стандартных отведениях ЭКГ и более чем на 2 mm в двух смежных грудных отведениях.
2. Остро возникшая полная блокада левой ножки пучка Гиса при сроке, прошедшем с начала заболевания, более 30 минут, но не превышающем 12 часов.
Применение тромболитических средств возможно и позже, в случаях когда сохраняются подъем сегмента ST, продолжается боль и/или наблюдается нестабильная гемодинамика.
Абсолютные противопоказания к тромболитической терапии:
— ранее перенесенный геморрагический инсульт или нарушение мозгового кровообращения неизвестной этиологии;
— ишемический инсульт, перенесенный в течение последних 3 месяцев;
— опухоль мозга, первичная и метастазы;
— подозрение на расслоение аорты;
— наличие признаков кровотечения или геморрагического диатеза (за исключением менструации);
— существенные закрытые травмы головы в последние 3 месяца;
— изменение структуры мозговых сосудов, например,
артериовенозная мальформация
, артериальные
аневризмы
.
Относительные противопоказания к тромболитической терапии:
— устойчивая, высокая, плохо контролируемая
артериальная гипертензия
в анамнезе;
— наличие плохо контролируемой артериальной гипертензии (в момент госпитализации САД >180 мм рт.ст., ДАД >110 мм рт.ст.);
—
ишемический инсульт
давностью >3 месяцев;
— деменция или внутричерепная патология, не включенная в абсолютные противопоказания;
— травматичная или длительная (>10 минут), сердечно-легочная реанимация или обширное оперативное вмешательство, перенесенное в течение последних 3 недель;
— недавнее (в течение предыдущих 2-4 недель) внутреннее кровотечение;
— пункция сосуда, не поддающегося прижатию;
— противопоказание для стрептокиназы — введение стрептокиназы, в том числе модифицированной, более 5 суток назад или известная аллергия на нее;
— беременность;
— обострение язвенной болезни;
— прием антикоагулянтов непрямого действия (чем выше
МНО
, тем выше риск кровотечения).
Тромболитические препараты:
— стрептокиназа;
— рекомбинантный тканевой активатор плазминогена (алтеплаза) и его модификация — тенектеплаза;
— модифицированная (рекомбинантная) проурокиназа (пуролаза).
Наиболее часто используется стрептокиназа:
— введение препарата проводится только через периферические вены, попытки катетеризации центральных вен недопустимы;
— перед инфузией возможно внутривенное введение 5-6 мл 25% магния сульфата либо 10 мл кормагнезина-200 в/в струйно, медленно (за 5 минут);
— «нагрузочная» доза аспирина (250-300 мг — разжевать) дается всегда, за исключением случаев, когда аспирин противопоказан;
— 1 500 000 Ед стрептокиназы разводится в 100 мл изотонического раствора хлорида натрия и вводится внутривенно за 30 минут.
Клинические признаки восстановления коронарного кровотока:
— прекращение ангинозных приступов через 30-60 минут после введения тромболитика;
— стабилизация гемодинамики;
— исчезновение признаков левожелудочковой недостаточности;
— быстрая (в течение нескольких часов) динамика ЭКГ с приближением сегмента ST к изолинии и формированием патологического зубца Q, отрицательного зубца Т (возможно внезапное увеличение степени подъема сегмента ST с последующим его быстрым снижением);
— появление реперфузионных аритмий (ускоренного идиовентрикулярного ритма, желудочковой экстрасистолии и др.);
— быстрая динамика МВ-КФК (резкое повышение ее активности на 20-40%).
Показания к проведению антикоагулянтной терапии:
— отсутствие показаний к тромболитической терапии (поздние сроки, мелкоочаговый или не-Q-инфаркт);
— невозможность проведения тромболизиса по организационным причинам;
— отсрочка тромоболизиса до госпитального этапа;
— наличие противопоказаний к тромболизису, не являющихся противопоказанием к назначению гепарина.
При наличии показаний, гепарин вводится на догоспитальном этапе (линейной бригадой) внутривенно болюсно в дозе 10000-15000 МЕ. Если в условиях стационара не проводится тромболитическая терапия, то переходят на длительную внутривенную инфузию гепарина со скоростью 1000 МЕ/час под контролем активированного частичного тромбопластинового времени. Альтернативой может, по-видимому, служить подкожное введение низкомолекулярного гепарина в «лечебной» дозе.
Введение гепарина на догоспитальном этапе не служит препятствием к проведению тромболизиса в условиях стационара.
С первых минут ИМ всем больным, при отсутствии противопоказаний, показано назначение малых доз ацетилсалициловой кислоты (аспирина), антитромбоцитарный эффект которой достигает своего максимума уже через 30 минут и своевременное начало применения которой позволяет существенно снизить летальность.
Наибольший клинический эффект может быть получен при применении ацетилсалициловой кислоты перед проведением тромболизиса.
Доза для первого приема на догоспитальном этапе составляет 160-325 мг (разжевать).
В дальнейшем, на стационарном этапе, препарат назначается 1 раз в сутки по 100-125 мг.
Уменьшение работы сердца и потребности миокарда в кислороде. Показано полноценное обезболивание и применение следующих препаратов:
1. Вазодилататоры-нитраты.
Внутривенное введение нитратов при ОИМ не только помогает купировать болевой синдром, левожелудочковую недостаточность, артериальную гипертензию, но и уменьшает размеры некроза и летальность.
Нитраты вводят капельно под постоянным контролем артериального давления и частоты сердечных сокращений с начальной скоростью 5-10 мкг/мин. с последующим увеличением скорости на 20 мкг/мин. каждые 5 минут до достижения желаемого эффекта или максимальной скорости введения — 400 мкг/мин. Обычно эффект достигается при скорости 50-100 мкг/мин.
При отсутствии дозатора, приготовленный раствор, содержащий в 1 мл 100 мкг нитрата, вводят при тщательном контроле с начальной скоростью 6-8 капель в минуту, которая при условии стабильной гемодинамики и сохранения болевого синдрома может быть постепенно увеличена вплоть до максимальной скорости — 30 капель в минуту.
Продолжительность внутривенного введения нитратов — 24 часа и более; за 2-3 часа до окончания инфузии дается первая доза нитратов перорально.
Передозировка нитратов, вызывающая падение сердечного выброса и снижение систолического артериального давления ниже 80 мм рт. ст., может приводить к ухудшению коронарной перфузии и к увеличению размеров ИМ.
2. Бета-адреноблокаторы.
Внутривенное введение бета-адреноблокаторов, как и применение нитратов, способствует купированию болевого синдрома. Ослабляя симпатические влияния на сердце, они способствуют уменьшению размеров ИМ, подавляют желудочковые аритмии, уменьшают риск разрыва миокарда и повышают таким образом выживаемость пациентов.
При отсутствии противопоказаний бета-адреноблокаторы назначаются всем больным ОИМ.
В первые 2-4 часа заболевания показано дробное внутривенное введение пропранолола (обзидана) по 1 мг в минуту каждые 3-5 минут под контролем артериального давления, частоты сердечных сокращений и ЭКГ до достижения частоты сердечных сокращений 55-60 уд./мин. или до общей дозы 10 мг.
При наличии брадикардии, признаков сердечной недостаточности, АВ-блокакды и снижении систолического артериального давления менее 100 мм рт. ст. пропранолол не назначается; при развитии указанных изменений на фоне применения препарата, его введение прекращается.
Ограничение размеров ИМ
Необходимо адекватное обезболивание, восстановление коронарного кровотока, уменьшение работы сердца и потребности миокарда в кислороде.
Этой же цели служит оксигенотерапия, показанная при ОИМ всем больным в связи с частым развитием
гипоксемии
даже при неосложненном течении заболевания.
Ингаляция увлажненного кислорода, проводящаяся, если это не причиняет чрезмерных неудобств, с помощью маски или через носовой катетер со скоростью 4-6 л/мин., целесообразна в течение первых 24-48 часов заболевания (начинается на догоспитальном этапе и продолжается в стационаре).
Лечение и профилактика осложнений ИМ
Проводятся дифференцированно в зависимости от варианта осложнений (отек легких, кардиогеннй шок, нарушения сердечного ритма и проводимости, а также затянувшийся или рецидивирующий болевой приступ).
Основные хирургические методы лечения ИМ (вопрос о выборе метода всегда решается индивидуально)
1. Аортокоронарное шунтирование (АКШ).
2. Внутрисосудистая операция (баллонная ангиопластика, стентирование).
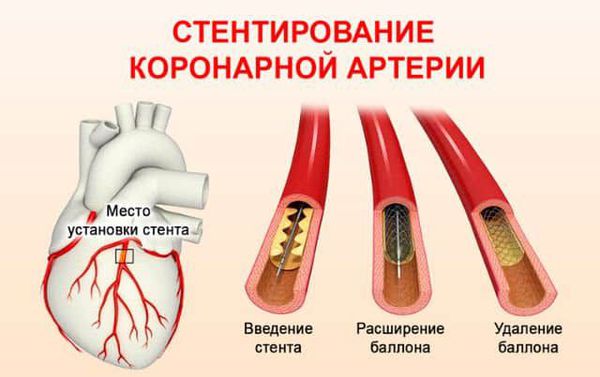
Коронарная ангиопластика является инвазивным способом лечения ишемической болезни сердца, который направлен на восстановление суженного просвета коронарной артерии различными механическими устройствами, доставляемыми путем чрескожной пункции и катетеризации артериального русла.
Устройства и инструменты для коронарной ангиопластики:
— баллонные катетеры для проведения баллонной ангиопластики;
— атерэктомические катетеры;
— ротаблаторы для проведения мелкодисперсной ротационной абляции;
— лазер-баллоны для лазерной абляции;
— стенты для эндопротезирования коронарных артерий.
Основной метод коронарной ангиопластики — баллонная ангиопластика. Остальные методы имеют ограниченное применение по специальным показаниям.
При баллонной ангиопластике баллонный катетер проводится по артериальной системе к коронарным сосудам. Баллон устанавливается в место сужения коронарной артерии и раздувается под давлением, восстанавливая просвет сосуда.
Абсолютные противопоказания для коронарной ангиопластики:
— локализация стеноза в главном стволе левой коронарной артерии;
— наличие стеноза в коронарной артерии, снабжающей весь оставшийся живой миокард;
— отказ больного от лечения.
Относительные противопоказания:
— тяжелая дисфункция левого желудочка;
— многососудистое окклюзирующее поражение со сложным коллатеральным снабжением миокарда, сопоставимое со стволовым стенозом;
— сложное с точки зрения морфологии поражение коронарной артерии, снабжающей значительный объем миокарда;
— невозможность достичь полной или почти полной
реваскуляризации
;
— нестабильное / неконтролируемое системное или метаболическое нарушение (например, почечная недостаточность, недавний инсульт, желудочно-кишечное кровотечение, лихорадка вследствие инфекции, неконтролируемая гипертензия, тяжелые электролитные нарушения, анафилаксия).
Стентирование, как доминирующая методика эндоваскулярного лечения, является наиболее эффективным и безопасным методом лечения ОИМ. Коронарная ангиопластика со стентированием позволяет воздействовать не только на тромб, но и на атеросклеротическую бляшку, суживающую просвет венечной артерии.
Именно стентирование способно восстанавливать исходную нативную анатомию коронарной артерии, в отличие от консервативной терапии и открытой хирургии.
Показанием к выполнению стентирования у больных с ОИМ является ИМ в ходу с признаками продолжающейся ишемии в области клинико-зависимой артерии при наличии ангиографических критериев возможности выполнения процедуры.
Определяющим фактором сохранения функционального состояния миокарда и снижения летальности у пациентов с ОИМ является время от начала ангинозного приступа до начала процедуры стентирования. Для улучшения непосредственных и отдаленных результатов стентирования необходимо сокращение до минимума временного интервала, с помощью экстренной госпитализации больных с ОИМ в специализированную клинику с наличием рентгеноперационной.
Показания к проведению коронарной ангиопластики постоянно расширяются. Основной стратегический принцип — максимально отсрочить необходимость проведения АКШ.
Поскольку коронарная ангиопластика может осложниться возникновением ситуаций, требующих срочного проведения хирургической операции, то если больной отказывается от АКШ, даже если выявленные сужения дилатируемы, коронарная ангиопластика не проводится.
При ОИМ коронарная ангиопластика (КА) или АКШ проводятся при неэффективности тромболитической терапии. Предпочтение следует отдавать проведению КА. АКШ проводится только при наличии прямых противопоказаний для КА.
При выполнении КА сразу после системного тромболизиса, ее называют немедленной, а через 1-7 суток — поздней.
Проведение немедленной КА сопряжено с высоким риском осложнений. Поэтому, если это возможно, предпочтительно ее выполнение после 4-7-дневной антикоагулянтной и антиагрегантной терапии.
Целью поздней коронарной ангиопластики является устранение остаточного стеноза, профилактика реокклюзии, ускорение восстановления функции левого желудочка. При этом существенно снижается риск формирования аневризмы сердца и летальности больных ОИМ.
Аортокоронарное шунтирование — это кардиохирургическая операция, при которой создается новый путь для кровотока в обход пораженной артерии. Для этого накладывается шунт между аортой и участком артерии после сужения. В качестве шунта применяются: большая подкожная вена, внутренняя грудная артерия, лучевая артерия, синтетический протез.
Доступ к сердцу осуществляется через разрез грудной клетки, чаще — через грудину. Еще один разрез выполняется в месте, где берут шунт. После АКШ требуется достаточно длительный период реабилитации, в течение которого заживают раны и срастается грудина.
Показания к проведению АКШ в остром периоде ИМ:
— неэффективность первичной коронароангиопластики;
— окклюзия сосуда или эндопротеза после эндоваскулярных вмешательств;
— кардиогенный шок;
— наружные и внутренние разрывы сердца.
Прогноз
Около 15-20% больных ИМ погибают на догоспитальном этапе, еще 15% — в больнице.
Общая летальность при ИМ составляет 30-35%.
Большая часть больничной летальности приходится на первые двое суток, поэтому основные лечебные мероприятия проводят именно в этот период.
Контролируемые испытания показали, что восстановление перфузии в течение первых 4-6 часов ИМ способствует ограничению его размеров, улучшению локальной и общей сократимости левого желудочка, снижению частоты больничных осложнений (сердечной недостаточности,
ТЭЛА
, аритмий) и летальности. Восстановление перфузии в течение первых 1-2 часов ИМ особенно благоприятно.
Позднее восстановление перфузии также сопровождается увеличением выживаемости, что связывают с улучшением заживления миокарда и уменьшением частоты аритмий (но не ограничением размеров инфаркта).
Госпитализация
Всем больным показана экстренная госпитализация.
Профилактика
Профилактические мероприятия в острой фазе ИМ
Важнейшее профилактическое значение с первых минут от начала инфаркта имеет антитромбоцитарная и антикоагулянтная терапия. Также целесообразно применение таких препаратов, как β-блокаторы, ингибиторы АПФ, нитраты, блокаторы кальциевых каналов, глюкозо-инсулино-калиевая смесь (ГИК) и др.
Вопрос о необходимости раннего, в том числе внутривенного, назначения бета-блокаторов в острой фазе остается открытым. В настоящее время рекомендуется дождаться стабилизации состояния больного и только после этого назначить бета-блокаторы обычным способом, перорально.
Не обнаружено существенных преимуществ раннего назначения нитратов, поэтому они не рекомендованы для рутинного использования, хотя возможность их применения у отдельных пациентов с продолжающейся ишемией миокарда не исключается.
Не рекомендованы для рутинного использования (без специальных показаний) также блокаторы кальциевых каналов, сульфат магния, ГИК , лидокаин.
Напротив, ингибиторы АПФ, назначаемые с первого дня ИМ, не намного, но достоверно уменьшают раннюю летальность больных. Поэтому в руководстве ESC рекомендуется начать прием ингибиторов АПФ в первые 24 часа от начала инфаркта, если нет противопоказаний.
Вторичная профилактика – общие принципы
Около 8-10% пациентов, выживших после ИМ, в течение года после выписки из стационара переживают повторный инфаркт. Летальность постинфарктных больных гораздо выше, чем смертность в общей популяции. На сегодняшний день известен ряд профилактических мероприятий, оказывающих достоверное благоприятное влияние на прогноз и уровень выживаемости таких пациентов.
1. Всем пациентам, перенесшим инфаркт, настоятельно рекомендуется отказаться от курения. Для медикаментозной поддержки больного, который бросает курить, могут использоваться бупропион и никотинсодержащие препараты, антидепрессанты.
2. Показана достаточная и регулярная физическая активность – аэробная нагрузка умеренной интенсивности как минимум 5 раз в неделю. Для больных высокого риска рекомендованы специальные реабилитационные программы с наблюдением медработников.
3. Если индекс массы тела ≥30 кг/м2 либо окружность талии превышает 102 см у мужчин или 88 см у женщин, необходимо снижение веса. Питание постинфарктных больных должно включать регулярное употребление фруктов, овощей, рыбы, отличаться низким содержанием соли и насыщенных жиров. Целесообразным может быть увеличение потребления омега-3-полиненасыщенных жирных кислот; с этой целью можно включать в рацион жирные сорта рыбы или же принимать рыбий жир. Не следует запрещать пациенту употреблять алкоголь в умеренных количествах.
4. Если у больного имеется сахарный диабет, необходимы соответствующие мероприятия по модификации образа жизни, контролю факторов риска (артериальной гипертензии, ожирения,
дислипидемии
) и сахароснижающая фармакотерапия для поддержания уровня гликозилированного гемоглобина <6,5%.
5. В случае артериальной гипертензии необходимы мероприятия по модификации образа жизни и фармакологическая терапия для поддержания уровня АД <130/80 мм рт. ст. .
Всем пациентам, перенесшим ИМ, при отсутствии противопоказаний как можно раньше следует назначить:
1. Антитромбоцитарную и/или антикоагулянтную терапию:
— АСК 75-100 мг/сут. постоянно;
— клопидогрель 75 мг/сут. в течение 12 месяцев в дополнение к АСК независимо от стратегии лечения (IIa, C) или постоянно вместо АСК, если прием АСК противопоказан;
— если противопоказаны и АСК, и клопидогрель, рекомендованы пероральные антикоагулянты (с удержанием МНО в рамках 2-3);
— пероральные антикоагулянты (с удержанием рекомендованного МНО) специально показаны в ряде клинических ситуаций (наличие мерцательной аритмии, тромба в полости левого желудочка, механических протезов клапанов сердца);
— в случае высокого риска тромбоэмболических событий, пероральные антикоагулянты можно принимать в комбинации с низкими дозами АСК, клопидогрелем или двойной антитромбоцитарной терапией (АСК + клопидогрель).
2. β-блокаторы (независимо от уровня АД или состояния функции левого желудочка).
3. Ингибиторы АПФ (независимо от уровня АД или состояния функции левого желудочка); при непереносимости – блокаторов рецепторов ангиотензина-II.
4. Гиполипидемическую терапию:
— статины рекомендованы у всех пациентов для достижения уровня холестерина липопротеинов низкой плотности (ЛПНП) < 100 мг/дл (2,5 ммоль/л) (I, A), у пациентов высокого риска следует рассмотреть целесообразность снижения этого показателя до еще более низкого целевого уровня – < 80 мг/дл (2,0 ммоль/л);
— если уровень триглицеридов превышает 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина липопротеинов высокой плотности (ЛПВП) < 40 мг/дл (1,0 ммоль/л), рекомендуются соответствующие мероприятия по модификации образа жизни;
— у пациентов, которые не переносят статины, могут использоваться фибраты и препараты омега-3-полиненасыщенных жирных кислот, особенно если уровень триглицеридов > 150 мг/дл (1,7 ммоль/л) и/или содержание холестерина ЛПВП < 40 мг/дл (1,0 ммоль/л).
5. Прививки против гриппа (I, B).
Для уменьшения риска внезапной сердечной смерти у больных с фракцией выброса ≤ 30-40% и СН ≥ II класса по NYHA (или III класса на протяжении по крайней мере 40 суток после ИМ) показана имплантация кардиовертера-дефибриллятора. Следует рассмотреть целесообразность такой тактики и у пациентов с фракцией выброса ≤ 30-35% и СН I класса по NYHA на протяжении, по крайней мере, 40 суток после ИМ.
Информация
Источники и литература
-
ACC/AHA Guideline Update for the Management of Patients With Unstable Angina and Non–ST-Segment Elevation Myocardial Infarction, 2002
-
ACC/AHA Guidelines for the Management of Patients With Unstable Angina /Non–ST-Elevation Myocardial Infarction, 2007
-
ACCF/AHA Guideline for the Management of ST-Elevation Myocardial Infarction, 2013
-
Алперт Дж., Френсис Г. Лечение инфаркта миокарда, М.: Практика, 1994
- стр. 255
-
Бабунашвили А.М., Рабкин И.X., Иванов В.А. Коронарная ангиопластика,М.: АСВ, 1996
- стр. 352
-
Байес де Луна А., Фиол-Сала М., Антман Э.М. ЭКГ при инфаркте миокарда с подъемом ST, СПб: Медицинская литература, 2009
-
Болезни сердца и сосудов. Руководство для врачей в 4 томах, под ред. Чазова Е.И., М.: Медицина, 1992
- «Хирургическое лечение ишемической болезни сердца и инфаркта миокарда» Акчурин Р. С. —
-
Гриффин Б.,Тополь Э. Кардиология (Manual of Cardiovascular Medicine), М.: Практика, 2008
-
Гурвич М.М. Заболевания сердца и сосудов. Лечебное питание, СПб:Эксмо, 2008
-
Кузьменко А.Т., Камышников В.С. Лабораторная диагностика острого инфаркта миокарда, СПб: Адукацыя i выхаванне, 2009
-
Лайбольд Г. Здоровое сердце и сосуды. Лечение и профилактика заболеваний сердечно-сосудистой системы, СПб: АСТ, Астрель, ВКТ, 2008
-
Люсов В.А., Волов Н.А., Гордеев И.Г. Инфаркт миокарда, СПб: Литтерра, 2010
-
Малышева И.С. Инфаркт. Профилактика и лечение, М.:Вектор, 2008
-
Сыркин А.Л. Инфаркт миокарда, СПб: Медицинское информационное агентство, 2006
-
Филатова М. «Жизнь после инфаркта», СПб: АСТ, Сова, 2007
-
Хубутия М.Ш., Газарян Г.А., Захаров И.В. Реперфузионная терапия в остром периоде инфаркта миокарда, СПб: ГЭОТАР-Медиа, 2010
-
Шилов А.М. Инфаркт миокарда, М.:Миклош, 2009
-
Якушин С.С. Инфаркт миокарда. Руководство, СПб: ГЭОТАР-Медиа, 2010
-
«Force on Practice Guidelines (Committee on the Management of Patients with Unstable Angina) 2002», «Journal of the American College of Cardiology» №40, 2002
-
«Myocardial infarction redefined — a consensus document of The Joint European Society of Cardiology/American College of Cardiology committee for the redefinition of myocardial infarction», «Journal of the American College of Cardiology», №36(3), 2000
-
«Дальнейшие шаги в исследовании сердечной недостаточности» Бураковский В.И., Работников В.С., Казаков Э.Н., «Грудная и сердечно-сосудистая хирургия», №7, 1991
-
«Коронарное русло, гемодинамика и сократительная функция миокарда у больных ИБС с постинфарктным кардиосклерозом в аспекте хирургического лечения» Алекян Б.Г.,автореф. дис. канд. мед. наук., М., 1980
-
«Ранние и одногодичные результаты коронарного шунтирования: связь с дислипопротеидемией» Агапов А.А., Власова Э.Е., Акчурин Р.С. и др., журнал «Кардиология», №12, 1996
-
«Факторы риска коронарного шунтирования при нестабильной стенокардии» Агапов А.А., Тарасова Л.В., Ширяев А.А., Акчурин Р.С., журнал «Кардиология», №11, 1996
Информация
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Несмотря на совершенствование медицинских технологий, дифференциальный диагноз боли в грудной клетке остается сложной задачей, так как ее могут вызывать многие заболевания и состояния, а также их сочетания [1]. Особое значение имеет своевременное и точное распознавание прогностически неблагоприятных клинических ситуаций, требующих специальной тактики лечения. Острый коронарный синдром (ОКС) относится к патологии, актуальность максимально быстрой диагностики которой хорошо известна и не вызывает сомнений. Однако гипердиагностика ОКС также является существенной проблемой. За рубежом до 90% лиц с острой болью в груди, направленных в отделения неотложной помощи, не имеют острой коронарной патологии [2–4]. По отечественным данным, диагноз ОКС не подтверждается у трети пациентов, поступающих в стационар [5]. Необоснованное инвазивное и медикаментозное лечение значительно увеличивает затраты на лечение, ухудшает течение заболеваний, приведших к развитию болевого синдрома, а также создает дополнительные риски, связанные с госпитализацией и диагностическими манипуляциями, включая инфекционные и процедурные осложнения [6–8].
С согласия пациента нами представлен клинический случай дифференциального диагноза с исключением ОКС. Пациент К., 34 лет, доставлен в скоропомощную больницу бригадой скорой медицинской помощи (СМП). Боль в средней трети грудины с иррадиацией в обе стороны по передней грудной стенке и плечевые суставы впервые появилась без видимых причин накануне вечером дома. Она не сопровождалась одышкой и сердцебиением, не ограничивала значимо обычную физическую активность, но усиливалась при глубоком вдохе. Пациент дважды принял таблетированные обезболивающие препараты на основе метамизола натрия, но боль не прошла. В два часа ночи боль стала резкой, интенсивной, и пациент вызвал бригаду СМП. При осмотре на дому фельдшером состояние пациента описано как удовлетворительное, указаны уровень артериального давления (АД) 140/90 мм рт. ст., пульс — 82 в минуту. Клинические проявления и данные электрокардиограммы (ЭКГ) оценены как проявления ОКС, введены парентерально нитрат и наркотический анальгетик (морфин), купировавшие боль; даны внутрь ацетилсалициловая кислота и клопидогрел в нагрузочных дозах. Дополнительно в приемном отделении выяснено, что у пациента в 17 лет после дорожной травмы удалена селезенка, последние 10 лет постепенно нарастает масса тела, отягощен семейный анамнез (отец умер в 54 года внезапно, на аутопсии выявлен ранее не диагностированный постинфарктный кардиосклероз). Ранее пациент длительно работал машинистом электропоезда и регулярно проходил тщательные медицинские осмотры, которые не выявляли никаких других отклонений в состоянии здоровья и лабораторных показателях. Последние 7 лет работа связана с физическими нагрузками (контроль строящихся объектов на местности), затруднений при выполнении ее не ощущал.
При осмотре на момент госпитализации состояние удовлетворительное. Тип телосложения гиперстенический. Повышенного питания, индекс массы тела (ИМТ) 34 кг/м2. Отеков нет. Кожный покров чистый. Зев гиперемирован, миндалины не увеличены. Щитовидная железа не увеличена. Грудная клетка правильной формы. Над легкими перкуторный легочный звук. Дыхание везикулярное, в нижних отделах, под лопатками жесткое. Частота дыхательных движений 16 в минуту. Границы сердца перкуторно не расширены. Пульс одинаковый на обеих руках, хорошего наполнения, ритмичный 86 в минуту. АД 120/80 мм рт. ст. на обеих руках. Тоны сердца ритмичные, 86 в минуту, акцент 2 тона над легочной артерией. Живот увеличен за счет подкожно-жировой клетчатки, по средней линии послеоперационный шов, при пальпации мягкий, безболезненный. Размеры печени перкуторно по Курлову увеличены на 2 см, при пальпации ее край эластичный, безболезненный. Почки не пальпируются.
На ЭКГ при поступлении — синусовый ритм 86 в минуту, подъем сегмента ST во II, III, AVF и всех грудных отведениях (рис. 1). Обзорная рентгенография органов грудной клетки патологии не выявила (рис. 2). При лабораторном обследовании в анализе периферической крови: лейкоцитоз 12,55 × 109 л без сдвигов в лейкоцитарной формуле, повышение уровня тропонина (0,12 нг/мл при референсном значении 0–0,1 нг/мл).

Пациент повторно тщательно опрошен, выяснено, что за 2 недели до госпитализации он «перенес на ногах», без лечения острое заболевание (общее недомогание, мышечная слабость, першение в горле без кашля и насморка), а ранее неоднократно болел ангинами с тяжелым течением, по поводу которых даже госпитализировался в инфекционную больницу (последний раз год назад).
Таким образом, на момент госпитализации в отделение первичное обследование пациента не позволяло точно дифференцировать у пациента острый миокардит или перикардит с острым инфарктом миокарда.
Диагноз определенного острого миокардита, по мнению всех авторитетных экспертных сообществ, необходимо обосновывать гистологическими, иммунологическими или иммуногистологическими критериями, доказывающими поражение сердца воспалительной природы [9–11]. Это делает практически невозможным достоверную диагностику миокардита в рутинной клинической практике и очень приблизительной оценку частоты заболевания. Последние статистические подсчеты предполагают развитие миокардитов в 22 случаях на 100 000 пациентов в год [12], хотя есть и сведения о том, что вирусный миокардит возможен у 1–5% пациентов с острыми вирусными инфекциями [13]. Вирусы в развитых странах считаются самой частой причиной миокардита [14–17]. Спектр вирусов, наиболее часто определяемых как причина миокардита, различен в зависимости от географического региона и меняется с течением времени [13, 18–20]. Важно, что при определенных клинических вариантах течения миокардита могут чаще выявляться определенные типы вирусов. Например, при клинической картине псевдокоронарного или инфарктоподобного течения миокардита в биоптатах миокарда часто определяется парвовирус B19 [21]. Именно его геном в настоящее время в Европейской популяции является одной из наиболее частых находок у пациентов с подтвержденным диагнозом миокардита [9].
В случае псевдокоронарного варианта миокардита, как и при ОКС, у пациентов имеются: острая боль в груди; изменения сегмента ST и зубца T на ЭКГ; могут определяться нарушения глобальной или очаговой сократимости или дисфункция желудочков, по данным Эхо-КГ, и повышаться уровни тропонинов T и I. Однако присутствуют анамнестические данные о перенесенной за 1–4 недели до болевого синдрома острой респираторной или кишечной инфекции и отсутствуют ангиографические данные об острых формах ишемической болезни сердца [9, 14, 22, 23]. Во всех случаях подозрения на миокардит экспертами рекомендуется обязательное исключение заболеваний, которые могли бы объяснить возникшие клинические проявления. При болевом синдроме в груди самым информативным методом для исключения ишемической болезни сердца (ИБС) является диагностическая коронароангиография (КАГ) [9, 23].
КАГ выявила у пациента протяженный (до 4 см) участок стеноза 90% просвета сосуда в проксимальном сегменте правой коронарной артерии (ПКА) (рис. 3) и ровные контуры всех остальных сосудов без признаков стенозирования. Для уточнения характера изменений во время КАГ проведена проба с введением нитроглицерина, однако ее результат оценен как сомнительный.
Таким образом, на этом этапе диагностики в пользу диагноза ОКС были неблагоприятный семейный анамнез по ИБС и сочетание приступа боли в груди с изменениями ЭКГ и повышением уровня тропонина. Сомнения в диагнозе острой коронарной патологии поддерживали: молодой возраст пациента и данные о тщательном наблюдении ранее, не выявлявшем каких-либо признаков заболеваний сердца и сосудов; характер болевого синдрома и его длительность; тип изменений на ЭКГ; протяженные ангиографические изменения только одного коронарного сосуда. Запись КАГ была пересмотрена с экспертами и обсуждена в консилиуме. Коллегиально изменения ПКА оценены как протяженный спазм.
В литературе широко представлен коронароспазм при вирусном миокардите, вызванном парвовирусом B19. Его связывают с вовлечением в воспалительный процесс эндотелиальных клеток сосудов и гиперкатехоламинемией. Повреждение кардиомиоцитов на небольших участках возникает вторично и обусловлено миграцией воспалительных клеток из коронарного сосуда в интерстиций. Клиническая картина в этих случаях проявляется псевдокоронарным болевым синдромом и, как правило, отсутствием симптомов выраженной сердечной недостаточности (СН) [24–27].
Вазоспазм коронарных артерий достаточно часто описан и при перикардите, и при миоперикардите [28–30]. Диагноз миоперикардита не часто используется в отечественной клинической практике. Между тем, с практической точки зрения, в ряде ситуаций он наиболее точно описывает патологию пациента. К тому же одновременное поражение перикарда и миокарда не является редкостью из-за их общей, чаще всего вирусной, этиологии. Термином «миоперикардит» обозначается перикардит с известным или клинически подозреваемым вовлечением миокарда [31]. Миоперикардит — наиболее частый вариант комбинации мио- и перикардитов в клинической практике. Его диагностируют при сочетании острого воспалительного перикардиального синдрома (ОВПС) с повышенными маркерами повреждения миокарда (тропонин I или Т, КФК-МВ) при отсутствии признаков новых нарушений функции левого желудочка (ЛЖ) по данным визуализации [31]. В свою очередь, ОВПС диагностируется при наличии хотя бы двух из четырех критериев: перикардитическая боль в груди, перикардиальные шумы, новый распространенный подъем ST или депрессия PR на ЭКГ, перикардиальный выпот (новый или ухудшившийся). Дополнительно подтверждать диагноз могут: повышение маркеров воспаления (т. е. С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), лейкоциты крови) и данные за воспаление перикарда методами компьютерной томографии и магнитно-резонансного исследования сердца. Для уточнения диагноза считается обязательным минимумом проведение аускультации, ЭКГ, Эхо-КГ, рентгенографии, обычных анализов крови, включая маркеры воспаления (т. е. СРБ или СОЭ) и поражения миокарда (КФК, тропонины). Подозрение на миоперикардит при отсутствии или незначительной дисфункции ЛЖ, без симптомов СН не требует проведения эндомиокардиальной биопсии. Однако для исключения ОКС при соответствующей клинической картине показана КАГ [31]. Анамнестически миокардиту, перикардиту и их сочетаниям часто предшествует или иногда сопутствует острая респираторная инфекция (особенно острый тонзиллит, пневмония) или гастроэнтерит.
У описанного нами пациента имелись необходимые два критерия для постановки ОВПС (перикардитическая боль и изменения на ЭКГ). При этом зарегистрированный на ЭКГ распространенный подъем ST, по литературным источникам, характерен для острого перикардита, предполагающего включение в воспалительный процесс эпикардиальной части миокарда [31, 32]. Дополнительно подтверждали диагноз лабораторные данные (лейкоцитоз, значительное повышение СРБ (61,94 мг/л при норме менее 5,0 в сочетании с маркерами поражения миокарда без нарушений функции ЛЖ по данным визуализирующих методик).
В дальнейшем боли в груди пациента не беспокоили, состояние оставалось удовлетворительным, гемодинамика была стабильной (пульс на фоне назначенной терапии не чаще 60 в минуту, удовлетворительных свойств, АД не выше 120/80 мм рт. ст. на обеих руках). По литературным данным, динамика ЭКГ-изменений при остром миоперикардите не имеет четкой характеристики [31, 33]. На контрольных ЭКГ к концу первых суток от начала болезни уменьшилась элевация сегмента ST в V1-V2, но сохранялись изменения в других отведениях, отмечался транзиторный синдром WPW (рис. 4). Лабораторно оставался лейкоцитоз с уменьшением относительного количества сегментоядерных лейкоцитов и повышением лимфоцитов к концу первой недели госпитализации, с конца первых суток госпитализации отмечалось повышение общей КФК (516,0 ЕД/л) и ее МВ-фракции (30,6 ЕД/л). В день поступления и в дальнейшем отмечалось незначительное повышение уровня антистрептолизина О (не более полутора норм), что не позволяло расценивать эти изменения как свидетельство перенесенной острой стрептококковой инфекции. Уровень СРБ через 2 дня снизился вдвое, а к 10-му дню госпитализации нормализовался. Отклонений в белковых фракциях не выявлено.
При ультразвуковом исследовании (УЗИ) органов брюшной полости описаны признаки гепатомегалии с диффузными изменениями в печени, характерными для жирового гепатоза, и повышенная эхогенность поджелудочной железы, в ложе оперативно удаленной селезенки округлая добавочная долька. Мультиспиральная компьютерная томография (МСКТ) органов грудной полости, выполненная через неделю после КАГ, не выявила изменений органов грудной клетки, в том числе признаков кальциноза коронарных артерий (расчетный индекс кальциноза по Агатстон составил 0). С диагностической целью еще через неделю было выполнено МСКТ — исследование области сердца в низкодозовом объемном режиме с использованием проспективной ЭКГ-синхронизации. Признаков стойких и динамических стенозов просветов коронарных артерий выявлено не было.
Заключительный клинический диагноз пациента: «Основное заболевание: острый миоперикардит (I30.1). Осложнения: вазоспастическая стенокардия. Сопутствующие заболевания: ожирение абдоминального типа. ИМТ 35 кг/м2. Транзиторный синдром WPW. Травма селезенки. Спленэктомия (1998 г.). Хронический тонзиллит, ремиссия».
Исходя из клинических проявлений, наиболее вероятный этиологический фактор миоперикардита в данном случае — парвовирус В19. Подтверждения вирусной этиологии заболевания серологическими исследованиями современные рекомендации по перикардиту и миокардиту считают нецелесообразным [9, 23, 31].
Пациент изначально получал стандартную для ОКС терапию, затем основу терапии составили ацетилсалициловая кислота, ингибитор ангиотензинпревращающего фермента (периндоприла аргинин 10 мг) и бета-блокатор (метопролола тартрат 50 мг). Выписан из отделения в удовлетворительном состоянии без жалоб. На контрольных амбулаторных осмотрах в последующие 1,5 года жалоб не предъявлял, снижения толерантности к физической нагрузке не отмечал. Состояние оценивалось как удовлетворительное. Однако периодически отмечалось повышение уровня АД до первой степени артериальной гипертензии.
При лабораторном обследовании пациента повышение уровня лейкоцитов в общем анализе крови при нормальном уровне СОЭ и снижении СРБ сохранялось в течение месяца.
На ЭКГ покоя в динамике ритм синусовый, ЧСС 70 в минуту, синдром WPW (рис. 4); при суточном мониторировании ЭКГ кроме синдрома WPW отмечены редкие одиночные наджелудочковые и желудочковые экстрасистолы. Контроль ЭхоКГ через 2, 9 и 12 месяцев дополнительно к выявленным ранее изменениям определил наличие уплотнения листков перикарда по задней стенке левого желудочка и эхо-свободное пространство в полости перикарда размером до 5 мм по периметру сердца в диастолу; оставались признаки увеличения полости левого предсердия и правого предсердия, гипертрофии межжелудочковой перегородки и задней стенки левого желудочка при нормальных показателях индекса массы миокарда левого желудочка; зон гипокинеза не выявлено, сократительная способность миокарда оценена как удовлетворительная, нарушений глобальной систолической и диастолической функций левого желудочка не было. С учетом появления незначительного по объему выпота в перикард исключены нарушения функции щитовидной железы (тиреоидный профиль лабораторно) и проведено УЗИ щитовидной железы (патологии не выявлено). Таким образом, появление малого (менее 10 мм) выпота в перикарде [31] и уплотнение листков перикарда, по данным УЗИ сердца, можно рассматривать как определенную стадийность течения миоперикардита. В то же время симптомы увеличения предсердий и утолщения МЖП невозможно однозначно трактовать как проявления поражения сердца при артериальной гипертонии (диагноз установлен исходя из данных наблюдения после выписки) или проявления и последствия миоперикардита.
Правильность интерпретации данных КАГ при первичном обследовании пациента подтвердили не только отсутствие клинических признаков атеросклероза коронарных артерий в дальнейшем, но и данные проведенных в последующем МСКТ. Кроме этого УЗИ брахиоцефальных сосудов через год также не выявило признаков атеросклероза периферических сосудов.
Быстрое улучшение состояния и доброкачественное течение заболевания у пациента вполне укладывается в стандартное описание проявлений миоперикардита. Как правило, прогноз при вовлечении миокарда в воспалительный процесс перикарда благоприятный, в литературе не описано развитие СН с ухудшением гемодинамики или смерть больных с миоперикардитом [31].
Вывод. Для правильного врачебного заключения, определяющего выбор тактики ведения пациента, необходим тщательный критический анализ всех имеющихся у пациента симптомов и данных анамнеза, а также постоянная настороженность в отношении более редких причин развития синдрома болей в груди.
Литература
- Cayley W. E. Jr. Diagnosing the cause of chest pain // Am. Fam. Physician. 2005. Vol. 72 (10). Nov (15). P. 2012–2021.
- Pope J. H. et al. Missed diagnoses of acute cardiac ischemia in the emergency department // N. Engl. J. Med. 2000. Vol. 342 (16). Apr (20). P. 1163–1170.
- Fanaroff A. C. et al. Does This Patient With Chest Pain Have Acute Coronary Syndrome?: The Rational Clinical Examination Systematic Review // JAMA. 2015. Vol. 314 (18). Nov. (10). P. 1955–1965.
- Tornvall P. Myocarditis or «true» infarction by cardiac magnetic resonance in patients with a clinical diagnosis of myocardial infarction without obstructive coronary disease: A meta-analysis of individual patient data // Atherosclerosis. 2015. Vol. 241 (1). Jul (7). P. 87–91.
- Багаутдинова Е. Р. с соавт. Дифференциальная диагностика стенокардии у пациентов, госпитализированных в стационар с диагнозом острый коронарный синдром // Медицинский вестник Башкортостана. 2010. Т. 5. № 2. С. 16–19.
- Dezman Z. D., Mattu A., Body R. Utility of the History and Physical Examination in the Detection of Acute Coronary Syndromes in Emergency Department Patients // West. J. Emerg. Med. 2017. Vol. 18 (4). Jun (6). P. 752–760.
- Freemantle N. et al. Weekend hospitalization and additional risk of death: an analysis of inpatient data // J. R. Soc. Med. 2012. Vol. 105 (2). Feb (2). P. 74–84.
- Bolognesi M., Bolognesi D. Acute coronary syndrome vs. myopericarditis — not always a straightforward. diagnosis // American. Journal of Case Reports. 2013. Vol. 14. P. 221–225.
- Caforio A. L. et al. European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases // Eur. Heart. J. 2013. Vol. 34 (33). Sep. (7). P. 2636–48.
- Richardson P. et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies // Circulation. 1996. Vol. 93 (5). Mar. (1). P. 841–842.
- Kindermann I. et al. Updateonmyocarditis // J. Am. Coll. Cardiol. 2012. Vol. 59 (9). Feb (28). P. 779–792.
- Global Burden of Disease Study 2013 Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013 // Lancet. 2015. Vol. 386 (9995). Aug. (22). P. 743–800.
- Fung G. et al. Myocarditis // Circ. Res. 2016. Vol. 118 (3). Feb 5. P. 496–514.
- Dennert R., Crijns H. J., Heymans S. Acuteviralmyocarditis // Eur. Heart. J. 2008. Vol. 29 (17). Sep. (9). P. 2073–2082.
- Kühl U. et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with «idiopathic» left ventricular dysfunction // Circulation. 2005. Vol. 111 (7). Feb. (22). P. 887–893.
- Hufnagel G. et al. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiological results // Herz. 2000. Vol. 25 (3). May (5). P. 279–285.
- Niccoli G., Scalone G., Crea F. Acute myocardial infarction with angiographically normal coronary arteries: what are we missing? // G. Ital. Cardiol. 2013. Vol. 14 (12). Dec (12). P. 817–827.
- Yilmaz A. et al. A geographical mystery: do cardiotropic viruses respect national borders? // J. Am. Coll. Cardiol. 2008. Vol. 52 (1). Jul (1). P. 82.
- Matsumori A. et al. Myocarditis and heart failure associated with hepatitis C virus infection // J. Card. Fail. 2006. Vol. 12 (4). May (5). P. 293–298.
- Sagar S. et al. Myocarditis // Lancet. 2012. Vol. 379 (9817). Feb (25). P. 738–747.
- Kühl U., Pauschinger M., Bock T. Parvovirus B19 mimicking acute myocardial infarction // Circulation. 2003. Vol. 108. P. 945–950.
- Благова О. В., Недоступ А. В. Современные маски миокардита (от клинических синдромов к диагнозу) // Рос. кард. журнал. 2014. № 5. С. 13–22.
- Национальные общества по изучению сердечной недостаточности и заболеваний миокарда. Клинические рекомендации. Миокардиты. 2016. [Электронный ресурс]. URL: http://cr.rosminzdrav.ru/#!/ischemia/131. (Доступ 01.12.2018).
- Dennert R. et al. Parvovirus-B19-associated fulminant myocarditis successfully treated with immunosuppressive and antiviral therapy // Antivir. Ther. 2010. Vol. 15 (4). P. 681–685.
- Testani J. M. et al. Focal myocarditis mimicking acute ST-elevation myocardial infarction: diagnosis using cardiac magnetic resonance imaging // Tex. Heart. Inst J. 2006. Vol. 33 (2). P. 256–259.
- Yilmaz A. Coronary vasospasm as the underlying cause for chest pain in patients with PVB19 myocarditis // Heart. 2008. Vol. 94 (11). Nov (11). P. 1456–1463.
- Kumar A. et al. Acute myocarditis triggering coronary spasm and mimicking acute myocardial infarction // World Journal of Cardiology. 2014. Vol. 6. № 9. P. 1045–1048.
- Jayaram A. A. et al. Prinzmetals Angina Masquerading as Acute Pericarditis // J. Clin. Diagn. Res. 2017. Vol. 11 (1). P. OD08–OD09.
- Lewis J. R. et al. Prinzmetal’s angina, normal coronary arteries and pericarditis // Can. Med. Assoc. J. 1978. Vol. 119 (1). Jul (8). P. 36–39.
- Hung M.-J. Coronary Artery Spasm // Int. J. Med. Sci. 2014. Vol. 11 (11). P. 1161–1171.
- Adler Y. et al. ESC Guidelines for the diagnosis and management of pericardial diseases: The Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (EACTS) // Eur. Heart. J. 2015. Vol. 36 (42). Nov (7). P. 2921–2964.
- Imazio M. et al. Good prognosis for pericarditis with and without myocardial involvement: results from a multicenter, prospective cohort study // Circulation. 2013. Vol. 128 (1). Jul (2). P. 2–9.
- Bhardwaj R. et al. Differential diagnosis of acute pericarditis from normal variant early repolarization and left ventricular hypertrophy with early repolarization: an electrocardiographic study // Am. J. Med. Sci. 2013. Vol. 345 (1). P. 28–32.
Е. А. Темникова*, 1, доктор медицинских наук, профессор
А. И. Кондратьев*, кандидат медицинских наук
В. В. Савилова**
А. С. Денисова*
А. Е. Колядко*
М. В. Темников***
* ФГБОУ ВО ОмГМУ Минздрава России, Омск
** БУЗОО ГК БСМП № 1, Омск
*** ФГБВОУ ВО ВМА им. С. М. Кирова МО РФ, Санкт-Петербург
1 Контактная информация: temnikovaomsk@mail.ru
Трудный диагноз. Острый инфаркт миокарда или миоперикардит?/ Е. А. Темникова, А. И. Кондратьев, В. В. Савилова, А. С. Денисова, А. Е. Колядко, М. В. Темников
Для цитирования: Лечащий врач № 1/2019; Номера страниц в выпуске: 71-81
Теги: сердце, воспаление, парвовирус, диагностика
Дата публикации 13 ноября 2019Обновлено 3 августа 2021
Определение болезни. Причины заболевания
Инфаркт миокарда (Myocardial infarction, heart attack) — это развитие некроза (омертвения) сердечной мышцы из-за остро возникшей недостаточности кровотока, при которой нарушается доставка кислорода к сердцу. Может сопровождаться болью в разных частях тела, потерей сознания, тошнотой, потливостью и другими симптомами [5].
Инфаркт миокарда является одной из наиболее острых клинических форм ишемической болезни сердца (ИБС).
Мужчины болеют инфарктом миокарда значительно чаще (примерно в 5 раз), чем женщины [6]. Эта закономерность особенно выражена в молодом и среднем возрасте. Инфаркты у женщин случаются в среднем на 10-15 лет позже по сравнению с мужчинами. Это может быть связано с более поздним развитием атеросклероза под влиянием защитного действия женских половых гормонов (эстрогенов) и меньшим распространением вредных привычек среди женщин. Заболеваемость инфарктом миокарда значительно увеличивается с возрастом.
Факторы риска развития инфаркта миокарда делятся на три группы:
- Факторы, которые можно скорректировать или устранить: курение, высокий уровень холестерина липопротеинов низкой плотности в крови, артериальная гипертензия.
- Факторы, которые хуже поддаются коррекции: сахарный диабет, снижение уровня липопротеинов высокой плотности (иначе их называют «хорошим холестерином»), ожирение, менопауза и постменопауза, употребление алкоголя, стресс, питание с избыточной калорийностью и высоким содержанием животных жиров, высокое содержание в крови липопротеина (А), высокий уровень гомоцистеина.
- Факторы, которые нельзя скорректировать или устранить: пожилой возраст, мужской пол, наследственность — раннее развитие инфаркта миокарда у родителей или кровных родственников до 55 лет.
Этиологические факторы инфаркта миокарда можно разделить на две группы:
1. Атеросклеротическое поражение сердечных артерий и развитие в них тромбов при разрыве атеросклеротической бляшки.
2. Неатеросклеротическое поражение коронарных артерий, возникшее из-за воспалительного процесса в стенках артерий различной этиологии. Воспаление возникает в результате:
- травмы артерии;
- радиационных повреждений (в том числе при лучевой терапии рака),
- снижения коронарного кровотока из-за спазма коронарных артерий, расслоения аорты или коронарной артерии, эмболии (закупорки коронарных сосудов);
- врождённых аномалий коронарных сосудов;
- несоответствия между потребностями миокарда в кислороде и его доставкой;
- нарушения свёртывания крови.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы инфаркта миокарда
Симптоматика инфаркта миокарда зависит от периода развития заболевания: прединфарктного, острейшего, острого, подострого и постинфарктного.
Прединфарктный период инфаркта миокарда. В прединфарктном периоде могут возникать кардиальные (касаются работы сердца) и некардиальные симптомы. К кардиальным сиптомам относятся: боли за грудиной, одышка, сердцебиения, аритмии. К некардиальным — слабость, потливость, головокружения, ощущение тяжести и боли в области желудка (в эпигастрии). В прединфарктном периоде могут наблюдаться только некардиальные симптомы при наличии аритмии и одышки (или без), но сам период проходит без болевых ощущений. При осмотре пациента можно обнаружить небольшой цианоз (посинение) губ, пространства под ногтевыми пластинами, аритмичный пульс, повышение болевой чувствительности кожи в области сердца.
Острейший период инфаркта миокарда. Болевой синдром — самый характерный симптом острейшего периода типичного инфаркта миокарда. У большинства пациентов наблюдаются чрезвычайно интенсивные боли сжимающего, давящего характера. Больные сравнивают давление с обручем или железными клещами, или с тяжёлой плитой, лежащей на груди. Могут ощущаться интенсивные жгучие (пожар в груди, ощущение кипятка, льющегося на грудь) или кинжальные боли. Болезненные ощущения сильнее, чем при обычном приступе стенокардии. Их интенсивность зависит от размера инфаркта миокарда и возраста больного. Тяжёлый и длительный приступ боли чаще наблюдается при обширных инфарктах. Более интенсивные боли наблюдаются у молодых больных по сравнению с лицами пожилого и старческого возраста. Нужно отметить, что слабо выраженные боли при инфаркте миокарда могут быть у больных с сахарным диабетом из-за повреждения вегетативной нервной системы и снижения болевой чувствительности.
Локализация боли:
- за грудиной (чаще всего);
- часто распространяется на прекордиальную зону (слева от края грудины) или на всю переднюю поверхность грудной клетки;
- в загрудинной области и справа от края грудины;
- в подложечной области (эпигастрии).
При осмотре больного кожные покровы бледные, повышена их влажность, отмечается цианоз (посинение) губ, ушей, носа, пространств под ногтями. Может наблюдаться небольшое увеличение частоты дыхания. Часто наблюдается учащение пульса до 90-100 ударов в минуту, однако в начале болевого приступа может возникать непродолжительное урежение ритма сердца (брадикардия), пульс может быть аритмичным.
Боль часто иррадиирует (распространяется) в другие части тела, как правило — в левую руку, иногда в обе, иногда появляется ощущение сильной сжимающей боли в запястьях (симптом «наручников», «браслетов»). Реже отдаёт в левое плечо, левую лопатку, область между лопаток, шею, нижнюю челюсть, ухо, глотку. Совсем редко — в правую руку и другие части тела. Возможны случаи, когда боль воспринимается больным преимущественно в зоне иррадиации, что затрудняет диагностику.
Для инфаркта очень характерен волнообразный характер боли в области сердца. Боль постепенно нарастает, усиливается, иногда становится невыносимой, затем её интенсивность несколько снижается. Однако вскоре боль снова нарастает и становится ещё сильнее. В среднем боли продолжаются несколько десятков минут (всегда больше 20-30 минут), иногда несколько часов, в некоторых случаях в течение одних-двух суток (при увеличении зоны некроза сердечной мышцы).
Во время приступа интенсивной боли при очень сильном возбуждении могут появляться галлюцинации.
В отдельных случаях боль в области сердца может быть не очень интенсивной или даже отсутствовать совсем. У таких больных развиваются атипичные формы инфаркта миокарда, когда на первый план выступает не болевой приступ, а другие проявления (например, аритмии или удушье).
Острый период инфаркта миокарда. В остром периоде окончательно формируется очаг некроза, боль обычно к этому моменту исчезает. Если боль сохраняется, то это может быть связано с расширением зоны инфаркта. Пульс учащённый, артериальное давление снижается.
Атипичные формы инфаркта миокарда. В ряде случаев могут возникать атипичные формы инфаркта миокарда. Они формируются из-за пожилого возраста, развитие инфаркта на фоне тяжело протекающей артериальной гипертензии или сердечной недостаточности, а также у тех, кто уже перенёс инфаркт ранее. Другими факторами являются: повышение порога болевой чувствительности, поражение вегетативной нервной системы с иннервацией (переходом от очага заболевании) боли в сердце (к примеру, при сахарном диабете или у больных алкоголизмом). Симптомы зависят от формы атипично протекающего инфаркта миокарда.
| Форма инфаркта миокарда | Симптомы |
|---|---|
| Периферическая форма с нетипичной локализацией боли | Боль различной интенсивности в области левой руки, левой лопатки, горла (по типу болей при ангине), шейно-грудного отдела позвоночника, нижней челюсти (воспринимается как зубная боль). Боль в области сердца отсутствует или неинтенсивная. Могут возникать слабость, головокружения, потливость, внезапное появление сердцебиений, аритмий, падение артериального давления. |
| Абдоминальная форма при диафрагмальном (заднем) инфаркте | Интенсивные боли наблюдаются в эпигастрии (верхней части живота), иногда в области правого подреберья или во всей правой половине живота. Боли часто сопровождаются тошнотой, рвотой, не приносящей облегчения, вздутием живота вследствие непроходимости кишечника и желудка. Возможно развитие желудочно-кишечного кровотечения. Живот болезненный в верхней половине, в правом подреберье, мышцы передней брюшной стенки напряжены. |
| Астматическая форма — сердечная астма | Возникает внезапный приступ удушья с кашлем и выделением пенистой мокроты розового цвета, характерны холодный пот и посинение конечностей. В нижних отделах лёгких можно услышать мелкопузырчатые хрипы. Боли в области сердца отсутствуют или выражены очень слабо. |
| Коллаптоидная форма (кардиогенный шок при повторных, обширных сквозных инфарктах миокарда) | Внезапно развивается обморочное состояние, беспокоят головокружения, потемнение в глазах, артериальное давление падает. Боль в области сердца отсутствует или не интенсивна. Появляется холодный пот, пульс частый и слабый, возможно появление аритмии. |
| Отёчная форма (при обширных и повторных инфарктах, приводящих к развитию сердечной недостаточности) | Появляется одышка, слабость, беспокоят сердцебиения, перебои в работе сердца, отёки в области голеней и стоп, в наиболее тяжёлых случаях наблюдается асцит (скопление жидкости в брюшной полости). |
| Аритмическая форма | Нарушение ритма в виде приступообразной мерцательной аритмии или тахикардии, частой экстрасистолии (аритмических сокращений), внезапно развивающейся атрио-вентрикулярной блокады. Болевой синдром в области сердца отсутствует. Наблюдается чаще при обширных, острых или повторных инфарктах, особенно у пожилых больных. Характерны клинические проявления ишемии головного мозга: головокружения, шум в ушах, потемнение в глазах, обморочные состояния. |
| Цереброваскулярная форма | На первый план выступают симптомы ишемии (недостаточного кровоснабжения) мозга. Чаще наблюдается у лиц пожилого возраста с выраженным поражением артерий головного мозга атеросклерозом, чаще у мужчин. Симптомы обусловлены динамическим нарушением мозгового кровоснабжения. Наблюдаются головокружения, потемнение в глазах, шум в ушах, тошнота, обмороки, преходящие нарушения зрения, слабость в конечностях, очаговая неврологическая симптоматика. Боли в области сердца, как правило, отсутствуют, артериальное давление чаще снижено. Реже наблюдается органическое нарушение мозгового кровообращения. Обычно в этом случае наблюдается тромбоз артерий мозга и развивается ишемический инсульт. Органическое нарушение кровоснабжения мозга проявляется парезами (снижением силы мышц), нарушением речи, очаговой неврологической симптоматикой. Могут развиваться нарушения психики в виде снижения критики своего состояния, галлюцинаций, иногда психозов. |
| Стёртая (малосимптомная) форма | Интенсивная боль в области сердца отсутствует. Наблюдаются нерезкие симптомы: непродолжительная слабость, потливость, ощущение нехватки воздуха. Симптомы быстро проходят. Больные не обращают на них внимание, не идут к врачу, им не проводится ЭКГ-исследование. Иногда наблюдается форма инфаркта миокарда совсем без симптомов, которая выявляется случайно при обнаружении на ЭКГ рубцовых изменений сердечной мышцы. |
| Комбинированная атипичная форма | Наблюдается сочетание клинических признаков из различных атипичных форм. |
Патогенез инфаркта миокарда
В основе развития инфаркта миокарда лежат три компонента:
1. Разрыв атеросклеротической бляшки.
2. Тромбоз (образование тромба и закупорка им коронарной артерии).
3. Вазоконстрикция (резкое сужение коронарной артерии).
Разрыв атеросклеротической бляшки или эрозия её поверхности происходит следующим образом. В бляшке развивается воспалительная реакция, мощным стимулятором которой является окисление проникающих в неё липопротеинов низкой плотности (одной из вредных фракций холестерина). После чего в бляшку поступают макрофаги (клетки, пожирающие другие вредоносные для организма клетки) и начинают продуцировать ферменты, разрушающие фиброзную покрышку бляшки. Прочность покрышки снижается и происходит разрыв.
Факторы, провоцирующие надрыв или разрыв атеросклеротической бляшки:
- накопление в бляшке окисленных липопротеинов низкой плотности;
- значительное давление крови на края бляшки;
- выраженный подъём артериального давления;
- курение;
- интенсивная физическая нагрузка.
В области повреждения бляшки происходит прилипание и склеивание тромбоцитов, что приводит к закупорке коронарной артерии. При разрыве бляшки кровь поступает внутрь, взаимодействуя с ядром бляшки. Тромб сначала образуется внутри бляшки, заполняет её объем, а затем распространяется в просвет коронарной артерии. При внезапном полном закрытии просвета коронарной артерии тромбом развивается сквозной инфаркт миокарда — некротизируется (омертвевает) вся толща сердечной мышцы. Сквозной инфаркт миокарда протекает тяжелее и более опасен в плане осложнений и смертельного исхода, чем мелкоочаговый несквозной инфаркт миокарда.
При неполной закупорке коронарной артерии (если тромб растворяется спонтанно или при помощи лекарств) формируется несквозной (нетрасмуральный) инфаркт миокарда.
В развитии закупорки просвета коронарной артерии большую роль играет спазм артерии, который обусловлен нарушением функции эндотелия, влиянием сосудосуживающих веществ, которые выделяют тромбоциты во время образования тромба. В итоге это приводит к спазму артерий, а тромбоциты начинают склеиваться ещё активней.
Развитие спазма коронарных артерий увеличивает степень её закупорки, вызванной атеросклеротической бляшкой и тромбом. Ток крови прекращается, что вызывает некроз миокарда [6][7].
Классификация и стадии развития инфаркта миокарда
Инфаркт миокарда можно классифицировать следующим образом [6]:
1. По глубине и обширности некроза на основе данных ЭКГ:
1.1. Крупноочаговый (обширный) QS или Q-инфаркт (ИМ с патологическим зубцом QS и Q на ЭКГ):
- крупноочаговый трансмуральный (т.е. сквозь всю стенку миокарда) (ИМ с патологическим зубцом QS);
- крупноочаговый нетрансмуральный (ИМ с патологическим зубцом Q).
1.2. Мелкоочаговый «не Q»инфаркт миокарда (без патологического зубца Q):
- субэндокардиальный (очаг некроза располагается только во внутренних субэндокардиальных слоях стенки сердца);
- интрамуральный (очаг некроза расположен в средних мышечных слоях стенки сердца).
2. По локализации инфаркта миокарда:
- инфаркт левого желудочка: передний; переднеперегородочный; верхушечный; переднебоковой; боковой; задний; заднебоковой; передне-задний;
- инфаркт миокарда правого желудочка;
- инфаркт миокарда предсердий.
3. По периодам развития инфаркта:
- прединфарктный (продромальный) — период нарастания тяжести уже имеющейся у пациента ишемической болезни сердца; продолжается от нескольких часов до 1-го месяца, наблюдается у 70-80% больных; одним из вариантов этого периода могут быть впервые возникшая стенокардия или рецидив стенокардии после длительного безболевого периода; наблюдается у больных после ранее перенесенного инфаркта или аорто-коронарного шунтирования; возможен безболевой вариант продромального периода;
- острейший — от момента возникновения недостаточного кровоснабжения миокарда до начала формирования очага некроза сердечной мышцы; продолжительность колеблется от 30 минут до 2-х часов (максимально до четырёх часов); опасен в плане возникновения жизнеугрожающих осложнений;
- острый — окончательно образуется очаг некроза, в нем формируется миомаляция (размягчение некротизированной мышечной ткани); продолжается от 2 до 14 дней, опасен в плане возникновения жизнеугрожающих осложнений;
- подострый — формируется полные замещение некротических масс молодой соединительной тканью, образующейся при процессах заживления дефектов в различных тканях и органах, на фоне очага некроза формируется рубец из соединительной ткани; длительность колеблется от 6 до 8 недель при неосложнённом инфаркте в зависимости от размера зоны некроза, возраста больного, а также наличия или отсутствия осложнений;
- постинфарктный (ближайший — 2-6 месяцев, отдалённый — после полугода) — на месте некроза миокарда полностью формируется рубец из соединительной ткани; сердечно-сосудистая система максимально полно адаптируется к новым условиям функционирования, когда омертвевший зарубцевавшийся участок сердечной мышцы выключается из сократительной функции.
4. По особенностям клинического течения:
- затяжное течение, рецидивирование, повторный инфаркт миокарда;
- неосложнённый инфаркт миокарда; инфаркт миокарда с осложнениями;
- типичное течение (классический вариант), атипичный инфаркт миокарда.
Осложнения инфаркта миокарда
Осложнения при инфаркте усугубляют течение заболевания и определяют его прогноз. Чаще всего встречаются следующие осложнения:
- Нарушения сердечного ритма и проводимости. Наблюдаются у 90-95 % больных в первые сутки после инфаркта. За такими нарушениями важно следить, так как они способны привести к смерти. Тяжёлые аритмии (например приступообразная желудочковая тахикардия) могут провоцировать развитие сердечной недостаточности. Степень выраженности и характер нарушений зависят от обширности, глубины, локализации инфаркта миокарда, а также от предшествующих заболеваний. Возможно возникновение аритмий сердца даже после восстановления кровотока (возникают так называемые «реперфузионные аритмии») [9].
- Острая сердечная недостаточность. К развитию острой сердечной недостаточности приводят обширные, сквозные инфаркты. Наиболее тяжёлая степень острой сердечной недостаточности левого желудочка проявляется сердечной астмой и отёком лёгких. Возникает выраженное удушье, ощущение нехватки воздуха, сильное чувство страха смерти. Больной ведёт себя беспокойно, судорожно хватает ртом воздух, находится в вынужденном полувозвышенном или сидячем положении. Дыхание частое, поверхностное. При прогрессировании недостаточности появляются кашель с отделением пенистой розовой мокроты и «клокочущее» дыхание, на расстоянии слышны влажные хрипы (симптом «кипящего самовара»). Симптомы указывают на развитие отёка лёгких. При прогрессировании левожелудочковой недостаточности и присоединении недостаточности правого желудочка у больного появляются чувство тяжести и боль в правом подреберье, что связано с острым набуханием печени. Видно набухание шейных вен, которое усиливается при надавливании на увеличенную печень. Появляется отёчность голеней и стоп.
- Кардиогенный шок. Развивается при крайней степени левожелудочковой недостаточности, из-за которой снижается сократительная функция миокарда. Это не компенсируется повышением тонуса сосудов и приводит к нарушению кровоснабжения всех органов и тканей, прежде всего жизненно важных. Систолическое артериальное давление падает до 80-70-ти мм рт. ст. и ниже [5].
- Аневризма левого желудочка. Это ограниченное выбухание тканей сердца, которые подверглись размягчению, истончению и потеряли сократительную способность. Из-за аневризмы определённый объём крови выключается из циркуляции. Постепенно на этом фоне может развиться сердечная недостаточность. При аневризме сердца могут развиваться тромбоэмболические осложнения. Часто возникают приступообразные нарушения ритма. Опасность заключается ещё и в том, что аневризма может расслоиться и разорваться.
- Ранняя постинфарктная стенокардия. Это частые приступы стенокардии напряжения и покоя, возникающие в госпитальном периоде. Иногда может развиваться при недостаточном растворении тромба с помощью тромболитической терапии. При стенокардии прогноз неблагоприятный, так как она может предвещать рецидив инфаркта и даже внезапную смерть.
- Перикардит. Воспаление наружной оболочки сердца наблюдается при сквозном и обширном инфаркте. При перикардите, как правило, прогноз благоприятен.
- Тромбоэмболические осложнения. Закупорка кровеносного сосуда тромбом может произойти из-за повышения свёртывающей активности крови, атеросклеротического поражения артерий, тромбоза в зоне инфаркта миокарда, наличия тромба в аневризме левого желудочка. Возникновению тромбоэмболических осложнений способствуют воспаления внутренней оболочки стенок вен нижних конечностей, длительный постельный режим и выраженная недостаточность кровообращения. Важно отметить, что в связи с активным применением терапии, направленной на растворение тромба, тромбоэмболии возникают нечасто, всего лишь у 2-6 % больных.
- Тромбоэндокардит. Это асептическое (без участия микробов) воспаление внутренней стенки сердца с образованием пристеночных тромбов в области некроза.
- Нарушения мочеиспускания. После инфаркта может возникнуть значительное снижение тонуса мочевого пузыря и задержка мочеиспускания. Наиболее часто это имеет место в первые дни заболевания у мужчин пожилого возраста с доброкачественной гиперплазией (увеличением) предстательной железы. Появляются жалобы на невозможность помочиться, ощущение переполненности мочевого пузыря и боли внизу живота.
- Осложнения со стороны желудочно-кишечного тракта. У больных могут возникать острые эрозии и язвы желудочно-кишечного тракта. Причина их развития — выброс в кровь высоких доз глюкокортикоидных гормонов как ответ на стресс, что усиливает выделение желудочного сока. При застойной сердечной недостаточности развиваются отёк слизистых и гипоксия (недостаточное насыщение кислородом), вызывающие изменения слизистой оболочки желудочно-кишечного тракта. Острые эрозии и язвы желудка и двенадцатиперстной кишки проявляются болями после еды, возможны ночные и «голодные» боли, изжога, рвота. У лиц пожилого возраста частым осложнением инфаркта становится парез (непроходимость) желудочно-кишечного тракта из-за уменьшения тонуса кишечной стенки и паралича мускулатуры кишечника. Основные симптомы — икота, ощущение переполненности желудка после еды, рвота, выраженное вздутие живота, отсутствие стула, разлитая болезненность живота при ощупывании.
- Постинфарктный аутоиммунный синдром Дресслера. Развивается у 3-4 % больных со 2 по 8 неделю после начала инфаркта миокарда. Иммунная система при этом синдроме начинает атаковать собственные клетки, воспринимая здоровые ткани в качестве чужеродных элементов. Это проявляется в виде следующих симптомов: перикардит (воспаление перикарда), плеврит (воспаление плевры), пневмонит (воспаление в тканях лёгких), лихорадка, повышение в крови эозинофилов, увеличение СОЭ (скорости оседания эритроцитов). Часто в воспалительный процесс вовлекаются суставы, развивается синовит (воспаление в синовиальной оболочке сустава), чаще поражаются крупные плечевые, локтевые, лучезапястные суставы.
- Синдром передней грудной клетки. Синдром плеча и руки. Развиваются у больных с остеохондрозом межпозвонковых дисков шейно-грудного отдела позвоночника спустя несколько недель и даже месяцев после возникновения инфаркта миокарда. При синдроме передней стенки грудной клетки возникает поражение грудинно-рёберных суставов. Появляется припухлость и боль в окологрудинных областях, усиливающиеся при надавливании на грудину и грудинно-рёберные сочленения, при поднятии рук кверху. При синдроме плеча и руки возникают боли в левом плечевом суставе (чаще всего), также могут быть боли в правом или в обоих плечевых суставах. Боли усиливаются при движении.
- Психические нарушения. Нарушения психики обычно развиваются на первой неделе заболевания из-за нарушения гемодинамики мозга, гипоксемии (понижения содержания кислорода в крови) и влияния продуктов распада некротического (омертвевшего) очага миокарда на головной мозг. Чаще всего расстройства психики наблюдаются у больных старше 60-ти лет с атеросклерозом сосудов головного мозга. Возникают психотические (оглушённость, оцепенение, делирий, сумеречные состояния) и непсихотические реакции (депрессивный синдром, эйфория).
Диагностика инфаркта миокарда
Постановка диагноза в большинстве случаев не представляет трудностей. Врач опирается на типичную клиническую картину, данные электрокардиографии и определение в крови биомаркеров некроза сердечной мышцы.
При подозрении на инфаркт миокарда сразу же необходимо выполнить ЭКГ (электрокардиография). Если есть возможность, рекомендуется сравнить ЭКГ, записанную в момент болевого приступа, с ранее зарегистрированной ЭКГ. ЭКГ следует записывать неоднократно, делая динамическое ЭКГ-наблюдение: иногда в первые часы и даже несколько первых дней ЭКГ-признаки инфаркта неубедительны, и только на последующих ЭКГ появляется характерная картина болезни. В стационаре наиболее целесообразно проводить ЭКГ-мониторирование в течение 24 часов от начала развития инфаркта миокарда.
Лабораторные исследования включают в себя:
- Общий анализ крови. Отражает резорбционно-некротический синдром. Начиная с 4-6-го часа инфаркта миокарда на фоне нормальных значений СОЭ начинает появляться лейкоцитоз (повышение числа лейкоцитов) нередко со сдвигом формулы влево. Лейкоцитоз сохраняется до четырёх дней и к концу первой недели снижается. Начиная со второго дня инфаркта миокарда постепенно начинает расти СОЭ. К началу второй недели заболевания число лейкоцитов нормализуется. Сохранение лейкоцитоза и/или умеренной лихорадки более недели свидетельствует о возможном наличии осложнений: плеврита, пневмонии, перикардита, тромбоэмболии мелких ветвей лёгочной артерии и др.
- Биохимический анализ сыворотки крови. Маркерами гибели клеток сердечной мышцы (миоцитов) являются изменения концентрации в крови креатинфосфокиназы (КФК), лактатдегидрогеназы (ЛДГ), аспартатаминотрансферазы (АСАТ), а также содержание в крови миоглобина, кардиотропонинов Т и I (TnI и TnT) [2].
Эхокардиография позволяет выявить такие осложнения острого инфаркта миокарда, как образование пристеночных тромбов в полостях сердца, появление аневризмы сердца, разрыв межжелудочковой перегородки или отрыв сосочковых мышц. С помощью эхокардиографии выявляется важнейший признак инфаркта миокарда — нарушения локальной сократимости миокарда. Эти нарушения соответствуют распространённости некроза.
Экстренная селективная коронарная ангиография проводится в тех случаях, когда ЭКГ и анализ активности ферментов не дают результатов, либо же их интерпретация затруднена (например, в условиях наличия сопутствующих заболеваний, «смазывающих» картину). Исследование представляет собой рентгеновский снимок сосудов сердца, в которые предварительно введено контрастное вещество. С помощью ангиографии (коронарографии) можно установить закупорку коронарной артерии тромбом и снижение сократимости желудочка. С помощью этого метода оценивают, можно ли провести аортокоронарное шунтирование или ангиопластику — операции, восстанавливающие кровоток в сердце [7].
Лечение инфаркта миокарда
Пациента с острым инфарктом необходимо оперативно доставить в стационар для профилактики осложнений и повышения шансов на выживание. Система оказания помощи больным инфарктом миокарда включает следующие этапы:
- Догоспитальный этап. Помощь оказывают бригады скорой помощи, они же транспортируют больного в стационар.
- Госпитальный этап. Помощь оказывается в специализированных сосудистых отделениях.
- Реабилитационный этап. Реабилитация проводится в специальных отделениях больниц или специализированных кардиологических санаториях.
- Диспансерное наблюдение и амбулаторное лечение. Диспансеризация в постинфарктном периоде осуществляется в областных или городских кардиологических центрах или в кардиологических кабинетах поликлиник [6].
На догоспитальном этапе решаются следующие задачи:
- устанавливается точный диагноз. Если это не удаётся, допустимо установление ориентировочного синдромного диагноза в максимально короткое время;
- под язык больному дают таблетку нитроглицерина (или использовать нитросодержащий спрей) и 0,25-0,35 г аспирина;
- боль снимается введением обезболивающих;
- ликвидируется острая недостаточность кровообращения и нарушения ритма сердца;
- больного выводят из состояния кардиогенного шока;
- при клинической смерти производят реанимационные мероприятия;
- как можно скорее транспортируют больного в стационар.
Дальнейшая терапия определяется стадией (периодом) инфаркта миокарда. В остром и острейшем периоде цель лечения — предотвращение увеличения очага омертвения миокарда, устранение боли и других симптомов. Важно восстановить ток крови по сердечным артериям и купировать боль. Интенсивность боли в этом периоде настолько велика, что пациент может погибнуть из-за остановки сердца. Необходимо провести профилактику тяжёлых осложнений. При переходе болезни в подострую стадию и в постинфарктном периоде цель терапии — снижение риска рецидива приступа и возможных осложнений.
Для лечения острого инфаркта миокарда используются лекарственные препараты из различных фармакологических групп:
Обезболивающие препараты. Анальгетики из группы наркотических обезболивающих (морфин, промедол, омнопон) в сочетании с анальгином, антигистаминными препаратами (димедрол). Наиболее эффективной является нейролептанальгезия, когда используется комбинация анальгетика фентанила с сильным нейролептиком дроперидолом. Эффективность применения этих препаратов заметна уже через несколько минут. Исчезает не только боль, но и страх смерти, немотивированная тревога и психомоторное возбуждение. Для снятия психомоторного возбуждения могут использоваться транквилизаторы (диазепам). Для уменьшения гипоксии (снижения кислорода в тканях) используются ингаляции кислорода с помощью носового катетера.
Тромболитическая терапия. Важно восстановить ток крови и растворить тромбы, чтобы омертвение сердечной мышцы на распространялось дальше. Чем меньше зона некроза, тем выше шансы больного на успешную реабилитацию и ниже риск опасных для жизни осложнений. Немедленное применение препаратов (желательно в течение первого часа после приступа) позволяет достичь максимальную эффективность лечения. Допускается временной лимит в пределах трёх часов. Для растворения тромба внутривенно вводятся тромболитические препараты, например, стрептокиназа, урокиназа, альтеплаза. Доза зависит от веса пациента.
Восстановление коронарного кровотока возможно также с помощью хирургического лечения — стентирования или аорто-коронарного шунтирования. Баллонный катетер вводится в узкий участок артерии под контролем рентгеноскопии. При этом атеросклеротическая бляшка «раздавливается», а просвет артерии сердца увеличивается. Затем в просвет сосуда может быть установлен стент (металлический каркас).
Антиагреганты. Препараты из этой группы влияют на клетки крови (тромбоциты и эритроциты). Действие антиагрегантов препятствует слипанию тромбоцитов, улучшая кровоток. Основным применяемыем препаратом является аспирин (ацетилсалициловая кислота). Противопоказания к применению аспирина: кровотечения из желудочно-кишечного тракта, обострение язвы желудка или двенадцатиперстной кишки.
Используются также ингибиторы P2Y12-рецепторов тромбоцитов, которые блокируют активацию тромбоцитов. Основные блокаторы — тикагрелор, прасугрел и клопидогрел.
Внутривенные/подкожные антикоагулянты. При остром коронарном синдроме для профилактики тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА) в остром периоде применяется нефракционированный гепарин (НФГ), который вводится внутривенно. Эноксапарин, который используется также для профилактики венозных тромбоэмболий, вводится подкожно.
Чтобы ограничить зону ишемии и некроза миокарда необходимо кроме восстановления кровотока в артериях сердца уменьшить гемодинамическую нагрузку на сердце. С этой целью используются нитраты и бета-блокаторы.
Нитраты. Оказывают противоболевой эффект, уменьшают потребность миокарда в кислороде, увеличивают коронарный и коллатеральный (обходной) кровоток, снижают нагрузку на сердечную мышцу, ограничивают размеры очага поражения миокарда. Особенно эффективна комбинация их с бета-блокаторами, приводящая к быстрой положительной динамике ЭКГ и снижению риска внезапной смерти [10].
Бета-адреноблокаторы оказывают антиаритмическое действие. Цель применения бета-адреноблокаторов (пропранолола, метопролола, атенолола) — уменьшение частоты и силы сердечных сокращений, что поможет уменьшить нагрузку на сердце и потребность миокарда в кислороде. Бета-блокаторы продолжают применять при отсутствии побочных эффектов и противопоказаний неопределённо длительное время [1].
Прогноз. Профилактика
Общий уровень смертности от инфаркта миокарда составляет примерно 30 %, от 50 до 60 % больных умирают на догоспитальном этапе. Летальность в стационаре составляет около 10 %.
Клинические характеристики, предсказывающие высокую (до 90 %) смертность у больных:
- пожилой и старческий возраст (31 % общей смертности);
- низкое систолическое артериальное давление (24 %);
- высокая частота сердечных сокращений (12 %);
- передняя локализация инфаркта миокарда (6 %).
Смертность среди больных сахарным диабетом и женщин несколько выше.
Смертность среди пациентов с первичным инфарктом миокарда составляет 8-10 % в первый год после острого инфаркта миокарда. Большинство смертей происходит в первые 3-4 месяца. Постоянная желудочковая аритмия, сердечная недостаточность и сохраняющаяся ишемия являются маркерами высокого риска смерти. Низкая переносимость физических нагрузок также ассоциируется с плохим прогнозом.
Профилактика инфаркта миокарда подразделяется на первичную и вторичную [3].
Первичная профилактика проводится при наличии каких-либо проблем с сердцем, но до того, как произошёл инфаркт. В неё входят:
- Физическая активность — малоподвижный образ жизни отрицательно влияет на сердечно-сосудистую систему, а занятия спортом помогают сбросить избыточный вес, повышающий риск атеросклероза и нагрузку на сердце.
- Отказ от вредных привычек — курение табака способствует развитию и прогрессированию атеросклероза. Алкоголь следует употреблять в небольшом количестве. Излишнее употребление алкоголя оказывает токсическое действие на сердечную мышцу и другие органы, может вызывать аритмии и сосудистый спазм (сужение сосудов).
- Правильное питание — включение в ежедневный рацион свежих овощей, фруктов и зелени. Жирное мясо (свинину) лучше заменить на мясо птицы или кролика. Полезны рыба и морепродукты. Необходимо ограничить приём соли. При экстрасистолии нельзя употреблять пряности, так как они могут спровоцировать развитие аритмии.
- Контроль над стрессом — отдых, полноценный сон (не менее восьми часов в сутки). Стрессы и депрессии могут провоцировать инфаркт, так как под их влиянием происходит спазм сосудов сердца. Некоторым людям необходимо пройти курс лечения у психолога.
- Регулярные посещения кардиолога — после 40 лет осмотр рекомендуется делать ежегодно. Обязательно необходимо делать ЭКГ-исследование, проводить определение липидного профиля (общего холестерина и его фракций), контролировать уровень сахара в крови.
- Контроль за давлением — разрыв атеросклеротической бляшки зачастую провоцирует повышенное артериальное давление. При выявленной артериальной гипертензии необходим своевременный постоянный приём гипотензивных (снижающих артериальное давление) препаратов, назначенных кардиологом.
Вторичная профилактика инфаркта миокарда необходима тем, кто уже перенёс инфаркт. Она направлена на предотвращение повторного инфаркта миокарда и длится всю жизнь. Помимо мер, которые применяются для первичной профилактики инфаркта, обязательно постоянное применение медикаментозных препаратов, назначенных врачом:
- двойная антиагрегантная терапия (аспирин и второй антиагрегант — тикагрелор или клопидогрел) в течение года после инфаркта миокарда для снижения риска сердечно-сосудистых событий; первичная профилактика аспирином не нужна;
- бета-блокаторы для уменьшения частоты сердечных сокращений и снижения уровня артериального давления;
- статины для снижения уровня холестерина и предотвращения прогрессирования атеросклероза;
- нитраты для купирования болевых приступов при возобновлении стенокардии;
- ингибиторы АПФ или сартаны для нормализации артериального давления, а также при наличии признаков сердечной недостаточности.
Обязателен регулярный контроль за состоянием больного, уровнем артериального давления, показателями биохимии (в частности уровнем печёночных ферментов и показателями липидного профиля), изменениями на ЭКГ, эхокардиографии. При необходимости проводится суточное мониторирование ЭКГ.
Сегодня заболевания сердечно-сосудистой системы входят в первую тройку причин смертности, а инфаркт миокарда является самой опасной для человека патологией сердца. Несмотря на то, что во многих случаях это серьезное заболевание можно предотвратить, люди часто беспечно относятся к себе, забывая не только о здоровом образе жизни, но даже игнорируя характерные для кардиопатологии сигналы организма. В Тюменском кардиологическом научном центре первыми пациентов, у которых случился острый инфаркт миокарда, встречают врачи анестезиологи-реаниматологи. Они оценивают их состояние, лечат, сопровождают на операцию, и знают, как тяжело переносится сердечный приступ. Мы попросили анестезиолога-реаниматолога Тюменского кардиоцентра, кандидата медицинских наук Юлию Крошкину рассказать о том, что такое инфаркт, как распознать его первые симптомы и почему при боли за грудиной нужно срочно вызывать скорую помощь.
Инфаркт миокарда (сердечный приступ) – одна из клинических форм ишемической болезни сердца, протекающая с развитием ишемического некроза участка миокарда, обусловленного абсолютной или относительной недостаточностью его кровоснабжения.
Юлия Сергеевна, в каком состоянии попадают в реанимацию пациенты?
Как правило, в реанимацию попадают пациенты с инфарктом миокарда с подъемом сегмента ST – это самая тяжелая форма заболевания, поэтому у них тяжелое или крайней степени тяжести состояние. Таких пациентов чаще всего привозят на скорой помощи. Как врачам сориентироваться, что это именно инфаркт миокарда и пациента нужно везти в кардиоцентр? Прежде всего, по изменениям в кардиограмме, характерным для сердечного приступа, а также соответствующим клиническим проявлениям – боли за грудиной давящего, сжимающего характера, иногда отдающие в левую руку. Когда человек поступает в кардиоцентр, у него берут анализы, в том числе маркеры некроза миокарда. Есть определенные показатели крови, которые показывают, случился ли инфаркт. Всем пациентам делают УЗИ сердца и в экстренном порядке отправляют на коронароангиографию (прим. Процедура исследования сосудов сердца), где в условиях операционной определяется дальнейшая тактика ведения пациента.
Многое зависит от скорой помощи – насколько быстро они доехали до пациента и привезли его в больницу. Очень важен период времени от момента инфаркта до восстановления кровотока в сердце. Сердце, как и все органы, кровоснабжается сетью артерий. И когда какая-то из них по любой причине закрывается, то прекращается кровоснабжение участка, к которому она подходила. Сначала появляется ишемия, потом этот участок отмирает – происходит некроз, а в дальнейшем появляется рубец. Основная задача – восстановить кровоток в поврежденной артерии, либо медикаментозно, либо с помощью операции. Чем быстрее он восстановится, тем лучше – меньше будет зона некроза, меньше осложнений, пациент будет лучше себя чувствовать. Поэтому на этапе скорой помощи зависит, как быстро медики приехали, как быстро сориентировались, что у человека инфаркт, как быстро его доставили в тот центр, где смогут прооперировать. В Тюмени до недавнего времени это были Тюменский кардиоцентр и Тюменская областная больница №1. Сейчас еще добавился госпиталь «Мать и дитя». В догоспитальном этапе считается, что с момента первого медицинского контакта с пациентом до постановки диагноза должно пройти не более 10 минут. До момента госпитализации должно пройти не более 120 минут.
А что в случае сердечного приступа зависит от самого пациента?
Нередко человек не может адекватно оценить свое состояние и ждет «а может и так пройдет».
Не всегда все зависит от врачей, к сожалению. Основная беда для грамотных людей – это Интернет. Они сами себе ставят диагноз, сами начинают лечиться. Очень важно – как только появилась боль за грудиной, надо сразу вызывать скорую помощь. Пусть это окажется остеохондроз или какая-то другая болезнь, которая не приводит к смерти. Но лишний раз лучше перестраховаться и вызвать скорую помощь, чем пропустить инфаркт. Такие пациенты у нас не редкость. Оказывается, первые боли возникли, например, 30 числа, потом стало вроде бы полегче, потом человек заболел повторно через неделю. А по факту выявляется, что инфаркт случился 30-го, а 8-го следующего месяца — уже рецидив. Таких пациентов потом намного сложнее лечить, у них больше осложнений. В поликлинике запись может быть через день, на завтра назначат кардиограмму, а счет может идти на минуты. В приемном отделении, куда пациента привезет «скорая», сделают все сразу. Врачи посмотрят и решат, надо ли госпитализировать больного. На самом деле, много пациентов, которые обращаются поздно. Терпят до последнего, боятся идти на больничный.
Чаще инфаркты случаются у мужчин или женщин?
К своему здоровью более ответственно все-таки относятся женщины. Мужчины зачастую затягивают с визитом к врачу. Если говорить о группах риска, то мужчины чаще болеют инфарктом миокарда. Женщины с инфарктом миокарда, особенно в молодом возрасте, — нонсенс. Женщины появляются в группе риска в постмепнопаузальный период. Пока они менструируют, здоровы, у них нет сопутствующих заболеваний крови, они не пьют препараты, повышающие свертываемость крови, то они не в зоне риска. Кстати, в зоне риска находятся женщины, принимающие оральные контрацептивы, которые увеличивают свертываемость крови. Поэтому, когда поступает молодая пациентка с инфарктом миокарда, то первое, что мы спрашиваем – какие лекарства она принимает. Также мужчины больше курят и больше алкоголизируются, чем женщины, и тяжелее переносят стрессы. Это тоже увеличивает риск инфаркта. По статистике, после первого инфаркта мало кто бросает курить, а после второго бросают процентов 80. Потому что повторные инфаркты протекают гораздо тяжелее. Сердце уже дискредитировано, на нем есть рубец, оно хуже сокращается. У женщин в молодом возрасте препятствуют тромбообразованию еще и женские половые гормоны. Пока яичники нормально функционируют, то риск инфаркта минимальный.
На что, помимо боли, необходимо обратить внимание, чтобы вовремя заметить инфаркт и обратиться к врачу?
Локализации инфаркта бывают разные – передние, задние. Нижние инфаркты, бывает, что проявляются изжогой. Человек думает, что у него нарушено пищеварение. Иногда бывает, что на первое место выступает одышка. Но чаще всего все-таки на первом плане будет боль, которая может отдавать в левую половину тела – шею, руку.
А можно ли пропустить инфаркт, перенести его на ногах?
Человек может находиться в состоянии стресса и не понимать, что с ним происходит что-то серьезное. Это характерно для мелкоочаговых инфарктов, когда клиника смазанная на фоне ОРВИ, стресса. Человек говорит, что у него никогда не было инфаркта, а на кардиограмме рубец. В диагнозе мы ставим «постинфарктный кардиосклероз неуточненной давности».
Сколько инфарктов способно перенести сердце человека?
Максимум, мне кажется, пять инфарктов. Потом сердце превращается в вялый мешочек, который плохо сокращается. Каждый последующий инфаркт переносится хуже, чем предыдущий.
Как долго пациент восстанавливается после инфаркта?
У нас в реанимации все пациенты лежат с инфарктами миокарда. Казалось бы, диагноз у всех одинаковый, но болезнь протекает по-разному, у каждого есть какая-то особенность. В целом, если больной поступил без осложнений, то он около трех суток находится в реанимации, около недели – в отделении неотложной кардиологии и потом на амбулаторном этапе – около двух месяцев. Нередко думают, что мы подлечим за два дня и отпустим. Но лечение требует времени.
Инфарктов сегодня становится больше или меньше?
Цифры стабильные. Может быть, это удивительно, но примерно всегда одинаковые проценты заболевших и осложнений.
Расскажите о наиболее интересных случаях в вашей практике?
Каждый по-своему уникален. Был пациент, ведущий спортивный образ жизни, — катался на лыжах, упал на лыжне, потерял сознание. Его увидел в лесу другой лыжник, пока транспортировали в город – инфаркт. Вроде бы человек прекрасно себя чувствовал, никогда ничем не болел… Также к нам одновременно с инфарктами миокарда попали два анестезиолога из другой больницы. Сами себя лечили, думали, что пройдет, терпели и ходили на работу.
Что нужно делать, чтобы предотвратить инфаркт миокарда?
Разговариваем с родственниками пациента с инфарктом, они недоумевают: «Как так, он не пил, не курил, ел нормальную пищу, и вдруг случился инфаркт миокарда». Но такое состояние вдруг не случается. Основная причина развития инфаркта миокарда – это отложение холестерина в коронарных артериях – атеросклероз. Процесс роста атеросклеротической бляшки не происходит внезапно, а развивается годами. Особенно так происходит у возрастных пациентов.
Не пить, не курить, следить за питанием, за массой тела, измерять артериальное давление. У гипертоников риск возникновения инфаркта в разы выше, чем у людей с нормальным давлением. Также нужно следить за холестерином – хотя бы раз в год проходить обследование у терапевта, записывать кардиограмму и сдавать липидный спектр. Высоким холестерин бывает и у худеньких, и у активных людей. Причина либо в питании, либо в генетической предрасположенности. Для нормализации состояния часто достаточно соблюдать диету. Обязательно нужно лечить и контролировать сопутствующие заболевания, особенно сахарный диабет. Но инфаркт миокарда – это не всегда атеросклероз. Случается, что на фоне ОРВИ на чистых сосудах развилось воспаление, возник отек. На фоне стресса происходит спазм артерии.
Какую роль в профилактике инфарктов играет активный образ жизни?
Здоровый образ жизни, активность – это профилактика лишнего веса. Можно просто ходить, подниматься пешком по лестнице. После инфаркта у нас есть специальная система реабилитации. Всех пациентов осматривают, консультируют врачи по лечебной физкультуре. С нашими пациентами занимаются уже через несколько дней после инфаркта – начинают с минимальных движений, объем и продолжительность которых со временем увеличивается.
Инфаркт миокарда
Электрокардиограмма (ЭКГ)
Эхокардиография (УЗИ сердца)
- Инфаркт
- Причины
- Симптоматика
- Диагностика
- Лечение
Инфаркт
По сей день иногда звучат, преимущественно от людей старшего поколения, примерно такие народно-кардиологические обороты: «Этак можно и инфаркт получить, то бишь разрыв сердца» (обычно имеется в виду потрясение от неожиданности или, скажем, от радостной новости). Земной поклон нашим несокрушимым дедам и бабушкам, и пусть все новости только радуют их усталые сердца.
Однако в терминологию, учитывая исключительную важность темы, все же стоит внести определенность.
Инфаркт — это не разрыв сердца. Более того, даже не обязательно речь идет именно о сердце: ничуть не слаще, скажем, инфаркт головного или спинного мозга, инфаркт почки или кишечника.
И определение, которое с автоматической назойливостью дает инфаркту одна из крупнейших поисковых систем в Интернете: «…прекращение тока крови при спазме артерий или их закупорке», – это тоже неправильно. Инфаркт не «прекращение тока крови», а результат такого прекращения, результат всегда патологический и, как правило, тяжелый.
Поэтому будем стремиться к точности определений и ясности формулировок. Тема действительно слишком серьезна.
Любая живая ткань состоит, как известно, из клеток. Для нормальной работы и эффективного выполнения своих функций эти клетки должны дышать, питаться и избавляться от шлаковых продуктов метаболизма (обмена веществ). Все эти процессы обеспечиваются кровотоком или, говоря точнее, перфузией – постоянным «пропитыванием», сквозным проливанием крови через ткань, за что отвечает система капилляров, самых мелких кровеносных сосудов. В капиллярную систему поступает артериальная кровь, приносящая в ткань питательные вещества и связанный эритроцитами кислород. Затем по малым, большим и магистральным венам кровь отводится к легким, печени, почкам – для нового цикла фильтрации, детоксикации, обогащения и газообмена.
Насосную функцию, то есть прокачивание крови под давлением по этой сложной сосудистой системе, выполняет сердечная мышца, или миокард. Сократительная активность сердца начинается еще в утробе матери, на первых неделях беременности, и безостановочно продолжается до последней минуты жизни человека. Верно и обратное: последняя минута наступает вследствие того, что останавливается ритмичное чередование сокращений (систола) и расслаблений (диастола).
Однако миокард как полая насосная мышца (анатомически и гистологически устроенная весьма сложно) состоит из живых тканей, которым тоже необходимы питание и кислород. В этом смысле миокард не отличается от прочих органов: ему самому нужна тканевая перфузия крови, непрерывная и достаточно интенсивная, учитывая работу в пожизненном режиме 24/7 без выходных и праздничных дней. Кровоснабжение сердца осуществляется по специальному артериально-венозному контуру. За внешнее сходство с атрибутом монаршества собственный круг кровообращения миокарда называют коронарным, или венечным.
Недостаточно объемный «пролив» крови через ткань (любую, не только сердечную) носит название гипоперфузия. Широко известный термин «ишемия» на разных этапах развития медицины трактовался по-разному; сегодня под ишемией понимают патологическое состояние ткани, развивающееся вследствие гипоперфузии, причем облигатными (обязательными для употребления термина или постановки диагноза) признаками ишемии являются нарушения всех основных процессов, обеспечиваемых тканевым кровоснабжением – питания, оксигенации (насыщение кислородом) и отвода шлаков.
Таким образом, ишемическая болезнь сердца (ИБС), – хроническое голодание и/или «засорение» тканей миокарда, обусловленное недостаточным функционированием коронарного контура кровообращения. Факторов риска и прямых причин развития ИБС, как и ее клинических вариантов, известно множество, но сейчас важнее другое: такая ситуация неизбежно приводит к перегрузке, преждевременному износу, дегенеративно-дистрофическим изменениям в тканях и разнообразным сбоям в работе сердечной мышцы (например, к приступам стенокардии). В условиях постоянной ишемии миокард, мозг, почка и любой другой орган просто не может в полном объеме выполнять свои функции – подобно тому, как задыхающийся и живущий впроголодь атлет не сможет заниматься профессиональным спортом.
Инфаркт представляет собой одновременную массовую гибель клеток на локальном участке ткани. Другими словами, это быстрый очаговый некроз, наступающий вследствие резкого сокращения кровоснабжения (неполная ишемия) или полного прекращения перфузии (тотальная ишемия).
- Инфаркт миокарда
- — омертвение одного или нескольких участков сердечной мышцы, наступившее по той причине, что в этих участках перестала циркулировать кровь коронарного круга.
В отношении инфаркта миокарда сегодня доступно огромное количество информации. Не всегда она, как показано выше, достоверна и точна, но это в любом случае лучше, чем полное непонимание нормальных и патологических процессов, происходящих в собственном организме. Останавливаться на подробностях эпидемиологии мы здесь не станем, однако кратко отметим четыре наиболее существенных и тревожных момента.
Во-первых, сердечнососудистые заболевания (в первую очередь ИБС и инфаркты) в статистических показателях ненасильственной летальности упорно удерживают лидерство: их доля в общей структуре смертности, по оценкам ВОЗ, превышает 30%.
Во-вторых, показатели летальности по России в два с половиной раза выше, чем в среднем по Европе; втрое выше, чем в США; в девять раз выше, чем в Японии.
В-третьих, инфаркт постоянно «молодеет»: усредненный возраст первичных больных с ИБС и инфарктами год от года устойчиво снижается.
В-четвертых, 80% инфарктов миокарда можно было предотвратить.
Причины
Факторы, длительным действием которых обусловлено подавляющее большинство инфарктов миокарда – это ишемическая болезнь сердца (иногда ее небезосновательно называют «инфарктом, растянутым во времени»), атеросклероз и артериальная гипертензия. О каждом из этих заболеваний написаны тысячи больших томов, однако полной ясности пока нет: обнаруживаются все новые и новые данные об их этиологии, патогенезе, клинике. Эти «три источника и три составные части» инфаркта находятся между собой в тесной и сложной взаимосвязи; они чаще всего действуют одновременно и потенцируют друг друга.
Непосредственной причиной острой ишемии и последующего некроза практически всегда оказывается тромбоэмболия – закупорка одного из коронарных сосудов сгустком крови, зацепившимся за атеросклеротическую бляшку, или самой бляшкой при достижении ею значительных размеров и отрыве от сосудистой стенки, или липидным комком (жировая эмболия в 90% случаев обусловлена скелетной травмой, особенно переломами трубчатых костей), или пузырьком воздуха (воздушная эмболия встречается редко). Кроме того, инфаркт миокарда возможен при длительном спазме коронарных артерий и некоторых пороках анатомического строения.
К дополнительным факторам риска относятся: пожилой возраст, экологические вредности, наличие ревматических заболеваний, тяжелых инфекций, сахарного диабета, уже перенесенного инфаркта в анамнезе, эмоциональные и физические перегрузки, особенно внезапные (включая резкий подъем после сна), а также мужской пол. Но главный фактор сердечнососудистого риска отлично известен, скучен и настолько банален, что воспринимается уже почти как норма, а не как грубая патология. Этот фактор состоит из всего того, что мы собираемся «бросить с понедельника», дабы начать «новую здоровую жизнь». Всё собираемся да собираемся, да откладываем до следующего раза.
И зря откладываем, надо заметить, поскольку буквально с каждым месяцем наше курение, ожирение, переедание, злоупотребление, круглосуточное сидение и лежание, наслаждение всякой малосъедобной гадостью, нежелание пройтись пешком, если можно подрулить, – становятся все опасней. Снисходительно посмеиваясь над теми молчаливыми утренними и вечерними тенями в спортивных костюмах, кто «бежит трусцой от инфаркта», мы очертя голову несемся в противоположном направлении.
Симптоматика
Казалось бы, что тут долго говорить: раз инфаркт, значит, сильно болит сердце. Если повезло, – приехали, увезли и откачали до следующего раза; прочитали нудную лекцию о вреде курения, рекомендовали санаторий и сдали напряженно улыбающимся родственникам. А коли не повезло – ну что ж, упал и умер, судьба такая, все под богом…
На самом деле клиника инфаркта миокарда, несмотря на фактически однотипный этиопатогенетический механизм, удивительно разнообразна. И исходы отнюдь не столь однозначны. Даже в критической ситуации сердце так просто не сдается; чувство ответственности за нашу жизнь развито у миокарда неизмеримо лучше, чем наша ответная о нем забота.
И на обыденном уровне, и в специальной литературе постоянно обсуждаются случаи инфарктов, перенесенных «на ногах» и диагностированных ретроспективно, иногда через много лет, на случайной ЭКГ. Такое действительно случается, и нередко: согласно некоторым публикациям, до 35-40% инфарктов миокарда в остром периоде остаются неидентифицированными, и именно наличие омертвевшего, зарубцевавшегося и не функционирующего участка резко повышает риск повторного инфаркта, теперь уже «большого» и, увы, с большой вероятностью фатального. Изредка встречаются безболевые формы, несколько чаще – атипичные. В этом случае инфарктом имитируется клиника астматического приступа, желудочно-кишечных заболеваний (с тошной, рвотой, абдоминальным болевым синдромом и пр.), внезапного психического расстройства (с галлюцинациями и психомоторным возбуждением), острого нарушения мозгового кровообращения и т.д.
Однако опытные «сердечники» и их близкие хорошо знают, на что обратить внимание. Классическая схема развития инфаркта включает следующее:
- резкая загрудинная боль, чаще слева, не купируемая нитроглицерином и не отпускающая в течение получаса и более (важно, что Скорая должна быть вызвана значительно раньше, уже через 5-7 мин после того, как станет очевидным отсутствие эффекта!);
- бледность кожных покровов, потливость, тотальная слабость, головокружение;
- острая нехватка воздуха;
- аномальный (учащенный или редкий) пульс;
- мучительный апродуктивный кашель;
- ажитация (тревога), панический страх смерти;
- полуобморочное или обморочное состояние.
Следует еще раз повторить, что этот общий сценарий очень вариативен. Например, симптоматика может сравнительно плавно манифестировать и затем скачкообразно усугубляться по мере отмирания новых участков миокарда. При обширном многоочаговом инфаркте вероятен т.н. кардиогенный шок, исход которого летален в 90-95% случаев. А иногда не успевает появиться ни симптоматика, ни ее вариации: у абсолютно здорового, как казалось ему и окружающим, человека инфаркт может манифестировать первой и последней остановкой сердца.
Следует знать и помнить, что даже при более благоприятном развитии острая ишемия оставляет очень незначительный запас времени на то, чтобы сделать ее транзиторной: через 20-30 минут изменения в тканях уже необратимы. Кроме того, даже если сам инфаркт пережит более или менее удачно, его последствия и осложнения могут оказаться значительно тяжелее: тромбозы, инсульты, постинфарктный синдром, инвалидизирующая ХСС (хроническая сердечная недостаточность), госпитальная пневмония и мн.др., не говоря уже о серьезных тревожно-депрессивных и невротических (кардиофобических, ипохондрических и т.п.) расстройствах.
Диагностика
Врачебно-фельдшерский состав служб неотложной помощи видит инфаркты, к сожалению, часто. Протокол диагностики, в том числе дифференциальной, хорошо отработан и позволяет свести вероятность ошибки практически к нулю. Столь же быстро и четко осуществляется госпитализация больного. Диагностическим стандартом остается электрокардиограмма, а также ЭхоКГ (УЗИ сердца), биохимический анализ крови, а в более спокойном отдаленном периоде – коронарография, сцинтиграфия и т.п
Лечение
В свою очередь, протоколы реанимации, купирования острой симптоматики и дальнейшего ведения больных с инфарктом миокарда тщательно разработаны, подробно прописаны (с целью предусмотреть все мыслимые и немыслимые варианты развития ситуации) и подтверждены мировой кардиологической практикой. Тем не менее, они продолжают постоянно совершенствоваться и уточняться: любой инфаркт – это всегда опасно для жизни и непредсказуемо на всех последующих этапах.
Первоочередной задачей является, конечно, восстановление коронарного кровообращения и ритмичной сердечной деятельности. С этой целью проводится интенсивная тромболитическая терапия, по показаниям – дефибриляция, экстренное кардиохирургическое вмешательство (аортокоронарное шунтирование, ангиопластика, принудительное аортальное наполнение и т.д.). К задачам первой очереди относится также купирование интенсивного болевого синдрома и дыхательной недостаточности, а также нормализация АД и стабилизация психического статуса. В дальнейшем назначают антиагреганты, антикоагулянты, тромболитики, бета-адреноблокаторы, однако эти схемы очень индивидуальны и специальны (на всякий случай уточним, что речь о каком бы то ни было самолечении не идет вообще).
Для иллюстрации всех сложностей острого, непосредственно постинфарктного и реабилитационного периодов в англоязычной литературе часто употребляется оборот «the golden hour» – досл. «золотой час». Имеется в виду своеобразная ступенчатая тенденция в статистике летальности: критическими являются первый час, а затем, если больной его пережил, – первые сутки, первая неделя, месяц и год.
По этому поводу заметим, что в кардиологических отделениях, да и за их пределами, упорно бытуют рассказы о чудесных исцелениях. Дескать, сам рассказчик (или сосед по палате, «один знакомый» и т.д.) сразу после инфаркта отпихнул санитаров, подмигнул медсестрам, пружинисто и бодро вскочил на ноги, выкурил полпачки сигарет, выпил с врачом бутылочку коньяку, – эта сюжетная линия почему-то особенно любима народными сказителями, – да и поехал домой (варианты: пошел пешком из Петербурга в Москву; четырнадцать раз отжал штангу; побежал играть в футбол в больничном дворе; съел тазик плова, и т.п.).
Но не будем слишком строги; возможно, это одна из форм стихийной коллективной психологической защиты, и в этом качестве басни действительно могут быть полезны (не случайно существует такое психотерапевтическое направление, как сказкотерапия).
В действительности же 60-70% больных не удается довезти до медучреждения. При грамотном и квалифицированном оказании неотложной помощи – уже в стационаре умирает каждый пятый. Из пожилых людей, перенесших острый период инфаркта, каждый четвертый умирает в течение первого месяца. Примерно каждый десятый уже спасенный, казалось бы, пациент умирает от повторного инфаркта в течение первого года.
Эта статистика чудовищна. И какие здесь, спрашивается, могут быть сигареты с футболом, когда нужно ловить буквально каждое слово врача и думать лишь о том, чтобы не нарушить предписанный режим – сначала строго постельный, затем очень осторожный в пределах палаты, затем щадящий госпитальный, а затем – особый, индивидуально-расписанный, реабилитационно-профилактический на всю, как говорится, оставшуюся жизнь. Чтобы длилась она как можно дольше.
Увы, радостное предвкушение и нетерпеливое ожидание выписки зачастую отвлекает, не давая внимательно выслушать, запомнить, а лучше всего – в деталях записать все, что скажет кардиолог стационара, а затем и тот врач, кто будет наблюдать и сопровождать в дальнейшем. Однако повторим: знать и как можно четче понимать происходящее должен и сам больной, и ближайшее его окружение. Невнимательности инфаркт не прощает.