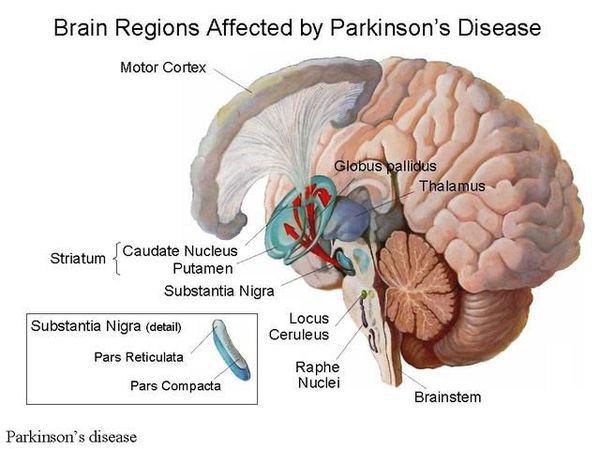
Невролог и приглашенный специалист Президентской клиники Матей Сковарнек о лечении болезни Паркинсона в Больнице Медицинского центра и пользе операций.
Матей Сковарнек – один из тех узких специалистов, которые весь фокус своей работы сосредотачивают на лечении пациентов с болезнью Паркинсона. В качестве приглашенного невролога он помогает врачам Президентской клиники выстроить слаженную командную работу. Под этим подразумевается, в первую очередь, умение правильно определить пациентов, которым рекомендована операция либо же строго противопоказана. О том, почему и как лечение при болезни Паркинсона может навредить, рассказывает сам специалист.

СПРАВКА: Доктор Сковарнек возглавляет департамент неврологии по двигательным расстройствам Университетской Больницы имени Луи Пастера, а также является доцентом кафедры неврологии факультета медицины Университета имени Сафарика в Словакии.

МАТЕЙ СКОВАРНЕК, НЕВРОЛОГ:
Паркинсон – это нейродегенеративное заболевание. У него есть классическая форма. Но вместе с этим, есть заболевания, которые включают симптомы паркинсонизма наряду с другими симптомами, которые мы не относим к болезни Паркинсона. И они, как раз таки, прогрессируют намного быстрее и не поддаются лечению.
На что мы обращаем внимание при классической форме болезни Паркинсона? На ранних стадиях пациент хорошо отвечает на лечение медикаментами. Мы можем даже не замечать, что у этого человека на самом деле есть болезнь. Но с прогрессией болезни, действие медикаментов ослабевает. В течение дня у таких пациентов начинают проявляться симптомы болезни, причем очень порывисто, с колебаниями: их двигательные способности то ухудшаются, то снова приходят в норму. Как правило, они не в силах больше планировать свой день, так как их состояние постоянно меняется. В таком случае, мы рекомендуем хирургическое лечение.
С помощью операции мы можем обеспечить постоянную стимуляцию головного мозга, благодаря чему опорно-двигательный аппарат пациента вновь становится стабильным. Это – главный результат операции.
Также, очень важно сделать операцию вовремя. Если затянуть, то у пациента может развиться сопротивляемость к фармакотерапии, а хирургия, в данном случае, может только ухудшить состояние. Оперативное лечение мы рекомендуем, когда пациент находится, скажем, на средней полосе: и не рано, и не поздно.
Сфера двигательных нарушений в этом плане очень специфична, потому что существует немало симптомов, которые очень похожи на болезнь Паркинсона. В связи с этим, немало пациентов, которым ставят неверный диагноз.
В случае с Паркинсоном, мировая статистика гласит: если диагноз установлен не экспертом в этой области, то вероятность ошибки постановки диагноза может достигать 40%. Каждый второй пациент на самом деле может и не иметь болезнь Паркинсона. Если же вы обратились к эксперту, то вероятность ошибки снижается до 10%. Поэтому у врача должна быть определенная компетенция, чтобы вести осмотр таких пациентов и ставить им диагноз.

Цель операции вылечить, а не навредить, потому здесь мы придерживаемся очень строгих принципов при отборе пациентов.

В Президентской клинике мы ведем прием пациентов совместно с командой нейрохирургов и неврологов, таким образом, мы обмениваемся опытом и делимся знаниями.
Дата публикации 14 ноября 2017Обновлено 2 февраля 2022
Определение болезни. Причины заболевания
Болезнь Паркинсона — это одно из самых распространенных нейродегенеративных заболеваний, поражающее преимущественно дофамин-продуцирующие (дофаминергические) нейроны в определенной области мозга, называемой чёрной субстанцией с накоплением в клетках белка альфа-синуклеина и особых внутриклеточных включений (телец Леви). Это заболевание — самая частая причина синдрома паркинсонизма (80% всех случаев). Распространенность болезни Паркинсона составляет около 140 (120-180) случаев на 100 000 населения.[1] Заболевание чаще всего проявляет себя после 50 лет, однако нередки случаи дебюта болезни и в более раннем возрасте (с 16 лет). Мужчины страдают немного чаще женщин.
Причина остается в значительной степени неизвестной. Предполагается, что на возникновение заболевания влияют генетические факторы, внешняя среда (возможное воздействие различных токсинов), процессы старения. Генетические факторы имеют доминирующее значение при раннем развитии болезни Паркинсона. Молодые пациенты с этим заболеванием и с семейной историей болезни с большей вероятностью переносят гены, связанные с болезнью Паркинсона, такие, как SNCA, PARK2, PINK1 и LRRK2. В одном из последних исследований показано, что 65% людей с ранним началом болезни Паркинсона в возрасте до 20 лет и 32% людей с началом от 20 до 30 лет имели генетическую мутацию, которая, как полагают, увеличивает риск развития болезни Паркинсона.[2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы болезни Паркинсона
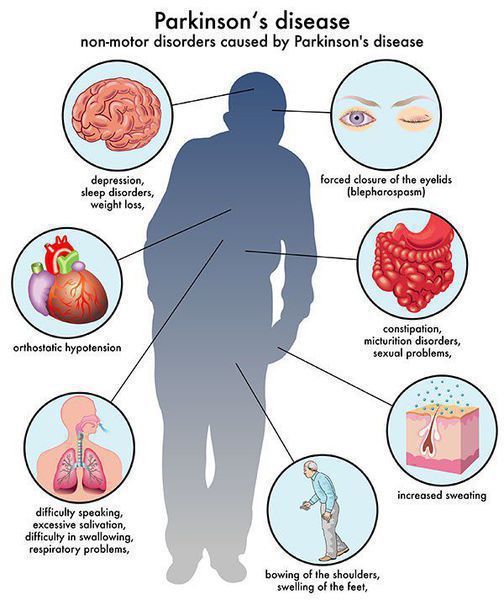
Многие симптомы болезни Паркинсона не связаны с движением. Немоторные («невидимые симптомы») болезни Паркинсона распространены и могут влиять на повседневную жизнь больше, чем более очевидные трудности с движением. Они могут включать:
- нарушение обоняния;
- расстройства сна;
- когнитивные симптомы (снижение памяти, легкомысленность);
- запор;
- расстройства мочеиспускания;
- повышенное потоотделение;
- сексуальную дисфункцию;
- усталость;
- боль (особенно в конечностях);
- покалывание;
- беспокойство и депрессию.[3]
В начале заболевания нередко ставится неверный диагноз — плечелопаточный периартрит, проявляющийся болью и напряжением в мышцах руки и спины.
Синдром паркинсонизма является основным клиническим проявлением болезни Паркинсона, его симптомы:[1]
- замедленность всех движений;
- истощаемость быстрых повторяющихся движений в руках и ногах;
- скованность мышц (мышечная ригидность);
- дрожание рук и ног (но почти никогда — головы), наиболее выражено в покое;
- неустойчивость при ходьбе;
- укорочение длины шага и шарканье при ходьбе, топтание на месте, застывания при ходьбе, отсутствие cодружественных движений руками при ходьбе.
Вначале симптомы возникают только с одной стороны тела, но постепенно приобретают двусторонний характер. Симптомы остаются выраженными на той стороне, где возникли в начале заболевания. Симптомы на другой стороне тела часто не становятся такими же тяжелыми, как симптомы на начальной стороне. Движения становятся все более замедленными (основной симптом паркинсонизма). Симптомы заболевания колеблются в течения дня и зависят от многих факторов.
Патогенез болезни Паркинсона
Болезнь Паркинсона относится к группе синуклеинопатий, так как избыточное накопление в нейронах альфа-синуклеина приводит к их гибели. Повышенный уровень альфа-синуклеина может быть следствием нарушения внутриклеточной системы клиренса белков, осуществляемого лизосомамии и протеосомами. У пациентов обнаружено нарушение функционирования указанной системы, среди причин которого указывают старение, окислительный стресс, действие воспаления, токсины окружающей среды. Клетки гибнут предположительно из-за активации генетически запрограмированного механизма (апоптоза).[4]
Классификация и стадии развития болезни Паркинсона
Болезнь Паркинсона классифицируется по форме, стадии и темпу прогрессирования заболевания.
В зависимости от преобладания в клинической картине того или иного симптома выделяют следующие формы:[1]
1. Смешанная (акинетико-ригидная-дрожательная) форма характеризуется наличием всех трёх основных симптомов в разном соотношении.
2. Акинетико-ригидная форма характеризуется выраженными признаками гипокинезии и ригидности, к которым обычно рано присоединяются нарушения ходьбы и постуральная неустойчивость, при этом тремор покоя отсутствует или выражен минимально.
3. Дрожательная форма характеризуется доминированием в клинической картине тремора покоя, признаки гипокинезии уходят на второй план.
Для характеристики стадий Болезни Паркинсона используется шкала Хен–Яра, 1967:
- на 1-й стадии акинезия, ригидность и тремор выявляются в конечностях с одной стороны (гемипаркинсонизм);
- на 2-й стадии симптоматика становится двусторонней;
- на 3-й стадии присоединяется постуральная неустойчивость, но сохраняется способность к самостоятельному передвижению;
- на 4-й стадии симптомы паркинсонизма резко ограничивают двигательную активность;
- на 5-й стадии в результате дальнейшего прогрессирования заболевания больной оказывается прикованным к постели.
Выделяют три варианта темпа прогрессирования заболевания:
- При быстром смена стадий заболевания от первой к третьей занимает 2 года или менее.
- При умеренном — от 2 до 5 лет.
- При медленном — более 5 лет.
Осложнения болезни Паркинсона
Болезнь Паркинсона — не смертельное заболевание. Человек умирает с ним, а не от него. Однако поскольку симптомы ухудшаются, они могут вызвать инциденты, которые приводят к смерти. Например, в сложных случаях затруднение глотания может привести к тому, что пациенты начнут аспирировать пищу в легкие, что приведет к пневмонии или другим легочным осложнениям. Потеря равновесия может привести к падению, которое, в свою очередь, может привести к серьезным травмам или смерти. Серьезность этих инцидентов во многом зависит от возраста пациента, общего состояния здоровья и стадии заболевания.
На более поздних стадиях заболевания проявляются более выраженные симптомы болезни Паркинсона: дискинезия (непроизвольные движения или подергивание частей тела, которые могут возникнуть в результате длительного использования леводопы, застывания (внезапное отсутствие возможности двигаться) или семенящая походка (короткие, почти бегущие шаги, которые как будто ускоряются сами по себе).
Следует помнить, что болезнь Паркинсона очень индивидуальна по своему течению и у каждого протекает по своему сценарию.
Диагностика болезни Паркинсона
Паркинсонизм относится к числу тех расстройств, которые можно диагностировать на расстоянии, особенно при развёрнутой картине заболевания. Однако диагностировать болезнь Паркинсона на ранней стадии сложно. Ранняя и точная диагностика заболевания очень важна для разработки лучших стратегий лечения и поддержания высокого качества жизни как можно дольше. В практике возможна недооценка или переоценка болезни Паркинсона. Невролог, специализирующийся на расстройствах движения сможет поставить наиболее точный диагноз. Первоначальная оценка проводится на основе анамнеза, неврологического обследования с использованием специальных тестов для оценки симптомов заболевания. Неврологическое обследование включает в себя оценку координации, ходьбы и мелких моторных задач, оценку нейропсихологического статуса.
Практика получения второго мнения в значительной степени зависит от личного выбора пациента. Но имейте в виду, что болезнь Паркинсона часто трудно диагностировать точно, особенно когда симптомы незначительно выражены. Простейшего диагностического теста нет, и примерно 25% диагнозов болезни Паркинсона неверны. Болезнь Паркинсона начинается с мало видимых симптомов, поэтому многие врачи, которые не обучены в сфере двигательных расстройств, не могут поставить точный диагноз. На самом деле даже лучшие неврологи могут ошибаться. Если врач не имеет особого опыта в этой области, то необходимо консультироваться со специалистом по расстройствам движения. Хороший невролог поймет ваше желание подтвердить диагноз. Второе мнение может помочь принять своевременно правильные решения относительно диагноза и терапии.
Лечение болезни Паркинсона
Несмотря на то, что излечения болезни Паркинсона не существует, есть множество методов, которые могут позволить вести полноценную и продуктивную жизнь на многие годы вперед. Многие симптомы могут облегчаться лекарствами, хотя со временем они могут утратить свою эффективность и вызвать нежелательные побочные эффекты (например, непроизвольные движения, известные как дискинезия).
Существует несколько методов лечения, замедляющих появление моторных симптомов и улучшающих двигательные функции. Все эти методы лечения предназначены для увеличения количества дофамина в головном мозге либо путем его замещения, либо продления эффекта дофамина путем ингибирования его распада. Исследования показали, что терапия на ранней стадии может задержать развитие двигательных симптомов, тем самым улучшая качество жизни.[5]
На характер и эффективность лечения влияет ряд факторов:
- выраженность функционального дефицита;
- возраст больного;
- когнитивные и другие немоторные нарушения;
- индивидуальная чувствительность к препаратам;
- фармакоэкономические соображения.
Задача терапии при болезни Паркинсона — восстановить нарушенные двигательные функции и поддержать оптимальную мобильность в течение максимально длительного периода времени, сведя к минимуму риск побочных действий препаратов.[1]
Существуют также хирургические вмешательства, такие, как глубокая стимуляция мозга, подразумевающая имплантацию электродов в мозг. Из-за рисков, присущих этому типу лечения, большинство пациентов исключают данный метод лечения до тех пор, пока лекарства, которые они принимают, больше не дают им значимого облегчения. Обычно этот метод лечения проводится у пациентов с длительностью заболевания от четырех лет, получающих эффект от лекарств, но имеющих моторные осложнения, такие, как: значительное «отключение» (периоды, когда лекарство плохо работает и симптомы возвращаются) и/или дискинезии (неконтролируемые, непроизвольные движения). Глубокая стимуляция мозга лучше всего работает в отношении таких симптомов, как: скованность, медлительность и тремор, не работает с целью коррекции устойчивости, застывания при ходьбе и немоторных симптомах. Данное лечение может даже усугубить проблемы с памятью, поэтому хирургия не рекомендуется для людей с когнитивными расстройствами.[6]
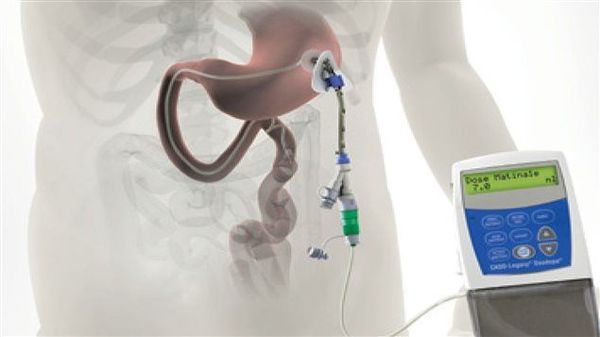
Различные новые способы введения леводопы открывают дополнительные возможности терапии. Сегодня используется интестинальный (кишечный) дуодопа-гель, который уменьшает ежедневные периоды «выключения» и дискинезию у пациентов с прогрессирующей болезнью Паркинсона благодаря постоянному неимпульсному режиму введения препарата.[7]
Исследуется альтернативный подход, использование допаминовых продуцирующих клеток, полученных из стволовых клеток. Хотя терапия стволовыми клетками имеет большой потенциал, требуется больше исследований, прежде чем такие клетки могут стать инструментом в лечении болезни Паркинсона.[8][9]
По мере прогрессирования болезни Паркинсона возможности хранения и буферизации дофамина в мозге становятся все более скомпрометированными, сужая терапевтическое окно для терапии и приводя к колебаниям двигательной системы человека. Апоморфин в виде помпы доставляет подкожную инфузию в течение дня для лечения флуктуаций (феномены «ON-OFF») у пациентов с болезнью Паркинсона, которые недостаточно контролируются пероральным антипаркинсоническими препаратами. Эта система используется постоянно, чтобы обеспечить мозг непрерывной стимуляцией.
При болезни Паркинсона очень полезна физическая нагрузка. Если дважды в неделю по 1–2 часа выполнять упражнения, то можно замедлить развитие заболевания: походка, осанка и когнитивные способности будут ухудшаться гораздо медленнее [12].
Прогноз. Профилактика
Болезнь Паркинсона уникальна для каждого человека, никто не может предсказать, какие симптомы появятся и когда именно. Существуют общее сходство картины прогрессирования болезни, но нет никакой гарантии, что то, что наблюдается у одного, будет у всех с аналогичным диагнозом. Некоторые люди оказываются в инвалидных колясках; другие все еще участвуют в марафонах. Некоторые не могут застегнуть ожерелье, в то время как другие делают ожерелья вручную.
Пациент может сделать всё, чтобы активно повлиять на течение болезни Паркинсона и, по крайней мере, на одну очень вескую причину: ухудшение симптомов часто значительно медленнее у тех, кто проявляет позитивную и активную позицию по отношению к своему состоянию, чем те, кто этого не делает. В первую очередь рекомендуется найти врача, которому доверит пациент, и который будет сотрудничать по развивающемуся плану лечения. Снижение стресса обязательно — стресс ухудшает каждый симптом болезни Паркинсона. Рекомендуются занятия образовательного направления: рисование, пение, чтение стихов, рукоделие, изучение языков, путешествия, работа в коллективе, занятия общественной деятельностью.
К сожалению, даже если адекватно подобрать медикаментозную терапию, это не гарантирует того, что клетки перестанут гибнуть при болезни Паркинсона. Терапия должна быть направлена на создание благоприятных условий для двигательной активности с учётом индивидуальных особенностей клинической картины заболевания. Как показывают результаты многочисленных исследований, профессиональная двигательная реабилитация является необходимым условием для замедления прогрессирования заболевания и улучшения его прогноза. На сегодняшний день по данным клинических исследований показана эффективность реабилитационной программы по протоколам LSVT LOUD, LSVT BIG, теоретическая основа которых сводится к развитию нейропластичности вещества мозга. Она направлена на коррекцию дрожания, ходьбы, постуры, равновесия, мышечного тонуса и речи.[10]
Реабилитационные методики должны быть направленные не только на поддержание сохранившихся двигательных способностей, но и выработку новых навыков, которые бы помогали человеку с болезнью Паркинсона преодолевать ограниченность его физических возможностей, чему способствует программа танцевально-двигательной терапии при болезни Паркинсона, работающая более чем в 100 сообществах по всему миру, включая Россию. Танцевальная терапия позволяет частично решить конкретные проблемы болезни Паркинсона: потеря равновесия, ухудшение координации, шаркающая походка, тремор, застывания, социальная изоляция, депрессия и повышенный уровень тревожности.
Согласно американскому исследованию с участием 52 больных болезнью Паркинсона, регулярная практика аргентинского танца уменьшает симптомы болезни, улучшает баланс и улучшает выполнение сложных движений при болезни Паркинсона.[11]
Алгоритм лечения ранних стадий болезни Паркинсона
Статьи
Профессор В.Л.Голубев,
зав. кафедрой неврологии ФУВ ММА им. И.М.Сеченова
В медицинской практике нередко встречаются ситуации, когда безуспешное лечение становится следствием неточной или ошибочной диагностики. Распознавание начальных стадий болезни Паркинсона часто осуществляется с большим трудом. Дебют этого заболевания всегда развивается субклинически и проходит немало времени (иногда – не один год), прежде чем ухудшающееся самочувствие заставит больного обраться к врачу. В настоящее время разработаны достаточно чёткие клинические критерии диагностики болезни Паркинсона. Они эффективно «работают» на развёрнутых стадиях заболевания и несомненно полезны для ранней диагностики, хотя в последнем случае их «разрешающая способность» не столь высока. Согласно этим диагностическим критериям, чтобы поставить диагноз болезни Паркинсона, нужно сделать три «шага»: распознать синдром паркинсонизма, исключить другие заболевания и найти симптомы, подтверждающие болезнь Паркинсона.
В целом современная концепция лечения болезни Паркинсона предполагает два стратегических подхода: поиск средств, способных замедлить, задержать или остановить её прогрессирование и создание новых более эффективных способов симптоматической терапии. Последний подход считается в настоящее время основным.
На ранних фазах заболевания врач ещё не видит у пациента тех серьёзных проблем, которые столь характерны для поздних стадий заболевания. Тем не менее уже на первых этапах болезни Паркинсона перед врачом неизбежно встаёт ряд задач, иногда весьма непростых и требующих корректного разрешения.
Поставив диагноз болезни Паркинсона, врач, прежде чем начинать лечение, обычно решает следующий круг вопросов:
- Когда следует начинать лечение и с каких лекарственных средств?
- Это должна быть монотерапия одним антипаркинсоническим препаратом или предпочтительнее сразу начинать комплексное лечение?
- Следует ли применять на самых ранних стадиях болезни дофаминергические средства?
- На каком этапе болезни прибегать к комбинации дофаминергических и недофаминергических препаратов?
- Какое место в схеме лечения должна занимать нефармакологическая терапия болезни Паркинсона?
- Какие проявления этой болезни требуют применения специальных средств симптоматического действия?
- Как преодолевать так называемые ранние побочные эффекты заместительной терапии болезни Паркинсона?
Впервые поставленный диагноз болезни Паркинсона не обязательно требует немедленного начала лекарственной терапии.
Первое обращение пациента за врачебной помощью чаще всего обусловлено непонятным для него ухудшением самочувствия, смутной тревогой за своё состояние здоровья и (или) ухудшением адаптации больного в повседневной бытовой и (или) профессиональной деятельности. Таким образом, пытаясь найти ответ на первый вопрос («когда следует начинать лечение?»), врач должен проанализировать целый ряд обстоятельств, от которых может зависеть ответ на этот вопрос.
К числу таких обстоятельств на всех стадиях заболевания, в том числе и при первом обращении пациента к врачу, относятся следующие факторы, каждый из которых может оказаться значимым для того или иного больного.
- Тяжесть заболевания (выраженность основных симптомов)
- Длительность заболевания и темп его прогрессирования
- Возраст больного
- Сопутствующие заболевания
- «Личная ситуация», которая включает характер профессиональной деятельности; семейное положение и микросоциальное окружение больного в семье, особенности его отношения к своей физической «несостоятельности», к врачу, установка на лекарственное лечение, его ожидания, особенности личности и актуальное психическое состояние
Совокупность перечисленных выше факторов (их можно сгруппировать в объективные и субъективные) позволяет максимально точно ответить на главный вопрос, важный для определения времени начала лечения: «Какова степень функциональных нарушений у данного больного?» или, иными словами, влияет ли она на его социальную адаптацию (профессиональную и повседневную активность). Эти субъективные и объективные факторы в своей совокупности и дают врачу основание для того, чтобы предложить больному лечебную помощь и приступить к лечению, предварительно обсудив её с пациентом.
Основные факторы, влияющие на оценку степени функциональных нарушений:
- Субъективные факторы (особенности личности больного, его самооценка, психологическая установка на то или иное лечение, наличие эмоционально-аффективных расстройств и их характер и пр.)
- Объективные факторы (выраженность основных двигательных симптомов).
Планируя стратегию лечения, врач имеет в своём арсенале потенциально разные варианты медикаментозной терапии, оперативное лечение, нелекарственные терапевтические подходы, социальную поддержку.
Принципы медикаментозной терапии болезни Паркинсона в значительной степени основаны на современных представлениях о функционировании дофаминергического синапса и патогенезе нейродегенеративных заболеваний. Эти принципы нацелены на использование средств, позволяющих: 1)увеличить синтез дофамина (ДА) в мозге; 2)стимулировать выброс ДА из пресинаптической терминали и блокировать его обратное поглощение пресинаптическими структурами; 3) задержать распад (катаболизм) ДА; 4) стимулировать постсинаптические ДА-рецепторы; 5) препятствовать прогрессирующей гибели нейронов и замедлить течение заболевания.
Начальная стадия заболевания сопровождается обычно слабо- или умеренно выраженными клиническими проявлениями, которые вполне можно успешно контролировать не леводопой, а менее сильнодействующими дофаминергическими средствами, не содержащими леводопу. В условиях России на выбор пациентом конкретных препаратов оказывает существенное влияние, помимо их наличия в аптечной сети, его социо-экономический статус (финансовые возможности больного). Достаточно высокая стоимость некоторых из них заставляет иногда учитывать и этот фактор.
К числу таких препаратов относятся: аматантадины (мидантан и ПК-Мерц), селективные ингибиторы МАО (юмекс, селегилин) и, конечно, агонисты дофаминовых (ДА) рецепторов, список которых продолжает пополняться всё новыми и новыми формами. Лечение начальных стадий заболевания указанными средствами возможно как в виде монотерапии (чаще), так и в виде различных комбинаций перечисленных препаратов (реже). Именно этот комплекс фармакологических средств рекомендуется для лечения начальных (I-II) стадий болезни Паркинсона. Целью терапии является восстановление нарушенных функций при минимальных эффективных дозах.
Лечение начальных (I-II по Hoehn и Yarh) стадий заболевания:
- Амантадины (Мидантан или ПК-Мерц)
- Селективные ингибиторы МАО-В (юмекс или его аналоги)
- ДА-агонисты (мирапекс, проноран и другие агонисты)
Что касается ингибиторов КОМТ (комтан, тасмар), то их эффективность на ранних стадиях болезни Паркинсона также показана в специальных исследованиях, но их применение на ранних этапах заболевания ещё не превратилось в традицию и нуждается в дальнейшем накоплении наблюдений.
Все перечисленные лекарственные средства несомненно уступают в своей эффективности дофасодержащим препаратам, но вполне подходят для лечения первых этапов заболевания. Если же их терапевтическую эффективность сравнивать не с леводопой, а между собой, то обнаруживается не столь разительная разница в их антипаркинсоническом действии. Тем не менее, большинство агонистов ДА-рецепторов пусть незначительно, но всё-таки эффективнее амантадинов и ингибиторов МАО, сохраняют дольше способность проявлять антипаркинсоническую активность по сравнению с леводопой и, что ещё важнее, обеспечивают несколько лучшие отдалённые перспективы для пациента. Изучение свойств ДА-агонистов теоретически позволяет предполагать наличие у них и некоторых других преимуществ. Поэтому они пользуются предпочтением у большинства исследователей. Однако практическому врачу не стоит слишком преувеличивать эти преимущества. Они действительно имеют место, но не столь выражены, как того хотелось бы, и, более того, клинически они не всегда заметны.
Некоторые преимущества ДА-агонистов по сравнению с другимиантипаркинсоническими препаратами:
- Возможность получения терапевтического эффекта без применения дофасодержащих препаратов (в том числе и на поздних стадиях)
- Более пролонгированный лечебный эффект (по сравнению с леводопой)
- Наличие нейропротекторных свойств:
- Антиапоптозное
- Антиэксайтотоксичное
- Антиоксидантное
Считается, что потенциально ДА-агонисты способны: на ранних стадиях — отсрочить назначение леводопы (!), на поздних стадиях — уменьшить дозу леводопы (!) На практике же удаётся иногда решить лишь первую задачу и очень редко – вторую. Справедливости ради следует признать, что и этого не так уж и мало.
Таким образом, если при первом визите больного врач видит очень слабо выраженные симптомы с минимальным снижением функциональных возможностей, то ДА-агонисты могут и не назначаться. Мидантан (или юмекс) будет вполне адекватным антипаркинсоническим препаратом, обладающим к тому же и нейропротективным действием. Если же клинические проявления таковы, что требуется более эффективный дофаминергический препарат, то более показанным будет ДА-агонист.
При ухудшении состояния (переход в III стадию), которое рано или поздно, но обязательно наступает независимо от характера лечения, рекомендуется увеличение дозы этих же препаратов, что обычно приводит к улучшению самочувствия, повышает адаптацию и качество жизни больного. И лишь при последующем ухудшении, которое, к сожалению, миновать никому не удаётся и которое характеризуется появлением постуральных расстройств (III-стадия), ставится вопрос о назначении дофасодержащего препарата.
Жёстких критериев, указывающих на оптимальное время начала лечения леводопой или дофасодержащими препаратами, не существует. Известен лишь принцип, согласно которому не следует торопиться с ранним назначением леводопы, как и не следует быстро форсировать её дозу, добиваясь по возможности отсрочки её применения. Полезно ориентироваться при этом и на возраст пациента. Если позволяет состояние больного, лучше не начинать лечение леводопой у лиц моложе 60-70 лет. У пожилых же пациентов с болезнью Паркинсона средством выбора при лечении даже начальных стадий заболевания являются дофасодержащие препараты (обычно мадопар или наком), к которым, в случае такой необходимости, добавляются ДА-агонисты, ингибиторы МАО, ингибиторы КОМТ и другие средства.
Лечение последующих этапов болезни:
- Увеличение дозы мидантана, юмекса и (или) ДА-агонистов.
- Назначение дофасодержащего препарата
Основные ориентиры в выборе дозы дофасодержащего препароата:
- Откликаемость пациента на предложенную (минимальную) дозу
- Улучшение показателей его адаптированности в быту и на работе
Как видно из таблицы, основным ориентиром в выборе дозы дофасодержащего препарата служит откликаемость больного на предложенную минимальную дозу мадопара (накома, дуэллина, сталево и т. д.), а также её переносимость. При выраженной клинической картине слишком низкая доза (например, четверть таблетки мадопара-250) может оказаться настолько недостаточной для данного пациента, что её эффект может остаться просто незамеченным как пациентом, так и врачом. Как правило, первая (стартовая) доза мадопара составляет 125 мг в день (одна капсула или половина таблетки мадопара-250). Иногда этой дозы вполне достаточно, чтобы удовлетворительно компенсировать больного или вернуть ему состояние более или менее приемлемой адаптации. Главный и вполне достаточный повод для любого увеличения дозы дофасодержащего препарата всегда заключается только в ухудшении адаптированности больного на работе и в быту.
Таким образом по мере прогрессирования заболевания арсенал используемых антипаркинсонических средств, как правило, расширяется и большинство больных получает комплексное лечение, которое заключается в той или иной комбинации вышеупомянутых препаратов. Все они не только хорошо сочетаются, но и потенцируют эффект друг друга. Правда при этом повышается стоимость такого лечения.
На ранних и, особенно на последующих этапах течения заболевания полезно учитывать также, какой из кардинальных симптомов паркинсонизма (акинезия, ригидность или тремор) является ведущим в клинической картине. Если составить таблицу, в которой напротив каждого из перечисленных симптомов расположить ряд антипаркинсонических препаратов, начиная с самого эффективного и кончая наименее действенным по отношению к нему, то такие ряды примут весьма характерный вид.
Основные симптомы паркинсонизма и сравнительная эффективность антипаркинсонических препаратов:
Акинезия: леводопа > ДА-агонисты > амантадины > холинолитики > юмекс
Ригидность: леводопа > ДА-агонисты > холинолитики > амантадины > юмекс
Тремор*: леводопа > холинолитики > ДА-агонисты > амантадины > юмекс
* Имеется в виду тремор покоя. По отношению к тремору действия (постуральному и кинетическому) более эффективным препаратом является обзидан. Последний обычно сочетается с другими вышеупомянутыми антипаркинсоническими средствами. В целом все антипаркинсонические препараты менее эффективны по отношению к тремору, чем к акинетико-ригидному синдрому. Тремор – особая проблема, требующая специального обсуждения.
Холинолитики (антихолинергические препараты) становятся менее популярными в лечении Болезни Паркинсона. Их побочные эффекты, ограниченная эффективность и целый ряд серьёзных противопоказаний, в том числе ятрогенное снижение когнитивных функций, делает их применение при болезни Паркинсона весьма ограниченным. Не рекомендуется их назначение у лиц старше 50-60 лет. Лишь у пациентов молодого возраста на ранних этапах заболевания при хорошей откликаемости и переносимости становится оправданным их применение.
Таким образом решение вопроса о сроках начала лечения, стартовой дозе препарата и последующего её титрования, включения в схему лечения других антипаркинсонических средств решается, как уже говорилось выше, строго индивидуально с учётом синдромальных особенностей паркинсонизма, возраста больного, характера его профессиональной деятельности и, что иногда очень важно, отношения самого пациента к своей физической несостоятельности, его психологической реакции на заболевание и действия врача. Описанная выше стратегия лечения ранних стадий болезни Паркинсона допускает, следовательно, возможность выбора в решении обсуждаемых вопросов, что и определяет принципиальную возможность индивидуального подхода к каждому конкретному пациенту, без чего невозможно эффективное лечение и сотрудничество с ним.
Что касается нефармакологического подхода к лечению (социальная поддержка и психотерапия; советы по режиму двигательной активности и профессиональной деятельности; характеру питания и т.д.), то оно уместно на всех стадиях этого заболевания, а некоторые из нефармакологических подходов могут применяться и на самых ранних его этапах. Важно разъяснить больному, что ему одинаково нежелательны как избыточная физическая активность, так и чрезмерное избегание её. Оптимальным будет для него сохранение на прежнем уровне того режима двигательной активности (впрочем как и психической), к которой он привык. Сохранение привычного темпа жизни и тех стереотипов, которые были ему свойственны до болезни, и стремление удержать свою активность на прежнем уровне – вот та стратегия, которой должен придерживаться пациент.
Нефармакологическое лечение:
- Социальная поддержка и психотерапия
- Диета
- ЛФК, массаж, физиотерапия
- Лекарственные каникулы
- Фототерапия
- Депривация сна
- Электросудорожная терапия
- Транскраниальная магнитная стимуляция
-
Физическая активность
- Хирургическое лечение
- Приспособления, улучшающие качество жизни
- Психотерапия
Здесь особенно важное значение придаётся рекомендациям по физической активности. На ранних стадиях заболевания применяются физические нагрузки, уровень которых может быть достаточно высоким и «предполагает преодоление внешних препятствий»:
- Ходьба через дверной проём
- Адаптированные занятия карате или другими видами бойцовских искусств
- Танцы (все формы)
- Игры с мячом
- Передвижение по пересечённой местности (в том числе на лыжах)
- Хорошо структурированная, «мягкая» аэробика.
На последующих этапах заболевания физическая нагрузка должна быть дозированной; здесь она уже «не предусматривает преодоления внешних препятствий и значительных усилий»:
- Обычная ходьба
- Ходьба на месте
- Тренажёры, обладающие низким сопротивлением
- Упражнения для стоп и подъём по ступенькам
- Имитация гребли на тренажёре
- Плавание
Основные двигательные симптомы, на которые нацелен тренинг, включают: ригидность, гипокинезию, нарушения походки, нарушения устойчивости и позы, подвижность в постели. Превентивно применяются также дыхательные упражнения (на поздних этапах болезни им свойственна гиповентиляция и пневмония становится опасной для них).
Используется и такие программы физической активности, которые требуют участия специально подготовленного методиста:
- Релаксирующие и мобилизирующие техники
- Групповые занятия
- Тренинг с мультисенсорным воздействием
- Реабилитация нарушений ходьбы (ходьба в толпе, через дверной проём, по разным поверхностям, медленная и быстрая ходьба, ходьба с разной длиной шага и т.д.)
- Упражнения, направленные на тренировку устойчивости
Функциональный тренинг, включающий манипуляции с окружающими предметами, ритмическая физическая нагрузка и т.д. уменьшают не только гипокинезию, ригидность и походку, но и достоверно снижают такие показатели как баллы в шкале UPRDS, улучшают когнитивные функции и настроение.
Широко используются различные приспособления, улучшающие качество жизни. Эти мероприятия в англоязычной литературе получили даже специальное название «модификации окружающей среды в целях безопасности и комфорта»
В некоторых случаях для больного становится особо актуальной симптоматическая терапия других (в том числе недвигательных) симптомов и синдромов. Имеются в виду депрессия, дизартрия, сиалорея, боли, запоры, нарушения поведения во время ночного сна и при пробуждениях, пароксизмы профузного гипергидроза и др. Некоторые из этих симптомов иногда выходят на передний план в клинической картине и становятся главными дезадаптирующими проявлениями, снижающими качество жизни.
Перечень отдельных симптомов и синдромов, которые могут потребовать дополнительного симптоматического лечения:
- Депрессия и (или) тревога
- Дизартрия и (или) дисфагия
- Сиалорея
- Тремор действия
- Болевой синдром
- Запоры
- Расстройства поведения, связанные с быстрым сном
- Пароксизмы профузного гипергидроза
- Дневная сонливость
- Инсомния
- Сонные апноэ
- Синдром беспокойных ног
- Симптомы периферической вегетативной недостаточности*, в том числе сексуальная дисфункция
- Постуральные нарушения и падения*
* Симптомы, которые чаще встречаются на последующих этапах болезни.
Лечение различных проявлений болезни Паркинсона может потребовать привлечения терапевта, психолога, психотерапевта, логопеда и врачей других специальностей. Их усилия могут способствовать более эффективному лечению, улучшению качества жизни и иногда — снижению дозы некоторых лекарственных антипаркинсонических средств.
Наконец, дополнительная фармакотерапия недофаминергическими средствами, включая препараты с нейропротекторными свойствами; антиглютаматные (NMDA-антагонисты) и антиапоптозные средства; антиоксиданты; средства, улучшающие метаболизм в мозге; нейротрофические факторы; иммуномодуляторы, проводится обычно регулярными повторными курсами как вспомогательная, но стратегически важная лекарственная терапия. И хотя многие представители этих фармакологических групп препаратов по своей эффективности оставляют желать лучшего, именно с ними связывают перспективы более успешной терапии болезни Паркинсона в будущем.
При лечении сопутствующих, в том числе соматических, заболеваний больному нежелательно назначение препаратов с нейролептическими свойствами и блокаторов кальциевых каналов.
Основные направления в выборе недофаминергических препаратов:
Нейропротекторная (помимо мидантана, юмекса и ДА-агонистов), общеукрепляющая (и симптоматическая) терапия:
- Антиглютаматные (антиэксайтотоксические) средства
- Средства, улучшающие метаболизм в мозге
- Антиоксиданты
- Другие (витамины С и Е, альфа-липоевая кислота и др.)
Ранние побочные эффекты дофаминергических средств (тошнота, рвота, анорексия, ортостатическая гипотензия, реже – другие симптомы) преодолеваются изменением (снижением) рекомендованной дозы, советами по диете, реже – сменой препарата или назначением дополнительных лекарственных препаратов. Как правило ранние побочные эффекты не столь трудны для коррекции, как поздние побочные эффекты, и в большинстве случаев удаётся адаптировать к ним пациента, не прибегая к отмене антипаркинсонического средства.
Наиболее часто встречающиеся побочные эффекты дофаминергических препаратов на ранних этапах лечения:
- Тошнота,
- Рвота
- Анорексия
- Ортостатическая гипотензия
- Инсомния
- Другие
Вопросы хирургического лечения болезни Паркинсона с применением конструктивных и деструктивных методов редко становятся актуальными на ранних её стадиях и чаще всего обсуждаются на более поздних этапах, когда фармакотерапия перестаёт справляться с возложенными на неё задачами и теряет свою эффективность.
Оценивая новые терапевтические подходы, всегда полезно помнить о незримом присутствии плацебо-эффекта, который реализуется, как недавно было показано, при участии тех же дофаминергических систем мозга и имеет место при всех заболеваниях, в том числе и при болезни Паркинсона. Эти больные нуждаются в адекватной психотерапии и социальной поддержке, организации специальных обществ и интернет-сайтов, которых уже достаточно много и где они могут получить ответы на свои вопросы.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Содержание:
- Болезнь Паркинсона.
- Причины развития болезни Паркинсона.
- Классификация стадий болезни Паркинсона.
- Явные и неявные симптомы.
- Профилактика болезни Паркинсона.
Болезнь Паркинсона
Болезнь Паркинсона — это дегенеративное заболевание головного мозга. Сопровождается симптомами нарушения двигательной функции (тремор, замедленность движений, потеря равновесия) и симптомами недвигательных нарушений (нарушения сна, психические расстройства, потеря памяти, снижение когнитивных функций).
Считается, что болезнь Паркинсона относится не к приводящим к сокращению длительности жизни заболеваниям, а к нарушениям, значительно ухудшающим качество жизни. И конечно же, страдающие от болезни Паркинсона нуждаются в наблюдении и уходе близких, так как двигательные нарушения могут мешать выполнять многие бытовые задачи, приводят к расстройствам речи и снижают коммуникативные способности человека.
Болезнь Паркинсона относится к заболеваниям определенного возраста. Несмотря на то что болезнь Паркинсона выявляется, как правило, у людей старше 50 лет, задумываться о профилактике такого типа заболеваний и снижении рисков следует еще в молодости. Ни одна болезнь не возникает из ниоткуда. Все развивается с течением времени. И болезнь Паркинсона не исключение. Прогрессирует это заболевание довольно медленно и может развиваться без явных симптомов от 10 до 20 лет. Основная причина развития болезни Паркинсона до сих пор не ясна, однако известно, что к факторам ее развития относятся генетические нарушения и токсическая нагрузка (пестициды, гербициды, загрязнение окружающей среды, токсины в продуктах питания, тяжелые металлы).
Знания нутрициологии позволят вам избежать многочисленных проблем со здоровьем и сделать свою жизнь и жизнь своих близких активной и полноценной. Приходите на тест-драйв курса «Интегративная нутрициология», чтобы познакомиться с экспертами и форматом обучения.
Интересный факт: 11 апреля — Всемирный день борьбы с болезнью Паркинсона. В этот день родился английский врач Джеймс Паркинсон, который в 1817 году впервые опубликовал описание этой болезни.
Причины развития болезни Паркинсона
Чем обусловлен запуск развития болезни Паркинсона? Во-первых, гибелью дофаминергических нейронов (клеток нервной системы), в основном в черной субстанции головного мозга, которая продуцирует нейротрансмиттер дофамин (гормон радости), гибель же дофаминергических нейронов приводит к его дефициту. Во-вторых, накопление белка α-синуклеина в головном мозге и формирование телец Леви (внутриклеточных включений). Потеря нейронов, дефицит дофамина и накопление патологических белков приводят к нарушению моторной функции, негативно влияют на сон, настроение, мышление, обучаемость — так развивается болезнь Паркинсона.
Образование телец Леви — основная причина когнитивных нарушений и развития деменции (потеря памяти) при болезни Паркинсона. Тельца Леви — нейрональные включения, состоящие из элементов белка α-синуклеина. Их формирование в отделах головного мозга — яркий маркер нейродегенеративных заболеваний. Хотя основной причины развития болезни Паркинсона еще не найдено, известен ряд факторов, запускающих этот процесс.
Генетика
Зачастую болезнь Паркинсона проявляется у нескольких родственников одного или нескольких поколений. Болезнь Паркинсона имеет мультифакторный характер, и один из них — генетические мутации. Выявлен ряд генов, мутации которых увеличивают риск развития паркинсонизма: SNCA, LRRK2, PRKN, DJ1, PINK1, ATP13A2. И проведение генетических исследований — самый эффективный способ увидеть возможные риски развития тех или иных заболеваний и заблаговременно заняться профилактикой.
Нейровоспаление
Нейровоспаление — воспаление головного или спинного мозга. Это приводит к активному выбросу воспалительных цитокинов и АФК (активных форм кислорода), в результате чего гибнут нейроны (клетки головного мозга) и развиваются нейродегенеративные заболевания, в частности болезнь Паркинсона.
Причины развития нейровоспалений:
- накопление тяжелых металлов;
- вирусная нагрузка;
- избыток лактата (молочной кислоты), гистамина, аммиака, желчных пигментов;
- постковид;
- нарушение микробиома кишечника.
Как восстановить баланс кишечной микрофлоры и улучшить здоровье нервной системы, рассказываем на бесплатном интенсиве «Биохимия микробиома».
Нервная ткань богата жирами, и это хорошая среда для накопления тяжелых металлов. К тяжелым металлам, накопление которых приводит к нейродегенеративным нарушениям, относятся ртуть, алюминий, мышьяк.
Сбой в работе печени и желчного пузыря нарушает работу системы детоксикации и приводит к накоплению нейротоксинов — токсичного непрямого билирубина, аммиака и лактата.
Печень — основной орган детоксикации. Именно в ней происходит обезвреживание токсинов во время второй фазы детоксикации. По ряду причин функции печени могут снижаться, и работа системы детоксикации ослабевает. Это может происходить при частом употреблении алкоголя, фруктов, сахара, бесконтрольном приеме лекарственных препаратов, при ожирении.
По ряду симптомов можно предположить, что печень работает с нарушениями:
- желтоватый оттенок лица;
- тошнота, изжога, отрыжка, рвота, запоры и вздутия;
- ПМС;
- сыпь на коже, пигментация, красные родинки на теле;
- перепады настроения;
- зуд кожи;
- неприятный запах изо рта и запах пота.
Одна из функций печени — обезвреживание и выведение непрямого билирубина. Накопление и откладывание токсичного непрямого билирубина в клетках мозга в результате снижения функций печени приводит к ряду последствий:
- разрушению миелиновой оболочки нервов;
- нарушению синтеза белков, в частности ферментов и нейромедиаторов, таких как дофамин;
- выбросу воспалительных цитокинов, приводящих к нейровоспалению.
Аммиак — конечный продукт белкового обмена, мощный нейротоксин. И печень непосредственно участвует в белковом обмене.
Печень синтезирует белки из аминокислот, поступающих с пищей. В процессе преобразования белка образуется токсичное вещество — аммиак, который преобразуется в мочевину и выводится из организма. Если печень на этом этапе не справляется, аммиак накапливается и становится одним из факторов, усиливающих нейровоспаление, что в дальнейшем приводит к развитию болезни Паркинсона и других нейродегенеративных заболеваний.
Симптомы избытка аммиака:
- туман в голове;
- хроническая усталость;
- отеки;
- синяки вокруг глаз;
- отвращение к белковой пище;
- фруктовый запах изо рта;
- химический запах пота, мочи, кала;
- трудность в обучении и усвоении информации.
Гипераммониемия может приводить и к накоплению лактата (молочная кислота, известная многим спортсменам, ведь именно из-за накопления лактата после тренировок болят мышц, происходит окислительная реакция в мышечной ткани). При повышении уровня аммиака организм находится в состоянии гипоксии (дефицит кислорода), нехватке энергии, поэтому глюкоза преобразуется по анаэробному (бескислородному) пути, в результате чего накапливается лактат. И это еще больше угнетает работу печени.
Нарушение обмена жиров тоже приводит к возникновению нейровоспаления. Происходит это по двум основным причинам:
- Нарушения в работе ЖКТ — застой желчи, нарушение работы печени и поджелудочной железы.
- Нарушение окисления жирных кислот.
Для того чтобы жирные кислоты могли попасть в клетку, им необходимы лизин, карнитин и ацилкарнитин. Эти вещества формируют карнитиновый челнок, при помощи которого жиры и попадают в клетку. При дефиците или избытке этих веществ нарушается система доставки жирных кислот в клетку, она страдает от дефицита энергии, в частности нейронов (клетки нервной системы).
Эти симптомы — повод задуматься о нарушении обмена жиров:
- трещины на пятках и сухие локти;
- выпадение волос и ломкость ногтей;
- сбой менструального цикла и низкое либидо (половое влечение);
- запоры или жирный стул;
- сухость глаз.
Избыток гистамина
Гистамин — стимулирующий нейротрансмиттер. При его избытке появляются головные боли, нарушается сон, нервная система перевозбуждается. При повышении уровня гистамина снижается активность микроглии. Клетки микроглии захватывают и уничтожают продукты распада нервной системы и чужеродные клетки, тем самым защищая нервную систему. При снижении активности микроглии восстановление нейронов ухудшается и нейровоспаление усиливается.
Уровень гистамина повышается по следующим причинам:
- стресс (повышает проницаемость клеточной мембраны);
- дефицит цинка, меди, витамина С и В6 (необходимы для работы фермента ДАО, расщепляющего гистамин);
- употребление продуктов, которые организм не переносит;
- СИБР (синдром избыточного бактериального роста) в кишечнике (избыток патогенной микрофлоры приводит к тому, что аминокислоты тирамин и гистидин преобразуются в гистамин).
Нарушение детоксикации головного мозга
В нашем организме есть особая система очищения — лимфатическая. Она собирает продукты метаболизма, чужеродные клетки и выводит их. Но у мозга есть и своя, дополнительная система очистки — глимфатическая система.
Глимфатическая система — это сеть сосудов, очищающих центральную нервную систему от токсинов. Работает эта система эффективно только при условии полноценного сна. Во время сна нервные клетки уменьшаются в объеме, протоки между нервными клетками расширяются, и это позволяет удалять токсичные отходы из мозга.
Лимфатическая система тоже очищает головной мозг. В частности, она принимает жидкость и продукты обмена из глимфатической системы и выводит их по лимфатическим сосудам слизистой носа в шейные лимфоузлы. Для того чтобы этот процесс работал без нарушений, важно поддерживать здоровье лор-органов (носа, гортани) и не допускать отека в области шейных лимфоузлов.
Подробнее о том, как поддерживать здоровье нервной системы, узнаете на бесплатном интенсиве «Биохимия нервной системы».
Классификация стадий болезни Паркинсона
В 1967 году Маргарет Хён и Мелвин Яр опубликовали первую классификацию стадий болезни Паркинсона. Позже она была модифицирована. Сегодня шкала стадий паркинсонизма выглядит так:
- стадия 0 — никаких признаков заболевания нет;
- стадия 1 — можно предположить развитие заболевания по симптомам на одной из рук или ног;
- стадия 1,5 — заболевание проявляет себя на одной из рук или ног и туловище;
- стадия 2 — заболевание проявляет себя на конечностях обеих сторон;
- стадия 2,5 — проявления с двух сторон с постуральной неустойчивостью. Больной способен преодолевать инерцию движения, вызванную толчком;
- стадия 3 — проявления с двух сторон. Постуральная неустойчивость. Больной может себя обслуживать;
- стадия 4 — обездвиженность. Больному требуется помощь. При этом он способен ходить или стоять без поддержки;
- стадия 5 — больной прикован к креслу или кровати.
Развиваться болезнь Паркинсона может быстрым темпом, медленным или умеренным:
- при быстром темпе смена стадий заболевания происходит в течение 2 лет и менее;
- при умеренном темпе смена стадий происходит за 2–5 лет;
- при медленном темпе — более чем за 5 лет.
Явные и неявные симптомы
К явным симптомам относятся:
- Тремор (дрожание) — один из самых известных и очевидных симптомов паркинсонизма. Вначале может проявляться только в одной руке или ноге, в дальнейшем становится двусторонним. Тремор всегда хорошо заметен, например, меняется почерк человека, написание букв становится корявым из-за дрожания руки.
- Гипокинезия (малоподвижность) — затрудняет весь процесс движения, от его планирования до осуществления самого движения. При гипокинезии затруднено и синхронное выполнение движений, например одновременное поднятие рук или выполнение какого-либо другого движения обеими руками одновременно.
- Брадикинезия (замедленность движений) — снижается трудоспособность человека, симптом проявляется в обычных бытовых делах. Замедляется процесс письма, с трудом дается шитье, завязывание шнурков и застегивание пуговиц. При брадикинезии усложняется выполнение ежедневных задач.
- Ригидность (тугоподвижность) — это жесткость при движении конечностей, которая может сопровождаться болью в суставах. При паркинсонизме усиливается мышечный тонус, сокращение мышц становится чрезмерным, поэтому любое движение становится более резким и затрудненным, теряется мягкость и плавность движений.
- Постуральная неустойчивость приводит к нарушению равновесия и падению человека. Это проявление болезни Паркинсона опасно тем, что падение может привести к травме человека. Количество падений коррелирует со степенью тяжести течения болезни.
- Поза просителя — самый яркий симптом паркинсонизма. Из-за повышения ригидности мышц формируется характерная поза, при которой появляется сутулость, голова наклоняется вперед, руки и ноги полусогнуты.
- Семенящая походка при согнутой позе просителя. Шаги становятся быстрыми, мелкими и шаркающими.
К неявным симптомам относятся:
- Потеря обоняния. Это происходит на первой стадии развития болезни в силу дегенеративных изменений в обонятельной луковице.
- Нарушения сна. Обычно проявляются на второй стадии развития болезни и связаны с поражением ядер ствола мозга.
- Психические расстройства (беспокойство, депрессия) и снижение когнитивных функций обычно проявляются на третьей и четвертой стадии развития болезни Паркинсона и связаны с тем, что на этих этапах происходит поражение лимбических структур, отвечающих за наши эмоции, и коры больших полушарий головного мозга, отвечающих за мышление, управление трудовой деятельностью и т. д.
- Запор. Возникает из-за нарушения тонуса и моторики кишечника, спазма диафрагмы и снижения двигательной активности.
Неявные признаки появляются в продромальную стадию развития болезни. Продромальная стадия — период начала болезни, еще до того, как появятся клинические симптомы заболевания. Клинические симптомы болезни Паркинсона — симптомы нарушения двигательных функций, а вот такие симптомы, как нарушение обоняния, сна, запоры, снижение когнитивных функций, беспокойство и депрессия, появляются в самом начале, и их неспецифичность затрудняет диагностирование болезни на ранних этапах.
Предположить развивающуюся болезнь Паркинсона по явным (моторным) симптомам может даже человек без медицинского образования, но постановкой диагноза занимается врач-невролог. Для того чтобы диагностировать паркинсонизм, прибегают к визуальному осмотру, функциональной диагностике, назначению лабораторных анализов, к применению специального препарата, устраняющего симптомы болезни Паркинсона (облегчение двигательных нарушений, как правило, подтверждает диагноз).

Профилактика болезни Паркинсона
Здоровый сон
Не пренебрегайте полноценным сном. Во время сна работа глимфатической системы головного мозга увеличивается на 90% и защищает от развития нейродегенеративных заболеваний, таких как болезнь Паркинсона. Здоровый сон должен соответствовать циркадным ритмам (отход ко сну до 22:00–23:00 и подъем в 06:00–07:00). За это время мы можем пройти 5–6 полноценных циклов сна, когда фазы быстрого сна сменяются фазами глубокого.
Как обеспечить качественный и глубокий сон:
- за 30 минут до сна проветривайте комнату;
- поддерживайте температуру в комнате на уровне 18–19 °С;
- пользуйтесь шторами блэкаут и берушами при необходимости;
- вечером убирайте телефоны и ноутбуки подальше. Если работа не позволяет убрать гаджеты совсем, переводите режим экрана на желтый свет, чтобы не нарушать выработку мелатонина (гормон сна);
- настраивайтесь на сон при помощи расслабляющих привычек (ванна с магниевой солью, чашка травяного чая, йога или легкая растяжка);
используйте удобные приложения для медитаций. Например, в приложении Meditopia большой выбор расслабляющих звуков, медитаций и программ, настраивающих на глубокий сон.
Если во время сна у вас или у ваших близких возникают приступы апноэ (кратковременная остановка дыхания), используйте ротовой аппликатор. Он может расширить дыхательные пути и препятствует западанию языка. Ночное апноэ можно диагностировать, если есть храп, дыхание через рот, кратковременная остановка дыхания, головные боли по утрам, сонливость в дневное время, раздражительность, быстрая утомляемость и проблемы в когнитивной сфере (память, мышление, внимание).
Еще больше ценной информации о циклах сна — в гайде «Нормализация сна».
Поддержка лимфодренажа всего тела
Сон важен для работы глимфатической системы, но и лимфатическая система всего тела участвует в детоксикации головного мозга. Поэтому поддержка общего лимфодренажа очень важна для профилактики болезни Паркинсона.
Для лимфодренажа всего тела можно выполнять ряд процедур:
- промывание носа физраствором или морской водой для обеспечения лимфотока по сосудам слизистой носа в шейные лимфоузлы;
- один раз в полгода проходить курс общего массажа для исключения застоев лимфы в разных частях тела;
- пить достаточное количество жидкости из расчета 30–40 мл на 1 кг веса;
- посещение сауны или бани;
- регулярно двигаться. Лимфа по системе лимфатических сосудов перемещается только за счет движения тела и работы мышц. Поэтому следует начать с регулярной ходьбы, утренней зарядки, плавания в бассейне, занятий танцами и т. д. Главное условие — как можно больше двигаться.
В гайде «Лимфодренаж» вы найдете еще больше инструментов для работы с лимфатической системой организма.
Исключение источников тяжелых металлов из жизни и их мягкое выведение из организма
Как минимизировать нагрузку из-за тяжелых металлов:
- сократите употребление рыбы крупных пород (акула, рыба-меч, тунец);
- по возможности замените амальгамные пломбы на пломбы из современных и более экологичных материалов;
- фильтруйте воду перед употреблением;
- крупы, бобовые и зелень замачивайте перед употреблением;
- устраните дефицит магния, цинка, кальция и железа. Дефицит этих минералов приводит к большему накоплению тяжелых металлов;
- не используйте бесконтрольно антацидные препараты (снижающие кислотность желудочного сока). В их составе есть алюминий;
- не готовьте еду в фольге и в посуде с антипригарным покрытием;
- замените дезодоранты, в составе которых есть алюминий, на более экологичные аналоги.
Поддержка работы системы детоксикации
Печень — главный орган детоксикации, и от ее работы напрямую зависит выведение токсинов из организма. Чтобы снизить риски развития болезни Паркинсона, следуйте этим правилам:
- поддерживайте питьевой баланс из расчета 30–40 мл на 1 кг веса;
- включите в рацион продукты, богатые аргинином (тыквенные семечки, фисташки, кедровые орешки, кешью, миндаль и грецкие орехи) и орнитином (цветочная пыльца, маточное молочко);
- включите в рацион продукты-гепатопротекторы (авокадо, расторопша, ламинария, яблоко, свекла, грецкие орехи, крестоцветные овощи);
- для эффективного обезвреживания лактата включите в рацион продукты, содержащие аланин (яйца, спирулина, форель, сельдь, скумбрия, устрицы, икра, говядина);
- исключите из рациона продукты, богатые гистамином (колбасы, ветчина, мясные консервы, консервированная рыба, все виды сыров, алкоголь).
Источники:
- https://www.who.int/ru/news-room/fact-sheets/detail/parkinson-disease
- https://cyberleninka.ru/article/n/simptomy-i-lechenie-bolezni-parkinsona/viewer
- https://cyberleninka.ru/article/n/nemotornye-simptomy-bolezni-parkinsona-1/viewer
- https://cyberleninka.ru/article/n/nemotornye-simptomy-bolezni-parkinsona-podvodnaya-chast-aysberga/viewer
- https://cyberleninka.ru/article/n/bolezn-parkinsona/viewer
- https://ru.wikipedia.org/wiki/
- https://cyberleninka.ru/article/n/alfa-sinuklein-kak-biomarker-bolezni-parkinsona/viewer
- https://www.msdmanuals.com/ru-ru/
Болезнь Паркинсона (PD) стала вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера (AD) и, по оценкам специалистов , встречается примерно у 1% населения старше 60 лет и у 4% людей старше 80 лет. Основными патологическими изменениями у пациентов с болезнью Паркинсона являются прогрессирующая дегенерация дофаминергических нейронов в черной субстанции и накопление интранейрональных включений α-синуклеина, которые называются тельцами Леви. Клинически, PD в основном проявляется в виде двигательных симптомов, таких как брадикинезия, тремор в покое, мышечная ригидность и постуральная нестабильность. Болезнь Паркинсона также коррелирует с «немоторными симптомами», включая нарушения обоняния , проблемы со сном, запоры, депрессию, из-за потери нейронов в некоторых других областях мозга, которые могут наблюдаться до или после потери дофаминергических нейронов.
Болезнь Паркинсона имеет много общих клинических признаков с некоторыми другими нейродегенеративными заболеваниями, в том числе множественную системную атрофию синуклеинопатий (MSA), прогрессирующий надъядерный паралич (PSP), деменцию с тельцами Леви (DLB), кортикобазальную дегенерацию (CBD) и т. д. Сообщалось, что на ранней стадии болезни Паркинсона частота ошибочного диагноза может достигать 25%.
Болезнь Паркинсона представляет собой сложное и прогрессирующее нейродегенеративное заболевание, течение развития которого можно разделить на три этапа: доклиническую стадию , когда уже начались нейродегенеративные процессы, но без явных симптомов; продромальную стадию , в которой присутствуют симптомы, но они еще недостаточны для диагностики этого заболевания; и клиническую стадию, когда диагноз основывается на наличии классических двигательных дисфункций.
Моторные симптомы брадикинезии, тремора в покое и ригидности мышц можно рассматривать как наиболее значимый и прямой диагностический маркер болезни Паркинсона. В то же время, эти двигательные функции также могут быть использованы для мониторинга реакции на лечение и оценки прогрессирования заболевания PD. Для ранней диагностики заболевания имеют значения многие немоторные особенности, включая гипосмию, расстройство сна во время быстрых движений глаз (REM) и запор, последние часто наблюдаются за несколько лет до появления двигательных симптомов.
Аносмия
Еще в 1975 году Ансари и Джонсон обнаружили связь между обонятельной дисфункцией и возникновением болезни Паркинсона (Ansari and Johnson, 1975 ). Впоследствии во многих исследованиях сообщалось, что примерно 75% пациентов с Болезнью Паркинсона имеют повышенный порог обнаружения запаха, и до 90% из них страдают от дефицита идентификации запаха. Многие исследования также показали, что обонятельная дисфункция у «бессимптомных» по отношению к болезни Паркинсона родственников первой степени родства связана с повышенным риском развития этого нейродегенеративного расстройства. С учетом современных достижений в области методов анализа патологии и визуализации головного мозга было выявлено, что нейродегенеративные изменения, в том числе наличие аномальных цитоплазматических белковых включений (тельца Леви), обычно наблюдаются в областях мозга, ответственных за обоняние, таких как обонятельная луковица, гиппокамп, миндалина и орбитофронтальная кора. Согласно теории Браака патологические процессы прогрессирования при болезни Альцгеймера делятся на шесть стадий. Эта теория предложила восходящий путь в патологии головного мозга, начиная с обонятельной луковицы и моторного ядра X дорсального ядра, затем достигая нижнего ствола мозга и, в конечном итоге, распространяясь на кору головного мозга (Braak et al., 2003 ; Goedert и др., 2013 ). Следовательно, обонятельная дисфункция может быть признана ранним диагностическим маркером болезни Паркинсона. В настоящее время UPSIT и Sniffin’s Sticks являются наиболее широко используемым инструментом для проверки обонятельной идентификации. Кроме того, также сообщается, что гипосмия связана с нарушением памяти, а гипосмия является значимым клиническим маркером когнитивной дисфункции при болезни Паркинсона.
RBD
RBD — это парасомния, вызывающая REM-сон, характеризующийся возникновением атипичных двигательных или когнитивных явлений во время REM-сна из-за сокращения атонии нормальной скелетной мышцы, что приводит к аномальному поведению в ночное время, таким как удары руками, ногами, бесспокойство и вокализация, нанесение себе травм или травм партнерам по постели. . До настоящего времени, RBD была самой распространенной и лучше всего характеризованной парасомнией при PD с приблизительной распространенностью между 30% и 60%. Вероятно, эта парасомния отражает потерю нейронов и α-синуклеиновую дегенерацию ядра ствола мозга, поэтому пораженная RBD область мозга находится во второй фазе гипотезы Браака. RBD коррелирует с нейродегенеративными заболеваниями, особенно с α-синуклеинопатиями, включая PD, MSA и DLB и так далее. RBD может предшествовать клиническим симптомам этих заболеваний на несколько лет, и уровень риска появления этих заболеваний составляет при этом от 30% до 91% после постановки диагноза RBD.
Болезнь Паркинсона является одним из распространенных прогрессирующих нейродегенеративных расстройств с несколькими нарушениями со стороны двигательной сферы и психическими расстройствами. Большинство моторных симптомов появляются на поздней стадии, когда большинство дофаминергических нейронов уже повреждено. Необходимы точные биомаркеры для ранней диагностики болезни Паркинсона , включая продромальную и доклиническую . В то же время, эти биомаркеры также могут быть использованы для мониторинга течения заболевания и оценки эффективности его лечения. Сочетание мультимодальных биомаркеров значительно повышает точность диагностики и облегчает внедрение персонализированного подхода к терапии болезни Паркинсона. Кроме того, наличие RBD тесно связана с деменцией. Таким образом, RBD может быть потенциальным биологическим биомаркером для развития симптомов PD , и , в частности , ее переходу в деменцию. RBD может быть подходящим клиническим биомаркером для диагностики продромального этапа PD, особенно , в сочетании с другими биомаркерами; а полисомнография (PSG) является золотым стандартом для диагностики RBD.
Запор
α-синуклеиновая дегенерация вегетативной нервной системы при болезни Паркинсона также включает в себя денервацию мицеллярного сплетения симпатической иннервацуии толстой кишки. Таким образом, запор является наиболее распространенным симптомом вегетативной дисфункции у пациентов с болезнью Паркинсона . Римские критерии — это международно признанный набор объективных признаков , которые используются для определения функциональных запоров. Основное внимание уделяется шести признакам: твердый и сухой стул, напряжение, неполная эвакуация, ощущение аноректальной обструкции или закупорки, два или менее испражнения (BM) в неделю и различные маневры ( приемы) для обеспечения эвакуации. Ранние неврологические изменения при болезни Паркинсона присутствуют в кишечной вегетативной нервной системе, особенно в дорсальном ядре блуждающего нерва. Одно ретроспективное исследование также сообщило, что присутствие α-синуклеина в материале при биопсии толстой кишки может показать за несколько лет (до появления двигательных симптомов) развитие болезни Паркинсона. Кроме того, у пациентов с болезнью Паркинсона также есть несколько других «немоторных симптомов», включая депрессию, симптоматическую гипотензию и сексуальную дисфункцию.
Биохимические маркеры
Как мы знаем, биохимические биомаркеры могут быть исследованы как в жидкостях организма, так и в тканях. Несколько потенциальных биохимических биомаркеров болезни Паркинсона уже были обнаружены в крови, слюне, спинномозговой жидкости (CSF) и биопсиях. . Но на данный момент комбинация нескольких биомаркеров может иметь решающее значение для достижения высокой чувствительности и специфичности диагностики PD.
Ураты
Ураты, образующиеся в печени и тонкой кишке, играют важную антиоксидантную роль, удаляя синглетный кислород, гидроксильные радикалы, гидроксипероксид и пероксинитрит. Ослабление антиоксидантных способностей может сделать клетки тканей организма более уязвимыми для свободных радикалов. Считается, что антиоксидантная защита уратов особенно важна для предотвращения окислительного повреждения мозга человека. Окислительный стресс может быть одной из причин потери и дегенерации дофаминергических нейронов в черной субстанции при болезни Паркинсона. in vitro ураты способны предотвратить самопроизвольную дегенерацию культивируемых нейронов черного вещества в моделях PD, а также гибель дофаминергических нейронов, вызванную окислительными и митохондриальными токсинами. Между тем in vivo на моделях мышей с PD повышенные концентрации урата в центральной нервной системе (ЦНС) приводят к улучшению фенотипа и гистопатологических данных. В двух клинических испытаниях, антиоксидантной терапии депренилом и токоферолом при паркинсонизме (DATATOP) и в исследовании Parkinson Research CEP-1347 (PRECEPT), исследователи предположили, что более высокий уровень сывороточного урата тесно связан с более медленной скоростью прогрессирования заболевания. Концентрация урата в CSF, которая составляет около 10% от концентрации периферической крови, зависит от концентрации урата в периферической крови и целостности гематоэнцефалического барьера. Кроме того, исследование DATATOP также показало, что у пациентов с когнитивной дисфункцией концентрация урата, очевидно, ниже по сравнению с пациентами с PD без когнитивной дисфункции.
Белок DJ-1
Белок DJ-1 является повсеместно распространенным многофункциональным белком, который участвует во многих клеточных метаболических процессах, включая нейропротекторную роль в окислительном стрессе во время нейродегенерации, связывание РНК, шаперон, протеазу и регуляцию митохондрий. Ослабление функции DJ-1 может привести к возникновению заболеваний, связанных с окислительным стрессом, таких как болезнь Паркинсона. Таким образом, мутации в гене DJ-1 PARK7 связаны с наследственным рецессивным вариантом болезни Паркинсона. Несколько исследований показали, что уровни DJ-1 повышены в CSF или плазме пациентов с PD по сравнению с контрольной группой. Кроме того, обширные эксперименты показали, что остаток цистеина в положении 106 (Cys-106) предпочтительно окисляется, когда он подвергается окислительному стрессу. Антиоксидантное действие Cys-106 определяет функции DJ-1. Более того, уровни окисления DJ-1 у Cys-106 в эритроцитах нелеченных пациентов с болезнью Паркинсона заметно повышены по сравнению с пациентами, получающими лекарственные препараты, и контрольными пациентами без PD. Таким образом, окислительный ответ Cys-106 играет важную роль в патогенезе PD.
Исследователи также показали, что уровень DJ-1 в крови, модифицированной 4-гидрокси-2-ноненалом (4-HNE), значительно снижается у пациентов с поздней стадией болезни Паркинсона и может быть полезным биомаркером.
Коэнзим Q10
Коэнзим Q10 (CoQ10) является антиоксидантом, который облегчает функцию митохондриальной цепи переноса электронов. Как липофильный антиоксидант, CoQ10 способен предотвращать нейродегенерацию в условиях дефицита митохондрий. Как мы знаем, убихинол-10 (восстановленная форма коэнзима Q10, CoQH2-10) окисляется в убихинон-10 (окисленная форма кофермента Q10, CoQ-10) на ранней стадии окисления в плазме человека, поэтому процентное содержание окисленной формы в общем коэнзиме Q10 (% CoQ-10) будет полезным биомаркером окислительного стресса. Предполагается, что уровни CoQ10 и % CoQ-10 могут использоваться в качестве биомаркеров в диагностике болезни Паркинсона . Кроме того, добавление CoQ10 может быть перспективным средством профилактики и лечения этого нейродегенеративного расстройства.
Гомоцистеин
Гомоцистеин (Hcy) — это природная аминокислота, вырабатываемая в процессе метилирования организма. Хорошо известно, что гипергомоцистеинемия сегодня стала важным фактором риска развития цереброваскулярных заболеваний среди населения в целом. С другой стороны, токсические эффекты Hcy на дофаминергические нейроны были подтверждены в экспериментах in vitro и in vivo. Гипергомоцистеинемия нейротоксична для черной субстанции, повреждая нейронную ДНК и стимулируя рецепторы NMDA, тем самым , способствуя ускоренной гибели дофаминергических нейронов. Кроме того, повышенные уровни Hcy приводят к обострению окислительного стресса в дофаминергических нейронах, вызывая MPTP-индуцированную PD-подобную патологию. Следовательно, гипергомоцистеинемия, вероятно, коррелирует с дискинезией и может служить показателем скорости нейродегенерации. Уровни Hcy у пациентов с PD, MCI, AD и церебральной амилоидной ангиопатией (CAA) относительно выше, чем у здоровых людей , но у пациентов с PD самые высокие уровни по сравнению с другими пациентами. Кроме того, считается, что более высокие уровни Hcy коррелируют с ухудшением когнитивных функций и более высокими уровнями амилоидного бета (Aβ) белка в плазме у пациентов с болезнью Паркинсона. Несмотря на то, что терапия леводопой повышает уровень Hcy в плазме, фолат и витамин B12 очень эффективны для устранения гипергомоцистеинемии, связанной с леводопой.
8-гидроксидезоксигуанозин
8-гидроксидезоксигуанозин (8-OHdG) является основным продуктом реакции окисления гидроксильных радикалов и остатков гуанина в ДНК и является одним из лучших биомаркеров повреждения ДНК вследствие окислительного стресса. Несколько исследований показали, что концентрации 8-OHdG избирательно повышаются в черной субстанции пациентов с болезнью Паркинсона.
AOPP
Продукты из окисленных белков (AOPP) являются надежным биомаркером галогенирующего стресса, а галогенирование белков является разновидностью окислительного стресса, вызванного фагоцитарной чрезмерной стимуляцией. При количественном определении концентраций AOPP с помощью иммуноферментных анализов (ELISA) исследователи обнаружили, что уровни AOPP в сыворотке пациентов с Болезнью Паркинсона значительно выше, чем у контрольных субъектов.
α-синуклеин
Альфа -синуклеин, состоящий из 140 аминокислот, экспрессируется главным образом в нейронах, более конкретно в нейрональных синапсах. Несмотяр на то, что физиологическая роль α-синуклеина еще не до конца понятна, представляется, что регуляция синаптической пластичности является одной из его ролей. Напомню читателю моего Блога , что присутствие телец Леви, которые являются агрегатами белка с α-синуклеином в выживших нейронах, является одной из патологических особенностей болезни Паркинсона. В то время как α-синуклеин является основным компонентом цитоплазматических включений телец Леви. Фосфорилирование, неправильное сворачивание и ненормальное накопление α-синуклеина играют важную роль в патогенезе болезни Паркинсона. Кроме того, α-синуклеин является продукцией SNCAген; а его мутация может вызвать одну из моногенных форм PD. Таким образом, теория распространения патологии Браака приводит к гипотезе о прионоподобном распространении неправильно свернутого α-синуклеина. Гистологические исследования измеряли уровни α-синуклеина CSF с помощью ELISA и пришли к выводу, что количество α-синуклеина CSF у пациентов с болезнью Паркинсона значительно ниже, чем в контрольной группе людей (без PD).
Aβ42
Амилоид бета 1–42 (Aβ42), состоящий из 42 аминокислот, в основном образуется в результате гидролиза белка-предшественника амилоида. Как все мы знаем, амилоидные бляшки, возникающие в результате неправильного складывания и полимеризации пептидов Aβ, являются одной из классических патологических особенностей AD. Кроме того, многие исследования продемонстрировали положительную связь между концентрацией Aβ42 и когнитивной дисфункцией. Снижение уровня Aβ42 вносит вклад в снижение памяти. С другой стороны, это также подтверждает, что Aβ42 может способствовать развитию болезней телец Леви, способствуя полимеризации α-синуклеина . В то время как уровни CSF Aβ42 значительно ниже у пациентов с AD, пациентов с DLB или пациентов с деменцией PD (PDD) по сравнению с нормальным контролем и пациентами с PD.
Tau
Tau — белок, ассоциированный с микротрубочками (MAP), обнаруживается преимущественно в аксонах здоровых нейронов как в ЦНС, так и в периферической нервной системе. Было установлено, что он является важным патологическим белком, вовлеченным в когнитивные нарушения. У пациентов с боленью Альцгеймера уровни общего белка тау (t-tau) и фосфорилированного белка тау (p-tau) связаны с дегенерацией нейронов и патологией тау-клубка, поэтому повышенные уровни t-tau и p-tau в CSF являются диагностическими вариациями нейродегенеративных расстройств. Большое количество исследований показало более низкие уровни t-tau и p-taus в CSF PD, по сравнению с пациентами с DLB, PDD, AD и MSA. Пациентов с болезнью Паркинсона можно отличить от MSA по комбинированным уровням t-тау и p-тау CSF с чувствительностью 82% и специфичностью 81%.
Нейрофиламенты
Нейрофиламенты, как основные компоненты промежуточных филаментов в нейронах, являются основными структурными компонентами аксонов. У пациентов с болезнью Паркинсона выявлено патологическое фосфорилирование нейрофиламентов. Являясь одной из трех субъединиц, нейрофиламенты играют ключевую роль в проведении нервных импульсов и поддержании целостности морфологии нейронов. Это потенциальный клинический биомаркер дегенерации крупных миелиновых аксонов.
BDNF
Полученный из мозга нейротрофический фактор (BDNF) является одним из наиболее широко распространенных нейротрофических факторов, который может регулировать выживание клеток и синаптическую пластичность, а также ингибировать клеточную гибель, обусловленную апоптозом. Недостаточное снабжение нейротрофическими факторами приведет к нейродегенеративному процессу. В обычных случаях BDNF синтезируется нейронами. Но когда нейроны повреждены, клетки микроглии могут продуцировать BDNF. Многие исследования показали, что экспрессия BDNF в черной субстанции у пациентов с болезнью Паркинсона снижается, особенно в вентральной латеральной ее части. BDNF играет важную роль в поддержании выживания дофаминергических нейронов. Более низкие уровни BDNF на ранних стадиях заболевания могут быть полезны для ранней диагностики болезни Паркинсона , и повышенная регуляция концентраций BDNF, вероятно, будет эффекивной терапией для пациентов с болезнью Паркинсона. Однако есть противоречивый сведения, что более высокие концентрации BDNF связаны с более длительной историей заболевания и более тяжелыми симптомами. С другой стороны, BDNF может регулировать когнитивные процессы путем регулирования синаптической пластичности и активации путей передачи сигнала.
IGF-1
Инсулиноподобный фактор роста 1 (IGF-1), секретируемый сосудистым сплетением, оказывает нейропротекторное действие, ингибируя апоптоз нейронов и усиливая выживаемость нейронов. В норме нейроны играют значительную роль в синтезе IGF-1, но в поврежденном мозге, реактивная микроглия продуцирует IGF-1. Большое количество исследований продемонстрировало несколько корреляций между IGF-1 и PD: (1) в черной субстанции существует высокая плотность рецепторов IGF-1; (2) IGF-1 увеличивает выживаемость дофаминергических и субстанциальных нейронов; (3) IGF-1 защищает дофаминергические нейроны от запрограммированного клеточного апоптоза. Исследования показывают, что только у пациентов с болезнью Паркинсона на поздней стадии (длительность заболевания> 3,5 года) уровни IGF-1 в сыворотке крови значительно выше, чем у здоровых людей. Cывороточный IGF-1 рассматривается как признак биомаркера на поздних стадиях болезни Паркинсона. Cывороточный IGF-1 рассматривается как признак биомаркера на поздних стадиях заболевания. Фактически, во многих областях мозга, имеющих решающее значение для когнитивной деятельности, сообщается о нескольких рецепторах IGF-1, причем самые высокие уровни наблюдаются в лобной коре и гиппокампе . IGF-1 может стать полезным инструментом для раннего выявления PDD.
Биомаркеры воспаления
Активированная микроглия может секретировать воспалительные цитокины, такие как IL-6, IL-1β и TNF-α, атаковать дофаминергические нейроны и приводить к дегенерации нейронов. В то же время она может также представлять антигены CD4 + T-клеткам и CD8 + цитотоксическим T-лимфоцитам по пути MHC-II, чтобы принимаь участие в иммунной регуляции. Нейровоспалительные реакции приводят к повышенной секреции IL-2, IL-6, IL-10, TNF-α, IL-1β и IFN-γ в плазме и в CSF. Следовательно, увеличение этих воспалительных факторов может стать потенциальным биомаркером для ранней диагностики и выявления прогрессирования болезни Паркинсона.
miRNA
МикроРНК (miRNA), которые впервые были описаны в 1993 году, представляют собой группу одноцепочечных некодирующих малых молекул, которые могут регулировать экспрессию своих генов-мишеней путем деградации РНК-мессенджера или ингибирования трансляции. Почти все PD-родственные гены регулируются ими, поэтому эти miRNAs вовлечены в патогенез PD. Экспрессия микроРНК обычно варьирует в зависимости от прогрессирования болезни Паркинсона и конкретной стадии заболевания, что приводит к гетерогенности микроРНК. Дисфункция этих miRNAs может приводить к ряду проблем, включая подавление белка DJ-1, сверхэкспрессию α-синуклеина , активацию патогенного белка LRRK2 , усиление или подавление воспалительного ответа , нарушение регуляции IGF , и вызвать даже смерть дофаминергического нейрона. Поскольку предполагается, что циркулирующие микроРНК являются специфичными для тканей , обильными, высокостабильными и поддающимися количественному определению, и они повышаются или понижаются за несколько лет до начала болезни Паркинсона , новый подход к использованию микроРНК в качестве неинвазивных биомаркеров для выявления раннего PD позволяет контролировать прогрессирование данной патологии. Еще в 2011 году Мартинс и его коллеги обнаружили, что 18 miRNAs были недостаточно экспрессированы у пациентов с PD при проведении исследования профилирования экспрессии miRNA, и они также определили, что miR-26a, miR-30b и miR-30c потенциально коррелировали с восприимчивостью к PD (Martins et al. al., 2011 ). Позже исследователи нашли четыре оптимальных биомаркера-кандидата: miR-450b-3p, miR-505, miR-626 и miR-1826.
Категория сообщения в блог:
ММА имени И.М. Сеченова
ММА имени И.М. Сеченова
Клиническая картина
Паркинсонизм (П) – синдром, связанный с поражением базальных ганглиев и их связей. Его главные проявления – бедность движений (акинезия) и повышение тонуса мышц (ригидность). Поэтому П по–другому называют акинетико-ригидным синдромом. В прямом понимании термин «акинезия» означает отсутствие движений или их обеднение. Акинезия проявляется отсутствием так называемых ассоциированных, спонтанных движений – например, во время ходьбы отсутствует физиологическая синкинезия в виде раскачивания рук или амплитуда этого движения резко уменьшена (ахейрокинез); обеднена мимика – отмечается редкое моргание, уменьшены эмоциональные движения (гипомимия). В понятие акинезии входит и затруднение начала (инициации) движений. При П имеет место также замедленность произвольных двигательных актов и их истощаемость, что некоторые исследователи обозначают термином «брадикинезия». Например, при повторном сжимании и разжимании кисти, пронации-супинации рук, постукивании ногой по полу и т. д. заметно, что амплитуда и сила первых движений больше, чем последующих. Помимо акинезии, обеднение движений обозначают таким же по смыслу термином – «гипокинезия» (а синдром П – гипокинетико-ригидным синдромом).
Ригидность – это особый тип повышения тонуса мышц. При пассивных движениях в суставах (сгибание–разгибание, пронация–супинация и т.д.) исследователь чувствует постоянное сопротивление, одинаковое на протяжении всего движения. Это ощущение похоже на то, которое возникает при сгибании и разгибании свинцовой трубки (в отличие от другого вида повышения тонуса – спастичности, при котором наибольшее сопротивление пассивным движениям отмечается в начале движения. Последнее называют «феноменом складного ножа»). Ригидность при П опеределяется как в мышцах шеи и туловища, так и в мышцах конечностей. Нередко повышение тонуса преобладает в мышцах–сгибателях, из-за чего формируется согбенная поза туловища с несколько согнутыми в локтевых суставах и приведенными к туловищу руками и согнутыми в коленных суставах ногами. Эту позицию называют «позой сгибателей» или «позой просителя».
Еще одним характерным симптомом является феномен «зубчатого колеса». Он встречается наряду с ригидностью, но может иметься и в ее отсутствие. Во время сгибания и разгибания в суставах исследователь ощущает неравномерное сопротивление производимому движению, создающее впечатление соскальзывания зацепляющихся между собой зубцов шестерен.
В дебюте П многие больные не замечают за собой каких-либо нарушений. Часто родственники и друзья пациента впервые обращают внимание на уменьшение выразительности лица (часто интерпретируя это, как проявление депрессии), ахейрокинез и замедленность движений, особенно при одевании, еде и ходьбе. Впоследствии сами больные отмечают уменьшение ловкости рук, особенно при выполнении тонких движений, таких как застегивание пуговиц, завязывание шнурков. Нарушаются привычные виды деятельности, требующие проворности рук (например, игра на музыкальных инструментах, работа на печатной машинке или за компьютером). Возникают нарушение письма – почерк меняется, становится мелким (микрография), менее разборчивым, а на продвинутых стадиях вовсе непонятным; трудности при чистке зубов, бритье и т.д. Значительно затруднены повороты в постели, проблемой является вставание с кресла или низкого стула, зачастую пациенты не в состоянии лечь в ванну и встать из нее, поэтому могут мыться только под душем. Многие больные связывают эти явления со «слабостью» и предъявляют соответствующие жалобы. Обычной жалобой является также отсутствие энергии и быстрая утомляемость. Впоследствии становится затруднен прием пищи из-за трудности жевания, возникает поперхивание при глотании. Из-за акинезии мыщц глотки глотательные движения становятся более редкими, что обусловливает развитие слюнотечения. Последнее может быть столь интенсивным, что больные вынуждены постоянно пользоваться платком или полотенцем.
Часто акинезия и ригидность сочетаются с тремором. Типичный паркинсонический тремор очень своеобразен, его трудно перепутать с другим видом дрожания. Во-первых, в преобладающем большинстве случаев его отмечают в руках, реже – в ногах. Следует помнить, что паркинсоническое дрожание никогда не начинается с головы, и даже на очень продвинутых стадиях П дрожание головы – исключительная редкость. Дрожание нижней челюсти и языка, напротив, можно наблюдать достаточно часто (обычно на поздних этапах). Во-вторых, паркинсонический тремор является тремором покоя. Это значит, что он наблюдается (или максимально выражен) в ситуации, когда руки пациента в расслабленном состоянии лежат на его коленях, ручках кресла, столе и т.д. При совершении движений дрожание исчезает или становится гораздо менее интенсивным. В-третьих, при паркинсоническом дрожании кисти пациента совершают круговые движения, а большой и указательный пальцы при этом двигаются навстречу друг другу. Это напоминает движения, совершаемые при счете денег или скручивании бумажных шариков. Поэтому паркинсоническое дрожание образно называют тремором по типу «счета монет» или «скатывания пилюль». Следует помнить, что дрожание не является обязательной составляющей синдрома П.
Болезнь Паркинсона. На рисунке А показан участок мозга здорового человека с хорошо пигментированным черным веществом. На рисунке В — участок мозга пациента, страдающего болезнью Паркинсона. Заметно отсутствие пигментации черного вещества.
П сопровождается также нарушением равновесия вследствие расстройства так называемых постуральных рефлексов. Последние обеспечивают прямостояние, сохранение устойчивости при разных движениях (движения рук, ходьба, присаживание и вставание, наклоны и т. д.), а также при внезапных дестабилизирующих воздействиях (например, при толчке, спотыкании и др.). Расстройство постуральных рефлексов проявляется в частых падениях больных. При более легких нарушениях падений не отмечается, но имеет место неустойчивость при легком толчке в грудь или спину. При присаживании на стул больные падают на него, нередко резко откидываясь на спинку. Постуральные нарушения обусловливают также возникновение пропульсий – одной из характерных черт П. Пропульсии выражаются в том, что при ходьбе больного «тянет вперед», он короткими шагами быстро идет вперед, как бы «догоняя свой центр тяжести», и не в состоянии резко остановиться. Нередко это заканчивается падением.
П – это синдром, который может встречаться в рамках разных заболеваний. Наиболее часто причиной П является идиопатический паркинсонизм, или болезнь Паркинсона (БП). П часто наблюдается в рамках других идиопатических дегенеративных заболеваний нервной системы. Последние часто называют паркинсонизмом–плюс. К этой группе относятся мультисистемная атрофия, прогрессирующий надъядерный паралич, болезнь диффузных телец Леви, кортико-базальная дегенерация. Нередко встречается симптоматический П (не связанный с первичным дегенеративным заболеванием нервной системы). К нему относят лекарственный, сосудистый, посттравматический, постэнцефалитический, токсический П, П при опухолях головного мозга и гидроцефалии. П характеризует также клиническую картину некоторых наследственных дегенеративных заболеваний ЦНС. К их числу относятся гепатолентикулярная дегенерация (болезнь Вильсона-Коновалова), спиноцеребеллярные атаксии, семейная кальцификация базальных ганглиев, болезнь Гентингтона и др. Таким образом, синдром П не является синонимом БП.
Диагноз и дифференциальный диагноз
Эссенциальный тремор
На первом этапе диагностической работы необходимо убедиться, что у больного действительно имеется синдром П. Наиболее часто за истинный П ошибочно принимают эссенциальный тремор (ЭТ) и своеобразные изменения походки, связанные с сосудистой патологией головного мозга. Таким пациентам очень часто неправильно ставят диагноз БП.
ЭТ – наследственное заболевание (хотя нередки и спорадические случаи), которое характеризуется двусторонним, симметричным тремором рук. В отличие от паркинсонического тремора дрожание рук при ЭТ отсутствует в покое и возникает при работе мышц. Обычно оно максимально выражено тогда, когда больной вытягивает руки перед собой, может присутствовать также при совершении произвольных движений, часто затрудняя бытовые виды деятельности (например, еду). Обычно при ЭТ наблюдается тремор головы по типу «нет-нет» или «да-да» и тремор голоса. Последние могут быть первыми проявлениями ЭТ, а также встречаться изолированно в отсутствие дрожания конечностей. В отличие от ЭТ дрожание головы и голоса, как правило, не встречаются при БП. Напротив, вертикальный тремор нижней челюсти в состоянии покоя и дрожание ног часто имеют место при БП и редко при ЭТ. Характерным для ЭТ признаком, который имеет диагностическое значение, является исчезновение тремора под воздействием алкоголя. Хорошо влияют на ЭТ также b-блокаторы. При ЭТ может иметь место феномен «зубчатого колеса», но в отличие от БП никогда не отмечается истинной акинезии и ригидности мышц. ЭТ чаще страдают пожилые люди, хотя он может встречаться и среди очень молодых людей.
В прошлом сосудистое поражение головного мозга считалось самой частой причиной П и даже рассматривалось, как причина БП. В настоящее время стало ясно, что БП – первичное дегенеративное заболевание ЦНС и сосудистое поражение не играет этиологической роли в ее развитии. Цереброваскулярные заболевания очень редко вызывают истинный П, что послужило поводом ввести понятие «атеросклеротический псевдопаркинсонизм», или «сосудистый псевдопаркинсонизм». Используются также такие обозначения, как «паркинсонизм нижней половины тела» и «паркинсоническая атаксия». Пациенты, страдающие этими нарушениями, как правило, пожилые люди, часто имеющие в анамнезе артериальную гипертензию. Наиболее характерной чертой сосудистого псевдопаркинсонизма является выраженное нарушение походки: больные ступают короткими шагами, нередко широко расставляя ноги (что нехарактерно для истинного П). Часто затруднена инициация ходьбы и повороты, имеют место также нарушение равновесия и падения. Наряду с этим в верхней половине тела, руках и лице полностью отсутствуют какие-либо проявления П: мимика больных живая, голос нормально модулирован, движения рук свободны, ахейрокинез отсутствует. Тремор также не является частью клинической картины. Сосудистый псевдопаркинсонизм может сочетаться со снижением высших психических функций, пирамидными знаками (хотя это не обязательное явление). Всем больным с подобной клинической картиной необходимо проведение визуализации головного мозга – магнитно-резонансной томографии (МРТ) или компьютерной томографии (КТ).
Тельца Леви при болезни Паркинсона. В цитоплазме нейрона определяется эозинофильное ядро окруженное неокрашенной зоной.
Последние, как правило, выявляют множественные мелкие очаги сосудистого происхождения (лакуны) в области базальных ганглиев и/или изменения белого вещества полушарий головного мозга (лейкоареоз). Следует иметь в виду, что схожая клиническая картина может возникать иногда при нормотензивной гидроцефалии и реже – при опухолевом поражении головного мозга. При нормотензивной гидроцефалии наряду с нарушением ходьбы по типу описанного выше имеют место деменция и расстройство функции тазовых органов (эту триаду симптомов называют триадой Хакима–Адамса). МРТ головы, как правило, обнаруживает резко расширенные боковые желудочки.
Болезнь Паркинсона
Самой частой причиной истинного П (более чем 80%), как говорилось выше, является БП. Это дегенеративное заболевание, при котором основной патологический процесс развивается в нигро-стриарной системе. В частности, прогрессирующей дегенерации подвергаются нейроны черной субстанции, которые вырабатывают дофамин. В результате развивается дефицит дофамина, что и обусловливает клиническую симптоматику. БП обычно страдают люди пожилого возраста. Все описанные выше симптомы П при БП развиваются в полной мере. Для БП типично асимметричное начало. В дебюте болезни симптомы касаются, как правило, одной стороны тела, возникая обычно в первую очередь в руке (чаще в правой), затем в ноге на той же стороне. Нередко первое проявление паркинсонизма в руке – микрография и ахейрокинез. Стадия гемипаркинсонизма длится обычно несколько месяцев, редко несколько лет. Затем симптоматика вовлекает контралатеральные конечности, а также мышцы туловища и шеи. Симптомы П могут возникать постепенно (например, изначально появляется акинезия и ригидность в руке, затем присоединяется дрожание). Может быть и обратная ситуация. Следует помнить, что тремор отсутствует у 30% больных БП в начале болезни, а в некоторых случаях в течение всей болезни. В связи с этим выделяют разные формы БП – акинетико-ригидную, ригидно-дрожательную и дрожательную. На стадии гемипаркинсонизма рука больного несколько согнута в локтевом суставе, не раскачивается во время ходьбы и как бы прижата к туловищу. На более продвинутых стадиях, когда такие же изменения возникают и на другой стороне, а ригидность и акинезия вовлекают мышцы туловища и шеи, формируется специфическая паркинсоническая «поза просителя». Нарушение равновесия и падения возникают на продвинутых стадиях БП, обычно через несколько лет после начала болезни. В рамки БП не входят мозжечковые и пирамидные расстройства, хотя имеется тенденция к оживлению глубоких рефлексов на более пораженной стороне. Иногда может наблюдаться экстензорная установка стопы и пальцев, напоминающая симптом Бабинского, так называемая стриарная стопа. Симптомы БП, как правило, значительно уменьшаются под воздействием препаратов леводопы. Если паркинсонические симптомы не реагируют или слабо реагируют на прием достаточной дозы этих препаратов, диагноз БП следует подвергнуть сомнению. При длительном лечении лекарствами, содержащими леводопу, практически у всех больных возникают побочные явления в виде двигательных флуктуаций и дискинезий. Последние выражаются в следующем: до очередного приема препарата отмечается выраженное нарастание симптомов П, нередко до полной обездвиженности больного, а в период, когда концентрация препарата в крови достигает максимальных значений, акинезия и ригидность полностью отсутствуют (феномен «включения и выключения») и даже наблюдаются избыточные непроизвольные движения (дискинезии). Последние иногда настолько выражены, что при первом взгляде на пациента создается впечатление, что он болен хореей.
Диагноз БП – это клинический диагноз. Параклинические методы исследования обычно выявляют неспецифические изменения. Нередко у больных с классической БП в головном мозге имеются сосудистые изменения. Это, однако, ни в коем случае не является свидетельством сосудистого генеза болезни. Просто у большинства пожилых людей, в том числе практически здоровых, подобные изменения могут иметь место. Тем не менее, в некоторых случаях на БП наслаивается атеросклеротический псевдопаркинсонизм, что может быть причиной необычной для БП походки и ранних постуральных нарушений.
Лекарственный паркинсонизм
Лекарственный П может быть обусловлен препаратами, которые воздействуют на пресинаптические дофаминовые нейроны черной субстанции, истощая запасы дофамина в них (например, резерпин) или, наиболее часто, нейролептиками, которые блокируют постсинаптические дофаминовые рецепторы, такими как производные фенотиазина (хлорпромазин), бутирофеноны (галоперидол), тиоксантины (флупентиксол) и бензамиды (сульпирид). Эти препараты часто применяются при психических заболеваниях. Также П может быть вызван прохлорперазином (используется при рвоте, головокружении и неустойчивости), метоклопрамидом (применяется при заболеваниях желудочно-кишечного тракта, для купирования тошноты и рвоты). П может быть обусловлен также циннаризином, который является атипичным блокатором кальциевых каналов (применяется при вестибулярных расстройствах). Комбинация нейролептиков и антидепрессантов также может быть причиной П.
В психиатрических лечебницах лекарственный П встречается часто. Гипомимия и ахейрокинез – настолько обычное явление среди этого контингента больных, что психиатры часто даже не обращают на них внимание. Тремор встречается менее часто, но может иметь вид классического паркинсонического дрожания. Более того, лекарственный П может быть асимметричным, подобно БП, и нередко совершенно не отличим от БП. Одним из признаков, по которому следует заподозрить лекарственный П, является наличие наряду с акинетико-ригидным синдромом насильственных движений в виде, например, оро-мандибулярной дискинезии (непроизвольные жевательные и/или сосательные движения) или дистонических явлений (спастической кривошеи, окулогирных кризов), стереотипий, акатизии (неусидчивость). Нередко тяжелый лекарственный П сопровождается выраженной дизартрией и дисфагией. Индивидуальная чувствительность к дофаминблокирующим препаратам очень разнообразна. Некоторые пациенты без каких-либо проблем переносят длительное лечение большими дозами этих веществ, тогда как у других побочные явления развиваются уже на малых дозах. Чаще, однако, признаки лекарственного П возникают при приеме больших доз нейролептиков. Лекарственный П обычно развивается постепенно в течение дней или недель. У большинства больных первые признаки появляются через 3 нед после начала лечения. Наиболее часто встречающиеся дебютные признаки – гипомимия и недостаточное раскачивание рук во время ходьбы.
Течение лекарственного П может быть различным. В большинстве случаев он постепенно, в течение нескольких недель, а иногда и дней, проходит после прекращения приема вызвавшего его препарата. Тем не менее нередки случаи, когда П длится в течение месяцев, иногда почти год. Такая ситуация наблюдается при применении нейролептических препаратов, способных к депонированию. В редких случаях лекарственный П не проходит и продолжает прогрессировать, несмотря на прекращение приема вызвавшего его агента. Подобные случаи чаще встречаются среди пожилых людей. Считается, что в таких случаях прогрессирует не сам по себе лекарственный П, а начинает развиваться БП.
Мультисистемная атрофия
Мультисистемная атрофия (МСА) – это спорадическое заболевание, возникающее у взрослых лиц, при котором в отличие от БП дегенерации подвергается не только нигро-стриарная система, но также множество других образований ЦНС, включая мозжечок и его связи, пирамидные пути и образования вегетативной нервной системы (отсюда и происходит название болезни). Соответственно клинически МСА характеризуется сочетанием П, мозжечковых нарушений, пирамидных расстройств и прогрессирующей вегетативной недостаточности (ПВН). П при МСА обусловлен не только поражением клеток черной субстанции, что вызывает дефицит дофамина, но также дегенерацией тех постсинаптических рецепторов, с которыми должен взаимодействовать дофамин.
МСА наиболее часто дебютирует после 50 лет и в отличие от БП значительно укорачивает продолжительность жизни больных, становясь причиной смерти в среднем в течение 9 лет от появления первых симптомов. П имеет место у 90% больных МСА, а доминирующим клиническим признаком является у 80%. Мозжечковые и пирамидные расстройства проявляются у 50% пациентов. Практически у всех больных отмечаются признаки ПВН. Вегетативные расстройства встречаются также при БП, поэтому одним из ключевых моментов дифференциальной диагностики МСА и БП является выяснение того, когда возникли признаки ПВН. При МСА они часто возникают еще до начала двигательных проявлений, нередко опережая последние на несколько лет, тогда как при БП они встречаются редко и, как правило, через несколько лет после начала болезни. У мужчин часто первым симптомом становится импотенция. Обычное явление как среди мужчин, так и среди женщин – недержание мочи. Нередко из-за этого больные, до того как обратиться к неврологу, попадают на прием к урологу и даже подвергаются ненужному хирургическому вмешательству. Для сравнения: при БП имеет место лишь учащение мочеиспускания и иногда императивные позывы к опорожнению пузыря в результате гиперрефлексии мышцы-детрузора. Для большинства лиц с МСА характерна также ортостатическая гипотензия (ОГ), которая может быть причиной липотимических состояний и обмороков. У больных с БП ОГ также встречается, но менее часто и, как правило, на продвинутых стадиях болезни. Характерна зябкость конечностей – так называемый симптом холодных рук. Примерно у 13% больных МСА имеет место выраженный респираторный стридор из-за паралича абдуктора голосовых связок. Стридор вначале отмечается только во время сна и становится причиной очень громкого храпа, а по мере прогрессирования проявляется и во время бодрствования. Паралич абдуктора голосовых связок настолько патогномоничен для МСА, что, по мнению некоторых исследователей, при сочетании П и недавно возникшего выраженного ночного храпа, следует подозревать МСА. Сам синдром П у больных МСА развивается не так, как при БП. В частности, при МСА П, обычно, начинается с общей замедленности движений, которая затрагивает руки и ноги как с левой, так и с правой стороны. Хотя симптоматика также бывает асимметрична, стадия гемипаркинсонзма в отличие от БП, как правило, отсутствует. Явления П при МСА могут начинаться с дизартрии — артикуляция больного становится более медленной, слова менее разборчивы и произносятся менее четко (смазанность речи). БП практически никогда не начинается с дизартрии. Часто у больных МСА присутствует выраженная дисфония – голос очень глухой и прерывающийся, нередко это сочетается с дисфагией, что становится причиной частых поперхиваний во время еды. Тремор покоя также может иметь место при МСА, однако классический вариант паркинсонического дрожания, описанный выше, по типу «счета монет», наблюдается лишь в 10% случаев. Напротив, часто имеет место постуральное дрожание и тремор во время движения. Нередко как тремор ошибочно расценивают нерегулярные миоклонические подергивания пальцев, характерные для МСА. Для этой болезни характерны также чувствительные к стимулам миоклонии. У ряда больных развивается так называемый диспропорциональный антеколлис – голова значительно наклонена вперед, несмотря на то, что в целом «согбенная поза» выражена незначительно. Этот признак, однако, не считается специфическим для МСА. Следует помнить, что деменция не является частью клинической картины МСА. В целом МСА протекает более злокачественно, чем БП, и значительно инвалидизирует больных нередко уже в течение первого года болезни.
В клинической картине МСА может преобладать та или иная симптоматика. Те случаи, при которых на первый план выступает П, обозначают термином нигро-стриальная дегенерация (СНД); если в клинической картине ведущим является мозжечковый синдром, это состояние называют оливо-понто-церебеллярной атрофией (ОПЦА); случаи, когда ядром клинической картины является ПВН, обозначают эпонимическим названием – синдром Шая–Дрейджера (СШД).
Несмотря на все различия, нередки ситуации, когда МСА невозможно отличить от БП. В таких случаях следует в основном ориентироваться на эффект препаратов леводопы. При БП эти препараты оказывают драматический положительный эффект, тогда как при МСА этот эффект не столь выражен, кратковременен, а нередко отсутствует совсем. Это обусловлено поражением постсинаптических рецепторов, с которыми должна взаимодействовать леводопа.
Признаки, при наличии которых у больных с П следует подумать об МСА, следующие: быстрое прогрессирование симптоматики; рано развившиеся нарушения равновесия и падения; отсутствие улучшения при лечении препаратами леводопы или недостаточный эффект этих препаратов; ПВН; пирамидные и/или мозжечковые знаки; похолодание, зябкость конечностей; контрактуры; диспропорциональный антеколлис; выраженная дисфония, дисфагия или дизартрия; респираторный стридор; нерегулярный тремор или миоклонии.
Из параклинических методов исследования в диагностике МСА могут помочь специальные тесты на выявление ПВН, электромиография наружного сфинктера мочеточника или анального сфинктера, которая выявляет денервационные изменения в них из-за поражения сакрального ядра Онуфа, откуда иннервируются эти мышцы. МРТ головного мозга нередко выявляет атрофию мозжечка, а при высокой разрешающей способности метода (с мощностью магнитного поля 1,5 тесла) в Т2 взвешенном изображении определяется гиперинтенсивный сигнал щелевой формы по наружному краю скорлупы. Однако ни одно из перечисленных изменений, взятое в отдельности, не является специфичным только для МСА, поэтому их следует оценивать только вкупе с клинической картиной. В целом диагноз МСА, так же как и БП, в основном является клиническим диагнозом. При жизни пациента диагностируется только «возможная» или «вероятная» МСА на основе специальных диагностических критериев, а достоверная диагностика возможна только при патоморфологическом обследовании в случае обнаружения специфических гистологических маркеров болезни – глиальных цитоплазматических включений.
Прогрессирующий надъядерный паралич
Прогрессирующий надъядерный паралич (ПНП), или синдром Стила–Ричардсона–Ольшевского, – еще один вариант дегенераций, поражающих множественные отделы нервной системы, при котором нередко ошибочно ставится диагноз БП. ПНП начинается позже, чем БП и МСА, – чаще после 70 лет. Средняя продолжительность жизни после появления первых симптомов составляет 6–7 лет. При этой болезни П характеризуется симметричностью, акинезия и ригидность в конечностях выражены не столь ярко, иногда практически отсутствуют, а страдает в основном аксиальная мускулатура, т.е. мышцы туловища и шеи. Нередко у больных ПНП отмечается несколько закинутая назад голова, хотя наличие этого признака необязательно, голова может также быть наклонена вперед или находиться в нормальном положении. Первым симптомом этого заболевания в большинстве случаев является нарушение равновесия и падения. Нередко ПНП дебютирует с дизартрии, наряду с которой могут иметь место непроизвольные глубокие вдохи, похожие на стон. Клиническим маркером болезни является надъядерная офтальмоплегия (НО), или надъядерный парез взора, вследствие поражения специфических образований среднего мозга. НО можно диагностировать, когда больной не в состоянии произвольно изменить направление взора, тогда как синкинетические и рефлекторные движения глаз сохранены. Например, при ПНП больной не может произвольно переместить глазные яблоки вверх и/или вниз, но при этом сохранен феномен Белла – отведение глазных яблок вверх при закрывании глаз; окулоцефалический рефлекс (при фиксированном на одной точке взоре во время поворота или наклона головы в какую-либо сторону глазные яблоки содружественно отводятся в противоположную). НО редко развивается в дебюте ПНП, обычно она присоединяется к другим симптомам в среднем через 2–4 года. В начале же болезни может иметь место выраженное замедление движений глаз, своеобразный застывший взор, жжение глаз и ощущение «песка в глазах» из-за очень редкого моргания характерного для ПНП. Часто отмечается непроизвольное насильственное зажмуривание глаз (блефароспазм), особенно при воздействии яркого света или других стимулов. Из-за этого некоторые больные вынуждены постоянно носить солнцезащитные очки. Может наблюдаться также так называемая апраксия открывания век, которая проявляется в том, что больному трудно открыть закрытые (не обязательно зажмуренные) глаза. Из-за нарушения движений глазных яблок пациентам бывает трудно есть, так как они не видят полностью расположенную перед ними тарелку. Нередко они роняют себе пищу на грудь («симптом грязного галстука»). Им трудно спускаться по лестнице, садясь на стул, они садятся мимо сиденья. Все это в сочетании с застывшим взором и редким морганием часто производит ошибочное впечатление, что больной неадекватен, неправильно ведет себя, малодоступен контакту. Из-за этого пациенты с ПНП могут иногда попадать на прием к психиатру. Для ПНП характерны также выраженные псевдобульбарные расстройства в виде оживления лицевых аксиальных рефлексов, у больных нередко отмечается выраженное углубление складок на лице (носогубных, лобных). Характерно также выраженное замедление психических процессов, из-за чего нередко больные долго думают перед ответом даже на элементарные вопросы.
Таким образом, хотя ПНП поверхностно схожа с БП из-за наличия ригидности аксиальных мышц, выраженной гипомимии и нарушения ходьбы, при внимательном осмотре обнаруживается, что в дистальных отделах конечностей П практически отсутствует или выражен очень мягко. Практически никогда не встречается классический тремор покоя. Препараты леводопы обычно не эффективны. Вегетативная недостаточность не характерна для ПНП. МРТ головного мозга может выявлять атрофию среднего мозга, однако это опять же является неспецифическим признаком и диагноз ПНП в основном базируется на клинических проявлениях. Так же, как в случае с МСА, клинически с помощью специально разработанных критериев ставится диагноз «возможного» или «вероятного» ПНП, а достоверный диагноз ставится при патоморфологическом исследовании в случае обнаружения специфических маркеров (нейрофибриллярных клубочков).
Болезнь диффузных телец Леви
В последнее время стали выделять новую нозологическую форму, протекающую с синдромом П – болезнь диффузных телец Леви (БДТЛ). Тельца Леви – это внутриклеточные эозинофильные цитоплазматические включения, которые обнаруживаются в клетках черного вещества при БП и считаются маркером этой болезни. При БДТЛ они встречаются не только в черном веществе, но в большом количестве широко диссеминированы по всему головному мозгу. Диагноз БДТЛ – патоморфологический диагноз. Клинически это заболевание характеризуется П, который обычно хорошо лечится препаратами леводопы, наряду с деменцией с выраженными зрительными галлюцинациями. Типичным является также флуктуация выраженности расстройств высших психических функций – в основном за счет изменения способности концентрации внимания.
Гепатолентикулярная дегенерация (болезнь Вильсона-Коновалова) и другие заболевания
Существует несколько более редких причин истинного или псевдопаркинсонизма. Одна из них, о которой следует всегда вспомнить при наличии П у людей моложе 45 лет (в том числе у детей), это гепатолентикулярная дегенерация, или болезнь Вильсона-Коновалова. Это наследственное заболевание, при котором отмечается нарушение метаболизма меди в организме из-за недостаточности фермента церулоплазмина. В результате медь в избыточном количестве откладывается в печени, базальных ганглиях и вокруг радужной оболочки глаза. Болезнь Вильсона-Коновалова следует подозревать не только при наличии П у молодых людей, но и при возникновении у них других признаков поражения экстрапирамидной системы (например, дистонии) или психических расстройств. Диагностика основана на обнаружении с помощью щелевой лампы отложения меди вокруг радужки – кольцо Кайзера–Флейшера. Последнее на стадии неврологических проявлений имеет место у 98% больных. Диагностическое значение имеет также исследование экскреции меди с мочой и концентрации церулоплазмина в крови. Последнее, однако, в отсутствие кольца Кайзера–Флейшера и нормальной экскреции меди не имеет диагностической значимости. Если ситуация продолжает оставаться неясной, проводится биопсия печени или генетическое тестирование. Болезнь Вильсона-Коновалова довольно успешно лечится с помощью D-пеницилламина и препаратов цинка в сочетании с диетой.
Токсический П может иметь место при интоксикации марганцем. Нередко встречается П, вызванный токсином МФТП (1-метил-4-фенил- 1, 2, 3, 6-тетрагидропиридин), так как оно избирательно поражает черную субстанцию, вызывая гибель дофаминовых нейронов. Схожий с этим веществом токсин вырабатывается при кустарном приготовлении некоторых наркотических веществ, поэтому П нередко наблюдается среди молодых людей, страдающих наркоманией. Наряду с П при этом могут отмечаться пирамидные и псевдобульбарные симптомы.
П встречается при энцефалопатии боксеров. Считается, что в таком случае этиологическую роль играют регулярно получаемые множественные черепно-мозговые травмы. Следует помнить, что энцефалопатия боксеров – практически единственная ситуация, когда черепно-мозговые травмы играют роль в развитии П. В целом у людей, не занимающихся боксом, наличию черепно-мозговой трамы в анамнезе (одной или нескольких) не придается этиологическое значение.
П иногда может иметь место при хорее Гентингтона, которое обычно протекает с выраженными гиперкинезами. Это наследственное заболевание обычно дебютирует на четвертом десятилетии жизни, однако встречаются случаи и более раннего начала. Обычно с акинетико-ригидным синдромом протекает так называемая ювенильная форма хореи Гентингтона (форма Вестфаля). Встречаются также семейные случаи П, в том числе ювенильного. Поэтому у всех больных, имеющих синдром П, сбор наследственного анамнеза имеет большое значение.
Акинезия и ригидность могут иногда наблюдаться при болезни Альцгеймера, Пика, при которых ядром клинической картины является прогрессирующая деменция. При болезни Альцгеймера в первую очередь страдает память, а при болезни Пика на первый план выступает распад личности. При этих заболеваниях П чаще проявляется умеренной акинезией, ригидность выражена меньше, а паркинсонический тремор практически никогда не наблюдается.
Кортико-базальная дегенерация (КБД) – одна из очень редких причин П. При КБД акинезия и ригидность строго асимметричны, обычно присутствуют в одной руке и сопровождаются миоклониями в ней, дистоническими явлениями и апраксией. Характерный признак болезни – «синдром чужой руки». Последнее проявляется тем, что рука больного независимо от его желания и намерений совершает разные движения, иногда даже достаточно сложные моторные акты.
Постэнцефалитический П в наше время практически не встречается. Много случаев наблюдалось после пандемии летаргического энцефалита в начале XX столетия. С тех пор в литературе описано только несколько случаев.
Особая эндемическая форма П наблюдается на острове Гуам и в некоторых других местах восточной части Тихого океана. В этих местах отмечается много случаев П в сочетании с амиотрофиями и деменцией (гуамский комплекс паркинсонизм – деменция). Патоморфологически мозг этих больных выглядит, как мозг больных ПНП. Одинаковыми являются также гистологические маркеры.
Как избежать ухудшений при болезни Паркинсона? 5 вопросов неврологу
Вылечить болезнь Паркинсона нельзя, но можно держать ее под контролем. Что об этом заболевании должны знать родственники пациента?
Консультация врача
Вы можете получить консультацию необходимого специалиста онлайн в приложении Доктис
Лаборатория
Вы можете пройти комплексное обследование всех основных систем организма
- Каких ухудшений можно ожидать при болезни Паркинсона
- Что приводит к ухудшениям?
- Психические расстройства при болезни Паркинсона
- Варианты психических расстройств при лечении болезни Паркинсона
- Нарушения интеллекта при болезни Паркинсона
- Профилактика колебаний артериального давления при болезни Паркинсона
Болезнь Паркинсона: отвечаем на вопросы
Отцу поставили диагноз «болезнь Паркинсона». Врач назначил лечение и предупредил: «Следите,
чтобы не было ухудшений». Каких ухудшений можно ожидать?
При болезни Паркинсона на фоне стабильного состояния иногда в течение нескольких дней или недель начинают
нарастать двигательные расстройства: скованность движений или их замедленность, дрожание рук, неустойчивость
при ходьбе… Появляются
лекарственные дискинезии — насильственные движения в разных группах мышц, как результат приема
лекарственных препаратов.
Например, больной принял назначенную дозу леводопы, его движения стали четче, но вдруг возникли
необычные подергивания мышц лица, шеи, туловища… Лекарство, которое раньше действовало 4−5 часов,
почему-то стало действовать только полтора – два часа, в результате нарастают основные симптомы
заболевания.
Если пациент болеет давно, могут возникнуть психические расстройства, галлюцинации, может резко снизиться
артериальное давление, появиться боль в мышцах. Об этих состояниях надо сообщить своему лечащему
врачу-неврологу.
Еще может случиться акинетический криз – внезапное и быстрое нарастание симптомов паркинсонизма, с полной
обездвиженностью, с тяжелыми вегетативными и психическими расстройствами, с нарушением
терморегуляции, когда температура не снижается жаропонижающими средствами. Такое состояние иногда сохраняется
более суток и оно, конечно, требует госпитализации.
Что приводит к ухудшениям?
- Сильный стресс.
- Физическая перегрузка. Например, чрезмерная работа летом на дачном участке. Вообще,
физическая активность необходима при болезни Паркинсона. Полезны лечебная гимнастика, скандинавская ходьба, если
сохранена координация – плаванье, танцы. Но изнурять себя физически нельзя. - Изменения погоды: резкие перепады атмосферного давления и температуры воздуха.
- Инфекционные заболевания: грипп, ОРВИ, воспаление легких, инфекции мочевыводящих путей…
- Запоры, которыми страдают почти все пациенты с болезнью Паркинсона. При неправильной
моторике кишечника нарушается всасываемость лекарств, и лечение становится малоэффективным. - Обезвоживание. При болезни Паркинсона мышца мочевого пузыря, выталкивающая мочу, как и остальные
мышцы, находится в постоянном тонусе. Гиперактивный мочевой пузырь заставляет часто пробуждаться ночью,
чтобы сходить в туалет. Больные, пытаясь избежать этой проблемы, стараются пить как можно меньше. А пить
надо. Выход – принимать жидкость в необходимом количестве до 18 часов. - Нарушение водно-электролитного баланса. Многие пациенты сидят на бессолевой диете, чтобы
не провоцировать подъем артериального давления. Это неправильно. Соль задерживает воду в организме и поддерживает
артериальное давление, а при болезни Паркинсона пациенты часто страдают колебаниями давления, когда
снижение бывает побочным эффектом приема лекарств. - Наркоз при операциях.
- Травмы.
- Лекарственные каникулы. Отмену всех препаратов на 2−3 недели ради того, чтобы
«отдохнули» печень и почки, раньше практиковали многие врачи. Сейчас понятно, что делать такие
«каникулы» нельзя, они ведут к резкому ухудшению состояния. - Нарушение схемы приема лекарств или перевод пациента с одного препарата на другой,
например, с оригинального на копию (дженерик). - Прием тех лекарств, которые противопоказаны при болезни Паркинсона. Это некоторые нейролептики,
такие, как галоперидол и аминазин; старые снижающие давление препараты (например, резерпин); холинолитики,
которые могут вызвать галлюцинации
У мужа, больного паркинсонизмом, появились галлюцинации. Так бывает? Нас это пугает.
Психические расстройства при болезни Паркинсона не редкость, хотя больные часто их скрывают от родных
и врача. Если такие расстройства появились,
надо обязательно сказать о них лечащему врачу-неврологу,
потому что при них нельзя назначать никакие паркинсонистические препараты, кроме левоподы.
Что это за расстройства?
- Малые (доброкачественные) галлюцинации. Когда у больного появляется эффект присутствия посторонних людей.
- Истинные галлюцинации, когда пациент видит животных, насекомых, умерших родственников, начинает вступать с ними
в контакт. - Слуховые галлюцинации.
- Обонятельные галлюцинации.
- Иллюзии – искажения восприятия реальных предметов. Например, на вешалке висит пальто, а пациенту
кажется, что это стоит человек. - Бред ревности, ущерба, когда будто бы кто-то, например, соседи, хотят нанести ущерб больному. Бред
преследования, плохого отношения. - Спутанность сознания.
- Дезориентация во времени и пространстве.
Эти расстройства чаще возникают у людей старческого возраста, у больных с депрессией, после травм,
болезней, операций. Первый предвестник психотических расстройств – постоянные нарушения сна.
Прежде всего, надо устранить провоцирующие факторы. Позаботиться о том, чтобы больной не находился в социальной
изоляции, а постоянно общался с сиделкой, родственниками. Врач отменит некоторые препараты, в частности
снотворные, потому что эти средства могут вызвать психозы.
Как проявляются нарушения интеллекта при болезни Паркинсона?
Обычно эти нарушения не грубые, но они повышают
риск развития галлюцинаций.
Это замедленность мышления, когда пациент долго не может ответить на вопрос; рассеянность внимания;
нарушение контроля над своей деятельностью; сложности при запоминании новой информации.
Что делать, если при болезни Паркинсона скачет артериальное давление?
Колебания давления, низкое артериальное давление – это часто встречающиеся проявления этой болезни, а также
побочный эффект противопаркинсонических средств.
Нужно избегать резких перемен положения тела. Когда утром больной поднимается с постели, он должен сначала
сесть, затем опустить ноги и посидеть так несколько минут, и только потом вставать.
Если предстоит долго стоять, например, в транспорте, можно скрестить ноги, как бы сжимая их в икроножных
мышцах.
Ни в коем случае нельзя находиться на солнце, перегреваться.
Не рекомендуется в жаркое время принимать алкоголь.
Надо выпивать за день не менее 2 литров воды. Пить по глоточку в течение дня до 18
часов.
Пищу рекомендуется принимать 5−6 раз в день и маленькими порциями – не более 150
мл.
Для нормализации давления можно приподнять изголовье кровати или спать на высоких подушках.
Рекомендуется носить эластичные компрессионные бинты или колготы.
Для поддержания давления полезна лечебная гимнастика.
Важно нормализовать стул.
Если все это не поможет, врач назначит препарат, который задерживает натрий и жидкость
в организме.
Если у вас остались вопросы, вы можете задать их врачу-неврологу онлайн,
воспользовавшись сервисом Доктис.
По данным статистических исследований, проводимых с 2005 по 2015 год, в России количество больных паркинсонизмом и болезнью Паркинсона составляет приблизительно 210000 человек. Это меньше, чем следует из данных общемировой статистики, и связано с тем, что не все пациенты, имеющие специфические признаки болезни, обращаются за помощью или состоят на учете у специалистов. Кроме того, проблема состоит еще и в том, что по внешним признакам и данным стандартных обследований крайне сложно на начальном этапе определить конкретный диагноз. Но при паркинсонизме прогнозы хуже, изменения мозга прогрессируют быстрее, и инвалидность возникает в более короткие сроки от момента начала патологии. Кроме того, пациенты почти не реагируют на прием лекарств, что сокращает продолжительность жизни. Как же отличить эти состояния, есть ли современные диагностические тесты?
Болезнь Паркинсона или синдром паркинсонизма?
Люди, которым выставляется диагноз болезни Паркинсона, требуют постоянного наблюдения и лечения, чтобы отсрочить наступление инвалидности и продлить жизнь. Без приема особых лекарств и постоянного наблюдения изменения в головном мозге могут прогрессировать относительно быстро, приводя к полной беспомощности и гибели пациента. Но, помимо самой болезни Паркинсона, первичного, самостоятельного заболевания, специалисты выделяют и синдром паркинсонизма — это вторичные изменения мозга и всей нервной системы. Вторичный паркинсонизм возникает как один из синдромов на фоне определенных патологий (сосудистых поражений, приема лекарств, гипоксии, токсических влияний на мозг). На долю первичной болезни приходится более 63%, оставшаяся часть — это пациенты с паркинсонизмом. Но у около четверти людей с этими расстройствами неправильно диагностируется болезнь Паркинсона, и их прогноз обычно хуже, он характеризуется быстрым ухудшением и сокращением продолжительности жизни.
Изменения мозга при этих патологиях
Болезнь Паркинсона и паркинсонизм связаны с потерей нейронов, которые синтезируют дофамин, в области черной субстанции и других отделов. На фоне этих изменений и дефицита дофамина активируется область базальных ганглиев, которая руководит активностью коры мозга. Однако, если болезнь Паркинсона прогрессирует медленно и мозг длительное время работает вполне адекватно, то при паркинсонизме потеря нейронов достаточно быстрая и выраженная и имеет более серьезные последствия, в том числе и для других частей мозга.
Для многих из этих вторичных расстройств средняя продолжительность жизни составляет от 5 до 10 лет. Инвалидность наступает быстрее. К сожалению, на сегодняшний день нет каких-либо тестов или инструментальных исследований, которые бы помогли различать эти два состояния. Хотя исследования ведутся, но пока они еще далеки от внедрения в клиническую практику, поэтому оценивать, как с течением времени изменяется мозг при болезни Паркинсона или вторичном паркинсонизме, приходится по большей части за счет косвенных признаков.
Признаки болезни и синдрома
Маскообразное лицо, тремор конечностей и замедленные движения считаются ключевыми признаками болезни, кроме отдельных случаев, когда определяются не все из симптомов или есть дополнительные проявления. Сложности возникают с определением паркинсонизма, нередко проходят годы, прежде чем ставится правильный диагноз, и это обычно происходит после того, как лекарства, используемые для лечения болезни Паркинсона, не дали эффекта.
По словам специалистов, у настоящей болезни есть четыре кардинальных особенности:
- Тремор покоя (который исчезает при движении),
- Ригидность,
- Замедленные движения,
- Аномальная походка.
Если какие-либо проявления не укладываются в картину болезни, важно проводить дополнительные исследования, подозревая именно паркинсонизм.
Если лекарства не работают?
Эксперты говорят, что если пациенты не реагируют на классические лекарства, это ключевой момент для того, чтобы исключить любые другие расстройства, которые могут приводить к симптомам паркинсонизма. Зачастую не все неврологи умеют диагностировать именно вторичный паркинсонизм и выставляют неправильный диагноз болезни, назначают лекарства, которые пациент принимает много месяцев, не получая в итоге облегчения, и тратя драгоценное время, необходимое для лечения иной причины расстройств. Если вовремя не начать лечение вторичного паркинсонизма, пациенту грозит инвалидность в ближайшие 4-5 лет.
Паркинсонизм: что может приводить к инвалидности?
Самым известным фактором, который может без полноценного лечения быстро приводить к инвалидности, является сосудистый паркинсонизм. Основу патологии составляет образование в мелких сосудах мозга тромбов, приводящих к микроинсультам.
Другие причины включают в себя:
- Болезнь Леви
Она характеризуется ранним началом деменции и когнитивной дисфункции. У людей также могут быть галлюцинации, что затрудняет лечение, поскольку антипсихотические лекарства, используемые для лечения галлюцинаций, могут ухудшить другие симптомы паркинсонизма. При этой патологии рано наступает инвалидность, пациенты требуют особого ухода.
- Прогрессирующий надъядерный паралич
При нем пациенты рано приобретают деменцию, проблемы с движением глаз и склонность к падениям. У них нет тремора покоя, типичного для пациентов с болезнью Паркинсона, но они имеют скованность и медлительность и не реагируют на заместительную терапию дофамином.
- Кортикобазальная дегенерация
Это одно из самых редких состояний с симптомами паркинсонизма — пациенты обычно теряют функцию только с одной стороны тела, может развиться синдром «чужой конечности», при котором рука или нога производят не контролируемые мозгом действия. У пациентов также могут развиться проблемы с речью и резкие движения тела. Состояние относительно быстро приводит к инвалидности, возникают сложности в лечении.
- Лекарственный паркинсонизм
Некоторые лекарства, а именно антипсихотические, препараты от тошноты и некоторые противосудорожные средства могут вызывать паркинсонизм. Большинство симптомов паркинсонизма исчезают после того, как люди перестают принимать эти лекарства.
- Множественная системная (мультисистемная) атрофия
Люди с этим заболеванием испытывают проблемы с координацией. У них могут быть проблемы с опорожнением кишечника и мочевого пузыря, ортостатическая гипотензия с обмороками. У мужчин может развиться эректильная дисфункция, а у женщин — задержка мочи.
Клиническая неврология / Никифоров А.С., Гусев Е.И. – 2007
Наследственные основы болезни Паркинсона / Пчелина С.Н., Якимовский А.Ф., Шварц Е.И. // Медицинская генетика – 2003 – Т. 2 №9