Как часто женщине нужно проверяться на рак груди?
Здесь нет однозначного ответа. Никто точно не скажет, как часто молодой здоровой женщине до 40 лет нужно ходить к врачу. Когда врач сидит на 10-минутном приеме, ему легче сказать: «Приходите раз в год. Все, до свидания, следующий, заходите». У меня прием длится полчаса, и я специально оставляю хотя бы пять минут в конце, чтобы объяснить, что нет универсальных рекомендаций. Нужно уделять внимание своей груди, осматривать ее, но как часто это делать — тоже никто не знает. Самообследование не приводит к снижению смертности от болезни, но при этом каждую четвертую опухоль женщины находят сами. На сегодня мы еще не изобрели таких диагностических методов, которые нам до биопсии скажут: с грудью все ок или не ок.
После 40 лет все более-менее понятно: с этого возраста риск заболеть раком молочной железы достоверно увеличивается. Одни медицинские организации говорят, что скрининг (Обследование здоровых людей с целью выявить у них заболевание, которое пока никак себя не проявляет. — Прим. ред.) пора делать с 40 лет, другие — с 45 лет. Частота обследований тоже отличается. Рекомендации немного расходятся в зависимости от системы здравоохранения. В Америке есть как минимум две организации, которые занимаются разработкой программы скрининга: Рабочая группа по профилактике заболеваний (USPSTF) и Американское онкологическое общество. У них разные рекомендации, потому что в некоторых штатах преобладает афроамериканское население, которое болеет тяжелее. В Великобритании проверяют с 50 лет раз в три года.
Сам скрининг проводят до 75 лет, это связано с продолжительностью жизни. Нет смысла проводить скрининговое обследование, если ожидаемая продолжительность жизни менее 10 лет. Потому что, скорее всего, то, что мы обнаружим, не сократит жизнь этого человека, а медицинской системе обойдется дорого.
В России насчет скринингов все говорят разное. Например, некоторые гинекологи считают, что после 40 лет маммографию нужно делать ежегодно или хотя бы раз в два года, а после 50 лет — ежегодно. Но на самом деле мы не знаем, как часто нужно проходить маммографию. Поэтому пропагандировать, что это надо делать раз в год, без объяснения того, что это за исследование и что делать с его результатами, — неправильно.
И каждый раз думаю: боже, сколько неправильных действий могут повлечь за собой какие-либо рекомендации. Из-за этого я завела свой блог. Мне кажется, что основная проблема не в том, делаем мы маммографию или не делаем, а в том, что мы не общаемся с пациентами. У меня много пациенток, которые приходят с болью или находят у себя уплотнение, и тогда мы с ними прицельно разбираемся, что боль в молочной железе — это не спутник онкологического заболевания, что уплотнение — это просто локальный фиброаденоматоз, так ведет себя железистая ткань. Мы можем сходить с пациенткой на УЗИ и уточнить это или понаблюдать динамику.
Рекомендации — это такая штука, которая нас может поддержать. Но принимаем решение мы сами: врач и пациент. У меня была молодая пациентка, которая прошла химиотерапию, операцию и была вынуждена принимать препарат, вызывающий искусственную менопаузу. В какой-то момент она сказала, что больше не может, мы обсудили все риски и приняли решение отказаться от лекарства, тем самым повысив вероятность рецидива. Но это было общее решение. Без желания пациента его лечить никто не будет.
Кому-то дают странную рекомендацию ходить каждые полгода на УЗИ. Вот пациентка ходит, делает очередное УЗИ, ей говорят, что все нормально, проходит два месяца, и она приходит ко мне с шишкой. А там рак. И она сидит в слезах на приеме: «Я ходила каждые полгода, потому что мне так сказали». Скрининг направлен на то, чтобы поймать рак, когда еще нет симптомов. Но не всех можно поймать.
Есть такая фраза, что мы скринингом пытаемся поймать «орлов» и «зайцев» — это быстрые, стремительные, очень внезапные раки, а ловим «черепашек», потому что они ползут-ползут и вот в какой-то момент мы находим их на маммографии.
«Черепашек» нужно лечить или можно их не трогать?
«Черепашки» — это не камни, которые не двигаются. Они все равно прогрессируют. Мы никогда не узнаем, как они себя поведут, потому что неэтично не лечить рак. Нет критериев, которые бы сказали, можно злокачественную опухоль наблюдать или ее нужно сразу же лечить. Вот есть карцинома in situ, это неинвазивный рак. После того, как его обнаружили, у женщины в восемь раз увеличивается риск инвазивного рака.
Инвазивный рак — один из основных раков молочной железы, это порядка 70% случаев. Пока опухоль внутри молочного протока — это нулевая стадия рака, он не может метастазировать. Инвазивный рак — это уже опухоль, которая вышла за пределы протока и у нее появляется шанс дать метастазы. И вот, казалось бы, что карциномы in situ можно наблюдать без вмешательства, но нет, потому что они могут развиваться в инвазивную опухоль.
А вот дольковая карцинома in situ не является злокачественной опухолью. Это стало понятно совсем недавно — в 2017 году, до этого к ней относились так же, как к внутрипротоковой карциноме. А теперь стало понятно, что она доброкачественная и ее не нужно оперировать. На сегодня нет таких форм рака молочной железы, которые этично наблюдать, в отличие например от некоторых видов рака предстательной железы.
Как врач определяет, рак перед ним или не рак?
В тот момент, когда мы ловим что-то в груди, мы не знаем, что это. Это кот в мешке. Биопсия все решает, и без нее лечение от рака никто не начнет. Даже пункция (Подвид биопсии, когда берут взвесь клеток, а не кусочек ткани. — Прим. ред.) не является основанием для лечения.
Решение о том, проводить биопсию или нет, принимают согласно критериям BI-RADS — Breast Imaging Reporting and Data System. Это шкала от нуля до шести, по которой рентгенолог ставит балл на основании маммографии, УЗИ или МРТ. BI-RADS 0 означает, что нужен дополнительный анализ, BI-RADS 2 — что опухоль доброкачественная, BI-RADS 4 — что есть подозрение на рак. С этим результатом пациентка приходит к онкологу или клиническому рентгенологу, и он принимает решение, делать биопсию или нет.
Рентгенолог может поставить BI-RADS 3. Это меньше 2% вероятности того, что есть рак молочной железы. Если BI-RADS больше, то нужно будет принять решение о биопсии, но образование совершенно не обязательно окажется раком. На биопсии рак уже нельзя перепутать с чем-то. Если это опухоль, это опухоль.
Если посмотреть на графики заболеваемости раком груди и смертности от него в России, видно, что заболеваемость растет, а смертность нет. Как это можно объяснить, по-вашему?
Это реально так. Проблема в том, что мы не можем понять достоверно: это потому, что мы делаем скрининг и лечим лучше, чем раньше, или только потому, что просто лечим лучше? Прерывать то или другое для того, чтобы выяснить причину, — неэтично, потому что от рака умирают.
Основной плюс маммографии не только в том, чтобы держать смертность под контролем. Маммография сильно влияет на объем лечения. Когда мы обнаруживаем опухоль на первой стадии, без симптомов, у нас есть возможность пролечить минимально: прооперировать и назначить профилактические таблетки. Когда этот же рак доходит до стадии клинических симптомов, мы уже не можем только этим обойтись. Тогда мы должны прооперировать еще подмышку, что увеличивает риски лимфатического отека, провести химиотерапию, которая снижает качество жизни, и так далее.
Может ли врач пропустить рак?
Конечно, это огромная проблема. В трети случаев рак может быть не найден при маммографии. Есть, во-первых, рентгенонегативные раки, которые на рентгене не видны. Именно поэтому очень важно сначала осмотреть пациента, а потом назначать исследования. А то может прийти 45-летняя женщина на маммографию, и ей напишут по результатам снимка: все ок. И она думает: ага, значит, эта шишечка — ничего страшного.
Да, бывает, что доктор ошибается, считает, что в анализах нет ничего страшного и не надо делать биопсию, или получает неинформативную биопсию и назначает какую-нибудь травку, просто чтобы пациента не оставлять без наблюдения. Хорошо, если пациент придет на следующее обследование пораньше.
А может врач, наоборот, перестраховаться там, где не надо?
У меня сейчас наблюдается пациентка. Что-то ее забеспокоило, закололо, и она пришла. Ей сделали маммографию, рентгенолог написал, что все нормально, а я вижу на снимке скопление кальцинатов (солей кальция) и тень в этом месте. То есть то ли он не видел, то ли он просто копипаст сделал, не понятно. И вот здесь начинаются минусы гипердиагностики.
Я говорю: «Вы знаете, тут что-то подозрительное, надо идти и делать не скрининговую маммографию, а прицельную, на которой сомнительное место фотографируют при увеличении». Естественно, пациентка волнуется. Она записывается на процедуру, ждет. По результатам снимка ей пишут BI-RADS 4, то есть нужно делать биопсию. Я тоже нервничаю, потому что недавно в том же самом месте писали, что все нормально, BI-RADS 2, а теперь когда я отправила эту пациентку досмотреть, пишут 4.
Потом мы идем на УЗИ, там ничего нет. Она записывается на МРТ — опять ожидание, ведь МРТ делают в определенный день цикла, а он у нее скачет. Она получает результат МРТ, там все нормально, но я прошу коллегу пересмотреть.
Мультимодальных диагностов молочной железы, которые владеют всеми методами диагностики, у нас в стране немного. Мне говорят: «Тут ничего нет, это нормальные кальцинаты, не подозрительные. Понятно, почему они тебя заинтересовали, но на прицельном снимке все ок». Я отвечаю: «Но рентгенологи BI-RADS 4 ставят, что они там видят-то?» Пациентка все это время была как на пороховой бочке.
Вот что происходит из-за гипердиагностики. Биопсию ей мы делать не стали. Но через полгода все нужно повторять, потому что я не могу отпустить ее на два года до следующего осмотра.
Это проблема интерпретации снимков?
Да, это проблема чтения снимков. Не знаю, может, я запустила эту волну и коллеги напугались, может, смотрел кто-то не совсем опытный. Проблема в том, что у нас нет метода диагностики до биопсии, который отвечает на вопрос: да-да, нет-нет.
В скандинавских странах одна из образцовых систем скрининга: там сидят два опытных рентгенолога и отсматривают снимки. Если их мнение совпадает, пациентке выдают диагноз. А если у них мнение не совпадает, то с ними проводят работу над ошибками. А у нас на скрининге, наоборот, сидят люди, которые вчера выпустились, потому что опытным интереснее где-нибудь еще.
Маммограмму еще нужно качественно отснять. Даже с прицельной маммограммой можно ошибиться. Но, каким бы ни было качество снимка, если человек не умеет интерпретировать, у него недостаточно опыта или он перестраховывается — от ошибок не уйти.
Еще надо понимать, что у одного доктора может быть этих маммограмм тридцать штук за день. Это же нереально. Человек может принять до семи, максимум девяти взвешенных решений, если он себя круто прокачал. А у нас люди продолжают сидеть, принимать по тридцать человек и отсматривать по тридцать снимков.
Какие еще есть минусы у гипердиагностики помимо лишних обследований и волнений?
Человек может проходить ненужную биопсию, ведь кто-то сделал бы биопсию в случае с моей пациенткой, о котором я рассказывала выше. Рентгенолог же поставил BI-RADS 4. Каждый рентгенолог может ошибиться, не только неграмотный или тот, который перестраховался.
Бывают более неоднозначные случаи. У меня была пациентка из государственной поликлиники, которая пришла с заключением BI-RADS 4 с обеих сторон груди. Я смотрю ее на УЗИ — там ничего. Смотрю маммограмму — ну да, есть скопление кальцинатов, но даже я вижу, что ничего страшного, хотя я не рентгенолог.
Ей вполне могли сделать биопсию, лечить бы не лечили, но понервничать заставили. Гипердиагностика неприятна именно из-за ненужных процедур, ненужных биопсий и больших переживаний по этому поводу.
Еще есть проблема в том, что в некоторых клиниках просто так назначают обследования. До «Чайки» я работала в клинике, где после каждого пациента меня вызывали на ковер и спрашивали: «Почему вы не назначили пациентке анализ крови, мочи, кала, где УЗИ?» Я говорю: «Без симптомов УЗИ делать не надо». А они ссылаются на рекомендации акушеров-гинекологов, на внутренние протоколы, которых никто никогда не видел. Онкомаркеры — это вообще любимейшая тема. «Почему вы ей не назначили онкомаркеры?» — говорят. Потому что их никому не надо назначать.
Так что я представляю себе этот кошмар, с которым пациентки могут встретиться. Поэтому лучше идти в клинику и к врачу, которому доверяешь
Быстрая и надежная диагностика злокачественных новообразований — одна из основных задач современной онкологии. На поздней стадии многие опухоли выявляются достаточно просто, но прогноз в этом случае чаще всего оказывается неблагоприятным. Основные трудности для диагностики представляют именно ранние или редкие формы онкологических заболеваний, при которых симптомы еще отсутствуют, а опухоль при этом активно растет и метастазирует.
Вне зависимости от того, на какой стадии заболевания врачам удалось установить диагноз, известие о наличии онкологического заболевания, как правило, оказывается шоком для самого пациента и его близких.
Чтобы сократить время, необходимое для назначения оптимального лечения (а значит, в конечном счете, улучшить прогноз), следует убедиться в том, что лечащий врач достаточно компетентен и способен в сжатые сроки определить необходимый объем диагностических исследований.
Насторожиться следует в случаях, когда врач не может однозначно и просто описать имеющуюся проблему и предлагает, например, провести хирургическую операцию для диагностики или, напротив, предлагает лечение без обследования, не объясняя, какими средствами и с какой целью будет проводиться терапия.
В этих случаях рекомендуется обратиться к другому онкологу для уточнения диагноза и получения так называемого «второго мнения». В распоряжении врачей, работающих в современных клиниках, сегодня имеется широкий арсенал средств для диагностики и лечения онкологических заболеваний, важно лишь правильно выбрать место лечения и доктора, который обладает достаточной квалификацией для того, чтобы разобраться в проблемах конкретного пациента.
Также следует отметить, что лечение в специализированных медицинских центрах, работающих по самым современным протоколам, может оказаться более эффективным, нежели терапия по месту жительства, поскольку выбор препаратов для химиотерапии (равно как и других методов лечения) в таких клиниках, как правило, существенно шире.
Подозрение на рак — обследование
Для обследования пациента с подозрением на онкологическое заболевание или больного, диагноз которого уже установлен, но вызывает сомнения, могут применяться различные методы лабораторной и инструментальной диагностики.
Лабораторные общеклинические анализы показывают в основном неспецифические изменения. Особенно важны в онкологической практике показатели периферической крови и костного мозга, а именно — эритропоэз и изменения лейкоцитарной формулы. До 70–80% случаев рака сопровождаются гипохромной анемией с изменением формы и размеров эритроцитов. Количество лейкоцитов и степень их зрелости при разных заболеваниях значительно варьируют — от лейкопении до лейкоцитоза.
Рентгенодиагностика занимает одно из ведущих мест в онкологии, ее методы постоянно совершенствуются. Компьютерная, магнитно-резонансная томография и исследования с контрастом позволяют обнаружить опухоль и метастазы даже при небольших размерах.
Благодаря эндоскопическим методам можно провести детальный осмотр новообразования в полостях и полых органах, а также взять кусочек ткани на биопсию.
УЗИ чаще всего применяют в диагностике опухолей щитовидной и молочной желез, малого таза, брюшной полости и забрюшинного пространства, мягких тканей, лимфатических узлов. Это доступный и простой метод, чувствительность которого может достигать 90%. Под контролем УЗИ проводят аспирационную биопсию опухолей.
Гистологическое и цитологическое исследования позволяют установить морфологический диагноз, степень злокачественности процесса и выбрать подходящую тактику ведения пациентов. Без них в онкологии невозможно установить окончательный диагноз. Для обнаружения атипичных клеток на гистологический анализ берут кусочек ткани, полученный при биопсии или в ходе операции. Для цитологического исследования используется клеточный материал. На цитологии под микроскопом с высокой разрешающей способностью исследуют материал, полученный путем аспирации или отслаивания (эксфолиации) клеток. Его специально концентрируют, чтобы увеличить количество клеток в объеме материала. Его фиксируют, окрашивают и изучают под микроскопом на предмет атипичных клеток. Это позволяет провести дифференциальную диагностику между злокачественными и доброкачественными опухолями.
Уточняющие методы обследования
Существует ряд обследований, которые помогают уточнить онкологический диагноз в сомнительных случаях.
Иммунодиагностика позволяет обнаружить антигены опухолевых клеток, которые отличаются от нормальных клеточных антигенов. Кровь и моча пациента содержат опухолевые маркеры, их выявляют при помощи реагентов, содержащих специальные антитела, при реакции ИФА. Наибольшую практическую ценность имеют такие антигены, как α-фетопротеин, PSA, СА-125, раково-эмбриональный антиген, хорионический гонадотропин, трофобластический В-глобулин.
Уточняющие онкологический диагноз обследования чаще всего сложные и дорогостоящие, поэтому не применяются массово в качестве скрининга. Но они обладают высокой точностью и в спорных ситуациях помогают врачу поставить верный диагноз. Уточняющая диагностика необходима не для удовлетворения академического интереса лечебного учреждения или врача, она призвана разрешить серьёзные сомнения в диагнозе, которые не отмели традиционные и не столь дорогие исследования. Возможно, с её помощью удастся разрешить вопрос «рак или не рак» или подобрать лучшее – оптимальное лечение опухоли. В любом случае эти исследования – крайняя необходимость, без которой невозможно решить важнейший для жизни вопрос, и тогда цена процедуры – вопрос совсем не главный.
Важен комплексный подход к диагностике, когда на начальном этапе выполняется стандартное и утверждённое клиническими рекомендациями обследование, а далее, по мере необходимости – крайней диагностической необходимости, поэтапно проводятся дополнительные исследования. Не все сразу, а только после тщательного анализа информативности предыдущего этапа. Перед каждым обследованием врач должен рассказать, на какие важные для пациента вопросы он надеется получить ответ, какие варианты ответов возможны, какие трактовки результатов удовлетворят его и помогут пациенту скорее начать лечение.
Можно назначать всё известное науке, используя всю установленную в медицинском центре аппаратуру, но также можно делать только необходимое, в оптимальном объёме и в разумные сроки. Стоимость процедур очень важна, но не важнее жизни. Наша клиника может предложить оптимальный подход во всём – и в диагностике, и в лечении, тем более что у нас есть всё, что позволит сделать это быстро и очень качественно.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Третьякова Ю.И.
1
Патрикеева М.С.
1
Меньшикова Н.С.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. ак. Е.А. Вагнера Минздрава России
В статье представлен клинический случай с описанием пациента 28 лет с агрессивным течением перстневидно-клеточного рака желудка, диагностированного на последней стадии. Из анамнеза известно, что в течение 2,5 месяцев больной наблюдался с диагнозом «гастропатия, индуцированная нестероидными противовоспалительными препаратами (НПВП), с назначением ингибиторов протонной помпы». В связи с ухудшением состояния и неэффективностью терапии пациент был госпитализирован в гастроэнтерологическое отделение клиники. На рентгенографии желудка были выявлены признаки инфильтративных изменений стенок желудка и канцероматоз брюшины. По данным фиброгастроскопии — слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации. По результатам патогистологического исследования выявлен недифференцированный аденогенный рак с образованием перстневидных клеток. Больному проведен один курс полихимиотерапии в краевом онкодиспансере без положительного эффекта. Пациент скончался в связи с прогрессированием основного заболевания и развитием полиорганной недостаточности. Был поставлен заключительный патологоанатомический диагноз: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b. В заключение статьи даны рекомендации по мерам профилактики онкологических заболеваний.
клинический случай
рак желудка
поздняя диагностика
перстневидно-клеточный рак
онкология.
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
2. Абдуллаев А.Г., Аллахвердиев А.К., Бесова Н.С., Бяхов М.Ю., Горбунова В.А., Давыдов М.И., Давыдов М.М., Ибраев М.А., Карселадзе А.И., Кувшинов Ю.П., Малихова О.А., Неред С.Н., Стилиди И.С., Трякин А.А. Клинические рекомендации по диагностике и лечению больных раком желудка. Ассоциация онкологов России, 2017. 40 с.
3. Денисов И.Н., Артемьева Е.Г., Маленкова В.Ю., Бусалаева Е.И. Рак желудка. Руководство для врачей общей практики (семейных врачей). Ассоциации врачей общей практики РФ, 2015. 14 с.
4. Белковец А.В., Курилович С.А., Решетников О.В. Наследственный рак желудка (научный обзор) // Международный журнал прикладных и фундаментальных исследований. 2016. № 1-4. С. 516-522.
5. Джемал А., Паоло В., Брей Ф., Торре Л., Форман Д. Атлас современной онкологии. Издание второе. Американское онкологическое общество, 250 Williams Street, Atlanta, Georgia 30303 USA (США), 2014. 136 с.
6. Бойкова С.П., Зайратьянц О.В., Зотова Л.А. Патологическая анатомия: атлас: учеб. пособие для студентов медицинских вузов и последипломного образования. М.: «ГЭОТАР-Медиа», 2014. 961 с.
7. Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В. Рак желудка у пациента 16 лет: описание клинического случая // Онкопедиатрия. 2017. Т. 2. №4. С.147–151.
8. Вашакмадзе Л.А., Филоненко Е.В., Бутенко А.В., Кириллов Н.В., Хомяков В.М. Отдаленные результаты хирургического лечения больных местнораспространенным и диссеминированным раком желудка в сочетании с интраоперационной фотодинамической терапией. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 1. №2. С.3-10.
9. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 236 с.
10. Бойцов С.А., Чучалин А.Г., Арутюнов В.Г. Биличенко Т.Н., Бубнова М.Г., Ипатов П.В., Калинина А.М., Карпин А.Д., Марцевич С.Ю., Оганов Р.Г., Погосова Н.В., Старинский В.В., Стаховская Л.В., Ткачева О.Н., Чиссов В.И., Шальнова С.А., Шестакова М.В. Профилактика хронических неинфекционных заболеваний. Клинические рекомендации. Москва. 2013. 136 с.
Смертность от онкологических заболеваний занимает второе место после болезней сердечно-сосудистой системы. В 2017 г. в России выявлено почти 541 тыс. онкобольных, а умерло 290,7 тыс., что составило 15,9% в общей структуре смертности [1, с. 3].
В последние годы отмечается тенденция к снижению заболеваемости раком желудка (РЖ), тем не менее в структуре заболеваемости злокачественными новообразованиями населения России РЖ занимает 4-е место у мужчин (7,6%) и 5-е место у женщин (4,7%) [1, с. 9, 10]. Пик заболеваемости приходится на возраст старше 50 лет. Злокачественные новообразования желудка занимают вторую позицию в структуре смертности у мужчин и женщин. Ежегодно в РФ регистрируют около 36 тыс. новых случаев РЖ, и более 34 тыс. больных умирает от этого заболевания. Этиология заболевания до конца не выяснена [2, с. 6].
Имеется связь возникновения патологии с определенными факторами риска. Их можно разделить на немодифицируемые: пол (мужчины страдают чаще), возраст (по мере увеличения возраста увеличивается частота возникновения РЖ), генетическая предрасположенность (5–10% пациентов, страдающих РЖ, имеют отягощенный семейный анамнез); и модифицируемые: инфекция Helicobacter Pylori (HP), характер рациона, ожирение, курение, алкоголь, профессиональная деятельности [3, с. 4-6].
В настоящее время установлено, что почти 90% случаев РЖ в мире обусловлено инфицированием бактерией HP. При этом средства лечения HP-инфекции существуют, но широко не применяются из-за недостатка подтвержденных данных эффективности в профилактике рака желудка и высокой стоимости [5, с. 22]. К возникновению РЖ могут привести фоновые заболевания: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие [2, с. 6]. Различают три гистологических типа РЖ (по Lauren, 1965 г.): кишечный, диффузный, смешанный. При диффузном раке опухоль представлена слабоорганизованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки). Для данного типа характерен диффузный инфильтративный рост [2, с. 7].
Перстневидно-клеточный рак желудка содержит не менее половины клеток с признаками внутриклеточного образования слизи. Скапливающаяся в цитоплазме слизь сдвигает ядро к периферии, и клетка приобретает сходство с перстнем [6, с. 589]. Согласно результатам клинических наблюдений неблагоприятный прогноз при диффузном раке желудка связывают с низкой выявляемостью на ранних стадиях, быстрым течением, более злокачественным потенциалом опухолевых клеток и ранним метастазированием [7].
Приводим случай летального исхода пациента с перстневидно-клеточным раком желудка, диагностированным на последней стадии.
Клиническое наблюдение. Пациент В., 28 лет, поступил в гастроэнтерологическое отделение клинической медико-санитарной части г. Перми 14.11.2017 г. с жалобами на постоянные боли в области правого фланка живота, преимущественно в нижней части; интенсивные боли в правом подреберье и правом боку при глубоком дыхании; тошноту, рвоту желчью, вздутие живота, Также пациента беспокоили отсутствие аппетита, отвращение к пище, жидкий стул 2–3 раза в сутки без примесей. Отмечались выраженная общая слабость, повышение температуры тела до 37,4°С. За 1 месяц больной похудел на 13 кг.
Анамнез. В начале сентября 2017 г. больной получал терапию антибактериальными и нестероидными противовоспалительными препаратами (НПВП) по назначению стоматолога (после экстракции зуба) в течение 7 дней. В начале октября 2017 г. были вновь назначены антибактериальная терапия и НПВП по поводу гайморита. На фоне приема препаратов появились боли в эпигастрии, изжога, неустойчивый стул. Больной обратился в поликлинику по месту жительства, где обследовался у участкового терапевта. 7 октября 2017 г. выполнена фиброгастродуоденоскопия (ФГДС), на которой выявлены множественные язвы желудка (6 дефектов), язва двенадцатиперстной кишки (ДПК) в стадии эпителизации, застойная гастропатия, дуоденогастральный рефлюкс. Уровень антител к HP составил 1,44. Получал терапию ингибиторами протонной помпы (ИПП), антацидами без эффекта – сохранялись тошнота и абдоминальный болевой синдром с локализацией в эпигастрии.
Участковым терапевтом дано направление на экстренную госпитализацию в терапевтическое отделение городской больницы с диагнозом: Множественные язвы желудка и язва луковицы ДПК, ассоциированные с HP. Гастринома? Синдром Золлингера–Эллиссона?, где больной находился с 12.10.2017 г. по 24.10.17 г. При обследовании в общем анализе крови (ОАК) от 13.10.2017 г.: гемоглобин – 157 г/л; умеренное повышение лейкоцитов до 11х109/л; ускоренная скорость оседания эритроцитов (СОЭ) – 40 мм/час. В биохимическом анализе крови от 13.10.2017 г. общий белок, амилаза, холестерин, печеночные тесты, электролиты крови в пределах нормальных значений. На ультразвуковом исследовании органов брюшной полости (УЗИ) от 13.10.2017 г. выявлены признаки диффузных изменений видимых участков поджелудочной железы. Кал на скрытую кровь – слабоположительный.
23.10.2017 г. выполнена повторная ФГДС: слизистая желудка диффузно гиперемирована с выраженным отеком, утолщена, сосудистый рисунок смазан. Слизистая оболочка в области привратника отечна, гиперемирована. По всем стенкам множественные точечные лимфоидные высыпания. Заключение: Диффузный катаральный гастрит выраженной степени активности. Дуоденогастральный рефлюкс. Диффузный катаральный бульбит выраженной степени активности. Косвенные признаки панкреатита. Гистологическое исследование не проводилось.
В стационаре по результатам обследований был поставлен диагноз: Язвенная болезнь желудка, луковицы ДПК. Множественные острые язвы желудка в активной стадии. НПВП-ассоциированная гастропатия. Язва луковицы ДПК в стадии эпителизации. Больной получал терапию спазмолитиками, ИПП 40 мг в сутки, антацидами.
На фоне лечения отмечалась положительная клиническая и эндоскопическая динамика в виде уменьшения болевого синдрома и эпителизации язвенных дефектов. Пациент был выписан из стационара с рекомендациями продолжить прием ИПП в дозе 40 мг в сутки и явиться на прием к участковому терапевту.
После выписки боли в эпигастрии усилились, появилась острая боль справа в боку в области ребер. Участковый терапевт назначил прием прокинетика, антацидных препаратов, НПВП внутримышечно (в/м) № 3. 4.11.2017 г. у пациента внезапно возникла острая боль в области верхнего левого фланка живота и межреберьях, связанная с дыханием. Больной обратился в приемное отделение клинической больницы, где был поставлен диагноз: Межреберная невралгия. Проведена терапия НПВП в/м, и больной был отпущен домой под наблюдение невролога и терапевта с рекомендациями приема НПВП. Далее по назначению гастроэнтеролога поликлиники принимал висмута трикалия дицитрат, спазмолитики, даларгин без эффекта – сохранялись абдоминальный болевой синдром, неустойчивый стул; также появились выраженное вздутие живота, рвота, отвращение к пище, прогрессирующее похудание. 13.11.2017 г. выполнена ректороманоскопия: стенка прямой кишки с трудом расправлялась воздухом, с эрозиями, утолщенными складками, сосудистый рисунок смазан. Заключение: эрозивно-катаральный проктосигмоидит.
14.11.2017 г. пациент был экстренно госпитализирован в гастроэнтерологическое отделение клиники для дальнейшего обследования и лечения.
Из анамнеза жизни известно, что пациент рос и развивался соответственно возрасту. Курил в течение 8 лет по 10 сигарет в день. Профессиональных вредностей не было. Со слов больного, ранее лечился по поводу мочекаменной болезни. Наследственность по заболеваниям органов пищеварения не отягощена.
При физическом исследовании обращала на себя внимание бледность кожных покровов с сероватым оттенком. Кожа чистая, отеков не отмечалось. Пульс – 92 удара в минуту, ритмичный. Тоны сердца ясные, ритм правильный. Дополнительные шумы не выслушивались. Дыхание везикулярное, ослаблено в нижних отделах, хрипы не выслушивались. Перкуторный звук несколько притуплен в нижних отделах легких. ЧДД – 16 в минуту.
Язык обложен бело-желтым налетом у корня, влажный. Живот плотный, увеличен за счет вздутия и асцита; пальпация резко болезненная в эпигастрии, в области правого фланка живота, по ходу толстой кишки. Ординаты Курлова 10х8х7 см. Стул оформленный, чередующийся с кашицеобразным, без патологических примесей, 1–2 раза в сутки. Со стороны почек и мочевого пузыря без видимой патологии.
Результаты лабораторно-инструментальных исследований представлены ниже.
ОАК: эритроциты 4,7х109/л, гемоглобин 140 г/л, среднее содержание гемоглобина (ССГ) 29%, тромбоциты 307х109/л, лейкоциты 8,4х/л, палочкоядерные нейтрофилы 7%, сегментоядерные нейтрофилы 75%, лимфоциты 15%, моноциты 3%, повышение СОЭ до 43 мм/час.
ОАМ: цвет – желтый, мутная, pH 6,0, умеренная протеинурия 0,39 г/л, лейкоциты 4–6 в поле зрения (п/з), эритроциты 0–1 в п/з, эпителий 2–3 в п/з, слизь +.
Биохимический анализ крови от 15.11.2017 г.: глюкоза 4,8 ммоль/л, Ca 2,29 ммоль/л, AСТ/АЛТ 16/18 Ед/л, ГГТП 84 Ед/л, ЩФ 285 Ед/л, общий белок 54 г/л, альбумины 27 г/л, билирубин общий 12 мкмоль/л, прямой 4,1 мкмоль/л, холестерин общий 3,7 мкмоль/л, калий 4,5 ммоль/л, натрий 134 ммоль/л, креатинин 51 ммоль/л, резкое повышение С-реактивного белка (СРБ) 105 мг/л, снижение железа сыворотки до 4,5 мкмоль/л, повышение общей железосвязывающей способности сыворотки до 75, незначительное повышение прокальцитонина до 0,2 нг/мл. При форезе белков выявлены снижение альбумина до 37,95% и повышение α1-глобулинов до 8,77%, α2-глобулинов до 13,28%, β-глобулинов до 18,5 3%, γ-глобулин 21,47%.
Коагулограмма от 15.11.2017 г.: протромбиновое время 14,9 секунд (11–15 секунд), тромбиновое время – 17,2 секунд, активированное частичное протромбиновое время – 28 секунд (24–35 секунд), резкое повышение фибриногена до 9,56 г/л.
Копрограмма от 16.11.2017 г.: консистенция жидкая, цвет темно-коричневый, переваренные мышечные волокна 0–1–2 в п/з, неизмененные мышечные волокна 0–1 в п/з, форменные элементы крови 0–1 в п/з, лейкоциты 10–20 в п/з, эпителий плоский – единичный в п/з, нейтральных жиров нет, жирных кислот нет, крахмал внеклеточно скудно, йодная флора +, детрит +++.
ФГДС от 14.11.2017 г.: складки желудка гипертрофированные, отечные. Слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации, ранимая при контакте с линейными рубцами неправильной формы. Луковица ДПК деформирована, рыхлая с увеличенными эрозированными фолликулами, на верхушках – фибрин. Заключение: Болезнь Крона? Дуоденогастральный рефлюкс. Косвенные признаки панкреатита. Выполнена биопсия.
Результаты патогистологического исследования слизистой желудка (20.11.2017 г.): в слизистой оболочке пилородуоденальной области очаговое скопление крупных клеток округлой и овальной формы, со светлой слизьсодержащей цитоплазмой, периферически расположенными уплощенными ядрами, единичные клетки с гиперхромными ядрами, скудной цитоплазмой. Диагноз: недифференцированный аденогенный рак с образованием перстневидных клеток.
16.11.2017 г. выполнена КТ органов брюшной полости. Выявлен выпот в реберно-диафрагмальные синусы с обеих сторон. Желудок в области тела и антрального отдела с неравномерно утолщенными стенками до 0,8 см. Большой сальник в области эпигастрия уплотнен, с узловыми образованиями. В брюшной полости большое количество свободного выпота. Заключение: Признаки двустороннего гидроторакса, инфильтративных изменений стенок желудка. Большой сальник в эпигастральной области уплотнен с узловыми образованиями (канцероматоз брюшины). Асцит. Аденопатия гепатодуоденальных лимфатических узлов.
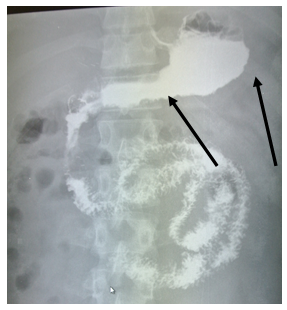
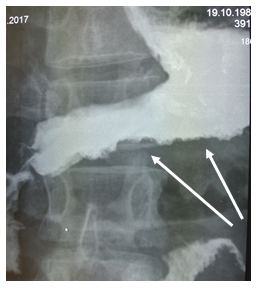
На рентгеноскопии пищевода, желудка, ДПК с бариевой взвесью диагностировано стойкое сужение просвета тела, синуса, выходного отдела желудка (рис. 1) с неровными фестончатыми контурами, атипичным рельефом слизистой (рис. 2). Заключение: Рентгенологические признаки инфильтративного поражения желудка.
Рис. 1. Рентгенологическое исследование желудка пациента В., 28 лет: сужение просвета тела, синуса, выходного отдела желудка
Рис. 2. Рентгенологическое исследование желудка пациента В., 28 лет: неровность и фестончатость контуров, атипичный рельеф слизистой
В условиях стационара проводилась инфузионная, антибактериальная, спазмолитическая, обезболивающая терапия. Амитриптилин 6,25–12,5 мг на ночь. Больной выписан из отделения 22.11.2017 г. с диагнозом:
Основной: Недифференцированный аденогенный рак выходного отдела желудка IV ст. Сопутствующий: Эрозивно-катаральный проктосигмоидит.
Осложнения: Канцероматоз брюшины. Аденопатия гепатодуоденальных лимфоузлов. Асцит. Двусторонний гидроторакс. Дефицит железа.
Пациенту выдано направление в онкологический диспансер. Даны рекомендации приема Амитриптилина 25 мг на ночь; Прегабалина 75 мг 1 раз в день; Нейробиона по 1 табл. 3 раза в день.
С 23.11.2017 г. по 30.11.2017 г. пациент находился в краевом онкологическом диспансере, где был подтвержден диагноз: Злокачественное новообразование желудка (ЗНО) IV ст. Т4NxMx».
Проведен 1 курс полихимиотерапии (ПХТ). После выписки, несмотря на проводимое лечение, состояние пациента прогрессивно ухудшалось. 18.12.2017 г. проведена эвакуация 10 литров асцитической жидкости в условиях стационара. 20.12.2017 г. – консультативный прием в онкологическом диспансере. Диагноз: Злокачественное новообразование желудка IV ст. Т4NxMx. Тотальное поражение. Канцероматоз брюшины. Прогрессирование. Кахексия. Асцит. Было рекомендовано продолжить симптоматическую терапию по месту жительства, а также попытка проведения гастростомии. Учитывая тяжесть состояния, ПХТ не показана.
22.12.2017 г. больной отметил появление одышки. На следующий день самостоятельно обратился в приемное отделение краевой больницы и был госпитализирован в отделение торакальной хирургии. На КТ органов грудной клетки (23.12.2017 г.) выявлен двусторонний гидроторакс. По легочным полям определялись очаги уплотнения по типу «матового стекла».
23.12.2017 г. и 25.12.2017 г. – плевральная пункция – эвакуирован 1 л серозно-геморрагического отделяемого. 26.12.2017 г. состояние больного тяжелое, с отрицательной динамикой. Появились рвота темной кровью, боли в эпигастрии, слабость, сухость во рту. На ФГДС – кровотечение интрагеморрагическое. Эрозивный эзофагит. Гемостаз системой EndoClot.
27.12.2017 г. состояние было крайне тяжелым. Сохранялась рвота темной кровью. Пациент переведен в ОРИТ, где проводилась инфузионная терапия, получал Метоклопрамид, Трамадол, Кетопрофен, Верошпирон, Транексам, Нексиум. При обследовании нарастала тромбоцитопения – 11569-41-19х109л, показатели очищения: мочевина 20,01 ммоль/л; креатинин 140,9 ммоль/л; гипопротеинемия 46,4 г/л.
27.12.2017 г. в 22:15 – асистолия. Реанимационные мероприятия в полном объеме – без эффекта.
27.12.2017 г. в 22:45 констатирована биологическая смерть. Труп В., 28 лет, был направлен на патологоанатомическое исследование с диагнозом: Перстневидноклеточный рак желудка с переходом на нижнюю треть пищевода T4NхM1. Канцероматоз плевры. Метастатическое поражение легких. Двусторонний экссудативный плеврит. Асцит. Осложнения: Кахексия. Желудочно-кишечное кровотечение. Геморрагический шок. Синдром полиорганной недостаточности.
Патологоанатомический диагноз:
Основное заболевание: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b.
Осложнение основного заболевания: Отек головного мозга. Двусторонний гидроторакс (1200/1200 мл). Асцит 3500 мл. Кахексия. Венозное полнокровие и паренхиматозная дистрофия миокарда, печени, почек.
Сопутствующие заболевания: Хронический пиелонефрит, ремиссия.
Обсуждение. В структуре заболеваемости РЖ возрастает доля молодого контингента больных (до 45 лет) с преобладанием низкодифференцированных и сложных форм, характеризующихся крайне плохим прогнозом [7, 8]. В настоящее время показатели несвоевременной диагностики рака желудка (IV стадия) являются одними из лидирующих, составляя в России 39,9% [9, с. 10].
Врач первичного звена является первой линией защиты в борьбе с онкопатологией. Первичная профилактика направлена на выявление и устранение влияния неблагоприятных факторов окружающей среды (канцерогенов) на процесс возникновения злокачественной опухоли, а также на устранение модифицируемых факторов риска [10]. У описанного нами пациента к факторам риска можно отнести длительный стаж курения и инфекцию НР.
Вторичная профилактика направлена на выявление и устранение предраковых заболеваний и диагностирование злокачественного новообразования на ранней стадии процесса при помощи ряда лабораторных и инструментальных методов обследования, включая полное гистологическое и молекулярно-генетическое исследование. При этом важно помнить о «симптомах тревоги» [10]. У пациента имели место снижение массы тела и повышение СОЭ, что должно было насторожить врачей. В течение 1,5 месяцев пациента вели с диагнозом «НПВП-гастропатия» с назначением ИПП, которые могли маскировать клинику рака желудка. Кроме того, отсутствие анамнестических данных о наличии фоновых заболеваний желудка и наследственной предрасположенности, молодой возраст пациента, неспецифическая симптоматика в начале заболевания, а также несвоевременное гистологическое исследование слизистой желудка послужили причиной поздней диагностики.
Заключение. Важно помнить, что рак желудка может быть диагностирован и в молодом возрасте, имея при этом крайне агрессивное течение. Необходимо выделять группы риска и своевременно проводить скрининг онкологических заболеваний. Регулярное диспансерное наблюдение является важнейшей массовой и высокоэффективной медицинской технологией сбережения здоровья и снижения преждевременной смертности населения.
Библиографическая ссылка
Третьякова Ю.И., Патрикеева М.С., Меньшикова Н.С. ПОЗДНЯЯ ДИАГНОСТИКА РАКА ЖЕЛУДКА У ПАЦИЕНТА 28 ЛЕТ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. – 2018. – № 6.
;
URL: https://science-education.ru/ru/article/view?id=28401 (дата обращения: 12.02.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
В онкологии любая врачебная ошибка грозит серьёзными последствиями: некорректно назначенная токсичная химиотерапия может убить пациента так же, как и отсутствие лечения, если у пациента есть рак, но диагноза нет.
Число онкологических диагнозов в России, как и во всём мире, растёт: в прошлом году отечественные врачи выявили 617,2 тысячи новых случаев злокачественных заболеваний – это на 20 тысяч больше, чем в 2017-м. Между тем, по мнению экспертов, как минимум 30% такихдиагнозов требуют корректировки: в уточнении могут нуждаться как вид ибиологические характеристикиопухоли или распространённость процесса, так и самый важный вопрос: злокачественная опухоль или доброкачественная.
Никто не застрахован от ошибок
Диагноз «рак» ставит врач-онколог, опираясь на результаты морфологических исследований. Основное из них – гистологическое, во время которого фрагмент опухоли исследуется под микроскопом: оно позволяет увидеть структурные изменения тканей, понять, идёт ли речь о раке или о доброкачественном новообразовании. Для его выполнения образец ткани, полученный при биопсии или, например, во время операции, направляется в патоморфологическую лабораторию, где его обрабатывают и делают из него парафиновые блоки, а блоки нарезают на гистологические стёкла, которые изучает врач-патоморфолог.
Для уточнения диагноза проводится углублённый иммуногистохимический анализ: его применяют, если первичный очаг заболевания неизвестен или обнаруженные клетки трудно отнести к определённому виду рака. Это исследование основано на использовании антител, которые вступают в реакции с антигенами опухоли. Набор характерных антител существует практически для каждого вида онкологических заболеваний, поэтому при помощи такого исследования можно подтвердить или опровергнуть диагноз, а также получить уточняющую информацию о заболевании. Но иногда и его недостаточно: часть случаев требует дополнительного молекулярно-генетического исследования для того, чтобы предсказать развитие болезни и подобрать эффективную схему лечения.
На всех этапах диагностики рака возможны ошибки: стёкла с образцами могут перепутать, при биопсии могут взять кусочек ткани не с того участка, сам врач, проводящий исследование, может ошибиться. Результаты исследований гистологических стёкол всегда зависят от квалификации врача, который смотрит в микроскоп, и случаев, с которыми ему уже доводилось сталкиваться на практике, ведь ни один патолог не может знать абсолютно все виды рака. Знания и опыт требуются как для выявления изменений, так и для верной трактовки результата. Цена ошибки в этом случае очень высока: если неопытный врач принял особенности строения тканей, характерные для некоторых доброкачественных состояний, за рак, пациента направят на операцию и сложное лечение, которого можно было бы избежать при выполнении исследования высококвалифицированным специалистом. При этом врач, который поставил диагноз, может и не подозревать, что ошибся.
Семь раз проверь
Чтобы избежать неправильного диагноза и, как следствие, некорректного лечения, необходимо показать гистологические блоки второму специалисту, желательно – специализирующемуся на конкретной локализации рака. В 2016 году на базе Лаборатории «Гемотест» – федеральной медицинской сети, которая охватывает 280 городов России, – был создан Независимый экспертный совет в рамках проекта «Онкологическая экспертиза». В совет вошли 30 ведущих специалистов национальных медицинских исследовательских центров, которые проводят пересмотр гистологических и цитологических препаратов, полученных в любых медицинских учреждениях, частных и государственных.
Для получения экспертного заключения достаточно отнести препараты – стёкла или блоки – в любое лабораторное отделение «Гемотест». В большинстве случаев при пересмотре диагноза выявляется клинически значимое расхождение – такое, которое способно существенно повлиять на тактику лечения. «Одно из самых сложных направлений в онкоморфологии – опухоли кроветворной и лимфоидной тканей, опухоли мягких тканей и костей, в которых частота расхождений высокая. В некоторых выборках расхождения могут достигать 50%, то есть из двух входящих случаев в одном диагноз меняется. Иногда процент расхождения выше», – говорит заведующий отделением клинической молекулярной морфологии Северо-Западного государственного медицинского университета имени И. И. Мечникова, консультант Экспертного совета «Гемостест», руководитель направления «Телепатология» Юрий Криволапов.
«Патологоанатом ориентируется на собственный опыт, квалификацию, существующие стандарты диагностики и критерии патологии. Естественно, если доктор не обладает должной практикой диагностики определённой патологии, то он может ошибиться, особенно в переходных моментах. Именно с этим и связано такое количество расхождений, – объясняет руководитель отдела гистологии лаборатории «Гемостест» Сергей Кижаев. – И часто, пересматривая биоматериал пациента, направленный из региональной лаборатории, мы даём заключение, отличное от первоначального. В своей практике мы используем несколько пар глаз, чтобы сойтись в одном мнении».
Опыт лаборатории «Гемотест»: результаты пересмотра диагнозов в рамках проекта «Второе мнение» (3 года, 2500 случаев)
Врач онколог, маммолог, хирург Алексей Галкин. Стаж 18+ лет. Принимает в Университетской клинике. Стоимость приема от 2000 руб.
Золотой стандарт для определения HER2 не установлен. Согласно ASCO/CAPs примерно 20% тестов HER2 могут быть неточными. К ним относятся преаналитические, аналитические и постаналитические переменные.
Причины неточностей анализа статуса HER2/neu
К таким преаналитическим переменным, которые влияют на производительность ИГХ или FISH относятся:
- время, необходимое для фиксации образца ткани;
- продолжительность его нахождения в растворе фиксатора;
- последующая обработка.
Такие переменные считаются менее значимыми при использовании методов гибридизации ISH, основанных на амплификации генов, и более значимыми для ИГХ, поскольку ДНК более стабильна, чем белок.
Время до фиксации, то есть время между биопсией или резекцией и помещением образца в фиксатор, должно быть как можно короче. Длительность фиксации оказывает большое влияние на результаты и является основным источником изменчивости. Для ИГХ предложен минимальный период фиксации 6-8 ч, руководящие принципы ASCO/CAP рекомендуют, чтобы фиксация не превышала 48 ч.
ИГХ обнаруживает сверхэкспрессию HER2 на уровне белка и зависит от условий проведения процедур тестирования. К ним относятся в дополнение к трем вышеперечисленным: денатурация, нагревание, извлечение антигена, используемая процедура окрашивания и интерпретация окрашивания. Несмотря на то, что существуют методы извлечения антигена, они могут привести к ложноположительным результатам иммуногистохимии.
Для определенного анализа нужно выбирать свой способ фиксации тканей.
Некоторые фиксаторы, химические вещества или тепло, могут помешать анализу FISH. Однако всегда применяется внутренний контроль для того, чтобы отличить отрицательный результат от неинформативного.
А например, иммуногистохимия способна ошибочно классифицировать опухоли на основе фиксированных формалином и внедренных в парафин образцов. А если использовать замороженный образец ткани того же пациента, то можно получить более точный результат. Фиксация формалином и парафиновое встраивание приводят к появлению множества артефактов, которые сбивают результаты анализа с толку. Очень трудно понять, получается действительно достоверный результат или ошибочный. Так утверждают многие специалисты. Результаты теста ИГХ наиболее надежны для свежих или замороженных образцов тканей. ИГХ является ненадежным способом тестирования тканей, которые сохраняются в воске или других химических веществах.
Тестирование FISH является предпочтительным способом оценки сохраненных образцов тканей.
- Аналитические факторы – аппаратура и квалификация специалиста также играют роль, и оказывают влияние на достоверность анализа HER2. Чтобы избежать ошибок, необходима регулярная калибровка микроскопов, использование стандартизированных лабораторных процедур, постоянное профессиональное развитие и специализированные программы обучения персонала.
- Постаналитические факторы связаны с интерпретацией результатов анализа, анализом изображений, отчетностью и постоянным обеспечением качества. Интерпретация ИГХ обычно выполняется вручную, включается субъективный фактор и результаты могут варьироваться в зависимости от опыта и бдительности наблюдателя. Например, при анализе ИГХ можно опросить двух патологоанатомов, смотрящих на один и тот же слайд, и один может назвать это 2+ положительное окрашивание, а другой может назвать это 3+ положительное окрашивание.
Оценка с помощью FISH и более новых методов тестирования HER2 CISH, SISH или DDISH, автоматизирована, поэтому является более объективным и количественным, чем с помощью иммуногистохимии. Например, интерпретация теста Fish HER2 – это гораздо более объективный процесс. С помощью анализа FISH патологоанатом подсчитывает фактические копии генов HER2, которые появляются в виде красного “сигнала” в окрашенном в синий цвет ядре раковой клетки, видимом через микроскоп.
Выделяют еще три основных фактора, которые могут привести к неправильному результату:
- Второй анализ на новом срезе фиксированной формалином, залитой парафином ткани, которая поступает из другой части опухоли, может дать другой результат. Хотя такие опухоли встречаются нечасто, но они могут быть HER2-положительными в одних местах и HER2-отрицательными в других.
- Иногда вся хромосома, на которой расположен ген HER2 (наряду с тысячами других генов), амплифицируется в опухолевой ткани. Это называется полисомией хромосомы 17, и ее можно неверно истолковать как амплификацию гена HER2.
- Техническая ошибка в анализе ИГХ (например, если дозатор, который выпускает каплю окрашивающего реагента на предметное стекло, не открывается) может быть обнаружена только путем включения контрольного образца ткани, а он, как известно, набирает 3+ на том же предметном стекле, что и тестируемая ткань. Если такой контрольный образец не используется, отсутствие окрашивания может быть неверно истолковано как отрицательный результат теста. Анализы FISH, в отличие от ИГХ, имеют встроенный контроль для предотвращения ложных отрицательных результатов.
Независимо от того, какой выбран метод определения HER2/neu статуса (иммуногистохимический или с помощью гибридизации FISH, CISH, SISH или DDISH), необходимо, чтобы он был проведен с соблюдением всех требований. Если получен двусмысленный результат, требуется проведение повторного анализа другим методом. Только так можно получить достоверные сведения о статусе HER2. И только таким образом определить возможность проведения таргетной терапии, которая значительно повышает выживаемость пациентов с раком молочной железы.
Продолжение статьи
- Часть 1. Статус HER2 при диагностике опухолей молочных желез. Характеристика. Часть 1.
- Часть 2. Статус HER2 при диагностике опухолей молочных желез. Иммуногистохимическое тестирование. Тесты ISH.
- Часть 3. Ошибки при определении статуса HER2.
Как часто при маммографии встречаются ложноположительные заключения?
Для уменьшения частоты ложноположительных заключений целесообразно проведение исследования 1 раз в 2 года – как при использовании 2D, так и 3D маммографии
Сотрудниками медицинского центра UC Davis Health было обнаружено, что около половины всех женщин по меньшей мере один раз в течение 10-летнего скрининга на рак молочной железы сталкиваются с ложноположительным заключением по маммограмме. Исследование проводилось ежегодно при помощи 3D цифровой маммографии. Такой риск значительно снижался при прохождении исследования 1 раз в 2 года. Результаты исследования опубликованы в JAMA Network Open.
Кроме того, авторы пришли к выводу, что 3D цифровая маммография лишь в небольшой степени снижает вероятность ложноположительного заключения в сравнении со стандартным 2D исследованием. Другие факторы характеризовались большим влиянием на частоту ложноположительных заключений – среди них частота скрининга, плотность молочных желез и возраст пациенток.
Злокачественные опухоли молочной железы занимают лидирующую позицию в списке онкологической заболеваемости. В России с этой проблемой сталкивается каждая десятая женщина. Раннее выявление и скрининговая маммография являются ключевыми элементами в стратегии по снижению риска развития запущенных стадий рака и смертности от этого заболевания.
Ложноположительная маммограмма отмечается в тех случаях, когда снимок расценивается как при наличии аномальных признаков при фактическом отсутствии рака молочной железы. В такой ситуации пациентка может быть вызвана на повторное проведение исследования. Несмотря на всю важность ранней диагностики, в некоторых случаях она может приводить к избыточному количеству исследований и необоснованных биопсий, финансовым и трудовым затратам, а также к излишнему беспокойству пациентов.
По данным исследования, около 12% двумерных маммограм требуют проведения дополнительного исследования, из них только 4,4% (в общей выборке 0,5%) действительно подтверждают диагноз злокачественного новообразования.
Авторы работы проанализировали данные Breast Cancer Surveillance Consortium из 3 млн скрининговых маммограм более 900 тыс женщин в возрасте 40-79 лет.
Согласно полученным данным, вероятность ложноположительного заключения в течение 10 лет была несколько ниже при использовании 3D маммографии – степень снижения была более выраженной для женщин с неплотными молочными железами, а также в случае ежегодного скрининга.
Было рассчитано, что в течение 10-летнего периода скрининга половина исследуемых женщин сталкивается с ложноположительным заключением по меньшей мере один раз, 17% – с рекомендацией по повторному исследованию в ближайшие сроки и 11% – с рекомендацией к проведению биопсии. При проведении 2D маммографии эти значения составили 56%, 18% и 12%, соответственно. Вне зависимости от типа скрининга, ложноположительные заключения встречались значительно реже у пожилых женщин в сравнении с более молодыми, а также при наличии большого количества жировой ткани в сравнении с плотными молочными железами.
Авторы приходят к выводу, что для уменьшения частоты ложноположительных заключений целесообразно проведение исследования 1 раз в 2 года – как при использовании 2D, так и 3D маммографии.
Источник: Ho Thao-Quyen H. et al. Cumulative Probability of False-Positive Results After 10 Years of Screening With Digital Breast Tomosynthesis vs Digital Mammography // JAMA Network Open. 2022
Еженедельный дайджест «Лечащего врача»: главные новости медицины в одной рассылке
Подписывайтесь на нашу email рассылку и оставайтесь в курсе самых важных медицинских событий
Cпасибо, ваши данные приняты. Не забудьте подтвердить подписку, в письме, которое вы получите на почту.
Несмотря на достижения медицины, рак молочной железы по-прежнему занимает 1 место среди онкологических патологий по смертности и заболеваемости у женщин. У каждой восьмой из нас есть риск развития рака груди. И этот риск постоянно растет из-за умножения стресса во всем мире, поздних первых родов, гиподинамии, лишнего веса и других причин.
Маммолог Республиканского клинического медицинского центра Александр Поддубный рассказал, что стоит знать каждой женщине о раке молочной железы.
Александр Александрович Поддубный
заведующий маммологическим кабинетом Республиканского клинического медицинского центра,
врач-акушер-гинеколог, маммолог высшей категории
«Хронический стресс рано или поздно приводит к патологии»
— Урбанизация как ни крути оставляет след на женском здоровье. Как минимум психоэмоциональные нагрузки и гиподинамия (малоподвижный образ жизни) присутствуют у многих. А это одни из ключевых факторов, способствующих развитию злокачественных опухолей.
Переживания во время редких ссор с мужем или из-за аврала на работе в конце года не считаются. Но хронический стресс, если вы постоянно находитесь в среде, в которой вам некомфортно, рано или поздно приводит к патологии.
Стресс может провоцировать, например, повышение гормона пролактина, который негативно влияет на молочную железу, если женщина не беременна и не кормит грудью.
Сегодня психоэмоциональных нагрузок у женщин так много, что не возникает вопроса, почему зачастую пациентки принимают антидепрессанты.
«Своевременные роды уменьшают подверженность груди мутагенезу»
Сейчас не всем нравится это слышать, но исследования показывают, что у женщин, которые впервые родили после 25 лет, риск возникновения рака груди увеличен в 3,5 раза по сравнению с теми, которые впервые родили до 25.
Причем это связано не столько с кормлением грудью, сколько с самими родами. Дело в том, что есть 4 типа долек молочной железы. 1 и 2 типы встречаются у нерожавших женщин. А у женщин, выносивших ребенка, тип долек 3 и 4.
Дольки 1 типа наименее дифференцированы и известны как девственные дольки, так как представляют незрелую женскую грудь до менархе (первые месячные). В протоках долек 1 типа могут наблюдаться паранеопластические поражения подобно атипической гиперплазии, которая может прогрессировать в рак протока (in situ) и до инвазивного рака молочной железы.
4 тип долек меньше подвержен мутагенезу. Анализ клеточной кинетики долек различных типов показал, что рожавшие женщины реже сталкиваются с раком молочной железы.
Итак, ранняя беременность способствует истинной дифференцировке долек, чего никогда не происходит у нерожавших женщин. То есть своевременные роды снижают риск рака молочной железы.
После менопаузы тип долек меняется в обратную сторону.
Кормление грудью тоже дает профилактический эффект, но только при мутации в гене BRCA2. Эта мутация чаще других встречается при наследственном раке молочной железы.
Что касается длительности кормления грудью: если месячные спустя 1 год уже отстроились, лактацию можно завершать. Если нет, можно кормить дольше.
«Рак может протекать под видом мастита, фиброаденомы»
Сейчас вероятность заболеть раком молочной железы увеличивается: на данный момент к пенсионному возрасту каждая 8 женщина рискует получить этот диагноз. Ежегодно в Беларуси выявляется в среднем 4,5 тысячи новых случаев рака груди. Это довольно большое число.
А смертность, несмотря на достижения медицины, такая же, как и раньше, к сожалению. Во-первых, стало больше высокоагрессивных форм. Во-вторых, рак умело маскируется. Есть много, так сказать, ползучих по протокам раков, которые очень трудно диагностировать. Кроме того, он может протекать под видом мастита, фиброаденомы.
Если с грудью что-то не так во время беременности или кормления, то и сама женщина, и ее врач-акушер-гинеколог заподозрят, скорее всего, мастит, лактостаз и т.п. К тому же диагностика в этих случаях крайне затруднена: методом пальпации (на ощупь) практически ничего не найти. А на самом деле там может быть рак. Поэтому специалисты не должны терять онконастороженность. И во всех непонятных случаях, если пациентка на что-то жалуется, нужно подключать инструментальные методы исследования.
Также есть женщины, которые думают, что они в относительной безопасности, так как в их семье не было опухолей. Но наследственность — далеко не основная причина рака груди. Заболеть им может любая женщина (мужчина — тоже, но такие случаи встречаются редко).
И все-таки от 5 до 10% рака молочной железы — наследственные. Поэтому хочется призвать мам не скрывать свой диагноз от детей и других родственников, чтобы они знали семейный анамнез. Вы же не хотите, чтобы дочь или другие ваши близкие были недообследованы?
«В брокколи, зеленом чае, винограде содержатся вещества, снижающие вероятность развития рака груди»
Способов, которые гарантированно защитят вас от онкологического заболевания, к сожалению, нет. Но некоторые вещества растительного происхождения — доказано — снижают риск развития рака молочной железы. Они содержатся в капусте брокколи (индол-3-карбинол), зеленом чае (галлат эпигаллокатехина), винограде (ресвератрол) и др.
Можно включить в свой рацион больше продуктов, которые содержат эти вещества, а можно принимать их в качестве биологических добавок — в аптеках широкий ассортимент.
Из наших местных продуктов полезны для профилактики рака груди ромашковый чай, сельдерей, грибы шампиньоны и вешенки (ингибиторы ароматазы), льняное масло, мука из льняного семени, чеснок, гинкго билоба.
Но не нужно приписывать этим растениям лечебные свойства. Если рак молочной железы установлен, требуется серьезное лечение, которое назначает только врач.
А профилактика должна быть комплексной. Помимо употребления отдельных растительных веществ, нужно обратить внимание на свое питание в целом: стараться каждый день есть овощи, фрукты и готовить пищу самостоятельно. Дело в том, что пресловутые добавки «Е», которые в большом количестве содержатся в готовых магазинных продуктах, все понемногу повышают риск развития рака.
Кроме того, важно вовремя лечить гинекологические патологии; избавиться от лишнего веса; регулярно уделять время физической активности; работать с психологом, если самостоятельно справиться со стрессом не получается; не откладывать рождение ребенка, если вы уже в браке; каждый год проходить скрининг рака молочной железы.
«До 50 лет нужно делать УЗИ молочных желез, после 50 — маммографию»
Самообследование руками, конечно, нужно проводить, но если опухоль прощупывается, то она уже довольно большая. А нам нужно поймать ее на ранней стадии. Поэтому 1 раз в год каждой женщине нужно делать УЗИ молочных желез независимо от того, есть жалобы или нет.
На УЗИ обнаруживают и нулевые стадии рака, и предраковые состояния. Но все-таки нужно понимать, что иногда опухоль недостижима для визуализации. Например, она может быть не узловой формы, а стелиться вдоль протока. Либо может быть еще малое количество раковых клеток на момент исследования.
Если возраст достиг 50 лет, раз в 2 года нужно проходить рентген-маммографическое исследование. А женщинам, в чьей семье (у мамы, сестры, дочери) есть или был рак, маммографический скрининг нужно начинать проходить уже не с 50 лет, а с 40.
Бывает, что плотность груди повышена. Тогда эффективность рентген-маммографии резко снижается — нужно выполнять МРТ молочных желез.
Также пациенткам из группы риска рекомендуется пройти исследование на мутации в генах (чаще всего приводят к раку мутации в генах BRCA1, BRCA2). Если они обнаруживаются, нужно дважды в год посещать врача-маммолога, чтобы можно было выявлять минимальные изменения. А некоторые женщины соглашаются на подкожную, профилактическую мастэктомию, то есть удаление молочной железы и жировой ткани через небольшой разрез с последующим эндопротезированием.
Если после исследования груди врач указывает явиться, например, через 3 месяца, значит, он в чем-то не уверен, что-то необходимо проконтролировать за короткий промежуток наблюдения. Поэтому не игнорируйте рекомендацию и не откладывайте визит.
А уж при каких-то изменениях в груди точно не стоит ждать, ведь есть высокоагрессивные раки, которые развиваются очень быстро. Обратитесь к врачу — и он назначит необходимые исследования.
«Боль в груди, если долго не лечить, увеличивает риск рака в 5 раз»
Некоторые состояния и препараты способны повышать вероятность раковой опухоли молочной железы. Например, гормоны заместительной терапии при менопаузе. Доказано, что 5-летний прием безопасен. А более длительный уже немного повышает риск рака молочной железы, хотя снижает риск колоректального рака, что немаловажно.
Также, например, если у вас есть боль в груди (масталгия) и вы не лечили ее на протяжении 37 месяцев, риск рака молочной железы увеличивается в 5 раз. То есть это не та боль, которую нужно терпеть. Хотя любую боль терпеть вредно.
Если болит грудь, обратите внимание на свое белье. Некоторые женщины выбирают бюстгальтер по принципу «лишь бы бюст хорошо смотрелся». Но если вы хотите сохранить здоровье, то ничего не должно передавливать, ведь из-за этого нарушается лимфоотток, появляются отеки.
Также есть формы доброкачественных заболеваний, которые в 5–10 раз повышают риск рака молочной железы. Их обычно стараются удалить, поскольку в дальнейшем гормональный сбой, стрессы могут спровоцировать злокачественную опухоль.
«Не бойтесь услышать диагноз. Теперь с раком молочной железы можно жить долго»
Некоторые пациентки, у которых выявили изменения в груди, не идут к врачу, так как боятся, что диагностируют рак. Но лучше его установить рано, чем поздно.
Это прежде считалось, что если у человека рак, то он скоро умрет. Теперь с этим живут долго. Может пройти и 20 лет без рецидива. И даже с агрессивной формой рака многие люди полноценно живут и работают, если выполнены все стандарты лечения.
Важно не прерывать терапию и доверять назначениям врача. Не проверяйте свой план лечения в интернете, ведь все индивидуально. Многое зависит от сопутствующих заболеваний, особенностей организма человека и даже от темперамента. Доктор все это учитывает.
Хирургия сегодня тоже не та, что раньше.
Если когда-то удалялась вся молочная железа и даже мышцы, то теперь большинство операций органосохраняющие. Можно сделать пластическую реконструкцию груди, лампэктомию, подкожную мастэктомию с одновременным эндопротезированием — вариантов очень много.
Нужно бояться не диагноза, а последствий несвоевременного лечения. Человек, который хоть раз видел, как тяжело умирают онкобольные, наоборот, будет стремиться как можно раньше узнать результаты исследования и лечиться, если рак все-таки обнаружен.
При выявлении опухоли молочной железы на ранней стадии довольно большой шанс предотвратить рецидив на длительное время. Сказать о полном излечении все же нельзя: иногда болезнь возвращается через 10, 15 лет. Нужно это понимать и научиться мирно сосуществовать с этим диагнозом. Выполняя все рекомендации специалистов, пациентки могут жить долго и без рецидива болезни.
«Измените свою жизнь до того, как возникнет рак»
От врача зависит не так уж много, как бы это ни звучало. Да, мы диагностируем, назначаем лечение, направляем к психологу, если это необходимо. Но изменить образ жизни и мышления — это задача самого пациента.
Важно понимать, для чего возникает рак. Не только за что и почему, но и для чего. Многие люди это осознают, меняют себя, свою жизнь, отношение к миру, привычки. А другие продолжают себя жалеть и остаются злыми, что тоже приводит к стрессу и депрессии, о которых мы говорили вначале.
Конечно, лучше прозреть поздно, чем никогда. Но, может, стоит стать добрее к другим и относится бережнее к себе уже сейчас?
Фото: Анна Занкович