Если вашему ребенку поставили диагноз врожденный порок сердца, не стоит опускать руки, нужно узнать все способы поддержания здоровья таких детей, а также причины развития данного заболевания, пройти необходимое обследование, чтобы врач назначил соответствующее лечение.
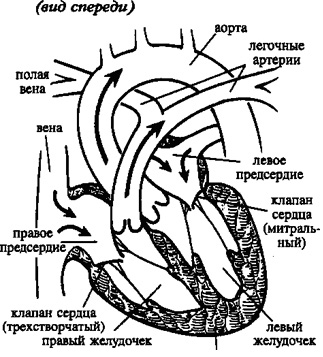
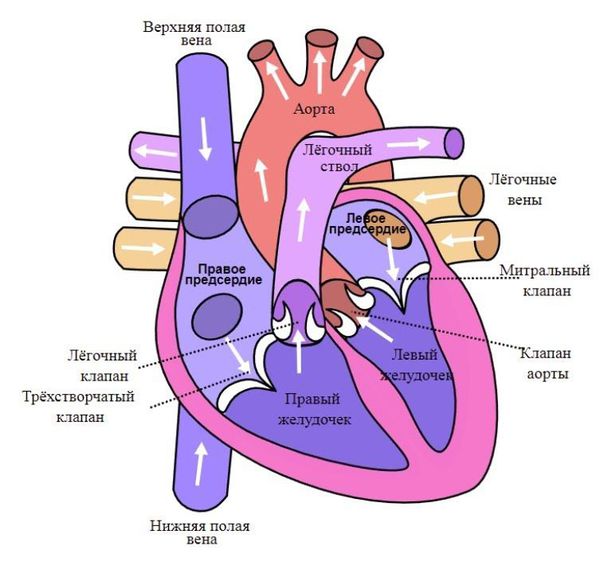
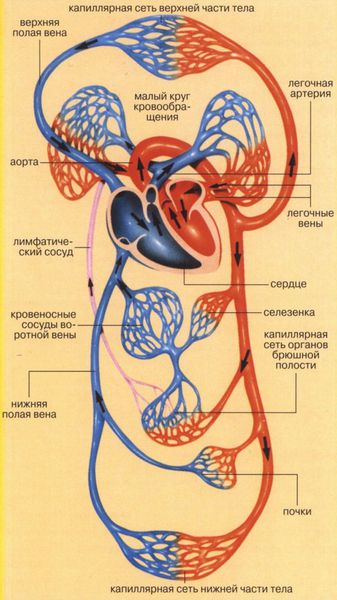
Сердце человека состоит из четырех камер: правое предсердие (ПП) и правый желудочек (ПЖ), левое предсердие (ЛП) и левый желудочек (ЛЖ). Правые и левые отделы сердца между собой никак не сообщаются. В этом нет необходимости, так как они обеспечивают движение крови каждый по своему кругу. Левые отделы сердца отвечают за движение крови по большому кругу кровообращения. Из левого предсердия через левый желудочек в аорту (Ао) поступает артериальная кровь, богатая кислородом. Из аорты по многочисленным артериям, а потом и по капиллярам она разносится по всему организму, доставляя клеткам кислород. В свою очередь, «отработанная» организмом венозная кровь собирается в мелкие вены, которые сливаются в более крупные венозные сосуды – верхнюю и нижнюю полые вены (ВПВ и НПВ). Конечная точка путешествия венозной крови – правое предсердие. Оттуда через правый желудочек кровь попадает в легочную артерию (ЛА). Малый круг кровообращения проходит через легкие, где венозная кровь обогащается кислородом и вновь становится артериальной. Отток обновленной крови осуществляется по легочным венам (ЛВ), впадающим, в свою очередь, в левое предсердие.
Особенности кровообращения у плода и новорожденного
Находясь в утробе матери, плод не дышит самостоятельно и его легкие не функционируют. Кровообращение осуществляется через плаценту. Насыщенная кислородом кровь матери поступает к плоду через пуповину: в венозный проток, откуда через систему сосудов в правое предсердие. У плода между правым и левым предсердием имеется отверстие – овальное окно. Через него кровь попадает в левое предсердие, затем в левый желудочек, аорту – и ко всем органам плода. Малый круг кровообращения отключен. В легкие плода кровь поступает через артериальный проток – соединение между аортой и легочной артерией. Венозный проток, овальное окно и артериальный проток имеются только у плода. Они называются «фетальными сообщениями». Когда ребенок рождается и пуповину перевязывают, схема кровообращения радикально изменяется. С первым вдохом ребенка его легкие расправляются, давление в сосудах легких снижается, кровь притекает в легкие. Малый круг кровообращения начинает функционировать. Фетальные сообщения больше не нужны ребенку и постепенно закрываются (венозный проток – в течение первого месяца, артериальный проток и овальное окно – через два-три месяца). В некоторых случаях своевременного закрытия не происходит, тогда у ребенка диагностируют врожденный порок сердца (ВПС). Иногда при развитии плода возникает аномалия и ребенок рождается с анатомически измененными структурами сердца, что также считается врожденным пороком сердца. Из 1000 детей с врожденными пороками рождается 8-10, и эта цифра увеличивается в последние годы (развитие и совершенствование диагностики позволяет врачам чаще и точнее распознавать пороки сердца, в том числе, когда ребенок еще в утробе матери).
«Синие» и «бледные» пороки сердца
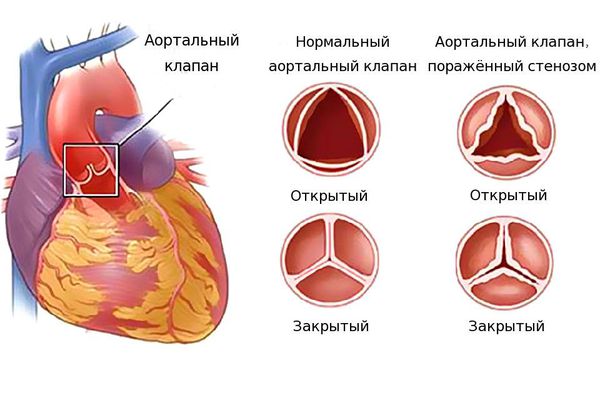
Аномалии могут быть очень разнообразными, наиболее часто встречающиеся имеют названия и объединяются в группы. Например, пороки разделяют на «синие» (при которых кожные покровы ребенка синюшные, «цианотичные») и «бледные» (кожные покровы бледные). Для жизни и развития ребенка более опасны «синие» пороки, при которых насыщение крови кислородом очень низкое. К «синим» порокам относятся Тетрада Фалло, транспозиция магистральных сосудов, атрезия легочной артерии. К «бледным» порокам относятся дефекты перегородок – межпредсердной, межжелудочковой. В некоторых случаях порок может частично компенсироваться за счет открытого артериального протока (в норме он закрывается, как только легкие ребенка расправляются с первым криком). Также у ребенка может недоразвиться клапан сердца – сформируется клапанный порок (наиболее часто, аортальный клапан или клапан легочной артерии).
Причины развития врожденного порока сердца
У плода формирование структур сердца происходит в первом триместре, на 2-8 неделе беременности. В этот период развиваются пороки, которые являются следствием наследственных генетических причин или воздействия неблагоприятных внешних факторов (например, инфекция или отравления). Иногда у ребенка имеется несколько пороков развития, в том числе и порок сердца. Риск рождения ребенка с врожденным пороком сердца очень высок, если:
— ранее у женщины были выкидыши или мертворожденные
— возраст женщины более 35 лет
— женщина во время беременности принимает алкоголь, психоактивные вещества (наркотики), курит
— в семье женщины есть история рождения детей с пороками или мертворождения
— женщина живет в экологически неблагоприятной местности (радиация, отравляющие вещества)
или работает на экологически неблагоприятном производстве
— во время беременности (особенно первые 2 месяца) женщина перенесла инфекционные, вирусные заболевания
— женщина принимала во время беременности лекарственные препараты
с тератогенным эффектом (приводящие к развитию уродств у плода) или
эндокринные препараты для сохранения беременности (гормоны).
Можно ли поставить диагноз ВПС у плода?
Возможность выявить у плода врожденный порок сердца существует, хотя ее нельзя назвать абсолютно информативной. Это зависит от многих причин, основные их которых — наличие высококлассной аппаратуры и квалифицированного специалиста, имеющего опыт перинатальной диагностики. Диагностика возможна начиная с 14-й недели беременности. Если при обследовании у плода выявляется аномалия развития, родителям сообщают о тяжести патологических изменений, возможностях лечения и о том, насколько будет ребенок жизнеспособен. Женщина может принять решение о прерывании беременности. Если есть надежда на успешные роды и лечение, женщина наблюдается у специалиста, роды принимают в специализированном роддоме (чаще всего женщине предлагают кесарево сечение).
Врожденный порок сердца у новорожденных
При рождении ребенка или в первые дни его жизни врачи могут заподозрить врожденный порок сердца.
На чем они основывают свои предположения?
— Шум в сердце. В первые несколько дней жизни ребенка шум в сердце нельзя расценивать как достоверный симптом врожденного порока сердца. Такого ребенка наблюдают, при сохранении шумов более 4-5 суток – обследуют. Само появление сердечного шума объясняется нарушением тока крови через сосуды и полости сердца (например, при наличии аномальных сужений, отверстий, резкой смены направления кровотока).
— синюшность кожных покровов (цианоз). В норме артериальная кровь богата кислородом и придает коже розовую окраску. Когда к артериальной крови примешивается бедная кислородом венозная кровь (в норме не происходит), кожа приобретает синюшный оттенок. В зависимости от типа порока цианоз может быть разной степени выраженности. Однако, врачам приходится уточнять причины цианоза, так как он может быть симптомом болезней органов дыхания и центральной нервной системы.
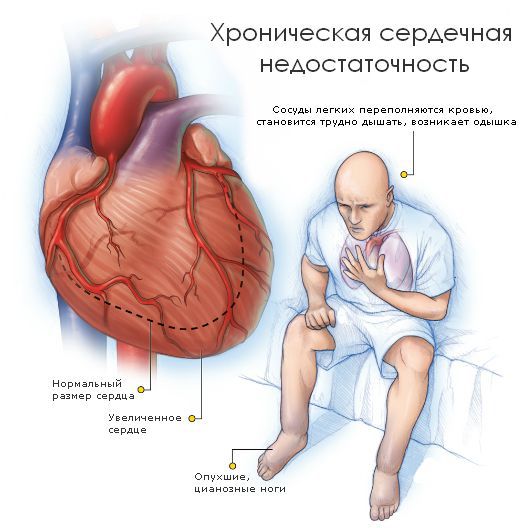
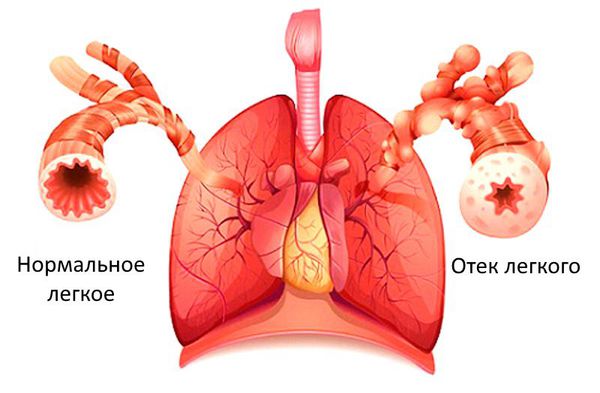
— проявления сердечной недостаточности. Сердце перекачивает кровь, работая как насос. Когда снижается насосная способность сердца, кровь начинает застаиваться в венозном русле, питание органов артериальной кровью снижается. Учащаются сердечные сокращения и дыхание, появляется увеличение печени и отечность, быстрая утомляемость и одышка. К сожалению, эти признаки очень трудно распознать у новорожденных. Высокая частота сердечных сокращений и дыхания наблюдается у маленьких детей в нормальном состоянии. Только при значительных отклонениях можно с достаточной уверенностью говорить о развитии у малыша сердечной недостаточности. Часто следствием развития сердечной недостаточности является спазм периферических сосудов, что проявляется похолоданием конечностей и кончика носа, их побледнением. Эти признаки помогают косвенно судить о недостаточности сердца.
— нарушения электрической функции сердца (сердечного ритма и проводимости), проявляющиеся аритмиями и, иногда, потерей сознания. Врач может услышать неровное сердцебиение при аускультации (выслушивании фонендоскопом) или увидеть на записи электрокардиограммы.
Как сами родители могут заподозрить у ребенка врожденный порок сердца?
Если порок сердца приводит к серьезным нарушениям гемодинамики (кровотока), как правило, его диагностируют уже в роддоме. При отсутствии выраженных проявлений ребенка могут выписать домой. Родители могут заметить, что малыш вялый, плохо сосет и часто срыгивает, во время кормления и при крике — синеет. Может проявиться выраженная тахикардия (частота сердечных сокращений выше 150 ударов в минуту). В этом случае нужно обязательно сообщить о жалобах педиатру и пройти специальные обследования.
Подтверждение диагноза врожденного порока сердца
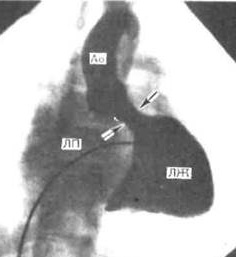
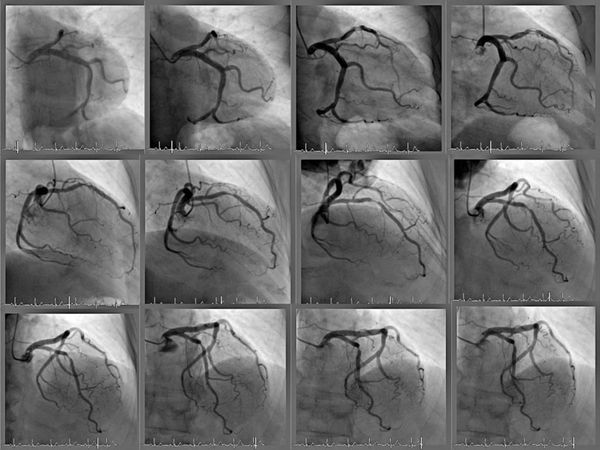
В настоящее время наиболее доступным, простым, безболезненным для ребенка и высокоинформативным методом диагностики пороков сердца является эхокардиография. Во время исследования с помощью ультразвукового датчика врач видит толщину стенок, размеры камер сердца, состояние клапанной системы и расположение крупных сосудов. Допплеровский датчик позволяет увидеть направления кровотока и измерить его скорость. Во время исследования можно выполнить снимки, подтверждающие заключение специалиста. Также ребенку обязательно запишут электрокардиограмму. При необходимости более точного исследования (как правило, для определения тактики хирургического лечения порока) врач порекомендует зондирование сердца. Это инвазивная методика, для выполнения которой ребенок госпитализируется в стационар. Зондирование проводится врачем-рентгенхирургом в рентгеноперационной, в присутствии врача-анестезиолога, под внутривенным наркозом. Через прокол в вене или артерии специальные катетеры вводятся в сердце и магистральные сосуды, позволяя точно измерить давление в полостях сердца, аорте, легочной артерии. Введение специального рентген-контрастного препарата позволяет получить точное изображение внутреннего строения сердца и крупных сосудов (см. рисунок).
Диагноз – не приговор. Лечение ВПС (врожденного порока сердца)
Современная медицина позволяет не только своевременно диагностировать, но и лечить врожденные пороки сердца. Лечением ВПС занимаются кардиохирурги. При выявлении порока, сопровождающегося серьезным нарушением гемодинамики, влияющего на развитие ребенка и угрожающего жизни малыша, операция проводиться как можно раньше, иногда в первые дни жизни ребенка. При пороках, которые не влияют значительно на рост и развитие ребенка, операция может проводиться позже. Выбор сроков операции определяется хирургом. Если ребенку рекомендовали хирургическое вмешательство и его не удалось выполнить своевременно (часто из-за отказа родителей, непонимания серьезности проблемы), у ребенка может начаться патологическое изменение гемодинамики, приводящее к развитию и прогрессированию сердечной недостаточности. На определенном этапе изменения становятся необратимыми, операция уже не поможет. Отнеситесь внимательно к советам и рекомендациям врачей, не лишайте своего ребенка возможности расти и развиваться, не быть инвалидом на всю жизнь!
Операция при врожденных пороках сердца
Многие годы операции при врожденных пороках сердца выполнялись только на открытом сердце, с использованием аппарата искусственного кровообращения (АИК), который берет на себя функции сердца во время его остановки. Сегодня при некоторых пороках такой операции существует альтернатива – устранение дефекта структур сердца с помощью системы AMPLATZER. Такие операции значительно безопаснее, не требуют раскрытия грудной клетки, не отличаясь по эффективности от «большой» хирургии. Если операция выполнена своевременно и успешно, ребенок полноценно развивается и растет, и часто – навсегда забывает о существовании порока. После операции обязательным является наблюдение педиатра, контрольные эхокардиографические исследования. Дети с врожденными пороками сердца часто болеют простудными заболеваниями из-за снижения иммунитета, поэтому в послеоперационном периоде проводится общеукрепляющее лечение и ограничиваются физические нагрузки. В дальнейшем у многих детей эти ограничения снимают и даже разрешают посещать спортивные секции.
Если Вы считаете, что у Вашего ребенка есть проблемы с сердцем, то Вы можете пройти эхокардиографическое исследование и обратиться за консультацией к детскому кардиологу.
Экстракардиальная патология у новорожденных как причина неверного диагноза врожденного порока сердца
Филиппова Е. А.1, Барышникова И. Ю.2
1НМИЦ АГиП им В.И. Кулакова, Москва; 2НМИЦ ССХ им. А.Н. Бакулева, Москва;
Актуальность. Причиной косвенных признаков ВПС — гипоксемии, кардиомегалии и легочной гипертензии (ЛГ) у новорожденных, могут быть не только ВПС, но и экстракардиальные врожденные пороки развития (ВПР). Наличие экстракардиальной патологии может кардинально повлиять на тактику терапевтического и хирургического лечения.
Цель исследования проанализировать спектр экстракардиальной ВПР, маскирующейся под ВПС и изучить возможности ультразвуковой диагностики в верификации диагноза.
Материал и методы. Ретроспективно были обследованы 2062 новорожденных, поступивших в НМИЦССХ из разных регионов России с первичным диагнозом ВПС, среди которых в 12 случаях выявлена изолированная экстракардиальная патология. У 5 пациентов, поступивших из НМИЦ АГиП им В. И. Кулакова, было верифицировано влияние экстракардиальной ВПР на появление клинических признаков недостаточности кровообращения и исключены ВПС. Всем пациентам выполняли ЭхоКГ исследование. При несоответствии клинической картины и ЭхоКГ данных повторно выполняли нейросонографию, ультразвуковое исследование органов брюшной. В случае стабильного состояния пациентов для исключения ВПС выполняли ангиокардиографию и компьютерную томографию с применением контрастного препарата (КТ-АГ).
Результаты. Из 4 случаев наличия аневризмы вены Галена, у 3 новорожденных пациентов сопутствующим диагнозом ошибочно была диагностирована коарктация аорты. У двух пациентов с высокой ЛГ и умеренной гипоксемией (SatO2=85-90%), при наличии преимущественно право-левого шунта крови через ООО, был установлен диагноз частичного аномального дренажа правых легочных вен. Последующее выполнение КТ АГ выявило нормальную анатомию легочных вен и наличие портокавального шунта (n=1) и большого аранцевого протока (n=1). В остальных 6 случаях у новорожденных присутствовала высокая ЛГ, обусловленная врожденной пневмонией и сопровождавшаяся выраженной гипоксемией, наличием право-левого шунта крови через ООО. В двух случаях состояние новорожденных было критическим — SatO2=28-33%% (FiO2-100%). Кровоток из легочных вен в левое предсердие не регистрировался. Терапия препаратами ПГЕ была неэффективна. Первичным диагнозом был установлен тотальный аномальный дренаж легочных вен. Ввиду критичности состояния и нетранспортабельности этим двум новорожденным была выполнена процедура закрытой атриосептостомии под контролем ЭхоКГ в условиях ОРИТ. Состояние было стабилизировано. Впоследствии, в возрасте 1,5 лет, одному их этих детей была выполнена пластика ДМПП.
Выводы: При наличии у новорожденных с сердечной недостаточностью изолированной экстракардиальной патологии ультразвуковая диагностика может быть достаточным инструментом постановки диагноза лишь при тщательном изучении анамнеза заболевания, грамотной трактовке клинических и лабораторных данных. Нетипичность клинической картины для подозреваемого порока является прямым указанием на необходимость дальнейшего обследования, несмотря на тяжесть состояния пациента.
Слияние яйцеклетки и сперматозоида означает начало новой жизни, и эта жизнь несет в себе всю генетическую информацию обоих родителей. Говорят: «Она похожа на папу…», «Он похож на моего дедушку по маме». А что это значит? Каждый из нас несет в себе огромную информацию не только о наших родителях и дедушках-бабушках, но и о пра-пра-прародителях. Эта информация в виде молекул белка заключена в сперматозоиде и яйцеклетке. При их соединении оба «банка данных» сливаются, и будущий ребенок несет их в себе. Структурной единицей информации является ген, или молекула белка. Слово «ген» означает «род», и факт наследования различных признаков был хорошо известен в древности, но наука о генах — генетика — возникла относительно недавно.
Каждая зародившаяся клетка несет в себе тысячи генов и каждый из этих генов заведует каким-либо процессом развития, например, образованием мозга, костей, или — сердца и какой-либо его части. Это называют «генетическим кодом» и ребенок обладает суммой кодов обоих родителей. Коды несут в себе и передают «признаки», т.е. «выражают» себя во вполне осязаемых и видимых чертах вашего ребенка. Но — не только видимых, но и скрытых: строение костей и внутренних органов, их функция в жизни и даже характер, поведение и привычки. Эти признаки могут быть очевидны и проявиться в первом поколении, т.е. у вашего сына или дочки. Но они могут проявиться и у внука, и даже — у правнука. И мы не понимаем, почему вдруг у родителей-блондинов может родиться ребенок-шатен. Или — голубоглазый, тогда как у папы и мамы глаза карие. В таких случаях говорят, что проявление определенного гена стало «доминантным». Это не означает, что другого гена – матери или отца — у ребенка в «коде» нет. Он есть, но не проявляет себя в этом поколении. Ученые называют этот ген рецессивным, т.е. скрытым.
К сожалению, обычно люди не могут проследить точно свою родословную дальше 3-4 колена. Мы говорим: «Бабушка по отцу умерла рано. От сердца». Или читаем в литературе даже прошлого века: «У них было пять детей, но двое умерли во младенчестве». От чего? Что с ними было? Да, были тогда и непобежденные еще инфекции, и антисанитария, но были и врожденные пороки, о которых просто не знали. Хотя люди очень давно заметили, что в закрытых сообществах, где браки разрешались лишь между хорошо известными друг другу, а подчас и родственными семьями, количество врожденных пороков, отклонений, гораздо выше. Не случайно браки между близкими родственниками, даже двоюродными, издавна были запрещены религией.
Сегодня геном человека прочитан, но до практического применения большинства знаний генетики еще очень далеко. И пока ни ученые, ни тем более вы или ваш партнер не можете точно знать, за что несут ответственность ваши гены в виде рецессивных признаков, когда и в чем они могут проявиться. Так что никого и никогда не надо винить в том, что у ребенка — врожденный порок сердца. Освободитесь от этого чувства. Забудьте о возможных причинах. Важнее разобраться в последствиях неверного развития и известных сегодня путях исправления этой неожиданной ошибки природы.
В семье, в которой уже есть ребенок с пороком сердца, при планировании следующей беременности крайне важно пройти всестороннее комплексное обследование с использованием современных инструментальных и лабораторных диагностических методик, медико-генетическую экспертизу. По отношению ко всему населению вероятность рождения ребенка с пороком сердца составляет примерно 1 на 100 здоровых детей. Вероятность рождения такого ребенка немного выше у тех, сестры или братья которых имеют ВПС.
Вероятность возникновения порока сердца у ребенка, если его брат/сестра страдают ВПС следующая:
|
ВПС, выявленный у брата/сестры |
Вероятный риск возникновения ВПС у следующего ребенка в семье, % |
|
Дефект межжелудочковой перегородки |
3,0 |
|
Открытый артериальный проток |
3,0 |
|
Дефект межпредсердной перегородки |
2,5 |
|
Тетрада Фалло |
2,5 |
|
Стеноз легочной артерии |
2,0 |
|
Коарктация аорты |
2,0 |
|
Стеноз аорты |
2,0 |
|
Транспозиция магистральных артерий |
1,5 |
|
Атрио-вентрикулярный канал |
2,0 |
|
Атрезия трехстворчатого клапана |
1,0 |
|
Аномалия Эбштейна |
1,0 |
|
Общий артериальный ствол |
1,0 |
|
Атрезия легочной артерии |
1,0 |
|
Синдром гипоплазии левого сердца |
2,0 |
Молодые женщины, страдающие ВПС, не должны считать, что они навсегда лишены счастья самим стать мамами. Конечно, их мучает множество вопросов — «Выдержит ли мое сердце беременность? Будет ли у моего ребенка порок сердца?» Большинство женщин после операции по поводу ВПС нормально переносят беременность и роды. В некоторых случаях (при сложных пороках) беременность опасна, и ее следует избегать исходя из интересов и матери, и плода. Но ВПС — это не приговор. Да, вероятность рождения ребенка с ВПС немного выше у матерей с пороком сердца. Анатомия порока сердца ребенка (если он формируется) в 50% случаев схожа с таковой у его матери.
Вероятность возникновения порока сердца у ребенка, если его мать/отец страдают ВПС такова:
|
ВПС, выявленный у родителей |
У матери |
У отца |
|
Вероятность возникновения ВПС у ребенка, % |
||
|
Аортальный стеноз |
13-18 |
3 |
|
Дефект межжелудочковой перегородки |
6 |
2 |
|
Открытый артериальный проток |
4 |
2,5 |
|
Дефект межпредсердной перегородки |
4,5 |
1,5 |
|
Тетрада Фалло |
6-10 |
1,5 |
|
Стеноз легочной артерии |
4-6,5 |
2 |
|
Коарктация аорты |
4 |
2 |
|
Атрио-вентрикулярный канал |
14 |
1 |
Единственным способом, позволяющим узнать о наличии врожденного порока сердца еще до рождения ребенка, является специальное ультразвуковое исследование сердца плода. С помощью современных методов диагностики сделать это удается очень рано, начиная уже с 12-14 недели беременности. Полученная в такие ранние сроки беременности информация о том, что у будущего ребенка сложный врожденный порок сердца, дает родителям возможность выбора — прервать или сохранить данную беременность. НО! Надо четко понимать, что правильная постановка такого диагноза и принятие в дальнейшем столь судьбоносных решений возможна только в том случае, если вы АБСОЛЮТНО уверены в квалификации врача. К сожалению, в настоящее время в России существует очень мало клиник, которые могут явиться в этом вопросе истиной в последней инстанции. Мы можем вам посоветовать Перинатальный кардиологический Центр при НМИЦ ССХ им. А.Н. Бакулева.
Очень важно и то, что пренатальное (до рождения ребенка) выявление порока сердца, позволяет родителям психологически подготовиться к тем неизбежным трудностям, которые ожидают их после рождения ребенка с таким серьезным заболеванием. Если родители готовы к предстоящим испытаниям и решают сделать все возможное для помощи будущему ребенку, они располагают временем, чтобы психологически подготовиться к предстоящей операции, свыкнуться с этой мыслью, насколько это может быть возможным. Более половины детей со сложными ВПС нуждаются в срочной операции, необходимой для спасения жизни новорожденного. Более 75% детей, которым не была вовремя проведена хирургическая операция, погибают, не дожив до одного года. Основная причина трагического исхода – позднее выявление порока, не оставляющее времени врачам и шансов ребенку и его родителям. Только оптимальная по своевременности и доступности медицинская помощь в условиях специализированной клиники даст наибольший шанс малышу не погибнуть, ведь с момента рождения и первого крика ребенка с врожденным пороком сердца и сосудов начинается быстрый обратный отсчет времени его жизни.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Лим В.А.
1, 2
1 Кыргызский государственный медицинский институт переподготовки и повышения квалификации им. С.Б. Даниярова
2 Центр диагностики матери и плода «Family»
Проблема врожденных пороков развития остается актуальной на сегодняшний день, в частности врожденные пороки сердца являются одной из основных причин детской смертности. Важной задачей акушерской службы является своевременная постановка диагноза, что включает в себя качественное скрининговое УЗИ, при необходимости детальный осмотр сердца плода. Необходимо отметить, что до настоящего времени нет конкретной связи с какими-либо факторами развития сердечной патологии, поэтому своевременная и грамотная внутриутробная диагностика пороков сердца играет важную роль. В данной статье проведен анализ 48 случаев различных врожденных пороков сердца, среди которых встречались как изолированные сердечные аномалии, так и сочетание с дефектами других систем. Сложные пороки сердца в большинстве случаев закончились летально. Изолированные дефекты межжелудочковой перегородки, которые в большинстве случаев имеют хороший прогноз, у плодов наших пациенток сочетались с хромосомными и генетическими заболеваниями. Наиболее ранний срок описания структуры пороков сердца пришелся на 18 недель беременности. Обучение врачей пренатальной диагностики правильному обследованию при врожденных пороках сердца, оснащение диагностических кабинетов ультразвуковыми аппаратами экспертного класса позволят значительно повысить качество выявления внутриутробной кардиальной патологии, а также сочетанных пороков развития плода.
плод
пороки сердца
беременность
множественные пороки
пренатальная диагностика
1. Бокерия Е.Л. Перинатальная кардиология: настоящее и будущее. Часть 1: врожденные пороки сердца // Российский вестник перинатологии и педиатрии. 2019. № 3. С. 5–10.
2. Pavliceka J., Gruszkaa T., Kapralovab S., Prochazkac M., Silhanovad E., Kaniovad R., Polanskaa S., Cernickovac R., Klaskova E. Associations between congenital heart defects and genetic and morphological anomalies. The importance of prenatal screening. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2019. Vol. 163. No. 1. P. 67–74.
3. Тюменева А.И. Пренатальная диагностика сложных врожденных пороков сердца: автореф. дис. … канд. мед. наук. Москва, 2008. 24 с.
4. Чепурных Е.Е., Григорьев Е.Г. Врожденные пороки сердца // Сибирский медицинский журнал (Иркутск). 2014. № 3. С. 121–127.
5. Hernandez-Andrade E., Patwardhan M., Cruz-Lemini M., Luewan S. Early evaluation of the fetal heart. Fetal Diagnosis and Theraphy. 2017. Vol. 42. P. 161–173.
6. Charafeddine F., Hachem А., Kibbi N., Abutaqa M., Bitar F., Bulbul Z., El-Rassi I., Arabi M. The first fetal echocardiography experience for prenatal diagnosis of congenital heart disease in Lebanon: successes and challenges. J Saudi Heart Associations. 2019. Vol. 31. P. 125–129.
7. Bravo-Valenzuela N., Peixoto A. B., Júnior E. A. Prenatal diagnosis of congenital heart disease: a review of current knowledge. Indian heart journal. 2018. Vol. 70. P. 150–164.
8. Jortveit J., Wik G., Degaard J. S., Sitras V., Perminov K.V., Holmstrom H. Diagnosis of severe congenital heart defects in Norway 2016. Tidsskrift for Den norske legeforening. 2019. P. 1–8.
9. Медведев М.В., Кубрина М.В., Галкина О.Л., Копытова Е.И., Полотова Е.В., Марченко Н.П. Атрезия легочной артерии с дефектом межжелудочковой перегородки: мультицентровой анализ случаев пренатальной диагностики // Пренатальная диагностика. 2017. Т. 16. № 2. С. 108–116.
Сердечная патология является одной из основных причин детской смертности и находится на втором месте среди причин младенческой смертности. Частота составляет 8 случаев на 1000 новорожденных [1, 2].
Неблагоприятный прогноз для жизни представляют сложные врожденные пороки сердца (ВПС). Под термином «сложный» понимают такие сердечные аномалии, как гипоплазированные камеры сердца, атрезии клапанов, аномальное отхождение магистральных сосудов, единственный желудочек, то есть изменения в сердце, при которых невозможно выполнить полную хирургическую коррекцию [3].
Критические пороки сердца, требующие хирургического вмешательства в ранний неонатальный период, составляют 25 % от всех врожденных сердечных аномалий. В первую неделю умирает 29 % новорожденных, к концу первого года жизни – 87 % [4].
Первое ультразвуковое скрининговое обследование (11–13 недель) является важным осмотром. В случае обнаружения увеличения толщины воротникового пространства, отклонения сердечной оси, рекомендуется расширенное обследование сердца (фетальная эхокардиография). При рутинном ультразвуковом исследовании лишь в 40 % выявляются пороки сердца у плодов, при том что детальный осмотр позволяет выявлять до 90 % сердечных пороков внутриутробно. Для своевременного выявления врожденных пороков сердца необходимо детально обследовать сердце плода ультразвуковым методом при втором скрининговом обследовании (18–22 недели) [5, 6].
Применяя фетальную эхокардиографию, возможно определить структуру порока и спрогнозировать исход для плода [7]. Особенно это касается сложных пороков сердца, так как имеет место позднее выявление патологии, при осмотре неонатологом в родильном доме или после выписки домой [8].
Данная тема является актуальной. Врачи пренатальной диагностики встречаются с трудностями точного определения структуры сердечных пороков, что связано с большой вариабельностью кардиальной аномалии у плодов.
Задачей врачей-гинекологов является правильная тактика ведения беременной после установки диагноза, так как своевременная хирургическая помощь спасает жизни детей и влияет на качество дальнейшей жизни.
Цель исследования: проанализировать течение беременности при выявлении кардиальной патологии у плодов, определить точность внутриутробной диагностики, описать случаи сочетания сердечных пороков с патологией развития других органов плода.
Материалы и методы исследования
В центре диагностики матери и плода «Family» г. Бишкек с января 2019 г. по ноябрь 2020 г. было осмотрено 48 беременных женщин с пороками сердца плода, требующими хирургической коррекции после рождения. Всем новорожденным было проведено эхокардиографическое обследование после родов врачами-кардиологами для уточнения структуры пороков. В случаях прерывания беременности, для подтверждения диагноза проводилось патологоанатомическое вскрытие.
Осмотр беременных выполнялся на ультразвуковых аппаратах General Electric (GE) Voluson E8 и E10, c использованием программы fetal heart. Также использовалась программа STIC (постобработка снимков, полученных в режиме объемного сканирования), основным являлся двумерный режим с цветовым и импульсным доплеровским картированием. У всех пациентов было получено информированное согласие на участие в нашем исследовании. Результаты были обработаны путем вычисления относительных величин (в %).
Результаты исследования и их обсуждение
Среди 48 плодов с ВПС сложные пороки сердца были в 40 случаях (83,3 %). Из общего количества умерли после родов 23 ребенка (47,9 %). Прервали беременность 3 женщины (6,2 %), в двух случаях проводилось патологоанатомическое вскрытие плодов. Третья беременная после заключения медицинской комиссии прервала беременность в сроке 31 неделя, в связи с плохим прогнозом для жизни ребенка. Диагноз был подтвержден методом эхокардиографии.
Из факторов риска, по анализам обменных карт, острые респираторные вирусные инфекции (ОРВИ) до 12 недели перенесли 14 женщин (29,1 %), ОРВИ во втором триместре перенесли 4 женщины (8,3 %). Анемия легкой степени имела место в 12 случаях (25,0 %), хроническая ревматическая болезнь сердца у матери – один случай (2,0 %). Многоплодные беременности как фактор риска в нашем случае встречались в двух случаях (4,1 %), обе дихориальные, диамниотические двойни.
Количество плодов мужского пола составило – 31 (64,5 %), женского 17 (35,4 %). Маловесными (вес менее 2600 г.) родились 9 детей (18,7 %), из них 8 имели сочетание порока сердца с ненормальным развитием других органов, в одном случае порок сердца был изолированным.
При ультразвуковом исследовании фетоплацентарное нарушение кровотока 1 степени выявлено у одной беременной (2,0 %), задержка внутриутробного развития у 4 (8,3 %), маловодие у 2 (4,1 %), многоводие у 5 (10,4 %), причем избыточное количество вод во всех случаях сочеталось с множественными пороками развития.
Сложности при ультразвуковом осмотре вызывали неправильное положение плода, большой срок гестации (после 35 недель), многоводие, маловодие. Необходимо отметить, что технология STIC информативна при осмотрах четырехкамерной проекции сердца (пороки атривентрикулярных клапанов, гипоплазии желудочков, дефекты межжелудочковой перегородки). Для осмотра выходных трактов желудочков, особенно при повороте оси сердца, осмотр в двумерном режиме является предпочтительным. Также для осмотра органов других систем маловодие и неудобное положение плода являются помехами для трехмерного ультразвука.
Структура выявленных пороков оказалась многообразна. Нами были диагностированы: у 5 плодов (10,4 %) двойное отхождение сосудов от правого желудочка, аномалия Эбштейна – 1 (2,0 %), транспозиция магистральных сосудов – 3 (6,2 %), стеноз легочной артерии – 7 (14,5 %), изолированный перимембранозный дефект межжелудочковой перегородки – 3 (6,2 %), декстрапозиция аорты с дефектом межжелудочковой перегородки – 5 (10,4 %), атрезия легочной артерии – 4 (8,3 %), атриовентрикулярный канал –5 (10,4 %), тетрада Фалло – 6 (12,5 %), перерыв дуги аорты – 1 (2,0 %), атрезия трикуспидального клапана – 1 (2,0 %), атрезия митрального клапана – 4 (8,3 %), из них в двух случаях аортальный клапан был атрезирован, также в двух случаях имелось двойное отхождение сосудов от правого желудочка. Коарктация аорты составила один случай (2,0 %), единственный желудочек – 2 (4,1 %).
После рождения вскрытие проводилось в одном случае – ребенку с аномалией Эбштейна, который умер в родильном доме на вторые сутки. Согласно заключению патологоанатома, причиной смерти стала острая сердечная недостаточность, дилатация полостей сердца, острый венозный застой внутренних органов.
В двух случаях единственного желудочка диагностика оказалась затруднительной как внутриутробно, так и после родов. В первом случае трикуспидальный клапан был атрезирован и полость правого желудочка практически отсутствовала, также имелся единый сосуд, исходящий из функционально единого желудочка. После родов рекомендовалась компьютерная томография для уточнения диагноза. При телефонном разговоре с матерью мы узнали, что в возрасте 10 месяцев ребенок еще не прошел полного обследования, но в развитии значительно отставал, не мог переворачиваться и самостоятельно не сидел.
Во втором случае мы диагностировали правосформированное, праворасположенное сердце в сочетании с единым атриовентрикулярным клапаном, двойным отхождением сосудов от правого желудочка, ребенок умер в первый месяц жизни.
Среди плодов с кардиальной патологией в 6 случаях (12,5 %) было сочетание с хромосомными аберрациями и генетическим заболеванием: синдромом Дауна – 4 случая, синдромом Ди Джорджи – один случай; также наблюдался один случай редкой генетической патологии (синдром Холта – Орама, наследственное заболевание, сочетание порока сердца с отсутствием первого пальца на кистях обеих рук до аплазии лучевой кости).
После родов успешно прооперированы были двое детей с тетрадой Фалло, также двое детей со стенозом клапана легочной артерии. Один ребенок с диагнозом двойного отхождения сосудов от правого желудочка благополучно оперирован в Турции. К сожалению, в случаях транспозиции магистральных сосудов и единственного желудочка детям было отказано в проведении оперативного лечения как местными, так и зарубежными хирургами в связи с высоким риском смерти сразу после операции.
Приводим наблюдение о несовпадении нашего диагноза с эхокардиографическим заключением после родов. В нашем центре при плановом обследовании на 30 неделе беременности был установлен диагноз коарктации аорты с дефектом межжелудочковой перегородки. В родильном доме при проведении эхокардиографии был выявлен только дефект мышечной перегородки, коарктация была исключена. Ребенок умер через 2 недели после родов, от вскрытия родители отказались. Мы пришли к выводу, что портативные ультразвуковые аппараты, на которых обследуют детей в родильных домах, могут вызывать сложности визуализации и неполную диагностику, что связано с менее четким изображением, чем на стационарном оборудовании.
По данным литературы, внутриутробная диагностика пороков сердца возможна с 13 недели беременности, в частности таких сложных для выявления ВПС, как атрезия легочной артерии [9]. В нашем центре плод с атрезией легочной артерии и дефектом межжелудочковой перегородки был выявлен в 18 недель беременности. Данная беременность была прервана в связи с неблагоприятным прогнозом для жизни. Патологоанатомическое вскрытие подтвердило диагноз. По нашему мнению, 18 неделя беременности (второе скрининговое обследование) является наиболее ранним сроком для точного определения структуры порока. Связано это с тем, что магистральные сосуды сердца плода плохо видны в сроки первого скринингового обследования, что может приводить к неточной диагностике.
Из 48 случаев с ВПС 16 плодов (33,3 %) имели множественные пороки развития, причем такие изменения, как гидроцефалия, укорочение трубчатых костей, выявлялись на сроках после 30 недель. А случаи атрезии ануса были обнаружены только при рождении детей. Таким образом, выявление любых изменений в сердце является поводом для обязательного повторного ультразвукового обследования в сроки 25–30 недель (таблица).
Сочетание врожденных пороков сердца с аномалиями других органов
|
Название порока сердца |
Сочетание ВПС с патологией других органов |
Сроки выявления ВПС (неделя беременности), исход |
|
1. Перимембранозный дефект межжелудочковой перегородки |
Синдром Холта – Орама |
В 27 недель выявлены изменения в сердце, на 38 неделе – укорочение трубчатых костей. Умер в течение первого месяца жизни |
|
2. Перимембранозный дефект межжелудочковой перегородки |
Синдром Дауна |
32 недели, также было выявлено укорочение бедренных костей и выраженное многоводие |
|
3. Общий открытый атриовентрикулярный канал в сочетании с гипоплазией легочной артерии |
Синдром Дауна |
В 26 недель, маловодие, маловесный ребенок (2520 г), под наблюдением у кардиолога |
|
4. Тетрада Фалло |
Атрезия ануса (выявлено после родов) |
В 28 недель обнаружен ВПС, многоводие, умер в родильном доме |
|
5. Двойное отхождение сосудов от правого желудочка |
Омфалоцеле |
35 недель, дихориальная двойня после экстракорпорального оплодотворения, маловесный ребенок (2370 г), умер на 7 месяце жизни |
|
6. Стеноз легочной артерии, перимембранозный дефект межжелудочковой перегородки |
Гидроцефалия, центральная расщелина губы и неба, косолапость |
36 недель, задержка развития плода, маловодие, маловесный ребенок (2200 г), умер в родильном доме |
|
7. Стеноз клапана легочной артерии |
Синдром Ди Джорджи |
26 недели, оперирован в г. Санкт-Петербурге, на учете кардиолога |
|
8. Двойное отхождение сосудов от правого желудочка, гипоплазия легочной артерии |
Кистозная дисплазия правой почки |
22 недели, умер в первый месяц жизни |
|
9. Перимембранозный дефект межжелудочковой перегородки |
Двусторонняя косолапость, единственная артерия пуповины |
20 недель, на поздних сроках беременности задержка развития плода, умер в родильном доме |
|
10. Декстрапозированная аорта, подаортальный дефект межжелудочковой перегородки |
Синдром Дауна, единственная артерия пуповины |
29 недель, умер в родильном доме |
|
11. Декстрапозированная аорта, подаортальный дефект межжелудочковой перегородки |
Гидроцефалия, косолапость |
33 недель, многоводие, умер в родильном доме |
|
12. Тетрада Фалло |
Атрезия ануса, гидроцефалия |
В 20 недель выявлен ВПС, атрезия ануса после родов, умер |
|
13. А триовентрикулярный канал (полная форма) |
Единственная артерия пуповины, косолапость |
34 недель, умер в родильном доме |
|
14. Атриовентрикулярный канал (полная форма) |
Синдром Дауна |
30 недель, прерывание беременности в 31 неделю по медицинским показаниям |
|
15. Декстрокардия, полная форма атриовентикулярного канала |
Левосторонняя диафрагмальная грыжа, гипоплазия почки |
24 недели, маловодие, задержка внутриутробного развития. Роды на 38 неделе гестации, масса 1200 г, умер в родильном доме |
|
16. Двойное отхождение сосудов от правого желудочка |
Атрезия пищевода |
27 недель, маловесный 2500 г, умер |
Из данных таблицы видно, что при сочетанных пороках развития в сердце в трех случаях был только изолированный дефект межжелудочковой перегородки. Этот порок на первый взгляд казался безобидным, но в последующем родились дети с хромосомной аберрацией и генетическим заболеванием.
В срок второго скрининга (18–22 недели) обследовано 3 пациентки, в остальных случаях пороки были выявлены позднее, с 24 по 36 неделю, что может свидетельствовать как о неполноценном обследовании, так и о развитии изменений в поздние сроки беременности. Из 16 случаев сочетанных аномалий после рождения умерло 12 детей, что еще раз доказывает необходимость тщательного осмотра всех органов при выявлении пороков сердца.
Выводы
1. Нет четких данных о конкретных факторах риска, способствующих развитию пороков сердца. Беременность плодами с ВПС протекает относительно нормально, нарушения кровотока при доплерометрии не характерны, задержка развития плодов встречается при множественных пороках развития. Таким образом, только качественная пренатальная диагностика может помочь правильной тактике ведения беременности.
2. Если в сроки второго скринингового обследования (18–22 недели) у плода определяется порок сердца без изменений в других органах, необходимо обязательно выполнить повторное ультразвуковое исследование через 2–3 недели, для исключения множественных пороков развития. Аппараты экспертного класса с программой Fetal heart значительно улучшают качество визуализации в базовом двумерном режиме.
3. При выявлении порока сердца у плода в сочетании с укорочением трубчатых костей и многоводием нужно рекомендовать консультацию генетика с последующим определением кариотипа.
Библиографическая ссылка
Лим В.А. ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ СЕРДЦА, ТЕЧЕНИЕ БЕРЕМЕННОСТИ, КЛИНИЧЕСКИЕ СЛУЧАИ СОЧЕТАНИЯ КАРДИАЛЬНОЙ ПАТОЛОГИИ ПЛОДА С АНОМАЛИЯМИ ДРУГИХ ОРГАНОВ // Научное обозрение. Медицинские науки. – 2020. – № 6.
– С. 88-92;
URL: https://science-medicine.ru/ru/article/view?id=1161 (дата обращения: 12.02.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Сердечные патологии сегодня лидирует в списке причин младенческой смертности. По данным статистики на одну тысячу новорожденных приходится примерно 8 случаев диагностированных пороков сердца. Но благодаря современным достижениям медицины, сегодня такой диагноз не является приговором. Даже самые сложные пороки успешно лечатся при условии, что патология обнаружена на ранних стадиях развития. Поэтому сегодня широко практикуется внутриутробная диагностика.
Особенности диагностики пороков сердца у плода
Первый ультразвуковой скрининг беременным женщинам проводится на сроках 11-13 недель. Процедура помогает выявить такие сложные пороки у плода, как:
- атрезия легочной артерии;
- отклонение сердечной оси;
- увеличенную толщин воротникового пространства;
- дефект межжелудочковой перегородки.
При детальном обследовании медикам удается выявить до 90% сердечных пороков именно с помощью внутриутробного обследования. Второе проведение скрининга на сроке 18-22 недели беременности уже дает более детальную картину имеющегося отклонения развития плода.
Самыми неблагоприятными считаются сложные пороки:
- аномальное отхождение магистральных сосудов;
- гипоплазия камер сердца;
- атрезии клапанов;
- наличие единственного желудочка.
Перечисленные аномалии развития не позволяют выполнить хирургическую коррекцию. Поэтому при таких пороках врачи дают неблагоприятный прогноз для жизни будущего ребенка.
Основная цель внутриутробной диагностики — сделать грамотный анализ течения беременности. При выявлении у плода кардиальной патологии врачу предстоит определить точность полученных диагностических данных с учетом развития других органов у плода.
Причины врожденных пороков
Вопреки устоявшемуся мнению, что врожденные пороки сердца имеют генетическую природу происхождения, такая связь обнаруживается в редких случаях. Намного чаще негативное влияние на формирующийся плод оказывают внешние факторы:
- вирусные инфекции: например, краснуха;
- хронические патологии у матери;
- алкоголизм и наркомания;
- ионизирующее излучение;
- прием некоторых лекарственных препаратов.
Но влияние на формирование пороков оказывает не только состояние здоровья матери, но и отца. К факторам риска также относится угроза прерывания беременности, мертворождение в анамнезе, а также наличие в семье детей с пороками развития. Конечно, даже на основе таких факторов невозможно дать точный прогноз, поэтому в подобных ситуациях родителей направляют на генетическую экспертизу.
Методы внутриутробной диагностики
На текущий момент тема перинатальной диагностики актуальна, как никогда ранее. Во многом такая тенденция объясняется информированностью населения. Ведь абсолютно всем родителям хочется иметь здоровое потомство. Особенно внимательно относятся к будущему материнству современные женщины, которые в большинстве своем четко выполняют все рекомендации гинеколога.
В свою очередь, главной задачей медиков является правильная тактика ведения беременности на всех этапах. После установки диагноза женщина находится под особым контролем, потому что достижения современной хирургии позволяют спасать жизни новорожденных с аномалиями развития. Выполненная в первые недели после рождения операция на сердце не отражается на качестве дальнейшей жизни.
К основным видам обследования в период беременности относятся:
- регулярное измерение артериального давления;
- контроль суточного баланса жидкости;
- биохимические анализы;
- ЭКГ;
- Электрокардиография.
Малышам сразу после появления на свет, если у них при внутриутробной диагностике был выявлен сердечный порок, назначаются инструментальные и лабораторные виды исследования, а также коагулограмма — комплексный тест крови. Также всем новорожденным проводится пульсометрия с обязательным измерением уровня сатурации. В случае необходимости детский кардиолог в Калининграде назначает рентгенографию органов грудной клетки.
Таким образом, диагностика пороков сердца в период внутриутробного развития плода является первой отправной точкой, от которой впоследствии можно отслеживать динамику состояния ребенка. При этом критические пороки сердца, которые нуждаются в срочном проведении хирургической операции составляют четверть от общего количества врожденных аномалий сердца.
С помощью фетальной эхокардиографии удается определить структуру этого порога, и составить прогноз для плода.
Результаты исследования
Здесь уместно отметить, что внутриутробный скрининг сегодня получил широкое распространение во всем мире. Такие мероприятия проводятся в детской многопрофильной поликлинике «Эдкарик». Поэтому все женщины, проживающие в Калининграде, могут пройти обследование, направленное на выявление пороков сердца у будущего ребенка.
К слову сказать, по последним данным статистики их 48 плодов со сложными пороками в 40 случаях патология была выявлена именно во время перинатальной диагностики. Каждая женщина имеет право сама решить, стоит ли ей рожать ребенка с крайне плохим прогнозом для жизни.
Сложность данного метода диагностики заключается в том, что неправильное положение плода может помешать проведению скрининга. Также осложняет процедуру многоводие и большой срок беременности (свыше 35 недель). Но подобные помехи осложняют ультразвуковое исследование и других органов плода, а не только сердечно-сосудистой системы.
И последнее замечание, на которое следует обратить внимание: проходить обследование во время беременности стоит лишь в учреждениях, имеющих лицензию на осуществление услуг такого рода. Работа частного детского центра «Эдкарик» подкреплена наличием всем необходимым разрешительных документов. Поэтому заключениям, сделанным нашими специалистами, можно доверять.
В качестве итога
Дородовая диагностика — это передовой метод исследования. С его помощью удается выявить у плода не только тяжелые пороки сердца, но также целый ряд других несовместимых с жизнью заболеваний. Например, синдром Дауна и Эдвардса сегодня тоже диагностируют еще на этапе гестации. Специалисты калининградской детской поликлиники «Эдкарик» обладают необходимыми знаниями и опытом, чтобы на качественном уровне выполнить весь комплекс диагностических процедур. Кроме высокого профессионализма наших детских кардиологов наших клиентов порадует:
- внимательное отношение персонала;
- полное отсутствие очередей;
- доброжелательная атмосфера в клинике;
- комфортные условия во время прохождения всех процедур.
Ко всему перечисленному можно добавить еще один существенный плюс — это вполне демократичные цены на все виды услуг.
После скрининга врач проанализирует полученные данные и сделает заключение. В случае выявления у плода порока сердца будет назначено повторное обследование. Узнать все подробности о проведении дородовой диагностики можно на официальном сайте нашего многопрофильного центра. Там же есть телефоны, по которым будущие мамы могут с нами связаться, чтобы выбрать удобное для обследования время. Мы ценим не только здоровье, но и время наших клиентов!
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.
Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла — сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
- дефект межпредсердной перегородки;
- дефект межжелудочковой перегородки;
- транспозиция главных артерий.
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
В нашей стране ежегодно на свет появляются около 10 тысяч детей с врожденными пороками сердца, которые нуждаются в операции. Из них более половины имеют критические пороки, которые необходимо лечить оперативным путем в первые 10 дней, еще в периоде новорожденности, чтобы спасти детские жизни. Почему возникают пороки сердца у детей? Поговорим об этом в нашей статье.
ВПС: такая разная статистика
По разным данным частота врожденных пороков сердца (ВПС) варьирует в достаточно широких пределах и составляет примерно от 4 до 50 случаев на 1000 живорожденных. Почему такая разница?
Дело в том, что нет четких критериев того, что считать за ВПС, а какие малые аномалии развития сердца не включать в эту статистику. Тем не менее, каждый год на свет появляется более 1,5 миллионов малышей, имеющих различные аномалии в строении сердца.
Если рассматривать только тяжелые и среднетяжелые случаи (пороки, которые обязательно требуют лечения), то их частота составляет 6 на 1000 детей (по данным США). Ну а если посчитать еще и пациентов, имеющих двустворчатый аортальный клапан, а также тех, кто имеет точечные мышечные дефекты межжелудочковой перегородки (не мешающие жизни и зарастающие самостоятельно), то это число возрастет в разы и составит 75 на 1000 живорожденных младенцев.
Что такое врожденный порок сердца?
Термин звучит для родителей очень пугающе, однако сам диагноз «врожденный порок сердца» не говорит о том, что ребёнок смертельно болен.
Пороки бывают разные. Данный диагноз ставят ребёнку в том случае, если у него есть любые анатомические дефекты (аномалии развития) самого сердца и /или магистральных (крупных) сосудов, которые развились внутриутробно. Примерно четверти пациентам с врожденными пороками сердца требуется проведение оперативного вмешательства на первом году жизни.
Иногда патологию удается обнаружить в первые дни или месяцы жизни, так как на это указывают соответствующие симптомы дыхательной и сердечно-сосудистой недостаточности.
В некоторых случаях бессимптомно протекающий порок сердца обнаруживается случайно при проведении планового ультразвукового исследования.
Самые тяжелые пороки развития нередко удается обнаружить еще до рождения ребёнка при проведении ультразвукового скрининга. Не избегайте УЗИ плода в беременность!
Статистические данные говорят, что с каждым годом возрастает число детей, имеющих пороки сердца. Почему так происходит? Неужели есть какой-то провоцирующий фактор, из-за которого стало рождаться больше больных детей? Нет, причина в другом.
Во-первых, улучшилась диагностика аномалий развития сердца. Многие пороки сердца стали выявлять очень рано из-за массового ультразвукового скрининга в первые месяцы жизни. Раньше часть пациентов ускользала от статистиков, потому что о существовании их бессимптомных пороков никто не знал.
Во-вторых, растет мастерство кардиохирургов, и дети с тяжелыми пороками сердца стали чаще выживать после операций сердца, магистральных сосудов.
Из-за чего образуются врожденные пороки сердца?
Невозможно сказать однозначно, почему у того или иного ребёнка сердце внутриутробно стало развиваться с некоторыми аномалиями, однако ученым удалось выявить различные факторы риска ВПС. Вот основные из них.
- Порок может быть связан с хромосомной аномалией
В период с 1994 по 2005 гг. в США проводилось масштабное исследование, в ходе которого изучали связь ВПС с хромосомными аномалиями. В исследование вошли как живорожденные, так и мертворожденные дети. Оказалось, что у 12% детей, родившихся с пороками сердца, имелись хромосомные нарушения. Наиболее частыми генетическими нарушениями, встречающимися у обследованных детей, оказались синдромы Дауна, Эдвардса, Патау, удлинение длинного плеча 21 хромосомы.
У половины детей с синдромом Дауна обнаруживаются различные пороки сердца. Среди них чаще встречаются атриовентрикулярный канал, дефекты перегородок, открытый артериальный проток, тетрада Фалло.
- Дефицит фолиевой кислоты (витамина В9)
Мы привыкли говорить о том, что недостаток фолиевой кислоты может сказаться дефектами образования нервной трубки у плода. Но результаты последних исследований говорят о том, что не только пороки развития нервной системы могут возникнуть из-за дефицита витамина В9, но и пороки сердца тоже.
Факт!
Прием фолиевой кислоты в 1 триместре, напротив, снижает риск формирования ВПС почти на треть!
Особенно это касается дефекта межжелудочковой перегородки (ДМЖП) и аномалий развития магистральных сосудов.
- Различные заболевания беременной женщины
Не так много взрослых людей могут похвастаться идеальным здоровьем. Тем не менее, выделяют такие болезни беременных женщин, при которых формирование пороков развития сердца плода происходит наиболее часто.
Особенно опасны некорригированная фенилкетонурия (в 6 раз выше риск ВПС), сахарный диабет любого типа (если гипергликемия была в первые 7 недель беременности), любые инфекционные заболевания с повышением температуры в первом триместре беременности (риск ВПС выше в 2-3 раза), ожирение, эпилепсия.
- Прием некоторых лекарств
Доказано тератогенное влияние талидомида (седативный и противораковый препарат), ретиноидов (производных витамина А), некоторых гормональных медикаментов, определенных противосудорожных средств, некоторых барбитуратов, ангиотензинпревращающего фермента, флуконазола, сульфаниламидов, сульфасалазина, метотрексата, метронидазола и других лекарственных средств.
- Употребление алкоголя, наркотиков, курение
Доказано, что тяжелые пороки сердца могут возникнуть у детей, если их матери при беременности будут принимать алкогольные напитки. При этом на данный момент не выявлено «безопасной» дозы алкоголя.
Выявлен риск формирования ВПС у плодов, чьи матери во время беременности употребляют наркотики (кокаин, марихуана).
Факт!
Негативное влияние курения в первом триместре на формирование сердца плода доказано в неоднократных исследованиях.
- Воздействие факторов окружающей среды
Доказано негативное воздействие на формирование сердечных структур при влиянии на мать в первом триместре пестицидов (занятость женщины в сельском хозяйстве, на личном участке), органических растворителей (красителей). Есть предположения о негативном влиянии ионизирующей радиации.
- Влияние социально-демографических показателей
Доказано, что риск рождения ребёнка с пороком сердца увеличивается после 35 лет у матери и 45 лет у отца. Негативное влияние оказывает отягощенный акушерский анамнез (выкидыши, преждевременные роды в анамнезе).
Факт!
В два раза возрастает риск, если мать пережила сильный стресс в первом триместре (развод, смерть близкого человека, потеря работы и др.).
В отношении некоторых пороков сердца отмечается влияние отягощенной наследственности. Так, если у матери при рождении отмечался дефект межпредсердной перегородки, то у ребёнка в 3 раза выше риск формирования этого же самого порока. На развитие некоторых ВПС оказывают негативное влияние близкородственные браки, что не является редкостью в некоторых популяциях.
Доказано, что у детей от многоплодной беременности выше риск возникновения пороков сердца (на 63%), особенно открытого артериального протока и коарктации аорты.
- Преэклампсия: исследования продолжаются
На сегодняшний день выдвинута гипотеза о том, что на появление ВПС может оказать влияние осложнение беременности под названием преэклампсия. Она возникает из-за нарушения работы сосудов плаценты и проявляется повышением артериального давления, отеками, появлением белка в моче, головными болями.
Некоторые исследователи указывают, что у женщин, страдающих преэклампсией, чаще рождаются дети с пороками сердца. Однако есть и противники данной теории, потому что аномалии развития сердца развиваются в первые недели беременности, а преэклампсия диагностируется уже после 20 недель, то есть к моменту ее возникновения сердце уже полностью сформировано. Тем не менее, исследования этой теории продолжаются. Возможно, ученым удастся найти общий провоцирующий фактор, который влияет и на закладку сердечных структур, и на формирование сосудов плаценты.
Выживаемость детей растет!
Врожденные аномалии сердца у детей занимают лидирующие позиции по распространенности в сравнении с другими пороками развития. Многими факторами риска можно управлять, чтобы снизить риск формирования аномалии сердца у будущего малыша. Но заранее предсказать невозможно, родится ребёнок здоровым или нет.
К счастью, многие тяжелые пороки сердца можно заподозрить антенатально по УЗИ, чтобы решить вопросы о пролонгации беременности, о выборе родильного дома для родоразрешения. Стремительно развивается неонатальная кардиохирургия. Прогресс дошел до того, что с тяжелыми пороками сердца стали выживать все больше и больше детей, и качество их жизни тоже улучшается.
Врожденные пороки сердца у детей: распространенность, факторы риска, смертность / Саперова Е.В., Вахлова И.В. // Вопросы современной педиатрии – 2017 – Том 16. №2
Врожденные пороки сердца / Чепурных Е. Е., Григорьев Е. Г. // Сибирский медицинский журнал (Иркутск) – 2014 – 3
Дата публикации 16 марта 2020Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Порок сердца — это органическое поражение клапанов сердца, его перегородок, больших сосудов и миокарда (мышечной ткани сердца). Заболевание приводит к нарушению функции сердца, застою крови в венах, тканях и органах.
Пороки могут быть как врождёнными, так и приобретёнными. Врождённые пороки выявляют в первый год жизни во время диспансеризации с помощью УЗИ сердца.
Приобретённые пороки сердца — органические изменения клапанов или дефекты перегородок сердца, возникающие вследствие заболеваний или травм. Такие пороки встречаются относительно часто, составляя, по разным данным, от 20 до 25 % всех органических заболеваний сердца у взрослых [3]. Самым распространённым фактором, вызывающим заболевание, является дегенерация створок клапанов сердца.
Изменение клапанов возникает под влиянием следующих причин:
- инфекционные болезни — ангина, грипп, энтеровирусные заболевания и др.;
- повышенное артериальное давление;
- хронические заболевания — сахарный диабет, хроническая болезнь почек, ревматоидный артрит;
- ревматические патологии — системная красная волчанка, ревматизм;
- эндокардит (воспаление внутренней оболочки сердца).
Изменение клапанов проявляется фиброзом (разрастанием соединительной ткани), утолщением створок и кальцинозом (отложением кальция в мягких тканях).
Пороки сердца могут возникнуть в любом возрасте, например после травмы грудной клетки. Но чаще всего заболевание формируется в пожилом возрасте. Это связано с тем, что для воздействия на организм большинства факторов требуется продолжительное время.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы приобретённых пороков сердца
В большинстве случаев заболевание проходит без симптомов, пока не приведёт к значимому изменению тока крови внутри сердца — ускорению потока или его обратному движению. Это становится причиной нарушения функции сердца и проявляется следующими симптомами:
- Одышка — нарушение частоты, глубины и ритма дыхания. При заболеваниях сердца появляется при физической нагрузке, а в состоянии покоя уменьшается или проходит [2].
- Отёки нижних конечностей— задержка жидкости в тканях, вызванная снижением насосной функции сердца и нарушением тока крови. При застоях в лёгких возможно появление кашля и кровохарканья.
- Кашель — связан с застойными явлениями в малом (лёгочном) круге кровообращения.
- Перебои в работе сердца — увеличение силы и частоты сердечных сокращений, ощущение, словно «сердце спотыкается«.
Основное проявление сердечной недостаточности — одышка — встречается при всех видах пороков сердца. Остальные симптомы проявляются не всегда, для каждой патологии характерны свои клинические признаки [6]. Например при стенозе (сужении просвета) митрального клапана в первую очередь происходит застой в малом круге кровообращения, что проявляется кашлем и одышкой. А при стенозе аортального клапана первыми симптомами будут одышка и отёки голеней.
Другим признаком приобретённых пороков сердца может быть цианоз — синюшное окрашивание кожи и слизистых оболочек разной интенсивности: от лёгкой светло-синей до выраженной синевато-чёрной. Цианоз на губах, кончике носа и кончиках пальцев называют акроцианозом. Он особенно выражен при митральном пороке сердца и получил название «митральный румянец». При аортальных пороках кожные покровы обычно бледные. Это связано с недостаточным наполнением капилляров кровью.
Если застой жидкости происходит в печени и сопровождается разрушением её клеток, то кожные покровы могут приобрести желтушный цвет. Особенно это заметно на белках глаз.
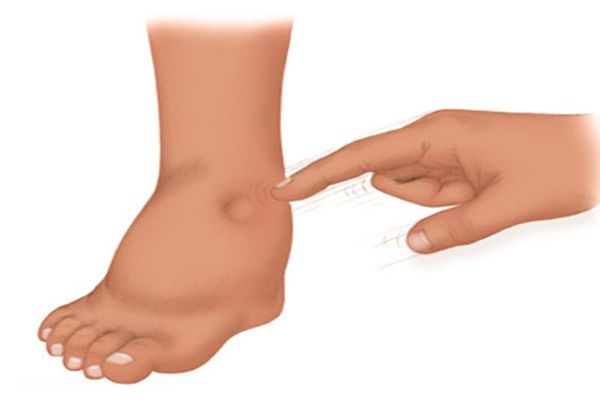
При приобретённых пороках сердца могут появиться отёки. Они выявляются при надавливании большим пальцем в области лодыжек, стопы, крестца и других частей тела.
При выслушивании сердца (аускультации) можно выявить различные шумы. При аускультации лёгких выслушиваются симметричные мелкопузырчатые, напоминающие лопанье пузырьков в газированном напитке влажные хрипы и ослабленное дыхание в нижних отделах.
Патогенез приобретённых пороков сердца
Сердце состоит из двух отделов: левого — артериального и правого — венозного. Артериальная кровь, обогащённая кислородом, течёт в левых отделах сердца, а венозная, обеднённая кислородом кровь, — в правых.
«Левое» сердце состоит из левого предсердия и лёгочных вен, левого желудочка и аорты. «Правое» сердце включает правое предсердие, верхнюю и нижнюю полые вены, правый желудочек и лёгочную артерию. Между предсердиями и желудочками находятся клапаны сердца:
- трикуспидальный (трёхстворчатый) клапан разделяет правое предсердие и правый желудочек;
- митральный клапан отделяет левое предсердие от левого желудочка;
- аортальный — левый желудочек от аорты;
- лёгочный — правый желудочек от лёгочного ствола[4].
Клапаны, словно двери, пропускают поток крови в одну сторону и не допускают прохода обратно. Если же клапан изменён и при закрытии его образуется щель, то происходит обратный поток крови — регургитация. Щель возникает из-за следующих патологических изменений:
- Фиброз — формирование избыточной соединительной ткани там, где должны быть расположены тонкие, упругие и гладкие створки клапанов. Разрастание ткани возникает, как правило, в результате хронического воспаления. Организм изолирует очаг воспаления от окружающих тканей и общего кровотока, что приводит к постепенной утрате функций поражённым органом.
- Кальциноз — отложение кальция на створках клапана. Нарушению способствуют возрастные изменения, остеопороз, атеросклероз, почечная недостаточность и воспалительные изменения. Ведущую роль в развитии кальциноза играет генетически обусловленный дисбаланс между образованием и разрушением внеклеточных структур ткани [11].
- Разрушение клапана в результате образования на нём рубцов и деформаций. Изменения могут возникать в результате возрастных изменений, после ревматизма (воспаление соединительной ткани сердца), инфекционного эндокардита (воспаление внутренней оболочки сердца) или сердечных приступов [12].
Если же клапан сужен, то это препятствует току крови. Такое состояние называется стенозом. Чаще всего стеноз или недостаточность возникают изолированно в отдельных клапанах, однако возможны ситуации, когда поражены несколько клапанов. Разрушение клапанов приводит к нарушению циркуляции крови, возникновению застойных явлений в малом и большом круге кровообращений. Из-за этого появляются признаки сердечной недостаточности: одышка, отёки, кашель и другие симптомы.
Классификация и стадии развития приобретённых пороков сердца
Существующие классификации приобретённых пороков сердца имеют некоторые различия. Это связано с тем, для каких специалистов они предназначены — кардиологов или кардиохирургов. В общей клинической практике целесообразно использовать классификацию по признакам заболевания в той последовательности, которая принята для постановки диагноза. Наиболее распространено разделение на следующие виды:
- По происхождению порока: ревматический, атеросклеротический, сифилитический, развившийся в результате бактериального эндокардита и вызванные другими причинами.
- По локализации с учётом количества поражённых клапанов: изолированный (один клапан) или комбинированный (два и более), пороки митрального, аортального, трикуспидального клапанов, клапана лёгочной артерии.
- По морфологической и функциональной характеристике поражения: недостаточность клапана или стеноз клапанного отверстия. При сочетании этих нарушений на одном клапане порок называют сочетанным.
- По степени влияния на нарушение внутрисердечной гемодинамики (движения крови по сосудам): без существенного воздействия, умеренной и резкой степени выраженности.
- По состоянию общей гемодинамики: компенсированные пороки (без нарушения кровообращения) и декомпенсированные (с недостаточностью кровообращения). Пороки с временной декомпенсацией сердца, появляющиеся при необычных для пациента нагрузках на систему кровообращения, называют субкомпенсированным. Такие состояния могут возникать при беременности или лихорадке [3].
Осложнения приобретённых пороков сердца
Без адекватного лечения, наблюдения и своевременного обращения к врачу порок сердца может привести к серьёзным осложнениям. Застойные явления в большом круге сначала приводят к отёкам нижних конечностей. Затем с развитием заболевания жидкость накапливается в брюшной полости, происходит застой в печени с её повреждением — клетки органа разрушаются, разрастается соединительная ткань. Это может привести к циррозу [9].
Если застойные явления происходят в малом круге кровообращения, то возникает дыхательная недостаточность и возможен отёк лёгких. Признаком дыхательной недостаточности является одышка при физической нагрузке. Если одышка возникает при нагрузке, которую пациент раньше выполнял без особых усилий, то она является патологической и следует обратиться к врачу.
Помимо нарушений, связанных с застойными явлениями, осложнения могут возникнуть непосредственно в сердце в виде увеличения камер и/или стенок. Например при митральном стенозе часто возникает расширение левого предсердия, а при стенозе аортального клапана — увеличение толщины стенок левого желудочка. Это способствует дальнейшему развитию заболевания [10].
При структурных изменениях в сердце могут происходить нарушения ритма: частые экстрасистолии (сильные сердечные толчки с «провалом» или «замиранием» после них), мерцательная аритмия (неравномерное учащённое сердцебиение), приступы тахикардии (увеличение частоты сердечных сокращений). Мерцательная аритмия часто возникает при расширении левого предсердия. Это может привести к тромбозу (закупорке сосуда, питающему головной мозг) и в результате — ишемическому инсульту (нарушению мозгового кровообращения), ослаблению мышц или параличу.
К образованию тромбов приводит не только нарушение сердечного ритма. При некоторых пороках сердца, например при стенозе митрального клапана в камере левого предсердия, существенно замедляется ток крови и увеличивается давление, что приводит к образованию пристеночных тромбов. Тромбы в камерах сердца могут появиться при нарушении тока крови [3].
Диагностика приобретённых пороков сердца
После тщательного опроса, изучения истории болезни и осмотра переходят к инструментальным и лабораторным методам исследований:
Эхокардиография.
Эхокардиография (ЭхоКГ) — ключевой метод подтверждения диагноза клапанной болезни сердца, а также оценки её тяжести и прогноза. В ходе исследования визуализируют структуру клапанного аппарата, измеряют объёмы и размеры камер сердца, определяют стеноз и наличие обратного тока крови.
Существует трансторакальная и чреспищеводная эхокардиографическая диагностика. Трансторакальный метод — более доступный и неинвазивный. Ультразвуковой датчик располагается на грудной клетке спереди. При чреспищеводном ЭхоКГ датчик вводится в пищевод, исследование проводят на уровне сердца. Так как датчик находится ближе к сердцу, то структуры на экране визуализируются более чётко.
На первом этапе обследования достаточно проведения трансторакального ЭхоКГ.
Другие неинвазивные методы исследования.
2.1 Нагрузочные тесты (стресс-эхокардиография, тредмил-тест, велоэргометрия)
Нагрузочные тесты применяют для выявления объективных признаков заболевания при неспецифических симптомах или их полном отсутствии. Эти тесты особенно полезны для оценки риска сердечно-сосудистых осложнений при аортальном стенозе. Пробы с физической нагрузкой также помогают определить уровень рекомендуемой активности, в том числе оптимальную интенсивность спортивных тренировок. Например при велоэргометрии на пациента прикрепляют электроды, просят сесть на велотренажер и крутить педали. Постепенно нагрузку увеличивают, одновременно следя за состоянием больного.
2.2 Магнитно-резонансная томография сердца. Для обследования пациентов с неодназначными результатами ЭхоКГ применяют магнитно-резонансную томографию сердца (МРТ). С помощью МРТ оценивают тяжесть поражения клапанов, выраженность обратного тока крови, определяют объём желудочков, систолическую функцию, аномалии восходящей аорты и фиброз миокарда. МРТ сердца — эталонный метод для определения объёма и функции правого желудочка. Исследование полезно для оценки последствий обратного тока крови при закрытии трикуспидального клапана.
2.3 Компьютерная томография. Мультиспиральную компьютерную томографию (МСКТ) используют для оценки тяжести поражения клапанов, особенно при аортальном стенозе. МСКТ играет важную роль при планировании транскатетерных вмешательств. Компьютерная томография может быть полезна для исключения ишемической болезни сердца.
2.4 Видеофлюороскопия — это съёмка работы сердца при помощи рентгеновских лучей. Предварительно в организм пациента вводят рентгеноконтрастное вещество, что даёт возможность наблюдать за током крови. Видеофлюороскопия важна для оценки механической дисфункции искусственного клапана.
2.5 Лабораторные методы исследования. Для выявления аортального стеноза и обратного тока крови определяют уровень натрийуретического пептида B-типа (BNP). BNP синтезируется клетками сердца в ответ на повышение кровяного давления. В норме он находится на уровне до 125 пг/мл. Показатель имеет важное значение для оценки риска сердечно-сосудистых осложнений и определения срока вмешательства, особенно у бессимптомных пациентов. Анализ сдают натощак, специальная подготовка не требуется [5].
3. Инвазивные методы исследования.
3.1 Коронарная ангиография (КАГ) показана для оценки ишемической болезни сердца (ИБС) при планировании открытого или эндоваскулярного вмешательства — операции на кровеносных сосудах, осуществляемой без разрезов через небольшие проколы на коже.
3.2 Катетеризация сердца — процедура, при которой гибкий катетер (полая трубка) через периферическую артерию или вену на руке или ноге вводится внутрь сосуда. Под контролем рентгеновского аппарата проверяют движение катетера до нужной полости сердца. Процедура даёт представление о давлении внутри камер сердца, составе крови в каждом отделе, работе клапанов, строении стенок и перегородок и используется для оценки кровотока.
Данные ЭхоКГ требуется подтверждать результатами инвазивного исследования, если единственным показанием к хирургическому лечению является высокое давление в лёгочной артерии. В большинстве же случаев эхокардиография — самый доступный метод обследования, с помощью которого с высокой достоверностью можно определить наличие или отсутствие порока сердца.
Лечение приобретённых пороков сердца
Лекарства, способного запустить обратный процесс и восстановить клапан до первоначального состояния, не существует. С помощью медикаментозного метода лечения возможно лишь повлиять на сердечно-сосудистую систему и снизить риск развития осложнений. В тяжёлых случаях применяют хирургические методы лечения.
Медикаментозное лечение
Цель терапии — устранить причины недостаточности кровообращения, улучшить функциональное состояние миокарда, восстановить нормальную циркуляцию крови, микроциркуляцию (транспорт клеток крови и веществ к тканям и от тканей) и предотвратить повторные расстройства кровообращения. Лечение при хронической недостаточности кровообращения включает полноценное сбалансированное питание и лекарственную терапию.
Основные группы препаратов, применяемых при нарушении в работе клапанов:
1. Ингибиторы АПФ (ангиотензинпревращающего фермента) — эналаприл, лизиноприл, рамиприл, периндоприл, фозиноприл. Препараты блокируют превращение гормона ангиотензина I в ангиотензин II. Ангиотензин II оказывает сосудосуживающее действие и вызывает быстрое повышение артериального давления. Ингибиторы АПФ применяют для лечения артериальной гипертензии, терапии или профилактики сердечной недостаточности.
2. Бета-блокаторы — карведилол, бисопролол, метопролол. Эти препараты снижают артериальное давление и нормализуют ритм сердечных сокращений. Действие вызвано блокированием бета-адренорецепторов, отвечающих за реакцию организма на стресс.
3. Антагонисты минералокортикоидных рецепторов — спиронолактон, эплеренон. Препараты понижают артериальное давление и обладают мочегонным воздействием, уменьшая содержание жидкости в тканях.
Существуют различные варианты пороков сердца, для лечения каждого из них применяют различные комбинации препаратов. Также учитывают сопутствующие патологии и индивидуальные особенности пациента.
Например при преобладании застойных явлений дополнительно назначают мочегонные препараты (фуросемид, торасемид), которые снижают объём циркулирующей крови, уменьшая застойные явления в малом и большом круге кровообращений. При наличии тромбов или при высоком риске их появления применяют антикоагулянты — препараты, снижающие свёртываемость крови (варфарин, ривароксабан, дабигатран, апиксабан).
Относительно недавно был разработан новый класс препаратов — ингибиторы рецепторов ангиотензина-неприлизина (сакубитрил). Основное их действие — это повышение количества пептидов, расщепляемых неприлизином. Препараты увеличивают диурез (объём мочи), натрийурез (выведения натрия с мочой), вызывают расслабление миокарда и препятствуют процессам нарушения структуры и функции сердца.
При невозможности применения бета-блокаторов их рекомендовано заменить на ингибиторы If-каналов (ивабрадин), которые также уменьшают частоту сердечных сокращений. При невозможности применения ингибиторов АПФ используют блокаторы рецепторов ангиотензина (лозартан, валсартан, кандесартан, телмисартан, ирбесартан, олмесартан). Они обладают свойствами, схожими с ингибиторами АПФ, но не снижают синтез ангиотензина II, а блокируют ангиотензиновые рецепторы [6].
Хирургическое лечение
При наличии показаний, недостаточной эффективности медикаментозного лечения и отсутствии противопоказаний применяют хирургические методы. Многих пациентов пугает необходимость проведения операции на сердце. В некоторых случаях хирургические методы действительно несут определённый риск, но существуют достаточно безопасные операции не на открытом сердце и без больших разрезов. К таким операциям относится баллонная комиссуротомия при стенозе митрального клапана. Метод состоит в расширении клапана с помощью катетера, проведённого через артерию.
Перед оперативным вмешательством проводят необходимые лабораторные, инструментальные исследования и стабилизируют состояние пациента лекарственными препаратами. При подготовке к операции важно уменьшить одышку, отёки, нормализовать пульс и артериальное давление.
Распространённым хирургическим методом является протезирование искусственным или биологическим клапаном. Существуют и клапан-сохраняющие операции, которые заключаются в пластике повреждённого клапана.
Оперативное лечение значительно улучшает качество жизни, однако после операции приём медикаментов продолжается, но при необходимости корректируется. Помимо этого, после определённых операций, например протезирования искусственным клапаном, постоянно принимают антикоагулянтную терапию. Препараты необходимы, поскольку возрастает риск тромбоэмболических осложнений (закупорки артерий тромбами) [5].
Прогноз. Профилактика
При своевременном обращении пациента к врачу и соблюдении рекомендаций прогноз благоприятный. К каждому случаю врач подходит индивидуально, начиная с подбора медикаментозного лечения и до выбора оперативных методов.
Первичная профилактика приобретённых пороков сердца состоит в предупреждении болезней, приводящих к поражению клапанного аппарата сердца: ревматизма, инфекционных эндокардитов, атеросклероза, сифилиса и более редких патологий, например карциноидной болезни.
Профилактика предполагает ведение здорового образа жизни, который включает:
- рациональное питание;
- достаточную физическую нагрузку;
- отказ от вредных привычек;
- избегание длительного психоэмоционального напряжения.
- своевременное лечение воспалительных заболеваний с рациональным использованием антибактериальных препаратов.
Вторичная профилактика — это система мероприятий, направленных на предотвращение органических изменений клапанного аппарата и нарушений насосной функции сердца. Проводится с помощью медикаментов, описанных выше [3].