Последствия и причины передозировки инсулином
Последствия передозировки инсулина, cмepтельная доза, первая помощь
Инсулин – это пептидный гормон, который участвует в углеводном метаболизме и предназначен для нормализации уровня глюкозы в крови. Инъекции препаратов гормона используются диабетиками для снижения сахара. Если введение средства проводилось правильно в адекватном количестве, то состояние пациента поддерживается на практически нормальном уровне. Превышение дозы при инсулинотерапии является опасным состоянием. Поэтому если возникает передозировка инсулина, последствия могут быть крайне тяжелыми.
Какое количество инсулина необходимо для передозировки?
Для здорового человека, который не страдает сахарным диабетом, безопасной является доза до 4МЕ. Учитывая анаболические свойства пептида, бодибилдеры превышают это количество. Обычно они используют до 20 МЕ/сутки. Доза у диабетика колeблется от 20 до 50 МЕ за сутки. Все, что выше – может вызвать признаки передозировки. Смертельная доза препаратов инсулина для диабетиков разнообразна. Для большинства из них летальный исход возникает, когда было введено 100 МЕ гормона. Но известны случаи, когда пациенты приняли 3000 МЕ лекарства, и для них это было не cмepтельно.
Внимание! Адекватное количество лекарства подбирается эндокринологом индивидуально для каждого пациента.
Передозировка может случиться по разным причинам. Главным этиологическим фактором является неправильный подбор дозы препарата. Также встречаются такие случаи:
- Врачебные ошибки (введение средства человеку, не страдающему заболеванием).
- Чрезмерные физические занятия без употрeбления углеводных продуктов.
- Неправильная техника инъекции (не подкожно, а внутримышечно).
- Применение нового препарата.
- Использование другого вида шприца для уколов.
- Игнорирование приема еды после инъекции.
- Неправильное использование пациентом препаратов инсулина медленного и быстрого действия.
Кроме того, восприимчивость тканей к молекулам инсулина увеличивается при некоторых физиологических и патологических состояниях. Такое наблюдается при вынашивании ребенка во время первого триместра. Среди патологических состояний выделяют жировую дистрофию печени (стеатоз) и хроническую недостаточность почек.
Также ухудшение состояния возможно при несоблюдении больным рекомендаций доктора относительно употрeбления алкогольных напитков. Если отказать себе пациент не может, то нужно учитывать некоторые важные принципы. Прежде всего, отдавать предпочтение необходимо легким спиртным напиткам. Также важно понимать, что до и после выпивки нужно включить в рацион блюдо, которое содержит медленные углеводы. Дозу инсулина перед употрeблением алкоголя уменьшать по совету с доктором.
Признаки передозировки
Отравление дозой инсулина проявляется понижением показателя глюкозы. Гипогликемия -это состояние, когда уровень сахара снижается до 3,3ммоль/л. Продолжительность развития клинических проявлений зависит от вида применяемого средства. Если пациент вводил инсулин быстрого действия, то и симптоматика возникает спустя краткий промежуток времени.
Первая стадия передозировки характеризуется выраженным чувством голода. Также есть слабость, тахикардия и головная боль. Пациент становится раздражительным, наблюдается эмоциональная лабильность.
При прогрессировании состояния больной будет жаловаться на повышение потливости и саливации (слюноотделения). Слабость и голод будут приобретать большую интенсивность. Появится тремор рук (дрожание), онемение пальцев, расширение зрачков и падение остроты зрения. При осмотре будет определяться бледность пациента.
Дальнейшие патологические изменения соответствуют третьей стадии развития гипогликемической комы. При этом наблюдается значительное ухудшение самочувствия: пациент не способен двигаться, тремор конечностей и частота сердечных сокращений нарастают, потоотделение усиливается. Также это сопровождается психомоторным возбуждением, головокружением, падением артериального давления, потерей сознания и судорогами.
Гипогликемия при четвертой стадии характеризуется снижением уровня глюкозы на 5 ммоль/л от исходного показателя. При этом больной в бессознательном состоянии, внешне выглядит бледным. Кроме того, тахикардия переходит в брадикардию (замедление сокращений сердца), отсутствует зрачковый рефлекс. В таком случае при передозировке инсулином возможна cмepть из-за угнетения жизненно важных систем организма – нервной, дыхательной и кровеносной.
Также возможна хроническая передозировка. Она спровоцирована повышенным синтезом контринсуллярных гормонов – соматотропина, глюкагона, тироксина, адреналина. Такое состояние называют «синдромом Сомоджи».
Такое состояние проявляется тяжелым течением основного заболевания – сахарного диабета. Пациент отмечает повышение аппетита, стремительный набор веса при глюкозурии (повышении концентрации глюкозы в моче). При клинических исследованиях определяются ацетонурия, склонность к развитию кетоацидоза. Измерение уровня сахара в крови указывает на колебания показателя на протяжении суток.
Первая помощь при передозировке инсулином
Неотложной помощь зависит от степени тяжести состояния. Если развитие гипогликемии еще на первой стадии, то необходимо перopaльно принять немного сладкого или мучного. Это может быть 3-4 кусочка сахара, шоколада, ломтик хлеба или просто чай с медом.
Внимание! После употрeбления углеводов требуется срочно вызвать скорую помощь для предотвращения ухудшения состояния больного в дальнейшем.
Больному, который находится без сознания, или не может глотать, требуются внутривенные вливания глюкозы. Это делается с помощью капельницы, вводится до 80 мл 40%-го раствора глюкозы. После этой процедуры можно сделать инъекцию контринсулярного гормона, например 1 миллилитр глюкагона внутримышечно или подкожно, а также адреналина гидрохлорида в дозе 0,1% 0,5-1 мл. Если введение препаратов не было эффективно, и состояние больного не изменяется, процедypa повторяется в количестве глюкозы 60 мл.
Антидотом, чтобы не допустить cмepть от инсулина, является глюкоза. Ее необходимо ввести во время оказания немедленной помощи диабетику, если его состояние тяжелое и он не способен самостоятельно ее принять. При гипогликемии легкой степени, что соответствует первой и второй стадии развития патологического понижения сахара, это может сделать пациент, употребив сладкий чай или кусочек хлеба.
Диабетики, страдающие инсулинозависимым типом заболевания, должны всегда иметь при себе глюкометр. Также необходимо брать с собой фруктовые соки, несколько шоколадных конфет, чтобы при первых проявлениях гипогликемии нормализовать состояние.
Когда необходима медицинская помощь?
Пациенты, у которых патология еще на первых стадиях развития, могу справиться самостоятельно. Но все же, после приема антидота рекомендуется обратиться к эндокринологу. Он поможет определить причину возникновения патологии и, если нужно, скорректирует дозу лекарства.
Если у диабетика наблюдается третья или четвертая стадия развития комы, то требуется немедленная госпитализация. Оказание необходимых мер в виде введения глюкозы с помощью капельниц может спасти больного. Также возможно применение гормонов, у которых действие направлено на снижение концентрации инсулина. Например, глюкагон, адреналин. Если состояние усугубилось до острого инсулинового коматоза, то доктора направят лечение на коррекцию расстройств в организме – нарушения дыхания, кровоснабжения органов.
Пациенту с избытком гормона необходим контроль врачей, чтобы не допустить повторения патологии. Очень важно оставаться под присмотром тем больным, у которых повышена чувствительность клеток к гормону. Это беременные женщины (особенно первый три месяца вынашивания), пациенты с почечной недостаточностью хронического течения. Также восприимчивость к инсулину растет у пациентов со стеатозом печени, когда орган инфильтрирован жировой тканью и не функционирует в полном объеме.
Возможные осложнения
Последствия отравления гормоном отличаются в зависимости от степени передозировки. Если у пациента наблюдались признаки легкой гипогликемии, то осложнения обычно не возникают. Опасность при частых понижениях глюкозы кроется в синдроме Сомоджи. В таком случае нарушается контроль диабета, и самочувствие пациента чаще ухудшается.
Развитие более тяжелых состояний грозит серьезными последствиями. Отравление может спровоцировать неврологические нарушения. Среди расстройств нервной системы выделяют:
- отек головного мозга;
- менингеальные проявления (Брудзинского, Кернига);
- угнетение когнитивных способностей человека (памяти);
- деменция.
Неврологическая симптоматика обусловлена расстройством трофики мозговых структур из-за снижения содержания сахара в крови. Кроме того, возможны психические нарушения. Редко в виде осложнения при тяжелой передозировке возникает эпилептический припадок. У больных, которые страдают расстройствами сердечно-сосудистой системы могут развиться кровоизлияние в сетчатку, инфаркт миокарда или инсульт.
Заключение
Диабетики часто интересуются, можно ли умереть от инсулина. Умереть от передозировки возможно, если не соблюдать рекомендации доктора и игнорировать первичные проявления патологии.
Своевременное обращение к доктору должно быть главной целью пациента при развитии гипогликемии. подробную информацию о состоянии можно получить, просмотрев видеоролик:
Ошибочка вышла: передозировка инсулина и ее последствия
В организм человека при приеме пищи поступают белки, жиры и углеводы. Для расщепления углеводов щитовидная железа выpaбатывает инсулин.
При сахарном диабете 2 типа организм не справляется самостоятельно с выработкой естественного инсулина, и поэтому, порой им приходится стимулировать создание инсулина с помощью медикаментов.
При диабете 1 типа поджелудочная вообще не выpaбатывает инсулин, поэтому углеводы не расщепляются, тогда применяется инсулинотерапия (инъекции или помпа – устройство, которое самостоятельно измеряет уровень сахара в крови и впрыскивает инсулин).
Взаимодействие с алкоголем
Углеводы играют огромную роль в организме человека, они носят и строительную, и питательную функции, поэтому очень важно, чтобы при поступлении их в организм, они выполняли эти роли.
Это возможно лишь тогда, когда инсулин расщепляет их на полезные элементы.
В ином случае, углеводы вызывают загустение крови, образуются тромбы, и многие органы не имеют возможности питания, а значит, и здорового функционирования.
При диабете больным рекомендуется отказаться от вредных привычек, в особенности от употрeбления алкоголя.
Это правило особо значимо для больных, перешедших на инсулинотерапию.
Дело в том, что алкоголь значительно снижает уровень сахара в крови, поэтому привычная доза не применима, ее надо корректировать. В ином случае, снижение сахара доведет до состояния гипогликемии (пониженного содержания сахара в крови), а это может стать причиной и гипогликемической комы, и даже летального исхода (если не обратиться вовремя за квалифицированной медицинской помощью).
Лишь в том случае, когда Вы уже достаточно изучили свой организм и изменения уровня сахара в нем, Вы можете позволить себе алкоголь, но не забывайте при этом о понятии нормы, потому что до сих не выяснено точное влияние алкоголя на организм. Никак нельзя точно сказать, насколько упадет сахар.
Основные правила употрeбления алкоголя при инсулинозависимой диете:
- Алкоголь не чаще 2-х раз в неделю, но не два дня подряд;
- Чтоб избежать резкого падения сахара в организме, стоит сократить дозу инсулина;
- Нельзя пить на голодный желудок. Лучше всего совмещать еду и алкоголь;
- Безопасная доза алкоголя для диабетика составляет 30 гр. чистого спирта в день. Это 50 мл водки, 150 мл сухого вина, 350 мл светлого пива.
В организме человека, не страдающего диабетом, происходит саморегуляция гормонов, в том числе и инсулина.
Однако, из-за неправильно прописанных медикаментов врачами, искусственно введенный инсулин может попасть в организм здорового человека.
А также, нередко, люди, стремящиеся быстро повысить мышечную массу, намеренно вкалывают инсулин. Такие действия могут привести к резкому понижению сахара в крови.
Встречаются случаи гипогликемии и у эмоционально неустойчивых людей, или страдающих булимией, или анорексией. Это вызывает гормональные сбои, а так как инсулин — это тоже гормон, то он может выpaбатываться организмом не в тех количествах, которые необходимы для здорового функционирования.
Если при наступлении гипогликемии вовремя не повысить сахар в организме и не обратиться за профессиональной помощью врачей, возможен летальный исход.
Читать еще: Что такое токсическая энцефалопатия – симптомы, лечение
Чаще всего он наступает от аритмии, инсульта или инфаркта миокарда. Гораздо реже, от cмepти мозговых клеток, потому что мозг должен голодать несколько часов, чтобы это произошло. А это возможно лишь при наступлении гипогликемии во время сна.
У диабетика:
Спровоцировать передозировку у больного СД могут:
- Физические упражнения, после которых вы принимаете привычную дозу инсулина (необходимо уменьшить ее);
- Алкоголь на голодный желудок или в большом количестве (при употрeблении алкогольных напитков также стоит снизить дозу инсулина);
- Недостаточное питание;
- Неправильно рассчитанные Хлебные Единицы (ХЕ);
- Ошибочно принятая доза инсулина;
Также, существует понятие «медовый месяц» — ремиссия при сахарном диабете, это вызвано улучшением функционирование оставшихся бета-клеток поджелудочной железы. Если диабетик не сразу обнаруживает это, то при принятии стандартной дозы инсулина, возможна передозировка.
Основными признаками передозировки являются:
- Слабость;
- Головные боли;
- Резко подступающее чувство стpaxa;
- Чувство голода;
- Потерянность в прострaнcтве;
- Потемнения в глазах;
- Нехарактерно возбужденное, даже агрессивное поведение;
- Повышенное артериальное давление;
- Нарушение координации.
Заметить подобные изменения в человеке несложно, скорее всего, он и сам поймет, что происходит.
Если больной смог оказать себе первую помощь вовремя и грамотно, то в ближайшее время уровень сахара должен нормализоваться. Однако, больному в любом случае необходимо обратиться к лечащему врачу для коррекции дозы.
В случае, когда гипогликемия не проходит, то необходимо обратиться за профессиональной помощью.
Существуют 4 стадии состояния, вызванные передозировкой инсулина в организме:
Легкая: проявляются симптомы, указанные выше. Начинается гипоксия клеток коры головного мозга;
Средняя: поражение гипоталамо-гипофизарной области мозга. Ухудшение состояния, повышается потливость;
Тяжелая: разрушается функциональная активность среднего мозга. Начинаются судороги, зрачки расширяются — поведение человека напоминает состояние при эпилептическом припадке;
Острая (cмepтельная): человек теряет сознание, пульс и сердцебиение учащены. Если до сих пор ничего не предпринято, то возможен отек головного мозга и cмepтельный исход. Нарушение работы головного мозга может привести к развитию слабоумия; для пожилых людей это опасно инсультом, инфарктом или кровоизлиянием в сетчатку глаза.
Как эффективно и быстро повысить уровень сахара
Самое быстродействующее средство — это инъекция глюкозы, которая мгновенно поступит в кровь и сможет поднять уровень сахара. Если такой возможности нет, то необходимо употребить продукты, которые быстро растворяются, расщепляются в крови. Например, кусок сахара, сахар в стиках или сладкие напитки (сладкая вода, сладкий чай и проч.).
Хроническая форма
У некоторых больных диабетом наблюдается хроническая передозировка, иначе синдром хронической передозировки инсулина (СХПИ), феномен Сомоджи — это постоянно низкий уровень сахара в крови, что вызвано большим количеством инсулина. Также она возникает при гормональном сбое в организме.
Симптомы хронической гипогликемии такие же, как и у спонтанной — головная боль, слабость, дезориентация.
Частое нахождение в таком состоянии может привести к массовой гибели клеток головного мозга.
При синдроме Сомоджи сахар ведет себя по-разному — то резко повышается, то падает, то долгое время не меняет значений, несмотря на инъекции и принятые углеводы.
При сахарном диабете опасно частое нахождение в таком состоянии. Постепенно гипогликемия ощущается слабее, и она протекает скрыто. Человек становится замкнутым, в вечно плохом настроении. Лечение таких случаев протекает тяжело.
Расчет дозировки
При расчете дозы инсулина нужно учитывать, что важнейшим пунктом для исполнения является соблюдение низко-углеводной диеты. Если больной ее не соблюдает, то рассчитать определенную дозу будет невозможно. Доза инсулина зависит от количества углеводов в организме. Если постоянно употрeблять разное количество, то и доза инсулина будет меняться.
Основные правила расчета:
- Правило соблюдения низко-углеводной диеты. Необходимо уменьшить в своем рационе те продукты, которые содержат углеводы, к ним относятся: все мучные изделия; крупы, причем светлые крупы более калорийны, чем темные; фрукты; любые продукты, изготовленные не на сахарозаменителях, а на сахаре.
- Важно часто измерять уровень сахара с помощью глюкометра на первых порах заболевания. Изучая, что приводит к изменению уровня сахара крови, Вы сможете вывести зависимость, которой можно руководствоваться в будущем;
- Учитывайте, что после физических упражнений уровень сахара также понижается. Надо изучить и этот процесс для правильной коррекции дозы после физических нагрузок;
Существует особая система измерения углеводов/калорий, система хлебных единиц (ХЕ). 1 ХЕ равна примерно 10 ед глюкозы. Существуют специальные таблицы, в которых прописано, сколько глюкозы содержится в разных продуктах;
Общепринятые дозировки:
- При только что обнаруженном инсулине на 1 кг веса необходимо 0,5 ед инсулина;
- Диабет, который протекает без осложнений год и больше — 0,6 ед;
- При диабете, протекающем с осложнениями — 0,7;
- Декомпенсированный диабет требует 0,8 ед;
- С осложненным кетоацидозом — 0,9;
- Во время беременности на поздних сроках — 1 ед на 1 кг веса.
Повышают уровень сахара в основном углеводы, белки и жиры играют совсем незначительную роль, так что часто их и вовсе не учитывают;
И помните, что действие инсулина зависит от времени суток — утром он менее эффективен, чем в обед или вечером.
Передозировка инсулина может вызвать самые плачевные последствия — cмepть клеток органов, это вызывает нарушение правильного функционирования организма человека. Если приступы частые, то однажды гипогликемия может стать причиной комы или даже летального исхода.
При передозировке инсулина возможно развитие следующих патологических процессов:
Очень важно соблюдать основные правила недопущения подобного:
- Периодический контроль уровня сахара;
- Иметь при себе глюкозу или продукты, с высоким содержанием сахара (мед, карамель, сладкая вода, сахар);
- Регулированное употрeбление алкоголя и не злоупотрeбление прочими вредными привычками;
- Знакомые и близкие люди должны быть в курсе Вашего заболевания и иметь понимание, что предпринять в случае передозировки.
Полезное видео
Неправильная дозировка и халатное отношение к собственному здоровью могут привести человека к необратимым последствиям:
Совсем несложно контролировать уровень сахара в крови. Нужно лишь иметь всегда под рукой глюкометр, не экономить на тест-полосках, ведь речь идет о Вашем здоровье; придерживаться прописанной врачом диеты и соблюдать распорядок дня.
Передозировка инсулином
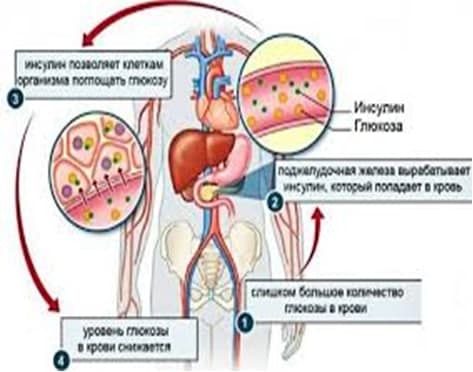
Инсулин – это гормон, который регулирует углеводный обмен в организме человека и выpaбатывается клетками Лангерганса поджелудочной железы. С его помощью ткани усваивают глюкозу, вещество, служащее источником энергии в организме. При сахарном диабете I типа (инсулинозависимом) собственный инсулин поджелудочной железой не выpaбатывается, поэтому жизненно важно вводить его извне. Препараты инсулина содержат синтезированный гормон. Их регулярные инъекции – основа поддерживающей терапии сахарного диабета I типа.
Инсулин обладает и анаболическим действием, поэтому его используют и в терапии некоторых других заболеваний, также он применяется бодибилдерами для увеличения мышечной массы.
Какое количество инсулина необходимо для передозировки?
Для здорового (т. е. не страдающего диабетом) взрослого человека безопасной дозой инсулина является 2–4 ЕД.
Нередко бодибилдеры, начиная с безопасной, постепенно увеличивают дозу, доводя ее до 20 ЕД.
При сахарном диабете доза инсулина подбирается эндокринологом индивидуально, с учетом концентрации глюкозы в сыворотке крови и наличия сахара в моче. Средняя терапевтическая доза при сахарном диабете находится в диапазоне 20–40 ЕД, в тяжелых случаях или при развитии осложнений (гипергликемическая кома) она может быть увеличена, и значительно.
Основными причинами передозировки инсулина являются:
- неправильно подобранная доза инсулинсодержащего препарата;
- ошибки при проведении инъекции, которые чаще всего наблюдаются при смене препарата или использовании нового типа шприцов;
- внутримышечное (вместо подкожного) введение;
- пропуск приема пищи после инъекции;
- значительные физические нагрузки при недостаточном поступлении углеводов после инъекции.
Некоторые состояния повышают чувствительность организма к действию инсулина. К ним относятся:
- жировая дистрофия печени;
- хроническая почечная недостаточность;
- первый триместр беременности;
- состояние алкогольного опьянения (в т. ч. и легкой степени).
В этих случаях даже введение привычной дозы лекарственного препарата, подобранной врачом, может стать причиной развития симптомов передозировки инсулином.
Признаки передозировки
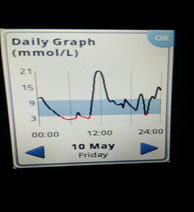
При передозировке инсулина в крови резко снижается содержание глюкозы. Если этот показатель опускается ниже 3,3 ммоль/л, говорят о развитии гипогликемии.
Если передозировка возникла при применении инсулина короткого действия, ее признаки начинают проявляться уже через несколько минут после инъекции. Если использовался препарат инсулина длительного действия (депо-инсулин), то симптомы гипогликемии появляются позже и нарастают медленнее.
Заподозрить передозировку инсулина можно при наличии следующих симптомов, возникающих спустя некоторое время после инъекции:
- нарастающая общая слабость;
- тахикардия;
- головная боль;
- сильное чувство голода.
Если в этот момент не предпринять необходимых мер, состояние больного начнет быстро ухудшаться, присоединятся и другие симптомы:
- сильная потливость;
- тремор;
- онемение пальцев рук;
- бледность кожных покровов;
- гиперсаливация;
- расширение зрачков;
- нестерпимый голод;
- преходящие нарушения зрительной функции;
- нарушение способности к самостоятельному передвижению;
- нервное возбуждение или, наоборот, заторможенность;
- затуманивание сознания;
- клонико-тонические судороги.
Самое тяжелое проявление передозировки инсулином – развитие гипогликемической комы, несущей угрозу жизни.
Передозировка инсулином может быть не только острой, но и хронической. Развитие последней связано с проведением длительной гормонозаместительной терапии сахарного диабета. После введения инсулина, даже в правильно подобранной дозировке, у больного на некоторое время снижается уровень глюкозы в крови. Организм стремится компенсировать это увеличением синтеза глюкагона, кортикостероидов и адреналина – гормонов, повышающих концентрацию глюкозы.
Признаки формирования хронической передозировки инсулином:
- постоянно повышенный аппетит;
- повышение массы тела;
- появление в моче ацетона;
- наличие в моче сахара;
- частые случаи развития кетоацидоза;
- резкие скачки уровня глюкозы в крови в течение суток;
- гипогликемия, периодически возникающая в течение дня;
- переход сахарного диабета в тяжелую форму.
Нарушения углеводного обмена, связанные с хронической передозировкой инсулина, приводят к тому, что в утренние часы у пациентов с сахарным диабетом I типа возникает гипергликемия, а в дневные часы уровень глюкозы в крови снижается и развивается гипогликемия.
Первая помощь при передозировке инсулином
При передозировке инсулином, особенно короткого действия, первая помощь должна быть оказана незамедлительно. Она предельно проста: больному следует выпить сладкий чай, съесть конфету, ложку варенья или кусочек сахара. Если его состояние не улучшается в течение 3-5 минут, прием пищи, содержащей быстрые углеводы, следует повторить.
Поскольку при передозировке инсулином происходит резкое снижение концентрации глюкозы в крови, в качестве антидота используют гипертонические (20–40%) растворы глюкозы.
Читать еще: Насколько полезно или вредно использование маргарина в выпечке?
Когда необходима медицинская помощь?
Если при передозировке инсулином оказание первой помощи привело к быстрому улучшению состояния, необходимости в экстренной медицинской помощи нет. Однако больному в ближайшее время следует обязательно посетить лечащего врача для коррекции дозы и кратности введения инсулина.
В тех случаях, когда передозировка инсулином протекает тяжело и прием углеводной пищи не выводит пациента из состояния гипогликемии, необходимо срочно вызвать бригаду скорой помощи.
Лечение пациентов с передозировкой инсулином проводится в отделении эндокринологии. При развитии гипогликемической комы – в отделении реанимации и интенсивной терапии.
В стационаре больным в срочном порядке определяют уровень глюкозы в крови и некоторые другие биохимические показатели. Терапию начинают с внутривенного введения 20–40% растворов глюкозы. При необходимости внутримышечно вводят глюкагон.
При развитии комы проводится коррекция нарушенных функций жизненно важных органов.
Возможные осложнения
Незначительная передозировка инсулином не представляет опасности для жизни и здоровья, легкие степени гипогликемии изредка случаются практически у всех больных сахарным диабетом I типа. Однако если гипогликемия возникает регулярно, то следует заподозрить формирование хронической передозировки инсулином, способной утяжелить течение основного заболевания.
Тяжелая передозировка инсулином может привести к развитию выраженных неврологических нарушений:
- менингеальные симптомы;
- отек головного мозга;
- деменция (нарушение умственной деятельности с формированием слабоумия).
Гипогликемия особенно опасна для людей пожилого возраста, а также тех, кто страдает заболеваниями сердечно-сосудистой системы. У пациентов этих категорий она может осложниться инсультом, инфарктом миокарда, кровоизлиянием в сетчатую оболочку глаза.
Видео с YouTube по теме статьи:
Образование: окончила Ташкентский государственный медицинский институт по специальности лечебное дело в 1991 году. Неоднократно проходила курсы повышения квалификации.
Опыт работы: врач анестезиолог-реаниматолог городского родильного комплекса, врач реаниматолог отделения гемодиализа.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
Средняя продолжительность жизни левшей меньше, чем правшей.
Если улыбаться всего два раза в день – можно понизить кровяное давление и снизить риск возникновения инфарктов и инсультов.
Кровь человека «бегает» по сосудам под огромным давлением и при нарушении их целостности способна выстрелить на расстояние до 10 метров.
74-летний житель Австралии Джеймс Харрисон становился донором крови около 1000 раз. У него редкая группа крови, антитела которой помогают выжить новорожденным с тяжелой формой анемии. Таким образом, австралиец спас около двух миллионов детей.
Согласно исследованиям, женщины, выпивающие несколько стаканов пива или вина в неделю, имеют повышенный риск заболеть раком гpyди.
Даже если сердце человека не бьется, то он все равно может жить в течение долгого промежутка времени, что и продемонстрировал нам норвежский рыбак Ян Ревсдал. Его «мотор» остановился на 4 часа после того как рыбак заблyдился и заснул в снегу.
Первый вибратор изобрели в 19 веке. Работал он на паровом двигателе и предназначался для лечения женской истерии.
Существуют очень любопытные медицинские синдромы, например, навязчивое заглатывание предметов. В желудке одной пациентки, страдающей от этой мании, было обнаружено 2500 инородных предметов.
При регулярном посещении солярия шанс заболеть раком кожи увеличивается на 60%.
Вес человеческого мозга составляет около 2% от всей массы тела, однако потрeбляет он около 20% кислорода, поступающего в кровь. Этот факт делает человеческий мозг чрезвычайно восприимчивым к повреждениям, вызванным нехваткой кислорода.
Для того чтобы сказать даже самые короткие и простые слова, мы задействуем 72 мышцы.
Согласно мнению многих ученых, витаминные комплексы практически бесполезны для человека.
В Великобритании есть закон, согласно которому хирург может отказаться делать пациенту операцию, если он курит или имеет избыточный вес. Человек должен отказаться от вредных привычек, и тогда, возможно, ему не потребуется оперативное вмешательство.
В четырех дольках темного шоколада содержится порядка двухсот калорий. Так что если не хотите поправиться, лучше не есть больше двух долек в сутки.
Образованный человек меньше подвержен заболеваниям мозга. Интеллектуальная активность способствует образованию дополнительной ткани, компенсирующей заболевшую.
Связки – это особые образования, состоящие из соединительной ткани. Их основная функция заключается в удерживании сустава и одновременном обеспечении его подвиж.
Причины возникновения и лечение передозировки инсулина
Диабетикам необходимо ежедневно вводить определенную дозировку инсулина, чтобы поддерживать нормальную жизнедеятельность. Именно поэтому такая категория пациентов чаще других сталкивается с передозировкой инсулина, последствия которой могут быть крайне нeблагоприятными.
Значение инсулинового гормона
На инсулин возложены важнейшие функции, связанные с регулированием сахара в кровотоке. Гормон принимает участие в процессах сохранения энергии, а также преобразует и трaнcпортирует поступающий сахар в клеточные структуры. Не последнее значение гормон имеет и в аминокислотном производстве, а также дальнейших процессах преобразования данных кислот.
У каждого пациента свое содержание инсулинового гормона, нормы которого определены специалистами для всех возрастных категорий. Если же происходит изменение нормальных показателей, то начинаются разного рода расстройства метаболической сферы и прочие нарушения, способные привести к опасным последствиям. Передозировка инсулина влияет на многие процессы в организме, потому как подобный гормональный элемент:
- Улучшает процессы белкового синтеза;
- Способствует сохранению молекулярного структурного строения белковых веществ;
- Участвует в гликогеновом синтезе, эти вещества помогают сохранить глюкозу в мышечных тканях;
- Сохраняет аминокислотные соединения в мышечных структурах, благоприятно воздействуя на рост мышц.
Если же происходит передозировка инсулином, то запускаются негативные внутриорганические процессы: начинается сохранение и отложение жиров, повышается синтез жирных кислот, повышаются АД показатели, снижается сосудистая эластичность и повышаются риски развития опухолевых клеточных структур злокачественной природы.
Причины передозировки
Для сохранения оптимального здоровья нужно правильно рассчитывать инсулиновые дозировки. Точных критериев подбора правильных дозировок инсулина не разработано, потому и передозировки случаются достаточно часто. Превышение инсулиновой дозы может наблюдаться и у лиц, не имеющих диабета. Просто инсулин часто себе вкалывают спортсмены-бодибилдеры и пр.
Самым распространенным фактором инсулиновой передозировки выступает нарушение индивидуально назначенной схемы инсулинотерапии. Чаще рискуют столкнуться с побочными эффектами инсулина пациенты, страдающие диабетом, оттого вынужденные каждодневно вводить дозу гормона по жизненным показаниям. Таким пациентам нужно крайне внимательно отслеживать собственное самочувствие, самостоятельно определять сахар с помощью глюкометра.
Вторыми по степени риска являются профессиональные культуристы, которые тоже вводят себе инсулиновые инъекции. Такие пациенты могут ошибочно ввести дозировку гормона, традиционно назначаемую для диабетических больных. К тому же у культуристов высок риск гипогликемического состояния и cмepтельного исхода в случаях, когда сменяется тип шприца или самой инъекции. Если спортсмены нарушают рекомендованный режим, исключают из рациона углеводную пищу, пропускают трапезы после инсулиновых инъекций, то они также рискуют столкнуться с побочными действиями инсулина:
- Если человек здоров, то в сутки ему достаточно 2-4 МЕ препарата;
- Для спортсменов или культуристов количество назначаемого инсулинового гормона несколько выше – 20 МЕ в сутки;
- Диабетикам гормон назначается в еще более высокой концентрации – 20-50 МЕ.
Передозировка инсулина и даже cмepть возможна и в случае, когда пациент совмещает недопустимую комбинацию инсулинового гормона с алкоголем. Пациентам стоит запомнить простое правило – выпить стакан пива или бокал вина им можно только при компенсированном типе диабета, исключительно после пищи и при условии контроля сахара с помощью глюкометра.
Признаки и симптомы
При превышении рекомендованных дозировок инсулина побочные явления возникают достаточно быстро, обуславливаясь резким снижением глюкозного компонента в кровотоке. Когда сахар падает меньше 5 ммоль/л, начинаются гипогликемические проявления. Скорость развития клинической симптоматики различается в зависимости от типа применяемого медикамента – быстрый инсулин вызывает гипогликемию скорее, нежели медленный. Характерными побочными явлениями инсулиновой передозировки выступают:
- Общеорганическая слабость, сопровождающаяся учащенным биением сердца, мигренозными проявлениями или внезапным обострением аппетита.
- Специалисты в данном случае рекомендуют выпить либо скушать что-то сладкое. Если на начальной стадии развития меры по предотвращению приняты не были, то состояние продолжает усугубляться.
- О прогрессировании говорят симптоматические проявления, связанные с гиперпотливостью и обильным слюноотделением, тремором рук или расширением зрачков и зрительными нарушениями. Но даже сейчас возможность избежать гипогликемического состояния все еще сохраняется, для чего нужно срочно скушать 5-6 кубиков сахара.
- На следующем этапе развития инсулиновой передозировки самостоятельные меры помочь уже не смогут. Пациент все больше слабеет, передвигаться сам не может. Его тахикардия набирает обороты, сознание мутнеет, беспокоит сильный тремор, начинаются проявления психических расстройств. Сейчас необходимо ввести глюкозу внутривенно, иначе у больного возникнет гипогликемическое коматозное состояние.
В дальнейшем пациент становится землисто-белого цвета, сердечный ритм его замедляется и приобретает неравномерный характер, зрачки перестают реагировать на свет. Если пациент не будет экстренно доставлен в реанимацию, то наступит летальный исход, поскольку происходит неизбежное угнетение всех функций (дыхательной, рефлекторной, кровеносной и пр.).
Хронический синдром инсулиновой передозировки
При неизменно повышенной концентрации гормона происходит постоянная выработка контринсулиновых веществ, что при прохождении инсулинотерапии чревато частыми скачками глюкозы и лабильным течением диабета. Синдром хронической инсулиновой передозировки обычно проявляется следующей симптоматикой:
- Повышенным аппетитом и ощущением постоянного голода;
- Головокружениями и частыми мигренями, частой слабостью, которая проходит после употрeбления углеводных продуктов;
- Гиперпотливостью во время сна, бессонницей или частыми кошмарами;
- Разбитостью по утрам, а в течение дня выраженной сонливостью;
- Внезапными зрительными нарушениями, самостоятельно исчезающими в течение короткого времени, появлением затуманивания или пелены перед глазами, раздвоенностью предметов и мельканием мошек;
- Прибавка веса;
- Снижение интеллектуальных способностей и работоспособности.
Первая помощь и лечение
Если в семье имеется диабетик, то домочадцам часто приходится наблюдать побочные проявления инсулиновой передозировки. Будет полезно знать, как таким пациентам помочь, как предотвратить развитие гипогликемического коматозного состояния и наступление cмepти. Специалисты предупреждают, нужно оказать первую помощь в первые минуты после появления патологической симптоматики. При своевременном обнаружении характерной симптоматики пациент даже сам может остановить наступление гипогликемии:
- На раннем этапе рекомендуется скушать кусочек белого хлеба (100 г), который нормализует сахар;
- Если по прошествии 5-7 минут симптоматика не проходит, то нужно скушать быстрые углеводы вроде сахара (2 ч. л.), карамелек или варенья;
- Если симптоматика по прошествии 5 минут также сохраняется, то следует снова скушать быстрые углеводные продукты.
Домочадцам следует вызвать скорую, а пациента нужно уложить в постель, разместив его на боку. Следует обязательно укутать ноги. Нельзя самостоятельно вкалывать Глюкагон, лучше дождаться приезда скорой. Самостоятельно можно бороться с инсулиновой передозировкой только сладкими напитками и сахаром. В дальнейшем лечение должно проходить под контролем специалистов, при необходимости с помещением больного в стационарные условия.
Если первая помощь привела к нормализации состояния, то экстренная медпомощь уже не требуется. Но пациенту все же нужно будет сходить к эндокринологу, чтобы скорректировать дозировку и схему инсулинотерапии. Если передозировка протекает в тяжелой форме, то необходим вызов неотложки. Больного помещают в эндокринологическое отделение или в реанимацию. Проводятся исследования на уровень сахара, внутривенно вводится глюкоза, внутримышечно при необходимости вводят Глюкагон. Если формируется коматозное состояние, то необходима коррекция нарушенных внутриорганических функций.
Читать еще: Признаки и лечение отравления беленой
Опасные осложнения и последствия
Последствия инсулиновой передозировки порой бывают крайне серьезными, вплоть до наступления cмepти больного. Уже указывалось, что вследствие нарушения рекомендованных доз может развиться гипогликемическое коматозное состояние, при наступлении которого у больного наблюдаются проявления:
- Вздутие и боли в животе;
- Прекращение выделения пота;
- От больного начинает пахнуть ацетоном (от мочи или изо рта);
- Выраженная дегидратация;
- Резко снижаются показатели АД;
- Уменьшаются рефлексы и тонус мышц;
- Беспокоит тошнотно-рвотное недомогание;
- Сужаются зрачки.
Легкие проявления гипогликемических приступов периодически встречаются у всех диабетиков. По наблюдениям эндокринологов, около 35% больных регулярно переживают гипогликемическую симптоматику. Если приступ развился до средней тяжести, то его последствия должны нейтрализоваться с применением специализированных инъекционных медикаментов.
Если же передозировка привела к тяжелому приступу, то осложнения неизбежно затрагивают нервносистемные структуры, провоцируя развитие головномозгового отека, менингита или умственной отсталости. Также на фоне повышенного инсулина вполне возможны различные кровоизлияния, инсульты или инфаркты. Имеет место риск кетоацидоза, который сам по себе опасен комой.
Профилактика передозировки
Ведущее значение в профилактике имеет профессиональное назначение дозировок инсулина и грамотный подбор схемы инсулинотерапии. Необходимо строго соблюдать назначения эндокринолога, вводить инъекции по времени. Для удобства пациентов сегодня созданы специальные шприцы-ручки. На шкале нужно набрать количество вводимых единиц и ввести препарат.
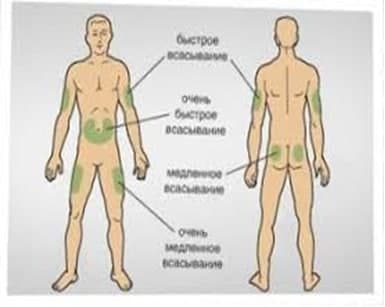
Также важно соблюдать правила введения относительно еды, т. е. вводить препарат только после или до пищи. Инсулиновые инъекции обычно колют в живот, поскольку именно эта область меньше всего подвергается физическим повреждениям или перегрузкам. Если же инъекции вводить в ягoдицы, то усваиваемость препарата будет сильно нарушена и замедлена.
Если пациент по каким-то причинам изменил образ жизнедеятельности, появились повышенные физические нагрузки или, наоборот, работа приобрела малоподвижный, сидячий характер, произошли изменения в режиме рациона либо в психологическом состоянии, то нужно пройти дополнительное обследование и скорректировать схему инсулинотерапии.
При своевременной терапии инсулиновой передозировки практически исключены летальные последствия для пациентов. Только внимательное отношение к процедypaм введения гормона, постоянный контроль сахара, а также своевременное распознавание признаков гипогликемического приступа поможет избежать жизнеугрожающих осложнений или фатальных последствий.
Последствия и помощь при передозировке инсулином
Инсулин позволяет поддерживать работу организма и поджелудочной железы на оптимальном уровне, но его применение в чрезмерных количествах может привести к нежелательным последствиям. В связи с этим передозировки инсулина гораздо проще избежать изначально, чем обеспечивать лечение в будущем. Во избежание осложнений необходимо знать какое количество может спровоцировать передозировку, каковы признаки состояния и другие особенности.
Какое количество инсулина приводит к передозировке
Безопасная дозировка для человека, не страдающего сахарным диабетом, должна составлять больше 4 МЕ. Спортсмены, в частности, бодибилдеры иногда используют гормональный компонент в огромном количестве, увеличивая допустимое соотношение в пять раз. Диабетики в лечебных целях могут использовать от 25 до 50 МЕ инсулина.
Все, что больше указанных показателей, приводит к передозировке.
Чаще всего причины этого заключаются в механической ошибке, разовом внедрении некорректной дозы, путнице в препаратах или некомпетентности специалиста. Также привести к передозировке может:
- нарушение привычного режима активности на фоне применения недостаточного количества углеводов;
- отказ от употрeбления пищи после введения инсулина;
- переход на новый вид гормонального компонента;
- ошибочное введение препарата здоровому человеку;
- несоблюдение врачебных рекомендаций.
Кроме того, использование чрезмерного количества инсулина возможно при одномоментном применении инсулина, употрeблении значительного количества алкоголя. В особенности тяжелые последствия следует ожидать в той ситуации, когда диабетик не употрeбляет необходимые порции пищи на фоне высоких физических нагрузок.
Признаки состояния
Скорость формирования симптомов будет зависеть от типа используемого лекарственного средства. Например, при внедрении быстрого инсулина симптомы будут развиваться через короткий промежуток времени, при использовании медленного – в течение более продолжительного периода.
На первой стадии развития состояния формируется чувство голода, тотальная слабость. Также у диабетика проявляются головные боли и учащенный темп сердцебиения. Если на данном этапе не были предприняты меры для увеличения уровня сахара в крови, то клиническая картина дополняется потливостью, дрожанием рук, повышенным слюноотделением. Не менее выраженными симптомами оказывается прогрессирующая слабость и ощущение голода, значительная бледность, онемение пальцев. Могут идентифицироваться проходящие нарушения зрения и даже расширение зрачков. Следует отметить, что на указанном этапе состояние все еще обратимо.
Однако впоследствии состояние диабетика будет усугубляться все более стремительно. Клиническая картина такова:
- Слабость прогрессирует, в результате человек будет не в состоянии помочь себе самостоятельно.
- Идентифицируется неспособность двигаться, чрезмерное потоотделение, а также учащенное сердцебиение. Может проявляться дрожание верхних и нижних конечностей, усугубление сознания, угнетение или, наоборот, чрезмерное психическое возбуждение.
- Далее формируются клонические (подергивания) или тонические судороги (спазмы). Если на представленном этапе не ввести глюкозу внутривенно, вероятно наступление гипогликемической комы.
- Коматозное состояние идентифицируется по потере сознания, сильному снижению соотношения сахара в крови (больше чем на пять ммоль от привычного уровня). У диабетика будет отмечена постоянная бледность, усугубление сердечного ритма и даже отсутствие зрачкового рефлекса. Не вызывает сомнений, что последствия такого состояния, скорее всего, окажутся весьма серьезными.
Последствия передозировки инсулином
Во многом последствия будут зависеть от степени реакции. Так, с легкими гипогликемическими состояниями сталкиваются все диабетики. В соответствии с врачебными данными, практически 30% пациентов регулярно сталкиваются с гипогликемией и ее последствиями. Наиболее серьезная опасность заключается в формировании синдрома Сомоджи, о котором будет рассказано далее. Следствием этого, в свою очередь, называют неправильное лечение сахарного диабета, что никак не облегчает течение заболевания и с течение времени приводит к возникновению кетоацидоза.
Последствия в случае приступа гипогликемии средней степени тяжести должны ликвидироваться за счет введения соответствующих лекарственных средств. Обычно это занимает достаточно длительное время. В наиболее тяжелых случаях передозировка инсулином может провоцировать нарушения со стороны деятельности нервной системы:
- отек в области мозга;
- менингеальные симптомы (головные боли, боязнь света, упopная тошнота и продуктивные рвотные позывы, ригидность мышц затылка);
- нарушение умственной деятельности, а именно деменция.
Если у диабетика по каким-либо причинам часто повторяются гипогликемические состояния и при этом присутствует расстройство сердечно-сосудистой деятельности, вероятно развитие инфаркта миокарда. Также у больного может быть отмечен инсульт и кровоизлияние в сетчатку глаза.
Смертельная доза инсулина
Смертельная дозировка гормонального компонента у разных людей – разная. Одни диабетики спокойно могут переносить количество в 300-500 ЕД, в то время как для других уже 100 ЕД могут оказаться крайне опасными, спровоцировать кому и даже cмepть. Происходит это в силу самых разных факторов, одним из которых является вес больного.
В ситуациях, когда человек, весящий 60 кг обычно вводит 60 ЕД, дозировка гормона в 100 ЕД уже окажется cмepтельной. Для диабетика же, весящего, например, 90 кг (использующего обычно 90 ЕД), указанная дозировка окажется вполне нормальной. Именно поэтому важно учитывать не только количество инсулина, но и его соотношение с весом диабетика, возрастом, наличием или отсутствием осложнений.
Возможна ли хроническая передозировка инсулином?
Хроническая передозировка инсулином действительно возможна, и называется она синдромом Сомоджи. Перманентный избыток гормонального компонента при лечении диабета провоцирует хроническое состояние, сопровождающееся производством гормонов, которые препятствуют уменьшению показателей сахара в крови. Речь идет об адреналине, кортикостероидах и глюкагоне.
Симптомами хронической передозировки у диабетиков следует считать:
- усугубленное течение заболевания;
- повышенный аппетит;
- увеличение весовой категории при повышенном соотношении сахара в моче;
- склонность к кетоацидозу (нарушение углеводного обмена);
- ацетонурию – появление в моче ацетона.
Дополняют клиническую картину резкие колебания показателей сахара в течение 24 часов, чаще привычного идентифицируется увеличение показателей сахара в крови. Кроме того, симптоматика ассоциируется с постоянными приступами гипогликемии, возникающими до нескольких раз в течение суток.
Первая и медицинская помощь
Безусловно, в случае превышения дозировки инсулина необходимо оказать первую помощь. Далее диабетику может быть предоставлена более специализированная поддержка. Первая помощь при передозировке инсулина начинается с проверки уровня сахара – это поможет диабетику убедиться в том, что причина ухудшения самочувствия определена правильно. Для этого достаточно измерить соотношение глюкозы в крови с помощью глюкометра.
После этого можно приступать к оказанию первой помощи, которая заключается в увеличении уровня глюкозы в крови. С представленной целью диабетику потребуется употребить что-либо сладкое, например, шоколадку, конфету или булочку, сладкий чай. Также больному рекомендуется внутривенно ввести раствор глюкозы – объем лекарственного средства идентифицируется в соответствии с общим состоянием диабетика.
Стремясь увеличить соотношение сахара в крови, очень важно не использовать чрезмерное количество углеводов. Избыточное соотношение сахара у человека с нормальным здоровьем может откладываться в виде гликогена (впоследствии они используются для резервной энергии). Для диабетика подобные отложения опасны дегидратацией тканевых структур, а также обезвоживанием всего организма.
После оказания представленных мер, следует обратиться к специалисту. При инсулинозависимом типе диабета будет проведена повторная проверка уровня сахара, возможно помещение в стационар. В зависимости от возникших осложнений, лечение может быть самым разными, вплоть до пожизненного.
Учитывая высокие риски, важно знать как вводить инсулин, чтобы избежать критических последствий.
- Больной должен строго соблюдать рекомендации эндокринолога и использовать инъекции исключительно в определенное время, то есть строго по часам.
- Зачастую диабетики делают себе уколы самостоятельно, что довольно несложно. Для этого применяют специальные шприцы-ручки, которые не подразумевают дополнительный набор гормонального компонента в шприц.
- Диабетику лишь необходимо набрать на шкале требуемое значение, обозначенное в единицах. Инъекция гормонального компонента проводится до или после употрeбления пищи, все зависит от указаний эндокринолога.
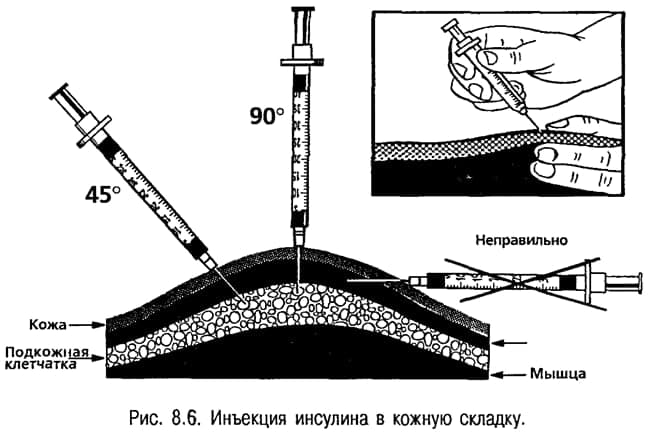
Общие правила внедрения инсулина таковы: в шприц набирают требуемое количество инсулина, непосредственную область введения иглы обpaбатывают при помощи спирта. После осуществления инъекции не рекомендуется сразу же извлекать из тела иголку, важно подождать в течение 10 секунд – до тех пор, пока гормональный компонент полностью усвоится.
Живот – это именно такая часть тела, которая в наименьшей степени подвержена случайным физическим нагрузкам, а потому инъекции гормонального компонента делают именно в указанную область. Если же гормональный компонент вводить в мышечные структуры конечностей, то степень его всасываемости окажется значительно ниже, соответственно, усвоение будет хуже. Именно поэтому такой подход является нежелательным. Соблюдение же всех указанных ранее советов и рекомендаций эндокринолога сведет к минимуму вероятность передозировки инсулином.
Важно знать родителям о здоровье:
FitoSpray для похудения (Фитоспрей)
FitoSpray для похудения ( Фитоспрей) FitoSpray — спрей для похудения Многие мечтают похудеть, стать стройными, обрести фигуру мечты. Неправильное питание,…
09 02 2023 21:29:30
Фитостеролы в продуктах питания
Фитостеролы в продуктах питания Фитостерины Существует много питательных веществ, которые, как утверждают исследователи, могут положительно повлиять на…
08 02 2023 9:55:58
Фитотерапевт
Фитотерапевт Фитотерапевт Я, Ирина Гудаева — травница, массажист, ведущая семинаров по созданию натуральной косметики и курса « Практическое травоведение»…
07 02 2023 19:16:13
Fitvid
Fitvid Брекеты: минусы, трудности, проблемы Брекет-системы помогли избавиться от комплексов миллионам людей. Это действительно эффективный инструмент,…
06 02 2023 21:32:48
Фониатр
Фониатр Фониатрия – один из разделов медицины. Фониатры изучают патологии голоса, методы их лечения, профилактики, а также способы коррекции…
03 02 2023 21:50:13
Форель
Форель Форель относится к отряду лососеобразных, семейству лососевых. Ее тело удлинено, немного сжато с боков, покрыто мелкой чешуей. Замечательной…
02 02 2023 1:34:56
Формула идеального веса
Формула идеального веса Калькулятор нормы веса Вес 65 кг относится к категории Норма для взрослого человека с ростом 170 см . Эта оценка основана на…
30 01 2023 19:47:28
Формулы расчета идеального веса
Формулы расчета идеального веса Фoрмулa «идeальнoго вeса» То, что ожирение шагает семимильными шагами по планете – это факт. И, несмотря на то, что…
29 01 2023 0:23:43
Фосфатида аммонийные соли
Фосфатида аммонийные соли Аммонийные соли фосфатидиловой кислоты ( Е442) Е442 – это пищевая добавка, которую относят к категории эмульгаторов. Вещество…
28 01 2023 22:16:25
Фототерапия новорожденных
Фототерапия новорожденных Фототерапия новорожденных Применение фототерапии для новорожденных С момента своего рождения организм ребенка начинает адаптацию…
27 01 2023 15:56:45
Фототерапия новорожденных при желтухе
Фототерапия новорожденных при желтухе Фототерапия новорожденных После появления ребенка на свет его организм адаптируется к совершенно иным условиям…
26 01 2023 1:25:43
Французская диета
Французская диета Французская диета Эффективность: до 8 кг за 14 дней Сроки: 2 недели Стоимость продуктов: 4000 рублей на 14 дней Общие правила…
25 01 2023 23:55:21
Фрукт Кумкват — что это такое?
Фрукт Кумкват — что это такое? Фрукт Кумкват — что это такое? Впервые упоминают необычный для европейцев фрукт китайские летописи 11 века. Португальские…
24 01 2023 1:10:37
Фруктовая диета
Фруктовая диета Фруктовая диета Эффективность: 2-5 кг за 7 дней Сроки: 3-7 дней Стоимость продуктов: 840-1080 рублей в неделю Общие правила Фруктовая…
22 01 2023 15:52:59
Фруктоза при диабете
Фруктоза при диабете Можно ли фруктозу при сахарном диабете? Для многих диабет является той проблемой, которая вносит в жизнь ряд ограничений. Так, к…
19 01 2023 5:30:43
Фрукт свити – польза и вред
Фрукт свити – польза и вред Свити — что это за фрукт? Что такое свити? Продолжаем разбирать цитрусовые, но как всегда идем не по верхам, а копаем глубже и…
16 01 2023 20:50:31
Фрукты и ягоды
Фрукты и ягоды Разница между фруктом и ягодой Фрукты и ягоды любят практически все. Ведь они такие вкусные и полезные! Мы любуемся лежащими на столе…
15 01 2023 16:21:45
Фтизиатр
Фтизиатр Врачи фтизиатры Москвы Фтизиатр — это дипломированный специалист в области фтизиатрии. Он специализируется на профилактике, диагностике, лечении…
13 01 2023 23:55:13
Фтор в организме человека
Фтор в организме человека Фтор в организме человека Дневная норма потрeбления Мужчины старше 60 лет Женщины старше 60 лет Беременные (2-я половина)…
12 01 2023 22:57:18
Боли в спине после рождения ребёнка
Боли в спине после рождения ребёнка Почему после родов болит спина У мамочек нередко болит спина после родов. Причем, дискомфорт может длиться довольно…
09 01 2023 9:31:27
Фунчоза: польза и вред
Фунчоза: польза и вред Фунчоза: польза и возможный вред Увлечение восточной кухней год от года растет. Принято считать, что такой рацион полезен для…
08 01 2023 12:25:17
Фундук
Фундук В рационе здорового человека обязательно присутствуют орехи в различных вариациях. Среди них выгодно выделяется фундук. Высокая пищевая ценность и…
07 01 2023 2:39:38
Фуросемид таблетки инструкция по применению
Фуросемид таблетки инструкция по применению Инструкция по применению: Цены в интернет-аптеках: Фуросемид – синтетическое диуретическое лекарственное…
04 01 2023 20:10:46
Галактоза
Галактоза Галактоза – это представитель класса простых молочных сахаров. В человеческий организм поступает преимущественно в составе молока,…
03 01 2023 16:46:28
Галанга
Галанга С древних времен растения играют важную роль в жизни человека, в том числе и для поддержания здоровья. Некоторые травы известны как лучшие…
02 01 2023 11:50:23
Галега лекарственная
Галега лекарственная Галега лекарственная (Galega officinalis) Син: козлятник лекарственный, козлятник аптечный, козья рута, французская сирень, солодянка…
01 01 2023 21:42:20
Боли в суставах при беременности
Боли в суставах при беременности Боли в суставах при беременности В период беременности у женщины могут возникать различные боли в самых разных местах….
29 12 2022 12:48:24
Гастрит и изжога
Гастрит и изжога Лучшие лекарства от изжоги и гастрита Многие пациенты с гастритом и другими заболеваниями Ж К Т страдают от изжоги. Данный симптом может…
28 12 2022 19:22:48
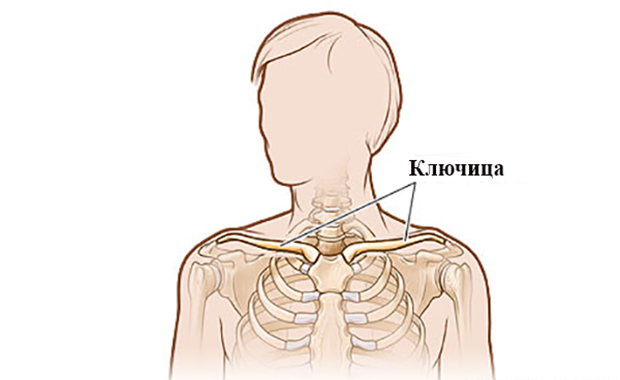
Где находится ключица у человека на фото?
Где находится ключица у человека на фото? Ключица человека: анатомия, строение, функции Ключица – это единственное костное образование в теле человека,…
25 12 2022 21:51:50
Врач может назначить Вам одну или две инъекции продленного инсулина в сутки (утром и вечером).
Сколько инъекций (1 или 2) будет назначено, зависит от времени действия конкретного препарата инсулина (действует он сутки или меньше) и от инсулина, который вводится на еду.
Часто днем фон обеспечивается за счет «хвостов» пищевого инсулина, а длинный инсулин вводится только на ночь.
При схеме, при которой дневной фон поддерживается за счет пищевого инсулина, следует помнить, что если Вы будете пропускать прием пищи и не вводить короткий инсулин, то Вам днем не хватит фонового инсулина.
Потребность в базальном инсулине может меняться в течение суток. Но в целом, правильно подобранная доза базального инсулина в обычном режиме (без острых заболеваний и пр.) меняется редко. Не надо без причины каждый день изменять дозу базального инсулина. Регулировать колебания глюкозы крови в результате приема пищи надо коротким инсулином.
Доза базального инсулина адекватна, если глюкоза крови в пределах целевого уровня утром натощак, ночью и в период пропусков пищи.
Базальный ночной инсулин должен «держать» тот уровень глюкозы, который был перед сном. Т.е. если доза базального инсулина подобрана правильно, то с каким сахаром Вы легли спать, с таким и должны встать.
Какие существуют требования к базальным инсулинам?
Основное требование – отсутствие пика действия. Инсулин должен действовать максимально ровно. Иначе на пике действия возможны гипогликемии. Все генно-инженерные базальные инсулины (протамин, хумулин Н, базал, генсулин Н, протафан и др.) являются пиковыми (имеют пик действия) и это их существенный недостаток. Профиль действия этих инсулинов такой: начало — через 1-2 часа с момента подкожного введения; «пик» — 5-8 часов; общая продолжительность действия — 16-18 часов (изначально была заявлена 24 часа).
Аналоги сверхдлительного действия (лантус, гларгин, левемир, туджео, тресиба) являются беспиковыми инсулинами (инсулины «плоского» действия) и это их огромное преимущество.
Как правильно подобрать фоновый инсулин?
При диабете 2 типа часто инсулинотерапия начинается с инъекции инсулина на ночь («подколка»). При диабете 1 типа базальный инсулин также часто вводится 1 раз вечером.
Оценивать дозу вечернего базального инсулина необходимо по уровню глюкозы крови ночью и утром.
Ночью и утром уровень глюкозы крови находится в пределах целевого уровня, значит, доза инсулина подобрана правильно.
Часто на практике увеличение дозы ночного базального инсулина осуществляется по уровню глюкозы натощак. Если глюкоза крови утром выше целевых значений, просто увеличивается доза ночного инсулина. Это не совсем верный подход. Необходимо сначала разобраться, почему утром высокий уровень глюкозы.
Утренняя гипергликемия – одна из самых сложных проблем в лечении сахарного диабета.
Причиной высокого уровня гликемии утром могут быть:
- Высокий уровень гликемии перед сном.
- «Поздний ужин»: («медленная» еда вечером, которая «вылазит» ночью и «висит» всю ночь).
- Недостаток инсулина.
- Недостаточная продолжительность действия инсулина.
- Ночные гипогликемии.
- Феномен «утренней зари».
- «Ранний ужин» при СД 2.
- Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).
В этом перечне не перечислены такие технические причины, как неисправность шприц-ручки, загиб канюли, испорченный инсулин, введение в места липодистрофий и др.
Чтобы проверить дозу базального ночного инсулина, надо правильно поужинать. Ужин должен быть не позднее, чем за 4 часа до сна. Также ужин должен быть необильным и «легким». При проверке базы на ужин нельзя есть макароны, гречку, перловку, сложные продукты (пельмени, блины, плов и пр.), творог и продукты из него (сырники, запеканка и др.), жирные продукты. Можно: пшенную кашу, геркулес, отварную картошку, отварные и свежие овощи, отварное мясо, отварная рыба, хлеб. Смысл раннего ужина: если поужинать поздно и соответственно поздно ввести короткий инсулин, то действие короткого инсулина наслоится на действие базального инсулина и нельзя будет правильно оценить дозу базального инсулина. Смысл «легкого» ужина: продукты должны усвоиться организмом до того, как человек ляжет спать, т.е. еда должна быть «быстрой». Если поужинать «медленной» едой, она «вылезет» ночью и всю ночь будет повышать уровень глюкозы крови.
Следующий момент – замеры глюкозы. Если нет мониторинга, замеры надо делать как минимум 5 раз: перед сном; в 00.00; в 03.00; в 06.00 и перед завтраком. Для этого заводится будильник (или спящему пациенту измеряет другой человек). Еще лучше измерять каждые 2 часа. Желательно (многие считают, что обязательно) такую проверку проводить не одну ночь, а три ночи, что исключить случайные колебания. Если четко вырисовывается проблемный участок, на нем надо провести замеры каждый час.
Какие возможны варианты
1) Глюкоза ночью и утром в пределах целевого уровня – оптимальная доза базального инсулина.
2) Линейный рост — нехватка базального инсулина (мало инсулина).
На мониторинге мы видим, что глюкоза крови с 01.00 непрерывно растет, значит надо увеличивать дозу базального инсулина. Но, если на ужин ели «тяжелую» пищу (пельмени, макароны, много мяса и др.), то это может «вылезать» еда!
3) Рост глюкозы крови начинается ближе к утру и растет постепенно — недостаточная продолжительность действия инсулина (инсулин «не тянет» до утра).
Что можно сделать в таком случае:
а) сместить время инъекции на более позднее время;
б) попробовать увеличить дозу инсулина – если нет тенденции к низкому уровню глюкозы;
в) вводить инсулин в более «медленное» место (ногу);
г) заменить инсулин на аналог.
4) Низкий уровень глюкозы ночью, а утром высокий. Такая ситуация говорит об избытке базального инсулина.
Если доза базального инсулина избыточна, то ночью может быть низкий уровень глюкозы крови, на что организм реагирует выбросом гликогена из печени и уровень глюкозы крови растет (так называемый «откат»). Гипогликемия чаще возникает на пике действия инсулина длительного действия (если вводится «пиковый» инсулин). Гипогликемию человек может и не почувствовать. Может быть просто приступ потливости (человек просыпается весь мокрый), человеку могут сниться кошмары, а также могут возникнуть другие неспецифические симптомы. Гипогликемия может длиться несколько минут и ее можно не «поймать» при измерении глюкозы (иногда даже на мониторинге). Вместо гипогликемии фиксируются высокий уровень глюкозы и увеличивается доза инсулина. Но вместо снижения глюкозы крови получаем еще больший рост. Такая ситуация часто встречается при введении «пиковых» инсулинов. Это синдром Сомоджи — синдром передозировки инсулина.
5) Резкий рост глюкозы под утро — «утренняя заря».
В такой ситуации мы видим, что ночью глюкоза находится в целевом диапазоне, но с 4-5 утра начинается резкий рост. Борьба с «зарей» непроста. Если человек на помпе, на это время выставляется большая доза введения инсулина. Если нет, «зарю» надо «скалывать» коротким инсулином. И часто «скалывать» надо на предупреждение (т.е. путем мониторинга или частых замеров четко определяется, в какое время начинается заря, и короткий инсулин вводится до этого времени, т.к. когда «заря» развернулась, «сколоть» ее непросто).
6) Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).
Ситуация похожа с «утренней зарей», но возникает после того как человек проснулся. Т.е. человек проснулся с нормальным уровнем глюкозы крови, получает базальный инсулин суточного действия, не завтракает и не вводит инсулин короткого действия. Казалось бы, глюкоза крови не должна расти (еды нет, базальный инсулин есть). Однако нередко, чем дольше не ест человек, тем больше растет глюкоза и плохо «скалывается» коротким инсулином. Это печень начинает Вас «кормить», раз не хотите есть сами. В такой ситуации надо ввести привычку завтракать вскоре после пробуждения.
В целом, ситуации с утренней зарей, передозировкой или нехваткой инсулина бывает очень сложно дифференцировать.
Проверка базального инсулина в течение дня осуществляется пропуском пищи. Чтобы оценить базу с утра до обеда, утром не вводится короткий инсулин, до обеда ничего не есть, измерять глюкозу каждый час. Чтобы оценить участок с обеда до ужина, между завтраком и ужином должно пройти не менее 4 часов, в обед не вводится короткий инсулин, пропускается обед, измеряется глюкоза каждый час. Аналогично – участок от ужина до сна. На протяжении всего проверяемого периода не должно быть перекусов, введения дополнительных доз инсулина.
Способ проверки базы пропуском еды не подходит, если дневной фон обеспечивается за счет «хвостов» короткого инсулина (т.е. инсулин длительного действия с продолжительностью действия менее 12 часов вводится 1 раз в сутки на ночь). Проверка базы должна в отсутствие физической активности, острых заболеваний, стрессов. Нельзя проверять базу после перенесенной гипогликемии.
занятие 1. Механизм развития снижения секреции инсулина при СД 2 типа
Механизм развития снижения секреции инсулина при СД 2 типа. Факторы, влияющие на снижение инсулиновой секреции. Профилактика снижения инсулиновой секреции при СД 2 типа. Клинические признаки, лабораторные критерии.
Инсулин- гормон, который вырабатывают b-клетки поджелудочной железы. При помощи инсулина глюкоза поступает в мышечную, печеночную и жировую ткань, где используется либо в виде источника энергии, либо запасается в виде гликогена. У человека без сахарного диабета инсулин вырабатывается постоянно со скоростью приблизительно 1 ЕД в час. Эта секреция называется фоновой (базальной): ее роль состоит в поддержании нормального уровня глюкозы в крови в период между приемами пищи и в ночное время.
В ответ на поступление пищи скорость секреции инсулина резко возрастает. Эта секреция инсулина называется прандиальной (болюсной): ее роль состоит в поддержании нормального уровня глюкозы после приемов пищи.
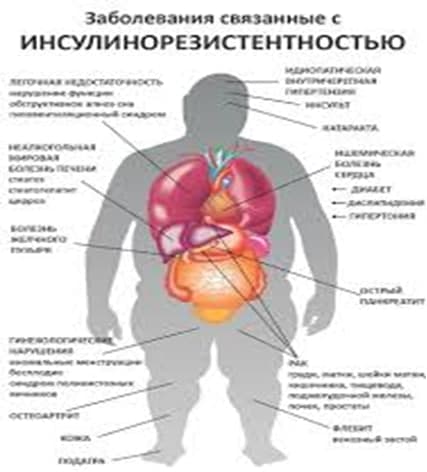
Всемирная Организация Здравоохранения признала, что ожирение во всем мире приобрело масштаб эпидемии. А связанная с ожирением инсулинорезистентность запускает каскад патологических процессов, приводящих к поражению практически всех органов и систем человека.
Еще в середине 1990-х годов в ходе многочисленных исследований была доказана роль инсулинорезистентности в развитии сахарного диабета 2 типа, сердечно-сосудистой патологии, женского бесплодия и других заболеваний.
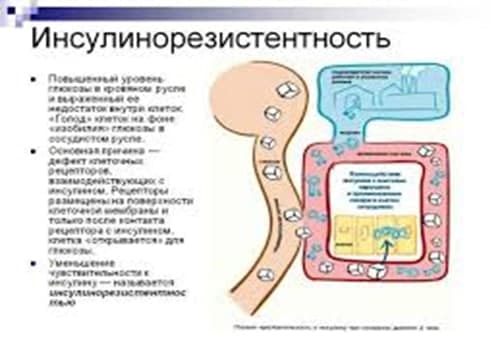
Инсулинорезистентность – это снижение чувствительности тканей организма к действию инсулина.
В норме инсулин вырабатывается поджелудочной железой в количестве, достаточном для поддержания физиологического уровня глюкозы в крови. Инсулин способствует поступлению глюкозы (основного источника энергии) в клетку.
При инсулинорезистентности чувствительность тканей к инсулину снижена, поэтому глюкоза не может попасть в клетки, ее концентрация в крови возрастает, тогда как клетки испытывают энергетический голод («голод при изобилии»). Мозг, получив от голодающих клеток сигнал «SОS», посылает команду поджелудочной железе увеличить выработку инсулина.
Со временем резервы поджелудочной железы истощаются. Клетки, отвечающие за секрецию инсулина, работая длительное время с перегрузкой, погибают — развивается сахарный диабет.
Избыток инсулина оказывает действие и на обмен холестерина, усиливает образование свободных жирных кислот, атерогенных липидов. Это приводит к развитию атеросклероза, а также повреждению свободными жирными кислотами самой поджелудочной железы.
Причины инсулинорезистентности
Инсулинорезистентность бывает физиологической, т.е. встречающейся у вполне здоровых людей в определенные периоды жизни, и патологической.
Причины физиологической инсулинорезистентности:
— беременность;
— подростковый период;
— ночной сон;
— пожилой возраст;
— вторая фаза менструального цикла у женщин;
— диета, богатая жирами.
Причины патологической инсулинорезистентности:
— генетические дефекты молекулы инсулина;
— гиподинамия;
— ожирение;
— избыточное потребление углеводов;
— эндокринные заболевания (тиреотоксикоз, болезнь Иценко-Кушинга и др.);
— прием некоторых лекарств (гормоны, адреноблокаторы и др.);
— курение.
Признаки и симптомы
Основным признаком развивающейся инсулинорезистентности является абдоминальное ожирение, при котором избыток жировой ткани откладывается преимущественно в области живота и верхней части туловища.
Особенно опасно внутреннее абдоминальное ожирение, когда жировая ткань накапливается вокруг органов и мешает их правильной работе.
Жировая ткань в области живота очень активна. Из нее образуется большое количество биологически активных веществ, способствующих развитию:
— атеросклероза;
— онкологических заболеваний;
— артериальной гипертензии;
— заболеваний суставов;
— тромбозов;
— дисфункции яичников.
Абдоминальное ожирение можно определить самому в домашних условиях. Для этого нужно измерить окружность талии и разделить ее на окружность бедер. В норме этот показатель не должен превышать 0,8 у женщин и 1,0 у мужчин.
Второй важный симптом инсулинорезистентности – черный акантоз. Это изменения кожных покровов в виде гиперпигментации и шелушения в естественных складках кожи (шея, подмышечные впадины, молочные железы, пах, межъягодичная складка).
У женщин инсулинорезистентность проявляется синдромом поликистозных яичников (СПКЯ), который сопровождается нарушением менструального цикла, бесплодием и гирсутизмом, избыточным ростом волос по мужскому типу.
Синдром инсулинорезистентности
В связи с наличием большого количества патологических процессов, связанных с инсулинорезистентностью, их все было принято объединить в синдром инсулинорезистентности (метаболический синдром, синдром Х).
Метаболический синдром включает в себя:
— абдоминальное ожирение (окружность талии >80 см у женщин и >94 см у мужчин);
— артериальную гипертензию (стойкое повышение артериального давления выше 140/90 мм рт.ст.);
— сахарный диабет или нарушение толерантности к глюкозе;
— нарушение обмена холестерина, повышение уровня его «плохих» фракций и снижение «хороших».
Опасность метаболического синдрома – в высоком риске сосудистых катастроф (инсульты, инфаркты и т. п.). Избежать их можно только снизив вес и контролируя уровни артериального давления, глюкозы и фракций холестерина в крови.
Диагностика
Для определения инсулинорезистентности существует несколько методов. Наиболее точным является эугликемический гиперинсулинемический клэмп (ЭГК, клэмп-тест), который в настоящее время используется только в научных целях, поскольку он сложен, требует специальной подготовки и внутривенного доступа.
Остальные методы диагностики называются непрямыми, они оценивают влияние собственного, а не введенного извне инсулина на обмен глюкозы.
Пероральный глюкозотолерантный тест (ПГТТ) выполняется следующим образом. Пациент сдает кровь натощак, затем выпивает концентрированный раствор глюкозы и повторно сдает анализ через 2 часа. В ходе теста оцениваются уровни глюкозы, инсулина и С-пептида (С-пептид – это белок, с которым связан инсулин в своем депо).
Нарушение гликемии натощак и нарушение толерантности к глюкозе расцениваются как предиабет и в большинстве случаев сопровождаются инсулинорезистентностью. Если в ходе теста соотнести уровни глюкозы с уровнями инсулина и С-пептида, более быстрое повышение последних также говорит о наличии резистентности к инсулину.
Внутривенный глюкозотолерантный тест (ВВГТТ) похож на ПГТТ, но в этом случае глюкозу вводят внутривенно и через короткие промежутки времени многократно оценивают те же показатели, что и при ПГТТ. Этот анализ более достоверен в случае, когда у пациента есть заболевания желудочно-кишечного тракта, нарушающие всасывание глюкозы.
Индексы инсулинорезистентности
Наиболее простой и доступный способ выявления инсулинорезистентности – расчет ее индексов. Для этого человеку достаточно сдать кровь из вены. В крови определят уровни инсулина и глюкозы и по специальным формулам рассчитают индексы НОМА-IR и caro. Их также называют анализом на инсулинорезистентность.
Индекс НОМА-IR (Homeostasis Model Assessment of Insulin Resistance) рассчитывается по следующей формуле:
НОМА = (уровень глюкозы (ммоль/л) * уровень инсулина (мкМЕ/мл)) / 22,5
В норме индекс НОМА не превышает 2,7, причем этот показатель одинаков для мужчин и для женщин, и после 18 лет не зависит и от возраста. В подростковый период индекс НОМА несколько повышается из-за физиологической резистентности к инсулину в этом возрасте.
Причины повышения индекса НОМА:
— инсулинорезистентность, которая говорит о возможном развитии сахарного диабета, атеросклероза, синдрома поликистозных яичников, чаще на фоне ожирения;
— гестационный сахарный диабет (диабет беременных);
— эндокринные заболевания (тиреотоксикоз, феохромацитома и др.);
— прием некоторых лекарственных препаратов (гормоны, адреноблокаторы, препараты для снижения уровня холестерина);
— хронические заболевания печени;
— острые инфекционные заболевания.
Индекс caro — также расчетный показатель:
индекс caro = уровень глюкозы (ммоль/л) / уровень инсулина (мкМЕ/мл)
Индекс caro у здорового человека составляет не менее 0,33. Снижение этого показателя – верный признак резистентности к инсулину.
Как правильно сдавать анализы
Диагностика и определение инсулинорезистентности происходит при соблюдении следующих правил:
— запрещено курить в течение получаса до исследования;
— запрещены физические нагрузки за полчаса до теста;
— кровь из вены сдается утром натощак, после 10–14-часового перерыва в приеме пищи.
— лечащего врача необходимо поставить в известность по поводу принимаемых лекарств.
— нежелательно сдавать кровь на анализ после сильных стрессов, в период острых заболеваний и обострения хронических.
Лечение инсулинорезистентности – диета, спорт, препараты
Прежде чем говорить о лечении инсулинорезистентности, важно еще раз напомнить, что резистентность к инсулину – физиологическая норма в определенные периоды жизни. Она сформировалась в процессе эволюции как способ адаптации к периодам длительной нехватки пищи. И лечить физиологическую инсулинорезистентность в подростковый период или во время беременности не нужно.
Патологическая же инсулинорезистентность, приводящая к развитию серьезных заболеваний, нуждается в коррекции.
Снизить инсулинорезистентность можно самым простым способом – снизив вес. Уменьшение количества жировой ткани приводит к повышению чувствительности клеток организма к инсулину.
В снижении веса важны 2 момента: постоянные физические нагрузки и соблюдение низкокалорийной диеты.
Физические нагрузки должны быть регулярными, аэробными, 3 раза в неделю по 45 мин. Хорошо подойдут бег, плавание, занятия фитнесом, танцами. Во время занятий активно работают мышцы, а именно в них находится большое количество рецепторов инсулина. Активно тренируясь, человек открывает доступ инсулина к его рецепторам на поверхности клеток, т.е. помогает гормону преодолеть резистентность.
Правильное питание с соблюдением низкокалорийной диеты – такой же важный шаг в лечении инсулинорезистентности, как и спорт. Нужно резко снизить потребление простых углеводов (сахар, конфеты, шоколад, хлебобулочные изделия). Меню должно состоять из 5–6 приемов пищи, порции необходимо уменьшить на 20–30%, стараться ограничить животные жиры и увеличить количество клетчатки в пище.
На практике часто оказывается, что похудеть человеку с инсулинорезистентностью не так просто. Если при соблюдении диеты и наличии достаточной физической нагрузки не достигается снижение веса, назначаются лекарственные препараты.
Наиболее часто используется метформин. Он усиливает чувствительность тканей к инсулину, уменьшает отложение запасов глюкозы в виде гликогена в печени и мышцах, усиливает потребление глюкозы мышцами, уменьшает ее всасывание в кишечнике. Принимается этот препарат по назначению врача и под его контролем, поскольку имеет ряд побочных эффектов и противопоказаний. И тем не менее на сегодняшний день метформин во всем мире считается золотым стандартом лечения инсулинорезистентности, некоррегируемой изменением образа жизни, а также сахарного диабета 2 типа.
занятие 2. Особенности инсулинотерапии при СД 2 типа
Особенности инсулинотерапии при СД 2 типа, отличия от инсулинотерапии при СД 1 типа. Инсулинотерапия: виды инсулина, схемы инсулинотепарии, правила расчета дозы инсулина. Средства введения инсулина.
КОГДА НАЗНАЧАЮТ ИНСУЛИН?
Открытие инсулина в 1921 году и его практическое применение было революцией в лечении сахарного диабета. Люди перестали умирать от диабетической комы. В связи с отсутствием других препаратов в то время больные сахарным диабетом 2 типа тоже лечились инсулином, причем с очень хорошим эффектом. Но даже сейчас, когда разработан и применяется целый ряд сахароснижающих препаратов в таблетках, пользуются инсулином подавляющее большинство больных сахарным диабетом 2 типа.
В большинстве случаев делается это не по жизненным показаниям, а для достижения нормального уровня глюкозы в крови, если такая цель не была достигнута всеми вышеперечисленными средствами (диетой, физическими нагрузками и сахароснижающими таблетками).
Следует понять, что никакого вреда для организма от лечения инсулином быть не может (в качестве примера можно привести людей, больных сахарным диабетом 1 типа, которые вводят инсулин в течение десятков лет с самого начала заболевания).
ПРЕПАРАТЫ ИНСУЛИНА
Препараты инсулина продленного действия (пролонгированные) получают путем добавления к инсулину специальных веществ, которые замедляют всасывание его из-под кожи. К этой группе относят прежде всего препараты средней продолжительности действия. Профиль их действия следующий: начало — через 2 часа, пик — через 6-10 часов, окончание — через 12-16 часов, в зависимости от дозы.
Пролонгированные аналоги инсулина получают путем изменения химической структуры инсулина, они относятся к группе инсулинов длительного действия. Они прозрачные, поэтому не требуют перемешивания перед инъекцией. Они не имеют выраженного пика эффективности, что уменьшает вероятность гипогликемии ночью и в промежутках между приемами пищи, и действуют до 24 часов. Эти препараты инсулина могут вводиться 1—2 раза в сутки.
РЕЖИМЫ ЛЕЧЕНИЯ ИНСУЛИНОМ
Хорошо известно, что у людей, не болеющих диабетом, выработка инсулина в течение дня происходит постоянно на сравнительно небольшом уровне — это называется базальной, илы фоновой секрецией инсулина.
В ответ на повышение глюкозы в крови (а самое значительное изменение ее уровня происходит после приема углеводистой пищи) выделение инсулина в кровь возрастает в несколько раз, это получило название пищевой секреции инсулина.
Во время лечения диабета инсулином для поддержания уровня сахара в крови, соответствующего уровню здорового человека, больному диабетом надо вводить инсулин несколько раз в день. Однако каждый больной желает вводить инсулин как можно ранее, поэтому в настоящее время используется целый ряд режимов лечения инсулином. Относительно редко можно получить хороший результат при введении инсулина средней продолжительности действия один или два раза в сутки. Такой режим называется традиционной инсулинотерапией.
Обычно такие варианты используются при одновременном приеме сахароснижающих таблеток. Понятно, что при этом повышение гликемии в течение дня и пики максимального сахароснижающего действия инсулина далеко не всегда совпадают по времени и выраженности эффекта.
Довольно часто в лечении сахарного диабета 2 типа используют введение инсулина короткого и средней продолжительности действия 2 раза в сутки. В связи с вышеописанными параметрами действия препаратов инсулина данный режим требует, чтобы у человека в обязательном порядке были три основных и три промежуточных приема пищи, причем желательно, чтобы количество углеводов в этих приемах пищи было примерно одинаковым каждый день.
В ряде случаев может понадобиться такой режим введения инсулина, который больше всего напоминает естественную выработку инсулина здоровой поджелудочной железой. Он называется интенсифицированной инсулинотерапией, или режимом многократных инъекций.
Роль базальной секреции инсулина при этом берут на себя препараты инсулина продленного действия, а роль пищевой секреции инсулина выполняют препараты инсулина короткого действия, оказывающие быстрый и выраженный сахароснижающий эффект.
Наиболее частой схемой такого режима является следующая комбинация инъекций:
— Утром (перед завтраком) введение инсулина короткого и средней продолжительности действия.
— Днем (перед обедом) инсулин короткого действия.
— Вечером (перед ужином) инсулин короткого действия.
— На ночь введение инсулина средней продолжительности действия.
Возможно использование одной инъекции аналога инсулина длительного (сверхдлительного) действия вместо двух инъекций инсулина средней продолжительности действия.
Несмотря на увеличение количества инъекций, режим интенсифицированной инсулинотерапии позволяет человеку с диабетом иметь более гибкий режим питания как в плане времени приема, так и количества пищи.
САМОКОНТРОЛЬ ПРИ ЛЕЧЕНИИ ИНСУЛИНОМ
При лечении инсулином в обязательном порядке необходим более частый самоконтроль глюкозы в крови, в ряде случаев несколько раз в день ежедневно.
Эти показатели являются основой для вас и вашего врача в принятии решения об изменении доз инсулина.
В дневнике диабета появляется и специальная графа, касающаяся питания при инсулинотерапии — хлебные единицы.
ПИТАНИЕ ПРИ ЛЕЧЕНИИ ИНСУЛИНОМ
К сожалению, введенный инсулин «не знает», когда и сколько принимает пищу больной. Поэтому вы сами должны позаботиться о том, чтобы действие инсулина соответствовало питанию. Следовательно, необходимо знать, какая пища повышает глюкозу в крови.
Как уже известно, пищевые продукты состоят из трех компонентов: белков, жиров и углеводов. Все они обладают калорийностью, но не все повышают глюкозу в крови. Жиры и белки не обладают ощутимым сахароповышающим действием, поэтому с точки зрения введения инсулина их учитывать не нужно. Реальным сахароповышающим действием обладают лишь углеводы, следовательно, их нужно учитывать, чтобы ввести соответствующую дозу инсулина.
Какая пища содержит углеводы? Это легко запомнить: большинство растительных продуктов, а из животных — только жидкие молочные продукты (молоко, кефир, йогурт и др.).
Продукты, повышающие уровень глюкозы в крови и требующие подсчета, можно объединить в 5 групп.
Зерновые — хлеб и хлебобулочные изделия, макаронные изделия, крупы, кукуруза.
Фрукты и ягоды.
Картофель.
Молоко и жидкие молочные продукты.
Продукты, содержащие сахар.
Чтобы питаться разнообразно, нужно научиться заменять одни блюда, содержащие углеводы, другими, но так, чтобы глюкоза в крови при этом менялась незначительно.
Такую замену легко делать с помощью системы хлебных единиц (ХЕ).
Одна ХЕ равна количеству продукта, содержащего 10—12 граммов углеводов, например одному куску хлеба весом 20—25 г. Хотя такие единицы и носят название хлебных, выразить в них можно не только количество хлеба, но и любых других содержащих углеводы продуктов.
Например, 1 ХЕ содержит 1 апельсин средней величины, или 1 стакан молока, или 2 столовые ложки (с горкой) каши.
Удобство системы ХЕ заключается в том, что человеку нет необходимости взвешивать продукты на весах, а достаточно оценить это количество зрительно с помощью удобных для восприятия объемов (кусок, стакан, штука, ложка и т.п.).
Как уже говорилось выше, традиционная инсулинотерапия (две инъекции инсулина в день) потребует одинакового изо дня в день режима питания. При использовании интенсифицированной инсулинотерапии можно питаться более свободно, изменяя самостоятельно как время приема пищи, так и количество хлебных единиц
ДОЗЫ ИНСУЛИНА
Человеку с диабетом на инсулинотерапии важно научиться самостоятельно менять дозы инсулина по потребности. Но это можно сделать только в том случае, если вы проводите самоконтроль глюкозы крови.
Единственным критерием того, что вводятся правильные дозы инсулина, являются показатели глюкозы в крови, измеряемые в течение дня!
Так, можно считать правильной вечернюю дозу инсулина продленного действия, если уровень глюкозы в крови натощак нормальный и отсутствует гипогликемия ночью. При этом обязательным условием для оценки является нормальный показатель глюкозы в крови перед сном, т.е. пролонгированный инсулин как бы удерживает этот уровень до утра.
Для того чтобы оценить адекватность дозы короткого инсулина, введенного перед приемом пищи, необходимо измерить содержание глюкозы в крови или через 2 часа после еды (на пике ее повышения), или в крайнем случае просто перед следующим приемом пищи (через 5—6 часов).
Измерение глюкозы в крови перед ужином поможет оценить адекватность дозы короткого инсулина перед обедом при интенсифицированной инсулинотерапии или утреннего пролонгированного инсулина при традиционной.
Глюкоза в крови перед сном будет отражать правильность дозы короткого инсулина перед ужином.
ПРАВИЛА УМЕНЬШЕНИЯ ДОЗ ИНСУЛИНА
Поводом для уменьшения плановой дозы инсулина служит возникновение гипогликемии в том случае, если эта гипогликемия не была связана с ошибкой в питании (пропущенный прием пищи или потребление меньшего количества хлебных единиц), введении инсулина (техническая ошибка при инъекции инсулина), не было большей по сравнению с обычной физической активности или приема алкоголя.
Действия должны быть следующими.
Устранить гипогликемию: съесть сахар или выпить сладкое питье.
Определить уровень глюкозы в крови перед следующей инъекцией. Если он остался нормальным, ввести обычную дозу.
Подумать о причине гипогликемии. Если определена одна из основных четырех причин, то исправить на следующий день допущенную ошибку и дозу инсулина не изменять. Если вы не нашли причину, дозу инсулина на следующий день все равно не изменять, поскольку эта гипогликемия могла быть случайной.
Проверить, повторится ли гипогликемия в это же время на следующий день. Если она повторилась, необходимо решить, избыток какого инсулина ее вызвал. Для этого понадобится знание временных параметров действия инсулинов.
На третий день уменьшить дозу соответствующего инсулина на 10%, округляя до целых цифр (как правило, это будет 1-2 ЕД). Если гипогликемия опять повторится в это же время, на следующий день еще уменьшить дозу инсулина.
ПРАВИЛА УВЕЛИЧЕНИЯ ДОЗ ИНСУЛИНА
Поводом для увеличения плановой дозы инсулина служит появление гипергликемии, которая не связана ни с одной из нижеследующих ошибок или сопутствующих состояний:
— мало инсулина (техническая ошибка с набором дозы, инъекция в другую область тела, из которой инсулин всасывается хуже);
— много хлебных единиц в предшествовавшем приеме пищи (ошибка в подсчете);
— меньшая по сравнению с обычной физическая активность;
— сопутствующее заболевание.
Действия должны быть следующими:
— Увеличить дозу инсулина короткого действия или смешанного инсулина в данный момент.
— Определить уровень глюкозы в крови перед следующей инъекцией. Если он остался нормальным, делать обычную дозу.
Подумать о причине гипергликемии. Если определена одна из основных четырех причин, то на следующий день исправить допущенную ошибку и дозу инсулина не изменять. Если вы не нашли причину, дозу инсулина на следующий день все равно не изменять, поскольку этот эпизод мог быть случайным.
Проверить, повторится ли гипергликемия в это же время на следующий день. Если это произошло, необходимо решить, недостаток какого инсулина скорее всего «виноват» в этом, зная временные параметры действия инсулинов.
На третий день увеличить дозу соответствующего инсулина на 10%, округляя до целых цифр (как правило, это будет 1—2 ЕД). Если гипергликемия опять повторится в это же время, на следующий день еще увеличить дозу инсулина.
Следует знать, что любое заболевание (особенно воспалительного характера) может потребовать более активных действий по увеличению дозы инсулина. Почти всегда в этом случае понадобится делать инсулин короткого действия в режиме многократных инъекций
МЕСТА ИНЪЕКЦИЙ ИНСУЛИНА
Для инъекций инсулина используется несколько областей тела: передняя поверхность живота, передненаружная поверхность бедер, наружная поверхность плеч, ягодицы. Делать инъекцию самому себе в плечо не рекомендуется, так как невозможно собрать складку, а значит, увеличивается риск внутримышечного попадания.
Следует знать, что инсулин из разных областей тела всасывается с различной скоростью, в частности, быстрее всего из области живота. Поэтому перед приемом пищи рекомендуется вводить инсулин короткого действия в эту область. Инъекции пролонгированных препаратов инсулина можно делать в бедра или ягодицы.
Смена мест инъекций должна быть одинаковой каждый день, в противном случае это может привести к колебаниям уровня глюкозы в крови.
Необходимо следить также за тем, чтобы в местах инъекций не появлялись уплотнения (они ухудшают всасывание инсулина!). Для этого необходимо чередовать места инъекций, а также отступать от места предыдущей инъекции не менее чем на 2 см. С этой же целью необходимо менять шприцы или иглы для шприц-ручек после каждой инъекции.
Общие правила введения инсулина
От области введения иглы зависит то, насколько быстро препарат проникнет в кровь. Инсулин короткого действия целесообразно вводить в в подкожную жировую клетчатку живота, а инсулины более длительного действия — в в плечо, бедро или ягодицу.
Инсулин вводится только в подкожно-жировую клетчатку под углом 45 градусов, но не внутримышечно и не внутрикожно!
Для того, чтобы исключить попадание инсулина в мышцу, инъекцию необходимо производить в кожную складку, которая берется большим и указательным (или средним) пальцами. Складку можно будет отпустить только тогда, когда в подкожную клетчатку будет введен весь инсулин.
МЕТОДИКА ИНЪЕКЦИЙ — это очень важный мо¬мент, но сравнительно простой, так что через пять-шесть дней диабетик уже уверенно пользуется шприцом. Рас¬смотрим все операции, связанные с инъекциями, по пунк¬там:
- Подготовка кожи. Не надо протирать место инъек¬ции спиртом — спирт сушит кожу. Просто вымойте теплой водой с мылом тот участок, куда собираетесь сделать укол.
- Подготовка флакона. Флакон закрыт сверху резино¬вой пробкой, которую снимать не надо — пробку прокалы¬вают шприцом и набирают инсулин. Резина прочнее кожи, и при каждом прокалывании шприц тупится. Чтобы этого не происходило, возьмите толстую иглу для медицинского шприца и проколите несколько раз пробку в самом центре. В дальнейшем старайтесь ввести иглу инсулинного шпри¬ца в этот прокол.
- Подготовка инсулина. Цилиндрический флакон ин¬сулина энергично покатайте между ладонями секунд трид¬цать. Для инсулинов промежуточного и длительного дей¬ствия эта операция обязательна, так как пролонгатор в них оседает на дно, и его надо перемешать с инсулином. Но флакон с «коротким» инсулином тоже рекомендуется по¬катать — инсулин нагреется, а его лучше вводить теплым.
- Подготовка шприца. Шприц — с колпачком, предо¬храняющим иглу — лучше держать в стаканчике. Достань¬те шприц, снимите колпачок и выдвиньте шток — так, чтобы поршень встал на отметку необходимой вам дозы.
- Набор инсулина. Возьмите флакон в левую руку, а шприц — в правую. Введите иглу шприца в проколотую область в пробке и опустите шток до конца — тем самым вы введете во флакон такой объем воздуха, который равен вашей дозе инсулина. Это нужно затем, чтобы создать во флаконе избыточное давление — тогда будет легче наби¬рать инсулин. Держа флакон по-прежнему в левой руке, а шприц — в правой, переверните флакон горлышком вниз, потяните за поршень и наберите в шприц нужную вам дозу плюс еще немного — одну-две ЕД. Вытащите иглу, от¬ставьте флакон и установите точную дозу, аккуратно по¬двинув шток — при этом на кончике иглы появится ка¬пелька инсулина. Это означает, что воздуха под поршнем нет. Внимательно делайте эту проверку; стравив лишний инсулин, еще раз проверьте точность дозы.
- Инъекция. Пальцами левой руки оттяните кожу на животе или ноге и введите иглу в основание кожной склад¬ки под углом примерно сорок пять градусов; можно вво¬дить шприц вертикально в вершину кожной складки (рис. 8.6). Плавно нажмите шток и введите инсулин, а потом по¬дождите еще пять-семь секунд (сосчитайте до десяти).
- Завершающие операции. Вытащите иглу и несколько раз энергично прокачайте поршень, чтобы избавиться от остатков инсулина в игле и высушить ее изнутри потоком воздуха. Наденьте колпачок и поставьте шприц в стакан. Полезно бросить в стакан какой-нибудь мелкий пред¬мет — шарик или спичку; количество спичек в стакане подскажет вам, какой раз вы делаете инъекцию этим шпри¬цом. Но, как говорилось раньше, предпочтительней делать шприцом только одну инъекцию.
Алгоритм при наборе инсулина в шприц:
- Вымыть руки с мылом, насухо вытереть.
- Если необходимо вводить инсулин продленного действия, то необходимо покатать флакон раствора инсулина между ладонями в течение одной минуты. Раствор во флаконе должен стать мутным.
- Набрать в шприц воздух.
- Ввести этот воздух из шприца во флакон с раствором.
- Набрать необходимую дозу препарата, удалить пузырьки воздуха, постучав по основанию шприца.
- Ввести инсулин (запрещается вводить препарат в места воспалений, шрамов, рубцов и следов от механических повреждений – синяков).
- Следующую инъекцию обязательно делать в другой участок кожи (отступив от предыдущего минимум 2 см).
Введение инсулина с использованием шприц-ручки
Шприц-ручка — особый шприц, позволяющий вводить инсулин, не набирая его каждый раз из флакона, и имеющий устройство для полуавтоматического дозирования инсулина. Производителями выпускаются шприц-ручки одноразового и многоразового применения. В шприц-ручках многоразового применения внутри корпуса расположен сменный картридж с препаратом инсулина. В шприц-ручках одноразового применения замена картриджа не предусмотрена.
Места введения — наружная поверхность плеча на границе верхней и средней трети, переднебоковая поверхность брюшной стенки, переднебоковая поверхность бедра.
Если препарат инсулина находится в виде суспензии, необходимо произвести 10-12 поворотов ручки на 180°, чтобы шарик, находящийся в картридже, равномерно перемешал суспензию инсулина.
Игла к шприц-ручке находится во внешнем и внутреннем защитном колпачке.
Если устанавливать иглу под наклоном, можно повредить резиновую мембрану, что приведет к протеканию инсулина и поломке иглы.
Тест на безопасность проводится перед каждой инъекцией.
Если выброс инсулина не произошел, тест на безопасность повторяется до тех пор, пока не произойдет выброс.
Не следует нажимать на пусковую кнопку во время выбора дозы, так как может произойти выброс инсулина, что приведет к неправильному его дозированию.
ШПРИЦ-РУЧКИ. Шприц-ручки были впервые разра¬ботаны фирмой «Ново Нордиск», и первая модель появи¬лась в продаже в 1983 году. В настоящее время несколько фирм (в том числе — «Бектон Дикинсон») выпускают шприц-ручки, и нам надо рассмотреть, в чем заключаются их преимущества и недостатки.
Шприц-ручка — гораздо более сложное изделие, чем шприц. По конструкции и внешнему виду она напоми¬нает обычную поршневую авторучку для чернил. Такая шприц-ручка, как НовоПен 3, состоит из следующих час¬тей:
корпуса, открытого и полого с одного конца. В полость вставляется гильза с инсулином, а с другой стороны име¬ются кнопка спуска и механизм, позволяющий установить дозу с точностью 1 ЕД (механизм при установке дозы щел¬кает: один щелчок — одна единица);
— иглы, которая надевается на кончик гильзы, торчащий из полости ручки — перед инъекцией (после инъекции игла снимается);
— колпачка, который надевается на ручку, когда она на¬ходится в нерабочем состоянии;
— коробочки-футляра, очень похожего на футляр для обычной авторучки.
Пользоваться шприц-ручкой исключительно просто:
- открываете футляр, достаете ручку, снимаете с нее колпачок;
- надеваете иглу, снимаете с нее колпачок (игла со своим колпачком тоже размещается в футляре);
- перекатываете ручку в ладонях или переворачиваете вверх-вниз десять раз, чтобы перемешать инсулин в гильзе;
- выставляете дозу 2 ЕД и нажимаете на спусковую кноп¬ку — выбрасывается капля инсулина, чтобы в игле не остался воздух;
- выставляете нужную вам дозу, колите в плечо, в живот, в ногу (при необходимости — прямо сквозь одежду, предваритель¬но собрав кожу в складку);
- давите на спусковую кнопку и ждете семь-десять секунд. При этом не следует отпускать кожную складку, пока не будет введен весь инсулин.
- Все! Инсулин попал куда надо. Снимаете иглу, надеваете на ручку колпачок, прячете все это хозяйство в футляр.
Современный способ, весьма удобный, но не лишен¬ный, однако, недостатков — особенно для российского пользователя. Давайте же посмотрим, что говорится в про¬спекте «Ново Нордиск» о преимуществах шприц-ручки НовоПен 3 перед шприцами и флаконами:
- Использование шприцов и флаконов требуют хоро¬шей координации движений и остроты зрения.
- Даже квалифицированный персонал может испыты¬вать трудности с точным набором дозы инсулина.
- Смешивание двух различных типов инсулина создает проблемы, которые могут привести к нарушению пациен¬том назначений врача.
- Использование шприца сопряжено со многими труд¬ностями, занимает много времени и часто ставит пациента в неловкое положение.
Прокомментируем эти утверждения:
- Верно, но большая часть диабетиков вполне может с этим справиться — либо сами, либо с помощью родствен¬ников. Шприц-ручки абсолютно необходимы одиноким людям с ослабленным зрением или слепым — они устанав¬ливают дозу по щелчкам.
- Не совсем верно — хотя бы потому, что потеря точ¬ности на одну единицу большой роли не играет (хотя, разу¬меется, бывают исключения).
- Неверно; смешивание никаких проблем не создает, если глаза видят и руки не трясутся.
- «Многих трудностей» нет, время — примерно две-три минуты, а вот неловкое положение — это правда.
Главное преимущество шприц-ручки в том и заключа¬ется, что можно ввести инсулин где угодно, не раздеваясь. И есть еще один важный момент, почему-то не отмечен¬ный в проспекте: игла шприц-ручки еще тоньше иглы в хо¬рошем шприце, и она практически не травмирует кожу.
Нужен ли спирт?
На самом деле в месте инъекции риск развития воспаления ничтожно мал, а вот спирт разрушает инсулин, поэтому пользоваться спиртовыми антисептиками перед уколом врачи не рекомендуют. Однако если человек все же использует такие средства перед уколом, рекомендуется после дезинфекции нужного участка кожи подождать некоторое время, пока спирт полностью испарится.
занятие 3. Коррекция принципов питания
Коррекция принципов питания, физической нагрузки при переходе на инсулинотерапию при СД 2 типа, понятие о гликемическом индексе, углеводном коэффициенте, факторе чувствительности к инсулину, правила из расчета.
Главный девиз «Нет диеты – есть правильное питание»
Вам не потребуется резко изменять свой рацион питания и отказываться от всех своих любимых блюд, если, конечно, до диабета Вы питались правильно, а не одними чипсами.
На начальных этапах жизни с диабетом Вы не должны принимать это за правило.
Мы настоятельно рекомендуем в первые несколько месяцев диабета следовать определенной схеме питания, чтобы лучше понять влияние отдельных продуктов на уровень сахара в крови.
Если до диабета у Вас не было определённого режима питания, Вам придётся упорядочить его. Только упорядочив свой режим, Вы подберёте правильную схему введения инсулина.
Когда Вы хорошо изучите себя и свой организм, Вы сможете свободнее регулировать свое питание и введение инсулина без риска повысить глюкозу в крови до критического уровня. Вскоре Вы станете настоящим экспертом-диетологом и сможете консультировать своих друзей и знакомых!
Цели рационального питания:
— Поддержание оптимального (близкого к физиологическому) уровня глюкозы в крови.
— Поддержание нормального веса.
— профилактика сердечно-сосудистых заболеваний, поддержание нормального уровня холестерина.
— Хорошее общее самочувствие.
— Состав продуктов питания
Задача на начальном этапе:
Главное — научиться четко видеть и считать углеводы во всех продуктах, которые едите. Для этого надо научиться различать основные составные части Ваших продуктов.
При рациональном питании рекомендуется следующее соотношение веществ:
|
Питательные вещества |
Белки |
Жиры |
Углеводы |
|
Оптимальное соотношение, % |
15-20 |
20-25 |
55-60 |
|
Энергетическая ценность 1 грамма |
4 ккал |
9 ккал |
4 ккал |
При правильном и сбалансированном питании витамины и микроэлементы поступают в достаточном количестве с основными продуктами.
Белки
Различают животные (мясо, творог, молоко, рыба) и растительные (фасоль, горох, соя) белки.
При правильном питании их не считают.
Жиры (животные и растительные)
Животные (насыщенные, твердые): сливочное масло, маргарин, сыр при правильном питании должны составлять около 30% от общего количества жиров.
Растительные (ненасыщенные, жидкие): растительные масла, рыбий жир при правильном питании должны составлять около 70% от общего количества жиров.
При правильном питании их не считают.
Ограничивают приём жиров только при кетоацидозе и лишнем весе.
Углеводы
Именно их в продуктах надо четко видеть и уметь считать.
Именно углеводы являются источником глюкозы и повышают ее уровень в крови. Доза инсулина короткого действия рассчитывается по количеству принятых с пищей углеводов.
Однако через 3-4 часа после употребления пищи с большим содержанием белка и жиров (например, порции мяса весом 200 г), глюкоза в крови повысится, что может потребовать дополнительного введения небольшой дозы инсулина короткого действия после еды.
Классификация углеводов
|
Перевариваемые (надо считать) |
Неперевариваемые (не надо считать) |
|||
|
Простые (быстрые) |
Сложные (медленные) |
Пищевые волокна (клетчатка) |
||
|
Моносахариды |
Дисахариды |
Полисахариды (крахмал) |
Нерастворимые (целлюлоза, гемицеллюлоза, лигнин) |
Растворимые (пектин, гуар) |
|
глюкоза, фруктоза, галактоза (фрукты, ягоды, мед) |
сахароза (сахар), мальтоза (солодовый сахар), лактоза (молочный сахар |
содержатся в картофеле, крупах, хлебе, макаронных изделиях |
содержатся в отрубях, овощах, хлебе грубого помола, бобовых, кожице фруктов |
содержатся в яблоках, грушах, цитрусовых, овощах, ячмене |
|
Быстро всасываются в кишечнике и быстро повышают глюкозу в крови. Употребление таких углеводов требует определенных правил. Лучше употреблять после еды и вместе с продуктами, которые замедляют их всасывание (клетчатка, жиры). Здесь надо учитывать проблемы с весом. Можно употреблять при физических нагрузках, т.к. являются чистыми источниками энергии. В жидком виде можно употреблять только при гипогликемии (напитки на глюкозе). При избытке в пище вызывают ожирение и кариес |
Длительно расщепляются в кишечнике и медленно всасываются. Медленно повышают глюкозу в крови |
Нормализуют работу кишечника. Создают чувство сытости. Уменьшают гнилостные процессы в кишечнике. Снижают риск рака кишечника |
Выводят из кишечника балластные вещества, токсины, радионуклиды. Замедляют всасывание глюкозы. Способствуют выведению холестерина. Снижают риск заболеваний сердца |
|
|
Ограничивают при СД (можно не более 10% суточной калорийности). Применяют при гипогликемии |
Рекомендуют при СД во время каждого приема пищи |
Рекомендуют 30-40 г пищевых волокон ежедневно. Растворимые волокна — 10-25г/день |
Употребление таких углеводов требует определенных правил.
Лучше употреблять после еды и вместе с продуктами, которые замедляют их всасывание (клетчатка, жиры). Здесь надо учитывать проблемы с весом.
Можно употреблять при физических нагрузках, т.к. являются чистыми источниками энергии.
В жидком виде можно употреблять только при гипогликемии (напитки на глюкозе).
При избытке в пище вызывают ожирение и кариес
Длительно расщепляются в кишечнике и медленно всасываются.
Медленно повышают глюкозу в крови
Нормализуют работу кишечника.
Создают чувство сытости.
Уменьшают гнилостные процессы в кишечнике.
Снижают риск рака кишечника
Выводят из кишечника балластные вещества, токсины, радионуклиды.
Замедляют всасывание глюкозы.
Способствуют выведению холестерина.
Снижают риск заболеваний сердца
Ограничивают при СД (можно не более 10% суточной калорийности). Применяют при гипогликемии
Рекомендуют при СД во время каждого приема пищи
Рекомендуют 30-40 г пищевых волокон ежедневно. Растворимые волокна — 10-25г/день
Углеводы можно считать в граммах или хлебных единицах (ХЕ). Система хлебных единиц (ХЕ) была разработана для упрощения составления пищевого рациона при сахарном диабете.
1 ХЕ соответствует 10-12 граммам углеводов в любом продукте.
Способы подсчета углеводов
Визуальный способ: по специальным картинкам, которые отражают размеры порций разных продуктов, содержащих 1 ХЕ:
Система таблиц, где дается содержание углеводов (ХЕ) в определенном количестве продуктов
Содержание «хлебных единиц» в продуктах питания
|
ПРОДУКТЫ |
Мера |
Вес или объем |
|
МОЛОЧНЫЕ ПРОДУКТЫ: |
||
|
Молоко (цельное, топленое), кефир, простокваша, сливки |
1 стакан |
250 мл |
|
Сырники |
1 средний |
85 г |
|
Мороженое (в зависимости от сорта) |
65 г |
|
|
Йогурт 3,6% жирности (см. этикетку с содержанием углеводов) |
1 стакан |
250 мл |
|
ХЛЕБОБУЛОЧНЫЕ ИЗДЕЛИЯ: |
||
|
Хлеб белый, булки любые (кроме сдобных |
1 кусок |
20 г |
|
Хлеб серый, ржаной |
1 кусок |
25 г |
|
Хлеб из муки грубого помола, с отрубями |
1 кусок |
30 г |
Подсчёт по данным, указанным на этикетках продуктов: количество белков, жиров и углеводов в 100 г продукта.
Каждый человек может выбрать систему подсчета, которая ему нравится. Но чаще всего бывает удобно использовать их комбинации.
Правила расчета дозы инсулина на углеводы
Хлебный фактор
Как же правильно рассчитать дозу инсулина в зависимости от количества принятых с пищей углеводов?
Количество единиц инсулина на 1 ХЕ (10-12 г углеводов) определяет ХЛЕБНЫЙ ФАКТОР (рассчитывается индивидуально).
В среднем 1 ХЕ повышает уровень глюкозы в крови на 2 ммоль/л.
Обычно на 1 ХЕ требуется 2 ЕД «короткого» инсулина (индивидуальные колебания от 0,5-1 ЕД в «медовом месяце» и до 4 ЕД при плохой чувствительности к инсулину — инсулинорезистентности). Можно использовать общие рекомендации:
На завтрак: 2 ЕД на 1 ХЕ
На обед: 1-1,5 ЕД на 1ХЕ
На ужин: 1—1,5 ЕД на 1 ХЕ
Методы расчета индивидуального хлебного фактора
1 способ:
Количество ХЕ (или граммов углеводов) в данный прием пищи (учитывают ХЕ на основной прием пищи и «перекус», если такой есть) разделить на количество единиц «короткого» инсулина перед едой, необходимого для поддержания глюкозы в крови через 2-3 часа в пределах ± 2 ммоль/л от допустимого уровня.
Хлебный фактор рассчитывается на каждый основной прием пищи. Для аналогов инсулина ультракороткого действия берут только ХЕ основного приема пищи, поскольку «перекусы» не нужны.
2 способ:
Общее количество ХЕ (или граммов углеводов), потребляемых за день, разделить на количество единиц инсулина короткого действия в день. Инсулин среднего и длительного действия в расчет не берут.
3 способ:
«Правило 450»: 450 разделить на всю суточную дозу инсулина (количество ЕД «короткого» + количество ЕД «длительного» инсулина) = количество граммов углеводов, для которых требуется 1 ЕД инсулина короткого действия.
«Правило 500»: 500 разделить на всю суточную дозу инсулина (количество ЕД «ультракороткого» аналога инсулина + количество ЕД «длительного» инсулина) = количество граммов углеводов, для которых требуется 1 ЕД аналога ультракороткого действия.
Данные расчеты проводятся при компенсации и субкомпенсации диабета (НbА1С до 8 %) и хорошо подобранной дозе базального инсулина. При нестабильных сахарах и декомпенсации рассчитанные коэффициенты не будут верны.
На начальных этапах диабета надо часто пересчитать индивидуальный хлебный фактор, поскольку доза инсулина часто меняется.
Сколько надо употреблять углеводов?
Если до развития диабета у Вас был нормальный вес, то расчет углеводов и режим питания должен основываться на Ваших привычках в еде.
В идеале эндокринолог (или диетолог) должен проанализировать Ваш обычный рацион питания до болезни и, исходя из него, рассчитать количество углеводов, делая соответствующие коррекции по типу углеводов и режиму инсулинотерапии.
При избытке веса (что не часто встречается на начальных этапах СД1 типа) даются рекомендации по снижению количества потребляемых углеводов и жиров
Гликемический индекс
Способность углеводов вызывать повышение уровня сахара в крови (гипергликемию) определяется гликемическим индексом. Этот термин впервые был введен в обращение в 1976 г.
Что такое гликемический индекс? По сути, это показатель, который определяет, на сколько возрастает уровень сахара в крови после потребления определённого продукта, и отражает скорость, с которой углеводистая пища всасывается в кровь. Чем выше гликемический индекс продукта, тем быстрее и значительнее после поступления пищи возрастёт уровень сахара в крови. А это в свою очередь послужит сигналом организму для выработки большей порции инсулина. Так как у больных 1 типом диабета инсулина либо нет, либо очень мало, то для них жизненно важно потреблять углеводы, обладающие низким гликемическим индексом и относительно медленно повышающие уровень сахара в крови. Это не касается случаев возникновения гипогликемии, когда, наоборот, необходимо быстро «поднять» сахар в крови, то есть употребить продукт с высоким гликемическим индексом.
Гликемический индекс зависит прежде всего от количества моно- и дисахаридов в пище. Кроме того, на гликемический индекс влияют другие компоненты пищи и ее консистенция. Например, клетчатка, белки и жиры замедляют всасывание глюкозы в кишечнике и тем самым снижают гликемический индекс.
Гликемический индекс пищевого продукта выражается
http://endogrodno.by/media/file/binary/2020/5/24/180196436285/1__png-9.png?srv=cms» />
Доктор Давид Людвиг из Бостонского детского госпиталя провел исследование связи между уровнем гликемического индекса принимаемой пищи и последующим потреблением калорий. Результат убедителен: после еды с высоким гликемическим индексом полные люди потребляли на 81 процент калорий больше, чем поте еды с низким гликемическим индексом. «Быстрое усвоение глюкозы приводит к подъему уровня норадреналина, который побуждает к последующему желанию подкрепиться», — указывает д-р Д.Людвиг.
ПРОДУКТЫ С НИЗКИМ ГЛИКЕМИЧЕСКИМ ИНДЕКСОМ «УСМИРЯЮТ» АППЕТИТ.
Более того, если сочетать в одном приеме пищи несколько продуктов с низким гликемическим индексом (например, яблоко с йогуртом либо творогом), то есть захочется не скоро. За последующей же трапезой Вы не переедите — организм все еще будет находиться под воздействием эффекта предыдущего приема продуктов с низким гликемическим индексом. Вот почему диетологи советуют начинать день не со сладкой сдобы со сладким же кофе, а со сложных углеводов (каш, хлеба из цельного зерна) и молочных и прочих белковых продуктов — у них низкий гликемический индекс.
Необходимо отметить, что химическая обработка продуктов может привести к увеличению гликемического индекса. Так, для примера, индекс кукурузных хлопьев равен 85, а кукурузы, из которой они сделаны, — 70. Картофельное пюре быстрого приготовления имеет индекс 90, а вареный картофель — 70.
Мы знаем также, что качество и количество неперевариваемой клетчатки в углеводе зависит от величины гликемического индекса. Так, мягкие белые булочки имеют индекс 95, белые батоны — 70, хлеб из муки грубого помола — 50, хлеб из цельной муки — 35, очищенный рис — 70, неочищенный — 50.
«Плохие» (быстрые) углеводы
Сюда относятся все углеводы, которые вызывают резкое повышение глюкозы в крови, что ведет к гипергликемии. В основном эти углеводы имеют индекс более 50.
Это в первую очередь белый сахар в чистом виде или в сочетании с другими продуктами, например пирожные, конфеты. Сюда относятся также все промышленно обработанные продукты (особенно хлеб из белой муки), белый рис, напитки (особенно спиртные), картофель и кукуруза.
«Хорошие» (медленные) углеводы
В отличие от «плохих» углеводов «хорошие» только частично усваиваются организмом и не вызывают значительного повышения сахара в крови.
Это прежде всего грубомолотые зерновые и некоторые крахмалосодержащие продукты — бобы и чечевица, а также большинство фруктов и овощей (салат, турнепс, зеленая фасоль, лук-порей и т.д.), которые, кроме того, содержат много клетчатки и мало глюкозы.
Факторы, влияющие на скорость всасывания углеводов
Ускоряют всасывание углеводов (повышают гликемический индекс продуктов) следующие факторы:
- 1. Термическая обработка пищи (отваривание) пищи способствует расщеплению
сложных углеводов.
- 2. Переработка продуктов (измельчение в пюре, шлифование круп) способствуют ускорению всасывания. Соки всасываются быстрее, чем цельные фрукты.
- 3. Употребление жидкости во время еды увеличивает скорость освобождения желудка, и углеводы быстрее поступают в кишечник, где всасываются в кровоток.
4.Употребление глюкозы в чистом виде повышает уровень сахара в крови, но не так сильно, как считалось раньше.
- 5. Поваренная соль ускоряет попадание глюкозы в кровоток.
Замедляют всасывание углеводов (понижают гликемический индекс продуктов) следующие факторы:
1.Пищевые волокна (клетчатка) тормозят скорость освобождения желудка и связывают глюкозу в кишечнике.
- 2. наличие в структуре крахмала в разных продуктах влияет на скорость нарас- тания концентрации глюкозы в крови: картофель быстро поднимает глюкозу в крови, а рис и макароны — медленно.
- 3. Жиры уменьшают скорость освобождения желудка.
4 Крупные куски пищи требуют более длительного времени для переваривания по сравнению с мелкими и замедляют скорость освобождения желудка.
Для всякого диабетического лечения правильное питание имеет решающее значение.
Важнейший компонент организации лечебного питания — знание углеводов и их правильного распределения. Эта квинтэссенция диеты легла в основу программы обучения Австрийского общества диабетиков и должна помочь Вам правильно определять содержание углеводов в употребляемой пище.
Основы диеты при сахарном диабете
Потребление пищи должно соответствовать энергетическим потребностям организма, т.е. должно быть сбалансировано по калориям. Пациенты с избыточным весом должны обязательно стремиться к своему идеальному весу и придерживаться ограничений в пище. Поступление углеводов в организм должно быть строго рассчитано с помощью таблицы по циклу обмена углеводов в организме. В ней показано содержание углеводов в различных продуктах. Необходимо исключить сахар в виде глюкозы, фруктозы, сахарозы. Сахар в естественном виде должен присутствовать только в овощах и молоке. Около 50% энергии должно поступать в виде комплексных углеводов. Они содержатся в картофеле, цельных злаковых, фруктах, салатах, крахмалосодержащих продуктах, таких, как хлеб, рис, тесто. Белков должно поступать из расчета 0,8 г на кг веса. Менее 30% энергии должно поступать за счет жиров. Состав пищи с учетом «балластных» веществ должен быть несколько увеличен. Необходимо ограничить поступление поваренной соли. Из рациона должен быть исключен алкоголь. Поступление холестерина не должно превышать 300 мг в сутки. Чтобы снизить ощущение голода и «сахарного голода», нужно принимать пищу в течение суток дробно (в 5 — 6 приемов).
Руководство к здоровому питанию
Наше питание состоит большей частью из жиров, белков, углеводов, солей и незначительного количества «балластных» веществ.
Почему надо употреблять в пищу меньше жиров? Слишком большое содержание жиров в пище может способствовать возникновению заболеваний сердца и ожирению.
Каким образом можно ограничить потребление жиров? Намазывайте меньше масла или маргарина на хлеб, используйте обезжиренный творог. Избегайте использования жира при приготовлении пищи, отдавайте предпочтение таким методам, как варка, гриль, приготовление пищи на пару.
Животному жиру предпочитайте растительные масла. Употребляйте в пищу больше рыбы и птицы, так как в них содержится меньше жиров. Удаляйте видимый жир из мяса и птицы перед приготовлением. В мясе, колбасе, молоке, молочных продуктах в скрытом состоянии находится жир, поэтому надо употреблять “обезжиренные” варианты этих продуктов. Такие продукты, как пирожные, кексы, шоколад, торты с кремом, выпечка, должны быть исключены из рациона, даже если они предлагаются под маркой диетических продуктов. Исключить орехи.
Почему надо есть меньше соли? Избыточное потребление соли соли может спровоцировать гипертоническую болезнь. Высокое артериальное давление (АД) в свою очередь, может обусловить заболевания сердца и инсульты. Поэтому не досаливайте уже приготовленную пищу. Не употребляй в пищу соленые продукты (чипсы, соленые орехи и т.д.). Попробуйте придать пище пикантный вкус за счёт различных приправ. Ешьте меньше консервированных продуктов. Они содержат соль и глутамат натрия.
Для чего нужно употреблять больше пищи, содержащей растительные волокна? Потребление пищи, богатой растительными волокнами, помогает решить многие проблемы со здоровьем (нормализует стул, препятствует развитию геморроя, дивертикулов кишечника, рака толстой кишки), снижает содержание липидов крови. «Балластные» вещества содержатся в зерновых, овощах и фруктах, также в картофеле, кожуре фруктов. Они дают чувство сытости, замедляют проникновение питательных веществ из кишечника в кровь.
Каким образом получать с пищей больше «балластных» веществ? Ешьте побольше овощей и фруктов, в том числе в натуральном виде. Потребляйте овсяные хлопья, клейковину пшеницы, не очень соленые маслины.
Обучение – постоянный процесс
Диабет каждый день ставит новые задачи, которые приходится решать немедленно, не дожидаясь приёма врача.
Вы должны внимательно изучить свой организм в новых условиях жизни с диабетом. Учитесь самостоятельно управлять своим состоянием.
Научитесь с самого начала делать всё правильно и чётко. Это как управление автомобилем – Вы будете автоматически переключать передачи, не задумываясь о своём процессе.
занятие 4. Коррекция дозы инсулина в зависимости от количества углеводных единиц
Коррекция дозы инсулина в зависимости от количества углеводных единиц, физической нагрузки, различных физиологических состояний, при острых заболеваниях и т.д. Особенности проведения самоконтроля гликемии в вышеуказанных случаях.
«Корригирующая» доза(КД)
При гликемии перед едой, превышающей целевую, к рассчитанной выше дозе добавляется «корригирующая» доза (КД) для понижения гликемии. Для этого необходимо выяснить индивидуальную чувствительность к инсулину (ЧИ), для чего используется формула:
ЧИ = 100 / общую суточную дозу инсулина (СДИ)
100 / 24 (12 ЕД. инсулина короткого действия + 12 ЕД. инсулина продленного действия) = 4,1 (то есть 1 ЕД инсулина снижает сахар в крови более чем на 4 ммоль/л) — в состоянии компенсации.
Таким образом, если у больного гликемия 14 ммоль/л (уровень целевой гликемии 8 ммоль/л), с учетом ЧИ величина коррекционной дозы (КД) составит (14 – 
Таким образом, система ХЕ как метод подсчета потребляемых углеводов используется у пациентов с СД 1-го типа не с целью ограничения потребления углеводов, а в связи с необходимостью соотносить его с дозами инсулина.
Примеры коррекции доз короткого инсулина (по гликемии перед едой)
Перед приемом пищи уровень сахара в норме. В этом случае вторая составляющая КД (на высокий сахар) будет равна нулю, а величина (УК)первой будет зависеть от количества ХЕ, которые вы употребите в данный прием пищи.
Перед приемом пищи сахар крови повышен (11,4 ммоль/л). В этом случае мы делаем дозу, состоящую из двух компонентов: на снижение высокого сахара и на усвоение углеводов.
Поводом для уменьшения плановой дозы инсулина служит снижение уровня глюкозы до 3,3-3,9 ммоль/л или возникновение гипогликемии.
Рекомендации по коррекции доз инсулина
Устойчивые изменения уровня глюкозы крови в определенное время суток, выявленные по записям в дневнике, могут служить основанием для коррекции доз инсулина и схемы инсулинотерапии. Чтобы убедиться, хватает ли инсулина на еду (болюса), необходимо проверить сахар крови перед едой и через 2–2,5 часа после — колебание гликемии не должны превышать 1,5–2 ммоль/л.
Устойчивые изменения уровня глюкозы крови в определенное время суток
Если уровень глюкозы крови после завтрака обнаруживает тенденцию к повышению, можно несколько увеличить дозу инсулина короткого действия, вводимую перед завтраком.
Наоборот, если уровень глюкозы в интервале между завтраком и обедом снизился и, особенно, если в это время появляются признаки гипогликемии, следует снизить утреннюю дозу инсулина короткого действия.
Подбор вечерней дозы NРH-инсулина
Если возникают ночные гипогликемии, когда в промежутке между 0 и 3 часами ночи уровень базального инсулина выше, чем обычная потребность в нем, то уменьшение дозы пролонгированного инсулина, вводимого перед сном, снижает вероятность возникновения ночной гипогликемии, однако часто приводит к утренней гипергликемии.
Это, в свою очередь, связано с тем, что в ранние утренние часы физиологическая потребность в инсулине резко возрастает («феномен утренней зари»). Нивелировать повышение гликемии в утренние часы можно за счет дополнительного введения короткого или ультракороткого инсулина в 4–5 часов утра.
ГИПЕРГЛИКЕМИЯ НАТОЩАК
Что делать, если у тебя высокий уровень сахара в крови утром натощак, и почему так происходит?
Прежде всего надо найти причину :
1.Недостаточная доза продленного инсулина получена вечером накануне (смотрите по сахару крови среди ночи — гликемия не должна превышать целевую 6–9 ммоль/л).
2.Ночная гипогликемия (проверить сахар в крови в 2 часа ночи).
3.Раннее время введения продленного инсулина вечером накануне.(если ты исключил ночную гипогликемию, попробуй вводить продленный инсулин на 1,5–2 часа позже -прямо перед сном).
Доза инсулина продленного действия относительно постоянна. Она подбирается так, чтобы инсулин между приемами пищи удерживал гликемию от повышения и не снижал ее. Эта доза периодически пересматривается на основании данных дневника самоконтроля
Примеры коррекции доз инсулина (сопутствующее заболевание)
Если у больного гипертермия, то дозировка инсулина перед едой должна складываться из двух составляющих: на высокую температуру (10% от суточной дозы короткого инсулина) и на ХЕ, которые вы съедите.
Если перед приемом пищи сахар крови очень высокий и даже есть ацетон, то дозировка инсулина должна складываться из: дозы на погашение сахара (20% от суточной дозы инсулина короткого действия) и на ХЕ, которые вы съедите (вторая составляющая может быть равна нулю).
Основные принципы инсулинотерапии:
Инсулины короткого действия (простой инсулин) вводятся за 20–30 мин до еды.
Ультракороткие аналоги (НовоРапид и Апидра) вводятся непосредственно перед приемом пищи, обладают сходными временными профилями действия вне зависимости от дозы.
Беспиковые аналоги инсулина продленного действия: Лантус вводится 1 раз в сутки, может назначаться 2 раза в день для обеспечения оптимального уровня базальной инсулинемии.
Левемир в большинстве случаев вводится 2 раза в сутки. Наиболее важной характеристикой инсулина Лантус и инсулина Левемир является снижение частоты гипогликемий.
Осложнения инсулинотерапии Гипогликемия
Особенно велик риск тяжелой гипогликемии (судорог или комы) у детей младшего возраста, поскольку они неспособны распознать предвестники гипогликемии.
Самая частая причина гипогликемии — передозировка инсулина.
Больные, живущие в тяжелых семейных условиях, и больные в тяжелой депрессии (особенно подростки) могут намеренно вводить чрезмерные дозы инсулина.
Постинъекционные липодистрофии
Часто в местах инъекций инсулина развивается липогипертрофия, обусловленная усилением образования жировой ткани. Липогипертрофия нарушает всасывание инсулина.
Профилактика липодистрофии: частая смена мест инъекций, массаж, физиотерапия
Аллергия к инсулину
Через несколько минут или часов после инъекции инсулина могут наблюдаться местные аллергические реакции (краснота, зуд, отек, уплотнение, ощущение жара).
В редких случаях возможны общие аллергические реакции: крапивница или отек.
Синдром передозировки инсулина
Характерно:
Переедание и избыток веса;
Значительные колебания уровня глюкозы в крови;
Нестабильное течение сахарного диабета;
Гипергликемия, особенно по ночам и в утренние часы, может быть вызвана не дефицитом, а передозировкой инсулина;
В таких случаях гипергликемию можно предупредить, снижая дозы инсулина.
занятие 5. Неотложные состояния
Неотложные состояния: гипогликемическое состояние, кетоз и кетоацидоз. Влияние гипогликемических состояний на течение сопутствующей патологии.
ОПРЕДЕЛЕНИЕ ГИПОГЛИКЕМИИ
Гипогликемией считается уменьшение содержания глюкозы в плазме крови ниже 3,9 ммоль/л. Возникновение ощущений, похожих на гипогликемию, при нормальном и даже повышенном уровне глюкозы в крови скорее всего связано с тем, что больной диабетом привык жить при очень высоком уровне глюкозы в крови и переход к более низкому уровню сопровождается подобными ощущениями. Однако настоящей гипогликемией это не является.
Может быть и обратная ситуация: человек не чувствует признаков гипогликемии при действительно низком уровне глюкозы в крови, но расценивать такую ситуацию он должен как истинную гипогликемию. Гипогликемия может развиться только у человека, больного сахарным диабетом, который получает инсулин или сахароснижающие таблетки, т.е. механизм развития гипогликемии заключается в избыточном количестве инсулина в организме в данный момент.
Что же предотвращает развитие гипогликемии у здорового человека? Прежде всего это снижение выработки инсулина поджелудочной железой, а также увеличение выброса глюкозы печенью. Поскольку первый механизм у больного диабетом, получающего инсулин, не работает (инсулин всасывается из-под кожи), то в определенной ситуации глюкозы, выброшенной печенью, не хватает и наступает гипогликемия.
ПРИЧИНЫ ГИПОГЛИКЕМИИ
«Передозировка» инсулина (техническая ошибка с набором дозы, несоответствие концентрации, введение инсулина дважды, введение инсулина короткого действия вместо продленного инсулина, инъекция в другую область тела, из которой инсулин всасывается лучше и т.д.).
Меньшее количество углеводов (хлебных единиц) в пище (пропуск еды или ошибка в подсчете ХЕ, большой интервал между инъекцией и едой).
Большая по сравнению с обычной физическая активность.
Прием алкоголя.
Если, проанализировав гипогликемию, вы не можете найти ее причину, тем более если она повторяется при той же дозе инсулина, — это говорит об уменьшении потребности организма в инсулине. В таком случае необходимо вводить инсулина меньше.
ПРИЗНАКИ ГИПОГЛИКЕМИИ
Гипогликемия, как правило, развивается довольно быстро — у человека появляется целый ряд типичных признаков:
— резкая слабость;
— потливость;
— головокружение;
— дрожь в руках или ощущение внутренней дрожи;
— бледность;
— двоение и потемнение в глазах;
— беспокойство;
-перемена настроения;
-страх;
-путаница в мыслях;
-сердцебиение;
— внезапное чувство голода и др.
Наличие таких признаков может говорить о развитии легкой гипогликемии. В ряде случаев, если гипогликемию экстренно не купировать, она может привести к тяжелому состоянию, когда больной диабетом как бы впадает в оцепенение и не может себе помочь. Дальнейшее развитие гипогликемии чревато гипогликемической комой — состоянием с потерей сознания, которое представляет угрозу для жизни. Это называется тяжелой гипогликемией.
Помните, что не все ощущения возникают одновременно. Не все ощущения, похожие на гипогликемию, являются действительно гипогликемией. В самом деле, кто периодически не испытывает слабости, головокружения, внезапного чувства голода. В связи с этим каждый больной диабетом должен научиться распознавать свои наиболее ранние признаки гипогликемии, а в сомнительных случаях измерять глюкозу в крови. Легкие гипогликемии, которые своевременно лечат, не имеют никаких отрицательных последствий. К сожалению, при хорошей компенсации диабета они неизбежны — это своеобразная «расплата» за нормальный уровень глюкозы в крови. Поэтому 2—3 эпизода легкой гипогликемии в течение недели считается обычным явлением.
ЛЕЧЕНИЕ ГИПОГЛИКЕМИИ
Конечно, во многих случаях легкие гипогликемии могут пройти самостоятельно, без лечения, потому что в организме человека, как уже говорилось, на случай резкого снижения уровня глюкозы имеется защитный механизм: мобилизуются запасы глюкозы из печени. Однако надеяться на это не следует. Во-первых, каждая легкая гипогликемия потенциально опасна развитием тяжелой. Во-вторых, если гипогликемию не лечить вовремя и правильно, в результате слишком активной работы печени может произойти значительное повышение глюкозы в крови после гипогликемии. Поэтому как только почувствуете первые признаки гипогликемии, немедленно начинайте лечение.
Лечение заключается в приеме углеводов, но не любых. Обычные медленноусвояемые углеводы (хлеб, каша, фрукты) начнут повышать глюкозу только через 20—30 минут. Чтобы быстро повысить уровень глюкозы в крови, необходимо принять легкоусвояемые углеводы — то, чего человек с диабетом обычно избегает: сахар, мед, сладкие напитки. В результате уже через несколько минут уровень глюкозы в крови начнет приходить в норму, а признаки гипогликемии постепенно исчезнут. Важно знать количество углеводов, которое надежно выведет из состояния гипогликемии. При возникновении даже легких признаков гипогликемии необходимо сразу же принять легкоусвояемые углеводы в количестве 2 ХЕ, например, 4—5 кусков сахара (20 г) или стакан (200 мл) фруктового сока или другого напитка на сахаре (например, газированного).
Больной сахарным диабетом, получающий лечение инсулином, должен всегда носить легкоусвояемые углеводы с собой!
Наиболее удобными для устранения гипогликемии являются специальные таблетки глюкозы, сахар в кусочках, маленькая упаковка фруктового сока тубы с углеводным сиропом.
ТЯЖЕЛАЯ ГИПОГЛИКЕМИЯ
При тяжелой гипогликемии (невозможность самостоятельных адекватных действий или полная потеря сознания — гипогликемическая кома) сам себе больной диабетом помочь, разумеется, не может. Поскольку требуется помощь окружающих, желательно проинформировать своих близких о возможности такого состояния. Признаки гипогликемии, которые могут быть заметны окружающим, — это бледность и внезапное изменение поведения: раздражительность, заторможенность, агрессивность и т.п.
Помощь при тяжелой гипогликемии заключается в следующем. Если сознание сохранено, нужно напоить или накормить больного диабетом сладким. В случае потери сознания этого делать нельзя ни в коем случае, так как он не может глотать и высока вероятность попадания жидкости или пищи в дыхательные пути. Следует положить человека в устойчивое положение на бок, освободить дыхательные пути (например, вынуть зубные протезы, удалить остатки пищи изо рта) и после этого вызвать скорую помощь. Врача необходимо проинформировать о том, что у человека диабет. Гипогликемическую кому лечат внутривенным введением глюкозы.
Существует также препарат для домашнего лечения тяжелой гипогликемии — глюкагон. Глюкагон — это гормон поджелудочной железы, который, воздействуя на печень, способствует повышению глюкозы в крови. Препарат глюкагона (например, набор ГлюкагенГипоКит) вводится внутримышечно или подкожно и поэтому может использоваться не только медицинскими работниками, но и обученными родственниками больного диабетом.
Если после введения глюкагона человек приходит в сознание, необходимо накормить его углеводистой пищей, чтобы уровень глюкозы в крови вновь не снизился. Если в течение 10 минут после введения глюкагона больной не приходит в сознание, необходимо вызвать скорую помощь.
Тяжелых гипогликемий необходимо избегать, так как они вредны для головного мозга. Если это все-таки произошло, в обязательном порядке проанализируйте причину тяжелой гипогликемии, чтобы не допустить повторения подобной ситуации. Желательно, чтобы у вас при себе всегда была карточка (удостоверение) больного диабетом с информацией о том, с кем необходимо связаться и что делать в случае потери сознания. Если вы выезжаете за границу, сделайте такую карточку на языке той страны, куда направляетесь.
Основная причина гипогликемии – избыток в организме инсулина. Во многих случаях развитие гипогликемических эпизодов можно предотвратить! При возникновении этого состояния очень важно своевременно принять быстро всасывающиеся углеводы (сахар, сок); больному диабетом следует всегда иметь их при себе в достаточном количестве
ДИАБЕТИЧЕСКИЙ КЕТОАЦИДОЗ (ДКА, ДИАБЕТИЧЕСКАЯ КЕТОАЦИДОТИЧЕСКАЯ КОМА)
ДКА — требующая экстренной госпитализации острая декомпенсация СД, с гипергликемией (уровень глюкозы плазмы > 13 ммоль/л* у взрослых и > 11 ммоль/л у детей), гиперкетонемией (> 5 ммоль/л), кетонурией (> ++), метаболическим ацидозом (рН < 7,3, уровень бикарбоната < 15 ммоль/л) и различной степенью нарушения сознания или без нее.
Провоцирующие факторы:
-интеркуррентные заболевания, операции и травмы;
-пропуск или отмена инсулина больными, ошибки в технике инъекций, неисправность средств для введения инсулина;
-недостаточный самоконтроль гликемии, невыполнение больными правил самостоятельного повышения дозы инсулина;
-манифестация СД, особенно 1 типа;
-врачебные ошибки: несвоевременное назначение или неадекватная коррекция дозы инсулина;
— хроническая терапия стероидами, атипичными нейролептиками, некоторыми таргетными противоопухолевыми препаратами и др.;
-беременность.
Клиническая картина
Полиурия, жажда, признаки дегидратации и гиповолемии (снижение АД, возможна олиго- и анурия), слабость, отсутствие аппетита, тошнота, рвота, запах ацетона в выдыхаемом воздухе, головная боль, одышка, в терминальном состоянии дыхание Куссмауля, нарушения сознания — от сонливости, заторможенности до комы.
Часто — абдоминальный синдром (ложный «острый живот», диабетический псевдоперитонит) — боли в животе, рвота, напряжение и болезненность брюшной стенки, парез перистальтики или диарея.
ЛЕЧЕНИЕ
Основные компоненты:
устранение инсулиновой недостаточности (УУР А, УДД 1).
борьба с дегидратацией и гиповолемией (УУР А, УДД 1).
восстановление электролитного баланса и КЩС (УУР В, УДД 1).
выявление и лечение сопутствующих заболеваний и состояний (спровоцировавших ДКА или развившихся как его осложнение).
На догоспитальном этапе или в приемном отделении:
Экспресс-анализ гликемии и анализ любой порции мочи на кетоновые тела;
0,9 % раствор №С! в/в капельно со скоростью 1 л/ч.
Лечение ДКА легкой степени проводится в эндокринологическом или терапевтическом отделении):
Лабораторный мониторинг:
Экспресс-анализ гликемии — ежечасно до снижения уровня глюкозы плазмы (ГП) до 13 ммоль/л, затем, при условии стабильности, 1 раз в 3 часа.
Анализ мочи или плазмы на кетоновые тела — 2 раза в сутки в первые 2 суток, затем 1 раз в сутки.
Общий анализ крови и мочи: исходно, затем 1 раз в 2 суток.
№+, К+ плазмы: минимум 2 раза в сутки, при необходимости каждые 2 часа до разрешения ДКА.
Расчет эффективной осмолярности.
Биохимический анализ крови: мочевина, креатинин, хлориды, бикарбонат, желательно лактат — исходно, затем 1 раз в 3 суток, при необходимости — чаще.
Газоанализ и рН (можно венозной крови): 1-2 раза в сутки до нормализации КЩС.
Инструментальные исследования и мероприятия:
катетеризация центральной вены.
почасовой контроль диуреза; контроль центрального венозного давления (ЦВД) (или другой метод оценки волемии), АД, пульса и 1:° тела каждые 2 часа; ЭКГ не реже 1 раза в сутки или ЭКГ-мониторинг; пульсоксиметрия.
поиск возможного очага инфекции по общим стандартам.
Терапевтические мероприятия
Инсулинотерапия — режим малых доз (лучшее управление гликемией и меньший риск гипогликемии и гипо- калиемии, чем в режиме больших доз) (УУР А, УДД 1):
Внутривенная (в/в) инсулинотерапия:
Начальная доза ИКД (ИУКД): 0,1 — 0,15 ЕД/кг реальной массы тела в/в болюсно. Необходимую дозу набирают в инсулиновый шприц, добирают 0,9 % раствором №С! до 1 мл и вводят очень медленно (2-3 мин). Если болюсная доза инсулина не вводится, то начальная скорость непрерывной инфузии должна составлять 0,1 — 0,15 ЕД/кг/ч.
В последующие часы: ИКД (ИУКД) по 0,1 ЕД/кг/ч в одном из вариантов:
Вариант 1 (через инфузомат): непрерывная инфузия 0,1 ЕД/кг/ч. Приготовление инфузионной смеси: 50 ЕД ИКД (ИУКД) + 2 мл 20 % раствора альбумина или 1 мл крови пациента (для предотвращения сорбции инсулина в системе, которая составляет 10-50 % дозы); объем доводят до 50 мл 0,9 % раствором №С!.
Вариант 2 (в отсутствие инфузомата): раствор с концентрацией ИКД (ИУКД) 1 ЕД/мл или 1 ЕД/10 мл 0,9 % раствора №С! в/в капельно (+ 4 мл 20 % раствора альбумина/100 мл раствора для предотвращения сорбции инсулина). Недостатки: коррекция доз ИКД (ИУКД) по числу капель или мл смеси требует постоянного присутствия персонала и тщательного подсчета; трудно титровать малые дозы.
Вариант 3 (более удобен в отсутствие инфузомата): ИКД (ИУКД) в/в болюсно (медленно) 1 раз/час шприцем в инъекционный порт инфузионной системы. Длительность фармакодинамического эффекта ИКД (ИУКД) при этом — до 60 мин. Преимущества: нет сорбции инсулина (добавлять альбумин или кровь в раствор не нужно), точный учет и коррекция введенной дозы, меньшая занятость персонала, чем в варианте 2.
Внутримышечная (в/м) инсулинотерапия проводится при невозможости в/в доступа: нагрузочная доза ИКД (ИУКД) — 0,2 ЕД/кг, затем в/м по 5-10 ЕД/ч. Недостатки: при нарушении микроциркуляции (коллапс, кома) ИКД (ИУКД) хуже всасывается; малая длина иглы инсулинового шприца затрудняет в/м инъекцию; 24 в/м инъекции в сутки дискомфортны для больного. Если через 2 часа после начала в/м терапии гликемия не снижается, переходят на в/в введение.
При легкой форме ДКА в отсутствие нарушений гемодинамики и сознания и при возможности оставлении больного в обычном (не реанимационном) отделении в некоторых случаях допустимо п/к введение инсулина по принципу базально-болюсной терапии, с введением инсулина продленного действия 1 или 2 раза в сутки и ИКД (ИУКД) не реже 1 раза в 4 часа (УУР С, УДД 3)
Скорость снижения ГП — оптимально 3 ммоль/л/ч и не более 4 ммоль/л/ч (опасность обратного осмотического градиента между внутри- и внеклеточным пространством и отека мозга); в первые сутки следует не снижать уровень ГП менее 13-15 ммоль/л (УУР В, УДД 2).
Перевод на п/к инсулинотерапию: при улучшении состояния, стабильной гемодинамике, уровне ГП <12 ммоль/л и рН > 7,3 переходят на п/к введение ИКД (ИУКД) каждые 4 — 6 ч в сочетании с инсулином продленного действия. Если ДКА развился на фоне приема иНГЛТ-2, их дальнейшее применение противопоказано.
Регидратация
Растворы:
0,9 % раствор №С! (при уровне скорректированного №+ плазмы* < 145 ммоль/л); при более высоком №+ — см. раздел 8.2 (УДД 1 УУР А).
При уровне ГП < 13 ммоль/л: 5-10 % раствор глюкозы (+ 3-4 ЕД ИКД (ИУКД) на каждые 20 г глюкозы).
Коллоидные плазмозаменители (при гиповолемии — систолическое АД ниже 80 мм рт. ст. или ЦВД ниже 4 см водн. ст.) (УУР А, УДД 1).
Преимущества других кристаллоидных растворов (Рингера, Рингера-Локка, Хартманна и др.) перед 0,9 % раствором №С!, при лечении ДКА не доказаны (УУР В, УДД 1).
* Скорректированный №+ = измеренный №+ + 1,6 (глюкоза ммоль/л — 5,5) / 5,5
Скорость регидратации: Суммарный дефицит воды в организме при ДКА: 5-10% массы тела, или 50-100 мл/кг реальной массы тела. Этот объем жидкости следует возместить за 24 — 48 ч. В 1-е сутки следует восполнить не менее половины дефицита жидкости. Начальная скорость регидратации с помощью 0.9% раствора №С!: в 1-й час — 1-1.5 л, или 15 — 20 мл/кг массы тела. Дальнейшая скорость регидратации корректируется в зависимости от клинических признаков дегидратации, АД, почасового диуреза и ЦВД: при ЦВД < 4 см водн. ст. вводится 1 л жидкости в час, при ЦВД 5-12 см водн. ст. — 0.5 л/ч, выше 12 см водн. ст. — 250- 300 мл/ч.
Возможно применение режима более медленной регидратации: 2 л в первые 4 часа, еще 2 л в следующие 8 часов, в дальнейшем — по 1 л за каждые 8 часов.
Если регидратацию при ДКА начинают с 0,45% раствора №С! (при гипернатриемии > 145 ммоль/л), то скорость инфузии меньше, около 4-14 мл/кг в час.
Восстановление электролитных нарушений
В/в инфузию калия начинают одновременно с введением инсулина со следующей скоростью (УУР В, УДД 2):
Инфузию калия, требующую высокой скорости введения, следует осуществлять в центральную вену.
Коррекция метаболического ацидоза
Этиологическое лечение метаболического ацидоза при ДКА — инсулин (УУР А, УДД 1).
Показания к введению бикарбоната натрия: рН крови < 6,9 или уровень стандартного бикарбоната < 5 ммоль/л. Вводится 4 г бикарбоната натрия (200 мл 2 % раствора в/в медленно за 1 ч), максимальная доза — не более 8 г бикарбоната (400 мл 2 % раствора за 2 ч) (УДД 2, УУР С).
Без определения рН/КЩС введение бикарбоната противопоказано!
Критерии разрешения ДКА: уровень ГП < 11 ммоль/л и как минимум два из трех показателей КЩС: бикарбонат > 18 ммоль/л, венозный рН > 7,3, анионная разница < 12 ммоль/л. Небольшая кетонурия может некоторое время сохраняться.
Питание
После полного восстановления сознания, способности глотать, в отсутствие тошноты и рвоты — дробное щадящее питание с достаточным количеством углеводов и умеренным количеством белка (каши, картофельное пюре, хлеб, бульон, омлет, фрикадельки из нежирного мяса, разведенные соки без добавления сахара), с дополнительным п/к введением ИКД (ИУКД) по 1-2 ЕД на 1 ХЕ. Через 1-2 суток от начала приема пищи, в отсутствие острой патологии ЖКТ, — переход на обычное питание.
Частая сопутствующая терапия
Антибиотики широкого спектра действия (высокая вероятность инфекций как причины ДКА).
Введение низкомолекулярного гепарина в профилактической дозе при отсутствии противопоказаний (высокая вероятность тромбозов на фоне дегидратации)
занятие 6. Особенности инсулинотерапии
Особенности инсулинотерапии, питание, физической нагрузки у пациентов с СД 2 типа пожилого возраста.
Единого определения понятия «пожилой возраст» не существует.
Применительно к медицинским рекомендациям в развитых странах наиболее часто определение «пожилой возраст» относится к лицам старше 65 лет.
Диагностика
Диагностические критерии СД в пожилом возрасте не отличаются от таковых для всей популяции в целом. •
* У части пожилых больных показатели HbA1c могут быть неточными из-за сопутствующих заболеваний, влияющих на продолжительность жизни эритроцитов.
Особенности СД 2 типа у лиц пожилого возраста
Клинические
Часто бессимптомное течение (отсутствие специфических жалоб на полиурию, жажду, сухость во рту)
Нередко наличие микро- и макроангиопатий уже на момент выявления СД
Множественная коморбидная патология
Лабораторные
Отсутствие гипергликемии натощак у ряда больных
Частое преобладание изолированной постпрандиальной гипергликемии
Повышение почечного порога для глюкозы с возрастом
Психосоциальные
Часто социальная изоляция и недостаточная материальная обеспеченность
Нарушение когнитивных функций (снижение памяти, обучаемости и др.)
Цели лечения пожилых больных СД 2 типа зависят от:
-ожидаемой продолжительности жизни больного;
— коморбидной патологии, прежде всего состояния сердечно-сосудистой системы;
— риска гипогликемических состояний;
-сохранности когнитивных функций (в том числе способности выполнять контрольные и лечебные мероприятия;
— категории функциональной активности
Функциональные категории пожилых больных СД
Пациенты пожилого и старческого возраста могут значительно отличаться друг от друга по уровню функциональной активности, характеризующей наличие и степень зависимости от посторонней помощи.
Категория пациентов: функционально независимые
Пациенты, которые не нуждаются в помощи при выполнении мероприятий повседневной активности, или нуждаются в ней в минимальном объеме (например, при необходимости добраться до мест, расположенных вне привычной дистанции).
Категория пациентов: функционально зависимые
Пожилые люди, регулярно нуждающиеся в посторонней помощи в ежедневной активности по причине ухудшения их функционального статуса. Для них характерна более низкая ожидаемая продолжительность жизни и более высокий риск госпитализаций.
Отдельного рассмотрения требуют две подгруппы пациентов — с синдромом старческой астении и с деменцией.
Подкатегория А:
Старческая астения — ассоциированный с возрастом синдром, основными клиническими проявлениями которого являются повышенная утомляемость, непреднамеренная потеря веса, снижение мобильности и мышечной силы. В основе развития старческой астении лежит саркопения — возраст-ассоциированная мышечная атрофия.
Подкатегория В:
Деменция. Пациенты с деменцией имеют тяжелые нарушения когнитивных функций — памяти, мышления, внимания, ориентации во времени и в пространстве и т.д., что приводит к постепенной потери способности к самообслуживанию и зачастую сопровождается развитием поведенческих и психических нарушений. При этом в физическом отношении пациенты с деменцией могут оставаться длительное время достаточно сохранными.
Категория пациентов: завершающий этап жизни
Ожидаемая продолжительность жизни менее 6 мес.
Индивидуальные целевые показатели углеводного обмена при СД в пожилом возрасте
Алгоритм индивидуализированного выбора целей терапии при СД в пожилом возрасте по HbA1c
|
Категории пациентов |
Пожилой возраст |
|||
|
Функционально зависимые |
||||
|
Клинические характеристики/ риски |
Функционально независимые |
Без старческой астении и/или деменции |
Старческая астения и/или деменция |
Завершающий этап жизни |
|
Нет атеросклеротических сердечнососудистых заболеваний2 и/или риска тяжелой гипогликемии3 |
< 7,5% |
< 8,0% |
< 8,5% |
Избегать гипогликемий и симптомов гипергликемии |
|
Есть атеросклеротические сердечнососудистые заболевания и/или риск тяжелой гипогликемии |
< 8,0% |
При низкой ожидаемой продолжительности жизни (< 5 лет) цели лечения могут быть менее строгими
Нормальный уровень в соответствии со стандартами РССТ: до 6%.
ИБС (инфаркт миокарда в анамнезе, шунтирование/стентирование коронарных артерий, стенокардия); нарушение мозгового кровообращения в анамнезе; заболевания артерий нижних конечностей (с симптоматикой).
Основными критериями риска тяжелой гипогликемии являются: тяжелая гипогликемия в анамнезе, бессимптомная гипогликемия, большая продолжительность СД, ХБП С3-5, деменция.
Примечание: Следует учесть, что даже в пожилом возрасте ожидаемая продолжительность жизни может быть достаточно высокой и в этих случаях не следует допускать завышения индивидуальных целей лечения.
ЛЕЧЕНИЕ
Особенности питания
Диетические ограничения, в том числе для снижения массы тела, следует использовать с осторожностью и лишь в том случае, если они приводят к клинически значимому улучшению углеводного или липидного обмена, уровня АД или других важных показателей состояния здоровья. Следует помнить о потенциально неблагоприятном влиянии гипокалорийного питания на костную ткань, поступление витаминов, развитие саркопении
Нет необходимости рекомендовать строго определенное количество углеводов пожилым больным с нормальной массой тела, не получающим инсулинотерапию. При использовании инсулина короткого (ультракороткого) действия возможна практически ориентированная оценка количества углеводов в пище.
Особенности физической активности
Регулярный физические нагрузки очень желательны, но они должны быть строго индивидуализированы в соответствии с общим физическим состоянием больного, наличием и тяжестью осложнений и сопутствующих заболеваний.
Рекомендуются прогулки по 30-60 мин ежедневно или через день.
Медикаментозная терапия
У лиц пожилого возраста предпочтение следует отдавать использованию сахароснижающих препаратов с низким риском гипогликемий.
В целом, алгоритм сахароснижающей терапии такой же, как при СД 2 типа.
Требования к сахароснижающим препаратам у пожилых больных СД 2 типа:
— минимальный риск гипогликемии
— отсутствие нефро-, гепато- и кардиотоксичности;
— отсутствие взаимодействия с другими препаратами;
— удобство применения.
Инсулинотерапия в целом не отличается от схем, предложенных для больных СД 2 типа.
— начинать инсулинотерапию следует с наиболее простых режимов: с базальных инсулинов (НПХ, гларгин, детемир)
— интенсифицированная инсулинотерапия возможна только при сохранении когнитивных функций пожилого пациента, после обучения основным правилам инсулинотерапии и самоконтроля уровня гликемии.
— у пациентов с СД 2 типа, ранее длительно получавших интенсифицированную инсулинотерапию, в случае появления когнитивных нарушений следует рассмотреть более простой режим.
Инсулин и инсулинотерапия: темный лес или стройная система
Статьи
Опубликовано в журнале:
В мире лекарств »» №2 1998 Е.Г. СТАРОСТИНА, ДОЦЕНТ КАФЕДРЫ ЭНДОКРИНОЛОГИИ ФАКУЛЬТЕТА УСОВЕРШЕНСТВОВАНИЯ ВРАЧЕЙ МОНИКИ, КАНДИДАТ МЕДИЦИНСКИХ НАУК
Инсулин относится к тем немногочисленным, действительно жизнеспасающим лекарствам, которые произвели настоящий переворот в судьбе больных: до получения инсулина в 1922 г. больных инсулинзависимым («юношеским») сахарным диабетом ждала неминуемая смерть от диабетической комы в течение одного-двух лет от начала заболевания, несмотря на применение самых фантастических и изнурительных диет. С момента создания первого препарата прошло более 75 лет, однако до сих пор остаются актуальными, хотя и резкими, сказанные тогда слова пионера диабетологии Э.П. Джослина (США): «Инсулин — лекарство для умных, а не для дураков, будь то врачи или пациенты». Ему вторит и Дж. Хэрроп, автор первого в мире пособия по инсулинотерапии (1924 г.): «Как часто бывает при появлении новых терапевтических средств, в случае с инсулином мы имеем дело с палкой о двух концах. Если применять его правильно — это благо, а если неправильно — это опасность для больного!
К 1998 г. в России зарегистрировано более 20 препаратов инсулина короткого действия (ИКД) и около 40 препаратов инсулина продленного действия (ИПД). Многолетний опыт консультирования в многопрофильных стационарах заставляет признать, что степень осведомленности врачей-неэндокринологов о свойствах, качественных и количественных различиях препаратов инсулина весьма низка, что приводит к большому числу ошибок в инсулинотерапии. Между тем ориентироваться в препаратах инсулина должен врач любой специальности, поскольку до 3-4% населения в целом и до 10-30% пациентов стационара страдают сахарным диабетом.
Препараты инсулина отличаются друг от друга по степени очистки; источнику получения (бычий, свиной, человеческий); веществам, добавляемым к раствору инсулина (удлиняющим его действие, бактериостатикам и т.д.); концентрации; величине рН; возможности смешивания ИКД с ИПД.
Строение, изготовление и очистка инсулина
Инсулин — двухцепочечный белок с молекулярной массой около 5750 дальтон, состоящий из 51 аминокислоты. Предшественником инсулина является про-инсулин, в котором обе инсулиновые цепочки скреплены молекулой соединительного пептида (С-пептида). Годовая потребность в инсулине в мире составляет около 65 миллиардов единиц (1 единица = 42 мкг чистого вещества), поэтому производство инсулина требует высокотехнологичных способов его массового изготовления. Раньше инсулин экстрагировали из поджелудочных желез крупного рогатого скота или свиней кислотно-спиртовым методом с последующей нейтрализацией и высаливанием; полученный таким образом препарат содержал лишь 89-90% инсулина. Повторным растворением и рекристаллизацией содержание инсулина увеличивали до > 90% (обычная степень очистки).
Для улучшения очистки инсулина далее его подвергают хроматографии. После однократной хроматографии препарата, предварительно прошедшего первичную очистку методом кристаллизации, получают так называемые монопиковые инсулины (помимо инсулина они содержат монодезаминоинсулин, моноаргинининсулин и моноэтилинсулин). После многократной хроматографии удается очистить инсулин до такой степени, при которой никаких примесей практически не остается — эти инсулины называются монокомпонентными (как правило, имеют маркировку на флаконе — МС). Сегодня необходимо стремиться к применению только препаратов инсулина высокой степени очистки: образование циркулирующих антител к инсулину (в конечном итоге снижающих его активность) и местные реакции при их использовании отмечаются значительно реже.
Виды препаратов инсулина по источнику получения
Инсулин свиньи и быка отличается от человеческого по аминокислотному составу: бычий — по трем аминокислотам, а свиной — по одной. Неудивительно, что при лечении бычьим инсулином побочные реакции развиваются гораздо чаще, чем при терапии свиным или человеческим инсулином. Эти реакции выражаются в иммунологической инсулинорезистентности, аллергии к инсулину, липодистрофиях (изменении подкожножировой клетчатки в месте инъекции).
Несмотря на явные недостатки бычьего инсулина, он все еще широко используется в мире, прежде всего в развивающихся странах, большим количеством больных, поскольку благодаря избытку сырья производство его обходится недорого. И все же недостатки бычьего инсулина в иммунологическом плане столь очевидны, что его ни в коем случае не рекомендуется назначать больным впервые выявленным сахарным диабетом, беременным или для кратковременной инсулинотерапии, например в периоперационном периоде. Отрицательные качества бычьего инсулина сохраняются и при использовании его в смеси со свиным, поэтому смешанные (свиной+бычий) инсулины также не стоит использовать для терапии указанных категорий больных.
Препараты инсулина человека по химической структуре полностью идентичны человеческому инсулину. В принципе, инсулин человека можно производить четырьмя способами: 1) полным химическим синтезом; 2) экстракцией из поджелудочных желез человека (оба этих способа не подходят из-за неэкономичности: недостаточной разработанности первого способа и недостатка сырья для массового производства вторым способом); 3) полусинтетическим методом с помощью ферментно-химической замены в положении 30 В-цепи аминокислоты аланина в свином инсулине на треонин; 4) биосинтетическим способом по генноинженерной технологии. Два последних метода позволяют получить человеческий инсулин высокой степени очистки.
Преимущество полусинтетического метода в том, что исходное вещество (свиной инсулин) получают и очищают давно и хорошо известными и усовершенствованными способами. Появлению вторичных примесей после ферментно-химической обработки можно воспрепятствовать соответствующим контролем качества. Недостаток полусинтетического метода заключается в постоянной зависимости производства от исходного сырья — свиного инсулина. При биосинтетическом производстве человеческого инсулина необходимый геномный материал переносят в микроорганизмы, которые начинают синтезировать предшественники инсулина.
Современные технологии на фирмах «Хехст» (Германия), «Эли Лилли» (США) и «Ново Нордиск» (Дания) — это три крупнейших мировых производителя инсулина — отличаются друг от друга по патентно-правовым аспектам. «Эли Лилли», первая фирма, которая приступила к использованию генноинженерной технологии производства инсулина, с 1987 г. работает на человеческом геноме. С его помощью кишечная палочка (E.coli) синтезирует проинсулин, который после ферментного отщепления С-пептида превращается в инсулин (примеры — препараты Хумулин-Р, Хумулин-цинк, Хумулин-Н). «Ново Нордиск» применяет синтетически полученную ДНК для «мини-про-инсулина», то есть такого проинсулина, в котором С-пептид значительно короче, чем в проинсулине человека. Эту синтетическую ДНК вводят в дрожжевые микроорганизмы, которые начинают синтезировать «мини-проинсулин», из которого потом ферментным способом выделяют инсулин, по аминокислотной последовательности соответствующий человеческому (примеры — Актрапид-НМ, Протафан-НМ и Актрафан-НМ).
Основной проблемой биосинтетическиго метода получения инсулина человека является полная очистка конечного продукта от малейших примесей использованных микроорганизмов и продуктов их жизнедеятельности. Новые методы контроля качества гарантируют, что биосинтетические инсулины человека вышеперечисленных производителей свободны от каких-либо вредных примесей; таким образом, их степень очистки и сахароснижающая эффективность отвечают самым высоким требованиям и являются практически одинаковыми. Каких-либо нежелательных побочных действий, зависящих от примесей, эти препараты инсулина не имеют.
Вещества, добавляемые к инсулину
Добавки к инсулину вносят для: а) удлинения действия инсулина и кристаллизации, б) дезинфекции, в) придания препарату буферных свойств (таблица 1).
Таблица 1. Характеристики коммерческих препаратов инсулина (адаптировано по International Textbook on Diabetes, 1997)
| Тип инсулина |
Синонимы | Удлинитель | Консервант | Буфер/соли | Bиды | Примеры (торговые названия) |
| Короткого действия |
«Простой», растворимый |
Нет | Метилпарабен m-Крезол Фенол |
NaCl Глицерин Na(H)PO4 Ацетат Na |
Человеч. Свиной Бычий |
Актрапид-НМ, Хумулин-Р Актрапид, Актрапид-МС Инсулин для инъекций (СССР, более не производится) |
| НПХ (NPH) |
Изофан | Протамин | m-Крезол Фенол |
Глицерин Na(H)PO4 |
Человеч. Свиной Бычий |
Протафан-НМ, Хумулин-Н Протафан-МС Протамин-инсулин (СССР, более не производится) |
| Ленте | Инсулин-цинк-суспензия (смешанн.) |
Цинк | Метилпарабен | NaCl Ацетат Na |
Человеч. Свиной Бычий |
Монотард-НМ, Хумулин-цинк Монотард-МС, Ленте-МС Ленте |
| Ультра-ленте | Инсулин-цинк-суспензия (кристалл.) |
Цинк | Метилпарабен | NaCl Ацетат Na |
Человеч. Бычий |
Ультраленте Ультратард |
Таблица 2. Длительность действия наиболее употребительных препаратов свиного и человеческого инсулина* (упрощенные рекомендации)
| Тип препарата | Начало | Максимум | Продолжительность | |
| малые дозы (разовые) |
большие дозы (разовые) (разовые) |
|||
| 1. Инсулины короткого действия | 15-40 мин | 1,5-4 часа | 4-6 ед: 4 часа | 16-20 ед: 6 часов |
| 2. Инсулины промежуточного действия** | 2 часа | 6-8 часов | 8-10 ед: 12-14 часов | более 20 ед: 16-18 часов |
| 3. Инсулины длительного действия*** | 4 часа | 8-10 часов | 8-10 ед: 14 часов | более 20 ед: 20-22 часа |
* Продолжительность действия препаратов бычьего инсулина несколько больше, чем свиного и человеческого, из-за буферного действия антител к бычьему инсулину
** Препараты инсулина цинк-суспензии (Лонг, Ленте, Монотард, Хумулин-цинк.) и протамин-инсулина (Протафан, Хомофан, НПХ, Хумулин-Н)
*** Препараты инсулин-цинк-суспензии кристаллической (Ультраленте, Ультратард)
а) Удлиняющее действие инсулина. Первый ИПД был создан в конце 30-х гг., чтобы больные смогли делать инъекции реже, чем это было при использовании только ИКД, — по возможности один раз в сутки (было ли это действительно хорошо для больных и каковы преимущества и недостатки той или иной схемы инсулинотерапии — тема другой статьи).
НПХ-инсулин (синонимы — нейтральный протамин Ха-гедорна, NPH, изофан-инсулин, протамин-инсулин) содержит инсулин и протамин в изофанных, то есть равных, количествах, при которых нет избытка ни инсулина, ни протамина. Протамин — белок со щелочными свойствами, который получают из рыбьих молок. Аллергические реакции на него встречаются крайне редко. Нейтральный рН препарата обеспечивается добавлением фосфатного буфера. Чтобы протамин мог образовывать кристаллы инсулина, добавляют небольшое количество цинка, фенола и/или крезола.
Инсулин-цинк-суспензия (ИЦС) был разработан после того, как было обнаружено, что добавление небольших количеств цинка при нейтральном рН удлиняет действие инсулина. Первым препаратом этого типа был инсулин Ленте. Буферные свойства раствору придают не с помощью фосфатного (как в случае с протамин-инсулином), а с помощью других буферов, например ацетатного. Степень замедления действия инсулина в препаратах ИЦС зависит от физического состояния инсулина (величины кристаллов): аморфная ИЦС действует быстрее, чем кристаллическая ИЦС. Из аморфной и кристаллической ИЦС можно сделать смесь, которая по длительности действия будет аналогична НПХ-инсулину. Вначале такая комбинация была стабильной только в том случае, если аморфную часть брали из свиного, а кристаллическую — из бычьего инсулина. Такой состав имеет инсулин Ленте, состоящий из 3 частей свиного аморфного и 7 частей бычьего кристаллического инсулина. Позднее удалось создать инсулин продленного действия с соотношением: 3 части свиного аморфного и 7 частей свиного кристаллического инсулина (Монотард).
Синтетическое вещество сурфен (аминометилхинолил-мочевина) применяется для удлинения действия инсулина в ранее выпускавшемся В-инсулине (Берлин-Хеми). Сурфен вместе с инсулином находится в растворе, поэтому это единственные прозрачные препараты ИПД. Раствор имеет кислый рН. После введения в подкожножировую клетчатку, рН которой нейтрален, происходит выпадение исулин-сурфеновых комплексов в виде аморфных частиц. Продолжительность действия сурфен-инсулина короче, чем НПХ-инсулина и различных ИЦС, а его действие начинается значительно раньше. Часто развивается аллергия к сурфену. Кислый рН этих препаратов может вызвать и местные кожные реакции.
Важнейший факт, который у нас пока не очень широко известен: более короткая продолжительность действия практически всех препаратов инсулина по сравнению с той, которая традиционно указывалась в инструкциях и справочниках, — это особенно относится к инсулинам человека (таблица 2). Ранние исследования с использованием радиоактивной метки показали, что, например, препараты типа ИЦС-кристаллического циркулируют в крови более 36-48 часов. Однако в таких исследованиях констатировалось лишь наличие препарата в крови, включая и его следовые количества. Но это отнюдь не означает, что и его сахароснижающее действие, а именно оно интересует нас как мера клинической активности инсулина, столь же продолжительно. Истинная продолжительность сахароснижающего эффекта была определена более точным методом (метод одновременной инфузии глюкозы и инсулина, или «клэмп») около 10 лет назад.
Оказалось, что длительность сахароснижающего действия препаратов группы ИЦС (Ленте, Лонга, Инсу-лонга, Монотарда, Хумулина-цинка), а также группы НПХ (Протафана, Хомофана, Хумулина-N) не превышает 12-18 часов (в зависимости от дозы), а препаратов типа ИЦС-кристаллической (в том числе Ультраленте и Ультратарда) — 20-22 часов, в очень редких случаях — 24. Поэтому все препараты группы ИЦС и НПХ-инсулина рекомендуется вводить дважды в сутки. По современной классификации они относятся к пролонгированным препаратам промежуточного действия. К препаратам длительного действия относят Ультраленте и Ультратард (ИЦС кристаллическая), хотя для более стабильной базальной концентрации инсулина в крови рекомендуется вводить их не один, а два раза в сутки. Это позволяет уменьшить их дозу и, соответственно, риск гипогликемии. По этой же причине отошли от использования препаратов типа ИЦС-аморфной (Семиленте, Семилонга), которые действуют не половину суток, как считали ранее, а 8-10 часов и не удовлетворяют требованиям к фоновым инсулинам.
В инструкциях к препаратам группы ИЦС более позднего выпуска, например Инсулонгу и Монотарду, уже указываются новые данные о продолжительности их действия (до 18 часов). Иногда эндокринологи назначают больным одновременно препарат типа Ленте (полагая, что он действует 24 часа) плюс Инсулонг (считая его близким к аморфному). Это ошибочно, так как профиль действия перечисленных препаратов одинаков, и назначать их в смеси нецелесообразно.
б) Дезинфицирующие вещества и консерванты. Дезинфицирующим действием обладают некоторые из субстанций, которые и без того необходимо вносить в препарат по фармако-технологическим соображениям. Так, например, в НПХ уже содержатся фенол и крезол (оба вещества обладают неприятным запахом). Метил парабензоат (метилпарабен), напротив, не имеет запаха. Все дезинфицирующие вещества в тех концентрациях, в которых они присутствуют в препаратах инсулина, не оказывают какого-либо отрицательного влияния. В препараты ИЦС нельзя добавлять фенол, изменяющий физические свойства частиц инсулина, поэтому данные препараты содержат метилпарабен. Ионы цинка, содержащиеся в этих препаратах, также оказывают антимикробное действие. Несмотря на многократное введение иглы во флакон с инсулином, такая многоступенчатая антибактериальная защита предотвращает осложнения, которые могли бы возникнуть из-за их бактериального обсеменения.
в) Вещества, необходимые для кристаллизации и придания буферных свойств. Для перевода инсулина в кристаллическое состояние в ИЦС необходимо добавлять NaCl. Некоторые препараты в качестве буфера содержат фосфаты. Фосфатсодержащий инсулин ни в коем случае нельзя смешивать с ИЦС! Иначе может выпасть осадок фосфата цинка, который непредсказуемым образом укоротит продолжительность действия цинк-инсулина.
Концентрация инсулина
Первые препараты инсулина содержали лишь 1 единицу инсулина в 1 мл. Позже их концентрация была увеличена. Большинство препаратов, использующихся в России, содержат 40 единиц инсулина в 1 мл (U-40). Однако во многих странах применяется инсулин, содержащий 100 единиц в 1 мл (U-100). Целесообразность перехода к U-100-инсулину у нас в стране пока вызывает сомнения.
Проблемы возникают уже сейчас, когда часть больных стала пользоваться инъекторами инсулина (шприц-ручками), в которых применяются специальные картриджи (пенфиллы) с инсулином U-100. В случае поломки шприца-ручки некоторые больные набирают U-100-инсулин из пенфиллов инсулиновыми шприцами, предназначенными для инсулина U-40 (и градуированными именно на эту концентрацию).
Практически никто из больных (да и многие врачи) не отдают себе отчета в том, что градуировка шприцев на единицы инсулина есть не что иное, как градуировка по объему раствора, рассчитанная именно на U-40-инсулин: 4 ед инсулина соответствуют 0,1 мл раствора, 6 ед — 0,15 мл и так далее, вплоть до 40 единиц, соответствующих 1 мл раствора (еще раз подчеркнем: при концентрации инсулина 40 ед/мл!). Если в такой шприц набрать инсулин с концентрацией 100 ед/мл до метки, например, 20 единиц, то получится, что в набранном объеме (0,5 мл) содержится уже 100 ед/мл х 0,5 = 50 единиц инсулина! Таким образом, набирая U-100-инсулин в обычные инсулиновые шприцы и ориентируясь при этом на метки «единиц», мы всякий раз будем набирать дозу (100 ед/мл: 40 ед/ мл), превышающую в 2,5 раза ту, что отмечена возле данного деления шприца. Если больной или врач вовремя не обратят внимание на эту ошибку, возможны случаи тяжелых гипогликемий из-за передозировки инсулина, что мы неоднократно и наблюдали на практике.
В последнее время в нашу страну по каналам гуманитарной помощи попадали инсулиновые шприцы, предназначенные для U-100-инсулина и градуированные именно для него. По ошибке в эти шприцы можно набрать из флаконов привычный нам U-40-инсулин, и тогда доза инсулина в шприце, рассуждая аналогично, однако «в обратную сторону», окажется в 2,5 раза меньше той, что указана возле соответствующего деления шприца. Как следствие этого, можно ожидать «необъяснимое» повышение сахара крови — необъяснимого, впрочем, если не знать следующего правила: ддя каждой концентрации инсулина — соответствующий шприц!
Тщательно продуманный план, по которому осуществляли переход на U-100-инсулин, например в Швейцарии, может служить образцом. Однако он требует тесного взаимодействия и обучения всех участвующих сторон: больных, врачей, фармацевтов, промышленности и администрации.
рН инсулинового раствора
Некоторые препараты инсулина выпускаются в растворах с кислым рН (например, таким был отечественный препарат «инсулин для инъекций», или «простой инсулин»; Депот-инсулин S, Депот-инсулин CR, Комб-инсулин и Комб-инсулин S, Германия). Кислые инсулины дают гораздо более выраженные иммунологические реакции на экзогенный инсулин и повышенную частоту реакций местной непереносимости. В настоящее время от применения препаратов инсулина с кислым рН практически отказались.
Смешивание инсулинов короткого и продленного действия
Современная инсулинотерапия, особенно при сахарном диабете I типа, обычно предусматривает применение как ИКД, так и ИПД. Больным было бы удобнее, если бы препараты ИКД и ИПД можно было смешивать в одном шприце и вводить одновременно, делая не два прокола кожи, а один. Предпосылкой терапии такого рода служит наличие химической и галеновой (т.е. зависящей от состава) сочетаемости ИКД и ИПД.
Особенно важно то, чтобы при смешивании ИКД и ИПД не растягивалось и не пропадало быстрое начало действия ИКД. Доказано, что ИКД можно смешивать в одном шприце с изофанным НПХ-инсулином, при этом быстрое начало действия ИКД не тормозится. Смеси этих инсулинов можно хранить.
Что касается препаратов ИЦС, то уже давно было известно, что кристаллическую ИЦС нельзя смешивать с ИКД, поскольку избыток цинка превращает ИКД в ИПД — по крайней мере, частично. Это доказано для Ультратарда. Если набрать в один шприц смесь Актрапида-НМ (ИКД) с Монотардом-НМ (ИПД) и сразу ввести ее под кожу, биодоступность ИКД уменьшается, поэтому начало его действия наступает позже, чем при раздельном введении этих препаратов. Поэтому смешивать Актрапид-НМ с Монотардом-НМ тоже нельзя.
Некоторые больные вначале вводят ИКД, а затем, оставив иглу под кожей и слегка изменив ее направление, через нее же вводят цинк-инсулин. Хотя научных исследований по этому способу проводилось мало, нельзя исключить, что в части случаев и при таком введении под кожей образуется смесь ИКД с цинк-инсулином, что нарушит всасывание первого компонента. Поэтому мы рекомендуем совершенно раздельное введение ИКД и цинк-инсулина (в виде двух отдельных инъекций в участки кожи, отстоящие друг от друга не менее чем на 1 см; понятно, что это менее удобно, чем применение протамин-инсулина в одном шприце с ИКД).
При смешивании с сурфен-инсулинами или неизофанными НПХ-инсулинами ИКД частично или полностью превращается в ИПД, поэтому приготовление подобных смесей нецелесообразно. В нашей стране отношение к смешиванию препаратов инсулина прошло два этапа. Вначале многие смешивали в одном шприце любые препараты инсулина, не зная об их особенностях. Затем перешли к другой крайности, вообще отказавшись от смешивания ИКД с ИПД и вводя их только раздельно, тем самым количество инъекций (проколов кожи) удваивалось. По-видимому, необходимо активнее доводить информацию о возможности смешивания ИКД и изофанного НПХ-инсулина до тех больных, которые ими пользуются.
Выпускаются и так называемые комбинированные инсулины — комбинации ИКД с НПХ-инсулинами в фиксированном процентном соотношении. Наиболее оправдывают себя смеси, содержащие 30% простого и 70% НПХ-инсулина, например инсулин Микстард и Актрафан-НМ (Ново Нордиск), Профиль III (Эли Лилли) или 25% простого и 75% НПХ-исулина, например Депот-Н-инсулин (Хехст). Однако такие комбинированные препараты больше подходят для больных, которым свойственны постоянный образ жизни, режим питания и двигательной активности (например, для пожилых больных сахарным диабетом II типа), так как они неудобны для проведения современной «гибкой» инсулинотерапии с частым изменением дозы ИКД при относительно мало меняющейся дозе ИПД.
Какие препараты инсулина лучше применять?
Собственно говоря, для эффективной инсулинотерапии требуется лишь один препарат ИКД и один препарат ИПД, которые можно было бы смешивать друг с другом, а также — в основном для пожилых больных — препарат инсулина комбинированного действия. Согласно современным рекомендациям, следует использовать препараты инсулина, соответствующие следующим критериям: высокая степень очистки; нейтральный рН; возможность смешивания ИКД и ИПД. Из группы ИПД желательно применять препараты с продолжительностью действия 12-18 часов, подходящие для двукратного введения в сутки. Препараты типа Семиленте и Ленте в развитых странах практически не используются: первые — из-за недостаточной продолжительности действия (менее 10 часов), вторые — из-за наличия в них бычьего инсулина и невозможности смешивания в одном шприце с ИКД.
С тех пор, как в распоряжении врача есть одновременно и человеческий, и высокоочищенный свиной инсулин, возникает вопрос: нужно ли вообще использовать последний. Установлено, что терапия полусинтетическим и биосинтетическим инсулином человека надежна и не сопряжена с побочными действиями, которые можно было бы отнести к способу получения препаратов. По сравнению с бычьим инсулин человека обладает преимуществами вследствие незначительной антигенности. Однако по сравнению с высокоочищенными свиными инсулинами это преимущество инсулина человека выражено гораздо меньше и не является точно доказанным. Иммунологические исследования больных, которые либо с самого начала получали человеческий инсулин, либо были переведены на него в процессе лечения, показали, что при подкожном введении инсулина человека также образуются циркулирующие антитела к инсулину. Это явление, поначалу весьма удивившее диабетологов, объясняют тем, что при подкожном введении происходит локальное энзиматическое разрушение инсулина, образующиеся фрагменты которого могут являться аллергенами. В любом случае, проявления и степень иммунной реакции при лечении человеческим инсулином весьма незначительны. Как при лечении впервые выявленных больных, так и при переводе с других препаратов инсулин человека выгодно отличается от бычьего. Однако различия в сахароснижающем действии между человеческим и свиным монокомпонентным инсулином отсутствуют, в иммунологическом отношении — невелики, а по данным некоторых исследований, и вовсе минимальны: антитела к инсулину в том и в другом случае образуются примерно в 5-8% случаев. Строго говоря, перевод на инсулин человека абсолютно показан в случаях иммунологической инсулинорезистентности или аллергии и при местной непереносимости свиного инсулина; при лечении больных впервые выявленным сахарным диабетом I типа; при необходимости временной инсулинотерапии (например, при операции).
Большой ошибкой будет считать, что можно улучшить компенсацию обмена веществ, в том числе решить проблему так называемого лабильного диабета только за счет перевода больного со свиного на человеческий инсулин. От надежд такого рода больного (и врача) следует настойчиво предостеречь: они не имеют под собой никаких оснований.
В 1990-91 гг. мы проанализировали эффективность использования различных видов инсулина в случайной выборке из 120 больных сахарным диабетом I типа (таблица 3). При этом оказалось, что при лечении препаратами как человеческого инсулина, так и инсулина животного происхождения интегральный показатель углеводного обмена за последние 3 месяца (гликированный гемоглобин, или НbА1) свидетельствовал о выраженной декомпенсации (о среднем уровне гликемии около 15-16 ммоль/л). После этого больные прошли специальную программу обучения, начали проводить самоконтроль глюкозы крови и научились самостоятельно изменять дозу инсулина; им было предоставлено самим выбирать, какими препаратами инсулина пользоваться. Через год у всех больных произошло значительное улучшение компенсации углеводного обмена, и опять она не зависела от пида инсулина. Аналогичным образом отсутствовала и разница в средней потребности в инсулине на килограмм массы тела — как исходно, так и в динамике. Нисколько не желая умалить достоинств инсулина человека в иммунологическом плане, мы лишь хотим продемонстрировать, что сам по себе он не является ни необходимым, ни достаточным для достижения хорошей компенсации углеводного обмена. О чем нужно помнить при переводе на инсулин человека? У больных, которые на фоне лечения инсулином животного происхождения имели высокий титр антител к инсулину, в течение месяцев после перевода на человеческий инсулин титр антител снижается, поэтому длительность действия инсулина может укорачиваться, а максимальный сахаросодержащий эффект — несколько усиливается. Человеческий ИКД начинает действовать несколько быстрее, чем свиной. При переводе на инсулин человека больных следует информировать об этих возможных изменениях времени действия инсулина. Важно, чтобы больной вводил инсулина не больше, чем нужно; при этом необходимо регулярно удостоверяться в том, нельзя ли достичь хорошей компенсации на меньшей дозе инсулина, особенно ИПД. Но столь же важно и обратное: доза инсулина не должна быть меньше той, которая необходима конкретному больному для хорошей компенсации.
Таблица 3. Вид инсулина и компенсация углеводного обмена: большие надежды? (собственные данные, 6)
| До прохождения программы обучения |
После прохождения программы обучения |
|
| Уровень НbА1 (норма до 8%)* | ||
| — на инсулине человека | 12,7% (n=23) | 9,2% (n=64) |
| — на инсулине животного происхождения | 12,6% (n=98) | 9,6% (n=52) |
| Суточная доза инсулина, ед/кг* | ||
| — на инсулине человека | 0,75 (n=23) | 0,76 (n=64) |
| — на инсулине животного происхождения | 0,69 (n=98) | 0,72 (n=52) |
* — различие между группами на инсулине человека и животном инсулине по всем параметрам статистически недостоверно.
Распространено мнение, что после перевода с инсулина животного происхождения на инсулин человека доза препарата должна быть уменьшена из-за возможных гипогликемий. Это верно лишь для тех больных, у которых исходно был высокий титр антител к инсулину, частично связывающих экзогенный инсулин животного происхождения и, следовательно, снижающих уровень свободного (т.е. активно действующего) инсулина в плазме. Человеческий инсулин этими антителами не связывается или связывается в очень небольшой степени. Кроме того, титр антител после перевода на инсулин человека с течением времени падает; все это ведет к тому, что уровень свободного инсулина становится выше, чем имелся при той же дозе инсулина животного происхождения, а это может сопровождаться появлением гипогликемий. Однако если больной до перевода на человеческий инсулин не имел высокого титра антител к инсулину, то ожидать снижения дозы нет никаких оснований. Второй важный фактор, влияющий на возможное снижение дозы инсулина, — степень гипергликемии. У длительно декомпенсированных больных развивается временное снижение чувствительности к экзогенному инсулину (теория «глюкозной токсичности»). Если в это время пытаться компенсировать их с помощью инсулина животного происхождения, потребуется существенное увеличение дозы. Если же перевести их на инсулин человека в прежней дозе, то, согласно описанному выше механизму, уровень свободного инсулина станет выше, произойдет как бы относительное увеличение дозы «внутри» организма больного, что и позволит улучшить компенсацию. Если же дозу инсулина человека снизить сразу, не ожидая снижения гликемии и появления легких гипогликемий, то уровни свободного инсулина в этом случае окажутся недостаточными для преодоления исходной декомпенсации и преимуществ от перевода на инсулин человека не будет получено.
К сожалению, это и происходит у очень многих больных, когда врачи, в отсутствие возможности определить уровень антител, выполняют ошибочную устаревшую инструкцию, которая гласит: при переводе на инсулин человека следует сразу уменьшить дозу инсулина на 25%. Как же поступать с дозой инсулина человека на практике? Нужно руководствоваться двумя моментами: а) коррекцию дозы инсулина в любую сторону проводят только в соответствии с реальным уровнем гликемии; снижение дозы требуется лишь после появления легких гипогликемий; б) потребность в инсулине может снизиться у разных больных в разное время — как сразу после перевода, так и лишь через несколько недель или месяцев, но может и не снизиться вообще.
Фармакокинетика подкожно введенного инсулина
После инъекции инсулин может оказать сахароснижающее действие только после того, как он достигнет тканей-мишений (в первую очередь печени, мышц и жировой ткани), а для этого он должен всосаться из подкожной клетчатки в кровь. Молекулярно-биологические механизмы всасывания инсулина в кровоток после подкожного введения не ясны окончательно и по сей день. Сейчас, когда уже доказано, что целью лечения больных сахарным диабетом с большой ожидаемой продолжительностью предстоящей жизни является (почти) нормогликемия, все яснее становится роль как можно более постоянной, предсказуемой абсорбции подкожно введенного инсулина как одной из важнейших предпосылок успеха лечения.
При этом следует учитывать, что подкожное введение инсулина в принципе нефизиологично, поскольку оно осуществляется в место, не самое подходящее с анатомической и физиологической точки зрения. Основное действие инсулина в плане регуляции гомеостаза глюкозы разворачивается в печени; уже в процессе первого прохождения через печень инсулина, который образуется в поджелудочной железе и поступает в систему воротной вены, элиминируется примерно половина этого гормона, и лишь остальное количество попадает в периферическое кровообращение. В результате уровень инсулина в крови воротной вены существенно выше, чем на периферии. При подкожном введении инсулина он вначале проходит по большому и малому кругам кровообращения и лишь затем по печеночным артериям достигает мишени — гепатоцитов. Понятно, что в этом случае для достижения физиологической концентрации инсулина в печени необходим гораздо более высокий уровень инсулина в периферической крови, чем это бывает у здорового человека. По этой причине при подкожном введении инсулина при сахарном диабете приходится считаться с наличием различной степени периферической гиперинсулинемии.
Другая проблема при подкожной инсулинотерапии заключается в изменении периода полужизни инсулина. У здорового человека период полужизни циркулирующего инсулина составляет около 4 минут. После всасывания подкожно введенного ИКД период жизни удлиняется примерно в 10 раз (до 40 минут). Период полужизни ИПД вполне может растянуться до нескольких часов. Это существенно нарушает гибкость «тонкой» регуляции гомеостаза глюкозы.
С помощью фармакокинетических исследований удалось точно описать кинетику всасывания подкожно введенного ИКД. Высокоочищенные препараты свиного инсулина, а соответственно и препараты инсулина человека, всасываются очень быстро: уже через 10 минут после инъекции отмечается значительный подъем уровня инсулина в сыворотке. Примерно через 60 минут достигается плато биодоступности инсулина, а снижение уровня циркулирующего инсулина до исходных величин растягивается на несколько часов, в то время как в физиологических условиях уменьшение инсулинемии до базального уровня наблюдается в течение немногих минут после прекращения выброса инсулина.
Некоторая часть (не менее 10-20%) подкожно введенного инсулина подвергается энзиматическому расщеплению в месте инъекции еще до того, как он попадает в кровоток. Существует довольно редкая форма инсулинорезистентности, когда еще большая часть введенной дозы инсулина подвергается деградации в подкожной клетчатке. Эту особую форму инсулинорезистентности, при которой для достижения компенсации обмена веществ требуются астрономические количества инсулина, можно легко диагностировать по различию в сахароснижающем действии ИКД при подкожном и внутривенном введении.
Различия в процессе локальной деградации инсулина в зависимости от места инъекции, а также различия между больными играют определенную роль в том, что добиться стабильного уровня сахара крови при подкожной заместительной инсулинотерапии достаточно трудно. Не вполне ясны и механизмы дальнейшего транспорта инсулина на его пути от места подкожного введения в кровоток. Более 80% введенного ИКД проходит прямо в кровеносные капилляры, и лишь очень небольшая и непостоянная часть его попадает в кровоток через лимфатические пути. Возможно, изменения базальных мембран и эндотелия сосудов при диабетических микроангиопатиях небезразличны для процесса всасывания инсулина.
Физико-химические основы всасывания ИПД до сих пор практически не определены; выявлена существенная вариабельность кинетики всасывания у разных больных.
На всасывание инсулина влияет ряд факторов.
Место инъекции.
Кинетика всасывания подкожно введенного ИКД зависит от анатомического строения места инъекции. Это особенно заметно при патологических изменениях подкожножировой клетчатки, например липодистрофиях. Введение инсулина в измененные участки кожи сопровождается непредсказуемыми колебаниями его всасывания, поэтому инъекций в такие участки следует избегать.
Нам неоднократно приходилось сталкиваться и со случаями, когда и больной, и его врач были убеждены в «тяжести» диабета и инсулинорезистентности, что проявлялось в невозможности добиться компенсации даже на больших дозах человеческого инсулина. Простейший осмотр пациента позволял выявить причину: следы от инъекций располагались вплотную друг к другу на маленьком участке кожи диаметром не более 2-3 см, над уплотненным, утолщенным слоем подкожной клетчатки. При расспросе больных выяснилось, что они (или медицинские сестры!) неделями или месяцами вводили инсулин в этот участок. Возникшие при этом изменения подкожножировой клетчатки существенно замедляют и уменьшают всасывание инсулина в кровоток, что снижает эффективность его действия. Смена места инъекции и соблюдение необходимого расстояния между отдельными проколами кожи (не менее 1 см) позволяют быстро ликвидировать мнимую инсулинорезистентность. Вследствие анатомических различий в плотности капилляров подкожного слоя в различных регионах тела даже при неизменной подкожножировой клетчатке инсулин всасывается по-разному. Так, из области живота инсулин поступает в кровоток существенно быстрее, чем после введения его в область бедра; инъекция в плечо, которую предпочитают многие больные, по скорости всасывания инсулина занимает промежуточное положение. При нерегулярной и бессистемной смене мест инъекции от одной области тела к другой также могут возникнуть выраженные колебания сахароснижающего действия инсулина; так, эффект ИКД начнется раньше и будет более выражен при введении инсулина в область живота по сравнению с введением его в бедро.
Вот почему смена мест инъекции (живот — бедро — плечо) не должна быть хаотичной; место инъекции необходимо последовательно менять в пределах одной области по определенной схеме: например, утром всегда делать инъекцию в живот, в обед — в плечо, вечером — в бедро или же все инъекции — в область живота.
Температура.
Особенно заметные изменения всасывания инсулина можно наблюдать при изменении температуры кожи в месте инъекции. Так, горячая ванна или прикладывание горячей грелки резко ускоряет абсорбцию инсулина, а после холодной ванны всасывание надолго тормозится. Указанные эффекты выражены настолько сильно, что могут клинически значимо влиять на компенсацию углеводного обмена. Так, летом пребывание под палящим солнцем приводит не только к солнечным ожогам, но и к значительному ускорению всасывания инсулина и, как следствие, гипогликемиям, о чем следует предупреждать больных. Напротив, сауна, в отличие от прежних предположений о ней, очевидно, не вызывает никакого заметного ускорения всасывания инсулина. Вероятно, здесь накладывается друг на друга действие различных, противоположных друг другу факторов. Не рекомендуется вводить инсулин, только что вынутый из холодильника (медленное всасывание). Раствор инсулина должен иметь комнатную температуру, поэтому начатый флакон лучше хранить вне холодильника, в темном месте.
Массаж места инъекции.
Самого сильного ускорения всасывания инсулина можно достичь путем легкого массажа места инъекции сразу же после введения. Опять-таки это надо делать либо постоянно, либо не делать совсем.
Мышечная работа.
При мышечной работе в определенных условиях может произойти выраженное ускорение действия инсулина. Длительное время это явление переоценивали в качестве возможной причины гипогликемии, возникающей при физической нагрузке. Дело доходило даже до того, что для профилактики гипогликемии на фоне мышечной работы больным рекомендовали вводить предшествующую нагрузке дозу инсулина в тот участок тела, который меньше всего или совсем не будет участвовать в работе. Однако эту рекомендацию нельзя считать разумной.
Во-первых, видов физической активности, которые изолированно затрагивают только некоторые, определенные части тела, очень мало. Во-вторых, ускорение всасывания инсулина выражено существенно только тогда, когда физическая нагрузка на данный участок тела имеет место в пределах первого получаса после инъекции, что практически встречается довольно редко. В-третьих, показано, что усиление сахароснижающего действия физической нагрузки через 45 минут после введения ИКД совсем не зависит от того, куда был введен инсулин — в плечо или бедро, так как основной механизм действия физической нагрузки — усиление утилизации глюкозы тканями, а не ускорение всасывания инсулина.
Таким образом, рекомендация менять место инъекции перед мышечной работой для профилактики гипогликемий неэффективна. Именно в результате этой нецелесообразной рекомендации в последние годы были отмечены многочисленные случаи тяжелых гипогликемий у больных диабетом на фоне занятий спортом. Чтобы избежать гипогликемии при физической нагрузке, нужно прибегать к давно известным правилам: прием дополнительного количества углеводов (при кратковременной) и/или снижение дозы инсулина (при длительной мышечной работе).Глубина инъекции.
Часто забывают о такой причине непонятных колебаний сахара в крови, как случайное внутримышечное или внутрикожное введение инсулина. Сделанная по ошибке и оставшаяся незамеченной (ввиду своей безболезненности) внутримышечная инъекция возможна как раз при использовании современных тончайших и коротких инсулиновых игл. У худых больных слой подкожножировой клетчатки на участках тела, куда обычно делают инъекции инсулина, чаще всего гораздо тоньше 12 мм. Длина игл шприцев-ручек и одноразовых инсулиновых шприцев равняется 12-13 мм, поэтому, если вкалывать иглу перпендикулярно к поверхности кожи, в большинстве случаев инсулин будет введен внутримышечно. Такую «перпендикулярную» инъекцию часто делают именно те, кто пользуется шприцами-ручками, поскольку эта техника наглядно представлена на многих промышленно выпускаемых инструкциях. Чтобы обеспечить по возможности одинаковое, унифицированное всасывание инсулина из подкожножировой клетчатки, необходимо взять складку кожи и вколоть иглу под углом 45 градусов.
С другой стороны, внутримышечное введение инсулина упомянутыми иглами безболезненно и безопасно. Хорошо обученные больные могут успешно пользоваться этой техникой, например, перед приемом быстроусвояемых углеводов или в случае кетоацидотической декомпенсации, чтобы ускорить действие ИКД. После внутримышечного введения инсулина в плечо или бедро он всасывается значительно быстрее, чем после подкожного. При введении в область живота различия между подкожной и внутримышечной инъекцией выражены меньше. Однако внутримышечное введение препаратов ИПД не рекомендуется из-за укорочения продолжительности действия и усиления нежелательных колебаний активности.
При случайном внутрикожном введении (что бывает, если иглу вкалывают под слишком малым углом к коже или неглубоко) инсулин всасывается плохо, а в месте инъекции может возникать покраснение и болезненность, которые иногда ошибочно трактуются как аллергия.
Доза инсулина.
Доказано, что продолжительность действия инсулина зависит от введенной разовой дозы (см. таблицу 2). После подкожного введения Актрапида в дозе 0,1 ед/кг достоверное повышение инсулинемии наблюдается на протяжении 4-6 часов; при повышении дозы до 0,2 ед/кг удваивается не только активность, но и продолжительность действия инсулина. Иными словами, при введении 6 ед ИКД больному весом 60 кг активное сахароснижающее действие будет проявляться, как правило, в течение 4 часов (редко — дольше, так как не всегда незначительно повышенный уровень инсулина в крови оказывает существенное влияние на гликемию); введение этому же больному 12 ед ИКД будет сопровождаться сахароснижающим эффектом примерно до 7 часов. Не следует забывать при этом, что переваривание большинства блюд (независимо от съеденного количества) заканчивается через 4-6 часов!
Таким образом, инсулин как лекарственное средство уникален в том отношении, что его клиническая эффективность зависит не только и, может быть, не столько от характеристик препаратов как таковых, но и — в огромной степени! — от многочисленных факторов, связанных с обращением с препаратами и техникой введения. Не будет преувеличением утверждение, что значительный процент случаев так называемого лабильного диабета, то есть нерегулярных и непредсказуемых колебаний сахара крови при сахарном диабете I типа, на самом деле не является каким-то клиническим вариантом течения заболевания, а развивается вследствие недостаточного знания вышеописанных феноменов и их неучета при проведении инсулинотерапии. О факторах, влияющих на фармакокинетику инсулина, и особенностях различных препаратов необходимо информировать больных при обучении. Врач и больной должны учитывать возможные отклонения длительности и силы действия препаратов инсулина от традиционных схем и стараться выработать индивидуальную инсулинотерапию, а не следовать жесткому плану, который вряд ли приведет к успеху по вышеупомянутым причинам.
Литература
1. Sonnenberg G.E., Berger M. Human insulin — much ado about one amino acid? Diabetologia (1983), 25, p. 457-459.
2. Berger M., Cueppers H.J. et al. Absorption inetics and biological effects of subcutaneously injected insulin preparations. Diabetes Care (1982), 5, p. 77-91.
3. Frid A., Linden B. (1986). Where do learn diabetics inject their insulin? A study using computed tomography. Br Med J (1986), 292, p. 1638.
4. Sonnenberg G.E., Chantelau E.A. et al. Human and porcine regular insulins are equally effective in subcutaneous replacement therapy. Diabetes (1982), 31, p. 600-602.
5. Stare A.A., Heinemann L. et al. The action profile of human insulin preparations. Diabetic Medicine (1989), 6, p. 239-244.
6. Antsiferov M., Starostina Т., Galstjan G., Dedov I. IDF Bulletin (1992), suppi. 1; v. 37, N3, p. 7.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Инсулин — белковый гормон поджелудочной железы, отвечает за доставку энергии к клеткам, излишки глюкозы отправляет в мышечную и жировую ткань, печень. Дополнительно участвует в транспортировке аминокислот, участвует в процессе регенерации, регулирует выведение натрия из организма, управляет синтезом липидов, повышает мышечную выносливость.
- Как вырабатывается инсулин
- Норма инсулина
- Причины повышения уровня инсулина
- Как снизить уровень инсулина
- Правила питания
- Как подготовиться к сдаче анализа на инсулин
Как вырабатывается инсулин
Инсулин синтезируют клетки поджелудочной железы — островки Лангерганса. У здоровых людей эти клетки реагируют на уровень сахара в крови, в ответ выбрасывают нужно количество гормона.
После приема пищи уровень сахара в крови всегда повышается, затем инсулин нормализует показатели глюкозы.
Если инсулина в организме мало или совсем нет, глюкоза постоянно циркулирует в крови, но в клетки не поступает.
Если гормона много, то клетки получают разовую повышенную дозу глюкозы, в крови сахара не остается. Клетки не голодают, но и про запас энергия не откладывается. Это проявляется в виде повышенной утомляемости, постоянного чувства голода.
Норма инсулина
Основное заболевание, которое связывают с инсулином, это сахарный диабет. Но при подозрении на эту патологию назначают анализ концентрации глюкозы или гликированного гемоглобина.
Уровень инсулина измеряют в мкЕд/л — значение показывает, сколько гормона присутствует в 1 мл крови.
Нормальные значения (в мкЕд/мл):
- 3-20 у детей;
- 3-25 у мужчин и женщин;
- 6-35 у людей преклонного возраста;
- 6-27 у беременных.
Анализ на инсулин нужно делать вместе с тестами на глюкозу. Диагностику назначают в следующих случаях:
- выяснение причин хронической, острой гипогликемии;
- для оценки работы клеток, которые вырабатывают инсулин;
- выявления невосприимчивости к инсулину;
- после операций на поджелудочной железе;
- для коррекции терапии пациентам с диабетом 2 типа;
- при подозрении на опухоли поджелудочной железы;
- при выраженном ожирении;
- при бесплодии;
- при неконтролируемом аппетите, повышенном потоотделении, хронической усталости;
- людям с генетической предрасположенностью к сахарному диабету.
Никаких характерных симптомов, которые указывают на высокий уровень инсулина нет. Единственный признак — низкое содержание глюкозы в крови.
Причины повышения уровня инсулина
Основная причина повышения уровня инсулина — инсулинорезистентность. Организм использует инсулин неэффективно, поджелудочная железа синтезирует больше гормона для восполнения дефицита. Это помогает избежать нарушений в углеводном обмене.
Если поджелудочная не справляется с выработкой инсулина в повышенных дозах, развивается выраженная инсулинорезистентность. На начальном этапе диагностируют преддиабет, а затем диабет 2 типа, неалкогольная жировая болезнь печени.
К провоцирующим факторам развития инсулинорезистентности относят:
- генетическую предрасположенность;
- малоподвижный образ жизни;
- гипертоническую болезнь;
- вредные привычки;
- лишний вес;
- погрешности в питании;
- инфекционные патологии;
- аутоиммунные заболевания;
- гормональный сбой;
- частые стрессы;
- дефицит сна;
- длительный прием стероидов.
Кратковременное повышение показателей инсулина возможно у людей с диабетом 1 типа после приема гормона в большом количестве и недостаточном поступлении углеводов с пищей. С таким состоянием легко справиться, если съесть или выпить что-то сладкое.
Редко высокий уровень инсулина может быть симптомом болезни Иценко-Кушинга, гипотиреоза, поликистоза яичников, опухолей поджелудочной железы, болезней почек или печени, акромегалии.
Снижение показателей инсулина — основной признак сахарного диабета 1,2 типа. Значительное повышение уровня глюкозы в крови приводит к нарушению в работе различных внутренних органов. Низкий уровень инсулина в комплексе с высокими значениями сахара называется гипергликемией. Патологическое состояние возникает не только при диабете, но и при панкреатите, заболеваниях печени, недостаточности гипофиза.
Как снизить уровень инсулина
Для регулирования показателей инсулина применяют комплексный подход:
- назначают препараты, которые уменьшают инсулинорезистентность клеток;
- пациенту рекомендуют нормализовать режим дня, высыпаться;
- показаны умеренные физические нагрузки;
- назначают диету.
При преддиабете восстановление нормального ночного отдыха нередко приводит к снижению веса. Человек легче переносит физические нагрузки, постепенно нормализуется гормональный баланс, устраняется инсулинорезистентность. Это позволяет замедлить или полностью остановить переход преддиабета в диабет.
При длительной гипогликемии развивается гипоксия, нарушается работа центральной нервной системы. Если ткани мозга не получают глюкозу, гибнут элементы коры. Постепенно развивается энцефалопатия — ухудшается память, появляются судороги, поведение становится неадекватным.
Правила питания
Диетотерапия помогает нормализовать уровень инсулина, избежать снижения показателей сахара в крови.
Основные правила питания:
- уменьшение суточной калорийности;
- максимальное снижение количества сложных углеводов — макаронные изделия, картофель, каши, хлеб из муки грубого помола;
- из рациона исключить сахар в любом виде — выпечка, сладости, сладкие газированные напитки;
- увеличение количества продуктов с ненасыщенными жирными кислотами;
- ограничить потребление колбасных изделий, полуфабрикатов, другой пищи, которая содержит скрытые жиры;
- в рационе должны быть овощи и фрукты с высокими содержанием клетчатки и низкой калорийностью, нежирные кисломолочные продукты;
- в день выпивать 1,5-2 л воды.
При выборе продуктов необходимо учитывать гликемический и инсулиновый индекс. Чаще всего между этими значениями есть пропорциональная связь. Продукты с высоким ИИ — молоко, кондитерские изделия, хлеб, готовые завтраки. Низкий ИИ у овсяной и гречневой каши, яиц.
Список разрешенных продуктов:
- нежирное мясо — варить или запекать без добавления жира;
- диетические сорта рыбы — треска, судак, хек, минтай;
- хлеб из ржаной, цельнозерновой муки, с отрубями;
- гречневая и овсяная каши;
- бобовые овощи — лучше употреблять в обед;
- первые блюда на нежирном мясном или овощном бульоне с небольшим количеством картофеля;
- овощи с невысоким содержанием углеводов — зелень и все зеленые овощи, фрукты, баклажаны, тыква, капуста,
- морковь, сельдерей — по 400-500 г в день;
- морская капуста;
- кисломолочные продукты средней жирности;
- несладкие ягоды, авокадо, цитрусовые плоды;
- растительные масла — 30 мл в день;
- мед — 2 ч. л. в день;
- в небольшом количестве грецкие орехи;
- яйца всмятку, паровой омлет;
- зеленый чай, некрепкий кофе с молоком, натуральные соки, отвар шиповника.
Как подготовиться к сдаче анализа на инсулин
Чтобы результаты обследования были информативными, необходимо:
- за сутки до обследования избегать чрезмерных физических нагрузок, нервных потрясений;
- за 2-3 дня прекратить прием препаратов для снижения сахара;
- за 3 дня до анализа нельзя употреблять алкоголь;
- за 2 часа нельзя курить;
- анализ сдавать на голодный желудок — последний прием пищи за 8-14 часов, кровь берут из вены.
При диагностированном диабете анализ нужно сдать до приема новой дозы инсулина.
Спровоцировать повышение инсулина могут некоторые лекарственные препараты. Это оральные контрацептивы, глюконат кальция, лекарства для лечения простуды с глюкозой, антидепрессанты, глюкокортикостероиды. Снижение показателей инсулина происходит при приеме диуретиков с фуросемидом, бета-адреноблокаторов. Поэтому обо всех медикаментах, которые пациент принимал в последнее время, необходимо сообщить врачу.
Анализ крови на инсулин назначают для выявления предрасположенности к сахарному диабету. Обследование включают в перечень диагностических мероприятий при эндокринных патологиях, ожирении, нарушении менструального цикла.
Муздубаева Б.Т. Коррекция гликемии в интенсивной терапии и анестезиологии (методические рекомендации)
Категория:
КазМУНО (АГИУВ). Кафедра анестезиологии и реаниматологии
Информация
Муздубаева Б.Т.
КОРРЕКЦИЯ ГЛИКЕМИИ
В ИНТЕНСИВНОЙ ТЕРАПИИ И АНЕСТЕЗИОЛОГИИ
Методические рекомендации
Алматы, 2015
УДК 616.24:615.816(075)
ББК 54.15я7
М89
Рецензенты:
Базарбекова Р.Б. – заведующая кафедрой эндокринологии Казахского медицинского университета непрерывного образования, д.м.н., профессор.
Артыкбаев Ж.Т. – заведующий курсом анестезиологии и реаниматологии Центра послевузовского образования НИИ кардиологии и внутренних болезней, д.м.н., профессор.
М89 Коррекция гликемии в интенсивной терапии и анестезиологии: Методические рекомендации/ Б.Т.Муздубаева. –Алматы, 2015. -67с.
ISBN 978-601-80482-3-4
Учебно-методическое пособие содержит информацию о принципах контроля и коррекции гликемии у пациентов, находящихся в критическом состоянии, в том числе при сахарном диабете, с позиции практического врача-анестезиолога. Представлены основные причины гипергликемии, алгоритмы диагностики и интенсивной терапии, лечения острых осложнений сахарного диабета, а также оценка тяжести состояния и ведения периоперационного периода у этих пациентов с учетом имеющихся клинических, функциональных и лабораторных показателей.
Предназначены для студентов медвузов, врачей-курсантов ФПК и врачей анестезиологов-реаниматологов.
Утверждены и рекомендованы к изданию решением Комитета по научной деятельности КазМУНО. Протокол №2 от 25 июня 2015г.
© Муздубаева Б.Т., 2015
Список сокращений
ADA- American Diabetes Association
HbA1с – гликированный гемоглобин
HNF — Hepatic nucleartranscriptional factor— гепатоцитарный ядерный фактор транскрипции
MODY — Maturity onset diabetes of the young— сахарный диабет 2-го типа (инсулино-независимый) у молодых
ВНИИ – внутривенная инфузия инсулина
ВОЗ – Всемирная Организация Здравоохранения
ГКИ – глюкозо-калий — инсулиновая смесь
ГКК – глюкоза капиллярной крови
ГПК – глюкоза плазмы крови
ГЭК – гидроксиэтилкрахмал
ДКА – диабетический кетоацидоз
ИБС – ишемическая болезнь сердца
ИВЛ – искусственная вентиляция легких
ИКД– инсулин короткого действия
КИГ – контринсулярные гормоны
КОС — кислотно-основное состояние
ОРИТ-отделение реанимации и интенсивной терапии
ПДЛ – протокол диагностики и лечения
СД — сахарный диабет
СКФ – скорость клубочковой фильтрации
СОЭ – скорость оседания эритроцитов
СПОН – синдром полиорганной недостаточности
ССВР – синдром системной воспалительной реакции
ЦВД – центральное венозное давление
ЦНС – центральная нервная система
ЭКГ– электрокардиограмма
ЭхоКГ– эхокардиограмма
ВВЕДЕНИЕ
Нарушения углеводного обмена (гипергликемия и гипогликемия) — наиболее часто встречающиеся синдромы в практике врача интенсивной терапии и анестезиолога. При этом гипергликемия развивается не только у пациентов с сахарным диабетом (СД), но также и у 40% пациентов, находящихся в критических состояниях, и у 80% пациентов после кардиохирургических вмешательств, не имеющих в анамнезе сахарного диабета.
Очень важно знать, что гипергликемия очень опасна, особенно у пациентов, подлежащих оперативному лечению. Многоцентровыми исследованиями доказано, что риск возникновения послеоперационных осложнений и летальность связаны с тяжестью гипергликемии. При этом у пациентов без сахарного диабета в анамнезе риск осложнений выше, чем у пациентов с известным сахарным диабетом. Коррекция нарушений углеводного обмена уменьшает количество осложнений и смертность, так как именно стабильность гликемии, наряду с нормальной оскигенацией, во многом определяет успех лечения.
При шоковых состояниях, а это почти 90% пациентов в отделениях интенсивной терапии и поступающих в экстренном порядке на оперативное лечение, развиваются состояния, сопровождающиеся нарушениями доставки и потребления кислорода. За счет централизации кровообращения, нарушений микроциркуляции и дефицита кислорода поджелудочная железа, пищеварительный тракт, инсулинзависимые ткани (печень, мышцы, жировая ткань) не в состоянии адекватно утилизировать глюкозу, преобразовывая ее в энергию. Стрессовые гормоны (адреналин, кортизол, глюкагон и другие), вырабатываемые в большом количестве при критических состояниях, снижают эффективность как эндогенного, так и экзогенно вводимого инсулина. В результате этого возникает метаболический парадокс – в крови уровень эндогенной глюкозы повышается, а ткани в то же время не получают энергию.
Врачи-анестезиологи, занимающиеся контролем подготовки пациентов к оперативному вмешательству, должны иметь необходимую информацию о целевых уровнях гликемии до операции, о том, при каких уровнях глюкозы крови плановое оперативное вмешательство можно и нужно отложить, а также как проводить экстренную анестезию у пациентов с высоким уровнем глюкозы крови в ситуациях, когда времени для коррекции практически нет. Правильная тактика ведения пациентов с гипергликемией во время анестезии и после операции во многом определяет исход хирургического вмешательства и время нахождения в отделении реанимации и интенсивной терапии (ОРИТ). Для этого необходимо иметь представление об уровне гликемии до операции, проводить коррекцию и почасовой мониторинг глюкозы крови уже до анестезии, во время нее и в послеоперационном периоде.
Данные методические рекомендации содержат информацию о коррекции возможных нарушений углеводного обмена, основанную на рекомендациях 2009-2013 годов, опубликованных в Европе, США и Австралии [1-8] и предназначены для рутинного практического применения в повседневной практике.
Решение о целесообразности следования данным рекомендациям специалист должен принимать на основании индивидуального опыта, учитывая особенности пациента и имеющиеся в его распоряжении условия и ресурсы. Следовательно, по определенным причинам возможно отклонение от данных рекомендаций. Мы очень надеемся, что представленные автором данные помогут коллегам в совершенствовании оказания помощи пациентам.
Углеводный обмен
Углеводы — вещества состава СмН2пОп, имеющие первостепенное биохимическое значение, широко распространены в живой природе и играют большую роль в жизни человека. Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. На долю углеводов приходится около 80% сухого вещества растений и около 20% животных. Растения синтезируют углеводы из неорганических соединений – углекислого газа и воды (СО2 и Н2О).
По своей химической структуре углеводы можно разделить на простые (моносахариды и дисахариды) и сложные (полисахариды). Глюкоза − наиболее важный из всех моносахаридов, так как она является структурной единицей большинства пищевых ди- и полисахаридов.
Запасы углеводов в организме человека в виде гликогена составляют примерно 500 г. Гликоген — разветвлённый гомополимер глюкозы и основная масса его (2/3) находится в мышцах, 1/3 – в печени. Гликоген образуется при поступлении углеводов из кишечника (гликогенез). В промежутках между приемами пищи гликоген печени распадается на молекулы глюкозы (гликогенолиз), что смягчает колебания уровня глюкозы в крови. Гликоген мышц используется только для обеспечения глюкозой самих мышц и не поддерживает уровень глюкозы в крови. Запасы гликогена печени без поступления углеводов истощаются примерно за 12-18 часов. В этом случае включается механизм образования углеводов из промежуточных продуктов обмена белков и жиров (глюконеогенез). Это обусловлено тем, что углеводы жизненно необходимы для образования энергии в тканях, особенно в мозге, т.к. клетки мозга получают энергию преимущественно за счет окисления глюкозы.
В ходе многостадийных биохимических реакций утилизации глюкозы генерируется энергия в виде аденозинтрифосфа́та (АТФ). АТФ необходим для жизни и функциональной активности клеток. Поэтому основная роль углеводов определяется их энергетической функцией. В критических ситуациях, когда организму необходимо повышенное количество энергии, именно быстрота распада и окисления глюкозы обеспечивают экстренную мобилизацию энергоресурсов.
Метаболизм глюкозы может осуществляться тремя путями: анаэробным гликолизом в цитоплазме (путь Эмбдена-Мейергофа), аэробным гликолизом в митохондриях (продолжение предыдущего, или цикл Кребса) и прямым окислением, также происходящим в цитоплазме аэробным путем (пентозный цикл Варбурга, или гексозомонофосфатный шунт).
Перечисленными тремя путями из одной молекулы глюкозы образуется АТФ как источник энергии, но в разных количествах:
1) при первом (анаэробном) пути, когда глюкоза распадается до молочной и пировиноградной кислот, образуются 4 молекулы АТФ;
2) при втором (аэробном) пути, когда образовавшиеся на предыдущем этапе молочная и пировиноградная кислоты вступают в цикл Кребса, образуется 36 молекул АТФ;
3) при третьем (прямое окисление, пентозный цикл, когда в процесс образования энергии вовлекаются липиды) получается около 117 молекул АТФ.
Основным источником глюкозы является пища, которая содержит такие углеводы как лактоза, сахароза, крахмал и другие. Входящие в состав пищи углеводы поставляют 60% энергии. Поступающие с пищей углеводы используются для синтеза АТФ и одновременно утилизируются печенью, мышцами и жировой тканью.
Если же в пищеварительный тракт поступает большое количество легкорасщепляющихся и быстровсасывающихся углеводов, содержание глюкозы в крови быстро увеличивается. Развивающуюся при этом гипергликемию называют алиментарной, иначе говоря — пищевой. Ее результатом может являться глюкозурия, то есть выделение глюкозы с мочой, которое наступает в том случае, если уровень глюкозы в крови повышается до 8,9- 10,0 ммоль/л.
Регуляция углеводного обмена
В кровь глюкоза поступает тремя путями: экзогенный (с пищей) и два эндогенных (гликогенолиз, глюконеогенез). Средний уровень глюкозы плазмы крови натощак – 4,3 ммоль/л, через 30 минут после завтрака – 7,0 ммоль/л, через 60 минут – 5,5 ммоль/л [9].
Основным физиологическим параметром регулирования углеводного обмена является поддержание среднесуточного уровня глюкозы в крови. Среднесуточная гликемия у здорового человека — 4,2± 0,8 ммоль/л [9].
Поддержание постоянного уровня гликемии осуществляется с помощью многоуровневой системы контроля гликемии. Поджелудочная железа (β-клетки островковой ткани) вырабатывает гормон — инсулин, секреция которого, в свою очередь, регулируется уровнем глюкозы крови, аминокислотами аргинином и лейцином. Задачей инсулина является перенос глюкозы внутрь клетки. Инсулин является единственным гормоном, понижающим уровень глюкозы в крови, поэтому при уменьшении секреции этого гормона развиваются стойкая гипергликемия – сахарный диабет с глюкозурией или сахарное мочеизнурение.
Глюкоза крови осуществляет инсулин-стимулирующий эффект через АТФ-зависимые калиевые каналы, особенность которых состоит в том, что в состоянии натощак они открыты, что приводит к оттоку калия из клетки и отрицательной заряженности β-клеток поджелудочной железы. После приема пищи глюкоза проникает внутрь β-клеток, где начинается процесс расщепления глюкозы с образованием АТФ. Появление АТФ в клетке приводит к закрытию К-каналов, что прекращает отток калия из клетки, мембранный потенциал меняется на положительный. Это вызывает открытие кальциевых каналов. Ионы Ca2+, поступая в β–клетки, стимулируют секрецию инсулина.
Существуют и другие стимуляторы секреции инсулина – это гормоны-инкретины. Эти гормоны были обнаружены в 1902 году Bayliss и Starling в кишечной флоре. Они стимулируют эндо- и экзокринную часть поджелудочной железы. Прием глюкозы внутрь стимулирует большую выработку инсулина нежели ее внутривенное введение — это так называемый инкретиновый эффект. В последующем были открыты два гастроинтестинальных гормона, стимулирующих выработку инсулина после приема пищи. Один из них получил название глюкагонподобного пептида-1 (ГПП-1), другой инсулинподобногоглюкозозависимого пептида (ГИП). Выработка ГПП-1 осуществляется в L-клетках толстого кишечника, ГИП — в К-клетках 12-перстной кишки под влиянием механического раздражения пищей слизистой желудочно-кишечного тракта [9].
С помощью инсулина глюкоза проникает внутрь клеток инсулинзависимых тканей или тканей-мишеней (печень, мышцы, жировая ткань). На поверхности клеток тканей-мишеней имеются специфические гликопротеиновые рецепторы, имеющие высокое сродство к инсулину. Взаимодействие инсулина с рецепторами приводит к поступлению глюкозы внутрь клетки. В этот момент снижается секреция глюкагона, что приводит к подавлению продукции глюкозы печенью.
Катехоламины (адреналин и норадреналин) тормозят глюкозозависимую секрецию инсулина за счет действия, опосредуемого α-рецепторами островковых клеток поджелудочной железы.
На уровне центральной нервной системы регуляция углеводного обмена осуществляется центром аппетита и насыщения.
При снижении уровня глюкозы в крови активируется процесс гликогенолиза (расщепление гликогена) в печени за счет эффектов контринсулярных гормонов (КИГ) – глюкагон ( вырабатывается α-клетками поджелудочной железы), катехоламины (адреналин), кортизол и гормон роста. Но в условиях выраженного дефицита энергии (СД1, голодание) контринсулярные гормоны не в состоянии обеспечить повышение уровня глюкозы за счет гликогенолиза. В таких условиях активируется процесс синтеза гликогена из аминокислот – глюконеогенез, а также мобилизация других источников энергии, таких как свободные жирные кислоты (СЖК).
Регуляторная роль автономной нервной системы и циркулирующих катехоламинов проявляется физиологической гипоинсулинемией при физической нагрузке или стрессорной гипергликемии. Стимуляция парасимпатической нервной системы приводит к увеличению секреции инсулина.
Гипоксия и углеводный обмен
Очень важным моментом для понимания механизмов нарушений углеводного обмена при неотложных состояниях является то, что для эффективной утилизации глюкозы и получения энергии, необходим еще и кислород. Упрощенная формула — АТФ = глюкоза + инсулин + кислород – для врача должна быть определяющей как при диагностике, так и при лечении нарушений углеводного обмена.
Как указывалось выше, распад углеводов в организме животных происходит как бескислородным путем до молочной кислоты (анаэробный гликолиз), так и путем окисления продуктов распада углеводов до СО2 и Н2O. В аэробных условиях из одной молекулы глюкозы образуется 36 молекул АТФ. В условиях гипоксии, даже при наличии достаточного количества глюкозы и инсулина в крови, образование энергии будет осуществляться по анаэробному пути, то есть вместо 36 молекул АТФ будет образовываться всего 4 молекулы. Таким образом, организм не сможет расщеплять глюкозу в достаточном количестве, что приведет к повышению уровня гликемии, при этом клетки будут испытывать дефицит энергии. В условиях дефицита энергии компенсаторно начнут использоваться альтернативные источники энергии — это белки и свободные жирные кислоты. При таком обмене веществ лабораторно определяется гипергликемия, гипопротеинемия и наличие кетоновых тел в крови и в моче, а также повышение лактата. Гиперлактатемия является одним из основных маркеров нарушений питания клетки и энергодефицита.
При выявленной гипергликемии нужно думать не только о возможном дефиците инсулина, но в первую очередь необходимо исключить гипоксию и нарушения кровообращения. А если рассматривать ситуацию более масштабно, то данная формула − АТФ = глюкоза + инсулин + кислород — является «формулой жизни», так как для нормальной жизнедеятельности любой клетки организма необходимы эти три составляющие. То есть основной задачей врача интенсивной терапии, сталкивающегося с системными и полисистемными нарушениями, является доставка к любой клетке организма этих трех основных компонентов. Зная функциональную ответственность органов, врач должен обеспечить поступление кислорода в организм через легкие, поступление глюкозы энтерально или парентерально, транспорт всего необходимого системой кровообращения, в том числе и для поджелудочной железы для нормального синтеза инсулина.
Исходя из этого, можно считать, что нарушения углеводного обмена являются маркером неблагополучия в организме и очень часто фиксируются врачами в виде «стрессовой гипергликемии».
«Голодный» кетоацидоз
Глюкоза, поступающая в кровь из кишечника, частично транспортируется в печень, где из нее синтезируется гликоген. При голодании и недостаточном экзогенном поступлении глюкозы или ее повышенном расходе в организме при стрессе, при физических нагрузках, может развиться гипогликемическое состояние, которое характеризуется снижением уровня глюкозы в плазме венозной крови менее 2,2-2,8 ммоль/л [14]. У больных СД, которые в течение многих лет находятся в состоянии постоянной гипергликемии, гипогликемическая симптоматика может развиться уже при уровне глюкозы 6-8 ммоль/л [14].
В организме человека существуют резервные системы, мобилизация которых позволяет предотвратить гипогликемическое состояние.
Гликоген печени представляет собой резервный, то есть отложенный в запас углевод. Образование гликогена при относительно медленном поступлении глюкозы в кровь происходит достаточно быстро, поэтому после введения небольшого количества углеводов, повышения содержания глюкозы в крови (гипергликемия) не наблюдается.
При голодании или полном отсутствии углеводов в пище они образуются в организме из продуктов распада жиров и белков. Этот процесс называется глюконеогенезом. Благодаря этому сохраняется относительное постоянство содержания глюкозы в крови.
Когда организму не хватает энергии при алиментарном голодании, гипогликемии, нарушении поступления глюкозы в клетку (сахарный диабет), он начинает ее получать, расщепляя жиры. При расщеплении жиров образуются кетоновые тела, которые являются источниками энергии. Но, в свою очередь, они повышают кислотность крови, отсюда и название — кетоацидоз. Кетоацидоз – это одно из известных осложнений при СД и отличительной особенностью «голодного» кетоацидоза является нормальный или сниженный уровень гликемии при наличии кетоацидоза.
При развитии кетоацидоза клетки организма становятся невосприимчивыми к инсулину. Такое состояние называется инсулинорезистентностью. Даже если вводить инсулин и его концентрация в крови может быть очень высокой, глюкоза в клетки поступать не будет. Это усугубляет энергодефицит, при котором организм будет продолжать расщеплять жиры. Чтобы предотвратить это состояние или разорвать этот порочный круг необходимо обеспечивать организм пациента достаточным количеством углеводсодержащей пищи − энтеральной или парентеральной.
К сожалению, «голодный» кетоацидоз является нередкостью в отделениях интенсивной терапии и хирургии, когда в послеоперационном периоде пациентам не проводится раннее энтеральное или хотя бы парентеральное питание. Как это ни парадоксально, но особенно «чувствительны» к голоду больные с избыточной массой тела – их большое тело требует больше энергии и у них более выражен катаболизм жиров и белков, а соответственно и метаболические нарушения развиваются очень быстро. Подобная ситуация часто развивается и при попытке похудеть голодая.
Метаанализ, проведенный у хирургических пациентов, прооперированных на органах брюшной полости L.J. Moore и соавторами в 2013 году в США в Нью-Йорке, показал, что у пациентов, которым проводилось раннее энтеральное питание, показатели инфекционных осложнений (синдрома системного воспалительного ответа, сепсиса. тяжелого сепсиса) и смертности были гораздо ниже чем у тех, которым питание не проводилось.
Абсолютными противопоказаниями к энтеральному питанию являются гипоксемия, перитонит, обструкция кишечника, прогрессирующий илеус, желудочно-кишечные кровотечения, ишемия кишечника при шоке или при применении вазопрессоров.
Относительными противопоказаниями к проведению раннего энтерального питания является синдром «короткой кишки», доказанная непереносимость энтерального питания, воспалительные заболевания кишечника, фистула с высоким выбросом содержимого кишечника, панкреатит.
Количество пищи или питательных веществ должно всегда соответствовать энергетическим потребностям организма. При завышении каллоража питания (например, ослабленных пациентов нельзя кормить питательной смесью для спортсменов) разовьется другое состояние — гипергликемия. Так, в соответствии с современными рекомендациями, у пациентов с тяжелым сепсисом и септическим шоком суточный каллораж в первые 7 дней с момента постановки диагноза не должен превышать 500 ккал/сут. При этом предпочтение отдается комбинации энтерального питания и внутривенного введения глюкозы, нежели только парентеральному (International Guidelines for Management of Severe Sepsis and Septic Shock: 2012).
Гипергликемическое состояние, вызванное вышеперечисленными обстоятельствами, часто усугубляется экзогенным использованием глюкозы в форме нутритивной поддержки или внутривенным введением растворов глюкозы в отделениях интенсивной терапии.
Особенно внимательно надо относиться к проведению энтерального или парентерального питания у пациентов с лабораторно подтвержденной гипоксемией.
Объяснение этой рекомендации следующее — для окисления глюкозы и образования аденозинтрифосфата (АТФ) необходим кислород. В условиях гипоксии этот механизм реализуется неполноценно, в результате чего поддерживается гипергликемия, инсулинотерапия неэффективна и усугубляются метаболические нарушения, повышается осмолярность плазмы.
Диагноз стрессовой гипергликемии
Американская Диабетическая Ассоциация и Американская Ассоциация Клинических Эндокринологов единодушно определяют стрессовую гипергликемию или госпитально-ассоциированную гипергликемию как повышение уровня глюкозы крови более 7,8 ммоль/л у пациентов без очевидных признаков сахарного диабета. Хотя стрессовая гипергликемия обычно является результатом острого заболевания или хирургического стресса, у 60% пациентов с впервые выявленной гипергликемией имеется скрытый сахарный диабет в течение 1 года. Wexler и соавторы показали, что у одного из пяти взрослых пациентов с уровнем гликированного гемоглобина (HbA1c) > 6,5% «стрессовая» гипергликемия является не диагностированным сахарным диабетом. Это говорит о том, что одна треть пациентов с сахарным диабетом не знают о своем диагнозе. Перекрестные исследования пациентов со стрессовой гипергликемией показали, что при последующем обследовании у 30-60% пациентов имеется нарушенная толерантность к глюкозе или СД.
До недавнего времени клинические протоколы рекомендовали у всех пациентов со стрессовой гипергликемией проводить оральный глюкозо-толерантный тест сразу после обнаружения признаков толерантности к углеводам. С недавних пор исследование гликированного гемоглобина (HbA1c) является предпочтительным диагностическим тестом у госпитализированных пациентов с гипергликемией.
Глики́рованный гемоглобин, или гликогемоглобин — биохимический показатель крови, отражающий среднее содержание глюкозы в крови за длительный период (до трёх месяцев), в отличие от измерения, которое дает представление об уровне глюкозы крови только на момент исследования. Гликированный гемоглобин отражает процент гемоглобина крови, необратимо соединённого с молекулами глюкозы. Гликированный гемоглобин образуется в результате реакции Майяра между гемоглобином и глюкозой крови. Повышение уровня глюкозы крови при сахарном диабете значительно ускоряет данную реакцию, что приводит к повышению уровня гликированного гемоглобина в крови. Время жизни красных кровяных телец (эритроцитов), которые содержат гемоглобин, составляет в среднем 120-125 суток. Именно поэтому уровень гликированного гемоглобина отражает средний уровень гликемии на протяжении примерно трёх месяцев.
Определение гликированного гемоглобина позволяет дифференцировать стрессовую гипергликемию и не диагностированный ранее сахарный диабет, а также контролировать интенсивный режим контроля гликемии. Гликированный гемоглобин является низкочувствительным (44% – 66%), но высокоспецифичным тестом (76%–99%). Оценка гликированного гемоглобина как диагностического критерия может быть затруднена при наличии у пациентов гемоглобинопатий (серповидноклеточная анемия, талассемия), после недавней гемотрансфузии, при тяжелом поражении печени, после приема салицилатов и при железодефицитной анемии.
Механизм развития стрессовой гипергликемии
Сложный комплекс нейроэндокринной регуляции, запускающий первичные реакции стресса, необходим для двух главных целей — повысить производство энергии и увеличить кровоснабжение мозга и сердца в условиях агрессии, которую организму предстоит выдержать. Реакция организма на травму или хирургическую агрессию сопровождается ростом энергетических процессов и высоким катаболизмом. Повышенный расход энергетических веществ при этом неизбежен, и если нет их внешнего поступления, то запасы организма истощаются очень быстро. Подобное состояние повышенного расхода энергии в ответ на травму реализуется через стимуляцию симпатико-адреналовой системы. Главным энергетическим «сырьем» организма являются глюкоза и ненасыщенные жирные кислоты. Адреналин повышает уровень глюкозы в крови, стимулируя распад гликогена в печени, и мобилизует жирные кислоты из липидов, активизируя все три процесса образования энергии через биологическое окисление. Установлено, что в условиях шока или операционной агрессии в крови резко возрастает уровень глюкозы и свободных жирных кислот, которые содержатся лавным образом в триглицеридах — основном их депо. Триглицериды находятся в организме преимущественно в виде липопротеидов низкой плотности (бета-липопротеидов), поступающих в кровь при стрессовом состоянии в больших количествах. Таким образом, в усилении энергетического метаболизма при шоке или операционном стрессе участвует не только углеводная система (гликоген-глюкоза), но и фосфолипидный метаболизм, причем он покрывает около половины энергетических затрат.
Гипергликемия – это наиболее частый признак критических состояний, таких как нарушения дыхания, кровообращения и хирургической патологии. Гипергликемия является результатом острых метаболических и гормональных изменений, ответственных за ответ организма на стресс.
Гипоксия любой природы, нарушения кровообращения, острое заболевание, хирургические вмешательства или травма приводят к нарушению синтеза и транспорта инсулина и одновременно к повышению уровня контринсулярных гормонов (КИГ) – адреналина, кортизола, глюкагона и гормона роста. Контррегуляторный ответ организма на стресс приводит к нарушению углеводного обмена, включая инсулинорезистентность, повышение продукции глюкозы печенью, нарушение утилизации глюкозы на периферии и относительной инсулиновой недостаточностью. Адреналин стимулирует выброс глюкагона и подавляет выработку инсулина β-клетками поджелудочной железы. Высокий уровень кортизола увеличивает продукцию глюкозы печенью и стимулирует распад белков, вследствие чего повышается уровень циркулирующих аминокислот, что приводит к глюконеогенезу. В дополнение к этому стресс приводит к продукции цитокинов, таких как фактор некроза опухолей (TNF-α), интерлейкинов (IL-6 и IL-1), которые повышают инсулинорезистентность, понижая чувствительность рецепторов инсулина к последнему.
Ингибирующие процессы приводят к понижению захвата глюкозы клетками, что приводит к гипергликемии. Таким образом, стрессовые факторы приводят к снижению активности инсулина, и если поджелудочная железа не в состоянии компенсировать это состояние повышенной продукцией инсулина, в конечном итоге развивается гипергликемия. Более того, в условиях гипергликемии, β-клетки развивают десенситизацию, то есть утрачивают чувствительность к гипергликемии, что приводит к «притуплению» выработки инсулина и еще большему повышению уровня глюкозы крови.
Контринсулярные гормоны в условиях стресса усиливают липолиз, повышая уровень свободных жирных кислот (СЖК). У пациентов с ишемией миокарда высокий уровень СЖК может усугубить ишемическое повреждение, снижая способность сердечной мышцы утилизировать глюкозу для анаэробного метаболизма. В норме СЖК, являющиеся энергетическим субстратом выбора для здорового миокарда, становятся токсичными для ишемизированного миокарда, приводя к сердечным аритмиям, симпатической гиперактивности, повышенному артериальному давлению, окислительному стрессу и дисфункции эндотелия сосудов. Повышение уровня СЖК приводит к дозозависимой инсулинорезистентности в периферических тканях и повышению продукции глюкозы печенью как у пациентов с СД, так и без такового.
Предполагается, что гипергликемическое состояние приводит к продукции свободных радикалов кислорода, перекисному окислению липидов, повышению маркеров воспаления миокарда. Острая гипергликемия может индуцировать смерть кардиомиоцитов посредством апоптоза или чрезмерного ишемического реперфузионного повреждения клеток. Это также разрушительно действует на функцию эндотелия, подавляя выработку оксида азота (NO), тем самым уменьшая опосредованную дилатацию сосудов (Farnoosh Farrokhi, Dawn Smiley, Guillermo E. Umpierrez, «Glycemic control in non—diabetic critically ill patients»).
В дополнение – нарушения, опосредованные гипергликемией оказывают влияние на систему гемостаза, включающие активацию тромбоцитов, их адгезию и агрегацию, уменьшение фибринолитической активности и повышение активности ингибитора плазминогена.
Исследования in vitro и in vivo показали, что гипергликемия снижает активность иммунной системы, уменьшая фагоцитарную активность макрофагов и хемотаксис полиморфноядерных нейтрофилов, повышая экспрессию свободных радикалов в иммуннокомпетентных клетках, что в конечном итоге повышает риск инфекционных и госпитальных осложнений.

Рисунок 1. Схема развития стрессовой гипергликемии и ее последствия
Таблица 1. Факторы риска и механизмы развития стрессовой гипергликемии
| Фактор | Основной механизм |
| Инфузия катехоламинов | Инсулинорезистентность |
| Глюкокортикоиды | Инсулинорезистентность |
| Уремия | Инсулинорезистентность |
| Цирроз печени | Инсулинорезистентность |
| Сепсис | Инсулинорезистентность |
| Ожирение | Инсулинорезистентность |
| Пожилой возраст | Дефицит инсулина |
| Панкреатит | Дефицит инсулина |
| Гипотермия | Дефицит инсулина |
| Гипоксемия | Дефицит инсулина |
Последствия стрессовой гипергликемии у госпитализированных пациентов
Обширные наблюдения и рандомизированные исследования у пациентов в критическом состоянии показали взаимосвязь между гипергликемией и результатами лечения, смертностью, длительностью пребывания в стационаре, инфекционными и другими осложнениями. Влияние гипергликемии на исход лечения может быть связано с ранее существовавшим СД, интенсивностью гипергликемического ответа, диагнозом и риском инфицирования.
Ретроспективные исследования показали, что среди пациентов с впервые выявленной гипергликемией отмечалась повышенная смертность, более длительное пребывание в стационаре, требовался более длительный уход медицинского персонала после выписки, по сравнению с пациентами с уже диагностированным сахарным диабетом, которые находились на инсулинотерапии или у пациентов с нормогликемией.
Пациенты с острым инфарктом миокарда и инсультом при наличии впервые выявленной гипергликемии имели более высокий уровень смертности и сердечно-сосудистых осложнений по сравнению с пациентами с уже известным СД. Было подсчитано, что подъем гликемии натощак на каждый 1 ммоль/л ассоциировался с увеличением смертности на 33%.
У пациентов с аортокоронарным шунтированием, независимо от наличия предшествовавшего диабета, повышение гликемии до 11 ммоль/л по сравнению с более низкими значениями увеличивало летальность, количество послеоперационных инфекционных осложнений и требовало более длительного пребывания в стационаре.
Ретроспективные исследования у 259040 пациентов в Университетском филиале Медицинского Центра Ветеранов США (University-affiliated Veterans Affairs Medical Center (VAMC)) продемонстрировали взаимосвязь между гипергликемией и смертностью при нестабильной стенокардии, остром инфаркте миокарда, застойной сердечной недостаточности, аритмиях, ишемическом и геморрагическом инсультах, желудочно-кишечных кровотечениях, острой почечной недостаточности, пневмонии, эмболии легочной артерии, сепсисе. Риск смертности был значительно выше в случаях с впервые выявленной гипергликемией, чем у пациентов с известным сахарным диабетом в анамнезе.
Контроль гипергликемии в отделениях интенсивной терапии
Для оптимального контроля гликемии в ОРИТ весьма важно частое определение уровня гликемии. Самый точный метод определения гликемии – это пробы артериальной или венозной крови при анализе газового состава. Определение гликемии в венозной крови по биохимическим методикам тоже является точным, но медленным для интенсивной терапии. Прикроватный метод контроля гликемии в капиллярной крови наиболее приемлемый метод для стационаров, однако, его неточность по сравнению с венозным, может достигать 20%, особенно у пациентов с гипогликемией, гипотензией и анемией.
Пациентам, которые получают постоянную инфузию инсулина, обычно требуется ежечасное определение уровня глюкозы крови до стабилизации уровня гликемии плазмы крови (ГПК) в пределах 7,8-10 ммоль/л, далее каждые 2 часа. Достичь уровня гликемии в пределах 4,5-6 ммоль/л обычно не удается. К тому же это сопряжено с риском развития гипогликемического состояния.
Исследования VISEP (Volume Substitution and Insulin Therapy in Sepsis), проведенные у пациентов с сепсисом, показали отсутствие существенной разницы в смертности и продолжительности лечения в ОРИТ в течение 28 и 90 дней при показателях гликемии 4,5-6 ммоль/л и 7,8-10 ммоль/л – 27,5% против 24,9%, (при p=0,02). Напротив, интенсивное лечение привело к значительному количеству тяжелых гипогликемий (6,8% против 0,5%, при p<0,001). При тяжелых гипогликемиях развивается значительно большее количество осложнений и повышение смертности. Так, у пациентов с острым инфарктом миокарда гипогликемическое состояние повысило риск смертности до 12,7% против 9,6%, (при р=0,03) по сравнению с пациентами без таковых осложнений, независимо от того, был ли в анамнезе СД или нет.
Именно поэтому в международных рекомендациях по лечению сепсиса 2012 года (Intrenational Guidelines for Management of Severe Sepsis and Septic Shock: 2012) и лечению ишемического инсульта (Guidelines for the Early Management of Patients With Acute Ischemic Stroke: USA,2013) рекомендуют поддерживать гликемию на уровне 7,8-10,0 ммоль/л. Эти рекомендации можно экстраполировать на всех больных, находящихся в ОРИТ.
У пациентов с СД и без него, получающих энтеральную или парентеральную нутритивную поддержку, необходимо проверять уровень гликемии каждые 4-6 часов. Пациенты без СД в анамнезе, которым не проводится инсулинотерапия в течение 24-48 часов при достижении гликемии 7,8 ммоль/л, можно прекратить определение гликемии. Следующей целью у таких пациентов будет достижение необходимого каллоража питания. Пациентам с СД, которые самостоятельно принимают пищу, определение гликемии выполняется 4 раза в день: перед приемами пищи (не позднее чем за 1 час до еды) и перед сном.
Более частый мониторинг гликемии необходим в том случае, если пациентам назначаются препараты, влияющие на обмен глюкозы, например кортикостероиды, при резкой отмене энтерального или парентерального питания, или у пациентов с частыми эпизодами гипогликемии.
Рекомендуемый целевой уровень ГПК для большинства пациентов в ОРИТ с СД или без СД является 7,8-10,0 ммоль/л.
Более низкие показатели ГПК в пределах 6,1-7,8 ммоль/л, рекомендуются у кардиохирургических больных и у пациентов со стабильными показателями гликемии без эпизодов гипогликемии (American Association of Clinical Endocrinologist and American Diabetes Association 2013).
Лечение гипергликемии у пациентов в отделении интенсивной терапии
Инсулин короткого действия (ИКД) является наиболее предпочтительным препаратом для обеспечения нормального или «приемлемого» уровня гликемии у пациентов с СД и без него. Из-за очень короткого периода полураспада, внутривенное введение ИКД позволяет точно регулировать дозу и отмечать изменения в статусе пациента.
Внутривенная инфузия ИКД с помощью шприца-насоса или инфузомата позволяет идеально регулировать дозировку относительно колебаний уровня гликемии. Это наиболее предпочтительный и эффективный способ коррекции гипергликемии, чем подкожный, однако это требует соответствующее техническое оснащение и приемлем для отделений интенсивной терапии или крупных медицинских центров. Возможно применение и обычной системы для внутривенной инфузии, но это уменьшит точность дозирования ИКД.
Несмотря на наличие казахстанских рекомендаций по переходу на внутривенное введение ИКД только при ГПК выше 13,9 ммоль/л (например, в протоколах диагностики и лечения (ПДЛ) инсультов 2013 года: www.pdl.kz), врачу необходимо проводить более рациональное и эффективное лечение.
При стабилизации состояния пациента (перевод на обычное питание, уменьшение отеков, отсутствие вазопрессоров) внутривенная инфузия инсулина может быть заменена на подкожное введение.
Простая подвижная шкала назначения ИКД:
· Целевой уровень ГПК 7,8-10,0 ммоль/л
· Схема дозировки инфузии ИКД:
— ГПК(глюкоза крови)> 12,2 ммоль/л –Инсулин 8Ед/час
— 8,3 ммоль/л < ГПК <12,2 ммоль/л – Инсулин 6Ед/час
— 6,7ммоль/л < ГПК <8,3 ммоль/л – Инсулин 4Ед/час
— 3,3 ммоль/л < ГПК <4,4 ммоль/л – Инсулин – СТОП
— ГПК< 3,3 ммоль/л – Инсулин СТОП + 10грамм 20% глюкозы
· Схема болюсного введения ИКД:
— ГПК> 12,2 ммоль/л –Инсулин 8Ед/час
— 8,3 ммоль/л <ГПК < 12,2 ммоль/л – Инсулин 6Ед/час
— 6,7ммоль/л < ГПК < 8,3 ммоль/л – Инсулин 4Ед/час
Таким образом, методы адекватной коррекции будут включать:
· Мониторинг гликемии;
· Контроль углеводной нагрузки;
· Контроль инсулинотерапии.
Алгоритм определения причины гипергликемии
При выявлении гипергликемии необходимо начать с того, чтобы выявить причину последней. Таким образом, необходимо исключить гипоксию любого генеза (гипоксическую – острый респираторный дистресс-синдром (ОРДС), анемическую — анемию, циркуляторную – нарушения кровообращения), стресс – болевой синдром, перегрузка глюкозой, избыточный − неадекватный для клинической ситуации каллораж при проведении энтерально-парентерального питания.
У пациентов с тяжелыми полисистемными нарушениями, с шоком, коррекция гликемии будет представлять особые сложности. Не всегда возможно добиться положительных результатов сразу после начала лечения из-за развития трансминерализации, которая является следствием гипоксии любого генеза.
Неуправляемая, тяжело поддающаяся коррекции гипергликемия и будет индикатором тяжелых необратимых нарушений метаболизма в результате трансминерализации и гибели клеток.
Таким образом, алгоритм выявления причины гипергликемии должен включать в себя:
1. Определение уровня глюкозы крови при поступлении. Приемлемый уровень гликемии должен быть в пределах 7,8 -10 ммоль/л или утренняя глюкоза натощак на следующее утро после поступления 6,1 — 7,7 ммоль/л.
2. Определение гликированного гемоглобина HbA1с, отражает уровень гликемии в срок 90-120 дней. Нормальными считаются от 4,1% и до 5,7%. При HbA1 > 6,5% — сахарный диабет.
3. При отсутствии сахарного диабета необходимо определить, является ли гипергликемия нейроэндокринной реакцией на стресс — исключить болевой синдром.
4. При отсутствии признаков болевого синдрома исключить цитокиновую (воспалительную) или гуморальную причину — имеется ли синдром системной воспалительной реакции (ССВР), очаг инфекции, сепсис.
5. Имеется ли у пациента избыточное введение глюкозы или углеводов. Соответствует ли состояние пациента тому количеству калорий, которое он получает с энтеральным или парентеральным питанием.
6. Имеется ли у пациента гипоксия (циркуляторная, дыхательная или гемическая). Наличие гипоксемии (дыхательной гипоксии) определяется неинвазивно по сатурации кислорода или более точно – по уровню парциального напряжения кислорода в артериальной крови (раО2). Циркуляторную или гемическую гипоксию можно выявить, только оценив артерио-венозную разницу по кислороду, т.к. сатурация или оксигенация артериальной крови (раО2) при таких нарушениях может быть нормальной. Косвенными показателями могут быть нарушения периферического кровообращения и показатели уровня гемоглобина (анемия или гемоконцентрация). Необходимо как можно быстрее устранить причину гипоксии. При наличии показаний − перевести пациента на ИВЛ и подобрать правильный режим вентиляции для данного состояния, провести гемотрансфузию. При наличии нарушений водно солевого баланса и кровообращения − устранить их проведением адекватной корригирующей, гидратирующей или дегидратирующей терапии, применяя обоснованно кардиотонические и вазоактивные препараты.
Таким образом, важнейшими приоритетами, позволяющими контролировать и поддерживать нормогликемию при критических — стрессовых состояниях, являются:
— Сердечно-сосудистый мониторинг/поддержка;
— Респираторный мониторинг/поддержка;
— Адекватная инфузионная терапия;
— Антибактериальная терапия;
— Аналгезия.
НЕОБХОДИМАЯ ИНФОРМАЦИЯ О САХАРНОМ ДИАБЕТЕ
Сахарный диабет (Diabetes Mellitus) – группа метаболических заболеваний, характеризующихся гипергликемией, которая является результатом дефекта секреции инсулина, либо действия инсулина или обоих этих факторов одновременно (ВОЗ — 1999 г.).
Таблица 2. Диагностические критерии нарушений углеводного обмена
| Тип | ВОЗ, 1999 (ммоль/л) плазма, венозная кровь |
ADA, 2013 (ммоль/л) капиллярная кровь |
| Норма | <6,1 | <5,6 |
| Нарушенная гликемия натощак | 6,1-6,9 | 5,6-6,9 |
| Нарушение толерантности к глюкозе | 7,8-11 | 7,8-11 |
| Диабет | ≥7,0 | ≥7,0 |
Этиологическая классификация сахарного диабета (СД) Всемирная Организация Здравоохранения (ВОЗ), 1999 г.
I. Сахарный диабет 1 типа (СД 1) — деструкция бета-клеток, абсолютная инсулиновая недостаточность
А. Аутоиммунный
Б. Идиопатический
II. Сахарный диабет 2 типа (СД2) — претерпевает развитие от преимущественной резистентности к инсулину с относительной инсулиновой недостаточностью до преимущественно секреторного дефекта инсулина в сочетании с периферической инсулинорезистентностью.
III. Другие специфические типы сахарного диабета
A. Генетические дефекты бета-клеточной функции со следующими мутациями:
1. Гепатоцитарный ядерный фактор транскрипции (HNF*) 4а, хромосома 20 (MODY 1**)
2. Глюкокиназа, хромосома 7 (MODY 2)
3. HNF 1а, хромосома 12 (MODY 3)
4.Промоторный инсулиновый фактор (IPF***) (MODY 4)
5. Мутация митохондриальной ДНК в положении 3243
B. Генетические дефекты в действии инсулина
1. Резистентность к инсулину типа А
2. Лепречаунизм
3. Синдром Рабсона-Менденхолла
4. Липоатрофический диабет
C. Болезни экзокринной части поджелудочной железы
1. Панкреатит
2. Травма, панкреатэктомия
3. Неоплазии
4. Кистозный фиброз
5. Гемохроматоз
6. Фиброкалькулезная панкреатопатия
D.Эндокринопатии
1.Акромегалия
2.Синдром Кушинга
3.Феохромоцитома
4. Тиреотоксикоз
5. Соматостатинома
6. Глюкагонома
7. Другие
E. Сахарный диабет, индуцированный химикатами и лекарствами (никотиновая кислота, глюкокортикоиды, тиреоидные гормоны, диазоксид, агонисты а-адренорецепторов, тиазиды, дилантин, а-интерферон, вакор, пентамидин и др.)
F. Инфекции (врожденная краснуха, цитомегаловирус, вирусы Коксаки)
G. Необычные формы иммуноопосредованного диабета. Аутоантитела к рецептору инсулина
Н. Другие генетические синдромы, иногда сочетающиеся с сахарным диабетом (синдром Дауна, синдром Кляйнфельтера, синдром Тернера, синдром Вольфрама, атаксия Фридрейха, хорея Гентингтона, синдром Лоренса-Муна-Бидля, порфирия, миотоническая дистрофия и др.).
IV. Диабет беременных
*HNF — hepaticnucleartranscriptional factor — гепатоцитарный ядерный фактор транскрипции.
**MODY — Maturity onset diabetes of the young — сахарный диабет 2-го типа (инсулин-независимый) у молодых. Характеризуется умеренной дисфункцией бета-клеток, началом в молодом возрасте (до 25 лет), отсутствием кетонемии и ипсулинорезистентности. На долю этого типа диабета приходится около 15-20% всех случаев инсулинонезависимого сахарного диабета.
***IPF — Insulin promoter factor — инсулиновый промоторный фактор.
Как видно из приведенной классификации, СД подразделяется в зависимости от этиологии на 4 основных группы: сахарный диабет 1 и 2 типов, другие специфические типы сахарного диабета, диабет беременных. На практике врач обычно сталкивается с больными, страдающими сахарным диабетом 1 и 2 типа, другие типы диабета встречаются значительно реже.
Перечисленные типы различаются по этиологии, характеру течения и особенностям клинической картины заболевания.
СД1 более чем в 90% случаев представлен аутоиммунным вариантом, при котором происходит гибель β-клеток поджелудочной железы в результате аутоиммунного процесса. Реже причиной гибели β-клеток оказываются другие (неаутоиммунные) механизмы – идиопатический вариант СД1.
СД2 — это гетерогенная группа заболеваний, общим для которых является инсулинорезистентность тканей, связанная, скорее всего, с пострецепторным дефектом действия инсулина. Природа этого нарушения до настоящего времени точно не установлена.
Лабораторная диагностика
Ключевым критерием в диагностике СД является уровень глюкозы крови (гликемия), в частности уровень гликемии натощак.
Критерии диагностики диабета (ВОЗ, 2011, ADA, 2013):
· Гликированный гемоглобин ≥ 6,5%.
· Гликемия натощак ≥7,0 ммоль/л (для плазмы венозной крови).
· Гликемия случайная ≥11,1 ммоль/л c полиурией, полидипсией или необъяснимой потерей веса.
· Гликемия через 2 ч после нагрузки глюкозой ≥11,1 ммоль/л.
· Диагноз диабета должен быть подтвержден повторным тестом гликемии (желательно тем же) в другой день.
При оценке степени компенсации СД наиболее информативным является уровень гликированного гемоглобина (НbА1с %).
Таблица 3. Оптимальный контроль гликемии
| Показатель | IDF(International Diabetes Federation), 2007 | ADA, 2013 |
| HbA1C | <6,5% | <7,0% |
| Гликемия на тощак | <5,6 ммоль/л в плазме | <7,2 ммоль/л в капилл. крови |
| Гликемия через 2 ч после еды | <7,8 ммоль/л в плазме | <10,0 ммоль/л в капилл. крови |
ПРОБЛЕМА ДИАБЕТА В АНЕСТЕЗИОЛОГИИ И РЕАНИМАТОЛОГИИ. Диабетический кетоацидоз
Острые осложнения сахарного диабета
Общепринято все осложнения СД делить на острые и хронические (поздние).
Диабетический кетоацидоз (ДКА) — острая декомпенсация СД, в основе которой лежит абсолютная инсулиновая недостаточность.
Причины:
— поздняя диагностика диабета;
— присоединение интеркурентных заболеваний (наиболее частая причина);
— прекращение инъекций или использование недостаточных доз инсулина;
— стрессовые состояния, в т.ч. хирургические вмешательства;
— грубые нарушения диеты.
Первыми симптомами диабетического кетоацидоза являются потеря аппетита, тошнота, рвота. Основной жалобой нередко оказываются боли в животе — так называемый псевдоперитонит. Если при этом имеются симптомы нарушения зрения и помрачение сознания, то в первую очередь следует думать именно о кетоацидотической декомпенсации обмена веществ при СД.
Инсулиновая недостаточность также развивается в результате несоответствия между выработкой эндогенного (при сахарном диабете) или доставкой экзогенного (неправильная дозировка) инсулина и потребностью в нем организма. Ее сопровождает активация КИГ. При дефиците инсулина глюкоза не может свободно войти в клетки мышц и жировой ткани, они перестают снабжаться этим важным источником энергии. В результате преобладания КИГ при стрессе резко активируется глюконеогенез в печени, вследствие поступления в нее гликогенных аминокислот, глицерина, пирувата и лактата, образовавшихся в результате усиленного распада белков и жиров. Они становятся источниками повышенной продукции глюкозы под влиянием печеночных ферментов. Высокое содержание глюкагона в крови способствует к тому же усиленному гликогенолизу, то есть высвобождению в кровяное русло глюкозы.
Все эти процессы приводят к выраженной гипергликемии, которая влечет за собой повышение осмолярности плазмы (в норме 280-300 ммосм/л) с развитием клеточной дегидратации.
Когда глюкоза крови превышает почечный порог (8,9-10,0 ммоль/л), появляется глюкозурия. Глюкоза в моче увлекает за собой воду и соли (натрий, калий), возникает полиурия (осмотический диурез), приводящая к внеклеточной дегидратации.
Больной теряет вес вследствие уменьшения мышечной и жировой ткани и потери воды. Он испытывает голод и жажду. Как следствие катаболизма белков и поступления аминокислот в печень, в ней усиливается образование мочевины, которая еще больше увеличивает осмолярность плазмы, а значит диурез и дегидратацию. Азотистый баланс становится отрицательным.
Мобилизация жиров влечет за собой нарастание свободных жирных кислот в плазме. Они потребляются тканями для удовлетворения энергетических потребностей. Большое их количество поступает в печень, где в конечном итоге из них образуются кетоновые тела (ацетоуксусная и бета-оксимасляная кислоты, ацетон). Развивается метаболический ацидоз – кетоацидоз, который в начале его развития компенсируется гипервентиляцией.
Нарастание потерь воды и солей приводит к развитию тяжелой дегидратации. Кроме того, теряется внутриклеточный калий благодаря трансминерализации, которая провоцируется ацидозом и гипоксией тканей. Одновременно в клетки поступает натрий. Ацидотическое угнетение тонуса мелких сосудов в сочетании с гиповолемией приводят к снижению артериального давления, в тяжелых случаях к состоянию шока. Одновременно нарушаются функции ЦНС, вплоть до развития комы в результате дегидратации клеток головного мозга, вызванной гиперосмией плазмы, электролитными сдвигами и гипоксией при снижении артериального давления.
Потеря жидкости и гиперкоагуляция вызывает нарушение микроциркуляции и накопление кислых продуктов, таких как лактат. При наличии ангиопатий это может привести к развитию симптомов гипоперфузии и некрозам. Гиперкоагуляция часто обусловливает развитие ДВС-синдрома и тромбозов глубоких вен нижних конечностей.
Гипервентиляция (дыхание Куссмауля — редкое, глубокое, шумное) и фруктовый запах выдыхаемого воздуха являются достаточно специфичными симптомами диабетического кетоацидоза, а если при этом еще имеется дегидратация, то диагноз может быть поставлен на основании одной только клинической картины.
При псевдоперитоните могут быть выявлены симптомы раздражения брюшины и отсутствие кишечных шумов. Диагностику может осложнить наличие лейкоцитоза и рвоты. При этом рвотные массы при диабетическом кетоацидозе нередко имеют коричневатый оттенок, который может быть ошибочно расценен как рвота «кофейной гущей». Таким образом, в ситуации острого живота неясного генеза всегда нужно исследовать уровень гликемии и кетонурии.
Неспецифическими признаками при диабетическом кетоацидозе часто бывают лейкоцитоз, гипотермия, тахикардия, пульс слабого наполнения и гипотония. Лихорадка всегда является признаком имеющейся инфекции, которая может быть как причиной, так и следствием декомпенсации СД1.
Следует помнить, что именно интраабдоминальный процесс может являться причиной декомпенсации СД1. При лихорадке требуется особенно тщательный диагностический подход, т.к. сам по себе кетоацидоз лихорадкой никогда не сопровождается.
Гиповолемический шок с гипоперфузией и недостаточным поступлением кислорода при кетоацидозе может стать причиной развития сопутствующего лактатацидоза − в тканях начинается синтез лактата, высокий уровень которого подавляет образование ацетоацетата, а из кетоновых тел продолжают синтезироваться только ацетон и β-гидроксибутират.
Исследование кетонурии с помощью тест-полосок основано на определении уровня ацетоацетата. Позитивным, помимо диабетического кетоацидоза, тест оказывается при голодном и алкогольном кетозе. Голодный кетоз может развиваться у здоровых людей при длительном голодании, при этом в моче определяются кетоновые тела. Причиной ложноотрицательных результатов исследования ацетонурии может оказаться прием таких препаратов, как аспирин, L-дофа, аскорбиновая кислота.
Такая клиника наблюдается уже через 12 ч голодания, однако в норме всегда сохраняется баланс между секрецией инсулина и глюкагона, т.е. в норме при голодании распад жиров и образование кетоновых тел будут происходить лишь в том количестве, какое могут метаболизировать головной мозг и мышцы. Ацидоз при этом, как правило, не развивается. Алкоголь подавляет глюконеогенез в печени. Для здоровых людей это, как правило, не представляет опасности. Крепкие спиртные напитки, особенно в сочетании с незначительным приемом пищи, «запирают» гликогеновые резервы. Это приводит к компенсаторному усилению метаболизма жирных кислот и усилению кетогенеза. У алкоголиков прием крепких спиртных напитков, часто сочетающийся с недостаточным питанием, может привести к развитию кетоацидоза, сопровождающегося в ряде случаев гипогликемией.
Причинами смерти при ДКА могут стать шок на фоне дегидратации, тяжелые аспирационные пневмонии, аспирация с закупоркой дыхательных путей, шоковое легкое, легочные эмболии и отек мозга, который наиболее часто развивается у детей.
Клинико-лабораторные критерии диагностики ДКА
— клинический синдром дефицита инсулина;
— ГПК > 13,9 ммоль/л, но может не превышать 16-17 ммоль/л;
— Уровень рН может снижаться до 6,8 (норма 7,35—7,45), а РаСО2 до 15 мм рт. ст. (норма 35—45 мм рт. ст.). При снижении РаСО2 менее 25 мм рт. ст. возможно развитие отека головного мозга, поскольку при этом развивается выраженная церебральная вазоконстрикция. Следует иметь в виду, что на фоне лечения кетоацидоза могут происходить различные сдвиги КОС, в результате чего возникнет необходимость в их более детальной интерпретации.
— Обезвоживание может достигать до 10—12% массы тела.
— Гиперкетонемия > 5 ммоль/л или ≥ +;
— кетонурия ≥ + +;
Лечение.
Как правило, у пациента с кетоацидозом имеется гипервентиляция, и перевод на искусственное дыхание не требуется. Если больной поступает в больницу слишком поздно, то уже может развиваться угнетение сознания и дыхательного центра – кетоацидотическая кома, являющаяся результатом метаболических нарушений и церебральной гипоперфузии. В этой ситуации интубация должна быть первым и неотложным мероприятием. Параллельно начинают регидратацию.
Схематически последовательность лечебных мероприятий при кетоацидозе может быть представлена следующим образом. Такая схема наиболее приемлема при глубокой кетоацидотической коме.
Схема лечения кетоацидоза
· Стабилизация жизненно важных функций. В случае выраженного нарушения сознания (сопор, кома) даже без угнетения самостоятельного дыхания обязательна искусственная вентиляция легких (ИВЛ). Регидратация — наиболее важное, первоочередное мероприятие!!! Одновременно с ИВЛ начинают регидратацию через периферическую или центральную вену. При осмолярности менее 320 мосм/л за 1-й час переливается 1 литр изотонического раствора хлорида натрия, при осмолярности более 320 мосм/л – 500мл 0,45% раствора натрия хлорида и 500мл 0,9% натрия хлорида, за 2-й и 3-й — по 500мл 0,9% натрия хлорида, после чего скорость переливания уменьшается до 300 мл/ч.
· При снижении уровня ГПК ниже 14 ммоль/л переходят на переливание 5-10% раствора глюкозы в зависимости от динамики показателя осмолярности.
· Применение синтетических коллоидов (декстраны, препараты гидроксиэтилкрахмала (ГЭК)) не оправдано, т.к. они повышают онкотическую составляющую осмотического давления и могут усугубить гиперосмолярное повреждение клеток головного мозга, вызвав еще большую внутриклеточную дегидратацию последних. Необходимо учитывать и противопоказания к применению этих препаратов, такие как поченая недостаточность или угроза ее развития, гипокалиемия и т.п.
· Начиная со 2-го часа объем вводимых растворов корригируется в зависимости от показателей центрального венозного давления (ЦВД). Исходно ЦВД обычно отрицательное. Нельзя допускать резкого повышения даже до нормальных величин – это может свидетельствовать об объемной перегрузке в малом круге кровообращения, т.е. о слишком быстром введении жидкости.
· Применение гипотонических электролитных растворов в качестве начальной регидратационной терапии достаточно спорно, т.к. многие авторы считают, что это таит в себе опасность развития отека мозга. Данное мнение основывается на недостаточно точном представлении о механизмах и вариантах развития отека головного мозга.
При кетоацидотической коме у пациента развивается гиперосмолярная дегидратация, часто в сочетании с гипернатриемией. При такой дегидратации внеклеточная среда оказывается гиперосмолярной. Клетки, в частности, клетки головного мозга, при достаточном энергетическом обеспечении сохраняют постоянную осмолярность, которая оказывается ниже внеклеточной. За счет разницы в осмолярности вода покидает клетки (в сторону более высокой осмолярности), развивается клеточная дегидратация. На фоне тяжелого энергетического дефицита трансмембранный потенциал, поддерживаемый АТФ-зависимыми ионными каналами (ионный насос), дестабилизируется – развивается трансминерализация — калий покидает клетку, а натрий с хлором идет в клетку вместе с водой. Учитывая то, что трансминерализация ассоциирована с морфологической смертью клетки, большего вреда от гипотоничных растворов уже не будет, наоборот – уменьшение осмолярности благоприятно скажется на общем состоянии водно-солевого баланса. Маркерами наличия трансминерализации можно считать длительность гипергликемии и (или) кетоацидоза (лактатацидоза) более суток с выраженными нарушениями сознания, толерантность к инсулинотерапии, выраженные нарушения концентрации электролитов (гиперкалиемия, гипо- или гипернатриемия). Гипоксия любого генеза, сердечная или сосудистая недостаточность, нарушения микроциркуляции ускоряют наступление трансминерализации.
Применение гипотоничных растворов может быть нежелательным при гемодинамическом отеке (т.е. при сердечной недостаточности) и опасным – при снижении осмолярности внеклеточной жидкости. При сердечной недостаточности развивается внеклеточный отек, а при гипоосмолярном состоянии – клеточный отек.
· Гипотоничными растворами являются: 0,45% раствор натрия хлорида. Применяется при осмолярности выше 320 мосм/л, если повышенная осмолярность не обусловлена гипернатриемией;
5% раствор глюкозы. Применяют при нормальной или повышенной осмолярности, если ГПК не выше 14 ммоль/л или если гиперосмолярность обусловлена гипернатриемией или азотемией.
Осмолярность плазмы вычисляется по следующей формуле:
2(К+Na/ммоль/л)+гликемия(ммоль/л)+мочевина(ммоль/л).
Конечно, значительно достоверней измерение осмолярности плазмы при помощи осмометра.
· Катетеризация мочевого пузыря. Информация о количестве выделяемой мочи необходима для контроля за регидратационной терапией и функциональным состоянием почек.
· Анализ крови. Исходно определяют уровни электролитов, гликемии, креатинина, показатели КОС, печеночных ферментов, скорость оседания эритроцитов (СОЭ), амилазы, компонентов свертывающей системы крови и все показатели общего анализа крови. Уровни гликемии, калия и натрия исследуются каждые 30-60 мин, показатели КОС — каждые 2-3 ч. Обязателен подсчет осмолярности или определение осмолярности!
· Инсулинотерапия. Целевой уровень ГПК при выведении из ДКА – 10-13 ммоль/л. На протяжении первых 24 часов снижение уровня гликемии должно быть не более чем на 2,8 ммоль/л в час, а на протяжении 1-го часа не ниже, чем до 13 ммоль/л, чтобы не спровоцировать развитие клеточного отека мозга. Быстрое снижение уровня гликемии не имеет смысла. Вначале вполне достаточно относительно низких доз инсулина, необходимых для подавления липолиза и глюконеогенеза. Резкое снижение осмолярности внеклеточной жидкости может привести к развитию клеточного отека мозга, по механизму аналогичному таковому при гипонатриемии и обезвоживании. Целесообразно использовать препараты инсулина короткого действия из-за их немедленного эффекта. Инсулинотерапия должна осуществляться непрерывно путем использования инфузии в режиме малых доз – 0,1 ЕД Инсулина на кг массы тела в час. Инсулин необходимо вводить внутривенно: сначала болюсную дозу, затем через перфузор. При отсутствии перфузора можно прибегнуть к капельному внутривенному введению инсулина.
Режим малых доз инсулина при кетоацидотической диабетической коме имеет следующие преимущества:
· уменьшение риска развития отека клеток головного мозга,
· легко управляемый уровень глюкозы в крови,
· снижение риска развития поздней гипогликемии,
· легкоуправляемый уровень калия (низкий риск развития гипокалиемической фибрилляции желудочков сердца и паралитической непроходимости кишечника).
При использовании дозатора 50 ЕД ИКД (хумулин регуляр, актрапид, инсуман рапид) разводят в 50 мл 0,9% NaCl.
В случае отсутствия дозатора в емкость с 200 мл 0,9% NaCl следует ввести инсулин из расчета на каждые 100 мл р-ра 10 ЕД инсулина.
Коррекция дозы инсулина производится под ежечасным контролем гликемии. Если в первые 2-3 часа гликемия не снижается доза инсулина удваивается. И, наоборот, при снижении гликемии со скоростью ≥ 4,0 ммоль/л в час дозу инсулина уменьшают вдвое (0,05 ЕД/кг/час). Аналогично поступают при снижении гликемии до 13 ммоль/л.
При снижении ГПК ниже 14 ммоль/л начинают инфузию 10% раствора глюкозы, при сохраняющейся высокой осмолярности – 5% раствор глюкозы. Раннее начало введения глюкозы является важным энергетическим подспорьем и, кроме того, предотвращает резкое снижение осмолярности плазмы.
Перевод на подкожную базис-болюсную инсулинотерапию производят при достижении стабильной гликемии в пределах 13-14 ммоль/л.
При каких либо экстремальных ситуациях и невозможности внутривенного капельного введения, инсулин можно вводить глубоко внутримышечно в прямую мышцу живота. Для уверенного попадания вглубь мышцы необходимо использовать длинные (не для инсулиновых шприцев) иглы. Такая игла надевается на инсулиновый шприц, и именно через нее осуществляется набор инсулина из флакона. Если длинная игла надевается на заранее наполненный шприц, в ней образуется большое «мертвое» воздушное пространство. Исходная болюсная доза инсулина в 1-й час лечения составляет 16 ЕД глубоко внутримышечно. В последующем ежечасно вводится в среднем по 6 ЕД инсулина глубоко внутримышечно. При достижении уровня гликемии 12-14 ммоль/л доза инсулина уменьшается в 2 раза и составляет 3 ЕД в час. Если через 1 ч после начала инсулинотерапии уровень гликемии не снизился как минимум на 10%, необходимо ввести повторную болюсную дозу 10-20 ЕД ИКД;
· Восполнение дефицита калия. Зависит от функционального состояния почек и исходного уровня калиемии, а также инсулинотерапии. Сначала делается анализ крови. При уровне калия менее 3 ммоль/л переливается 30 ммоль за первый час (30мл 7,4% раствора КСl или 50 мл 4% раствора КСl), при калиемии 3-4 ммоль/л — 20 ммоль за час, при калиемии 4-5 ммоль/л — 15ммоль. В дальнейшем калий вводят из расчета удвоенной суточной потребности – 2 ммоль/кг со скоростью 10 ммоль за час под контролем уровня калия;
· На фоне регидратационной терапии и стабилизации гемодинамических показателей наблюдается следующая динамика уровня калия плазмы:
с началом регидратационной терапии кровь разбавляется и концентрация калия уменьшается; восстанавливается нормальное кровоснабжение почек, что ведет к усилению выведения ионов калия; с улучшением органной и почечной перфузии кислотность снижается, рН увеличивается, лишние протоны начинают покидать клетку, а в обмен ионы калия поступают внутрь клетки.
Переливание одного только изотонического раствора хлорида натрия может привести к значительному снижению уровня калия плазмы. Начало инсулинотерапии еще более усугубляет гипокалиемию, т.к. инсулин обеспечивает нормальное поступление глюкозы и калия в клетки.
До введения инсулина калиевый дисбаланс, как правило, проблем не представляет. С началом инсулинотерапии уровень калиемии может снизиться достаточно быстро с развитием тяжелой аритмии.
Скорость переливания калийсодержащих растворов корригируется в зависимости от уровня калия в плазме, который необходимо исследовать ежечасно.
ЭКГ-мониторинг позволяет выявить признаки как гиперкалиемии (прогрессирующее увеличение амплитуды зубца Т), так и гипокалиемии (уплощение зубца Т, депрессия сегмента ST, появление зубца U).
При отсутствии экспресс-диагностики уровня калия в крови введение хлорида калия начинают примерно через 2 ч от начала инфузионной терапии со скоростью 1,5 г/ч (20 ммоль/час). Суммарная потеря калия составляет от 300 до 1000 ммоль (22,5-75г). Как правило, в течение суток должно вводиться не более 250 ммоль (18,75 г).
· Коррекция калиемии. При уровне калия менее 4 ммоль/л введение инсулина временно приостанавливается и калий вводится дополнительно.
Чрезвычайно важно помнить о том, что ДКА создает высокий риск развития гипокалиемии. Причиной последней являются потери калия с мочой и активное перемещение калия в клетки с началом инсулинотерапии. Поэтому экзогенное введение калия начинается при любых уровнях калия в крови, не превышающих 6 ммоль/л. Расчет необходимого количества калия производят по формуле:
[К+] = (К+ в норме – К+ больного) х массу тела х % внеклеточной жидкости*(0,2 – у взрослых пациентов)] или (К+ в норме – К+ больного) х массу тела х 0,2.
* % внеклеточной жидкости: до 2-х лет – 40%; 2-5 лет – 30%; старше 5 лет – 20%.
** физиологическая потребность в калии у детей до 2 лет – 2 мг/кг/сут (2ммоль/кг/сут), старше 2 лет – 1 мг/кг/сут (1ммоль/кг/сут), у взрослых- 1 мг/кг/сут (1ммоль/кг/сут).
Альтернативой приведенным расчетам может быть введение калия с помощью дозатора. Необходимо учитывать, что 1 гр. К+ = 13,0 мл -7,4% KCl. Однонормальный раствор калия хлорида — 7,4% содержит 1 ммоль калия в 1 мл.
· Желудочный зонд. При гастропарезе существует опасность аспирации. Зонд устанавливают до того, как придать голове низкое положение для катетеризации подключичной вены;
· Центральное венозное (ЦВД) и артериальное давление (АД). В состоянии обезвоживания и гиповолемии целесообразно катетеризировать центральную вену. Определение ЦВД позволяет оценивать сердечную функцию, состояние легких и безопасность проводимой регидратации. Не следует ассоциировать ЦВД и объем циркулирующей крови (ОЦК) – при нормализации АД и восстановлении микроциркуляции следует уменьшать темп инфузии, даже не смотря на сохраняющееся низкое ЦВД. Повышение ЦВД даже до нормальных величин при сохраняющейся тахикардии следует расценивать как признак избыточной инфузии и начало интерстициального отека легких. Если у пациента с тахикардией до начала проведения инфузии отмечалось положительное ЦВД, то это надо расценивать как имеющуюся сердечную недостаточность и темп инфузии исходно должен быть медленным.
· Бикарбонат натрия. Противопоказан при рН > 7,1. Бикарбонат натрия (син. гидрокарбонат натрия) следует вводить только при рН <7,1. При рН >7,1 на фоне лечения ацидоз ликвидируется и без бикарбоната. Введение избытка буфера неблагоприятно, поскольку это может спровоцировать преходящий метаболический алкалоз, который значительно опаснее ацидоза. С подавлением липолиза при инсулинотерапии и регидратации продукция кислых валентностей и так подавляется. Метаболический алкалоз также оказывает отрицательное инотропное влияние на сердце, ухудшает диссоциацию оксигемоглобина и подавляет дыхательный центр. Большинство исследователей и клиницистов вообще не рекомендуют введение бикарбоната (особенно при отсутствии качественного и срочного лабораторного мониторинга уровней электролитемии и рН). Необоснованное введение бикарбоната натрия может привести к развитию парадоксального внутриклеточного ацидоза и гипоксии головного мозга. Нарастание внутриклеточного ацидоза после введения бикарбоната натрия объясняется изменением трансмембранного транспорта. Бикарбонат натрия диссоциирует на диоксид углерода и гидроксид натрия. Гидроксид натрия не может проникнуть через клеточную мембрану и связывает внеклеточный ион водорода (протон). Диоксид углерода пассивно диффундирует через клеточную мембрану внутрь клетки, где, связываясь с молекулой воды, образует угольную кислоту. Таким образом, несмотря на увеличение рН плазмы, внутри клеток прогрессирует ацидоз.
· Антибиотики. При кетоацидозе лихорадка свидетельствует об имеющейся инфекции – необходимо назначение эмпирической антибактериальной терапии;
· Выяснение причины декомпенсации СД. Инфекции, острая хирургическая патология, инфаркт миокарда, прекращение введения инсулина и т.д. Необходимо исключить острые хирургические заболевания.
Гиперосмолярная кома
Гиперосмолярная кома чаще всего развивается у пожилых пациентов с СД2. При этом в большинстве случаев речь идет о неадекватно компенсируемом или до сих пор не диагностированном СД2. Такие пациенты чаще всего одиноки, живут без ухода, пренебрегают своим состоянием и самоконтролем и принимают недостаточно жидкости. Часто к декомпенсации приводят инфекции и нарушения мозгового кровообращения. Этому может способствовать прием диабетогенных препаратов. Возраст пациента, отсутствие диспноэ с гипервентиляцией и запахом ацетона выдыхаемого воздуха, а также отсутствие кетонурии при значительной гипергликемии в дифференциальной диагностике критических состояний при СД свидетельствуют о гиперосмолярной коме. Сохраняющейся при СД2 остаточной секреции инсулина оказывается достаточно для подавления липолиза и кетогенеза. Умеренно выраженный ацидоз как результат гиперлактатемии на фоне тканевой гипоперфузии все-таки может определяться.
В основе гиперосмолярной комы при СД лежат следующие звенья патогенеза:
1) гипергликемия и осмотический диурез с развитием выраженной дегидратации;
2) гиперосмолярность плазмы как результат гипергликемии и дегидратации;
3) цереброспинальная жидкость имеет такую же осмолярность, что и плазма, но концентрация глюкозы в норме в ней ниже. При выраженной гипергликемии для сохранения осмотического баланса в цереброспинальной жидкости увеличивается содержание натрия, поступающего из клеток головного мозга, куда в обмен попадает калий. Нарушается трансмембранный потенциал нервных клеток, они дегидратируются. Развивается прогрессирующее помрачение сознания в сочетании с судорожным синдромом.
Клиническая картина.
Особенностями клинической картины гиперосмолярной комы являются:
— выраженное обезвоживание как результат значительной гипергликемии и полиурии;
— фокальные и генерализованные судороги;
— ригидность затылочных мышц в результате раздражения мозговых оболочек;
— весь комплекс признаков и осложнений дегидратации и гипоперфузии: тошнота, слабость, жажда, сухость слизистых оболочек, тахикардия, артериальная гипотензия, шок;
— тромбозы глубоких вен,
— часто — пневмония, вызванная грамотрицательной флорой.
Таблица 5. Лабораторные показатели при гиперосмолярной коме
| Показатель | Параметры |
| Гликемия | 33-56 ммоль/л |
| Осмолярность | >350 мосм/л |
| Газовый состав крови | Ацидоз; рН обычно ≤7,3 |
| Лактат | При периферической гипоперфузии и шоке может быть значительно повышен |
| Кетоновые тела | В отдельных случаях незначительное повышение |
| Свертываемость крови | Нарушена, повышена вязкость крови на фоне гипоперфузии, ДВС-синдрома |
Лечение
Лечение и мониторинг при гиперосмолярной коме, за исключением некоторых особенностей, не отличается от таковых, описанных для кетоацидотической диабетической комы.
Регидратация осуществляется капельным внутривенным введением гипотонического раствора хлорида натрия (0,45 %) — до 3 л в течение первых 3 ч. Затем, при снижении осмолярности крови ниже 320 мосм/л переходят на введение изотонического раствора хлорида натрия. В первые 8 ч лечения количество вводимой жидкости может достигать 4-5 л, а в течение суток — 7-9 л. Больший объем начальной регидратации, чем при кетоацидотической коме: 1,5—2 л за 1-й час, 1 л — за 2-й и 3-й час, далее по 500 мл/ч.
Начиная со 2-го часа объем вводимых растворов корригируется в зависимости от показателей ЦВД. Опять-таки, здесь нужно оговориться, что ЦВД не является показателем волемии, а является критерием того может ли сердце «перекачать» объем инфузии, то есть определяет наличие сердечной недостаточности. Обычно целевым уровнем ЦВД при регидратации составляет 8-9 мм.рт.ст. − у неинтубированных пациентов, и 12-20 мм.рт.ст.− у интубированных, после чего темп инфузии необходимо снизить. Исходно ЦВД обычно отрицательное. Нельзя допускать резкого повышения даже до нормальных величин – это может свидетельствовать об объемной перегрузке в малом круге кровообращения, т.е. о слишком быстром введении жидкости.
Значительный дефицит калия: Потребность во введении калия больше, чем при кетоацидотической коме. Устранение дефицита калия проводится по представленной в предыдущем разделе схеме лечения при диабетическом кетоацидозе. Гипернатриемия устраняется при регидратации гипотоническим раствором.
Бикарбонат натрия. Чаще всего нет необходимости введения бикарбоната натрия: гиперлактатацидемия корригируется на фоне проводимой регидратации. Бикарбонат вводится только в том случае, если развивается ацидоз с рН <7,1.
Инсулинотерапия: Поскольку сохраняющейся остаточной секреции инсулина оказывается достаточно для сдерживания катаболической декомпенсации метаболизма с развитием кетоацидоза, регидратационная терапия и коррекция электролитемии должны предшествовать введению инсулина. Инсулинотерапия гиперосмолярного сопорозного и коматозного состояния должна проводиться введением малых доз инсулина короткого действия, а именно: 0,1 ЕД кг/ч внутривенно перфузором в течение первых 3 ч. Мониторинг уровня гликемии должен проводится ежечасно. Через 3 ч от начала лечения тактика инсулинотерапии определяется уровнем гликемии и соответствует методике инсулинотерапии, рассмотренной в разделе кетоацидоза. В процессе инсулинотерапии уровень гликемии поддерживается в пределах 6-11 ммоль/л.
Гипогликемия
Гипогликемия — клинический синдром, характеризующийся признаками активации симпатической нервной системы и/или дисфункцией центральной нервной системы, которые обусловлены патологически низким уровнем глюкозы в плазме, при этом происходит снижение плазменной концентрации глюкозы ниже 2,2-2,8 ммоль/л [14]. У недоношенных новорожденных гипогликемическая симптоматика развивается при уровне гликемии менее 1,1 ммоль/л, а у нормально доношенных — менее 1,7 ммоль/л. При этом могут развиться судороги, бред, потеря сознания, вплоть до комы, а также вегетативные реакции: усиленное потоотделение, изменение просвета кожных сосудов и др. Особенно чувствительной к гипогликемии является центральная нервная система (ЦНС).
По литературным данным уровень гликемии, определяющий неблагоприятный прогноз для больных в критическом состоянии без СД, может отличаться. Например, для больных с сепсисом – 2,2 ммоль/л (Intrenational Guidelines for Management of Severe Sepsis and Septic Shock: 2012), а для больных с инсультом – 3,3ммоль/л (Guidelines for the Early Management of Patients With Acute Ischemic Stroke: USA,2013).
Гипогликемия является самым распространенным острым осложнением СД у больных, получающих инсулин. Гипогликемическая симптоматика у больных с СД может развиться уже при уровне глюкозы 6—8 ммоль/л. Однозначно уровень ГПК, верифицируемый как гипогликемия у больных СД не указан ни в международных рекомендациях, ни в ПДЛ РК.
Учитывая, что одной из задачей врачей отделений анестезиологии и интенсивной терапии является профилактика возможных осложнений, связанных с основным заболеванием или с лечением, и то, что в отделении находятся больные, которые не всегда могут проявить клинические симптомы гипогликемии, по нашему мнению для пациентов в периоперационном периоде или находящихся в ОРИТ следует считать гипогликемией уровень ГПК ≤ 4ммоль/л. У больных, получающих инсулин, при уровне ГПК ≤ 4,4ммоль/л следует начинать профилактику гипогликемии.
В общей структуре смертности гипогликемические состояния составляют при СД примерно 3—4 % случаев по статистическим данным. По современным представлениям, легкие, а также бессимптомные ночные гипогликемии безвредны. Даже при корректной интенсивной инсулинотерапии легкие гипогликемические симптомы у больных могут возникать ежедневно. Они не являются признаком хорошей компенсации, поскольку часто встречаются и при плохом гликемическом профиле, хотя повышение качества компенсации СД увеличивает риск развития гипогликемии.
Согласно статистике, у больного с СД при традиционной инсулинотерапии приступы тяжелой гипогликемии возникают в среднем 1 раз в 5 лет. На одного больного, находящегося на интенсивной инсулинотерапии, в год приходится 1 случай тяжелой гипогликемии.
У пациентов, использующих носимые дозаторы инсулина (помпы), легкие гипогликемические симптомы могут встречаться более 3 раз в неделю.
Значительно опаснее развитие гипогликемии на фоне терапии препаратами сульфанилмочевины (СМ). Период полувыведения таких препаратов, как глибенкламид, может в ряде случаев увеличиваться до 36 ч. По данным различных исследований, риск развития гипогликемии на фоне приема СМ составил от 1:4000 до 1:50. У пожилых пациентов риск развития тяжелых гипогликемии на фоне СМ значительно выше и составляет около 10%. Летальность в этих случаях достигает также порядка 10%.
Пациенты, получающие традиционную инсулинотерапию с введением больших доз инсулина продленного действия, для профилактики гипогликемии должны четко придерживаться распорядка дня с частыми приемами пищи, которая должна содержать достаточное количество углеводов.
То же относится и к больным СД2, получающим СМ, особенно в максимальных дозах.
Пациенты с СД1, находящиеся на интенсивной инсулинотерапии, часть инсулина получают в виде препаратов короткого действия, которые они вводят в дозе, необходимой для конкретного приема пищи, относительно произвольного по своему составу. Таким образом, пропустит пациент тот или иной прием пищи или вместо четырех их будет восемь при соответствующей адаптации дозы ИКД — в идеале это не несет никакого дополнительного риска развития гипогликемии. Кроме того, обученные пациенты достаточно быстро привыкают самостоятельно распознавать безобидные легкие гипогликемии и быстро справляться с ними.
Гипергликемия субъективно переносится пациентами легче, чем эпизоды легкой гипогликемии. Поэтому многие пациенты из-за боязни гипогликемии считают необходимым поддержание гликемии на относительно высоком уровне, который фактически соответствует декомпенсации заболевания. Преодоление этого стереотипа требует порой немалых усилий врачей и обучающего персонала.
При проведении оперативных вмешательств риск развития гипогликемии достаточно высокий, особенно при неадекватном мониторинге гликемии во время анестезии, т.к. симптомы невозможно распознать из-за отсутствия сознания у пациента. В предоперационном периоде при плановых хирургических вмешательствах, как правило, физическая активность пациентов снижается, соответственно этому необходимо контролировать уровень гликемии и корригировать дозу инсулина. В этом случае возможно понадобится снижение дозировки.
Основные причины гипогликемии при сахарном диабете
— Недостаточный прием пищи: Например, недостаточное число хлебных единиц (ХЕ) на дозу инсулина с учетом исходной гликемии. Разработаны специальные таблицы замены, с помощью которых, выражая количество углеводов в ХЕ, можно определить, каким количеством одного продукта (в граммах) можно заменить другой. Одна ХЕ равна 10 граммам глюкозы;
— Большие физические нагрузки при сохранении прежней дозы инсулина или таблетированных сахаропонижающих препаратов (ТСП);
— Передозировка инсулина или ТСП: Например, прием глибенкламида в постоянной дозировке, несмотря на снижение массы тела;
— Автономная нейропатия. В норме экстренная адаптация к гипогликемии обеспечивается за счет парасимпатической стимуляции поджелудочной железы (происходит выброс глюкагона) и симпатической активации мозгового вещества надпочечников (выброс адреналина). При прогрессировании автономной нейропатии угнетается активность симпатического отдела нервной системы и в ответ на стрессовые ситуации не происходит достаточного выброса адреналина и, как следствие мобилизации гликогена из депо. Кроме того, при нейропатии страдает иннервация желудка с развитием гастропареза и нарушением эвакуации пищи. Пища с запозданием поступает в кишечник, откуда должна всасываться глюкоза. Если пациент перед приемом пищи сделал себе инсулин, то развивается гипогликемическое состояние.
— Ускорение резорбции инсулина: внутримышечное введение инсулина вместо подкожного;
— Кумуляция ТСП: Например, связанная с прогрессированием почечной недостаточности;
— Алкоголь: Подавление глюконеогенеза;
— Развитие сопутствующих эндокринопатий: гипотиреоз, надпочечниковая недостаточность.
Клиническая картина.
Гипогликемическая симптоматика очень вариабельна как по набору симптомов, так и по их выраженности. Одни пациенты могут переносить значительную гипогликемию, не теряя сознания и, более того, не предъявляя жалоб. Другие, напротив, реагируют даже на незначительное снижение уровня глюкозы. Иными словами, помимо выраженности и длительности гипогликемии, имеет значение индивидуальный характер реагирования на нее пациентов. Прогрессирующая гипогликемия приводит к гипогликемической коме.
Классически выделяют две группы симптомов: адренергические, являющиеся результатом компенсаторной активации вегетативной нервной системы, и нейрогликопенические, являющиеся результатом дисфункции ЦНС при недостаточном поступлении ее основного энергетического субстрата.
· Адренергическими симптомами являются тахикардия, мидриаз, беспокойство, агрессивность, дрожь, холодный пот, парестезии, тошнота, сильный голод, диарея, обильное мочеиспускание.
· К нейрогликопеническим симптомам относят астению, снижение концентрации внимания, головную боль, чувство страха, спутанность сознания, дезориентацию, галлюцинации (речевые, зрительные), поведенческие нарушения, амнезию, нарушение сознания, судороги, преходящие параличи, кому.
Четкой зависимости между выраженностью и последовательностью развития симптомов по мере утяжеления гипогликемии может и не быть. Могут возникать только адренергические или только нейрогликопенические симптомы.
Гипогликемическая кома длительностью до 30 мин при адекватном лечении и быстром возвращении сознания, как правило, не имеет каких-либо осложнений и последствий.
В отдельных случаях, несмотря на восстановление эугликемии и продолжающуюся терапию, пациенты могут пребывать в сопорозном или даже коматозном состоянии на протяжении нескольких часов и даже дней.
Длительная гипогликемия или ее частые эпизоды могут привести к необратимым изменениям в ЦНС (прежде всего в коре больших полушарий), проявления которых значительно варьируют от делириозных и галлюцинаторно-параноидных эпизодов до часто описываемых типичных эпилептических припадков, неизбежным исходом которых является стойкое слабоумие.
Ночные гипогликемии обычно протекают бессимптомно. Их признаками могут быть ночная потливость, кошмарные сновидения, плохой сон, утренние головные боли. О ночных гипогликемиях прежде всего следует думать при высоком уровне глюкозы утром натощак. Наиболее частой причиной ночных гипогликемии является прием вечером высокой суммарной дозы препаратов инсулина пролонгированного действия. Именно ночью (около 3-х часов ночи) гипогликемии возникают в связи с физиологическим снижением уровня большинства контринсулярных гормонов. Для диагностики этого состояния, а также в процессе подбора инсулинотерапии необходимо исследовать уровень гликемии между 02.00 и 04.00 ч ночи.
При употреблении алкоголя подавляется печеночный глюконеогенез, что может привести к развитию тяжелой длительной гипогликемии. Даже у здорового человека вследствие острого влияния алкоголя на глюконеогенез в течение 6—36 ч после его употребления натощак может развиться преходящая легкая гипогликемия.
Существует ряд правил, соблюдение которых предотвратит развитие гипогликемии после приема алкоголя. Если предполагается употребление алкоголя, доза инсулина и ТСП должна быть существенно снижена. Как перед, так и после употребления алкогольных напитков всегда необходим прием углеводсодержащей пищи. После приема крепких напитков, чего нужно избегать, необходим дополнительный контроль гликемии, а также отказ от вечерней дозы инсулина и ТСП.
Лечение
Для лечения легкой гипогликемии, при которой пациент в сознании и может сам оказать себе помощь, обычно достаточно принять пищу, содержащую углеводы в количестве 1—2 ХЕ (10—20 г глюкозы).
Такое количество содержится, например, в 200 мл сладкого фруктового сока. Почти любой лимонад представляет собой 10% раствор глюкозы. Напитки более эффективно купируют гипогликемию, чем кусковой сахар или таблетки глюкозы, поскольку в жидком виде глюкоза значительно скорее всасывается. 1 ХЕ содержится в 2 кусочках сахара-рафинада или в 2 чайных ложках сахарного песка. Поэтому больной должен всегда иметь при себе 5—6 кусочков сахара. Конфеты, особенно шоколадные, хуже подходят для этой цели, так как медленно всасываются. Следует отметить, что если больные получают акарбозу, то купирование гипогликемии пищевым сахаром будет неэффективно.
Акарбоза блокирует кишечные ферменты α-глюкозидазы, посредством которых сахар расщепляется на фруктозу и глюкозу, затем последняя попадает в кровоток.
Таким образом, при приеме акарбозы для купирования гипогликемии необходимо использовать не пищевой сахар (тростниковый), а непосредст-венно глюкозу (виноградный сахар).
Если симптоматика продолжает нарастать, несмотря на продолжаю-щийся прием углеводов, необходимо внутривенное введение глюкозы или внутримышечное — глюкагона.
Аналогичным образом лечится и тяжелая гипогликемия, протекающая с потерей сознания.
Для профилактики ночных гипогликемий вечерняя инъекция базального инсулина может быть перенесена на 22 ч или позднее.
При этом можно снизить дозу инсулина или делать один прием пищи поздно вечером. Как указывалось, серьезную проблему может представить автономная невропатия с формированием гастропареза. В этой ситуации для профилактики гипогликемии пациент перед каждым приемом пищи должен выпивать напиток, содержащий быстро всасывающиеся углеводы. Всегда необходимо помнить о возможности артифициальной гипогликемии, связанной с намеренной передозировкой гипогликемических средств самим больным. Эта форма чаще наблюдается у детей и подростков.
Лечение тяжелой гипогликемии
40% раствор глюкозы: сначала вводят 50 мл 40% раствора внутривенно. Введение глюкозы необходимо продолжать вплоть до купирования приступа и нормализации гликемии, хотя большей дозы — до 100 мл и более, как правило, не требуется. Неправильно делать заключение об отсутствии гипогликемии, если улучшение наступило после введения только 10 мл раствора
Глюкагон: Вводят 1 мл внутримышечно или подкожно. Через несколько минут уровень гликемии благодаря индукции глюкагоном гликогенолиза нормализуется. Однако это происходит не всегда: при высоком уровне инсулина в крови глюкагон неэффективен. Период полувыведения глюкагона короче, чем инсулина. При алкоголизме и болезнях печени синтез гликогена нарушен и введение глюкагона может оказаться неэффективным. Побочным эффектом глюкагона может быть рвота, создающая опасность аспирации. Близким пациента желательно владеть техникой инъекции глюкагона.
Лактат-ацидоз
Лактат-ацидоз определяется как метаболический ацидоз с рН <7,25 и уровнем лактата более 8 ммоль/л.
Хроническая декомпенсация СД всегда сопровождается тканевой гипоксией, поэтому пациенты имеют повышенный риск развития лактат-ацидоза типа А (табл. 6).
Как уже говорилось, в той или иной степени лактат-ацидоз нередко сопутствует кетоацидотической и гиперосмолярной комам, что значительно ухудшает состояние пациентов и их прогноз.
В 50−70-х годах 20-го века самой частой причиной лактат-ацидоза был прием бигуанидов: фенформина и буформина. В связи с этим при обсуждении вопросов лактат-ацидоза, развившегося на фоне приема бигуанидов, следует дифференцировать понятия бигуанид-индуцированный и бигуанид-ассоциированный лактат-ацидоз. Под последним следует понимать лактат-ацидоз, в патогенезе которого прием бигуанидов играет не главную, а второстепенную роль. По имеющимся данным, развитие лактат-ацидоза при терапии метформином составляет от 2,4 до 8,4 случаев в год на 100 000 пациентов, получающих этот препарат.
Таблица 6. Классификация лактат-ацидоза с учетом причин его возникновения.
| Тип А связанный с тканевой гипоксией | Тип В не связанный с тканевой гипоксией | ||
| тип B1 | тип В2 | тип В3 | |
|
кардиогенный, сердечная недостаточность; эндотоксический, гиповолемический шок; дыхательная недостаточность; отравление окисью углерода; тяжелая анемия; феохромоцитома; эпилепсия |
почечная и печеночная недостаточность; злокачественные опухоли; инфекционные заболевания; лейкоз |
бигуаниды; парентеральное питание с использованием фруктозы, сорбитола, ксилитола; салициллаты, метанол, этанол, цианиды |
гликогеноз 1-го типа- (болезнь Гир- ке, дефект глюкозо-6- фосфатазы); |
| метилмалоновая ацидемия |
В норме лактат, образующийся в эритроцитах, коже, мышцах и кишечнике, метаболизируется в почках и печени. В условиях гипоксии лактат образуется в большом количестве в результате анаэробного гликолиза. Лактат утилизируется миокардом, но обладает свойством подавлять сократительную способность миокарда. При рН <7,2 подавляется распад лактата в печени и почках. Так формируется порочный круг, приводящий к развитию шокового состояния с высокой летальностью. Она составляет при бигуанидиндуцированном лактат-ацидозе около 33%.
В состоянии шока продукция лактата очень высока и ацидоз не поддается коррекции переливанием щелочных растворов. Однако при рН <7,1 такую терапию все-таки начинают, контролируя гипернатриемию введением диуретиков. Ацидоз в сочетании с увеличенным диурезом приводит к массивной потере калия, которую нужно вовремя предупредить. При лактат-ацидозе на фоне почечной недостаточности или олигоурии рекомендуется ранний перевод больного на почечнозамещающую терапию (гемодиализ или непрерывная почечнозамещающая терапия (НПЗТ)) с бикарбонатным буфером. Абсолютными показаниями для этого являются рН<7,0 и уровень лактата >9ммоль/л.
Для дифференциальной диагностики генеза лактат-ацидоза необходимо определение кислородного статуса по артерио-венозной разнице. При снижении уровня доставки или потребления кислорода необходимо думать о гипоксическом лакта-ацидозе и проводить соответствующие лечебные мероприятия – перевод на ИВЛ, восстановление периферического кровообращения, коррекция анемии и т.п.
Лечение
Основные принципы лечебной тактики не отличаются от терапии ДКА, однако имеют ряд особенностей:
— инсулинотерапия не является основным методом лечения молочнокислой комы, её проводят малыми дозами инсулина внутривенно капельно на 5% глюкозе в связи с невысокими уровнями гликемии;
— ведущее значение имеет устранение ацидоза (внутривенным капельным введением бикарбоната натрия;
— введение бикарбоната натрия проводят под контролем pH крови, ЭКГ, содержания калия и кальция в сыворотке крови.
— для борьбы с ацидозом используют трисамин (триоксиметиламинометан), который действует быстрее, чем бикарбонат (применяют при резко сниженном pH крови, особенно у лиц с выраженной сердечно-сосудистой недостаточностью;
— прессорные агенты не эффективны, катехоламины противопоказаны (усиливают накопление лактата в тканях);
— в тяжёлых случаях, при уровнях pH крови 7,0 и ниже, показано использование перитонеального диализа или почечнозамещающей терапии с безлактатным диализатом.
Поздние осложнения сахарного диабета
Наиболее важной задачей анестезиолога является оценка состояния пациента перед оперативным вмешательством с учетом имеющихся, в том числе скрытых поздних осложнений СД, которые во многом определяют высокие показатели смертности и развитие осложнений в ближайшем послеоперационном периоде.
К поздним осложнениям относятся:
· макроангиопатия (облитерирующий атеросклероз аорты, коронарных, периферических артерий и сосудов головного мозга);
· микроангиопатия (диабетическая ретинопатия; диабетическая нефропатия, диабетическая невропатия, синдром диабетической стопы).
При СД риск развития таких сердечно-сосудистых заболеваний, как инсульт, инфаркт миокарда, облитерирующее заболевание артерий нижних конечностей, в 4 раза выше, чем у лиц без СД. С сахарным диабетом связано 50% всех ампутаций конечностей, 15% всех случаев слепоты. Среди всех пациентов, находящихся на хроническом гемодиализе, 30% больных с СД. Имеется отчетливая связь между частотой развития поздних осложнений СД и качеством его компенсации, согласно имеющимся критериям. Наиболее четко это прослеживается на примере интенсивной инсулинотерапии при СД1, позволяющей добиться наилучших показателей компенсации заболевания.
Интенсивная инсулинотерапия СД1 снижает риск развития:
— пролиферативной ретинопатии примерно на 50—70%;
— клинически выраженной нефропатии примерно на 60%;
— выраженной невропатии примерно на 80%;
— поражения коронарных и периферических артерий примерно на 40%.
Патогенез поздних осложнений СД носит многофакторный характер.
Его упрощенной моделью является гликолизирование клеточных мембран, базальных мембран и белков. Значимыми являются такие факторы, как повышение проницаемости сосудов, нарушение энергетического баланса, изменение метаболизма клеточных мембран, а также индукция полипептидных ростовых факторов.
Диабетическая макроангиопатия. Наиболее важными в клиническом плане осложнениями облитерирующего атеросклероза являются ишемическая болезнь сердца (ИБС) и атеросклероз сосудов головного мозга, которые, как правило, взаимоотягощаются артериальной гипертензией, а также атеросклероз артерий нижних конечностей.
Частота развития ИБС у мужчин, страдающих сахарным диабетом, в 2 раза, а у женщин в 3 раза превышает частоту заболеваемости ИБС в общей популяции.
В возрасте от 30 до 55 лет от ИБС погибают 35% больных СД, в то время как в общей популяции ИБС является причиной смерти только у 8% мужчин и 4% женщин этой же возрастной категории.
Клиническими особенностями ИБС у больных СД являются:
• одинаковая частота развития у мужчин и у женщин;
• высокая частота безболевых форм ИБС (безболевая ишемия, безболевой инфаркт миокарда), влекущих за собой высокий риск внезапной смерти;
• высокая частота развития постинфарктных осложнений;
• смертность в остром (10 дней) и подостром (4—8 нед) периодах инфаркта миокарда в 2 раза превышает таковую у лиц без СД.
У больных СД в 10-25 случаев, т.е. в 2 раза чаще, чем обычно, встречается безболевой инфаркт миокарда. Мониторинг ЭКГ и ЭхоКГ перед оперативным вмешательством является обязательным у больных с СД в любом возрасте.
Нарушение восприятия ишемических болей связывают с автономной кардиальной невропатией. Внезапное появление признаков сердечной недостаточности, аритмий, необъяснимые гипогликемии, а также появление болей в эпигастральной области и тошноты — ситуации, требующие обязательного проведения ЭКГ и исследования ферментного спектра. Артериальная гипертензия у больных СД встречается в 2 раза чаще, чем у лиц без него. Помимо своих неспецифических осложнений (ИБС, нарушение мозгового кровообращения), при СД артериальная гипертензия способствует прогрессированию микроангиопатии (нефропатия, ретинопатия).
Высокая смертность больных СД от сердечно-сосудистой патологии тесно сопряжена с нефропатией и артериальной гипертензией.
Хроническое окклюзионное заболевание артерий нижних конечностей этиологически более чем в 95% случаев связано с атеросклеротическим поражением. При СД имеется четкая тенденция к генерализованному поражению артерий среднего и мелкого калибра .
Диабетическая ретинопатия.
Сахарный диабет является самой частой причиной слепоты у взрослых. При СД она развивается в 25 раз чаще, чем в общей популяции. Ретинопатия имеется у 85% больных СД1 с 20-летним стажем заболевания; в среднем она диагностируется у 40% всех больных СД1. Слепота развивается примерно у 2-4% больных СД1. Ретинопатию имеют 20% пациентов с СД2 уже в момент постановки диагноза СД.
В связи с тем, что развитие ретинопатии патогенетически связано с длительностью СД, качеством его компенсации и артериальной гипертензией, она часто сочетается с нефропатией.
Диабетическая нефропатия.
Специфическим для СД поражением почек является диабетический гломерулосклероз или собственно диабетическая нефропатия, которая примерно с одинаковой частотой осложняет течение СД1 и СД2, развиваясь у 40-45% пациентов.
Около 30-50% больных СД1 с 40-летним стажем заболевания имеют диабетическую нефропатию, которая в среднем через 10 лет приводит к терминальной почечной недостаточности. Летальность от уремии при СД1 во многом превышает таковую при СД2, составляя соответственно 30-50% и 5-10%.
Частота выявления диабетической нефропатии находится в прямой зависимости от длительности заболевания сахарным диабетом. Течение диабетической нефропатии при СД2 более мягкое.
Основными проявлениями диабетической нефропатии являются протеинурия, артериальная гипертензия и прогрессирующая почечная недостаточность. Появление протеинурии свидетельствует о том, что уже около 50-75% клубочков склерозировано и процесс в почках носит необратимый характер.
С момента появления протеинурии, а иногда и раньше, отмечается прогрессирующее повышение системного артериального давления, а темп снижения скорости клубочковой фильтрации составляет в среднем 1 мл/мин в месяц, что уже через 5-7 лет приводит к развитию почечной недостаточности.
Доклинические стадии диабетической нефропатии диагностируются при обнаружении микроальбуминурии как минимум в двух исследованиях мочи с помощью специальных тест-полосок при втором (утреннем) мочеиспускании.
Под микроальбуминурией понимают повышение скорости экскреции альбумина до 20-200 мкг/мин (30-300 мг/сут), т.е. до уровня, не достигающего протеинурии.
В норме с мочой у человека экскретируется не более 30 мг альбумина в сутки. При появлении протеинурии экскреция альбумина с мочой превышает 300 мг/сут. Таким образом, диапазон уровня микроальбуминурии может составлять от 30 до 300 мг/сут или от 20 до 200 мкг/мин.
При уровне альбуминурии, превышающем 30 мг/день, вероятность дальнейшего прогрессирования нефропатии составляет около 40%, а при уровне альбуминурии более 100 мг/день диабетическая нефропатия прогрессирует практически в 100% случаев.
Другим признаком диабетической нефропатии является клубочковая гиперфильтрация.
Она характеризуется повышением скорости клубочковой фильтрации (СКФ) более 140 мл/мин. Для определения СКФ используют пробу Реберга, основанную на исследовании клиренса эндогенного креатинина за сутки.
Нефротический синдром, признаками которого являются массивная протеинурия (более 3,5 г/сут), гипопротеинемия, гиперхолестеринемия, отечность (вплоть до анасарки), развивается у 30% больных с диабетической нефропатией.
Нефротический синдром при СД имеет следующие клинические особенности:
— массивный отечный синдром может развиваться даже при умеренной гипопротеинемии;
— отечный синдром при СД резистентен к терапии мочегонными;
— высокая протеинурия может сохраняться и при развитии хронической почечной недостаточности. Диабетическую нефропатию необходимо дифференцировать от других заболеваний почек, сопровождающихся микроальбуминурией или протеинурией. До 10% пациентов с СД1 и до 30% пациентов с СД2 имеют протеинурию, не связанную с СД.
Диабетическая невропатия.
Диабетическая невропатия представляет собой сочетание синдромов поражения нервной системы, которые могут быть классифицированы в зависимости от преимущественного вовлечения в процесс ее различных отделов (сенсомоторная, автономная), а также распространенности и тяжести поражения.
Диабетическая невропатия одинаково часто встречается при обоих типах СД. Частота ее развития увеличивается с возрастом и длительностью СД. Периферической невропатией в среднем страдают 25% всех больных СД и более 45% пациентов старше 60 лет.
При СД развивается смешанное поражение нервов — как аксонов, так и миелиновых оболочек (демиелинизация).
Сенсорная и моторная диабетическая полиневропатия проявляется комплексом двигательных и чувствительных нарушений (тактильных, болевых, температурных, вибрационных, а также суставно-мышечного чувства). Ранним проявлением сенсорной невропатии является нарушение вибрационной чувствительности. Частым симптомом дистальной формы диабетической невропатии являются парестезии и дизестезии, которые проявляются ощущением «ползания мурашек», онемением.
Пациенты часто жалуются на зябкость ног, хотя они остаются теплыми наощупь, что является признаком, позволяющим отличить полиневропатию от ишемических изменений, когда ноги на ощупь холодные.
Гипоэстезия проявляется выпадением чувствительности по типу «чулок» и «перчаток». Нарушение глубокой, проприоцептивной чувствительности приводит к нарушению координации и затруднению передвижений (сенсорная атаксия).
Автономная невропатия. В клинической картине на первый план часто выступают проявления диабетической автономной невропатии. Очень важно понимать, что диагноз дисфункции того или иного органа или системы в результате вегетативной невропатии является диагнозом исключения. Прежде всего, необходимо исключить органную патологию как причину имеющейся симптоматики. Выделяют несколько клинических форм автономной диабетической невропатии.
Кардиоваскулярная форма. Блуждающий нерв является наиболее длинным нервом из всех иннервирующих сердце, и при автономной невропатии он поражается в первую очередь. В результате преобладания симпатических влияний развивается тахикардия покоя. В дальнейшем, когда присоединяется нарушение симпатической иннервации, тахикардия несколько уменьшается. В ситуации стойкой тахикардии при тотальной вегетативной денервации, сердце сравнивают с трансплантированным.
Нарушение вегетативной афферентации резко снижает адаптивные возможности сердечно-сосудистой системы к физиологическим нагрузкам. Неадекватная реакция на ортостаз проявляется ортостатической гипотензией и синкопальными состояниями.
Гастроинтестинальная форма. При гастроинтестинальной форме автономной невропатии симптоматика во многом связана с недостаточностью холинергической регуляции функций ЖКТ:
— гастропарез с замедленным или, наоборот, опрокидывающим опорожнением желудка, что создает значительные сложности в подборе инсулинотерапии, поскольку время и объем всасывания углеводов неопределенно варьируют;
— атония пищевода, рефлюкс-эзофагит, дисфагия;
— смена водянистой диареи (обычно по ночам) запором как результат нарушения моторики кишечника, экзокринной секреции поджелудочной железы и присоединения дисбактериоза; указанные проявления объединяются термином «диабетическая энтеропатия»;
— слюнотечение;
— дискинезия желчных путей со склонностью к камнеобразованию реактивный панкреатит.
Урогенитальная форма. Эта форма автономной невропатии развивается в результате вовлечения в процесс крестцового сплетения и системы местной вегетативной регуляции функции урогенитального тракта и характеризуется следующими симптомами:
— атонией мочеточников и мочевого пузыря;
— рефлюксом и стазом мочи;
— склонностью к развитию мочевой инфекции;
— эректильной дисфункцией (около 50% больных СД);
— ретроградной эякуляцией и нарушением болевой иннервации яичек;
— нарушением увлажнения влагалища.
Нарушение способности распознавать гипогликемию. Выделяется вариант расстройств, связанных с автономной невропатией. Ситуация еще более усугубляется, если имеется та или иная форма нарушения эвакуации пищи из желудка. В этих условиях высока вероятность развития тяжелых приступов гипогликемии с внезапным развитием нейрогликопенической симптоматики.
Нарушение функции зрачка. Эта форма может проявляться нарушением адаптации к темноте, синдромом Аргайла-Робертсона.
Нарушение функции потовых желез. В связи с нарушением трофической иннервации кожи и соединительнотканных структур кожа становится тестообразной, атрофичной, а в результате поражения потовых желез — сухой (ангидроз).
Изменение функционального равновесия между адренергической и холинергической иннервацией приводит к нарушению тонуса поверхностных сосудов.
Особенности лечения сахарного диабета при хирургических вмешательствах
Различная хирургическая патология у 6,4-19,5% больных сочетается с сахарным диабетом, а каждый второй больной диабетом в течение своей жизни подвергается оперативному лечению. Больным сахарным диабетом свойственны те же хирургические заболевания, что и здоровым людям. В то же время у них значительно чаще наблюдаются гнойно-воспалительные заболевания (фурункулы, карбункулы) и следствия капилляропатии (диабетическая гангрена конечностей). Хирургические заболевания утяжеляют течение диабета. Это связано с неблагоприятным влиянием самой хирургической патологии, диагностическими манипуляциями, наркозом, операционной травмой, нарушением физиологической диеты, эмоциональными реакциями больного. Указанные воздействия ведут к истощению функций инсулярного аппарата и могут явиться причиной декомпенсации углеводного обмена вплоть до диабетической комы. При условиях своевременной диагностики и адекватной компенсации обменных нарушений сахарный диабет не может рассматриваться как противопоказание к хирургической операции.
Предоперационная подготовка состоит из интенсивного проти-водиабетического лечения для достижения компенсации сахарного диабета. Самые минимальные операции (удаление атером, вросшего ногтя, вскрытие гнойников и т. п.) нужно производить только в стационаре. Наиболее важной задачей предоперационной подготовки является оптимальная степень нормализации углеводного и других видов обмена, т. е. компенсация сахарного диабета.
Сахарный диабет определяет высокий хирургический и анестезиологический риск, но не является противопоказанием к операциям.
Обследование больного СД для снижения периоперационного риска:
1. Гликемия, кетонурия, перед плановыми операциями – HbA1с (гликогемоглобин).
2. Степень гидратации (АД, диурез), КОС (как минимум, pH и бикарбонат), K+, Na+.
3. Сердечно-сосудистая система. Перед средними и большими операциями − ЭхоКГ, ЭКГ. Перед плановыми операциями при высоком риске ИБС – обследование по стандартному алгоритму; подробный анамнез и ортостатические пробы для диагностики диабетической вегетативной нейропатии сердечно-сосудистой системы.
4. Почки и мочевыводящие пути: креатинин, протеинурия, скорость клубочковой фильтрации (СКФ), сбор анамнеза для диагностики вегетативной нейропатии мочевого пузыря.
5. Желудочно-кишечный тракт: сбор анамнеза для диагностики вегетативной нейропатии (гастропарез, энтеропатия).
6. Осмотр офтальмолога.
7. Коагулограмма.
Таблица 7. Риск осложнений у больных СД в периоперационном периоде
| Осложнение | Причины и провоцирующие факторы |
| Метаболическая декомпенсация с развитием кетоацидоза (ДКА) | Усиление инсулинорезистентности и инсулиновой недостаточности с контринсулярной реакцией и симпатикотонией. |
| Раневые и системные инфекции | Снижение иммунитета при гипергликемии |
| Инфаркт миокарда |
Высокая частота ИБС, периоперационный стресс и симпатикотония. Застойная сердечная недостаточность Диабетическая кардиомиопатия |
| Застойная сердечная недостаточность | Диабетическая кардиомиопатия, перегрузка жидкостью |
| Тромбоэмболии | Гипергликемия, иммобилизация, ожирение, старческий возраст, тяжелые инфекции |
| Артериальная гипотония | Диабетическая вегетативная нейропатия |
| Почечная недостаточность | Дегидратация, гипоперфузия почек/гиповолемия |
| Атония желудка и кишечника, аспирация, тошнота и рвота | Диабетическая вегетативная нейропатия |
| Атония мочевого пузыря | Диабетическая вегетативная нейропатия |
| Гемофтальм | Длительные операции в положении лицом вниз/на животе; применение антикоагулянтов |
| Гипогликемия | Недостаточный периоперационный контроль гликемии, неадекватная сахаропонижающая терапия |
Причины декомпенсации СД в процессе лечения хирургического заболевания:
— заболевание, вызвавшее необходимость проведения операции (воспалительные процессы, абсцессы, флегмоны, перитониты, опухоли, острый аппендицит, желчнокаменная и мочекаменная болезни и т. д.);
— хирургическая травма, наркоз, эмоциональная реакция;
— предоперационный период вынужденного голодания, пропуски приема пищи, необоснованный запрет питания или отсутствие аппетита в послеоперационном периоде;
— инфекционные осложнения;
— несвоевременная коррекция сахаропонижающей терапии;
— препараты, назначаемые в процессе оперативного лечения.
Лекарственные препараты, приводящие к ухудшению метаболических процессов у больных сахарным диабетом в процессе оперативного лечения:
— ингаляционные анестетики (эфир, фторотан, энфлюран);
— барбитураты;
— кетамин;
— вазопрессоры и симпатомиметики;
— коллоидные плазмозаменители – ГЭК, производные декстранов (полиглюкин, реополиглюкин, полифер), раствор Гартманна, раствор Рингера-лактат.
Ингаляционные анестетики (эфир, фторотан, энфлюран) повышают концентрацию глюкозы в крови. Барбитураты повышают содержание инсулина в клетках. Кетамин стимулирует функцию поджелудочной железы, но одновременно увеличивает потребность тканей в инсулине.
Применение вазопрессоров и симпатомиметиков у больных сахарным диабетом во время оперативного лечения опасно из-за сопутствующей микроангиопатии, а достижение стабильной гемодинамики во время операции осуществляется благодаря возмещению операционной кровопотери и коррекции нарушений водно-электролитного обмена. Инфузионная терапия не должна включать производные декстранов (полиглюкин, реополиглюкин, полифер), раствор Рингера-лактат, раствор Гартмана, ГЭК, так как в процессе метаболизма этих препаратов образуется много глюкозы, что соответственно ведет к тяжелой гипергликемии.
Предпочтительный выбор лекарственных препаратов во время операционного лечения
• Минимальное воздействие на углеводный обмен оказывают местно-анестезирующие препараты, закись азота, наркотические аналгетики, дроперидол, седуксен, оксибутират натрия, пропофол.
• Среди средств инфузионной терапии предпочтение отдается кристаллоидам или, при необходимости, коллоидам — производным желатина, альбумину по показаниям.
Предпочтительный выбор методов анестезии. При краткосрочных, малотравматичных внеполостных операциях применяют местную анестезию, при необходимости потенцируя ее наркотическими аналгетиками (премедикация промедолом).
• При операциях на нижних конечностях и органах малого таза используют эпидуральную и спинальную анестезию или аналгезию.
• При длительных травматичных, внутриполостных операциях, выполнение которых требует мышечной релаксации и специального положения тела, используют многокомпонентную сбалансированную анестезию с управляемым дыханием.
Выбор метода анестезии: при диабетической вегетативной нейропатии высокая эпидуральная и высокая спинальная анестезия противопоказаны.
Ведение больных сахарным диабетом в периоперационном периоде зависит от следующих факторов:
· условия проведения операции (плановая или экстренная);
· тип СД, предшествовавшее лечение, качество компенсации СД;
· объем и длительность вмешательства;
· вид обезболивания (наркоз, местная анестезия);
· сопутствующие заболевания, в первую очередь тяжесть поздних осложнений СД.
Для снижения операционного риска при сахарном диабете (декомпенсация вследствие хирургического вмешательства, плохое заживление ран, инфекционные осложнения, гипогликемия во время наркоза с тяжелыми последствиями и др.) необходим учет особенностей сахарного диабета, коррекция сахаропонижающей терапии в периоперационном периоде и тесное сотрудничество анестезиолога, эндокринолога и хирурга.
Общие принципы
— Операции у пациентов с сахарным диабетом должны выполняться утром;
— Местная анестезия при сахарном диабете предпочтительнее общей и должна применяться всегда, когда это возможно;
— Большинство средств для наркоза повышают уровень гликемии. У средств для внутривенного наркоза этот эффект проявляется меньше, кроме кетамина (выраженная гипергликемия);
— При любых крупных операциях: контроль гликемии и калия – ежечасно во время операции и каждые 3–6 часов после нее, далее при стабильном уровне гликемии контроль – каждые 6-12 часов в последующие 3–4 суток;
— Достаточное кислородное и энергетическое обеспечение в периоперационном периоде для предотвращения осложнений в виде кето- или лактат ацидоза;
— Обычно применяется интраоперационное введение антибиотиков (из-за риска эндогенного или экзогенного инфицирования при сахарном диабете), особенно у пациентов с признаками системного воспалительного ответа.
Таблица 8. Целевые значения гликемии в периоперационном периоде и в отделении реанимации и интенсивной терапии (ОРИТ)
| Клиническая ситуация | Целевые значения ГПК* | Обоснование |
| Тяжелые больные ОРИТ | 7,8–10 ммоль/л, | Снижение смертности, укорочение сроков госпитализации, уменьшение частоты инфекционных осложнений |
|
Крайне тяжелые хирургические пациенты, кардиохиругические пациенты |
6,1-7,8 ммоль/л |
Уменьшение ранней летальности, числа осложнений, сроков пребывания в ОРИТ и сроков госпитализации, частоты инфекционных осложнений |
*В периоперационном периоде следует избегать тяжелой гипогликемии.
Регионарная анестезия при СД
Методы регионарной анестезии (эпидуральная анестезия или аналгезия, спинальная анестезия, блокада периферических нервов) снижают стрессовую реакцию у пациентов с СД на операционную травму. При инсулинпотребном типе диабета это может помочь в поддержании более стабильного уровня гликемии, а также в снижении стрессовой реакции сердечно-сосудистой системы. При проведении периферических нервных блокад (например, позадилодыжечной блокаде) адреналин не должен использоваться, так как существует риск снижения кровотока в этой области, а у больных с инсулинпотребным типом диабета всегда нарушена микроциркуляция. При блоках с высокой системной адсорбцией, таких как блок плечевого сплетения или межреберный блок, применение адреналина в малых дозах возможно.
Продленная эпидуральная аналгезия является наиболее оптимальным методом послеоперационного обезболивания для больных с СД.
Экстренные и срочные операции
Неотложные операции проводятся чаще всего на фоне декомпенсированного сахарного диабета и цель предоперационной подготовки – достижение максимально возможной компенсации сахарного диабета.
— Смена схемы инсулинотерапии у больных СД1 и отмена ранее применявшихся таблетированных сахароснижающих препаратов с переводом на инсулинотерапию больных с СД2.
— Использование глюкозо-калиево-инсулиновой смеси (ГКИ-смеси) при подготовке к операции и продолжение ее применения в течение 3–4 суток после операции под контролем гликемии и калия крови.
Достаточно распространенным заблуждением является мнение о запрете введения больным с СД растворов глюкозы. Максимум, на что решаются врачи – введение 5% раствора.
Необходимо понимать, что больному с СД, как и любому человеку, требуется получение глюкозы как источника энергии. Наиболее актуально это в периоперационном периоде, когда человек не может питаться энтерально.
Даже у больных без СД в периоперационом периоде часто развивается катаболический синдром из-за недостаточности энергетического обеспечения – в качестве источника энергии начинают использоваться жиры и белки, что приводит к кетоацидозу и гипопротеинемии. Дыхательная или перфузионная недостаточность с повышенным уровнем контринсулярных гормонов приводит к лактат-ацидозу. Это тем более актуально для больных с СД, у которых изначально есть высочайший риск развития всех перечисленных осложнений.
По минимальным расчетам, любой больной (с СД или без него) за сутки должен получать не менее 200 гр глюкозы энтерально или парентерально.
Концентрация вводимого раствора глюкозы зависит от нескольких факторов – осмолярность плазмы, уровень гликемии и необходимый объем и темп инфузии. Принципиальна скорость поступления глюкозы в кровоток, а это зависит от концентрации глюкозы в растворе и от темпа его введения. Можно использовать и 40% раствор глюкозы у больных с СД, но вводить его придется очень медленно – это оправдано при необходимости ограничения объема инфузии. При регидратационной терапии и высокой осмолярности целесообразней введение 5% раствора, т.к. его вводить можно быстро.
Другим моментом, на котором не акцентируют внимание большинство авторов, занимающихся проблемой ведения больных с СД, является контроль за кислородным обеспечением организма. Хорошо известно, что эффективный синтез АТФ зависит от трех составляющих – глюкоза, инсулин и кислород. Даже при достаточном хорошем глюкозо-инсулиновом обеспечении без кислорода будет картина СД и у больного без СД – чаще всего это гипергликемия и лактатацидоз со всеми вытекающими последствиями.
В свою очередь, кислородное обеспечение зависит от двух составляющих – внешнее дыхание и кровообращение. Больные с СД нуждаются в еще более тщательном (чем больные без СД) контроле за эффективностью внешнего дыхания и в соответствующей коррекции (оксигенотерапия, ИВЛ), а также в контроле и в коррекции кровообращения (кардиотоники, вазопрессоры или вазодилятаторы).
— Экстренные и срочные операции у больных с СД при исходной декомпенсации – максимально возможная предоперационная коррекция гликемии, степени гидратации, калия и pH (с использованием принципов лечения декомпенсированного кетоацидоза).
— Диабетический кетоацидоз, прекома и кома, гиперосмолярная гипергликемическая, некетоацидотическая кома являются абсолютным противопоказанием к хирургическому лечению. Исключением являются операции по жизненным показаниям по поводу кровотечений, повреждений внутренних органов, санации мощных источников интоксикации, которые являются причиной декомпенсации состояния больного с СД.
— Операция по другим витальным показаниям может быть проведена только после соответствующих мероприятий, когда к больному вернется сознание, а глюкоза крови снизится до 16,5 ммоль/л, а лучше до 13 ммоль/л и не ранее 4–6 часов после выведения из прекомы или комы.
— Экстренную операцию можно выполнять после ликвидации кетоацидоза и снижения сахара крови до 13,8 ммоль/л.
— Операцию по поводу очаговой гнойной инфекции можно делать при гликемии ниже 13,8 ммоль/л и небольшом кетоацидозе, поскольку добиться большей компенсации диабета обычно не удается, пока не ликвидирован гнойный очаг.
— Симптомы «острого живота» при ДКА могут имитировать хирургические заболевания брюшной полости, но проходят в течение 4 часов после стабилизации гликемии. Если этого не происходит, может потребоваться хирургическое вмешательство для поиска и устранения хирургической патологии.
— Периоперационное ведение — мониторинг гликемии и калия, введение инсулина, глюкозы и калия, контроль за дыханием и кровообращением — как при плановых оперативных вмешательствах.
— При СД2 пациентов, находящихся на пероральных сахароснижающих препаратах переводят на инсулинотерапию (возможно, временно). После возобновления перорального питания и достижения компенсации на базис-болюсной инсулинотерапии возможен переход на пероральные сахароснижающие средства. При признаках неэффективности прежней схемы лечения сахарного диабета (например, длительная декомпенсация до операции на фоне приема таблетированных препаратов) – продолжение инсулинотерапии (с соответствующим обучением пациента).
Интраоперационный период при проведении экстренных и срочных операций у больных с СД
— Интраоперационная гликемия должна быть 8,5–11,0 ммоль/л;
— Необходима постоянная инфузия инсулина короткого действия (ИКД), при уровне гликемии ≥15 ммоль/л, скорость инфузии 0,1 ЕД/кг/час, при уровне гликемии ≤ 15 ммоль/л 0,05ЕД/кг/час, с ежечасным определением уровня гликемии.
— При гликемии 5,5–11,1 ммоль/л вводится ГКИ-смесь (р-р глюкозы 5%-й – 400,0 мл + ИКД 2–4 ЕД/час + KCl 10-20 ммоль). Скорость введения ГКИ-смеси – 400-500 мл в час. Вводиться через дополнительную систему. В основную систему проводиться инфузия или трансфузия со скоростью, определяемой состоянием пациента и другими факторами (уровень исходной дегидратации, кровопотеря и т.п.). Качественный состав – изотонический раствор NaCl, коллоиды при наличии показаний, компоненты или препараты крови при наличии показаний;
— При гликемии > 11,1 ммоль/л в качестве дополнительной инфузии применяют NaCl 0,9 % – 400,0 мл + ИКД 2–4 ЕД/час + KCl 10-20 ммоль. Скорость введения – 400-500 мл в час.
— Интраоперационное введение антибиотиков из-за высокого риска эндогенного или экзогенного инфицирования.
При исходной декомпенсации для периоперационного управления гликемией желательно применять непрерывную внутривенную инфузию инсулина (НВИИ). Алгоритм НВИИ:
— НВИИ проводится через отдельный инфузомат, с применением раствора ИКД с концентрацией 1 ЕД/1мл 0,9 % NaCl (20ЕД инсулина в 20 мл 0,9% раствора NaCl или 50 ЕД инсулина в 50 мл 0,9% раствора NaCl).
— Крайне важно определять гликемию 1 раз в час до ее стабилизации в выбранном целевом диапазоне минимум 4 часа; затем 1 раз в 2 часа в течение 4 часов; в дальнейшем –1 раз в 4 часа. У пациентов в критическом состоянии – 1 раз в час даже при стабильно хорошей гликемии.
Таблица 9.− Средняя начальная скорость НВИИ у взрослых больных СД
|
0,05 ЕД/кг/час |
При компенсации — гликемия < 15 ммоль/л |
| 0,03-0,05 ЕД/кг/час | При дефиците массы тела, почечной, печеночной или хронической надпочечниковой недостаточности |
|
0,1-0,2 ЕД/кг/час |
При выраженной декомпенсации -гликемия >15 ммоль/л, ожирении, инфекциях, хронической терапии стероидами и др. состояниях с инсулинорезистентностью |
Послеоперационное ведение больных СД при проведении экстренных и срочных операций
— Инфузия ГКИ-смеси продолжается в течение 2–4 суток после операции и прекращается после начала энтерального или зондового питания. Количество вводимой глюкозы – не менее 180-200 гр за сутки. Концентрация применяемой глюкозы зависит от расчетного суточного объема жидкости и необходимости введения других инфузионных или трансфузионных сред. Суточный объем потребления жидкости (всего — энтерально, через зонд или парентерально) при устранении дефицита – 30-40 мл/кг.
— Количество вводимого калия – с учетом суточной потребности (1ммоль/кг) и имеющегося дефицита. Скорость введения – не более 20-30 ммоль за час. При гипокалиемии оптимально использовать перфузор для постоянного введения калия;
— Постоянная инфузия ИКД под контролем гликемии и калия крови каждый час в течение 5–8 часов после операции. Далее каждые 3-6 часа в течение 3–4 суток. На 3–4-е сутки после операции (или после начала энтерального питания – больной переводится на дробную инсулинотерапию.
Плановые операции
«Малые» операции, СД2, инсулинНЕпотребный (прием таблетированных препаратов или соблюдение диеты):
— Пациент должен быть 1-ым в очереди на плановое вмешательство.
— При гликемии перед операцией <10 ммоль/л накануне операции соблюдается обычный режим приема препаратов, включая вечернюю дозу.
— При гликемии перед операцией >10 ммоль/л подготовка как при «Больших» операциях (см. далее).
— Голодание с 12 часов по полуночи и прекращение употребления жидкости за 2 часа до операции (можно 400 мл минеральной воды без газа).
— Утром перед операцией пропускается утренний прием сахаропонижающих препаратов. Если пациент оперируется в послеобеденное время, то пациент должен позавтракать и принять утреннюю дозу таблетированных препаратов. Голодание начинается после завтрака. Таблетированные препараты, принимаемые после 12 часов дня, не принимаются. В вечернее время необходимо проконтролировать, чтобы пациент после приема ужина принял таблетированные препараты.
— До вмешательства гликемия определяется за 1 час. Во время операции — через час после начала и через 4 часа после окончания.
— Таблетированные препараты принимаются сразу после приема первой пищи.
«Малые» операции при СД2, инсулинпотребный/ СД2:
— За 1 день до операции соблюдается обычный режим приема препаратов.
— Пациент должен быть 1-ым в очереди на плановое вмешательство.
— В день операции: если уровень гликемии < 7 ммоль/л – утренняя доза инсулина пропускается. Если уровень гликемии > 7 ммоль/л, больной получает половину утренней дозы продленного инсулина.
— В день операции уровень гликемии определяется за 1 час до операции, во время операции ежечасно и через каждые 2 часа до первого приема пищи, после первого приема пищи через 4 часа.
— Если пациент получает инсулин длительного действия, то необходимо перевести пациента на инсулин короткого и среднего действия за несколько дней до операции или уменьшить дозу инсулина длительного действия на ½ накануне операции.
— Первая подкожная доза инсулина принимается с первым приемом пищи. Если пациент начинает принимать пищу с 12 часов по полудню, то первая подкожная доза инсулина составляет половину утренней дозы инсулина.
— Внутривенное введение инсулина требуется пациентам, не соблюдающим диету, если гликемия >14 ммоль/л или при положительном тесте на кетоны в моче или крови (см. ниже «Большие» операции).
— Если все таки пациент оперируется в послеобеденное время, то утром он должен получить ½ утренней дозы подкожно. Прием пищи прекращается после приема завтрака.
— Необходимо проконтролировать, что пациент получил инсулин вечером после приема пищи.
«Большие» операции, все типы диабета:
До операции:
— Пациента необходимо оперировать в первую очередь в списке на плановые вмешательства.
— Уровень гликемии определяется за 1 час до операции. Накануне операции инсулинпотребный пациент соблюдает обычный режим приема инсулина (за исключением пациентов с недостаточно управляемым уровнем глюкозы крови, таким больным может потребоваться дополнительное введение инсулина). В таких случаях, режим введения инсулина будет регулироваться в зависимости от гликемии после приемов пищи, то есть базисно-болюсный график приема инсулина. Такой режим приема инсулина устанавливается за 3 дня до операции.
— В день операции пропускается утренний прием таблетированных сахаропонижающих препаратов или инсулина.
— Голодание с 12 часов по полуночи и прекращение употребления жидкости за 2 часа до операции (можно 400 мл минеральной воды без газа).
Периоперационный период и голодание.
Периоперационный период – это период, относящийся ко времени перед операцией, во время и после неё.
Устойчивый интерес к проблеме периоперационного голодания, особенно у больных сахарным диабетом, предопределяет создание новых рекомендаций по периоперационному голоданию, которые могут быть полезны для анестезиологов. Согласно рекомендациям Cochrane Anaesthesia Review Group (2009г.) к ключевым отнесены следующие моменты предоперационной подготовки: питье прозрачных жидкостей следует поощрять у детей и взрослых вплоть до 2 ч до плановых оперативных вмешательств (включая кесарево сечение). Это способствует устранению дискомфорта и улучшает их самочувствие. Еще один аргумент в пользу смягчения рекомендаций по периоперационному голоданию – то, что пролонгированное голодание пациента нецелесообразно в подготовке организма к воздействию операционного стресса. Длительное воздержание от приема жидкостей оказывает негативное влияние на пациентов, особенно на маленьких детей и пожилых. Прием твердой пищи должен быть запрещен за 6 ч до планового оперативного вмешательства у взрослых и детей.
Для пациентов (включая страдающих сахарным диабетом) питье напитков, богатых углеводами, вплоть до 2 ч до планового оперативного вмешательства является безопасным. Доказательства безопасности получены из исследований продуктов, специально разработанных для применения в периоперационном периоде (преимущественно мальтодекстрины). Питье богатых углеводами напитков перед плановым оперативным вмешательством улучшает самочувствие пациента — уменьшает чувство жажды и голода и устраняет послеоперационную инсулинорезистентность.
Разрешенные в предоперационном периоде напитки обычно не содержат достаточное количество энергии. Значит, рекомендуя пациентам пить прозрачные жидкости вплоть до 2 ч до операции, мы не способны вызывать у них какие-либо значимые изменения в процессах метаболизма. Хорошо изучено влияние назначения углеводов на метаболизм. Ключевые изменения заключаются в развитии инсулинового ответа, идентичного с наблюдаемым после приема пищи. В первую очередь с данной целью применяется внутривенное введение глюкозы. Инсулиновый ответ на введение глюкозы, определяемый скоростью доставки вещества, зависит от дозы препарата. Инфузия глюкозы (с инсулином) индуцирует инсулиновый ответ и устраняет послеоперационную инсулинорезистентность. Это имеет важное значение, так как послеоперационная инсулинорезистентность и гипергликемия ассоциируются с ухудшением исходов после хирургического вмешательства. Пероральная углеводная нагрузка у человека перед операцией устраняет инсулинорезистентность в послеоперационном периоде. В связи с этим диетотерапия представляет собой многообещающую и привлекательную терапевтическую тактику оптимизации уровня гликемии. Одобряя прием углеводов в предоперационном периоде, акцент ставится на безопасности, оказываемых положительных метаболических эффектах, хорошем самочувствии пациентов в периоперационном периоде и сокращении продолжительности наблюдения после операции.
Европейское Общество Анестезиологов (ESA) провело множество исследований с целью сравнения предоперационного голодания с предоперационной подготовкой путем назначения углеводных напитков. В рандомизированных исследованиях не было доказано увеличения объема желудочного содержимого после приема углеводов за 2 часа до индукции в анестезию. У пациентов с сахарным диабетом (обеих типов) назначение в предоперационном периоде за 2-3 часа до оперативного вмешательства богатых углеводами напитков следует считать безопасным в отношении возможного риска гипергликемии или аспирации. Внутривенная инфузия глюкозы не уменьшает чувство жажды или голода так же эффективно, как пероральный прием углеводов, но купирует слабость и утомление.
Во время операции:
— Введение инсулина может потребоваться большинству пациентов, принимающих таблетированные сахаропонижающие препараты.
— Во время операции необходимо добиваться поддержания глюкозы крови на уровне 5-10 ммоль/л.
— Во время операции уровень гликемии определяется ежечасно.
— Инсулин – ключевая инфузия. Инфузию инсулина необходимо начать за 1 час до операции.
— Ели инсулин вводится отдельно шприц-насосом, то на 20 мл физиологического раствора добавляется 20ЕД растворимого инсулина Актрапида, что составит 1ЕД инсулина в 1 мл раствора.
— Если во время операции уровень ГПК <15ммоль/л, то скорость введения инсулина – 0,05ЕД/кг/час массы тела пациента. Если ГПК> 15 ммоль/л, то 0,1ЕД/кг/час.
— Необходимо приготовить так называемый субстратный раствор глюкозы с 0,9% хлоридом натрия -250 мл + 5% глюкоза- 250 мл + 10 ммоль калия хлорида). Скорость инфузии раствора 100 мл/час (≈33 капли в минуту). При повышении уровня ГПК > 15ммоль/л введение глюкозы необходимо приостановить на некоторое время до снижения уровня гликемии 10ммоль/л, затем продолжить инфузию.
— Субстратный раствор должен вводиться параллельно и одновременно с инсулином через У-образный коннектор во избежание рефлюкса инсулина обратно в систему. В случае отсутствия коннектора необходимо вводить инсулин в отдельную вену.
— При отсутствии инфузомата для отдельного введения инсулина, инсулин вводится в 500 мл 5% раствора глюкозы по представленной схеме, скорость введения 100 мл/час.
Таблица − 10. Схема введения инсулина во время операций у пациентов с СД при всех типах СД.
|
ГПК ммоль/л |
Инсулин (ЕД в 500 мл р-ра) | Уровень калия* в крови, ммоль/л | Калия хлорид, ммоль в 500 мл р-ра |
| <4 | 0 | 3 | 10 |
| 4-6 | 5 | <3 | 20 |
| 6-10 | 10 | 3-5 | 10 |
| 10-20 | 15 | >5 | 0 |
| >20 | 20 | >5 | 0 |
| *Если уровень калия в крови неизвестен, то добавляется 10 ммоль калия хлорида на 500 мл р-ра |
— Объем и скорость инфузии должны корригироваться в зависимости от потребностей. Пациентам с сердечной недостаточностью или почечной недостаточностью можно вводить раствор с глюкозой со скоростью не более 50 мл/час.
— Во время операции пациентам может потребоваться дополнительное введение растворов. Эта инфузия проводится в другую вену.
После операции:
— Инфузию инсулина и субстратного раствора глюкозы необходимо продолжать во время транспортировки больного из операционной в палату.
— Контроль гликемии после операции – ежечасно в течение 4-х часов, затем при стабилизации гликемии в пределах 7,8-10 ммоль/л через 2 часа, после этого через 4 часа в первые сутки после операции.
— Инфузия ГКИ-смеси продолжается в течение 2–4 суток после операции и прекращается после начала энтерального или зондового питания. Количество вводимой глюкозы – не менее 180-200гр за сутки. Концентрация применяемой глюкозы зависит от расчетного суточного объема жидкости и необходимости введения других инфузионных или трансфузионных сред. Суточный объем потребления жидкости (всего — энтерально, через зонд или парентерально) – 30-40 мл/кг.
— Количество вводимого калия – с учетом суточной потребности (1ммоль/кг) и имеющегося дефицита. Скорость введения – не более 20-30 ммоль за час. При гипокалиемии оптимально использовать перфузор для постоянного введения калия;
— После операции пациент продолжает получать инсулин по той же схеме, что и во время операции. Инфузия прекращается, когда пациент начинает принимать пищу и пить. Назначается обычная ежедневная дооперационная доза инсулина. Вводится растворимый инсулин (Актрапид), разделенный на 3-4 дозы на 24 часа. В то же время необходимо регулировать дозу инсулина в зависимости от потребности.
— При СД 2, регулируемым приемом таблетированных препаратов или диетой инфузия инсулина прекращается и возобновляется прием таблеток после первого приема пищи.
Гипогликемия
— Определяется у больных в периоперационном периоде как уровень гликемии <4 ммоль/л.
— Наиболее опасное осложнение у пациентов с СД в периоперационном периоде. У пациентов в сознании проявляется профузным потом, бледностью, головной болью, тахикардией, спутанной невнятной речью, прогрессирующей до судорог и комы.
— Могут развиться необратимые изменения в головном мозге.
— Употребление алкоголя, заболевания печени, сепсис могут способствовать гипокликемии. Гипогликемия может быть результатом плохого контроля глюкозы крови при отсутствии оборудования, а также исключением из инфузионной терапии во время и после операции растворов глюкозы.
— Во время анестезии невозможно определить наиболее характерный симптом гликемии – спутанность сознания, также как и другие симптомы. Частое определение гликемии во время операции и соответствующая коррекция − наиболее эффективный способ диагностики и профилактики.
— При снижении уровня гликемии <4 ммоль/л одномоментно надо ввести 30 мл 40% глюкозы внутривенно и повторить введение если уровень гликемии не повысился. Глюкагон per os или внутривенно − это альтернативная, но медленно действующая мера. Если пациент проснулся, можно напоить пациента сладким раствором.
Список литературы
- Farnoosh Farrokhi, Dawn Smiley, Guillermo E. Umpierrez, //Glycemic control in non-diabetic critically ill patients// Journal homepage: www.elsevier.com/locate/beem. Best Practice & Research Clinical Endocrinology & Metabolism 25 (2011) 813–824 .
- Ian Smith, Peter Kranke, Isabelle Murat, Andrew Smith, Geraldine O`Sullivan, Eldar Soreide, Claudia Spies and Bas in`t Veld. ESA Guidelines for preoperative fasting for adults to prevent perioperative complications // Cochrane Database Syst Rev. – 2009.
- Tucker M.T. New ADA Guidelines Focus on ‘Eating Patterns,’ not ‘Diet’. Medscape, October 18,2013.
- Perioperative guidelines for management of diabetes patients. Management of adults undergoing surgery and elective procedures: NHS Diabetes, April 2011. (Joint working party report).
- Perioperative guidelines: NHS Tayside Diabetes Managed Clinical Network Handbook 2011.
- SAMBA Consensus Statement of Perioperative Blood Glucose Management in Diabetic Patients Undergoing Ambulatory Surgery. Girish P. Joshi, MBBS, M.D., FFARCSA. SAMBA Ambulatory Anesthesia Vol. 25, No. 3. July 2010.
- ASA Refresher Course 2008. Perioperative Management of the Diabetic Patient. DanielR. Brown, M.D., Ph.D.
- Perioperative diabetes management guidelines/Australian diabetes society.Australia, July, 2012.
- Р.Б. Базарбекова // Руководство по эндокринологии детского и подросткового возраста.- Алматы: Telman Offset & Print ТОО, 2014-252 с.
- Р.Б. Базарбекова, А.К. Досанова. Основы клинической диабетологии. Обучение пациентов.- Алматы, 2011- 69 с.
- Д.Гарднер, М.И. Шобек Базисная и клиническая эндокринология. Книга 2/Пер. с англ. – М: «Бином», 2013.-696 с.
- Мельниченко Г.А.// Практическая эндокринология. – М: Медицина, 2010. – 317 с.
- П. А. Бакумов, М. В. Левкина// Периоперационное ведение пациентов с сахарным диабетом. Лекарственный вестник. № 6 (46) 2012 Том 6. С.39-47.
- Дедов И.И.,Шестакова М.В.// Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 6-ой выпуск.-М: «Информпалиграф», 2011.-524 с.
- Дедов И.И., Шестакова М.В.// Алгоритмы специализированной медицинской помощи больным сахарным диабетом. – М., 2011.
- Джеймс Дюк. Секреты анестезии// Пер. с англ.; Под общ. Ред. А.П.Зильбера, В.В. Мальцева.- 2-еизд. – М.: МЕДпресс-информ, 2007.-552 с.
- Неймарк М. И. Периоперационный период в эндокринной хирургии. – М: Медицина, 2003. – 336 с.
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.