Журнал Национального научного центра хирургии им. А.Н. Сызганова
127
Наряду с клиническим улучшением отмечена положительная динамика исходно нарушенных функциональных показателей состояния сердечно-сосудистой, дыхательной и нервной систем.
Выявление «скрытой» коронарной недостаточности свидетельствует об ишемической болезни сердца, не диагностируемой ранее.
Включение в план лечебно-реабилитационных мероприятий индивидуально подобранных методов лечебно-восстановительного лечения дало положительную динамику улучшения общего состояния лиц, пострадавших от воздействия ионизирующего излучения.
Литература
A.Н.Окороков «Диагностика болезней внутренних органов», Москва, 2002г.
Ю.Н.Беленков, С.К.Терновой «Функциональная диагностика сердечно-сосудистых заболеваний», Москва, 2007г.
B.Н.Орлов «Руководство по электрокардиографии» Д.М.Аронов, В.П.Лупанов «Функциональные пробы в кардиологии», 2003г.
Л.Р.Зенков «Клиническая электроэнцефалография», Москва, 2002г. В.А.Епифанов «Лечебная физическая культура», Москва, 2001г. Б.Н.Семёнов и др.«Об организации службы медицинской реабилитации», в ж. «Вопросы курортологии физиотерапии и лечебной физической культуры» Москва «Медицина», с.44-47, №2,1998 г.
Причины врачебных ошибок при диагностике туберкулезных спондилитов
ДжайшеваК.Т., Узбекова А.А., Нсанова Б.К., Каймаков К., Умралиева А.М., Баймолдина Л.М., Калдыбаева К.К. ЗКГМУ им. М.Оспанова, КДП №4, КДП №2 г.Атырау, клиника «Сенм», ОПТД г. Актобе
Туберкулезный спондилит занимает первое место среди всех локализаций костно-суставного туберкулеза, составляя 50-60 % от общего числа костнотуберкулезных больных. За последние годы увеличилась частота двойных и тройных локализаций у взрослых, составляющая около 10 % [1]. В Республике Казахстан среди зарегистрированных больных с внелегочным туберкулезом до 30-40% отмечаются осложненные формы в виде нарушения функции спинного мозга, деформации скелета, развития хронической почечной недостаточности, микро-цистиса, нарушения репродуктивной функции у женщин. В республике выявляются осложненные и запущенные формы туберкулеза (г.Алматы — 2 случая; Алматинская — 2случая; ЮКО — 2 случая, Кызылординской, Акмолинской , Восточно-Казахстанской, Павлодарской областях по одному случаю ) . В 2009г выявлено-28 случаев, в 2010г.- 10 случаев. Не снижается уровень инвалидизации больных с внелегочным туберкулезом [2]. Важнейшую роль в своевременной диагностике внелегочных форм туберкулеза играет уровень профессиональной подготовки врачей общей лечебной сети, которые часто допускают ошибки. В результате этого до 60 % внелегочных форм туберкулеза выявляется в запущенной стадии, имеет запущенный и осложненный характер, что приводит к высокому уровню инвалидности — до 56 % случаев [3, 4]. К этой группе относятся больные с костно-суставным туберкулезом, обратившиеся к врачам общей лечебной сети к хирургам, нейрохирургам, ортопедам, травматологам, невропатологам, ревматологам и другим специалистам, состоящих у них на учете по поводу нетуберкулезных заболеваний с частыми обострениями и низкой эффективность проводимого лечения [5].
Цель исследования
— рассмотреть причины, приводящие к ошибкам диагностики туберкулезных спондилитов.
Материалы и методы
Для анализа были взяты истории болезни больных, находившихся на лечении во внелегочном отделении Актюбинского областного противотуберкулезного диспансера за период 2007-2010 гг.
Результаты и обсуждение
Данные свидетельствуют, что по Актюбинской области за период с 2007 по 2010 гг туберкулезный спондилит без сопутствующего легочного специфического процесса был выявлено впервые у 39 (47,6 %) больных из 82 находившихся на лечении. Несмотря на определенную симптоматику туберкулезного спондилита, подкрепленную анамнестическими данными, встречается значительное количество диагностических ошибок. Одной из
Причины врачебных ошибок при диагностике туберкулезных спондилитов. К. Т. Джайшева, А. А. Узбекова, К.Каймаков, Б.К. Нсанова, А.М.Умралиева, Л.М.Баймолдина, К.К. Калдыбаева. ЗКГМУ им. М.Оспанова, КДП №4, КДП №2 г№Атырау, клиника «Сенм»,ОПТД г. Актобе. В статье показаны основные диагностические ошибки, допускаемы врачами общей лечебной сети при выявлении туберкулезного спондиллита: отсутствие настороженности у врачей по внелегочному туберкулезу, даже при наличии контакта с больными активной формой туберкулеза, недостаточное знание клиники туберкулезного спондилита и частое запоздалое применение лучевых методов исследования.
Туберкулездк спондилитт/’н аныцтау кезндег дэргерлк цател/’ктер себептерi. К.Т. Джайшева, А.А. Узбекова, К.Каймаков, Б.К. Нсанова, А.М.Умралиева, Л.М.Баймолдина, К. К. Калдыбаева. М.Оспанов атындагы Б^ММУ, КДП №4, КДП №2 Атырау ц., «Сенм» клиникасы , Актобе ц. ОТ^КД. Мацалада mуберкулездi спондилиттi аныцтау кезндег жалпы емдеу желiсiнде цызмет етет/’н дэр/’герлерд/’н ж/берген нег/’зг/’ цател/’ктер себептер кврсеmiлген: екпеден тыс туберкулез mYрлерiнih^ клиникасына, ауру тархында туберкулездн, белсенд/’ mYрлерiмен цатынасы болган жагдай да мэц бермеу, mуберкулездi спондилитт/’н клиникалыц белглерн аныц блмеу жэне сэулел/к тексеру тэстдер/’н кеш цолдану жатады
основных причин ошибочного диагноза туберкулезного спондилита является укрепившееся представление о спондилите туберкулезной этиологии как о болезни детского возраста, что отвлекает мысль врача от предположения о возможности заболевания позвоночника туберкулезом у взрослого. По данным нашего исследования среди впервые выявленных больных дети и подростки составили 10,3 % (четверо, из них 1- 8 лет, 1- 14 лет и 2 — 17 лет). Взрослые больные составили — 89,7 %, в основном, лица в возрасте 30-39 лет — 21 (53,8 %), 18-29 лет — 9 (23,1 %) и 40-49 лет — 5 (12,8 %) больных. Контакт с больными туберкулезом на момент первичного осмотра отмечали лишь 12,3 % больных.
Клинические проявления туберкулезного спондилита у впервые выявленных больных, проиллюстрированы на таблице № 1. Как показано в таблице №1, классическая сочетанная триада, характерная для туберкулезного спондилита: горб, натечный абсцесс и паралич мышц ног, имел место не у всех исследуемых больных. Так, самый яркий симптом спондилита — гиббус, отсутствовавший у всех взрослых пациентов, был диагностирован только у ребенка 8 лет, т.е. имел место в 2,3 % случаев.
128
Вестник хирургии Казахстана №1, 2012
Таблица №1. Клинические симптомы туберкулезного спондилита у впервые выявленных больных
Клинические симптомы Годы Всего
2007 2008 2009 2010
абс % абс % абс % абс % абс %
Горб — — — — 1 10,0 — — 1 2,3
Натечный абсцесс 6 60,0 12 75,0 5 50,0 5 62,5 28 63,6
Парезы и параличи 2 20,0 2 12,5 3 30,0 2 25,0 9 20,4
Нарушения функции тазовых органов 2 20,0 2 12,5 1 10,0 1 12,5 6 13,7
Итого: 10 100 16 100 10 100 8 100 44 100
В наших исследованиях болевой симптом отмечали 68,2 % больных. Наличие же болей — непременного спутника спондилита — зачастую приводит к ошибочным диагнозам, ибо боли при спондилите весьма схожи с неврологическими корешковыми болями или болями при спондилоартрите. Поэтому, больные обращались к различным специалистам. Так у терапевта наблюдались 4 (10,2 %) , у ВОП — 3 (7,7 %), у невропатолога — 29 (74,4 %), не наблюдались — 3 (7,7 %) впервые выявленных больных. Как видно из выше приведенных данных, 74,4 % больных наблюдались у невропатолога, так как диа-
Медленное, постепенное развитие заболевания, чрезвычайная скудность симптомов в начале процессов заставляют врачей особенно внимательно относиться к анамнестическим данным больных с подозрением на туберкулезный спондилит, главным образом взрослых. Такие симптомы как утомляемость, изменение походки, иррадиирующие, беспричинные боли в животе у детей могут быть признаками туберкулезного спондилита. У взрослых необходимо выяснить профессию, установить наличие в анамнезе таких заболеваний, как ревматизм, радикулит, инфекционные процессы, а также туберкулез других органов.
В наших исследованиях в большей степени были выявлены натечный абсцесс у 63,6 %, парезы и параличи у 20,4 % и нарушения функции тазовых органов отмечались у 13,7 % лиц. Таким образом, важной причиной ошибочных диагнозов, особенно в начале заболевания, могло быть отсутствие у взрослых больных характерного симптома спондилита — гиббуса. Но у взрослых нередко и при большой давности заболевания все же встречаются затруднения при распознавании спондилита, обусловленные отсутствием одного, двух, а иногда и всех трех симптомов. Следует подчеркнуть, что начало спондилита у взрослых часто проявляется как бы мало характерным, типичным для этой болезни симптомокомплексом. В связи с этим правильный диагноз нередко ставится поздно, когда налицо уже имеются значительные разрушения в позвонках и другие симптомы этой тяжелой болезни, т.е появляются локальные боли в определенном отделе позвоночника, что указывает на уже далеко зашедший активный процесс, разрушение кортикального слоя тела позвонка и достигший мягких тканей. Ощупыванием позвоночника (проведение рукой по остистым отросткам) удается обнаружить выступание остистых отростков; при проведении рукой снизу вверх по остистым отросткам улавливается выступающий отросток нижнего пораженного тела (ступенька Менара). Наличие этого симптома подтверждает диагноз туберкулеза позвоночника, который становится несомненным при обнаружении пуговчатого кифоза. При ощупывании длинных мышц спины, легко проводя пальцами по обеим сторонам остистых отростков, удается уловить их напряжение. Надавливание на остистые отростки при туберкулезном спондилите обычно боли не вызывает, но постукивание по остистым отросткам, вызывая волнообразное сотрясение, идущее через дужки до тела, при поражении тела позвонков дает ощущение боли. В самых ранних стадиях проявления туберкулезного спондилита ригидность мышц спины легко обнаруживается у больных, особенно у детей, в лежачем положении. Больного укладывают на стол животом вниз с вытянутыми по бокам руками; врач одной рукой берет согнутые в коленных суставах ноги и приподнимает их кверху; при этом поднимается и нижний сегмент спины, затем он опускает ноги. В это время другой рукой проверяется подвижность остистых отростков. В верхнегрудном отделе ригидность мышц проверяется активным отклонением кзади верхнего отдела туловища или симптомом «вожжей» П.Г.Корнева. Исследование коленных рефлексов, клонусов стоп и надколенника должно обязательно проверяться у больных с подозрением на туберкулезный спондилит, также как исследование всех типичных мест для натечного абсцесса, в которых он может быть обнаружен.
гноз неврологического заболевания, чаще всего остеохондроза какого-либо отдела позвоночника нередко ставился, главным образом, только по одному болевому симптому. Кроме того, ошибочно устанавливались диагноз ишиаса, люмбаго, радикулита и т.д. Сроки наблюдения больных у различных специалистов, до установления диагноза туберкулезного спондилита
□ 1 -1,5 мес до 6мес
□ Сектор 2
□ 1 — 3 года
□ 5 лет и более
Рисунок 1. Сроки наблюдения больных у различных специалистов до установления диагноза туберкулезного спондилита
были следующими, как проиллюстрировано на рисунке 1.
Как следует из данных рисунка №1 у невропатолога до установления диагноза туберкулезного спондилита наблюдались сроком до 1-1,5 мес 10,3 %, до 6 мес — 15,4 %, от 1 года до 3 лет 61,5 % и сроком 5 лет и более 12, 8 % больных. Все больные получили лечение нестероидными противовоспалительными препаратами, витаминотерапию, массаж и другие физиотерапевтические процедуры. У 29,8 % отмечали кратковременное улучшение состояния. Только после лучевых методов исследования (рентгенография и КТ позвоночника), которые были назначены сразу после первого посещения 5 (12,8 %), через 1 год наблюдения и лечения — 21 (53,9 %), через 2 года — 6 (15,4 %), через 3 года — 4 (10,3 %) и через 5 лет — 3 (7,7 %) больных. Диагноз туберкулезного спондилита был выставлен в основном после рентгенологического обследования сразу 15 38,5 % больным, уточнен после исследования компьютерной томографией у 27 (69,2 %) больных
Таким образом, основными причинами диагностических ошибок при выявлении туберкулезного спондилита явились отсутствие настороженности у врачей ПМСП по внелегочному туберкулезу, даже при наличии контакта с больными активной формой туберкулеза, недостаточное знание клиники туберкулезного спондилита и частое запоздалое применение лучевых методов исследования после неоднократной неэффективной терапии остеохондрозов, ишиасов, люмбаго и т.д.
Литература
1. Левашев Ю.Н., Репин Ю.М. Руководство по легочному и внелегочному туберкулезу. — СПб. ЭЛБИ-СПб. -2006. — С.262-273.
2. Справка по внелегочному туберкулезу на селекторном совещании 14.06.2011 г.
3. Аксенова В.А., Шилова В.М., Хрулева Т.С. Пособие для специалистов общей лечебной сети по своевременному выявлению туберкулеза. — М., 1996
4. Исмаилов Ш.Ш., Дюсембаев А.К. Своевременная диагностика, комплексный мониторинг на уровне ПМСП, рациональное хирургическое лечение туберкулеза костей и суставов. // Фти-зиопульмонология. — 2007. — №1 (11). С.40-42.
5. Иванов В.М., Кучинский К.В., Кутулуцкая Т.В. Дифференциальная диагностика туберкулеза позвоночника.//Фтизиопульмо-нология.- 2010.- №1(16). — С.36-38.
Туберкулез органов дыхания – одна из самых актуальных проблем здравоохранения в мире и в Российской Федерации. Заболеваемость населения РФ туберкулезом с 1991 г. увеличилась на 150% и в 2002 г. составила 88,1 на 100 тыс. населения. Смертность от туберкулеза увеличилась за этот период почти в 3 раза [1]. Высок процент поздней диагностики туберкулеза легких в лечебных учреждениях общей лечебной сети. В этих случаях только у около 20% больных туберкулезом легких заболевание диагностируют в первые 2–3 недели заболевания, а у остальных 80% – в сроки от 1 до 3 мес. Расхождение диагнозов по туберкулезу у умерших в нетуберкулезных больницах достигает 80% и более. По данным А.Г. Хоменко, особенно часты диагностические ошибки при абациллярных формах туберкулеза. Известно также, что у больных активным туберкулезом органов дыхания микобактерии туберкулеза в мазках мокроты в первые 2–3 недели болезни нередко не обнаруживаются, особенно у больных казеозной пневмонией, и при отсутствии деструктивных изменений в легких [2].
Поскольку основой диагностики туберкулеза служит обнаружение микобактерии туберкулеза (МОТ), приведем сравнительную характеристику методов их обнаружения. При бактериоскопии мазка, окрашенного по Цилю–Нильсену, МБТ могут быть обнаружены при наличии не менее 100.000 –1.000.000 бактериальных клеток в 1 мл патологического материала. Такое значительное количество МБТ встречается при распространенных, преимущественно легочных формах заболевания (диссеминированная, фиброзно–кавернозная, цирротическая). Методы накопления (флотация) повышают выявляемость МБТ по сравнению с обычной микроскопией на 10%. Люминесцентная микроскопия при туберкулезе в настоящее время является эффективным бактериоскопическим методом лабораторной диагностики, широко применяющимся в микробиологических лабораториях Российской Федерации. Чувствительность метода люминесцентной микроскопии 10.000 – 100.000 МБТ в 1 мл материала [8].
Культуральный метод выявления МБТ дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что МБТ являются в основном медленно растущими организмами и рост их колоний наблюдают в течение 2–3 месяцев. Для увеличения результативности культурального метода рекомендуется применять посев материала одновременно на две–три различных питательных среды. Продолжительность роста МБТ ограничивает диагностические возможности клиницистов. МБТ выявляются лишь при 52–65% случаев активного туберкулеза легких, а в клинике внелегочного туберкулеза удельный вес их выявления еще ниже. Значительные трудности представляет обнаружение микобактерий у лиц со скудным их выделением. Среди впервые выявленных больных у одной трети бактериовыделение является однократным. Культуральный метод позволяет проводить определение чувствительности и устойчивости МБТ к противотуберкулезным антибиотикам [8].
За рубежом широкое распространение получила радиометрическая система ВАСТЕС для быстрого обнаружения живых МБТ в жидкой питательной среде. Микобактерии культивируют в жидкой ВАСТЕС–среде, где в качестве источника углерода используется меченая 14С пальмитиновая кислота. При положительных данных бактериоскопического исследования рост МБТ обнаруживали радиометрически на 7–10–й день и на 14–21–й дни при отрицательных данных. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся: высокая себестоимость исследования; необходимость применения радиоактивных изотопов и специального радиометрического оборудования, сложность работы с изотопной технологией; необходимость дополнительного посева на плотную питательную среду при возникновении проблем с идентификацией или интерпретацией результатов.
Метод ПЦР основан на ферментативной амплификации выбранных специфических участков генома бактерий рода Mycobacterium tuberculosis, их дальнейшей детекции и идентификации. Аналитическая чувствительность метода очень высока и соответствует выявлению 1–10 бактериальных клеток. Чувствительность метода достигает 74–92%, специфичность 92–100%. На эффективность ПЦР–анализа существенным образом влияет метод обработки клинического материала [3]. В ПЦР–диагностике туберкулеза для исследований обычно используют мокроту, промывные воды бронхов, бронхиальные аспираты, плевральную жидкость, мочу, спинномозговую жидкость, кровь, биоптаты лимфоузлов и других тканей.
Если у пациента не удается обнаружить МБТ при стандартном обследовании, проводится дальнейший диагностический поиск, включающий патоморфологическое исследование материала, полученного при биопсии пораженного органа, при котором подтверждением диагноза служит выявление туберкулезной гранулемы с казеозным некрозом, эпителиодными клетками, лимфоцитами, гигантскими многоядерными клетками Пирогова–Лангханса.
Как уже было сказано выше, в настоящее время растет число больных с острыми формами туберкулеза органов дыхания. По данным Челноковой О. (2003г.) , среди впервые выявленных больных туберкулезом органов дыхания число остро прогрессирующих форм составило 35%, у 7% была казеозная пневмония.[7].
Приводим наше наблюдение.
Больная К., 52 лет, поступила в клинику госпитальной терапии ММА имени И.М. Сеченова 01.03.05 с жалобами на выраженную слабость, одышку при минимальной физической нагрузке, разговоре, надсадный приступообразный кашель с выделением желто–зеленой мокроты до 50 мл за сутки, усиливающийся ночью, повышение температуры тела до 38°С, кожный зуд, отсутствие аппетита, похудание на 12 кг за год.
Из анамнеза жизни: Родилась 13 августа 1953 г. в Тамбовской области. В детстве от сверстников в физическом развитии не отставала. Образование высшее – закончила Волгоградский Медицинский институт. Работала врачом–терапевтом. С 1989 года живет в Москве. До 2004 года работала терапевтом–реабилитологом в отделении реабилитации инвалидов центра социального обслуживания. Замужем, имеет 2 сыновей (23 и 16 лет). Вредные привычки отрицает. Менструации с 14 лет, регулярные, необильные, безболезненные. Было 7 беременностей, из них 3 родов, 4 медицинских аборта. Менопауза в 46 лет. Из перенесенных заболеваний: в детстве – частые ангины, ОРВИ, корь, паротит. В 7 лет перенесла туберкулезный бронхоаденит, по поводу чего в течение года принимала противотуберкулезные препараты. В последующем к фтизиатру не обращалась. Аппендэктомия в 20 лет, тонзиллэктомия в 25 лет. Миопия средней степени. Отец умер в 92 года от острого нарушения мозгового кровообращения, мать умерла в 47 лет от рака желудка. Сестра 45 лет – практически здорова. Дети: первый сын трагически погиб, второй сын 23 лет здоров, у третьего сына 16 лет несахарный диабет. Аллергологический анамнез не отягощен.
Из истории заболевания: с 37 летнего возраста пациентка страдала первичным билиарным циррозом. С 1997 г. наблюдается в клинике госпитальной терапии ММА имени И.М. Сеченова, где диагноз первичного билиарного цирроза был подтвержден морфологически. По данным обследования в это время в анализах крови уровень щелочной фосфатазы (ЩФ) и гамма–глутамилтранспептидазы (Г–ГТ) превышал норму в 10 раз, АЛТ и АСТ в 3 раза, также отмечалась анемия (Нв 80–90 г/л), ускорение СОЭ до 50–60 мм/ч. Проводилась терапия урсофальком, сеансы плазмафереза, однако активность заболевания оставалась постоянно высокой: сохранялись синдром цитолиза, холестаза. С 2001 г. выявляется варикозное расширение вен пищевода 2–3 ст., синдром печеночно–клеточной недостаточности. Пациентка продолжала принимать урсофальк, соблюдала диету, чувствовала себя относительно удовлетворительно, кожный зуд был незначительным. Отмечала постепенное снижение массы тела, к концу 2003 года масса тела составляла 58–60 кг.
Резкое ухудшение состояния с декабря 2003 г., когда после переохлаждения появился кашель с гнойной мокротой, эпизод кровохарканья, лихорадка до 38°С. Пациентка была госпитализирована в отделение реанимации и интенсивной терапии (ОРИТ) городской больгницы по месту жительства, где диагностирована двухсторонняя плевропневмония с локализацией инфильтрации в нижней доле слева и верхней и нижней долях справа. Консультирована фтизиатром – туберкулез был отвергнут. Проводилась терапия антибактериальными препаратами, трихополом. Температура тела нормализовалась в течение недели, однако кашель и одышка сохранялись, пациентка похудела на 7 кг. В марте 2004 г. в связи с появлением бронхообструктивного синдрома была госпитализирована в городскую больницу. При исследовании функции внешнего дыхания выявлено снижение показателей жизненной емкости легких, вентиляционные нарушения по обструктивному типу, проба с бронхолитиками отрицательная. Проводилась терапия фликсотидом, вентолином – без существенного эффекта. В апреле вновь отмечаются подъемы температуры тела до 38–39°С, самостоятельно лечилась линкомицином и пефлоксацином в течение 5 дней, температура снизилась до субфебрильных цифр, но одышка и кашель сохранялись на прежнем уровне. Была вновь госпитализирована в городской стационар, где диагносцирован хронический бронхит, проводимая терапия не известна. После выписки сохранялась и нарастала выраженная слабость, кашель с гнойной мокротой, одышка при небольшой нагрузке, субфебрильная температура тела с периодическим повышением до фебрильных цифр, иногда озноб, потливость. В конце июня была госпитализирована в клинику госпитальной терапии им. А.А. Остроумова.
При обследовании было выявлено: в анализах крови: анемия, ускорение СОЭ, снижение альбумина, выраженный синдром холестаза, цитолиза, печеночно–клеточной недостаточности. В мокроте: лейкоциты покрывают все поля зрения. Candida. При компьютерной томографии (КТ) легких: справа во 2 сегменте плотные очаги, в 4 сегменте на фоне ограниченного фиброза – плотные очаги, уплотнение междолевой плевры справа; слева в 3 сегменте участок ограниченного фиброза; в корне правого легкого визувализируется мягкотканный конгломерат, отмечается уменьшение объема и уплотнение легочной ткани 2 и 6 сегментов, просвет 2 бронха не визуализируется, просвет 6 бронха резко сужен и деформирован; конгломерат интимно прилежит к костальной и медиастинальной плевре; субплеврально справа в 6 сегменте – неправильной формы округлое образование 17мм, связанное с конгломератом; жидкости в плевральных полостях не определяется; структуры средостения и корней легких дифференцированы; признаков лимфаденопатии не выявлено. В клинике проводился дифференциальный диагноз между воспалительным процессом в правом легком (возможно, грибковой этиологии), туберкулезом, опухолью правого бронха. Проводилась дезинтоксикационная терапия, урсофальк, цефтриаксон. Однако пациентка отказалась от продолжения обследования и противомикробной терапии и была выписана по собственному желанию. Диагноз оставался неясным.
За последующие 4 месяца отмечалось усиление ночного кашля с выделением слизисто–гнойной мокроты, нарастание одышки (вплоть до одышки при разговоре, в покое), периодически лихорадка до 38–39°С, выраженная общая слабость, отсутствие аппетита, дальнейшее похудание. В начале ноября отметила появление плотного округлого болезненного образования в подчелюстной области слева. Самостоятельно принимала антибиотики без особого эффекта. 25 ноября 2004 г. была госпитализирована в клинику госпитальной терапии им. А.А. Остроумова. Больная поступила в крайне тяжелом состоянии: кахексия, масса тела 38 кг. Кожные покровы бледные, сухие. В подчелюстной области справа пальпируется болезненное округлое образование плотноэластической консистенции, над легкими дыхание ослаблено, в нижних отделах с обеих сторон крепитация, тоны сердца приглушены, ритм правильный, ЧСС 90 в мин, АД 95/60 мм рт.ст., живот мягкий, безболезненный, печень на 1 см выступает из–под края реберной дуги, отеков нет. В связи с нарастанием дыхательной недостаточности 28 ноября пациентка была переведена в ОРИТ ГТК. При обследовании: в анализе крови отмечалась анемия Нв 107 г/л, лейкоцитоз до 24 тыс., относительная лимфопения, ускорение СОЭ до 35 мм/ч, снижение альбумина до 2,7 г/л, холинэстеразы до 1012 МЕ/л (норма 5600–12900), повышение уровня ЩФ 1590 ед/л (норма 98–274), Г–ГТ 323 ед/л (5–61), АСТ 52 ед (0–40), АЛТ 48 ед (0–400, общего билирубина 2,0 мг/дл (0,2–1,0). При компьютерной томографии легких выявлено: в легких в ранее обнаруженном конгломерате в области 2 и 6 сегментов справа определяются полости распада размером 25–28 мм; слева определяется участок консолидации легочной ткани, занимающий практически полностью 8 сегмент и частично 9 и 10; просветы бронхов в данном участке прослеживаются; в области этих изменений в 9 и 10 сегментах определяется снижение воздушности легочной ткани по типу «матового стекла» и усиление легочного рисунка; обширные участки консолидации, снижения воздушности легочной ткани и усиления легочного рисунка определяются преимущественно в язычковых сегментах слева, а также в средней доле, в 3 и 6 сегментах справа; лимфоузлы средостения умеренно увеличены в количестве. Заключение: По сравнению с предыдушими данными наблюдается отрицательная динамика в виде появления обширных участков консолидации и снижения воздушности легочной ткани; формирования полостей в ранее обнаруженных учасках уплотнения легочной ткани. К дифференциально–диагностическому ряду рекомендовано добавить бронхиолит с пневмонией, аспирационную пневмонию, саркоидоз (альвеолярный саркоид), менее вероятно наличие бронхиоло–альвеолярного рака. На ЭКГ: синусовая тахикардия с ЧСС 110 в мин; блокада передней ветви левой ножки пучка Гиса; перегрузка правого предсердия. При УЗИ органов брюшной полости: печень не увеличена, умеренно неоднородная, внутрипеченочные желчные протоки не расширены, воротная вена до 8 мм; желчный пузырь не увеличен, обычной формы, стенки плотные, камней нет; поджелудочная железа не увеличена, умеренно неоднородная, уплотнена; селезенка 116х46 мм; почки расположены низко, нормальных размеров (до 110х48 мм), толщина паренхимы до 12 мм; патологических образований не выявлено; в целом эхогенность паренхимы почек повышена; убедительных данных за наличие лимфатических узлов в брюшной полости не получено.
30 ноября проведена пункция образования подчелюстной области слева, получено 30 мл сливкообразного гноя. В цитограмме картина воспаления, в посеве выявлен рост Staphylococcus aureus 107 (MSSA), Candida 103. Больной проводились повторные санационные фибробронхоскопии (ФБС). При ФБС: просвет трахеи свободный, слизистая бледная, атрофичная, взята биопсия из верхне–долевого бронха слева и справа, браш–биопсия из нижних отделов. В цитограмме бронхиального смыва – клетки пролиферирующего бронхиального эпителия с элементами атипии на фоне воспаления; в посеве выявлен рост Acinetobacter anitratus – 103, чувствительный к левофлоксацину и ципрофлоксацину, Candida – 103. В повторных посевах – рост Candida. Браш–биопсия – клетки бронхиального кубического эпителия, макрофаги, лейкоциты до 20 в п/зр (нейтрофилы, лимфоциты). Биопсия бронха – стенка бронха с явлениями склероза и воспалительной инфильтрации; в прилежащей легочной паренхиме явления неспецифического интерстициального фиброза и слабо выраженная лимфо–гистиоцитарная инфильтрация. В бронхиальном смыве и в жидкости бронхо–альвеолярного лаважа методом ПЦР ДНК микобактерий туберкулеза (МБТ) не обнаружена. В повторных анализах мокроты при микроскопии микобактерии не обнаружены. Однократно в посеве крови выявлен рост E.coli, в связи с чем обсуждался вопрос развития септицемии. Тем не менее в связи с сохраняющимся подозрением на туберкулезную этиологию процесса пациентка неоднократно консультирована фтизиатром. Консультация фтизиатра: «Учитывая длительность заболевания, сохранение инфильтративных изменений в легких с обеих сторон, сохранение полостей деструкции, нельзя исключить специфическую природу заболевания. Рекомендовано: повторное исследование мокроты на микобактерии туберкулеза, повторная рентгенография, компьютерная томография легких в динамике».
Несмотря на ингаляции увлажненного О2, продолжалось нарастание явлений дыхательной недостаточности: состояние больной было тяжелым: отмечалось частое поверхностное дыхание с частотой до 40 и более в мин, угнетение сознания. В связи с этим 29 ноября больная была интубирована и переведена на искусственную вентиляцию легких, требовавшую медикаментозной седации. По мере компенсации состояния к 5 декабря введение седативных препаратов было прекращено. Учитывая компенсацию клинических признаков дыхательной недостаточности, а также положительную рентгенологическую динамику, с 7 декабря проводились попытки перевода больной на самостоятельное дыхание. Однако они оставались безуспешными: при уменьшении количества аппаратных дыханий у больной развивалось тахипноэ до 25–30 в мин и происходило быстрое истощение больной. 10 декабря проведена трахеостомия, и продолжена ИВЛ через трахеостомическую трубку. Течение заболевания осложнилось развитием ДВС–синдрома, проводилась трансфузионная терапия, переливание свежезамороженной плазмы, альбумина. Проводилась массивная антибактериальная терапия со сменой антибактериальных препаратов с учетом результатов посева и определения чувствительности (левофлоксацин + ванкомицин, имипинем, амоксициллин/клавуланат + амикацин), противогрибковая терапия (флуконазол), бронхолитическая, муколитическая, иммунокорригирующая терапия. На фоне проводимой терапии состояние улучшилось, и с 12 декабря ее удалось перевести на самостоятельное дыхание с ингаляцией увлажненного кислорода через трахеостомическую трубку, а с 18 декабря показатели газов крови сохранялись в пределах нормы без ингаляции кислорода. При контрольной компьютерной томографии легких отмечалась некоторая положительная динамика в виде уменьшения консолидации легочной ткани нижней доли левого легкого и формирования полостей в передне–базальных участках с обеих сторон. В результате проведенного обследования с учетом характера течения заболевания диагноз был сформулирован следующим образом: хронический абсцесс средней доли правого легкого с абсцедированием и развитием деструктивной пневмонии обоих легких бактериально–грибковой этиологии. Септицемия. Абсцесс подчелюстной области слева. ДВС–синдром. Дыхательная недостаточность 2–3 ст., продленная ИВЛ. Состояние после трахеостомии от 10.12.2004 г. – хронический слизисто–гнойный бронхит в фазе обострения. Первичный билиарный цирроз, умеренно активный, субкомпенсированный. Портальная гипертензия. Варикозное расширение вен пищевода 2 ст. Печеночно–клеточная недостаточность. Вторичный иммунодефицит. Кахексия. В дальнейшем пациентка была переведена в отделение пульмонологии, где продолжалась антибактериальная (амоксициллин/клавуланат, затем цефепим) и противогрибковая терапия, вводился пентаглобин, гепатопротекторы, свежезамороженная плазма. На фоне проводимой терапии сосотояние несколько улучшилось: нормализовалась температура, уменьшился кашель, пациентка стала передвигаться в пределах палаты. Больная была выписана домой под наблюдение участкового терапевта с рекомендациями продолжить антибактериальную терапию. Но несмотря на это в феврале вновь отмечаются подъемы температуры до 38°С с ознобом, усиление кашля, нарастание одышки и слабости.
В марте 2005 г. пациентка госпитализирована. В повторных анализах мокроты МБТ не обнаруживаются. В отделении проводилась терапия амикацином в течение 2 недель. При микологическом исследовании мокроты выявлен рост Candida albicans и Candida fland в высоком титре, резистентных к флуконазолу и чувствительных только к амфотерицину В. Учитывая деструктивный характер изменений при компьютерной томографии легких, результаты микологического исследования, 14 марта была начата терапия амфотерицином В. Однако в связи с плохой переносимостью, нарастанием гипокалиемии препарат был отменен, продолжена терапия фунгизоном. Продолжалось введение свежезамороженной плазмы, иммуноглобулина, альбумина, гепатопротекторов. В связи с отсутствием динамики в состоянии пациентка заочно была консультирована фтизиатрами: «Туберкулезная природа изменений в легких маловероятна так как: отсутствуют данные за перенесенный туберкулез, остаточные изменения туберкулеза органов дыхания на КТ; повторная микроскопия мокроты и бронхиальных смывов на выявление МБТ при наличии множественных полостей деструкции в обоих легких, исследование мокроты на ДНК МБТ методом ПЦР дали отрицательный результат; лечение антибиотиками широкого спектра в 2004 г. привело к интенсивному улучшению распространенных полисегментарных изменений (инфильтратов) в обоих легких. Целесообразно дополнительно провести исследование мокроты на МБТ методом микроскопии и посева». Течение заболевания осложнилось развитием левостороннего пневмоторакса, проводились пункция и дренирование плевральной полости. В связи с отрицательной динамикой по КТ легких начата антибактериальная терапия ципрофлоксацином и ванкомицином, но в связи с неэффективностью в течение последующих дней получала линезолид. 7 апреля рецидив пневмоторакса. При контрольной КТ: в области 9 сегмента левого легкого наблюдается появление участка инфильтрации легочной ткани размером 40х30х56 мм; также участок инфильтрации 8х16х29 мм определяется слева в 3 сегменте. Воздуха в полости плевры не обнаружено. Пациентка была выписана домой с диагнозом: «Двухсторонняя деструктивная пневмония смешанной этиологии (стафилококковая, кандидозная), тяжелого течения с образование множественных полостей. Рецидивирующий пневмоторакс слева от 27.03.05 и 07.04.04. Диффузный и очаговый пневмофиброз. Вторичная легочная гипертензия. Дыхательная недостаточность 3 стадии. Состояние после трахеостомии от 10.12.04 г. Хронический слизисто–гнойный бронхит в фазе обострения. Первичный билиарный цирроз 3–4 стадии. Печеночно–клеточная недостаточность 2 степени по Чайлд–Пью. Кахексия. Вторичное иммунодефицитное состояние. Энцефалопатия смешанного генеза 2 ст, астено–вегетативный синдром, вестибулопатия».
Однако на следующий день в связи с повторным пневмотораксом была госпитализирована в городскую больницу. Со слов родственников известно, что в стационаре была отменена антибактериальная терапия, назначены системные глюкокортикостероиды, который получала в течение месяца – практически без эффекта. Была выписана домой. 12 июля пациентка скончалась дома. Труп был доставлен в патолого–анатомическое отделение больницы.
Из протокола вскрытия: «В просвете гортани и трахеи гноевидное содержимое. Слизистая оболочка дыхательных путей серо–розовая, без кровоизлияний. Левое легкое воздушной консистенции. На разрезах ткань левого легкого темно–красная, с поверхности разрезов выдавливается пенистая розовая жидкость, из сосудов вытекает жидкая кровь. На поверхности разреза в ткани левого легкого определяются множественные серовато–желтоватые участки без четких границ, творожистой консистенции, размерами до 3х2, 5х2 см, с полостями, заполненными гноем, без четкой капсулы. В верхней доле правого легкого – участок светло–серо–желтого цвета, размерами 6,5х5х3 см, не связанный с крупными бронхами, с нечеткими границами, мягко–эластической консистенции. В остальной ткани правого легкого множественные участки творожистой консистенции, размерами 2,5х5х2 см, светло–серовато–желтоватого цвета, без четких границ, а также полости диаметром до 2 см, заполненные гноем. В обоих легких множественные сливающиеся мелкие зернистые очаги с гноевидным отделяемым. Лимфатические узлы корня легкого уплотнены, размерами до 3,5х2,5х2 см, ткань на разрезах черная, с серовато–желтыми включениями. Пристеночная плевра не утолщена, тонкая, гладкая, блестящая».
Результаты патогистологического исследования: «Легкие – множественные очаги казеозного некроза, часть их без демаркационной зоны. Прилежащие к зоне казеозного некроза альвеолы заполнены фибринозным экссудатом. Часть очагов казеозного некроза со слабо выраженной капсулой, представленной рыхлыми пучками соединительной ткани, диффузно–инфильтрированной лимфоидными элементами. В отдельных участках – эпителиоидные клетки, гигантские клетки инородных тел и Пирогова–Лангханса. Лимфатические узлы корня правого легкого – лимфоидные фолликулы единичные мелкие, без светлых центров. В– и Т–зоны опустошены. Диффузно в препарате лимфоциты. Единичные эпителиоидно–гигантоклеточные гранулемы без явлений казеоза и фиброзирующиеся гранулемы»
Патологоанатомический диагноз: «Основное заболевание: Инфильтративный туберкулез верхней доли правого легкого с кавернизацией. Полисегментарная казеозная пневмония в верхней доле правого легкого. Диссеминация – множественные очаги казеозного некроза в обоих легких. Казеозный некроз лимфатических узлов корня правого легкого. Осложнения: Отек головного мозга. Малокровие органов. Смешанные свертки крови в полостях сердца и крупных сосудах. Дистрофические изменения миокарда, почек. Кахексия. Сопутствующие заболевания: Атерокальциноз аорты. Мелкоузловой цирроз печени. Склероз поджелудочной железы. Остеопороз».
Анализируя данный клинический случай, хочется отметить изначально имевшуюся у врачей настороженность в отношении туберкулеза. Несмотря на повторные отрицательные результаты обнаружения МБТ в мокроте, неспецифическую картину воспаления, полученную при биопсии бронха, и отрицательные результаты ПЦР, сомнения в отношении туберкулезной этиологии процесса оставались до последних дней пребывания больной в стационаре. Особенностью данного случая является отсутствие выделения МБТ даже в той стадии заболевания, когда по данным КТ имелись признаки деструкции легочной ткани. Возможно, это было обусловлено проведением массивной антибактериальной терапии, включавшей препараты, обладающие туберкулостатическим действием (фторхинолоны II поколения и аминогликозиды). Существенным фактором, повлиявшим на ошибку в диагностике было повторное выявление роста бактериальной (золотистый стафилоккк, ацинетобактер) и грибковой флоры в посевах бронхиальных смывов и мокроты. Остается неясным вопрос о сроках развития у больной такой формы туберкулеза, как казеозная пневмония. Кажется маловероятным, что пациентка страдала этой формой туберкулеза в течение всего периода заболевания. Возможно, она развилась уже в терминальной стадии, когда иммунодефицитное состояние усугубило назначение системных глюкокортикостероидов.
По данным Мишина В.Ю., основными причинами диагностических ошибок туберкулеза легких в лечебных учреждениях общей медицинской сети являются: неполно собранный фтизиатрический анамнез, связанный с недостаточной настороженностью в отношении туберкулеза; неправильная оценка и интерпретация клинических проявлений туберкулеза легких в современных эпидемических условиях; неправильная трактовка рентгенологических изменений в легких и отсутствие рентгенологического контроля через 7–10 дней лечения пневмонии; отсутствие или однократное исследование мазков мокроты на микобактерии туберкулеза по Цилю–Нильсену; обзорная бронхоскопия без взятия биопсийного материала; тяжелая сопутствующая патология. Наибольшее число диагностических ошибок отмечается при инфильтративном туберкулезе легких и казеозной пневмонии [4,7].
Казеозная пневмония – это форма вторичного туберкулеза легких, характеризующаяся быстрым развитием и распространением казеозно–некротических изменений в легких в условиях выраженного иммунодефицита и бурного размножения микобактерий. Клинически она проявляется остро прогрессирующим течением с неуклонным усилением интоксикационного, бронхопульмонального синдромов, рентгенологически в легких выявляется поражение 3 и более сегментов, лабораторными признаками иммунодефицита, выраженными метаболическими нарушениями. Госпитализация подавляющего большинства больных казеозной пневмонией (до 86%) в общесоматические стационары определяется наличием «масок» заболевания и тяжелым состоянием больных при обращении за медицинской помощью. Дифференциальный диагноз наиболее часто приходится проводить с сепсисом, гангреной, абсцессом легкого, деструктивной пневмонией [5]. Высокая смертность (60–80%) определяется не только тяжелым, прогрессирующим течением, но и поздним началом противотуберкулезной терапии. При позднем начале она бывает неэффективна вследствие значительного объема поражения легочной ткани и развития выраженных полиорганных нарушений. Неуклонное увеличение объема поражения легочной ткани, которое носит необратимый характер, прогрессивное ухудшение состояния определяют сроки диагностики казеозной пневмонии в течение 1–2 недель как критические. По истечении данного периода в случае отсутствия эффекта от проводимой терапии, отрицательных результатов исследований мокроты на МБТ при сохранении подозрения на казеозную пневмонию целесообразно начинать комплексную противотуберкулезную терапию [6].
В последнее время все чаще врачам терапевтических стационаров приходится сталкиваться с различными формами туберкулеза органов дыхания, протекающими атипично, без бактериовыделения. Настороженность в отношении туберкулеза, тщательный клинико–анамнестический анализ, повторные лабораторные и инструментальные исследования для подтверждения специфической этиологии процесса позволяют своевременно диагностировать туберкулез и направить больного в противотуберкулезный стационар для проведения специфической терапии. С другой стороны, всегда нужно помнить о возможности и необходимости проведения в определенных случаях пробной противотуберкулезной терапии.
Литература:
1. Трифонова А.Ю., Стаханов В.А. Медико–социальные и психологические аспекты заболеваемости населения туберкулезом в современных условиях. // Российский медицинский журнал, №5, 2005 г. с.9–11.
2. Хоменко А.Г. Туберкулез: Руководство для врачей. М., 1998 г.
3. Вишневская Е.Б. Особенности выделения ДНК для ПЦР при туберкулезе внелегочных локализаций. // Проблемы туберкулеза. № 5, 1998 г., с.23–26.
4. Мишин В.Ю., Дейкина О.Н., Назарова Н.В. Дифференциальная диагностика туберкулеза легких и внебольничной пневмонии. // Консилиум медикум, т.6, № 4, 2004 г., с.232.
5. Степанян И.Э. Вопросы диагностики и дифференциальной диагностики туберкулеза органов дыхания в современных условиях. //РМЖ, т.7, №17, 1999г. с.836.
6. Кибрик Б.С., Челнокова О.Г. Проблемы диагностики и лечения казеозной пневмонии. // Пульмонология, т. 13 № 4, 2004 г. с.41–44.
7. Даниляк И.Г. Трудный диагноз болезней органов дыхания. «Русский врач», М., 2005 г. С. 48–70.
8. Козулицына Т.И. Микробиологические исследования./ В руководстве для врачей: Туберкулез органов дыхания. М.,1981 г.– с.136–149.
Пневмония – это воспалительное заболевание легких, которое может иметь бактериальное, вирусное или грибковое происхождение. Для подбора адекватного лечения необходимо правильно и своевременно установить диагноз.
В некоторых случаях симптомы пневмонии могут совпадать с другими заболеваниями органов дыхания, однако методы их лечения будут отличаться. В этом случае врачу необходимо провести дифференциальную диагностику для уточнения диагноза. Для получения качественного обследования рекомендуется обратиться в Юсуповскую больницу.
Таблица возбудителей
Дифференциальная диагностика пневмонии позволяет точно поставить диагноз для назначения необходимой терапии. При подборе препаратов обязательно учитывается причина развития заболевания. Ниже представлена таблица с основными возбудителями воспаления легких и как они проявляются:
|
Тип возбудителя |
Клиническая картина |
|
Пневмококки |
· острое начало; · повышение температуры тела до 38-40°С; · кашель с мокротой желтого цвета. |
|
Микоплазмы |
· постепенное начало; · першение в горле; · насморк; · анемия; · несильный кашель; · субфебрильная температура тела. |
|
Стафилококк |
· выраженный интоксикационный синдром; · одышка; · кашель; · боль в грудной клетке; · повышение температуры тела до 38-40°С; · тяжелое течение. |
|
Вирусы |
· ринит; · фарингит; · частый кашель с хрипами; · увеличение лимфатических узлов; · колебание температуры тела в течение суток. |
|
Грибки |
· кашель; · легочные кровотечения; · слабость; · мышечная боль; · колебание температуры тела. |
Дифференциальная диагностика внебольничной пневмонии
Внебольничная пневмония — заболевание, которое возникло вне лечебного учреждения (синоним: амбулаторная, домашняя). Является очень серьезной патологией легких и может закончиться летальным исходом. Поэтому важно начать лечение как можно раньше. От правильно установленного диагноза будет зависеть эффективность лечения.
Дифференциальная диагностика направлена на сравнение заболеваний по определенным критериям (симптоматика, результаты исследований) и исключение неподходящих заболеваний для получения единственно верного диагноза. При пневмонии дифференциальная диагностика поможет исключить следующие болезни:
- туберкулез;
- бронхит;
- рак.
Они имеют схожую клиническую картину в начале развития заболевания.
Дифференциальная диагностика пневмонии и туберкулеза
Наиболее часто ошибки в диагностике совершают при сравнении пневмонии и туберкулеза. Важно отличать эти два заболевания, поскольку терапевтические схемы их лечения значительно разнятся. Те методы терапии, которые дают результат при пневмонии, не будут эффективны при туберкулезе. Также большинство методов физиотерапии при пневмонии нельзя использовать при туберкулезе. Это связано с риском усугубить состояние.
Дифференциальная диагностика туберкулеза легких и пневмонии в Юсуповской больнице проводится с использованием новейшей аппаратуры европейских и американских производителей. Современные рентгенологические, бактериологические и лабораторные методы исследования позволяют врачам клиники быстро установить точный диагноз и назначить адекватную терапию.
|
Критерий |
Туберкулез |
Пневмония |
|
Общая интоксикация организма |
Выраженная |
Выраженная |
|
Температура тела |
Выше 38°С |
Выше 38°С |
|
Сухой кашель с болевыми ощущениями |
Присутствует |
Присутствует |
|
Наличие мокроты |
Присутствует, может появляться кровь |
Присутствует |
|
Бледность кожных покровов |
Присутствует |
Присутствует |
|
Туберкулиновая проба |
Всегда положительна |
В большинстве случаев отрицательна (очень редко показывает положительный результат, что и дает основание для неправильного диагноза) |
|
Эффективность антибиотикотерапии |
Отсутствует |
Присутствует |
|
Результаты рентгенограммы |
Инфильтративные тени неоднородны, присутствуют очаги отсева |
Четкие локальные инфильтративные тени |
|
Результаты бактериологического исследования |
Микобактерии туберкулеза |
Неспецифическая флора |
Инфильтративным туберкулезом чаще болеют люди, имеющие контакт с больным или пребывающие в группе риска. Причиной пневмонии является переохлаждение, фарингит, заболевание придаточных пазух носа, трахеобронхит. Воспаление легких начинается остро, для туберкулеза характерно подострое начало. При туберкулезе интоксикация умеренная, воспаление легких протекает с выраженным интоксикационным синдромом.
При инфильтративном туберкулезе температура тела субфебрильная, реже фебрильная, с чередованием высоких и нормальных цифр. Пневмония проявляется высокой температурой постоянного характера. Кашель при туберкулезе неинтенсивный и нечастый, с выделением слизисто-гнойной мокроты. Признаком пневмонии является интенсивный кашель, преимущественно с гнойной мокротой.
В общем анализе крови у пациентов с туберкулезом определяют умеренное повышение количества лейкоцитов и скорости оседания эритроцитов, нередко лимфопению и моноцитоз. При пневмонии отмечается выраженный лейкоцитоз и значительно повышенная скорость оседания эритроцитов. В мокроте больных туберкулезом находят микобактерии туберкулеза, при пневмонии – грамположительные или грамотрицательные микроорганизмы. На рентгенограммах больных туберкулезом рентгенологи определяют сегментарное или полисегментарное затемнение неоднородного характера. Оно располагается преимущественно в 1-2 и 6 сегментах легкого. В зоне поражения или корней легкого определяются кальцинаты. При пневмонии однородное затемнение локализуется в базальных сегментах средней и нижней доли легкого.
Клинико-рентгенологические проявления пневмонии и инфильтративного туберкулеза легких и пневмонии имеют определенные особенности, но они носят косвенный характер. Для того чтобы установить точный диагноз, врачи Юсуповской больницы проводят бактериологическое исследование, позволяющее идентифицировать возбудителя инфекционного заболевания. Во время диагностической бронхоскопии производят биопсию и отправляют материал на гистологическое исследование. Компьютерная томография также позволяет провести дифференциальную диагностику пневмонии и туберкулеза легких.
Клинико-рентгенологическая картина при туберкулезе легких и пневмонии будет выглядеть следующим образом:
|
Морфологические проявления |
Рентгенологические симптомы |
Клиническая форма туберкулеза легких |
|
Бронхолобулярное экссудативное воспаление |
Неоднородная тень, которая состоит из сливающихся мелких или крупных в один или несколько соединений, в центре которых выявляется полость распада |
Инфильтративный туберкулез, ограниченный 1–2 сегментами легких |
|
Сливное бронхолобулярное экссудативное воспаление |
Неправильной или округлой формы неоднородная тень, слабой интенсивности, с нечеткими контурами или же обширная неоднородная тень с наличием одиночных или множественных полостей распада |
Инфильтративный туберкулез, ограниченный 1–2 долями легких |
|
Лобарный творожистый некроз |
Обширное интенсивное затемнение, которое распространяется более чем на одну долю легкого с наличием одиночных или множественных полостей распада |
Казеозная пневмония |
Причины ошибок дифференциальной диагностики
В 30% случаев первично установленный диагноз пневмонии не подтверждают при дальнейшем обследовании пациентов. 20% пациентам туберкулез диагностируют в течение первых 2-3 недель заболевания. У 80% дифференциальная диагностика туберкулеза и пневмонии проводится 1-3 месяца.
Основными причинами диагностических ошибок являются:
- плохо собранный фтизиатрический анамнез;
- неправильная оценка и интерпретация клинических проявлений туберкулеза легких в современных условиях;
- некорректная трактовка рентгенологических изменений в легких;
- отсутствие рентгенологического контроля через 7–10 дней лечения пневмонии;
- отсутствие или однократное исследование мазков мокроты на микобактерии туберкулеза;
- выполнение обзорной бронхоскопии без взятия биопсийного материала;
- тяжелые сопутствующие заболевания.
Наиболее часто врачи допускают диагностические ошибки при казеозной пневмонии и инфильтративном туберкулезе легких.
Дифференциальная диагностика пневмонии и обструктивного бронхита
Обе патологии чаще всего начинаются с острых респираторных заболеваний. При обструктивном бронхите и при пневмонии основным симптомом является кашель с выделением мокроты. Однако пневмония обычно протекает тяжелей: у больного имеется выраженная интоксикация, высокая температура тела. В некоторых случаях пневмония у курящего пациента будет иметь одинаковую клиническую картину с хроническим бронхитом курильщика. При обструктивном бронхите температура может повышаться в течение 2-3 дней и далее не превышает субфебрильные показатели. Во время проведения дифференциального диагноза учитывают природу происхождения заболевания: у пневмонии – преимущественно бактериальная, у обструктивного бронхита – легочная.
|
Критерий |
Обструктивный бронхит |
Пневмония |
|
Общая интоксикация организма |
Нет или умеренная |
Выраженная |
|
Температура тела |
В пределах от 37 до 38°С |
Выше 38°С |
|
Одышка |
Присутствует |
Присутствует |
|
Сухие свистящие хрипы |
Присутствуют |
Отсутствуют |
|
Влажные хрипы |
Отсутствуют |
Присутствуют |
|
Результаты рентгенограммы |
Усиление легочного рисунка |
Четкие локальные инфильтративные тени |
Дифференциальная диагностика пневмонии и рака легких
Начальные проявления воспаления легких и развития онкологического процесса не отличаются. При подозрении на пневмонию пациенту назначают курс антибиотиков. Если через неделю они не показывают результат, пациента отправляют на обследование для подтверждения или исключения злокачественного новообразования. Дифференциальный анализ проводят на ранней стадии рака, так как в дальнейшем будут проявляться характерные симптомы. При метастазировании и прорастании опухоли в плевральные ткани заболевание имеет ярко выраженную клиническую картину. Появляются сильные боли при кашле, в мокроте присутствует кровь. Возникают боли в суставах.
|
Критерий |
Рак легких |
Пневмония |
|
Общая интоксикация организма |
Нет или умеренная |
Выраженная |
|
Температура тела |
Нет или субфебрильная |
Выше 38°С |
|
Сухой кашель с болевыми ощущениями |
Присутствует |
Присутствует |
|
Наличие мокроты |
Присутствует, может появляться кровь |
Присутствует |
|
Бледность кожных покровов |
Присутствует |
Присутствует |
|
Эффективность антибиотикотерапии |
Отсутствует |
Присутствует |
|
Результаты рентгенограммы |
Очаговая тень |
Четкие локальные инфильтративные тени |
|
Результаты бактериологического исследования |
Аномальные клетки |
Неспецифическая флора |
Лечение пневмонии
В Юсуповской больнице выполняют своевременную и точную постановку диагноза. В клинике проводят все необходимые диагностические мероприятия для выявления пневмонии: осмотр терапевта, лабораторные исследования, рентгенографию. Качественная диагностика позволяет определить тип пневмонии, что важно при назначении терапии.
Воспаление легких лечат медикаментозно с помощью антибактериальной терапии. Выбор препарата будет зависеть от возбудителя заболевания. Дополнительно используют препараты для симптоматического лечения. К ним относятся жаропонижающие, болеутоляющие, отхаркивающие средства. После получения первых положительных результатов лечения и стабилизации нормальной температуры назначают специальные массажи и дыхательную гимнастику. Больной пневмонией должен соблюдать постельный режим, хорошо питаться, принимать витамины, пить достаточное количество жидкости.
Юсуповская больница предлагает своим пациентам стационарное лечение с комфортными палатами. Пациенту оказывают круглосуточное медицинское обслуживание опытные врачи-терапевты, пульмонологи и квалифицированный младший персонал. В палатах есть все необходимые предметы гигиены, специальная система вентиляции обеспечивает очищение воздуха в каждом помещении больницы. Пациентам предоставляют сбалансированное питание, которое подбирает диетолог, учитывая пожелания пациента.
Все сложные для дифференциальной диагностики случаи пневмонии обсуждаются на заседании экспертного совета. Запишитесь на прием к врачу по телефону Юсуповской больницы, где работают кандидаты и доктора медицинских наук, врачи высшей категории, являющиеся ведущими специалистами в области диагностики заболеваний легких.
- Case Report
- Open Access
- Published: 09 June 2020
Infectious Diseases of Poverty
volume 9, Article number: 66 (2020)
Cite this article
-
2754 Accesses
-
8 Citations
-
Metrics details
Abstract
Background
Tuberculosis (TB) is a great mimicker and diagnostic chameleon, and prone to be diagnosed as malignancy. Even though many reports have described the differences between pulmonary TB and lung cancer, the atypical systemic hematogenous disseminated TB (HDTB) is very rare and more confusing in clinical practice.
Case presentation
A 73-year-old man, HIV-negative, was hospitalized to the local county hospital because of chest pain, low-grade fever, asthenia, anorexia and weight loss for the pasting two months. The CT findings of the two lungs showed multiple round or round-like nodules of different sizes, with clear boundaries and partial fusion. The level of serum CA19–9 was significantly higher than normal, and progressively increased. There were multiple enlarged lymph nodes in the neck, mediastinum, abdominal cavity and pelvic cavity. The symptoms were diagnosed as hematogenous spread of gastrointestinal tumor in the local county hospital. However, when transferred to our provincial hospital, through comprehensive dynamic analysis, this patient was diagnosed as atypical systemic HDTB, no cancer at all. Through routine anti-TB therapy for one year, the patient was recovered very well at the follow-up of half year after withdrawal.
Conclusions
In the past, most TB misdiagnosis cases involved in single organ and were finally confirmed through invasive examination. This case enriched clinical experiences in the diagnosis of atypical HDTB. We encouraged clinicians to establish a dynamic thinking for diagnosis and treatment and emphasized the value of biopsy and 18F-FDG-PET in distinguishing TB and cancer.
Background
Tuberculosis (TB) is a huge threat for public health in China, which is within the “high-burden country” list [1]. Even though enormous effort has been taken, treatment and control of TB still face many challenges. Detection and diagnosis of Mycobacterium tuberculosis (MTB) is difficult in most case. What’s worse, TB is a great mimicker and diagnostic chameleon, and prone to be diagnosed as malignancy, and vice-versa, because the radiographic characteristics and clinical symptoms of the two diseases are very similar [2,3,4,5]. Since cancer usually has worse prognosis and costs more medical resources compared with TB, misdiagnosis surely increases much more psychological stress and economical burden to the real TB patients. Furthermore, treatment strategy is totally different between neoplasm and TB. In such case, clinicians are placed into a dilemma to make a definite diagnosis, and are even at risk to become a “misdiagnosis murder” [6]. Thus, it’s pivotal to describe and summarize the nuances between neoplasm and TB through more case reports. Here, we described a very unusual case that a 73-year-old immunocompetent man with hematogenous disseminated TB (HDTB) was misdiagnosed as metastasis with multiple organs involvement.
Case presentation
Lung metastasis
On 7 March, 2018, a 73-year-old man, HIV-negative, was hospitalized to the local county hospital for 2-month chest pain, low-grade fever, asthenia, anorexia and weight loss. The patient had history of type II diabetes mellitus with regular administration of gliclazide, but efficacy was poor. Physical examination revealed body temperature 36.7 °C, pulse rate 96 beats/min, blood pressure 133/83 mmHg, respiratory rate 20/min, oxygen saturation 96% and mildly yellow skin and sclera. Respiratory system, cardiovascular system, neurological system and abdomen were normal. Laboratory examination showed anemia (hemoglobin 114 g/L), abnormal liver function (alanine aminotransferase 57 U/L, aspartate aminotransferase 48 U/L, γ-glutamyl transpeptidase 818 U/L, alkaline phosphatase 671 U/L, total bilirubin 44 μmol/L) and elevated cancer antigen 19-9 (CA19-9, 165 U/ml). The interferon-γ release assay test was negative. The skull computerized tomography (CT) showed lacunar infarction in bilateral basal ganglia. The thorax CT revealed multiple round or round-like nodules with variable sizes scattered throughout both lungs, suggestive of metastatic lung disease (Fig. 1A). Abdominal enhancement CT showed that a mass at the pancreatic head was obviously strengthened in the arterial phase, and the pancreatic duct and intrahepatic bile duct was slightly dilated (Fig. 2). Taken together, all examination results were strongly suspected of lung metastasis, which was originated from the pancreatic head or intestinal origin. However, TB infection could not be excluded completely. The patient denied further biopsy, and chose to accept experimental anti-TB therapy with rifampin and isoniazid. After one month, chest CT showed that lung lesions were not absorbed. Laboratory test showed that CA19-9 sharply increased, up to 1167 U/ml. Sputum smear for acid-fast bacilli (AFB) was negative. The doctors in the local county hospital excluded TB infection and proposed gastrointestinal malignant tumors combined with lung metastasis. The patient family was in deep sorrow and prepared to give up.
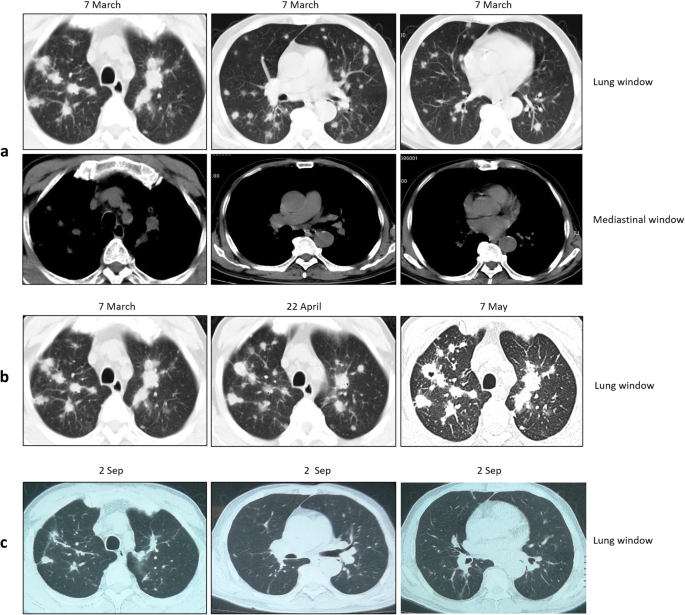
Thorax CT scan at different time points displayed evolution of lesions. a At admission, the thorax CT revealed multiple round or round-like nodules with variable size scattered throughout both lungs. b Development and evolution of lung lesions. The lung CT scan showed that pulmonary nodules gradually evolved with signs of fibrous tissue hyperplasia, such as cords, long burrs and fusion. c After four months of anti-TB treatment, thorax CT scan showed obvious absorbance of the lung lesions
Full size image
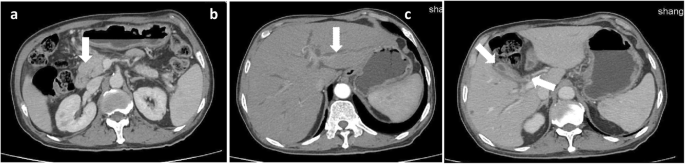
Abdominal enhancement CT suggested lesions in the intestinal tract. a There was a mass at the pancreatic head, indicated by arrow. b Intrahepatic bile duct was dilated, indicated by arrow. c The gallbladder wall (left arrow) and the wall of the upper end of the common bile duct (right arrow) were thicken
Full size image
Hematogenous disseminated TB
On 7 May, 2018, his daughter persuaded the patient to the provincial hospital for further diagnosis. Laboratory examination revealed hyperbilirubinemia (total bilirubin 70 μmol/L), CA19-9 832 U/ml, cancer antigen 125 141 U/ml, neuron-specific enolase 22.98 ng/ml, angiotensin-converting enzyme 178 U/L and serum (1,3)-β-D-glucan 235 pg/ml. 18F-fluorodeoxyglucose positron-emission tomography (18F-FDG-PET) scan showed focal high uptake in the multiple organs, including lung, liver, pancreas, spleen, gallbladder neck (Fig. 3), which suggested benign disease (especially TB). The patient accepted the endoscopic retrograde cholangiopancreatography to relieve hyperbilirubinemia, which was caused by bile duct obstruction. Biopsy from brushed biliary cell indicated no malignant tumor. A CT scan-guided transthoracic needle biopsy of the nodule at the left upper lobe was performed and the histopathology showed coagulative necrosis combining with granulomatous inflammation. AFB staining was positive and Periodic Acid-Schiff staining was negative (Fig. 4). In the meanwhile, qPCR for MTB DNA showed 4900 copy/ml in the sputum. Thus, the diagnosis of TB infection was definite. The patient then accepted anti-TB regimen, including isoniazid (300 mg/once a day [QD]), rifampicin (450 mg/QD), ethambutol (750 mg/QD), pyrazinamide (1500 mg/QD), levofloxacin (600 mg/QD) for three months, followed by isoniazid (300 mg/QD) and rifampicin (450 mg/QD) for another nine months.
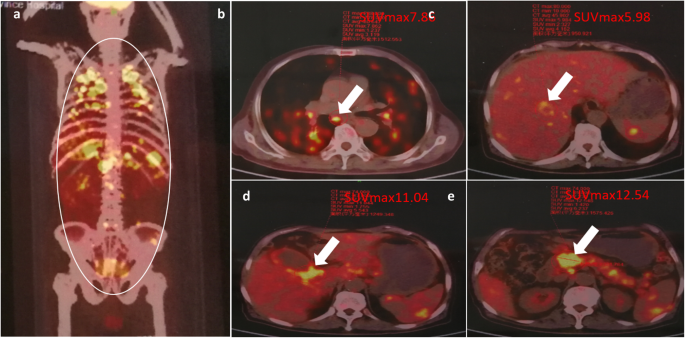
FDG-PET showed high uptake at different foci. a Foci in the whole body were defined by a circle. The yellow bright spots represented high uptake of 18F-FDG by local tissues. The maximum standard uptake value in different organs were shown, including lung (b, 7.86), liver (c, 5.98), gallbladder neck (d, 11.04), pancreatic head mass (e, 12.54)
Full size image
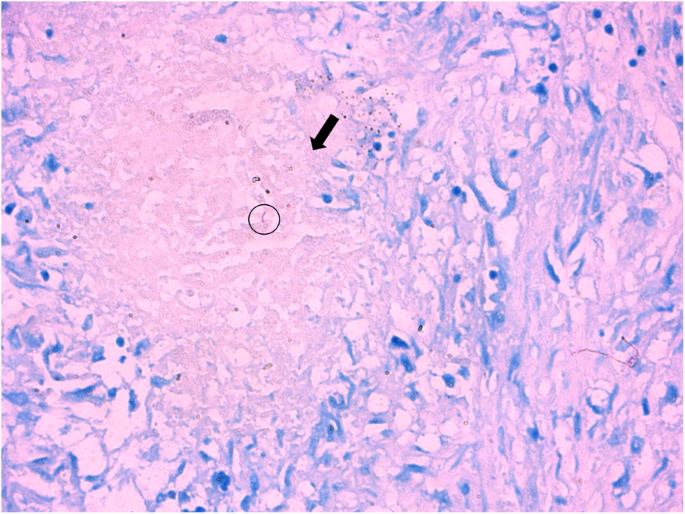
Puncture biopsy of left lung upper lobe revealed coagulative necrosis combined with granulomatous inflammation with hematoxylin-eosin staining (black arrow). Ziehl-Neelsen staining detected acid-fast bacilli (black circle) and Periodic Acid-Schiff staining was negative. Magnification × 200
Full size image
On 2 September, 2018, almost four months after hospitalization to our hospital, the thorax CT revealed that the lung lesions were absorbed significantly (Fig. 1B). After one year of treatment, continuous clinical and radiological improvement was observed, and the drugs were then withdrawn. The patient was asymptomatic at the follow-up of half year after withdrawal.
Discussion
Characteristics of TB misdiagnosis cases
We conducted literature search in NCBI PubMed database with keywords “tuberculosis” and “cancer” or “tumor” from 2016 to 2019. Totally, 23 hits were retrieved about TB misdiagnosis [7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28], including 1 summary analysis and 22 case reports. Half of 22 patients were young adults, with average age under 40. To our interest, none of these 22 patients had underlying diseases at admission except 2 with oncology history, 1 with familial Mediterranean fever, and 1 just subjected to kidney transplantation. It’s noted that 15 (68.2%) of the 22 cases involved in single organ, with lung the most involved organ (54.5%). Of the 22 cases, 19 (86.4%) were confirmed by invasive examination, like biopsy of the lesion. In summary, the clinical manifestations of some TB cases are non-specific, which are most likely misdiagnosed as tumor.
Differences of pulmonary modules between lung metastasis and HDTB
Pulmonary nodules refer to the round intrapulmonary lesions with less than 3 cm in diameter [29]. Multiple nodules in the lung are one of the most common clinical imaging presentations, which appear in a variety of diseases, such as lymphangitis carcinomatosa, silicosis, and bronchioloalveolar carcinoma [30]. In particular, multiple small pulmonary nodules are frequently observed in both lung metastasis and HDTB [31, 32]. Besides, some chronic inflammation and unusual lymphoma involving in the lungs, could also display multiple pulmonary nodules [33]. The imaging manifestations of those diseases are so similar that a definite diagnosis is difficult to make [34]. The differences of nodule characteristics between lung metastasis and HDTB are summarized in Table 1. In our case, lung CT showed multiple round nodules of different size, with clear boundaries and partial fusion. Abdominal CT showed slight dilatation of intrahepatic bile duct and pancreas, enlargement of pancreatic head, multiple low-density foci in spleen.
Full size table
Nonspecificity of CA19-9
CA19-9 level was significantly higher than normal, and progressively increased. It is known that, CA19-9 is synthesized by pancreatic and biliary ductal cells, as well as gastric, colon, endometrial and salivary epithelia. Only small amount of CA19-9 is present in serum [39]. CA19-9 is considered as the marker for pancreatic cancer in clinical practice. However, this indicator has the disadvantage of low specificity [39, 40]. Overexpression of CA19-9 was observed in several benign gastrointestinal disorders, which may be relevant to glycan mediated cell-cell interactions in mucosal immunity [40]. Additionally, higher level of CA19-9 was found in the pancreatic tuberculosis [41, 42]. In our case, sharply increased CA19-9 also played a role of misleading.
Clues to make definite diagnosis
When we looked into these symptoms with comprehensive dynamic analysis, we found that this patient had anemia and his white blood cells was not high, indicating that he was in the course of chronic infection (our clinical experience). There were multiple pulmonary nodules, most of which distributed along with the bronchovascular bundle. Some nodules were not very regular. Pulmonary nodules in the upper lung showed a trend of enlargement, fusion and infiltration. In addition, signs of fibrous hyperplasia such as strips and long burrs appeared in the process of evolution (Fig. 1C). We gradually thought it was more likely to be inflammatory granuloma lesions, instead of malignant tumor. At the other hand, abdominal CT suggested thickening of the gallbladder wall and uniform thickening of the upper-end wall of the common bile duct. Although the head of the pancreas was enlarged, it still had regular shape, clear boundary, and consistent enhancement with the whole pancreas body. All these signs also suggested chronic inflammation. Additionally, in this case, the maximum standard uptake value (SUVmax) of PET CT imaging for pulmonary nodules was 7.86, located between 2.65 and 10.9, which probably indicated benign lesions. The value of PET CT in evaluating the efficacy of TB treatment, especially extrapulmonary TB, has been widely recognized [23]. Unfortunately, given its high cost, it cannot be widely used in China at present. The patient also refused to accept re-examination by PET CT for this reason. Otherwise, the effect of individualized chemotherapy regimen can be better evaluated through the changes in pathological metabolism. Finally, puncture biopsy of lung confirmed pulmonary TB. Through anti-TB treatment, the patient was cure, which in turn supported our diagnosis.
Conclusions
The patient turned out to be atypical systemic HDTB, not cancer at all. Such atypical HDTB was relatively rare in clinical practice. We encouraged clinicians to keep dynamic thinking of the disease in mind and know more special signs of rare diseases.
Availability of data and materials
Data relating to this study are contained and presented in this document. Other materials are available from the corresponding authors on reasonable request.
Abbreviations
- TB:
-
Tuberculosis
- MTB:
-
Mycobacterium tuberculosis
- HDTB:
-
Hematogenous disseminated TB
- CT:
-
Computerized tomography
- AFB:
-
Acid-fast bacilli
- 18F-FDG-PET:
-
18F-fluorodeoxyglucose positron-emission tomography
- QD:
-
Once a day
References
-
World Health Organization. Global tuberculosis report 2019. Geneva: World Health Organization. 2019, Licence: CC BY-NC-SA 3.0 IGO.
-
Fijołek J, Wiatr E, Polubiec-Kownacka M, Błasińska-Przerwa K, Szołkowska M, Szczepulska-Wójcik E, et al. Pulmonary tuberculosis mimicking lung cancer progression after 10 years of cancer remission. Adv Respir Med. 2018;86(2):92–6. https://doi.org/10.5603/ARM.2018.0012.
Article
PubMedGoogle Scholar
-
Ko Y, Mo E-K, Park YB, Kang M-R, Bae JS, Kim Y. Miliary Tuberculosis mimicking brain metastasis from renal cell carcinoma. J Neurocrit Care. 2018;11(1):47–53. https://doi.org/10.18700/jnc.180045.
-
Lang S, Sun J, Wang X, Xiao Y, Wang J, Zhang M, et al. Asymptomatic pulmonary tuberculosis mimicking lung cancer on imaging: a retrospective study. Exp Ther Med. 2017;14(3):2180–8. https://doi.org/10.3892/etm.2017.4737.
Article
PubMed
PubMed CentralGoogle Scholar
-
Singh VK, Chandra S, Kumar S, Pangtey G, Mohan A, Guleria R. A common medical error: lung cancer misdiagnosed as sputum negative tuberculosis. Asian Pac J Cancer Prev. 2009;10(3):335–8. 19640168.
-
Vaghasiya K, Sharma A, Verma R. Misdiagnosis murder: Disguised TB or lung cancer? Pulmon Res Respir Med. 2016;3:e5-6. https://doi.org/10.17140/PRRMOJ-3-e006.
-
Chamberlin K, Orfanos S, Mukherjee A, Moy E, Koganti M, Khan W. A case of disseminated tuberculosis mimicking metastatic cancer. Respir Med Case Rep. 2018;25:239–41. https://doi.org/10.1016/j.rmcr.2018.10.001.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Morikawa K, Misumi S, Fukuda T. A case of pulmonary tuberculosis with multiple nodules mimicking lung metastases. BJR Case Rep. 2019;5(3):20180124. https://doi.org/10.1259/bjrcr.20180124.
Article
PubMed
PubMed CentralGoogle Scholar
-
Kawaratani H, Moriya K, Ishida K, Noguchi R, Namisaki T, Takaya H, et al. Cecal tuberculosis mimicking submucosal tumor. Cecal tuberculosis mimicking submucosal tumor. Intern Med. 2016;55(14):1859–63. https://doi.org/10.2169/internalmedicine.55.5139.
Article
PubMedGoogle Scholar
-
Pintos-Pascual I. Cervix tuberculosis simulating cancer. Cecal tuberculosis mimicking submucosal tumor. Intern Med. 2016;55(14):1859–63. https://doi.org/10.2169/internalmedicine.55.5139.
Article
Google Scholar
-
Ciftci F, Shimbori N, Karnak D. Concurrent central nervous system and endobronchial tuberculosis mimicking a metastatic lung cancer. Clin Respir J. 2017;11(1):98–102. https://doi.org/10.1111/crj.12311.
Article
PubMedGoogle Scholar
-
Ando M, Mukai Y, Ushijima RI, Shioyama Y, Umeki K, Okada F, et al. Disseminated mycobacterium tuberculosis infection masquerading as metastasis after heavy ion radiotherapy for prostate Cancer. Intern Med. 2016;55(22):3387–92. https://doi.org/10.2169/internalmedicine.55.7039.
Article
PubMed
PubMed CentralGoogle Scholar
-
Voit FM, Abdelhafez M, Rothe K, Slotta-Huspenina J, Gaa J, Schmid RM, et al. Disseminated tuberculosis mimicking metastatic gastric cancer-a case report. Z Gastroenterol. 2019;57(12):1487–92. https://doi.org/10.1055/a-1030-4781.
Article
PubMedGoogle Scholar
-
Hajjar W, Ahmed I, Aljetaily S, Al-Obaidan T, Hajjar AW. Endobronchial tuberculosis simulating carcinoid tumor. J Coll Physicians Surg Pak. 2018;28(3):S39-41. https://doi.org/10.29271/jcpsp.2018.03.S39.
-
Di Giovanni SE, Cunha TM, Duarte AL, Alves I. Endometrial tuberculosis simulating an ovarian cancer: a case report. Acta Med Port. 2016;29(6):412–5. https://doi.org/10.20344/amp.7706.
-
Wang H, Qu X, Liu X, Ding L, Yue Y. Female peritoneal tuberculosis with ascites, pelvic mass, or elevated CA 125 mimicking advanced ovarian cancer: A retrospective study of 26 cases. J Coll Physicians Surg Pak. 2019;29(6):588–9. https://doi.org/10.29271/jcpsp.2019.06.588.
-
Gera K, Kishore N. Image diagnosis. Endobronchial tuberculosis masquerading as an Endobronchial tumor with presentation as middle lobe syndrome. Perm J. 2017;21:16–006. https://doi.org/10.7812/TPP/16-006.
Article
PubMedGoogle Scholar
-
Sassalos TM, Rao RC, Demirci H. Ocular tuberculosis masquerading as a tumor. Lancet Infect Dis. 2018;18(8):924. https://doi.org/10.1016/S1473-3099(18)30123-3.
Article
PubMed
PubMed CentralGoogle Scholar
-
Daoudi M, Herrak L, Ftouh ME, Achachi L. [Pseudotumoral bronchopulmonary tuberculosis mimicking cancer in an immunocompetent patient]. Pan Afr Med J. 2019;32:170. doi:https://doi.org/10.11604/pamj.2019.32.170.18129.
-
Moukit M, Fadel FA, Kouach J, Babahabib A, Dehayni M, Rahali DM. Pseudo-tumoral peritoneal tuberculosis mimicking ovarian cancer: an important differential diagnosis to consider. Pan Afr Med J. 2016;25:193. https://doi.org/10.11604/pamj.2016.25.193.10929.
-
Pilaniya V, Gera K, Kunal S, Shah A. Pulmonary tuberculosis masquerading as metastatic lung disease. Eur Respir Rev. 2016;25(139):97–8. https://doi.org/10.1183/16000617.00002315.
Article
PubMedGoogle Scholar
-
Nowakowska-Arendt A, Jagiełło G. Pulmonary tuberculosis mimicking numerous lung metastases—a case study. Med Res J. 2018;3(1):43–6. https://doi.org/10.5603/MRJ.2018.0008.
-
Yates JA, Collis OA, Sueblinvong T, Collis TK. Red snappers and red herrings: pelvic tuberculosis causing elevated CA 125 and mimicking advanced ovarian cancer. A case report and literature review. Hawaii J Med Public Health. 2017;76(8):220–4. 28808611.
PubMed
PubMed CentralGoogle Scholar
-
Schmidt-Lauber C, Jacobi J, Polifka I, Hilgers KF, Wiesener MS. Suspected colonic cancer turns out to be disseminated tuberculosis in a kidney transplant recipient: a case report. Medicine (Baltimore). 2019;98(36):e16995. https://doi.org/10.1097/MD.0000000000016995.
Article
Google Scholar
-
Lan C-C, Wu C-W, Wu Y-K. Systemic tuberculosis mimicking lung Cancer with multiple metastases. Am J Med Sci. 2020;359(3):186–7. https://doi.org/10.1016/j.amjms.2019.09.006.
Article
PubMedGoogle Scholar
-
Rodpenpear N. Tuberculosis of cervix resembling cervical Cancer. J Med Assoc Thail. 2016;99(Suppl 8):S249–52. 29906057.
Google Scholar
-
Vamsi Krishna S, Mallikarjunaswamy B, Issac T, Srinivasalu S. Tuberculosis of knee joint mimicking giant cell tumor-a case report. Indian J Tuberc. 2018;65(3):260–1. https://doi.org/10.1016/j.ijtb.2016.09.021.
Article
PubMedGoogle Scholar
-
Sellami M, Mnejja M, Charfi S, Ghorbel A. Tuberculosis of the tonsil simulating a cancer. Lancet Infect Dis. 2017;17(12):1317. https://doi.org/10.1016/S1473-3099(17)30315-8.
Article
PubMedGoogle Scholar
-
Setio AAA, Traverso A, De Bel T, Berens MS, van den Bogaard C, Cerello P, et al. Validation, comparison, and combination of algorithms for automatic detection of pulmonary nodules in computed tomography images: the LUNA16 challenge. Med Image Anal. 2017;42:1–13. https://doi.org/10.1016/j.media.2017.06.015.
Article
PubMedGoogle Scholar
-
MacMahon H, Naidich DP, Goo JM, Lee KS, Leung ANC, Mayo JR, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner society 2017. Radiology. 2017;284(1):228–43. https://doi.org/10.1148/radiol.2017161659.
-
Dursun P, Ersoz S, Gultekin M, Aksan G, Yüce K. Ayhan A. Disseminated peritoneal tuberculosis mimicking advanced-stage endodermal sinus tumor: a case report. 2006;16(Suppl 1):303–7. https://doi.org/10.1111/j.1525-1438.2006.00205.x.
Article
Google Scholar
-
Falagas M, Kouranos V, Athanassa Z, Kopterides P. Tuberculosis and malignancy. QJM. 2010;103(7):461–87. https://doi.org/10.1093/qjmed/hcq068.
Article
CAS
PubMedGoogle Scholar
-
Denning DW, Page ID, Chakaya J, Jabeen K, Jude CM, Cornet M, et al. Case definition of chronic pulmonary aspergillosis in resource-constrained settings. Emerg Infect Dis. 2018;24(8):e171312. https://doi.org/10.3201/eid2408.171312.
Article
PubMed CentralGoogle Scholar
-
Onuigbo WI. Some nineteenth century ideas on links between tuberculous and cancerous diseases of the lung. Br J Dis Chest. 1975;69:207–10. https://doi.org/10.1016/0007-0971(75)90081-9.
Article
CAS
PubMedGoogle Scholar
-
Aquino SL. Imaging of metastatic disease to the thorax. Radiol Clin N Am. 2005;43(3):481–95. https://doi.org/10.1016/j.rcl.2005.02.006.
Article
PubMedGoogle Scholar
-
Kawaguchi K, Taniguchi T, Fukui T, Nakamura S, Yokoi K. Radiological findings and surgical outcomes of pulmonary metastases originating from biliary tract carcinoma. Gen Thorac Cardiovasc Surg. 2019;67(11):962–8. https://doi.org/10.1007/s11748-019-01122-6.
Article
PubMedGoogle Scholar
-
Khan F. Review of literature on disseminated tuberculosis with emphasis on the focused diagnostic workup. J Family Community Med. 2019;26(2):83–91. https://doi.org/10.4103/jfcm.JFCM_106_18.
Article
PubMed
PubMed CentralGoogle Scholar
-
Chierakul N, Boonsuk J, Muangman N, Totanarungroj K. Radiographic features for predicting smear-negative pulmonary tuberculosis. J Med Assoc Thail. 2016;99(6):697–701.
Google Scholar
-
Scarà S, Bottoni P, Scatena R. CA 19-9: biochemical and clinical aspects. Adv Exp Med Biol. 2015;867:247–60. https://doi.org/10.1007/978-94-017-7215-0_15.
Article
CAS
PubMedGoogle Scholar
-
Pavai S, Yap S. The clinical significance of elevated levels of serum CA 19-9. Med J Malaysia. 2003;58(5):667–72.
CAS
PubMedGoogle Scholar
-
Bhatia V, Garg PK, Arora VK, Sharma R. Isolated pancreatic tuberculosis mimicking intraductal pancreatic mucinous tumor. Gastrointest Endosc. 2008;68(3):610–1. https://doi.org/10.1016/j.gie.2007.12.022.
Article
PubMedGoogle Scholar
-
Yang Y-J, Li Y-X, Liu X-Q, Yang M, Liu K. Pancreatic tuberculosis mimicking pancreatic carcinoma during anti-tuberculosis therapy: A case report. World J Clin Cases. 2014;2(5):167–169. doi: https://doi.org/10.12998/wjcc.v2.i5.167.
Download references
Acknowledgements
Not applicable.
Funding
This work was supported by Natural Science Foundation of Jiangsu province (Grant No. BK20170133) and social development project of key research and development plan of Jiangsu province (Grant No. BE2018606).
Author information
Authors and Affiliations
-
Department of Tuberculosis, the Second Hospital of Nanjing, Nanjing University of Chinese Medicine, 1-1 Zhongfu Road, Gulou District, Nanjing, Jiangsu Province, 210003, China
Tian-Xing Hang, Gang Fang, Yan Huang & Chun-Mei Hu
-
Clinical Research Center, the Second Hospital of Nanjing, Nanjing University of Chinese Medicine, 1-1 Zhongfu Road, Gulou District, Nanjing, Jiangsu Province, 210003, China
Wei Chen
Authors
- Tian-Xing Hang
You can also search for this author in
PubMed Google Scholar - Gang Fang
You can also search for this author in
PubMed Google Scholar - Yan Huang
You can also search for this author in
PubMed Google Scholar - Chun-Mei Hu
You can also search for this author in
PubMed Google Scholar - Wei Chen
You can also search for this author in
PubMed Google Scholar
Contributions
TXH and GF conducted the literature review and wrote the draft. YH collected clinical data. CMH and WC conceived the study and revised the manuscript. The author(s) read and approved the final manuscript.
Corresponding authors
Correspondence to
Chun-Mei Hu or Wei Chen.
Ethics declarations
Ethics approval and consent to participate
Written consent was exempted by the institutional review boards of the Second Hospital of Nanjing, since no identifying images or other personal information were included.
Consent for publication
All authors have read and approved the manuscript.
Competing interests
The authors declare that they have no competing interests.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Hang, TX., Fang, G., Huang, Y. et al. Misdiagnosis of a multi-organ involvement hematogenous disseminated tuberculosis as metastasis: a case report and literature review.
Infect Dis Poverty 9, 66 (2020). https://doi.org/10.1186/s40249-020-00681-8
Download citation
-
Received: 24 February 2020
-
Accepted: 26 May 2020
-
Published: 09 June 2020
-
DOI: https://doi.org/10.1186/s40249-020-00681-8
Keywords
- Misdiagnosis
- Hematogenous disseminated tuberculosis
- Metastasis
- Pulmonary nodule
- Case Report
- Open Access
- Published: 09 June 2020
Infectious Diseases of Poverty
volume 9, Article number: 66 (2020)
Cite this article
-
2754 Accesses
-
8 Citations
-
Metrics details
Abstract
Background
Tuberculosis (TB) is a great mimicker and diagnostic chameleon, and prone to be diagnosed as malignancy. Even though many reports have described the differences between pulmonary TB and lung cancer, the atypical systemic hematogenous disseminated TB (HDTB) is very rare and more confusing in clinical practice.
Case presentation
A 73-year-old man, HIV-negative, was hospitalized to the local county hospital because of chest pain, low-grade fever, asthenia, anorexia and weight loss for the pasting two months. The CT findings of the two lungs showed multiple round or round-like nodules of different sizes, with clear boundaries and partial fusion. The level of serum CA19–9 was significantly higher than normal, and progressively increased. There were multiple enlarged lymph nodes in the neck, mediastinum, abdominal cavity and pelvic cavity. The symptoms were diagnosed as hematogenous spread of gastrointestinal tumor in the local county hospital. However, when transferred to our provincial hospital, through comprehensive dynamic analysis, this patient was diagnosed as atypical systemic HDTB, no cancer at all. Through routine anti-TB therapy for one year, the patient was recovered very well at the follow-up of half year after withdrawal.
Conclusions
In the past, most TB misdiagnosis cases involved in single organ and were finally confirmed through invasive examination. This case enriched clinical experiences in the diagnosis of atypical HDTB. We encouraged clinicians to establish a dynamic thinking for diagnosis and treatment and emphasized the value of biopsy and 18F-FDG-PET in distinguishing TB and cancer.
Background
Tuberculosis (TB) is a huge threat for public health in China, which is within the “high-burden country” list [1]. Even though enormous effort has been taken, treatment and control of TB still face many challenges. Detection and diagnosis of Mycobacterium tuberculosis (MTB) is difficult in most case. What’s worse, TB is a great mimicker and diagnostic chameleon, and prone to be diagnosed as malignancy, and vice-versa, because the radiographic characteristics and clinical symptoms of the two diseases are very similar [2,3,4,5]. Since cancer usually has worse prognosis and costs more medical resources compared with TB, misdiagnosis surely increases much more psychological stress and economical burden to the real TB patients. Furthermore, treatment strategy is totally different between neoplasm and TB. In such case, clinicians are placed into a dilemma to make a definite diagnosis, and are even at risk to become a “misdiagnosis murder” [6]. Thus, it’s pivotal to describe and summarize the nuances between neoplasm and TB through more case reports. Here, we described a very unusual case that a 73-year-old immunocompetent man with hematogenous disseminated TB (HDTB) was misdiagnosed as metastasis with multiple organs involvement.
Case presentation
Lung metastasis
On 7 March, 2018, a 73-year-old man, HIV-negative, was hospitalized to the local county hospital for 2-month chest pain, low-grade fever, asthenia, anorexia and weight loss. The patient had history of type II diabetes mellitus with regular administration of gliclazide, but efficacy was poor. Physical examination revealed body temperature 36.7 °C, pulse rate 96 beats/min, blood pressure 133/83 mmHg, respiratory rate 20/min, oxygen saturation 96% and mildly yellow skin and sclera. Respiratory system, cardiovascular system, neurological system and abdomen were normal. Laboratory examination showed anemia (hemoglobin 114 g/L), abnormal liver function (alanine aminotransferase 57 U/L, aspartate aminotransferase 48 U/L, γ-glutamyl transpeptidase 818 U/L, alkaline phosphatase 671 U/L, total bilirubin 44 μmol/L) and elevated cancer antigen 19-9 (CA19-9, 165 U/ml). The interferon-γ release assay test was negative. The skull computerized tomography (CT) showed lacunar infarction in bilateral basal ganglia. The thorax CT revealed multiple round or round-like nodules with variable sizes scattered throughout both lungs, suggestive of metastatic lung disease (Fig. 1A). Abdominal enhancement CT showed that a mass at the pancreatic head was obviously strengthened in the arterial phase, and the pancreatic duct and intrahepatic bile duct was slightly dilated (Fig. 2). Taken together, all examination results were strongly suspected of lung metastasis, which was originated from the pancreatic head or intestinal origin. However, TB infection could not be excluded completely. The patient denied further biopsy, and chose to accept experimental anti-TB therapy with rifampin and isoniazid. After one month, chest CT showed that lung lesions were not absorbed. Laboratory test showed that CA19-9 sharply increased, up to 1167 U/ml. Sputum smear for acid-fast bacilli (AFB) was negative. The doctors in the local county hospital excluded TB infection and proposed gastrointestinal malignant tumors combined with lung metastasis. The patient family was in deep sorrow and prepared to give up.

Thorax CT scan at different time points displayed evolution of lesions. a At admission, the thorax CT revealed multiple round or round-like nodules with variable size scattered throughout both lungs. b Development and evolution of lung lesions. The lung CT scan showed that pulmonary nodules gradually evolved with signs of fibrous tissue hyperplasia, such as cords, long burrs and fusion. c After four months of anti-TB treatment, thorax CT scan showed obvious absorbance of the lung lesions
Full size image

Abdominal enhancement CT suggested lesions in the intestinal tract. a There was a mass at the pancreatic head, indicated by arrow. b Intrahepatic bile duct was dilated, indicated by arrow. c The gallbladder wall (left arrow) and the wall of the upper end of the common bile duct (right arrow) were thicken
Full size image
Hematogenous disseminated TB
On 7 May, 2018, his daughter persuaded the patient to the provincial hospital for further diagnosis. Laboratory examination revealed hyperbilirubinemia (total bilirubin 70 μmol/L), CA19-9 832 U/ml, cancer antigen 125 141 U/ml, neuron-specific enolase 22.98 ng/ml, angiotensin-converting enzyme 178 U/L and serum (1,3)-β-D-glucan 235 pg/ml. 18F-fluorodeoxyglucose positron-emission tomography (18F-FDG-PET) scan showed focal high uptake in the multiple organs, including lung, liver, pancreas, spleen, gallbladder neck (Fig. 3), which suggested benign disease (especially TB). The patient accepted the endoscopic retrograde cholangiopancreatography to relieve hyperbilirubinemia, which was caused by bile duct obstruction. Biopsy from brushed biliary cell indicated no malignant tumor. A CT scan-guided transthoracic needle biopsy of the nodule at the left upper lobe was performed and the histopathology showed coagulative necrosis combining with granulomatous inflammation. AFB staining was positive and Periodic Acid-Schiff staining was negative (Fig. 4). In the meanwhile, qPCR for MTB DNA showed 4900 copy/ml in the sputum. Thus, the diagnosis of TB infection was definite. The patient then accepted anti-TB regimen, including isoniazid (300 mg/once a day [QD]), rifampicin (450 mg/QD), ethambutol (750 mg/QD), pyrazinamide (1500 mg/QD), levofloxacin (600 mg/QD) for three months, followed by isoniazid (300 mg/QD) and rifampicin (450 mg/QD) for another nine months.

FDG-PET showed high uptake at different foci. a Foci in the whole body were defined by a circle. The yellow bright spots represented high uptake of 18F-FDG by local tissues. The maximum standard uptake value in different organs were shown, including lung (b, 7.86), liver (c, 5.98), gallbladder neck (d, 11.04), pancreatic head mass (e, 12.54)
Full size image

Puncture biopsy of left lung upper lobe revealed coagulative necrosis combined with granulomatous inflammation with hematoxylin-eosin staining (black arrow). Ziehl-Neelsen staining detected acid-fast bacilli (black circle) and Periodic Acid-Schiff staining was negative. Magnification × 200
Full size image
On 2 September, 2018, almost four months after hospitalization to our hospital, the thorax CT revealed that the lung lesions were absorbed significantly (Fig. 1B). After one year of treatment, continuous clinical and radiological improvement was observed, and the drugs were then withdrawn. The patient was asymptomatic at the follow-up of half year after withdrawal.
Discussion
Characteristics of TB misdiagnosis cases
We conducted literature search in NCBI PubMed database with keywords “tuberculosis” and “cancer” or “tumor” from 2016 to 2019. Totally, 23 hits were retrieved about TB misdiagnosis [7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28], including 1 summary analysis and 22 case reports. Half of 22 patients were young adults, with average age under 40. To our interest, none of these 22 patients had underlying diseases at admission except 2 with oncology history, 1 with familial Mediterranean fever, and 1 just subjected to kidney transplantation. It’s noted that 15 (68.2%) of the 22 cases involved in single organ, with lung the most involved organ (54.5%). Of the 22 cases, 19 (86.4%) were confirmed by invasive examination, like biopsy of the lesion. In summary, the clinical manifestations of some TB cases are non-specific, which are most likely misdiagnosed as tumor.
Differences of pulmonary modules between lung metastasis and HDTB
Pulmonary nodules refer to the round intrapulmonary lesions with less than 3 cm in diameter [29]. Multiple nodules in the lung are one of the most common clinical imaging presentations, which appear in a variety of diseases, such as lymphangitis carcinomatosa, silicosis, and bronchioloalveolar carcinoma [30]. In particular, multiple small pulmonary nodules are frequently observed in both lung metastasis and HDTB [31, 32]. Besides, some chronic inflammation and unusual lymphoma involving in the lungs, could also display multiple pulmonary nodules [33]. The imaging manifestations of those diseases are so similar that a definite diagnosis is difficult to make [34]. The differences of nodule characteristics between lung metastasis and HDTB are summarized in Table 1. In our case, lung CT showed multiple round nodules of different size, with clear boundaries and partial fusion. Abdominal CT showed slight dilatation of intrahepatic bile duct and pancreas, enlargement of pancreatic head, multiple low-density foci in spleen.
Full size table
Nonspecificity of CA19-9
CA19-9 level was significantly higher than normal, and progressively increased. It is known that, CA19-9 is synthesized by pancreatic and biliary ductal cells, as well as gastric, colon, endometrial and salivary epithelia. Only small amount of CA19-9 is present in serum [39]. CA19-9 is considered as the marker for pancreatic cancer in clinical practice. However, this indicator has the disadvantage of low specificity [39, 40]. Overexpression of CA19-9 was observed in several benign gastrointestinal disorders, which may be relevant to glycan mediated cell-cell interactions in mucosal immunity [40]. Additionally, higher level of CA19-9 was found in the pancreatic tuberculosis [41, 42]. In our case, sharply increased CA19-9 also played a role of misleading.
Clues to make definite diagnosis
When we looked into these symptoms with comprehensive dynamic analysis, we found that this patient had anemia and his white blood cells was not high, indicating that he was in the course of chronic infection (our clinical experience). There were multiple pulmonary nodules, most of which distributed along with the bronchovascular bundle. Some nodules were not very regular. Pulmonary nodules in the upper lung showed a trend of enlargement, fusion and infiltration. In addition, signs of fibrous hyperplasia such as strips and long burrs appeared in the process of evolution (Fig. 1C). We gradually thought it was more likely to be inflammatory granuloma lesions, instead of malignant tumor. At the other hand, abdominal CT suggested thickening of the gallbladder wall and uniform thickening of the upper-end wall of the common bile duct. Although the head of the pancreas was enlarged, it still had regular shape, clear boundary, and consistent enhancement with the whole pancreas body. All these signs also suggested chronic inflammation. Additionally, in this case, the maximum standard uptake value (SUVmax) of PET CT imaging for pulmonary nodules was 7.86, located between 2.65 and 10.9, which probably indicated benign lesions. The value of PET CT in evaluating the efficacy of TB treatment, especially extrapulmonary TB, has been widely recognized [23]. Unfortunately, given its high cost, it cannot be widely used in China at present. The patient also refused to accept re-examination by PET CT for this reason. Otherwise, the effect of individualized chemotherapy regimen can be better evaluated through the changes in pathological metabolism. Finally, puncture biopsy of lung confirmed pulmonary TB. Through anti-TB treatment, the patient was cure, which in turn supported our diagnosis.
Conclusions
The patient turned out to be atypical systemic HDTB, not cancer at all. Such atypical HDTB was relatively rare in clinical practice. We encouraged clinicians to keep dynamic thinking of the disease in mind and know more special signs of rare diseases.
Availability of data and materials
Data relating to this study are contained and presented in this document. Other materials are available from the corresponding authors on reasonable request.
Abbreviations
- TB:
-
Tuberculosis
- MTB:
-
Mycobacterium tuberculosis
- HDTB:
-
Hematogenous disseminated TB
- CT:
-
Computerized tomography
- AFB:
-
Acid-fast bacilli
- 18F-FDG-PET:
-
18F-fluorodeoxyglucose positron-emission tomography
- QD:
-
Once a day
References
-
World Health Organization. Global tuberculosis report 2019. Geneva: World Health Organization. 2019, Licence: CC BY-NC-SA 3.0 IGO.
-
Fijołek J, Wiatr E, Polubiec-Kownacka M, Błasińska-Przerwa K, Szołkowska M, Szczepulska-Wójcik E, et al. Pulmonary tuberculosis mimicking lung cancer progression after 10 years of cancer remission. Adv Respir Med. 2018;86(2):92–6. https://doi.org/10.5603/ARM.2018.0012.
Article
PubMedGoogle Scholar
-
Ko Y, Mo E-K, Park YB, Kang M-R, Bae JS, Kim Y. Miliary Tuberculosis mimicking brain metastasis from renal cell carcinoma. J Neurocrit Care. 2018;11(1):47–53. https://doi.org/10.18700/jnc.180045.
-
Lang S, Sun J, Wang X, Xiao Y, Wang J, Zhang M, et al. Asymptomatic pulmonary tuberculosis mimicking lung cancer on imaging: a retrospective study. Exp Ther Med. 2017;14(3):2180–8. https://doi.org/10.3892/etm.2017.4737.
Article
PubMed
PubMed CentralGoogle Scholar
-
Singh VK, Chandra S, Kumar S, Pangtey G, Mohan A, Guleria R. A common medical error: lung cancer misdiagnosed as sputum negative tuberculosis. Asian Pac J Cancer Prev. 2009;10(3):335–8. 19640168.
-
Vaghasiya K, Sharma A, Verma R. Misdiagnosis murder: Disguised TB or lung cancer? Pulmon Res Respir Med. 2016;3:e5-6. https://doi.org/10.17140/PRRMOJ-3-e006.
-
Chamberlin K, Orfanos S, Mukherjee A, Moy E, Koganti M, Khan W. A case of disseminated tuberculosis mimicking metastatic cancer. Respir Med Case Rep. 2018;25:239–41. https://doi.org/10.1016/j.rmcr.2018.10.001.
Article
CAS
PubMed
PubMed CentralGoogle Scholar
-
Morikawa K, Misumi S, Fukuda T. A case of pulmonary tuberculosis with multiple nodules mimicking lung metastases. BJR Case Rep. 2019;5(3):20180124. https://doi.org/10.1259/bjrcr.20180124.
Article
PubMed
PubMed CentralGoogle Scholar
-
Kawaratani H, Moriya K, Ishida K, Noguchi R, Namisaki T, Takaya H, et al. Cecal tuberculosis mimicking submucosal tumor. Cecal tuberculosis mimicking submucosal tumor. Intern Med. 2016;55(14):1859–63. https://doi.org/10.2169/internalmedicine.55.5139.
Article
PubMedGoogle Scholar
-
Pintos-Pascual I. Cervix tuberculosis simulating cancer. Cecal tuberculosis mimicking submucosal tumor. Intern Med. 2016;55(14):1859–63. https://doi.org/10.2169/internalmedicine.55.5139.
Article
Google Scholar
-
Ciftci F, Shimbori N, Karnak D. Concurrent central nervous system and endobronchial tuberculosis mimicking a metastatic lung cancer. Clin Respir J. 2017;11(1):98–102. https://doi.org/10.1111/crj.12311.
Article
PubMedGoogle Scholar
-
Ando M, Mukai Y, Ushijima RI, Shioyama Y, Umeki K, Okada F, et al. Disseminated mycobacterium tuberculosis infection masquerading as metastasis after heavy ion radiotherapy for prostate Cancer. Intern Med. 2016;55(22):3387–92. https://doi.org/10.2169/internalmedicine.55.7039.
Article
PubMed
PubMed CentralGoogle Scholar
-
Voit FM, Abdelhafez M, Rothe K, Slotta-Huspenina J, Gaa J, Schmid RM, et al. Disseminated tuberculosis mimicking metastatic gastric cancer-a case report. Z Gastroenterol. 2019;57(12):1487–92. https://doi.org/10.1055/a-1030-4781.
Article
PubMedGoogle Scholar
-
Hajjar W, Ahmed I, Aljetaily S, Al-Obaidan T, Hajjar AW. Endobronchial tuberculosis simulating carcinoid tumor. J Coll Physicians Surg Pak. 2018;28(3):S39-41. https://doi.org/10.29271/jcpsp.2018.03.S39.
-
Di Giovanni SE, Cunha TM, Duarte AL, Alves I. Endometrial tuberculosis simulating an ovarian cancer: a case report. Acta Med Port. 2016;29(6):412–5. https://doi.org/10.20344/amp.7706.
-
Wang H, Qu X, Liu X, Ding L, Yue Y. Female peritoneal tuberculosis with ascites, pelvic mass, or elevated CA 125 mimicking advanced ovarian cancer: A retrospective study of 26 cases. J Coll Physicians Surg Pak. 2019;29(6):588–9. https://doi.org/10.29271/jcpsp.2019.06.588.
-
Gera K, Kishore N. Image diagnosis. Endobronchial tuberculosis masquerading as an Endobronchial tumor with presentation as middle lobe syndrome. Perm J. 2017;21:16–006. https://doi.org/10.7812/TPP/16-006.
Article
PubMedGoogle Scholar
-
Sassalos TM, Rao RC, Demirci H. Ocular tuberculosis masquerading as a tumor. Lancet Infect Dis. 2018;18(8):924. https://doi.org/10.1016/S1473-3099(18)30123-3.
Article
PubMed
PubMed CentralGoogle Scholar
-
Daoudi M, Herrak L, Ftouh ME, Achachi L. [Pseudotumoral bronchopulmonary tuberculosis mimicking cancer in an immunocompetent patient]. Pan Afr Med J. 2019;32:170. doi:https://doi.org/10.11604/pamj.2019.32.170.18129.
-
Moukit M, Fadel FA, Kouach J, Babahabib A, Dehayni M, Rahali DM. Pseudo-tumoral peritoneal tuberculosis mimicking ovarian cancer: an important differential diagnosis to consider. Pan Afr Med J. 2016;25:193. https://doi.org/10.11604/pamj.2016.25.193.10929.
-
Pilaniya V, Gera K, Kunal S, Shah A. Pulmonary tuberculosis masquerading as metastatic lung disease. Eur Respir Rev. 2016;25(139):97–8. https://doi.org/10.1183/16000617.00002315.
Article
PubMedGoogle Scholar
-
Nowakowska-Arendt A, Jagiełło G. Pulmonary tuberculosis mimicking numerous lung metastases—a case study. Med Res J. 2018;3(1):43–6. https://doi.org/10.5603/MRJ.2018.0008.
-
Yates JA, Collis OA, Sueblinvong T, Collis TK. Red snappers and red herrings: pelvic tuberculosis causing elevated CA 125 and mimicking advanced ovarian cancer. A case report and literature review. Hawaii J Med Public Health. 2017;76(8):220–4. 28808611.
PubMed
PubMed CentralGoogle Scholar
-
Schmidt-Lauber C, Jacobi J, Polifka I, Hilgers KF, Wiesener MS. Suspected colonic cancer turns out to be disseminated tuberculosis in a kidney transplant recipient: a case report. Medicine (Baltimore). 2019;98(36):e16995. https://doi.org/10.1097/MD.0000000000016995.
Article
Google Scholar
-
Lan C-C, Wu C-W, Wu Y-K. Systemic tuberculosis mimicking lung Cancer with multiple metastases. Am J Med Sci. 2020;359(3):186–7. https://doi.org/10.1016/j.amjms.2019.09.006.
Article
PubMedGoogle Scholar
-
Rodpenpear N. Tuberculosis of cervix resembling cervical Cancer. J Med Assoc Thail. 2016;99(Suppl 8):S249–52. 29906057.
Google Scholar
-
Vamsi Krishna S, Mallikarjunaswamy B, Issac T, Srinivasalu S. Tuberculosis of knee joint mimicking giant cell tumor-a case report. Indian J Tuberc. 2018;65(3):260–1. https://doi.org/10.1016/j.ijtb.2016.09.021.
Article
PubMedGoogle Scholar
-
Sellami M, Mnejja M, Charfi S, Ghorbel A. Tuberculosis of the tonsil simulating a cancer. Lancet Infect Dis. 2017;17(12):1317. https://doi.org/10.1016/S1473-3099(17)30315-8.
Article
PubMedGoogle Scholar
-
Setio AAA, Traverso A, De Bel T, Berens MS, van den Bogaard C, Cerello P, et al. Validation, comparison, and combination of algorithms for automatic detection of pulmonary nodules in computed tomography images: the LUNA16 challenge. Med Image Anal. 2017;42:1–13. https://doi.org/10.1016/j.media.2017.06.015.
Article
PubMedGoogle Scholar
-
MacMahon H, Naidich DP, Goo JM, Lee KS, Leung ANC, Mayo JR, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the Fleischner society 2017. Radiology. 2017;284(1):228–43. https://doi.org/10.1148/radiol.2017161659.
-
Dursun P, Ersoz S, Gultekin M, Aksan G, Yüce K. Ayhan A. Disseminated peritoneal tuberculosis mimicking advanced-stage endodermal sinus tumor: a case report. 2006;16(Suppl 1):303–7. https://doi.org/10.1111/j.1525-1438.2006.00205.x.
Article
Google Scholar
-
Falagas M, Kouranos V, Athanassa Z, Kopterides P. Tuberculosis and malignancy. QJM. 2010;103(7):461–87. https://doi.org/10.1093/qjmed/hcq068.
Article
CAS
PubMedGoogle Scholar
-
Denning DW, Page ID, Chakaya J, Jabeen K, Jude CM, Cornet M, et al. Case definition of chronic pulmonary aspergillosis in resource-constrained settings. Emerg Infect Dis. 2018;24(8):e171312. https://doi.org/10.3201/eid2408.171312.
Article
PubMed CentralGoogle Scholar
-
Onuigbo WI. Some nineteenth century ideas on links between tuberculous and cancerous diseases of the lung. Br J Dis Chest. 1975;69:207–10. https://doi.org/10.1016/0007-0971(75)90081-9.
Article
CAS
PubMedGoogle Scholar
-
Aquino SL. Imaging of metastatic disease to the thorax. Radiol Clin N Am. 2005;43(3):481–95. https://doi.org/10.1016/j.rcl.2005.02.006.
Article
PubMedGoogle Scholar
-
Kawaguchi K, Taniguchi T, Fukui T, Nakamura S, Yokoi K. Radiological findings and surgical outcomes of pulmonary metastases originating from biliary tract carcinoma. Gen Thorac Cardiovasc Surg. 2019;67(11):962–8. https://doi.org/10.1007/s11748-019-01122-6.
Article
PubMedGoogle Scholar
-
Khan F. Review of literature on disseminated tuberculosis with emphasis on the focused diagnostic workup. J Family Community Med. 2019;26(2):83–91. https://doi.org/10.4103/jfcm.JFCM_106_18.
Article
PubMed
PubMed CentralGoogle Scholar
-
Chierakul N, Boonsuk J, Muangman N, Totanarungroj K. Radiographic features for predicting smear-negative pulmonary tuberculosis. J Med Assoc Thail. 2016;99(6):697–701.
Google Scholar
-
Scarà S, Bottoni P, Scatena R. CA 19-9: biochemical and clinical aspects. Adv Exp Med Biol. 2015;867:247–60. https://doi.org/10.1007/978-94-017-7215-0_15.
Article
CAS
PubMedGoogle Scholar
-
Pavai S, Yap S. The clinical significance of elevated levels of serum CA 19-9. Med J Malaysia. 2003;58(5):667–72.
CAS
PubMedGoogle Scholar
-
Bhatia V, Garg PK, Arora VK, Sharma R. Isolated pancreatic tuberculosis mimicking intraductal pancreatic mucinous tumor. Gastrointest Endosc. 2008;68(3):610–1. https://doi.org/10.1016/j.gie.2007.12.022.
Article
PubMedGoogle Scholar
-
Yang Y-J, Li Y-X, Liu X-Q, Yang M, Liu K. Pancreatic tuberculosis mimicking pancreatic carcinoma during anti-tuberculosis therapy: A case report. World J Clin Cases. 2014;2(5):167–169. doi: https://doi.org/10.12998/wjcc.v2.i5.167.
Download references
Acknowledgements
Not applicable.
Funding
This work was supported by Natural Science Foundation of Jiangsu province (Grant No. BK20170133) and social development project of key research and development plan of Jiangsu province (Grant No. BE2018606).
Author information
Authors and Affiliations
-
Department of Tuberculosis, the Second Hospital of Nanjing, Nanjing University of Chinese Medicine, 1-1 Zhongfu Road, Gulou District, Nanjing, Jiangsu Province, 210003, China
Tian-Xing Hang, Gang Fang, Yan Huang & Chun-Mei Hu
-
Clinical Research Center, the Second Hospital of Nanjing, Nanjing University of Chinese Medicine, 1-1 Zhongfu Road, Gulou District, Nanjing, Jiangsu Province, 210003, China
Wei Chen
Authors
- Tian-Xing Hang
You can also search for this author in
PubMed Google Scholar - Gang Fang
You can also search for this author in
PubMed Google Scholar - Yan Huang
You can also search for this author in
PubMed Google Scholar - Chun-Mei Hu
You can also search for this author in
PubMed Google Scholar - Wei Chen
You can also search for this author in
PubMed Google Scholar
Contributions
TXH and GF conducted the literature review and wrote the draft. YH collected clinical data. CMH and WC conceived the study and revised the manuscript. The author(s) read and approved the final manuscript.
Corresponding authors
Correspondence to
Chun-Mei Hu or Wei Chen.
Ethics declarations
Ethics approval and consent to participate
Written consent was exempted by the institutional review boards of the Second Hospital of Nanjing, since no identifying images or other personal information were included.
Consent for publication
All authors have read and approved the manuscript.
Competing interests
The authors declare that they have no competing interests.
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made. The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder. To view a copy of this licence, visit http://creativecommons.org/licenses/by/4.0/. The Creative Commons Public Domain Dedication waiver (http://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Hang, TX., Fang, G., Huang, Y. et al. Misdiagnosis of a multi-organ involvement hematogenous disseminated tuberculosis as metastasis: a case report and literature review.
Infect Dis Poverty 9, 66 (2020). https://doi.org/10.1186/s40249-020-00681-8
Download citation
-
Received: 24 February 2020
-
Accepted: 26 May 2020
-
Published: 09 June 2020
-
DOI: https://doi.org/10.1186/s40249-020-00681-8
Keywords
- Misdiagnosis
- Hematogenous disseminated tuberculosis
- Metastasis
- Pulmonary nodule
Флюорографическое исследование — скрининговый и бюджетный способ диагностирования туберкулёза среди населения.
Эпидемии удалось победить ещё много лет назад, но вспышки этого заболевания заставляют врачей держать вопрос на контроле. Поэтому на уровне государства принято решение об обязательном прохождении диагностики.
Флюорография туберкулёза поможет своевременно предположить первые признаки заболевания.
Флюорограф цифровой сканирующий (самый безопасный и современный метод диагностики)
Флюорографическое исследование является разновидностью рентгеновской диагностики. При флюорографии через тело человека пропускаются лучи. Отражаясь от тканей различной плотности, исследование в результате показывает картинку из 256 оттенков чёрного и белого цвета, которые визуализируют органы грудной клетки.
При прохождении исследования организм подвергается воздействию лучевой нагрузки. Высокие дозы могут принести пациенту неприятности со здоровьем, но прохождение флюорографии один раз в год не несёт никакого вреда. Ввиду сохранения риска мутаций клеток, исследование не рекомендуют проходить чаще предписанного срока.
Процедура исследования отличается некоторыми особенностями, которые позволили внедрить её в массовую практику. Это мощная профилактика выявления эпидемических очагов и локальных вспышек, помогающая сохранить здоровье и жизнь людям. Особенности флюорографии состоят в следующем:
Снимок лёгких — норма
- бюджетный вид диагностики — каждая больница обеспечена флюорографическими установками, и врач даёт направление на бесплатную диагностику органов грудной клетки. Для большего охвата населения есть бесплатные передвижные флюорографические установки (приезжают в отдалённые районы, на крупные предприятия, к людям с ограниченными возможностями). При таких методах обследуются бесплатно широкие массы населения;
- быстрота проведения — проводится флюорографическое исследование максимально быстро. Время пребывания в кабинете — 5-7 минут. За это время доктор-рентгенолог подготавливает аппарат к снимку, записывает данные больного. Пациент раздевается до пояса и становится перед матрицей. Дальнейшие действия проходят под рекомендациями врача — пациент прижимается к матрице, задерживает вдох и через несколько секунд снимок готов;
- неинвазивность — процедура флюорографии неинвазивная и безболезненная. Это значит, что показать туберкулёз может без нарушения целостности кожного покрова, приёма контрастного вещества;
- информативность — главная особенность флюорографии. С высокой вероятностью покажет туберкулёз, визуализируя на снимке очаг воспаления.
Противопоказания
Флюорография (цифровая) является безопасной процедурой и не несёт риски для здоровья человека. Всё дело в дозе получаемого облучения. При прохождении исследования, высокой нагрузки пациент не получает, к тому же излучение со временем выводится из организма.
Если же организм получает высокую нагрузку, то могут начаться патологические процессы на клеточном уровне и человеку грозят неприятные последствия, вплоть до развития онкологии. Для таких последствий нужно получать чрезвычайно высокое излучение, которое в условиях флюорографического кабинета просто невозможно.
Флюорографию не проводят:
- детям до пятнадцати лет — достаточно реакции Манту у детей, чтобы подтвердить отсутствие туберкулёзного агента;
- беременным женщинам и кормящим матерям;
- лежачим больным, которые не способны вертикально поддерживать корпус тела;
- пациентам с дыхательной недостаточностью.
Для пациентов этих категорий проводятся другие исследования, а беременным женщинам флюорографию делают после родов.
Формы туберкулёза и их признаки
Туберкулёз лёгких на флюорографии не отчётливо заметен, поэтому врач направляет на рентген лёгких в двух проекциях.
На рентгене определяют несколько типов патологии, которые сопровождаются различными признаками. Формы туберкулёза:
Синдром уплотнения. Очаг низкой и средней плотности. Туберкулез.
- туберкулёз внутригрудных лимфоузлов — проявляется как расширение корня лёгкого, контуры размыты и неоднородные, заметны соединительнотканные тяжи, наличие кальцинатов;
- диссеминированный туберкулёз — характеризуется множественными участками затемнения. Такие участки составляют не более 2 мм, поэтому увидеть бывает непросто. Они имеют чёткие границы и разбросаны по лёгкому, а при прогрессировании заболевания сливаются в крупные очаги;
- очаговый туберкулёз — образование затемнения от одного до двух сантиметров, имеет чёткие границы и локализовано в любой части лёгкого. При обострении заболевания очаги сливаются друг с другом;
- инфильтративный — признаки туберкулёза визуализируются как белёсые образования с неровными краями. Обнаруживается в верхних долях лёгкого и имеет характерные дорожки;
- казеозная форма туберкулёза — одна из тяжёлых форм. На снимке патологический участок занимает почти всё лёгкое. Затемнения однородные, но меняются по ходу течения заболевания;
- кавернозный — при туберкулёзе появляется полость с очагом распада, которая видна как тёмное новообразование со светлым пятном внутри;
- фиброзно-кавернозный — помимо характерной каверны становятся заметными участки фиброза, лёгочный рисунок деформирован, может отмечаться смещение органов;
- цирротический — затемнения в одной или обеих долях. Лёгкие уменьшены в объёме, а корень лёгкого приближен к участку патологии;
- туберкулёзный плеврит — заболевание с типичными признаками патологии в нижней доле лёгкого, на снимке определяют выпотный плеврит;
- милиарный — множественные очаги поражения, которые накладываются друг на друга. Расположены равномерно в двух лёгких.
Ошибки при диагностике
Фиброзно-кавернозный туберкулез
При диагностике заболевания врачи могут допускать ошибки. Чаще причина неправильных диагнозов кроется в несоответствии клинической картины от рентгенологической на флюорограммах. Как правило, ошибки приводят к постановке диагноза пневмония. Происходит это по причине изменения течения этих заболеваний. Например, врачи часто встречают случаи стёртой пневмонии, которая не даёт выраженных признаков, в то же время некоторые стадии туберкулёза чаще проявляются как ярко выраженная пневмония, поэтому и возникают трудности в диагностике этих заболеваний.
Из-за того, что признаки схожи и определение затрудняется, врачи тщательно разбирают данные о пациенте — жалобы, данные внешнего осмотра, клинические проявления, изучаются отличия мокроты. Для снижения радиационной нагрузки контроль проводят на цифровых аппаратах. Как отличить пневмонию — подскажут сами снимки органов грудной клетки.
Сигналы к проведению исследования
Срочный рентген лёгких понадобится при возникновении признаков, указывающих на туберкулёз. К ним относят:
- слабость;
- потеря веса;
- длительно не проходящий сухой или мокрый кашель;
- присутствие крови в мокроте;
- приступы гипергидроза по ночам;
- боль в груди;
- одышка;
- повышение температуры до субфебрильной без видимых причин;
- отсутствие аппетита.
Если у человека есть эти признаки, то требуется пройти рентген, независимо от того, истёк ли срок прошлой диагностики.
Расшифровка результатов
Для расшифровки результатов необходимы сутки. Через этот промежуток времени больной получает выписку о том, есть туберкулёз или нет.
Врачи при расшифровке результатов внимательно изучают признаки патологического затемнения в лёгких, корень лёгкого, бронхи, наличие кальцинатов. Эти признаки говорят о той или иной форме туберкулёза.
Чтобы исключить вероятность врачебных ошибок в некоторых клиниках снимки изучают два врача.
Флюорография при туберкулёзе — чрезвычайно ценное диагностическое исследование, но только для определения первичных симптомов, для уточнения диагноза врач отправляет на дополнительное исследование — рентген лёгких. Исследование помогает увидеть болезнь на ранней стадии — благодаря этому начинают своевременное лечение заболевания, изолировав больного от здорового окружения.
Видео
Флюорография туберкулез: как распознать заболевание на снимке — Сайт о методах диагностики организма
Инкубационный период туберкулеза может длиться несколько лет. Микробактерии заболевания способны поражать любую ткань организма, за исключением ногтей и волос.
Наиболее частое место их локализации – легкие. Для диагностики болезни используют различные виды томографий, флюорографию, а также рентгенографию в боковой и прямой проекциях.
Чаще всего врачи выявляют туберкулез легких на рентгене или флюорографии.
Подозрение на туберкулез становится прямым показанием к рентгену грудной клетки. Рентгенография входит в обязательные стандарты диагностики. Снимок назначают, чтобы:
- опровергнуть или подтвердить присутствие болезни;
- отличить туберкулез от заболеваний легких с похожими симптомами (пневмония, абсцесс, силикоз);
- выявить степень поражения легких, распространенность и локализацию процесса.
Рентгенография необходима, если больной обращается с жалобами на кашель, слабость, повышенное потоотделение, снижение веса, одышку и боли в груди. Направить пациента на обследование врачи обязаны также при положительной реакции Манту (туберкулиновой пробе) и увеличении ее более чем на 6 мм по отношению к предыдущему исследованию.
В отличие от рентгена, флюорография – это профилактическое исследование. Прямых показаний к ее прохождению нет. Процедура проводится при диспансеризации, даже если человеку была сделана прививка БЦЖ. Главное преимущество этого метода перед рентгеном – низкая стоимость. Поэтому флюорографию широко используют для плановых обследований населения.
Оба метода рекомендуют применять не чаще одного раза в год. В таких дозах излучение безопасно для пациента. Лучевая нагрузка при рентгенографии ниже, чем при проведении флюорографии.
Современные методы позволяют использовать цифровые технологии для проведения обследования. При этом врач может увеличивать и уменьшать изображения на компьютере, чтобы лучше разглядеть очаги поражения.
Рентгенодиагностика туберкулеза, как и флюорография не требует специальной подготовки.
Признаки различных форм туберкулеза на рентгеновском снимке
Туберкулез легких может проявляться по-разному. В зависимости от формы заболевания будут разниться и рентгенологические признаки болезни. Характер патологии определяет врач, сделав расшифровку полученных результатов.
Рентген-снимки дают возможность не только увидеть наличие или отсутствие заболевания, но и определить область его локализации и характер поражения.
От того, как выглядит туберкулез на рентгене, будет зависеть дальнейшая тактика лечения.
Поражения, связанные с лимфатическими узлами грудной полости
Поражения внутригрудных лимфатических узлов при туберкулезе часто встречается у подростков и детей раннего возраста. При этом, на снимке отчетливо становится видно расширение тени корня легкого.
Обобщенно термином «корень легкого» называют бронхи и главные сосуды.
На стороне поражения тень имеет размытый контур и неоднородную структуру. Ясно видны перемычки соединительной ткани.
На снимке также просматриваются кальцинаты – участки легкого, ткань которых подверглась обызвествлению. Так организм пытался самостоятельно локализовать болезнь, заключая инфекцию в оболочку из твердых органических веществ.
На снимке кальцинаты остаются видны даже после выздоровления больного.
Поэтому ответ на вопрос, виден ли туберкулез на рентгене, в этом случае положительный.
Диссеминированный туберкулез
При этом виде туберкулеза на рентгенограмме видны мелкие многочисленные очаги затемнения. Их диаметр обычно не превышает 2 мм. Очаги имеют четкие границы, располагаются они по всему легочному полю в больших количествах.
При сложных формах «точки» на снимке сливаются в крупные конгломераты. Если найти в интернете или медицинских энциклопедиях рентген-снимки легких при туберкулезе с описанием, можно заметить, что эта форма болезни примерно у 30 % пациентов обнаруживается случайно при плановом обследовании.
Очаговый легочный туберкулез
У больного очаговым туберкулезом на рентгенограмме видны участки (очаги) затемнения. Их диаметр достигает 1-2 см. Участки чаще всего имеют округлую форму. Реже – эллиптическую или вытянутую.
По цвету на снимке очаги темнее костной ткани. Пораженные участки имеют склонность к слиянию.
Рентген при очаговой форме туберкулеза часто показывает, что болезнь развивается, как осложнение ранее пролеченного первичного туберкулеза.
Инфильтративный легочный туберкулез
Инфильтративный туберкулез характеризуется присутствием в легких очагов инфильтрации. На снимке они проявляются как одиночные или многочисленные затемнения одинаковой консистенции. Очаги имеют белый цвет. Края их неровные. Чаще всего инфильтраты локализуются в верхних долях легких. От затемненного участка прослеживается «дорожка», идущая к легочному корню.
Рентгенологические признаки туберкулеза легких в этом случае говорят о тяжелой форме течения болезни, поскольку инфильтрат представляет собой скопление клеток с примесью крови. Такое состояние может указывать на слабость антител, способных противостоять микобактерии Коха.
Без срочного лечения, бактерии начинают разрушать не только легкие, но и соседние органы. Такая открытая форма болезни встречается достаточно часто. Рентген при инфильтративной форме туберкулеза позволяет определить, начался ли распад тканей легкого или его можно предотвратить.
Казеозная пневмония
Казеозная пневмония – тяжелая форма туберкулеза легких. На снимках она проявляется значительным затемнением нескольких долей или всего легкого. Вначале орган имеет однородную структуру. По мере распада появляются очаги затемнения или просветления. Легкое становится негомогенным.
Кавернозный легочный туберкулез
Рентген при кавернозной форме туберкулеза часто отображает «дорожку», ведущую к корню органов дыхания. Основной признак, который показывает данный тип заболевания на рентгене – это затемнение со светлым четким участком в центре. Такой участок называется каверна. Это абсцесс, который имеет округлую форму и располагается обычно ближе к периферии.
Фиброзно-кавернозный туберкулез легких
Рентгенограмма при фиброзно-кавернозной форме туберкулеза легких показывает разрастание соединительной ткани и деформацию формы органа. На снимках также может прослеживаться «дорожка» к корню легкого, в тяжелых случаях часть тканей легкого отмирает.
На рентгеновских снимках больных фиброзно-кавернозным легочным туберкулезом отчетливо видны участки фиброза и старые каверны. Заметна также деформация легочного рисунка. У человека, страдающего данной формой туберкулеза, часто развивается сопутствующая патология – плеврит. Ее отчетливо видно на снимках в нижних частях дыхательных органов.
В некоторых случаях средостенные органы могут смещаться в сторону поражения. Как и рентгенологические признаки туберкулезного спондилита (болезнь Потта – инфекционное поражение позвоночника), такие снимки говорят о тяжелой форме заболевания.
Цирротический легочный туберкулез
На рентгенограмме цирротический легочный туберкулез проявляется выраженным затемнением одной или нескольких долей легких. Корень легкого подтягивается вверх и смещается в сторону поражения. Объем пораженных долей легких уменьшается. Это запущенная стадия болезни, которая, как правило, выявляется в случаях, когда рентген при первичном туберкулезном комплексе не был назначен.
Туберкулезный плеврит легких
Туберкулезный плеврит на рентгенограмме виден, как интенсивное затемнение. Оно локализовано обычно в нижних отделах легких и имеет четкую косую или горизонтальную верхнюю границу. Плеврит может быть:
- выпотным. На снимке заметно однородное затемнение легочной ткани с косым верхним уровнем жидкости (если скапливается больше 1 л. При меньшем объеме наблюдается затемнение нижне-бокового синуса)
- сухим. На рентгенограмме можно заметить лишь по небольшому снижению прозрачности на периферии легочной ткани
- гнойным.
Милиарный туберкулез
На рентгенограмме больного милиарным туберкулезом визуализируются небольшие очаги поражения, диаметром 2-3 мм. Они имеют четкие границы и не сливаются друг с другом. Процессы протекают равномерно в обоих областях легочных полей. Из-за этого сосудистый рисунок легкого бывает практически невозможно оценить.
В первые дни болезнь не заметна на снимках.
Рентген при милиарной форме туберкулеза покажет заболевание примерно через 10 дней после попадания микробактерий в кровь. Мельчайшие очаги проявляются на второй-третьей неделе от начала болезни. Картина долго остается стабильной даже во время лечения. Очаги при этом не сливаются.
Флюорография позволяет врачам оценить состояние легких и при необходимости назначить дополнительные лабораторные исследования. Несмотря на то, что метод применяют как профилактический, он часто позволяет увидеть заболевание даже на ранних стадиях.
Флюорография при профилактике туберкулеза широко применяется не только в России, но и в других странах. Согласно статистическим данным, регулярные обследования грудной клетки значительно снижают риск развития заболевания.
Флюорография грудной клетки покажет долю легких, в которой начинаются патологические изменения. Глядя на снимок, врач может оценить предполагаемую скорость развития болезни, сегментарность поражения, а также другие нюансы.
Ответ на вопрос, показывает ли флюорография туберкулез на ранних стадиях, неоднозначный. Риск ошибочной диагностики существует, но незначительный. На качество снимка может повлиять техническая неисправность или несоблюдение правил проведения обследования. В этом случает существует вероятность увидеть, как ложно положительные, так и ложно отрицательные результаты.
Однако дополнительная диагностика позволяет пациентам быть уверенными в правильности диагноза. Флюорография показывает туберкулез, не сразу. В первые дни увидеть болезнь на снимках не всегда бывает возможно.
Обследование на поздних стадиях
ФЛГ-обследование на поздних стадиях болезни позволяет не только увидеть изменения, но и отнести их в нужную категорию. Снимок дает возможность четко идентифицировать искажения органов грудной клетки. Опытный пульмонолог по полученным данным поставит точный диагноз. На вопрос можно ли определить туберкулез по флюорографии на поздних стадиях, специалисты отвечают утвердительно.
При расшифровке результатов обследования врач определяет долю легкого, которая поражена, сегментарность, предполагаемую скорость развития воспаления и другие нюансы. Все отклонения от нормы на поздних стадиях отчетливо видны на снимках.
Поскольку метод исследует те же области, что и рентген, оценить, как выглядит туберкулез на снимке флюорографии можно, прочитав предыдущий раздел данной статьи.
Важно помнить, что справиться с туберкулезом без последствий можно только, если болезнь была обнаружена на ранней стадии. Поэтому государство настаивает на ежегодном прохождении гражданами флюорографии. Отсутствие симптомов не означает отсутствие заболевания.
Четкое следование указаниям врача, позволяет пациентам надеяться на благоприятный исход, независимо от того, как выглядят легкие при туберкулезе на флюорографии.
Заключение
Выраженность картины на снимке зависит от периода и сложности течения болезни. На флюорографии и рентгене могут быть видны четкие очаги туберкулеза или «дымки».
Здоровые легкие заполнены воздухом и на снимке выглядят полупрозрачными. Участки болезни имеют белые и черные зоны. Заметно также изменение величины сосудов.
В редких случаях у пациента может быть туберкулез, если флюорография в норме. Важно понимать, что метод не способен выявить бактерию, спровоцировавшую появление болезни. Как и рентген, показывает только последствия. Чтобы точно подтвердить наличие в крови палочки туберкулеза необходимы лабораторные анализы крови (ИФА, ПЦР).
Обследование грудной клетки может выявить только туберкулез легких и не показывает поражения других органов. Тем не менее, роль флюорографии в раннем выявлении туберкулеза огромна. Врачи-рентгенологи сравнивают результаты на снимке с нормами по выверенным таблицам. С их помощью составляется полная картина болезни.
Как и при любой диагностике, флюорография и рентген не исключает возможность технической ошибки и не гарантируют выявление болезни на ранней стадии. Ложный результат рентгенодиагностика туберкулеза легких может, например, показать из-за аномалий органов грудной клетки. В этом случае специалисту помогает история болезни пациента.
Процесс рубцевания тканей, который только начинается, также может быть не заметен. Без дополнительных обследований это повлечет за собой неверную трактовку снимка.
Чтобы не сомневаться, может ли флюорография или рентген не показать туберкулез, рекомендовано дополнить диагностику МРТ, КТ, УЗИ, биопсией и обратиться к высококвалифицированному фтизиатру.
- Только совокупность различных исследований позволяет врачу представить общую картину болезни и поставить точный диагноз.
Флюорография при туберкулезе легких: показывает ли заболевание и как выглядит на снимке?
С каждым годом медицина все больше развивается. Ученые создают новые лекарства от различных заболеваний, изготавливают инновационное оборудование. Постоянное развитие технологий способствует поиску новых методов изучения болезней.
Особенно актуально вопрос стоит о таком заболевании, как туберкулез легких. Течение и развитие болезни может определить флюорография. Это метод был создан еще в двадцатом веке и до сегодняшнего дня является одним из самых популярных и достоверных.
Что такое «флюорография»?
Флюорография – это метод, с помощью которого просматриваются легкие и органы грудной клетки. Еще его называют методом рентгенодиагностики. На сегодняшний день флюорография чаще всего является методом профилактической диагностики туберкулеза, а также заменяет рентген людям, которым требуется повторная диагностика.
Основной функцией такого исследования является быстрое выявление скрытых заболеваний легких.
С помощью флюорографии можно выявить туберкулез, даже когда заболевание находится на ранних стадиях.
Особенно актуальным передвижной аппарат флюорографии становится для людей, живущих в местности, недоступной для установления стационарного оборудования.
Флюорография при туберкулезе проводится при помощи разной рентгенодиагностической аппаратуры:
- пленочная флюорография – облучение грудной клетки в среднем на одного человека идет в размере 0,5 миллизиверта за один раз. Такая доза считается достаточно высокой и может иметь некоторые противопоказания;
- цифровая флюорография – облучение грудной клетки в размере 0,03 миллизиверта. Она значительно снижает дозу облучения, что делает ее безопаснее. А также намного качественнее передает сигнал, а значит, и показывает результат.
Флюорографический метод профилактики заболеваний легких подходит не всем.
Дети и взрослые по-разному проходят рентгенодиагностику: для детей этот метод назначается только для подтверждения диагноза, для взрослых – ежегодно в качестве профилактики. Процедура проходит следующим образом:
- пациент оголяет грудную клетку, снимает одежду и все предметы на теле (цепочки, сережки, крестики) до пояса;
- для того чтобы снимок был четким, требуется задержать дыхание на несколько секунд и не двигаться;
- пациент становится лицом к специальному экрану и прилаживает плечи плотно к нему:
- врач говорит, когда следует сделать глубокий вдох и не двигаться через несколько минут процесс рентгенодиагностики завершен;
- результаты обрабатываются и предоставляются пациенту.
Процедура очень быстрая, все зависит от того, в каком физическом состоянии находится человек. Если пациент – инвалид или маленький ребенок, то для снимка понадобятся определенные условия. В основном детям поднимают руки над головой или пристегивают специальными приспособлениями.
Диагностика туберкулеза при помощи этого метода
Сегодня существует мнение, что туберкулез – это заболевание людей, которые имеют низкий социальный статус. К сожалению, это только стереотип. Туберкулезом может заразиться каждый человек, вне зависимости от положения в обществе.
Конечно же, существует определенная «группа риска» людей, которые более подвержены этому заболеванию (люди с иммунодефицитом, находящиеся в местах заключения, пожилые люди).
Туберкулез – болезнь, которая передается воздушно-капельным путем. Обнаружен он был еще в восьмидесятых годах девятнадцатого века. Возбудителем заболевания является палочка Коха. Она опасна тем, что имеет очень большой порог устойчивости к внешним факторам окружающей среды.
Метод флюорографии может показать заболевание на ранних стадиях. Это способствует быстрому и эффективному лечению, уменьшает риск заражения окружающих и развития эпидемии. Рентгенодиагностика производится без предварительного обследования человека. Регулярное обследование грудной клетки значительно снижает риск заболеваний.
Если человек обращается в больницу, в обязательном порядке ему назначают флюорографию — на сегодняшний день рентгенодиагностика просто незаменима в выявление такого заболевания, как туберкулез.
Если у человека имеются нарушения, аппарат сразу их выявит. Он имеет большую пропускную способность и быстро передает данные о состоянии органов грудной клетки. Эти данные выводятся на экран, который просматривает специалист.
Также при помощи снимка можно установить окончательный диагноз.
Формы туберкулез на снимках
Туберкулез на снимках бывает нескольких видов:
- очаговый туберкулез легких – на снимке такое заболевание появляется как маленькие пятнышки в виде очагов. Их локализация в верхней части легкого и под ключицей. О чаги могут распространяться по всей поверхности органа. Без должного лечения заболевание приводит к фиброматозу;
- инфильтративный туберкулез легких– рецидив, который стал результатом очагового туберкулеза. Он осложняется тем, что приводит к отмиранию тканей и выведению их через кашель и мокроту. В мокроте содержатся бактерии, провоцирующие заражение других людей. Инфильтративный туберкулез имеет открытую форму, на снимках проявляется в виде темных пятен неопределенной конфигурации;
- фиброзно-кавернозный хронический туберкулез – при такой форме будут видны темные пятна, которые покрывают всю поверхность легких. Заболевание переходит в стадию, когда начинает развиваться фиброз и кровотечения. Также оно затрагивает гортань и кишечник.
Если рентгенодиагностика происходит на поздних стадиях, то нередко болезнь сопровождается осложнениями:
- туберкулез гортани;
- туберкулез кишечника;
- туберкулез мочеполовой системы.
Все осложнения довольно тяжелые и на снимках их видно очень хорошо. Своевременное лечение может предотвратить развитие этих заболеваний.
Расшифровка результатов
Результат, полученный в ходе исследования грудной клетки, обязательно следует расшифровать. Существуют специальные таблицы, в которых установлены нормы для каждого заболевания. Опытные специалисты знают, что снимок больных легких имеет неоднородный цвет. Некоторые органы плохо поглощают рентгеновские лучи, поэтому на снимке могут быть темные участки.
Здоровые легкие на снимке отображаются равномерным цветом. При воспалительном процессе показываются затемнения, а если это воздушность ткани, то светлые участки.
После проведения процедуры рентгенодиагностики врач в обязательном порядке должен дать описание.
- различной интенсивности изображения на снимке;
- увеличении размера сосудов;
- разнообразных пятнах и очагах;
- тенях;
- запаянном синусе.
Описание снимка может происходить в течение нескольких дней. Все зависит от квалифицированности врача и качественности аппаратуры.
Существуют несколько причин, по которым нельзя делать флюорографию легких. Она противопоказана:
Как выглядит туберкулез на флюорографии
Общеизвестно, что, если приступить к лечению болезни на ранних стадиях, то гораздо больше шансов на благоприятный исход. Очень важна и профилактика. Для своевременного диагностирования большинства известных заболеваний достаточно регулярно проходить соответствующие обследования.
Чтобы выявить туберкулёз, выбирают один из двух основных способов – рентгено- или флюорографию.
Конечно, существуют и альтернативные методики – туберкулиновые пробы, Диаскинтест, анализы крови и посева мокроты, компьютерная томография. Но в предложенной статье мы рассмотрим самый популярный – флюорографию (ФЛГ).
Будут даны ответы на вопросы: «Настолько точно может выявить флюорография туберкулез?», «Как выглядят лёгкие больного на снимке?», «Возможны ли ошибки?»
Общая информация о болезни и специфике проведения процедуры
Несмотря на неограниченный доступ к информации, в обществе по-прежнему доверяют ошибочным стереотипам. Один из них связан с туберкулёзом. Некоторые всё ещё считают, что это болезнь, поражающая исключительно представителей низшего социального статуса. Это не так. Инфекция не избирательна к достатку человека, в организм которого она попадает.
Риск заразиться туберкулёзом есть у любого человека, он передаётся воздушно-капельным путём, при обычном бытовом контакте от носителя к здоровому человеку.
Однако есть люди, более подверженные риску заболеть:
- пожилые;
- военные;
- заключённые;
- лица без определённого места жительства;
- лица с вредными для здоровья привычками;
- те, у кого серьёзные проблемы с иммунитетом.
Возбудитель туберкулёза – микобактерия палочка Коха. Она была идентифицирована ещё в восьмидесятых годах позапрошлого века. Опасность инфекции в том, что она крайне устойчива к окружающим условиям.
Микроорганизм длительное время может оставаться живым на пище, предметах обстановки, даже на пылинках. Туберкулёзом можно заразиться, просто вдохнув пыль с остатками слюны инфицированного человека.
Отсутствие необходимого лечения приводит к летальному исходу, поскольку микобактерии постепенно заполняют собой всё пространство дыхательных путей, разрушают их, и больной задыхается.
Флюорография – метод рентгенологического исследования лёгких и органов грудной клетки. Позволяет выявить скрытые патологии этой зоны.
Она является основной формой профилактической туберкулёзной диагностики (обнаруживает даже начальные специфические изменения) и альтернативой рентгенографии. Обычно её назначают вместо повторного рентгена.
Раннее выявление туберкулёза позволяет назначить своевременное лечение, увеличивает его эффективность, уберегает окружающих от заражения и предотвращает эпидемию.
Флюорография – обязательное обследование. При обращении больного в поликлинику (к какому бы специалисту ни направлялся), он обязательно должен сделать «флюшку».
Эта разновидность рентгенографического исследования была открыта американскими и итальянскими учёными в конце девятнадцатого – начале двадцатого веков. Но более широкое использование метод получил в Бразилии, за несколько лет до начала Второй мировой войны.
Вся процедура сводится к следующим простым действиям.
- Обследуемый снимает с себя все предметы одежды и украшения, остаётся обнажённым до пояса.
- Затем пациент проходит к аппарату, становится лицом к экрану, максимально плотно прижимает к нему плечи и грудную клетку.
- После этого врач даёт команду «Не дышать», и обследуемый задерживает дыхание на несколько секунд. Это необходимо для того, чтобы в момент выполнения снимка дыхательные движения не «смазали» картинку.
В результате флюорографического исследования получается снимок легких, который и используется для проведения дальнейшей диагностики. Рентгенолог расшифровывает изображение и передаёт результаты пациенту или его лечащему врачу.
Обычно процедура не занимает много времени. Если обследование проходит пациент с ограниченной подвижностью, вероятно, потребуются специальные приспособления. Для детей используются удерживающие ремни, либо родитель должен держать ребёнка и его руки в поднятом положении.
Как часто можно делать, и бывают ли ошибки
Современные ФЛГ-аппараты обладают высоким разрешением и при этом довольно компактны.
Они размещаются в специально оборудованных стационарных кабинетах или в передвижных лабораториях (на базе транспортных средств).
Вторые используются для реализации противотуберкулёзных профилактических рейдов, чтобы обследование могли пройти все сотрудники организации, жители целого населенного пункта или вообще все желающие.
Существует два вида флюорографии:
- цифровая – более современный вид. При таком методе происходит значительно меньшее облучение обследуемого, поскольку используется более современное оборудование. Доза радиации за один сеанс – 0,03 миллизиверта. К тому же качество сигнала и изображения, несмотря на уменьшенную площадь картинки, – высокие;
- плёночная – традиционный вид. При нём обследуемый получает большую почти в пятнадцать раз дозу радиации – 0,5 миллизиверта. Эта цифра не превышает разрешённые значения, но при назначении процедуры важно учитывать противопоказания.
Запись результатов исследования на цифровой носитель – огромное преимущество, это даёт возможность показать снимок нескольким врачам даже удалённо, и не возникнет необходимости проходить процедуру повторно.
При отсутствии соответствующих симптомов взрослым специалисты советуют проходить такое обследование не чаще одного раза в год. Справка, полученная в результате исследования, действительна двенадцать месяцев.
Можно определить туберкулез на флюорографии почти со стопроцентной точностью. Однако не стоит полностью исключать врачебные ошибки, так называемый «человеческий фактор».
К тому же были отмечены случаи, когда снимки не показывают туберкулёз, при этом налицо наличие симптомов, характерных для данного заболевания.
Тревожными признаками данной болезни являются затруднённость дыхания и одышка. При появлении таких симптомов необходимо срочно обращаться за медицинской помощью к врачу, который назначит соответствующие обследования.
Должны насторожить те проявления болезни, которые вызывают меньший дискомфорт, однако важны при постановке диагноза. Это внезапная потеря веса и аппетита, слегка повышенная температура, кашель с мокротой, продолжающийся более трёх недель.
- На более поздних стадиях присутствует кашель, при котором отхаркивается кровь.
-
- Существуют и противопоказания к проведению ФЛГ даже при подозрении на туберкулёз. Вот эти случаи:
- беременность;
- онкология;
- лучевая болезнь;
- неспособность принять вертикальное положение;
- наличие болей в груди и сильного кашля.
Не рекомендуется делать процедуру детям, не достигшим пятнадцати лет. Назначение такой формы обследования детям обуславливается только невозможностью установления диагноза другими способами. Мониторинг заболеваемости туберкулёзом среди несовершеннолетних в Российской Федерации проводится путём ежегодной пробы Манту.
При запрете на проведение данной процедуры назначают анализы: мокроты, мочи, крови.
В любом случае, надёжнее сдать дополнительные анализы, поскольку вопрос о том, всегда ли флюорография выявляет заболевание, остаётся открытым. Некорректные результаты процедуры могут стать итогом сбоя в работе оборудования.
Как выглядит туберкулёз на снимке
На снимке обычно видны очаги затемнения, круглой или овальной формы, диаметром примерно в пару сантиметров. Однако попадаются менее крупные тёмные пятна, размером менее пяти миллиметров, а также участки спиралевидной или неправильной формы.
На снимке дифференцируются следующие формы туберкулёза.
- Очаговый. На изображении видны локализованные группы маленьких пятен. Обычно такие скопления фиксируются в верхней части лёгких, под ключицей, но могут распространяться по всей площади органа. В запущенной форме трансформируется в фиброз – патологическое разрастание соединительной ткани.
- Инфильтративный. Осложнение очагового туберкулёза. Характеризуется отмиранием тканей, которые выводятся кашлем с мокротой. Это – открытая форма заболевания, мокрота такого пациента содержит живые микобактерии, он заразен. На снимке видны несимметричные тёмные пятна.
- Фиброзно-кавернозный. На этой стадии тёмные пятна покрывают всю поверхность лёгких, прогрессирует фиброз, возникают кровотечения. Туберкулёзный процесс переходит на другие органы – гортань, кишечник, мочеполовую систему.
Снимок больного туберкулезом отличается от снимка того, у кого имеются другие заболевания, сопровождающиеся кашлем, а также при плеврите.
При кашле получится снимок без тёмных участков.
Плеврит является более серьёзным заболеванием, и отличить его от того же туберкулёза сложнее. При таком диагнозе в лёгких скапливается жидкость объёмом более одного литра.
Симптомом, схожим с туберкулёзом, является длительный кашель с выделением мокроты. На снимке бывает виден скошенный уровень жидкости. Если её скопилось немного, то она будет обнаружена на синусах.
Возможны затемнения в виде двояковыпуклой линзы.
«Затемнения» на снимке выглядят как белые пятна, а само изображение лёгких – тёмное.
Чем отличается от изображения пневмонии
При туберкулёзе видны лишь небольшие зоны, существенно отличающиеся по цвету от остальной площади лёгкого. При пневмонии однородно затемнёнными оказываются значительные участки органа, например, треть или половина.
Поставить чётко определенный диагноз позволяет флюорографический метод исследования, поскольку при пневмонии, плеврите и туберкулёзе присутствует такой симптом, как кашель с мокротой.
На изображении бывают видны кальцинаты (петрификаты) лёгкого. Это абсолютно безвредные образования, представляющие собой скопления солей в виде шрамов или рубцов.
Несмотря на то, что они не представляют опасности здоровью, и не нужно их удалять, такие скопления являются маркерами (симптомами) более сложных заболеваний, например, туберкулёза или пневмонии.
Поэтому наличие таких шрамов в лёгких – повод для врачей назначить дополнительные исследования и прописать адекватное лечение по их результатам.
Кальцинаты могут быть признаками:
- изменений, которые появились после выздоровления от туберкулёза;
- остаточных явлений после перенесённой пневмонии. Возможно, потребуется дополнительное лечение;
- роста опухолей (не злокачественных) в лёгком или близкорасположенных органах;
- новообразований онкологического происхождения;
- наличия метастазов;
- присутствия в лёгких инородных металлических предметов;
- глистной инвазии;
- нарушения кальциевого обмена в организме.
Кальцинаты могут быть представлены на изображении в виде ярких белых пятен мелкого размера (не более одного сантиметра).
Показывает ли флюорография туберкулез на ранних стадиях — Врачебный метод
Методы борьбы с туберкулезом, как и с любым инфекционным заболеванием, направлены на прерывание путей передачи возбудителя и ликвидацию источников инфекций, а также выявление пациентов из группы риска, которые выделяют с мокротой микобактерии туберкулеза, и незамедлительное их лечение. Постановка диагноза у таких больных должна быть ранней и своевременной. На сегодняшний день «золотым стандартом» диагностики при туберкулезе легких является флюорография.
Общая информация
В выявлении больных туберкулезом особенное место занимают флюорографические осмотры, которые совершаются:
- Передвижными флюорографами – обеспечивается своевременное проведение плановых профосмотров у контингента людей любой местности;
- Стационарными флюорографами – располагаются, как правило, в рентгенологических кабинетах поликлиники.
Плановую флюорографию проводят лечебные учреждения, которые оказывают первичную и вторичную медицинскую помощь. Флюорографические обследования делятся на:
- профилактические;
- диагностические.
Целью профилактических осмотров является своевременное выявление опасных заболеваний органов дыхания – туберкулеза в активной фазе и его остаточных изменений, злокачественных опухолевых болезней, неспецифических заболеваний легких, средостения, костей грудной клетки. А вот показывает ли флюорография туберкулез на ранних стадиях, попробуем разобраться дальше.
Показания для проведения флюорографии
Для профилактики туберкулеза все люди, начиная с 15 лет, проходят флюорографию 1 раз в год. Если произошел контакт с больным туберкулезом – через 6 месяцев от даты последнего обследования. Существуют определенные группы риска пациентов по развитию заболевания – медицинские и социальные. Они подлежат обязательным флюорографическим осмотрам и диспансерному наблюдению.
Медицинская группа включает в себя следующие категории населения:
- люди с профзаболеваниями легких (например, пневмокониоз);
- больные с эндокринологической патологией;
- пациенты, постоянно принимающие глюкокортикостероиды;
- ВИЧ-инфицированные;
- больные с хроническими обструктивными заболеваниями легких, пневмонией, плевритами;
- состоящие на учете в наркологическом диспансере;
- контактируемые с больными туберкулезом.
Факторы риска развития туберкулеза
Социальная группа риска:
- лица без определенного места жительства, бездомные;
- освобожденные из мест лишения свободы и те, кто там содержатся;
- мигранты, беженцы, переселенцы из бедных стран (разрешено проводить только с разрешения миграционной службы);
- малообеспеченные семьи.
Направляют на обследование органов грудной клетки соответствующие специалисты – фтизиатры, семейные врачи, пульмонологи, терапевты и т.д.
Обязательному профилактическому рентгенологическому обследованию подлежат роженицы до выписки из родильного дома и взрослые члены семьи с обеих сторон (матери и отца).
Данные о результатах исследования заносятся в детскую карту. При отсутствии информации о проведенной флюорографии все члены семьи направляются педиатром на ее проведение.
Внеочередная профилактическая флюорография может быть назначена в связи с ухудшением эпидемической ситуации по туберкулезу.
Положительный результат флюорографии при туберкулезе отправляется в противотуберкулезный диспансер.
Такой человек ставится на учет фтизиатром и подлежит немедленному лечению, потому что заболевание может протекать как в обычной, так и быстротечной форме со смертельным исходом.
Проведение обследования
Метод, на котором основана флюорография, заключается в получении рентгеновского снимка из флуоресцентного экрана. Процесс достаточно прост и заключается в способности рентгеновских лучей по-разному проходить через ткани и органы. Можно считать, что флюорография — это аналог рентгена, только мобильный и более дешевый.
Этот метод диагностики достаточно быстрый в своем выполнении. Доктор располагает пациента напротив специального экрана, фиксирует его положение относительно экрана, и при глубоком вдохе делается снимок.
На все это уходит не более чем 30 секунд. Трудоемкой считается работа над снимком, поэтому результат выдают пациенту обычно через несколько дней.
Полученное изображение на снимке может быть мелкокадровое (к 35 мм) и крупнокадровое (к 100 мм), но это уже специфика обработки данных.
Существует два вида флюорографического оборудования, которое можно встретить в больницах нашей страны: цифровое и аналоговое. Аналоговый флюорограф — это классический аппарат, который большинство видит при прохождении флюорографии. Он считается недостаточно информативным и несет в себе опасность для пациента.
Доказано, что пациент, делая снимок на таком аппарате, получает высокую дозу облучения. Не в пользу аналогового флюорографа и низкое качество снимка: на рентген-снимке тени всех органов грудной клетки накладываются друг на друга.
На замену аналоговому пришло цифровое оборудование, которое более безопасно для пациента и дает качественное изображение. Его можно хранить на диске и контролировать динамику рентгенологической картины. Достоинство этого аппарата неоспоримо. Однако цифровой флюорограф стоит достаточно дорого, и у многих медицинских центров нет возможности на его приобретение.
Снимок и формы туберкулеза
Попробуем разобраться, как выглядит снимок флюорографии больного туберкулезом. Флюорографический снимок формируется из оттенков двух цветов — черного и белого. Выделяют три типа затемнений, характерных для туберкулеза:
- Частичные — они единичны и видны на небольшом участке.
- Распространенные — патологический очаг не один, а несколько, и они все расположены по всей ткани легкого.
- Ограниченные — очаги неправильной формы с четкими контурами и незначительным перифокальным отеком, которые чаще всего являются признаками опухолей.
Уплотнение легкого при туберкулезе будет выглядеть на снимке темным пятном. Белые пятна говорят в пользу изменений в плотности тканей.
Согласно Международной классификации болезней, выделяют две основные клинические формы туберкулеза: легочную и внелегочную. Существует много подтипов этих форм. Рассмотрим самые основные и часто встречающиеся:
- Первичный туберкулезный комплекс характеризуется наличием зоны воспаления с наличием гомогенной тени, иногда с частичным рассасыванием инфильтрата.
- Диссеминированный туберкулез на снимке флюорографии представлен наличием многочисленных очагов разных размеров и плотности на фоне деформированного легкого, с возможным развитием каверн.
- При инфильтративной форме определяются тени диметром больше 1 см, неоднородной структуры. Визуализируются своеобразные «дорожки» к корню, представляющие собой инфильтрацию стенки бронха.
- Для фиброзно-кавернозного типа характерно наличие полости, окруженной фиброзной тканью. На снимке флюорографии четко можно увидеть сформированную полость распада.
Противопоказания
Современные аппараты для проведения флюорографии используют малое количество излучения, а пленка, на которую переносится изображение – повышенной чувствительности. Это делает метод менее вредным для организма. Однако при всех этих положительных фактах существуют ситуации, когда этот рентгенологический метод нельзя применять.
Международным сообществом рентгенологов выделен ряд противопоказаний, среди которых:
- Беременность – категорически запрещено проходить процедуру до 25 недели беременности, поскольку в этот период формируются все органы и системы ребенка.
Если есть необходимость диагностики заболевания после 25 недели, то обязательно во время процедуры следует надеть свинцовый фартук.
Ошибки и их последствия
Квалификация врача-рентгенолога, который занимается трактовкой флюорографических снимков, должна быть высокой, поскольку от заключения, которое напишет он, в 70% случаев зависит окончательный диагноз и лечение. Нельзя пропускать никаких изменений, даже если, на первый взгляд, они кажутся незначительными.
Существует такой фактор как индивидуальная вариабельность, когда разные специалисты по-разному интерпретируют одну и ту же рентгенограмму. В большинстве таких случаев диагноз «туберкулез» ставится ошибочно.
Ошибки также могут быть не только со стороны врача, но и со стороны технического обеспечения. Плохой флюорограф или некачественный снимок ведут к неправильной трактовке результата. Ошибочный диагноз очень дорого обходится пациентам. Ведь медикаментозная терапия при туберкулезе очень агрессивная и здоровому организму она способна навредить.
Рассмотрим вторую сторону этой проблемы: может ли флюорография не показать туберкулез? Опять-таки, это зависит от всех вышеперечисленных факторов, а также здесь добавляется стадия заболевания. «Старые» флюорографы не всегда способны распознать патологию при начальных проявлениях и в результате пациент своевременно не получает необходимого лечения.
На сегодняшний день туберкулез как эпидемическое заболевание взят на контроль благодаря комплексу профилактических и диагностических мероприятий. Флюорография – эффективный метод, благодаря которому выявляется большая часть заболеваний легких в период, когда клиническая картина болезни плохо выражена.
-
Архив журнала
/ -
2017
/ - №5
Маски урогенитального туберкулеза как причина диагностических ошибок
DOI: https://dx.doi.org/10.18565/urology.2017.5.100-105
Д.П. Холтобин, Е.В. Кульчавеня
ФГБУ «Новосибирский НИИ туберкулеза» Минздрава России, Новосибирск, Россия; ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия
Урогенитальный туберкулез не имеет патогномоничных симптомов, поэтому часты ошибки в диагностике. С целью оценки причин и частоты ошибочных диагнозов был проведен систематический обзор литературы. Мы критически оценивали некоторые статьи, авторы которых описывали наблюдение урогенитального туберкулеза как редкое и необычное, потому что сами редко встречались с этим заболеванием, хотя на самом деле это было типичное проявление мочеполового туберкулеза.
Проанализированы и проиллюстрированы особенности мочеполового туберкулеза у больных туберкулезом легких, особенности дифференциальной диагностики урогенитального туберкулеза и рака почек и мужских половых органов, приведены ошибки в диагностике туберкулеза уретры, туберкулеза яичка и его придатка, туберкулеза полового члена и туберкулеза предстательной железы. Описана мочекаменная болезнь как маска и сопутствующее заболевание мочеполового туберкулеза. Указаны действительно редкие формы проявления как причина ошибок диагностики туберкулеза мочевого пузыря. Приведены примеры фатальных исходов мочеполового туберкулеза. Проанализированы грануломатозный интерстициальный нефрит вследствие туберкулезной инфекции и туберкулез почечной артерии как причина реноваскулярной артериальной гипертензии.
Наиболее частой причиной поздней диагностики урогенитального туберкулеза являются отсутствие типичной картины, тенденция протекать под маской других заболеваний.
Туберкулез остается одной из самых смертельных болезней. Согласно данным ВОЗ, в 2016 г. туберкулезом заболели 10,4 млн человек и умерли от него 1,8 млн [1]. Основное внимание ВОЗ уделяет туберкулезу легких; допускаем, что им не известен тот факт, что по аутопсийным исследованиям 77% мужчин, умерших от туберкулеза всех локализаций, имели таковой предстательной железы, как правило при жизни не установленный. Вместе с тем генитальный туберкулез – заболевание, передающееся половым путем, и одна из основных причин бесплодия, как мужского, так и женского [2, 3]. До сих пор во многих регионах Российской Федерации сохраняется напряженной эпидемическая ситуация по туберкулезу [4, 5]. Структура внелегочного туберкулеза нестабильна, зависит от многих причин, но доля мочеполового туберкулеза в течение десятилетий не опускалась ниже второго места [6, 7]. Настороженность в отношении уротуберкулеза невысока, социально-демографические характеристики пациентов существенно отличаются от таковых при туберкулезе легких [8]. Своевременному выявлению туберкулеза мочевого пузыря могла бы способствовать оптимальная терапия по поводу инфекций нижних мочевыводящих путей, под маской которых нередко скрывается туберкулез, но, как показывают опросы специалистов и анализы амбулаторных карт, не менее половины врачей выбирают для эмпирической терапии неоптимальные препараты [9–12].
Проблема урогенитального туберкулеза отражает много противоречий – от терминологии, классификации до подходов к лечению. Тем не менее нам следует преодолеть их для лучшего понимания этого загадочного и потенциально смертельного заболевания.
С целью оценки причин и частоты ошибочных диагнозов мы провели систематический обзор литературы.
В поисковых системах Medline/PubMed и Google Shcolar был осуществлен поиск статей по ключевым словам «urogenital tuberculosis, rare» и «urogenital tuberculosis, unusual»; в системе elibrary поиск проведен по ключевым словам «редкие случаи мочеполового туберкулеза», «мочеполовой туберкулез». В русскоязычной литературе нам не удалось обнаружить статей, посвященных необычному течению мочеполового туберкулеза. По запросу «urogenital tuberculosis rare» было найдено 230 статей, по запросу «urogenital tuberculosis unusual» – 81; всего – 311 источников. Тридцать четыре статьи повторялись, поэтому были исключены из анализа, 33 касались эпидемических данных, были обзором литературы, 48 описывали случаи нетуберкулезных заболеваний, 3 были посвящены врожденному туберкулезу, 16 – урогенитальному туберкулезу как сопутствующему заболеванию и 8 статей – урогенитальному туберкулезу как осложнению БЦЖ-терапии, поэтому также были исключены. Кроме того, мы исключили 22 статьи, в которых описывались подходы к лечению, но не было данных о клинической картине. Среди оставшихся 147 мы выбрали 43, которые описывали действительно редкие случаи заболевания; в обзор также вошло 6 источников, касающихся эпидемиологических исследований.
Мы критически оценивали некоторые статьи, авторы которых описывали случай урогенитального туберкулеза как редкий и необычный потому, что сами редко встречались с этим заболеванием, хотя на самом деле это было типичное проявление мочеполового туберкулеза.
Мочеполовой туберкулез у больных туберкулезом легких
Последнее время все реже диагностируют изолированный урогенитальный туберкулез и все чаще – сочетанный с другими локализациями, преимущественно с туберкулезом органов дыхания [3]. Генерализованный туберкулез в 16% случаев манифестирует урогенитальными проявлениями [3]. Подобную ситуацию описали G. Colbert и соавт. [13]. Пациент жаловался на тошноту и почечную колику; при обследовании выявлялся генерализованный туберкулез легких, брюшины и мочевой системы. Туберкулез вульвы у пациентки с туберкулезом легких в течение длительного времени интерпретировали как заболевание, передаваемое половым путем [14]. Гистологическое иследование биоптата вульвы у женщины с туберкулезом легких и периферических лимфатических узлов подтвердило специфическое воспаление половых органов [15].
Мочеполовой туберкулез и рак почек
A. Androulaki и соавт. [16] сообщили о клиническом наблюдении, когда первоначально по данным рентгенологического обследования был установлен диагноз «рак почки», однако в моче была обнаружена Mycobacterium tuberculosis (Mtb) и диагноз был пересмотрен. Больной был излечен консервативно противотуберкулезными препаратами. A. Bouchikhi и соавт. [17] описали пациента с жалобами на боль в области левой почки, учащенное мочеиспускание и повторные эпизоды макрогематурии в течение 6 мес. Мультиспиральная компьютерная томография выявила левосторонний гидронефроз, гидроуретер со значительным утолщением стенки левого мочеточника в нижней трети. На этом основании пациенту был выставлен диагноз «опухоль нижней трети левого мочеточника». Однако нарастающая дизурия, присоединившийся эпидидимит и пиоспермия заставили задуматься о урогенитальном туберкулезе. Моча была исследована на Mtb молекулярно-генетическим методом, результат оказался положительным [17]. Диагноз был изменен на «туберкулез мочеточника». Это яркий пример неверной интерпретации клинической картины: авторы констатировали генерализованное инфекционно-воспалительное заболевание мочеполовой системы, в которое оказались вовлеченными почки, мочеточник, мочевой пузырь, придаток яичка и предстательная железа, однако расценили его как изолированный туберкулез мочеточника. Согласно классификации [3], туберкулез мочевыводящих путей всегда вторичен по отношению к нефротуберкулезу, что исключает диагноз «изолированный туберкулез мочеточника» в принципе.
Урогенитальный туберкулез и рак мужских половых органов
В дифференциально-диагностическом ряду мочеполового туберкулеза злокачественные опухоли стоят на одном из первых мест. Именно под маской рака очень часто протекает урогенитальный туберкулез. Изолированный туберкулезный эпидидимит в структуре туберкулеза мужских половых органов [6] занимает 21,5% и безусловно необычайно сложен для диагностики. Сообщалось о 20-летнем мужчине, который в течение 2 мес отмечал постепенное увеличение мошонки в размерах, боли не было. У пациента диагностирована паратестикулярная опухоль справа и запланировано хирургическое вмешательство. Однако в день операции появилась сильная боль, покраснение правой половины мошонки. Картина повторного УЗИ свидетельствовала скорее в пользу изменений воспалительного характера. Больному была выполнена секционная биопсия придатка, и туберкулез подтвержден патоморфологически [18].
Изолированный эпидидимит/орхоэпидидимит легко можно принять за опухоль, особенно у пациента, не имеющего в анамнезе контакта с туберкулезом и ранее не болевшего туберкулезом. В течение 4 мес у 44-летнего мужчины нарастала «опухоль» левой половины мошонки, по поводу чего ему была выполнена левосторонняя орхэктомия. Гистологически диагностирован туберкулез [19]. Похожие случаи описаны и другими авторами [20]. У пациента возникла безболевая форма орхоэпидидимита через 5 мес после биопсии простаты, которая была выполнена в связи с высоким уровнем простатспецифического антигена; гистологически, однако, в биоптатах опухолевые клетки обнаружены не были. Тем не менее больному поставлен диагноз рака яичка и выполнена орхэктомия; патоморфологическое исследование операционного материала указывало на туберкулезное воспаление [21].
Мочекаменная болезнь как маска и сопутствующее заболевание мочеполового туберкулеза
Схожая клиническая и рентгенологическая картины уролитиаза и нефротуберкулеза способствуют ошибочной диагностике. Описано наблюдение мочеполового туберкулеза, протекавшее с клинической картиной камня мочеточника [22]. У других авторов [23] был пациент с камнями в обеих почках, почечной недостаточностью. Больному проведена левосторонняя нефрэктомия, гистологически установлен туберкулез, начата противотуберкулезная химиотерапия и на ее фоне выполнена правосторонняя уретеролитотрипсия. Разумеется, благоприятный прогноз у этого больного весьма сомнительный.
В. Я. Фарбировичем с коллегами четырежды был диагностирован туберкулез мочеточника у пациентов, поступавших в стационар с «почечной коликой вследствие рентгеннегативного камня». Во время уретероскопии обнаруживали язву слизистой мочеточника, выполняли биопсию, патоморфологически верифицировали туберкулез [3].
Казеозные массы в каверне почки могут имбибироваться солями кальция, что формирует рентгенологическую картину, схожую с таковой при уролитиазе [24].
Редкие формы проявления как причина ошибок диагностики туберкулеза мочевого пузыря
Туберкулез мочевого пузыря диагностируют более чем у половины больных туберкулезом почек [3]. Именно вовлечение в процесс мочевого пузыря часто побуждает пациента обращаться к врачу. Сообщалось [25] о двух наблюдених кавернозного туберкулеза легких, диагностированных после того, как развился туберкулез мочевого пузыря и простаты. Типичную ситуацию описывают T. Kanekoи соавт. [26]. В 19 лет у пациента впервые появился приступ дизурии и макрогематурии, который повторялся в течение 5 лет по нескольку раз в год, купировался самостоятельно или домашними средствами. В 21 год пациент все же решил обратиться в клинику, где была диагностирована инфекция мочевыводящих путей и проведена антибактериальная терапия. Поскольку никакого улучшения пациент не отметил, он продолжил самолечение еще в течение 3 лет. В 24 года он поступил в клинику с жалобами на учащенное болезненное мочеиспускание. Трансректальное УЗИ показало значительное уменьшение емкости мочевого пузыря, утолщение его стенки и полости в предстательной железе. В моче обнаружена Mtb [25]. В течение длительного времени урогенитальный туберкулез протекал под маской цистита, и в результате туберкулез мочевого пузыря был диагностирован в 4-й, терминальной, стадии.
Туберкулез мочевого пузыря 4-й стадии не может быть излечен консервативно противотуберкулезными препаратами, таким больным показана цистэктомия с энтеропластикой [3, 27, 28]. Вместе с тем для своевременной диагностики туберкулеза мочевого пузыря достаточно направлять пациентов к фтизиоурологу в случае низкой эффективности стандартных курсов терапии по поводу цистита, если изменение поведения, адекватная контрацепция и ммунопрофилактика не дают результатов [28, 29].
F. Lopes и соавт. [27] представили наблюдение 67-летнего пациента, которому 31 год назад была выполнена аугментационная илиоцистопластика по поводу урогенитального туберкулеза. Больной обратился к врачу в связи с бессимптомной микрогематурией. Рентгенологически было обнаружено три полипа в артифициальном мочевом пузыре. Была выполнена энтероцистпростатэктомия; гистологическое исследование операционного материала выявило аденокарциному мочевого пузыря и предстательной железы, Gleason 7 (3+4) [27].
Редко, но бывает спонтанный разрыв пораженного туберкулезом мочевого пузыря. У молодой женщины, экстренно оперированной по поводу «острого живота», во время лапаротомии были обнаружены перфорации аппендикса и мочевого пузыря. Туберкулез был верифицирован патоморфологически. Впоследствии у этой пациентки выявлена стриктура нижней трети правого мочеточника [30]. Ряд авторов [31, 32] также описывают спонтанные разрывы мочевого пузыря вследствие туберкулеза.
Ошибки в диагностике туберкулеза уретры
A. Bouchikhi и соавт. [33] сообщили о невероятном случае мочеполового туберкулеза у мужчины, проявившегося протяженной стриктурой уретры и множественными уретроскротальными свищами. Пациент предъявлял жалобы на нарушение мочеиспускания и гнойные выделения из уретры. Ретроградная уретроцистограмма выявила сужение просвета уретры на всем протяжении и множественные свищи. Однако туберкулез не был заподозрен и пациенту была выполнена уретропластика. В послеоперационном периоде отмечен рецидив и даже большее распространение свищей, рана нагноилась. Только после этого был предположен туберкулез и проведена биопсия периуретральных тканей и стенок свища; туберкулез был подтвержден гистологически [33]. Полагаем, у этого пациента был также и нефротуберкулез, поскольку туберкулез мочевыводящих путей вторичен по отношению к туберкулезу почек, фактически является его осложнением.
Ошибки в диагностике туберкулеза яичка и его придатка
A. Rakototiana и соавт. [34] столкнулись с трудностями в диагностике изолированного туберкулезного орхоэпидидимита у двоих мальчиков, что, впрочем, неудивительно. Клиническая картина была нетипичной: в одном случае заболевание протекало как гидроцеле, в другом – по типу острого орхоэпидидимита. Оба мальчика были оперированы, в обоих случаях были обнаружены узловатые образования яичек, на поверку оказавшиеся туберкулезными.
Травма может провоцировать активацию латентного туберкулеза. Увеличение в размере и уплотнение правого придатка у молодого человека были расценены как осложнение после травмы мошонки. Тем не менее было принято решение о проведении биопсии, по результатам которого выявлен туберкулезный эпидидимит. В ходе дальнейшего обследования был диагностирован кавернозный туберкулез левой почки, в моче обнаружена Mtb [35].
Ошибки в диагностике туберкулеза полового члена
Неожиданно много работ было посвящено туберкулезу головки полового члена – и не только как осложнению после БЦЖ-терапии по поводу рака мочевого пузыря [36].
Язвы на коже полового члена у инфицированного вирусом иммунодефицита (ВИЧ) мужчины были расценены как заболевание, передаваемое половым путем, однако результаты соскоба края язвы на предмет наличия Mtb оказались положительными [37].
Сообщалось [38] о наблюдении язвенного туберкулеза головки полового члена, развившегося после полового акта с больной туберкулезом женщиной. J. Kar и соавт. [39] обнаружили первичный язвенный туберкулез головки полового члена у 31-летнего мужчины. У пациента была гиперэргическая проба Манту; диагноз верифицирован патоморфологически. Тщательное обследование не выявило других очагов туберкулеза в организме этого пациента. Аналогичное наблюдение было в практике и других авторов [40]. Возможна и безъязвенная форма туберкулеза полового члена, когда пальпируются плотные подкожные безболезненные узлы [41, 42]. Поскольку биопсия таких образований не представляет затруднений, диагноз подтверждают патоморфологическим исследованием ткани. Все авторы отмечают выраженную реакцию на внутрикожное введение туберкулина (реакция Манту) больным туберкулезом полового члена. K. Karthikeyan и соавт. [43] образно назвали длительно текущий туберкулез полового члена «надутый пузырь». S. Nakamura и соавт. [44] описали 37 наблюдений туберкулеза полового члена, диагностированных в Японии в течение 10 лет (с 1978 по 1987 г.).
Приведен случай ошибочной трактовки симптомов туберкулеза полового члена как гангрены Фурнье; неэффективность проводимой терапии заставила пересмотреть диагноз [45].
Ошибки в диагностике туберкулеза предстательной железы
Туберкулез предстательной железы – нередкая форма урогенитального туберкулеза. Описана история 65-летнего мужчины, который обратился к врачу по поводу учащенного болезненного мочеиспускания, ослабления струи мочи. За последние полгода он потерял 10 кг массы тела. Легких патологических изменений не выявлено, тест на ВИЧ отрицательный. При пальцевом ректальном исследовании пальпировалась увеличенная плотная предстательная железа с крупными плотными узлами. Трансректальное УЗИ признаков малигнизации не обнаружило, объем железы составил 39 см3. Гистологически найдены призанки туберкулезного воспаления, при окраске биоптатов по Цилю–Нильсену обнаружены Mtb [46]. В другом наблюдении у 64-летнего мужчины с симптомами обструкции нижних мочевыводящих путей предполагали рак простаты, однако патоморфологическое исследование биоптатов предстательной железы выявило туберкулез [47].
Фатальные случаи мочеполового туберкулеза
Ввиду отсутствия патогномоничных симптомов диагностика урогенитального туберкулеза может запаздывать, иногда фатально. Примером тому служит следуеющее наблюдение [48]. Молодая женщина поступила в клинику в состоянии адинамии, анорексии, лихорадки, с потерей массы тела и обширными отеками. Считает себя больной 10 мес. Живот был увеличен в размере, болезненный при пальпации. Лабораторные анализы показали азотемию, лейкоцитоз, умеренную лейкоцитурию и протеинурию. Объем суточной мочи был снижен. Трансабдоминальное УЗИ брюшной полости обнаружило сморщенный мочевой пузырь с толстыми стенками и образование, содержащее негомогенную жидкость, в тазовой области слева. Дважды была выполнена диагностическая лапаротомия, пока, наконец, не обнаружен осумкованный абсцесс в области малого таза. Была начата стандартная противотуберкулезная полихимиотерапия. Позже был получен рост Mtb из мочи. На фоне лечения отмечено прогрессивное снижение почечных функций, что послужило основанием для проведения гемодиализа. Методом компьютерной томографии был диагностирован двусторонний поликавернозный туберкулез, осложненный туберкулезом мочеточников. Вскоре появились менингеальные симптомы, развился менингоэнцефалит и больная погибла [48].
Tуберкулез почечной артерии как причина реноваскулярной артериальной гипертензии
Z. Bouziane и соавт. [49] наблюдали туберкулез почечной артерии. Семнадцатилетний пациент был обследован по поводу артериальной гипертензии. Обнаружены окклюзия правой почечной артерии, увеличенные параренальные и мезентериальные лимфатические узлы. Авторы предположили туберкулез и начали соответствующую терапию. Через 1 мес выполнена реваскуляризация. Артериальное давление нормализовалось. Случай интересный, но сомнительный, поскольку туберкулез ничем, кроме увеличенных лимфоузлов, не подтвержден, а купирование гипертензии наступило не на фоне приема противотуберкулезных препаратов, а вследствие операции.
Грануломатозный интерстициальный нефрит вследствие туберкулезной инфекции
Грануломатозный интерстициальный нефрит (ГИН) – нечастая форма острого интерстициального нефрита. Описана история молодого человека с прогрессирующим ухудшением почечных функций и нарастанием протеинурии [50]. Биопсия почки выявила ГИН; также в биоптате была обнаружена Mtb методом полимеразной цепной реакции. Пациенту была начата противотуберкулезная полихимиотерапия в сочетании с глюкокортикоидами; также он получил 11 сеансов гемодиализа.
Мочеполовой туберкулез не имеет характерных симптомов; наиболее часто пациенты отмечают боль (в области почки, над лоном, в промежности, в мошонке), дизурию, почечную колику, гематурию, но частота этих симптомов может многократно колебаться в разных регионах при разной эпидемической ситуации и в разное время. Проведенный анализ подтвердил нашу гипотезу: большинство так называемых редких и необычных случаев мочеполового туберкулеза на самом деле таковыми являются только для врачей, кто очень редко диагностирует или хотя бы подозревает урогенитальный туберкулез и, соответственно, не выполняет необходимый комплекс исследований. Всегда следует иметь в виду туберкулез у больных с инфекциями мочевыводящих путей, при урогенитальном раке, мочекаменной болезни, так как возможно как маскирование, так и сочетание этих заболеваний. Туберкулез может способствовать развитию злокачественной опухоли, поэтому всегда должна быть соответствующая настороженность в отношении больных с хроническим течением и даже излеченных от туберкулеза. Фактически урогенитальный туберкулез не редкая, а редко диагностируемая болезнь. Урогенитальный туберкулез – контагиозное заболевание со многими осложнениями, в том числе летальными. Именно поэтому должен использоваться весь арсенал диагностических средств, чтобы не пропустить его.
Литература
1. WHO Global tuberculosis report 2015: who.int›tb/publications/global_report/en/
2. Kamyshan I.S. Handbook on tuberculosis of urogenital organs. Kiev, 2003. 212 p. Russian (Камышан И.С. Руководство по туберкулезу урогенитальных органов. Киев, 2003. 212 с.).
3. Kulchavenya E.V., Krasnov V.A., Mordyk A.V. Almanac of extrapulmonary tuberculosis. Novosibirsk: Sibprint, 2015. 247 p.: ill. ISBN 978-5-94301-579-3. Russian (Кульчавеня Е.В., Краснов В.А., Мордык А.В. Альманах внелёгочного туберкулеза. Новосибирск: Сибпринт, 2015. 247 с.: илл. ISBN 978-5-94301-579-3).
4. Kulchavenya E., Zhukova I., Kholtobin D. Spectrum of Urogenital Tuberculosis. J Infect Chemother October. 2013;19(Issue 5):880–883.
5. Kulchavenya E.V., Khomyakov V.T. Tuberculosis of extrapulmonary localization in Western Siberia. Tuberkulez i bolezni legkikh. 2003;80(4):13–15. Russian (Кульчавеня Е.В., Хомяков В.Т. Туберкулез внелегочной локализации в Западной Сибири. Туберкулез и болезни легких. 2003;80(4):13–15).
6. Kulchavenya E., Khomyakov V. Male Genital Tuberculosis in Siberians. World J Urol. 2006;24(1):74–78.
7. Kulchavenya E.V., Koveshnikova E.Yu., Zhukova I.I. Clinical and epidemiological features of modern tuberculous spondylitis. Tuberkulez i bolezni legkikh. 2013;1:41–45. Russian (Кульчавеня Е.В., Ковешникова Е.Ю., Жукова И.И. Клинико-эпидемиологические особенности современного туберкулезного спондилита. Туберкулез и болезни легких. 2013;1:41–45).
8. Osadchii A.V., Kulchavenya E.V., Reikhrud T.A., Naryshkina S.L., Kozhevnikova E.V., Khomyakov V.T. Socio-demographic characteristics of patients with pulmonary tuberculosis and extrapulmonary localization. Tuberkulez i bolezni legkikh. 2015;2:46–48. Russian (Осадчий А.В., Кульчавеня Е.В., Рейхруд Т.А., Нарышкина С.Л., Кожевникова Е.В., Хомяков В.Т. Социально-демографическая характеристика больных туберкулезом легких и внелегочных локализаций. Туберкулез и болезни легких. 2015;2:46–48).
9. Gadzhieva Z.K., Kazilov Yu.B., Alyaev Yu.G., Aboyan I.A., Kazilov B.R. Urination disorders. Do we know all about them? Urologiia. 2014;1:20–26. Russian (Гаджиева З.К., Казилов Ю.Б., Аляев Ю.Г., Абоян И.А., Казилов Б.Р. Нарушения мочеиспускания. Все ли мы о них знаем? Урология. 2014;1:20–26).
10. Gadzhieva Z.K., Kazilov Yu.B., Mugutdinov T.M., Kazilov B.R., Alyaev Yu.G., Aboyan I.A. Features of diagnosis and treatment of various disorders of urination by physicians of the Republic of Dagestan and other regions of the North Caucasus and Southern Federal districts. Urologiia. 2016;4:48–56. Russian (Гаджиева З.К., Казилов Ю.Б., Мугутдинов Т.М., Казилов Б.Р., Аляев Ю.Г., Абоян И.А. Особенности диагностики и лечения различных нарушений мочеиспускания врачами Республики Дагестан и других регионов Северо-Кавказского и Южного Федеральных округов. Урология. 2016;4:48–56).
11. Kulchavenya E.V., Brizhatyuk E.V. Tuberculosis of the urinary bladder: diagnosis and treatment. Urologiia. 2006;3:61–65. Russian (Кульчавеня Е.В., Брижатюк Е.В. Туберкулез мочевого пузыря: диагностика и лечение. Урология. 2006;3:61–65).
12. Kulchavenya E.V., Breusov A.A. Effectiveness of Uro-Vaxom in recurrent infectious and inflammatory diseases of the genitourinary system. Urologiia. 2011;4:7–11. Russian (Кульчавеня Е.В., Бреусов А.А. Эффективность уро-ваксома при рецидивирующих инфекционно-воспалительных заболеваниях мочеполовой системы. Урология. 2011;4:7–11).
13. Colbert G., Richey D., Schwartz J.C. Widespread tuberculosis including renal involvement. Proc (Bayl Univ Med Cent). 2012;25(3):236–239.
14. Nanjappa V., Suchismitha R., Devaraj H.S., Shah M.B., Anan A., Rahim S.N. Vulval tuberculosis – an unusual presentation of disseminated tuberculosis. J Assoc Physicians India. 2012;60:49–52.
15. Wong S., Rizvi H., Cerio R., O’Toole E.A. An unusual case of vulval papulonecrotic tuberculid. Clin Exp Dermatol. 2011;36(3):277–280. Doi: 10.1111/j.1365-2230.2010.03925.x. Epub 2010 Sep 30.
16. Androulaki A., Papathomas T.G., Liapis G. et al. Inflammatory pseudotumor associated with Mycobacterium tuberculosis infection. Int J Infect Dis. 2008;12(6):607–10. Doi: 10.1016/j.ijid.2007.12.011.
17. Bouchikhi A.A., Amiroune D., Tazi M.F. et al. Isolated urethral tuberculosis in a middle-aged man: a case report. J Med Case Rep. 2013;7(1):97. DOI: 10.1186/1752-1947-7-97.
18. Kho V.K., Chan P.H. Isolated tuberculous epididymitis presenting as a painless scrotal tumor. J Chin Med Assoc. 2012;75(6):292–95. Doi: 10.1016/j.jcma.2012.04.014.
19. Badmos K.B. Tuberculous epididymo-orchitis mimicking a testicular tumour: a case report. Afr Health Sci. 2012;12(3):395–397.
20. Lakmichi M.A., Kamaoui I., Eddafali B. et al. An unusual presentation of primary male genital tuberculosis. Rev Urol. 2011;13(3):176–178.
21. Yu-Hung L.A., Lu S.H., Yu H.J., Kuo Y.C., Huang C.Y. Tuberculous epididymitis presenting as huge scrotal tumor. Urology. 2009;73(5):1163.e5-7. Doi: 10.1016/j.urology.2008.04.015.
22. Wong N., Hoag N.A., Jones E.C., Rowley A., McLoughlin M.G., Paterson R.F. Genitourinary tuberculosis masquerading as a ureteral calculus. Can Urol Assoc J. 2013;7(5–6):E363–E366.
23. Gupta S., Santhosh R., Meitei K.S., Singh S.R. Primary Genito-Urinary Tuberculosis with Bilateral Urolithiasis and Renal Failure-An Unusual Case. J Clin Diagn Res. 2013;7(5):927–929.
24. Prakash J., Goel A., Sankhwar S., Singh B.P. Extensive renal and ureteral calcification due to tuberculosis: rare images for an uncommon condition. BMJ Case Rep. 2013;2013.
25. Kumar A., Srivastava A., Mishra V.K., Banerjee G. Tubercular cavity behind the prostate and bladder: an unusual presentation of genitourinary tuberculosis. J Urol. 1994;151(5):1351–1352.
26. Kaneko T., Kudoh S., Matsushita N. et al. Case of bladder tuberculosis with onset at the age of nineteen – treatment of urinary tract tuberculosis in accordance with the new Japanese Tuberculosis Treatment Guidelines. Nihon Hinyokika Gakkai Zasshi. 2008;99(1):29–34.
27. Lopes F.A., Rolim N., Rodrigues T., Canhoto A. Intestinal adenocarcinoma in an augmented ileocystoplasty. BMJ Case Rep. 2013;2013.
28. Kholtobin D.P., Kulchavenya E.V., Khomyakov V.T. Bladder tuberculosis stage 4: how to restore urination? Urologiia. 2014;5:26–29. Russian (Холтобин Д.П., Кульчавеня Е.В., Хомяков В.Т. Туберкулез мочевого пузыря 4-й стадии: как восстановить мочеиспускание. Урология. 2014;5:26–29).
29. Kulchavenya E.V., Brizhatyuk E.V., Khomyakov V.T., Breusov A.A. Incidence of cystitis depending on the type of contraception. Urologiia. 2013;1:41–42. Russian (Кульчавеня Е.В., Брижатюк Е.В., Хомяков В.Т., Бреусов А.А. Частота возникновения цистита в зависимости от вида контрацепции. Урология. 2013;1:41–42).
30. Kong C.H., Ali S.A., Singam P., Hong G.E., Cheok L.B., Zainuddin Z.M. Spontaneous bladder perforation: a rare complication of tuberculosis. Int J Infect Dis. 2010;14(Suppl. 3):e250-2. Doi: 10.1016/j.ijid. 2009.10.006.
31. Kumar R.V., Banerjee G.K., Bhadauria R.P., Ahlawat R. Spontaneous bladder perforation: an unusual management problem of tuberculous cystitis. Aust N Z J Surg. 1997;67(1):69–70.
32. Vallejo G.C., Palacio E.V., Reig R.C., Raventos B.C., Morote R.J., Soler R.A. Spontaneous bladder rupture secondary to urinary tuberculosis. Actas Urol Esp. 1994;18(8):829–832.
33. Bouchikhi A.A., Amiroune D., Tazi M.F. et al. Pseudotumoral tuberculous ureteritis: a case report. J Med Case Rep. 2013;7(1):45.
34. Rakototiana A.F., Hunald F.A., Razafimanjato N., Ralahy M.F., Rakoto-Ratsimba H.N., Rantomalala H.Y. Isolated testicular tuberculosis in children. Report of 2 Malagasy cases. Arch Pediatr. 2009;16(2):112–114. Epub 2008 Dec 13.
35. Michel P. Urogenital tuberculosis revealed by scrotal trauma. Presse Med. 1990;19(31):1454–1455.
36. Chowdhury A.R., Dey R.K.Penile tuberculosis following intravesical Bacille Calmette-Guérin immunotherapy. Indian J Urol. 2013;29(1):64–66. DOI: 10.4103/0970-1591.109989.
37. Stockamp N.W., Paul S., Sharma S., Libke R.D., Boswell J.S., Nassar N.N. Cutaneous tuberculosis of the penis in an HIV-infected adult. Int J STD AIDS. 2013.
38. Toledo-Pastrana T., Ferrándiz L., Pichardo A.R., Muniaín Ezcurra M.A., Camacho Martínez F.M. Tuberculosis: an unusual cause of genital ulcer. Sex Transm Dis. 2012;39(8):643–644. Doi: 10.1097/OLQ.0b013e318251577b.
39. Kar J.K., Kar M. Primary tuberculosis of the glans penis. J Assoc Physicians India. 2012;60:52–53.
40. Sah S.P., AshokRaj G., Joshi A. Primary tuberculosis of the glans penis. Australas J Dermatol. 1999;40(2):106–107.
41. Baskin L.S., Mee S. Tuberculosis of the penis presenting as a subcutaneous nodule. J Urol. 1989;141(6):1430–1431.
42. Yonemura S., Fujikawa S., Su J.S., Ohnishi T., Arima K., Sugimura Y. Tuberculid of the penis with a scab on the nodule. Int J Uro. 2004;11(10):931–933.
43. Karthikeyan K., Thappa D.M., Shivaswamy K.N. «Water can» penis caused by tuberculosis. Sex Transm Infect. 2004;80(1):75.
44. Nakamura S., Aoki M., Nakayama K., Kanamori S., Onda S. Penis tuberculid (papulonecrotic tuberculid of the glans penis): treatment with a combination of rifampicin and an extract from tubercle bacilli (T.B. vaccine). J Dermatol. 1989;16(2):150–153.
45. López Barón E., Gómez-Arbeláez D., Díaz-Pérez J.A. Primary prostatic tuberculosis. Case report and bibliographic review. Arch Esp Urol. 2009;62(4):309–313.
46. Savu C., Surcel C., Mirvald C., Gîngu C., Hortopan M., Sinescu I. Atypical primary tuberculosis mimicking an advanced penile cancer. Can we rely on preoperative assessment? Rom J Morphol Embryol. 2012;53(4):1103–1106.
47. Rabesalama S.S., Rakoto-Ratsimba H.N., Rakototiana A.F. et al. Isolated prostate tuberculosis. Report of a case in Madagascar. Prog Urol. 2010;20(4):314–316. Doi: 10.1016/j.purol.2009.06.004.
48. Daher E.F., Silva J.G.B., Damasceno R.T. et al. End-stage renal disease due to delayed diagnosis of renal tuberculosis: a fatal case report. Braz J Infect Dis. 2007;11(1):169–171.
49. Bouziane Z., Boukhabrine K., Lahlou Z. et al. Tuberculosis of the renal artery: a rare cause of renovascular arterial hypertension. Ann Vasc Surg. 2009;23(6):786.e7–9. Doi: 10.1016/j.avsg.2008. 02.022.
50. Sampathkumar K., Sooraj Y.S., Mahaldar A.R. et al. Granulomatous interstitial nephritis due to tuberculosis-a rare presentation. Saudi J Kidney Dis Transpl. 2009;20(5):842–845.
Об авторах / Для корреспонденции
А в т о р д л я с в я з и: Е. В. Кульчавеня – д.м.н., проф., гл. науч. сотр. ННИИТ, проф. кафедры туберкулеза НГМУ, Новосибирск, Россия; e-mail: urotub@yandex.ru
Похожие статьи
- Современный алгоритм диагностики и лечения острого гестационного пиелонефрита в крупном промышленном городе
- Эректильная дисфункция: современное состояние проблемы
- Антропоморфологические особенности больных туберкулезом предстательной железы
- Вспомогательные технологии в лечении больных урогенитальным туберкулезом
- Некоторые эпидемиологические аспекты инфекций мочевыводящих путей на примере крупных стационаров Алтайского края