Цели урока:
- Сформулировать знания учащихся о
пространственном строении алканов. - Продолжить формировать понятия о гомологах.
- Рассмотреть химические свойства алканов,
показать взаимосвязь между строением и
свойствами. - Продолжить формирование умений анализировать,
сравнивать, делать выводы; развить навыки
культуры общения.
Тип урока: сообщение новых знаний.
Вид урока: лекция + элементы беседы.
Оборудование:
- Шаростержневая и объёмная модели молекулы
метана. - Таблицы:
- “Строение метана”;
- “Строение этана и бутана”;
- Кодограмма “Хлорирование метана”.
ХОД УРОКА
I. Организационный момент
II. Сообщение новых знаний
Знакомство с планом новой темы:
- Особенности пространственного строения
предельных углеводородов. - Анализ химических связей алканов.
- Химические свойства.
- Зависимость свойств предельных углеводородов
от их строения, характера химических связей.
III. Изложение лекционного материала учителем
в соответствии с планом
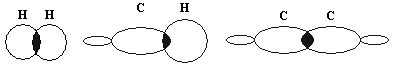
Современные представления о строении вещества
не сводятся только к установлению порядка
соединений атомов, но также включают
рассмотрение пространственного строения
молекул и электронной природы химических связей.
Предлагается написать молекулярную,
электронную, структурную формулы метана,
выяснить, что они показывают.
СН4 – молекулярная формула
(качественный, количественный состав);
–
электронная формула (ковалентная полярная
связь);
–
структурная формула (порядок соединения атомов в
молекуле).
Но данные формулы не отражают истинного
строения молекул метана. Молекула метана не
имеет плоского строения, как можно представить
на основании структурной формулы.
IV. Работа с моделями молекулы метана
Молекула метана в действительности имеет форму
тетраэдра. Тетраэдр – это пирамида, в основании
которой лежит равносторонний треугольник. В
центре тетраэдра находится атом углерода, а все
его четыре валентности направлены к вершинам
тетраэдра. Физическими методами исследования
установлено, что валентные углы равны 109о28′.
Учащимся предлагаются проблемные вопросы:
- Почему молекула метана имеет такую
пространственную форму? - Чем объясняется направление валентных связей
атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении
атома углерода и молекулы метана.
С 1S2 2S2 2P2
––> C
* 1S2 2S1 2P3
(основное
состояние) (возбужденное
состояние)
Так как на втором энергетическом уровне
Р-подуровне есть свободная орбиталь, то на неё
переходит один из 2S2-электронов. В
результате этого атом углерода в возбуждённом
состоянии имеет четыре неспаренных электрона,
т.е. становится четырёхвалентным.
(негибридные электронные
облака) (гибридные электронные
облака)
Облака всех четырёх валентных электронов атома
углерода выравниваются, становятся одинаковыми.
При этом они принимают форму вытянутых в
направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и
выравнивание по форме и энергии электронных
облаков, называется гибридизацией.
Так как гибридизации подвергаются один S
и три Р-электрона, то такое состояние
называется SP3-гибридизацией.
Несимметричное распределение электронной
плотности означает, что вероятность нахождения
электрона по одну сторону от ядра больше, чем по
другую. Гибридные электронные облака вытянуты в
пространстве под углом 109о28′ к
вершинам воображаемого тетраэдра, и в этом
направлении они перекрываются с электронными
облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое
строение, что обусловлено SP3-гибридизацией
атома углерода, тетраэдрическим направлением
четырёх гибридных электронных облаков атома
углерода.
Сравнивая масштабную и шаростержневую модели
молекул метана, можно отметить, что
шаростержневая модель, появившаяся до
возникновения электронной теории, более
наглядно рассматривает строение молекулы
метана.
V. Работа с таблицами “Строение метана” и
“Строение этана и бутана”
Для активизации учащихся им предлагается
рассмотреть данные таблицы и ответить на вопросы
(анализ информации, заключённой в таблицах).
- Что общего в строении молекул метана, этана,
бутана вы видите? - Чему равны валентные углы в молекулах гомологов
метана? - Почему углеродный скелет у молекулы бутана
имеет зигзагообразную форму? - Виды химической связи в молекулах этана, бутана?
Проанализировав информацию, учащиеся делают
выводы.
Для гомологов метана характерно:
- тетраэдрическое строение атома углерода (SP3-гибридизация);
- одинаковое значение всех валентных углов;
- наличие С – С и С – Н химических связей.
VI. Анализ химических связей алканов
При рассмотрении второго вопроса плана
обращается внимание на характер С – С и С
– Н связей, являющихся ковалентными по
характеру образования. Углерод-углеродные и
углерод-водородные связи в алканах относятся к (сигма)
связям.
(сигма)
связь – это химическая связь, при образовании
которой перекрывание электронных облаков
происходит по прямой, соединяющей ядра атомов.
Эти связи разнообразны.
VII. Химические свойства алканов
Предельные углеводороды характеризуются малой
реактивной способностью. Их называют
инерционными, химически стойкими, парафинами (от
латинского parum affinis – “мало сродства”).
В данной лекции познакомимся со
взаимодействием алканов с кислородом,
галогенами, термическим разложением,
изомеризацией.
1. Горючесть алканов.
При поджигании (t = 600oС) алканы вступают в
реакцию с кислородом, при этом происходит их
окисление до углекислого газа и воды.
СnН2n+2 + O2 ––>CO2 + H2O
+ Q
например:
СН4 + 2O2 ––>CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при
поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных
отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом),
т.к. метан и кислород вступают в реакцию
полностью.
Подобные смеси опасны в каменноугольных
шахтах. Чтобы обеспечить безопасность работы в
шахтах, там устанавливают анализаторы,
сигнализирующие о появлении газа, и мощные
вентиляционные устройства.
С3Н8 + 5O2 ––>3CO2 + 4H2O
+ Q
Горение пропан-бутановой смеси можно
продемонстрировать на примере газовой
зажигалки.
При горении алканов выделяется много теплоты,
что позволяет использовать их в качестве
источника энергии. Но большая часть их
используется в качестве сырья для получения
других продуктов.
2. Разложение алканов.
СnН2n+2
C + H2

СН4
C + 2H2
С4Н10
4C + 5H2
Метан в термическом отношении более устойчив,
чем другие алканы. Причина этого в достаточной
прочности С – Н связей.
3. Реакции замещения (протекают с галогенами и
другими окислителями при определённых условиях:
свет, температура).
СН4 + Cl2
CH3Cl + HCl
СН3Cl + Cl2
CH2Cl2 + HCl (кодограмма)
СН2Cl2 + Cl2
CHCl3 + HCl
СНCl3 + Cl2
CCl4 + HCl
Механизм цепных реакций достаточно сложен,
объяснение ему было дано русским учёным Н.Н.
Семёновым, за что он в 1956 г. был удостоен
Нобелевской премии.
4. Реакции изомеризации характерны не для
всех алканов. Обращается внимание на возможность
превращения одних изомеров в другие, наличие
катализаторов.
С4Н10
C4H10
Уравнение вызывает недоумение, т.к. учащиеся не
встречались с реакциями, при которых состав
молекул не изменялся. Значит, химические реакции
могут сопровождаться не только изменением
состава веществ, но и изменением их строения, что
часто встречается в органической химии. Чтобы
выразить такое превращение, надо пользоваться
структурными формулами.
С уравнением учащиеся знакомятся
самостоятельно, работая с учебником.
VIII. Выводы
В конце лекции учащиеся записывают выводы,
вытекающие из содержания лекции, включая пункт №
4 плана. Алканы (предельные углеводороды)
характеризуются общими свойствами, на основании
которых объединяются в гомологические ряды:
- имеют общую формулу СnH2n+2;
- все атомы углерода находятся в них в состоянии SP3-гибридизации;
- имеют прочные ковалентные
(сигма) связи;
- обладают сходными химическими свойствами,
способностью к полному, частичному, постепенному
окислению.
Свойства алканов находятся в зависимости от
электронно-пространственного строения, прочных
химических связей.
IX. Обобщение
По завершении лекции каждый учащийся заполняет
обобщающую таблицу о соответствующем гомологе
по образцу, выдаваемому учителем.
| Название вещества | Молекулярная формула | Структурная формула | Уравнения реакций | Тип реакции |
|
Метан |
СН4 |
|
СН4 + 2O2 ––> CO2 + 2H2O | Горение (полное окисление) |
| СН4 C + 2H2 |
Разложение (частичное окисление) | |||
| СН4 + Cl2 |
Замещение (постепенное окисление) |
Выводы и обобщающая таблица являются кратким
конспектом лекции.
X. Первичная проверка усвоения темы урока
После подведения итогов проводится небольшой
тест.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах
имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма
молекул 120о,
и
-связи;
б) SP-гибридизация, линейная форма молекул 180о,
и
-связи;
в) SP3-гибридизация, форма молекул –
тетраэдр 109о28′,
-связи.
4. Невозбуждённый атом углерода имеет
электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную
конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
7. Найдите ошибку.
а) Все алканы – химически активные вещества.
б) Для алканов характерны реакции присоединения.
в) Алканы окисляются с трудом при высоких
температурах кислородом воздуха.
г) Для алканов характерны реакции с разрывом—
связи С – С и С – Н.
Учитель предлагает варианты правильных
ответов, учащиеся проводят самоконтроль.
Строение и номенклатура алканов
PPTX / 1.01 Мб
/data/files/w1594560324.pptx (Строение и номенклатура алканов)ПРОЕКТ ОТКРЫТОГО МЕРОПРИЯТИЯ НА ТЕМУ « СТРОЕНИЕ АЛКАНОВ. ИЗОМЕРИЯ. »
Дата:
Предмет: химия
Класс: 10
Учитель: Малишевская Светлана Валентиновна
УРОК –ОБОБЩЕНИЕ ПО ТЕМЕ «СТРОЕНИЕ АЛКАНОВ, ИЗОМЕРИЯ»
Цель урока:
— изучить строение и гомологический ряд углеводородов алканов;
— систематизировать умения учащихся по составлению структурных формул алканов
— развивать логику, абстрактное мышление.
Задачи:
Обучающие:
— обобщение и систематизация знаний о пространственном строении алканов;
— обобщить понятия о гомологах, вспомнить правила составления названий орг. Соединений по систематической номенклатуре;
— выявление уровня усвоения основных понятий, правил; проверка умений решать задачи на вывод МФ (молекулярной формулы) органических веществ;
Развивающие:
— развивать умение рационально планировать свою деятельность, продолжить формирование умений применять приемы сравнения, систематизации, составления уравнений химических реакций;
— развивать монологическую речь.
3. Воспитательные:
— воспитывать у школьников интерес к учению;
— стремление добиваться успехов в учебе за счет добросовестного отношения к своему труду.
Методы и методические приемы: беседа, рассказ с использованием опорных схем, наглядные методы, презентация.
Оборудование: ПСХЭ, модели молекул, опорные схемы, компьютер, предметы быта.
Ход урока
I. Организационный момент.
Учитель: Мы продолжаем с Вами изучать гомологический ряд алканов. Нам предстоит рассмотреть способы получения, химические свойства и применение алканов. Мы должны охарактеризовать химические свойства, обусловленные строением алканов, рассмотреть лабораторные и промышленные способы получения алканов.
II. Проверка знаний
Фронтальная беседа (5 мин).
Что называется органической химией и кто является создателем теории строения органических соединений?
(Органи́ческая хи́мия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза).
Назовите основные положения этой теории? (а) Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
б) Свойства веществ зависят от их химического строения
в) По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы — предвидеть свойства.
г) Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга).
3. Что такое углеводороды? Их состав. (это органические соединения, состоящие из двух химических элементов – УГЛЕРОДА И ВОДОРОДА).
Что такое алканы, какова общая формула алканов? (Сn H2n+2)
Углеводороды – это органические соединения, состоящие из двух элементов — углерода и водорода.
Таких соединений очень много. Алканы – название предельных углеводородов по международной номенклатуре.
(?) Какое историческое название алканов, почему? Исторически алканы называют парафинами, что в переводе с латинского языка означает малоактивный. Алканы по сравнению с другими углеводородами относительно менее активные.
Их также называют насыщенными, т.к. все валентности атомов С насыщены атомами водорода.
(?) Кто является простейшим представителем алканов? Простейшим представителем предельных углеводородов является метан.
ИТАК…. ( по картинке)
УЧЕНИК ДЕЛАЕТ ШАРОСТЕРЖНЕВЫЕ МОДЕЛИ МЕТАНА, ЭТАНА И ПРОПАНА.
Что такое радикалы? (Радикал — группа атомов, содержащая углеводородный остаток в молекуле.
Что такое гомолог? Гомологи — это вещества одного класса органических соединений, которые отличаются друг от друга на какое-либо число гомологических единиц).
Существует много углеводов, сходных с метаном, то есть гомологов метана. В их молекулах имеются 2, 3, 4 и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов СН2. Например, если к формуле СН4 прибавить группу СН2, получим следующий углеводород С2Н6 – этан – гомолог метана. Группа СН2 называется гомологической разностью.
Как образуется название радикала? (заменой суффикса ан-на ил от названия соответствующего предельного УВН)
Продолжите ряд….
Назовите формулу этана? (С2 Н6)
По рисунку объяснить, где представлены атомы углерода и водорода. Составить структурную формулу этана.
Какой парафин образуется при соединении двух радикалов- -СН2 и –С2Н5? пропан
7. Какова формула пропана? (С3Н8)
Какие существуют виды изомерии алканов? (Углеродного скелета – структурная изомерия) С какого представителя гомологического ряда алканов начинается структурная изомерия-изомерия углеродного скелета? ( с бутана)
Число структурных изомеров алканов
|
Молекулярная формула |
СН4 МЕТАН |
С2Н6 ЭТАН |
С3Н8 ПРОПАН |
С4Н10 БУТАН |
С5Н12 ПЕНТАН |
С6Н14 ГЕКСАН |
|
Число изомеров |
1 |
1 |
1 |
2 |
3 |
5 |
|
Молекулярная формула |
С7Н16 ГЕПТАН |
С8Н18 ОКТАН |
С9Н20 НОНАН |
С15Н32 пентадекан |
С30Н62 триаконтан |
|
|
Число изомеров |
9 |
18 |
35 |
4347 |
4111846673 |
Сделать вывод!
После картинки с изомерией- Так кто же такие изомеры? (соединения, имеющие одинаковый состав, но разное строение и свойства)
Каковы правила составления названия алканов по систематической номенклатуре?
Для составления названия алканов по систематической номенклатуре нужно:
Выбрать самую длинную неразветвленную цепь углерода.
Пронумеровать эту цепь таким образом, чтобы заместители, которые в молекулах углеводородов замещают атомы водорода, были ближе к началу цепи.
Указать цифрой место и название заместителя, затем название основной цепи с суффиксом –ан. Для этого нужно знать название радикалов (образуются при отщеплении атома водорода от атома углерода), которые образуются от названий соответствующих углеводородов, путём замены суффикса –ан на –ил.
Пока ученик строит изомеры, второй решает задачу, третий-модели метана!
Классификация веществ по группам. (проверка у доски)
Какие вещества, формулы которых приведены ниже относятся к:
алканам
С6Н14; С5Н8; С4Н10; С5Н10; С3Н8; С2Н2; С2Н4; С6Н6; С7Н14 @ сделать, ответ
Вещества выпишите в столбик, дайте им названия
Отгадаем ребусы перед сложным строением атома
|
|
|
Упражнения:
1. Сколько веществ изображено на рисунке:
а)одно б) два в) три г) четыре
|
|
|
Ответ : одно- это бутан |
записать на доске возможные изомеры пентана
Алкан имеет плотность паров по воздуху 4,42. Определите молекулярную формулу предельного углеводорода. (решает один ученик у доски), в это время-изомерия.
Решение: 1.Найдем Мr (СnH2n+ 2 )=4,42×29=128;
2.Найдем число атомов в алкане, составив уравнение: 12n+2n=128; 14n=128; N= 9.
3. Запишем формулу алкана: С9Н20.
ПРОВЕРКА
Алкан имеет плотность паров по воздуху 4,42. Определите молекулярную формулу предельного углеводорода. (решает один ученик у доски), в это время-изомерия.
Решение: 1.Найдем Мr (СnH2n+2)=4,42×29=128;
2.Найдем число атомов в алкане, составив уравнение: 12n+2n=128; 14n=128; N= 9.
Запишем формулу алкена: С9Н20.
2. Особенности пространственного строения предельных углеводородов. Современные представления о строении вещества не сводятся только к установлению порядка соединений атомов, но также включают рассмотрение пространственного строения молекул и электронной природы химических связей.
Предлагается написать молекулярную, электронную, структурную формулы метана, выяснить, что они показывают. (1 человек, потом проверка на слайде)
СН4 – молекулярная формула (качественный, количественный состав);


Но данные формулы не отражают истинного строения молекул метана. Молекула метана не имеет плоского строения, как можно представить на основании структурной формулы.
ШАРОСТЕРЖНЕВЫЕ МОДЕЛИ!
Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра. Физическими методами исследования установлено, что валентные углы равны 109о28′.
Ответ следует искать в электронном строении атома углерода и молекулы метана.
Электронное строение атома углерода
С 1S2 2S2 2P2 
(основное состояние) (возбужденное состояние)
Вспомним электронные s— и р-облака. Что вы можете о них сказать?
Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2S2-электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным.
(негибридные электронные облака) (гибридные электронные облака)
Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок.
Что такое гибридизация? (Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией).
Почему гибридизация называется sp3? (Так как гибридизации подвергаются один S и три Р-электрона, то такое состояние называется SP3-гибридизацией).
Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую. Гибридные электронные облака вытянуты в пространстве под углом 109о28′ к вершинам воображаемого тетраэдра, и в этом направлении они перекрываются с электронными облаками атомов водорода.
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Сравнивая масштабную и шаростержневую модели молекул метана, можно отметить, что шаростержневая модель, появившаяся до возникновения электронной теории, более наглядно рассматривает строение молекулы метана.
Для активизации учащихся им предлагается рассмотреть данные таблицы и ответить на вопросы (анализ информации, заключённой в таблицах).
Что общего в строении молекул метана и этана вы видите?
Чему равны валентные углы в молекулах гомологов метана?
Виды химической связи в молекулах метана и этана?
Проанализировав информацию, учащиеся делают выводы.
Для гомологов метана характерно:
тетраэдрическое строение атома углерода (SP3-гибридизация);
одинаковое значение всех валентных углов;
наличие С – С и С – Н химических связей.
Строение алканов. Атом углерода в невозбужденном состоянии:
в алканах атом углерода находится в возбужденном состоянии:
Метан
Метан, он же болотный или рудничный газ. Не обладает цветом и запахом; легче воздуха, мало растворим в воде.
Повсеместно распространён в природе. Является главной составной частью многих горючих газов, как природных, так и искусственных, образующихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти.
Выделяется со дна болот и из каменноугольных пластов в рудниках, где он медленно образуется при разложении растительных остатков без доступа воздуха.
Метан содержится в атмосфере Сатурна и Юпитера, в твёрдом состоянии обнаружен на Нептуне и Уране.
Однако, характер его не столь романтичный, как кажется на первый взгляд.
В сочетании с воздухом (или с кислородом в соотношении по объёму 1:2) метан образует взрывчатые смеси. По уравнению реакции, метан взаимодействует с кислородом с образованием углекислого газа и воды; при этом выделяется 880 кДж энергии. Поэтому он опасен как в быту, так и в шахтах.
При неполном сгорании превращается в угарный газ (СО), как в первом уравнении реакции, или в сажу (С), как во втором. В присутствии катализаторов может окисляться до формальдегида или метанола.
Категорически не выносит реакций присоединения, что связано с его строением. Зато охотно вступает в реакции замещения; особенно на свету с хлором и бромом. Так, при взаимодействии метана с хлором образуется хлорметан и хлороводород(НС1).
В обычных условиях не любит щелочей и кислот, кроме, пожалуй, азотной. При вступлении в реакцию с азотной кислотой под действием температуры и давления, из метана образуется нитрометан и выделяется вода.
Вот такой он, метан. Главный из алканов и наш друг.
Этан
Этан — второй представитель гомологического ряда алканов, но не второй по значению. Почти всегда находится вместе с метаном, но в меньших концентрациях, чем последний газ. Отчего часто пребывает в грустном меланхоличном состоянии. А зря. Ведь этан тоже имеет ряд важных применений. Его используют в процессе получения хлорэтана при взаимодействии этана с хлором под действием квантов света. Хлорэтан служит важнейшим сырьём для производства тетраэтилсвинца. В Соединённых Штатах из этана получают в промышленности этилен.
Некоторое время назад этан был обнаружен в атмосфере Юпитера, Сатурна и некоторых их спутников.
Этан горит, с образованием углекислого газа и воды; подвергается дегидрированию (под действием катализаторов и температуры превращается в непредельный углеводород этилен, при этом выделяется водород). И точно так же, как и метан, не выносит реакцию присоединения (что связано с его строением), но охотно вступает в замещение с галогенами хлором и бромом. Реакции протекают на свету. В первом случае образуется хлорэтан и хлороводород, во втором — бромэтан и бромоводород.
Этилен, ацетилен, этаналь и многие другие являются его родственниками.
Поэтому не надо грустить, этан. Пусть ты не первый, но ведь ты не один в стране алканов, в мире углеводородов.
V. Первичная проверка полученных знаний
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма молекул 


б) SP-гибридизация, линейная форма молекул 


в) SP3-гибридизация, форма молекул – тетраэдр 

4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
Опросный лист.
Ученика 10 «___» класса ________________________________________
Вариант 1.
Проверка знаний.
Органическая химия – это …
Сколько веществ представлено формулами:
СН3 – СН2 – СН – СН3 СН3 – СН2 – СН2 – СН3
СН3
СН3
СН3 – СН2 – СН – СН3
Ответ: _______
Перечислите основные положения теории строения органических соединений А.М. Бутлерова:
__________________________________________
__________________________________________
__________________________________________
__________________________________________
II. Закрепление новых знаний.
Какие из этих соединений являются предельными (подчеркнуть)? Дать им названия.
С5Н12 — ,С5Н10 — , С4Н8 — , С2Н4 — , С3Н6 — , С10Н22 — .
Дайте названия следующим радикалам:
СН3 — _____________, С3Н7 — _________________
С2Н5 — _____________, С4Н9 — _________________
СН3 – СН — ______________.
СН3
Назовите следующие вещества:
III. Первичная проверка новых знаний.
Выделите правильный ответ.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма молекул 


б) SP-гибридизация, линейная форма молекул 


в) SP3-гибридизация, форма молекул – тетраэдр 

4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Всем алканам присущи свойства:
а) вступать в реакцию замещения;
б) окисляться при обычных условиях;
в) гореть в кислороде;
г) реагировать с активными металлами.
Опросный лист.
Ученика 10 «___» класса ________________________________________
Вариант 2.
I. Проверка знаний.
1. Изомерия – это …2. Сколько веществ представлено формулами:
СН2 – СН2 СН3 – СН2 – СН2 – СН3
СН3 СН3
СН3
СН3 – СН2 – СН2 Ответ: ______
Перечислите основные положения теории строения органических соединений А.М. Бутлерова:
1.__________________________________________
2.__________________________________________
3.__________________________________________
4.__________________________________________
Закрепление новых знаний.
Какие из этих соединений являются предельными (подчеркнуть)? Дать им названия.
С5Н12 — ,С5Н10 — , С4Н8 — , С2Н4 — , С3Н6 — , С10Н22 — .
Дайте названия следующим радикалам:
СН3 — _____________, С3Н7 — _________________
С2Н5 — _____________, С4Н9 — _________________
СН3 – СН — ______________.
СН3
Назовите следующие вещества:
III. Первичная проверка новых знаний.
Выделите правильный ответ.
1. Укажите ошибочное определение алканов:
а) предельные углеводороды;
б) карбоциклические соединения (в молекулах имеются циклы);
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула алканов:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение алканов:
а) SP3-гибридизация, плоская форма молекул 


б) SP-гибридизация, линейная форма молекул 


в) SP3-гибридизация, форма молекул – тетраэдр 

4. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г) 1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
Составьте все возможные изомеры для вещества состава С5Н12.
Составьте по два изомера для вещества состава
С6Н14.
__________________________________________________
Составьте по два изомера для вещества состава
С7Н16
____________________________________________________
Конспект урока
Тема урока: Алканы.
Цель урока: На примере ацетилена изучить и научиться предсказывать химические свойства, составлять уравнения реакции, характеризующие химические свойства алкинов.
Задачи:
Образовательные:
— обобщить понятие класса алканов, их общую формулу, гомологический ряд, гомологии и изомерии характерной для класса алканов, проверить уровень усвоения учебного материала по теме урока.
Воспитательные:
— воспитывать мировоззрение и единую химическую картину мира,- воспитывать дисциплинированность, ответственное отношение к учебному труду, выработка личностных качеств: аккуратности, внимательности при заполнении тетрадей, точности ответов, показать тесную связь химии с жизнью, умение работать самостоятельно.
Развивающие:
— развивать умения выделять главное, существенное, развивать химически грамотную речь, образное и логическое мышление
Новые знания: алканы, метан
Опорные знания: природные источники углеводородов, изомерия, номенклатура.
Формы проведения урока: урок.
Методы проведения урока: объяснительно-иллюстративный репродуктивный, частично-поисковый, наглядный.
Тип урока: урок усвоения новых знаний.
Литература:
- Габриелян О.С. – Химия. 10 класс: учеб. для общеобразоват. учреждений/ О.С.Габриелян. – М.: Дрофа 2005;
- О.С.Габриелян, И.Г. Остроумова Настольная книга учителя химия 10 Дрофа М 2008г Л.Ю. Аликберова Занимательная химия;
- Габриелян О.С. – Химия: пособие для школьников старших классов и поступающих в вузы.
Ход урока.
|
№ |
Деятельность учителя |
Деятельность учащихся |
t |
|
1 |
Организационный момент — Здравствуйте, ребята. Присаживайтесь. Все ли присутствуют на уроке? |
Ученики здороваются. Дежурный называет отсутствующих. |
|
|
2 |
Актуализация чувственного опыта т опорных знаний учащихся. Что называется органической химией? Правила и особенности классификации. |
— раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. В основе классификации лежит структура органических соединений. Основа описания структуры — структурная формула. Атомы элементов обозначаются латинскими символами, как они обозначены в периодической таблице химических элементов |
|
|
3 |
Мотивация Значение органических соединений огромно уже потому, что жизнь на Земле связана с их возникновением и превращениями. В любом живом организме протекают миллионы химических реакций, обеспечивающих процессы дыхания, пищеварения, размножения, функционирования каждой клетки, органов и ткани. |
||
|
4 |
П ервичное восприятие и осознание нового материала Алканы, или парафины — алифатические предельные углеводороды, в молекулах которых атомы углерода связаны между собой простой s-связью. Оставшиеся валентности углеродного атома, не затраченные на связь с другими атомами углерода, полностью насыщены водородом. Поэтому предельные углеводороды содержат в молекуле максимальное число водородных атомов. Что такое изомеры? Характерна изомерия углеродного скелета (структурная изомерия). Что такое номенклатура? Номенклатура. Для названия предельных углеводородов применяют в основном систематическую и рациональную номенклатуры. Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан. Общее название предельных углеводородов — алканы. По рациональной номенклатуре алканы рассматривают как производные метана, в молекуле которого один или несколько водородных атомов замещены на радикалы Получение алканов. Для получения алканов используют в основном природные источники. Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум. 1. 500 °С, оксиды железа nC+2nН2→СnН2n + 2 2 лабораторные методы: 1.Гидрирование этиленовых и ацетиленовых углеводородов в присутствии катализатора (Pt, Pd, Ni): H2C=CH2+H2→H3C—CH3 2.Действие металлического натрия на галогенопроизводные алканов (галогеналкилы) — реакция А.Вюрца: Н3С—I + 2Na + I—СН3→Н3С—СН3 + 2NaI 3. Сплавление солей карбоновых кислот со щелочами: Н3С—СOONa + NaOH→СН4 + Na2CО3 4. Восстановление галогенопроизводных (Pt): Н3С—С1+Н2→CH4+НС1 Физические свойства. Первые четыре члена гомологического ряда метана — газообразные вещества, начиная с пентана — жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые вещества (при обычной температуре). Алканы — неполярные соединения и трудно поляризуемые. Они легче воды и в ней практически не растворяются. Не растворяются также в других растворителях с высокой полярностью. Жидкие алканы — хорошие растворители для многих органических веществ. Метан и этан, а также высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит бесцветным пламенем. Химические свойства. Предельные углеводороды характеризуются малой реактивной способностью. Их называют инерционными, химически стойкими, парафинами (от латинского parum affinis – “мало сродства”). Сегодня на уроке познакомимся со взаимодействием алканов с кислородом, галогенами, термическим разложением, изомеризацией. 1. Горючесть алканов. При поджигании (t = 600oС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. СnН2n+2 + O2 → CO2 + H2O + Q например: СН4 + 2O2 → CO2 + 2H2O + Q Смесь метана с кислородом или воздухом при поджигании может взрываться. Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью. Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства. С3Н8 + 5O2 → 3CO2 + 4H2O + Q Горение пропан-бутановой смеси можно продемонстрировать на примере газовой зажигалки. При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов. 2. Разложение алканов. СnН2n+2 СН4 С4Н10 Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей. 3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура). СН4 + Cl2 СН3Cl + Cl2 СН2Cl2 + Cl2 СНCl3 + Cl2 Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии. 4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов. С4Н10 Уравнение вызывает недоумение, т.к. учащиеся не встречались с реакциями, при которых состав молекул не изменялся. Значит, химические реакции могут сопровождаться не только изменением состава веществ, но и изменением их строения, что часто встречается в органической химии. Чтобы выразить такое превращение, надо пользоваться структурными формулами. Структурно это выглядит следующим образом: СН3 – СН2 – СН2 –СН3 бутан СН3 изобутан присоединение (гидрирование): C6H12 + H2 →C6H14 (при нагревании под давлением в присутствии Ni-катализатора) разложение (дегидрирование, крекинг, пиролиз): C6H12 →C6H6 + 3H2 (при нагревании с катализатором). |
— химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам. — это совокупность терминов, названий, употребляемых в какой-либо специальной области знаний или деятельности |
|
|
5 |
Осмысление внутренних закономерностей, связей между изучаемыми предметами в процессе мыслительной работы и выполнения познавательных заданий Составьте структурные формулы:
|
||
|
6 |
Обобщение и систематизация изученных на уроке понятий и ранее усвоенных знаний 1. Укажите ошибочное определение алканов: а) предельные углеводороды; 2. Общая формула алканов: а) СnH2n; 3. Признаки, характеризующие строение алканов: а) SP3-гибридизация, плоская форма молекул 4. Невозбуждённый атом углерода имеет электронную конфигурацию: а) 1S22S12P3; 5. Возбужденный атом углерода имеет электронную конфигурацию: а) 1S22S22P3; |
||
|
7 |
Подведение итогов урока. Оценка работы всего класса. В конце урока учащиеся записывают выводы, вытекающие из содержания изученного материала . Алканы (предельные углеводороды) характеризуются общими свойствами, на основании которых объединяются в гомологические ряды: имеют общую формулу СnH2n+2; все атомы углерода находятся в них в состоянии SP3-гибридизации; имеют прочные ковалентные на основе их свойств алканы широко используются в различных сферах деятельности человека. Свойства алканов находятся в зависимости от электронно-пространственного строения, прочных химических связей. |
||
|
8 |
Домашнее задание. параграф 11,составить задание по пройденной теме – творч. задание. |
учащиеся записывают |